ГОСТ Р ИСО 8637-99
Группа Р24
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГЕМОДИАЛИЗАТОРЫ, ГЕМОФИЛЬТРЫ И ГЕМОКОНЦЕНТРАТОРЫ
Технические требования и методы испытаний
Haemodialysers, haemofilters and haemoconcentrators.
Technical requirements and test methods
ОКС 11.040.20
ОКСТУ 9444
Дата введения 2001-01-01
Предисловие
1 РАЗРАБОТАН ЗАО "ВНИИМП-ВИТА"
ВНЕСЕН Техническим комитетом по стандартизации ТК 11 "Медицинские приборы и аппараты"
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 29 декабря 1999 года N 853-ст
3 Настоящий стандарт представляет собой аутентичный текст международного стандарта ИСО 8637-89 "Гемодиализаторы, гемофильтры и гемоконцентраторы. Технические требования и методы испытаний"
4 ВВЕДЕН ВПЕРВЫЕ
Введение
Настоящий стандарт распространяется на устройства однократного применения, предназначенные для гемодиализа, гемофильтрации и гемоконцентрации. Приведенные в настоящем стандарте требования к устройствам способствуют обеспечению их безопасной и эффективной эксплуатации.
Установлено, что нецелесообразно определять свойства конструкционных материалов указанных устройств, а также устанавливать методы испытаний на биосовместимость, стерильность, апирогенность и некоторые эксплуатационные характеристики устройств. Поэтому настоящий стандарт требует, чтобы материалы, из которых изготавливаются устройства, были испытаны, и информация по методам этих испытаний и полученным результатам предоставлялась по запросу. В настоящем стандарте не определяются и не устанавливаются предельные значения эксплуатационных характеристик устройств однократного применения, предназначенных для гемодиализа, гемофильтрации и гемоконцентрации, поскольку подобные ограничения не требуются для квалифицированного пользователя и сузят альтернативу выбора аналогичного устройства для специфического применения.
При разработке устройств однократного применения, предназначенных для гемодиализа, гемофильтрации и гемоконцентрации, необходимо учитывать конструктивную совместимость в части соединений их кровопроводящих полостей с кровопроводящими магистралями, оговоренными в ГОСТ Р ИСО 8638.
Конструкция и размеры этих соединений выбраны таким образом, чтобы свести к минимуму риск утечки крови и попадания воздуха. Соединения по диализирующему раствору рассчитаны на соединители Хансена или Уолтера.
1 Область применения
Настоящий стандарт устанавливает требования к катушечным, пластинчатым и капиллярным гемодиализаторам, а также гемофильтрам и гемоконцентраторам (далее - устройства), предназначенным для однократного применения.
Настоящий стандарт не устанавливает параметры конструкционных материалов, методы испытания на биосовместимость, оценку стерильности, апирогенность и отдельные эксплуатационные характеристики устройств.
Настоящий стандарт не распространяется на устройства, собранные и стерилизованные пользователем, кровопроводящие магистрали, плазмофильтры, устройства сосудистого доступа, гемоперфузионные устройства, перфузионные насосы, мониторы измерения давления и контроля воздушных включений в магистралях, гемодиализные и гемофильтрационные аппараты, а также аппараты для гемоконцентрации.
Примечание - Требования к комплекту кровопроводящих магистралей для гемодиализаторов, гемофильтров и гемоконцентраторов по ГОСТ Р ИСО 8638.
Требования настоящего стандарта являются обязательными.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ Р ИСО 8638-99 Комплект кровопроводящих магистралей для гемодиализаторов, гемофильтров и гемоконцентраторов
ИСО 472-79* Пластики. Словарь
________________
Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
ИСО 7000-89* Графические символы, используемые на оборудовании. Индексы и обозначения
_______________
* Международные стандарты - во ВНИИКИ Госстандарта России.
3 Определения
В настоящем стандарте применяют следующие термины с соответствующими определениями:
3.1 магистраль кровопроводящая артериальная: Составная часть экстракорпоральной системы, обеспечивающая соединение устройства сосудистого доступа пациента со входом полости по крови гемодиализатора, гемофильтра или гемоконцентратора.
3.2 объем заполнения кровопроводящей полости: Объем крови, необходимый для заполнения полости по крови гемодиализатора, гемофильтра или гемоконцентратора при заданном трансмембранном давлении или среднем давлении в катушечном гемодиализаторе.
3.3 расход крови,: Количество крови, проходящее через гемодиализатор, гемофильтр или гемоконцентратор в (за) единицу времени.
Примечание - Расход крови обычно выражают в миллиметрах в минуту (мл/мин).
3.4 клиренс, : Количество крови, полностью очищенной от определенного растворенного в ней вещества в единицу времени при гемодиализе или гемофильтрации, вычисляют, если это допустимо, по формулам:
- при гемодиализе с открытым контуром (слив)
![]() . (1)
. (1)
Примечание - ![]() - клиренс вследствие конвекции;
- клиренс вследствие конвекции;
- при гемодиализе с закрытым контуром (рециркуляция)
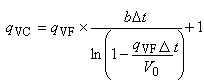 . (2)
. (2)
Примечание - выражение (2) верно только при большем чем 2 мл/мин;
- при гемофильтрации
![]() . (3)
. (3)
При вычислениях по формулам (1) и (3) для величин ,
и
следует использовать те же единицы измерения.
В формулах (1) - (3):
- угол наклона временной линейной регрессии натурального логарифма концентрации в резервуаре;
- концентрация растворенного вещества в крови на входе полости по крови гемодиализатора или гемофильтра;
- концентрация растворенного вещества в (ультра)фильтрате;
- концентрация фильтрата на выходе полости по крови гемодиализатора или гемофильтра;
- расход крови на входе устройства, мл/мин;
- расход фильтра (скорость ультрафильтрации), мл/мин;
- продолжительность измерения, (
), мин,
где - время начала измерения;
- время окончания измерения;
- объем крови в момент времени
, мл.
Примечания
1 Термин "ультрафильтрация" обычно используют в качестве синонима термина "фильтрация" при гемодиализе.
2 Клиренс обычно выражают как количество крови, мл, полностью очищенной от растворенного вещества за 1 мин (справедливо для ультрафильтрации).
3.5 остаточная тромбированная кровь: Остаток крови, которая не может быть возвращена отмывкой полости по крови устройства.
3.6 податливость: Изменение объема полости по крови гемодиализатора, гемофильтра или гемоконцентратора при изменении трансмембранного давления.
Примечание - Податливость обычно выражают в миллилитрах на 100 мм рт.ст. трансмембранного давления или среднего давления в катушечном гемодиализаторе.
3.7 диализанс, : Скорость изменения в единицу времени концентрации растворенного вещества в единице объема крови по градиенту концентрации относительно диализирующего раствора, вычисляемая по формуле
![]() , (4)
, (4)
где - концентрация растворенного вещества в диализирующем растворе на входе полости по диализату гемодиализатора.
Остальные обозначения по 3.4.
При вычислениях величин ,
и
следует использовать те же единицы измерения.
Примечания
1 Допускается выводить клиренс из диализанса для систем с циркулирующим диализирующим раствором по формуле
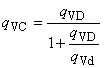 , (5)
, (5)
где - расход диализирующего раствора.
2 Измерение диализанса целесообразно для сравнения устройств, используемых в системах, где концентрация компонента диализирующего раствора, поступающего в гемодиализатор, больше нуля, т.е. в рециркуляционных системах.
3 Диализанс эквивалентен клиренсу проточных систем, т.е. когда =0.
3.8 диализирующий раствор (диализат): Раствор, используемый при гемодиализе для перемещения диализирующего раствора через полость, которая отделена полупроницаемой мембраной от полости по крови.
3.9 объем полости диализирующего раствора: Объем диализирующего раствора, необходимый для заполнения полости гемодиализатора, предназначенной для диализирующего раствора, при определенном трансмембранном давлении.
3.10 дополнительный расход диализирующего раствора: Расход свежеприготовленного диализирующего раствора при перемещении в рециркуляционно-проточную систему.
Примечание - Дополнительный расход диализирующего раствора выражают в мл/мин.
3.11 расход диализирующего раствора, : Расход диализирующего раствора при поступлении в гемодиализатор.
Примечание - Расход диализирующего раствора выражают в мл/мин.
3.12 расход рециркуляции диализирующего раствора: В гемодиализаторах катушечного типа расход рециркуляции диализирующего раствора.
Примечание - Расход рециркуляции диализирующего раствора выражают в мл/мин.
3.13 дистрибьютор: Любая сторона, за исключением изготовителя, которая предлагает на продажу гемодиализатор, гемофильтр или гемоконцентратор.
3.14 фильтрат: Раствор, перемещенный из полости по крови через полупроницаемую мембрану в полость по диализату или фильтрата гемодиализатора, гемофильтра или гемоконцентратора по градиенту давления на полупроницаемой мембране.
3.15 возвращаемая остаточная кровь: Остаточная кровь, которую можно вернуть дополнительной отмывкой полости крови по рекомендуемой изготовителем методике.
3.16 гемоконцентрация: Метод обработки крови, посредством которого экстракорпоральную кровь транспортируют через устройство (гемоконцентратор) с целью выделения плазмы из крови.
Примечание - При гемоконцентрации кровь перемещается через кровопроводящую полость, отделенную полупроницаемой мембраной. Фильтрат, проходящий через мембрану, собирается в другой полости и выводится для дальнейшей обработки. Проницаемость мембраны не допускает клинически значимых потерь протеинов крови.
3.17 гемоконцентратор: Устройство, используемое для проведения гемоконцентрации.
3.18 гемодиализатор: Устройство, используемое для проведения гемодиализа.
3.19 гемодиализ: Метод обработки крови, в процессе которого экстракорпоральную кровь транспортируют через устройство (гемодиализатор), в котором осуществляется массообмен веществ диффузией и конвекцией для уменьшения биохимических аномалий, а также нарушений водного, электролитного и кислотно-щелочного равновесий.
Примечание - При гемодиализе кровь транспортируют через полость крови, отделенную полупроницаемой мембраной от полости, по которой транспортируют диализирующий раствор. Массообмен компонентов плазмы крови между кровью и диализирующей жидкостью осуществляется в основном за счет диффузии. Водный обмен между кровью и диализирующей жидкостью осуществляется в основном за счет ультрафильтрации. Проницаемость мембраны не допускает клинически значимых потерь протеинов крови.
3.20 гемофильтр: Устройство для гемофильтрации.
3.21 гемофильтрация: Метод обработки крови, при котором экстракорпоральную кровь транспортируют через фильтрующее устройство (гемофильтр) для уменьшения биохимических аномалий, а также нарушений водного, электролитного и кислотно-щелочного равновесий. Обработка достигается замещением фильтрата крови эквивалентным объемом физиологического замещающего раствора.
Примечание - При гемофильтрации кровь транспортируют через полость по крови, отделенную полупроницаемой мембраной от полости, из которой удаляют фильтрат, при этом замещающий фильтрат физиологический раствор инфузируют в кровоток. Проницаемость мембраны не допускает клинически значимых потерь протеинов крови.
3.22 гидравлическое сопротивление: Сопротивление потоку жидкости в полости крови или диализирующего раствора, измеренное как падение давления, мм рт.ст., или изменение давления между входным и выходным соединениями гемодиализатора, гемофильтра или гемоконцентратора при заданном расходе жидкости.
3.23 изготовитель: Сторона, которая берет на себя ответственность за обеспечение качества готового изделия.
3.24 среднее давление в катушечном гемодиализаторе (МСР), : Среднее арифметическое значение давлений на входе и выходе кровопроводящей полости катушечного гемодиализатора с открытой полостью по диализирующему раствору, вычисленное по формуле
![]() , (6)
, (6)
где - давление крови на стороне артерии гемодиализатора, мм рт.ст.;
- давление крови на венозной стороне гемодиализатора, мм рт.ст.
3.25 апирогенность: Отсутствие пирогенов в пределах погрешности контроля для методов испытаний, приводимых в нормативных документах (НД) и поддержание данного состояния защитными мерами.
3.26 рециркуляционная система: Система транспортирования диализирующего раствора, в которой через гемодиализатор непрерывно рециркулирует диализирующий раствор.
3.27 рециркуляционно-проточная система: Система транспортирования диализирующего раствора, в которой через гемодиализатор непрерывно перемещается диализирующий раствор, рециркулирующий объем которого постоянно вытесняется в слив свежеприготовленным диализирующим раствором.
3.28 остаточная кровь: Объем крови, оставшийся в гемодиализаторе, гемофильтре или гемоконцентраторе после завершения методики, рекомендованной изготовителем для возврата крови из устройства к пациенту.
Примечание - Объем остаточной крови обычно выражают в мл.
3.29 полупроницаемая мембрана: Мембрана для отделения полости по крови от полости по диализирующему раствору во время гемодиализа или через которую при гемофильтрации или гемоконцентрации проходит фильтрат.
3.30 проточная система диализирующего раствора: Система транспортирования диализирующего раствора, в которой диализирующий раствор транспортируется в слив после однократного перемещения через гемодиализатор.
3.31 стерильность: Отсутствие живых микроорганизмов при проверках на стерильность и поддержание данного состояния с помощью защитных мер.
3.32 трансмембранное давление (ТМР), : Гидростатическая составляющая давления, воздействующая на полупроницаемую мембрану гемодиализаторов (капиллярных, пластинчатых или катушечных) или гемофильтров, вычисляемая по формулам:
- для гемодиализа
![]() ; (7)
; (7)
- для гемофильтрации
![]() , (8)
, (8)
где - давление диализирующего раствора на входе полости диализата гемодиализатора;
- давление диализирующего раствора на выходе полости диализата гемодиализатора;
- давление фильтрата на выходе полости фильтрата гемофильтра;
и
- по 3.24.
3.33 пользователь: Оператор устройства.
3.34 магистраль кровопроводящая венозная: Составная часть экстракорпоральной системы, обеспечивающая соединение выхода полости по крови гемодиализатора, гемофильтра или гемоконцентратора с устройством сосудистого доступа пациента.
4 Технические требования
4.1 Условия качественного производства
Гемодиализаторы, гемофильтры или гемоконцентраторы должны изготавливаться в условиях чистого производства, при этом внутренняя поверхность устройств должна быть свободна от видимых посторонних частиц.
Испытание проводят в соответствии с 5.1.
4.2 Токсикология и биологическая совместимость
Устройства должны быть нетоксичны.
Токсикологические испытания устройств проводят в соответствии с действующими НД, при этом информация о методе испытаний и результаты испытаний могут быть предоставлены изготовителем по запросу.
Испытание проводят в соответствии с 5.2.
4.3 Стерильность
Устройства должны поставляться в стерильном виде.
Испытание проводят в соответствии с 5.3.
4.4 Пирогенность
Кровопроводящие полости устройств должны быть апирогенны.
Информация о методе испытаний и результаты испытаний могут быть предоставлены изготовителем по запросу.
Испытание проводят в соответствии с 5.4.
4.5 Последствия стерилизации
После стерилизации по методике, рекомендованной изготовителем, устройства испытывают на отсутствие токсичных осадков, которые могут оказать отрицательное химическое, физическое и биологическое воздействия на кровь или обусловить выделение в кровь потенциально опасных веществ в клинически недопустимых количествах.
Информация о методе испытаний и результаты испытаний могут быть предоставлены изготовителем по запросу.
Испытание проводят в соответствии с 5.5.
4.6 Механические характеристики
4.6.1 Конструкционная прочность
Образцы гемодиализатора, гемофильтра или гемоконцентратора должны обладать способностью выдерживать полуторное максимальное трансмембранное давление или среднее давление в катушечном гемодиализаторе, установленное изготовителем.
Устройства с герметичной полостью по диализату или полостью по фильтрату должны также выдерживать избыточное давление:
- в 1,5 раза выше максимального избыточного давления, заданного изготовителем;
- на 700 мм рт.ст. ниже атмосферного давления, если максимально установленное изготовителем избыточное давление превышает данное значение.
Испытание проводят в соответствии с 5.6.1.
4.6.2 Целостность мембраны
Испытание, выявляющее утечку крови, проводят на каждом гемодиализаторе, гемофильтре или гемоконцентраторе.
Испытание проводят в соответствии с 5.6.2.
4.6.3 Соединения с полостью по крови
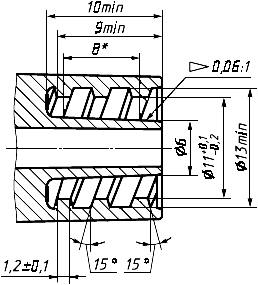
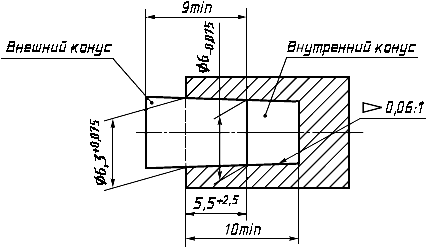
За исключением случаев, когда гемодиализатор, гемофильтр или гемоконцентратор сконструированы таким образом, что составляют одно целое с кровопроводящими магистралями, размеры кровопроводящих соединителей должны соответствовать приведенным на рисунках 1 и 2.
_______________
* Двухзаходная резьба.
Рисунок 1 - Основные размеры соединителей на входе и выходе полости по крови
Рисунок 2 - Длина свинчивания наружного и внутреннего конусов соединителей на входе и выходе полости по крови
Испытание проводят в соответствии с 5.6.3.
4.6.4 Соединения с полостью по диализату гемодиализатора
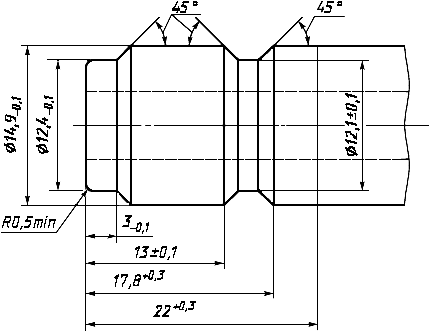
Размеры соединителей с полостью диализата должны соответствовать приведенным на рисунке 3. Кроме того, соединитель с полостью диализата может иметь узел с самоуплотняющимся коннектором.
Рисунок 3 - Основные размеры входного и выходного соединителей полости по диализату
Размеры соединителей с полостью диализата проверяют по 5.6.4.
4.6.5 Соединения с полостью фильтрата гемофильтра или гемоконцентратора
Соединители с полостью фильтрата гемофильтра или гемоконцентратора должны отвечать требованиям, установленным в 4.6.3 или 4.6.4.
Соединители полости фильтрата проверяют по 5.6.5.
4.7 Эксплуатационные характеристики
4.7.1 Общие требования
Эксплуатационные характеристики, установленные в 4.7.2-4.7.6, определяют перед реализацией устройств нового типа на рынке и перепроверяют в конкретном устройстве, если внесенные изменения могут повлиять на его рабочие качества.
Образцы устройств выбираются из серийной продукции изготовителя произвольно и должны (если это применимо) отвечать всем критериям безопасности и качества. Подготовка образцов - согласно рекомендациям изготовителя для клинического применения. Измерения проводят в стендовых условиях при температуре (37±1) °C. В случае нелинейной зависимости между переменными величинами проводят необходимое число определений для интерполяции между частными значениями. Методы измерения - арбитражные. Допускается использовать другие методы, при условии, что расхождения между полученными результатами и результатами арбитражного метода находятся в пределах ±5%.
Приведенные выше методы испытаний не содержат всей необходимой информации о реальной испытательной системе. Проектирование конструкций и характеристики реальных испытательных систем способствуют возникновению погрешностей:
- измерения давления вследствие эффектов смещения статического напора и динамического падения давления;
- времени стабилизации параметров;
- неконтролируемых изменений температуры при непостоянстве расходов, рН;
- от разрушения испытательных веществ вследствие тепла, света и времени;
- от дегазации испытательных жидкостей и загрязнения системы инородным материалом, водорослями и бактериями.
В документации или в спецификации на изделие указывают:
- число испытанных устройств;
- среднюю и стандартную девиацию показаний для каждого параметра;
- характер изменений в режиме работы в течение периода наблюдения;
- информацию (если это целесообразно) о том, что результаты, полученные в стендовых условиях (in vitro), могут отличаться от результатов, полученных в естественных условиях (in vivo), с оценкой различия (если она известна).
4.7.2 Клиренс гемодиализаторов
Скорость снижения мочевины, креатинина и витамина устанавливают во всем диапазоне расходов крови и диализирующего раствора, рекомендованного изготовителем, и включают расход крови 200 мл/мин и расход диализирующего раствора 500 мл/мин. Расход фильтрата
приводят для каждого значения диапазона расходов крови и диализирующего раствора.
Полость по крови перфузируют диализирующим раствором, приготовленным на основе стандартных тест-растворов. Перфузат должен содержать следующие вещества:
мочевина от 15 до 35 ммоль/л
креатинин от 500 до 1000 мкмоль/л
витамин от 15 до 40 мкмоль/л.
Диализат перемещают через полость диализирующего раствора. В катушечных гемодиализаторах диализанс не заменяют клиренсом, что указывают дополнительно; особое внимание обращают на соотношение между диализансом и клиренсом и его клиническим соответствием. Дополнительно указывают скорость рециркуляции диализата в катушечном гемодиализаторе.
Примечание - Примеры испытательных систем приведены на рисунках 4-8.
4.7.3 Клиренс для гемофильтров
Скорость снижения мочевины, креатинина и витамина устанавливают во всем диапазоне расходов крови, рекомендованном изготовителем, и включают расход крови 200 мл/мин. Химический состав раствора, перфузирующего полость крови, приводится в 4.7.2.
Примечание - Пример испытательной системы приведен на рисунке 8.
4.7.4 Скорость фильтрации
При нелинейной зависимости между скоростью фильтрации и трансмембранным давлением или средним давлением в катушечном гемодиализаторе скорость фильтрации, выраженную в мл/ч, приводят для установленного изготовителем диапазона трансмембранного давления или среднего давления на катушечном гемодиализаторе. При линейной зависимости между скоростью фильтрации и трансмембранным давлением или средним давлением на катушечном гемодиализаторе приводят коэффициент фильтрации, выражаемый в мл/ч. Давление заполнения не должно превышать максимального испытательного давления.
Измерения проводят раствором, перфузирующим полость крови и, (для гемодиализаторов) без раствора, перемещаемого через полость диализирующего раствора. Последовательность измерения - от минимального до максимального трансмембранного давления или среднего давления в катушечном гемодиализаторе.
Примечание - Схемы испытательных систем приведены на рисунках 8 и 9.
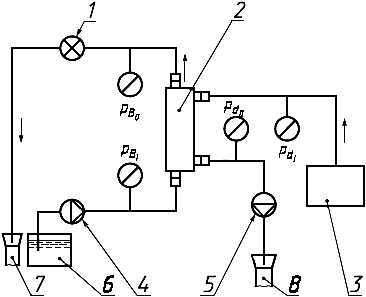
1 - регулятор давления; 2 - гемодиализатор; 3 - система подачи диализирующего раствора; 4 - перфузионный насос; 5 - источник вакуумметрического давления диализирующего раствора; 6 - резервуар испытательного раствора; 7, 8 - слив
Примечание - Условные обозначения по 3.24 и 3.32.
Рисунок 4 - Схема системы с открытым контуром для измерения клиренса в пластинчатом или капиллярном гемодиализаторе
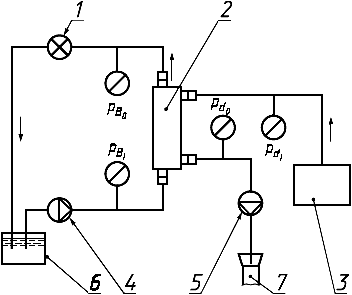
1 - регулятор давления; 2 - гемодиализатор; 3 - система подачи диализирующего раствора; 4 - перфузионный насос; 5 - источник вакуумметрического давления диализирующего раствора; 6 - резервуар для испытательного раствора; 7 - слив
Примечание - Условные обозначения по 3.24. и 3.32.
Рисунок 5 - Схема системы с закрытым контуром для измерения клиренса в пластинчатом или капиллярном гемодиализаторе

1 - регулятор давления; 2 - свежеприготовленный диализирующий раствор; 3 - гемодиализатор; 4 - переток диализирующего раствора в слив; 5 - рециркуляционный насос диализирующего раствора; 6 - перфузионный насос; 7 - резервуар для испытательного раствора; 8 - слив
Примечание - Условные обозначения по 3.24.
Рисунок 6 - Схема системы с открытым контуром для измерения клиренса в катушечном гемодиализаторе
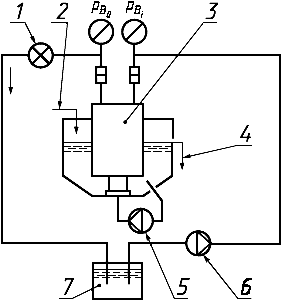
1 - регулятор давления; 2 - свежеприготовленный диализирующий раствор; 3 - гемодиализатор; 4 - переток диализирующего раствора в слив; 5 - циркуляционный насос диализирующего раствора; 6 - перфузионный насос; 7 - резервуар для испытательного раствора
Примечание - Условные обозначения по 3.24.
Рисунок 7 - Схема системы с закрытым контуром для измерения клиренса в катушечном гемодиализаторе
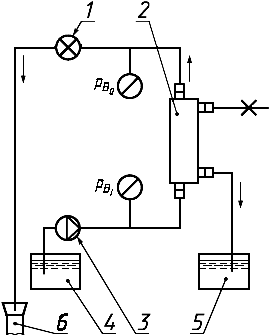
1 - регулятор давления; 2 - гемодиализатор, гемофильтр или гемоконцентратор; 3 - перфузионный насос; 4 - резервуар для испытательного раствора; 5 - фильтрат; 6 - слив
Примечание - Условные обозначения по 3.24.
Рисунок 8 - Схема системы для измерения клиренса в гемофильтре или скорости фильтрации в пластинчатом или капиллярном гемодиализаторе, гемофильтре или гемоконцентраторе
4.7.3 Клиренс для гемофильтров
Скорость снижения мочевины, креатинина и витамина устанавливают во всем диапазоне расходов крови, рекомендованном изготовителем, и включают расход крови 200 мл/мин. Химический состав раствора, перфузирующего полость крови, приводится в 4.7.2.
Примечание - Пример испытательной системы приведен на рисунке 8.
4.7.4 Скорость фильтрации
При нелинейной зависимости между скоростью фильтрации и трансмембранным давлением или средним давлением в катушечном гемодиализаторе скорость фильтрации, выраженную в мл/ч, приводят для установленного изготовителем диапазона трансмембранного давления или среднего давления на катушечном гемодиализаторе. При линейной зависимости между скоростью фильтрации и трансмембранным давлением или средним давлением на катушечном гемодиализаторе приводят коэффициент фильтрации, выражаемый в мл/ч. Давление заполнения не должно превышать максимального испытательного давления.
Измерения проводят раствором, перфузирующим полость крови и, (для гемодиализаторов) без раствора, перемещаемого через полость диализирующего раствора. Последовательность измерения - от минимального до максимального трансмембранного давления или среднего давления в катушечном гемодиализаторе.
Примечание - Схемы испытательных систем приведены на рисунках 8 и 9.
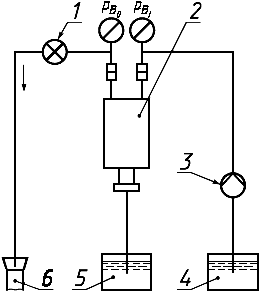
1 - регулятор давления; 2 - гемодиализатор; 3 - перфузионный насос; 4 - резервуар для испытательного раствора; 5 - фильтрат; 6 - слив
Примечание - Условные обозначения по 3.24.
Рисунок 9 - Схема системы для измерения скорости фильтрации в катушечном гемодиализаторе
4.7.5 Объем полости по крови
Объем полости по крови и (если применимо) полости по диализирующей жидкости определяют при смоченных мембранах (т.е. устройство должно быть подготовлено по рекомендациям изготовителя для клинического применения), используя неспособную к ультрафильтрации жидкость. Этот объем определяют для всего указанного изготовителем диапазона трансмембранного давления или среднего давления в катушечном гемодиализаторе.
4.7.6 Гидравлическое сопротивление
Гидравлическое сопротивление полости по крови и (если это применимо) полости по диализирующему раствору определяют, используя 32%-ный () раствор глицерина и воды. Эти измерения проводят для всего указанного изготовителем диапазона расхода крови, расхода диализирующего раствора и трансмембранного давления или среднего давления в катушечном гемодиализаторе.
5 Методы испытаний
5.1 Условия качественного производства
Соответствие требованию, установленному в 4.1, определяют проверкой.
5.2 Токсикология и биологическая совместимость
Токсичность и биологическую совместимость материалов устройств, которые контактируют с биологическими растворами, определяют на образцах устройств каждого нового типа перед их реализацией, после внесения каких-либо изменений в конструкционные материалы устройств данного типа или в метод стерилизации.
Примечание - Испытание проводят методами, установленными в соответствующих НД.
5.3 Стерильность
Процесс стерилизации проверяют на образцах готовой продукции до ее реализации, а в дальнейшем стерильность изделий - на образцах из каждой партии.
5.4 Пирогенность
Испытание на пирогенность проводят на образцах устройств каждого нового типа до их реализации, при этом изготовитель проводит проверку пирогенности образцов из каждой партии для гарантии апирогенности продукции.
5.5 Последствия стерилизации
Образцы готовых изделий испытывают на содержание потенциально опасных осадков по установленным токсикологическим методам перед каждой реализацией устройств нового типа, и в дальнейшем изготовитель проводит испытание на определение токсичных осадков на образцах из каждой партии с целью гарантии безопасности продукции, а также при любых изменениях материалов конструкции.
5.6 Механические характеристики
5.6.1 Конструкционная прочность
Испытание проводят перед реализацией на рынке устройств нового типа и не рассматривают в качестве проверки качества.
5.6.1.1 Методика испытания
Устройство заполняют водой, прикладывают к нему избыточное давление и проверяют, нет ли утечки или других дефектов. Если целесообразно, испытывают устройство при вакуумметрическом давлении и также проверяют, нет ли утечки или других дефектов.
5.6.1.2 Реагенты
5.6.1.2.1 Антикоагулированная бычья или человеческая плазма с массовой концентрацией протеина (60±5) г/л.
5.6.1.2.2 Вода при температуре (37±1) °C; если проводится испытание при вакуумметрическом давлении (5.6.1.5.3), то используется только что вскипяченная вода.
5.6.1.3 Техническое оснащение и принадлежности
5.6.1.3.1 Комплект кровопроводящих магистралей, перфузионный насос и сосуд из нержавеющей стали или пластика, рассчитанные на применение плазмы крови (5.6.1.2.1), которые используют при моделировании гемодиализа, гемофильтрации или гемоконцентрации по ГОСТ Р ИСО 8638.
5.6.1.3.2 Соединения для подключения к кровопроводящим полостям устройства, оснащенные трубками, способными выдержать испытательное давление и (при необходимости) пригодные для подачи давления (5.6.1.3.6) по ГОСТ Р ИСО 8638.
5.6.1.3.3 Соединения для подключения полости по диализату или фильтрату, оснащенные трубопроводами и способные выдержать испытательное давление.
Примечание - Используют соединения с устройствами, имеющими закрытые полости диализирующего раствора или фильтрата по ГОСТ Р ИСО 8638.
5.6.1.3.4 Блокирующие устройства (фитинги), предназначенные для закрытия полости по диализату, установленные на трубопроводе и способные выдержать испытательное давление.
Примечание - Используют только фитинги с устройствами, имеющими открытые полости диализирующего раствора или фильтрата.
5.6.1.3.5. Зажимы для трубок (по НД).
5.6.1.3.6. Источник или источники, пригодные для подачи заданного давления (давлений).
5.6.1.3.7. Измерители давления соответствующего диапазона давлений с погрешностью измерения ±10 мм рт.ст. (по НД).
5.6.1.4 Отбор и подготовка образцов для испытания
Образцы выбирают произвольно из продукции изготовителя, в отношении которой должны использоваться все критерии контроля безопасности и качества. Подготовка отобранных образцов - в соответствии с рекомендациями изготовителя для клинического применения.
5.6.1.5 Методика испытания
5.6.1.5.1 Устройство перфузируют плазмой (5.6.1.2.1) в течение 7 ч при температуре (37±1) °С и градиенте максимального давления на полупроницаемой мембране, рекомендованном изготовителем.
Собирают устройство (рисунок 10).
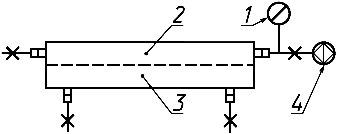
1 - измеритель давления; 2 - полость по крови; 3 - полость диализирующего раствора или фильтрата; 4 - источник жидкости для испытания при избыточном или вакуумметрическом давлении
Примечание - Гемофильтры и гемоконцентраторы могут иметь только одно соединение по полости фильтрата; в гемодиализаторах с открытой полостью диализирующего раствора соединения этой полости герметизируют заглушками, специально сконструированными для данного испытания.
Рисунок 10 - Схема испытания на конструкционную прочность
Промывают полости крови и диализирующего раствора или фильтрата водой (5.6.1.2.2) при температуре (37±1) °С, учитывая, что устройство необходимо освободить от воздуха.
5.6.1.5.2 Создают избыточное давление, в 1,5 раза превышающее рекомендуемое изготовителем, и герметизируют устройство. Через 10 мин измеряют давление и осматривают устройство.
5.6.1.5.3 При необходимости создают вакуумметрическое давление, в 1,5 раза превышающее рекомендуемое изготовителем, и герметизируют устройство таким образом, чтобы вакуумметрическое давление было меньше минус 700 мм рт.ст.; затем устанавливают вакуумметрическое давление минус 700 мм рт.ст. Через 10 мин измеряют давление и осматривают устройство.
5.6.1.6 Оформление результатов
5.6.1.6.1 Испытание на избыточное давление
Неудовлетворительный результат испытания выражается в снижении давления более чем на 1%, утечке или деформации материалов конструкции.
Результаты фиксируют как "удовлетворительные" или "неудовлетворительные".
5.6.1.6.2 Испытание на вакуумметрическое давление
Неудовлетворительный результат испытания выражается в снижении вакуумметрического давления более чем на 1%, утечке или деформировании материалов конструкции.
Результаты фиксируют как "удовлетворительные" или "неудовлетворительные".
5.6.1.7 Протокол испытаний
Оформляют протокол испытаний, где испытание фиксируют как "удовлетворительное", если все образцы выдержали испытания, и "неудовлетворительное", если какой-либо из образцов не выдержал испытаний.
Указывают размер выборки и обоснование ее статистической достоверности.
5.6.2 Целостность мембраны
Целостность мембраны по 4.6.2 определяют по методике, рекомендованной изготовителем. По запросу информация об испытании и его результаты должны быть предоставлены изготовителем. Адекватность метода испытания мембраны на целостность проверяют перед реализацией устройств нового типа в соответствии с методом, приведенным в приложении А.
5.6.3 Соединения полости по крови
Соответствие требованиям к соединениям полости по крови по 4.6.3 определяют визуально.
5.6.4 Соединения с полостью по диализату гемодиализатора
Соответствие требованиям 4.6.4 определяют визуально.
5.6.5 Соединения с полостью фильтрата гемофильтра или гемоконцентратора
Соответствие требованиям 4.6.5 определяют визуально.
6 Упаковка, маркировка и эксплуатационные документы
6.1 Упаковка и маркировка
6.1.1 Потребительская тара (упаковка)
Потребительская упаковка должна содержать:
- наименование и адрес изготовителя;
- наименование изделия;
- идентификационный код изготовителя изделия;
- номер партии, позволяющий проследить последовательность изготовления конкретного устройства;
- заключение о стерильности и апирогенности, а также информацию о стерильности всего содержимого упаковки или только путей перемещения жидкости в устройстве;
- месяц и год стерилизации с точностью до 30 дней, начиная с фактической даты стерилизации;
- указание об однократном использовании.
Примечание - Допускается также использовать обозначение по ИСО 7000;
- надпись "Прочтите инструкции перед применением";
- инструкцию по подготовке к применению гемодиализатора, гемофильтра или гемоконцентратора;
- условия хранения и обращения.
6.1.2 Транспортная тара (упаковка)
Маркировка транспортной упаковки должна содержать:
- наименование и адрес изготовителя;
- наименование и адрес дистрибьютора, если они отличаются от наименования и адреса изготовителя;
- наименование изделия, описание содержимого и количество устройств, содержащихся в транспортной упаковке;
- идентификационный код изготовителя;
- номер партии, позволяющий проследить последовательность изготовления данного устройства;
- заключение о стерильности и апирогенности;
- месяц и год стерилизации с точностью до 30 дней, начиная с фактической даты стерилизации;
- инструкции и предупреждения о хранении и обращении.
6.1.3 Маркировка устройства
Маркировка устройства должна содержать:
- наименование предприятия-изготовителя;
- наименование изделия;
- идентификационный код предприятия-изготовителя изделия;
- номер партии, позволяющий проследить последовательность изготовления данного устройства;
- максимальное, рекомендуемое изготовителем трансмембранное давление (ТМР) или (при необходимости) среднее давление в катушечном гемодиализаторе (МСР);
- направление кровотока и потока диализирующего раствора (при необходимости).
6.2 Документация
6.2.1 Эксплуатационная документация
Документация каждой транспортной упаковки должна содержать:
- наименование и адрес предприятия-изготовителя;
- наименование изделия;
- идентификационный код предприятия - изготовителя изделия;
- заключение о стерильности и апирогенности, а также метод стерилизации;
- указание об однократном применении.
Примечание - Может также использоваться обозначение по ИСО 7000;
- различные предупредительные сообщения (6.2.3);
- рекомендуемую практику антикоагуляции;
- информацию о любом необходимом вспомогательном оборудовании;
- наименование типа и (при необходимости) фирменный знак мембраны;
- общее описание устройства.
Примечание - Описание должно содержать специальные параметры, например скорость фильтрации, требующую специальных регуляторов, или необходимость деаэрации диализирующего раствора;
- рекомендации по применению соединений полости диализирующего раствора или фильтрата;
- эксплуатационные характеристики в соответствии с 4.7.
Примечание - При необходимости информацию приводят в виде графиков, позволяющих провести интерполяцию параметров;
- уведомление пользователя о предоставлении по его запросу следующей информации:
а) описание методов испытания, используемых для получения значений при определении характеристик in vitro;
б) соответствие характеристики in vivo приведенным в 4.7 характеристикам in vitro:
в) объем тромбированной и остаточной возвращаемой крови;
г) основные наименования материалов конструкции в соответствии с НД;
д) число и диапазон размеров микрочастиц и волокон в отмывочном растворе при подготовке согласно рекомендациям предприятия-изготовителя для клинического использования, а также описание метода испытания, используемого для проведения подобного измерения.
6.2.2 Инструкция пользователя
Инструкция должна содержать следующую информацию для установки и наладки устройства:
- направление монтажа устройства на несущей конструкции, если это применимо;
- расположение соединений для кровопроводящих магистралей и (при необходимости) расположение соединений трубопровода для диализирующего раствора;
- рекомендуемую методику заправки, отмывки и завершения процессов гемодиализа, гемофильтрации и гемоконцентрации;
- направление кровотока (если это применимо);
- типичную диаграмму потоков.
6.2.3 Предупредительные сообщения
Сообщение должно содержать:
- ограничения по давлениям;
- ограничения по расходу диализирующего раствора (для гемодиализаторов);
- ограничения по расходу крови;
- предупреждение (при необходимости) о том, что вследствие обязательной фильтрации нулевая скорость фильтрации не может быть достигнута без положительного давления диализирующего раствора, которое представляет опасность из-за риска проникновения нестерильного диализирующего раствора в кровоток и (если это возможно) риска пережатия полости по крови в результате сдавления диализирующим раствором полупроницаемой мембраны;
- инструкцию по отмыванию устройства перед его использованием;
- предупреждение о необходимости использования специального оборудования;
- перечень известных отрицательных реакций;
- перечень общих и специальных противопоказаний, например "Не рекомендовано для педиатрического использования", "Не использовать на недеаэрирующих системах подачи диализирующего раствора";
- предупреждение о снижении эксплуатационных характеристик при использовании устройств со сниженным уровнем давлений и расхода ниже определенного уровня или при изменении ориентации в пространстве (горизонтальной, вертикальной и т.д.).
ПРИЛОЖЕНИЕ А
(обязательное)
Проверка адекватности методики испытания на целостность мембраны
Испытание проводят непосредственно перед реализацией устройства (5.6.2) и не рассматривают как испытание на контроль качества.
А.1 Сущность метода
Изделие подвергают неразрушающему испытанию для выявления утечек мембраны. Для определения утечки крови проводят перфузию устройства кровью в стендовых условиях (in vitro).
А.2 Реагенты
А.2.1 Антикоагулированная бычья или человеческая кровь с гематокритом 25% и концентрацией протеина (60±5) г/л при температуре (37±1) °C.
А.2.2 Диализирующий раствор: вода при температуре 37 °С или (если имеет значение клиренс ионов) раствор хлорида натрия 154 мгэкв/л.
А.3 Аппаратура
А.3.1 Перфузионный насос (по НД) для клинического гемодиализа, гемофильтрации и гемоконцентрации.
А.3.2 Сосуд из пластика или нержавеющей стали для перфузата.
А.3.3 Нагреватель, не имеющий непосредственного контакта с перфузатом и обладающий способностью поддерживать температуру перфузата (37±1) °С (по НД).
А.3.4 Измерители давления (по НД), используемые при гемодиализе, гемофильтрации или гемоконцентрации.
А.3.5 Комплект кровопроводящих магистралей для клинического гемодиализа, гемофильтрации или гемоконцентрации по ГОСТ Р ИСО 8638.
А.3.6 Система для перемещения диализирующего раствора температурой (37±1) °С через полость по диализату гемодиализатора.
Примечание - Данную систему принимают только для гемодиализаторов.
A.4 Выборка и подготовка образцов к испытанию
Используют (где это применимо) статистически значимую выборку образцов устройств, отвечающих всем критериям безопасности и качества. Подготовка устройств - в соответствии с рекомендациями к клиническому применению изготовителя.
А.5 Методика
Полость по крови (А.2.1) заполняют кровью. Кровь рециркулируют через полость по крови при максимальном градиенте давления на полупроницаемой мембране, рекомендованном изготовителем, при этом расход крови выбирают типичным для расхода крови при клинической процедуре.
По истечении 30 мин исследуют визуально диализирующий раствор или фильтрат на присутствие крови.
А.6 Оформление результатов
Не должно быть обнаружено присутствия крови.
Полученные результаты оценивают в протоколе как "удовлетворительные" или "неудовлетворительные".
А.7 Протокол испытания
Если какой-либо образец не прошел испытание, результат фиксируют в протоколе как "неудовлетворительный".
В протоколе испытаний приводят также объем выборки и обоснование ее статистической достоверности.
________________________________________________________________________
УДК 616-073.27-7:006.354 ОКС 11.040.20 Р24 ОКСТУ 9444
Ключевые слова: медицинское изделие, кровь, диализ, гемодиализаторы, определения, технические условия, испытания, упаковка, маркировка
________________________________________________________________________
Электронный текст документа
и сверен по:
М.: ИПК Издательство стандартов, 2000