ГОСТ Р ИСО 13958-2015
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
КОНЦЕНТРАТЫ ДЛЯ ГЕМОДИАЛИЗА И СОПУТСТВУЮЩЕЙ ТЕРАПИИ
Concentrates for haemodialysis and related therapies
ОКС 11.040.40
ОКП 93 9890
Дата введения 2016-03-01
Предисловие
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией "Институт медико-биологических исследований и технологий" (АНО "ИМБИИТ") на основе собственного аутентичного перевода на русский язык международного стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 422 "Оценка биологического действия медицинских изделий"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 20 марта 2015 г. N 149-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 13958:2009* "Концентраты для гемодиализа и сопутствующей терапии" (ISO 13958:2009 "Concentrates for haemodialysis and related therapies").
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
Международная организация по стандартизации (ИСО) является всемирной федерацией национальных организаций по стандартизации (комитетов - членов ИСО). Разработка международных стандартов обычно осуществляется техническими комитетами ИСО. Каждый комитет-член, заинтересованный в деятельности, для которой был создан технический комитет, имеет право быть представленным в этом комитете. Международные правительственные и неправительственные организации, имеющие связи с ИСО, также принимают участие в работах. Что касается стандартизации в области электротехники, то ИСО работает в тесном сотрудничестве с Международной электротехнической комиссией (МЭК).
Проекты международных стандартов разрабатываются в соответствии с правилами Директив ИСО/МЭК, Часть 2.
Основная задача технических комитетов заключается в подготовке международных стандартов. Проекты международных стандартов, принятые техническими комитетами, рассылаются комитетам-членам на голосование. Их опубликование в качестве международных стандартов требует одобрения не менее 75% комитетов-членов, принимающих участие в голосовании.
Следует иметь в виду, что некоторые элементы настоящего международного стандарта могут быть объектом патентных прав. ИСО не может нести ответственность за идентификацию какого-либо одного или всех патентных прав.
ИСО 13958 был подготовлен Техническим комитетом ИСО/ТС 150, Имплантаты для хирургии, Подкомитетом SC 2, Сердечно-сосудистые имплантаты и экстракорпоральные системы.
Настоящее второе издание отменяет и заменяет первое издание ИСО 13958:2002, которое было технически пересмотрено.
Требования и цели, установленные данным стандартом, помогают обеспечивать эффективные безопасные рабочие характеристики концентратов для гемодиализа и сопутствующих материалов. Данный стандарт отражает сознательные усилия заинтересованных врачей, клинических инженеров, медсестер, обслуживающего персонала при диализе и пациентов на диализе при консультациях с производителями изделий и представителями правительства по разработке стандарта на уровне рабочих характеристик, которые могут быть реально достигнуты на момент публикации. Термин "согласие" в приложении к разработке добровольных стандартов на медицинские изделия не подразумевает единства мнений, а скорее отражает компромисс, необходимый по некоторым вопросам, когда необходимо согласовать различные интересы.
На протяжении данного стандарта приведены рекомендации по использованию воды качества ИСО. Поэтому, рекомендуется просмотреть ИСО 13959 совместно с данным стандартом.
Данный стандарт не включает диализирующие растворы, которые используются для клинического диализа пациента. Диализирующий раствор обсуждается в ИСО 11663. Приготовление диализирующего раствора включает дозирование концентрата и воды в палате или в центральной системе доставки диализирующего раствора. Хотя требования к диализирующим растворам, помещаемые на этикетку, наносятся на этикетку концентрата, обеспечение надлежащего использования является ответственностью пользователя.
Кроме того, данный стандарт не включает оборудование для гемодиализа, которое рассматривается в новом издании МЭК 60601-2-16.
Глагольные формы, используемые в данном стандарте, соответствуют описанным в Приложении Н Директив ИСО/МЭК, Часть 2.
В рамках данного стандарта грамматическая форма:
- "должен" означает, что соответствие требованию или испытанию обязательно для соответствия данному международному стандарту;
- "следует" означает, что соответствие требованию или испытанию желательно, но не обязательно для соответствия данному международному стандарту;
- "может" используется для описания допустимых способов достижения соответствия требованиям или испытаниям.
1 Область применения
Настоящий стандарт определяет минимальные требования к концентратам, используемым для гемодиализа и сопутствующей терапии. В рамках настоящего стандарта "концентраты" - это смесь химических элементов и воды, или смесь химических элементов в виде сухого порошка, или другие сильно концентрированные среды, которые поставляются конечному пользователю для производства диализирующих растворов, используемых для проведения гемодиализа и сопутствующей терапии.
Настоящий стандарт предназначен для производителей подобных концентратов. В некоторых случаях в стандарте возникает необходимость обратиться к диализирующему раствору, приготовляемому конечным пользователем, чтобы помочь прояснить требования к производству концентратов. Производитель концентратов не может контролировать конечный диализирующий раствор, любые ссылки на диализирующий раствор даны для пояснения, а не как требования к производителю.
Настоящий стандарт включает концентраты, как в жидком виде, так и в виде сухого порошка.
Настоящий стандарт включает добавки, называемые присадки, которые представляют собой химические вещества, которые могут быть добавлены к концентрату для увеличения концентрации одного или более имеющихся ионов в концентрате и, следовательно, в конечном диализирующем растворе.
В настоящем стандарте приведены требования к оборудованию, используемому для смешивания кислотного и бикарбонатного порошка в концентрате в лечебном учреждении пользователя.
Из области применения настоящего стандарта исключаются концентраты, приготовленные из предварительно упакованных солей и воды в диализных отделениях для использования в отделении. Хотя здесь появляются ссылки на диализирующий раствор.
Настоящий стандарт не касается диализирующих растворов, производимых конечным пользователем. Исключаются из области применения данного настоящего стандарта требования к частоте контроля чистоты воды, используемой для производства диализирующего раствора диализным отделением. Рекомендации по контролю качества воды содержатся в ИСО 23500.
Настоящий стандарт не касается упаковки для стерильного диализирующего раствора или сорбентов системы регенерации диализирующего раствора, в которой регенерируют и циркулируют малые объемы диализирующего раствора.
2 Нормативные ссылки
Ссылка на следующие документы обязательна при использовании данного документа*. Для ссылок применяются только указанное по тексту издание. Для ссылок необходимо использовать самое последнее издание нормативного ссылочного документа (включая любые изменения).
________________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ИСО 11663 Качество диализирующего раствора для гемодиализа и сопутствующей терапии (ISO 11663, Quality of dialysis fluid for haemodialysis and related therapies)
ИСО 13959 Вода для гемодиализа и сопутствующей терапии (ISO 13959, Water for haemodialysis and related therapies)
МЭК 60601-1 Медицинское электрооборудование. Часть 1. Общие требования к основам безопасности и основным рабочим характеристикам (IEC 60601-1, Medical electrical equipment - Part 1: General requirements for basic safety and essential performance)
МЭК 61010-1 Требования безопасности электрического оборудования для измерения, контроля и лабораторного использования. Часть 1. Общие требования (IEC 61010-1, Safety requirements for electrical equipment for measurement, control and laboratory use - Part 1: General requirements)
3 Термины и определения
В настоящем стандарте применены термины с соответствующими определениями:
3.1 ацетатный концентрат (acetate concentrate): Смесь солей, содержащая ацетат, которая при разведении водой для диализа образует свободный от бикарбонатов диализирующий раствор для использования при диализе.
Примечания
1 Ацетатный концентрат может содержать глюкозу.
2 Ацетат натрия используется для обеспечения буфера вместо бикарбоната натрия.
3 Ацетатный концентрат используется как унифицированный концентрат.
3.2 кислотный концентрат А-концентрат (acid concentrate A-concentrate): Подкисленная концентрированная смесь солей, которая при разведении водой для диализа с бикарбонатным концентратом образуют диализирующий раствор для использования при диализе.
Примечания
1 Термин "кислотный" относится к небольшому количеству кислоты (обычно уксусной кислоты), включенной в концентрат.
2 Кислотный концентрат может содержать глюкозу.
3 Кислотный концентрат может быть в виде жидкости, сухого порошка или комбинации обеих форм.
3.3 добавка присадка (additive spike): Небольшое количество отдельного химического вещества, которое при добавлении в концентрат увеличивает концентрацию отдельного имеющегося химического вещества на значение, маркированное на упаковке добавки.
3.4 пакетная система (batch system): Аппаратура, в которой диализирующий раствор готовится в крупной таре большими партиями перед каждой процедурой диализа.
3.5 бикарбонатный концентрат В-концентрат (bicarbonate concentrate B-concentrate): Концентрированный бикарбонат натрия, который при разведении водой для диализа с кислотным концентратом образует диализирующий раствор для использования при диализе.
Примечания
1 Бикарбонат натрия также известен как гидрокарбонат натрия.
2 Некоторые бикарбонатные концентраты могут также содержать хлорид натрия.
3 Бикарбонатный концентрат может быть в виде жидкости или сухого порошка.
4 Сухой бикарбонат натрия без добавления хлорида натрия также используется в генераторах концентрата для производства насыщенного раствора бикарбоната натрия, используемого диализными аппаратами для приготовления диализирующего раствора.
3.6 бикарбонатный диализирующий раствор (bicarbonate dialysis fluid): Диализирующий раствор, содержащий физиологические или более высокие концентрации бикарбоната.
Примечание - Бикарбонатный диализирующий раствор обычно производится из двух концентратов: одного, содержащего бикарбонат, и другого, содержащего кислоту и другие электролиты, см. 3.2, 3.5.
3.7 доставка крупной тарой (bulk delivery): Доставка контейнеров большого объема с концентратами в диализное отделение.
Примечание - Доставка крупной тарой включает такие контейнеры, как баки, которые могут быть поставлены в накопители, обслуживаемые диализным отделением. Альтернативно баки могут быть оставлены в центре и использоваться для заполнения контейнеров для переноса, в которых концентрат переносится к машинам для диализа. Доставка крупной тарой может также включать большие контейнеры для подключения к центральной системе поставки концентрата.
3.8 накопители для хранения (bulk storage tank): Большие накопители в учреждении пользователя для хранения воды для диализа и концентратов, доставляемых крупной тарой, или для концентратов, приготовленных в крупной таре в учреждении пользователя из порошка и воды для диализа.
3.9 центральная система концентраторов (central concentrate system): Система, которая готовит и/или хранит концентраты в центральной точке для последующего распределения в точки использования.
3.10 генератор концентрата (concentrate generator): Система, при которой концентрат доставляется пользователю в виде порошка в контейнере, подходящем для подсоединения к диализной установке, которая предполагается для использования, и где затем происходит преобразование в концентрированный раствор.
Примечание - Раствор, произведенный генератором концентрата, используется машиной для диализа для получения конечного диализирующего раствора, подаваемого в диализатор.
3.11 концентрированная смесь (concentrate mixer): Смесь для подготовки концентрата для диализа или диализирующего раствора в отделении диализа.
3.12 диализирующий раствор (dialysis fluid): Жидкость на водной основе, содержащая электролиты и обычно буфер и глюкозу, предназначенная для обмена растворенных веществ с кровью при гемодиализе.
Примечания
1 Термин "диализирующий раствор" используется на протяжении данного документа в значении жидкости, приготовленной из воды для диализа и концентратов, доставляемой в диализатор через систему доставки диализирующего раствора. В значении диализирующего раствора могут использоваться такие фразы как "диализат", "раствор для диализа" или "диализирующая жидкость".
2 Диализирующий раствор, вводимый в диализатор, считается "свежим диализирующим раствором", а жидкость, выводимая из диализатора, считается "использованным диализирующим раствором".
3 Диализирующий раствор не включает предварительно упакованные парентеральные жидкости, используемые при некоторых видах заместительной терапии функции почек, таких как гемодиафильтрация и гемофильтрация.
3.13 система доставки диализирующего раствора (dialysis fluid delivery system): Устройство, которое:
- готовит диализирующий раствор из воды для диализа и концентратов в режиме реального времени или хранит и распределяет предварительно смешанный диализирующий раствор;
- обеспечивает циркуляцию диализирующего раствора через диализатор;
- контролирует температуру, проводимость (или эквивалент), давление и поток диализирующего раствора и утечки крови;
- препятствует диализу в режимах дезинфекции или чистки
Примечания
1 Термин включает резервуары, каналы, дозаторы жидкости для диализа, а также мониторы и аварийные сигнализации, и контролирующие устройства, собранные как система для целей, перечисленных выше.
2 Система доставки диализирующего раствора может быть встроенной частью для отдельного пациента или централизованной системой приготовления, которая питает множество систем прикроватного контроля.
3 Система доставки диализирующего раствора также известна как система дозирования и система поставки диализирующего раствора.
3.14 вода для диализа (dialysis water): Вода, которая была обработана, чтобы соответствовать требованиям ИСО 13959 и которая подходит для использования при гемодиализе, включая приготовление диализирующего раствора, повторную обработку диализатора, приготовление концентратов и приготовление замещающей жидкости для конвекционной терапии в режиме реального времени.
3.15 эндотоксины (endotoxin): Основной компонент внешней стенки клеток грамотрицательных бактерий.
Примечание - Эндотоксины - это липополисахариды, которые состоят из цепочек полисахаридов, ковалентно связанных с липидами А. Эндотоксины могут резко активировать как гуморальный, так и клеточный иммунитет, что приводит к синдрому, характеризующемуся лихорадкой, дрожью, ознобом, гипотензией, полиорганной недостаточностью и даже смертью, если допустить их проникновение в систему кровообращения в достаточном количестве.
3.16 единицы эндотоксинов (endotoxin units EU): Единицы, определенные при испытании с использованием лизата амебоцита Limulus (Limulus amoebocyte lysate, LAL) на эндотоксины.
Примечания
1 Активность эндотоксинов зависит от бактерий, из которых они получены, их активность соотносится со стандартным эндотоксином.
2 В некоторых странах концентрации эндотоксинов выражаются в международных единицах (international units, IU). С 1983 г., когда была гармонизирована оценка эндотоксинов, EU и IU эквиваленты.
3.17 гемодиализ (haemodialysis): Форма заместительной терапии функции почек, при которой ненужные растворенные вещества удаляются в основном за счет диффузии из кровеносного потока с одной стороны мембраны в поток диализирующего раствора с другой стороны.
Примечание - Удаление жидкости, достаточное для получения требуемой потери веса, достигается при помощи установления градиента гидростатического давления через мембрану. Данное удаление жидкости обеспечивает некоторое дополнительное удаление ненужных растворенных веществ, в частности высокомолекулярных растворенных веществ.
3.18 испытание с использованием лизата амебоцита Limulus LAL испытание (Limulus amoebocyte lysate test LAL test): Проба, используемая для определения эндотоксинов.
Примечание - Метод определения, использующий химический ответ мечехвоста (Limulus polyphemus) на эндотоксины.
3.19 производитель (manufacturer): Организация, разрабатывающая, производящая, монтирующая, собирающая, изготовляющая или обрабатывающая конечное изделие.
Примечание - Производители включают, но не ограничивается, тех, кто выполняет функции стерилизации по контракту, установки, повторного этикетирования, повторного производства, повторной упаковки или разработки спецификации, а также начальных дистрибьюторов иностранных организаций, выполняющих эти функции. Термин не включает приготовление концентратов из предварительно упакованных сухих химических элементов в диализных отделениях или обращение с концентратами в крупной таре в диализных отделениях после того, как ответственность за концентраты была передана от производителя пользователю.
3.20 система дозирования (proportioning system): Установка, которая дозирует воду для диализа и концентраты для гемодиализа для приготовления диализирующего раствора.
3.21 пользователь (user): Врач или представитель врача, ответственный за корректное производство и обслуживание диализирующего раствора.
Примечание - Данный международный стандарт на медицинские изделия направлен в первую очередь на производителей изделий, и в данном контексте "пользователь" определяется, как описано выше.
4 Требования
4.1 Концентраты
4.1.1 Физическое состояние
Концентраты для гемодиализа могут поставляться в сухой или жидкой форме. Упаковка может быть для непосредственного использования с отдельным диализным аппаратом или для использования в системах, питающих сложные машины для диализа (использование с крупной тарой).
4.1.2 Растворы концентратов
4.1.2.1 Жидкие растворы концентратов
Все электролиты, указанные на этикетке, должны присутствовать в пределах ±5% от установленной концентрации или ±0,1 мЭкв/л (выраженные как концентрации диализирующего раствора), в зависимости от того, что больше, за исключением натрия, который должен присутствовать в пределах ±2,5% от концентрации, заявленной на этикетке. Глюкоза должна присутствовать в пределах ±5% от концентрации, заявленной на этикетке, или ±0,05 г/л (при измерении в диализирующем растворе, разведенном соответствующим образом), в зависимости от того, что больше.
Если концентраты включают нетрадиционные составляющие, такие как антиоксиданты и соединения железа, эти составляющие должны присутствовать в номинальных концентрациях с допуском ±5%.
Большинство концентратов производится со стандартными традиционными химическими веществами, такими как хлорид натрия, хлорид калия, хлорид магния, хлорид кальция, уксусная кислота, глюкоза и т.д. На рынке доступны новые концентраты, в которых некоторые химические вещества заменены другими; например, уксусная кислота заменяется лимонной кислотой. Если это происходит, этикетка должна это четко отражать, а замещающие химические вещества должны присутствовать в номинальных концентрациях с допуском ±5%.
4.1.2.2 Растворы концентратов на основе порошка
Если концентрат пакуется в сухой форме или как комбинация сухой и жидкой форм и смешивается в соответствии с инструкцией по эксплуатации производителя, конечный концентрат должен соответствовать требованиям 4.1.2.1.
4.1.3 Вода
Качество воды, используемой для производства концентрата, должно соответствовать ИСО 13959.
4.1.4 Бактериология концентратов
4.1.4.1 Бактериология бикарбонатных концентратов
Концентрат, содержащий бикарбонат, поставляемый в виде жидкости, должен быть в изолированном контейнере и производиться процессом, валидированным как производящий диализирующий раствор, соответствующий микробиологическим требованиям ИСО 11663, при использовании в соответствии с инструкциями производителя. Порошок бикарбоната, предназначенный для подготовки концентрата в диализном отделении, должен давать возможность производства диализирующего раствора, соответствующего микробиологическим требованиям ИСО 11663, при использовании в соответствии с инструкциями производителя.
4.1.4.2 Бактериология кислотных концентратов
Нет опубликованных данных, что кислотосодержащие концентраты поддерживают рост бактерий, и по этой причине нет необходимости испытывать кислотосодержащие концентраты на рост бактерий.
4.1.5 Уровни эндотоксинов
Концентрат должен быть произведен и упакован, используя процесс, утвержденный для производства диализирующего раствора, соответствующего требованиям к эндотоксинам по ИСО 11663 или применимым фармакопеям, при использовании в соответствии с инструкцией производителя.
4.1.6 Объем заполнения
Превышение объема заполнения контейнеров для жидкости или порошка, используемых с пакетной системой для унифицированной процедуры диализа, должно быть в пределах 2% от объема, заявленного на этикетке. Для непакетного использования объем заполнения должен быть 100% от установленного объема.
4.1.7 Качество химических элементов
Все химические элементы должны соответствовать требованиям применимых фармакопей, включая применимые части основных уведомлений и основных требований к испытаниям и пробам. Если все другие требования выполнены, обозначенные пределы для натрия, калия, кальция, магния и/или pH могут быть превышены, при надлежащей поправке, по необходимости, на наличие данных ионов в конечном составе. Также любые требования фармакопеи к химическим элементам, заявленным на этикетке для использования при гемодиализе, могут не выполняться, если производитель проводит свое собственное испытание на соответствие требованиям применимой фармакопеи.
4.1.8 Частицы
Жидкие концентраты для диализа должны фильтроваться через фильтр частиц с номиналом 1 мкм или меньше. Используемый фильтр частиц должен иметь мембрану, не высвобождающую волокна, которая не содержит материалов, которые известны как способные нанести вред человеку.
4.1.9 Добавки - "присадки"
Если поставляются добавки, то их концентрация, при правильном разведении водой или концентратом, не должна иметь превышать значение в пределах ±5% по весу от значения, заявленного на этикетке.
4.1.10 Контейнеры
Контейнеры, включая герметичные, не должны химически или физически взаимодействовать с содержимым так, чтобы изменять концентрацию, чистоту или качество концентратов при обработке, хранении и транспортировке. Контейнеры должны иметь запорные элементы, предотвращающие загрязнение или потерю содержимого. Каждый контейнер должен маркироваться, чтобы было показано его содержимое. Один из способов отображения содержимого - это использование соответствующего символа, приведенных в таблице 2.
4.1.11 Концентраты, доставляемые крупной тарой
Если концентраты доставляются в крупной таре, ответственность за обеспечение соответствия данному международному стандарту переходит от производителя к пользователю в юридической точке передачи груза. Как только концентрат передан от производителя пользователю, пользователь ответственен за поддержание продукта в пригодном состоянии с соответствующими процедурами по этикетированию и поддержанию неизменности.
4.1.12 Генераторы концентрата
Системы генераторов концентрата включают системы, которые смешивают порошок или порошок и сильно концентрированную жидкость с получением концентрата, образуя вязкий или жидкий раствор в контейнере, предназначенном для работы с определенными машинами для диализа. Смешивание совершается автоматической динамической дозирующей системой в пределах системы доставки диализирующего раствора. Эти концентраты доставляются пользователю в виде порошка или сильно концентрированной жидкости в контейнерах, разработанных для определенных машин, производитель генераторов концентрата ответственен за обеспечение того, что:
- все применимые разделы данного документа, касающиеся порошка, соблюдаются;
- контейнер функционирует с машинами, как определено производителями машин;
- неразведенный порошок защищен от попадания в поток диализирующего раствора.
4.2 Производственное оборудование
Любые материалы компонентов производственного оборудования (например, трубопроводных систем, систем хранения и распределения), которые могут контактировать с конечным концентратом или любыми компонентами концентрата, не должны физически или химически взаимодействовать с продуктом так, чтобы существенно менять концентрацию, чистоту или качество концентрата, оставляемого пользователю. Примеры материалов, которые не следует использовать в производственном оборудовании, включают медь, латунь, цинк, оцинкованные материалы или алюминий.
4.3 Системы для смешивания концентрата в отделении диализа
4.3.1 Общие положения
Следующие требования применяются к таким системам, как центральная система концентратов, используемая для приготовления кислотосодержащего или бикарбонатного концентратов на основе воды для диализа и порошка или других сильно концентрированных сред в отделении диализа.
4.3.2 Совместимость материалов
Материалы любых компонентов устройств/систем, смешивающих концентрат (включая системы хранения и распределения), контактирующие с раствором концентрата не должны химически или физически взаимодействовать с ним так, чтобы влиять на его чистоту или качество. Эти компоненты должны быть выполнены из инертных материалов (например, пластика) или соответствующей нержавеющей стали. Использование материалов, которые, как известно, приводят к токсичности при гемодиализе, таких как медь, латунь, цинк, оцинкованные материалы или алюминий, строго запрещено.
4.3.3 Защита при дезинфекции
4.3.3.1 Общие положения
Если производитель системы смешивания рекомендует химические дезинфицирующие вещества (см. 6.7.2 k), должны быть приняты меры по восстановлению системы до безопасного состояния по уровню остаточных дезинфицирующих средств до того, как система будет использована для приготовления партии концентрата. Если используется формальдегид, уровень остаточных веществ должен быть менее 3 мг/л; если используется хлорная известь, уровень остаточных веществ должен быть менее 0,1 мг/л; если используется озон, уровень остаточных веществ должен быть менее 0,1 мг/л; если используется коммерчески доступное бактерицидное средство, отличное от формальдегида, хлорной извести или озона, уровень остаточных веществ должен быть менее уровня, рекомендованного производителем конкретного бактерицидного средства. Если производитель рекомендует химическое дезинфицирующее вещество, то он должен также рекомендовать метод испытания уровня остаточных веществ дезинфицирующего вещества.
Если производитель системы смешивания рекомендует высокотемпературную дезинфекцию, должны быть приняты меры по восстановлению системы до безопасной температуры до того, как она будет использована для приготовления партии концентрата.
4.3.3.2 Блокировка доступа к системе
Если дезинфекция выполняется автоматически процедурами с использованием химических дезинфицирующих веществ, озона или высокой температуры, активация системы дезинфекции должна приводить к активации системы предупреждения, а также должны быть приняты меры для изоляции машин для гемодиализа от системы приготовления и распределения концентрата.
4.3.4 Требования безопасности
Каждое устройство/система для смешивания концентрата должно характеризоваться следующими минимальными параметрами безопасности:
a) блоки управления работой должны быть расположены так, чтобы минимизировать случайное управление и регулировку функций;
b) блоки управления распределением должны четко маркироваться, чтобы минимизировать вероятность ошибки при передаче концентрата.
4.3.5 Накопители для хранения
Следует, чтобы при использовании для бикарбонатного концентрата накопители для хранения имели коническое или чашеобразное основание и опорожнялись через нижнюю точку основания. Следует, чтобы бикарбонатные накопители для хранения имели плотно пригнанную крышку для предотвращения попадания загрязнителей и вентилировались через гидрофобный воздушный фильтр 0,45 мкм.
Жесткие, несгибаемые накопители для хранения кислотосодержащих концентратов могут иметь плоское дно, также следует обеспечить вентиляцию так, чтобы предотвратить засорение концентрата.
Не следует, чтобы накопители для хранения имели смотровые трубки, на которых могут расти водоросли и грибы. Должны быть предусмотрены меры по эффективной дезинфекции любого накопителя для хранения в системе распределения концентрата, подвергающегося микробиологическому загрязнению.
Дезинфекция накопителей для кислотосодержащих концентратов обычно не требуется. Тем не менее, бикарбонатные накопители следует дезинфицировать регулярно. Для хранения кислотосодержащих концентратов могут использоваться альтернативные накопители для хранения, такие как баллоны.
4.3.6 Ультрафиолетовые излучатели
Если системы хранения и распределения концентрата снабжаются ультрафиолетовыми излучателями для бактериологического контроля, они должны соответствовать следующему:
- ультрафиолетовый излучатель должен работать на частоте волн 254 нм;
- ультрафиолетовый излучатель должен обеспечивать дозу излучаемой энергии 16 милливатт-сек/см, если он снабжен калиброванным измерителем интенсивности ультрафиолета, в противном случае он должен обеспечивать дозу излучаемой энергии 30 милливатт-сек/см
;
- ультрафиолетовый излучатель должен быть калиброван соответственно максимальной скорости потока;
- ультрафиолетовый излучатель должен быть снабжен устройством контроля выходной энергии излучения в режиме реального времени или должна быть установлена рекомендуемая частота замены лампы;
- за ультрафиолетовым излучателем должен быть фильтр, удерживающий эндотоксины.
4.3.7 Системы трубок
Системы распределения концентрата не должны способствовать микробиологическому загрязнению концентрата. Системы распределения концентрата должны быть разработаны и работать таким образом, чтобы минимизировать распространение бактерий и образование биопленок, которые могут загрязнять восприимчивые концентраты. Частая дезинфекция - это один из способов минимизации распространения бактерий и биопленок.
4.3.8 Требования электрической безопасности
Там, где есть вероятность проникновения жидкости к пациенту, что способствует прохождению электрического тока, устройство должно соответствовать требованиям МЭК 60601-1 по электрической безопасности.
Если электрическая система изолирована от пациента, устройство должно соответствовать требованиям МЭК 61010-1, по электрической безопасности.
Примечание - Есть вероятность проникновения жидкости к пациенту, что способствует прохождению электрического тока. Ее наличие зависит от системы распределения и инструкции производителя по эксплуатации системы смешивания концентрата. Для достижения максимальной электрической безопасности рассматривают два случая: а) если есть вероятность устойчивого электрического канала и b) если электрическая система изолирована от пациента.
5 Испытания
5.1 Общие положения
В разделе определены методы испытания, с помощью которых может быть проверено соответствие требованиям раздела 4. Нумерация следующих подразделов соответствует нумерации подразделов раздела 4. Перечисленные методы испытания не представляют единственно приемлемые методы испытания, но предназначены для представления примеров приемлемых методов. Могут использоваться другие методы испытания, если продемонстрирована валидность методов испытания.
5.2 Концентраты
5.2.1 Физическое состояние
Соответствие требованиям 4.1.1 может быть определено визуальной инспекцией.
5.2.2 Растворы концентратов
5.2.2.1 Жидкие растворы концентратов
Соответствие требованиям 4.1.2.1 для кальция, калия, магния и натрия может быть определено, используя методы, описанные Американской ассоциацией здравоохранения [7], методы, рекомендуемые Агентством США по охране окружающей среды [12], методы, рекомендуемые в применимых фармакопеях или другие эквивалентные валидированные аналитические методы.
Образцы должны быть собраны в изолированные контейнеры. Для обеспечения точного определения должна использоваться соответствующая подготовка образцов, включая использование соответствующих каналов для смешивания и приведение pH, если необходимо.
Соответствие требованиям 4.1.2.1 для новых и нетрадиционных компонентов концентратов может быть определено используя соответствующие и валидированные аналитические методы.
Как предельные значения для воды для диализа должны использоваться максимальное содержание контаминантов, определенные в ИСО 13959.
Соответствие требованиям к составу диализирующего раствора может быть определено, как описано в таблице 1.
Таблица 1 - Аналитические испытания для химических компонентов
Компонент | Методы испытания |
Ацетат | Газовая хроматография, жидкостная хроматография, энзимный или потенциометрический методы |
Бикарбонат | Титрование и расчет кислоты, ионная хроматография или другие методы для общего СО |
Кальций | Титриметрический ЭДТА (EDTA) метод, или атомная абсорбция (прямое проникновение), спектрометрия индуктивно связанной плазмы (прямое проникновение), или ионная хроматография |
Глюкоза | Поляриметрия, энзимная, жидкостная хроматография или химические методы |
Магний | Атомная абсорбция (прямое проникновение), спектрометрия индуктивно связанной плазмы (прямое проникновение) или ионная хроматография |
Калий | Пламенно-фотометрический метод, атомная абсорбция (прямое проникновение), спектрометрия индуктивно связанной плазмы (прямое проникновение) или ионная хроматография |
Натрий | Атомная абсорбция (прямое проникновение), пламенно-фотометрический метод, спектрометрия индуктивно связанной плазмы (прямое проникновение), ионно-специфичный электрод или ионная хроматография |
5.2.2.2 Растворы концентратов на основе порошка
Для испытания растворов концентратов на основе сухого порошка содержимое упаковки должно смешиваться в соответствии с инструкциями производителя и испытываться в соответствии с 5.2.2.1.
5.2.3 Вода
Соответствие требованиям к качеству воды 4.1.3 может быть определено, используя методы, приведенные в ИСО 13959.
5.2.4 Бактериология бикарбонатных концентратов
Чтобы убедиться в соответствии с 4.1.4, можно использовать следующую процедуру. Общее число жизнеспособных организмов (стандартное число в чашке Петри) должно быть получено, используя метод мембранного фильтра или другие валидированные стандартные бактериологические методы испытания. Метод калиброванного цикла не должен использоваться. Питательной средой должен быть триптоноглюкозный агар (tryptone glucose extract agar, TGEA) с добавлением 4% бикарбоната натрия, Reasoner 2A (R2A) с добавлением 4% бикарбоната натрия, триптический соевый агар (trypticase soy agar, TSA) или эквивалент. Нельзя использовать кровяной агар или шоколадный агар. Необходимо использовать температуру инкубации от 17°С до 23°С и время инкубации 168 ч (7 д.).
5.2.5 Уровни эндотоксинов
Соответствие требованиям 4.1.5 может быть определено LAL испытанием на эндотоксины.
5.2.6 Объем заполнения
Соответствие требованиям 4.1.6 может быть определено, используя соответствующие волюметрические и гравиметрические методики.
5.2.7 Качество химикатов
Чистота химикатов, как определено в 4.1.7, может быть определена при помощи методов испытания, изложенных в соответствующей фармакопее.
5.2.8 Частицы
Соответствие требованиям 4.1.8 может быть определено инспекцией записей производителя продуктов, чтобы убедиться, что концентрат фильтровался через фильтр с номиналом 1 мкм.
5.2.9 Добавки - "присадки"
Соответствие 4.1.9 может быть определено растворением добавок в соответствующем концентрате с последующим измерением концентрации добавленных химических веществ для определения, изменяет ли присутствие добавок концентрацию данного химического вещества в пределах ±5% от значения, определенного на этикетке добавки. Альтернативно, добавки могут быть растворены в воде соответствующего качества и испытаны для определения, обеспечивают ли добавки определенное увеличение концентрации в пределах ±5% от значения, заявленного на этикетке. Должно быть проведено испытание в соответствии с 5.2.2.1, как только введены добавки.
5.2.10 Контейнеры
Соответствие требованиям 4.1.10 может быть определено испытаниями для пластиковых контейнеров, описанными в соответствующей фармакопее, или испытанием с вымыванием с химическим анализом вымываемого.
5.2.11 Концентраты, доставляемые крупной тарой
Соответствие требованиям 4.1.11 может быть определено пересмотром процедур доставки.
5.2.12 Генераторы концентрата
Соответствие 4.1.12 может быть подтверждено пересмотром производственных записей контейнеров, содержащих порошок, функциональными испытаниями с машиной для гемодиализа, для которой они предназначены и инспекцией этикеток продукта.
Примечание - Признается, что производитель может изменять свое оборудование, чтобы использовать системы генераторов концентрата других производителей. В данном случае, ответственность производителя машины - обеспечить, чтобы система генератора концентрата была совместима с машиной для диализа.
5.3 Производственное оборудование
Биосовместимость материалов компонентов, используемых при производстве оборудования, должна быть определена верификацией того, что компоненты, контактирующие с концентратом или водой, выполнены из инертных материалов (например, пластмасс или соответствующей нержавеющей стали), соответствующих требованиям применимых фармакопей или испытаний с вымыванием с химическим анализом вымываемого, и что эти компоненты, как известно, не вызывают токсичность системы с диализирующим раствором.
5.4 Системы для смешивания концентрата в отделении диализа
5.4.1 Общие положения
Следующие методы испытания применяются к 4.3.2-4.3.8, как указано.
5.4.2 Совместимость материалов
Соответствие требованиям 4.3.2 может быть проверено визуальной инспекцией и испытаниями, описанными в применимой фармакопеи или испытанием с вымыванием с химическим анализом вымываемого.
5.4.3 Защита при дезинфекции
5.4.3.1 Общие положения
Соответствие требованиям 4.3.3.1 может быть определено проверкой дезинфицирующего вещества в воде для ополаскивания в конце цикла дезинфекции. Если дезинфицирующим веществом является формальдегид, уровень остаточных веществ может быть определен реакцией Ханча, реагентами Шиффа или эквивалентными испытаниями. Если дезинфицирующим веществом является хлорная известь, уровень остаточных веществ может быть определен, используя DPD (3,5-дихлор-фенилдиазониевой солью) метод титрометрии железа или эквивалентные испытания. Если дезинфицирующим веществом является озон, уровень остаточных веществ может быть определен, используя контроль в режиме реального времени растворенного озона или анализ образца воды, используя испытательный набор на основе синего трисульфоната или DPD химии. Если используется коммерчески доступное бактерицидное средство (гермицид), отличное от формальдегида, хлорной извести или озона, должны использоваться испытания на уровне остаточных веществ бактерицидных средств (гермицида), установленные производителем бактерицидного средства (гермицида), в соответствии с инструкциями производителя по испытаниям.
Соответствие требованиям 4.3.3.1 для высокотемпературной дезинфекции может быть показано демонстрацией того, что температура воды для ополаскивания вода возвращается к безопасному значению.
5.4.3.2 Блокировка доступа к системе t
Соответствие требованиям 4.3.3.2 может быть определено физическими испытаниями и/или визуальной инспекцией.
5.4.4 Требования безопасности
Соответствие 4.3.4 может быть определено инспекцией.
5.4.5 Накопители для хранения
Соответствие требованиям 4.3.5 может быть определено визуальной инспекцией.
5.4.6 Ультрафиолетовые излучатели
Соответствие 4.3.6 может быть определено инспекцией.
5.4.7 Системы трубок
Отсутствие алюминиевых, медных, свинцовых, цинковых или гальванизированных компонентов и конфигурация системы/устройства для смешивания концентрата могут быть определены визуально. Отсутствие поступления бактерий и определенных химических загрязнителей в раствор из системы распределения может быть проверено, используя испытания, описанные в 5.2.4 и 5.3.
5.4.8 Требования электрической безопасности
Соответствие требованиям 4.3.8 может быть определено, используя испытания, приведенные в МЭК 60601-1 или МЭК 61010-1 в зависимости от того, что приемлемо.
6 Этикетирование
6.1 Общие положения
Термин "этикетирование" в данном международном стандарте включает любые письменные материалы, сопровождающие концентраты для гемодиализа и системы смешивания концентратов или любые письменные инструкции, предоставляемые производителем.
Этикетка на контейнере концентрата должна, как минимум, предоставлять информацию, содержащуюся в 6.2-6.6. Если приемлемо, могут использоваться символы.
Примечания
1 См. ИСО 15223.
2 В некоторых машинах смешивание концентрата происходит автоматически, а не проводится пользователем. В данных случаях, инструкции по эксплуатации могут быть изменены, чтобы соответствовать конкретной ситуации. Например, если машина берет порошок и жидкость и смешивает их внутри, нет необходимости в утверждении, что "концентрат хорошо перемешивается перед использованием". Конструкция машины должна это учитывать и смешивать концентрат соответствующим образом.
6.2 Общие требования к этикетированию концентратов
Этикетки концентратов согласно общим требованиям должны включать следующее:
a) наименование и адрес производителя/дистрибьютора;
b) дату окончания срока годности, если применимо.
Примечание - Обычно, на продукте указана дата окончания срока годности, а не дата производства;
c) дату производства, только если не применима дата окончания срока годности;
d) идентифицирующий номер партии;
e) список всех ингредиентов в конечном концентрате и последующих растворах;
f) состав, включая концентрации в граммах на литр (г/л) каждого ингредиента для жидкого концентрата или вес в контейнере каждого ингредиента для порошка;
g) состав диализирующего раствора, включая номинальные концентрации каждого электролита в миллиэквивалентах на литр (мЭкв/л) или милимоль на литр (ммоль/л) и концентрации не электролитов в диализирующем растворе в граммах на литр (г/л) или ммоль/л; химические концентрации в диализирующем растворе должны быть помещены на этикетку кислосодержащего концентрата.
Примечание - Если на этикетке недостаточно места, чтобы корректно представить требуемую информацию, допустимо предоставить эту информацию в альтернативном варианте, таком как вкладыш в упаковку;
h) для систем с крупной тарой, объем или вес концентрата(ов) для диализа и количество и качество воды, которые необходимо смешать; если смешивание производится автоматически, следовать инструкциям по эксплуатации производителя;
i) для дозирующих систем, соотношение концентрата для диализа и воды, которые необходимо смешать;
j) торговое наименование продукта, если применимо;
k) утверждение, касающееся требований по хранению, такое как, если применимо: "Хранить при комнатной температуре или ниже"; "Не замораживать"; и/или "Кратковременное воздействие горячих условий (40°С) не вредит кислотосодержащему концентрату";
l) любые специальные требования, которые необходимы из-за специфичности продукта (например, использовать генераторы концентрата с определенной системой доставки диализирующего раствора);
m) предупреждение о том, что может возникнуть рост бактерий, при использовании бикарбонатного концентрата (только бикарбонатного концентрата) и любые другие меры предосторожности, которые следует предпринять при смешивании концентрата;
n) если применимо, утверждение о необходимости испытания конечного диализирующего раствора по одному из следующих параметров: проводимость, pH, осмотическое давление, концентрация натрия или концентрация хлорида;
o) утверждение, что для разведения концентрата при создании диализирующего раствора необходимо использовать воду качества ИСО, соответствующую требованиям ИСО 13959;
р) предостережение от чрезмерного перемешивания бикарбонатного концентрата;
q) утверждение, касающееся любых специальных вопросов относительно буфера, если применимо (см. А.2.1.1).
6.3 Требования к этикетированию жидких концентратов
Этикетки жидких концентратов должны включать следующее:
а) инструкции по эксплуатации
1) Этикетка должна включать инструкции по тщательному перемешиванию перед использованием и инструкции не использовать поврежденные контейнеры. Если используется бикарбонат, должны быть включены предупреждения о возможности возникновения роста бактерий в концентрированном или разведенном бикарбонатном растворе.
2) На этикетке должно быть указано, что открытый бикарбонатный концентрат должен быть использован в течение времени, определенного производителем или в пределах 24 ч, если не указаны меры по продлению этого периода. Временной предел использования (определенный производителем) должен быть периодом, в течение которого концентрат постоянно производит диализирующий раствор, соответствующий химическим и микробиологическим рекомендациям ИСО 11663 при использовании в системе, обслуживаемой соответствующим образом.
3) На этикетках жидких концентратов можно включать геометрические символы (см. таблицу 2) для дифференциации различных соотношений смешивания. Если используются подобные символы, числа, представляющие систему дозирования, должны быть также хорошо видны и расположены в пределах контура геометрического символа. Этикетка должна включать средства различения кислоты и бикарбоната. Если концентрат не содержит калия или кальция, это должно быть заметно отображено на этикетке. Если используется цветовое кодирование, красный должен использоваться для кислоты, синий - для бикарбоната и белый - для ацетата.
b) утверждение о том, что раствор является апирогенным, если применимо
c) объем заполнения контейнера
d) номинальная проводимость конечного диализирующего раствора при смешивании в соответствии с инструкциями производителя или утверждение, что эта информация доступна у производителя.
6.4 Требования к этикетированию концентратов на основе порошка
Этикетки концентратов на основе порошка должны включать следующее.
a) инструкции по эксплуатации
1) Этикетка должна включать рекомендуемые условия хранения и правила смешивания. Если используется бикарбонат, должны быть указаны микробиологические пределы для используемой воды и другие микробиологические критерии (например, дезинфекция смешивающих аппаратов и аппаратов для хранения). Для определенных условий хранения должны быть указаны максимальное время хранения (срок годности) до разведения и после разведения. Если необходимо для обеспечения качества продукта конечным пользователем, руководство должно инструктировать пользователя по корректному использованию продукта. Следует, чтобы эти руководства включали, но не ограничивались бы этим качеством воды, используемой для разведения сухого порошка, корректные методы испытания (например, проводимости или pH) для проверки корректности разведения конечного диализирующего раствора, и любые специальные меры, которые следует принять для обеспечения корректного использования продукта.
2) Этикетка порошковых концентратов может включать геометрические символы (см. таблицу 2) для дифференциации различных соотношений смешивания. Если используются подобные символы, числа, представляющие систему дозирования, должны быть также хорошо видны и расположены в пределах контура геометрического символа. Этикетка должна включать средства различения кислоты и бикарбоната. Если концентрат не содержит калия или кальция, это должно быть заметно отображено на этикетке. Если используется цветовое кодирование, красный должен использоваться для кислоты и синий для бикарбоната.
b) инструкции по смешиванию сухого порошка в жидкий концентрат
c) количество воды, которое должно использоваться для восстановления концентрата
d) если применимо, оборудование для смешивания, с которым используется порошок
e) для бикарбонатного концентрата, временной предел использования для предотвращения возможного бактериального загрязнения. Также применимые предупреждения, что остаточный бикарбонатный концентрат, не вычищенный из накопителей для смешивания и систем для смешивания, способствует росту бактерий
f) качество воды, которая должна использоваться для смешивания концентрата (т.е. максимальный уровень бактерий и эндотоксинов)
6.5 Добавки
Этикетки добавок должны включать следующее:
- список продуктов, для которых могут использоваться добавки. Эффективные изменения в формуле концентрата и последующие изменения диализирующего раствора, к которым приводит добавление добавок;
- эффекты разведения конечного диализирующего раствора любыми жидкими добавками (наносится только на этикетки жидких добавок).
6.6 Требования к этикетированию генераторов концентрата
Этикетки генераторов концентрата должны включать следующее:
а) систему дозирования или машину для диализа, с которыми они используются.
Примечание - Возможно, что производитель может изменять свое оборудование, чтобы использовать системы генераторов концентрата других производителей. В данном случае, ответственность производителя машины - маркировать машину корректной моделью системы генератора концентрата и производителя;
b) значение времени, в течение которого разумно ожидается, что генератор концентрата подает раствор в диализатор, основываясь на скорости потока, определенной производителем (например, 6 ч при скорости потока 500 мл/мин); альтернативно, емкость генератора концентрата может быть выражена как объем концентрата, который может быть произведен генератором концентрата;
c) любую дополнительную информацию, которая должна быть известна пользователю, чтобы обеспечить корректное использование продукта (например, качество воды, срок годности после смешивания и т.д.).
Таблица 2 - Символы для систем контейнеров для концентратов: типы концентрата
Обозначение |
|
|
|
| Другое |
Соотношение для смешивания | 1:1,23:32,77 | 1:1,83:34 | 1:1,72:42,28 | 1:1,1:34 | TBD |
Соотношение для смешивания кислоты | 1:34 | 1:35,83 | 1:44 | 1:35,1 | TBD |
Соотношение для смешивания бикарбоната | 1:27,46 | 1:19,13 | 1:25,16 | 1:31,8 | TBD |
Символ | Квадрат | Круг | Треугольник | Ромб | TBD |
| |||||
6.7 Этикетирование систем смешивания концентрата
6.7.1 Общие положения
Этикетки систем смешивания концентрата должны включать следующее:
a) наименование и адрес производителя (нанесенные на устройство);
b) торговое наименование и тип изделия (нанесенные на устройство);
c) модель и серийный номер (нанесенные на устройство);
d) предупреждение, что следует прочитать сопроводительную литературу продукта до использования системы смешивания концентрата;
e) выделенное предупреждение о веществах (например, бактерицидных средствах), которые следует удалить из устройства перед его использованием;
f) идентификацию типа соединения или спецификацию, если необходимо предотвратить некорректное соединение (предпочтительно, прикрепленную к устройству, в противном случае, включенную в инструкцию по эксплуатации).
6.7.2 Сопроводительная литература продукта для систем смешивания концентратов
Производитель должен предоставить литературу, которая содержит, но не ограничивается данной информацией, каждому пользователю:
а) предупреждение, что каждая партия концентрата должна испытываться перед использованием в соответствии с инструкциями производителя;
b) предупреждение, что выбор оборудования для смешивания концентратов для диализа является ответственностью специалиста, отвечающего за диализ;
c) описание устройства или системы, включая список контролирующих устройств, сигнализации и компонентов устройства, предоставляемых в стандартной комплектации;
d) схематическую диаграмму устройства или системы, показывающую положение любых клапанов, устройств, осуществляющих контроль в режиме реального времени или портов забора образцов;
e) рабочие спецификации, такие как давление воды и скорость потока;
f) подробные инструкции по эксплуатации, включая начальный запуск; испытания и калибровку; работу и значения сигнализаций; рабочую регулировку контролирующих устройств, сигнализации и управляющих устройств; и соединения;
g) меры обеспечения безопасности и предупреждения, касающиеся последствий, если эти меры не будут приняты;
h) информацию, касающуюся устройств, контролирующих в режиме реального времени качество воды или концентратов, включая рабочие факторы, которые могут повлиять на рабочие характеристики устройства (например, температура);
i) конструкционные материалы, определенные в общем, которые контактируют с растворами;
j) информацию о бактерицидных веществах и чистящих агентах, которые известны как совместимые с материалами, используемыми в устройстве, а также информацию об известных химических веществах, с которыми материалы, используемые в конструкции устройства, несовместимы;
k) если применимо, методы очистки и дезинфекции оборудования, временной интервал между чистками и дезинфекциями системы, и методы удаления остаточных бактерицидных веществ;
l) другие инструкции по эксплуатации и обслуживанию, включая рекомендуемые процедуры и расписание профилактического обслуживания, рекомендуемое расписание контроля, руководство по выявлению и устранению неполадок пользователем, сервисную информацию, список рекомендуемых запасных частей, предупреждения о последствиях при невыполнении инструкции по эксплуатации;
m) предупреждение, что если после установки и последующего использования любые компоненты системы смешивания концентратов изменяются или заменяются, пользователь должен провести соответствующие испытания и калибровку;
n) если используется ультрафиолетовое излучение, необходимы этапы обслуживания, такие как замена и чистка источников излучения при обслуживании системы.
Приложение А
(справочное)
Обоснования для разработки и пересмотра настоящего стандарта
А.1 Область применения
Составляющие, включенные в область применения данного стандарта, это реагенты и устройства, необходимые для производства концентрата для гемодиализа. Данный стандарт относится как к жидким, так и к сухим концентратам. Он в первую очередь относится к производителям, но содержит полезную информацию и для пользователей.
Системы, которые регенерируют диализирующий раствор, за счет пропускания диализирующего раствора через систему для восстановления исходного состава диализирующего раствора, были специально исключены из области действия данного международного стандарта.
Концентрированные растворы, используемые при приготовлении диализирующего раствора для гемодиализа, жидкие или сухие, общие или специальные, начинают использоваться профессиональным пользователем, этот критический конечный этап производитель не контролирует. Данная двухступенчатая ответственность может приводить к путанице в обязанностях и ответственности вовлеченных сторон.
Концентрат, подготовленный и этикетированный соответствующим образом, может использоваться в неправильной комбинации; для данного пациента могут не использоваться корректные опции; некорректное обслуживание может привести к загрязнению конечного диализирующего раствора. Никакое оборудование или система не могут предотвратить или избежать данных ошибок. Только информированный и надежный специалист может контролировать эти конечные этапы процесса. Вероятность человеческой ошибки требует человеческого контроля.
Эти обстоятельства приводят к необходимости того, чтобы производитель маркировал концентраты четко, полно и ясно, и документировал доставку продукта и передачу ответственности за его применение учреждению пользователя и его профессиональному персоналу.
Клинический опыт ясно показал, что назначенные специалисты не могут точно знать количество буфера, добавленного как результат присутствия ацетата (в случае жидких концентратов) и ацетата и уксусной кислоты (гидрокарбонат натрия) (в случае сухого концентрата). Это добавляет 6 мЭкв/л анионов, для которых возможен метаболизм с образованием бикарбоната, независимо от первоначально прописанной концентрации бикарбоната, и может приводить к неожиданно высокой конечной концентрации буфера.
Хотя принципиальные положения направлены на адекватное безопасное лечение пациентов, другие соображения повлияли на содержание данного международного стандарта, такие как теоретические опасности, или отдаленные краткосрочные и долгосрочные риски. Гемодиализ - это сложная и дорогая процедура. Следовательно, была предпринята попытка создать стандарты, которые согласуются с рабочими ограничениями и удобством использования всегда, когда это возможно. Строгие нормы зарезервированы для серьезных терапий или для особенностей, которые уже достижимы при низкой нагрузке с минимальным неудобством для оператора. Более свободные нормы выбраны, когда риск для пациента является незначительным или фактор безопасности приближается к ограничениям имеющегося оборудования, требуется дорогостоящая модификация или обеспечиваются существенные проблемы для оператора.
А.2 Требования
А.2.1 Общие положения
А.2.1.1 Обзор
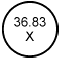
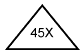
Отображение идентифицирующих данных и основной информации о содержимом снабжает необходимой информацией по использованию и ссылочной информацией и обеспечивает прослеживаемость. Использование бикарбонатного диализирующего раствора требует использования двух концентраций при приготовлении диализирующего раствора, т.к. концентрированный кальций и бикарбонат при смешивании выпадают в осадок. Широко используется технология двойного смешивания. Различные системы смешивают в различных соотношениях (например, 35Х, 36,83Х, 45Х), а другие системы используют непосредственно сухой порошок, из которого получают насыщенный раствор. Некоторые из этих концентратов содержат хлорид натрия в бикарбонатном растворе, что требует соответствующей корректировки для соответствующего дополняющего кислотосодержащего концентрата. Эта сложность ассортимента может приводить к путанице. В настоящее время не существует адекватного контроля для обеспечения того, что из неправильно подобранных концентратов не будет произведено конечного диализирующего раствора корректной общей проводимости, но не корректного состава. Пользователя предостерегают от того, чтобы полагаться только на измерения проводимости, для обеспечения безопасности, следует рассматривать все релевантные факторы, включая pH. Утверждение и использование соответствующих концентратов для производства желаемого диализирующего раствора является ответственностью пользователя. При вычислении общего количества оснований в конечном диализирующем растворе, следует рассматривать вклад ацетата (или любого другого органического аниона, дающего бикарбонат, так как он метаболизируется) из кислотосодержащего концентрата в дополнении к бикарбонату, содержащемуся в бикарбонатном концентрате.
Некоторые кислотосодержащие концентраты, например, те, которые имеют в составе гидрокарбонат натрия (смесь, образованная из уксусной кислоты и ацетата натрия), содержат больше органических анионов, чем традиционные концентраты. При использовании одного из этих концентратов, следует учитывать значительное увеличение оснований, полученных из кислотосодержащего концентрата, при выборе концентрации бикарбоната диализирующего раствора.
Таким образом, стандарты на системы доставки бикарбонатного диализирующего раствора должны касаться как системы дозирования, так и системы контроля, а также упаковки и этикетирования концентратов.
Учитывая вероятность некорректного использования концентрата, было принято решение подчеркнуть важность обучения и подготовки пользователей и определить требования к этикетированию.
Бикарбонатный диализирующий раствор может увеличивать образование осадка и накипи в путях, проводящих диализирующий раствор, включая контрольные электроды. Регулярная эффективная чистка путей, проводящих диализирующий раствор, особенно важна для функциональных характеристик машины. Галофильные бактерии могут размножаться в бикарбонатных концентратах, в то время как не известно бактерий, размножающихся в кислотосодержащих или ацетатных концентратах.
Спецификации на обслуживание, срок годности и микробиологический контроль должны устанавливаться каждым пользователем в соответствии с рекомендациями производителя. Производители должны предоставлять полную информацию и разумное руководство для специалистов в области здравоохранения для производства безопасного, соответствующего диализирующего раствора.
С настоящими технологиями конечная безопасность является ответственностью оператора по оборудованию. Для достижения конечного уровня безопасности, персонал должен быть обучен и подвергаться контролю. Эти меры являются ответственностью медицинского руководителя программы диализа.
Ацетатный концентрат - это унифицированный концентрат, который использует ацетат натрия, а не бикарбонат в качества буфера. С развитием технологий, частота использования ацетатного концентрата снижается.
А.2.1.2 Физическое состояние
Концентраты могут быть либо в жидкой, либо в сухой форме, в зависимости от их применения. В некоторых случаях, часть концентратов жидкие, а оставшиеся в сухой форме; в других случаях, используются два жидких концентрата.
А.2.1.3 Жидкие концентраты
Важно, чтобы реальные концентрации растворов, содержащихся в концентратах, были настолько близки, насколько это возможно, к значениям, заявленным на этикетке. Хотя значительные отклонения могут быть опасными для пациента, допуски менее 5% для глюкозы и второстепенных катионов могут быть последовательно достигнуты. Далее, если эти компоненты присутствуют в малых количествах, применимо отклонение 0,1 мЭкв/л для второстепенных катионов или 5 мг/дл для глюкозы. Эти отклонения необходимы для учета присутствия этих растворенных веществ в других исходных материалах и ограничений при производстве и испытании.
А.2.1.4 Вода
Было решено, что должна быть некоторая уверенность, что вода, используемая для подготовки концентрата, не вносит существенного вклада в уровень химического загрязнения, присутствующего в самом концентрате. Соответственно, требования к воде были взяты из ИСО 13959.
А.2.1.5 Бактериология бикарбонатных концентратов
Было показано, что бикарбонатные концентраты способствуют росту бактерий и представляют другие источники начального биозагрязнения, способные быстро увеличиваться после разведения (Ebben [9]; Bland [8]). Признание этих опасностей требует дополнительных мер предосторожности при приготовлении, помещении в контейнеры, хранении и быстром использовании для предотвращения чрезмерного роста галофильных организмов. Средства, обеспечивающие безопасность должны рекомендоваться производителем и устанавливаться и соблюдаться пользователями.
Много обсуждался вопрос использования подходящих сред и условий инкубации культур в бикарбонатном концентрате. В данном международном стандарте приведен один приемлемый метод. Вместо эталонного метода, описанного в 5.2.4, могут использоваться другие методы, которые согласно результатам испытания показывают, по крайней мере, в основном эквивалентные результаты.
Большинство микроорганизмов не растут в кислотосодержащих концентратах и, следовательно, нет требований к испытанию выходного уровня бактерий в кислотосодержащем концентрате.
А.2.1.6 Объем заполнения
Поставщик должен гарантировать, что объем соответствует этикетке и, следовательно, ожиданиям пользователя.
А.2.1.7 Качество химических элементов
Рекомендуется, чтобы все химические элементы соответствовали требованиям применимых фармакопей. Предельное содержание натрия, калия, кальция, магния и pH могут быть превышены, при условии, что их превышение компенсируется в конечном составе. Так как эти ионы добавляются в конечный состав, возможно внести некоторые корректировки для компенсации этих ионов без наложения ограничений соответствия требованиям.
Также учитывается, что на этикетке должно быть указано, используются ли эти химические вещества в гемодиализе. Т.к. требования к этикетированию не отражают всех изменений в спецификациях фармакопеи, было решено, что эти требования не улучшают качество продукта.
А.2.1.8 Добавки - "присадки"
Все вещества конечного концентрата должны быть указаны на этикетке так, чтобы пользователь мог определить точный состав продукта, т.к. любой компонент концентрата может проникать в кровеносный поток. Консерванты или индикаторы, присутствующие в концентрате, должны быть указаны на этикетке.
А.2.1.9 Контейнеры
Вещества из контейнера, загрязняющие концентрат могут проникать в пациента во время диализа и могут наносить вред пациенту. Следовательно, должны использоваться относительно инерционные контейнеры, которые не влияют на концентрацию или чистоту концентрата.
А.2.1.10 Уровни эндотоксинов
Контроль эндотоксинов в концентрате важен для предотвращения пирогенных реакций у пациента во время диализа. Предел эндотоксинов считается существенным для воды и диализирующего раствора, т.к. существуют доказательства, что пирогены из диализирующего раствора могут передаваться пациенту. Предел был установлен в ИСО 11663, т.к. конечный диализирующий раствор оказывает максимальное влияние на пациента и диализирующий раствор - это комбинация многих факторов, таких как бактериальное состояние концентрата, воды и чистота машины для диализа и любых соответствующих систем распределения.
А.2.1.11 Концентраты, доставляемые в большой таре
Доставка концентратов в большой таре становится общепринятой в некоторых странах. Это практика влечет за собой наличие ответственности, как пользователя, так и производителя. При осуществлении доставки крупной тарой, продукт распределяется в большие накопители для хранения и оригинальная этикетка утрачивается. Обслуживание накопителей обычно является ответственностью пользователя. Накопитель и связанная трубопроводная система должны периодически чиститься и дезинфицироваться в соответствии со стандартными процедурами. Следует обращать внимание на обеспечение того, что корректный состав помещается в правильный накопитель.
Используется много различных путей осуществления доставки крупной тарой. Было решено, что точка передачи раствора концентрата - это точка, в которой ответственность за его этикетирование и целостность переходит пользователю. Эти изменение должны определяться письменными процедурами.
Если концентрат доставляется конечному пользователю крупной тарой, пользователь должен принимать меры по обеспечению того, что корректный состав доставляется в правильный накопитель для хранения. Должна быть оформлена письменная документация по корректной доставке и точке передачи ответственности.
А.2.1.12 Системы генераторов концентрата
Как технологический прогресс, некоторые производители делают системы приготовления концентрата, которые готовят раствор для использования в машине для диализа. Было решено, что эти системы следует добавить в данный международный стандарт. Эти системы производят концентрированную суспензию, которая динамически смешивается с кислотосодержащим концентратом в машине для диализа. Т.к. смешивание производится динамически, эти канистры могут использоваться различным соотношением содержания кислот (36,1Х и 45Х). Символы на этих этикетках считаются необязательными и, возможно, вводящими в заблуждение из-за их неоднозначности. Так как соединяющие элементы могут отличаться, считается, что необходимо определить с какой машиной могут использоваться канистры.
Системы генераторов концентрата не могут использоваться с некоторыми дозирующими системами, такими как системы 36,83, в которых бикарбонат натрия смешивается с хлоридом натрия, т.к. нет возможности определить, что выдержано соотношение растворения бикарбоната натрия и хлорида натрия.
Ответственность производителя машины - разработать и произвести машину для диализа, включая все необходимые проверки безопасности для гарантии того, что система доставляет безопасный и эффективный диализирующий раствор для диализа. Если необходимо, должны быть предусмотрены фильтры для предотвращения проникновения в поток диализирующего раствора нерастворенного порошка.
А.2.2 Производственное оборудование
А.2.2.1 Общие положения
Нетоксичность конструкционных материалов для производственного оборудования - это основной способ предотвратить загрязнение концентрата. В настоящее время доступны данные, показывающие, что материалы, однажды принятые как инертные, могут быть токсичными при их применении (например, выщелачивание меди из медных труб, особенно при низком pH, которое может возникнуть при истощении деионизатора). Другие материалы были отмечены как опасные для пациента (например, медь, латунь, цинк, гальванизированные материалы и алюминий), и их также следует избегать. Некоторые хорошо известные не токсичные материалы включают определенные составы нержавеющей стали, силиконовую резину, боросиликатное стекло, полипропилен, поливинилхлорид, полиэтилен высокой плотности и политетрафторэтилен. Опасность конструкционных материалов возникает в результате длительной накапливающейся токсичности.
А.2.2.2 Уровни эндотоксинов
Требуется, чтобы концентрация эндотоксинов в бикарбонатном концентрате была такой, чтобы при его смешивании с водой в соответствующей пропорции, получившийся диализирующий раствор удовлетворял требованиям качества ИСО 11663. Так как эндотоксины в конечном диализирующем растворе могут быть получены как из концентрата, так и из воды, следует, чтобы вода, используемая для разведения концентрата для испытания на эндотоксины, содержала максимальный допустимый уровень эндотоксинов, допустимый ИСО 13959, чтобы конечный диализирующий раствор соответствовал требованиям ИСО 11663 в условиях наихудшего исполнения. Подразумевается, что вода, используемая для смешивания порошка для испытания, может содержать 0,25 EU/мл эндотоксинов. Практически невозможно приготовить воду, содержащую заданный уровень эндотоксинов, кроме того, оцениваемая концентрация эндотоксинов может изменяться при добавлении ионов из концентрата (образование агрегатов).
А.3 Этикетирование
А.3.1 Общие положения
Существующие нормативные акты устанавливают общие требования к этикетированию всех медицинских изделий, включая такую информацию, как наименование и адрес производителя, серийный номер. Тем не менее, было решено, что избыточность данных требований предпочтительнее пропуска и требования, сходные с информацией, определенной другими нормативными документами, были включены.
А.3.2 Требования к этикетированию жидких концентратов
Данная специализированная информация приведена для корректного использования концентрата для гемодиализа, поставляемого в жидком виде. Требование защиты от чрезмерного охлаждения, также как и требование защиты от чрезмерного нагрева рассматривались, но было отмечено, что условие тщательного перемешивания перед использованием защитит от использования концентрата, который был подвержен экстремальному охлаждению. Более того, защита от случайного использования некорректного раствора из-за схожести контейнеров считается крайне важной.
Не известны случаи пирогенных реакций, вызванных пирогенами кислотной части концентрата. Также существует вероятность, что кислотный концентрат деактивирует пирогены из-за низкого pH.
А.3.3 Требования к этикетированию концентратов на основе порошка
Известно, что бикарбонатный концентрат способствует росту бактерий. Другие данные поддерживают факт, что если контейнер не был корректно очищен и дезинфицирован, остаточный бикарбонатный концентрат способствует росту бактерий. Обычно производители рекомендуют срок годности для минимизации случаев возникновения роста бактерий. Этот предел должен точно соблюдаться пользователем.
Этикетка должна включать инструкции по тому, что следует избегать воздействия чрезмерных температур и держать контейнер тщательно изолированным во время использования. Если используется бикарбонат, должно быть включено предупреждение, что вода, содержащая даже приемлемое число бактерий, добавляется в среду, которая может способствовать росту бактерий и, следовательно, следует проводить процедуры для обеспечения микробиологической безопасности. В инструкции могут предлагаться методы, такие как улучшение качества воды или короткий период хранения, и следует, чтобы рекомендовалось, чтобы контейнер был чистым и недавно дезинфицировался. Аппаратура для смешивания бикарбоната должна также дезинфицироваться через соответствующие интервалы, в соответствии с инструкциями производителя.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ИСО 13959 | - | * |
ИСО 11663 | - | * |
МЭК 61010-1 | - | * |
МЭК 60601-1:2005 | IDT | ГОСТ Р МЭК 60601-1-2010 "Изделия медицинские электрические. Часть 1. Общие требования безопасности с учетом основных функциональных характеристик" |
* Соответствующий национальный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов. | ||
Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандарта: | ||
Библиография
[1] ИСО 15223-1 | Медицинские устройства. Символы, используемые на ярлыках медицинских устройств, при маркировке и в предоставляемой информации. Часть 1. Общие требования (ISO 15223-1 Medical devices - Symbols to be used with medical device labels, labelling and information to be supplied - Part 1: General requirements) | |
[2] ИСО 15223:2000/Amd 1:2002 | Медицинские устройства. Символы, используемые на ярлыках медицинских устройств, при маркировке и в предоставляемой информации. Часть 1. Общие требования, Дополнение 1 (ISO 15223:2000/Amd. 1:2002 Medical devices - Symbols to be used with medical device labels, labelling and information to be supplied - Amendment 1) | |
[3] ИСО 15223:2000/Amd 2:2004 | Медицинские устройства. Символы, используемые на ярлыках медицинских устройств, при маркировке и в предоставляемой информации. Часть 1. Общие требования, Дополнение 2 (ISO 15223:2000/Amd 2:2004 Medical Devices - Symbols to be used with medical device labels, labelling and information to be supplied, Amendment 2) | |
[4] ИСО 23500 | Жидкости для гемодиализа и сопутствующей терапии (ISO 23500, Fluids for haemodialysis and related therapies 1) | |
[5] МЭК 60601-2-16 | Медицинское электрооборудование. Часть 2-16. Специальные требования к основам безопасности и основным рабочим характеристикам оборудования для гемодиализа, гемодиафильтрации и гемофильтрации (IEC 60601-2-16, Medical electrical equipment - Part 2-16: Particular requirements for basic safety and essential performance of haemodialysis, haemodiafiltration and haemofiltration equipment) | |
[6] | ALFREY, А.С. and SMYTHE, W.R. Trace element abnormalities in chronic uremia. Proc. 11th Ann.Contractors Conf. (Artificial Kidney-Chronic Uremia Program, NIAMDD) pp. 137-139, 1978 | |
[7] | American Public Health Association, Standard Methods for the Examination of Water and Wastewater, (21 st ed.). Washington, D.C., APHA, 2005 | |
[8] | BLAND, L.A., et al. Potential bacteriologic and endotoxin hazards associated with liquid bicarbonate concentrate, Trans. Am. Soc. Artif. Int. Organs. 33, pp. 542-545, 1987 | |
[9] | EBBEN, J.P., et al. Microbiologic contamination of liquid bicarbonate concentrate for haemodialysis, Trans. Am. Soc. Artif. Int. Organs, 23, pp. 269-273, 1987 | |
[10] | European Pharmacopoeia, 5 | |
[11] | KESHAVIAH, P., LUEHMANN, D. and SHAPIRO, F. et al. Investigation of the risks and hazards associated with haemodialysis systems (Technical Report, Contract #223-78-5046), Dept, of Health and Human Services, Public Health Service/Food and Drug Administration/Bureau of Medical Devices, Silver Spring, MD, June, 1980 | |
[12] | U.S. Environmental Protection Agency, Methods for Chemical Analysis of Water and Waste (EPA-600-4-79-020) (Revised March 1983) Environmental Research Center, Environmental Monitoring and Support Laboratory, Cincinnati (Ohio), 1979 | |
[13] | U.S. Environmental Protection Agency, Methods for the Determination of Metals in Environmental Samples, Supplement 1 (EPA-600-R-94-111) Environmental Monitoring Systems Laboratory, Cincinnati (Ohio), 1994, htpp://www.epa.gov/OGWDW/methods/methods.html | |
[14] | U.S. Environmental Protection Agency, Safe Drinking Water Act, 1996 (Public Law 104-182).Washington, D.C., EPA, 1996 | |
[15] | United States Pharmacopeia, United States Pharmacopeia-National Formulary (USP 26-NF 21), Rockville, MD, United States Pharmacopeial Convention Inc., 2003 | |
УДК 628.1.038:616.61-78:006.354 | OKC 11.040.40 | ОКП 93 9890 |
Ключевые слова: гемодиализ, концентрат, диализирующий раствор, система доставки | ||
Электронный текст документа
и сверен по:
, 2015