ГОСТ Р 53000-2008
Группа Р23
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ЭНДОПРОТЕЗЫ МОЛОЧНЫХ ЖЕЛЕЗ
Общие технические требования
Методы испытаний
Implantable mammary prostheses.
General technical requirements. Test methods
ОКС 11.040.40
ОКП 93 9600
Дата введения 2009-07-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 РАЗРАБОТАН Федеральным государственным учреждением "Институт хирургии им. А.В.Вишневского Федерального агентства по высокотехнологичной медицинской помощи" (ФГУ "Институт хирургии им. А.В.Вишневского Росмедтехнологий")
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 453 "Имплантаты в хирургии"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 10 ноября 2008 г. N 293-ст
4 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
Настоящий стандарт распространяется на силиконовые однокамерные, наполненные силиконовым гелем эндопротезы молочных желез (далее - эндопротезы) и устанавливает общие технические требования, методы испытаний, требования к упаковке и маркировке.
Настоящий стандарт не распространяется на силиконовые эндопротезы молочных желез с другими наполнителями.
В соответствии с ГОСТ Р 51609 эндопротезы по требованию безопасности относятся к классу 3.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р ИСО 10993-1-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
ГОСТ Р ИСО 14630-99 Неактивные хирургические имплантаты. Общие технические требования
ГОСТ Р 51609-2000 Изделия медицинские. Классификация в зависимости от потенциального риска применения. Общие требования
ГОСТ Р 52770-2007 Изделия медицинские. Требования безопасности. Методы санитарно-химических и токсикологических испытаний
ГОСТ 8.423-81 Государственная система обеспечения единства измерений. Секундомеры механические. Методы и средства поверки
ГОСТ 9.030-74 Единая система защиты от коррозии и старения. Резины. Методы испытаний на стойкость в ненапряженном состоянии к воздействию жидких агрессивных сред
ГОСТ 166-89 (ИСО 3599-76) Штангенциркули. Технические условия
ГОСТ 270-75 Резина. Метод определения упругопрочностных свойств при растяжении
ГОСТ 427-75 Линейки измерительные металлические. Технические условия
ГОСТ 745-2003 Фольга алюминиевая для упаковки. Технические условия
ГОСТ 7328-2001 Гири. Общие технические условия
ГОСТ 11358-89 Толщиномеры и стенкомеры индикаторные с ценой деления 0,01 и 0,1 мм. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 13835-73 Каучук синтетический термостойкий низкомолекулярный СКТН. Технические условия
ГОСТ 17035-86 Пластмассы. Методы определения толщины пленок и листов
ГОСТ 17527-2003 Упаковка. Термины и определения
ГОСТ 24104-2001 Весы лабораторные. Общие технические требования
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25706-83 Лупы. Типы, основные параметры. Общие технические требования
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 28840-90 Машины для испытания материалов на растяжение, сжатие и изгиб. Общие технические требования
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 эндопротез молочной железы (маммарный имплантат): Устройство, внедряемое в организм для формирования искусственной молочной железы с косметической функцией.
3.2 оболочка эндопротеза: Камера, выполненная из силиконового эластомера в форме естественной молочной железы.
3.3 основание эндопротеза: Уплощенная часть оболочки, которая служит ориентиром при определении размеров протеза.
3.4 высота эндопротеза: Длина большой оси основания протеза.
3.5 ширина эндопротеза: Длина малой оси основания протеза.
3.6 профиль эндопротеза: Максимальная высота выпуклой части оболочки протеза, помещенного основанием на горизонтальную поверхность.
3.7 силиконовый гель: Наполнитель оболочки мягко-эластичной консистенции.
3.8 экстрагирование: Метод извлечения селективным растворителем свободного (несшитого) силикона из силиконового эндопротеза.
3.9 гель-фракция: Нерастворимая (сшитая) часть силиконового геля.
3.10 золь-фракция: Растворимая часть силиконового геля.
3.11 формоустойчивость геля: Отсутствие текучести и хрупкости геля.
3.12 идентификационная метка: Метка на поверхности или внутри эндопротеза, сохраняющаяся в течение срока его функционирования.
4 Назначение и общая характеристика эндопротезов
Эндопротезы молочных желез предназначены для хирургической коррекции контуров молочных желез при реконструктивно-восстановительных и эстетических операциях.
Эндопротезы молочных желез состоят из эластичной силиконовой оболочки, наполненной силиконовым гелем. Гель герметично укупорен в оболочке. Эндопротезы характеризуются размерами, формой, массой, плотностью геля. На оболочку эндопротеза могут быть нанесены метки для ориентации расположения эндопротеза при операции. Оболочка может иметь накладки для фиксации эндопротеза в организме.
5 Технические требования
5.1 Свойства эндопротезов молочных желез должны обеспечивать безопасность для здоровья пациентов. Изделия должны быть биосовместимыми и нетоксичными в соответствии с требованиями ГОСТ Р ИСО 10993-1, ГОСТ Р ИСО 14630 и ГОСТ Р 52770.
5.2 Эндопротезы молочных желез должны выпускаться стерильными (ГОСТ Р ИСО 14630, раздел 9). Метод и контроль стерилизации определяет изготовитель.
5.3 Упаковка эндопротезов должна соответствовать требованиям раздела 10 ГОСТ Р ИСО 14630. Эндопротез должен быть упакован в наружную и внутреннюю жесткую тару по ГОСТ 17527. Внутренняя тара должна обеспечивать сохранение стерильности эндопротеза.
5.4 Эндопротезы должны соответствовать характеристикам, установленным изготовителем в части: массы, формы, размеров, типов; отметки о стерильности с указанием метода стерилизации; запрета на повторную стерилизацию; сроках выпуска; сроках и условиях хранения и транспортирования.
5.5 Оболочка - силиконовый эластомер, наполнитель - силиконовый гель (далее - гель). Все используемые материалы по безопасности должны удовлетворять требованиям ГОСТ Р ИСО 10993-1, ГОСТ Р ИСО 14630 и ГОСТ Р 52770.
5.6 Поверхность эндопротеза не должна быть маслянистой. На поверхности эндопротеза не должно быть дефектов, видимых невооруженным глазом и через лупу: трещин, наплывов, загрязнений, пузырьков воздуха. Место закрытия технологического отверстия оболочки накладкой должно быть гладким и не содержать пустот. На оболочке протеза должна быть идентификационная метка.
5.7 Отклонение массы от номинальной не должно быть более ±3%. Рекомендуемая максимальная масса эндопротеза - 500 г.
5.8 Отклонение высоты, ширины и профиля от номинальных размеров не должно быть более ±10%.
5.9 Эндопротез не должен разрушаться при сжатии под воздействием груза массой 10 кг в течение 10 мин: не должно быть разрыва оболочки, образования трещин, расслоения соединительных элементов оболочки и герметизирующей накладки.
5.10 Рекомендуемая толщина оболочки - не более 0,70 мм.
5.11 Предел прочности оболочки при разрыве должен быть не менее 3 МПа. Относительное удлинение при разрыве оболочки должно быть не менее 350%, остаточное удлинение должно быть не более 10%.
5.12 Соединение оболочки эндопротеза и накладки, герметизирующей технологическое отверстие, должно выдерживать растяжение на 300% в течение 10 с. После растяжения образца не должно быть разъединения соединительных элементов.
5.13 Гель должен быть формоустойчивым, не должен быть текучим и хрупким. При разрезании геля должна выявляться плоскость разреза. После набухания в растворителях гель должен сохранять первоначальную форму.
5.14 Содержание летучих веществ в геле должно быть не более 2%.
5.15 Содержание гель-фракции в геле должно быть не менее 50%.
6 Методы испытаний
6.1 Определение внешнего вида эндопротеза
Внешний вид эндопротеза оценивают визуально и с помощью лупы (ГОСТ 25706) с 4-кратным увеличением. Проверяют целостность оболочки и герметичность закрытия технологического отверстия, а также чистоту и гладкость поверхности оболочки, наличие на оболочке идентификационной метки. В сомнительных случаях используют лупу с 10-кратным увеличением.
Маслянистость поверхности эндопротеза определяют по отпечатку от эндопротеза, помещенного на фильтровальную бумагу (ГОСТ 12026). Эндопротез не должен оставлять на бумаге маслянистый след.
6.2 Определение массы эндопротеза
Массу эндопротеза определяют взвешиванием на лабораторных весах по ГОСТ 24104 с пределом взвешивания 1 кг и дискретностью отсчета 0,01 г.
6.3 Определение размеров эндопротеза
Размеры эндопротеза определяют с помощью металлической линейки по ГОСТ 427 и штангенциркуля по ГОСТ 166. Измерения проводят при расположении эндопротеза основанием на горизонтальной поверхности.
6.4 Определение устойчивости эндопротеза к сжатию
Устойчивость эндопротеза к сжатию определяют его способностью выдерживать статическую нагрузку массой 10 кг в течение 10 мин. Эндопротез помещают между металлическими пластинами из нержавеющей стали площадью, примерно в два раза превышающей площадь основания эндопротеза. На верхнюю пластину ставят гирю по ГОСТ 7328 массой 10 кг и выдерживают нагрузку в течение 10 мин. Испытания проводят при температуре (23±2) °С. После снятия гири проводят визуальный контроль целостности эндопротеза (отсутствие трещин, разрыва оболочки, фрагментации геля).
6.5 Определение толщины оболочки эндопротеза
Толщину оболочки эндопротеза определяют по ГОСТ 17035 с помощью толщиномера по ГОСТ 11358 с ценой деления не менее 0,01 мм после отделения геля от оболочки. Измерение толщины проводят по всей поверхности изделия (исключая места герметизации) не менее чем в 30 точках. Результаты суммируют, определяют среднеарифметическое значение.
6.6 Определение упруго-прочностных свойств оболочки эндопротеза
Определение упруго-прочностных свойств оболочки проводят в соответствии с ГОСТ 270. Перед испытанием оболочку протеза разрезают и удаляют гель с оболочки механически или с применением растворителей. Испытания проводят на образцах типа IV. Вырубку образцов для испытаний рекомендуется проводить по схеме, приведенной в приложении А, рисунок А.1. Толщину образца измеряют по 6.5 не менее чем в 5 точках рабочего участка. За результат принимают наименьшее значение. Испытания проводят на разрывной машине по ГОСТ 28840 при скорости движения подвижного зажима (500±25) мм/мин при температуре (23±2) °С.
6.7 Определение прочности герметизации оболочки
Прочность герметизации технологического отверстия оболочки определяют по прочности склеивания оболочки и накладки. Испытания проводят по ГОСТ 270 на разрывной машине на образцах типа IV, которые рекомендуется вырубать так, чтобы место склеивания вошло в рабочую зону образца (приложение А, рисунок А.2). Определяют устойчивость образца к растяжению на 300% в течение 10 с. Время определяют секундомером по ГОСТ 8.423.
6.8 Определение формоустойчивости геля
6.8.1 Определение формоустойчивости геля методом разрезания
Из общей массы геля вырезают ножницами или скальпелем образец произвольных формы и размера. При разрезании гель не должен тянуться за лезвием - плоскость разреза должна быть четко выражена.
6.8.2 Определение формоустойчивости геля методом набухания
Качественное определение формоустойчивости геля к воздействию растворителя проводят по ГОСТ 9.030. Вырезанный образец геля любой формы, массой около 2 г, помещают в стеклянный бюкс с крышкой по ГОСТ 25336 вместимостью 50 см, в который добавляют 30 см
растворителя (гептан, гексан, петролейный эфир или др.). Набухание геля проводят при комнатной температуре в течение 24 ч. По окончании испытаний растворитель удаляют и визуально определяют сохранность исходной формы образца.
6.9 Определение содержания летучих веществ в геле
Определение содержания летучих веществ в геле проводят по п.3.4 ГОСТ 13835 по изменению массы образца при прогреве в термостате при температуре (150±2) °С в течение 3 ч. Массу образцов определяют на лабораторных весах по ГОСТ 24104 с точностью измерения до 0,0002 г.
6.10 Определение содержания в геле гель-фракции
Определение содержания в геле гель-фракции проводят по ГОСТ 9.030, метод Б, экстрагированием в аппарате Сокслета, удаляя золь-фракцию обработкой геля кипящим растворителем (6.8.2) в течение 24 ч.
Образец геля массой не менее 2 г, взвешенный с точностью до 0,0002 г, помещают в пенал в форме цилиндра, изготовленный из перфорированной фольги по ГОСТ 745 с отверстиями размером не более 0,5 мм. Взвешивают образец вместе с пеналом. Пенал с образцом помещают в экстрактор и проводят экстрагирование растворимой части кипящим растворителем. По окончании процесса пенал вместе с образцом высушивают в термокамере при температуре (100±2) °С до постоянной массы. Определяют изменение массы исходного образца геля после экстрагирования.
Содержание гель-фракции , %, вычисляют по формуле
![]() ,
,
где - масса пенала с образцом до экстракции, г;
- масса пенала с образцом после экстракции, г;
- масса образца геля, г.
7 Упаковка и маркировка
7.1 Упаковка
Упаковка эндопротеза должна соответствовать требованиям ГОСТ Р ИСО 14630 и ГОСТ 17527. Каждый эндопротез должен быть упакован в индивидуальную тару, состоящую не менее чем из двух контейнеров. Внутренний контейнер должен быть герметичным и обеспечивать сохранение стерильности эндопротеза до вскрытия в течение срока годности. Наружный контейнер должен обеспечивать сохранение свойств эндопротезов при хранении и транспортировании.
Определенное число единиц продукции в индивидуальной таре может быть упаковано в групповую тару, обеспечивающую сохранность эндопротезов при транспортировке.
7.2 Маркировка
7.2.1 Индивидуальная тара
На каждую индивидуальную тару должна быть нанесена маркировка (слова, фразы, символы или рисунки), включающая в себя:
- наименование и адрес изготовителя;
- наименование и торговую марку изделия;
- обозначение модели эндопротеза с указанием его размеров и следующих характеристик:
материала оболочки,
материала наполнителя,
формы,
поверхности оболочки,
массы протеза, г,
высоты, см,
ширины, см,
профиля, см,
знака идентификационной метки,
номера партии или серийного номера,
надписи "СТЕРИЛЬНО" и метода стерилизации,
знака недопустимости повторного использования (однократность применения),
даты изготовления и срока годности до имплантации или надписи "годен до..." (месяц, год),
обозначения нормативного документа.
Примечание - Допускается наносить маркировку на нестерильную поверхность внутреннего контейнера индивидуальной тары.
Каждый наружный контейнер индивидуальной тары должен быть снабжен информационной картой эндопротеза в виде наклейки (не менее трех экземпляров). В карту должны быть включены основные характеристики:
- наименование и координаты фирмы-изготовителя;
- наименование и марка эндопротеза;
- объем и форма эндопротеза;
- партия, серийный номер.
В каждый наружный контейнер индивидуальной тары должен быть вложен листок с информацией для потребителя.
7.2.2 Групповая тара
На каждую групповую тару должна быть нанесена маркировка, включающая в себя всю информацию, приведенную в 7.2.1, а также дополнительно:
- число единиц изделий в групповой таре;
- инструкции по хранению и транспортированию.
8 Информация для потребителя
Информация для потребителя должна содержать:
- наименование и адрес изготовителя;
- наименование и торговую марку эндопротеза;
- размер и характеристики эндопротеза;
- показания и противопоказания к применению;
- инструкцию по применению, включающую в себя:
рекомендуемые методы стерильного извлечения и подготовки изделия к операции;
меры предосторожности при имплантации и удалении эндопротезов;
рекомендации по послеоперационному ведению пациентов;
потенциально возможные осложнения и пути их разрешения.
Приложение А
(рекомендуемое)
Образцы для испытаний оболочки
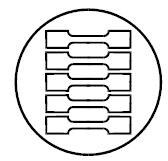
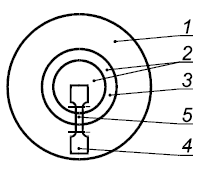
Рисунок А.1 - Рекомендуемая схема вырубки образцов из передней поверхности эндопротеза
1 - оболочка, 2 - накладка, 3 - область соединения, 4 - образец, 5 - рабочая зона образца
Рисунок А.2 - Рекомендуемая схема вырубки образцов из основания эндопротеза
Электронный текст документа
и сверен по:
, 2008