ГОСТ Р ИСО 10993.6-99
Группа Р20
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Изделия медицинские
ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 6
Исследование местного действия после имплантации
Medical devices. Biological evaluation of medical devices. Part 6. Tests for local effects after implantation
ОКС 01.140.20*
ОКСТУ 9403
_______________
* В указателе "Национальные стандарты" 2008 год ОКС 11.040.40. -
.
Дата введения 2002-01-01
Предисловие
1 РАЗРАБОТАН Всероссийским научно-исследовательским и испытательным институтом медицинской техники (ВНИИИМТ)
ВНЕСЕН Техническим комитетом по стандартизации ТК 422 "Оценка биологического действия медицинских изделий"
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 29 декабря 1999 г. N 862-ст
3 Разделы настоящего стандарта, за исключением раздела 3, представляют собой аутентичный текст международного стандарта ИСО 10993.6-94 "Оценка биологического действия медицинских изделий. Часть 6. Исследование местного действия после имплантации"
4 ВВЕДЕН ВПЕРВЫЕ
Введение
Соблюдение положений стандартов серии ГОСТ Р ИСО 10993 "Оценка биологического действия медицинских изделий" позволит обеспечить системный подход к исследованию биологического действия медицинских изделий.
Целью этих стандартов не является безусловное закрепление конкретных методов исследований и испытаний за группами однородных медицинских изделий в соответствии с принятой классификацией по виду и длительности контакта с организмом человека. Поэтому планирование и проведение исследований и испытаний должны осуществлять специалисты, имеющие специальную подготовку и опыт в области санитарно-химической, токсикологической и биологической оценок медицинских изделий.
Стандарты этой серии являются руководящими документами для прогнозирования биологического действия медицинских изделий на стадии выбора материалов, предназначенных для их изготовления, а также для исследований готовых образцов.
В стандарты серии ГОСТ Р ИСО 10993, имеющие групповой заголовок "Изделия медицинские. Оценка биологического действия медицинских изделий", входят следующие части:
- часть 1 - оценка и исследования;
- часть 3 - исследование генотоксичности, канцерогенности и токсического действия на репродуктивную функцию;
- часть 4 - исследование изделий, взаимодействующих с кровью;
- часть 5 - исследование на цитотоксичность: методы in vitro;
- часть 6 - исследование местного действия после имплантации;
- часть 7 - остаточное содержание этиленоксида после стерилизации;
- часть 9 - основные принципы идентификации и количественного определения потенциальных продуктов деструкции;
- часть 10 - исследование раздражающего и сенсибилизирующего действия;
- часть 11 - исследование общетоксического действия;
- часть 12 - приготовление проб и стандартные образцы;
- часть 13 - идентификация и количественное определение продуктов деструкции полимерных медицинских изделий;
- часть 16 - моделирование и исследование токсикокинетики продуктов деструкции и вымывания.
В настоящем стандарте представлены методы исследования местного действия после имплантации, используемые для оценки материалов и медицинских изделий, в том числе стоматологического назначения, по виду и длительности контакта соответствующих ГОСТ Р ИСО 10993.1.
Использование методик имплантации in vivo для исследования биологической реакции ткани на изучаемый материал позволяет оценивать такие материалы, которые невозможно оценить используя другие методы исследования.
При выборе методов исследования изучаемого материала исследователь должен учитывать его предполагаемое применение, а также рекомендации, содержащиеся в ГОСТ Р ИСО 10993.1.
1 Область применения
Настоящий стандарт устанавливает методы исследования местного действия имплантируемого материала на живую ткань на макро- и микроскопическом уровне.
Исследуемые образцы имплантируют в такие участки тела и ткань, которые пригодны для оценки биологической безопасности материала. Имплантат не подвергают механической или функциональной нагрузке. Местное действие оценивают, сравнивая реакцию ткани, вызванную исследуемым материалом, с реакцией, вызванной материалом, используемым в медицинских изделиях, безопасность применения которых ранее установлена.
Исследование местного действия после имплантации проводят для оценки субхронического (кратковременного - до 12 недель) или хронического (длительного - от 12 до 104 недель) действия.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ Р ИСО 10993.1-99 Изделия медицинские. Оценка биологического действия медицинских изделий. Оценка и исследования
ИСО 10993-2-92* Оценка биологического действия медицинских изделий. Часть 2: Требования к защите животных
________________
* Международные стандарты - во ВНИИКИ Госстандарта России.
3 Общие положения
3.1 Определения
В настоящем стандарте используют термины, приведенные в ГОСТ Р ИСО 10993.1, а также следующее определение:
образец (имплантат): Часть исследуемого или контрольного материала заданной формы, обработанная соответствующим способом.
3.2 Приготовление образцов для имплантации
3.2.1 Твердые материалы
Физические характеристики образца (форма, плотность, твердость, обработка поверхности) могут влиять на характер реакции ткани на исследуемые материалы.
Каждый имплантат изготовляют, обрабатывают, очищают от загрязнений и стерилизуют методом, который используют для изделия, готового к применению в медицинской практике.
После окончательной подготовки и стерилизации с имплантатами обращаются с особой осторожностью.
3.2.2 Нетвердые материалы (включая порошки)
За нетвердые материалы принимают жидкости, пасты и частицы, отличные от указанных в 3.2.1. Компоненты смешивают перед использованием (например стоматматериалы) и оставляют затвердевать в течение различных периодов времени.
Для проведения исследования местного действия после имплантации нетвердые материалы помещают в трубки из полиэтилена (ПЭ), полипропилена (ПП) или политетрафторэтилена (ПТФЭ).
Перед заполнением трубки промывают 70%-ным водным раствором этанола и стерилизуют автоклавированием или другим методом, принятым в медицинской практике. Нетвердые материалы, имплантируемые сразу после смешивания, предварительно подвергают исследованию с целью определения микробиологического загрязнения.
Исследуемый образец готовят в соответствии с инструкциями изготовителя и наполняют им трубку до верхнего края с особой осторожностью, чтобы исследуемый материал не попал на внешнюю поверхность трубки. Не допускается попадание воздуха в трубку. Поверхность исследуемого материала на концах трубки, а также концы самой трубки не должны иметь шероховатостей.
Примечание - Трубки из ПЭ могут деформироваться под действием автоклавирования. Трубки из ПТФЭ плохо поддаются разрезанию с помощью микротома, поэтому их заменяют трубками из ПЭ или ПП тех же размеров в тех случаях, когда трубки оставляют в блоках ткани для приготовления гистологических срезов.
3.2.3 Контрольные образцы
Размеры, форма и особенно состояние поверхности контрольного и исследуемого образцов должны быть, по возможности, аналогичными. Если исследуемый материал заключен в трубку, контрольный образец должен представлять собой стержень, изготовленный из того же материала, что и трубка, диаметром, равным диаметру внешнего сечения трубки. Контрольные образцы готовят, очищают и стерилизуют таким образом, чтобы они соответствовали требованиям к контрольным образцам и не изменяли при этом свои характеристики.
Контрольные материалы перечислены в приложении А. Пример формы и размера цилиндрического образца приведен на рисунке Б.1. Допускается использовать другие материалы, разрешенные к применению в медицинской практике и близкие к исследуемым материалам.
3.3 Планирование исследования
Процесс исследования следует планировать настолько детально, чтобы получить максимум информации от использования каждого животного.
3.3.1 Животные и ткани
Отношение к животным должно быть бережным.
При выборе вида лабораторных животных учитывают размеры исследуемых образцов, предполагаемую продолжительность наблюдения в сравнении с продолжительностью жизни животного, а также известные различия биологической реакции твердых и мягких тканей.
Для кратковременного исследования методом имплантации в подкожную ткань и мышцу используют мышей, крыс, морских свинок и кроликов. Выбирают один из видов животных.
Для длительного исследования методом имплантации в подкожную ткань, в мышцу и кость используют крыс, морских свинок, кроликов, собак, овец, коз и других животных с относительно долгой продолжительностью жизни. Выбирают один из видов животных.
Образцы исследуемого и контрольного материалов имплантируют в одинаковых условиях одному и тому же виду животных, одного и того же возраста, пола и породы в соответствующие анатомические участки. Число и размеры имплантатов, вводимых каждому животному, зависят от размера животного и анатомического положения имплантата.
3.3.2 Продолжительность исследования
Местную реакцию ткани на имплантированные материалы оценивают в кратковременных (до 12 недель) и продолжительных (свыше 12 недель) опытах.
Продолжительность исследования выбирают так, чтобы достигнуть устойчивой фазы биологической реакции. Местная тканевая реакция на имплантированные материалы зависит от свойств материала и травмы, вызванной хирургическим вмешательством. Конфигурация ткани вокруг имплантата изменяется за время, прошедшее после имплантации. Обычно спустя неделю после имплантации обнаруживают высокую активность клеток, за которой следует переходная стадия. В мышечной и соединительной тканях в зависимости от вида животных устойчивая фаза в популяции клеток наблюдается после 9-12 недель. Имплантация в костную ткань может потребовать более продолжительных периодов наблюдения.
Продолжительность исследования при кратковременной имплантации выбирают по таблице 1, при длительной имплантации - по таблице 2.
Таблица 1 - Кратковременная имплантация в подкожную ткань и мышцу
Вид животных | Имплантационный период, недели | ||||
1 | 3 | 4 | 9 | 12 | |
Мыши | х | х | х | ||
Крысы | х | х | х | ||
Морские свинки | х | х | х | ||
Кролики | х | х | х | ||
Таблица 2 - Длительная имплантация в подкожную ткань, мышцу и кость
Вид животных | Имплантационный период, недели | ||||
12 | 26 | 52 | 78 | (104) | |
Крысы | х | х | х | ||
Морские свинки | х | х | х | ||
Кролики | х | х | х | х | |
Собаки | х | х | х | х | х |
Овцы | х | х | х | х | х |
Козы | х | х | х | х | х |
Свиньи | х | х | х | х | х |
Примечание к таблицам 1 и 2 - Знаком "х" обозначена продолжительность имплантации.
В зависимости от предполагаемого применения исследуемого материала в соответствии с ГОСТ Р ИСО 10993.1 не обязательно использовать все предлагаемые периоды исследования. При необходимости продолжительность исследования может быть 104 недели.
Количество имплантатов на одно животное и количество животных на период исследования приведены в разделах 4-6. Следует вводить достаточное количество имплантатов для того, чтобы оценка по конечному количеству образцов дала достоверный результат.
3.3.3 Хирургическая процедура
Животным проводят соответствующую анестезию. Волосяной покров в области операции удаляют стрижкой, бритьем или другим механическим способом. Этот участок обрабатывают соответствующим антисептическим раствором. Шерсть не должна контактировать с имплантатом или с раневыми поверхностями. Особенности процедур введения или имплантации описаны в разделах 4-6.
Хирургическая методика может оказать значительное влияние на результаты любой имплантационной процедуры. Хирургическую процедуру следует проводить в стерильных условиях способом, снижающим вероятность травмы на участке имплантации.
После хирургической операции рану закрывают, используя зажимы или швы, проявляя осторожность для поддержания условий стерильности.
3.3.4 Послеоперационное наблюдение
За каждым животным наблюдают в течение всего периода исследования и регистрируют данные о любых патологических признаках, включая местное действие, действие на организм в целом и поведение.
3.3.5 Забой животных
По окончании эксперимента животных забивают с помощью высокой дозы анестетика или другим гуманным методом.
3.4 Оценка биологической реакции
Оценивают биологическую реакцию путем классификации и документирования макроскопической и гистологической реакций во времени.
Сравнение реакций, вызванных исследуемым и контрольным материалами, проводят на одинаковых участках по отношению к каждому имплантату, чтобы влияние относительного смещения между имплантатом и тканью было минимальным в соответствии с примечанием.
Примечание - Для образцов цилиндрической формы выбирают участок посередине между концами цилиндра, для имплантатов цилиндрической формы с пазами - центральные части между пазами, а также между плоскими поверхностями имплантата.
При использовании нетвердых или порошкообразных материалов, помещенных в трубку, следует использовать область на конце трубки.
3.4.1 Макроскопическое исследование
Каждый участок имплантации исследуют с помощью увеличительных линз.
Регистрируют вид и размеры любой наблюдаемой реакции ткани.
3.4.2 Подготовка к гистологическому исследованию
3.4.2.1 Извлечение имплантата и приготовление образца
Вырезают имплантат вместе с достаточным количеством окружающей его неизмененной ткани для оценки местной тканевой реакции. Для проведения гистологических и других исследований вырезанные блоки ткани, содержащие исследуемые или контрольные имплантаты, соответствующим образом обрабатывают.
При использовании традиционных методик тканевую капсулу вскрывают до или после обработки фиксатором и регистрируют в отчете состояние поверхности имплантата и тканевого ложа.
Примечание - В случае применения такой методики слои ткани, наиболее близко расположенные к имплантату, как правило, повреждаются.
Когда изучают поверхность соприкосновения имплантата и ткани, предпочтительно использовать жесткий пластик для введения имплантата in situ. Для приготовления гистологических срезов используют соответствующие методики. Необходимо продемонстрировать, что методика введения с использованием пластиков не вызывает значительных изменений поверхности соприкосновения с тканью.
3.4.3 Гистологическое исследование
Степень реакции определяют измерением расстояния от поверхности соприкосновения имплантата с тканью до участков, имеющих характеристики нормальной ткани с нормальным кровообращением. Регистрируют ориентацию среза относительно размеров имплантата, ориентацию имплантата, количество срезов и геометрию сечения.
Оценивают и регистрируют следующие параметры биологической реакции:
- степень фиброза и (или) фиброзной ткани и воспаления;
- дегенерацию, определяемую изменениями в морфологии ткани;
- число и распределение клеток, характеризующих воспалительный процесс, таких как полиморфонуклеарные лейкоциты, лимфоциты, плазматические клетки, эозинофилы, макрофаги и многоядерные клетки, по которым можно судить о степени реакции тканей на имплантат;
- наличие некроза, определяемое по осколкам ядер и (или) по разрушению стенок капилляров;
- другие параметры, такие как осколки материала, жировой инфильтрат, гранулома и т.д.
- качество и количество вросшей ткани для пористого материала.
При имплантации в кость исследуют поверхность соприкосновения ткани и материала. Оценивают площадь контактирующей кости, количество костной ткани, расположенной вблизи имплантата, и присутствие некальцифицированных тканей. Регистрируют наличие резорбции костной ткани и (или) ее разрастание.
3.5 Отчет об исследовании
3.5.1 Содержание отчета об исследовании
Отчет об исследовании должен содержать достаточное количество материала для проведения независимой оценки результатов (3.5.2-3.5.6).
3.5.2 Имплантируемые образцы
В разделе "Имплантируемые образцы" описывают исследуемый и контрольный материалы, их состояние, изготовление, состояние поверхности, а также форму и размеры имплантатов. В отчет включают обоснование выбора контрольных материалов.
Условия и процесс подготовки образцов могут влиять на реакцию ткани. В отчет включают условия и процесс подготовки образцов, применяемые методы очистки, обработки и стерилизации. Если имплантаты готовили в другом месте, информацию о подготовке представляют до начала исследования.
3.5.3 Животные и имплантация
В разделе "Животные и имплантация" регистрируют возраст, пол и породу животных, условия содержания, рацион и массу животных в течение периода наблюдения. В ходе исследования оценивают состояние здоровья животных. Все наблюдения, включая неожиданную гибель, регистрируют.
Указывают используемые методы имплантации, участок имплантации, количество имплантатов на одно животное и на каждый период наблюдения.
3.5.4 Извлечение и гистологическое исследование
В раздел "Извлечение и гистологическое исследование" включают описание методики извлечения имплантатов, регистрируют количество извлеченных имплантатов на одно животное и период наблюдения. Все образцы должны быть учтены и рассмотрены. Описывают методики, используемые для фиксации и подготовки гистологических срезов.
3.5.5 Оценка
При макроскопическом исследовании проводят как обследование каждого имплантата, так и макроскопическое исследование внешнего вида тканей, окружающих имплантаты. В отчет включают выводы, сделанные при каждом гистологическом исследовании.
3.5.6 Окончательная оценка
В раздел "Окончательная оценка" включают сравнительную оценку биологической реакции на исследуемый и контрольный материалы с подробным описанием биологической реакции.
4 Метод имплантации в подкожную ткань
4.1 Область применения
Данный метод исследования используют для оценки биологической реакции подкожной ткани экспериментальных животных на имплантируемый материал.
Метод используют для сравнения действия различных типов поверхностей или различных состояний одного и того же материала, а также для оценки действия различных видов обработки или модификации исследуемого материала.
4.2 Основные положения
Метод позволяет сравнить биологическую реакцию на имплантаты, изготовленные из исследуемого материала, с биологической реакцией на имплантаты из контрольного материала, разрешенного к применению в медицинской практике в соответствии с 3.2.3.
4.3 Исследуемые образцы
Условия приготовления исследуемых и контрольных образцов изложены в 3.2. Размеры имплантата зависят от размеров экспериментального животного.
4.3.1 Применяют образцы материала в форме пленки диаметром от 10 до 12 мм и толщиной от 0,3 до 1 мм.
Примечание - Для проведения оценки полимерного материала в форме пластины особенно подходит подкожный участок, расположенный ниже мышцы panniculus carnosus. Во внутримышечном участке такой материал может образовывать складки, что влияет на оценку действия материала per se.
4.3.2 Для большинства материалов образцы готовят в форме цилиндра с закругленными краями диаметром 1,5 мм и длиной 5 мм.
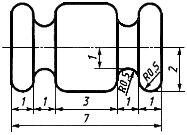
4.3.3 Желобчатые имплантаты готовят диаметром 4 мм и длиной 7 мм (приложение Б).
Примечание - При врастании ткани в желобки раздражение ткани, вызываемое движением при соприкосновении, минимальное.
4.3.4 Нетвердые материалы (включая порошки) помещают в трубки диаметром 1,5 мм и длиной 5 мм (3.2.2).
4.4 Экспериментальные животные и участки имплантации
Имплантаты вводят в соединительную ткань спины мышей, крыс, морских свинок или кроликов. Выбирают один из видов животных.
Для каждого периода имплантации используют не менее трех животных и достаточное количество имплантационных участков для введения десяти образцов каждого материала.
4.5 Процедура имплантации
4.5.1 Имплантация в область средней линии спины
Разрезают кожу и тупым рассечением делают один или более карманов. Основание кармана располагают на расстоянии более 10 мм от линии разреза. В каждый подкожный карман помещают по одному имплантату, так чтобы имплантаты не соприкасались друг с другом.
Приложение - Допускается помещать имплантат в нужный участок с помощью трокара.
4.5.2 Имплантация в шею
У мышей делают надрез длиной 1 см над крестцом и тупым рассечением подготавливают подкожный туннель, направленный к шее. Один имплантат, выполненный в соответствии с чертежом приложения Б, проталкивают через туннель и размещают в шее.
У крыс имплантируют по одному образцу контрольного и исследуемого материала отдельно в обе стороны шеи, так чтобы имплантаты не соприкасались друг с другом.
На определенном расстоянии от имплантата туннель закрывают с помощью трех стежков неметаллического шовного материала для предотвращения движения имплантата.
4.6 Продолжительность имплантации
Продолжительность имплантации, обеспечивающую устойчивую фазу биологической реакции ткани, выбирают в соответствии с 3.3.2.
4.7 Оценка биологической реакции
Биологическую реакцию оценивают в соответствии с 3.4.
4.8 Форма отчета об исследовании
Результаты исследования и заключительный отчет представляют в соответствии с требованиями 3.5.
5 Метод имплантации в мышечную ткань
5.1 Область применения
Данный метод используют для оценки реакции мышечной ткани экспериментальных животных на имплантируемый материал.
5.2 Основные положения
Метод позволяет сравнить биологическую реакцию на имплантаты из исследуемого материала с биологической реакцией на имплантаты из контрольных материалов, разрешенных к применению в медицинской практике в соответствии с 3.2.3.
5.3 Исследуемые образцы
Условия приготовления исследуемых и контрольных образцов приведены в разделе 3.2. Размеры имплантата выбирают исходя из размеров выбранной группы мышц. Для паравертебральных мышц кролика используют образцы шириной от 1 до 3 мм и длиной 10 мм.
Образцы обычно имеют закругленные края и концы.
5.4 Экспериментальные животные и участки имплантации
Имплантаты помещают в мышечную ткань кроликов и других животных. Мышцы должны быть размером, достаточным для размещения имплантируемых образцов. В одном месте используют один имплантат.
Примечание - В качестве участков имплантации используют паравертебральные мышцы кроликов, ягодичные мышцы крыс и мышцы бедра кроликов.
Для каждого периода имплантации используют не менее трех животных и достаточное количество имплантационных участков для введения восьми испытуемых и восьми контрольных образцов.
Если контрольный материал может вызвать реакцию более значительную, чем минимальная, используют два образца такого контроля. Имплантируют два дополнительных контрольных образца из материала, о котором известно, что он вызывает минимальную реакцию ткани, в участок, противоположный тому, в который имплантирован исследуемый образец.
5.5 Процедура имплантации
Имплантацию проводят с помощью иглы для подкожных впрыскиваний или трокара. Для имплантатов большого диаметра можно использовать другие методы имплантации.
Исследуемые образцы имплантируют в мышцы тела так, чтобы направление оси имплантата было параллельно мышечным волокнам.
В паравертебральную мышцу кролика имплантируют по четыре образца исследуемого материала с одной стороны спины на расстоянии 25-50 мм от средней линии параллельно позвоночному столбу и приблизительно на расстоянии 25 мм друг от друга. Каждому животному имплантируют также четыре образца контрольного материала в контралатеральную мышцу.
5.6 Продолжительность имплантации
Продолжительность имплантации, обеспечивающую устойчивую фазу биологической реакции ткани, выбирают в соответствии с 3.3.2.
5.7 Оценка биологической реакции
Биологическую реакцию оценивают в соответствии с требованиями 3.4.
5.8 Форма отчета об исследовании
Результаты исследования и заключительный отчет представляют в соответствии с требованиями 3.5.
6 Метод имплантации в костную ткань
6.1 Область применения
Данный метод исследования используют для оценки биологической реакции костной ткани экспериментальных животных на имплантируемый материал.
Метод используют для сравнения действия различных типов поверхностей или различных состояний одного и того же материала или для оценки действия различных видов обработки или модификации исследуемого материала.
6.2 Основные положения
Метод позволяет сравнить биологическую реакцию на имплантаты из исследуемого материала с биологической реакцией на имплантаты из контрольного материала, разрешенного к применению в медицинской практике в соответствии с 3.2.3.
6.3 Исследуемые образцы
Общие условия приготовления исследуемых и контрольных образцов приведены в 3.2.
6.3.1 Форма имплантируемых образцов
Применяют образцы в форме винта или с резьбой, чтобы обеспечить неподвижность имплантата в кости. При необходимости допускается использовать цилиндрическую форму.
6.3.2 Размеры исследуемых образцов
Размер имплантата определяет выбор экспериментального животного и кости:
- для кроликов - цилиндрические имплантаты диаметром 2 мм и длиной 6 мм;
- для собак - цилиндрические имплантаты диаметром 4 мм и длиной 12 мм;
- для кроликов, собак, овец, коз, свиней - ортопедические костные винтовые имплантаты от 2 мм до 4,5 мм.
6.4 Экспериментальные животные и участки имплантации
6.4.1 Экспериментальные животные
Имплантацию проводят в кости собак, овец, коз, свиней и кроликов. Выбирают один из видов животных. Физиология кости зависит от вида животного, поэтому ее оценивают до начала процедуры имплантации. В каждый имплантационный период используют не менее четырех кроликов или по два представителя каждого другого вида животных.
6.4.2 Участки имплантации
Для имплантации исследуемых и контрольных образцов используют одинаковые автоматические* участки. Исследуемые имплантаты располагают контралатерально по отношению к контрольным. Участки имплантации выбирают с учетом минимизации опасности перемещения имплантата.
_______________
* Текст соответствует оригиналу. - .
Примечание - Для имплантации подходят бедро и область большой берцовой кости.
Выбирают следующее количество участков имплантации:
- для кролика - не более 6 участков (три для исследуемых образцов и три для контрольных);
- для собаки, овцы, козы или свиньи - не более 12 участков (шесть для исследуемых образцов и шесть для контрольных).
Не допускается использовать более 12 участков для имплантации на одном животном.
Размеры, массу и возраст животных, а также участок имплантации выбирают с учетом того, чтобы размещение имплантата не было причиной увеличения опасности патологического перелома в исследуемом участке. При использовании более молодых животных не допускается использовать участки, относящиеся к эпифизу, или другую незрелую кость.
6.5 Процедура имплантации
Подготовку кости проводят с использованием сверления при низкой скорости, прерывая сверление для обильного увлажнения физиологическим раствором и отсасывания. Чрезмерное нагревание может привести к частичному некрозу костной ткани.
Диаметр имплантата и место приложения его к кости должны достаточно хорошо подходить друг к другу во избежание фиброза костной ткани.
Обнажают боковую поверхность каждой бедренной или большой берцовой кости и сверлят соответствующее количество отверстий для имплантатов. У кроликов делают три отверстия, у более крупных животных - шесть отверстий. Перед введением имплантата отверстие рассверливают до получения нужного диаметра или развинчивают. Цилиндры вставляют, прижав пальцем. Имплантаты в форме винта вкручивают на место с помощью инструмента, контролируя крутящий момент. Крутящий момент регистрируют.
6.6 Продолжительность имплантации
Продолжительность имплантации, обеспечивающую устойчивую фазу биологической реакции ткани, выбирают в соответствии с 3.3.2.
6.7 Оценка биологической реакции
Биологическую реакцию оценивают в соответствии с 3.4.
6.8 Форма отчета об исследовании
Результаты исследования и заключительный отчет представляют в соответствии с 3.5.
ПРИЛОЖЕНИЕ А
(справочное)
Контрольные материалы
А.1 Реакция
Биологическую реакцию на контрольные материалы не оценивают как "Отсутствие реакции", но она является эталоном для оценки реакции других материалов.
При отсутствии пористого контрольного материала для сравнительной реакции допускается использовать непористый контрольный материал.
Если предполагается, что наиболее подходящий контрольный материал может вызвать более сильную тканевую реакцию, чем нормально наблюдаемая реакция у контрольных материалов, приведенных в данном приложении, в качестве контроля для оценки хирургической методики имплантируют образцы из материалов, приведенных в этом приложении.
А.2 Металлические контрольные материалы
Для изготовления контрольных образцов используют нержавеющую сталь, кобальтхром, титан и титановые сплавы. Биологическая реакция этих материалов достаточно хорошо изучена в широкой научной и клинической практике. Более подробная информация изложена в ИСО 5832, части 1-8 ([1]-[8]).
А.3 Полимерные и керамические контрольные материалы
Информация о неметаллических контрольных материалах приведена в [9], [10] и [11].
ПРИЛОЖЕНИЕ Б
(справочное)
Цилиндрический образец
Форма и размеры в миллиметрах цилиндрического образца для имплантации мыши приведены на рисунке Б.1.
Рисунок Б.1 - Специальный цилиндр с пазами
ПРИЛОЖЕНИЕ В
(справочное)
Библиография
Контрольные материалы
[1] ISO 5832-1:1987, Implants for surgery - Metallic materials - Part 1: Wrought stainless steel
[2] ISO 5832-2:1993, Implants for surgery - Metallic materials - Part 2: Unalloyed titanium
[3] ISO 5832-3:1990, Implants for surgery - Metallic materials - Part 3: Wrought titanium 6-aluminium 4-vanadium alloy
[4] ISO 5832-4:1978, Implants for surgery - Metallic materials - Part 4: Cobalt-chromium-molybdenum casting alloy
[5] ISO 5832-5:1993, Implants for surgery - Metallic materials - Part 5: Wrought cobalt-chromium-tungsten-nickel alloy
[6] ISO 5832-6:1980, Implants for surgery - Metallic materials - Part 6: Wrought cobalt-nickel-chromium-molybdenum alloy
[7] ISO 5832-7:1994, Implants for surgery - Metallic materials - Part 7: Forgeable and coldformed cobalt-chromium-nickel-molybdenum-iron alloy
[8] ISO 5832-8:1987, Implants for surgery - Metallic materials - Part 8: Wrought cobalt-nickel-chromium-molybdenum-tungsten-iron alloy
[9] ISO 5834-2:1985, Implants for surgery - Ultrahigh molecular weight polyethylene - Part 2: Moulded forms
[10] ISO 6474:1994, Implants for surgery - Ceramic materials based on high purity aluminia
[11] BS 5736-2 PRS:1986, Positive control plastic reference standard for implantation.
Национальные стандарты
[12] ASTM F 748. Practice for Selecting Genetic Biological Test Methods for Materials and Devices
[13] ASTM F 736, Practice for Short-Term Screening of Implant Materials
[14] ASTM F 981, Practice for Assessment of Compatibility of Biomaterials for Surgical Implants with Respect to Effect of Materials on Muscle and Bone
[15] NF S 90-703:1989, Material medico-chirurgical - Implants chirurgicaux - Essais de tolerance d'un biomaterial destine a entrer en contact avec tissus musculaires et osseux: implantations a court terme et a Ion terme
[16] UNI 9582-3:1990, Biocompatibility of Medical Materials and Devices - Bone Implant Test
[17] U.S. Pharmacopeia XXII: 1990, Biological reactivity test, in-vivo
Дополнительная литература
[18] Cohen, J. Assay of Foreign-Body Reaction, Journal of Bone and Joint Surgery, 41A, pp.152-166 (1959)
[19] Ferguson, AB. Jr., Laing, PG. and Hodge, ES. The lonization of Metal Implants in Living Tissues, Journal of Bone and Joint Surgery, 42A, pp.77-90, 1960
[20] Geret, V., Rahn, BA., Mathys, R., Straumann, F. and Perren, SM. In vivo Testing of Tissue Tolerance of Implant Materials: Improved Quantitative Evaluation through Reduction of Relative Motion at the Implant Tissue Interface. From Current Concepts of Internal Fixation of Fracture. HK. Uhthoff (ed.). Springer Verlag, 1980
[21] Geret, V., Rahn, BA., Mathys, R., Straumann, F. and Perren, SM. Chapter 35: A Method for testing Tissue Tolerance for Improved Quantitative Evaluation Through Reduction of Relative Motion at the Implant-Tissue Interface. Evaluation of Biomaterials, GD. Winter, JL. Leray, K. de Groot (eds). John Wiley & Sons Ltd., 1980
[22] Kaminski, EJ., Oglesby, RJ., Wood, NK. and Sandrik, J. The Behavior of Biological Materials at Different Sites of Implantation. Journal of Biomedical Materials Research, 2, pp.81-88, 1968
[23] Laing, PG., Ferguson, AB. Jr. and Hodge, ES. Tissue Reaction in Rabbit Muscle Exposed to Metallic Implants. Journal of Biomedical Materials Research, 1, pp.135-149, 1967
[24] Langeland, К., Guttuso, J., Langeland, LL. and Tobon, G. Methods in the study of biological response to endodontic materials. Tissue response to endodontic materials. Tissue responce to #2 (root canal sealer0. Oral Surg, 27, p.522, 1969
[25] Pizzoferrato, S., Savarino, L., Stea, S. and Tarabusi, C. Result of Histological Grading on 100 cases of Hip Prosthesis Failure. Biomaterials, 9, pp.314-328, 1988
[26] Rahn, BA., Geret, V., Capaul, C., Lardi, M. and Solothurnmann, B. Morphometric Evaluation of Tissue Reaction to Implants Using Low Cost Digitizing Techniques. Clinical Applications of Biomaterials, AJC. Lee, T. Alberktsson and P.-I. Branemark (eds). John Wiley & Sons Ltd., 1982
[27] Torneck, CD. Reaction of Rat Connective Tissue to Polyethylene Tube Implants. Oral Surg, 21, p.379, 1966
[28] Torneck, CD. Reaction of Rat Connective Tissue to Polyethylene Implants, Oral Surg, 24, p.674, 1967
[29] Turner, E., Lawrence, WH. and Autian, J. Subacute Toxicity Testing of Biomaterials Using Histological Evaluation of Rabbit Muscle Tissue. Journal of Biomedical Materials Research, 7, pp.39-58, 1973
[30] ГОСТ Р 51148-98 Изделия медицинские. Требования к образцам и документации, представляемым на токсикологические, санитарно-химические испытания, испытания на стерильность и пирогенность
Электронный текст документа
и сверен по:
М.: ИПК Издательство стандартов, 2000