ГОСТ Р ИСО 14971.1-99
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Медицинские изделия
УПРАВЛЕНИЕ РИСКОМ
Часть 1
Применение анализа риска к медицинским изделиям
Издание официальное
БЗ 12—99/679
ГОССТАНДАРТ РОССИИ Москва
Предисловие
1 РАЗРАБОТАН Закрытым акционерным обществом «ВНИИМП-ВИТА»
ВНЕСЕН Техническим комитетом по стандартизации ТК 11 «Медицинские приборы и аппараты»
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 29 декабря 1999 г. № 806-ст
3 Настоящий стандарт представляет собой аутентичный текст международного стандарта ИСО 14971-1—98 «Медицинские изделия. Управление риском. Часть 1. Применение анализа риска к медицинским изделиям»
4 ВВЕДЕН ВПЕРВЫЕ
© И ПК Издательство стандартов, 2000
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Госстандарта России
Содержание
1 Область применения
2 Определения
3 Процедура
3.1 Общие вопросы
3.2 Идентификация количественных и качественных характеристик медицинских изделий . .
3.3 Определение возможных опасностей
3.4 Оценка риска для каждого случая опасности
3.5 Обзор случаев риска
3.6 Снижение уровня риска
3.7 Возникновение других опасностей
3.8 Оценка всех заявленных опасностей
3.9 Отчет об анализе риска
4 Обзор анализа риска
Приложение А Руководство по процедуре анализа риска при использовании изделий для in vitro
диагностики
Приложение В Руководство по процедуре анализа риска при возникновении токсикологических опасностей
Приложение С Примеры возможных причин и факторов, влияющих на возникновение опасных ситуаций» ассоциируемых с медицинскими изделиями
Приложение D Информация о методиках анализа риска
Приложение Е Упрощенная взаимосвязь между анализом риска и другими действиями, относящимися к управлению риском
Приложение Г Библиография
Введение
Нормативные документы о безопасности медицинских изделий, включая возможность возникновения ситуаций риска, необходимы для того, чтобы определить пригодность использования медицинского изделия в предполагаемой области его предполагаемого применения. Факторы, влияющие на осознание безопасности как таковой, включают в себя социально-экономический и образовательный статус рассматриваемого общества, также реальную и моделируемую ситуацию и состояние пациента. Наряду с предполагаемой областью применения медицинского изделия должны быть приняты во внимание технические характеристики, безопасность, в том числе риск и польза, при его клиническом применении.
Весь процесс контроля риска рассматривается как управление риском. Настоящий стандарт описывает методики анализа риска, основанные на количественной и качественной оценке вероятностей возникновения опасных для пациента ситуаций вследствие предполагаемых действий при применении медицинских изделий. Анализ риска является первоначальной стадией всего процесса управления риском. Элементы оценки и снижения риска включены в диаграмму, представленную в настоящем стандарте в целях полноты освещения проблемы и для иллюстрации взаимосвязи между анализом, оценкой и снижением риска (см. приложение Е).
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ Р ИСО 10993. J—99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
ГОСТ Р ИСО 10993.3—99 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 3. Исследование генотоксичности, канцерогенности и токсического действия на репродуктивную функцию
ГОСТ Р 50267.0.4—99 (МЭК 60601-1-4—96) Изделия медицинские электрические. Часть 1. Общие требования безопасности. 4. Требования безопасности к программируемым медицинским электронным системам
ГОСТ Р ИСО 14971.1-99
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ Медицинские изделия
УПРАВЛЕНИЕ РИСКОМ
Часть 1
Применение анализа риска к медицинским изделиям
Medical devices. Risk management. Part 1. Application of risk analysis
Дата введения 2001—01—01
1 Область применения
Настоящий стандарт устанавливает процедуру исследования безопасности медицинских изделий, включая изделия для in vitro диагностики (IVD) (далее — изделия), с помощью информации или приспособлений, путем определения (идентификации) возможных опасностей и оценки риска при использовании изделия. Требования настоящего стандарта могут быть использованы в тех областях, в которых еще нет соответствующих стандартов или же их не применяют.
Настоящий стандарт не претендует на полноту требований к процедуре исследования безопасности изделия, так как они определяются множеством факторов, которые не могут быть установлены в настоящем стандарте.
Не предполагается, что настоящий стандарт будет являться руководством во всех аспектах управления риском. Более того, не предполагается, что настоящий стандарт предусматривает процесс принятия решений при оценке показаний и противопоказаний использования определенного изделия.
2 Определения
П р и м с ч а н и е — Определения в 2.1 — 23 и 2.5 соответствуют определениям Руководства ИСО/МЭК51 [I].
В настоящем стандарте применяют следующие термины с соответствующими определениями:
2.1 вред: Нанесение ущерба пациенту, персоналу, оборудованию или окружающей среде.
2.2 опасность: Потенциальный источник вреда.
Примечание — Термин «опасность» определен для того, чтобы обозначить происхождение или природу ожидаемого вреда (например, опасность электрического поражения, опасность быть раздавленным, порезанным, токсическая опасность).
2.3 риск: Вероятная частота возникновения опасности, причиняющей вред и усиление степени тяжести от причиненного вреда.
2.4 анализ риска: Исследование информации для определения опасностей и оценки риска.
Примечания
1 См. приложение Е.
2 Примеры источников информации — по 3.4.
2.5 безопасность: Отсутствие неприемлемого риска от причиненного вреда.
Издание официальное
3 Процедура
3.1 Общие вопросы
Должна быть соблюдена процедура анализа риска, описанная в 3.2 — 3.9 и схематично изображенная на рисунке I. Записи в ходе анализа риска и результаты анализа риска должны быть документированы, и изготовители должны руководствоваться ими.
Примечания
1 Анализ риска может быть выполнен как часть работы, направленной на обеспечение качества изделия.
2 Документальное подтверждение процедуры проведения испытаний и результатов анализа риска должно включать в себя, по меньшей мере, следующее:
a) полное описание и определение (идентификацию) рассматриваемого изделия или приспособления;
b) перечень возможных опасностей, определенных в 3.3;
c) указание на методы (средства), с помощью которых риск может быть уменьшен (снижен) до приемлемого уровня;
d) определение тех частей, которые были подвергнуты анализу риска.
3.2 Идентификация количественных и качественных характеристик медицинских изделий
Для данного рассматриваемого изделия или приспособления все те характеристики, которые могут повлиять на безопасность его применения, должны быть, по возможности, перечислены с указанием пределов допустимого риска.
Примечания
t Дополнительное руководство по процедуре анализа риска для iVD-издслия (изделия для in vitro диагностики) дано в приложении А.
2 Дополнительное руководство по процедуре анализа токсикологического риска дано в приложении В.
Следующие вопросы могут послужить руководством в составлении подобного перечня:
a) Какова предполагаемая область применения изделия и каким образом оно будет использовано?
Рассматриваемые факторы: предполагаемый пользователь, необходимость наличия навыков и тренировки (обучение) пользователя, эргономические аспекты; окружающая среда, в которой изделие будут применять; кем оно будет устанавливаться и сможет ли сам пациент управлять изделием или влиять на его использование. Особое внимание необходимо уделять таким категориям пользователей, как люди с физическими недостатками, дети и пожилые люди. Людям этих категорий может понадобиться дополнительная помощь со стороны других людей при пользовании изделиями.
b) Будет ли изделие контактировать с пациентом или другими людьми?
Рассматриваемые факторы: предполагается ли контакт с изделием; каким этот контакт является: поверхностным, внутриполостным, инвазивным; имплантируемое ли это изделие и, соответственно, период и частота контакта с пациентом.
c) Какие материалы и (или) компоненты включены в изделие или использованы в нем?
Рассматриваемые факторы: соответствие характеристик используемых материалов условиям безопасности их применения.
d) Подают ли энергию пациенту или же отводят от пациента?
Рассматриваемые факторы: вид передаваемой энергии, контроль за подачей энергии, качество, количество и время воздействия.
e) Вводят и (или) выводят вещества пациенту (из пациента)?
Рассматриваемые факторы: информация о том, какое вещество вводят в пациента или выводят из него, является ли это вещество единственным или же вводят (выводят) смесь веществ, а также минимальная и максимальная скорость введения (выведения) вещества и, естественно, контроль.
О Подвергаются ли биологические вещества обработке посредством изделия для последующего использования?
Рассматриваемые факторы: тип обработки и обрабатываемое вешество(а) (например, автотрансфузия, диализаторы).
g) Поставляют ли изделие уже стерильным или же его предполагается стерилизовать самому пользователю, или же применяют другие виды микробиологической обработки?
Рассматриваемые факторы: предназначено ли данное изделие для одноразового применения или же его можно применять многократно; упаковка; срок сохранности изделия (приспособления) и любые ограничения по количеству циклов повторного применения; используемые виды процессов стерилизации.
h) Предназначено ли изделие для изменения среды, окружающей пациента?
Рассматриваемые факторы: информация о температуре, влажности, составе газов воздуха и давлении.
i) Предполагается ли проведение измерений?
Рассматриваемые факторы должны включать в себя данные о возможности проводить различные измерения, о точности измерений.
j) Является ли изделие интерпретирующим (расшифровывающим)?
Рассматриваемые факторы: информация о том, выдает ли изделие заключение (делает ли оно выводы) на основе вводимых или получаемых данных, об используемых алгоритмах и доверительных пределах.
k) Предназначено ли изделие для контроля или же для взаимодействия с другими изделиями или лекарствами?
Рассматриваемые факторы: определение других изделий или лекарств, которые могут быть использованы с данным изделием, и проблемы, связанные с возможным взаимодействием между ними.
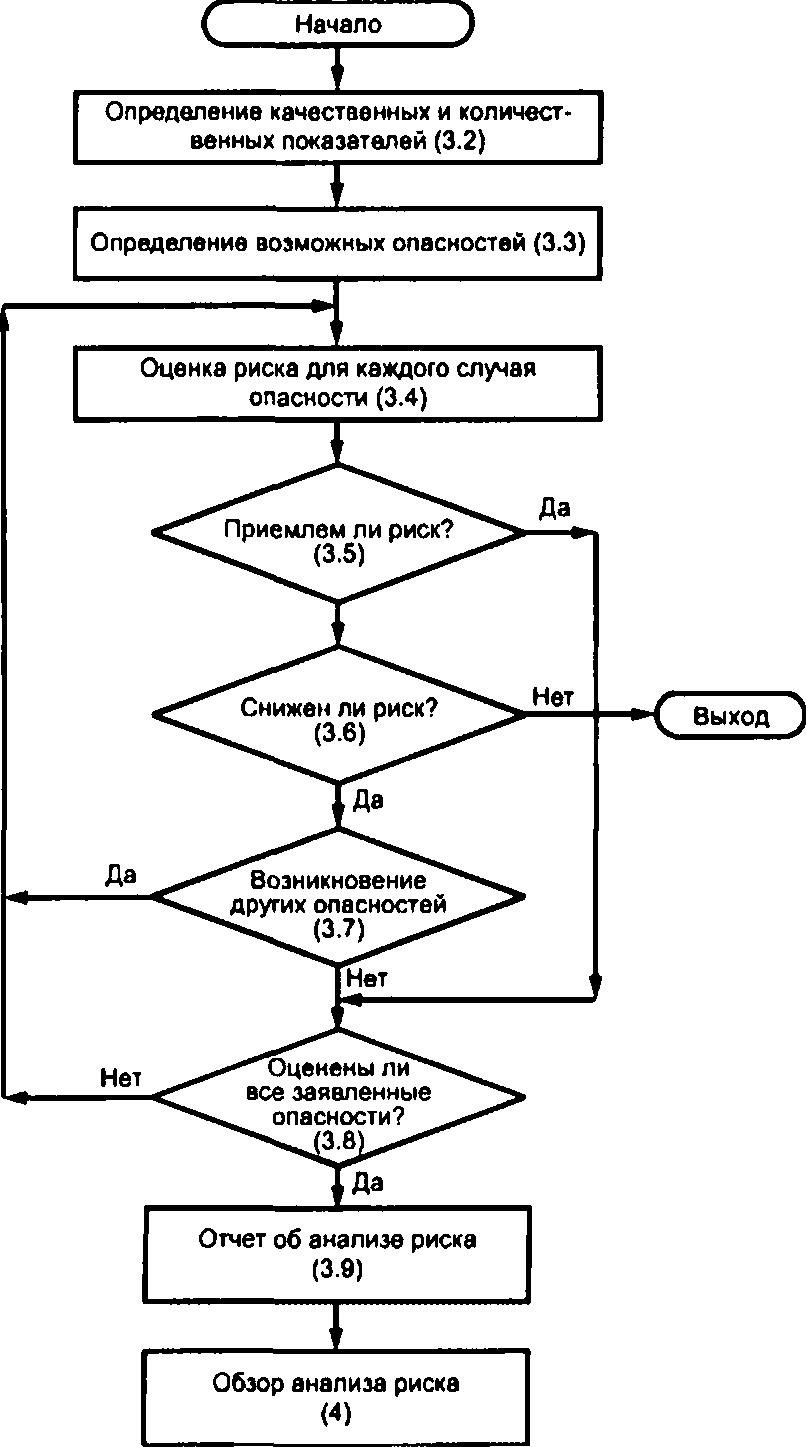
Рисунок I — Процедуры анализа риска
I) Может ли произойти нежелательный выброс энергии или веществ?
Рассматриваемые факторы: связанные со всевозможными видами энергии, включая шум, вибрацию, теплоту, излучение (включая ионизирующее, неионизирующее, ультрафиолетовое, видимое, инфракрасное), температуру на поверхностях, доступных для контакта, токи утечки и электрические и (или) магнитные поля.
Факторы, связанные с веществами, должны учитывать выброс химических веществ, в том числе отходов биологического происхождения.
т) Чувствительно ли изделие к воздействию окружающей среды?
Рассматриваемые факторы: условия работы, транспортирования, хранения изделия, в том числе возможные утечки жидкостей, нарушения в энергоснабжении и охлаждении.
п) Являются ли изделие или приспособления и комплектация к нему чрезвычайно энергопотребляющими?
Рассматриваемые факторы: спецификация таких комплектующих приспособлений, любые ограничения которых по электропотреблению должен учитывать пользователь при их выборе.
o) Необходимы ли техническое обслуживание и (или) калибровка?
Рассматриваемые факторы: нужны ли техническое обслуживание и калибровка, которые может осуществить пользователь, оператор или специалист, и кто другой может их осуществить.
p) Входит ли в состав изделия программное обеспечение?
Рассматриваемые факторы: необходимость установки программного обеспечения, модификации или замены его пользователем или оператором (ГОСТ Р 50267.0.4).
q) Есть ли у изделия ограничения по срокам сохраняемости?
Рассматриваемые факторы: способы маркировки, индикации и ликвидации (замены) изделия, связанные со сроками хранения.
г) Возможны ли задержанные во времени эффекты и (или) эффекты, возникающие при длительном использовании изделия и (или) длительном перерыве в использовании?
Рассматриваемые факторы: эргономические и кумулятивные эффекты.
s) Каким механическим воздействиям может быть подвержено изделие?
Рассматриваемые факторы: силы, воздействию которых может быть подвергнуто изделие при пользовании им.
t) Что определяет срок службы (работы) изделия?
При автономном питании определяющими факторами являются срок годности и энергоемкость батареек.
и) Предназначено ли изделие для однократного или длительного использования?
3.3 Определение возможных опасностей
Используя примеры возможных опасностей, перечисленных в приложении Сив А.2 приложения А для IVD-изделий, в качестве памятки заполняют перечень возможных опасностей при использовании изделия как в нормальных условиях работы, так и в условиях неисправности.
3.4 Оценка риска для каждого случая опасности
Для каждых возможных случаев опасностей, определенных в 3.3, риск, могущий возникнуть как при нормальной работе изделия, так и в условиях неисправности, должен быть оценен с использованием данных, имеющихся в наличии. Оценка риска должна предусматривать определение первопричины возникновения опасной ситуации или условия. Должны быть приняты во внимание последовательность событий; любые, даже незначительные особенности, природа и частота возникновения возможных вредных последствий от уже идентифицированных опасностей любого уровня.
Примечания
1 Последовательность и возможность возникновения различных опасностей должны быть проанализированы отдельно посредством качественных или количественных методов в зависимости от того, что более подходит. Этот этап анализа включает в себя ответы на следующие вопросы:
- существует ли опасность при отсутствии отказа изделия?
- существует ли опасность при отказе изделия?
- существует ли опасность только в условиях множественных отказов изделия?
В приложении D и в А.З приложения А для IVD-изделий дана информация о некоторых методиках анализа риска, которые могут быть использованы.
2 Методики, которые можно использовать для анализа риска, включают в себя анализ эффектов в режиме неисправности (Failure Mode Effect Analysis/ (FMEA) МЭК 60812 (2) |, анализ древа неисправностей (Fault Tree Analysis/ (FTA) МЭК 61025 (3) ) и исследования опасности в процессе производства (Hazard and Operability (HAZOP)l- Необходимость в выборе и использовании подобных методик может зависеть от особенностей конструкции самого изделия и находиться за пределами компетенции настоящего стандарта. В приложении D кратко изложены результаты использования некоторых методик. Более подробно эти концепции рассмотрены в МЭК 60300-3-9 (4|.
3 Информация (данные) может быть получена из:
- соответствующих стандартов;
- научных данных;
- данных испытаний подобных изделий, уже используемых, включая опубликованные отчеты об инцидентах;
- клинических заключений;
- результатов соответствующих исследований.
3.5 Обзор случаев риска
Если риск для данной возможной опасности определен правильно согласно соответствующему стандарту или приемлемость этого риска уже продемонстрирована другими средствами, переходят к 3.8. Если желанный риск, установленный в 3.4, превышает уровень приемлемости, определенный соответствующими стандартами или определенный другими средствами, переходят к 3.6.
Если риск рассматривают как выходящий за пределы приемлемого только в режиме неисправности, подобная вероятность неисправности должна быть проанализирована. При проведении такого анализа должны быть рассмотрены следующие вопросы:
- может ли неисправность быть обнаружена пользователем до того, как возникает опасность?
- можно ли устранить неисправность более эффективным контролем при производстве изделия или же путем квалифицированного технического обслуживания?
- увеличивает ли вероятность неисправности неправильное обращение с изделием?
- может ли изделие быть дополнено устройством сигнала тревоги?
3.6 Снижение уровня риска
Если уровень риска снижен до приемлемого, переходят к 3.7. Если же риск не снижен до приемлемого, возобновляют процедуру анализа.
Уровни риска могут быть снижены до приемлемых:
a) прямыми средствами обеспечения безопасности (конструкция);
b) косвенными средствами обеспечения безопасности (защита).
Примеры защиты:
- ограничение доступности, например при опасности облучения;
- экранирование от опасного облучения, например с помощью защитного покрытия;
c) предписанными (директивными) средствами обеспечения безопасности, например ограничениями продолжительности и частоты использования изделия, области его применения, срока эксплуатации, условий окружающей среды;
d) пересмотром определения области применения.
3.7 Возникновение других опасностей
Определяют, не являются ли процедуры снижения риска источниками возникновения новых опасностей.
3.8 Оценка всех заявленных опасностей
Если риск оценен для всех определенных возможных опасностей, переходят к 3.9, а если нет, то возвращаются к 3.4.
П р и м с ч а и и с — В тех случаях, когда не используют необходимость подтверждения третьей стороны, можно приступить к анализу проверки (подтверждения) в соответствии с 5.5 МЭК 60300-3-9 (4].
3.9 Отчет об анализе риска
Документируют результаты анализа риска в соответствии с 3.1 с целью принятия решения о том, ассоциируются ли оставшиеся ситуации риска с уже определенными опасностями и являются ли их уровни приемлемыми, учитывая предполагаемое использование и область применения.
4 Обзор анализа риска
Когда новая информация (данные) станет доступной, необходимо провести новые анализы риска.
Примечание - Обзор анализа риска может быть необходим в случае, если ситуации риска время от времени изменяются. Быстроизмсняемая технология может устранить любую возможную опасность, увеличить или уменьшить ее степень. Могут возникнуть новые ситуации риска или проявиться старые.
Руководство по процедуре анализа риска при использовании изделий для in vitro диагностики
А.1 Общие вопросы
Данное приложение представляет собой дополнительное руководство по анализу риска при использовании медицинских изделий для in vitro диагностики с учетом особенностей и специфических аспектов этих изделий. Использование in vitro диагностических медицинских изделий не создает какого-либо непосредственного риска пациенту или же лицу, производящему обследование, так как эти изделия не соприкасаются с телом пациента и не вводятся в его тело. Тем нс менее, в определенных ситуациях может возникнуть косвенная ситуация появления опасностей, связанных с применением изделия. Данная ситуация, в свою очередь, может привести к ошибочным решениям или спровоцировать их. Кроме того, опасности, которые можно отнести на счет оператора, также должны быть приняты во внимание.
А.2 Идентификация опасностей
В дополнение к аспектам, упомянутым в приложении С при определении опасностей, грозящих пациенту или же лицу, подлежащему обследованию, необходимо принимать в расчет такие факторы, как:
- групповая неоднородность; несовместимость одной группы (партии реагентов) с другой;
- общие факторы помех;
- эффекты износа изделий;
- погрешности при идентификации проб (выборок);
- проблемы стабильности (при хранении, транспортировании, использовании, после первоначального вскрытия контейнера);
• проблемы, возникающие при взятии проб, подготовке образцов и их стабильность (устойчивость);
- неадекватная спецификация исходных данных.
Потенциальная опасность для пациента может возникнуть из-за радиоактивности, инфекции, токсичности ингредиентов, составляющих изделие, а также исходить от конструкции упаковки. Необходимо принимать во внимание проблемы потенциального загрязнения инструментов во время передачи (манипулирования ими), работы и обслуживания в дополнение к неспецифическим опасностям, связанным с применением инструментов (например, энергоопасность).
А.З Оценка риска
При оценке риска для каждой опасности необходимо принимать во внимание следующие аспекты:
- степень надежности аналитических результатов, влияющих на медицинское заключение (медицинское заключение по результатам аналитических исследований);
• достоверность проверок;
- доступность и использование контроля;
- гарантия качества средств измерений и методик, применяемых в медицинских лабораториях;
- способность обнаружения дефектов (погрешностей);
- ситуацию при использовании изделия (например, непредвиденные условия, случаи);
- профессиональное (непрофессиональное) использование (применение).
Руководство по процедуре анализа риска при возникновении токсикологических опасностей
В.1 Общие вопросы
Данное приложение представляет собой руководство по процедуре анализа риска при возникновении токсикологических опасностей. ГОСТ Р ИСО 10993.1 и ГОСТ Р ИСО 10993.3 устанавливают общие принципы биологической оценки материалов (изделий), химические составляющие которых способны нанести биологический вред.
Необходимо приложить усилия для того, чтобы избежать излишних тестирований на подопытных животных. В ИСО 10993.2 (5] обращено внимание на требования к охране животных и на соответствующее национальное законодательство, например Европейскую общественную директиву по охране животных (European Community-Directive on Animal Protection) (86/609/EEC) (6).
Тест можно нс проводить, если есть научно подтвержденная возможность нс делать этого.
В.2 Оценка риска, связанного с токсикологическими опасностями
При анализе риска, связанного с токсикологическими опасностями, следует принимать во внимание:
- химическую природу материалов;
- предшествующее использование материала;
- данные тестирования на биологическую безопасность.
Количество необходимых данных и глубина исследования могут быть изменены в зависимости от предполагаемого использования изделия, а также зависеть от его природы и длительности контакта с пациентом. Требования к данным обычно менее строги по отношению к упаковочным материалам, изделиям, контактирующим с неповрежденной кожей, и к любым компонентам изделия, которые нс входят в непосредственный контакт с тканями организма, слизистыми оболочками или поврежденной кожей и не являются физиологическими жидкостями. Для того чтобы установить необходимость в наличии дополнительных данных касательно возникновения токсикологического риска, нужно провести обзор современных знаний о материалах (изделиях), описанных в научной литературе, а также полученных в результате предыдущих клинических испытаний или любым другим научным способом. В некоторых случаях необходимо получить отредактированные (сформулированные) данные, а также остаточные данные (например, данные о процессе стерилизации, о простых соединениях), данные биологических тестов и т. п.
В.2.1 Химическая природа материалов
Информация, характеризующая химическую идентичность и биологическую реакцию материалов, чрезвычайно полезна при оценке медицинского изделия в области его применения. Необходимо принимать в расчет некоторые факторы, могущие воздействовать на биосовместимость:
- идентичность, концентрацию, доступность и токсичность всех составляющих (например добавки, средства обработки, мономеры, катализаторы, продукты реакции);
- влияние биодеградации и других разрушений материалов.
Там, где используют реактивные или токсичные ингредиенты, или же там, где они могут образоваться в результате производства, обработки, хранения или же в случаях деградации материала, следует учитывать и рассматривать возможность взрыва остаточных веществ. Информация, относящая к концентрации остаточных веществ, а также к выщелачиванию, может быть необходима.
В случае, когда полностью сформулированные данные недоступны изготовителю по причине их конфиденциальности, необходимо получить подтверждение относительно оценки пригодности и возможности использования такого материала в предполагаемой среде.
В.2.2 Предыдущее применение
Необходимо проверить и пересмотреть информацию о предыдущем применении каждого материала, в том числе предполагаемого для добавки, а также любые неблагоприятные реакции, которые могут возникнуть при применении материала. Предыдущее использование ингредиента или материала не обязательно гарантирует его пригодность в одинаковых случаях применения. Необходимо принимать в расчет предполагаемую область применения (использования), концентрацию ингредиентов и текущую токсикологическую информацию.
В.2.3 Данные исследования биологической безопасности
ГОСТ Р ИСО 10993.1 даст руководство к тому, результаты каких тестов должны быть учтены при каждом отдельном случае применения изделия. Необходимость тестирования следует пересматривать, принимая во внимание уже существующие данные с тем, чтобы нс проводить ненужные испытания.
Примеры возможных причин и факторов, влияющих на возникновение опасных ситуаций, ассоциируемых с медицинскими изделиями
С.1 Общие вопросы
Перечни некоторых возможных причин и факторов, в результате которых могут возникнуть опасности, связанные с применением медицинских изделий, даны в С.2—С.7. Эти перечни являют собой примерную сводку причин, необходимую для обеспечения вспомогательными средствами при определении возможных опасностей, подходящих под требования 3.3 при проведении процедуры анализа риска (шаг на рисунке 1).
С.2 Энергетические опасности
Это следующие опасности:
- электричество;
- теплота;
- механические силы;
- ионизирующее излучение;
- неионизирующее излучение;
- электромагнитные поля;
- движущиеся части;
• подвешенные массы;
- неисправности в изделиях, поддерживающих пациента;
- давление (разрушение емкости, сосуда);
- акустическое давление;
- вибрация;
- магнитные поля (например, аппараты с использованием магнитно-ядерного резонанса).
С.З Биологические опасности
Это следующие опасности:
- биозагрязнение;
- бионесовместимость;
- несоответствие выходных параметров (вещества/энергии);
- неправильная дозировка (химических составов);
- токсичность;
• аллергичность;
- мутагенность;
- тератогенность (аномалии развития);
- канцерогенность;
- возможность инфекций и перекрестные инфекции;
• пирогенность;
- неспособность поддерживать гигиеническую безопасность;
- деградация.
С.4 Опасности, связанные с окружающей средой
Это следующие опасности:
• электромагнитные помехи;
- неадекватность подачи энергии или охлаждения;
- ограничения в охлаждении;
- вероятность работы изделия вне пределов, предписанных по условиям применения;
- несовместимость с другими изделиями;
• внезапные механические поломки (неисправности);
- загрязнение отходами и (или) отработанными частями.
С.5 Опасности, обусловленные использованием самого изделия
Это следующие опасности:
- неправильная маркировка;
- неправильные инструкции по использованию (применению);
- неправильная спецификация принадлежностей;
- неправильная спецификация предварительной проверки;
- усложненные инструкции по применению и работе изделия;
- недоступные или разрозненные инструкции по пользованию;
- использование неподготовленным (необученным) персоналом;
- предполагаемое неправильное обращение с изделием;
• недостаточность предостережений о побочных эффектах;
- недостаточность предостережений о запрете многоразового использования изделий однократного при* менения;
- неправильность проведения измерений или другие метрологические аспекты;
- неправильность диагностики;
- ошибки при передаче данных;
- неправильное представление результатов;
- несовместимость с расходными материалами, приспособлениями и другими изделиями.
С.6 Опасности, обусловленные функциональными неполадками, обслуживанием и старением
Это следующие опасности:
- неадекватность рабочих характеристик для предполагаемого применения изделия;
- недостаточность или неадекватность спецификации для технического обслуживания, в том числе спецификации по проверке после технического обслуживания;
- неадекватная эксплуатация;
- потеря механической целостности;
* неадекватность упаковки [загрязнение и (или) порча изделий];
- неправильное повторное использование.
Информация о методиках анализа риска
1)Л Общие вопросы
Данное приложение представляет собой руководство по применению некоторых доступных методик анализа риска в соответствии с 3.4. Данные методики являются дополнительными. Возможно применение более чем одной из них.
D.2 Анализ вида и последствий отказов (Failure Mode and Effect Analysis — FMEA)
FMEA — прежде всего качественная методика, с помощью которой систематически определяют и оценивают последовательность отдельных компонентов в режиме неисправности. Это индикативная методика, в ходе осуществления которой определяют, «что случится па выходе, если .. ?» Компоненты анализируют последовательно, один за другим, таким образом выявляя условие единичной неисправности. Эту методику выполняют в режиме «снизу вверх», т. е. процесс анализа проходит от одного уровня до следующего, более высокого уровня системы.
FMEA можно расширить, включив в нес более жесткую методику анализа последовательностей неисправностей (отказа), относительных возможностей возникновения неисправностей и возможности обнаружения их. Таким образом, FMEA может стать FMECA (Failure Mode Effect and Criticality Analysis (т. e. анализ вила и последствий критических отказов). Для проведения последнего анализа необходимо досконально, во всех деталях знать изделие.
Методика FMEA может быть также очень полезной при обнаружении погрешностей, связанных с человеческим фактором. Эту методику также можно использовать для определения опасностей, таким образом обеспечивая вход в методику «анализ древа неисправностей — FTA» (Fault Tree Analysis).
Недостатком методики FMEA является избыточность информации, а также вовлечение в анализ процедур ремонта, профилактического обслуживания и ограничений, связанных с определением единичной неисправности.
D.3 Анализ древа неисправностей (FTA)
Древо неисправностей (ТА) — это средство анализа опасностей, определенных в ходе осуществления других методик, которое начинается от постулата (предварительного условия) нежелаемого последствия. Его также называют «top event» — «главное событие (фактор)». Дедуктивным методом, начиная с главного фактора, исследуют всевозможные причины или неисправности в режиме работы, начиная с низшего уровня, постепенно выходя на более высокие уровни и определяя причины и следствия неисправностей. Следуя пошаговой идентификации выявления неисправностей с более высокого уровня системы на более низкий уровень, можно выйти на желаемый уровень системы, который и является источником работы изделия в режиме неисправности. Эта выявленная последовательность и выведет к предполагаемому условию. Применение методики FTA особенно полезно при судебных разбирательствах.
Результаты данной методики представляют в виде рисунка в форме древа событий. Неисправности, определенные на древе, могут быть теми факторами, которые ассоциируются с неполадками в аппаратном или программном обеспечении, возникшими в результате работы человека (человеческого фактора) или же по любой другой причине, которая и привела к нежелательному явлению. Преимуществом методики FTA является то, что она не ограничена условиями единичной неисправности.
FTA — это системный анализ, который одновременно и достаточно гибко позволяет исследовать большое количество разнообразных факторов, включая и человеческий фактор. FTA, используемый при анализе риска, в первую очередь является средством оценки возможных неисправностей. Графическое представление данной методики позволяет легко разобраться в поведении системы и факторов, входящих в систему (зависящих от системы). Но если древо становится большим, то обработка древа неисправностей потребует применения сложных математических методов. Эта особенность данной методики делает проверкудрева неисправностей затрудненной.
D.4 Исследование опасности в процессе производства (Hazard and Operability Study — HAZOP)
Методику HAZOP рассматривают как форму методики FMEA. Эта системная методика предназначена для определения опасностей и проблем, связанных с процессом производства изделий. Первоначально данная методика была разработана для ее применения в химической промышленности. Принципы HAZOP могут быть применены к техническим процессам работающих заводов или же на разных стадиях проектных разработок. HAZOP, проводимая на начальных стадиях проекта, зачастую является руководством к детальному проектированию, обеспечивающему безопасность.
Цели этой методики следующие:
a) произвести полное описание завода (предприятия) и процессов, включающих в себя предполагаемые проектом условия;
b) систематически проверять каждую часть процесса с тем, чтобы обнаружить, как отклонения от условий нормальной работы могут повлиять на проект (конструкцию);
c) определить, к каким последствиям могут привести такие отклонения от условий нормальной работы и каков будет результат, а затем решить, смогут ли подобные отклонения привести к возникновению опасности или явиться производственной проблемой.
Эта последняя составляющая методики HAZOP полезна при анализе риска самого изделия особенно тогда, когда конструкция изделия зависит от процесса изготовления.
Упрошенная взаимосвязь между анализом риска и другими действиями, относящимися к управлению риском

Обобщенная оценка риска
Управление риском
и Предмет настоящего стандарта.
ПРИЛОЖЕНИЕ F (справочное)
Библиография
|1| ИСО/МЭК 51—90 Руководство по включению проблем безопасности в стандарты
12] МЭК 60812—85 Методики ана/зиза надежности системы. Процедуры по анализу эффектов в режиме неисправностей (FMEA)
PJ МЭК 61025—90 Методики анализа надежности систем. Процедуры по анализу древа неисправности (FTA)
(4) МЭК 60300-3-9—95 Управление зависимостью. Часть 3. Руководство к применению. Раздел 9. Анализ риска технологических систем
|5| ИСО 10993.2—93 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 2. Требования по охране животных
16] 86/609/ЕЕС Директива Европейского Сообщества по защите животных
УДК 615.46:658.382.3:006.354 ОКС 11.040.10 Р20 ОКСТУ 9400
11.040.01
35.240.80
13.260
Ключевые слова: медицинское изделие, риск, опасность, анализ риска, применение
Редактор Л. В. Афанасенко Технический редактор Н. С. Гришанова Корректор С. И. Фирсова Компьютерная верстка В. Н. Романовой
Изд. лиц. № 02354 от 14.07.2000. Сдано в набор 08.09.2000. Подписано в печать 23.10.2000. Усл. псч. л. 1,86. Уч.-изд. л. 1,45. Тираж 159 экз. С 6070. Зак. 2312
ИПК Издательство стандартов,107076, Москва, Колодезный пер., 14. Набрано в Калужской типографии стандартов на ПЭВМ. Калужская типография стандартов, 248021, г. Калуга, ул. Московская, 256. ПЛР № 040138

