ГОСТ Р 53469-2009
Группа П46
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ОПТИКА И ОПТИЧЕСКИЕ ПРИБОРЫ
ЭНДОСКОПЫ И ПРИБОРЫ ЭНДОТЕРАПЕВТИЧЕСКИЕ МЕДИЦИНСКИЕ
Часть 1
Общие требования
Optics and optical instruments. Medical endoscopes and endotherapy devices. Part 1. General requirements
ОКС 11.040.55
ОКП 94 4210
Дата введения 2011-01-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 ПОДГОТОВЛЕН Открытым акционерным обществом "ТКС-оптика" совместно с рабочей группой ПК 5 "Микроскопы и эндоскопы" Технического комитета ТК 296 "Оптика и оптические приборы" на основе собственного аутентичного перевода международного стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 296 "Оптика и оптические приборы"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 9 декабря 2010* г. N 627-ст
_______________
* Вероятно, ошибка оригинала. Следует читать: 2009. - .
4 Настоящий стандарт является модифицированным по отношению к международному стандарту ИСО 8600-1:2005* "Оптика и фотоника. Медицинские эндоскопы и эндотерапевтические приборы. Часть 1. Общие требования" (ISO 8600-1:2005 "Optics and photonics - Medical endoscopes and endotherapy devices - Part 1: General requirements"). При этом дополнительные слова (фразы), включенные в текст стандарта для учета потребностей национальной экономики Российской Федерации и/или особенностей российской национальной стандартизации, выделены курсивом**
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей.
** В бумажном оригинале обозначения и номера стандартов и нормативных документов в разделе "Предисловие" и таблице ДА.1 приложения ДА приводятся обычным шрифтом, остальные по тексту документа выделены курсивом. - .
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
Настоящий стандарт распространяется на эндоскопы и эндотерапевтические приборы, применяемые в практической медицине.
Стандарт устанавливает общие требования, предъявляемые к эндоскопам и эндотерапевтическим приборам, и методы их испытаний.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 23496-89 Эндоскопы медицинские. Общие технические требования и методы испытаний
ГОСТ 26332-84 Эндоскопы медицинские. Маркировка, упаковка, транспортирование и хранение
ГОСТ Р 50267.0-92 (МЭК 601-1-88) Изделия медицинские электрические. Часть 1. Общие требования безопасности
ГОСТ Р 50267.18-94 (МЭК 601-2-18-90) Изделия медицинские электрические. Часть 2. Частные требования безопасности к эндоскопической аппаратуре
ГОСТ Р 50444-92 Приборы, аппараты и оборудование медицинские. Общие технические условия
ГОСТ Р 51609-2000 Изделия медицинские. Классификация в зависимости от потенциального риска применения. Общие требования
ГОСТ Р ИСО 10993-1-2009 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования
ГОСТ Р ИСО 14971-2009 Изделия медицинские. Применение менеджмента риска к медицинским изделиям
ГОСТ Р ИСО 15223-2002 (ИСО 15223:2000) Изделия медицинские. Символы, применяемые при маркировании на медицинских изделиях, этикетках и в сопроводительной документации
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов и классификаторов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями по [1]:
3.1 эндоскоп (endoscope): Медицинский прибор, имеющий устройство для наблюдения, содержащее или не содержащее оптические элементы, вводимый во внутренние полости и органы человека через естественные или созданные хирургическим способом каналы для проведения обследования, диагностики или лечения.
Примечание - Эндоскопы могут быть твердотельными или гибкими; все типы могут иметь различные системы получения изображения (например, с помощью линз или ультразвуковых датчиков) и различные системы передачи изображения (например, оптические линзовые или волоконно-оптические системы или электрическим способом).
3.2 эндотерапевтический прибор (endotherapy device): Медицинское устройство, предназначенное для ввода через один с эндоскопом канал или через отдельный естественный или созданный хирургическим способом канал, во время проведения эндоскопических процедур обследования, диагностики или лечения.
Примечание - Эндотерапевтические приборы содержат устройство, через которое вводят эндоскоп или сам эндотерапевтический прибор в виде направляющей трубки, троакара или скользящей трубки и др. В число эндотерапевтических приборов входят устройства, вводимые не в те каналы, в которые вводят эндоскоп, для обеспечения безопасности при предполагаемом их использовании в условиях эндоскопического наблюдения.
3.3 жесткий эндоскоп [эндотерапевтический прибор] (rigid endoscope [endotherapy device]): Эндоскоп (эндотерапевтический прибор), рабочая часть которого не подвергается изгибу в естественных или созданных хирургическим способом каналах в организме человека или в инструментальных каналах.
3.4 гибкий эндоскоп [эндотерапевтический прибор] (flexible endoscope [endotherapy device]): Эндоскоп [эндотерапевтический прибор], рабочая часть которого подвержена изгибу в естественных или созданных хирургическим способом каналах в организме человека или в инструментальных каналах.
3.5 французская мера (шкала Шаррьера), (French): Мера размера некоторых круглых и некруглых сечений эндоскопов, определяемая по формуле:
![]() ,
,
где - периметр поперечного сечения, мм.
3.6 дистальный (distal): Расположение той части эндоскопа или эндотерапевтического прибора, которая находится от оператора дальше некоторой опорной точки.
3.7 проксимальный (proximal): Расположение той части эндоскопа или эндотерапевтического прибора, которая находится от оператора ближе некоторой опорной точки.
3.8 инструментальный канал (instrument channel): Участок эндоскопа или эндотерапевтического прибора, на прохождение через который рассчитан эндоскоп или эндотерапевтический прибор.
3.9 рабочая часть (insertion portion): Часть эндоскопа или эндотерапевтического прибора, предназначенная для введения в естественный или созданный хирургическим способом канал в организме человека или введения в инструментальный канал эндоскопа или эндотерапевтического прибора.
3.10 максимальная ширина рабочей части (maximum insertion portion width): Максимальная наружная ширина эндоскопа или эндотерапевтического прибора по всей длине рабочей части.
3.11 минимальная ширина инструментального канала (minimum instrument channel width): Минимальная внутренняя ширина инструментального канала.
3.12 рабочая длина (working length): Максимальная длина рабочей части.
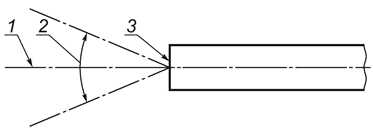
3.13 поле зрения (field of view): Размер поля в пространстве предметов, наблюдаемого через оптический эндоскоп, выражаемый в виде угла при вершине конуса, град, расположенного на дистальной поверхности окна эндоскопа (см. рисунок 1).
Примечание - Понятие поля зрения неприменимо, если эндоскоп предназначен для работы в контакте с объектом.
1 - центральная ось поля зрения; 2 - поле зрения; 3 - дистальная поверхность окна эндоскопа
Рисунок 1 - Поле зрения
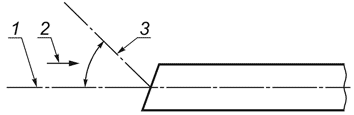
3.14 направление наблюдения (direction of view): Положение центра поля предмета относительно нормальной оси эндоскопа, выраженное в виде угла, град, между нормальной осью эндоскопа (0°) и центральной осью поля зрения (см. рисунок 2).
1 - нормальная ось эндоскопа; 2 - направление наблюдения; 3 - центральная ось поля зрения
Рисунок 2 - Направление наблюдения
3.15 управляемая часть (controllable portion): Участок рабочей части эндоскопа или эндотерапевтического прибора, движением которой оператор может управлять дистанционно.
3.16 медицинское изделие (medical device): По ГОСТ Р ИСО 14971 (пункт 2.7).
4 Общие* требования
_________________
* Слово "Общие" в наименовании пункта 4 в бумажном оригинале выделено курсивом. - .
4.1 Общие положения
4.1.1 Общие требования, предъявляемые к медицинским эндоскопам и эндотерапевтическим приборам, должны соответствовать требованиям, изложенным в настоящем разделе. Медицинские эндоскопы с волоконными световодами должны соответствовать общим техническим требованиям по ГОСТ 23496.
4.1.2 Дизайн и конструкция эндоскопов или эндотерапевтических приборов должны соответствовать требованиям, указанным в 4.2-4.9 настоящего стандарта, с учетом современного состояния науки и техники.
4.2 Требования к поверхности и краям
4.2.1 Эндоскопы и эндотерапевтические приборы должны быть сконструированы таким образом, чтобы их предполагаемое применение не привело к непредусмотренным травмам. Разработчиком должны быть соблюдены общие требования по ГОСТ Р 51609.
4.2.2 На поверхностях эндоскопов и эндотерапевтических приборов не должно быть пор, трещин и остатков обрабатывающих средств.
4.3 Требования к максимальной ширине рабочей части
4.3.1 Максимальная ширина рабочей части недолжна превышать значения, указанного в инструкции по эксплуатации (далее - ИЭ), предоставляемой изготовителем (см. раздел 7, перечисление d), позиция третья).
4.4 Требования к минимальной ширине инструментального канала
4.4.1 Минимальная ширина инструментального канала не должна быть меньше значений, указанных в ИЭ, предоставляемой изготовителем (см. раздел 7, перечисление d), позиция восьмая).
4.5 Требования к полю зрения
4.5.1 Отклонение поля зрения эндоскопа, содержащего оптические элементы, от номинального значения, установленного изготовителем в нормативной документации на конкретный тип эндоскопа, должно быть не более 15%.
4.5.2 В каталогах, ИЭ указание о поле зрения допускается не приводить.
4.6 Требования к направлению наблюдения
4.6.1 Отклонение направления наблюдения жесткого эндоскопа, содержащего оптические элементы, от номинального значения, установленного изготовителем в ИЭ, должно быть не более 10° (см. раздел 7, перечисление d), позиция четвертая).
4.7 Требования к безопасности
4.7.1 Эндоскопы и эндотерапевтические приборы должны соответствовать общим требованиям безопасности по ГОСТ Р 50267.0 и частным требованиям - по ГОСТ Р 50267.18.
4.8 Требования к биологической совместимости
4.8.1 Материалы, используемые для наружной поверхности рабочей части эндоскопов и эндотерапевтических приборов, должны быть проверены на биологическую совместимость в соответствии с требованиями ГОСТ Р ИСО 10993-1.
4.9 Требования к соединителям и подключению
4.9.1 Изготовитель эндоскопов и эндотерапевтических приборов должен проводить процедуру менеджмента риска в соответствии с ГОСТ Р ИСО 14971, чтобы учесть вероятность неправильного подключения медицинских изделий, предназначенных для подключения к эндоскопам или эндотерапевтическим приборам, к неэндоскопическим соединителям, связанным с пациентом (например, для внутривенного введения).
4.9.2 Целью процедуры менеджмента риска является оценка:
- физической возможности неправильного подключения медицинских изделий к неэндоскопическим соединителям, связанным с пациентом, в частности к соединителям по Люэру, в соответствии с [4] и [5];
- вероятности возникновения неправильного подключения, что может стать потенциальной возможностью нанесения вреда пациенту.
4.9.3 В случае наличия соответствующих нормативных документов на соединители, которые соответствуют предполагаемому применению эндоскопа, эндотерапевтического прибора или медицинского изделия, предназначенного для подключения к эндоскопам или эндотерапевтическим приборам, эти стандарты следует применять, если они не противопоказаны процедурой менеджмента риска.
4.9.4 Руководящие указания по применению менеджмента риска к соединителям эндоскопов, эндотерапевтических приборов и медицинских изделий приведены в приложении A.
5 Методы испытаний
5.1 Общие положения
5.1.1 Все испытания, представленные в настоящем стандарте, являются едиными для эндоскопов и эндотерапевтических приборов.
5.2 Испытание поверхности и краев
5.2.1 Соответствие прибора требованиям 4.2 настоящего стандарта должно оцениваться визуальным и субъективным методами, без применения увеличительных средств и при достаточном освещении.
5.3 Испытание максимальной ширины рабочей части
5.3.1 Максимальная ширина рабочей части должна быть определена в соответствии с [3].
5.4 Испытание минимальной ширины инструментального канала
5.4.1 При определении минимальной ширины инструментального канала точность применяемого измерительного прибора должна быть более 0,01 мм.
5.5 Испытание поля зрения
5.5.1 Поле зрения эндоскопа, содержащего оптические элементы, должно быть определено в соответствии с [2].
5.6 Испытание направления наблюдения
5.6.1 Направление наблюдения эндоскопа, содержащего оптические элементы, должно быть определено в соответствии с [2].
6 Требования к маркировке
6.1 Маркировка эндоскопов и эндотерапевтических приборов должна соответствовать требованиям ГОСТ Р 50444 (раздел 8) с дополнениями и уточнениями, изложенными в настоящем разделе.
6.2 Каждый эндоскоп и эндотерапевтический прибор должны иметь следующую минимальную маркировку:
a) номер по каталогу и/или другой знак, достаточный для идентификации прибора и его изготовителя;
b) максимальную ширину рабочей части, минимальную ширину инструментального канала, рабочую длину, поле зрения и/или направление наблюдения, если такая идентификация необходима для предполагаемого использования эндоскопа или эндотерапевтического прибора. Ширина рабочей части и ширина инструментального канала должны быть выражены в миллиметрах. Ширина рабочей части и ширина инструментального канала могут также обозначаться по французской мере по 3.5, идентифицированной размером , или числом в круге;
c) приборы и съемные компоненты или съемные не полностью собранные компоненты по возможности должны быть идентифицированы по номеру партии или заводскому номеру.
6.3 Маркировка должна быть несмываемой, разборчивой во время использования, чистки, дезинфекции, стерилизации и хранения прибора, осуществляемых в соответствии с ИЭ изготовителя.
6.4 Если на приборы, съемные компоненты или съемные, не полностью собранные компоненты маркировку нанести нельзя из-за их размеров или конфигурации, необходимая маркировка должна быть нанесена на этикетку, упаковку или указана в ИЭ.
6.5 Символы, применяемые при маркировке эндоскопов и эндотерапевтических приборов, в документации изготовителя должны соответствовать требованиям ГОСТ Р ИСО 15223.
7 Требования к инструкции по эксплуатации
7.1 Изготовитель эндоскопов или эндотерапевтических приборов должен предоставить пользователю ИЭ, содержащую следующую информацию:
a) указание предполагаемого использования прибора;
b) инструкцию по функциям и надлежащему использованию прибора;
c) изображение прибора с пояснениями, чтобы дать пользователю возможность идентифицировать соответствующие части и характеристики прибора, на которые дается ссылка в ИЭ и которые соответствуют разделу 4 настоящего стандарта;
d) описание и технические данные прибора, включая:
- наименование и адрес изготовителя или поставщика;
- номер по каталогу и наименование прибора;
- максимальную ширину рабочей части и рабочую длину;
- направление наблюдения;
- описание органов дистанционного управления и связанных с ними положений управляемой части;
- описание узлов, заменяемых пользователем, и инструкции по их замене;
- координаты службы, обеспечивающей авторизованное обслуживание прибора;
- минимальную ширину инструментального канала каждого прибора; в случае необходимости в ИЭ должно быть дано следующее предупреждение: "Не гарантируется, что приборы, выбранные только с учетом указанной минимальной ширины инструментального канала, будут взаимозаменяемы в сочетаниях с медицинскими изделиями";
e) необходимые инструкции по сборке прибора для надлежащей эксплуатации, по его разборке и повторной сборке после чистки, дезинфекции и/или стерилизации;
f) меры предосторожности и инструкции по предусмотренному использованию прибора, в том числе в части электрических, электронных, электронно-оптических, электромедицинских или электроакустических узлов, предназначенных для совместного использования с данным прибором и отвечающих требованиям ГОСТ Р 50267.0 и ГОСТ Р 50267.18:
- наличие или отсутствие жидкостей, предназначенных для использования вместе с эндоскопом, например, контрастной среды, антисклерозантов, смазочных материалов и анестезирующих средств, а также предупреждений, касающихся жидкостей, не перечисленных выше;
- меры предосторожности по использованию медицинских изделий в горючей среде;
g) инструкции по проведению осмотра в целях проверки работоспособности медицинских изделий;
h) инструкции по чистке медицинских изделий многократного использования с указанием специальных чистящих приспособлений или оборудования;
i) инструкции по особым условиям дезинфекции и стерилизации, которые прибор может выдержать;
j) рекомендуемые методики по хранению медицинских изделий перед использованием, а для медицинских изделий многократного использования - между периодами применения.
8 Требования к упаковке, транспортированию и хранению*
_________________
* Слова "транспортированию и хранению" в наименовании пункта 8 в бумажном оригинале выделены курсивом. - .
8.1 Требования к упаковке, транспортированию и хранению эндоскопов и эндотерапевтических приборов - по ГОСТ 26332.
8.2 Изготовитель должен упаковать эндоскоп и эндотерапевтические приборы таким образом, чтобы защитить их от неблагоприятных воздействий окружающей среды.
Приложение A
(справочное)
Руководящие указания по применению менеджмента риска для соединителей эндоскопов, эндотерапевтических приборов и медицинских изделий
A.1 Данное приложение содержит руководящие указания для изготовителей эндоскопов, эндотерапевтических приборов и медицинских изделий, предназначенных для подключения к эндоскопам или эндотерапевтическим приборам, при оценке уровня риска, связанного с соединителями, в отношении их предполагаемого использования, если специальные соединители не предусмотрены соответствующими стандартами.
A.2 Как указано в ГОСТ Р ИСО 14971 (приложение Е) оценка уровня риска для медицинских изделий должна быть произведена путем комбинирования двух компонентов:
- вероятности возникновения вреда (как часто может возникать вред);
- последствий вреда (степень тяжести нанесения вреда).
Оценку вероятности возникновения вреда следует основывать на количественных данных, но если таких данных нет, следует применить качественный подход, который включает прогнозирование вероятности возникновения вреда с использованием аналитических или имитирующих методов и/или с учетом мнения эксперта.
Обычно бывает проще количественно ранжировать степень тяжести нанесения вреда, распределив ее на три или четыре уровня.
Приемлемость риска подразделяют в основном на три категории:
a) в целом приемлемый;
b) разумно низкий допустимый риск (насколько допускает практика (ALARP));
c) неприемлемый.
A.3 При рассмотрении соединителей анализ рисков изготовителя должен включать рассмотрение вероятности и тяжести следующих факторов:
a) перекрестные соединения;
b) неправильное подключение к соединителям, не связанным с пациентом;
c) неправильное подключение к соединителям, не связанным с медицинским оборудованием;
d) надежность соединений в нормальных условиях и при одиночной неисправности;
e) предусмотренное использование соединителя (например, специальный или универсальный);
f) доработка соединителей многократного использования.
При оценке вероятности возникновения таких факторов также следует учитывать другие факторы, включая следующие:
- предусмотренное или ожидаемое место использования (например, использование в отделении интенсивной терапии, где количество соединений, предназначенных для пациента, может представлять более высокие риски неправильного соединения, чем при использовании в эндоскопическом отделении);
- принято ли то, что соединения, связанные с пациентом, закрыты/спрятаны от прямого наблюдения при проведении предусмотренной процедуры;
- наличие тесного соседства соединений эндоскопической системы с другими возможными соединениями, связанными с пациентом;
- использование соединителя внутри или снаружи непосредственного окружения пациента;
- сохранение соединений с пациентом, задействованных во время проведения эндоскопической процедуры, после завершения процедуры;
- возможность дотянуть соединитель до пациента в условиях нормального использования или при единичной неисправности;
- нормальный уровень надзора/кадрового обеспечения в связи с процедурой.
В отношении медицинских изделий многократного использования риски, возникающие при изменении существующего состояния, также следует оценивать, включая переходные меры, которые могут стать необходимыми, если предполагают, что оборудование с "новыми" соединителями должно безопасно использоваться в комбинации с оборудованием, имеющим "старые" соединители.
Если, выполняя требования по применению менеджмента риска в соответствии с ГОСТ Р ИСО 14971, изготовитель решает использовать соединитель по Люэру в соответствии с [4] и [5], рекомендуется представить полное обоснование такого решения в протоколе управления рисками, так как неправильное соединение линий, питающих эндоскоп (например, для вдувания газа, отсоса, промывающей жидкости), и веществ, вводимых через шприц (например, воздух, вода, контрастные среды, вещества для местного обезболивания, антисклерозанты, вещества для окрашивания слизистой и т.д.), может стать роковым при неправильном подключении к неэндоскопическим входам пациента (например, вдувание газа под высоким давлением в сосудистую систему).
Приложение ДА
(обязательное)
Сведения о соответствии ссылочных национальных стандартов международным стандартам, использованным в качестве ссылочных в примененном международном стандарте
Таблица ДА.1
Обозначение ссылочного национального стандарта | Степень соответствия | Обозначение и наименование ссылочного международного стандарта |
ГОСТ Р ИСО 10993-1-2009 | IDT | ИСО 10993-1:2003 "Оценка биологического действия медицинских изделий. Часть 1. Оценка и испытания" |
ГОСТ Р ИСО 14971-2009 | IDT | ИСО 14971:2007 "Изделия медицинские. Применение менеджмента рисков к медицинским изделиям" |
ГОСТ Р ИСО 15223-2002 | IDT | ИСО 15223:2000 "Изделия медицинские. Символы, используемые на этикетках и ярлыках медицинских изделий и предлагаемая информация" |
ГОСТ Р 50267.18-94 | MOD | МЭК 60601-2-18:1990 "Электроаппаратура медицинская. Часть 2. Частные требования к безопасности аппаратуры для эндоскопии" |
ГОСТ Р 50267.0-99 | MOD | МЭК 60601-1:1988 "Электроаппаратура медицинская. Часть 1. Общие требования к безопасности" |
Примечание - В настоящей таблице использованы следующие условные обозначения степени соответствия стандартов: - IDT - идентичные стандарты; - MOD - модифицированные стандарты. | ||
Библиография
[1] ИСО 8600-6:2005* Оптика и фотоника. Медицинские эндоскопы и эндотерапевтические приборы. Часть 6. Словарь
_______________
* Сведения о соответствии ссылочных национальных стандартов международным см. Приложение ДА
[2] ИСО 8600-3:1997 Оптика и фотоника. Медицинские эндоскопы и эндотерапевтические приборы. Часть 3. Определение поля зрения и направления наблюдения эндоскопов, содержащих оптические компоненты
[3] ИСО 8600-4:1997 Оптика и фотоника. Медицинские эндоскопы и эндотерапевтические приборы. Часть 4. Определение максимальной ширины вводимой части
[4] ИСО 594-1:1986 Конические фитинги, суживающиеся на 6% (по Люэру) для шприцев, игл и другого специального медицинского оборудования. Часть 1. Общие требования
[5] ИСО 594-2:1998 Конические фитинги, суживающиеся на 6% (по Люэру) для шприцев, игл и другого специального медицинского оборудования. Часть 2. Блокирующие фитинги
Электронный текст документа
и сверен по:
, 2011