ГОСТ Р 56432-2015/GHTF/SG3/N 17:2008
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Система менеджмента качества
ИЗДЕЛИЯ МЕДИЦИНСКИЕ
Руководство по управлению продукцией и услугами, получаемыми от поставщиков
Quality management system. Medical devices. Guidance on the control of products and services obtained from suppliers
ОКС 03.120.10
11.040.01
Дата введения 2016-07-01
Предисловие
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью "МЕДИТЕСТ" (ООО "МЕДИТЕСТ") на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 436 "Управление качеством медицинских изделий"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 10 июня 2015 г. N 635-ст
4 Настоящий стандарт идентичен по отношению к международному документу Целевой группы по глобальной гармонизации (Global Harmonization Task Force - GHTF) GHTF/SG3/N 17:2008* "Система менеджмента качества. Изделия медицинские. Руководство по управлению продукцией и услугами, получаемыми от поставщиков" (GHTF/SG3/N 17:2008 "Quality management system - Medical devices - Guidance on the control of products and services obtained from suppliers", IDT)
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
5 ВВЕДЕН ВПЕРВЫЕ
6 ПЕРЕИЗДАНИЕ. Февраль 2020 г.
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
Настоящий стандарт разработан Целевой группой по глобальной гармонизации (GHTF) - добровольным сообществом, состоящим из представителей регулирующих органов медицинской промышленности. Настоящий стандарт не предназначен как обязательное руководство для использования его в регулировании медицинских изделий.
Настоящий стандарт предназначен для изготовителей медицинских изделий. Предполагается, что пользователь настоящего стандарта знаком с регулирующими требованиями, связанными с системой менеджмента качества, установленными в медицинской промышленности. Настоящий стандарт может быть полезен для регулирующих органов и поставщиков, но он не предназначен для оценки соответствия регулирующим требованиям.
Существующие регулирующие требования, например, установленные в пунктах ИСО 13485 (подразделы 4.1 и 7.4), а также некоторые требования, установленные регулирующими органами США и Японии, требуют, чтобы организации управляли продукцией и услугами, получаемыми от поставщиков. Эти требования обязывают организации установить тип и степень такого управления, которые должны быть определены и документированы в системе менеджмента качества. Управление может быть определено и документировано в договорах, соглашениях и контрактах, планах по качеству или в других типах документов.
Некоторые требования, установленные регулирующими органами для медицинских изделий и связанные с системой менеджмента качества, основываются на требованиях ИСО 9001. ИСО 9001 (подраздел 4.1), содержит требования в отношении "процессов, выполнение которых передано сторонним организациям", однако само определение термина таких процессов в ИСО 9000 не установлено. ИСО 9001 (подраздел 7.4), устанавливает требования к закупкам, используя термины "закупленная продукция" и "поставщики", но не включает и не содержит ссылку на "процессы, выполнение которых передано сторонним организациям" указанных в пункте 4.1. Это приводит к различным интерпретациям относительно управления процессами, выполнение которых передано сторонним организациям, поскольку они касаются как управления закупками (ИСО 9001, подраздел 7.4) так и требований системы менеджмента качества для изготовителей медицинских изделий.
Технический Комитет ИСО (ТК 176), который разрабатывает стандарты серии ИСО 9000, выпустил руководство, разъясняющее требования подраздела 4.1 ИСО 9001, в отношении управления процессами, выполнение которых передано сторонним организациям.
В пункте 2.2 этого руководства определено:
Цель установления требования ИСО 9001 (подраздела 4.1), состоит в том, что когда организация решает передать сторонним организациям выполнение какого-либо процесса (постоянно или временно), который затрагивает соответствие продукции требованиям (см. ИСО 9001, пункт 7.2.1), то организация не может просто игнорировать этот процесс, а также не вправе исключать его из своей системы менеджмента качества.
Организация должна демонстрировать, что осуществляет достаточное управление, которое обеспечивает, что этот процесс выполнен согласно применимым требованиям ИСО 9001, а также любым другим требованиям системы менеджмента качества организации. Характер этого управления будет зависеть от важности переданного сторонним организациям процесса, привнесенного риска, а также способности и компетентности поставщика выполнить требования процесса.
Процессы, переданные сторонним организациям, взаимодействует с другими процессами системы менеджмента качества организации (эти другие процессы могут быть выполнены организацией самостоятельно, или могут сами являться процессами, переданными сторонним организациям). Такие взаимодействия также должны быть подвергнуты соответствующему управлению (см. 4.1[а] и [b]) ИСО 9001.
_______________
ISO/TC 176/SC 2/N630R2 "ИСО 9001. Введение и поддержка. Руководство по процессам, переданным на аутсорсинг".
Поэтому, когда изготовитель медицинского изделия решает использовать услуги поставщиков, он должен обеспечить управление любой получаемой от них продукции или услуги, которое должно быть определено в системе менеджмента качества (СМК). Управление может осуществляться и далее, если поставщик использует субподрядчиков.
Далее по тексту настоящего стандарта термин "процессы, выполнение которых передано сторонним организациям" не применяют.
1 Область применения
Настоящий стандарт предназначен для изготовителей медицинских изделий при управлении продукцией и услугами, получаемыми от поставщиков.
Для целей настоящего стандарта, продукцией или услугами являются те, которые изготовитель закупает или получает иным способом. Кроме того, поставщиком является любое лицо, которое не включено в систему менеджмента качества изготовителя. Это относится и к поставщику, который может быть частью организации изготовителя, но осуществляет свою деятельность в рамках отдельной системы менеджмента качества. Например, если поставщик не является объектом внутреннего аудита изготовителя, то считается, что этот поставщик находится под управлением отдельной системы менеджмента качества и должен рассматриваться как внутренний поставщик.
Организации, которые имеют корпоративную политику в области качества и соответствующие процедуры, не обязательно размещают все подразделения или группы под управление единой системы менеджмента качества. Исходя из этого, одни подразделения или группы могут являться внутренними поставщиками по отношению к другим подразделениям или группам в рамках одной и той же корпорации или компании.
Внутренние поставщики должны управляться тем же способом, что и внешние поставщики.
Изготовители должны определять и документировать тип и степень управления, применяемого к поставщикам, а также поддерживать объективные свидетельства, что продукция и услуги соответствуют установленным спецификациям. Эти документы и записи являются объектом оценивания на предмет соответствия регулирующим требованиям и поэтому, должны находиться по адресу местонахождения изготовителя или быть доступными по первому требованию. Отказ в доступе или отсутствие таких объективных свидетельств управления, связанного с действиями поставщика, может привести к регистрации значительного несоответствия.
_______________
GHTF/SG4/N28 "Руководство по аудиту систем менеджмента качества изготовителей медицинских изделий на соответствие регулирующим требованиям. Часть 1. Общие требования".
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 поставщик (supplier): Организация (3.3.1) или лицо, предоставляющие продукцию (3.4.2).
[ИСО 9000, пункт 3.3.6]
Примеры - Изготовитель, дистрибьютор, предприятие розничной торговли или продавец продукции, исполнитель услуги, поставщик информации.
Примечания
1 Поставщик может быть внутренним или внешним по отношению к организации.
2 В контрактной ситуации поставщика иногда называют "подрядчиком".
2.2 продукция (product): Результат процесса (3.4.1).
[ИСО 9000, пункт 3.4.2]
Примечания
1 Имеются четыре общие категории продукции:
- услуги (например, перевозки);
- программные средства (например, компьютерная программа, словарь);
- технические средства (например, узел двигателя);
- перерабатываемые материалы (например, смазка).
Многие виды продукции содержат элементы, относящиеся к различным общим категориям продукции. Отнесение продукции к услугам, программным средствам, техническим средствам или перерабатываемым материалам зависит от преобладающего элемента.
Например, поставляемая продукция "автомобиль" состоит из технических средств (например, шин), перерабатываемых материалов (горючее, охлаждающая жидкость), программных средств (программное управление двигателем, инструкция для водителя) и услуги (разъяснения по эксплуатации, даваемые продавцом).
2 Услуга является результатом по меньшей мере одного действия, обязательно осуществленного при взаимодействии поставщика (3.3.6) и потребителя (3.3.5), она, как правило, нематериальна. Предоставление услуги может включать, к примеру, следующее:
- деятельность, осуществленную на поставленной потребителем материальной продукции (например, автомобиль, нуждающийся в ремонте);
- деятельность, осуществленную на поставленной потребителем нематериальной продукции (например, заявление о доходах, необходимое для определения размера налога);
- предоставление нематериальной продукции (например, информации в смысле передачи знаний);
- создание благоприятных условий для потребителей (например, в гостиницах и ресторанах).
Программное средство содержит информацию и обычно является нематериальным, может также быть в форме подходов, операций или процедур (3.4.5).
Техническое средство, как правило, является материальным и его количество выражается исчисляемой характеристикой (3.5.1). Перерабатываемые материалы обычно являются материальными и их количество выражается непрерывной характеристикой. Технические средства и перерабатываемые материалы часто называются товарами.
3 Обеспечение качества (3.2.11) направлено главным образом на предполагаемую продукцию.
2.3 процесс (process): Совокупность взаимосвязанных и взаимодействующих видов деятельности, преобразующая входы в выходы.
[ИСО 9000, пункт 3.4.1]
Примечания
1 Входами к процессу обычно являются выходы других процессов.
2 Процессы в организации (3.3.1), как правило, планируются и осуществляются в управляемых условиях с целью добавления ценности.
3 Процесс, в котором подтверждение соответствия (3.6.1) конечной продукции (3.4.2) затруднено или экономически нецелесообразно, часто относят к "специальному процессу".
2.4 объективное свидетельство (objective evidence): Данные, подтверждающие наличие или правдивость чего-либо.
[ИСО 9000, пункт 3.8.1]
Примечание - Объективное свидетельство может быть получено путем наблюдения, измерения, испытания (3.8.3) или другими способами.
2.5 изготовитель (manufacturer): "Изготовитель" означает любое физическое или юридическое лицо, ответственное за проектирование и/или производство медицинского изделия с целью выпустить в обращение медицинское изделие под его собственным именем, независимо от того, спроектировано и/или произведено ли это медицинское изделие организацией или по ее поручению другим лицом (лицами).
[GHTF SG1(PD)N055 R6, подраздел 4.1]
Примечания
1 Указанное физическое или юридическое лицо несет полную ответственность за обеспечение соблюдения всех применимых регулирующих требований для медицинских изделий в странах или регионах, где эти изделия планируется поставлять или продавать.
2 Ответственность изготовителя распространяется на все стадии жизненного цикла медицинского изделия, а также за обеспечение соответствия регулирующим требованиям, включая отчетность о происшествиях и уведомления о корректирующих действиях.
3 Проектирование и/или производство может включать:
а) разработку спецификации, производство, изготовление, монтаж, обработку, упаковку, переупаковку, маркировку, перемаркировку, стерилизацию, установку или полную переработку; и/или
б) сборку, упаковку, переработку и/или маркировку одной или большего числа единиц готовой продукции.
4 Любое лицо, которое собирает или адаптирует в соответствии с инструкцией по применению ранее поставленное другим лицом для конкретного пациента медицинское изделие, не является изготовителем, при условии, что сборка или адаптация не меняет предусмотренного назначения изделия.
5 Любое лицо, которое не действует от имени изготовителя и которое изменяет предусмотренное назначение изделия или изменяет само готовое медицинское изделие таким образом, что может повлиять на безопасность или результативность изделия, а также делает изделие доступным для использования под своим собственным именем, должно считаться изготовителем этого измененного медицинского изделия.
6 Аналогичные правила распространяются также на принадлежности, при условии, что они подчиняются регулирующим требованиям для медицинских изделий. Лицо, ответственное за разработку и/или производство такой принадлежности считается изготовителем.
3 Основные принципы
В существующих системах регулирования термин "изготовитель" может иметь различные определения. Тем не менее, каждый регулирующий орган, в итоге, определяет единственного "изготовителя" медицинского изделия или лицо, которое несет ответственность за выполнение регулирующих требований системы менеджмента качества. Этот "изготовитель" или лицо, которое несет окончательную ответственность за систему менеджмента качества, не может переложить (по договору или иным способом) собственную обязанность и ответственность в отношении любых функций в рамках системы менеджмента качества. Это означает, что ответственность за выполнение требований системы менеджмента качества никогда не может быть передана какому-либо поставщику продукции и услуг.
Некоторые поставщики могут быть подвергнуты некоторой форме надзора проводимого или регулирующим органом власти или третьей стороной, действующей от имени регулирующего органа (например, лица, осуществляющие стерилизацию по договору, лаборатории, осуществляющие испытания по договору, изготовители фармацевтической продукции, другие изготовители медицинских изделий и т.д.). Проведение такого надзора не освобождает изготовителя от ответственности за установление управления и предоставление свидетельств в отношении продукции и услуг, получаемых от поставщиков.
Регулирующие органы и третья сторона будут проводить инспекции или аудит изготовителя, с целью удостоверения того, что у изготовителя имеются или доступны по первому требованию объективные свидетельства управления продукцией и услугами, получаемыми от поставщиков. Отказ предоставить любое свидетельство или обеспечить доступ к любому объективному свидетельству управления, связанного с продукцией и услугами, получаемыми от поставщиков, могут закончиться выводом проверяющей стороны о том, что система менеджмента качества изготовителя, является несоответствующей.
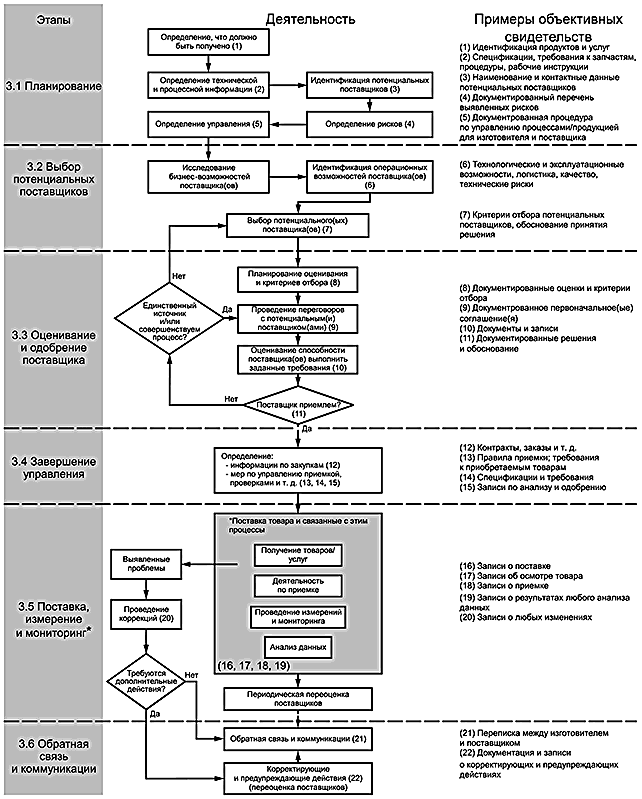
Процесс установления управления в отношении продукции и услуг, полученных от поставщиков, как правило, включает шесть стадий, которые состоят:
- из планирования;
- выбора потенциальных поставщиков;
- установления критериев выбора и оценивания поставщика;
- завершения управления;
- поставки, измерения и мониторинга;
- обратной связи и коммуникаций, включая процессы корректирующих и предупреждающих действий.
Приведенная на рисунке 1 схема иллюстрирует ключевые действия (деятельность), которые осуществляет изготовитель. Также, приведены примеры объективных свидетельств, которые могли бы быть сформированы для демонстрации управления со стороны изготовителя. Некоторые из этих действий могут быть выполнены параллельно друг с другом. Указанный перечень ключевых действий не должен рассматриваться как всеобъемлющий и закрытый. Кроме того, некоторые из этих действий могут осуществляться в пределах других процессов СМК. Например, планирование управления поставщиком может быть частью планирования в области качества. Примеры объективных свидетельств, приведенных на схеме, могут являться объектом аудита на соответствие регулирующим требованиям только в отношении безопасности и результативности медицинского изделия.
После рассмотрения других юридических и законодательных ограничений и обязательств, изготовитель может закончить договор с поставщиком в любое время в течение процесса.
|
* В этом блоке приведены действия, которые могут идентифицировать проблемы, связанные с поставкой товаров/услуг, а также проблемы, связанные непосредственно с поставщиками, и соблюдения договоренностей с поставщиками.
Примечание - Деятельность, приведенная на этом рисунке носит рекомендательный характер и не предполагает строгой последовательности. В некоторых случаях некоторая деятельность может выполняться параллельно.
Рисунок 1
3.1 Планирование
В течение планирования и выполнения производства и поставки продукции в отношении нового или уже существующего медицинского изделия изготовитель, как правило, идентифицирует ту продукцию или услуги, которые будут получены от поставщиков. Существующая СМК изготовителя, может потребовать в отношении некоторой продукции или услуг, получаемых от поставщиков (например, обучение, архивирование документов и т.д.), обязательного планирования и управления.
При установлении управления в отношении продукции и услуг, получаемых от поставщиков, предполагается, что планирование этой деятельности инициирует сам процесс. Результатом этой деятельности могут быть планы проектирования и разработки, планы по качеству, планы закупок и т.д., как это определено в СМК изготовителя. Изготовитель должен рассмотреть цели, риски, требования, процессы и ресурсы для демонстрации того, что управление установлено и результативно, а регулирующие требования выполнены.
Планирование дает общее руководство по установлению степени управления в отношении продукции и услуг, получаемых от поставщиков. Такие планы, как правило, являются частью СМК и подлежат документированию и одобрению.
3.1.1 Продукция и услуги, получаемые от поставщика(ов)
Результат планирования обеспечивает идентификацию продукции и услуг, которые могут быть получены от поставщиков. Такая продукция и услуги могут включать компоненты, сырье, услуги по метрологическому обеспечению, услуги по очистке или стерилизации, услуги уполномоченного представителя и т.д.
Они могут классифицироваться иначе, согласно региональным или национальным регулирующим требованиям, например:
- готовые:
- электронные компоненты (резисторы, конденсаторы, блоки питания и т.д.),
- механические компоненты (винты, шайбы, шланги, трубки и т.д.),
- коммерческое программное обеспечение (операционные системы, базы данных и т.д.),
- компьютерные аппаратные средства (ноутбуки, регистраторы и т.д.);
- части и компоненты, изготовленные по спецификациям изготовителя:
- механические (клапаны, насосы и т.д.),
- электрические (различные датчики, ЭКГ-электроды и т.д.),
- программное обеспечение специального назначения (для управления подачей энергии при различной терапии и т.д.),
- однократного применения (тест-полоски для глюкометра, реактивы, ферменты и т.д.);
- услуги, получаемые от поставщиков:
- стерилизация,
- проектирование,
- производство (сборка, печать, упаковка, маркировка и т.д.),
- архивация документов,
- транспортирование и хранение,
- мониторинг производственной среды (например, микробных тел и механических частиц в чистых помещениях),
- калибровка,
- консультирование;
- готовые медицинские изделия:
- любое готовое медицинское изделие (например, которое имеет соответствующую маркировку);
- поставляемое медицинское изделие, используемое изготовителем как компонент в его медицинском изделии (рентгеновские трубки, ЭКГ-электроды, медицинские батареи, мониторы пациента).
Объективные свидетельства могут включать:
- идентификацию продукции и услуг, которые будут получены. Это может быть общим описанием или уже конкретной спецификацией.
3.1.2 Информация по процессам и техническая информация
Соответствующий персонал, который будет вовлечен в разработку необходимой информации по процессам и технической информации, нуждается в информации и данных, являющихся существенными для идентификации и оценивания риска, который привносит закупаемая продукция или услуга (см. 3.1.4), а также потенциальные поставщики.
Объективные свидетельства могут включать:
- требования к продукции и услугам для частей, материалов, процессов, программного обеспечения, окружающей среды, испытаний и т.д.;
- требования к процессам СМК, например, процедуры или рабочие инструкции для отчетов о неблагоприятных событиях, аудиты СМК, сбор данных на стадии жизненного цикла, "после выпуска в обращение", проектирование, производство, калибровка, ремонт, деятельность по верификации и т.д.
3.1.3 Идентификация потенциальных поставщиков(а)
Изготовитель может принять решение идентифицировать одного или более потенциальных поставщиков в зависимости от выявленной им потребности. Поставщики могут быть как внутренними, так и внешними.
Объективные свидетельства могут включать:
- наименование потенциального поставщика(ов) и контактную информацию.
3.1.4 Идентификация риска(ов)
Как часть процесса планирования, изготовитель должен идентифицировать риски, связанные с продукцией или услугами, которые будут получены.
В процессе идентификации рисков желательно рассмотреть некоторые существенные обстоятельства, например:
- действительно ли эта комплектующая часть отсутствует в наличии и ее необходимо закупать?
- какую роль играет эта комплектующая в производстве?
- какова критичность этой комплектующей части? (Если был проведен FMEA проекта, то результаты такого анализа в отношении тяжести последствий отказа уже имеются в распоряжении изготовителя);
- в настоящее время поставщик производит комплектующие для какого-либо медицинского изделия, подпадающего под регулирующие требования к этой промышленности, или это его первая поставка?
Информация о потенциальных поставщиках (например, техническая, финансовая, в отношении непрерывности поставки и т.д.) должна использоваться с целью определения дополнительных возможных привнесенных рисков (например, деловых рисков).
Рассмотрение деловых рисков может включать, например:
- финансовую устойчивость поставщика;
- непрерывность поставки;
- надежность, ответственность;
- объем работ, заказанный поставщику по отношению к его максимальной загрузке;
- финансовые инвестиции;
- монопольное положение (единственный поставщик);
- легальный статус (например, наличие лицензии).
Объективные свидетельства могут включать:
- зарегистрированный и документированный перечень идентифицированных рисков (хотя такой перечень не является регулирующим требованием).
3.1.5 Идентификация мер управления
Для установления типа и степени управления, идентифицированные риски должны быть оценены. Это управление должно быть определено, задокументировано и включать в себя любые требования в отношении качества. Изготовителю, в некоторых случаях, может потребоваться обеспечить дальнейшее управление, за пределами поставщика первого уровня, из-за потенциальных дефектов и проблем, допущенных поставщиками второго или третьего уровня.
Изготовителю следует обеспечить, чтобы при разработке мер управления были приняты во внимание и другие уместные регулирующие требования, например законодательство по защите окружающей среды, профессионального здоровья, персональных данных, требования GMP и т.д.
Такое управление может включать:
- аудит поставщика;
- управление поставщиком второго уровня (или последующими в цепи поставки);
- испытание/верификацию;
- сертификаты соответствия;
- формальные требования для СМК, например, сертификаты и аттестаты (СМК, экологического менеджмента, аккредитованных лабораторий, аккредитации третьей стороной);
- различные инструменты измерения (например, ключевые показатели эффективности);
- инструментарий анализа системы (например, воспроизводимость и повторяемость);
- деятельность по обеспечению экологической совместимости, электромагнитной совместимости, надежности/прогнозов надежности;
- возможности процесса и улучшение процесса;
- валидацию процесса;
- время реагирования;
- статистическое управление производственным процессом;
- деятельность по исправлению, переделке;
- управление запасами ("первая партия на приход - первая в расход" (FIFO), временной предел);
- управление размером партии, объемом партии;
- управление прослеживаемостью (процесса, продукции, оборудования, оператора);
- управление изменениями (изменение процесса, процедуры и т.д.);
- менеджмент конфигурации;
- защита интеллектуальной собственности;
- защита персональных данных пациента;
- сроки хранения документов;
- записи СМК.
Объективные свидетельства могут включать:
- перечень потенциальных мер управления в зависимости от идентифицированного риска.
3.2 Выбор потенциальных поставщиков
При выборе потенциальных поставщиков изготовитель должен проанализировать их деловые качества, способность действовать оперативно, включая технологические возможности и другие аспекты, демонстрирующие, что поставщик может обеспечить необходимое качество, безопасность, результативность и надежность продукции и услуг.
3.2.1 Практические возможности поставщика
Деловые качества и практические возможности потенциальных поставщиков, их опыт, репутация и финансовые возможности могут являться полезной информацией для оценки и выбора конкретного поставщика. Практические возможности и физические способности потенциальных поставщиков могут оказывать существенный эффект на способность изготовителя поставлять безопасные и результативные изделия. Финансовые возможности потенциального поставщика особенно важны, если изготовитель намеревается вступить в долгосрочное сотрудничество.
Результат такого анализа, вместе с анализом присущих данной продукции или данной услуги рисков, может повлиять на решение изготовителя относительно степени управления продукцией и услугами, получаемыми от поставщиков.
3.2.2 Технические возможности и оперативность поставщика
Должна быть проанализирована оперативность поставщика с целью определения того, что он способен выполнить условия, выдвинутые изготовителем (например, время согласования, поставка точно в срок, время ответа и т.д.). Область проводимого анализа может включать выполнение поставщиком предыдущих заказов, его опыт и наличие человеческих ресурсов.
Анализ технологических возможностей поставщика должен включать оценку его способности выполнить требования изготовителя к продукции и/или услуге. В такой анализ следует включать адекватность производственных процессов и используемого оборудования, информационные технологии, существующую инфраструктуру, инжиниринговые возможности и т.д.
Объективные свидетельства могут включать:
- оценку изготовителем ресурсов поставщика (например, службы обеспечения, персонал, инфраструктура), текущий объем заказов;
- документацию и записи поставщика (например, записи в отношении управления производственной средой, обслуживания программного обеспечения оборудования, записи о поверке/калибровке, записи о квалификации соответствующего персонала, отчеты по валидации процессов, планы по выпуску продукции, различные удостоверения и т.д.).
3.2.3 Выбор потенциального поставщика
Изготовитель должен выбрать потенциальных поставщиков в соответствии с предварительно установленными критериями и результатами анализа возможностей.
Объективные свидетельства могут включать:
- документацию потенциальных поставщиков;
- критерии выбора и объяснение решений.
3.3 Оценивание и одобрение поставщика
В настоящем подразделе приведено руководство для процесса оценивания изготовителем выбранного потенциального поставщика (см. 3.2), который способен поставлять продукцию или предоставлять услугу в соответствии с требованиями изготовителя.
Степень и глубина предпринимаемой деятельности по оцениванию и одобрению должна быть пропорциональна идентифицированному риску (см. 3.1.4), связанному с закупаемой продукцией и/или услугой и их влиянием на безопасность, результативность или функциональные характеристики конечного продукта.
Все процессы, имеющие отношение к данному пункту, можно изложить в следующей последовательности:
- планирование оценивания и разработка критериев отбора;
- связь с потенциальным поставщиком и детализация требований;
- оценивание способности потенциального поставщика выполнять критерии отбора;
- одобрение поставщика.
3.3.1 Планирование оценивания и разработка критериев отбора
Изготовитель должен осуществлять планирование оценивания и определять критерии отбора потенциальных поставщиков, с целью уменьшения количества поставщиков до количества, подлежащего одобрению.
Оценивание компетентности поставщика и его способности выполнять требования изготовителя должно базироваться на определенном наборе критериев отбора, которые основаны:
- на продукции и/или услугах, которые будут закуплены;
- их предусмотренном назначении;
- на влиянии закупаемой продукции и/или услуги на последующие этапы производства продукции или на готовое изделие.
В процессе оценивания, в зависимости от риска и возможного влияния продукции или услуги на качество изделия, изготовитель должен рассмотреть сочетание некоторых существенных факторов, которые могут включать:
- используемые технологии;
- складские запасы;
- соответствие продукции и/или услуги требованиям изготовителя;
- историю взаимодействия с конкретным поставщиком;
- наличие сертификатов (например, на соответствие ИСО 13485, ИСО 9001).
Сертификация может играть роль в оценке поставщиков, но изготовителям не следует полагаться исключительно на сертификат как свидетельство того, что поставщики способны обеспечить высокое качество продукции или услуги.
3.3.2 Связь с потенциальными поставщиками
Для проведения должного оценивания потенциального поставщика следует установить с ним обмен некоторой информацией или данными.
Изготовитель несет ответственность за доведение до сведения поставщика установленных критериев. Кроме того, изготовитель вправе запросить у потенциального поставщика некоторые данные и/или определенную продукцию (например, единичное изделие, единичную партию, опытный образец) для доказательства его способности выполнять установленные требования.
Должна собираться, обрабатываться и сохраняться любая уместная информация, которая может повлиять на разработку первоначального соглашения с поставщиком.
3.3.3 Оценивание способности потенциального поставщика выполнять критерии отбора
Оценивание изготовителем выбранного потенциального поставщика должно быть основано на свидетельствах, демонстрирующих его способность удовлетворять установленным критериям отбора.
Такие свидетельства, учитывая пропорциональность со степенью риска (см. 3.1.4), могут включать, но не ограничиваться оценкой единичного изделия, единичной партии или опытного образца, аудита поставщика, сведений от других организаций или любой их комбинации. Если применимо, должны использоваться обоснованные статистические методы.
3.3.4 Одобрение поставщика
Если потенциальный поставщик выбран для одобрения, то изготовитель должен документировать решение об одобрении, например включением поставщика в зарегистрированный список одобренных поставщиков. Записи результатов оценивания должны быть сохранены.
Если потенциальный поставщик не удовлетворяет одному или нескольким из установленных критериев, то следует рассмотреть возможность:
- разработки плана относительно переоценивания поставщика; или
- проведения оценивания следующего поставщика из перечня потенциальных поставщиков; или
- осуществить выбор нового поставщика.
Например, от потенциального поставщика электронных плат требуется обеспечение определенного уровня чистоты (минимизации реактивных остатков), для того чтобы избежать проблем надежности и производительности, связанных с процессом пайки. Для этого поставщик подвергает печатные платы процессу стандартной водной промывки и контролирует ионное загрязнение моющего раствора в качестве косвенного показателя чистоты. После получения и испытания первой партии плат выясняется, что некоторые платы не прошли определенные тесты. Изготовитель отслеживает остаточную реакцию на платах. Изготовитель и поставщик совместно исследуют эту проблему и определяют, что ионное загрязнение моющего раствора находится в пределах спецификации. Оба приходят к заключению, что косвенное определение чистоты плат недостаточно, и поставщик соглашается выполнять испытания в тех областях, которые особенно чувствительны и могут привести к проблемам производительности, вызванных реактивными остатками. Платы, которые не прошли тест, будут подвергнуты дополнительному процессу очистки. Первоначально, несоответствующие платы, которые были подвергнуты этому процессу, должны пройти дальнейшее тестирование. Эти действия должны привести к выполнению дополнительного процесса тестирования и очистки, а поставщик может быть признан одобренным.
Если единственный поставщик не удовлетворяет одному или более из установленных критериев, то изготовитель не имеет возможности выбора того или иного потенциального поставщика. В этом случае должен быть обеспечен дополнительный обмен информацией с целью определения способности единственного поставщика выполнять установленные требования. Если единственный исходный поставщик не готов или не способен должным образом подготовиться к выполнению требований, то изготовитель должен установить дополнительное управление в рамках своей СМК. Если дополнительное управление установить невозможно, то изготовителю вероятней всего будет необходимо вернуться к процессам проектирования и разработки.
Записи результатов оценивания, а также любых действий являющихся результатом оценивания, должны быть поддержаны в рабочем состоянии (ИСО 13485, пункт 7.4.1).
Объективные свидетельства на стадии оценивания и одобрения могут включать:
- документирование оценивания и критериев выбора поставщика;
- документирование первоначального соглашения;
- документы и записи;
- документирование решений и обоснований.
3.4 Завершение управления
Этот пункт является руководством по доработке элементов управления, взаимно согласованных между изготовителем и поставщиком. Установление масштабов и степени управления, а также четких границ ответственности, должно быть определено изготовителем.
В результате оценивания и одобрения поставщика, все элементы управления должны быть завершены, как это установлено ранее в процессе планирования (см. 3.1.5).
В некоторых случаях, в зависимости от риска, привнесенного продукцией и/или услугой, может появиться необходимость в элементах управления для поставщиков второго или последующего уровня. Например, изготовитель закупает стерильный продукт в качестве компонента для своего также стерильного комплекта. Поставщик стерильного продукта использует контрактный стерилизатор. В этом случае, изготовитель может потребовать проведения аудиторских проверок, или изучить записи по валидации процесса, которые ведет стерилизующая организация, являющаяся поставщиком второго уровня. Изготовитель должен убедиться, что повторная стерилизация поставляемого стерильного продукта не будет иметь никакого негативного влияния на безопасность и результативность медицинского изделия. Необходимо уделить особое внимание поставляемому изделию и его свойствам для обеспечения того, что оба (возможно, различные) процесса стерилизации не будут негативно влиять на безопасность и результативность всего медицинского изделия или на соответствие любым установленным требованиям. Изготовитель готового изделия отвечает за весь комплект со всеми его компонентами и должен обеспечить, чтобы подобная утвержденная им информация была легкодоступна для демонстрации пригодности всех процессов стерилизации.
Изготовитель и поставщик должны договориться о рамках своей индивидуальной ответственности. В то время как изготовитель несет ответственность за все медицинское изделие, поставщик также имеет определенные обязательства, например, такие как обмен информацией. Ни при каких обстоятельствах изготовитель не может передать поставщику ответственность за свое медицинское изделие.
Регулирующие требования обязывают изготовителя валидировать процессы, результаты которых не могут быть проверены последующим мониторингом или измерениями. Независимо от того, кто на самом деле выполняет валидацию процессов, именно изготовители несут полную ответственность за правильное ее проведение. Изготовитель должен иметь возможность продемонстрировать, что все связанные документы и записи были рассмотрены и одобрены.
Изготовитель и поставщик должны согласовать процесс оценки любых изменений валидированного процесса, с целью определения необходимости повторной валидации и документирования. Эти требования должны быть установлены в соглашении между изготовителем и поставщиком.
Некоторые типичные области, которые нужно рассмотреть до заключения соглашения между изготовителем и его поставщиком:
- деятельность по приемке и действия по верификации;
- обработка жалоб;
- анализ первопричины;
- корректирующие и предупреждающие действия;
- менеджмент риска;
- проектирование;
- требования к маркировке и прослеживаемости;
- техническая документация (в отношении поставки);
- обработка несоответствий;
- требования к управлению изменениями;
- создание и сохранение документов и записей;
- аудит поставщиков;
- отзыв продукции;
- периодическое оценивание или переоценивание (продукция поставщика, услуги и/или данные).
Управление, ответственность и обязанности, как правило, документируются в контрактных соглашениях, заявках, обязательствах (соглашениях о взаимодействии) и т.д. Независимо от наименования, подобные разделы таких соглашений являются неотъемлемыми.
В случае использования внутренних поставщиков, подобных договорных соглашений или заявок может и не быть. Тем не менее, должен быть установлен некоторый тип формального соглашения (соглашений о взаимодействии). Стандартизованный процесс разработки таких соглашений может принести пользу изготовителю, особенно в целях обеспечения соответствия всем регулирующим и законодательным требованиям.
На основании данных, свидетельствующих о проведении должного оценивания поставщика, установленных средств управления, распределения ответственности и способов обмена информацией, изготовитель должен определить подлежащие исполнению действия по одобрению. Сочетание управления закупками и деятельности по приемке должно быть непосредственно связано с привносимым риском продукции и/или услуги.
Объективные свидетельства могут включать:
- контракты, заказы на закупку, соглашения по обмену информацией и т.д.;
- процедуры приемки или одобрения, требования к закупкам;
- спецификации и требования;
- записи по анализу, приемке или одобрению.
3.5 Поставка, измерение и мониторинг
На данной стадии управления, одобренный поставщик будет способен поставлять изготовителю продукцию или услуги в соответствии с заключенным соглашением. В рамках процессов производства продукции изготовитель должен установить в отношении продукции поставщика входной контроль с целью проверки выполнения поставщиком установленных требований. Как правило, такие мероприятия включают:
- получение продукции или услуги;
- выполнение деятельности по приемке (например, визуальный контроль или испытания, анализ сертификатов соответствия и/или протоколов исследований);
- проведение измерения и мониторинга;
- анализ данных с использованием подходящих статистических методов.
В результате проведения таких мероприятий могут быть обнаружены проблемы с поставляемой поставщиком продукцией и/или услугой, а также проблемы, связанные с соблюдением поставщиком условий заключенного соглашения.
Если обнаруженная проблема находится в рамках производственных или связанных с ними процессов (см. рисунок 1), то изготовитель должен инициировать коррекцию, а также, если применимо, корректирующее и/или предупреждающее действие.
В зависимости от риска привнесенного закупаемой продукцией и/или услугой, изготовитель может планировать и осуществлять периодическое переоценивание поставщика, независимо от того, были ли обнаружены проблемы. Цель такого переоценивания состоит в том, чтобы время от времени подтверждать способность поставщика выполнять согласованные требования.
Объективные свидетельства могут включать:
- получение, визуальный контроль, записи о приемке;
- записи результатов любых действий, связанных с коррекциями.
3.6 Обратная связь и коммуникации
Изготовитель должен иметь возможность сообщить поставщику о его соответствии своим потребностям и ожиданиям. Должна быть обеспечена как положительная, так и отрицательная обратная связь.
Изготовитель должен обеспечить наличие эффективной двухсторонней связи, с целью обсуждения проблем и/или жалоб, а также решения других вопросов. Важно развивать доверие между сторонами, чтобы разрешать любые проблемы совместно и оперативно.
Если проблемы идентифицированы и устранены, то должно быть принято решение в отношении необходимости дополнительной обратной связи.
Если корректирующее или предупреждающее действие (далее - САРА) установлено применительно к поставщику, то может потребоваться дополнительная обратная связь и средства передачи информации. Как часть этой деятельности, изготовителю следует провести переоценивание возможностей поставщика в долгосрочной перспективе.
В зависимости от характера поставляемой продукции и/или услуги, часть действий САРА, которая должна быть выполнена, может быть передана изготовителем поставщику. Результаты таких объединенных действий САРА изготовителя и поставщика должны удовлетворить требования применимых стандартов и регулирующих требований.
Несмотря на то, что некоторые из действий САРА могут быть переданы поставщику, полная ответственность за эти действия лежит на изготовителе. Все решения связанные с САРА, а также проверка их результативности, являются предметом ответственности изготовителя, которая не может быть передана поставщику. Если реализация действий САРА передана поставщикам, то изготовитель должен обеспечить что:
- в СМК изготовителя установлены положения по выполнению поставщиками действий, связанных с САРА;
- будут выполнены все действия САРА, связанные с требованиями к продукции, поставляемой поставщиком. Информация и данные, полученные от этого поставщика, будут идентифицированы (например, связанные со степенью управления, необходимого в отношении поставщика);
- обязательства поставщика, связанные с действиями САРА, ясно и четко установлены в договоре или ином соглашении (например, непосредственно в самом контракте или соглашении по обеспечению качества);
- поставщик неукоснительно соблюдает свои договорные обязательства относительно действий САРА (например, своевременная реализация исправлений);
- документация и записи, связанные с действиями САРА поставщика находятся под управлением и доступны по первому требованию.
Если поставщик не способен выполнить действия САРА, как установлено в соглашении, то изготовитель должен предпринять действия, достаточные для исправления обозначенной проблемы. Такие действия могут включать обучение сотрудников поставщика, пересмотр ответственности за реализацию действий САРА, предоставление поставщику ресурсов. Если необходимые результаты не могут быть достигнуты, то следует обратиться к другому поставщику.
Изготовитель должен быть способен продемонстрировать посредством предоставления объективных свидетельств, что полный процесс САРА осуществлен и является результативным.
Объективные свидетельства могут включать в себя:
- способы связи, установленные изготовителем и/или поставщиком;
- документацию и записи процессов корректирующих и предупреждающих действий.
УДК 006.83:006.354 | ОКС 03.120.10 |
11.040.01 | |
Ключевые слова: изделия медицинские, система менеджмента качества, поставщики, продукция и услуги, получаемые от поставщиков | |
Электронный текст документа
и сверен по:
, 2020