ГОСТ Р 53139-2008
Группа Н59
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
СОКИ И СОКОВАЯ ПРОДУКЦИЯ. ИДЕНТИФИКАЦИЯ
Определение аскорбиновой кислоты ферментативным методом
Juices and juice products. Identification. Determination of ascorbic acid by enzymatic method
ОКС 67.080
ОКСТУ 9109
Дата введения 2010-01-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 ПОДГОТОВЛЕН Государственным образовательным учреждением высшего профессионального образования "Московский государственный университет пищевых производств" Министерства образования и науки Российской Федерации (ГОУ ВПО МГУПП)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 93 "Продукты переработки фруктов, овощей и грибов" и Государственным образовательным учреждением высшего профессионального образования "Московский государственный университет пищевых производств" Министерства образования и науки Российской Федерации (ГОУ ВПО МГУПП)
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 18 декабря 2008 г. N 568-ст
4 В настоящем стандарте учтены основные нормативные положения следующих международных (региональных) стандартов:
- CODEX-STAN 247-2005 "Единый стандарт на фруктовые соки и нектары" (CODEX-STAN 247-2005 "Codex general standard for fruit juices and nectars") в части требований к обеспечению качества, подлинности, необходимого состава и методов оценки показателей соков и нектаров;
- ИФУ N 5:2000 "Рекомендации к анализу витамина С" Сборник методов физико-химического анализа соков Международной федерации производителей фруктовых соков [IFU Recommendation No. 5, 2000 "Recommendations for Vitamin C Analysis", (International Federation of Fruit Juice Produces)]
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
Настоящий стандарт распространяется на соки и соковую продукцию, включая соки и соковую продукцию для детского питания, в т.ч. фруктовые и овощные соки, нектары, морсы и сокосодержащие напитки, фруктовые и овощные пюре, а также на концентрированные фруктовые и овощные соки, концентрированные морсы, концентрированные фруктовые и овощные пюре и устанавливает метод ферментативного определения массовой концентрации аскорбиновой кислоты (витамина С) в виде кислоты или ее соли. Диапазон определения массовой концентрации аскорбиновой кислоты составляет от 0,0003 до 0,2 г/дм включительно.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 245-76 Реактивы. Натрий фосфорнокислый однозамещенный 2-водный. Технические условия
ГОСТ 841-64* Реактивы. Кислота метафосфорная. Технические условия
______________
* На территории Российской Федерации действует ГОСТ 841-76, здесь и далее по тексту. - .
ГОСТ 1625-89 Формалин технический. Технические условия
ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 3652-69 Реактивы. Кислота лимонная моногидрат и безводная. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 24104-2001 Весы лабораторные. Общие технические требования
ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 26313-84 Продукты переработки плодов и овощей. Правила приемки, методы отбора проб
ГОСТ 26671-85 Продукты переработки плодов и овощей, консервы мясные и мясорастительные. Подготовка проб для лабораторных анализов
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 29227-91 (ИСО 835-2-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Обозначения и сокращения
В настоящем стандарте применены следующие сокращения и обозначения:
МТТ - бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолия,
ФМС - переносчик электронов - феназинметосульфат,
МТТ - формазан - комплекс МТТ и формазана,
АО - аскорбатоксидаза.
4 Сущность метода
Аскорбиновая кислота (витамин С) и другие редуцирующие вещества ![]() восстанавливают бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолия (МТТ) в присутствии переносчика электронов феназинметосульфата (ФМС) при рН 3,5 до комплекса МТТ-формазана. В кювете с пробой измеряют сумму редуцирующих веществ:
восстанавливают бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолия (МТТ) в присутствии переносчика электронов феназинметосульфата (ФМС) при рН 3,5 до комплекса МТТ-формазана. В кювете с пробой измеряют сумму редуцирующих веществ:
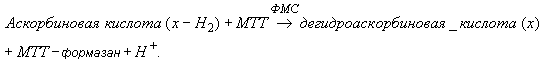
Для обеспечения специфичного определения аскорбиновой кислоты в контрольной кювете проводят окисление аналита аскорбатоксидазой (АО) в присутствии кислорода воздуха. Образующаяся дегидроаскорбиновая кислота не взаимодействует с МТТ и ФМС:
![]() .
.
Количество образовавшегося комплекса МТТ-формазан, эквивалентное количеству аскорбиновой кислоты в исходной пробе, определяют спектрофотометрическим измерением оптической плотности исследуемого раствора пробы при длине волны 578 нм.
5 Отбор проб
5.1 Отбор проб - по ГОСТ 26313, подготовка проб - по ГОСТ 26671.
6 Проведение определения
6.1 Средства измерений, вспомогательные устройства, реактивы и материалы
Гидроокись калия по ГОСТ 24363, ч.д.а., раствор молярной концентрации (KОН)=10 моль/дм
.
Поливинилполипирролидон (код пищевой добавки Е1202) с содержанием основного вещества не менее 95% по [1].
Фосфорнокислый однозамещенный 2-водный натрий, NaHPO
·2Н
О по ГОСТ 245, ч.д.а.
Лимонная кислота моногидрат, СН
О
·Н
О, по ГОСТ 3652, ч.д.а.
Аскорбиновая кислота, СН
О
по [2], [3], х.ч.
Формалин по ГОСТ 1625, раствор с объемной долей 5%.
3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолий бромид (МТТ) с содержанием основного вещества не менее 95% по [1].
Феназинметосульфат (феназин/ФМС) с содержанием основного вещества не менее 95% по [1].
Аскорбатоксидаза (сухой лиофилизат/АО), Е 1.10.3.3 с содержанием основного вещества не менее 95% по [1].
Метафосфорная кислота, (НРО)
, по ГОСТ 841, раствор массовой концентрации 15 г/дм
.
Дистиллированная вода по ГОСТ 6709.
Спектрофотометр, позволяющий проводить измерения при длине волны 578 нм, или фотометр фотоэлектрический с шириной спектральной полосы не более 10 нм и допустимой абсолютной погрешностью измерений не более ±1%, или спектрофотометр на ртутной лампе, позволяющий проводить измерения при 578 нм.
Кюветы из оптического стекла или полимерных материалов с длиной оптического пути 1 см.
Держатель для кювет.
Иономер или рН-метр с погрешностью измерения не более ±0,05 рН.
Пипетки номинальной вместимостью 0,01, 0,02, 0,1, 0,2, 0,5, 1, 2, 5 и 10 см с относительной погрешностью дозирования ±1% по ГОСТ 29227 1-го класса точности или дозаторы пипеточные с аналогичными или изменяемыми объемами доз с относительной погрешностью дозирования не более ±1% [4] или импортные с аналогичными характеристиками.
Колбы мерные по ГОСТ 1770 вместимостью 100, 250 и 1000 см.
Стаканы по ГОСТ 25336 вместимостью 20 и 200 см.
Цилиндры по ГОСТ 1770 вместимостью 50 и 100 см.
Лабораторная воронка по ГОСТ 25336 диаметром 5 см.
Часы лабораторные.
Электроплитка.
Термометр жидкостный стеклянный по ГОСТ 28498 для диапазона температур от 0 °С до 100 °С с пределом допускаемой погрешности не более ±1 °С.
Весы лабораторные по ГОСТ 24104 с пределом допускаемой абсолютной погрешности однократного взвешивания не более ±0,1 мг.
Шпатели пластиковые или палочки стеклянные оплавленные длиной от 8 до 10 см диаметром 2-3 мм для перемешивания содержимого кювет при проведении ферментативного определения.
Бумага фильтровальная лабораторная по ГОСТ 12026.
Водяной или воздушный термостат, обеспечивающий поддержание заданной температуры ферментативной реакции в диапазоне 30 °С - 40 °С и контроль температуры с погрешностью не более 0,5 °С.
Допускается применять другие средства измерений с метрологическими характеристиками, вспомогательные устройства с техническими характеристиками, а также реактивы, в том числе готовые наборы реактивов, по качеству не ниже перечисленных в настоящем разделе.
6.2 Приготовление растворов реактивов*
________________
* Допускается использование готового набора реактивов для ферментативного определения аскорбиновой кислоты производства "Roche Diagnostics/R-Biopharm AG" (номер набора 10 409 677 035) согласно схеме дозирования и смешивания реактивов, прилагаемой к набору. Указанный набор реактивов является рекомендуемым для применения. Эта информация дана для сведения пользователей настоящего стандарта и не означает, что стандарт устанавливает обязательное применение этого набора реактивов.
6.2.1 Фосфатно-цитратный буферный раствор (натрий фосфорнокислый однозамещенный молярной концентрации 0,2 моль/дм, раствор моногидрата лимонной кислоты молярной концентрации 0,1 моль/дм
, рН 3,6)
Растворяют 35,6 г натрия фосфорнокислого однозамещенного в мерной колбе вместимостью 1000 см в 500 см
дистиллированной воды, полученной непосредственно перед приготовлением раствора реактива. После полного растворения реактива объем раствора в колбе доводят до метки дистиллированной водой.
Растворяют 21,0 г лимонной кислоты моногидрата в мерной колбе вместимостью 1000 см в 500 см
свежей дистиллированной воды. После полного растворения реактива объем раствора в колбе доводят до метки дистиллированной водой.
Для приготовления фосфатно-цитратного буферного раствора с рН 3,6 смешивают 31,6 частей раствора натрия фосфорнокислого однозамещенного молярной концентрации 0,2 моль/дм и 68,4 частей раствора моногидрата лимонной кислоты молярной концентрации 0,1 моль/дм
.
Фосфатно-цитратный буферный раствор годен для применения в течение 1 мес при условии хранения при температуре 4 °С. Перед использованием необходимо контролировать рН и температуру фосфатно-цитратного буферного раствора, значения которых должны составлять соответственно 3,6 и 20 °С - 25 °С. Контроль температуры осуществляют термометром. При отклонении от требуемого значения рН фосфатно-цитратный буферный раствор готовят заново.
6.2.2 Рабочий раствор МТТ массовой концентрации 5 мг/см
Растворяют 200 мг МТТ в 40 см фосфатно-цитратного буферного раствора с рН 3,6 (см. 6.2.1). Объем рабочего раствора МТТ достаточен для проведения примерно 20 отдельных определений аскорбиновой кислоты (см. 6.4).
Рабочий раствор МТТ годен для применения в течение 1 мес при условии хранения при температуре 4 °С (без доступа света!). Перед использованием необходимо контролировать рН и температуру рабочего раствора МТТ, значения которых должны составлять соответственно 3,6 и 20 °С - 25 °С. Контроль температуры осуществляют термометром. При отклонении от требуемого значения рН рабочий раствор МТТ готовят заново.
6.2.3 Рабочий раствор ФМС массовой концентрации 0,6 мг/см
Растворяют 30 мг ФМС в 50 см дистиллированной воды, полученной непосредственно перед приготовлением раствора реактива и нагретой на электроплитке до 40 °С - 50 °С. Рабочий раствор ФМС годен для применения в течение 12 мес при условии хранения при температуре 4 °С. Незначительно красное окрашивание, которое может появиться при хранении рабочего раствора ФМС, не влияет на результаты ферментативного определения аскорбиновой кислоты.
6.2.4 Рабочий раствор АО (1700 U/см)*
________________
* Допускается использовать в определении готовые препараты аскорбатоксидазы. Аскорбатоксидаза, иммобилизованная на пластиковом шпателе на целлюлозной подложке (рабочая активностью фермента 17 U), входит в состав готового набора реактивов для определения аскорбиновой кислоты производства "Roche Diagnostics/R-Biopharm AG" (номер набора 10 409 677 035). Пример схемы ферментативного определения с использованием готового набора реактивов приведен в таблице 3. Указанный набор реактивов является рекомендуемым для применения. Эта информация дана для сведения пользователей настоящего стандарта и не означает, что стандарт устанавливает обязательное применение этого набора реактивов.
Навеску сухого лиофилизата, соответствующую активности фермента 1700 U, растворяют в 1,0 см фосфатно-цитратного буферного раствора с рН 3,6 (см. 6.2.1). Раствор готовят непосредственно перед использованием.
6.2.5 Раствор гидроокиси калия молярной концентрации (KОН)=10 моль/дм
Растворяют 14,03 г гидроокиси калия в мерной колбе вместимостью 250 см в 150 см
дистиллированной воды, полученной непосредственно перед приготовлением раствора реактива. После полного растворения реактива объем раствора в колбе доводят до метки.
6.2.6 Раствор формалина с объемной долей 5%
В химический стакан на 20 см вносят 3 см
раствора формалина с объемной долей формальдегида 35%. Добавляют 4 см
дистиллированной воды. Раствор перемешивают стеклянной палочкой и используют для подготовки пробы согласно 6.3.3.
6.2.7 Раствор метафосфорной кислоты массовой концентрации (НРО)
=15 г/дм
Растворяют 15 г метафосфорной кислоты массовой долей 33,5% в мерной колбе вместимостью 1000 см в 500 см
дистиллированной воды, полученной непосредственно перед приготовлением раствора реактива. После полного растворения реактива объем раствора в колбе доводят до метки.
6.3 Подготовка пробы
Концентрированные соки и пюре перед определением восстанавливают согласно нормативным документам свежей дистиллированной водой до содержания растворимых сухих веществ согласно нормативным документам для соответствующего вида продукции.
6.3.1 Прозрачные или мутные слабоокрашенные пробы
С помощью раствора гидроокиси калия (10 моль/дм) проводят корректировку рН пробы до значения 3,5-4,0. В зависимости от количества аскорбиновой кислоты пробу разбавляют дистиллированной водой или раствором метафосфорной кислоты (15 г/дм
) согласно таблице 1.
Таблица 1
Массовая концентрация аскорбиновой кислоты в пробе*, г/дм | Разбавление | Фактор разбавления F |
<0,20 | - | 1 |
0,20-2,0 | 1+9 | 10 |
2,0-20,0 | 1+99 | 100 |
>20 | 1+999 | 1000 |
* Для оценки количества аскорбиновой кислоты используют документы, содержащие сведения о составе соков и соковой продукции [5]. | ||
Пробу, содержащую мутную взвесь, после разбавления фильтруют через бумажный складчатый фильтр. Для определения аскорбиновой кислоты используют визуально прозрачный слабоокрашенный фильтрат в количестве 0,100 см.
6.3.2 Прозрачные или мутные сильноокрашенные пробы
С помощью раствора гидроокиси калия молярной концентрации 10 моль/дм проводят корректировку рН пробы до значения 3,5-4,0. В зависимости от количества аскорбиновой кислоты пробу разбавляют дистиллированной водой или раствором метафосфорной кислоты массовой концентрации 15 г/дм
согласно таблице 1.
Для удаления природных красящих пигментов к 10 см пробы добавляют 100 мг поливинилполипирролидона. Пробу перемешивают в течение 1 мин, затем фильтруют через бумажный складчатый фильтр.
Для определения аскорбиновой кислоты используют визуально прозрачный слабоокрашенный фильтрат в количестве 0,100 см.
6.3.3 Подготовка проб, содержащих в повышенных количествах диоксид серы
К 10 см пробы добавляют одну каплю разбавленного раствора формалина объемной долей 5%. Пробу перемешивают и выдерживают 5 мин при комнатной температуре. Значение рН пробы при необходимости корректируют раствором гидроокиси калия (10 моль/дм
) и разбавляют согласно таблице 1. Мутные пробы дополнительно фильтруют (см. 6.3.1, 6.3.2). Сильноокрашенные пробы обрабатывают поливинилполипирролидоном согласно 6.3.2.
В определении по 4.5 используют от 0,200 до 0,500 см фильтрата.
6.4 Условия определения
Длина волны при фотометрическом измерении составляет 578 нм. Для измерения используют стеклянную кювету* с толщиной оптического слоя 1 см, равной ширине грани. Ферментативное определение проводят при температуре 37 °С. Общий объем инкубационной смеси в кювете составляет 2,70 см.
________________
* Вместо кювет из оптического стекла допускается использование одноразовых кювет из полимерных материалов.
Измерение оптической плотности инкубационной смеси проводят против воздуха (без кюветы в световом пути прибора). Проба в инкубационной смеси в кювете должна содержать от 0,5 до 20 мкг аскорбиновой кислоты в 0,1-1,6 см пробы.
6.5 Ферментативное определение
Ферментативное определение аскорбиновой кислоты в пробе проводят по схеме дозирования и смешивания реактивов, приведенной в таблице 2. Если в определении используют иммобилизованную АО и готовые наборы реактивов, дозирование и смешивание реактивов проводят по схеме таблицы 3.
Таблица 2 - Схема дозирования и смешивания реактивов для ферментативного определения аскорбиновой кислоты
Дозирование в кювету | Контрольная проба | Проба |
Рабочий раствор МТТ* (см. 6.2.2) | 1,000 см | 1,000 см |
Дистиллированная вода | 1,490 см | 1,500 см |
Проба** (см. 6.3) | 0,100 см | 0,100 см |
Рабочий раствор АО (см. 6.2.4) | 0,01 см | - |
Перемешивают. Помещают контрольную кювету и кювету с пробой в термостат при температуре 37 °С. В течение 6 мин*** интенсивно перемешивают содержимое кюветы с контрольной пробой пластиковой или стеклянной палочкой с целью насыщения инкубационной смеси воздухом (необходимое условие полного окисления аскорбиновой кислоты в контрольной пробе!). После выдержки в контрольной кювете и в кювете с пробой измеряют значение оптической плотности | ||
Рабочий раствор ФМС**** (см. 6.2.3) | 0,100 см | 0,100 см |
Перемешивают. Инкубируют (в темноте!) при температуре 37 °С в течение 15 мин, после чего немедленно измеряют значение оптической плотности | ||
* Температура раствора должна составлять 37 °С. ** Перед дозированием в кювету пипетку или наконечник дозатора следует ополоснуть фильтратом пробы (см. 6.3). *** При определении аскорбиновой кислоты в пробах, содержащих повышенные количества диоксида серы, время выдержки кюветы с контрольной пробой увеличивают до 10 мин. **** После внесения рабочего раствора ФМС кюветы изолируют от доступа света. | ||
Таблица 3 - Схема дозирования и смешивания реактивов для ферментативного определения аскорбиновой кислоты при использовании иммобилизованной АО
Дозирование в кювету | Контрольная проба | Проба |
Рабочий раствор МТТ (см. 6.2.2) | 1,000 см | 1,000 см |
Дистиллированная вода | 1,500 см | 1,500 см |
Проба (см. 6.3) | 0,100 см | 0,100 см |
Иммобилизованная АО | Один шпатель | - |
Перемешивают. Помещают контрольную кювету и кювету с пробой в термостат при температуре 37 °С. В течение 6 мин интенсивно перемешивают содержимое кюветы с контрольной пробой шпателем с иммобилизованной АО с целью насыщения инкубационной смеси воздухом (необходимое условие полного окисления аскорбиновой кислоты в контрольной пробе!). После выдержки в контрольной кювете и в кювете с пробой измеряют значение оптической плотности | ||
Рабочий раствор ФМС (см. 6.2.3) | 0,100 см | 0,100 см |
Перемешивают. Инкубируют (в темноте!) при температуре 37 °С в течение 15 мин, после чего немедленно измеряют значение оптической плотности | ||
7 Обработка результатов измерений
Значение разницы между конечным и начальным значениями оптической плотности контроля и пробы рассчитывают по формуле
![]() . (1)
. (1)
Значение разницы оптических плотностей должно составлять не менее 0,100.
Искомую массовую концентрацию аскорбиновой кислоты в исходной пробе, г/дм, рассчитывают по общей формуле
![]() , (2)
, (2)
где - общий объем инкубационной смеси, см
;
- объем пробы, см
;
- молекулярный вес аскорбиновой кислоты или аскорбата (176,13 и 175,12 г/моль соответственно);
- длина оптического пути кюветы, см;
- молярный коэффициент оптической плотности формазана (при измерении и длине волны 578 нм составляет 16,9 дм
/ммоль·см).
Подставляя в формулу (2) необходимые значения для аскорбиновой кислоты, получают модифицированную формулу (3) для расчета массовой концентрации аскорбиновой кислоты (в г/дм) в пробе:
![]() . (3)
. (3)
Если перед ферментативным определением проба подвергалась разбавлению, то результат, полученный по формуле (3), умножают на коэффициент разбавления .
В случае концентрированных соков или пюре результат определения выражают в г/100 г продукта. Расчет осуществляют с учетом навески, взятой для получения восстановленного продукта (см. 6.3), по формуле
![]() ,* (4)
,* (4)
где * - массовая концентрация аскорбиновой кислоты в исследованной пробе, рассчитанная по формуле (2), г/дм
;
- навеска концентрированного сока или пюре, взятая для получения восстановленного продукта (см. 6.3), г.
_______________
* Формула и экспликация к ней соответствуют оригиналу. - .
8 Дополнительные указания
8.1 Факторы, влияющие на определение
Если общая разница оптических плотностей менее 0,100, то необходимо повторно провести определение, используя большую навеску или увеличенный объем пробы, дозируемой в инкубационную смесь (до 1,490 см
по схеме дозирования таблицы 2 или до 1,500 см
по схеме дозирования таблицы 3). В этом случае объем воды, добавляемой в кювету, должен быть уменьшен на соответствующее значение для сохранения общего объема инкубационной смеси (2,70 см
) в кювете с неизменными контролем и пробой. Увеличенный объем пробы необходимо принимать во внимание при расчете конечного результата согласно формуле (3).
8.2 Специфичность определения
Метод специфичен для определения общей аскорбиновой кислоты, включающей D- и L-изомеры.
В анализе коммерческих препаратов аскорбиновой кислоты (например, витаминов) в свежеприготовленных растворах можно ожидать, что степень повторного нахождения искомого вещества составит 94% - 100%. На качество результатов определения степени повторного нахождения влияет срок хранения коммерческого препарата аскорбиновой кислоты и растворитель, используемый для получения растворов. Рекомендуется использовать раствор метафосфорной кислоты (см. 4.1) с доведением рН пробы до 3,5-4,0.
На стабильность аскорбиновой кислоты в водных растворах сильно влияет присутствие ионов металлов, например железа и меди, а также наличие в пробе кислорода. В этом случае ожидаемая степень повторного нахождения будет составлять менее 100%, что обусловливается частичной потерей аскорбиновой кислоты.
С помощью настоящего ферментативного метода нельзя определить L-аскорбилпальмитат, так как в ходе щелочного гидролиза происходит спонтанное разрушение свободной аскорбиновой кислоты.
8.3 Причины возможных ошибок при проведении определения
Сахароза, содержащаяся в соках и соковой продукции, не мешает определению, если ее концентрация в кювете не превышает 30 мг.
Определению аскорбиновой кислоты мешает D-сорбит (при концентрации более 20 мг в кювете), который ингибирует аскорбатоксидазу, а также этанол в высоких концентрациях, превышающих 100 мг/кювета. Влияние большинства мешающих факторов на результат определения исключается путем увеличения длительности инкубации контрольной пробы с аскорбатоксидазой до 10 мин.
Диоксид серы в высоких концентрациях, превышающих 50 мкг/кювета, взаимодействует с МТТ и ФМС и вызывает тем самым медленно текущую реакцию. В этом случае пробу подвергают предварительной обработке согласно 6.3.3.
Ионы металлов в концентрациях более 100 мкг/кювета могут понизить рН системы и, тем самым, ингибировать действие аскорбатоксидазы.
Нитрит, который может содержаться в некоторых овощных соках, не мешает определению. Однако его присутствие в системе может привести к спонтанному распаду аскорбиновой кислоты.
Ионы оксалата в концентрациях от 30 мкг/кювета способны оказывать значительное ингибирующее действие на аскорбатоксидазу. Высокую концентрацию оксалата устраняют путем добавления ионов кальция до концентрации 30 мкг/кювета и выше, а также созданием в системе слабокислой среды (рН 5-6).
8.4 Выявление и устранение мешающих факторов при проведении анализа.
Контроль ферментативного определения
8.4.1 Общие указания
Если разница оптических плотностей менее 0,100, следует провести повторную подготовку пробы к определению, увеличив ее навеску или уменьшив разбавление. Значение рН пробы в любом определении должно находиться в интервале от 3,5 до 4,0.
8.4.2 Операции с контрольной пробой
Содержимое кюветы с контрольной пробой интенсивно перемешивают стеклянной или пластиковой палочкой (или шпателем с иммобилизованной АО) в течение предварительной реакции.
После внесения рабочего раствора ФМС реакция проявляет повышенную чувствительность к свету, поэтому инкубирование при температуре 37 °С необходимо проводить в полной темноте. Для чего кюветы, находящиеся, например, в держателе, помещенном в водяной или воздушный термостат, накрывают плотной светонепроницаемой тканью. Попадание света приводит к возникновению нежелательной медленно текущей реакции.
В случае медленно текущей реакции, вызванной попаданием света, значение оптической плотности системы определяют в соответствии с рекомендациями 6.4.5. Так как кюветы с пробой и контрольной пробой содержат одинаковый объем инкубационной смеси, медленно текущие реакции в них идентичны. От экстраполяции в этом случае можно отказаться. Однако необходимо принимать во внимание, что оптическую плотность
в кювете с контрольной пробой и в кювете с пробой необходимо измерять непосредственно одну за другой.
Если разница оптических плотностей ![]() контрольной пробы менее 0,020, то следует соблюдать следующие правила: рабочий раствор МТТ должен храниться в темноте; при использовании рабочего раствора МТТ его нельзя подвергать прямому облучению солнечным или электрическим светом; содержимое кюветы с контрольной пробой необходимо интенсивно перемешивать стеклянной или пластиковой палочкой (или шпателем с иммобилизованной АО) с целью насыщения инкубационной смеси воздухом; после внесения в инкубационную смесь рабочего раствора ФМС кюветы с контрольной пробой и пробой защищают от солнечного или электрического света.
контрольной пробы менее 0,020, то следует соблюдать следующие правила: рабочий раствор МТТ должен храниться в темноте; при использовании рабочего раствора МТТ его нельзя подвергать прямому облучению солнечным или электрическим светом; содержимое кюветы с контрольной пробой необходимо интенсивно перемешивать стеклянной или пластиковой палочкой (или шпателем с иммобилизованной АО) с целью насыщения инкубационной смеси воздухом; после внесения в инкубационную смесь рабочего раствора ФМС кюветы с контрольной пробой и пробой защищают от солнечного или электрического света.
8.4.3 Стабильность аскорбиновой кислоты
Водные растворы аскорбиновой кислоты нестабильны. При анализе твердых проб рекомендуется проводить выделение аскорбиновой кислоты раствором метафосфорной кислоты концентрации 15 г/дм. После экстрагирования рН вытяжки корректируют раствором гидроокиси калия (10 моль/дм
) до 3,5-4,0.
Для стабилизации аскорбиновой кислоты не рекомендуется применять растворы оксалатов, так как их ионы ингибируют аскорбатоксидазу.
Разбавление пробы дистиллированной водой или метафосфорной кислотой проводят непосредственно перед определением. В этом случае нет необходимости в проведении корректировки рН до 3,5-4,0.
8.4.4 Медленно текущие реакции
Из практики применения метода следует, что оптическая плотность инкубационной смеси может увеличиваться даже после окончания ферментативной реакции (возникает медленно текущая реакция). В этом случае расчет значения конечной оптической плотности проводят экстраполированием на момент внесения в инкубационную смесь рабочего раствора ФМС (см. 6.2.3).
Экстраполяцию проводят графическим способом или согласно следующей схеме: по истечении 15 мин после добавления в кюветы рабочего раствора ФМС (см. 6.2.3) проводят измерение оптической плотности , измерения повторяют каждые две минуты до тех пор, пока приращение
![]() не будет принимать постоянные значения. Измерения останавливают и действительное значение конечной оптической плотности инкубационной смеси на момент внесения рабочего раствора ФМС (см. приложение А) рассчитывают по формуле
не будет принимать постоянные значения. Измерения останавливают и действительное значение конечной оптической плотности инкубационной смеси на момент внесения рабочего раствора ФМС (см. приложение А) рассчитывают по формуле
![]() . (5)
. (5)
Затем по формуле (1) рассчитывают значение разницы между значениями конечной и начальной оптической плотности контроля и пробы.
8.5 Контроль ферментативного определения
Контроль определения осуществляют при необходимости проверки качества реактивов, оценки уровня квалификации персонала лаборатории, осуществляющего анализ аскорбиновой кислоты, а также для выявления и устранения случайных и систематических ошибок определения.
8.5.1 Приготовление стандартного раствора аскорбиновой кислоты
Берут навеску в 200 мг аскорбиновой кислоты и количественно переносят ее в мерную колбу вместимостью 100 см. Объем раствора в колбе доводят до метки метафосфорной кислотой (15 г/дм
), затем тщательно перемешивают. Переносят 10 см
приготовленного раствора в другую мерную колбу вместимостью 100 см
, затем доводят объем раствора до метки метафосфорной кислотой (15 г/дм
). Содержимое колбы тщательно перемешивают.
Стандартный раствор аскорбиновой кислоты стабилен в течение суток при температуре 20 °С, в течение трех дней при температуре 4 °С и в течение одной недели при минус 20 °С. В схемах дозирования и определения (таблицы 2, 3 и 4) допускается использовать в качестве внешнего стандарта только свежеприготовленный стандартный раствор аскорбиновой кислоты.
8.5.2 Применение стандартного раствора аскорбиновой кислоты в качестве внутреннего стандарта
Ферментативное определение с применением стандартного раствора аскорбиновой кислоты (см. 6.5.1) в качестве внутреннего стандарта проводят по следующей схеме дозирования (см. таблицу 4):
По формуле (1) рассчитывают разницу значений оптических плотностей для кювет "Проба + стандарт (внутренний)", "Стандарт (внешний)" и "Проба". Степень повторного нахождения (, %) для аскорбиновой кислоты, содержащейся в стандартном растворе (см. 6.5.1), рассчитывают по формуле
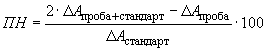 . (6)
. (6)
Ферментативное определение проведено без ошибок, если степень повторного нахождения аскорбиновой кислоты находится в интервале от 95% до 100%.
Таблица 4 - Схема дозирования и смешивания реактивов для ферментативного определения с использованием раствора аскорбиновой кислоты в качестве внешнего и внутреннего стандарта (8.5.2)
Дозируют в кювету | Контрольная проба | Проба | Стандарт (контроль) | Стандарт (внешний) | Контроль | Проба |
Рабочий раствор МТТ (см. 6.2.2) | 1,000 см | 1,000 см | 1,000 см | 1,000 см | 1,000 см | 1,000 см |
Дистиллирован- ная вода | 1,490* см | 1,490* см | 1,490* см | 1,490* см | 1,490* см | 1,490* см |
(1,500** см | (1,500** см | (1,500** см | (1,500** см | (1,500** см | (1,500** см | |
Проба (см. 6.3) | 0,100 см | 0,100 см | - | - | 0,050 см | 0,050 см |
Стандартный раствор аскорби- новой кислоты (см. 6.5.1) | - | - | 0,100 см | 0,100 см | 0,050 см | 0,050 см |
Рабочий раствор АО (см. 6.2.4) или иммобилизован- ная АО | 0,010* см | - | 0,010* см | - | 0,010* см | - |
Перемешивают. Помещают кюветы в термостат при 37 °С. В течение 6 мин интенсивно перемешивают содержимое контрольных кювет с целью насыщения инкубационной смеси воздухом (необходимое условие полного окисления аскорбиновой кислоты!). После выдержки измеряют значение начальной оптической плотности А1. Продолжают реакцию добавлением: | ||||||
Рабочий раствор ФМС (см. 6.2.3) | 0,100 см | 0,100 см | 0,100 см | 0,100 см | 0,100 см | 0,100 см |
Перемешивают. Инкубируют (в темноте!) при температуре 37 °С в течение 15 мин, после чего немедленно измеряют значение конечной оптической плотности А2. | ||||||
* При использовании рабочего раствора АО (см. 6.2.4). ** При использовании иммобилизованного препарата АО (например, шпателя с иммобилизованной АО). | ||||||
8.6 Граница чувствительности метода
Граница чувствительности метода составляет 0,30 мг/дм при
0,015 (при 578 нм) и максимальном объеме пробы
в 1,490 (или 1,600) см
.
8.7 Линейность определения
Линейность определения сохраняется в интервале от 0,5 мкг аскорбиновой кислоты в кювете (0,3 мг аскорбиновой кислоты/дм пробы; объем пробы -
1,600 см
) до 20 мкг аскорбиновой кислоты в кювете (0,2 г аскорбиновой кислоты/дм
пробы; объем пробы
0,100 см
).
9 Метрологические характеристики метода
В параллельном определении возможны различия между значениями оптических плотностей, которые будут составлять от 0,005 до 0,010. Это соответствует объему пробы 0,100 см
и концентрации аскорбиновой кислоты от 1,5 до 3 мг/дм
. При использовании в определении навески пробы в 1 г/100 см
(=10 г/дм
) ожидаемые различия между параллельными определениями составят 0,015-0,030 г/100 г. Метрологические характеристики метода приведены в приложении Б.
Приложение А
(справочное)
Информация о медленно текущих реакциях
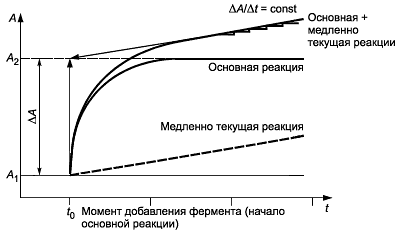
Ферментативные реакции в большинстве случаев являются реакциями нулевого порядка. Основная реакция характеризуется высокой скоростью. Для побочной - медленно текущей реакции - характерны низкие скорости. С практической точки зрения начало основной реакции связано с началом побочной реакции нулевого порядка. Характерным признаком медленно текущей реакции является постоянное количественное изменение оптической плотности с течением времени. Для получения достоверных результатов значение имеет только основная реакция. Концентрацию искомого вещества (субстрата в основной реакции) рассчитывают на основе количественной разницы между значением оптической плотности суммарной реакции (основная + медленно текущая реакции) и значением оптической плотности медленно текущей реакции.
Медленно текущая реакция начинается в отправной точке суммарной реакции (рисунок А.1). В этот момент времени в инкубационной смеси отсутствуют продукты ферментативной реакции, в том числе продукты медленно текущей реакции, которые могли бы привести к изменению оптической плотности системы. Для количественного определения общей разницы оптических плотностей значение конечной оптической плотности инкубационной смеси экстраполируют на момент начала основной реакции - внесение фермента или добавление рабочего реактива (рабочего раствора ФМС в ферментативном определении аскорбиновой кислоты). Контроль медленно текущей реакции позволяет получить только один количественный результат - значение оптической плотности в начальной точке суммарной реакции (основная + побочная реакции). Присутствие в инкубационной смеси медленно текущей реакции регистрируют с момента завершения основной реакции.
Суммарная реакция = основная + медленно текущая реакции
Рисунок А.1 - Графическое определение конечной оптической плотности инкубационной смеси, в которой присутствует медленно текущая реакция
Приложение Б
(справочное)
Метрологические характеристики метода
Метрологические характеристики метода, полученные в трех лабораториях, приведены в таблицах Б.1 и Б.2.
Таблица Б.1
Показатель | В одной серии определений | ||
Лаборатория 1 | Лаборатория 2 | Лаборатория 3 | |
Среднеарифметическое значение | 0,059 | 0,192 | 0,380 |
Среднеквадратичное отклонение повторяемости результатов определения | 0,00142 | 0,00346 | 0,00456 |
Коэффициент вариации, % | 2,4 | 1,8 | 1,2 |
Таблица Б.2
Показатель | В повторных сериях определений | ||
Лаборатория 1 | Лаборатория 2 | Лаборатория 3 | |
Среднеарифметическое значение | 0,059 | 0,192 | 0,380 |
Среднеквадратичное отклонение повторяемости результатов определения | 0,00224 | 0,00422 | 0,0076 |
Коэффициент вариации, % | 3,8 | 2,2 | 2,0 |
Библиография
[1] | База данных сети Интернет R-Biopharm AG. Food and Feed Analysis. Enzymatic BioAnalysis. - http://www.r-biopharm.com. - 2008 |
[2] ФС 42-2668-95 | Кислота аскорбиновая (витамин С) |
[3] ГФ СССР X, ст.6 | Кислота аскорбиновая (витамин С) |
[4] ТУ 64-13329-81 | Дозаторы пипеточные |
[5] | Свод правил для оценки качества фруктовых и овощных соков Ассоциации промышленности соков и нектаров из фруктов и овощей Европейского союза (издание на русском языке). - М.: Нововита. - 2004 |
Электронный текст документа
и сверен по:
, 2009