ГОСТ 32015-2012
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКТЫ ПИЩЕВЫЕ, КОРМА, ПРОДОВОЛЬСТВЕННОЕ СЫРЬЕ
Метод определения содержания анаболических стероидов и производных стильбена с помощью газовой хроматографии с масс-спектрометрическим детектором
Food products, feeds, food raw materials. Method of determination of anabolic steroids and stylben derivatives by gas chromatography using mass spectrometry
МКС 65.120
67.050
Дата введения 2014-07-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным учреждением "Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов" (ФГБУ "ВГНКИ"), Федеральным государственным учреждением "Центральная научно-методическая ветеринарная лаборатория" (ФГУ "ЦНМВЛ")
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Росстандарт)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 3 декабря 2012 г. N 54-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 27 июня 2013 г. N 240-ст межгосударственный стандарт ГОСТ 32015-2012 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2014 г.
5 Стандарт подготовлен на основе применения ГОСТ Р 54035-2010
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
ВНЕСЕНА поправка, опубликованная в ИУС N 1, 2020 год
Поправка внесена изготовителем базы данных
1 Область применения
1 Область применения
Настоящий стандарт распространяется на продукты пищевые, корма, продовольственное сырье и устанавливает метод газовой хроматографии с масс-спектрометрическим детектированием для идентификации и количественного определения анаболических стероидов и производных стильбена.
Диапазон измерений от 0,1 до 100,0 мкг/кг.
Метод может быть использован для идентификации и количественного определения анаболических стероидов и производных стильбена в физиологических жидкостях и органах животных.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.1.019-79* Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
________________
* На территории Российской Федерации документ не действует. Действует ГОСТ Р 12.1.019-2009, здесь и далее по тексту. - .
ГОСТ 12.2.085-2002 Сосуды, работающие под давлением. Клапаны предохранительные. Требования безопасности
ГОСТ 61-75 Реактивы. Кислота уксусная. Технические условия
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2603-79 Реактивы. Ацетон. Технические условия
ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
ГОСТ 4166-76 Реактивы. Натрий сернокислый. Технические условия
ГОСТ 6995-77 Реактивы. Метанол-яд. Технические условия
ГОСТ 13496.0-80* Комбикорма, сырье. Методы отбора проб
________________
* На территории Российской Федерации документ не действует. Действует ГОСТ Р ИСО 6497-2011, здесь и далее по тексту. - .
ГОСТ 13647-78 Реактивы. Пиридин. Технические условия
ГОСТ 13867-68 Продукты химические. Обозначение чистоты
ГОСТ 24104-2001* Весы лабораторные. Общие технические требования
_______________
* В Российской Федерации действует ГОСТ Р 53228-2008.
ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Сущность метода
Идентификацию и количественное определение анаболических стероидов и производных стильбена проводят методом газовой хроматографии с масс-спектрометрическим детектором (ГХ-МС) с использованием аналитических стандартов анаболических веществ с учетом критериев идентификации.
Количественное определение анаболических стероидов и производных стильбена проводят методом внутреннего стандарта по площади пика идентифицированных соединений относительно градуировочной зависимости, полученной при анализе градуировочных растворов в аналогичных условиях.
4 Средства измерений, вспомогательное оборудование, реактивы и материалы
4.1 При определении содержания анаболических стероидов и производных стильбена применяют следующие средства измерений и вспомогательное оборудование:
- хромато-масс-спектрометр, позволяющий проводить измерения в диапазоне масс от 45 до 650 атомных единиц массы (а.е.м.), с разрешением по шкале масс не более 1,0 а.е.м. и чувствительностью в режиме ионизации электронным ударом: при инжекции в колонку 2 пг гексахлорбензола (сканирование в диапазоне от 45 до 350 а.е.м. за 1 с) отношение сигнал/шум на молекулярном ионе с m/z 284 не менее 10/1;
- колонку кварцевую капиллярную 30 м0,25 мм
0,25 мкм с индексом полярности неподвижной жидкой фазы от пяти до 30;
- компьютер с установленным программным обеспечением для управления хромато-масс-спектрометром и обработки результатов измерений;
- автосамплер для газового хроматографа;
- бинарный жидкостный хроматограф со спектрофотометрическим детектором;
- ВЭЖХ (высокоэффективная жидкостная хроматография) колонка С18 250 мм4,6 мм
5 мкм;
- ВЭЖХ предколонка С18 10 мм4,6 мм
5 мкм;
- пипетки одноканальные переменного объема 10-100 мм, 40-200 мм
, 200-1000 мм
, 1-5 см
с допустимой относительной погрешностью дозирования по метанолу не более 2% (Transferpettor Brand, Германия)*;
_______________
* Указанные материалы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- весы класса точности I и класса точности II с дискретностью отсчета d=0,1 мг, поверочным делением е=10 d по ГОСТ 24104;
- модуль термостатируемый нагревательный с системой отдувки растворителей инертным газом и максимальной температурой термостатирования 250 °С;
- измельчитель-гомогенизатор лабораторный;
- испаритель ротационный со скоростью вращения от 20 до 280 об/мин и температурным диапазоном нагревательной бани от 30 °С до 100 °С;
- центрифугу лабораторную рефрижераторную со скоростью вращения ротора не менее 3500 об/с и диапазоном рабочих температур от минус 10 °С до 25 °С, с адаптерами для пробирок вместимостью 15, 50 см и микроцентрифужных пробирок вместимостью 1,5 см
;
- картриджи для твердофазной экстракции объемом не менее 12 см, заполненные обращенно-фазным сорбентом С18 с диаметром частиц не более 50 мкм;
- устройство вакуумное для твердофазной экстракции;
- флаконы стеклянные вместимостью 4 см с завинчивающимися крышками и тефлоновыми прокладками;
- флаконы стеклянные вместимостью 40 см с завинчивающимися крышками и тефлоновыми прокладками;
- флаконы стеклянные вместимостью 2 см с завинчивающимися тефлоновыми прокладками и вставками объемом 100 мм
;
- колбы мерные стеклянные 2-10-2 по ГОСТ 1770;
- колбы мерные стеклянные 2-100-2 по ГОСТ 1770;
- колбы мерные стеклянные 2-1000-2 по ГОСТ 1770;
- колбы круглодонные К-1-100-14/23 ТС по ГОСТ 25336;
- баню ультразвуковую с рабочей частотой не менее 20 кГц и объемом не менее 1 дм;
- рН-метр с набором электродов, с пределами абсолютной погрешности измерений ±0,01 рН.
Допускается применение других средств измерений и вспомогательного оборудования с метрологическими и техническими характеристиками не ниже указанных.
(Поправка. ИУС N 1-2020).
4.2 При выполнении измерений применяют следующие реактивы и материалы:
- гелий газообразный марки "60";
- фермент протеолитический Subtilisine A (Sigma, Германия, N Р-5380)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- уксусную кислоту по ГОСТ 61, х.ч.;
- соляную кислоту по ГОСТ 3118, х.ч.;
- натрий уксуснокислый, х.ч.;
- эфир метил-трет-бутиловый для хроматографии;
- воду деионизованную;
- N-метил-N-триметилсилил-трифторацетамид (МСТФА) (Sigma, Германия, N М-7891)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- триметилйодсилан (ТМИС) (Aldrich, Германия, N 19,552-9)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- дитиоэритритол (ДТЭ), х.ч.;
- пиридин по ГОСТ 13647;
- N,N-бис-триметилсилилтрифторацетамид (БСТФА) (Sigma, Германия, N Т-5634)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- триметилхлорсилан (ТМХС) (Sigma, Германия N Т-4252)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- пентафторпропионовый ангидрид, х.ч.;
- метоксиламин гидрохлорид ангидрид (Aldrich, Германия, N 22,690-4)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- н-Гексан, х.ч.;
- калия гидроокись по ГОСТ 24363, х.ч.;
- метанол-яд по ГОСТ 6995;
- этанол абсолютный, х.ч.;
- изооктан, х.ч.;
- кальций хлористый двухводный, х.ч.;
- ацетон по ГОСТ 2603, х.ч.;
- сорбент С18 40 мкм (Varian, США , N 12213012)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- сок пищеварительный Helix pomatia (Merck, Германия, N 1.04114)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- натрий сернокислый по ГОСТ 4166, х.ч.;
- ацетонитрил, ч.д.а;
- трис(гидроксиметил)-аминометан, х.ч.
Все реактивы должны относиться к подгруппе чистоты 2 х.ч. или 3 ч.д.а. по ГОСТ 13867.
4.3 Для определения содержания анаболических стероидов и производных стильбена применяют следующие стандартные образцы:
- диэтилстильбэстрол-d6 с содержанием основного вещества не менее 99,0% (RIKILT**, BRS 01)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
** Институт пищевой безопасности, расположенный в Нидерландах.
- диенестрол-d2 с содержанием основного вещества не менее 99,0% (RIKILT, BRS 02)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- гексестрол-d4 с содержанием основного вещества не менее 98,0% (RIKILT, BRS 03)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- нортестостерон-d3 с содержанием основного вещества не менее 98,0% (RIKILT, BRS 04)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- метилтестостерон-d3 с содержанием основного вещества не менее 98,0% О (RIKILT, BRS 05)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- 17-Эстрадиол-dЗ с содержанием основного вещества не менее 98,0% (RIKILT, BRS 54)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- 17-Тестостерон-d2 с содержанием основного вещества не менее 98,0% (RIKILT, BRS 55);
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- 17-Нортестостерон с содержанием основного вещества не менее 99,0% (RIKILT, BRS 56)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- 17-Тренболон с содержанием основного вещества не менее 99,0% (RIKILT, BRS 57)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- 17-Тренболон с содержанием основного вещества не менее 99,0% (RIKILT, BRS 58)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- 17-Тренболон-d2 с содержанием основного вещества не менее 99,0% (RIKILT, BRS 59)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- 17-Тренболон-d3 с содержанием основного вещества не менее 99,0% (RIKILT, BRS 72)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- 17-Метилтестостерон с содержанием основного вещества не менее 98,0% (Acros, 225730050)*
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- 17-Этинилэстрадиол с содержанием основного вещества не менее 98,0% (Sigma, Е-4876)*
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- -Эстрадиол с содержанием основного вещества не менее 98,0% (Sigma, Е-8875)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- 17-Тестостерон с содержанием основного вещества не менее 99,0% (Acros, 164410050)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- прогестерон с содержанием основного вещества не менее 99,0% (Sigma, Р-0130)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- 19-Нортестостерон с содержанием основного вещества не менее 99,0% (Fluka, 74640)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- диенэстрол с содержанием основного вещества не менее 98,0% (Sigma, D-3253)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- гексестрол с содержанием основного вещества не менее 99,0% (Sigma, Н-7753)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- диэтилстильбэстрол с содержанием основного вещества не менее 99,0% (Sigma, D-4628)*;
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
- стандартные образцы с аттестованным содержанием анаболических веществ*:
_______________
* Указанные реактивы и стандартные образцы являются рекомендуемыми к применению. Эта информация приведена для удобства пользователей настоящего стандарта.
1) лиофилизованная моча с аттестованным содержанием диэтилстильбэстрола (IRMM**, BCR-411);
_______________
** Институт референтных материалов и измерений, расположенный в Бельгии.
2) лиофилизованное мясо с аттестованным содержанием диэтилстильбэстрола (IRMM, BCR-411);
3) лиофилизованная печень с аттестованным содержанием 17-Тренболона (IRMM, BCR-474/475).
5 Условия выполнения измерений и требования безопасности
5.1 Используемые в работе реактивы относятся к веществам 1-го и 2-го класса опасности по ГОСТ 12.1.007, при работе с ними необходимо соблюдать требования безопасности, установленные для работ с токсичными, едкими и легковоспламеняющимися веществами по ГОСТ 12.1.005.
5.2 Помещения, в которых проводят анализ и подготовку проб, должны быть оборудованы приточно-вытяжной вентиляцией.
5.3 Операции по приготовлению и дозированию градуировочных растворов в процессе подготовки проб следует проводить под тягой в вытяжном шкафу.
5.4 При проведении испытаний следует соблюдать ГОСТ 12.2.085 и правила устройства и безопасной эксплуатации сосудов, работающих под давлением, действующие на территории государства, принявшего стандарт.
5.5 При выполнении измерений на хромато-масс-спектрометре следует соблюдать правила электробезопасности в соответствии с ГОСТ 12.1.019 и инструкцией по эксплуатации прибора.
5.6 К выполнению измерений методом газовой хроматографии допускаются лица, владеющие техникой ГХ-МС и изучившие инструкции по эксплуатации применяемой аппаратуры.
5.7 При определении анаболических стероидов и производных стильбена в лаборатории должны быть соблюдены следующие условия:
- температура окружающего воздуха | от 20 °С до 25 °С; |
- атмосферное давление | от 84 до 106 кПа; |
- напряжение в электросети | (220±20) В; |
- частота тока в электросети | от 49 до 51 Гц; |
- относительная влажность воздуха | от 40% до 80%. |
5.8 Хроматографические измерения проводят в условиях, указанных в инструкции по эксплуатации соответствующего прибора.
6 Подготовка к проведению измерений
6.1 Отбор проб
6.1.1 Отбор проб мяса и мясных продуктов, включая мясо и продукты из мяса птицы, проводят в соответствии с [1].
6.1.2 Объем отбираемых образцов мочи должен быть не менее 40 см.
Объем отбираемых образцов желчи должен быть не менее 30 см.
Отобранные образцы мочи и желчи при отсутствии возможности исследования в день отбора замораживают при температуре минус 20 °С до проведения исследования.
6.1.3 Отбор проб кормов - по ГОСТ 13496.0.
6.2 Подготовка хромато-масс-спектрометра к выполнению измерений
Подготовку хромато-масс-спектрометра к работе осуществляют в соответствии с техническим руководством по эксплуатации прибора.
6.3 Приготовление растворов
6.3.1 Приготовление трис-буфера молярной концентрации 0,1 моль/дм и рН 9,5
В мерную колбу вместимостью 1000 см вносят 12,1 г трис(гидроксиметил)-амино-метана и 7,3 г кальция хлористого двухводного, растворяют в 800 см
деионизованной воды, измеряют рН, доводят значение рН до (9,5±0,1) соляной кислотой молярной концентрации 1 моль/дм
(6.3.7) и доводят объем до метки деионизованной водой.
Срок хранения при температуре от 2 °С до 4 °С - не более 1 мес.
6.3.2 Приготовление щелочного раствора для гидролиза
В мерную колбу вместимостью 100 см вносят 5,6 г гидроокиси калия, растворяют в 80 см
метанола и доводят объем до метки метанолом.
Срок хранения при температуре от 2 °С до 4 °С - не более 1 нед.
6.3.3 Приготовление ацетатного буферного раствора молярной концентрации 0,2 моль/дм
В мерную колбу вместимостью 1000 см вносят 16,4 г натрия уксуснокислого, растворяют в 900 см
деионизованной воды, измеряют рН, доводят значение рН до (5,2±0,1) концентрированной уксусной кислотой и доводят объем до метки деионизованной водой.
Срок хранения при температуре от 2 °С до 4 °С - не более 1 мес.
6.3.4 Приготовление "кислого" буферного раствора
Для приготовления "кислого" буферного раствора смешивают 1,7 см соляной кислоты с 98,3 см
ацетатного буферного раствора (6.3.3) в мерной колбе вместимостью 100 см
.
Срок хранения при температуре от 2 °С до 4 °С - не более 1 нед.
6.3.5 Приготовление раствора для дериватизации
Для приготовления раствора МСТФА/ТМИС/ДТЭ смешивают 1000 мм МСТФА и 5 мм
ТМИС во флаконе вместимостью 2 см
, добавляют к полученному раствору 2 мг ДТЭ.
Срок хранения при температуре от 2 °С до 4 °С - не более 1 нед.
6.3.6 Приготовление 2%-ного раствора метоксиламин гидрохлорида в сухом пиридине
Для приготовления раствора 0,04 г метоксиламин гидрохлорида вносят во флакон вместимостью 4 см и приливают 2 см
пиридина.
Срок хранения при комнатной температуре в вытяжном шкафу - не более 1 нед.
6.3.7 Приготовление раствора соляной кислоты молярной концентрации 1 моль/дм
В мерную колбу вместимостью 1000 см приливают 500 см
деионизованной воды, вносят 81 см
концентрированной соляной кислоты и доводят объем до метки деионизованной водой.
Срок хранения при комнатной температуре - не более 1 мес.
6.3.8 Приготовление растворов внутреннего стандарта
В мерную колбу вместимостью 100 см вносят 1 мг стандартного образца дейтрированных производных, приливают 80 см
этанола, перемешивают и помещают раствор на 1 мин на ультразвуковую баню, затем доводят объем до метки этанолом. В мерную колбу вместимостью 10 см
пипеточным дозатором вносят 0,1 см
приготовленного раствора и доводят объем до метки этанолом.
Массовая концентрация раствора внутреннего стандарта составляет 0,1 мкг/см.
6.3.9 Приготовление стандартного раствора анаболических стероидов и производных стильбена
В мерную колбу вместимостью 100 см вносят 10 мг стандартного образца, приливают 80 см
этанола, перемешивают и помещают раствор на 1 мин на ультразвуковую баню, затем доводят объем до метки этанолом.
Массовая концентрация каждого соединения в растворе составляет 0,1 мг/см
.
Срок хранения при температуре не выше минус 18 °С - не более 12 мес.
6.3.10 Приготовление стандартного раствора анаболических стероидов и производных стильбена
В мерную колбу вместимостью 10 см пипеточным дозатором вносят 0,1 см
стандартного раствора
(6.3.9) и доводят объем до метки этанолом.
Массовая концентрация каждого соединения в растворе составляет 1000 нг/см
.
Срок хранения при температуре от 2 °С до 4 °С - не более 4 мес.
6.3.11 Приготовление стандартного раствора анаболических стероидов и производных стильбена
В мерную колбу вместимостью 10 см пипеточным дозатором вносят 1 см
стандартного раствора
(6.3.10) и доводят объем до метки этанолом.
Массовая концентрация каждого соединения в растворе составляет 100 нг/см
.
Срок хранения при температуре от 2 °С до 4 °С - не более 4 мес.
6.3.12 Приготовление стандартного раствора анаболических стероидов и производных стильбена
В мерную колбу вместимостью 10 см пипеточным дозатором вносят 1 см
стандартного раствора
(6.3.11) и доводят объем до метки этанолом.
Массовая концентрация каждого соединения в растворе составляет 10 нг/см
.
Срок хранения при температуре от 2 °С до 4 °С - не более 4 мес.
6.3.13 Приготовление стандартного раствора анаболических стероидов и производных стильбена
В мерную колбу вместимостью 10 см пипеточным дозатором вносят 5 см
стандартного раствора
(6.3.12) и доводят объем до метки этанолом.
Массовая концентрация каждого соединения в растворе составляет 5 нг/см
.
Срок хранения при температуре от 2 °С до 4 °С - не более 4 мес.
6.3.14 Приготовление градуировочных растворов анаболических стероидов и производных стильбена
Для приготовления градуировочного раствора массовой концентрации 0,1 нг/см к сухому остатку после упаривания чистой пробы исследуемого типа матриц вносят 0,02 см
стандартного раствора
(6.3.13), приливают 0,1 см
раствора каждого внутреннего стандарта (6.3.8). Затем пипеточным дозатором вносят 0,88 см
этанола, переносят на шейкер и гомогенизируют. Затем помещают на центрифугу и центрифугируют при 15000 об/мин в течение 10 мин при температуре 10 °С.
Для приготовления градуировочного раствора массовой концентрации 0,5 нг/см используют стандартный раствор
(6.3.13).
Для приготовления градуировочного раствора массовой концентрации 1 нг/см используют стандартный раствор
(6.3.12).
Для приготовления градуировочного раствора массовой концентрации 10 нг/см используют стандартный раствор
(6.3.11).
Для приготовления градуировочного раствора массовой концентрации 100 нг/см используют стандартный раствор
(6.3.10).
К сухому остатку после упаривания чистой пробы исследуемого типа матриц вносят 0,1 см соответствующего стандартного раствора, приливают 0,1 см
раствора внутреннего стандарта (6.3.8). Затем пипеточным дозатором вносят 0,8 см
этанола, переносят на шейкер и гомогенизируют. Затем помещают на центрифугу и центрифугируют при 15000 об/мин в течение 10 мин при температуре 10 °С.
Приготовленные градуировочные растворы и растворы внутренних стандартов хранят в морозильнике при температуре не выше минус 20 °С. Перед применением растворы выдерживают при комнатной температуре в темном месте не менее 30 мин.
6.4 Подготовка газового хроматографа к выполнению измерений
6.4.1 Подготовку газового хроматографа к работе осуществляют в соответствии с техническим руководством по эксплуатации прибора. Для получения градуировочных характеристик устанавливают параметры газового хроматографа в соответствии с 6.5.1.
6.4.2 Для получения градуировочных данных используют градуировочные растворы анаболических стероидов и производных стильбена и растворы их дейтерированных производных в соответствии с таблицей 1, внесенные в заведомо чистые образцы исследуемого типа матриц (градуировочные растворы анаболических стероидов, производных стильбена и их дейтерированные производные вносят в матрицу перед этапом дериватизации). В качестве внутреннего стандарта используют дейтерированные производные определяемых соединений. Для каждого анаболического стероида и производного стильбена используют соответствующее дейтерированное производное.
Таблица 1 - Массовая концентрация анаболических стероидов и производных стильбена в градуировочных растворах
Наименование анаболического стероида и производного стильбена | Градуировочный уровень | ||||
N 1 | N 2 | N 3 | N 4 | N 5 | |
Массовая концентрация, нг/см | |||||
Нативные анаболические стероиды и производные стильбена | |||||
17 | 0,1 | 0,5 | 1 | 10 | 100 |
17 | 0,1 | 0,5 | 1 | 10 | 100 |
17 | 0,1 | 0,5 | 1 | 10 | 100 |
17 | 0,1 | 0,5 | 1 | 10 | 100 |
| 0,1 | 0,5 | 1 | 10 | 100 |
| 0,1 | 0,5 | 1 | 10 | 100 |
17а-Этинилэстрадиол | 0,1 | 0,5 | 1 | 10 | 100 |
17-Метилтестостерон | 0,1 | 0,5 | 1 | 10 | 100 |
17 | 0,1 | 0,5 | 1 | 10 | 100 |
17 | 0,1 | 0,5 | 1 | 10 | 100 |
Диенэстрол | 0,1 | 0,5 | 1 | 10 | 100 |
Гексестрол | 0,1 | 0,5 | 1 | 10 | 100 |
Диэтилстильбэстрол | 0,1 | 0,5 | 1 | 10 | 100 |
Прогестерон | 0,1 | 0,5 | 1 | 10 | 100 |
Изотопно-меченые анаболические стероиды и производные стильбена/внутренний стандарт | |||||
Нортестостерон-d3 | 10 | 10 | 10 | 10 | 10 |
17 | 10 | 10 | 10 | 10 | 10 |
17 | 10 | 10 | 10 | 10 | 10 |
17 | 10 | 10 | 10 | 10 | 10 |
Метилтестостерон-d3 | 10 | 10 | 10 | 10 | 10 |
Диенэстрол-d2 | 10 | 10 | 10 | 10 | 10 |
Гексестрол-d4 | 10 | 10 | 10 | 10 | 10 |
Диэтилстильбэстрол-d6 | 10 | 10 | 10 | 10 | 10 |
6.4.3 При установлении градуировочной характеристики следует использовать не менее трех уровней массовых концентраций градуировочных растворов в диапазоне массы определяемого аналита от 1 до 100 нг. В инжектор хроматографа вводят не менее двух раз каждый градуировочный раствор.
С помощью компьютерной системы обработки данных устанавливают градуировочную зависимость для площади пика методом внутреннего стандарта для каждого аналита по формуле
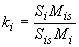 , (1)
, (1)
где - коэффициент отклика для
-го аналита;
- площадь пика
-го аналита в градуировочном растворе;
- площадь пика внутреннего стандарта в градуировочном растворе;
- массовая концентрация
-го аналита в градуировочном растворе, нг/см
;
- массовая концентрация внутреннего стандарта в градуировочном растворе, нг/см
.
Проверяют приемлемость полученных значений коэффициента отклика для каждого аналита анализируемых градуировочных уровней, используя неравенство
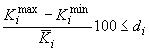 , (2)
, (2)
где 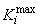 - максимальное значение
- максимальное значение -го коэффициента отклика;
- минимальное значение
-го коэффициента отклика;
- среднее значение
-го коэффициента отклика;
- относительная разность коэффициентов отклика.
Значения (при
0,95) не должны превышать: 5% (
3) или 4% (
2);
- число параллельных определений
-го коэффициента отклика для каждого градуировочного уровня.
6.4.4 При отсутствии дейтерированных производных анаболических стероидов и производных стильбена используют метод абсолютной градуировки. Образцы для градуировки готовят по 6.4.2, за исключением введения раствора дейтерированных производных.
6.4.5 Расчеты коэффициента отклика и площади пика выполняют с помощью системы обработки данных в автоматическом режиме.
6.4.6 Градуировочную характеристику считают приемлемой, если рассчитанное программным обеспечением значение квадрата коэффициента корреляции для каждого аналита 0,98, а значение "Accuracy" для каждой точки градуировочной кривой находится в диапазоне 80%-120%.
6.4.7 Построение новой градуировочной кривой проводят после каждого включения газового хроматографа (остановка работы для сервисного обслуживания или текущей профилактики).
6.5 Условия хроматографических измерений
6.5.1 Газовый хроматограф с масс-спектрометрическим детектором включают в соответствии с руководством (инструкцией) по эксплуатации и устанавливают параметры, рекомендуемые изготовителем капиллярных колонок. Например, для кварцевой капиллярной колонки 30 м0,25 мм
0,25 мкм применяют следующие хроматографические условия:
- газ-носитель - гелий;
- скорость потока газа носителя 1 см/мин;
- температура инжектора 280 °С;
- инжектор в режиме без деления потока;
- температурная программа колонки:
- начальная температура 100 °С в течение 0,5 мин;
- программируемый нагрев от 100 °С до 290 °С со скоростью 8,0 °С/мин;
- изотерма при 290 °С до 40 мин;
- время анализа 40 мин;
- объем пробы от 1 до 5 мм.
Допускается использование других хроматографических условий, обеспечивающих разделение компонентов пробы.
6.5.2 Градуировку и настройку масс-спектрометрического детектора в режиме электронной ионизации и тандемной масс-спектрометрии проводят согласно инструкции по эксплуатации прибора.
7 Порядок выполнения измерений
7.1 Обработка проб органов, тканей, мочи, желчи животных и кормов
7.1.1 100 г мышечной ткани, предварительно очищенной от грубой соединительной ткани, измельчают на гомогенизаторе и взвешивают на лабораторных весах по 5,0 г гомогенизированной пробы в двух флаконах вместимостью по 40 см. Во флаконы добавляют 15 см
трис-буфера (6.3.1), 5 мг протеолитического фермента и пипеточным дозатором вносят по 50 мм
раствора дейтерированных стандартных образцов массовой концентрации 10 нг/см
.
Флаконы закрывают крышкой с тефлоновой прокладкой и помещают на нагревательный модуль с магнитной мешалкой при температуре 55 °С на 3 ч. Затем флаконы с образцами охлаждают до комнатной температуры и приливают 2 см соляной кислоты. Гидролизат экстрагируют два раза по 15 см
метил-трет-бутиловым эфиром, собирая эфирные фракции в отдельный флакон. При неполном отделении метил-трет-бутилового эфира флаконы с образцами помещают на центрифугу и центрифугируют при 3000 об/мин в течение 3 мин. Объединенные эфирные экстракты упаривают на ротационном испарителе досуха. Сухой остаток растворяют в 4 см
метанола, затем приливают 1 см
деионизованной воды и обезжиривают два раза по 3 см
н-Гексаном. Водно-метанольную фракцию очищают методом твердофазной экстракции (ТФЭ), а затем методом ВЭЖХ.
Если интересующие компоненты представлены в виде эфиров (например, гестагены или ацетат тренболона), дополнительно проводят их щелочной гидролиз. Для этого сухой остаток растворяют в 0,2 см щелочного раствора для гидролиза (6.3.2) и помещают на нагревательный модуль при температуре 37 °С на 30 мин. Гидролиз останавливают добавлением 1 см
"кислого" буферного раствора (6.3.4) и обезжиривают два раза по 3 см
н-Гексаном.
7.1.2 Пробу печени или почек измельчают на гомогенизаторе и взвешивают на лабораторных весах по 5,0 г гомогенизированной пробы в двух флаконах вместимостью по 40 см. Во флаконы добавляют по 15 см
ацетатного буферного раствора (6.3.3) и 50 мм
пищеварительного сока Helix pomatia. Пипеточным дозатором вносят по 50 мм
раствора дейтерированных стандартных образцов массовой концентрации 10 нг/см
и ставят флаконы на нагревательный модуль при температуре 37 °С на 15 ч для ферментативного гидролиза коньюгатов стероидов. После гидролиза флаконы с образцами охлаждают до комнатной температуры, добавляют 2 см
соляной кислоты и экстрагируют два раза по 15 см
метил-трет-бутиловым эфиром. При неполном отделении метил-трет-бутилового эфира флаконы с образцами помещают на центрифугу и центрифугируют при 3000 об/мин в течение 3 мин. Объединенные эфирные экстракты переносят в круглодонную колбу и упаривают на ротационном испарителе досуха. Сухой остаток растворяют в 4 см
метанола, затем приливают 1 см
деионизованной воды и обезжиривают два раза по 3 см
н-Гексаном. Водно-метанольную фракцию очищают методом ТФЭ (7.2), а затем методом ВЭЖХ (7.3).
7.1.3 Во флакон вносят 10 см мочи, 10 см
ацетатного буферного раствора (6.3.3) и 100 мм
пищеварительного сока Helix pomatia. Пипеточным дозатором вносят 50 мм
раствора дейтерированных стандартных образцов массовой концентрации 10 нг/см
и ставят флаконы на нагревательный модуль при температуре 52 °С на 15 ч для ферментативного гидролиза коньюгатов стероидов. Энзиматический гидролизат охлаждают до комнатной температуры и очищают методом ТФЭ (7.2), а затем методом ВЭЖХ (7.3).
7.1.4 Во флакон вносят 5 см желчи, 15 см
ацетатного буферного раствора (6.3.3) и 100 мм
пищеварительного сока Helix pomatia. Далее проводят обработку пробы в соответствии с 7.1.3.
7.1.5 5 г жира взвешивают на лабораторных весах в стеклянном флаконе вместимостью 40 см. Во флакон добавляют 20 см
н-Гексана и 10 см
ацетонитрила. Пипеточным дозатором вносят 50 мм
раствора дейтерированных стандартных образцов массовой концентрации 10 нг/см
. Помещают флакон на ультразвуковую баню на 15 мин, до полного растворения жира. Затем интенсивно перемешивают, флакон с образцом помещают на центрифугу и центрифугируют при 2000 об/мин в течение 10 мин. Ацетонитрильную фракцию отбирают и повторяют жидкостно-жидкостную экстракцию 10 см
ацетонитрила. Объединенные ацетонитрильные фракции упаривают досуха на ротационном испарителе. Сухой остаток растворяют в 1 см
метанола, а затем приливают 1 см
деионизованной воды и обезжиривают два раза по 3 см
н-Гексаном. Водно-метанольную фракцию очищают методом ТФЭ (7.2), а затем методом ВЭЖХ (7.3).
7.1.6 100 г кормов измельчают на гомогенизаторе и взвешивают на лабораторных весах по 5,0 г гомогенизированной пробы в двух флаконах вместимостью по 40 см. Во флаконы добавляют 20 см
раствора метанола и деионизованной воды, взятых в соотношении 80:20, и пипеточным дозатором вносят по 50 мм
раствора дейтерированных стандартных образцов массовой концентрации 10 нг/см
. Помещают флаконы на ультразвуковую баню на 20 мин. Затем интенсивно перемешивают, флаконы с образцами помещают на центрифугу и центрифугируют при 2000 об/мин в течение 10 мин. Надосадочный слой обезжиривают два раза по 5 см
н-Гексана и упаривают на ротационном испарителе при температуре 40 °С до окончания упаривания метанола. Водный остаток очищают методом ТФЭ (7.2), а затем методом ВЭЖХ (7.3).
7.2 Очистка методом твердофазной экстракции
Картриджи для ТФЭ объемом 12 см с 1 г сорбента С18 40 мкм кондиционируют на вакуумном устройстве для ТФЭ, пропуская последовательно 10 см
метанола и 4 см
деионизованной воды. К водно-метанольному экстракту, полученному после стадий экстракции в соответствии с 7.1.1-7.1.6, приливают 15 см
деионизованной воды и пропускают через кондиционированный картридж со скоростью элюирования не более двух капель в секунду. Промывают картридж последовательно 2 см
деионизованной воды, 10 см
раствора метанола и деионизованной воды, взятых в соотношении 20:80, 5 см
раствора метанола и деионизованной воды, взятых в соотношении 40:60. Элюируют аналиты 10 см
раствора метанола и деионизованной воды, взятых в соотношении 80:20. Упаривают элюат на ротационном испарителе при температуре от 45 °С до 48 °С до 1 или 1,5 см
. Водный остаток очищают методом ВЭЖХ.
7.3 Очистка методом высокоэффективной жидкостной хроматографии
7.3.1 Систему ВЭЖХ с бинарным градиентом и спектрофотометрическим детектором подготавливают в соответствии с руководством по эксплуатации прибора. Вместо петли инжектора устанавливают предколонку С18. Разделение анаболических стероидов и производных стильбена проводят на аналитической колонке С18 (250 мм4,6 мм
5 мкм). При этом соблюдают следующие хроматографические условия:
- подвижная фаза: А - метанол 30%, Б - вода 70%;
- градиент до 100% подвижной фазы А к 10 мин, с 10 до 15 мин - 100% А, с 15 до 23 мин соотношение А/Б - 30/70;
- скорость потока подвижной фазы - 1 см/мин.
7.3.2 Порядок элюирования анаболических стероидов и производных стильбена: тренболон (7,0 мин), нортестостерон, транс-диэтилстильбэстрол, этинилэстрадиол, гексестрол, диенэстрол, эстрадиол, тестостерон, метилтестостерон, цис-диэтилстильбэстрол, прогестерон (11,5 мин). Времена удерживания уточняют после предварительного анализа стандартного раствора концентрации 1 мкг/см для каждого аналита при спектрофотометрическом детектировании 254 нм. Время отбора интересующей фракции должно быть больше на 1 мин времени удерживания последнего аналита.
7.3.3 В положении Load инжектора пропускают через предколонку 0,5 см деионизованной воды, а затем водный остаток пробы после ТФЭ очистки. Переводят инжектор в положение Inject и собирают фракцию, соответствующую временам удерживания анаболических стероидов и производных стильбена. Полученную фракцию анаболических стероидов и производных стильбена после ВЭЖХ упаривают досуха на ротационном испарителе при температуре не выше 45 °С. Сухой остаток растворяют в 1 см
абсолютного этанола и переносят во флакон вместимостью 4 см
. Упаривают этанол досуха в токе азота на нагревательном модуле при температуре 40 °С.
7.4 Дериватизация анаболических стероидов и производных стильбена
7.4.1 Для получения триметилсилиловых производных анаболических стероидов и производных стильбена к сухому остатку после ВЭЖХ очистки пипеточным дозатором приливают 50 мм раствора МСТФА/ТМИС/ДТЭ (6.3.5). Помещают флаконы в нагревательный модуль на 60 мин при температуре 60 °С. Реакционную смесь переносят в стеклянные флаконы вместимостью 2 см
с вставками на 100 мм
и используют для ГХ-МС анализа.
7.4.2 Для получения пентафторпропионовых производных анаболических стероидов и производных стильбена к сухому остатку после ВЭЖХ очистки пипеточным дозатором приливают 200 мм ацетона и 50 мм
пентафторпропионового ангидрида. Помещают флаконы в нагревательный модуль на 60 мин при температуре 60 °С. Реакционную смесь упаривают досуха в токе азота на нагревательном модуле при температуре 40 °С. Сухой остаток растворяют в 50 мм
изооктана, переносят в стеклянные флаконы вместимостью 2 см
с вставками на 100 мм
и используют для анализа.
7.4.3 Данный метод дериватизации используют для получения метилоксим/триметилсилиловых (МО/ТМС) производных тренболона и других кетостероидов. При этом к сухому остатку после ВЭЖХ очистки пипеточным дозатором приливают 100 мм 2%-ного раствора метоксиламин гидрохлорида в сухом пиридине (6.3.6). Полученную реакционную смесь помещают на нагревательный модуль при температуре 60 °С на 30 мин. По истечении указанного времени реакционную смесь упаривают досуха в токе азота. К сухому остатку добавляют 100 мм
БСТФА с 1 мм
ТМХС и помещают в нагревательный модуль при температуре 60 °С на 60 мин. Реакционную смесь упаривают досуха в токе азота на нагревательном модуле при температуре 40 °С. Сухой остаток растворяют в 50 мм
изооктана с 5% реакционной смеси БСТФА/ТМХС, переносят в стеклянные флаконы вместимостью 2 см
с вставками на 100 мм
и используют для ГХ-МС анализа.
7.5 ГХ-МС анализ
7.5.1 В инжектор хроматографа вводят от 1 до 5 мм пробы и проводят анализ в условиях, указанных в 6.5. При этом для каждого образца проводят не менее двух определений.
7.5.2 Времена удерживания анаболических стероидов и производных стильбена определяют при анализе градуировочных растворов. Времена удерживания идентифицированных анаболических стероидов и производных стильбена в анализируемой пробе не должны отличаться от времен удерживания анаболических стероидов и производных стильбена в градуировочном растворе более чем на 2,5%.
7.5.3 Данные о диагностических ионах дериватов анаболических стероидов и производных стильбена указаны в таблице 2.
Таблица 2 - Диагностические ионы дериватов анаболических стероидов и производных стильбена
Наименование анаболического стероида и производного стильбена | Триметилсилиловое производное | Метилосим/триметилсилиловое производное | Пентафторпропионовое производное |
Тестостерон | 417/432 | 268/358/374/389 | 401/417/565/580 |
Тестостерон d2 | 419/434 | 270/360/376/391 | 403/419/567/582 |
Нортестостерон | 418 | 254/285/344/375 | 256/402/566 |
Нортестостерон d3 | 421 | 257/288/347/378 | 256/405/569 |
Метилтестостерон | 301/341/356/446 | 305/319/415/430 | |
Метилтестостерон d3 | 301/344/359/449 | ||
Прогестерон | 458 | 273/286/341/372 | 375/427/445/460 |
Диэтилстильбэстрол | 217/383/397/412 | 217/383/397/412 | 291/397/531/560 |
Диэтилстильбэстрол d6 | 220/386/400/418 | 220/386/400/418 | 294/403/534/566 |
Диенэстрол | 381/395/410 | 381/395/410 | 395/530/543/558 |
Диенэстрол d2 | 382/397/412 | 382/397/412 | 397/530/545/560 |
Эстрадиол | 285/326/416 | 285/326/416 | 237/359/401/564 |
Этинилэстрадиол | 285/425/440 | 285/425/440 | 381/396/409/424 |
Тренболон | 240/266/340/371 |
8 Обработка результатов ГХ-МС анализа
8.1 В соответствии с данными, полученными при анализе градуировочных растворов, оформляют таблицу пиков с использованием программного обеспечения хромато-масс-спектрометра. Аналиты в пробе идентифицируются по временам удерживания аналитов, определенным при анализе градуировочных растворов. Метод обработки хроматограммы - внутренний стандарт. При этом используют следующую формулу:
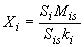 , (3)
, (3)
где - содержание
-го аналита в анализируемой пробе, мкг/кг;
- площадь пика
-го аналита в анализируемой пробе;
- площадь пика внутреннего стандарта в анализируемой пробе;
- содержание внутреннего стандарта в анализируемой пробе, мкг/кг;
- коэффициент отклика для
-го аналита.
8.1.1 Расчеты количества анаболического стероида и производного стильбена и площади пика выполняются системой обработки данных в автоматическом режиме.
8.1.2 Результаты измерений округляют до второго десятичного знака и выражают в мкг/кг.
За окончательный результат измерений содержания -го аналита принимают среднеарифметическое результатов двух параллельных определений, если выполняется условие приемлемости:
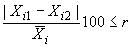 , (4)
, (4)
где и
- результаты параллельных определений содержания
-го аналита, мкг/кг;
- среднеарифметическое
и
, мкг/кг;
- предел повторяемости при
0,95; значение приведено в таблице 6, %.
8.1.3 Для целей количественного и подтверждающего анализа допускается проведение измерений в различных режимах тандемной масс-спектрометрии, позволяющих получить требуемое количество подтверждающих критериев. При количественном анализе допускается проведение измерения по одному наиболее интенсивному иону в соответствии с требованиями, установленными в 8.2. Подтверждающий анализ проводят при наличии не менее четырех диагностических критериев в соответствии с требованиями, установленными в 8.2.
8.2 Идентификацию анаболических стероидов и производных стильбена и их количественное определение проводят с соблюдением следующих условий для масс-спектрометрического детектирования:
- молекулярный ион используют для идентификации, если присутствует в масс-спектре с относительной интенсивностью не менее 10%;
- относительная ионная интенсивность каждого из диагностических ионов должна быть не менее 10%;
- соотношение сигнал/шум для каждого диагностического иона должно быть не менее 3/1.
Относительные интенсивности детектированных ионов, выраженные как процент от интенсивности самого интенсивного иона, должны соответствовать таковым из калибровочного раствора, в сопоставимых концентрациях, измеренные при тех же самых условиях, в пределах допустимых отклонений, указанных в таблице 3.
Таблица 3 - Максимально допустимые отклонения для относительных ионных интенсивностей
Относительная интенсивность (% от основного пика) | Электронная ионизация (ЭИ)-ГХ-МС (относительная), % | ГХ-МС |
Св. 50% | ±10 | ±20 |
" 20% до 50% включ. | ±15 | ±25 |
От 10% " 20% " | ±20 | ±30 |
Менее 10% | ±50 | ±50 |
При проведении подтверждающего анализа число диагностических ионов для каждого из масс-спектрометрических методов определяют с учетом идентифицирующих критериев.
Для подтверждения каждого из анаболических стероидов и производных стильбена необходимы минимум четыре идентифицирующих критерия. В таблице 4 установлено число идентифицирующих критериев в зависимости от используемых масс-спектрометрических методов.
Таблица 4 - Отношение между масс-спектрометрическими методами и количеством полученных идентифицирующих критериев
Масс-спектрометрические методы | Количество идентифицирующих критериев, полученных на диагностический ион |
Масс-спектрометрия низкого разрешения (HP) | 1,0 |
НР-МС | 1,0 |
НР-МС | 1,5 |
Масс-спектрометрия высокого разрешения (ВР) | 2,0 |
ВР-МС | 2,0 |
ВР-МС | 2,5 |
В таблице 5 показаны примеры числа идентифицирующих критериев ( - целое число), полученных для различных масс-спектрометрических методов.
Таблица 5 - Примеры расчета идентифицирующих критериев
Методы ГХ-МС анализа | Число диагностических ионов | Количество идентифицирующих критериев |
ГХ-МС [ЭИ или химическая ионизация (ХИ)] | ||
ГХ-МС (ЭИ или ХИ) 2 производных | 2 (Производное А) + 2 (Производное Б) | 4 |
ГХ-МС-МС | 1 предшественник и 2 дочерних | 4 |
ГХ-МС-МС | 2 предшественника, каждый с 1 дочерним | 5 |
9 Метрологические характеристики
Значения допускаемой относительной расширенной неопределенности , % (при коэффициенте охвата
2) измерений содержания индивидуальных анаболических стероидов и производных стильбена по установленному в настоящем стандарте методу приведены в таблице 6.
Таблица 6 - Метрологические характеристики метода
Диапазон измерений содержаний анаболических стероидов и производных стильбена, мкг/кг | Относительная расширенная неопределенность | Предел повторяемости при | |||||
От | 0,10 | до | 1,00 | включ. | 25 | 20 | |
Св. | 1,00 | " | 10,00 | " | 15 | 10 | |
" | 10,00 | 10 | 5 |
Фактические значения расширенной неопределенности , мкг/кг (при коэффициенте охвата
2) результатов, полученных при определении содержания индивидуальных бета-адреностимуляторов и признанных приемлемыми (8.1.2), рассчитывают по формуле (7).
10 Оформление результатов измерений
Результат анализа в документах, предусматривающих его использование, представляют в виде
 , (5)
, (5)
где - окончательный результат определения анаболического стероида и производного стильбена мкг/кг;
- среднеарифметическое двух параллельных измерений содержания
-го аналита в анализируемой пробе, выполненных в условиях повторяемости, мкг/кг;
- расширенная неопределенность (при коэффициенте охвата
2) определения содержания
-го аналита, определяемая по формуле (7), мкг/кг.
11 Контроль точности измерений
11.1 Контроль стабильности градуировочной характеристики проводят не реже одного раза в пять дней. Заново анализируют образцы для градуировки хроматографа по 6.4 и определяют коэффициенты отклика для каждого анаболического стероида и производного стильбена (два параллельных определения) в тех же условиях, в которых была установлена градуировочная характеристика. Градуировочную характеристику признают стабильной, если коэффициент отклика для каждого из двух параллельных определений отличается от значения, установленного при градуировке, не более чем на 10%. Если градуировочная характеристика нестабильна, градуировку хроматографа проводят заново.
11.2 Контроль смещения результатов измерений с помощью стандартных образцов проводят не реже одного раза в месяц. С использованием стандартной процедуры подготовки проб проводят анализ стандартных образцов в соответствии с разделом 7 и получают результат измерений содержания -го аналита (
, мкг/кг). Результаты измерений признают удовлетворительными при выполнении неравенства
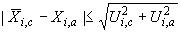 , (6)
, (6)
где - содержание
-го аналита в анализируемом стандартном образце, мкг/кг;
- аттестованное значение содержания
-го аналита в стандартном образце, мкг/кг;
- расширенная неопределенность (при коэффициенте охвата
2) результата измерений содержания
-го аналита, полученного при соблюдении требований настоящего стандарта, мкг/кг, рассчитывают по формуле
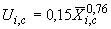 , (7)
, (7)
где - расширенная неопределенность (при коэффициенте охвата
2) аттестованного содержания
-го аналита в аттестованном стандартном образце в соответствии с паспортом (сертификатом) на конкретный стандартный образец, мкг/кг.
Библиография
[1] | ISO 17604:2003* | Microbiology of food and animal feeding stuffs - Carcass sampling for microbiological analysis (Микробиология пищевых продуктов и кормов для животных. Отбор проб с туши для микробиологического анализа) |
________________ |
Редакция документа с учетом
изменений и дополнений подготовлена
 , %
, %
