ГОСТ EN 15891-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ОПРЕДЕЛЕНИЕ ДЕЗОКСИНИВАЛЕНОЛА В ПРОДОВОЛЬСТВЕННОМ ЗЕРНЕ, ПРОДУКТАХ ЕГО ПЕРЕРАБОТКИ И ПРОДУКТАХ НА ЗЕРНОВОЙ ОСНОВЕ ДЛЯ ПИТАНИЯ ГРУДНЫХ ДЕТЕЙ И ДЕТЕЙ РАННЕГО ВОЗРАСТА
Метод ВЭЖХ с применением иммуноаффинной колоночной очистки экстракта и спектрофотометрического детектирования в ультрафиолетовой области спектра
Foodstuffs. Determination of deoxynivalenol in cereals, cereal products and cereal based foods for infants and young children. HPLC method with immunoaffinity column cleanup and UV detection
МКС 67.060
Дата введения 2015-07-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Открытым акционерным обществом "Всероссийский научно-исследовательский институт сертификации" (ОАО "ВНИИС") при участии специалистов Государственного научного учреждения Всероссийского научно-исследовательского института консервной и овощесушильной промышленности Российской академии сельскохозяйственных наук (ГНУ ВНИИКОП Россельхозакадемии) на основе собственного аутентичного перевода на русский язык европейского регионального стандарта, указанного в пункте 4
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (ТК 335)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол N 57-П от 27 июня 2013 г.)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизстан | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Узбекистан | UZ | Узстандарт |
4 Настоящий стандарт идентичен европейскому региональному стандарту EN 15891:2010* "Foodstuffs. Determination of deoxynivalenol in cereals, cereal products and cereal based foods for infants and young children. HPLC method with immunoaffinity column cleanup and UV detection" (Продукты пищевые. Определение дезоксиниваленола в продовольственном зерне, продуктах его переработки и продуктах на зерновой основе для питания грудных детей и детей раннего возраста. Метод ВЭЖХ с применением иммуноаффинной колоночной очистки экстракта и спектрофотометрического детектирования в ультрафиолетовой области спектра).
________________
* Доступ к международным и зарубежным документам, упомянутым здесь и далее по тексту, можно получить, перейдя по ссылке на сайт . - .
Перевод с английского языка (en)
Официальный экземпляр европейского регионального стандарта, на основе которого подготовлен настоящий межгосударственный стандарт, имеется в Федеральном агентстве по техническому регулированию и метрологии Российской Федерации.
Степень соответствия - идентичная (IDT)
5 Приказом Федерального агентства по техническому регулированию и метрологии от 08 ноября 2013 г. N 1517-ст межгосударственный стандарт ГОСТ EN 15891-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2015 г.
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
1 Область применения
Настоящий стандарт устанавливает метод определения дезоксиниваленола в продовольственном зерне (в том числе, в муке), пищевых продуктах на зерновой основе, а также продуктах на зерновой основе для питания грудных детей и детей раннего возраста с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с применением очистки экстракта на колонке с иммуноаффинным сорбентом и спектрофотометрического детектирования в ультрафиолетовой области спектра.
Метод прошел валидацию путем трех межлабораторных испытаний. В одном случае объектами испытаний были пробы зерна пшеницы и кукурузы, рисовой и овсяной муки, кукурузной каши (поленты) и пищевого концентрата типа сухого завтрака на пшеничной основе с содержанием дезоксиниваленола в диапазоне от 85,4 до 1768 мкг/кг. В другом случае объектами испытаний были пробы зерна пшеницы, и кукурузы с содержанием дезоксиниваленола в диапазоне от 165 до 4700 мкг/кг. В третьем случае объектами испытаний были пробы продуктов на зерновой основе для питания грудных детей и детей раннего возраста с содержанием дезоксиниваленола в диапазоне от 58 до 452 мкг/кг. Подробная информация о валидации метода приведена в разделе 9 и в приложении В.
ПРЕДУПРЕЖДЕНИЕ - Применение настоящего стандарта предусматривает использование опасных веществ, материалов, процедур и оборудования. В задачи настоящего стандарта не входит решение проблем, связанных с обеспечением безопасности при его применении. Ответственность за принятие надлежащих мер предосторожности и соблюдение правил техники безопасности лежит на пользователе настоящего стандарта.
2 Нормативные ссылки
Приведенные ниже ссылочные нормативные документы являются обязательными для применения настоящего стандарта. Датированные ссылки предполагают возможность использования только указанного издания документа. В случае недатированных ссылок используют последнее издание документа, включая все дополнения.
EN ISO 3696:1995 Water for analytical laboratory use - Specification and test methods (ISO 3696:1987) (Вода для лабораторного анализа. Технические требования и методы испытаний)
3 Сущность метода
Метод основан на экстракции дезоксиниваленола из пробы водой, последующем удалении из экстракта веществ, мешающих анализу, путем очистки на колонке с иммуноаффинным сорбентом и количественном определения дезоксиниваленола с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) со спектрофотометрическим детектированием в ультрафиолетовой области спектра.
4 Реактивы
4.1 Общие положения
Для проведения анализа при отсутствии особо оговоренных условий используют только реактивы гарантированной аналитической чистоты и воду не ниже первой степени чистоты по EN ISO 3696:1995. Используемые растворители по степени чистоты должны быть пригодны для применения в анализе с помощью ВЭЖХ. Допускается использовать доступные для приобретения готовые растворы, характеристики которых не отличаются от приведенных ниже.
4.2 Натрий фосфорнокислый двухзамещенный безводный или гидратированный ![]() .
.
4.3 Калий хлористый.
4.4 Калий фосфорнокислый однозамещенный.
4.5 Натрий хлористый.
4.6 Натрия гидроксид.
4.7 Кислота соляная, раствор массовой долей ![]() 37%.
37%.
4.8 Кислота соляная, раствор молярной концентрации ![]() 0,1 моль/дм
0,1 моль/дм
Раствор готовят разбавлением 8,28 см раствора соляной кислоты по 4.7 водой до 1 дм
.
4.9 Натрия гидроксид, раствор молярной концентрации ![]() 0,1 моль/дм
0,1 моль/дм
Раствор готовят растворением 4 г гидроксида натрия по 4.6 в 1 дм воды.
4.10 Раствор фосфатно-хлоридный буферный молярной концентрации хлористого натрия ![]() 120 ммоль/дм
120 ммоль/дм, хлористого калия
![]() 2,7 ммоль/дм
2,7 ммоль/дм, фосфатного буфера
![]() 10 ммоль/дм
10 ммоль/дм, 7,4 ед. рН
Растворяют 8,0 г хлористого натрия по 4.5, 1,2 г безводного двухзамещенного фосфорнокислого натрия [или 2,9 г гидратированного двухзамещенного фосфорнокислого натрия ![]() ] по 4.2, 0,2 г однозамещенного фосфорнокислого калия по 4.4 и 0,2 г хлористого калия по 4.3 в 900 см
] по 4.2, 0,2 г однозамещенного фосфорнокислого калия по 4.4 и 0,2 г хлористого калия по 4.3 в 900 см воды.
Значение рН приготовленного раствора доводят до 7,4 ед. рН путем добавления раствора соляной кислоты по 4.8 либо раствора гидроксида натрия по 4.9, после чего объем раствора доводят водой до 1 дм. В качестве альтернативы допускается использовать доступный для приобретения готовый раствор с аналогичными характеристиками.
4.11 Ацетонитрил.
ПРЕДУПРЕЖДЕНИЕ - Ацетонитрил является токсичным веществом, поэтому все операции по приготовлению растворов, содержащих ацетонитрил, следует проводить в вытяжном шкафу с использованием взрывобезопасного перемешивающего устройства. Фильтрование растворов, содержащих ацетонитрил, следует проводить также в вытяжном шкафу.
4.12 Полиэтиленгликоль молекулярной массой около 8000 г/моль.
4.13 Метанол.
4.14 Кислота уксусная массовой долей 96% или кислота уксусная ледяная массовой долей 100%.
4.15 Растворитель - дилюент для приготовления раствора пробы для анализа с помощью ВЭЖХ
Смешивают 9,5 объемных частей метанола по 4.13 с 90,5 объемными частями воды.
4.16 Подвижная фаза для ВЭЖХ
Смешивают 15 объемных частей метанола по 4.13 с 85 объемными частями воды. К полученной смеси добавляют 0,1 объемной части уксусной кислоты по 4.14. При необходимости проводят корректировку состава подвижной фазы (объемной доли метанола и присутствия в ней уксусной кислоты) применительно к выбранной аналитической колонке для ВЭЖХ. Перед использованием подвижную фазу дегазируют.
4.17 Подвижная фаза для кондиционирования аналитической колонки
Смешивают 50 объемных частей метанола по 4.13 с 50 объемными частями воды.
4.18 Колонка с иммуноаффинным сорбентом
Для проведения испытания пригодна колонка с иммуноаффинным сорбентом, содержащим иммобилизованные антитела, специфичные в отношении дезоксиниваленола, имеющая сорбционную емкость по дезоксиниваленолу не менее 1000 нг и обеспечивающая полноту обнаружения не менее 80% при внесении в нее 500 нг дезоксиниваленола в водном растворе объемом от 1 до 2 см.
4.19 Дезоксиниваленол массовой долей основного вещества не менее 97%.
ПРЕДУПРЕЖДЕНИЕ - Дезоксиниваленол является высокотоксичным веществом. Все работы, связанные с подготовкой пробы и приготовлением стандартных растворов, должны проводиться в вытяжном шкафу с использованием перчаток и защитных очков.
4.20 Дезоксиниваленол, основной раствор массовой концентрации 1,25 мг/см (основной раствор I)
Порцию дезоксиниваленола по 4.19 массой около 5 мг растворяют в 4,0 см ацетонитрила по 4.11. Массовая концентрация дезоксиниваленола в полученном растворе составляет около 1,25 мг/см
. В качестве альтернативы можно использовать доступный для приобретения стандартный образец состава раствора дезоксиниваленола с такими же характеристиками.
Основной раствор I хранят при температуре около минус 18 °С, при этом срок его годности составляет 12 мес. При хранении основного раствора I более 6 мес перед его использованием проверяют соответствие фактической массовой концентрации дезоксиниваленола приписанному значению.
4.21 Дезоксиниваленол, основной раствор массовой концентрации 250 мкг/см (основной раствор II)
Порцию основного раствора I по 4.20 объемом 800 мм разбавляют ацетонитрилом по 4.11 до объема 4 см
. Массовая концентрация дезоксиниваленола в полученном растворе составляет около 250 мкг/см
. Основной раствор II хранят при температуре около минус 18 °С, при этом срок его годности составляет 12 мес. При хранении основного раствора II более 6 мес перед его использованием проверяют соответствие фактической массовой концентрации дезоксиниваленола приписанному значению.
4.22 Дезоксиниваленол, стандартный раствор А
Порцию основного раствора II по 4.21 объемом 200 мм разбавляют ацетонитрилом по 4.11 до объема 2 см
. Массовая концентрация дезоксиниваленола в полученном растворе составляет около 25 мкг/см
.
Для определения точного значения массовой концентрации дезоксиниваленола в стандартном растворе регистрируют его оптическую плотность в диапазоне длин волн от 200 до 270 нм с интервалом 5 нм с использованием спектрофотометра по 5.16. В качестве раствора сравнения используют ацетонитрил. По полученному спектру определяют длину волны, соответствующую максимальной оптической плотности. Массовую концентрацию дезоксиниваленола, ![]() , мкг/см
, мкг/см, рассчитывают по формуле
![]() , (1)
, (1)
где - максимальное значение оптической плотности в данном диапазоне длин волн (в данном случае при 220 нм);
- молярная масса дезоксиниваленола, г/моль (
296,3 г/моль);
- молярный коэффициент поглощения дезоксиниваленола в ацетонитриле по 4.11, м
/моль, (в данном случае 681 м
/моль, согласно [1]);
- длина оптического пути кюветы, см.
Массовую концентрацию дезоксиниваленола в основном растворе II, ![]() , мкг/см
, мкг/см, рассчитывают по формуле
![]() . (2)
. (2)
Стандартный раствор А хранят при температуре около минус 18 °С. При указанных условиях хранения срок годности раствора составляет 12 мес. При хранении стандартного раствора А более 6 мес перед его использованием проверяют соответствие фактической массовой концентрации дезоксиниваленола ранее установленному значению.
Примечание - Допускается готовить стандартные растворы гравиметрическим методом путем определения точных масс порций дезоксиниваленола и ацетонитрила, используемого для его растворения.
4.23 Дезоксиниваленол, раствор для искусственного загрязнения проб при контроле полноты обнаружения массовой концентрации 100 мкг/см
Порцию основного раствора II по 4.21, содержащую 500 нг дезоксиниваленола, отмеряют пипеткой и помещают в мерную колбу вместимостью 5 см, объем содержимого в колбе доводят до метки ацетонитрилом по 4.11.
Раствор хранят при температуре около минус 18 °С. При указанных условиях хранения срок годности раствора составляет 12 мес. При хранении раствора более 6 мес перед его использованием проверяют соответствие фактической массовой концентрации дезоксиниваленола ранее приписанному значению.
4.24 Дезоксиниваленол, стандартный раствор В массовой концентрации 10 мкг/см
Порцию раствора для искусственного загрязнения проб по 4.23 объемом 500 мм отмеряют пипеткой и помещают в мерную колбу вместимостью 5 см
, объем содержимого в колбе доводят до метки ацетонитрилом по 4.11.
Раствор хранят при температуре около минус 18 °С. При указанных условиях хранения срок годности раствора составляет 12 мес. При хранении раствора более 6 мес перед его использованием проверяют соответствие фактической массовой концентрации дезоксиниваленола ранее приписанному значению.
5 Аппаратура
5.1 Общие положения
При проведении испытания используют общеупотребительные лабораторную посуду и оборудование, в частности, перечисленные ниже.
5.2 Весы аналитические, пригодные для взвешивания с точностью до 0,0001 г.
5.3 Весы лабораторные, пригодные для взвешивания с точностью до 0,1 г.
5.4 Блендер высокоскоростной или гомогенизатор.
5.5 Встряхиватель лабораторный или мешалка магнитная с возможностью установки скорости перемешивания около 500 мин.
5.6 Устройство перемешивающее (миксер) типа Вортекс или аналогичное.
5.7 Центрифуга лабораторная, обеспечивающая центробежное ускорение 2500 g.
5.8 Пробирки центрифужные вместимостью 250 см.
5.9 Фильтры бумажные складчатые, пригодные для качественного анализа, быстрофильтрующие, диаметром 18,5 см.
5.10 Фильтры стекловолоконные быстрофильтрующие мелкопористые, задерживающие частицы размером не более 1,6 мкм.
5.11 Пипетки вместимостью 10, 5 и 1 см и от 25 до 250 мм
.
5.12 Резервуары для элюента вместимостью, например 20 см, снабженные подходящими адаптерами для соединения с иммуноаффинными колонками.
5.13 Флаконы стеклянные или пробирки диагностические различной вместимости.
5.14 Нагреватель или баня водяная термостатируемая, пригодные для поддержания температуры греющей среды около 50 °С.
5.15 Система для ВЭЖХ в указанной ниже комплектации:
5.15.1 Инжектор, обеспечивающий объем ввода от 100 до 300 мм.
5.15.2 Насос для подачи подвижной фазы, пригодный для создания скорости подачи подвижной фазы 1 см/мин при отсутствии пульсаций.
5.15.3 Колонка для ВЭЖХ аналитическая, длиной от 15 до 25 см, внутренним диаметром 4,6 мм, заполненная обращенно-фазовым сорбентом, например, с привитыми октадецильными группами (ODS), размером диаметра частиц 5 мкм, обеспечивающая отделение пика дезоксиниваленола от сопутствующих пиков. Перекрывание пика дезоксиниваленола другими пиками должно составлять менее 10% его высоты. При необходимости для достижения приемлемой степени разделения пиков проводят корректировку состава подвижной фазы. Для предотвращения потери работоспособности аналитической колонки следует использовать защитную колонку, заполненную подходящим обращенно-фазовым сорбентом.
5.15.4 Детектор спектрофотометрический, пригодный для проведения измерений при длине 220 нм.
5.15.5 Самописец, интегратор или компьютерная система обработки данных.
5.15.6 Устройство для переключения подвижных фаз, или второй насос для ВЭЖХ.
5.16 Спектрофотометр с рабочим диапазоном длин волн в ультрафиолетовой области спектра.
6 Процедура проведения испытания
6.1 Общие положения
Метод прошел валидацию путем трех межлабораторных испытаний, проведенных в разных лабораториях в разное время. По этой причине процедуры экстракции и иммуноаффинной очистки экстракта для зерна пшеницы, кукурузы, рисовой и овсяной муки, поленты и концентратов типа сухого завтрака на пшеничной основе, описанные в 6.2 и 6.4, и для продуктов для питания грудных детей и детей раннего возраста на зерновой основе, описанные в 6.3 и 6.5, различаются. Процедура проведения испытания, описанная в настоящем разделе, аналогична процедуре, использованной при проведении межлабораторных испытаний.
6.2 Процедура экстракции при испытании зерна пшеницы, кукурузы, рисовой и овсяной муки, поленты и концентратов типа сухого завтрака на пшеничной основе
25 г пробы для анализа , взвешенной с точностью до 0,1 г, помещают в центрифужную пробирку по 5.8. В пробирку добавляют 5 г полиэтиленгликоля по 4.12 и 200 см
воды
(или другой объем воды, предписанный производителем иммуноаффинной колонки). Содержимое пробирки гомогенизируют при большой скорости в течение 3 мин с использованием гомогенизатора по 5.4.
В качестве альтернативы допускается использовать следующие способы экстракции, обеспечивающие аналогичные результаты. Пробу для анализа помещают в коническую колбу, добавляют экстрагент, после чего содержимое колбы встряхивают с использованием встряхивателя кистевого типа в течение 2 ч, либо перемешивают с помощью магнитной мешалки по 5.5 в течение 30 мин при средней скорости. В обоих случаях пробу для анализа и экстрагент предварительно тщательно перемешивают вручную.
По окончании экстракции гомогенизированную пробу центрифугируют в течение 15 мин при центробежном ускорении 2500 g. Центрифугат фильтруют через стекловолоконный фильтр по 5.10.
Примечание - В ходе межлабораторных испытаний установлено, что для некоторых матриц, в частности, кукурузы, при экстракции с использованием магнитной мешалки последующее центрифугирование не обязательно.
6.3 Процедура экстракции при испытании продуктов на зерновой основе для питания грудных детей и детей раннего возраста
25 г пробы для анализа , взвешенной с точностью до 0,1 г, помещают в коническую колбу вместимостью 250 или 500 см
. В колбу добавляют 200 см
воды
, после чего колбу укупоривают и встряхивают с использованием лабораторного встряхивателя по 5.5 в течение 1 ч. По окончании встряхивания осадку дают отстояться, после чего порцию надосадочной жидкости объемом 50 см
переносят в центрифужную пробирку по 5.8 и центрифугируют в течение 15 мин при центробежном ускорении 2500 g. Центрифугат фильтруют через воронку с фильтром по 5.9 в коническую колбу вместимостью 250 или 500 см
.
6.4 Очистка экстракта на колонке с иммуноаффинным сорбентом при испытании зерна пшеницы, кукурузы, рисовой и овсяной муки, поленты и концентратов типа сухого завтрака на пшеничной основе
Иммуноаффинную колонку подготавливают к использованию в соответствии с инструкциями производителя.
Аликвоту водного экстракта, полученного по 6.2, объемом 2,0 см
вносят в резервуар (5.12) иммуноаффинной колонки по 4.18 и полностью пропускают через колонку со скоростью около одной капли в секунду. Далее колонку промывают, пропуская через нее 5,0 см
воды или фосфатно-хлоридного буферного раствора по 4.10. Затем из колонки удаляют жидкость путем продувания через нее воздуха. Далее в резервуар колонки вносят пипеткой 2,0 см
ацетонитрила по 4.11 или метанола по 4.13, в соответствии с инструкциями производителя. Растворителю дают медленно впитаться в колонку, после чего выход элюата перекрывают. Колонку выдерживают в таком состоянии в течение 1 мин, после чего открывают выход элюата и элюируют дезоксиниваленол со скоростью около одной капли в секунду, собирая элюат во флакон вместимостью 4 см
или диагностическую пробирку по 5.13. По окончании выхода растворителя из колонки через нее аккуратно продувают воздух для обеспечения полного, вплоть до последней капли, выведения и сбора элюата.
Примечание - При проведении очистки экстракта следует обращать внимание, чтобы сорбционная емкость колонки не была превышена.
6.5 Очистка экстракта на колонке с иммуноаффинным сорбентом при испытании продуктов на зерновой основе для питания грудных детей и детей раннего возраста
Иммуноаффинную колонку подготавливают к использованию в соответствии с инструкциями производителя.
Аликвоту водного экстракта, полученного по 6.3, объемом 10,0 см
вносят в резервуар (5.12) иммуноаффинной колонки по 4.18 и дают жидкости медленно протечь через колонку со скоростью около одной капли в секунду. После полного прохождения экстракта через колонку пропускают 5,0 см
воды или фосфатно-хлоридного буферного раствора по 4.10. Затем из колонки удаляют жидкость путем продувания через нее азота в течение около 5 с. На данной стадии очистки экстракта элюент отбрасывают. Далее в резервуар колонки вносят 0,5 см
метанола по 4.13 и дают растворителю впитаться в колонку. Колонку выдерживают в течение 1 мин, не допуская вытекания из нее растворителя, после чего начинают элюирование, собирая элюат во флакон по 5.13 вместимостью от 2,0 до 2,5 см
. Затем в резервуар колонки вносят новую порцию метанола объемом 1,0 см
и продолжают элюирование. Для обеспечения полного, вплоть до последней капли, выведения и сбора элюата через колонку аккуратно продувают воздух.
Примечание - Для иммуноаффинных колонок разных производителей методы ввода экстракта, промывания колонки и элюирования аналита несколько различаются. Поэтому следует в точности соблюдать прилагаемую к колонке инструкцию по ее использованию. В общем виде процедура приготовления раствора пробы при определении дезоксиниваленола включает в себя операции получения водного экстракта, его центрифугирования и фильтрации, ввода аликвоты экстракта в предварительно промытую колонку с применением давления, промывания колонки дистиллированной водой или фосфатно-хлоридным буферным раствором и элюирования дезоксиниваленола метанолом или ацетонитрилом. Следует обращать внимание, чтобы предельно допустимый объем вводимого в колонку экстракта или сорбционная емкость колонки не были превышены.
6.6 Приготовление раствора пробы для хроматографического анализа
Флакон с элюатом помещают в нагреватель или термостатируемую водяную баню по 5.14 и выпаривают растворитель в токе азота при температуре не более 50 °С. Сухой остаток перерастворяют при комнатной температуре в 0,5 см дилюента по 4.15 или подвижной фазы по 4.16. Для обеспечения полного растворения остатка содержимое флакона тщательно перемешивают в течение не менее 30 с, например с использованием миксера типа Вортекс по 5.6.
Примечания:
1 При необходимости перед хроматографическим анализом раствор пробы фильтруют. При этом для проверки отсутствия потерь аналита при фильтрации следует провести предварительный контрольный опыт с раствором пробы с добавлением стандартного раствора дезоксиниваленола.
2 Допускается хранить сухой остаток после выпаривания элюата в течение недели при температуре (4±2) °С в отсутствии доступа света.
6.7 Приготовление контрольной пробы с добавкой дезоксиниваленола
Для определения полноты обнаружения аналита готовят контрольную пробу с добавлением раствора дезоксиниваленола по 4.23. В пробу вносят такое количество дезоксиниваленола, чтобы его массовая концентрация в растворе пробы для хроматографического анализа находилась в пределах диапазона градуировки, предпочтительно, в его середине. Раствор дезоксиниваленола добавляют к анализируемой порции пробы, заведомо не содержащей дезоксиниваленола. Приготовленную таким образом пробу для анализа выдерживают в течение 30 мин до добавления экстрагента.
7 Анализ с помощью ВЭЖХ
7.1 Условия хроматографического анализа
Приведенные ниже параметры обеспечивают удовлетворительное качество хроматографического анализа (см. рисунок А.1, приложение А) при использовании оборудования по 5.15 и колонки по 5.15.3. При необходимости для достижения отделения пика дезоксиниваленола от сопутствующих пиков проводят корректировку состава подвижной фазы (объемной доли метанола и присутствия в ней уксусной кислоты) применительно к выбранной аналитической колонки для ВЭЖХ.
Скорость протока подвижной фазы через колонку - 1,0 см/мин.
Рабочая длина волны спектрофотометрического детектора - 220 нм.
Объем инжекции анализируемых растворов - от 100 мм до 300 мм
.
При использовании устройства для переключения подвижных фаз по 5.15.6 применяют программу элюирования, приведенную в таблице 1.
Таблица 1 - Программа элюирования
Время, мин | Скорость подачи подвижной фазы, см | Объемная доля в элюенте подвижной фазы по 4.16, % | Объемная доля в элюенте подвижной фазы для кондиционирования по 4.17, % |
0-15 | 1 | 100 | 0 |
15-25 | 1 | 0 | 100 |
25-35 | 1 | 100 | 0 |
При указанных выше условиях хроматографического анализа время удерживания пика дезоксиниваленола составляет около 11 мин (см. рисунок 1).
Примечание - Приемлемой альтернативой подвижным фазам указанного состава являются смеси ацетонитрила и воды, которые допустимо использовать при условии обеспечения ими удовлетворительного разделения пиков.
7.2 Приготовление градуировочных растворов
В мерные колбы вместимостью 10 см вносят стандартный раствор В по 4.24 в объемах, указанных в таблицах 2 и 3, растворитель выпаривают, объем содержимого в колбах доводят до метки дилюентом по 4.15 или подвижной фазой по 4.16.
Таблица 2 - Приготовление градуировочных растворов при испытании зерна пшеницы, кукурузы, рисовой и овсяной муки, поленты и концентратов типа сухого завтрака на пшеничной основе
Градуировочный раствор | Объем стандартного раствора В по 4.24, взятый для приготовления градуировочного раствора, мм | Массовая концентрация дезоксиниваленола в градуировочном растворе, нг/см | Содержание дезоксиниваленола в пробе, эквивалентное его массовой концентрации в градуировочном растворе, мкг/кг |
1 | 1000 | 1000 | 2000 |
2 | 750 | 750 | 1500 |
3 | 500 | 500 | 1000 |
4 | 250 | 250 | 500 |
5 | 50 | 50 | 100 |
Таблица 3 - Приготовление градуировочных растворов при испытании продуктов на зерновой основе для питания грудных детей и детей раннего возраста
Градуировочный раствор | Объем стандартного раствора В по 4.24, взятый для приготовления градуировочного раствора, мм | Массовая концентрация дезоксиниваленола в градуировочном растворе, нг/см | Содержание дезоксиниваленола в пробе, эквивалентное его массовой концентрации в градуировочном растворе, мкг/кг |
1 | 1250 | 1250 | 500 |
2 | 1000 | 1000 | 400 |
3 | 750 | 750 | 300 |
4 | 500 | 500 | 200 |
5 | 250 | 250 | 100 |
6 | 125 | 125 | 50 |
7.3 Построение градуировочного графика
Градуировку осуществляют ежедневно перед анализом растворов проб, для чего проводят хроматографический анализ приготовленных по 7.2 градуировочных растворов подходящего диапазона массовых концентраций при объеме инжекции от 100 до 300 мм. Градуировочный график строят, откладывая в системе координат значения массовой концентрации дезоксиниваленола в нанограммах на кубический сантиметр против соответствующих значений площади или высоты его пика. Полученный график проверяют на соответствие требованиям линейности с помощью регрессионного анализа (
0,998).
7.4 Определение дезоксиниваленола в растворах проб
Проводят хроматографический анализ растворов проб по 6.6 при тех же условиях что были использованы при анализе градуировочных растворов, и объеме инжекции от 100 до 300 мм.
7.5 Идентификация пика аналита
Пик дезоксиниваленола на хроматограмме раствора анализируемой пробы идентифицируют по совпадению его времени удерживания со временем удерживания наиболее близкого ему по площади пика дезоксиниваленола на хроматограмме соответствующего градуировочного раствора. Необходимо, чтобы массовая концентрация дезоксиниваленола в растворе пробы находилась в границах диапазона градуировки. Если массовая концентрация дезоксиниваленола в растворе пробы превышает верхнюю границу диапазона градуировки, раствор пробы разбавляют в требуемой мере дилюентом для ВЭЖХ или подвижной фазой и проводят его повторный хроматографический анализ. Разбавление раствора пробы учитывают во всех последующих расчетах.
8 Обработка результатов
По градуировочному графику определяют массовую концентрацию дезоксиниваленола, нг/см, в растворе пробы по 6.6.
Содержание дезоксиниваленола в пробе, ![]() , мкг/кг, рассчитывают по формуле
, мкг/кг, рассчитывают по формуле
![]() , (3)
, (3)
где ![]() - массовая концентрация дезоксиниваленола в анализируемом растворе пробы, найденная по градуировочному графику, нг/см
- массовая концентрация дезоксиниваленола в анализируемом растворе пробы, найденная по градуировочному графику, нг/см;
- объем растворителя, использованный для экстракции по 6.2 или 6.3, см
(
200 см
);
- объем приготовленного по 6.6 раствора пробы для хроматографического анализа, см
(
0,5 см
);
- объем аликвоты экстракта, взятой для очистки на иммуноаффинной колонке, см
(
2,0 см
по 6.4 и
10,0 см
по 6.5);
- масса анализируемой пробы, г (
25 г).
Результат испытания представляют числом с тремя значащими цифрами.
9 Презиционность
9.1 Общие положения
Подробности межлабораторных испытаний по определению прецизионности метода для зерна пшеницы, кукурузы, рисовой и овсяной муки, поленты и концентратов типа сухого завтрака на пшеничной основе приведены в [2] и [3]. Подробности межлабораторных испытаний по определению прецизионности метода для продуктов на зерновой основе для питания грудных детей и детей раннего возраста приведены в [4]. Данные по прецизионности методики приведены в приложениях А и В. Значения метрологических характеристик, полученные в результате межлабораторных испытаний, могут быть не применимы к другим содержаниям аналита и другим типам матриц, чем те, что указаны в данных приложениях.
9.2 Повторяемость
Абсолютное расхождение между результатами двух независимых единичных испытаний, полученными одним методом на идентичном объекте испытаний в одной лаборатории одним оператором с использованием одного оборудования в течение короткого промежутка времени, не должно превышать предел повторяемости более чем в 5% случаев.
При проведении экстракции дезоксиниваленола по 6.2 и очистки экстракта по 6.4 предел повторяемости равен следующим значениям:
для овсяной муки: при 1768 мкг/кг
153,8 мкг/кг (проба, загрязненная естественным путем);
для рисовой муки: при 458 мкг/кг,
83,6 мкг/кг (искусственно загрязненная проба);
при 85 мкг/кг,
33,7 мкг/кг (искусственно загрязненная проба);
для пшеничной муки: при 678 мкг/кг*,
113,7 мкг/кг (искусственно загрязненная проба);
________________
* Обозначение соответствует оригиналу. - .
для поленты: при 123 мкг/кг,
22,1 мкг/кг (искусственно загрязненная проба);
для концентрата типа сухого завтрака: при 217 мкг/кг,
80,6 мкг/кг (искусственно загрязненная проба);
для зерна пшеницы: при 165 мкг/кг,
95 мкг/кг (проба, загрязненная естественным путем);
при 1466 мкг/кг,
197,1 мкг/кг (проба, загрязненная естественным путем);
при 4612 мкг/кг,
579,2 мкг/кг (проба, загрязненная естественным путем);
для зерна кукурузы: при 501 мкг/кг,
145,6 мкг/кг (проба, загрязненная естественным путем);
при 2763 мкг/кг,
274,5 мкг/кг (проба, загрязненная естественным путем);
при 4712 мкг/кг,
480,8 мкг/кг (проба, загрязненная естественным путем).
При проведении экстракции дезоксиниваленола по 6.3 и очистки экстракта по 6.5 предел повторяемости для продуктов на зерновой основе для питания грудных детей и детей раннего возраста равен следующим значениям:
при 115 мкг/кг
24,2 мкг/кг (искусственно загрязненная проба);
при 212 мкг/кг
83,0 мкг/кг (искусственно загрязненная проба);
при 58 мкг/кг
22,8 мкг/кг (проба, загрязненная естественным путем);
при 115 мкг/кг
20,5 мкг/кг (проба, загрязненная естественным путем);
при 452 мкг/кг
103,0 мкг/кг (проба, загрязненная естественным путем).
9.3 Воспроизводимость
Абсолютное расхождение между результатами двух единичных испытаний, полученными одним методом на идентичном объекте испытаний в разных лабораториях разными операторами с использованием разного оборудования не должно превышать предел воспроизводимости более чем в 5% случаев.
При проведении экстракции дезоксиниваленола по 6.2 и очистки экстракта по 6.4 предел воспроизводимости равен следующим значениям.
для овсяной муки: при 1768 мкг/кг
685,3 мкг/кг (проба, загрязненная естественным путем);
для рисовой муки: при 458 мкг/кг,
146,9 мкг/кг (искусственно загрязненная проба);
при 85 мкг/кг,
35,5 мкг/кг (искусственно загрязненная проба);
для пшеничной муки: при 678 мкг/кг,
309,3 мкг/кг (искусственно загрязненная проба);
для поленты: при 123 мкг/кг,
79,6 мкг/кг (искусственно загрязненная проба);
для концентрата типа сухого завтрака: при 217 мкг/кг,
160 мкг/кг (искусственно загрязненная проба);
для зерна пшеницы: при 165 мкг/кг,
177,4 мкг/кг (проба, загрязненная естественным путем);
при 1466 мкг/кг,
844,7 мкг/кг (проба, загрязненная естественным путем);
при 4612 мкг/кг,
3681,3 мкг/кг (проба, загрязненная естественным путем);
для зерна кукурузы: при 501 мкг/кг,
315,8 мкг/кг (проба, загрязненная естественным путем);
при 2763 мкг/кг,
1834,6 мкг/кг (проба, загрязненная естественным путем);
при 4712 мкг/кг,
2700,9 мкг/кг (проба, загрязненная естественным путем).
При проведении экстракции дезоксиниваленола по 6.3 и очистки экстракта по 6.5 предел воспроизводимости для продуктов на зерновой основе для питания грудных детей и детей раннего возраста равен следующим значениям:
при 115 мкг/кг
40,9 мкг/кг (искусственно загрязненная проба);
при 212 мкг/кг
119,0 мкг/кг (искусственно загрязненная проба);
при 58 мкг/кг
24,7 мкг/кг (проба, загрязненная естественным путем);
при 115 мкг/кг
30,2 мкг/кг (проба, загрязненная естественным путем);
при 452 мкг/кг
133,9 мкг/кг (проба, загрязненная естественным путем).
10 Протокол испытаний
Протокол испытаний должен содержать как минимум следующие сведения:
a) всю информацию, необходимую для идентификации пробы;
b) ссылку на настоящий стандарт;
c) дату и время отбора пробы (если известны);
d) дату поступления пробы в лабораторию;
e) дату проведения испытания;
f) результаты испытания с указанием единиц измерения;
g) все особенности, наблюдавшиеся при проведении испытания;
h) все операции, не оговоренные в методе или рассматриваемые как необязательные, которые могли повлиять на результат испытания.
Приложение А (справочное). Пример типичной хроматограммы
Приложение А
(справочное)
Рисунок А.1 - Пример типичной хроматограммы пробы пшеничной муки, загрязненной дезоксиниваленолом естественным путем. Содержание дезоксиниваленола около 900 мкг/кг
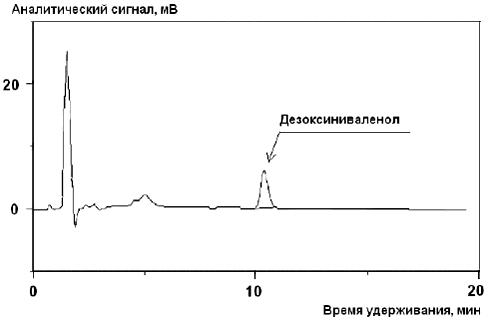
Рисунок А.1 - Пример типичной хроматограммы пробы пшеничной муки, загрязненной дезоксиниваленолом естественным путем. Содержание дезоксиниваленола около 900 мкг/кг
Приложение В (справочное). Данные по прецизионности метода
Приложение В
(справочное)
Приведенные в таблице В.1 данные для овсяной, рисовой и пшеничной муки, поленты, а также для концентратов типа сухого завтрака на основе пшеницы получены в результате межлабораторных испытаний [2], выполненных в соответствии с Руководством АОАС по проведению межлабораторных испытаний для определения характеристик эффективности методов анализа [5]. Данные для зерна пшеницы и кукурузы получены в результате межлабораторных испытаний, организованных Межотраслевым Бюро Аналитических Исследований (Франция) в мае 2004 г. [3].
Таблица В.1 - Данные по прецизионности метода для овсяной и рисовой муки, зерна пшеницы и пшеничной муки, зерна кукурузы, поленты и концентратов типа сухого завтрака на основе пшеницы
Наименование показателя | Мука овся- | Мука рисо- | Мука рисо- | Мука пше- | Полен- | Сухой завтрак | Пше- | Пше- | Пше- | Куку- | Куку- | Куку- |
Год проведения испытаний | 2003 | 2003 | 2003 | 2003 | 2003 | 2003 | 2004 | 2004 | 2004 | 2004 | 2004 | 2004 |
Количество лабораторий- | 13 | 13 | 13 | 13 | 13 | 13 | ||||||
Количество лабораторий, оставшихся после исключения выбросов | 10 | 11 | 10 | 12 | 11 | 12 | 16 | 16 | 17 | 16 | 16 | 17 |
Количество выбросов (лабораторий) | 2 | 1 | 2 | 2 | 1 | 1 | ||||||
Число принятых результатов | 10 | 11 | 10 | 12 | 11 | 12 | 16 | 16 | 17 | 17 | 16 | 17 |
Среднее значение | 1768 | 458 | 85 | 678 | 123 | 217 | 165 | 1466 | 4612 | 501 | 2763 | 4712 |
Стандартное отклонение повторяемости | 54,92 | 26,97 | 12,04 | 40,62 | 7,88 | 26,77 | 34,3 | 71,1 | 209 | 52,5 | 99 | 173,4 |
Относительное стандартное отклонение повторяемости | 3,1 | 6,5 | 14,1 | 6,0 | 6,4 | 13,2 | 21 | 5 | 5 | 10 | 4 | 4 |
Предел повторяемости | 153,8 | 83,6 | 33,7 | 113,7 | 22,1 | 80,6 | 95 | 197,1 | 579,2 | 145,6 | 274,5 | 480,8 |
Стандартное отклонение воспроиз- | 244,8 | 52,5 | 12,7 | 110,5 | 26,4 | 57,1 | 64 | 304,7 | 1400,2 | 113,9 | 661,9 | 974,4 |
Относительное стандартное отклонение воспроиз- | 13,8 | 11,5 | 14,8 | 16,3 | 23,1 | 26,3 | 39 | 21 | 30 | 23 | 34 | 21 |
Предел воспроиз- | 685,3 | 146,9 | 35,5 | 309,3 | 79,6 | 160,0 | 177,4 | 844,7 | 3881,3 | 315,8 | 1834,6 | 2700,9 |
Полнота обнаружения, %*** | 81 | 86 | - | 81 | 86 | 86 | - | - | - | - | - | - |
Значение индекса Горвица, рассчитанное по [6] | 0,9 | 0,6 | 0,6 | 1,0 | 1,1 | 1,3 | 1,9 | 1,4 | 2,4 | 1,3 | 1,8 | 1,7 |
Значение индекса Горвица, рассчитанное по [7] | 0,9 | 0,6 | 0,7 | 1,0 | 1,1 | 1,3 | 1,9 | 1,4 | 2,4 | 1,3 | 1,8 | 1,7 |
* Проба, загрязненная естественным путем. |
________________ Текст документа соответствует оригиналу. - .
Данные, приведенные в таблице В.2, получены в результате межлабораторных испытаний [4], выполненных в соответствии с Руководством АОАС по проведению межлабораторных испытаний для определения характеристик эффективности методов анализа [5].
Таблица В.2 - Данные по прецизионности методики для продуктов на зерновой основе для питания грудных детей и детей раннего возраста
Наименование показателя | Продукты на зерновой основе для питания грудных детей и детей раннего возраста | |||||
искусственно загрязненная проба | искусственно загрязненная проба | проба, загрязненная естест- | проба, загрязненная естест- | проба, загрязненная естест- | проба, загрязненная естест- | |
Год проведения испытаний | 2005 | 2005 | 2005 | 2005 | 2005 | 2005 |
Количество лабораторий- | 12 | 14 | 14 | 11 | 12 | 14 |
Количество лабораторий, оставшихся после исключения выбросов | 11 | 13 | 14 | 11 | 10 | 12 |
Количество выбросов (лабораторий) | 1 | 1 | 0 | 0 | 2 | 1 |
Число принятых результатов | 11 | 13 | 14 | 11 | 10 | 13 |
Среднее значение | 115 | 212 | менее 6 | 58 | 115 | 452 |
Стандартное отклонение повторяемости | 8,6 | 29,6 | - | 8,2 | 7,3 | 36,7 |
Относительное стандартное отклонение повторяемости | 7,5 | 14,0 | - | 14,0 | 6,4 | 8,1 |
Предел повторяемости | 24,2 | 83,0 | - | 22,8 | 20,5 | 103,0 |
Стандартное отклонение воспроизводимости | 14,6 | 42,5 | - | 8,8 | 10,8 | 47,8 |
Относительное стандартное отклонение воспроизводимости | 12,7 | 20,1 | - | 15,2 | 9,4 | 10,6 |
Предел воспроизводимости | 40,9 | 119,0 | - | 24,7 | 30,2 | 133,9 |
Полнота обнаружения, % | 89 | 85 | - | - | - | - |
Значение индекса Горвица, рассчитанное по [6] | 0,6 | 1,0 | - | 0,6 | 0,4 | 0,6 |
Значение индекса Горвица, рассчитанное по [7] | 0,7 | 1,0 | - | 0,7 | 0,4 | 0,6 |
Библиография
[1] | Krska R., Schubert-Ulrich P., Josephs R.D., Emteborg H., Buttinger G., Petterson H., Van Egmond H.P, Schothorst R.C., MacDonald S. and Chan D., 2007, Determination of molar absorptivity coefficients for major type-B trichotecenes and calculation of calibrators for deoxynivalenol and nivalenol, Anal. Bioanal Chem., 388, 1215-1226 |
[2] | MacDonald S.J., Chan D., Brenton P., Damant A. and Wood R., 2005, Determination of deoxynivalenol in cereals and cereal products by immunoaffinity column cleanup with liquid chromatography: interlaboratory study, Journal of AOAC International, 88, 1197-1204 |
[3] | IRTAC-BIPEA - Rapport de comparaisons inter laboratories - Mars 2004, N 002 |
[4] | Stroka J., Derbyshyre M., Mischke C, Ambrosio M., Kroeger K., Amanz I., Sizoo E. and Van Egmond H.P., 2006, Liquid Chromatographic Determination of Deoxynivalenol in Baby Food and Animal Feed: Interlaboratory Study, Journal of AOAC International, 89, 1012-1020 |
[5] | AOAC International 1995, AOAC Official Methods Programm, Associate Referee's Manual on development, Study, Review and Approval Process. Part IV AOAC Guidelines for Collaborative Studies, 23-51 |
[6] | Horwitz, W. and Albert, R., (2006), The Horwitz Ratio (HorRat): A Useful Index of Method Performance with Respect to Precision, Journal of AOAC International, 89, 1095-1109 |
[7] | Thompson, M., 2000, Recent trends in inter-laboratory precision at ppb and sub-ppb concentrations in relation to fitness for purpose criteria in proficiency testing, Analyst, 125, 385-386 |
__________________________________________________________________________
УДК 633.1:006.354 МКС 67.060 IDT
Ключевые слова: продукты пищевые, определение дезоксиниваленола, продовольственное зерно, продукты переработки зерна, продукты на зерновой основе для питания грудных детей и детей раннего возраста, метод высокоэффективной жидкостной хроматографии, очистка экстракта на иммуноаффинной колонке, спектрофотометрическое детектирование
__________________________________________________________________________
Электронный текст документа
и сверен по:
официальное издание
М.: Стандартинформ, 2014

