ГОСТ 33774-2016
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Острая токсичность для эмбрионов рыбы
Testing of chemicals of environmental hazard. Fish embryo acute toxicity (FET)
МКС 13.020.01
Дата введения 2017-03-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Ассоциацией "Некоммерческое партнерство "Координационно-информационный центр государств - участников СНГ по сближению регуляторных практик" (Ассоциация "НП КИЦ СНГ") на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Росстандарт)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 20 апреля 2016 г. N 87-П)
За принятие проголосовали:
Краткое наименование страны по МК (ISO 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Туркмения | TM | Главгосслужба "Туркменстандартлары" |
Узбекистан | UZ | Узстандарт |
(Поправка. ИУС N 1-2023).
4 Приказом Федерального агентства по техническому регулированию и метрологии от 30 июня 2016 г. N 756-ст межгосударственный стандарт ГОСТ 33774-2016 введен в действие в качестве национального стандарта Российской Федерации с 1 марта 2017 г.
5 Настоящий стандарт является модифицированным по отношению к международному документу OECD Test N 236:2013 "Острая токсичность для эмбрионов рыбы" ("Fish Embryo Acute Toxicity (FET) Test", MOD) путем изменения структуры. Сравнение структуры международного документа со структурой настоящего стандарта приведено в дополнительном приложении ДА.
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Наименование настоящего стандарта изменено относительно наименования международного документа для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6)
Перевод с английского языка (en)
Степень соответствия - модифицированная (MOD)
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет ()
ВНЕСЕНА поправка, опубликованная в ИУС N 1, 2023 год
Поправка внесена изготовителем базы данных
Введение
Метод FET основан на результатах исследований и процедур по валидации, выполненных на данио-рерио [1]-[14]. Метод FET может успешно применяться для широкого ряда веществ, обладающих различными механизмами действия, растворимостью, летучестью и гидрофобностью (см. [15] и [16]).
1 Область применения
Настоящий стандарт устанавливает метод определения острой токсичности для эмбрионов рыбы (FET) с использованием данио-рерио (Danio rerio). Данный метод предназначен для определения острой токсичности химических веществ на эмбриональных стадиях развития рыбы.
2 Термины и определения
В настоящем стандарте применены термины с соответствующими определениями:
2.1 основная конечная точка (apical endpoint): Вызывающая эффект на уровне популяции.
2.2 бластула (blastula): Клеточное образование вокруг анимального полюса, которое покрывает определенную часть желтка.
2.3 эпиболия (epiboly): Массивная пролиферация преимущественно эпидермальных клеток в фазе гаструляции эмбрионов и их перемещение из дорсальной к вентральной стороне, посредством чего клетки энтодермального слоя интернализуются в процессах, подобных инвагинации, и желток включается в эмбрион.
2.4 проточный (динамический) тест (flow-through test): Испытание с непрерывным потоком испытуемых растворов через тест-систему во время воздействия.
2.5 внутренний контроль планшета (internal plate control): Внутренний контроль, состоящий из 4 лунок, заполненных водой для разведения, в 24-луночном планшете для идентификации потенциального загрязнения планшетов изготовителем или исследователем во время процедуры и любого возможного эффекта планшета, который может оказывать влияние на результаты испытания.
2.6 ИЮПАК (IUPAC): Международный союз теоретической и прикладной химии.
2.7 вода для поддержания (maintenance water): Вода, в которой разводится взрослая рыба.
2.8 средняя летальная концентрация (LC) (median lethal concentration): Концентрация испытуемого вещества, которая вызывает гибель 50% испытуемых организмов во время испытания.
2.9 полустатическое испытание с обновлением (semi-static renewal test): Испытание с регулярным обновлением испытуемых растворов после определенных периодов времени (например, каждые 24 ч).
2.10 SMILES (Simplified Molecular Input Line Entry Specification): Спецификация упрощенного представления молекул в строке ввода.
2.11 сомит (somite): У развивающихся эмбрионов позвоночных сомиты представляют собой массы мезодермы, распределенные в радиальном направлении к нервной трубке, которые в конечном итоге превращаются в дерму (дерматому), скелетные мышцы (миотом) и позвонки (склеротом).
2.12 статическое испытание (static test): Испытание, в котором испытуемые растворы остаются неизменными в течение всего испытания.
2.13 UVCB: Вещества с неопределенным и переменным составом, продукты сложных реакций или биологические материалы.
3 Принцип метода
Только что оплодотворенную икру данио-рерио подвергают воздействию испытуемого вещества в течение 96 ч. Каждые 24 ч проводят не менее четырех основных наблюдений в отношении показателей гибели [6]:
1) коагуляция оплодотворенной икры;
2) отсутствие образования сомитов;
3) отсутствие отделения хвостовой почки от желтка;
4) отсутствие сердцебиения.
В конце периода воздействия определяют острую токсичность на основе положительного результата, полученного в любом из четырех зарегистрированных основных наблюдений, и рассчитывают LC.
4 Предварительные условия
4.1 Полезная информация о свойствах конкретного вещества включает структурную формулу, молекулярную массу, чистоту, стабильность в воде и на свету, значения рК и K
, растворимость в воде и давление паров, а также результаты испытания на полную биоразлагаемость ([17] или [18]). Растворимость и давление паров можно использовать для вычисления постоянной закона Генри, которая указывает, могут ли возникнуть потери за счет испарения испытуемого вещества. Должен быть в наличии надежный аналитический метод количественного определения вещества в испытуемых растворах с известной и подтвержденной точностью и пределом обнаружения.
4.2 Если настоящий стандарт используют для испытания смеси химических веществ, то необходимо охарактеризовать ее состав, насколько это возможно, например химической идентификацией ее составляющих компонентов, их количественным содержанием и свойствами этих конкретных веществ (см. 4.1). Перед использованием настоящего стандарта для испытания смеси с последующим представлением результатов в регулирующие органы следует учитывать возможность обеспечения приемлемых результатов для определенной регулирующими органами цели.
4.3 В отношении веществ, которые могут активироваться в результате метаболизма, существуют сведения о том, что эмбрионы данио-рерио обладают способностью к биотрансформации химических соединений [19]-[22]. Однако метаболический потенциал эмбрионов рыбы не всегда аналогичен таковому у неполовозрелых или взрослых рыб. Например, протоксикант аллиловый спирт [9] был пропущен во время проведения FET. Следовательно, если имеются какие-либо обоснованные доказательства того, что метаболиты или другие продукты трансформации могут быть более токсичными, чем исходное соединение, то также рекомендуется проводить испытание таких метаболитов/продуктов трансформации и также использовать полученные результаты при подготовке заключения о токсичности испытуемого химического вещества, или альтернативно провести другое испытание, в котором будет учитываться его метаболизм.
4.4 Для веществ с молекулярной массой 3 kDa, т.е. очень объемных молекулярных структур, и веществ, вызывающих задержку вылупления яиц, которые могут элиминировать или уменьшать воздействие после вылупления яиц, эмбрионы, как ожидают, не будут чувствительны за счет ограниченной биодоступности вещества, и для таких веществ используют более подходящие другие протоколы испытания на токсичность.
5 Достоверность испытания
Для испытания используют следующие критерии достоверности:
а) общий уровень оплодотворения всех собранных яиц должен составлять 70% в испытуемой партии;
б) температура воды в испытательных камерах должна поддерживаться на уровне (26±1)°С в течение всего испытания;
в) общая выживаемость эмбрионов в отрицательном контроле (в воде для разведения) и в некоторых случаях в контроле на растворитель должна составлять 90% до окончания 96-часового воздействия;
г) воздействие в положительном контроле (например, 3,4-дихлоранилина в концентрации 4,0 мг/л для данио-рерио) должно приводить к минимальной гибели на уровне 30% по окончании 96-часового воздействия;
д) уровень вылупления в отрицательном контроле (и в контроле на растворитель, если он используется) должен составлять 80% по окончании 96-часового воздействия;
е) по окончании 96-часового воздействия концентрация растворенного кислорода в отрицательном контроле и самая высокая испытуемая концентрация должны составлять 80% от насыщения.
6 Описание метода
Описание рекомендуемых условий содержания и испытания приведено в приложении А.
6.1 Оборудование
Требуется следующее оборудование:
а) контейнеры для рыбы из химически инертного материала (например, стекла) и соответствующей вместимости с учетом рекомендуемой нагрузки (см. 6.5);
б) инвертационный микроскоп и/или бинокуляр с 80-кратным увеличением. Если в помещении, используемом для проведения наблюдений, невозможно установить температуру на уровне (26±1)°С, то необходимо поддерживать температуру стадией перекрестного изменения с регулировкой температуры или другими способами;
в) испытательные камеры, например, стандартные 24-луночные планшеты с глубиной примерно 20 мм (см. 6.2);
г) например, самоклеящаяся пленка для покрытия 24-луночных планшетов;
д) термостат или помещение с кондиционируемым воздухом с регулируемой температурой для поддержания температуры на уровне (26±1)°C в лунках (или испытательных камерах);
е) рН-метр;
ж) оксиметр;
и) оборудование для определения жесткости и проводимости воды;
к) нерестовая ловушка: инструментальный лоток из стекла, нержавеющей стали или других инертных материалов; проволочная сетка (размер отверстий (2±0,5) мм) из нержавеющей стали или другого инертного материала для защиты икринок после кладки; нерестовый субстрат (например, имитация растений из инертного материала) (приложение 4а [23]);
л) пипетки с широкими отверстиями для сбора икринок;
м) стеклянные сосуды для приготовления различных испытуемых концентраций и воды для разведения (стаканы, мерные колбы, мерные цилиндры и мерные пипетки) или отбора икринок данио-рерио (например, стаканы, кристаллизационные чашки);
н) если для проведения испытания используют альтернативные системы воздействия, такие как проточные [24] или с пассивным дозированием [25], то требуются соответствующие условия и оборудование.
6.2 Испытательные камеры
Используют стеклянные или полистироловые испытательные камеры (например, 24-луночные планшеты с вместимостью для заполнения 2,5-5 мл на лунку). В том случае, если предполагается наличие адсорбции испытуемого химического вещества на полистироле (например, это касается неполярных, планарных соединений с высоким K), используют инертные материалы (стекло) для снижения потерь за счет адсорбции [26]. Испытательные камеры располагают в термостате произвольно.
6.3 Вода и условия испытания
Разведение водой для поддержания рекомендуется для достижения уровня жесткости, характерного для широкого ряда поверхностных вод. Воду для разведения следует получать из восстановленной воды [27]. Полученная степень жесткости должна быть эквивалентна 100-300 мг/л CaCO для предупреждения чрезмерного осаждения карбоната кальция. Можно использовать другую хорошо охарактеризованную поверхностную или родниковую воду. Восстановленную воду можно адаптировать к технической воде с низкой жесткостью разведением деионизированной водой в соотношении 1:5 с обеспечением минимальной жесткости 30-35 мг/л CaCO
. Воду аэрируют для насыщения кислородом перед добавлением испытуемого вещества. Температура в лунках должна поддерживаться на уровне (26±1)°C в течение всего испытания. Значение рН должно находиться в диапазоне от рН 6,5 до 8,5 и не изменяться в пределах этого диапазона более чем на 1,5 единицы во время испытания. Если предполагается, что значение рН не будет находиться в данном диапазоне, то доведение рН проводят до начала испытания. Доведение рН проводят таким образом, чтобы существенно не изменялась концентрация стокового раствора и чтобы не была спровоцирована химическая реакция или осаждение испытуемого вещества. Рекомендуется использовать соляную кислоту (HCl) и гидроксид натрия (NaOH) для доведения рН в растворах, содержащих испытуемое вещество.
6.4 Испытуемые растворы
Испытуемые растворы с выбранными концентрациями можно приготовить, например, разведением стокового раствора. Стоковые растворы предпочтительно готовят простым смешиванием или перемешиванием испытуемого вещества в воде для разведения с использованием механических средств (например, мешалки и/или обработкой ультразвуком). Если испытуемое химическое вещество трудно растворимо в воде, то следует придерживаться процедур, описанных в Руководстве по работе с веществами, с которыми трудно проводить манипуляции [28]. Следует избегать использования растворителей, но в некоторых случаях их применяют для получения достаточно концентрированного стокового раствора. Если растворитель используется для облегчения приготовления стокового раствора, то его конечная концентрация не должна превышать 100 мкл/л и должна быть одинаковой во всех испытуемых сосудах. При использовании растворителя требуется включить дополнительный контроль на растворитель.
6.5 Содержание родительского стада рыб
Для яйцекладки используют родительское стадо, не подвергавшееся какому-либо воздействию, данио-рерио дикого типа с хорошо известным уровнем продукции икры. У рыбы должны отсутствовать внешние симптомы инфекций и заболеваний, и рыба не должна подвергаться обработке фармацевтическими препаратами (в лечебных или профилактических целях) за два месяца до нереста. Разведение рыбы в аквариумах проводится с рекомендуемым уровнем загрузки из расчета 1 л воды на рыбу и установленным 12-16-часовым световым периодом [29]-[33]. Следует отрегулировать оптимальную скорость фильтрации; необходимо избегать избыточной скорости фильтрации, что может вызвать сильное возмущение воды. Режим кормления см. в приложение А. Следует избегать избыточного кормления, регулярно контролировать качество и чистоту воды в аквариумах и при необходимости приводить в исходное состояние.
6.6 Подтверждение квалификации
В качестве стандартного вещества испытывают 3,4-дихлоранилин (использованный в испытаниях по валидации [1], [2]) по всему диапазону зависимости "концентрация-эффект" для проверки чувствительности используемого штамма рыбы предпочтительно два раза в год. В каждой лаборатории перед первоначальной постановкой испытания используют стандартное химическое вещество. Лаборатория может использовать это химическое вещество для подтверждения своей технической компетентности в выполнении испытания до представления результатов регулирующим органам.
6.7 Яйцекладка
6.7.1 Икра данио-рерио может быть получена с использованием нерестовых групп (в отдельных резервуарах для нереста) или с использованием массового нереста (в технических резервуарах). В случае нерестовых групп самцов и самок (например, в соотношении 2:1) в родительской группе помещают в резервуары для нереста за несколько часов до наступления темноты за день до испытания. Поскольку нерестовые группы данио-рерио иногда могут не нереститься, рекомендуется использовать параллельно не менее трех резервуаров для нереста. Для предупреждения генетических изменений икру собирают минимум из трех родительских групп, смешивают и произвольно отбирают.
6.7.2 Для сбора икры нерестовые ловушки помещают в резервуары для нереста или технические резервуары до наступления темноты за день до испытания или до появления света в день испытания. Для предупреждения поедания икры взрослыми особями данио-рерио нерестовые ловушки покрывают инертной проволочной сеткой с соответствующим размером отверстий [примерно (2±0,5) мм]. При необходимости искусственные растения из инертного материала (например, из пластика или стекла) можно прикрепить к сетке в качестве стимула для нереста [3]-[5], [23], [35]. Для этих целей используют атмосферостойкие пластиковые материалы, которые не выщелачиваются (например, фталаты). Спаривание, нерест и оплодотворение проходят в течение 30 мин после появления света, и нерестовые ловушки с собранной икрой осторожно удаляют. Рекомендуется промыть икру восстановленной водой после сбора из нерестовых ловушек.
6.8 Дифференциация икры
При 26°С оплодотворенная икра подвергается первому делению примерно через 15 мин, и в результате последовательных синхронных делений образуются 4-, 8-, 16- и 32-клеточные бластомеры (приложение Б, [35]). На этих стадиях оплодотворенную икру можно четко идентифицировать по развитию бластулы.
7 Проведение испытания
7.1 Условия воздействия
Двадцать эмбрионов на каждую концентрацию (один эмбрион на лунку) подвергают воздействию испытуемого вещества. Воздействие должно быть таким, чтобы ±20% от номинальной концентрации химического вещества поддерживалось на протяжении всего испытания. Если этого невозможно достичь в статической системе, то используют контролируемые полустатические системы, обновляемые через определенные интервалы (например, обновление каждые 24 ч). В этих случаях концентрации, использованные для воздействия, проверяют как минимум для самой высокой и самой низкой испытуемых концентраций в начале и в конце каждого интервала воздействия (см. 7.7.2). Если концентрация воздействия, составляющая ±20% от номинальной концентрации, не может быть обеспечена, то проверяют все концентрации в начале и в конце каждого интервала воздействия (см. 7.7.2). При обновлении следует соблюдать осторожность, чтобы эмбрионы оставались покрытыми небольшим количеством "старых" испытуемых растворов для предупреждения высыхания. Дизайн испытания можно адаптировать, чтобы он соответствовал требованиям испытания конкретных веществ (например, проточные системы [24] или системы с пассивным дозированием [25] для легко деградируемых или высоко адсорбирующихся веществ [29] или для летучих веществ [36], [37]). В любом случае следует проявлять осторожность для минимизации любого стресса для эмбрионов. Испытательные камеры выдерживают в течение не менее 24 ч с испытуемыми растворами до начала испытания. Условия испытаний приведены в приложении А.
7.2 Испытуемые концентрации
7.2.1 Обычно для соответствия статистическим требованиям должно быть пять концентраций испытуемого вещества, различающихся не более чем в 2,2 раза. Если используют менее пяти концентраций, то приводят обоснование такого дизайна. Предпочтительно, чтобы самая высокая испытуемая концентрация приводила к 100% гибели, а самая низкая испытуемая концентрация не вызывала видимых токсических эффектов, как это определено в 7.6.1. В устанавливающем диапазон испытании до проведения окончательного испытания имеется возможность выбрать соответствующий диапазон концентраций. Устанавливающее диапазон испытание обычно проводят с использованием десяти эмбрионов на каждую концентрацию. Следующие указания относятся к проведению испытания в 24-луночных планшетах. Если используют разные испытательные камеры (например, небольшие чашки Петри) или проверяют больше концентраций, то указания следует соответствующим образом скорректировать.
7.2.2 Подробное описание и иллюстративные указания для распределения концентраций в 24-луночных планшетах приведены в 7.5 и приложении В, рисунок В.1.
7.3 Контроли
7.3.1 Контроль на воду для разведения требуется в качестве отрицательного контроля и в качестве внутреннего контроля в планшете. Если во внутреннем контроле в планшете имеется более чем один мертвый эмбрион, то планшет удаляют, тем самым уменьшая количество концентраций, используемых для установления LC. Если планшет полностью удаляют из испытания, то возможность оценить и определить видимые эффекты может стать более затруднительной, особенно если удаленный планшет представляет планшет с контролем на растворитель или планшет, в котором также подвергаются воздействию обработанные эмбрионы. В первом случае испытание необходимо повторить. Во втором случае потеря целой группы(групп) обработки из-за гибели во внутреннем контроле в планшете может ограничить возможность оценки эффектов и определения значения LC
.
7.3.2 Положительный контроль, в качестве которого используют 3,4-дихлоранилин в определенной концентрации 4 мг/л, проводят с каждой партией икры, используемой для испытания.
7.3.3 В случае использования растворителя дополнительную группу из 20 эмбрионов подвергают воздействию растворителя в отдельном 24-луночном планшете, обеспечивая, таким образом, контроль на растворитель. Чтобы испытание считалось приемлемым, должно быть показано, что растворитель оказывает незначительный эффект на вылупление, выживаемость или не оказывает других отрицательных эффектов на эмбрионы (см. 5в).
7.4 Начало воздействия и продолжительность испытания
7.4.1 Испытание начинают сразу же после оплодотворения икры и прекращают через 96 ч воздействия. Эмбрионы должны быть погружены в испытуемые растворы до начала деления зародышевого диска или самое позднее до 16-клеточной стадии. Для начала воздействия с минимальной задержкой, по меньшей мере удвоенное количество икры, необходимое для каждой группы обработки, отбирают произвольно и переносят в соответствующие концентрации и контроли (например, в кристаллизационные чашки емкостью 100 мл; икра должна быть полностью покрыта) не позднее чем через 90 мин после оплодотворения.
7.4.2 Жизнеспособная оплодотворенная икра должна быть отделена от неоплодотворенной икры и перенесена в 24-луночные планшеты, предварительно кондиционированные в течение 24 ч и вновь наполненные свежеприготовленными испытуемыми растворами из расчета 2 мл/лунку в течение 180 мин после оплодотворения. С помощью стереомикроскопа (предпочтительно 30-кратное увеличение) отбирают оплодотворенную икру, подвергшуюся делению и не показывающую никаких явных нарушений деления (например, асимметрию, формирование пузырьков) или повреждений хориона. Рекомендации по отбору и распределению икры на группы см. приложение Б, рисунки Б.1 и Б.3 и приложение В, рисунок В.2.
7.5 Распределение икры по 24-луночным планшетам
Икру распределяют в лунки планшетов в следующем количестве (см. приложение В, рисунок В.1)
- 20 икринок на один планшет для каждой испытуемой концентрации;
- 20 икринок в качестве контроля на растворитель на один планшет (при необходимости);
- 20 икринок в качестве положительного контроля на один планшет;
- 4 икринки в воде для разведения в качестве внутреннего контроля в планшете на каждый из вышеперечисленных планшетов;
- 24 икринки в воде для разведения в качестве отрицательного контроля на один планшет.
7.6 Наблюдения
7.6.1 Основные наблюдения, проводимые за каждым испытуемым эмбрионом, включают следующие показатели: коагуляция, отсутствие формирования сомитов, неотделение хвоста, а также отсутствие сердцебиения (таблица 1). Данные наблюдения используют для определения гибели: любой положительный результат в одном из данных наблюдений означает, что эмбрион данио-рерио погиб. Кроме того, ежедневно регистрируют уровень вылупления в обработанной и контрольной группах, начиная с 48 ч. Наблюдения регистрируют каждые 24 ч до окончания испытания.
Таблица 1 - Основные наблюдения по острой токсичности на эмбрионах данио-рерио на 24-96 ч после оплодотворения
Время воздействия | ||||
24 ч | 48 ч | 72 ч | 96 ч | |
Коагулированные икринки | + | + | + | + |
Отсутствие формирования сомитов | + | + | + | + |
Неотделение хвоста | + | + | + | + |
Отсутствие сердцебиения | + | + | + | |
7.6.2 Коагуляция: коагулированные икринки имеют молочно-белый цвет и выглядят темными под микроскопом (см. приложение Г, рисунок Г.1). Количество коагулированных икринок определяют через 24 ч, 48 ч, 72 ч и 96 ч.
7.6.3 Отсутствие формирования сомитов: у нормально развивающихся эмбрионов данио-рерио при (26±1)°С формируется примерно 20 сомитов в течение 24 ч (см. приложение Г, рисунок Г.2). У нормально развивающегося эмбриона имеются спонтанные движения (маятниковые сокращения). Спонтанные движения указывают на формирование сомитов. Отсутствие сомитов регистрируют через 24 ч, 48 ч, 72 ч и 96 ч. Отсутствие формирования сомитов через 24 ч может быть связано с общей задержкой развития. Самое позднее через 48 ч должно быть обнаружено формирование сомитов. Если оно отсутствует, то эмбрионы считают погибшими.
7.6.4 Неотделение хвоста: у нормально развивающихся эмбрионов данио-рерио отделение хвоста (см. приложение Г, рисунок Г.3) от желтка наблюдают после удлинения тела эмбриона. Отсутствие отделения хвоста регистрируют через 24 ч, 48 ч, 72 ч и 96 ч.
7.6.5 Отсутствие сердцебиения: у нормально развивающихся эмбрионов данио-рерио при (26±1)°С сердцебиение просматривается через 48 ч (см. приложение Г, рисунок Г.4). Следует обратить особое внимание на регистрацию данной конечной точки, поскольку нерегулярное (непостоянное) сердцебиение не следует рассматривать в качестве показателя гибели эмбриона. Кроме того, видимое сердцебиение без кровообращения в брюшной аорте не считается признаком гибели. Для регистрации данной конечной точки эмбрионы без сердцебиения следует исследовать при минимальном 80-кратном увеличении не менее одной минуты. Отсутствие сердцебиения регистрируют через 48 ч, 72 ч и 96 ч.
7.6.6 Скорость вылупления во всех обработанных и контрольных группах регистрируют, начиная с 48 ч и далее, и результаты приводят в отчете. Хотя вылупление не является конечной точкой, используемой для расчета LC, вылупление обеспечивает воздействие на эмбрион без наличия потенциальной барьерной функции хориона и, таким образом, способствует интерпретации данных.
7.6.7 Подробное описание нормального развития [35] и примеры аномального развития эмбрионов данио-рерио приведены в приложениях Б и Г.
7.7 Аналитические определения
7.7.1 В начале и в конце испытания измеряют рН, общую жесткость и проводимость в контроле(ях) при самой высокой испытуемой концентрации химического вещества. В полустатических обновляемых системах рН измеряют до и после обновления воды. Концентрацию растворенного кислорода измеряют в конце испытания в отрицательных контролях и при самой высокой испытуемой концентрации с жизнеспособными эмбрионами, где она должна соответствовать критериям достоверности испытания (см. 5е). Если имеется опасение в том, что температура различается в 24-луночных планшетах, то температуру измеряют в трех произвольно отобранных сосудах. Предпочтительно температуру регистрируют непрерывно во время испытания или как минимум ежедневно.
7.7.2 В статической системе концентрацию испытуемого вещества измеряют как минимум при самой высокой и самой низкой испытуемых концентрациях, но предпочтительно во всех обработках в начале и в конце испытания. В полустатическом испытании (с обновлением), где, как ожидается, концентрация испытуемого вещества сохраняется в пределах ±20% от номинальных значений, рекомендуется как минимум измерять самую высокую и самую низкую испытуемые концентрации при условии недавнего приготовления и непосредственно перед обновлением. Для испытаний, где концентрация испытуемого вещества, как ожидают, не сохраняется в пределах ±20% от номинальной, все испытуемые концентрации измеряют при условии недавнего приготовления и непосредственно перед обновлением. В случае недостаточного объема для анализа может быть полезным объединение испытуемых растворов или использование суррогатных камер из того же материала и имеющих тот же объем по отношению к площади поверхности, как 24-луночные планшеты. Настоятельно рекомендуется, чтобы результаты основывались на измеренных концентрациях. Если концентрация не сохраняется в пределах 80-120% от номинальной концентрации, то эффективная концентрация должна быть выражена по отношению к геометрическому среднему значению измеренных концентраций, для более подробной информации см. главу 5 в [28].
7.8 Определение диапазона предельных концентраций
Используя методики, описанные в настоящем стандарте, определение диапазона предельных концентраций можно провести в концентрации испытуемого химического вещества 100 мг/л или на уровне его предельной растворимости в испытуемой среде (в зависимости от того, какое значение ниже) с целью показать, что LC не превышает эту концентрацию. Определение диапазона предельных концентраций проводят с использованием 20 эмбрионов в каждой обработке, положительном контроле и при необходимости в контроле на растворитель и 24 эмбрионов в отрицательном контроле. Если процент гибели при испытуемой концентрации превышает гибель в отрицательном контроле (или контроле на растворитель) на 10%, то проводят полное испытание. Любые наблюдаемые эффекты регистрируют. Если гибель превышает на 10% таковую в отрицательном контроле (или контроле на растворитель), то испытание рассматривается как недостоверное и его повторяют.
8 Данные и отчет о проведении испытания
8.1 Обработка результатов
В данном испытании отдельные лунки планшета рассматриваются в качестве независимых повторностей, используемых для статистического анализа. Строят график зависимости процента эмбрионов, для которых по меньшей мере одно из основных наблюдений является положительным через 48 ч и/или 96 ч от испытуемой концентрации. Для расчета наклона кривой следует использовать значения LC и доверительные интервалы (95%), соответствующие статистические методы [38] и следует принять во внимание [39].
8.2 Отчет о проведении испытания
Отчет о проведении испытания должен содержать следующую информацию.
8.2.1 Испытуемое химическое вещество
Однокомпонентная субстанция:
- внешний вид, растворимость в воде и соответствующие дополнительные физико-химические свойства;
- химическая идентификация: например, название по IUPAC или CAS, номер CAS, код SMILES или InChI, структурная формула, чистота, химическая идентификация примесей, если это необходимо и практически осуществимо и т.п. (в том числе содержание органического углерода при необходимости).
Многокомпонентная субстанция, UVBC (вещества неизвестного или переменного состава, продукты комплексных реакций или биологические материалы) и смеси:
- в максимально возможной степени характеризуются химической идентификацией (см. выше), по количественному составу и соответствующим физико-химическими свойствам отдельных компонентов.
8.2.2 Тестовые организмы:
- научное название, штамм, источник и метод отбора оплодотворенной икры и последующая обработка.
8.2.3 Условия испытания:
- используемая методика испытаний (например, полустатическая, обновляемая);
- световой период;
- дизайн испытания (например, количество испытательных камер, типы контролей);
- качественные характеристики воды, используемой для содержания рыбы (например, рН, жесткость, температура, проводимость, концентрация растворенного кислорода);
- концентрация растворенного кислорода, рН, общая жесткость, температура и проводимость испытуемых растворов в начале и через 96 ч;
- метод приготовления стоковых растворов и испытуемых растворов, а также периодичность обновления;
- обоснование применения растворителя и обоснование выбора растворителя, если он не является водой;
- также представляют номинальные испытуемые концентрации и результаты всех анализов по определению концентраций испытуемого вещества в испытательных сосудах; эффективность метода извлечения и предел количественного определения (LoQ),
- подтверждение соответствия контролей критериям достоверности по общей выживаемости;
- уровень оплодотворения икры;
- скорость вылупления в обработанной и контрольной группах.
8.2.4 Результаты:
- максимальная концентрация, не вызывающая гибели во время проведения испытания;
- минимальная концентрация, вызывающая 100% гибель во время проведения испытания;
- суммарная гибель для каждой концентрации в рекомендуемый период наблюдений;
- значения LC через 96 ч (и необязательно через 48 ч) по гибели с 95% доверительных интервалов, при наличии;
- график кривой "концентрация-гибель" в конце испытания;
- гибель в контролях (отрицательные контроли, внутренние контроли в планшете, а также положительные контроли и любой используемый контроль на растворитель);
- результаты по каждому из четырех основных наблюдений;
- частота возникновения и описание морфологических и физиологических аномалий, если таковые имели место (см. приложение Г, рисунок Г.2);
- случайные события во время проведения испытания, которые могли повлиять на интерпретацию результатов;
- статистический анализ и обработка данных (пробит-анализ, логистическая регрессия и геометрическое среднее значение для LC);
- наклон и доверительные интервалы регрессии (преобразованной) кривой "концентрация - эффект".
Любое отклонение от стандарта и соответствующие пояснения.
Обсуждение и интерпретация результатов.
Приложение А
(рекомендуемое)
Содержание, разведение и стандартные условия для проведения испытаний по острой токсичности на эмбрионах данио-рерио
Данио-рерио (Danio rerio) | ||
Происхождение видов | Индия, Бирма, Малакка, Суматра | |
Половой диморфизм | Самки: выпуклая линия брюшка при вынашивании икры. | |
Режим кормления | Сухой хлопьевидный корм (максимально 3% от массы рыбы в сутки) 3-5 раз в сутки; дополнительно науплии креветки (Artemia spec.) и/или небольшие дафнии соответствующего размера, полученные из незагрязненных источников. Кормление живым кормом обеспечивает источник обогащения среды, поэтому следует давать живой корм при возможности. Для обеспечения оптимального качества воды, излишки корма и фекалии следует удалять примерно через час после кормления | |
Средняя масса взрослой рыбы | Самки: (0,65±0,13) г | |
Содержание маточного стада (родительского стада рыб) | Освещение | Флуоресцентные лампы (широкий спектр); 10-20 мкE/м |
Температура воды | (26±1)°С | |
Качество воды | О | |
Дополнительные критерии качества воды | Вещество в виде частиц <20 мг/л, общий органический углерод <2 мг/л, общее содержание фосфорорганических пестицидов <50 нг/л, общее содержание хлорорганических пестицидов плюс полихлорированных бифенилов <50 нг/л | |
Размер резервуара для содержания | например, 180 л, 1 рыба/л | |
Очистка воды | Постоянная (угольная фильтрация); другие варианты включают комбинации с полустатическим обновляемым обслуживанием или проточную систему с постоянным обновлением воды | |
Рекомендуем соотношение самцов и самок для размножения | 2:1 (или масса нерестовой рыбы) | |
Резервуары для нереста | Например, резервуары вместимостью 4 л, снабженные на дне стальной сеткой и муляжами растений в качестве стимулятора нереста; внешние нагревательные маты, или масса нерестовой рыбы в пределах технических резервуаров | |
Структура и внешний вид икры | Твердый хорион (т.е. высокая прозрачность, не липкий, диаметр ~0,8-1,5 мм) | |
Скорость протекания нереста | Одна взрослая самка откладывает по меньшей мере 50-80 икринок в сутки. В зависимости от штамма скорость протекания нереста может быть значительно выше. Уровень оплодотворения должен составлять | |
Вид испытания | Статический, полустатический с обновлением, проточный, (26±1)°С, кондиционированные в течение 24 ч испытательные камеры (например, 24-луночные планшеты с лунками вместимостью 2,5-5 мл) | |
Приложение Б
(рекомендуемое)
Нормальное развитие данио-рерио при температуре 26°С
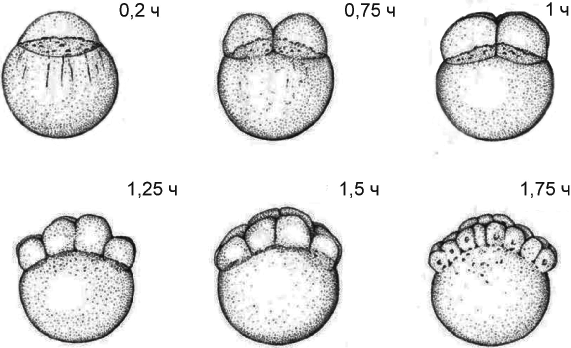
Пример стадий развития данио-рерио (Danio rerio) после оплодотворения приведен на рисунке Б.1.
Рисунок Б.1 - Отдельные стадии раннего развития данио-рерио (Danio rerio): 0,2-1,75 ч (из Kimmel et al., 1995) после оплодотворения
Временная последовательность нормального развития может быть использована для оценки оплодотворения и жизнеспособности икры (см. 7.4.2: отбор оплодотворенной икры).
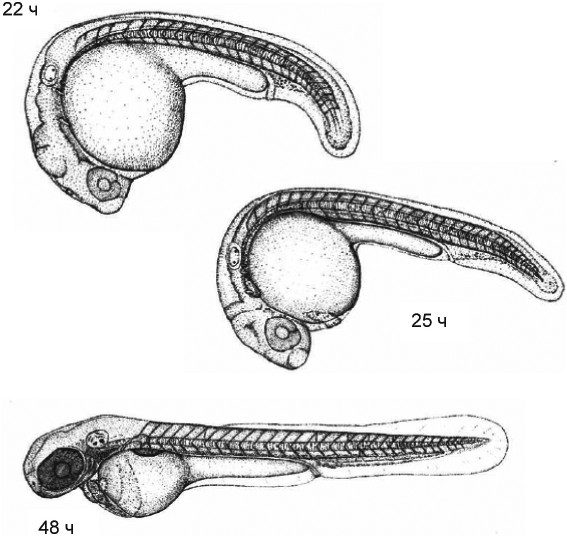
Пример отдельных стадий позднего развития данио-рерио (Danio rerio) после оплодотворения приведен на рисунке Б.2.
Рисунок Б.2 - Отдельные стадии позднего развития данио-рерио (Danio rerio): (эмбрион с удаленным хорионом для улучшения визуального контроля): 22-48 ч после оплодотворения (из Kimmel et al., 1995 [35])
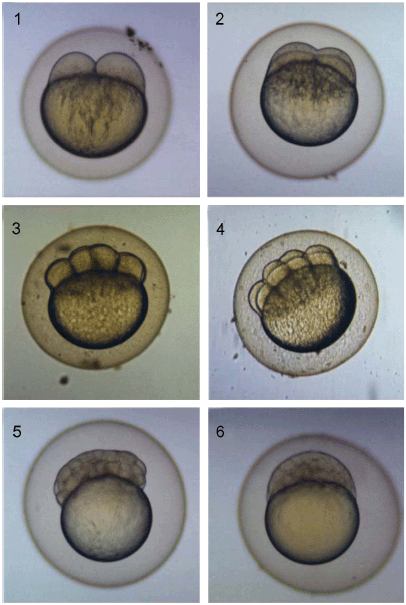
Пример нормального развития эмбрионов данио-рерио (Danio rerio) приведен на рисунке Б.3.
1) 0,75 ч - 2-клеточная стадия;
2) 1 ч - 4-клеточная стадия;
3) 1,2 ч - 8-клеточная стадия;
4) 1,5 ч - 16-клеточная стадия;
5) 4,7 ч - начало эпиболии;
6) 5,3 ч - примерно 50% эпиболия
Рисунок Б.3 - Нормальное развитие эмбрионов данио-рерио (Danio rerio): (из Braunbeck & Lammer, 2006 [40])
Приложение В
(рекомендуемое)
Распределение икры по 24-луночным планшетам
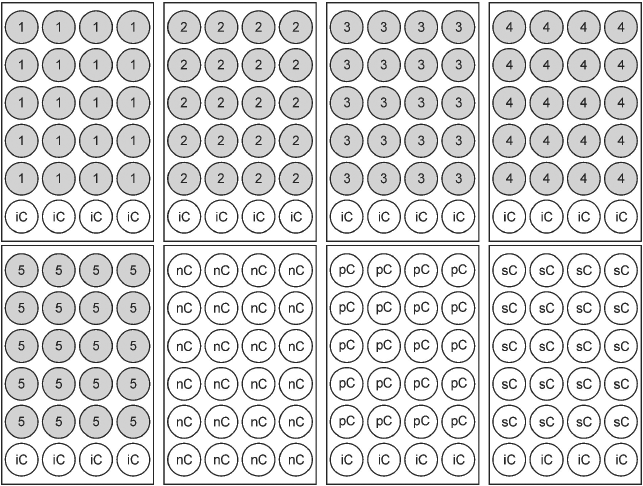
Пример распределения проб в 24-луночных планшетах приведен на рисунке В.1.
1-5 - пять испытуемых концентраций/химическое вещество;
nC - отрицательный контроль (вода для разведения);
iC - внутренний контроль в планшете (вода для разведения);
pC - положительный контроль (3,4-DCA 4 мг/л);
sC - контроль на растворитель
Рисунок В.1 - Распределение проб в 24-луночных планшетах
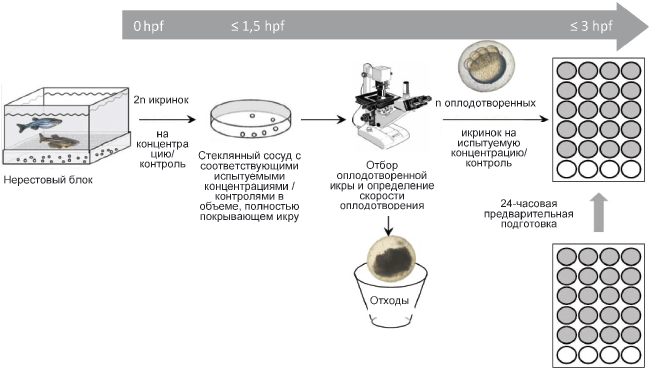
Пример схемы проведения испытания по острой токсичности на эмбрионах данио-рерио (Danio rerio) приведен на рисунке В.2.
Рисунок В.2 - Схема проведения испытания по острой токсичности на эмбрионах данио-рерио
Примечание - Слева направо: получение, сбор оплодотворенной икры сразу после оплодотворения в стеклянных сосудах, отбор оплодотворенной икры с использованием инвертационного микроскопа или бинокуляра и распределение оплодотворенной икры в 24-луночные планшеты, подготовленные с соответствующими концентрациями испытуемого вещества/контролями, n - количество икры, необходимой на каждую концентрацию испытуемого вещества/контроль (здесь 20), hpf - часы после оплодотворения.
Приложение Г
(рекомендуемое)
Атлас летальных конечных точек в испытании по определению острой токсичности на эмбрионах данио-рерио
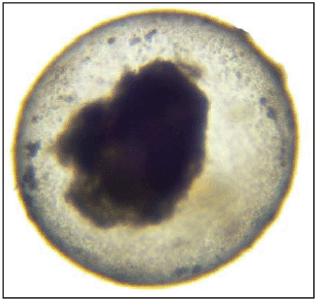
Следующие основные конечные точки характеризуют острую токсичность и, следовательно, гибель эмбрионов: коагуляция оплодотворенной икры, неотделение хвоста, отсутствие формирования сомитов и отсутствие сердцебиения. Следующие микрофотографии были выбраны для иллюстрации этих конечных точек (рисунок Г1).
Рисунок Г.1 - Коагуляция икринок
Примечание - При ярком освещении в коагулированных икринках данио-рерио видны различные непрозрачные включения.
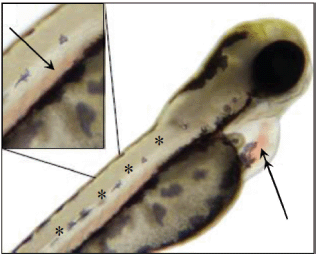
Наглядный пример отсутствия формирования сомитов приведен на рисунке Г.2.
Рисунок Г.2 - Отсутствие формирования сомитов
Примечание - Несмотря на отставание в развитии примерно через 10 ч, в эмбрионе данио-рерио через 24 ч развития имеются на а) хорошо развитые сомиты (), в то время как в эмбрионе на b) отсутствуют признаки формирования сомитов (
). Несмотря на выраженный отек желточного мешка (*), через 48 ч развития в эмбрионе данио-рерио имеется на c) явное формирование сомитов (
), в то время как через 96 ч развития в эмбрионе данио-рерио на d) отсутствуют какие-либо признаки формирования сомитов (
). Отметим также искривление позвоночника (сколиоз) и отек перикарда (*) у эмбриона, показанного на d).
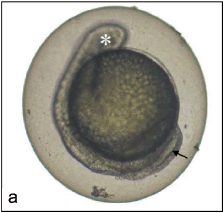
Пример неотделения хвостовой почки в боковой проекции приведен на рисунке Г.3.
Рисунок Г.3 - Неотделение хвостовой почки в боковой проекции
Примечание - а: ; через 96 ч развития эмбриона данио-рерио. Примечательно также отсутствие глазной почки (*).
Пример отсутствия сердцебиения приведен на рисунке Г.4.
Рисунок Г.4 - Отсутствие сердцебиения
Примечание - Отсутствие сердцебиения трудно проиллюстрировать на микрофотографии. Отсутствие сердцебиения определяют по отсутствию сокращений сердца (двойная стрелка). Неподвижность клеток крови, например в брюшной аорте ( на вставке), не является показателем отсутствия сердцебиения. Отмечается также отсутствие формирования сомитов у данного эмбриона (*, однородный, а не сегментарный вид мышечных тканей). Время наблюдения для регистрации отсутствия сердцебиения должно составлять по меньшей мере одну минуту с минимальным 80-кратным увеличением.
Приложение ДА
(справочное)
Сравнение структуры настоящего стандарта со структурой международного документа
Таблица ДА.1
Структура настоящего стандарта | Структура международного документа | |||
Разделы | Подразделы | Перечисления | Разделы | Перечисления |
Введение | 1 | - | ||
1 | - | - | 1 | - |
2 | - | - | 2 | - |
2.1 | - | Приложение 1 | - | |
2.2 | - | Приложение 1 | - | |
2.3 | - | Приложение 1 | - | |
2.4 | - | Приложение 1 | - | |
2.5 | - | Приложение 1 | - | |
2.6 | - | Приложение 1 | - | |
2.7 | - | Приложение 1 | - | |
2.8 | - | Приложение 1 | - | |
2.9 | - | Приложение 1 | - | |
2.10 | - | Приложение 1 | - | |
2.11 | - | Приложение 1 | - | |
2.12 | - | Приложение 1 | - | |
2.13 | - | Приложение 1 | - | |
3 | - | 1 | 3 | i |
2 | ii | |||
3 | iii | |||
4 | iv | |||
4 | 4.1 | - | 4 | - |
4.2 | - | 5 | - | |
4.3 | - | 6 | - | |
4.4 | - | 7 | - | |
5 | - | а | 8 | a |
б | b | |||
в | c | |||
г | d | |||
д | e | |||
е | f | |||
6 | - | - | 9 | - |
6.1 | а | 10 | a | |
б | b | |||
в | c | |||
г | d | |||
д | e | |||
е | f | |||
ж | g | |||
и | h | |||
к | i | |||
л | j | |||
м | k | |||
н | l | |||
6.2 | - | 11 | - | |
6.3 | - | 12 | - | |
6.4 | - | 13 | - | |
6.5 | - | 14 | - | |
6.6 | - | 15 | - | |
6.7 | - | - | - | |
6.7.1 | - | 16 | - | |
6.7.2 | - | 17 | - | |
6.8 | - | 18 | - | |
7 | 7.1 | - | 19 | - |
7.2 | - | - | - | |
7.2.1 | - | 20 | - | |
7.2.2 | - | 21 | - | |
7.3 | - | - | - | |
7.3.1 | - | 22 | - | |
7.3.2 | - | 23 | - | |
7.3.3 | - | 24 | - | |
7.4 | - | - | - | |
7.4.1 | - | 25 | - | |
7.4.2 | - | 26 | - | |
7.5 | - | 27 | - | |
7.6 | - | - | - | |
7.6.1 | - | 28 | - | |
7.6.2 | - | 29 | - | |
7.6.3 | - | 30 | - | |
7.6.4 | - | 31 | - | |
7.6.5 | - | 32 | - | |
7.6.6 | - | 33 | - | |
7.6.7 | - | 34 | - | |
7.7 | - | - | - | |
7.7.1 | - | 35 | - | |
7.7.2 | - | 36 | - | |
7.8 | - | 37 | - | |
8 | 8.1 | - | 38 | - |
8.2 | - | 39 | - | |
Приложение А | Приложение 2 | |||
Приложение Б | Приложение 3 | |||
Приложение В | Приложение 4 | |||
Приложение Г | Приложение 5 | |||
Библиография | Литература | |||
Библиография
[1] | OECD (2011) Validation Report (Phase 1) for the Zebrafish Embryo Toxicity Test: Part I and Part II. Series on Testing and Assessment No.157, OECD, Paris |
[2] | OECD (2012) Validation Report (Phase 2) for the Zebrafish Embryo Toxicity Test: Part I and Part II (Annexes). Series on Testing and Assessment No.179, OECD, Paris |
[3] | Braunbeck, T., |
[4] | ISO (2007) International Standard Water quality - Determination of the acute toxicity of waste water to zebrafish eggs (Danio rerio). ISO 15088:2007(E) International Organization for Standardization |
[5] | Nagel, R. (2002) DarT: The embryo test with the zebrafish (Danio rerio) - a general model in ecotoxicology and toxicology. ALTEX 19: 38-48 |
[6] | Schulte, C. and Nagel, R. (1994) Testing acute toxicity in embryo of zebrafish, Brachydanio rerio as alternative to the acute fish test - preliminary results. ATLA 22, 12-19 |
[7] | Bachmann, J. (2002) Development and validation of a teratogenicity screening test with embryos of the zebrafish (Danio rerio). PhD-thesis, Technical University of Dresden, Germany |
[8] | Lange, M., Gebauer, W., Markl, J. and Nagel, R. (1995) Comparison of testing acute toxicity on embryo of zebrafish (Brachydanio rerio), and RTG-2 cytotoxicity as possible alternatives to the acute fish test. Chemosphere 30/11: 2087-2102 |
[9] |
|
[10] | Kammann, U., Vobach, M. and Wosniok, W. (2006) Toxic effects of brominated indoles and phenols on zebrafish embryos. Arch. Environ. Contam. Toxicol., 51:97-102 |
[11] | Groth, G., Kronauer, K. and Freundt, K.J. (1994) Effects of N,N-diemethylformamide and its degradation products in zebrafish embryos. Toxicol. In Vitro 8: 401-406 |
[12] | Groth, G., Schreeb, K., Herdt, V. and Freundt, K.J. (1993) Toxicity studies in fertilized zebrafish fish eggs treated with N-methylamine, N,N-dimethylamine, 2-aminoethanol, isopropylamine, aniline, N-methylaniline, N,N-di-methylaniline, quinone, chloroacetaldehyde, or cyclohexanol. Bull. Environ. Contam. Toxicol. 50: 878-882 |
[13] | Nguyen, L.T. and Janssen, C.R. (2001) Comparative sensitivity of embryo-larval toxicity assays with African catfish (Clarias gariepinus) and zebra fish (Danio rerio). Environ. Toxicol. 16: 566-71 |
[14] | Cheng, S.H., Wai, A.W.K., So, C.H. and Wu, R.S.S. (2000) Cellular and molecular basis of cadmium-induced deformities in zebrafish embryos. Environ. Toxicol. Chem. 19: 3024-3031 |
[15] | Belanger, S.E., Rawlings J.M. and Carr G.J. Use of Fish Embryo Toxicity Tests for the Prediction of Acute Fish Toxicity to Chemicals. Environmental Toxicology and Chemistry (Accepted) |
[16] | Lammer, E., Carr, G.J., Wendler, K., Rawlings, J.M., Belanger, S.E., Braunbeck, T. (2009) Is the fish embryo toxicity test (FET) with the zebrafish (Danio rerio) a potential alternative for the fish acute toxicity test? Comp. Biochem. Physiol. C Toxicol. Pharmacol.: 149 (2), 196-209 |
[17] | OECD (1992) Ready Biodegradability, Test Guideline No.301, Guidelines for the Testing of Chemicals, OECD, Paris |
[18] | OECD (2006) Ready Biodegradability, CO2 in sealed vessels, Test Guideline No.310, Guidelines for the Testing of Chemicals, OECD, Paris |
[19] | Weigt, S., Huebler, N., Strecker, R., Braunbeck, T., Broschard, T.H. (2011) Zebrafish (Danio rerio) embryos as a model for testing proteratogens. Toxicology 281: 25-36 |
[20] | Weigt, S., Huebler, N., Strecker, R., Braunbeck, T., Broschard, T.H. (2012) Developmental effects of coumarin and the anticoagulant coumarin derivative warfarin on zebrafish (Danio rerio) embryos. Reprod. Toxicol. 33: 133-141 |
[21] | Incardona, J.P, Linbo, T.L., Scholz, N.L. (2011) Cardiac toxicity of 5-ring polycyclic aromatic hydrocarbons is differentially dependent on the aryl hydrocarbon receptor 2 isoform during zebrafish development. Toxicol. Appl. Pharmacol. 257: 242-249 |
[22] | Kubota, A., Stegeman, J.J., Woodin, B.R., Iwanaga, T., Harano, R., Peterson, R.E., Hiraga, T., Teraoka, H. (2011) Role of zebrafish cytochrome P450 CYP1C genes in the reduced mesencephalic vein blood flow caused by activation of AHR2. Toxicol. Appl. Pharmacol. 253: 244-252 |
[23] | OECD (2009) Fish Short Term Reproduction Assay. Test Guideline No.229, Guidelines for the Testing of Chemicals, OECD, Paris. See ANNEX 4a |
[24] | Lammer, E., Kamp, H.G., Hisgen, V., Koch, M., Reinhard, D., Salinas, E.R., Wendlar, K., Zok, S., Braunbeck, T. (2009) Development of a flow-through system for the fish embryo toxicity test (FET) with zebrafish (Danio rerio). Toxicol. In Vitro 23: 1436-1442 |
[25] | Brown, R.S., Akhtar, P., Akerman, J., Hampel, L., Kozin, I.S., Villerius, L.A., Klamer, H.J.C., (2001) Partition controlled delivery of hydrophobic substances in toxicity tests using poly (dimethylsiloxane) (PDMS) films. Environ. Sci. Technol. 35, 4097-4102 |
[26] | Schreiber, R., Altenburger, R., Paschke, A., |
[27] | ISO (1996) International Standards. Water quality - Determination of the acute lethal toxicity of substances to a freshwater fish [Brachydanio rerio Hamilton-Buchanan (Teleostei, Cyprinidae)]. ISO 7346-3: Flow-through method. Available: [http://www.iso.org] |
[28] | OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Series on Testing and Assessment No.23, OECD, Paris |
[29] | Laale, H.W. (1977) The biology and use of zebrafish, Brachydanio rerio, in fisheries research. A literature review. J. Fish Biol. 10: 121-173 |
[30] | Westerfeld, M. (2007) The zebrafish book: A guide for the laboratory use of zebrafish (Brachydanio rerio). 5th edition. Eugene, University of Oregon Press, Institute of Neuroscience, USA |
[31] | Canadian Council on Animal Care (2005) Guidelines on: the Care and Use of Fish in Research, Teaching and Testing, ISBN: 0-919087-43-4 [http://www.ccac.ca/Documents/Standards/Guidelines/Fish.pdf] |
[32] | European Commission (2007) Commission recommendation 2007/526/EC of 18 June 2007 on guidelines for the accommodation and care of animals used for experimental and other scientific purposes (notified under document number C(2007) 2525) [http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2007:197:0001:0089:EN:PDF] |
[33] | European Union (2010) Directive 2010/63/EU of the European Parliament and Council of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union, L 276:33-79; 20.10.2010 [http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2010:276:0033:0079:EN:PDF] |
[34] | Nagel, R. (1986) Untersuchungen zur Eiproduktion beim Zebrab |
[35] | Kimmel, C.B., Ballard, W.W., Kimmel, S.R., Ullmann, B. and Schilling, T.F. (1995) Stages of embryonic development of the zebrafish. Dev. Dyn. 203: 253-310 |
[36] | OECD (2004) Daphnia sp., Acute Immobilistaion Test. Test Guideline No.202. Guidelines for the Testing of Chemicals, OECD, Paris |
[37] | Weil, M., Scholz, S., Zimmer, M., Sacher, F., Duis, K. (2009) Gene expression analysis in zebrafish embryos: a potential approach to predict effect conentrations in the fish early life stage test. Environ. Toxicol. Chem. 28: 1970-1978 |
[38] | ISO (2006) International Standard. Water quality - Guidance on statistical interpretation of ecotoxicity data ISO TS 20281. Available: [http://www.iso.org] |
[39] | OECD (2006) Guidance Document on Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application. Series on Testing and Assessment No.54. OECD, Paris |
[40] | Braunbeck, T., Lammer, E., 2006. Detailed review paper "Fish embryo toxicity assays". UBA report under contract no. 20385422 German Federal Environment Agency, Berlin. 298 pp |
УДК 658.382.3:006.354 | МКС 13.020.01 | MOD |
Ключевые слова: химическая продукция, окружающая среда, эмбрион, рыба, острая токсичность | ||
Редакция документа с учетом
изменений и дополнений подготовлена