ГОСТ 33638-2015
Группа Т58
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Испытания по воздействию на половозрелость рыб
Testing of chemicals of environmental hazard. Fish Sexual Development Test
МКС 13.020.01
Дата введения 2016-09-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский институт стандартизации материалов и технологий" (ФГУП "ВНИИ СМТ") на основе аутентичного перевода на русский язык документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Росстандарт)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 октября 2015 г. N 81-П)
За принятие стандарта проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 13 ноября 2015 г. N 1780-ст межгосударственный стандарт ГОСТ 33638-2015 введен в действие в качестве национального стандарта Российской Федерации с 1 сентября 2016 г.
5 Настоящий стандарт модифицирован по отношению к международному документу OECD, Test No. 234:2011* Fish Sexual Development Test (ОЭСР, Тест N 234:2011 Испытания по воздействию на половозрелость рыб) путем изменения структуры.
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Сравнение структуры международного документа со структурой настоящего стандарта приведено в приложении ДА.
Перевод с английского языка (en).
Степень соответствия - модифицированная (MOD)
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru).
Введение
Настоящий стандарт разработан на основании решения, принятого в 1998 г. о необходимости разработки нового или обновлению существующего Руководства по испытанию для скрининга и испытания потенциальных веществ, оказывающих отрицательное влияние на эндокринную систему. Метод испытания воздействия на половозрелость рыб (FSDT) был определен в качестве перспективного метода, охватывающего чувствительную стадию цикла развития рыб, реагирующую на химические вещества с эстроген- и андрогенподобным действием. Метод испытания проходил межлабораторную проверку достоверности применения с 2006 по 2010 гг., в которой были валидированы в качестве объектов воздействия японская оризия (Oryzias latipes), данио-рерио (Danio rerio) и трехиглая колюшка (Gasterosteus aculeatus) и частично валидирован черный толстоголов (Pimephales promelas) [1]-[3]. Данный протокол основан на использовании японской оризии, трехиглой колюшки и данио-рерио. По существу, протокол является расширением [4], в котором воздействие продолжается до наступления половозрелости у рыб, т.е. около 60 сут после вылупления (dph) для японской оризии, трехиглой колюшки и данио-рерио (период воздействия может быть короче или длиннее для других видов, которые будут валидироваться в дальнейшем), и добавляются конечные точки, чувствительные к воздействию эндокринной системы. С использованием FSDT оценивается влияние химических веществ на ранней стадии цикла развития рыб с предполагаемым отрицательным воздействием на эндокринную систему (например, ингибиторов эстрогенеза, андрогенеза и стероидогенеза), а именно на половозрелость. Испытание включает сочетание двух основных эндокринных конечных точек: концентрацию вителлогенина (VTG) и стенотипическое соотношение полов, позволяющих объяснить механизм действия испытуемого химического вещества. FSDT могут использоваться для оценки опасности и риска за счет изменения фенотипического соотношения полов в релевантной популяции. Однако если метод применяется для оценки опасности или риска, то не следует использовать колюшек, поскольку имеющиеся данные по валидации показывают, что у данного вида рыб редко наблюдаются изменения фенотипического соотношения полов в результате воздействия испытуемых веществ.
Протокол основан на рыбе, подвергнутой воздействию химических веществ через воду во время периода полового созревания, в котором, как ожидается, рыбы проявляют наиболее высокую чувствительность к влиянию химических веществ, оказывающих отрицательное влияние на эндокринную систему и препятствующих половому развитию. В качестве показателей связанных с эндокринной системой нарушений развития измеряются две основные конечные точки: концентрация VTG и соотношение полов, что определяется исследованием гистологии половых желез. Гистопатология половых желез (оценка и определение стадий развития ооцитов и сперматозоидов) не является обязательной. Кроме того, где это возможно, определяется генетический пол (например, на японской оризии и трехиглой колюшке). Наличие маркера генетического пола дает существенное преимущество, поскольку это повышает мощность статистики соотношения полов и позволяет определить индивидуальную смену фенотипического пола. Другие основные конечные точки, которые следует измерять, включают скорость вылупления, выживание, длину и массу тела. Метод испытания может быть адаптирован к другим видам рыб, помимо упомянутых выше, при условии проведения процедуры валидации, аналогичной проделанной для японской оризии, трехиглой колюшки и данио-рерио, где контрольные рыбы в конце испытания проходят половое дифференцирование, уровни VTG были достаточно высокими для выявления значительных изменений, связанных с химическим веществом, и чувствительность тест-системы устанавливалась с помощью стандартных активных для эндокринной системы химических веществ, таких как антиэстрогены, антиандрогены, ингибиторы ароматазы и т.д. Кроме того, отчет(ы) по валидации со ссылкой на данные FSDT с использованием других видов рыб должен(ны) быть рассмотрен(ы) ОЭСР, а итоги валидации должны рассматриваться в качестве удовлетворительных.
1 Область применения
1.1 Настоящий стандарт устанавливает метод испытания воздействия веществ на половозрелость рыб FSDT in vivo, предназначенный для обнаружения химических веществ с андрогенными и эстрогенными свойствами, а также антиандрогенными, антиэстрогенными и ингибирующими стероидогенез свойствами. Фазы валидации FSDT (1 и 2) охватывают эстрогены, андрогены и химические вещества, ингибирующие стероидогенез. Эффекты антагонистов эстрогенов и андрогенов в FSDT представлены в таблице 1.
1.2 FSDT не распространяется на репродуктивную стадию развития рыб, и, следовательно, в данном методе испытанию подвергаются химические вещества, которые, как предполагается, влияют на воспроизведение в более низких концентрациях, чем на половое развитие, и их оценивают в методе, касающемся воспроизведения.
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 основная конечная точка (apical endpoint): Вызывающая эффект на уровне популяции.
2.2 ASV: Значение насыщения воздуха.
2.3 биомаркер (biomarker): Вызывающий эффект на уровне отдельного организма.
2.4 dph (days post hatch): Дни после вылупления.
2.5 DMY: Y-сцепленный DM-домен гена, необходимый для развития самца рыбы оризия.
2.6 ELISA (enzyme-Linked Immunosorbent Assay): Иммуноферментный твердофазный анализ.
2.7 масса рыбы (fish weight): Сырая масса рыбы (масса, определенная после промакивания насухо).
2.8 FSDT (Fish Sexual Development Test): Тест по оценке влияния на половозрелость рыб.
2.9 HPG ось (HPG axis): Гипоталамо-гипофизарно-гонадная ось.
2.10 рыбы-гермафродиты (intersex fish): Рыба с более чем одной яйцеклеткой в семенниках на 6 проанализированных срезов или сперматогенными клетками в яичниках (да/нет).
2.11 уровень загрузки (loading rate): Сырая масса рыбы на единицу объема воды.
2.12 МОА (mode of action): Механизм действия.
2.13 RT-PCR (reverse Transcriptase Polymerase Chain-Reacti): Полимеразная цепная реакция с обратной транскриптазой.
2.14 TG (test Guideline): Руководство по испытанию.
2.15 недифференцированная рыба (undifferentiated fish): Рыба с гонадами с неразличимыми половыми клетками.
2.16 Vitellogenin (VTG): Вителлогенин.
3 Общие положения
3.1 VTG в норме продукцируется печенью яйцекладущих позвоночных самок в ответ на эндогенный эстроген в крови [5]. Продукт является предшественником белков яичного желтка и после синтеза в печени транспортируется с кровотоком в яичники, где он захватывается и модифицируется под действием развивающихся яиц. Синтез VTG происходит на очень низком уровне, хотя детектируется у неполовозрелых рыб и взрослых самцов рыб, поскольку они не имеют достаточного уровня эстрогена в крови. Однако печень способна синтезировать и секретировать VTG в ответ на стимуляцию экзогенным эстрогеном [6]-[8].
3.2 Измерение VTG служит для обнаружения химических веществ с эстрогенным, антиэстрогеным, андрогенным механизмом действия и химических веществ, нарушающих стероидогенез, например, ингибиторов ароматазы. Обнаружение химических веществ с эстрогенным действием можно проводить по измерению индукции VTG у самцов рыбы, и в специальной научной литературе имеется большое количество сообщений по этому вопросу. Индукция VTG была также продемонстрирована после воздействия ароматизированных андрогенов [9], [10]. Снижение уровня циркулирующих эстрогенов у самок, например в результате ингибирования ароматазы, катализирующей превращение эндогенного андрогена в природный эстроген 17-эстрадиол, приводит к снижению концентрации VTG, что используется для обнаружения химических веществ, обладающих ингибирующими свойствами в отношении ароматазы, или ингибиторов стероидогенеза в более широком смысле [11]. Установлено и имеется много сообщений о биологическом значении изменения уровня VTG после ингибирования эстрогенов/ароматазы [12], [13]. Однако, возможно, что на синтез VTG у самок также могут оказывать влияние химические вещества, обладающие общей токсичностью и эффектами, не связанными с эндокринной системой.
3.3 Было успешно разработано и стандартизировано для широкого применения несколько методов количественной оценки VTG в пробах крови, печени, всем теле или гомогенате головного/хвостового концов, отобранных от отдельных рыб. Это относится к данио-рерио, трехиглой колюшке и японской оризии, а также частично валидированному виду толстоголова; имеются методы видоспецифического иммуноферментного твердофазного анализа (ELISA), в которых используется иммунохимия для количественной оценки VTG [8], [14]-[20]. У японской оризии и данио-рерио существует высокая корреляция между измеренными уровнями VTG в плазме крови, печени и гомогенатах, хотя анализ гомогенатов показывает несколько более низкие значения, чем анализ проб плазмы [21]-[23]. В приложение Г приведены методики отбора проб для анализа VTG.
3.4 Изменение фенотипического соотношения полов (пропорции полов) является конечной точкой, отражающей смену пола. В принципе, эстрогены, антиэстрогены, андрогены, антиандрогены и химические вещества, ингибирующие стероидогенез, могут влиять на соотношение полов у развивающихся рыб [24]. Было показано, что эта смена пола является частично обратимой у данио-рерио [25] после воздействия химических веществ с эстрогеноподобным действием, тогда как смена пола после воздействия химических веществ с андрогеноподобным действием является постоянной [26]. Пол определяется как самка, самец, гермафродит (ооциты и сперматогенные клетки в одной гонаде) или недифференцированные, которые устанавливаются гистологическим исследованием половых желез у отдельных рыб. Руководящие указания приведены в приложении Е и [27].
3.5 Генетический пол определяется с помощью генетических маркеров, когда они имеются у данного вида рыб. У самки или самца японской оризии соответственно гены XX и XY могут быть обнаружены с помощью полимеразной цепной реакции (PCR), или Y-сцепленный DM-домен гена (DMY) может быть определен (DMY отрицательный или положительный), как описано в [28], [29]. Для трехиглой колюшки существует аналогичный метод PCR для определения генетического пола, описанный в приложении К. Если генетический пол может быть индивидуально связан с фенотипическим полом, то мощность испытания повышается, и поэтому генетический пол следует определять у видов с уставленными генетическими половыми маркерами.
3.6 В совокупности две основные эндокринные конечные точки, VTG и соотношение полов, могут свидетельствовать об эндокринном механизме действия (МОА) химического вещества (см. таблица 1). Соотношение полов является важным биомаркером на уровне популяции [30], [31] и для некоторых четко определенным механизмом действия, результаты FSDT могут быть использованы для оценки опасности и рисков, если это будет сочтено целесообразным регулирующим органом. В настоящее время такими механизмами действия обладают ингибиторы эстрогенов, андрогенов и стероидогенеза.
Таблица 1 - Реакция эндокринных конечных точек для химических веществ с различным механизмом действия
Механизм действия (МОА) | VTG | VTG | Соотношение полов | Ссылки |
Слабый агонист эстрогенов |
| [32], [42] | ||
Сильный агонист эстрогенов |
| [33], [42] | ||
Антагонист эстрогенов | - | - |
| [34] |
Агонист андрогенов |
|
|
| [33], [26] |
Антагонист андрогенов | - | - |
| [35] |
Ингибитор ароматазы |
| [11] | ||
Условные обозначения, принятые в таблице: |
| |||
| ||||
Примечание - МОА в настоящее время задокументированы в меньшей мере. | ||||
4 Принцип метода
4.1 В испытании воздействию подвергают рыбу от только что оплодотворенной яйцеклетки до завершения половой дифференциации не менее чем в трех концентрациях испытуемого вещества, растворенного в воде. Условия испытаний должны быть проточными, за исключением случаев отсутствия пригодности или соответствующих свойств испытуемого вещества (например, ограниченная растворимость). Испытание начинается с помещения только что оплодотворенных яйцеклеток (до расщепления бластодиска) в испытательные камеры. Загрузка камер для каждого вида описана в 7.1.2. Для валидированных видов рыб: японской оризии, трехиглой колюшки и данио-рерио, испытание завершается на 60 сут после вылупления. По окончании испытания вся рыба подвергается гуманной эвтаназии. Биологическую пробу (плазму крови, печень или гомогенат головного/хвостового концов) отбирают для анализа VTG от каждой рыбы, а оставшуюся часть фиксируют для гистологической оценки гонад с целью определения фенотипического пола; дополнительно может быть выполнена гистопатология (например, определение стадий гонад, уровень гермафродитов). Биологическая проба (анальный или спинной плавник) для определения генетического пола отбирается у видов, обладающих соответствующими маркерами (приложения И, К).
4.2 Краткое описание соответствующих условий испытания, специфичных для валидированных видов: японской оризии, трехиглой колюшки и данио-рерио, приводится в приложении А.
5 Информация об испытуемом веществе
5.1 Должны быть в наличии результаты испытания острой токсичности или другого метода оценки краткосрочной токсичности TG 215 [36] и TG 210 [4], предпочтительно на видах, выбранных для данного испытания. Кроме того, должны быть данные по растворимости в воде и давлении паров исследуемого вещества и надежный метод количественного анализа химического вещества в испытательных камерах с известной и подтвержденной точностью и пределом обнаружения.
5.2 Другая полезная информация включает структурную формулу, чистоту химического вещества, стабильность в воде и на свету, рКа, Pow и результаты испытания по биоразложению TG 301 [37].
5.3 Критерии приемлемости испытания
Для приемлемости результатов испытания должны соблюдаться следующие условия:
- концентрация растворенного кислорода должна составлять не менее 60% значения насыщения воздуха (ASV) в течение всего испытания;
- температура воды не должна отличаться более чем на ±1,5°С между испытательными камерами в любой момент времени в течение периода воздействия и должна поддерживаться в температурных диапазонах, указанных для тестовых видов (приложение А);
- должен иметься в наличии валидированный метод анализа испытуемого химического вещества с пределом обнаружения значительно ниже самой низкой номинальной концентрации, и должны быть получены данные, подтверждающие удовлетворительное сохранение концентрации испытуемого вещества в растворе в пределах ±20% средней измеряемой величины;
- общая выживаемость оплодотворенных яйцеклеток в контроле и в тех случаях, когда он имеется, в контроле на растворитель должна быть более или равна пределам, определенным в приложении А;
- критерии приемлемости, связанные с ростом и соотношением полов, по окончании испытания основываются на данных, полученных в контрольных группах (объединенных контролях на растворитель и воду, если они значительно отличаются, то только на растворитель):
Японская оризия | Данио-рерио | Трехиглая колюшка | ||
Рост | Сырая масса рыбы, после промокания насухо | >150 мг | >75 мг | >120 мг |
Длина (стандартная) | >20 мм | >14 мм | >20 мм | |
Соотношение полов | (самцы или самки) | 30-70% | 30-70% | 30-70% |
При использовании растворителя он не должен оказывать статистически значимое влияние на выживаемость и нарушать эндокринную функцию или оказывать другие отрицательные эффекты на ранних стадиях развития, что показывает контроль на растворитель.
Если наблюдается отклонение от критериев приемлемости испытания, то последствия следует учитывать применительно к достоверности результатов испытания и проанализированные данные включают в отчет.
6 Описание метода
6.1 Испытательные камеры
Могут быть использованы камеры из стекла, нержавеющей стали или других химически инертных материалов. Размеры камер должны быть достаточно большими, чтобы обеспечивались критерии уровня загрузки, приведенные ниже. Желательно, чтобы испытательные камеры располагались произвольно в месте проведения испытания. Рандомизированный блочный дизайн с каждой концентрацией, присутствующей в каждом блоке, является предпочтительнее полностью рандомизированного дизайна. Испытательные камеры должны быть защищены от нежелательного нарушения.
6.2 Выбор тестовых видов
Рекомендуемые виды рыб приведены в приложении А. Процедуры включения новых видов приведены во введении.
6.3 Содержание родительского стада рыб
Подробную информацию о содержании родительского стада рыб в удовлетворительных условиях можно найти в TG 210 [4]. Родительское стадо рыб кормят один или два раза в день соответствующим кормом.
6.4 Обращение с эмбрионами и личинками
6.4.1 Вначале эмбрионы и личинки подвергают воздействию в основной камере, в которой находятся более маленькие камеры из стекла или нержавеющей стали, снабженные сетчатыми сторонами или днищами, для обеспечения потока испытуемого вещества через камеру. Нетурбулентный поток через эти маленькие камеры обеспечивают суспендированием их содержимого передвижением рукой камеры вверх и вниз, но всегда сохраняя организмы, погруженными в воду.
6.4.2 Если контейнеры, решетки или сетки с яйцами использовались для содержания яиц внутри основной испытательной камеры, то эти ограничивающие устройства удаляют после вылупления личинок, за исключением сеток, которые остаются для предупреждения исчезновения рыб. Если существует необходимость в переносе личинок, то они не должны подвергаться воздействию воздуха и не следует использовать сетки для высвобождения рыбы из контейнеров с яйцами. Сроки такого переноса зависят от тестового вида рыб, и перенос не всегда требуется.
6.5 Вода
В качестве испытуемой воды подходит любая вода, в которой тестовые виды в контроле выживают по меньшей мере так же, как в воде, описанной в приложении Б. Она должна быть постоянного качества в течение всего периода испытания. В целях гарантии того, что вода для разведения не оказывает существенного влияния на результаты испытания (например, за счет взаимодействия с испытуемым веществом) или негативно воздействует на производительность родительского стада, через определенные интервалы времени отбирают воду для анализа. Такие показатели, как общий органический углерод, проводимость, рН и содержание взвешенных твердых частиц измеряют, например, раз в три месяца, когда известно, что вода для разведения относительно постоянна по своему качеству. Измерения тяжелых металлов (например, Cu, Pb, Zn, Hg, Cd, Ni), основных анионов и катионов (например, Са, Mg, Na, K, CI, SO и пестицидов необходимо проводить, если качество воды вызывает сомнение. Подробная информация о химическом анализе и отборе проб воды приведена в 7.4.1.
6.6 Испытуемые растворы
6.6.1 Если это возможно с практической точки зрения, то используют проточную систему. При проведении испытаний с проточным дизайном для доставки серии концентраций в испытательные камеры необходима система, непрерывно дозирующая и разбавляющая исходный стоковый раствор испытуемого вещества (например, дозирующий насос, пропорциональный разбавитель и сатурационная система). Скорость потоков растворов и воды для разведения проверяют через определенные интервалы времени в ходе испытания, и они не должны изменяться более чем на 10% в течение всего испытания. Подходящая скорость потока составляет не менее пяти объемов испытательных камер за 24 ч [4]. Не используют пластиковые трубки или другие материалы, содержащие биологически активные химические вещества или вещества, адсорбирующие испытуемое вещество.
6.6.2 Стоковый раствор предпочтительно готовят без использования растворителей простым смешиванием или перемешиванием испытуемого вещества в воде для разведения с помощью механических средств (например, встряхиванием или ультразвуком). Если испытуемое вещество трудно растворимо в воде, то используют процедуры, описанные в Руководстве ОЭСР по работе с веществами, с которыми трудно проводить манипуляции [38]. Предпочтительно растворитель не используют, но в некоторых случаях он применяется для получения достаточно концентрированного стокового раствора. Примеры подходящих растворителей приведены в ссылке [38].
6.6.3 Следует избегать полустатических условий испытаний, если только на то не имеются веские причины, связанные с испытуемым веществом (например, его стабильностью, ограниченной доступностью, высокой стоимостью или опасностью при применении). Для полустатического метода выполняют две различные процедуры восстановления. В первом случае новые испытуемые растворы готовят в чистых камерах, и выжившие яйца и личинки осторожно переносят в новые камеры, во втором тестовые организмы остаются в испытательных камерах, а часть (не менее двух третей) испытуемой воды меняется ежедневно.
7 Проведение испытания
7.1 Условия воздействия
7.1.1 Сбор яиц и продолжительность
Для предупреждения генетического смещения яйца собирают минимум от трех пар или групп, предназначенных для разведения, смешивают и произвольно отбирают для начала испытания. Описание искусственного оплодотворения для трехиглой колюшки приведено в приложении Л. Испытание начинают как можно раньше после оплодотворения яиц, предпочтительно эмбрионы погружают в испытуемые растворы, прежде чем начнется расщепление бластодиска, или сразу же после этой стадии и не позднее 12 ч после оплодотворения. Испытание продолжается до завершения половой дифференциации в контрольной группе (60 сут после вылупления для японской оризии, трехиглой колюшки и данио-рерио).
7.1.2 Загрузка
В начале испытания число оплодотворенных яиц должно составлять не менее 120 на каждую концентрацию, которые разделяют между не менее четырьмя повторностями (для контроля принято распределение квадратный корень). Яйца произвольно распределяют (с помощью статистических таблиц для рандомизации) между обработками. Уровень загрузки должен быть достаточно низким для поддержания концентрации растворенного кислорода на уровне не менее 60% ASV без прямой аэрации камер. Для испытаний в проточных условиях рекомендуемый уровень загрузки составляет не более 0,5 г/л за 24 ч и не более 5 г/л раствора в любое время. Не позднее 28 сут после оплодотворения имеющееся количество рыбы в повторностях перераспределяют таким образом, чтобы по возможности в каждой повторности находилось равное количество рыбы. Если при воздействии испытуемого химического вещества имеет место гибель рыбы, то количество повторностей сокращают таким образом, чтобы по возможности плотность рыбы поддерживалась равной для отдельных концентраций.
7.1.3 Свет и температура
Световой период и температура воды должны соответствовать содержанию тестовых видов. Условия для FSDT приведены в приложении А.
7.1.4 Кормление
Корм и кормление являются критическими факторами, и очень важно, чтобы необходимое количество корма обеспечивалось для каждой стадии в соответствующие интервалы времени и на уровне, достаточном для поддержания нормального роста. Рыб кормят вволю с небольшим избытком. Для получения достаточной скорости роста рыбу кормят не менее двух раз в день (допускается один раз в день по выходным) с интервалом не менее трех часов между каждым кормлением. Излишки корма и фекалии удаляют по мере необходимости для предупреждения накопления отходов и выделений. Корма и режимы кормления постоянно корректируются по мере накопления опыта для улучшения выживаемости и оптимизации роста. Следовательно, должна быть проведена предварительная работа для подтверждения предлагаемого режима кормления признанными экспертами в этой области. Кормление прекращают за 24 ч до окончания испытания. Примеры соответствующего корма перечислены в приложении А и [39].
7.2 Испытуемые концентрации
7.2.1 Испытуемые вещества размещают согласно приложению В. Минимум три испытуемые концентрации используют не менее чем в четырех повторностях. При выборе диапазона испытуемых концентраций учитывают результаты острого опыта, в частности, кривую зависимости LC от периода воздействия. Если результаты будут использоваться для оценки риска, то рекомендуется пять испытуемых концентраций.
7.2.2 Не следует тестировать концентрации химических веществ, на 10% превышающие LC, установленную в опыте для взрослых особей, или менее 10 мг/л. Максимальная испытуемая концентрация должна составлять 10% значения LC
для особей, находящихся на личиночной/неполовозрелой стадии развития.
7.3 Контроль
7.3.1 Дополнительно к испытуемым концентрациям ставят контроль на воду для разведения (не менее четырех повторностей) и при необходимости контроль на растворитель (не менее четырех повторностей). В испытании используют только проверенные растворители для исключения статистически значимого влияния на параметры испытания.
7.3.2 Если используется растворитель, то его конечная концентрация не должна превышать 0,1 мл/л [38], и она должна быть одинаковой во всех испытательных камерах, за исключением контроля на воду для разведения. Однако по возможности такой растворитель не используют или используют его в минимальной концентрации.
7.4 Периодичность аналитических определений и измерений
7.4.1 Химический анализ концентраций испытуемого вещества проводят до начала испытания для проверки соответствия критериям приемлемости. Все повторности анализируют по отдельности в начале и конце испытания. Во время испытания одна повторность на каждую испытуемую концентрацию анализируется не менее одного раза в неделю, изменяясь систематически между повторностями (1, 2, 3, 4, 1, 2,...). Если пробы оставляют для анализа на более позднее время, то способ хранения проб должен быть предварительно валидирован. Пробы фильтруют (например, с использованием фильтра с размером пор 0,45 мкм) или центрифугируют для гарантии того, что анализ выполняется на истинном растворе химического вещества.
7.4.2 В ходе испытания во всех испытательных камерах измеряют такие показатели, как содержание растворенного кислорода, рН, общую жесткость, проводимость, соленость (при необходимости) и температуру. Один раз в неделю измеряют как минимум содержание растворенного кислорода, соленость (при необходимости) и температуру, в то время как рН, проводимость и жесткость - в начале и конце испытания. Температуру желательно контролировать постоянно как минимум в одной испытательной камере.
7.4.3 Результаты должны основываться на измеренных концентрациях. Однако если концентрация испытуемого вещества в ходе всего испытания в растворе сохранялась на удовлетворительном уровне, например в пределах ±20% номинальной концентрации, то результаты могут основываться на номинальных или на измеренных значениях концентрации испытуемого вещества.
7.5 Наблюдения и измерения
7.5.1 Стадия эмбрионального развития
Воздействие начинают сразу же после оплодотворения до расщепления бластодиска и не позднее 12 ч после оплодотворения для того, чтобы охватить стадии раннего эмбрионального развития.
7.5.2 Вылупление и выживаемость
Наблюдения за вылуплением и выживаемостью проводят не менее одного раза в сутки, и данные регистрируют. Мертвые эмбрионы, личинки и молоди рыбы удаляют сразу же при обнаружении, поскольку они быстро разлагаются и оказывают негативное действие на других рыб. Особую осторожность следует соблюдать при удалении мертвых особей, чтобы не ударить и физически не повредить прилегающие к ним яйца/личинки, которые являются очень хрупкими и чувствительными ко всякому воздействию. Критерии гибели различаются в зависимости от стадии развития:
- для яиц, особенно на ранних стадиях, имеет место потеря прозрачности и изменение окраски, вызванные свертыванием и/или осаждением белка, что приводит к появлению белого матового внешнего вида;
- для личинок и молоди рыб неподвижность и/или отсутствие дыхательных движений, и/или отсутствие сердечных сокращений, и/или белая матовая окраска центральной нервной системы, и/или отсутствие реакции на механические раздражители.
7.5.3 Аномальный внешний вид
Регистрируют количество личинок или рыб с аномальной формой тела и описывают внешний вид и характер аномалий. Необходимо отметить, что аномальные эмбрионы и личинки встречаются и в норме, и для некоторых видов могут составлять порядка нескольких процентов в контроле(ях). Аномальных особей удаляют из испытательных камер только в случае гибели. Однако это может противоречить некоторым принятым локальным правилам, и если отмечаются значительные страдания (суверенностью можно прогнозировать очень тяжелый и летальный исход), то рыбу подвергают анестезии и эвтаназии согласно 5.6.1 и учитывают как гибель при анализе данных.
7.5.4 Аномальное поведение
По внешнему виду регистрируют аномалии, например гипервентиляцию, нескоординированное плавание, аномальную неподвижность и атипичное пищевое поведение.
7.5.5 Масса
В конце испытания всех выживших рыб подвергают эвтаназии (анестезию проводят при отборе пробы крови) и измеряют индивидуальную массу тела (после промакивания насухо).
7.5.6 Длина
7.5.6.1 В конце испытания измеряют длину тела у отдельных рыб (стандартную длину).
7.5.6.2 Результаты указанных измерений являются основой части или всех следующих данных, приводимых в отчете:
- общая гибель;
- число здоровой рыбы в конце испытания;
- время начала и окончания вылупления;
- длина и масса выживших особей;
- число деформированных личинок;
- число рыб, проявляющих аномальное поведение.
7.6 Отбор рыбы
Отбор рыбы проводят в конце испытания. Отобранную рыбу подвергают эвтаназии, например с использованием MS-222 (100-500 мг на 1 л, забуференном 200 мг NaHCO на л) или FA-100 (4-аллил-2-метоксифенол: эвгенол), и измеряют сырую массу каждой рыбы (после промакивания насухо) или проводят анестезию, если требуется отобрать пробы крови (см. 7.7.2.3).
7.7 Отбор проб для анализа VTG и определения пола с помощью гистологического исследования
7.7.1 Всю рыбу отбирают и подготавливают для определения пола и VTG. Для определения пола проводят гистологический анализ всей рыбы. Для измерения VTG берут подгруппу не менее из 16 рыб из каждой повторности. Если полученные результаты по подгруппе являются неопределенными, то анализ VTG проводят на большем количестве рыбы.
7.7.2 Процедура отбора проб для анализа VTG и определения попа зависит от метода анализа VTG.
7.7.2.1 Метод с гомогенатом головного/хвостового концов для анализа VTG
Рыбу подвергают эвтаназии. Голову и хвост каждой рыбы отделяют от тела срезами, сделанными непосредственно сзади грудных плавников и непосредственно сзади спинного плавника, с помощью скальпеля (см. рисунок 1). Головную и хвостовую часть от каждой рыбы объединяют, взвешивают, индивидуально нумеруют, замораживают в жидком азоте и хранят для анализа на VTG при температуре -70°С или ниже. Часть туловища рыбы нумеруют и фиксируют в соответствующем фиксаторе для последующего гистологического анализа [27]. С использованием данного метода анализа VTG и гистопатологии оценивают каждую особь, и, таким образом, возможное изменение уровня VTG может быть связано с фенотипическим полом рыбы или генетическим полом рыбы (японской оризии и трехиглой колюшки). Дополнительная информация приведена в приложениях Г и Д.
|
Рисунок 1 - Способ приготовления срезов рыбы для измерения VTG в гомогенате головного/хвостового концов и гистологической оценки средней части
7.7.2.2 Метод с гомогенатом печени для анализа VTG
Рыбу подвергают эвтаназии. Печень извлекают и хранят при -70°С или ниже. Рекомендуемые процедуры для извлечения печени и предварительной обработки приведены в TG 229 [40] или 230 [41]. Затем печень от каждой рыбы гомогенизируют по отдельности, как описано в TG 229 и 230. Собранную надосадочную жидкость используют для измерения VTG с использованием ELISA (см. для примера количественной оценки приложение Д для данио-рерио или TG 229 для японской оризии). Следуя данному подходу, также можно иметь соответствующие данные по каждой рыбе как по VTG, так и гистологии гонад.
7.7.2.3 Метод с плазмой крови для анализа VTG
Отбирают кровь от анестезированной рыбы сердечной пункцией, срезом хвостовой вены или хвоста, и центрифугируют при температуре 4°С для получения плазмы. До использования плазму хранят при температуре -70°С или ниже. Всю рыбу подвергают эвтаназии и фиксируют для гистологического исследования. Для соответствия VTG с полом рыбы пробы плазмы крови и рыбы нумеруют по отдельности.
7.7.2.4 Определение генетического пола
Биологическую пробу для определения генетического пола отбирают индивидуально от каждой рыбы, имеющей соответствующий видовой маркер. У японской оризии отбирают анальный или спинной плавник. В приложении И приведено подробное описание, включая отбор проб тканей и определение пола с помощью PCR-метода. Аналогично для трехиглой колюшки в приложении К приведено описание отбора проб ткани и определение пола PCR-методом.
7.8 Измерение VTG
Измерение VTG должно основываться на количественно и аналитически валидированном методе. Должна быть представлена информация по внутрилабораторной и межлабораторной вариабельности метода, используемого в данной лаборатории. Причиной меж- и внутрилабораторной вариабельности (вероятнее всего) являются различные стадии развития в популяции рыб. С учетом вариабельности определения VTG значения NOEC, основанные только на одной конечной точке, следует интерпретировать с большой осторожностью. Имеются различные аналитические методы оценки синтеза VTG на видах рыб, используемых в настоящем методе. Относительно чувствительной и специфичной методикой проведения измерения является определение концентрации белка с помощью иммуноферментного твердофазного анализа (ELISA). Следует использовать гомологичные антитела (продуцированные на VTG у рыбы того же вида) и наиболее широко применяемые гомологичные стандарты.
7.9 Определение пола
7.9.1 В зависимости от процедуры отбора проб для анализа VTG целую рыбу или оставшуюся среднюю часть каждой рыбы помещают в предварительно промаркированные кассеты для гистологической проводки и фиксируют в соответствующем фиксаторе для гистологического определения пола (при необходимости также для определения стадии гонад). Руководство по фиксации и заливке приведено в приложении Е, а также в руководстве ОЭСР по диагностике гистопатологии гонад рыб, связанной с эндокринной системой [27]. После проводки образцы рыбы заливают в парафиновые блоки. Образцы располагают в продольном направлении в парафиновом блоке. Делают не менее шести продольных срезов (толщиной 3-5 мкм) во фронтальной плоскости, включая ткань гонад из обеих гонад от каждой особи. Интервал между этими срезами должен составлять примерно 50 мкм для самцов и 250 мкм для самок. Однако поскольку каждый блок будет часто включать и самцов и самок (если более одной особи залито в каждый блок), то интервал между срезами в этих блоках должен равняться примерно 50 мкм до тех пор, пока не будет получено не менее шести срезов гонад от каждого самца. После этого интервал между срезами можно увеличить приблизительно до 250 мкм для самок. Срезы окрашивают гематоксилином и эозином и исследуют с помощью световой микроскопии, обращая особое внимание на пол (самец, самка, гермафродит или недифференцированные). Гермафродит определяется по наличию более чем одного ооцита в семеннике на шесть проанализированных срезов или сперматогенных клеток (да/нет) в яичниках. Гистопатология и определение стадии яичника и семенника не являются обязательными, но если такие исследования проводятся, то результаты подвергают статистическому анализу и регистрируют. Следует отметить, что у некоторых видов рыб в норме отсутствует полностью развившаяся пара гонад, и может присутствовать только одна гонада (например, у японской оризии, а иногда и у данио-рерио). Все такие наблюдения должны быть зарегистрированы.
7.9.2 Определение генетического пола у особей японской оризии основано на присутствии или отсутствии гена DMY, определяющего пол самцов, находящегося в Y-хромосоме. Генотипирование пола оризии проводят секвенированием гена DMY из ДНК, экстрагированной, например, из части анального или спинного плавника. Присутствие гена DMY указывает на особь XY (самец) независимо от фенотипа, а отсутствие DMY указывает на особь XX (самка) независимо от фенотипа [28]. Рекомендации по подготовке тканей и проведению PCR приведены в приложении И. Определение генетического пола у особей трехиглой колюшки также выполняют с помощью метода PCR, описанного в приложении К.
7.9.3 О наличии гермафродитов (см. раздел 2) указывают в отчете.
7.10 Вторичные половые признаки
Вторичные половые признаки находятся под контролем эндокринной системы у таких видов, как японская оризия, поэтому наблюдения за внешним видом рыбы, если это возможно, производят по окончании воздействия испытуемого вещества. У самок японской оризии папиллярные образования на задней части анального плавника являются андрогензависимыми признаками.
Соответствующие фотографии вторичных половых признаков у самцов и андрогенизированных самок приведены в [41].
8 Данные и отчет о проведении испытания
8.1 Обработка результатов
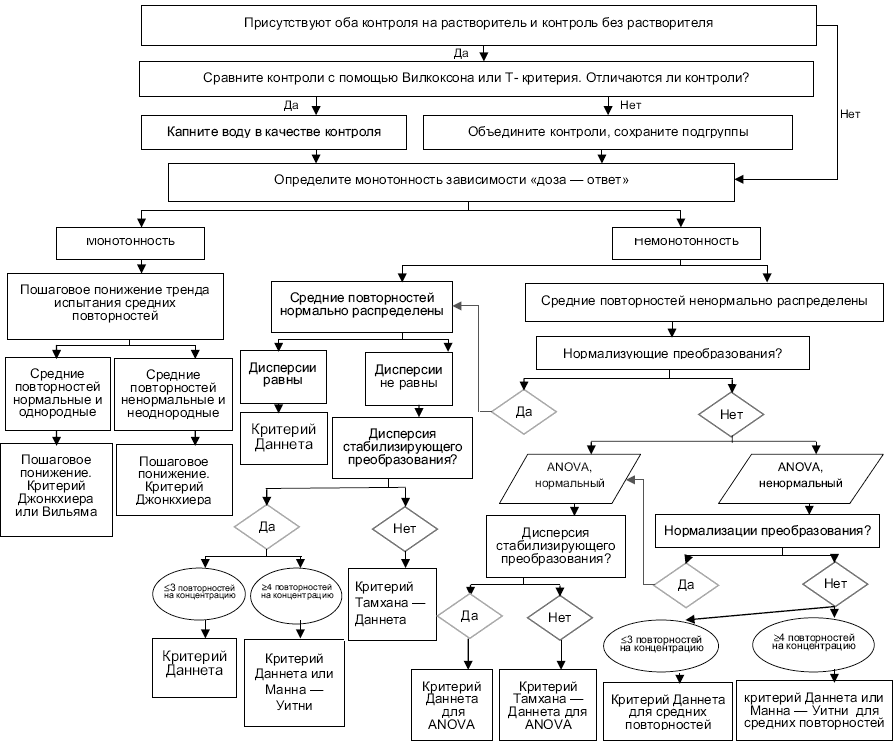
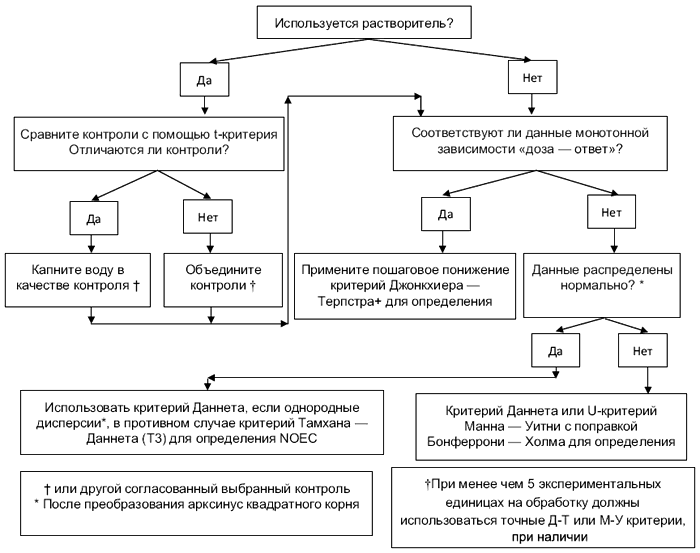
Важно, чтобы самый мощный обоснованный статистический критерий определял конечную точку. Повторность является экспериментальной единицей, но вариабельность внутри повторности включают в статистическую проверку. Блок-схема для принятия решения при определении наиболее подходящих статистических критериев при обработке характеристик полученных экспериментальных данных представлена в приложении Ж. Статистический уровень значимости составляет 0,05 для всех включенных конечных точек.
8.2 Соотношение полов и генетический пол
Если зависимость "доза-ответ" монотонна, то соотношения полов должны быть проанализированы на значимость от воздействия (NOEC/LOEC подход) с использованием критерия Джонкхиера-Терпстра (критерия тренда). Если выявлена немонотонность, то применяют метод парных сравнений. В случае если выявлены нормальность и однородность дисперсии, используют критерий Даннета. Если гетерогенность дисперсии не выявлена, то используют критерий Тамхана-Даннета. В противном случае используют точный критерий Манна-Уитни с поправкой Бонферрони-Холма. Блок-схемы, описывающие статистику соотношения полов, приведены в приложении Ж. Соотношения полов представляют в таблицах как отношение концентраций ±SD у самцов, самок, гермафродитов и недифференцированных. Должна быть выделена статистическая значимость. Примеры приведены в [2]. Генетический пол должен быть представлен как процент фенотипической трансформации пола самцов, самок, гермафродитов и недифференцированных.
8.3 Концентрации VTG
8.3.1 Концентрации VTG анализируют на предмет статистически значимого эффекта воздействия (NOEC/LOEC подход). Критерий Даннета более предпочтителен, чем t-критерий с поправкой Бонферрони. Если используется поправка Бонферони, то желательно пользоваться также поправкой Бонферони-Холма. Необходимо выполнить log-трансформацию значений VTG для достижения нормальности и однородности дисперсии. Далее, если подтверждается монотонность "концентрация-ответ", то критерий Джонкхиера-Терпстра предпочтительнее любого из вышеперечисленных. Если используются t-критерии или критерий Даннета, то отсутствует необходимость в использовании F-критерия ANOVA. Дополнительные сведения см. в блок-схеме в приложении Ж. Результаты представляют в таблице в виде средней концентрации ±SD для самцов, самок, гермафродитов и недифференцированных по отдельности. Должна быть выделена статистическая значимость для фенотипических самок и фенотипических самцов. Примеры приведены в [2].
8.3.2 Фактические концентрации испытуемого вещества
Фактические концентрации испытуемого вещества в камерах анализируют с периодичностью, указанной в 5.4.1. Результаты приводят в таблицах в виде средних концентраций ±SD для базовых значений повторностей, а также для базовых значений концентраций с информацией о количестве проб и с выпадающими значениями из средних концентраций обработки выделяют ±20%. Примеры приведены в [2].
8.4 Интерпретация результатов
Результаты испытаний интерпретируют с осторожностью, когда измеренные концентрации испытуемого вещества в испытуемых растворах находятся на уровнях, близких к пределу чувствительности аналитического метода.
8.5 Отчет о проведении испытания
Отчет о проведении испытания должен включать в себя следующую информацию:
8.5.1 Испытуемое вещество:
- соответствующие физико-химические свойства;
- химическая идентификация;
- данные, включающие чистоту и аналитический метод количественного определения испытуемого вещества.
8.5.2 Условия испытания:
- используемая методика испытаний (например, проточная полустатическая/восстанавливаемая);
- дизайн испытания, включая испытуемые концентрации, способ приготовления стоковых растворов (в приложении), периодичность восстановления (указывают солюбилизирующий агент и его концентрацию, при использовании);
- номинальные испытуемые концентрации, средние измеренные значения и их стандартные отклонения в испытательных камерах и метод, с помощью которого они были определены (используемый аналитический метод должен быть представлен в приложении). Доказательства того, что измерения относятся к концентрации испытуемого вещества в истинном растворе;
- качество воды в испытательных камерах: рН, жесткость, температура и концентрация растворенного кислорода;
- подробная информация о кормлении (например, тип корма, источник, скармливаемое количество и периодичность кормления, результаты анализа на примеси (например, ПХД, ПАУ и хлорорганических пестицидов), при необходимости.
8.5.3 Результаты:
- доказательства того, что контроль соответствовал критериям валидации: данные по скорости вылупления представляют в таблицах в виде процентов на каждую повторность и на каждую концентрацию. Отмечают выпадающие значения из критериев приемлемости (при проведении контроля);
- выживаемость представляют в виде процентов на каждую повторность и на каждую концентрацию. Отмечают выпадающие значения из критериев достоверности (при проведении контроля);
- четкое указание результатов, полученных на различных наблюдаемых конечных точках: выживаемость эмбрионов и успешное вылупление, внешние аномалии; длина и масса; измерения VTG (нг/г гомогената, нг/мл плазмы или нг/мг печени); данные по гистологии гонад, соотношение полов, генетический пол; случаи любых необычных реакций со стороны рыбы и каких-либо видимых эффектов, вызванных испытуемым веществом.
8.5.4 Результаты представляют в виде средних значений ± стандартное отклонение (SD) или стандартная ошибка (SE). Статистику указывают как минимум в виде NOEC и LOEC и доверительных интервалов. Руководствуются статистической блок-схемой (приложение Ж).
Приложение А
(рекомендуемое)
Экспериментальные условия для FSDT (пресноводные виды)
1 Рекомендуемые виды | Японская оризия (Oryzias latipes) | Данио-рерио (Danio rerio) | Трехиглая колюшка (Gasterosteus aculeatus) |
2 Тип испытаний | Проточный или полустатический | Проточный или полустатический | Проточный или полустатический |
3 Температура воды | (25±2)°С | (27±2)°С | (20±2)°С |
4 Качество освещения | Флуоресцентные лампы (широкий спектр) | Флуоресцентные лампы (широкий спектр) | Флуоресцентные лампы (широкий спектр) |
5 Интенсивность света | 10-20 мкЕ/М | 10-20 мкЕ/М | 10-20 мкЕ/М |
6 Световой период | 12-16 ч свет, | 12-16 ч свет, | 16 ч свет, |
7 Минимальный размер камеры | Отдельные камеры должны содержать минимальный объем, равный 7 л воды | Отдельные камеры должны содержать минимальный объем, равный 7 л воды | Отдельные камеры должны содержать минимальный объем, равный 7 л воды |
8 Объем для замены испытуемых растворов | Минимум 5 объемов ежедневно | Минимум 5 объемов ежедневно | Минимум 5 объемов ежедневно |
9 Возраст тестовых организмов в начале воздействия | Только что оплодотворенные яйцеклетки (стадия ранней бластулы) | Только что оплодотворенные яйцеклетки (стадия ранней бластулы) | Только что оплодотворенные яйцеклетки |
10 Число яиц в обработке | Минимум 120 | Минимум 120 | Минимум 120 |
11 Число обработок | Минимум 3 (плюс соответствующие контроли) | Минимум 3 (плюс соответствующие контроли) | Минимум 3 (плюс соответствующие контроли) |
12 Количество повторов на обработку | Минимум 4 (если распределение корень квадратный в контроли) | Минимум 4 (если распределение корень квадратный в контроли) | Минимум 4 (если распределение корень квадратный в контроли) |
13 Режим кормления | Живые артемии, замороженные взрослые солоноводные (морские) креветки, хлопьевидный корм и т.д. Рекомендуется кормить два раза в день | Специальный корм мальков, живые артемии, замороженные взрослые солоноводные (морские) креветки, хлопьевидный корм и т.д. Рекомендуется кормить два раза в день | Живые артемии, замороженные взрослые солоноводные (морские) креветки, хлопьевидный корм и т.д. Рекомендуется кормить два раза в день |
14 Аэрация | Не требуется, если концентрация DO не снижается ниже 60% насыщения | Не требуется, если концентрация DO не снижается ниже 60% насыщения | Не требуется, если концентрация DO не снижается ниже 70% насыщения |
15 Вода для разведения | Хорошая или восстановленная вода с чистой поверхностью | Хорошая или восстановленная вода с чистой поверхностью | Хорошая или восстановленная вода с чистой поверхностью |
16 Продолжительность воздействия испытуемым веществом | 60 сут после вылупления | 60 сут после вылупления | 60 сут после вылупления |
17 Биологические конечные точки | Результат вылупления, макроморфология выживших особей, VTG гистология гонад, генетический пол, соотношение полов | Результат вылупления макроморфология выживших особей, VTG гистология гонад, генетический пол, соотношение полов | Результат вылупления, макроморфология выживших особей, VTG гистология гонад, генетический пол, соотношение полов |
18 Критерии приемлемости испытания для объединенных повторностей контролей | Результат вылупления более 80%; | Результат вылупления более 80%; | Результат вылупления более 80%; |
Приложение Б
(рекомендуемое)
Химические характеристики приемлемой воды для разведения
Вещество | Концентрация |
Вещество в виде частиц, мг/л | менее 20 |
Общий органический углерод, мг/л | менее 2 |
Неионизированный аммиак, мкг/л | менее 1 |
Остаточный хлор, мкг/л | менее 10 |
Общее количество фосфорорганических пестицидов, нг/л | менее 50 |
Общее количество пестицидов хлорорганических плюс полихлорированные бифенилы, нг/л | менее 50 |
Общий органический хлор, нг/л | менее 25 |
Приложение В
(рекомендуемое)
Руководство по испытуемым концентрациям по TG 215
Количество концентраций от 100 до 10, или от 10 до 1* | ||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 |
100 | 100 | 100 | 100 | 100 | 100 | 100 |
32 | 46 | 56 | 63 | 68 | 72 | 75 |
10 | 22 | 32 | 40 | 46 | 52 | 56 |
3,2 | 10 | 18 | 25 | 32 | 37 | 42 |
1,0 | 4,6 | 10 | 16 | 22 | 27 | 32 |
2,2 | 5,6 | 10 | 15 | 19 | 24 | |
1,0 | 3,2 | 6,3 | 10 | 14 | 18 | |
1,8 | 4,0 | 7,2 | 10 | 13 | ||
1,0 | 2,5 | 5,2 | 7,2 | 10 | ||
1,6 | 3,7 | 5,2 | 7,5 | |||
1,0 | 2,7 | 3,7 | 5,6 | |||
1,9 | 2,7 | 4,2 | ||||
1,4 | 1,9 | 3,2 | ||||
1,0 | 1,4 | 2,4 | ||||
1,0 | 1,8 | |||||
1,3 | ||||||
1,0 | ||||||
* Серии из трех (или более) последовательных концентраций могут быть выбраны из соответствующей графы. Средние точки между концентрациями в графе (х) можно найти в графе (2х+1). Приведенные значения представляют концентрации, выраженные в процентах на единицу объема или массы (миллиграмм на л или микрограмм на л). Значения могут быть умножены или разделены на 10, где как подходит. Графа "1" может быть использована, если имеется значительная неопределенность по уровню токсичности. | ||||||
Приложение Г
(рекомендуемое)
Руководство по гомогенизации головной и хвостовой частей от неполовозрелых данио-рерио, черного толстоголова, трехиглой колюшки и японской оризии
Целью этого раздела является описание процедуры, выполняемой перед количественным определением концентрации VTG. Можно использовать другие процедуры, которые приводят к сопоставимой количественной оценке VTG. Настоящий вариант представляет возможный дизайн определения концентрации VTG в плазме крови или печени вместо гомогената головного и хвостового концов.
Процедура
1 Рыбу подвергают анестезии и эвтаназии согласно описанию испытания.
2 Отрезают голову и хвост от туловища рыбы согласно описанию испытания. В обязательном порядке следует промыть и очистить надлежащим образом все инструменты, используемые для препарирования, и разделочную доску (например, 96% этанолом) между обработкой каждой отдельной рыбы, чтобы предотвратить "загрязнение проб VTG" от самок или от индуцированных самцов к неиндуцированным самцам.
3 Определяют массу объединенных головной и хвостовой частей от каждой рыбы с точностью до мг.
4 После взвешивания образцы помещают в соответствующие пробирки (например, пробирки Эппендорфа емкостью 1,5 мл) и замораживают при температуре -80°С перед гомогенизацией или сразу же гомогенизируют на льду с использованием двух пластиковых пестиков. (Могут быть использованы другие методы, если они выполняются на льду и в результате получается гомогенная масса.) В обязательном порядке пробирки должны быть пронумерованы надлежащим образом так, чтобы головная и хвостовая часть рыбы соответствовала их отсеченному туловищу, которое будет использоваться для гистологии гонад.
5 Когда гомогенная масса достигает значения, в 4-10 раз превышающего массу ткани, то добавляют буфер для гомогенизации* (обращают внимание на разведение). Продолжают проводить гомогенизацию пестиками, пока смесь не станет однородной.
________________
* Буфер гомогенизации:
50 мМ трис-HCI рН 7,4; 1% смесь ингибиторов протеаз (Sigma): 12 мл Трис-HCI рН 7,4 +120 мкл смеси ингибиторов протеаз (или эквивалентных смесей ингибиторов протеаз).
ТРИС: трис-ULTRA PURE (ультра чистый) (ICN).
Коктейль ингибиторов протеаз: от Sigma (для тканей млекопитающих). Номер товара (продукта) Р 8340.
Примечание - Буфер для гомогенизации следует использовать в день его приготовления. Во время использования буфер помещают на лед.
Примечание: Для каждой рыбы следует использовать отдельные пестики.
6 Пробы помещают на лед до центрифугирования, которое проводят при температуре 4°С с частотой вращения 50000 g в течение 30 мин.
7 С помощью пипетки порции от 20 до 50 мкл (отмечают количество) надосадочной жидкости вносят не менее чем в две пробирки путем погружения наконечника пипетки ниже жирового слоя на поверхности и осторожным всасыванием надосадочной жидкости без жира или фракции осадка.
8 Пробирки хранят при температуре -80°С до использования.
Приложение Д
(рекомендуемое)
Руководство для количественного определения вителлогенина в гомогенате головного и хвостового концов у данио-рерио
1 Микропланшеты (микротитрационные планшеты) (сертифицированные Maxisorp F96, Nunc, Roskilde Дания), предварительно покрытые 5 мкг/мл анти-липовителлин-lgG-антителами данио-рерио, размораживают и промывают три раза буфером для промывания*.
________________
* Буфер для промывания:
PBS-стоковый **** | 500,0 мл |
BSA | 5,0 г |
Твин | 20 5,0 мл |
рН доводят до 7,3, и доводят НO Millipore до 5 л. Хранят при температуре 4°С.
2 Готовят серийные разведения стандарта Battelle данио-рерио АР4.6.04 (1,18 мг/мл (AAA)) до 0,2; 0,5; 1; 2; 5; 10 и 20 нг/мл в буфере для разведения**, а пробы разводят по меньшей мере в 200 раз (для предотвращения влияния матрицы) в буфере для разведения и вносят в лунки планшетов. Лабораторный контроль применяют в двух повторностях. 150 мкл применяют в каждой ячейке. Стандарты используют в двух повторностях и пробы - в трех повторностях. Инкубируют в течение ночи при температуре 4°С на шейкере.
________________
** Буфер для разведения:
PBS-стоковый **** | 100,0 мл |
BSA | 3,0 г |
Твин | 20 1,0 мл |
рН доводят до 7,3, и доводят НO Millipore до 5 л. Хранят при температуре 4°С.
3 Планшеты промывают пять раз буфером для промывания.
4 HRP, конъюгированную с декстраном (например, AMDEX/S, Дания) и конъюгированные антитела разводят буфером для промывания***; фактическое разведение отличается в зависимости от партии и возраста. 150 мкл вносят в каждую лунку, и планшеты инкубируют в течение 1 ч при комнатной температуре на шейкере.
________________
*** ТМБ плюс является "готовым к использованию" субстратом производства KemEnTec (Дания). Он чувствителен к воздействию света. Хранят при температуре 4°С.
5 Планшеты промывают пять раз буфером для промывания, и дно планшета тщательно очищают этанолом.
6 150 мкл ТМБ плюс**** вносят в каждую лунку. Планшет покрывают от света фольгой и наблюдают за развитием цвета на шейкере.
________________
**** PBS-стоковый:
NaCI | 160,0 г |
КН | 4,0 г |
Na | 26,6 г |
KCI | 4,0 г |
рН доводят до 6,8, и доводят НO Millipore до 2 л. Хранят при комнатной температуре.
7 Если активность фермента полностью соответствует стандартной кривой, то реакцию останавливают добавлением 150 мкл 0,2М HSO
в каждую лунку.
8 Поглощение измеряют при 450 нм (например, на ридере для планшетов Molecular Devices Thermomax). Данные анализируют с помощью соответствующего программного обеспечения (например, SOFTmax).
Приложение Е
(рекомендуемое)
Руководство по подготовке тканевых срезов для определения пола и стадии гонад
Целью этого раздела является описание процедуры, проводимой перед оценкой гистологических срезов. Могут быть использованы другие процедуры, которые дают аналогичные результаты при определении пола и стадии гонад. За некоторым исключением эти процедуры аналогичны для японской оризии (JMD) и данио-рерио (ZF).
Эвтаназия, вскрытие и фиксация тканей
Цели:
1 Рыбу подвергают эвтаназии гуманным способом.
2 Проводят определение массы тела и другие необходимые измерения.
3 Оценивают вторичные половые признаки.
4 Извлекают ткань для анализа VTG.
5 Фиксация ткани гонад.
Процедуры:
1 Рыбу умерщвляют непосредственно перед аутопсией. Если в испытании не участвует несколько патологоанатомов, то несколько рыб не должно умерщвляться одновременно.
2 Используя небольшой сачок, рыбу извлекают из экспериментальной камеры и переносят в транспортном контейнере в место проведения аутопсии.
3 Рыбу помещают в раствор для эвтаназии. Рыбу вынимают из раствора, когда происходит остановка дыхания и рыба не реагирует на внешние раздражители.
4 Рыбу взвешивают влажной.
5 Для приготовления тканей для проведения анализа VTG рыбу помещают на пробковую доску на подставке препаровальной лупы.
а) у данио-рерио голову отрезают непосредственно сзади грудного плавника, а хвост отрезают непосредственно сзади спинного плавника;
б) у японской оризии брюшину вскрывают с помощью тщательно сделанного разреза, проходящего по вентральной средней линии брюшины от грудного пояса до точки непосредственно к анусу. Используя небольшие щипцы и маленькие ножницы, осторожно извлекают печень.
6 Образцы для анализа VTG помещают в пробирки Эппендорфа и немедленно замораживают в жидком азоте.
7 Тушку, включающую гонады, помещают в предварительно маркированную пластиковую кассету для тканей, которую переносят в фиксатор Дэвидсона или Боуэна. Объем фиксатора должен не менее чем в 10 раз превышать объем ткани. Контейнер с фиксатором осторожно перемешивают в течение пяти секунд, чтобы удалить пузырьки воздуха из кассеты.
8 Все ткани оставляют в фиксаторе Дэвидсона на ночь, затем на следующий день их переносят в отдельные контейнеры с 10% нейтральным буферным раствором формалина. Контейнеры с кассетами осторожно перемешивают в течение 5 с для обеспечения адекватного проникновения формалина в кассеты.
в) Ткани остаются в фиксаторе Боуэна в течение 24 ч, а затем их переносят в 70%-ный этанол.
Обработка тканей
Цели:
Ткани обезвоживают для адекватного проникновения парафина;
Ткани пропитывают парафином для поддержания целостности тканей и получения прочной поверхности для приготовления гистологических срезов.
Процедуры:
1 Маркированные кассеты для тканей удаляют из смеси формалин/этанол, в которой они хранились, и кассеты помещают в корзину(ы) для проводки. Корзины для проводки загружают в гистопроцессор.
2 Выбирают график проводки образцов.
3 После завершения цикла проводки в гистопроцессоре корзину(ы) переносят на станцию парафиновой заливки.
Заливка
Цель:
Правильно расположить образец в затвердевшем парафине для приготовления гистологических срезов.
Процедуры:
1 Корзину(ы) с кассетой извлекают из процессора и погружают в заполненную парафином переднюю камеру термоконсоли станции парафиновой заливки, или кассеты переносят в отдельный парафиновый нагреватель.
2 Первую кассету, предназначенную для заливки, извлекают из передней камеры термоконсоли или парафинового нагревателя. Крышку кассеты снимают и отбрасывают, а маркировку кассеты проверяют на соответствие по каждой рыбе для предупреждения возможных расхождений до заливки.
3 Выбирают форму для заливки соответствующего размера.
4 Форму держат перед носиком дозирующей консоли и заполняют расплавленным парафином.
5 Образец извлекают из кассеты и помещают в расплавленный парафин в форме. Такую процедуру повторяют с 4-8 образцами для каждой формы для заливки парафином. Положение каждой рыбы отмечают расположением рыбы N 1 на 180° по отношению к рыбам 2 - 4/8.
6 Добавляют дополнительное количество парафина для покрытия образца.
7 Форму с кассетами помещают на охлаждающую пластину криоконсоли.
8 После затвердевания парафина блок (т.е. затвердевший парафин, содержащий ткани и кассеты) извлекают из формы.
Приготовление гистологических срезов
Цель:
Сделать и приготовить гистологические срезы для окрашивания
Процедуры:
1 Начальную фазу микротомии называют "облицовкой" и проводят следующим образом:
а) парафиновый блок устанавливают в патрон микротома;
б) патрон продвигают вращением колеса микротома, и толстые срезы вырезают с парафиновой поверхности блока до тех пор, нож не достигнет залитых тканей;
в) толщину среза на микротоме устанавливают между 3-5 мкм. Патрон продвигают и делают многочисленные срезы с блока для удаления любых артефактов, появившихся на поверхности среза ткани во время грубой обрезки;
г) блок удаляют из патрона и помещают лицевой стороной на лед для замачивания тканей.
2 Следующим этапом микротомии является окончательное приготовление срезов и помещение срезов ткани на предметные стекла. Данные процедуры проводят следующим образом:
а) если блок был помещен на лед, то блок удаляют со льда и помещают в патрон микротома;
б) устанавливают толщину срезов на микротоме в 3-5 мкм, патрон продвигают вращением колеса микротома, срезы срезают с блока, пока не получена "лента", содержащая не менее одного приемлемого среза, включающего гонады. (При необходимости в процессе приготовления срезов блок удаляют из патрона, помещают на лед для замачивания тканей и заменяют в патроне);
в) срезы помещают на плоскую поверхность воды в водяной бане. Предпринимают попытку получить хотя бы, один срез, не содержащий неровностей и пузырьков воздуха под ним;
г) на предметное стекло микроскопа помещают наилучший срез, который поднимают из воды, используя стекло. Этот процесс называется "фиксацией" среза на стекле;
д) готовят три среза для ряда рыб. Второй и третий срезы отбирют с интервалом в 50 мкм от первого среза. Если рыбы не залиты с их гонадами на том же самом уровне приготовления срезов, то следует приготовить еще несколько срезов для получения не менее шести срезов, включающих гонады, полученные из каждой рыбы;
е) маркером для стекол наносят номер блока, из которого было получено стекло;
ж) стекло помещают в подставку для окрашивания;
и) блок удаляют из патрона и помещают лицевой стороной вниз на хранение.
Окрашивание, покрытие покровным стеклом и маркировка стекол
Цели:
1 Срезы окрашивают для гистологического исследования.
2 Герметично закрывают подготовленные и окрашенные ткани.
3 Идентифицируют окрашенные срезы способом, обеспечивающим полную прослеживаемость образцов, на длительный период времени.
Процедуры:
1 Окрашивание:
а) стекла высушивают на воздухе перед окрашиванием;
б) срезы окрашивают гематоксилин-эозином.
2 Покрытие покровным стеклом:
а) покровные стекла можно наносить вручную или автоматически;
б) стекло погружают в ксилол или TissueClear, и избыток ксилола/TissueClear осторожно удаляют со стекла;
в) приблизительно 0,1 мл фиксирующей среды наносят ближе к концу стекла, противоположному замороженному концу или на покровное стекло;
г) покровное стекло наклоняют под небольшим углом при нанесении на предметное стекло.
3 Маркировка:
а) маркировка каждого стекла должна содержать следующую информацию:
- наименование лаборатории;
- виды;
- образец N/Стекло N;
- химическое вещество/обработанная группа;
- дата.
Приложение Ж
(рекомендуемое)
Статистическая блок-схема для анализа вителлогенина
|
Приложение И
(рекомендуемое)
Статистическая блок-схема для анализа соотношения полов
|
Приложение К
(рекомендуемое)
Руководство по отбору проб тканей для определения генетического пола и для определения генетического пола с помощью PCR-метода
Отбор проб тканей, подготовка и хранение перед определением генетического пола с помощью PCR у оризии (подготовлено Лабораторией водных организмов из Bayer CropScience AG)
1 Анальный или спинной плавник срезают тонкими ножницами у каждой отдельной рыбы и помещают в пробирку, заполненную 100 мкл буфера для экстракции 1 (подробнее о подготовке буфера см. ниже). Ножницы хорошо очищают после обработки каждой рыбы в химическом стакане с дистиллированной НO и высушивают бумажной салфеткой.
2 Затем ткани плавника гомогенизируют с помощью тефлонового пестика в микропробирке для лизиса клеток. Для каждой пробирки используют новый пестик для предупреждения любого загрязнения. Пестики помещают на ночь в 0,5М NaOH, промывают в течение 5 мин в дистиллированной НO и хранят до использования в этаноле или стерильными после автокпавирования.
3 Также ткани плавника можно хранить без буфера для экстракции 1 на сухом льду и затем при температуре -80°С в холодильнике для предупреждения разрушения ДНК. Но экстракция проходит лучше, если одновременно экстрагируют ДНК (обработка см. выше; образцы оттаивают на льду после хранения при температуре -80°С до заполнения пробирок буфером).
4 После гомогенизации все пробирки помещают на водяную баню и кипятят в течение 15 мин при температуре 100°С.
5 Затем 100 мкл буфера для экстракции 2 (подробнее о подготовке буфера см. ниже) вносят пипеткой в каждую пробирку. Образцы хранят при комнатной температуре в течение 15 мин и периодически осторожно встряхивают рукой.
6 После этого все пробирки помещают на водяную баню и снова кипятят в течение еще 15 мин при температуре 100°С.
7 Пробирки замораживают при температуре -20°С до следующего анализа.
Приготовление буфера:
1 PCR-буфер 1:
а) 500 мг N-лауроилсаркозина (например, Merck KGaA, Darmstadt, GE);
б)2 мл 5M NaCI;
в) до 100 мл дистиллированной НO.
Затем автоклавируют.
2 PCR-буфер 2:
а) 20 г Килекса (например Biorad, Munich, GE);
б) Дают набухнуть в 100 мл дистиллированной НO.
Затем автоклавируют.
Определение генетического пола (с использованием PCR) у оризии (подготовлено Лабораторией водных организмов из Bayer CropScience AG и ![]()
![]() Biozentrum)
Biozentrum)
Подготовленные и замороженные пробирки (описанные в предыдущем разделе) оттаивают на льду. После этого их центрифугируют с использованием центрифуги Эппендорфа (30 с при максимальной скорости, при комнатной температуре). Для PCR используют прозрачную надосадочную жидкость, отделенную от осадка. Необходимо полностью избегать переноса следов Килекса (находящихся в осадке) в PCR-реакцию, поскольку это будет оказывать отрицательное влияние на активность полимеразы Taq. Надосадочную жидкость используют сразу же или хранят в замороженном виде (при минус 20°С), и затем повторно оттаивают в несколько циклов без негативного воздействия на ДНК для последующих анализов.
1 Приготовление "реакционной смеси" (25 мкл на пробу):
Объем | Конечная концентрация | ||
ДНК-матрица 0,5 мкл - 2 мкл | |||
10хПЦР-буфер с MgCI | 2,5 мкл | 1х | |
Нуклеотиды (каждый из дАТФ, дЦТФ, дГТФ, дТТФ) | 4 мкл (5 мМ) 200 мкМ | ||
Прямой праймер (10 мкМ) (см. пункты 3-5) | 0,5 мкл | 200 нм | |
Обратный праймер (10 мкМ) (см. пункты 3-5) | 0,5 мкл | 200 нм | |
ДМСО 1,25 мкл 5% | |||
Вода (ПЦР класс) | до 25 мкл | ||
Taq Е-полимераза | 0,3 мкл | 1,5 Ед. | |
10хПЦР-буфер с MgCI | 670 мм Трис/HCI (рН 8,8 при 25°С), | ||
160 мМ (NH | |||
25 мМ MgCI | |||
Для каждой реакции PCR (см. пункты 3-5) требуется специальный праймер в качестве новой комбинации типа "реакционной смеси" и адекватное необходимое количество ДНК-матрицы для каждого образца (см. выше). Соответствующие объемы переносят в новые пробирки с помощью пипетки. После этого все пробирки закрывают, перемешивают (приблизительно 10 с) и центрифугируют (10 с при комнатной температуре). Затем запускают соответствующие PCR-программы. Кроме того, помимо опытных образцов в каждой PCR-программе используют положительный контроль (стандартный образец ДНК (контрольная ДНК-матрица) с известной активностью и четкими результатами) и отрицательный контроль (1 мкл дистиллированной НO).
2 Подготовка агарозного геля (1%) во время цикла PCR-программы:
- раствор кипятят в микроволновой печи (приблизительно 2-3 мин);
- горячий раствор переносят в специальную камеру для горизонтального электрофореза, находящуюся на льду;
- примерно через 20 мин гель агарозы готов к применению;
- агарозный гель в 1хТАЕ-буфере хранят до окончания PCR-программы.
3 PCR-программа для актина
Данная PCR-реакция предназначена для демонстрации того, что ДНК в пробе не повреждена.
- специальный праймер:
- "М действие 1 (верхний/ прямой)" ТТС AAC AGС ССТ GCC ATG ТА;
- "М действие 2 (нижний/обратный)" GCA GCT CAT AGC ТСТ ТСТ CCA GGG AG.
- Программа:
- 5 мин при 95°С;
- цикл (35 раз):
- денатурация 45 с при 95°С;
- отжиг 45 с при 56°С;
- элонгация 1 мин при 68°С;
- 15 мин при 68°С.
4 PCR-программа для генов Х- и Y-хромосом
Образцы с неповрежденной ДНК используют в данной PCR-программе для выявления Х- и Y-генов. ДНК самцов должна показать одну двойную полосу, а ДНК самок должна показать одну-единственную полосу (после окрашивания и гель-электрофореза). В данный анализ необходимо включить один положительный контроль для самцов (XY-образец) и один для самок (ХХ-образец).
- Специальный праймер:
- "PG 17,5" (верхний/прямой) CCG GGT GCC CAA GTG СТС CCG CTG;
- "PG 17,6" (нижний/обратный) GAT CGT ССС ТСС АСА GAG AAG AGA.
- Программа:
- 5 мин при 95°С.
- цикл (40 раз):
- денатурация 45 с при 95°С;
- отжиг 45 с при 55°С;
- элонгация 1 мин 30 с при 68°С;
- 15 мин при 68°С.
5 PCR-программа для гена Y-хромосомы в качестве "контроля" для PCR-программы для генов Х- и Y-хромосом:
Данная PCR-программа проверяет результаты "PCR-программы для генов Х- и Y-хромосом". "Образцы самцов" должны показывать одну полосу, а "образцы самок" не должны показывать какой-либо полосы (после окрашивания и гель-электрофореза).
- Специальный праймер:
- "DMTYa (верхний/прямой)" GGC CGG GTC ССС GGG TG;
- "DMTYd (нижний/обратный)" ТТТ GGG TGA ACT САС ATG G.
- Программа:
- 5 мин при 95°С.
- цикл (40 раз):
- денатурация 45 с при 95 °С;
- отжиг 45 с при 56°С;
- элонгация 1 мин при 68°С;
- 15 мин при 68°С.
6 Окрашивание образцов PCR:
- Окрашивающий раствор:
- 50% глицерин;
- 100 мМ ЭДТА;
- 1% SDS;
- 0,25% бромфеноловый синий;
- 0,25% ксиленцианол.
В каждую пробирку вносят пипеткой 1 мкл окрашивающего раствора.
7 Старт гель-электрофореза:
- приготовленный 1% агарозный гель переносят в камеру для гель-электрофореза, заполненную 1хТАЕ- буфером;
- 10-15 мкл каждого окрашенного образца для ПЦР вносят пипеткой в лунку агарозного геля;
- также 5-15 мкл "линейки" размером 1 т.п.н. (Invitrogen) вносят пипеткой в отдельную лунку;
- начинают электрофорез при 200 V;
- через 30-45 мин останавливают.
8 Идентификация полос:
- агарозный гель очищают в дистиллированной НO;
- затем агарозный гель переносят в раствор бромистого этидия на 15-30 мин;
- после этого картину агарозного геля просматривают в окне УФ-света. Наконец, образцы анализируют в сравнении с положительной контрольной полосой (или полосами) и "линейкой".
Приложение Л
(рекомендуемое)
Руководство по отбору проб тканей для определения генетического пола с использованием PCR у трехиглой колюшки
Отбор проб тканей и экстракция ДНК
ДНК экстрагируют с помощью различных промышленно доступных реактивов и ручных или автоматизированных систем экстракции. Протокол, используемый в лаборатории CEFAS Weymouth, описан ниже и добавлены альтернативные методы в случае необходимости.
1 Небольшой кусочек ткани (10-20 мг) из дорсолатеральной области (после удаления головы и хвоста для анализа VTG) срезают тонкими ножницами у каждой отдельной рыбы. Ткань вносят в пробирку или непосредственно помещают в жидкий азот (для хранения при температуре -80°С), или заливают 70%-ным этанолом (для транспортировки и последующего хранения при температуре 4°С). Ножницы очищают после каждой рыбы в 70%-ном этаноле, затем в дистиллированной воде и высушивают салфеткой.
2 Этанол (если присутствует) удаляют аспирацией, а ткань переваривают в течение ночи с использованием протеиназы К в 400 мкл буфера ATL (Qiagen). Апиквотную порцию перевара (200 мкл) переносят в 96-луночный S-блок (Qiagen) и ДНК экстрагируют в 96-луночном формате, используя автоматизированный аппарат Qiagen Universal BioRobot и набор реагентов Qlamp Investigator BioRobot. ДНК элюируют в воду с 50 мкл ДНКазы и несодержащую РНКазу. При использовании твердых тканей для извлечения ДНК (например, образцы позвоночника или грудного плавника) может быть необходима гомогенизация образца в лизирующем буфере с применением аппарата для лизирования тканей FastPrep или эквивалентной системы для разрушения ткани.
Альтернативно
а) Ткань переваривают в течение ночи с использованием протеиназы К в 400 мкл лизирующего буфера G2 (Qiagen) и ДНК экстрагируют из 200 мкл перевара с помощью набора для экстракции ДНК из тканей EZ-1 и автоматизированного аппарата для экстракции ДНК EZ-1 или с помощью мини-набора для экстракции ДНК из тканей. ДНК элюируют в объеме 50 мкл.
б) Ткани обрабатывают с использованием реагента DNAzol для экстракции ДНК. Вкратце, образцы тканей лизируют в 1 мл реагента DNAzol в течение 10 мин в пробирке для микроцентрифуги емкостью 1,5 мл и затем центрифугируют при 13000 об/мин в течение 5 мин для удаления всех твердых частиц. Затем лизированный образец переносят в новую пробирку для микроцентрифуги емкостью 1,5 мл, содержащую 500 мкл 100%-ного этанола для работ в молекулярной биологии, а затем центрифугируют при 13000 об/мин в течение 10 мин для осаждения ДНК. Этанол удаляют и замещают 400 мкл 70%-ного этанола для работ в молекулярной биологии, центрифугируют при 13000 об/мин в течение 5 мин и осадок ДНК растворяют в 50 мкл воды с молекулярной ДНКазой и несодержащей РНКазу. Вновь при использовании твердых тканей (например, грудного плавника) может потребоваться гомогенизация образца в лизирующем буфере с применением аппарата для лизирования тканей lyser FastPrep или эквивалентной системы для разрушения ткани перед экстракцией ДНК.
3 ДНК хранят при температуре -20°С до использования.
Примечание - Все манипуляции проводят в перчатках.
Анализ полимеразной цепной реакции (PCR)
Амплификацию проводят с использованием 2,5 мкл экстракта ДНК в объеме реакции 50 мкл с использованием праймеров для локуса Idh (как описано Peichel и др., 2004 Current Biology 1:1416-1424):
- прямой праймер 5' GGG ACG AGС AAG ATT TAT TGG 3';
- обратный праймер 5' TAT AGT TAG CCA GGA GAT GG 3'.
Существует множество поставщиков подходящих ПЦР реактивов. Метод, описанный ниже, в настоящее время используется в лаборатории Cefas Weymouth.
1 Приготовление "реакционной смеси" (50 мкл на образец):
- Реакционную смесь Mastermix готовят следующим образом. Ее можно приготовить заранее и хранить замороженной при температуре -20°С до использования. Готовят достаточное количество реакционной смеси Mastermix для отрицательного контроля (только вода для работ в молекулярной биологии).
Объем | Конечная концентрация | |
(стоковый концентрат)/образец | ||
Реакционный буфер 5xGoTaq | 10 мкл | 1х |
MgCI | 5 мкл (25 мм) | 2,5 мМ |
Нукпеотиды (дАТФ, дЦТФ, дГТФ, дТТФ) | 0,5 мкл (по 25 мМ каждого) | 250 мкМ каждого |
Прямой праймер | 0,5 мкл (0,1 нмоль/мкл) | 2,0 мкМ |
Обратный праймер | 0,5 мкл (0,1 моль/мкл) | 2,0 мкМ |
Вода для работ в молекулярной биологии | 30,75 мкл | |
GoTaq полимераза | 0,25 мкл | 1,25 Ед. |
- Вносят 47,5 мкл в маркированную тонкостенную пробирку для ПЦР вместимостью 0,5 мл.
- Добавляют 2,5 мкл очищенной ДНК в маркированную пробирку. Указанные манипуляции повторяют для всех образцов и отрицательных контролей.
- Покрывают 2 каплями минерального масла. Альтернативно используют амплификатор с подогреваемой крышкой.
- Крышки закрывают.
- Образцы денатурируют в амплификаторе Peltier РТС-225 при (94±2)°С в течение 5 мин с последующими 39 циклами при (94±2)°С в течение 1 мин, при (55±2)°С в течение 1 мин, при (72±2)°С в течение 1 мин, а окончательное наращение проводится при (72±2)°С в течение 10 мин.
2 Приготовление агарозного геля (2%-ного)
Традиционно продукты PCR разделяют на 20%-ном агарозном геле, содержащем бромистый этидий. Также могут быть использованы системы капиллярного электрофореза.
- Взвешивают 2 г агарозы в 100 мл 1хТАЕ-буфера.
- Нагревают в микроволновой печи (около 2-3 мин) для растворения агарозы.
- Добавляют 2 капли бромистого этидия до конечной концентрации 0,5 мкг/мл.
Горячий раствор переносят в устройство для заливки геля. Гелю дают возможность затвердеть.
3 Гель-электрофорез:
- агарозный гель переносят в камеру для электрофореза и погружают в 1хТАЕ-буфер;
- 20 мкл каждого образца вносят в отдельную лунку, добавляя маркер молекулярной массы (ДНК "линейка" 100 п.н., Promega) в запасную лунку;
- электрофорез проводят при 120 V в течение 30-45 мин.
4 Визуализация продуктов амплификации
Если бромистый этидий был включен в агарозный гель, как описано выше, то продукты ДНК визуализируют под источником УФ-света. Альтернативно агарозный гель окрашивают, покрывая гель разбавленным раствором бромистого этидия (0,5 мкг/мл в воде) в течение 30 мин перед визуализацией.
Приложение М
(рекомендуемое)
Руководство по процедуре искусственного оплодотворения для трехиглой колюшки
Целью этого раздела является описание процедуры получения оплодотворенных яйцеклеток трехиглой колюшки с учетом их использования в FSDT.
Процедуры
Получение сперматозоидов от самцов
1 Самца с хорошим окрасом из требуемой популяции подвергают эвтаназии.
2 Семенники извлекают с каждой стороны рыбы. Семенники обычно сильно пигментированы, представляют органы палочкообразной формы, которые хорошо видны на латеральной средней линии тела. Используют один из следующих методов:
а) с помощью пары тонких ножниц, начиная с клоаки, делают разрез длиной 1,0-1,5 см под углом примерно в 45°.
б) используя скальпель, делают небольшой разрез в боку рыбы немного сзади от таза и вентральнее боковых пластин.
3 Семенники извлекают с помощью тонких щипцов и помещают в чашку Петри.
4 Каждый семенник покрывают 100 мкл свежеприготовленного конечного раствора Хэнкса*.
________________
* Буферный солевой раствор Хэнкса (БСРХ)
БСРХ необходим для сохранения спермы, пока идет подготовка к оплодотворению. Важное примечание: хотя большинство необходимых исходных стоковых растворов может быть приготовлено заранее, стоковый раствор 5 и затем конечный раствор должен быть свежеприготовленным, т.е. готовится в день использования.
Стоковый раствор 1:
NaCI - | 8,00 г; |
KCI - | 0,40 г; |
дистиллированная вода - | 100 мл |
Стоковый раствор 2:
Na | 0,358 г; |
КН | 0,60 г; |
Дистиллированная вода - | 100 мл |
Стоковый раствор 3:
СаСl | 0,72 г; |
Дистиллированная вода - | 50 мл |
Стоковый раствор 4:
MgSO, 7HO - | 1,23 г; |
Дистиллированная вода - | 50 мл |
Стоковый раствор 5 (свежеприготовленный):
NaHCO | 0,35 г; |
Дистиллированная вода - | 10 мл |
Примечание - Если имеются в наличии некоторые из вышеуказанных солей, но с другим содержанием воды (т.е. 2HO вместо безводного), то их можно использовать, но сначала необходимо скорректировать массу с учетом молекулярной массы.
Для конечного раствора Хэнкса растворы объединяют в следующем порядке:
1 Стоковый раствор 1 | 1,0 мл |
2 Стоковый раствор 2 | 0,1 мл |
3 Стоковый раствор 3 | 0,1 мл |
4 Дистиллированная вода | 8,6 мл |
5 Стоковый раствор 4 | 0,1 мл |
6 Стоковый раствор 5 | 0,1 мл |
Перед использованием хорошо перемешивают.
5 Семенники мелко измельчают, используя лезвие бритвы или скальпель. Такая манипуляция приводит к освобождению спермы, и раствор Хэнкса становится молочного цвета.
6 Жидкость, содержащую сперму, вносят в пробирку, пытаясь исключить какие-либо фрагменты ткани семенников.
7 800 мкл конечного раствора Хэнкса добавляют в пробирку и хорошо перемешивают.
8 При необходимости самец может быть законсервирован фиксацией в 100%-ном этаноле или другом требуемом фиксаторе. Это имеет особое значение, если исследование определяет родительское происхождение потомков.
Оплодотворение
1 Крупных беременных самок идентифицируют из требуемой популяции, самки готовы к выдавливанию икры, только когда можно увидеть яйца, выступающие из клоаки. Готовые самки имеют характерную позу с "приподнятым головным концом".
2 Аккуратно проводят указательным пальцем или большим пальцем вниз к хвосту рыбы для стимуляции выделения яйцевого мешка в приготовленную чашку Петри. Повторяют с другой стороны и рыбу возвращают в резервуар.
3 Яйца распределяют (образуя монослой) с помощью тонкой кисточки. Важно подвергнуть воздействию сперматозоидов как можно больше яиц, поскольку максимизация площади поверхности яиц полезна.
Примечание - Яйца хранят влажными, положив влажную ткань вокруг них (важно чтобы яйца непосредственно не касались воды, поскольку это может преждевременно сделать твердым хорион, что предотвращает оплодотворение). Существует большой разброс в количестве яиц, которое может произвести каждая самка, но в среднем примерно 150 яиц можно легко получить от одной беременной самки.
4 25 мкл спермы в смеси Хэнкса равномерно распределяют по всей поверхности яиц с помощью кисточки. Яйца быстро затвердевают и меняют цвет (в течение одной минуты), как только начинается оплодотворение. Если расчетное число яиц составляет более 150, то процедуру повторяют. Аналогично, если яйца не затвердевают в течение минуты, то добавьте немного больше спермы.
Примечание - Добавление большего количества спермы необязательно улучшит показатель оплодотворения.
5 Яйца и сперма должны быть оставлены для взаимодействия не менее чем на 15 мин, а оплодотворенные яйца помещают в аквариумы, в которых проводится испытание, в течение 1,5 ч после оплодотворения.
6 Процедуру повторяют с использованием другой самки, пока не будет собрано необходимое количество яиц.
7 Отбирают несколько яиц из последней партии и фиксируют в 10%-ной уксусной кислоте.
Подсчет и распределение яиц в испытательные аквариумы
1 Яйца должны быть равномерно распределены между каждым уровнем обработки, чтобы избежать генетического смещения. Каждую партию оплодотворенных яиц разделяют на группы равного размера (на количество уровней обработки) с помощью тупого инструмента (например, широким лезвием энтомологических щипцов или бактериологической петлей). Если в испытании для каждой обработки имеется четыре повторности по 20 яиц каждая, то нужно распределить 80 яиц в аквариумы, в которых проводится испытание.
Примечание - Рекомендуется добавить еще 20% яиц (то есть 96 яиц в каждую обработку), пока есть гарантия того, что можно получить 100%-ный показатель оплодотворения.
2 Яйца колюшки очень подвержены грибковым инфекциям за пределами гнезда, которое охраняет самец. В связи с этим очень важна обработка всех яиц метиленовой синькой в течение первых 5 суток испытания. Стоковый раствор метиленовой синьки готовят в концентрации 1 мг/мл и добавляют в аквариумы, в которых проводится испытание, чтобы получить максимальную конечную концентрацию 2,125 мг/л.
Примечание - Колюшки не должны подвергаться воздействию метиленовой синьки, поскольку после вылупления успокаивающие системы должны быть свободны от метиленовой синьки на шестые сутки.
3 Яйца ежедневно проверяют и регистрируют мертвые или неоплодотворенные яйца.
Примечание - Пока они вылупляются, яйца никогда не должны находиться вне воды, даже на очень короткий период времени.
Приложение ДА
(справочное)
Сравнение структуры международного документа со структурой настоящего стандарта
Таблица ДА.1
Структура настоящего стандарта | Структура международного документа | |||
Раздел | Подраздел | Перечисления | Раздел | Перечисления |
Введение | 1, 2 | - | ||
1 | 1.1 | - | 11 | - |
1.2 | - | 9 | - | |
2 | - | - | 10 | - |
2.1 | - | Приложение 1 | - | |
2.2 | - | Приложение 1 | - | |
2.3 | - | Приложение 1 | - | |
2.4 | - | Приложение 1 | - | |
2.5 | - | Приложение 1 | - | |
2.6 | - | Приложение 1 | - | |
2.7 | - | Приложение 1 | - | |
2.8 | - | Приложение 1 | - | |
2.9 | - | Приложение 1 | - | |
2.10 | - | Приложение 1 | - | |
2.11 | - | Приложение 1 | - | |
2.12 | - | Приложение 1 | - | |
2.13 | - | Приложение 1 | - | |
2.14 | - | Приложение 1 | - | |
2.15 | - | Приложение 1 | - | |
2.16 | - | Приложение 1 | - | |
3 | 3.1 | - | 3 | - |
3.2 | - | 4 | - | |
3.3 | - | 5 | - | |
3.4 | - | 6 | - | |
3.5 | - | 7 | - | |
3.6 | - | 8 | - | |
4 | 4.1 | - | 12 | - |
4.2 | - | 13 | - | |
5 | 5.1 | - | 14 | - |
5.2 | - | 15 | - | |
5.3 | - | 16 | - | |
6 | 6.1 | - | 17 | - |
| 6.2 | - | 18 | - |
6.3 | - | 19 | - | |
6.4 | - | - | - | |
6.4.1 | - | 20 | - | |
6.4.2 | - | 21 | - | |
6.5 | - | 22 | - | |
6.6 | - | - | - | |
6.6.1 | - | 23 | - | |
6.6.2 | - | 24 | - | |
6.6.3 | - | 25 | - | |
7 | - | - | - | - |
7.1 | - | - | - | |
7.1.1 | - | 26 | - | |
7.1.2 | - | 27 | - | |
7.1.3 | - | 28 | - | |
7.1.4 | - | 29 | - | |
7.2 | - | - | - | |
7.2.1 | - | 30 | - | |
7.2.2 | - | 31 | - | |
7.3 | - | - | - | |
7.3.1 | - | 32 | - | |
7.3.2 | - | 33 | - | |
7.4 | - | - | - | |
7.4.1 | - | 34 | - | |
7.4.2 | - | 35 | - | |
7.4.3 | - | 36 | - | |
7.5 | - | - | - | |
7.5.1 | - | 37 | - | |
7.5.2 | - | 38 | - | |
7.5.3 | - | 39 | - | |
7.5.4 | - | 40 | - | |
7.5.5 | - | 41 | - | |
7.5.6 | - | - | - | |
7.5.6.1 | - | 42 | - | |
7.5.6.2 | - | 43 | - | |
7.6 | - | 44 | - | |
| 7.7 | - | - | - |
7.7.1 | - | 45 | - | |
7.7.2 | - | 46 | - | |
7.7.2.1 | - | 47 | - | |
7.7.2.2 | - | 48 | - | |
7.7.2.3 | - | 49 | - | |
7.7.2.4 | - | 50 | - | |
7.8 | - | 51 | - | |
7.9 | - | - | - | |
7.9.1 | - | 52 | - | |
7.9.2 | - | 53 | - | |
7.9.3 | - | 54 | - | |
7.10 | - | 55 | - | |
8 | 8.1 | - | 56 | - |
8.2 | - | 57 | - | |
8.3 | - | - | - | |
8.3.1 | - | 58 | - | |
8.3.2 | - | 59 | - | |
8.4 | - | 60 | - | |
8.5 | - | 61 | - | |
8.5.1 | - | 61 | - | |
8.5.2 | - | 61 | - | |
8.5.3 | - | 61 | - | |
8.5.4 | - | 62 | - | |
Приложение А | Приложение 2 | |||
Приложение Б | Приложение 3 | |||
Приложение В | Приложение 4 | |||
Приложение Г | Приложение 5 | |||
Приложение Д | Приложение 6 | |||
Приложение Е | Приложение 7 | |||
Приложение Ж | Приложение 8 | |||
Приложение И | Приложение 9 | |||
Приложение К | Приложение 10 | |||
Приложение Л | Приложение 11 | |||
Библиография | Литература | |||
Библиография
[1] | OECD (2011), Validation Report (Phase 1) for the Fish Sexual Development Test, Series on Testing and Assessment No 141, ENV/JM/MONO(2011)22, OECD, Paris |
[2] | OECD (2011), Validation Report (Phase 2) for the Fish Sexual Development Test, Series on Testing and Assessment No 142, ENV/JM/MONO(2011)23, OECD, Paris |
[3] | OECD (2011), Peer Review Report of the validation of the Fish Sexual Development Test, Series on Testing and Assessment No 143, ENV/JM/MONO(2011)24, OECD, Paris |
[4] | OECD (1992), Fish, Early Life Stage Toxicity Test, Test Guideline No.210, Guidelines for the Testing of Chemicals, OECD, Paris |
[5] | Jobling, S., D.Sheahan, J.A.Osborne, P.Matthiessen, and J.P.Sumpter, 1996, Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals, Environmental Toxicology and Chemistry 15, pp.194-202 |
[6] | Sumpter, J.P. and S.Jobling, 1995, "Vitellogenesis As A Biomarker for Estrogenic Contamination of the Aquatic Environment", Environmental Health Perspectives 103, pp.173-178 |
[7] | Tyler, C.R., R.van Aerie, Т.Н.Hutchinson, S.Maddix, and H.Trip (1999), "An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin", Environmental Toxicology and Chemistry 18, pp.337-347 |
[8] | Holbech, H., L.Andersen, G.I.Petersen, B.Korsgaard, K.L.Pedersen, and P.Bjerregaard (2001a), "Development of an ELISA for vitellogenin in whole body homogenate ofzebrafish (Danio rerio)", Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 130, pp.119-131 |
[9] | Andersen, L., P.Bjerregaard, and B.Korsgaard (2003), "Vitellogenin induction and brain aromatase activity in adult male and female zebrafish exposed to endocrine disrupters", Fish Physiology and Biochemistry 28, pp.319-321 |
[10] | Orn, S., H.Holbech, Т.Н.Madsen, L.Norrgren, and G.I.Petersen (2003), "Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone", Aquatic Toxicology 65, pp.397-411 |
[11] | Kinnberg, K., H.Holbech, G.I.Petersen, and P.Bjerregaard (2007), "Effects of the fungicide prochloraz on the sexual development of zebrafish (Danio rerio)", Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp.165-170 |
[12] | Panter, G.H., Т.Н.Hutchinson, R.Lange, C.M.Lye, J.P.Sumpter, M.Zerulla, and C.R.Tyler (2002), "Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances", Environmental Toxicology and Chemistry 21, pp.319-326 |
[13] | Sun, L.W., J.M.Zha, PA.Spear, and Z.J.Wang (2007), "Toxicity of the aromatase inhibitor letrozole to Japanese medaka (Oryzias latipes) eggs, larvae and breeding adults", Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp.533-541 |
[14] | Parks, L.G., A.O.Cheek, N.D.Denslow, S.A.Heppell, J.A.McLachlan, G.A.LeBlanc, and C.V.Sullivan (1999), "Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds", Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 123, pp.113-125 |
[15] | Brion, F., B.M.Nilsen, J.K.Eidem, A.Goksoyr, and J.M.Porcher (2002), "Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio)", Environmental Toxicology and Chemistry 21, pp.1699-1708 |
[16] | Nishi, K., M.Chikae, Y.Hatano, H.Mizukami, M.Yamashita, R.Sakakibara, and E.Tamiya (2002), "Development and application of a monoclonal antibody-based sandwich ELISA for quantification of Japanese medaka (Oryzias latipes) vitellogenin", Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 132, pp.161-169 |
[17] | Hahlbeck, E., I.Katsiadaki, I.Mayer, M.Adolfsson-Erici, J.James, and B.E.Bengtsson (2004), "The juvenile three-spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption - II - kidney hypertrophy, vitellogenin and spiggin induction", Aquatic Toxicology 70, pp.311-326 |
[18] | Tatarazako, N., M.Koshio, H.Hori, M.Morita, and T.Iguchi (2004), "Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the medaka", Journal of Health Science 50, pp.301-308 |
[19] | Eidem, J.K., H.Kleivdal, K.Kroll, N.Denslow, R. van Aerle, C.Tyler, G.Panter, T.Hutchinson, and A.Goksoyr (2006), "Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin. Aquatic Toxicology", 78, pp.202-206 |
[20] | Jensen, K.M. and G.T.Ankley (2006), "Evaluation of a commercial kit for measuring vitellogenin in the fathead minnow (Pimephales promelas)", Ecotoxicology and Environmental Safety 64, pp.101-105 |
[21] | Holbech, Н., Petersen, G.I., Norman, A., |
[22] | Nilsen, B.M., K.Berg, J.K.Eidem, S.I.Kristiansen, F.Brion, J.M.Porcher, and A.Goksoyr (2004), "Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening", Analytical and Bioanalytical Chemistry 378, pp.621-633 |
[23] | Orn, S., S.Yamani, and L.Norrgren (2006), "Comparison of vitellogenin induction, sex ratio, and gonad morphology between zebrafish and Japanese medaka after exposure to 17 alpha-ethinylestradiol and 17 beta-trenbolone", Archives of Environmental Contamination and Toxicology 51, pp.237-243 |
[24] | Scholz, S. and N.Kluver (2009), "Effects of Endocrine Disrupters on Sexual, Gonadal Development in Fish, Sexual Developments, pp.136-151 |
[25] | Fenske, M., G.Maack, C.Schafers, and H.Segner(2005), "An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio", Environmental Toxicology and Chemistry 24, pp.1088-1098 |
[26] | Morthorst, J.E., H.Holbech, and P.Bjerregaard (2010), "Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations", Aquatic Toxicology 98, pp.336-343 |
[27] | OECD (2010), Guidance Document on the Diagnosis of Endocrine-related Histopathology in Fish Gonads, Series on Testing and Assessment No. 123, ENV/JM/MONO(2010)14, OECD, Paris |
[28] | Kobayashi, Т., M.Matsuda, H.Kajiura-Kobayashi, A.Suzuki, N.Saito, M.Nakamoto, N.Shibata, and Y.Nagahama (2004), "Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes", Developmental Dynamics 231, pp.518-526 |
[29] | Shinomiya, A., H.Otake, K.Togashi, S.Hamaguchi, and M.Sakaizumi (2004), "Field survey of sex-reversals in the medaka, Oryzias latipes: genotypic sexing of wild populations", Zoological Science 21, pp.613-619 |
[30] | Kidd, K.A., P.J.Blanchfield, K.H.Mills, V.P.Palace, R.E.Evans, J.M.Lazorchak, and R.W.Flick (2007), "Collapse of a fish population after exposure to a synthetic estrogen", Proceedings of the National Academy of Sciences of the United States of America 104, pp.8897-8901 |
[31] | Palace, V.P, R.E.Evans, K.G.Wautier, K.H.Mills, P.J.Blanchfield, B.J.Park, C.L.Baron, and K.A.Kidd (2009), "Interspecies differences in biochemical, histopathological, and population responses in four wild fish species exposed to ethynylestradiol added to a whole lake", Canadian Journal of Fisheries and Aquatic Sciences 66, pp.1920-1935 |
[32] | Panter, G.H., Т.Н.Hutchinson, K.S.Hurd, J.Bamforth, R.D.Stanley, S.Duffell, A.Hargreaves, S.Gimeno, and C.R.Tyler (2006), "Development of chronic tests for endocrine active chemicals - Part 1. An extended fish early-life stage test for oestrogenic active chemicals in the fathead minnow (Pimephales promelas)", Aquatic Toxicology 77, pp.279-290 |
[33] | Holbech, H., K.Kinnberg, G.I.Petersen, P.Jackson, K.Hylland, L.Norrgren, and P.Bjerregaard (2006), "Detection of endocrine disrupters: Evaluation of a Fish Sexual Development Test (FSDT)", Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 144, pp.57-66 |
[34] | Andersen, L., K.Kinnberg, H.Holbech, B.Korsgaard, and P.Bjerregaard (2004), "Evaluation of a 40 day assay for testing endocrine disrupters: Effects of an anti-estrogen and an aromatase inhibitor on sex ratio and vitellogenin concentrations in juvenile zebrafish (Danio rerio)", Fish Physiology and Biochemistry 30, pp.257-266 |
[35] | Kiparissis.Y., T.L.Metcalfe, G.C.Balch, and C.D.Metcalf (2003), "Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka (Oryzias latipes)", Aquatic Toxicology 63, pp.391-403 |
[36] | OECD (2000), Fish, Juvenile Growth Test, Test Guideline No. 215, Guidelines for the Testing of Chemicals, OECD, Paris |
[37] | OECD (1992), Ready Biodegradability, Test Guideline No.301, Guidelines for the Testing of Chemicals, OECD, Paris |
[38] | OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Series on Testing and Assessment No.23, ENV/JM/MONO(2000)6, OECD, Paris |
[39] | OECD (2011), Fish Testing Framework (draft available at: http://www.oecd.org/document/12/0,3746,en_2649_34377_1898188_1_1_1_1,00.html) |
[40] | OECD (2009), Fish Short Term Reproduction Assay, Test Guideline No. 229, Guidelines for the Testing of Chemicals, OECD, Paris |
[41] | OECD (2009), 21-Day Fish Assay: A Short Term Screening for Oestrogenic and Androgenic Activity, and Aromatase Inhibition, Test Guideline No. 230, Guidelines for the Testing of Chemicals, OECD, Paris |
[42] |
|
[43] | Panter, G.H., Т.Н.Hutchinson, K.S.Hurd, A.Sherren, R.D.Stanley, and C.R.Tyler (2004), "Successful detection of (anti-) androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development", Aquatic Toxicology 70, pp.11-21 |
УДК 658.382.3:006.354 | МКС 13.020.01 | Т58 |
Ключевые слова: химическая продукция, окружающая среда, токсичность, половозрелость, рыбы | ||
Электронный текст документа
и сверен по:
, 2016