ГОСТ 33641-2015
Группа Т58
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Испытание токсичности на хирономидах на протяжении цикла развития с использованием обогащенной воды или обогащенного осадка
Testing of chemicals of environmental hazard. Sediment-Water Chironomid Life-Cycle Toxicity Test Using Spiked Water or Spiked Sediment
МКС 13.020.01
Дата введения 2016-09-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский институт стандартизации материалов и технологий" (ФГУП "ВНИИ СМТ")
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Росстандарт)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 октября 2015 г. N 81-П)
За принятие проголосовали:
Краткое наименование страны по | Код страны по | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 18 ноября 2015 г. N 1863-ст межгосударственный стандарт ГОСТ 33641-2015 введен в действие в качестве национального стандарта Российской Федерации с 1 сентября 2016 г.
5 Настоящий стандарт модифицирован по отношению к международному документу OECD, Test No. 233:2010 Sediment-Water Chironomid Life-Cycle Toxicity Test Using Spiked Water or Spiked Sediment (ОЭСР, Тест N 233:2010 Испытание токсичности на хирономидах на протяжении жизненного цикла с использованием обогащенной воды или обогащенного осадка) путем изменения структуры. Сравнение структуры международного документа со структурой настоящего стандарта приведено в приложении ДА.
Перевод с английского языка (en).
Степень соответствия - модифицированная (MOD)
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
Настоящий стандарт представляет собой дальнейшее развитие существующих стандартов, распространяющихся на проведение испытаний ОЭСР 219 или 218 с использованием протоколов воздействия соответственно через обогащенную воду [1] или обогащенный осадок [2]. При его разработке учитывались имеющиеся протоколы по оценке токсичности для Chironomus riparius и Chironomus dilutus (ранее С.tentans [3]), которые были разработаны в Европе и Северной Америке [4]-[10], а также кольцевой метод [8], [11]-[13]. Можно также использовать другие хорошо известные виды хирономид, например Chironomus yoshimatsui [14], [15]. Полная продолжительность воздействия составляет примерно 44 сут для С. riparius и С. yoshimatsui и примерно 100 сут для С. dilutus.
В настоящем стандарте описаны оба протокола воздействия через обогащение воды и осадка. Выбор соответствующего протокола воздействия зависит от предполагаемого применения испытания. Протокол воздействия через воду, включающий обогащение водной колонки, предназначен для имитации события сноса пестицида при опрыскивании и включает первоначальную максимальную концентрацию в поверхностных водах. Обогащение воды также подходит для других типов воздействия (включая проливы химических соединений), но не для процессов аккумуляции, которые продолжаются дольше, чем период испытания. В данном случае и также, когда сточные воды являются основным путем попадания пестицидов в водоемы, дизайн с обогащенным осадком является более подходящим. Если представляют интерес другие протоколы воздействия, то дизайн испытаний может быть легко адаптирован. Например, если распределение испытуемого вещества между водной фазой и слоем осадка не представляет интерес и адсорбция осадка сведена до минимума, то используют суррогатный искусственный осадок (например, кварцевый песок).
Вещества, требующие оценки их влияния на организмы, заселяющие отложения, могут удерживаться в отложении в течение длительного периода времени. Организмы, заселяющие отложения, могут подвергаться воздействию химических веществ целым рядом путей. Относительное значение каждого пути воздействия и время, требующееся для каждого из них в проявлении общих токсических эффектов, зависит от физико-химических свойств конкретного вещества. Для соединений с высокими адсорбционными свойствами или для соединений, ковалентно связывающихся с отложениями, поглощение организмами загрязненного корма может быть основным путем воздействия. Для предупреждения недооценки токсичности высоколипофильных соединений можно использовать корм, добавленный в осадок, до внесения испытуемого вещества (см. 9.1.5.1). Таким образом, можно охватить все пути воздействия и все стадии развития хирономид.
Измеряемыми конечными точками являются общее количество вылупившихся взрослых особей (для 1-го и 2-го поколений), скорость развития (для 1-го и 2-го поколений), соотношение полов полностью вылупившихся и живых взрослых особей (для 1-го и 2-го поколений), количество тяжей яиц на самку (только 1 поколение) и фертильность тяжей яиц (только 1 поколение).
Рекомендуется использовать искусственный осадок. Искусственный осадок имеет несколько преимуществ по сравнению с природными отложениями:
- вариабельность в экспериментах снижается за счет того, что он представляет воспроизводимый "стандартизованный матрикс", и отпадает необходимость в поиске незагрязненного и чистого осадка;
- испытания можно начинать в любое время года, не сталкиваясь с сезонной вариабельностью испытуемого осадка, и отсутствует необходимость в предварительной обработке осадка для удаления природной фауны;
- снижаются затраты на отбор достаточного количества осадка в естественных условиях для обычного испытания;
- искусственный осадок позволяет сравнить токсичность и классифицировать вещества соответствующим образом [4].
1 Область применения
Настоящий стандарт устанавливает метод оценки влияния продолжительного воздействия химических веществ на пресноводных двукрылых Chironomus sp., который охватывает полностью 1-е поколение (поколение Р) и ранний период 2-го поколения (поколения F1).
2 Термины и определения
В настоящем стандарте применены термины с соответствующими определениями:
2.1 искусственный или реконструированный, составленный или синтетический осадок (formulated sediment or reconstituted, artificial or synthetic sediment): Смесь веществ, использованных для имитации физических компонентов природного осадка.
2.2 надосадочная вода (overlying water): Вода, находящаяся над осадком в испытуемом сосуде.
2.3 интерстициальная вода или поровая вода (interstitial water): Вода, занимающая пространство между осадком и частицами почвы.
2.4 обогащенная вода (spiked water): Испытуемая вода, в которую добавлено испытуемое вещество.
3 Принцип метода
Личинки хирономид первой стадии развития подвергаются воздействию испытуемого химического вещества в ряде концентраций в системах осадок-вода. Испытание начинают внесением личинок хирономид первой стадии развития (1-е поколение) в испытуемые стаканы, содержащие обогащенный осадок, или альтернативно воду обогащают испытуемым веществом после добавления личинок. Определяют вылупление, время до вылупления хирономид и соотношение полов полностью вылупившихся и живых комаров. Вылупившиеся взрослые особи переносят в камеры для культивирования, чтобы облегчить роение, спаривание и кладку яиц. Определяют количество полученных тяжей яиц и их фертильность. Из этих тяжей яиц получают личинки первой стадии развития 2-го поколения. Данные личинки помещают в только что приготовленные испытуемые стаканы (процедура обогащения такая же, как использовалась для 1-го поколения) для определения жизнеспособности особей 2-го поколения по их вылуплению, времени до вылупления и соотношению полов полностью вылупившихся и живых комаров (схема проведения испытания цикла развития приведена в приложении Г). Полученные данные анализируют, используя регрессионную модель для установления концентрации, которая будет вызывать x%-ное снижение соответствующей конечной точки, или используя проверку гипотезы для определения неэффективной наблюдаемой концентрации (NOEC). Для последнего варианта требуется сравнение эффектов обработки с соответствующими эффектами в контроле с использованием статистических методов. Следует отметить, что в протоколе с обогащением воды, в случае быстро деградирующих веществ, последние стадии развития каждого поколения (например, стадию куколки) можно подвергнуть воздействию испытуемого вещества в более низкой концентрации в надосадочной жидкости, чем для личинок 1-й стадии развития. Если это имеет значение и требуется сравнение уровня воздействия на каждую стадию развития, то следует внести следующие поправки в метод испытания:
- проведение параллельных испытаний с обогащением на разных стадиях развития или;
- повторное обогащение (или обновление надосадочной жидкости) тест-системы во время обоих этапов испытания (1-го и 2-го поколений), в результате чего интервалы обогащения (обновления) следует корректировать с учетом поведения испытуемого вещества.
Такие поправки целесообразны только для протокола с обогащенной водой, но не для протокола с обогащенным осадком.
4 Информация об испытуемом веществе
Информация об испытуемом веществе должна содержать сведения о растворимости испытуемого вещества в воде, давлении пара и ![]() , измеренном или рассчитанном распределении в осадке и стабильности в воде и осадке. Должен быть в наличии надежный аналитический метод для количественного определения испытуемого вещества в надосадочной жидкости, поровой воде и осадке с известной и установленной точностью и нижним пределом обнаружения. Полезная информация включает структурную формулу и чистоту испытуемого вещества. Также полезными являются сведения о химическом поведении испытуемого вещества (например, рассеянии, разрушении в абиотических и биотических условиях и т.п.). Дополнительное руководство по испытанию веществ с физико-химическими свойствами, которые затрудняют проведение испытания, приводится в [16].
, измеренном или рассчитанном распределении в осадке и стабильности в воде и осадке. Должен быть в наличии надежный аналитический метод для количественного определения испытуемого вещества в надосадочной жидкости, поровой воде и осадке с известной и установленной точностью и нижним пределом обнаружения. Полезная информация включает структурную формулу и чистоту испытуемого вещества. Также полезными являются сведения о химическом поведении испытуемого вещества (например, рассеянии, разрушении в абиотических и биотических условиях и т.п.). Дополнительное руководство по испытанию веществ с физико-химическими свойствами, которые затрудняют проведение испытания, приводится в [16].
5 Стандартные вещества
Стандартные вещества периодически подвергают испытанию для подтверждения того, что чувствительность лабораторной популяции комаров остается без изменений. Как и для дафний, будет достаточным проведение 48-часового острого опыта согласно разделу 8. Однако если отсутствует валидированный стандарт по острому опыту, то следует принять во внимание протокол хронического испытания согласно документу OECD, Test No. 219:2004. Примерами стандартных токсикантов, успешно используемых в кольцевых методах и при валидации, являются: линдан, трифлуралин, пентахлорфенол, хлорид кадмия и хлорид калия [1], [4], [7], [8], [18].
6 Достоверность испытания
Для подтверждения достоверности испытания используют следующие критерии:
- средняя вылупляемость личинок в контролях должна составлять в конце периода воздействия не менее 70% для обоих поколений [1], [8];
- период вылупления 85% общего числа вылупившихся взрослых комаров для С. riparius и С. yoshimatsui в контроле для обоих поколений должен находиться в пределах от 12 до 23 сут после внесения в сосуды личинок первой стадии развития; для С. dilutus требуется 20-65 сут;
- среднее соотношение полов полностью вылупившихся и живых взрослых особей (самки или самцы) в контроле обоих поколений должно составлять не менее 0,4, но не более 0,6;
- для каждой камеры для культивирования число тяжей яиц в контроле 1-го поколения должно составлять не менее 0,6 на самку, внесенную в камеру для культивирования;
- относительное число фертильных тяжей яиц в каждой камере для культивирования для контроля 1-го поколения должно составлять не менее 0,6;
- в конце периода воздействия для обоих поколений определяют рН и концентрацию растворенного кислорода в каждом сосуде. Концентрация кислорода должна составлять не менее 60% значения насыщения воздуха (ASV), и рН надосадочной воды находится в диапазоне 6-9 во всех испытуемых сосудах;
_______________
При температуре 20°С и нормальном атмосферном давлении ASV в пресной воде равно 9,1 мг/л (60% равно 5,46 мг/л).
- температура воды не должна различаться более чем на ±1,0°С.
7 Описание метода
7.1 Испытуемые сосуды и камеры для культивирования
Личинки подвергают воздействию испытуемого вещества в стеклянных стаканах вместимостью 600 мл с диаметром 8 см. При обеспечении соответствующей высоты слоя надосадочной воды и осадка пригодны и другие сосуды. Поверхность осадка должна быть достаточной для обеспечения 2-3 см на личинку. Соотношение высоты слоя осадка к высоте надосадочной воды должно составлять 1:4.
Используют камеры для культивирования (размером не менее 30 см в трех измерениях) с марлей (размер отверстий должен быть примерно равен 1 мм) сверху и с одной стороны камеры (см. приложение Г). В каждую камеру для кладки яиц помещают кристаллизационную чашку вместимостью 2 л, содержащую испытуемую воду и осадок. Для кристаллизационной чашки соотношение высоты слоя осадка к высоте надосадочной жидкости также должно составлять примерно 1:4.
После сбора тяжей яиц в кристаллизационной чашке их помещают в 12-луночный микротитрационный планшет (один тяж на лунку, содержащую не менее 2,5 мл воды из "обогащенной" кристаллизационной чашки), после чего планшеты покрывают крышкой для предупреждения интенсивного испарения. Также можно использовать другие сосуды, подходящие для хранения тяжей яиц.
За исключением микротитрационных планшетов все испытуемые сосуды и другое оборудование, контактирующее с тест-системой, должны быть изготовлены полностью из стекла или другого химически инертного материала (например, тефлона).
7.2 Выбор вида хирономид
Предпочтительным видом для использования в испытании является Chironomus riparius. Также может использоваться С. yoshimatsui. С. dilutus также является подходящим, но с ним труднее работать и требуется более длительный период испытания. Подробное описание методов культивирования Chironomus riparius приводится в приложении А. Также имеется информация об условиях культивирования для других видов, то есть С. dilutus [6] и С. yoshimatsui [15]. Перед началом испытания проводят идентификацию вида, но это не требуется для каждого испытания, если организмы происходят из внутрилабораторной культуры.
7.3 Осадок
7.3.1 Рекомендуется использовать искусственный осадок (осадок, также называемый реконструированным, составленным или синтетическим). Если используется природный осадок, то его следует охарактеризовать (определить рН, содержание органического углерода, а также рекомендуются такие параметры, как соотношение C/N и гранулометрия), и он не должен содержать каких-либо загрязнений и других организмов, конкурирующих с хирономидами или питающихся ими. Также перед использованием в испытании токсичности для хирономид природный осадок кондиционируют в течение 7 сут в тех же условиях, в которых будет проводиться последующее испытание. Рекомендуется согласно [1], [20], [21] применение следующего искусственного осадка, как описано в [1]:
а) 4%-5% (сухая масса) торфа: рН как можно ближе к 5,5-6,0; следует использовать торф в виде измельченного порошка с размером частиц не менее 1 мм, высушенного только на воздухе;
б) 20% (сухая масса) каолиновой глины (содержание каолинита предпочтительно более 30%);
в) 75%-76% (сухая масса) кварцевого песка (должен преобладать мелкий песок с более чем 50% частиц размером в пределах от 50 до 200 мкм);
г) деионизированная вода добавляется для обеспечения влажности конечной смеси в пределах 30%-50%;
д) химически чистый карбонат кальция (CaCO) добавляется для доведения рН конечной смеси осадка до 7,0-0,5;
е) содержание органического углерода конечной смеси должно составлять 2%±0,5% и доводиться соответствующими количествами торфа и песка согласно перечислениям а) и в).
7.3.2 Необходимо иметь информацию об источнике торфа, каолиновой глины и песка. Компоненты осадка исследуют на отсутствие химического загрязнения (например, тяжелыми металлами, хлорорганическими соединениями, фосфорорганическими соединениями и т.п.). Пример получения искусственного осадка описан в приложении Б. Также можно смешать составляющие компоненты в сухом виде, если было показано, что после добавления надосадочной воды не происходит разделения компонентов (например, всплытия частиц торфа), и что торф или осадок были достаточно кондиционированы.
7.4 Вода
В качестве испытуемой воды используют любую воду, соответствующую по своим химическим характеристикам приемлемой воде для разведения, как указано в приложениях А и В. Любая подходящая вода, природная вода (поверхностная или грунтовая вода), восстановленная вода (см. приложение А) или дехлорированная водопроводная вода является приемлемой в качестве воды для культивирования и воды для испытания, если хирономиды будут выживать в ней во время культивирования и проведения испытания без признаков стресса. В начале испытания значение рН испытуемой воды должно составлять от 6 до 9, и общая жесткость должна быть не более 400 мг/л по CaCO. Однако если имеется предположение о взаимодействии ионов жесткости с испытуемым веществом, то необходимо использовать воду с более низкой жесткостью (и таким образом, в данной ситуации не должна использоваться среда Elendt Medium M4). Во время всего испытания используют одинаковый тип воды. Характеристики качества воды, приведенные в приложении В, определяют не менее двух раз в год, или при наличии подозрения, что данные характеристики могли существенно измениться.
7.5 Стоковые растворы - обогащенная вода
Испытуемые концентрации рассчитывают на основе концентраций в водной колонке, т.е. надосадочной воде. Испытуемые растворы с выбранной концентрацией обычно готовят разведением стокового раствора. Стоковые растворы готовят растворением испытуемого вещества в испытуемой среде. В некоторых случаях требуется использование растворителей или диспергирующих агентов для получения соответствующего концентрированного стокового раствора. Примерами подходящих растворителей являются ацетон, этанол, метанол, моноэтиловый эфир этиленгликоля, диметиловый эфир этиленгликоля, диметилформамид и триэтиленгликоль. Используемыми диспергирующими агентами могут быть Кремофор RH40, твин 80, 0,01% метилцеллюлоза и НСО-40. Концентрация солюбилизирующего агента в конечной испытуемой среде должна быть минимальной (т.е. не более 0,1 мл/л) и одинаковой во всех испытаниях. Если используют солюбилизирующий агент, то он не должен оказывать существенного влияния на выживаемость хирономид или проявлять видимое отрицательное воздействие на личинок хирономид, что может быть установлено контролем на растворитель. Однако следует избегать применения таких веществ.
7.6 Стоковые растворы - обогащенный осадок
Обогащенный осадок с выбранной концентрацией обычно готовят добавлением раствора испытуемого вещества непосредственно к осадку. Стоковый раствор испытуемого вещества в деионизированной воде смешивают с искусственным осадком на роликовой мельнице, кормосмесителе или перемешиванием вручную. Если испытуемое вещество плохо растворяется в воде, то его можно растворить в минимальном объеме подходящего органического растворителя (например, в гексане, ацетоне или хлороформе). Затем данный раствор смешивают с 10 г мелкого кварцевого песка для каждого испытуемого сосуда. Затем растворитель выпаривают до его полного удаления из песка; затем песок смешивают с соответствующим количеством осадка. Для солюбилизации, диспергирования или эмульгирования испытуемого вещества используют только легколетучие растворители. Следует иметь в виду, что количество песка, входящее в смесь испытуемого вещества и песка, необходимо учитывать при приготовлении осадка (готовить осадок следует с меньшим количеством песка). Добавляемое испытуемое вещество тщательно и равномерно распределяют в осадке. При необходимости анализируют дополнительные пробы для определения степени однородности.
8 Дизайн испытания
Дизайн испытания связан с выбором количества и диапазона разнесения испытуемых концентраций, количества сосудов для каждой концентрации и количества личинок на сосуд, количества кристаллизационных чашек и камер для культивирования. Ниже описаны дизайны для определения ЕС, NOEC и диапазона предельных концентраций.
8.1 Дизайн для регрессионного анализа
8.1.1 Эффективная концентрация (ЕС) и диапазон концентраций, в котором действие испытуемого вещества представляет интерес, должны охватывать концентрации, включенные в испытание, так как конечная точка не экстраполируется за пределами полученных данных. Следует избегать экстраполяции значительно ниже самой низкой действующей концентрации или выше самой высокой концентрации. Предварительное испытание для определения диапазона предельных концентраций согласно стандартам ОЕСР 218 или 219 проводят для выбора подходящего диапазона испытуемых концентраций.
8.1.2 Для установления ЕС требуется не менее пяти концентраций в восьми повторностях для каждой концентрации. Для каждой концентрации используют две камеры для культивирования А и Б (см. документ OECD, Test No. 233:2010). Восемь повторностей разделяют на две группы по четыре повторности для каждой камеры для культивирования. Такое число повторностей требуется с учетом количества комаров, необходимого в камере для оценки воспроизведения звуковых сигналов. Однако для 2-го поколения также требуется восемь повторностей из подвергшихся воздействию популяций в камерах для культивирования. Интервал между концентрациями не должен быть больше двух (исключение может быть сделано для случаев, если кривая концентрация-эффект имеет пологий наклон). Количество повторностей для каждой обработки может быть уменьшено до шести (три на каждую камеру для культивирования), если количество испытуемых концентраций с различным эффектом является большим. Увеличение количества повторностей или уменьшение диапазона испытуемых концентраций приводит к более узким доверительным интервалам для значений ЕС
.
8.2 Дизайн для установления NOEC
Для установления NOEC используют пять испытуемых концентраций как минимум в восьми повторностях (4 на каждую камеру для культивирования, указанные в приложениях А и Б (см. документ OECD, Test No. 233:2010)), и интервал между концентрациями не должен быть больше двух. Количество повторностей должно быть достаточным для обеспечения адекватной статистической мощности для выявления разницы в размере 20% контроля на 5%-ном уровне значимости (р=0,05). Для определения скорости развития, плодовитости и фертильности обычно необходим дисперсионный анализ (ANOVA) с последующим применением критерия Даннетта или критерия Вильямса [22]-[25]. Для определения показателя вылупления и соотношения полов подходят критерий Кохрана-Армитажа, точный критерий Фишера (с поправкой Бонферрони) или критерий Ментеля-Хензеля.
8.3 Определение диапазона предельных концентраций
Определение диапазона предельных концентраций выполняют (одна испытуемая концентрация и контроль), если никакие эффекты не были выявлены в предварительном устанавливающем диапазон испытаний, включая максимальную концентрацию. Целью определения диапазона предельных концентраций является установление того, что токсическая концентрация испытуемого вещества выше, чем испытуемая предельная концентрация. Предлагается для воды 100 мг/л и для осадка 1000 мг/кг (сухая масса). Используют не менее восьми повторностей на каждую обработку и контроль. Должна быть показана адекватная статистическая мощность для выявления разницы в размере 20% контроля при 5%-ном уровне значимости (р=0,05). Для данных по метрическому эффекту (например, скорость развития) установление t-критерия является подходящим статистическим методом, если данные отвечают требованиям данного критерия (нормальное распределение, однородность дисперсии). Если указанные требования не выполняются, то используют t-критерий с различными дисперсиями или непараметрический критерий, такой как критерий Вилкоксона-Манна-Уитни. Для данных по показателю вылупления подходит точный критерий Фишера.
9 Проведение испытания
9.1 Условия испытания
9.1.1 Подготовка системы вода-осадок (обогащение воды)
Искусственный осадок (см. 7.3.1-7.3.2 и приложение Б) вносят в каждый испытуемый сосуд и кристаллизационную чашку с получением слоя высотой не менее 1,5 см (для кристаллизационной чашки он может быть немного ниже), но максимально 3 см. Добавляют воду (см. 7.4.1) таким образом, чтобы соотношение высоты слоя осадка и высоты воды не превышало 1:4. После приготовления испытуемых сосудов систему осадок-вода оставляют при легкой аэрации в течение 7 сут перед добавлением личинок первой стадии развития 1-го и 2-го поколений (см. 7.3.2 и приложение Б). Система осадок-вода в кристаллизационных чашках не подвергается аэрации во время испытания, поскольку в них не поддерживается выживаемость личинок (тяжи яиц были извлечены до вылупления). Для предупреждения разделения компонентов осадка и ресуспендирования мелких частиц во время добавления испытуемой воды в водную колонку осадок покрывают пластиковым диском и воду выливают на него, и после этого диск сразу же удаляют. Подходят также другие устройства.
9.1.2 Подготовка системы вода-осадок (обогащенный осадок)
9.1.2.1 Обогащенные осадки, приготовленные согласно 7.6, помещают в сосуды и кристаллизационную чашку, и добавляют надосадочную жидкость с получением объемного соотношения осадок-вода 1:4. Высота слоя осадка должна находиться в пределах от 1,5 до 3 см (для кристаллизационной чашки он может быть немного ниже). Для предупреждения разделения компонентов осадка и ресуспендирования мелких частиц во время добавления испытуемой воды в водную колонку осадок покрывают пластиковым диском и воду выливают на него, и после этого диск сразу же удаляют. Подходят также другие устройства. После приготовления обогащенного осадка с надосадочной водой требуется обеспечить проникновение испытуемого вещества из осадка в водную фазу [5], [6], [8], [18]. Предпочтительно это проводят в условиях температуры и аэрации, используемых в испытании. Соответствующее время уравновешивания является специфическим для осадка и химического вещества и может находиться в пределах от нескольких часов до суток, а в редких случаях до пяти недель. Поскольку за это время может произойти деградация многих химических веществ, то не ожидают окончания уравновешивания, но рекомендуемый период уравновешивания составляет 48 ч. Если период полураспада в осадке является большим (см. 4.1), то период уравновешивания увеличивают. В конце этого дополнительного периода уравновешивания определяют концентрацию испытуемого вещества в надосадочной жидкости, поровой воде и осадке по меньшей мере при самой высокой концентрации и при одной более низкой концентрации (см. 9.3.1.1). Данные аналитические измерения испытуемого вещества позволяют рассчитать массовый баланс и выразить результаты на основе установленных концентраций.
9.1.2.2 Испытуемые сосуды покрывают (например, стеклянными пластинками). Если необходимо, то во время испытания уровень воды доводят до первоначального объема для компенсации потери воды за счет испарения. Для предупреждения отложения солей используют дистиллированную или деионизированную воду. Кристаллизационные чашки в камерах для культивирования не покрывают, и необязательно доводить объем для компенсации потери воды во время периода испытания, поскольку тяжи яиц контактируют с водой в течение примерно суток и чашки используют только во время короткой фазы испытания.
9.1.3 Внесение тестовых организмов
9.1.3.1 За 4-5 сут личинок первой стадии развития для получения 1-го поколения кладки яиц отбирают из культур и помещают в небольшие сосуды с культуральной средой. Используют выдержанную среду из исходной культуры или свежеприготовленную среду. В любом случае в культуральную среду добавляют небольшое количество корма, например зеленые водоросли и/или несколько капель фильтрата мелко измельченной суспензии хлопьевидного корма для рыб (см. приложение А). Используют только недавно отложенные кладки яиц. Обычно личинки начинают вылупляться через 2 сут после кладки (2-3 сут для Chironomus riparius при температуре 20°С и 1-4 сут для Chironomus dilutus при температуре 23°С и Chironomus yoshimatui при температуре 25°С), и рост личинок происходит в четыре стадии развития, каждая продолжительностью 4-8 сут. В испытании используют личинок первой стадии развития (не более 48 ч после кладки). Стадию развития личинок определяют по ширине головной капсулы [8].
9.1.3.2 В каждый испытуемый сосуд, содержащий систему осадок-вода, произвольно вносят 20 личинок первой стадии развития 1-го поколения, используя пипетку с тупым кончиком. Аэрацию воды останавливают во время внесения личинок в испытуемые сосуды и еще на 24 ч после этого (см. 9.1.6.1). Согласно выбранному дизайну испытания (см. 8.1.2 и 8.2.1) число используемых личинок на каждую концентрацию составляет не менее 120 (6 повторностей на каждую концентрацию) при установлении ЕС и 160 при установлении NOEC (8 повторностей на каждую концентрацию). В дизайне с обогащенным осадком воздействие начинают с внесения личинок.
9.1.4 Обогащение надосадочной жидкости
Через 24 ч после внесения личинок первой стадии развития 1-го поколения в надосадочную водную колонку добавляют испытуемое вещество и вновь проводят легкую аэрацию (возможные поправки к протоколу испытания приведены в 3.1). Небольшие объемы растворов испытуемого вещества вносят пипеткой ниже поверхности воды. Затем надосадочную воду осторожно перемешивают, не нарушая осадок. В протоколе с обогащенной водой воздействие начинают с обогащения воды (т.е. через одни сутки после внесения личинок).
9.1.5 Сбор вылупившихся взрослых особей
9.1.5.1 Вылупившихся комаров 1-го поколения собирают не менее одного раза, но предпочтительно два раза в сутки (см. 9.2.1.2) из испытуемых сосудов с использованием аспиратора или аналогичного устройства (см. приложение Г). Следует соблюдать особую осторожность, чтобы не повредить взрослых особей. Собранных комаров из четырех испытуемых сосудов в одной обработке переносят в камеру для культивирования, которая заранее была для них приготовлена. В день первого вылупления (самцов) в кристаллизационные чашки пипеткой вносят небольшой объем стокового раствора испытуемого вещества ниже поверхности воды (дизайн с обогащенной водой). Затем надосадочную воду осторожно перемешивают, чтобы не нарушить осадок. Номинально концентрация испытуемого вещества в кристаллизационных чашках является такой же, как и в обработанных сосудах, которые относятся к данной камере для культивирования. Для дизайна с обогащенным осадком кристаллизационные чашки готовят примерно на 11 сут после начала воздействия (т.е. внесения 1-го поколения личинок) таким образом, чтобы они могли уравновеситься в течение примерно 48 ч до образования первых тяжей яиц.
9.1.5.2 Тяжи яиц собирают из кристаллизационной чашки, находящейся в камере для культивирования, с использованием пинцета или пипетки с тупым кончиком. Каждый тяж яиц помещают в сосуд с культуральной средой из кристаллизационной чашки, из которой его отобрали (например, лунку 12-луночного микропланшета не менее чем с 2,5 мл среды). Сосуды с тяжами яиц покрывают крышкой для предупреждения значительного испарения. Проводят наблюдение за тяжами яиц в течение не менее 6 сут после их образования для того, чтобы отнести к фертильным или нефертильным.
Для получения ранней стадии 2-го поколения личинок отбирают не менее трех, а предпочтительно шесть тяжей фертильных яиц из каждой камеры для культивирования и в присутствии небольшого количества корма, что обеспечивает вылупление. Данные тяжи яиц получены на пике кладки яиц, что обычно имеет место примерно на 19 сут испытаний в контроле. Теоретически 2-е поколение во всех обработках появляется в тот же день, но за счет воздействия испытуемого вещества на развитие личинок это не всегда так. В таком случае при более высоких концентрациях 2-е поколение может появиться позднее по сравнению с более низкими концентрациями и контролем (на растворитель).
9.1.5.3 В дизайне с обогащенной водой систему осадок-вода для 2-го поколения готовят внесением испытуемого вещества в надосадочную водную колонку примерно за 1 ч до добавления личинок первой стадии развития в испытуемые сосуды. Небольшие объемы растворов испытуемого вещества вносят пипеткой ниже поверхности воды. Затем надосадочную воду осторожно перемешивают, не нарушая осадок. После обогащения проводят легкую аэрацию.
9.1.5.4 В дизайне с обогащенным осадком обработанные сосуды, содержащие систему осадок-вода для 2-го поколения, готовят аналогичным образом как для 1-го поколения.
9.1.5.5 В каждый испытуемый сосуд, содержащий систему обогащенный осадок-вода, произвольно вносят 20 личинок первой стадии развития 2-го поколения (максимум в течение 48 ч после вылупления), используя пипетку с тупым кончиком. Аэрацию воды останавливают во время внесения личинок в испытуемые сосуды и еще на 24 ч после этого. Согласно выбранному дизайну испытания (см. 8.1.2 и 8.2.1) число используемых личинок на каждую концентрацию составляет не менее 120 (6 повторностей на каждую концентрацию) при установлении ЕС и 160 при установлении NOEC (8 повторностей на каждую концентрацию).
9.1.6 Корм
Личинок кормят предпочтительно каждый день или не менее трех раз в неделю. Корм для рыб (суспензия в воде или мелко измельченный корм, например, Tetra-Min или Tetra-Phyll; подробное описание см. в приложении А) в количестве 0,25-0,5 мг (0,35-0,5 мг для С. yoshimatui) на личинку в сутки является достаточным для личинок раннего возраста в течение первых 10 сут. Немного больше корма требуется для личинок более старшего возраста: 0,5-1 мг на личинку в сутки является достаточным для остального периода испытания. Количество корма снижают во всех обработках и контроле, если отмечен рост грибов, или в контроле наблюдается гибель личинок. Если невозможно остановить рост грибов, то испытание повторяют заново.
В общем, токсикологическое значение воздействия через потребление внутрь является выше для веществ с высоким сродством к органическому углероду или веществ, ковалентно связывающихся с осадком. Следовательно, при испытании веществ с такими свойствами корм, необходимый для обеспечения выживаемости и естественного роста личинок, добавляют к искусственному осадку до стабилизации в зависимости от нормативных требований. Для предупреждения ухудшения качества воды используют растительный материал вместо корма для рыб, например, добавляют 0,5% (сухая масса) мелко измельченных листьев жгучей крапивы (Urtica dioeca), шелковицы (Morus alba), клевера ползучего или белого (Trifolium repens), шпината (Spinacia oleracea) или другого растительного материала (Cerophyl или аотфа-целлюлоза). Добавление полного рациона из источника органического корма к осадку перед обогащением не является ни тривиальным с точки зрения качества воды и биологической функции [21], ни стандартизованным методом, но результаты недавно проведенных исследований показывают, что данный метод работает [19], [26]. Взрослых комаров в камере для культивирования обычно не кормят, но их плодовитость и фертильность повышаются, если используют ватную палочку, пропитанную насыщенным раствором сахарозы в качестве источника корма для вылупившихся взрослых особей [34].
9.1.7 Условия инкубации
9.1.7.1 Проводят легкое аэрирование надосадочной воды в испытуемых сосудах предпочтительно в течение 24 ч после внесения личинок и продолжают в течение всего испытания (следует соблюдать осторожность в отношении того, что концентрация растворенного кислорода не должна снижаться менее 60% ASV). Аэрацию проводят через стеклянную пастеровскую пипетку, зафиксированную на 2-3 см выше слоя осадка, обеспечивающую один или несколько пузырьков/сек. В случае испытания летучих химических веществ аэрацию системы осадок-вода не проводят, но в то же время выполняют критерий достоверности не менее 60% ASV (см. 6). Дополнительные рекомендации приведены в [16].
9.1.7.2 Испытание с С. riparius проводят при постоянной температуре (20±2)°С. Для С. dilutus и С. yoshimatui рекомендуются температуры соответственно (23±2)°С и (25±2)°С. Используют 16-часовой световой период, и интенсивность света должна составлять от 500 до 1000 люкс. Для камер для культивирования дополнительно увеличивают на 1 ч светового периода и темноты.
9.1.8 Продолжительность воздействия
Дизайн с обогащением воды: период воздействия на 1-е поколение начинают, когда испытуемое вещество вносят в надосадочную жидкость испытуемых сосудов (1 сут после добавления личинок - возможные поправки к дизайну испытания см. в разделе 3 настоящего стандарта). Воздействие на 2-е поколение личинок начинают сразу же, поскольку они были внесены в уже обогащенную систему осадок-вода. Максимальная продолжительность воздействия для 1-го поколения составляет 27 сут и для 2-го поколения - 28 сут (1-е поколение личинок находится одни сутки в сосудах без воздействия) для С. riparius и С. yoshimatui. Для С. dilutus максимальная продолжительность воздействия составляет 64 и 65 сут соответственно для 1-го и 2-го поколений. Общая продолжительность равна примерно 100 сут.
Дизайн с обогащенным осадком: воздействие начинается с внесения личинок и составляет не более для обоих поколений С. riparius и С. yoshimatui 28 сут и не более 65 сут для обоих поколений С. dilutus.
9.2 Наблюдения
9.2.1 Вылупление
9.2.1.1 Определяют время вылупления и общее количество полностью вылупившихся комаров (самцов и самок). Самцов легко определить по их перистым усикам.
9.2.1.2 Испытуемые сосуды осматривают не менее трех раз в неделю для визуальной оценки любого аномального поведения (например, выход из осадка, аномальное плавание) по сравнению с контролем. В период предполагаемого вылупления, который начинается примерно через 12 сут после внесения личинок С. riparius и С. yoshimatui (через 20 сут для С. dilutus), подсчитывают число вылупившихся комаров и определяют пол не менее 1 раза, но предпочтительно 2 раза в сутки (рано утром и поздно вечером). После идентификации комаров 1-го поколения осторожно извлекают из сосудов и переносят в камеру для культивирования. Комаров 2-го поколения удаляют и умерщвляют после идентификации. Любые тяжи яиц, остающиеся до окончания испытания, в испытуемых сосудах 1-го поколения собирают по отдельности и переносят не менее чем в 2,5 мл нативной воды в 12-луночные микропланшеты (или другие подходящие сосуды), которые покрывают крышкой для предупреждения значительного испарения. Регистрируют количество мертвых личинок и куколок, которые по визуальным наблюдениям не подверглись вылуплению. Примеры камеры для культивирования, испытуемого сосуда и аспиратора приведены в приложении Г.
9.2.2 Размножение
Влияние на размножение оценивают по числу тяжей яиц, отложенных 1-м поколением комаров, и определяют фертильность этих тяжей яиц. Один раз в день собирают тяжи яиц из кристаллизационной чашки, находящейся в каждой камере для культивирования. Собранные тяжи яиц переносят не менее чем в 2,5 мл нативной воды в 12-луночный микропланшет (один тяж яиц в каждую лунку) или другие подходящие сосуды, которые покрывают крышкой для предупреждения значительного испарения. Регистрируют следующие показатели для каждого тяжа яиц: день образования, размером ((1,0±0,3) см или менее; (обычно не более 0,5 см) и структура (в норме - бананообразная форма со спиральным тяжем яиц или аномальная, например, неспиральный тяж яиц) и фертильность (фертильные или нефертильные). В течение 6 суток после образования оценивают фертильность тяжа яиц. Тяж яиц считают фертильным, если вылупляется не менее одной трети яиц. Используют общее число самок, внесенных в камеру для культивирования, для расчета числа тяжей яиц на самку и число фертильных тяжей яиц на самку. При необходимости число яиц в тяже определяют неразрушающим методом, используя кольцевой метод (подробное описание приведено в 9.1.6.1 и в 9.1.6.2).
9.3 Аналитические определения
9.3.1 Концентрация испытуемого вещества
9.3.1.1 В начале испытания анализируют как минимум пробы надосадочной воды, поровой воды и осадка (в случае обогащения воды предпочтительно через 1 ч после внесения испытуемого вещества, а в конце испытания анализу подвергают указанные пробы только при самой высокой концентрации и при одной более низкой концентрации. Это относится к сосудам для обоих поколений. Из кристаллизационных чашек в камере для культивирования анализируют только надосадочную жидкость, поскольку именно с ней контактируют тяжи яиц (для дизайна с обогащенным осадком анализируют концентрацию испытуемого вещества в осадке). При необходимости проводят анализ осадка, поровой воды или надосадочной воды во время испытания. Результаты определения концентрации испытуемого вещества предоставляют информацию о поведении/распределении испытуемого вещества в системе вода-осадок. Для отбора проб осадка и поровой воды в начале и во время испытания (см. 9.3.1.2) используют дополнительные испытуемые сосуды для проведения анализа. Анализ осадка в дизайне с обогащенной водой проводят, только если имеются четкие данные о распределении испытуемого вещества между водой и осадком при исследовании воды/осадка в сравнимых условиях (например, при том же соотношении осадка к воде, типе внесения, содержании органического углерода в осадке) или если было показано, что определенные концентрации в надосадочной воде сохраняются на уровне 80%-120% номинальной или определенной первоначальной концентрации.
9.3.1.2 При проведении промежуточных измерений (например, на 7 и/или 14 сут) и если для анализа требуются большие пробы, которые невозможно отобрать из испытуемых сосудов, не нарушив тест-систему, то аналитические измерения проводят на пробах из дополнительных испытуемых сосудов, подготовленных аналогичным образом (включая присутствие тестовых организмов), но не используемых для биологических наблюдений.
9.3.1.3 Для выделения интерстициальной (=поровой) воды проводят центрифугирование, например, при 10000 g и 4°С в течение 30 мин. Однако если испытуемое вещество не адсорбируется на фильтрах, то допустимо фильтрование. В некоторых случаях невозможно определить концентрацию испытуемого вещества в поровой воде, поскольку размер пробы является слишком маленьким.
9.3.2 Физико-химические показатели
Измеряют рН, содержание растворенного кислорода в испытуемой воде и температуру испытуемых сосудов соответствующим образом (см. раздел 6). В начале и конце испытания определяют жесткость воды и содержание аммиака в контрольных сосудах и в одном испытуемом сосуде с самой высокой концентрацией.
10 Данные и отчет о проведении испытания
10.1 Обработка результатов
10.1.1 Целью данного испытания цикла развития комаров является оценка влияния испытуемого вещества на размножение, скорость развития и общее число полностью вылупившихся комаров (самцов и самок) для двух поколений. Для показателя вылупления следует объединить данные по самцам и самкам. Если отсутствуют статистически значимые различия в половой чувствительности, то данные по самцам и самкам объединяют для статистического анализа.
10.1.2 Эффективные концентрации, выраженные в виде концентраций испытуемого вещества в надосадочной воде (для обогащенной воды) или в осадке (для обогащенного осадка), обычно рассчитывают на основе установленных концентраций в начале воздействия (см. 9.3.1.1). Следовательно, для обогащенной воды концентрации определяют в начале воздействия в надосадочной воде сосудов для обоих поколений и кристаллизационных чашках и рассчитывают среднее значение для каждой обработки. Для обогащенного осадка концентрации определяют в начале воздействия в сосудах для обоих поколений (и необязательно в кристаллизационных чашках) и рассчитывают среднее значение для каждой обработки.
10.1.3 Для расчета точки ЕС или другой ЕС
используют статистику на сосуд в качестве фактических повторностей. При расчете доверительного интервала для любой ЕС
учитывают вариабельность между сосудами, или ею можно пренебречь, если доказано, что эта вариабельность является незначительной. При определении модели методом наименьших квадратов проводят преобразование в статистику на сосуд для повышения однородности дисперсии. Значения ЕС
рассчитывают после преобразования эффекта в исходное значение.
10.1.4 Если статистический анализ основывается на определении NOEC путем проверки гипотезы, то следует учитывать вариабельность между сосудами, например, с использованием методов ANOVA (например, критерия Вильямса или критерия Даннета). Критерий Вильямса подходит, если теоретически предполагается монотонная зависимость концентрация-эффект, а критерий Даннетта пригоден, если не соблюдается гипотеза монотонности. Альтернативно подходящими являются более ошибкоустойчивые критерии [27] в ситуациях, когда имеются нарушения обычных допущений ANOVA [31].
10.1.5 Показатель вылупления
10.1.5.1 Показатели вылупления являются дискретными данными, и их можно анализировать с помощью критерия Кохрана-Армитажа, примененного пошагово, где предполагается монотонная зависимость концентрация-эффект, и эти данные совпадают с этим предположением. В противном случае используют точный критерий Фишера или критерий Ментеля-Хензеля с поправкой Бонферрони-Холма р-значений. Если имеется доказательство большой вариабельности между повторностями в одной и той же концентрации, что указывает на биноминальное распределение (часто относится к "экстрабиноминальной" вариации), то тогда используют робастный критерий Кохрана-Армитажа и точный критерий Фишера, например, предложенный в [27].
Определяют суммарное количество вылупившихся комаров на сосуд и делят на число внесенных личинок
по формуле
![]() , (1)
, (1)
где - показатель вылупления;
- число вылупившихся комаров на сосуд;
- число внесенных личинок на сосуд.
Если больше
(т.е. непреднамеренно больше чем предусмотренное число внесенных личинок), то
считают равным
.
10.1.5.2 Альтернативой, которая наиболее подходит для больших выборок проб при наличии экстрабиноминальной дисперсии, является обработка показателя вылупления в виде постоянного эффекта и использование таких методов, как критерий Вильямса, если предполагается монотонная зависимость концентрация-эффект и совпадает с данными . При отсутствии монотонности подходит критерий Даннета. Большая выборка проб означает в данном случае количество вылупившихся личинок и количество невылупившихся личинок, в обоих случаях в более пяти повторностях (сосудах).
10.1.5.3 Для применения методов ANOVA значения вначале подвергают преобразованию "арксинус-квадратный корень" или преобразованию по методу Тьюки-Фримана для получения примерного нормального распределения и уравнивания дисперсий. При использовании абсолютных частот применяют критерий Кохрана-Армитажа, точный критерий Фишера или Ментеля-Хензеля. Преобразование "арксинус - квадратный корень" рассчитывают как арксинус (синус
) от квадратного корня
.
10.1.5.4 Для показателей вылупления рассчитывают значения ЕС, используя регрессионный анализ (или например, пробит, логит, анализ Вейбулла [28]). При невозможности применения регрессионного анализа (например, при наличии менее двух частичных эффектов) используют другие непараметрические методы, такие как скользящее среднее или простая интерполяция.
10.1.6 Скорость развития
10.1.6.1 Среднее время развития представляет собой средний временной интервал между внесением личинок (сутки 0 испытания) и вылуплением опытной группы комаров. (Для расчета фактического времени развития учитывают возраст личинок на время внесения). Скорость развития является обратной величиной времени развития (единица: 1/сутки) и представляет скорость развития личинки, которое имеет место в сутки. Скорость развития предпочтительна для оценки данных испытаний по токсичности с осадком, поскольку его дисперсия ниже и данные являются более однородными и ближе к нормальному распределению по сравнению со временем развития. Следовательно, для оценки скорости развития используют мощные параметрические критерии, но не для времени развития. Для скорости развития в виде постоянного эффекта значения ЕС устанавливают с использованием регрессионного анализа [29], [30]. NOEC для средней скорости развития определяют методами ANOVA, например, с использованием критериев Вильямса или Даннета. Поскольку самцы вылупляются раньше самок, т.е. имеют более высокую скорость развития, то рассчитывают скорость развития для каждого пола в дополнении к общей популяции комаров.
10.1.6.2 Для следующих статистических тестов число комаров, наблюдаемое при испытании на сутки , считают равным числу вылупившихся комаров за средний временной интервал между сутками
и сутками
(
- длина интервала между определениями, равна 1 сут). Среднюю скорость развития на сосуд
рассчитывают по формуле
![]() , (2)
, (2)
где: - интервал между определениями;
- максимальное число интервалов между определениями;
- число вылупившихся комаров в интервале между определениями
;
- число вылупившихся комаров в конце испытания, равное
;
- скорость развития вылупившихся комаров в интервале между определениями, определяемая по формуле
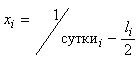 , (3)
, (3)
где ![]() - сутки после внесения;
- сутки после внесения;
- длина интервала между определениями
(обычно равна 1 сут).
10.1.7 Соотношение полов
Соотношение полов как дискретную величину оценивают с использованием точного критерия Фишера или других подходящих методов. Природное соотношение полов С. riparius составляет 1, т.е. число самок и самцов является одинаковым. Для обоих поколений данные по соотношению полов обрабатывают одинаково. Поскольку максимальное число комаров на сосуд, равное 20, слишком мало для представительного статистического анализа, то общее число вылупившихся и живых комаров каждого пола суммируют по всем сосудам в каждой обработке. Эти данные, не подвергшиеся преобразованию, сравнивают с контролем (растворителем) или объединенными контрольными данными в 22 таблице сопряженности.
10.1.8 Размножение
10.1.8.1 Размножение в виде плодовитости рассчитывают как число тяжей яиц на самку. Общее число образовавшихся тяжей яиц в камере для культивирования делят на число живых и неповрежденных самок, внесенных в камеру. NOEC для плодовитости определяют методом ANOVA, например критерием Вильямса или Даннета.
10.1.8.2 Фертильность тяжей яиц используют для количественного анализа числа тяжей фертильных яиц на самку. Общее число образовавшихся тяжей яиц в камере для культивирования делят на общее количество живых и неповрежденных самок, внесенных в камеру. NOEC для фертильности определяют методом ANOVA, например критерием Вильямса или Даннета.
10.2 Отчет о проведении испытания
Отчет о проведении испытания должен включать в себя следующую информацию.
10.2.1 Испытуемое вещество:
- физическая природа и при необходимости физико-химические свойства (растворимость в воде, давление пара, ![]() , коэффициент распределения в почве (или в осадке, если такие данные имеются), стабильность в воде и осадке и т.п.);
, коэффициент распределения в почве (или в осадке, если такие данные имеются), стабильность в воде и осадке и т.п.);
- данные по химической идентификации (общее наименование, структурная формула, номер CAS и т.п.), включая чистоту и аналитический метод количественного определения испытуемого вещества.
10.2.2 Вид тестового организма:
- используемые тестовые организмы: вид, научное наименование, источник организмов и условия культивирования;
- информация по обращению с кладками яиц и личинами;
- информация по обращению с вылупившимися взрослыми особями 1-го поколения с использованием аспиратора (см. приложение Г);
- возраст тестовых организмов на время внесения в испытуемые сосуды 1-го и 2-го поколений.
10.2.3 Условия испытания:
- используемый осадок, т.е. природный или искусственный осадок;
- для природного осадка: источник и описание места отбора проб осадка, включая, по возможности историю загрязнения; характеристики: рН, содержание органического углерода, соотношение C/N и гранулометрия при необходимости;
- приготовление искусственного осадка: компоненты и характеристики (содержание органического углерода, рН, влажность и т.п. в начале испытания);
- подготовка испытуемой воды (если используется восстановленная вода) и характеристики (концентрация кислорода, рН, проводимость, жесткость и т.п. в начале испытания);
- высота слоя осадка и надосадочной воды для испытуемых сосудов и кристаллизационных чашек;
- объем надосадочной воды и поровой воды; масса влажного осадка с и без поровой воды для испытуемых сосудов и кристаллизационных чашек;
- испытуемые сосуды (материал и размер);
- кристаллизационные чашки (материал и размер);
- камеры для культивирования (материал и размер);
- метод приготовления стоковых растворов и испытуемых концентраций для испытуемых сосудов и кристаллизационных чашек;
- внесение испытуемого вещества в испытуемые сосуды и кристаллизационные чашки: испытуемые концентрации, число повторностей и применение растворителя при необходимости;
- условия инкубации для испытуемых сосудов: температура, световой цикл и интенсивность, аэрация (число пузырьков в секунду);
- условия инкубации для камер для культивирования и кристаллизационных чашек: температура, световой цикл и интенсивность;
- условия инкубации тяжей яиц в микропланшетах (или других сосудах): температура, световой цикл и интенсивность;
- подробная информация о кормлении, включая тип корма, его подготовку, количество и режим кормления.
10.2.4 Результаты:
- номинальные испытуемые концентрации, установленные испытуемые концентрации и результаты всех анализов по определению концентрации испытуемого вещества в испытуемых сосудах и кристаллизационных чашках;
- качество воды в испытуемых сосудах и кристаллизационных чашках, то есть рН, температура, содержание растворенного кислорода, жесткость и уровень аммиака;
- возмещение испарившейся испытуемой воды в испытуемых сосудах, если это имело место;
- число вылупившихся комаров (самцов и самок) в сосуде и за сутки для 1-го и 2-го поколений;
- соотношение полов полностью вылупившихся и живых комаров на обработку для 1-го и 2-го поколений;
- число личинок невылупившихся комаров в сосуде для 1-го и 2-го поколений;
- процент/доля вылупления на повторность и испытуемую концентрацию (общее число самцов и самок комаров) для 1-го и 2-го поколений;
- средняя скорость развития полностью вылупившихся и живых комаров на повторность и каждую обработку (число самцов и самок комаров отдельно, а также общее число) для 1-го и 2-го поколений;
- число тяжей яиц, отложенных в кристаллизационных чашках каждой камеры для культивирования и за сутки;
- плодовитость - число тяжей яиц на число самок, внесенных в камеру для культивирования;
- фертильность - число тяжей фертильных яиц на число самок, внесенных в камеру для культивирования;
- значения токсических конечных точек, например ЕС (и соответствующие доверительные интервалы), NOEC и статистические методы, использованные для их определения;
- обсуждение результатов, включая любое влияние на результаты испытания, возникающее в результате отклонений от требований настоящего стандарта.
Приложение А
(рекомендуемое)
Рекомендации по культивированию Chironomus riparius*
_____________________
* В бумажном оригинале слова "Chironomus riparius" в наименовании приложения А выделены курсивом. - .
А.1 Личинки Chironomus культивируют в кристаллизационных чашках или более крупных контейнерах. Мелкий кварцевый песок распределяют тонким слоем высотой примерно 5-10 см над дном контейнера. Было показано, что кизельгур (например, Merck, Art 8117) является подходящим субстратом (достаточным является более тонкий слой в несколько мм). Затем добавляют соответствующую требованиям воду на высоту несколько см. Уровень воды пополняют при необходимости для восстановления потерь в результате испарения и предупреждения высыхания. Воду заменяют при необходимости. Проводят легкую аэрацию. Сосуды с культивируемыми личинками находятся в подходящей камере, которая будет предупреждать вылет вылупившихся взрослых особей. Камера должна быть достаточно большой, чтобы обеспечить роение вылупившихся взрослых особей, иначе не будет происходить копуляция (минимальный размер составляет примерно 3030
30 см).
А.2 Камеры находятся при комнатной температуре или при постоянной температуре окружающей среды (20±2)°С со световым периодом 16 ч свет (интенсивность примерно 1000 люкс), 8 ч темнота. Имеются данные, что влажность воздуха менее 60% относительной влажности может тормозить репродукцию.
Вода для разведения
А.3 Используют любую соответствующую требованиям природную или искусственную воду. Обычно используют колодезную воду, дехлорированную водопроводную воду и искусственные среды (например, среда Elendt "М4" или "М7", см. ниже). Перед применением воду аэрируют. При необходимости культуральную воду обновляют, осторожно сливая или откачивая использованную воду из сосудов для культивирования, не нарушая трубочек личинок.
Кормление личинок
А.4 Личинок Chironomus кормят хлопьевидным кормом для рыб (Tetra Min, Tetra Phyll
или кормом для рыб другой аналогичной марки) из расчета примерно 250 мг на сосуд в сутки. Корм вносят в виде сухого размельченного порошка или в виде суспензии в воде: 1,0 г хлопьевидного корма добавляют к 20 мл воды для разведения и перемешивают для получения однородной смеси. Такую суспензию скармливают из расчета 5 мл на сосуд в сутки (перед использованием встряхивают). Личинки более старшего возраста получают большее количество корма.
А.5 Кормление корректируют в зависимости от качества воды. Если культуральная среда становится "мутной", то количество вносимого корма уменьшают. Добавление корма тщательно контролируют. Слишком малое количество корма будет вызывать переселение личинок по водной колонке, а слишком большое количество корма будет вызывать повышенную микробиологическую активность и снижение концентрации кислорода. Оба фактора могут приводить к пониженным скоростям роста.
А.6 При закладке новых сосудов для культивирования также можно добавлять некоторые зеленые водоросли (например, Scenedesmus subspicatus, Chlorella vulgaris).
Кормление вылупившихся взрослых особей
А.7 Некоторые экспериментаторы предложили использовать ватные палочки, пропитанные насыщенным раствором сахарозы, служащие в качестве корма для вылупившихся взрослых особей.
Вылупление
А.8 При температуре (20±2)°С взрослые особи начинают вылупляться в сосудах с культивируемыми личинками примерно через 13-15 сут. Самцов легко отличить по перистым усикам.
Кладки яиц
А.9 После появления взрослых особей внутри камеры для культивирования все сосуды для культивирования личинок тщательно осматривают три раза в неделю на отложение студенистых кладок яиц. Если они присутствуют, то кладку яиц осторожно удаляют. Ее переносят в небольшую чашку, содержащую пробу воды для культивирования. Кладку яиц используют для закладки нового сосуда для культивирования (например, 2-4 кладки яиц/сосуд) или используют для испытания токсичности.
А.10 Личинки первой стадии развития вылупляются через 2-3 сут.
Закладка новых культуральных сосудов
А.11 После получения культур закладывают новые сосуды для культивирования личинок каждую неделю или реже в зависимости от требований испытания, удаляя более старые сосуды после вылупления взрослых комаров. Используя такую систему, можно получить регулярную продукцию взрослых особей при минимальных усилиях.
Получение испытуемых растворов "М4" и "М7"
А.12 В [35] описана среда "М4". Среду "М7" готовят как и среду "М4", за исключением веществ, приведенных в таблице А.1, концентрации которых в четыре раза ниже в среде "М7", чем в среде "М4". В литературе описано приготовление среды "М7" (Elendt, персональное сообщение). Испытуемый раствор не следует готовить в соответствии с [36] для концентраций NaSiO·5 H
O, NaNO
, KН
РО
и K
НРО
, которые не подходят для приготовления стоковых растворов.
Приготовление среды "М7"
А.13 Каждый стоковый раствор (I) готовят отдельно, а объединенный стоковый раствор (II) получают из данных стоковых растворов I (см. таблицу А.1). 50 мл объединенного стокового раствора (II) и определенное количество каждого стокового раствора макроэлементов, приведенных в таблице А.2, доводят до 1 л деионизированной водой с получением среды "М7". Стоковый раствор витаминов готовят добавлением трех витаминов к деионизированной воде, как показано в таблице А.3, и 0,1 мл объединенного стокового раствора витаминов добавляют к конечной среде "М7" непосредственно перед применением (стоковый раствор витаминов хранят замороженным небольшими порциями). Среду аэрируют и стабилизируют.
Таблица А.1 - Стоковые растворы микроэлементов для среды М4 и М7
Стоковый раствор (I) | Количество раствора, доведенное до 1 л деионизированной водой, мг | Для получения объединенного стокового раствора (II) смешивают следующие количества стокового раствора (I) и доводят до 1 л деионизированной водой, мл | Конечная концентрация в испытуемых растворах, мг/л | ||
М4 | М7 | М4 | М7 | ||
Н | 57190 | 1,0 | 0,25 | 2,86 | 0,715 |
МnСl | 7210 | 1,0 | 0,25 | 0,361 | 0,090 |
LiCI | 6120 | 1,0 | 0,25 | 0,306 | 0,077 |
RbCI | 1420 | 1,0 | 0,25 | 0,071 | 0,018 |
SrCl | 3040 | 1,0 | 0,25 | 0,152 | 0,038 |
NaBr | 320 | 1,0 | 0,25 | 0,016 | 0,004 |
Na | 1260 | 1,0 | 0,25 | 0,063 | 0,016 |
CuCI | 335 | 1,0 | 0,25 | 0,017 | 0,004 |
ZnCI | 260 | 1,0 | 1,0 | 0,013 | 0,013 |
СоСl | 200 | 1,0 | 1,0 | 0,010 | 0,010 |
Kl | 65 | 1,0 | 1,0 | 0,0033 | 0,0033 |
Na | 43,8 | 1,0 | 1,0 | 0,022 | 0,0022 |
NH | 11,5 | 1,0 | 1,0 | 0,00058 | 0,000058 |
Nа | 5000 | 20,0 | 5,0 | 2,5 | 0,625 |
FeSO | 1991 | 20,0 | 5,0 | 1,0 | 0,249 |
| |||||
Таблица А.2 - Стоковые растворы макроэлементов для среды "М4" и "М7"
Стоковый раствор | Количество раствора, доведенное до 1 л деионизированной водой, мг | Количество стоковых растворов макроэлемента, добавленное для приготовления сред "М4" и "М7", мл/л | Конечная концентрация в испытуемых растворах, мг/л |
CaCl | 293800 | 1,0 | 293,8 |
MgSО | 246600 | 0,5 | 123,3 |
KCI | 58000 | 0,1 | 5,8 |
NaHCО | 64800 | 1,0 | 64,8 |
NaSiO | 50000 | 0,2 | 10,0 |
NаNО | 2740 | 0,1 | 0,274 |
KН | 1430 | 0,1 | 0,143 |
K | 1840 | 0,1 | 0,184 |
Таблица А.3 - Стоковые растворы витаминов для среды "М4" и "М7"
Стоковый раствор | Количество раствора, доведенное до 1 л деионизированной водой, мг | Количество стоковых растворов витаминов, добавленное для приготовления сред "М4" и "М7", мл/л | Конечная концентрация в испытуемых растворах, мг/л |
Тиамин гидрохлорид | 750 | 0,1 | 0,075 |
Цианокобаламин (В12) | 10 | 0,1 | 0,0010 |
Биотин | 7,5 | 0,1 | 0,00075 |
Приложение Б
(рекомендуемое)
Приготовление искусственного осадка
Состав осадка
Состав искусственного осадка должен быть следующим.
Составляющий компонент | Характеристика | Содержание в сухой массе осадка, проценты |
Торф | Торф сфагнум, рН максимально близко к 5,5-6,0; без видимых растительных остатков, мелко измельченный (размер частиц не более 1 мм) и высушенный на воздухе | 4-5 |
Кварцевый песок | Размер частиц: более 50% частиц должно быть в диапазоне 50-200 мкм | 75-76 |
Каолиновая глина | Содержание каолинита не менее 30% | 20 |
Органический углерод | Доведенный добавлением торфа и песка | 2±0,5 |
Карбонат кальция | СаСО | 0,05-0,1 |
Вода | Проводимость не менее 10 мкС/см | 30-50 |
Приготовление
Торф высушивают на воздухе и измельчают до мелкого порошка. Готовят суспензию необходимого количества торфяного порошка в деионизированной воде с использованием высокоэффективного устройства для гомогенизации. рН данной суспензии доводят СаСО до 5,5±0,5. Суспензию кондиционируют в течение не менее двух суток при осторожном перемешивании при (20±2)°С для стабилизации рН и установления стабильного микробного компонента. Вновь измеряют рН, и его значение должно составлять 6,0±0,5. Затем торфяную суспензию перемешивают с другими составляющими компонентами (песком и каолиновой глиной) и деионизированной водой для получения однородного осадка с содержанием воды в диапазоне 30%-50% сухой массы осадка. Вновь определяют рН конечной смеси и при необходимости доводят СаСО
до 6,5-7,5. Отбирают пробы осадка для определения сухой массы и содержания органического углерода. Затем перед использованием в испытании токсичности для хирономид рекомендуют кондиционировать искусственный осадок в течение 7 сут в условиях, аналогичных последующему испытанию.
Хранение
Сухие компоненты для приготовления искусственного осадка хранят в сухом и прохладном месте при комнатной температуре. Искусственный (влажный) осадок не следует хранить до его использования в испытании. Осадок используют сразу же после 7 сут кондиционирования, когда заканчивается его подготовка.
Приложение В
(рекомендуемое)
Химические характеристики приемлемой воды, предназначенной для разведения
Вещество | Концентрация |
Вещество в виде частиц, мг/л | менее 20 |
Общее содержание органического углерода, мг/л | менее 2 |
Неионизированный аммиак, мкг/л | менее 1 |
Жесткость в виде СаСО | менее 400* |
Остаточный хлор, мкг/л | менее 10 |
Общее содержание фосфорорганических пестицидов, нг/л | менее 50 |
Общее содержание хлорорганических пестицидов плюс полихлорированных бифенилов, нг/л | менее 50 |
Общий органический хлор, нг/л | менее 25 |
* Необходимо отметить, что если предполагается наличие взаимодействия между ионами жесткости и испытуемым веществом, то используют воду с более низкой жесткостью (и, таким образом, в такой ситуации не используют среду Elendt M4). | |
Приложение Г
(рекомендуемое)
Руководство по проведению испытания
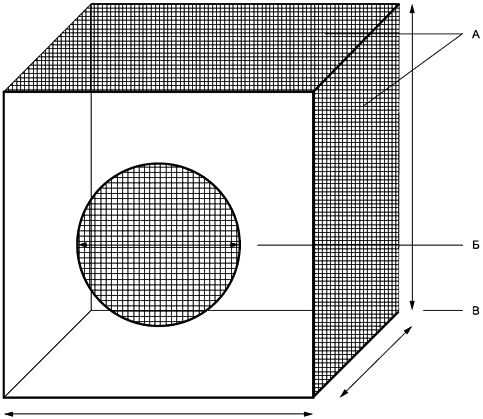
Пример камеры для культивирования приведен на рисунке Г.1.
А - марля в верхней части и по меньшей мере на одной стороне камеры (размер отверстий примерно 1 мм); Б - отверстие для внесения вылупившихся взрослых особей внутрь камеры для культивирования и извлечения тяжей отложенных яиц из кристаллизационных чашек (не показаны на рисунке); В - размер камеры для культивирования составляет минимум 30 см длиной, 30 см высотой и 30 см шириной
Рисунок Г.1 - Камера для культивирования
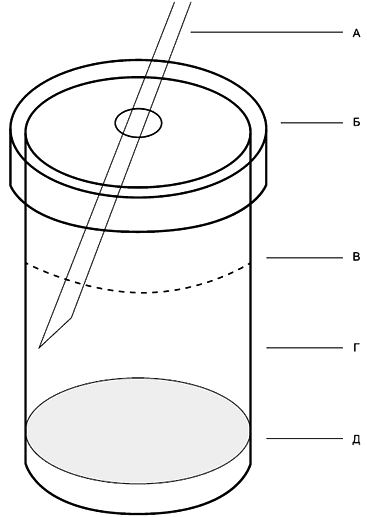
Пример испытуемого сосуда приведен на рисунке Г.2.
А - пастеровская пипетка для подачи воздуха в надосадочную жидкость; Б - стеклянная крышка для предупреждения вылета вылупившихся комаров; В - поверхностный слой воды; Г - испытуемый сосуд (стеклянный стакан вместимостью не менее 600 мл); Д - слой осадка
Рисунок Г.2 - Испытуемый сосуд
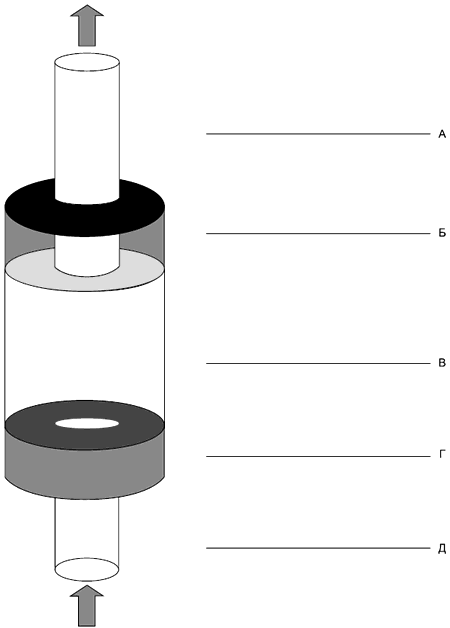
Пример аспиратора для сбора взрослых комаров (стрелками указаны направления потока воздуха) приведен на рисунке Г.3.
А - стеклянная трубка (внутренний диаметр примерно 5 мм), соединенная с самовсасывающим насосом; Б - пробка из вулканизованной резины, перфорированная стеклянной трубкой А. Внутри отверстие для стеклянной трубки А покрыто хлопчатобумажной тканью и марлей (размер отверстий примерно 1 мм) для предупреждения повреждения комаров при всасывании аспиратором; В - прозрачный контейнер (пластиковый или стеклянный длиной примерно 15 см) для собранных комаров; Г - пробка из вулканизованной резины, перфорированная трубкой Д. Для высвобождения комаров в камеру для культивирования пробка Г вынимается из контейнера В; Д - трубка (пластиковая или стеклянная, внутренний диаметр примерно 8 мм) для сбора взрослых комаров из сосуда
Рисунок Г.3 - Аспиратор для сбора взрослых комаров
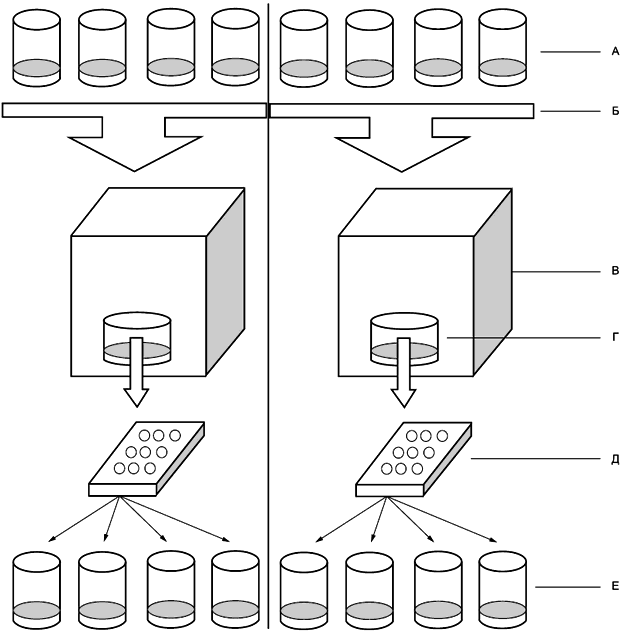
Схема проведения испытания цикла развития приведена на рисунке Г.4.
А - 1-е поколение - испытуемые сосуды, содержащие систему осадок-вода, 8 повторностей, 20 личинок 1-й стадии развития на сосуд; Б - четыре испытуемых сосуда для каждой камеры для культивирования, А и Б; В - камеры для культивирования (А и Б) для роения, спаривания и кладки яиц; Г - кристаллизационные чашки для кладки тяжей яиц; Д - микропланшеты, одна лунка на каждый тяж яиц; Е - 2-е поколение - испытуемые сосуды, содержащие систему осадок-вода, 8 повторностей, 20 личинок 1-й стадии развития на сосуд
Рисунок Г.4 - Ловушка для вылупления личинок хирономид
Приложение ДА
(справочное)
Сравнение структуры международного документа со структурой настоящего стандарта
Таблица ДА.1
Структура настоящего стандарта | Структура международного документа | |||
Разделы | Подразделы | Перечисления | Разделы | Перечисления |
Введение | - | - | 1, 2, 3, 4, 5, 6 | - |
1 | - | - | 1 | - |
2 | 2.1 | - | Приложение 1 | - |
2.2 | - | Приложение 1 | - | |
2.3 | - | Приложение 1 | - | |
2.4 | - | Приложение 1 | - | |
3 | - | - | 7 | - |
4 | - | - | 8 | - |
5 | - | - | 9 | - |
6 | - | - | 10 | - |
7 | 7.1 | - | 11 | - |
7.2 | - | 12 | - | |
7.3 | - | - | - | |
7.3.1 | а | 13 | а | |
б | b | |||
в | с | |||
г | d | |||
д | е | |||
е | f | |||
7.3.2 | - | 14 | - | |
7.4 | - | 15 | - | |
7.5 | - | 16а | - | |
7.6 | - | 16b | - | |
8 | - | - | 17 | - |
8.1 | - | - | - | |
8.1.1 | - | 18 | - | |
8.1.2 | - | 19 | - | |
8.2 | - | 20 | - | |
8.3 | - | 21 | - | |
9 | 9.1 | - | - | - |
9.1.1 | - | 22а | - | |
9.1.2 | - | - | - | |
9.1.2.1 | - | 22b | - | |
9.1.2.2 | - | 23 | - | |
9.1.3 | - | - | - | |
9.1.3.1 | - | 24 | - | |
9.1.3.2 | - | 25 | - | |
9.1.4 | - | 26 | - | |
9.1.5 | - | - | - | |
9.1.5.1 | - | 27 | - | |
9.1.5.2 | - | 28 | - | |
9.1.5.3 | - | 29а | - | |
9.1.5.4 | - | 29b | - | |
9.1.5.5 | - | 30 | - | |
9.1.6 | - | 31 | - | |
9.1.7 | - | - | - | |
9.1.7.1 | - | 32 | - | |
9.1.7.2 | - | 33 | - | |
9.1.8 | - | 34 | - | |
9.2 | - | - | - | |
9.2.1 | - | - | - | |
9.2.1.1 | - | 35 | - | |
9.2.1.2 | - | 36 | - | |
9.2.2 | - | 37 | - | |
9.3 | - | - | - | |
9.3.1 | - | - | - | |
9.3.1.1 | - | 38 | - | |
9.3.1.2 | - | 39 | - | |
9.3.1.3 | - | 40 | - | |
9.3.2 | - | 41 | - | |
10 | 10.1 | - | - | - |
10.1.1 | - | 42 | - | |
10.1.2 | - | 43 | - | |
10.1.3 | - | 44 | - | |
10.1.4 | - | 45 | - | |
10.1.5 | - | - | - | |
10.1.5.1 | - | 46 | - | |
10.1.5.2 | - | 47 | - | |
10.1.5.3 | - | 48 | - | |
10.1.5.4 | - | 49 | - | |
10.1.6 | - | - | - | |
10.1.6.1 | - | 50 | - | |
10.1.6.2 | - | 51 | - | |
10.1.7 | - | 52 | - | |
10.1.8 | - | - | - | |
10.1.8.1 | - | 53 | - | |
10.1.8.2 | - | 54 | - | |
10.2 | - | 55 | - | |
Приложение А | Приложение 2 | |||
Приложение Б | Приложение 3 | |||
Приложение В | Приложение 4 | |||
Приложение Г | Приложение 5 | |||
Библиография | Литература | |||
Библиография
[1] | OECD (2004), Sediment-water chironomid toxicity test using spiked water, Test Guideline No. 219, Guidelines for the Testing of Chemicals, OECD, Paris |
[2] | OECD (2004), Sediment-water chironomid toxicity test using spiked sediment, Test Guideline No. 218, Guidelines for the Testing of Chemicals, OECD, Paris |
[3] | Shobanov, N.A., Kiknadze, I.I. and M.G. Butler (1999), Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera: Chironomidae). Entomologica Scandinavica, 30: 311-322 |
[4] | Fleming, R. et al. (1994), Sediment Toxicity Tests for Poorly Water-Soluble Substances, Final Report to the European Commission, Report No: EC 3738. August 1994. WRc, UK |
[5] | SETAC (1993), Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments, From the WOSTA Workshop held in the Netherlands |
[6] | ASTM International (2009), E1706-05E01: Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, In: Annual Book of ASTM Standards, Volume 11.06, Biological Effects and Environmental Fate; Biotechnology. ASTM International, West Conshohocken, PA |
[7] | Environment Canada (1997), Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius), Biological Test Method, Report SPE 1/RM/32, December 1997 |
[8] | US-EPA (2000), Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates, Second edition, EPA 600/R-99/064, March 2000, Revision to the first edition dated June 1994 |
[9] | US-EPA/OPPTS 850.1735 (1996), Whole Sediment Acute Toxicity Invertebrates |
[10] | US-EPA/OPPTS 850.1790 (1996), Chironomid Sediment toxicity Test |
[11] | Milani, D., Day, K.E., McLeay, D.J. and R.S. Kirby (1996), Recent intra- and inter-laboratory studies related to the development and standardization of Environment Canada's biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius), Technical Report, Environment Canada, National Water Research Institute, Burlington, Ontario, Canada |
[12] | Norberg-King, T.J., Sibley, P.K., Burton, G.A., Ingersoll, C.G., Kemble, N.E., Ireland, S., Mount, D.R. and C.D. Rowland (2006), Interlaboratory evaluation of Hyalella azteca and Chironomus tentans short-term and long-term sediment toxicity tests, Environ. Toxicol. Chem., 25: 2662-2674 |
[13] | Taenzler, V., Bruns, E., Dorgerloh, M., Pfeifle, V. and L. Weltje (2007), Chironomids: suitable test organisms for risk assessment investigations on the potential endocrine-disrupting properties of pesticides, Ecotoxicology, 16: 221-230 |
[14] | Sugaya, Y. (1997), Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui, Jp. J. Sanit. Zool, 48: 345-350 |
[15] | Kawai, K. (1986), Fundamental studies on chironomid allergy, I. Culture methods of some Japanese chironomids (Chironomidae, Diptera), Jp. J. Sanit. Zool., 37: 47-57 |
[16] | OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environment, Health and Safety Publications, Series on Testing and Assessment No. 23, ENV/JM/MONO(2000)6, OECD, Paris |
[17] | Weltje, L., Rufli, H., Heimbach, F., Wheeler, J., Vervliet-Scheebaum, M. and M. Hamer (2010), The chironomid acute toxicity test: development of a new test system, Integr. Environ. Assess. Management |
[18] | Environment Canada. (1995), Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant, Report EPS 1/RM/30, September 1995 |
[19] | Oetken, M, Nentwig, G., |
[20] | Suedel, B.C. and J.H. Rodgers (1994), Development of formulated reference sediments for freshwater and estuarine sediment testing, Environ. Toxicol. Chem., 13: 1163-1175 |
[21] | Naylor, С. and С. Rodrigues (1995), Development of a test method for Chironomus riparius using a formulated sediment, Chemosphere, 31: 3291-3303 |
[22] | Dunnett, C.W. (1964), A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc, 50: 1096-1121 |
[23] | Dunnett, C.W. (1964), New tables for multiple comparisons with a control, Biometrics, 20: 482-491 |
[24] | Williams, D.A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103-117 |
[25] | Williams, D.A. (1972), The comparison of several dose levels with a zero dose control. Biometrics, 28: 510-531 |
[26] | Jungmann, D., Bandow, C., Gildemeister, T., Nagel, R., Preuss, T.G., Ratte, H.T., Shinn, C., Weltje, L. and H.M. Maes (2009), Chronic toxicity of fenoxycarb to the midge Chironomus riparius after exposure in sediments of different composition. J Soils Sediments, 9: 94-102 |
[27] | Rao, J.N.K. and A.J. Scott (1992), A simple method for the analysis of clustered binary data. Biometrics, 48: 577-585 |
[28] | Christensen, E.R. (1984), Dose-response functions in aquatic toxicity testing and the Weibull model, Water Res., 18: 213-221 |
[29] | Bruce, R.D. and D.J. Versteeg (1992), A statistical procedure for modelling continuous toxicity data, Environ. Toxicol. Chem, 11: 1485-1494 |
[30] | Slob, W. (2002), Dose-response modelling of continuous endpoints. Toxicol. Sci., 66: 298-312 |
[31] | OECD (2006), Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application, OECD Series on Testing and Assessment No. 54, 146 pp., ENV/JM/MONO(2006)18, OECD, Paris |
[32] | Benoit, D.A., Sibley, P.K., Juenemann, J.L. and G.T. Ankley (1997), Chironomus tentans life-cycle test: design and evaluation for use in assessing toxicity of contaminated sediments, Environ. Toxicol. Chem., 16: 1165-1176 |
[33] | Vogt, С., Belz, D., Galluba, S., Nowak, C., Oetken, M. and J. Oehlmann (2007), Effects of cadmium and tributyltin on development and reproduction of the non-biting midge Chironomus riparius (Diptera) - baseline experiments for future multi-generation studies, J. Environ. Sci. Health Part A, 42: 1-9 |
[34] | OECD (2010), Validation report of the Chironomid full life-cycle toxicity test, Forthcoming publication in the Series on Testing and Assessment, OECD, Paris |
[35] | Elendt B.P. (1990): selenium deficiency in Crustacean. Protoplasma, 154, 25-33 |
[36] | Elendt B.P. & W.-R. Bias (1990): trace nutrient deficiency in Daphnia magna cultured in standard medium for toxicity testing. Effects on the optimization of culture conditions on life history parameters of D. magna. Water Research 24(9), 1157-1167 |
УДК 658.382.3:006.354 | МКС 13.020.01 | Т58 |
Ключевые слова: химическая продукция, окружающая среда, токсичность, хирономиды, цикл развития, обогащенная вода, обогащенный осадок | ||
Электронный текст документа
и сверен по:
, 2016