ГОСТ 32368-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Оценка репродуктивной способности рыб
Testing of chemicals of environmental hazard. Fish short term reproduction assay
МКС 13.020
Дата введения 2014-08-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены".
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ" (ФГУП "ВНИЦСМВ") на основе аутентичного перевода на русский язык международного документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Росстандарт)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 5 ноября 2013 г. N 61-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Азербайджан | AZ | Азстандарт |
Беларусь | BY | Госстандарт Республики Беларусь |
Армения | AM | Минэкономики Республики Армения |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Туркменистан | TM | Главгосслужба "Туркменстандартлары" |
Узбекистан | UZ | Узстандарт |
Украина | UA | Минэкономразвития Украины |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г. N 791-ст межгосударственный стандарт ГОСТ 32368-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 августа 2014 г.
5 Настоящий стандарт идентичен международному документу OECD. Test No. 229:2009* "Fish short term reproduction assay" (ОЭСР, Тест N 229 "Оценка репродуктивный способности рыб").
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Международный документ разработан Организацией экономического сотрудничества и развития (ОЭСР/OECD).
Перевод с английского языка (en).
Степень соответствия - идентичная (IDT).
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячных информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомления и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
Введение
Необходимость разработки и утверждения методики анализа репродуктивной способности рыб, способного обнаружить эндокринно-активные вещества, обусловлена опасением, что фоновый уровень загрязнения химическими веществами окружающей среды может оказывать вредное воздействие и на человека, и на объекты окружающей среды путем взаимодействия этих веществ с эндокринной системой.
Метод оценки репродуктивной способности рыб прошел широкую программу проверки, состоящей из межлабораторных исследований с отдельными химическими веществами для демонстрации актуальности и достоверности данного метода испытаний веществ, влияющих на воспроизводство рыб и различные механизмы, включая эндокринные. Все результаты испытаний в соответствии с описываемым методом были проверены на гольяне (Pimephales promelas) и были подтверждены на японской медаке (Oryzias latipes) (вителлогенин и вторичные половые признаки) и данио рерио (вителлогенин).
1 Область применения
Настоящий стандарт описывает in vivo пробит-тестна группе рыб (состоящей из половозрелых самцов и самок в репродуктивном возрасте), подвергающихся воздействию химиката в период, ограниченный их биологическим циклом (21 день). По завершении 21-дневного периода воздействия измеряют два биомаркера у самцов и самок в качестве показателей эндокринной активности исследуемых химических веществ. Этими биомаркерами являются вителлогенин (VTG) и вторичные половые признаки. VTG измеряют у толстоголового гольяна, данио рерио и японской медаки, вторичные половые признаки измеряю у толстоголового гольяна и японской медаки.
Анализ не предназначен для определения конкретных механизмов гормонального нарушения, поскольку подопытные животные обладают здоровой гипоталамо-гипофизарно-гонадной (ГГГ) осью и способны реагировать на вещества, воздействующие на ось ГГГ на различных уровнях.
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 коэффициент вариации (КВ) (CV - coefficient of variation).
2.2 ELISA (Enzyme-Linked Immunosorbent Assay): Твердофазный иммуноферментный анализ.
2.3 величина загрузки (Loading rate): Живой вес рыбы в объеме воды.
2.4 плотность заселения (Stocking density): Количество рыб в объеме воды.
2.5 ВТГ (VTG): Вителлогенин-фосфолипогликопротеин, предшественник белка желтка яйцеклетки, который обычно синтезируется у сексуально активных самок всех яйцекладущих видов.
2.6 ось ГГГ (HPGaxis): Гипоталамическая гипофизарная гонадальная ось.
2.7 МДК: Максимальная допускаемая концентрация (составляет приблизительно 10% LC50).
3 Основные положения
3.1 Исходные положения и ограничения
3.1.1 На протяжении всего испытания ежедневно количественно отслеживают репродуктивность. Сохраняют половые железы и оценивают гистопатологию для характеристики репродуктивной способности подопытных животных и придания убедительности другим результатам.
3.1.2 Данный биоанализ проводят в естественных условиях. В настоящем стандарте репродуктивную способность рыб рассматривают как метод анализа в естественных условиях и предоставления данных о нескольких механизмах эндокринной системы.
3.1.3 VTG обычно производится печенью самок яйцекладущих позвоночных в ответ на циркуляцию эндогенного эстрогена, предшественника белков яичного желтка, который производится печенью и затем переносится кровотоком в яичники, где используется в развитии и изменении ооцитов. VTG практически необнаружим в плазме незрелых самок и самцов рыб, потому что они испытывают недостаток в эстрогене; однако их печень способна к синтезу и выделению VTG в ответ на экзогенную стимуляцию эстрогена.
3.1.4 Измерение VTG используют для обнаружения веществ с различными антиэстрогенными свойствами. Обнаружение антиэстрогенных химических веществ возможно через измерение индукции VTG y самцов рыб. Индукция VTG была также продемонстрирована после экспонирования ароматизированными андрогенами. Снижение уровня циркулирующих эстрогенов у самок в результате, например, ингибирования ароматазы-фермента, который превращает андрогены в эндогенные эстрогены в естественных условиях (17-эстрадиол), приводит к снижению уровня VTG, используемого для обнаружения ингибиторов ароматазы. Биологическая значимость реакции VTG в ответ на ингибирование эстрогена/ароматазы установлена и хорошо изучена. Однако производство VTG у самок также может быть изменено общей токсичностью и токсическим действием веществ не обладающих эндокринной токсичностью (например, гепатотоксичность).
3.1.5 Несколько методов измерения были успешно разработаны и стандартизированы для повседневного использования. Это касается конкретных видов иммуноферментного анализа (ИФА), использующихся в иммунохимии для количественного определения VTG, синтезированного в малых образцах крови или печени, собранных от отдельных особей рыб. Образцы для измерения VTG отбирают у трех видов: толстоголового гольяна (кровь), данио рерио (кровь или гомогенат головы/хвоста) и медаки японской (печень). У японской медаки наблюдается высокая корреляция между концентрацией VTG, измеренной в крови и печени. В приложении А приведены рекомендуемые процедуры отбора проб для анализа VTG. Оборудование для измерения вителлогенина доступно, такие установки должны быть основаны на проверке видоспецифическим методом ИФА.
3.1.6 Вторичные половые признаки у самцов рыб отдельных видов являются вполне различимыми, определяются количественно и реагируют на уровни циркулирующих эндогенных андрогенов, в случае толстоголового гольяна и японской медаки, но не для данио рерио, не обладающего вторичными половыми признаками, которые возможно измерить количественно. Самки обнаруживают способность формировать мужские вторичные половые признаки, когда они подвергаются действию андрогенных веществ в воде. Уменьшение вторичных половых признаков у самцов следует интерпретировать с осторожностью из-за низкой статистической достоверности и должно быть подтверждено экспертными оценками и убедительными доказательствами. Существуют ограничения в использовании данио рерио в этом пробит анализе, в связи с отсутствием измеримых вторичных половых признаков, чувствительных к действию андрогенотоксичных веществ.
3.1.7 У толстоголового гольяна главным индикатором воздействия экзогенного андрогена является количество брачных бугорков, расположенных на передней части головы самки. У японской медаки главным маркером экзогенного воздействия андрогенов является количество папиллярных бугорков у самок рыб. В приложении В и приложении С приведены рекомендуемые процедуры, которым необходимо следовать для оценки половых характеристик толстоголового гольяна и японской медаки, соответственно.
3.1.8 21-дневная методика анализа рыб включает количественную оценку производства яйцеклеток и сохранение гонад для дополнительной экспертизы гистопатологии. Некоторые регулирующие органы могут потребовать наличия данного показателя для более полной оценки репродуктивной функции подопытных животных, или в случаях, когда вителлогенин и вторичные половые признаки не реагируют на воздействие химических веществ. Некоторые показатели легко диагностируемы (например, индукция вителлогенина у самцов и образование бугорка у самок), не все данные анализа (например, плодовитость и гистопатология гонад) способны однозначно определить конкретные клеточные механизмы действия. Совокупность полученных результатов позволяет сделать выводы в отношении возможных нарушений эндокринной системы и тем самым служит руководством для дальнейших испытаний. Хотя этот параметр не относится к эндокринному и к общей плодовитости из-за демонстрации чувствительности на воздействие известных эндокринно-активных веществ, он является важным показателем, так как отсутствие данных реакций, а также других реакций увеличивает вероятность того, что соединение не имеет эндокринной активности.
3.2 Принцип теста
3.2.1 В пробит-анализе самцы и самки рыб репродуктивного возраста совместно подвергаются воздействию в тестовых сосудах. Состояние нереста позволяет дифференцировать каждый пол и таким образом связать результаты с анализом каждой конечной точки, а также гарантирует их чувствительность к экзогенным химическим веществам. По завершении теста животные подвергаются макроскопическим исследованиям гонад после вскрытия брюшной полости ножницами. Обзор соответствующих условий для отбора биопроб приведен в приложении D.
Исследование начинают с отбора рыб, выбранных из поголовья, которое находится в состоянии икрометания; старые животные не должны использоваться. Исследование проводят с использованием воздействия трех концентраций химического вещества плюс "чистый" контроль и контрольная проба с растворителем, если это необходимо. Используют два параллельных испытания (каждый сосуд, содержит пять самцов и пять самок) для японской медаки или данио рерио, тогда как для толстоголового гольяна используют четыре репликации (каждый сосуд, содержит два самца и четыре самки). Этот принцип учитывает территориальное поведение самцов толстоголового гольяна, сохраняя при этом достаточную точность анализа. Время экспозиции составляет 21 день, отбор образцов также осуществляется на 21-й день.
3.2.2 На 21-й день все рыбы подвергаются эвтаназии. Вторичные половые признаки измеряют на толстоголовом гольяне и японской медаке (приложения B и C); отбирают образцы крови для определения вителлогенина у данио рерио и толстоголового гольяна, альтернативно голова/хвост может быть отобраны для определения вителлогенина у данио рерио (приложение А); образцы печени, отбираются для анализа VTG у японской медаки (приложение А); все гонады фиксируются по отдельности для потенциальных гистопатологических оценок.
3.3 Критерии достоверности исследования
Для результатов теста могут быть применены следующие условия:
- смертность в воде (или растворителе) не должна превышать 10% на момент окончания периода воздействия;
- концентрация растворенного кислорода должна составлять по крайней мере, 60% величины воздушного насыщения в течение всего периода воздействия;
- температура воды не должна колебаться более чем на ±1,5°С между тестовыми сосудами в любой момент проведения теста и должна поддерживаться в пределах диапазона в 2°С определенном для тестируемых видов (приложение D);
- полученные данные должны демонстрировать, что концентрация тестируемого вещества в растворе поддерживается в пределах ±20% средневзвешенных значений;
- рыбы должны находиться в состоянии активного нереста во всех взятых для оценки воздействия химических веществах и в контроле во время теста.
4 Описание метода
4.1 Оборудование
Стандартное лабораторное оборудование, в частности:
- кислородомеры и рН-метры;
- оборудование для определения жесткости и щелочности воды;
- надлежащий прибор для контроля температуры, предпочтительно, непрерывного действия;
- емкости, выполненные из химически инертного материала и имеющие объем соответствующий рекомендуемой загрузке и плотности заселения (приложение D);
- свежий субстрат для толстоголового гольяна и данио рерио (приложение E);
- весы соответствующего класса точности (±0,5 мг).
4.2 Вода
Для эксперимента может быть использована любая вода, которая обеспечивает условия долговременного выживания и рост тестовых видов. Она должна иметь постоянные характеристики в течение проведения теста. Величина рН воды должно быть в диапазоне 6,5-8,5, но во время теста это значение должно колебаться в пределах ±0,5. Чтобы гарантировать, что вода, используемая для разбавления, не будет влиять на результаты эксперимента (например, путем образования комплексов с тестируемым веществом), должны быть взяты пробы воды для анализа.
Необходимо каждые три месяца в разбавляющей воде измерять концентрацию тяжелых металлов (,
,
,
,
,
и т.д.), основных анионов и катионов (
,
,
,
,
,
и т.д.), пестицидов (общее содержание фосфора и хлорорганических веществ), содержание общего органического углерода и сухой остаток для того, чтобы быть уверенным в том, что вода является относительно постоянной по своему составу. Если существуют доказательства того, что качество воды постоянно в течение года, определения могут быть менее частыми (например, каждые шесть месяцев). Некоторые химические характеристики приемлемого разбавления водой перечислены в приложении F.
4.3 Тестовый раствор
4.3.1 Тестовые растворы требуемых концентраций готовят путем разбавления основного раствора. Основной раствор подготавливают путем растворения необходимых веществ в воде с использованием механических средств (например, магнитные или ультразвуковые мешалки). Для получения необходимого концентрированного раствора можно использовать таблицы растворимости. Использование растворителей не рекомендуется. Однако при необходимости нужно отдельно поставить контрольную пробу с растворителем в той же самой концентрации, что и в эксперименте. Выбор растворителя будет определяться химическими свойствами вещества. Рекомендуется максимальная концентрация растворителя 100 мкл/л. Рекомендуется минимизировать концентрацию растворителя везде, где это технически выполнимо (в зависимости от физико-химических свойств исследуемого вещества).
4.3.2 Может быть использован динамический (проточный) тип эксперимента. Такой тест требует установки системы непрерывного распределения и разбавления основного раствора исследуемого вещества (например, дозаторный насос, пропорциональный разбавитель, система растворения) для обеспечения ряда концентраций в тестовых аквариумах. Объемные скорости потока основных растворов и разбавляющей воды следует проверять регулярно, предпочтительно ежедневно, во время теста и они не должны меняться более чем на 10% в течение теста. Необходимо с осторожностью использовать низкосортные пластиковые трубки или другие материалы, которые могут содержать биологически активные вещества. Выбирая материал для перекачивающей системы, необходимо учитывать возможную адсорбцию исследуемого вещества на этом материале.
4.4 Содержание подопытных рыб
4.4.1 Подопытные рыбы должны быть отобраны из лабораторий, предпочтительно из одной лаборатории, и должны быть акклиматизированы в течение по крайней мере двух недель до теста при условиях качества воды и освещения, подобных используемым в тесте. Важно соблюдать норму заселения в аквариумы для каждого тестового вида рыб (приложения D и G).
4.4.2 После 48-часового периода акклиматизации регистрируют смертность и следующие параметры:
- более чем 10% смертность выборки через семь дней: исключают из эксперимента всю группу;
- смертность между 5% и 10% выборки: акклиматизация в течение семи дополнительных дней; если более чем 5% смертность в течение дополнительных семи дней: исключают из эксперимента всю группу;
- смертность меньше 5% выборки через семь дней: рыбы допускаются к тесту.
4.4.3 Рыбы не должны получать лечение от болезней во время периода акклиматизации, в период перед экспозицией или во время теста.
4.5 Предварительная экспозиция и выбор рыб
4.5.1 В период от одной до двух недель до контакта рекомендуется поместить рыб в емкости, аналогичные тестовым. Рыб необходимо хорошо кормить в течение периода акклиматизации и экспозиции. Период экспозиции начинают с отбора взрослых сексуально диморфных особей из лабораторной поставки половозрелых животных (например, с выраженными вторичными половыми признаками, заметными у толстоголовый гольяна и японской медаки), пригодными для разведения. Для ориентира (эти критерии не могут рассматриваться изолировано от фактически наблюдаемого репродуктивного статуса конкретных рыб), толстоголовый гольян должен быть приблизительно 20 (±2) недельного возраста, при условии, что рыбки выращивались при температуре 25 (±2)°С в течение всей продолжительности жизни. Японская медака должна быть приблизительно 16 (±2) недель, содержащаяся при 25 (±2)°С в течении всей жизни. Данио рерио должны быть приблизительно 16 (±2) недель при культивации при 26 (±2)°С. Производство яйцеклеток следует оценивать ежедневно в течение предварительной экспозиции. Рекомендуется, чтобы икрометание наблюдалось во всех репликациях до начала фазы экспозиции. Рекомендации по значению количества ежедневно производящейся икры не могут быть предоставлены на данном этапе, но довольно часто наблюдается в среднем более 10 яйцеклеток/самка/день для каждого вида.
4.6 Процедура тестового метода
4.6.1 Используют два раствора различных концентраций исследуемого вещества, один контрольный (вода) и, при необходимости, один раствор с растворителем. Данные могут быть проанализированы для определения статистически значимых различий между основными и контрольными растворами. Эти анализы дают представление о долгосрочном воздействии теста на побочные эффекты (а именно, выживание, развитие, рост и размножение), необходимые для оценки химического вещества, а не для использования при оценке рисков.
4.6.2 Для данио рерио и японской медаки, на 21-й день эксперимента, в экспериментальных группах каждой тестируемой концентрации (пять самцов и пять самок в каждой из двух повторностей) и в контроле(ях) берут пробы на вителлогенин и вторичные половые признаки, где это применимо. Для толстолобого гольяна на 21-й день экспозиции, самцов и самок (2 самца и 4 самки в каждой из четырех репликаций) и в контроля(ях) берут пробы для измерения вителлогенина и проверки вторичных половых признаков.
Количественная оценка плодовитости, если это необходимо, и гонадный материал фиксируют целиком или в части, необходимой для проведения гистопатологической оценки, в случае необходимости.
4.7 Выбор тестовых концентраций
4.7.1 Для данного теста самой высокой тестируемой концентрацией должна быть максимально допускаемая концентрация (МДК), установленная в ходе предварительного эксперимента или от других данных токсичности, или принимают равной 10 мг/л, или определяют исходя их* максимальной растворимости в воде, выбирая самую низкую концентрацию. МДК определяют как самую высокую тестовую концентрацию вещества, которая приводит к менее чем 10% смертности. Использование этого подхода предполагает, что существуют эмпирические данные по острой или другой токсичности, по которым может быть оценена МДК. Оценка МДК может быть неточной и обычно требует некоторого обсуждения.
________________
* Текст документа соответствует оригиналу. - .
4.7.2 Требуются три тестовые концентрации с постоянным фактором, не превышающим 10, и контроль без вещества (в случае необходимости еще и контроль с растворителем). Рекомендуется диапазон факторов разбавления между 3,2 и 10.
5 Процедура испытания
5.1 Выбор и взвешивание экспериментальных рыб
Важно минимизировать разброс в весе рыб в начале теста (приложение D). Диапазон индивидуального веса для самцов и самок рыб в начале теста должен быть по возможности в пределах ±20% от среднего арифметического веса животных того же пола. Взвешивание рекомендуется проводить в период предварительной экспозиции.
5.2 Условия воздействия
5.2.1 Продолжительность
Продолжительность теста - 21 день после периода предварительной экспозиции. Рекомендуемый период предварительной экспозиции - одна неделя.
5.2.2 Кормление
5.2.2.1 Рыб необходимо кормить соответствующим кормом в объемах достаточных для поддержания физической формы. Необходимо соблюдать осторожность, чтобы избежать роста микроорганизмов и помутнения воды. Рекомендуется ежедневную порцию делить на две или три равные части для многократного кормления в сутки, разделяя каждое кормление по крайней мере трехчасовым промежутком. Корм можно давать одной большой порцией во время выходных дней. Кормление необходимо прекратить за 12 ч, до начала выборки/вскрытия животных.
5.2.2.2 Пища рыб должна быть проверена на наличие загрязняющих примесей, таких как хлорорганические пестициды, полициклические ароматические углеводороды (ПАУ), полихлорированные бифенилы (ПХБ). Корм с высоким уровнем фитоэстрогенов, который может поставить под угрозу точность анализа как известных антагонистов эстрогена (например, 17 эстрадиол) недопустим.
5.2.2.3 Несъеденную пищу и фекалии следует удалять из тестовых емкостей по крайней мере два раза в неделю, например, с помощью тщательной очистки дна с помощью сифона.
5.2.3 Свет и температура
Фотопериод и температура воды должны соответствовать требованиям содержания видов (приложение D).
5.3 Частота аналитических определений и измерений
5.3.1 До начала периода экспозиции должна быть проверена система внесения вещества. Все необходимые аналитические методы должны быть проведены, включая информацию о стабильности вещества в тестируемой среде. Во время теста концентрацию исследуемого вещества определяют через равные промежутки следующим образом: объемные скорости потока растворителя и основного раствора исследуемого вещества по возможности ежедневно, но реже чем два раза в неделю, и не должны изменяться более чем на 10% в течение теста. Рекомендуется измерять фактические концентрации вещества во всех сосудах в начале теста и в еженедельных интервалах после этого.
5.3.2 Рекомендуется обосновывать результаты на измеренных концентрациях. Если концентрация тестового вещества в растворе была удовлетворительно поддержана в пределах ±20% от номинальной концентрации в течение всего теста, то результаты могут быть привязаны или к номинальной концентрации, или измеренным значениям.
5.3.3 При необходимости образцы должны быть отфильтрованы (например, с помощью фильтра с размерами пор 0,45 мкм) или отцентрифугированы. Центрифугирование является предпочтительным. Если тестируемое вещество не адсорбирует на фильтры, фильтрация приемлема.
5.3.4 Во время теста растворенный кислород, температура и рН среды должны измеряться во всех тестовых сосудах по крайней мере раз в неделю. Общая жесткость и щелочность должны измеряться в одном сосуде с самой высокой концентрацией по крайней мере раз в неделю. Температура должна проверяться непрерывно по крайней мере в одном тестовом сосуде.
5.4 Наблюдения
Ряд общих биологических реакций (выживание, например) и целевых тестов (уровни вителлогенина, например) оценивают в ходе или по окончании теста. Количественный контроль плодовитости можно при необходимости проводить ежедневно. Измерения и оценки этих биомаркеров и их полезность описаны далее в настоящем стандарте.
5.4.1 Выживание
Рыбы должны обследоваться ежедневно во время тестового периода, и смертность в этот период должна регистрироваться. Мертвые рыбы должны быть удалены как можно скорее. Заменять мертвых рыб в контроле или в тестовых сосудах нельзя. Пол рыб, которые гибнут во время теста, должен быть определен макроскопической оценкой гонад.
5.4.2 Поведение и внешний вид
5.4.2.1 Любое отклонение в поведении (относительно контроля) должно быть отмечено; это может быть проявлением общей токсичности, включая гипервентиляцию, нескоординированное плавание, потерю равновесия, неподвижность или атипичное кормление. Следует также отмечать любые внешние аномалии (например, кровотечение, изменение цвета). Следует проявлять осторожность при интерпретации этих признаков токсичности, так как они не являются надежными свидетельствами биомаркеров о потенциальном воздействии на эндокринную систему. Эти наблюдения могут также предоставить качественную информацию, полезную для планирования будущих экспериментов на рыбах, например, территориальную агрессивность самцов или маскулинизацию самок у толстоголового гольяна под воздействием андрогенов. Характерное поведение данио рерио выметывать икру с первыми лучами солнца может меняться под воздействием эстрогенов или антиандрогенов.
5.4.2.2 Наблюдения за качественными изменениями в поведении рыб важны также и при отборе экспериментальных животных. Некоторые активные для эндокринной системы вещества могут немедленно повлиять на следующие особенности поведения толстоголового гольяна: окраска (осветление или потемнение), равномерность окраски (наличие вертикальных полос) и форма тела (в районе головы и груди). Поэтому наблюдения за физическим появлением рыб следует проводить в течение всего теста, вплоть до его завершения.
5.4.3 Плодовитость
Ежедневные количественные наблюдения нереста должны быть записаны в рабочий журнал. Образование яйцеклеток должно учитываться как количество яйцеклеток/количество выживших самок/день. Яйцеклетки удаляются из испытательных камер ежедневно. Поверхность для нереста должна быть помещена в испытательную камеру для видов толстоголового гольяна и данио рерио чтобы испытуемые рыбы шли на нерест в нормальных условиях. Приложение E
дает более подробную информацию о рекомендуемых нерестовых субстратах для видов данио рерио и толстоголовый гольян. Обеспечение вида японская медака субстратом для нереста не считается необходимым.
5.4.4 Эвтаназия рыбы
В 21-й день, то есть в завершении экспозиции, рыбы должны быть подвергнуты эвтаназии с помощью раствора трикаина (трикаина метансульфонат, Metacain, MS 222 (CAS 886-86-2) в концентрации 100-500 мг/л, буферизованных с 300 мг/л ![]() (CAS 144-55-8), предназначенного для снижения раздражения слизистой оболочки; кровь и ткань собирают для определения вителлогенина.
(CAS 144-55-8), предназначенного для снижения раздражения слизистой оболочки; кровь и ткань собирают для определения вителлогенина.
5.4.5 Наблюдение вторичных половых признаков
Некоторые эндокринные нарушения могут влиять на вторичные половые признаки (количество брачных бугорков у самцов толстоголового гольяна, папиллярные бугорки у самцов японской медаки). Некоторые вещества могут также вызывать аномальные проявления вторичных половых признаков представителей другого пола; например, антагонисты рецепторов андрогена, такие, как тренболон, метилтестостерон и дигидротестостерон, могут привести к развитию у самок толстоголового гольяна брачных бугорков или появлению папиллярных полос у самок японской медаки. Также было отмечено, что антагонисты рецепторов эстрогена могут привести к уменьшению числа брачных бугорков и размера затылочной подушки у взрослых самцов. Такие морфологические наблюдения могут предоставить полезную качественную и количественную информацию при планировании дальнейших исследований. Число и размер свадебных бугорков у гольяна и папиллярные бугорки у медаки могут быть определены количественно непосредственно или позднее в сохраненных образцах.
5.4.6 Вителлогенин (VTG)
5.4.6.1 Кровь собирают у хвостовой артерии/вены капиллярной трубочкой с гепарином с помощью микрогематокрита или шприцем пункцией сердца. В зависимости от размера рыбки собираемые объемы крови колеблются от 5 до 60 мкл для толстоголового гольяна и 5-15 мкл для данио рерио. Плазму отделяют от крови центрифугированием и храниться с ингибиторами протеазы при минус 80°С до анализа на вителлогенин. У медаки для анализа используются печень, у данио рерио также можно использовать как источник ткани для анализа вителогенина гомогенат головы/хвоста. Измерение VTG следует проводить по утвержденному гомологическому методу ELISA с использованием гомологических стандартов и антител VTG. Рекомендуется использовать метод, способный обнаружить VTG в плазме на уровне нескольких нанограмм/милллиметр плазмы (нг/мл ткани), который является фоновым уровнем для интактных самцов рыб.
5.4.6.2 Контроль качества анализа вителлогенина достигается с помощью стандартных наборов химикатов и дублированием анализа. Для каждого метода ELISA строят матричный эффект (эффект разбавления пробы) для определения минимального фактора разбавления. Каждая пластина ELISA, используемая для анализа VTG, должна включать следующие контрольные образцы: по крайней мере шесть стандартных калибровочных растворов, охватывающих ожидаемый диапазон концентраций вителлогенина, и по крайней мере один холостой опыт (проанализированный в двух повторностях). Степень поглощения света в холостых пробах должна составить менее чем 5% максимальной абсорбции стандартного калибровочного раствора. Будут проанализированы по крайней мере два определенных количества (абсолютно одинаковых) каждого типового разбавления. В случае разброса между повторностями более чем на 20% анализ повторяют.
5.4.6.3 Коэффициент корреляции () для калибровочных кривых должен быть больше 0,99. Высокая степень корреляции недостаточна для того, чтобы гарантировать адекватное предсказание концентрации во всех диапазонах. В дополнение к наличию достаточно высокой корреляции значений калибровочной кривой к концентрации каждого стандарта вычисляют кривую стандартных растворов, которая должна находиться между 70% и 120% ее номинальной концентрации. Если номинальная концентрация расположена далеко от линии регрессии калибровочного графика (например, при более низких концентрациях), это может привести к необходимости разбить калибровочную кривую в низком и высоком диапазонах или к применению нелинейной модели, чтобы соответственно удовлетворить полученные результаты абсорбции. Если кривая разбита, каждый ее сегмент должен иметь
0,99.
5.4.6.4 Предел обнаружения (LOD) обозначается как концентрация наименьшего аналитического стандарта, предел количественного определения (LOQ) понимают как наименьшую концентрацию наименьшего стандарта, умноженную на самый низкий фактор разбавления.
5.4.6.5 В день выполнения анализа на вителлогенин, проводят анализ усиленного образца стандартного раствора (приложение 3). Также систематически сверяют отношения между ожидаемой и измеренной концентрацией, выполненной в тот же день.
5.4.7 Оценка гонадальной гистопатологии
Гонады фиксируются либо сохраняется все тело или его части. Когда требуется гистопатология, специфические эндокринно-связанные ответы на гонады будут искать в оценке эндокринной деятельности исследуемого вещества. Эти диагностические результаты по существу включают наличие яичек ооцитов, гиперплазию клеток Лейдига, снижение образования желтка, увеличение сперматогонии и околофолликулярную гиперплазию. Другие половые поражения, такие как атрезия яйцеклетки, дегенерация яичек, и другие стадии изменения могут иметь различные причины. Руководящий документ по гистопатологии гонад рыб содержит процедуры, которые используются при вскрытии, фиксации, секционировании и гистопатологических оценках гонады.
6 Данные и отчетность
6.1 Оценка ответов биомаркеров с помощью дисперсионного анализа (ANOVA)
Чтобы идентифицировать потенциальное воздействие вещества на эндокринную систему, сравнивают результаты опытной контрольной группы, с помощью дисперсионного анализа (ANOVA). Где используется контроль содержащий растворитель, соответствующий статистический тест должен быть выполнен между контролем с водой и контролем с растворителем для каждого наблюдаемого эффекта.
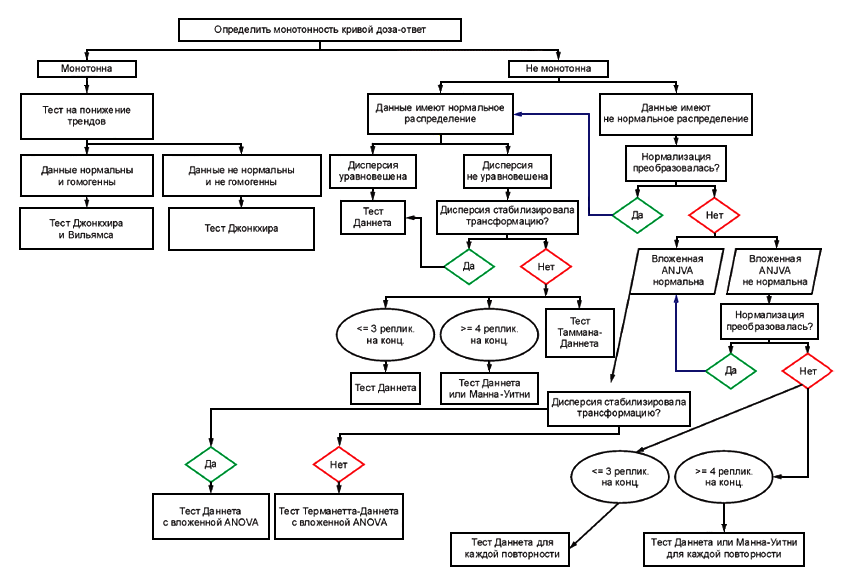
Все данные, связанные с биологической реакцией, должны быть проанализированы и приведены в привязке к полу. Если гипотеза не проверятся с помощью параметрических методов - ненормальное распределение (например, тест Шапиро-Вилка) или гетерогенная дисперсия (тест Барлета или тест Левена), должна быть рассмотрена возможность трансформировать данные для гомогенизации дисперсии до выполнения ANOVA, или к выполнению взвешенного анализа. Тест Даннетта (параметрический) на многократные попарные сравнения или анализ Манна-Уитни (непараметрический) с регулированием Бонферрони может использоваться для немонотонного отношения доза-ответ. Другие статистические тесты также могут использоваться (например, тест Jonckheere-Terpstra или тест Williams), если отношение доза-ответ является приблизительно монотонным.
6.2 Отчет об исследовании
Отчет об исследовании должен включать:
6.2.1 Установочные данные:
- степень подготовленности персонала к проведению теста;
- каждая лаборатория должна продемонстрировать свою компетентность, включая наличие необходимых реактивов.
6.2.2 Тестируемое вещество:
- характеристики тестируемого вещества;
- физическая природа и соответствующие физико-химические свойства;
- метод и частота подготовки тестовых концентраций;
- информация о стабильности и способности к разложению микроорганизмами.
6.2.3 Растворитель:
- исследование растворителя (природа, используемые концентрации);
- обоснование выбора растворителя (кроме воды).
6.2.4 Подопытные животные:
- виды и место разведения;
- поставщик и оборудование, применяемое при доставке;
- возраст рыб в начале теста и репродуктивный статус;
- детали процедуры акклиматизации животных;
- вес тела рыб в начале экспозиции (начиная с предварительного выбора рыб).
6.2.5 Условия проведения теста:
- используемый метод (тип эксперимента, степень нагрузки, плотность заселения и т.д.);
- метод подготовки основных растворов и их расход;
- номинальные тестовые концентрации, еженедельное измерение концентраций экспериментальных растворов реактивов и используемые аналитические методы, средневзвешенные значения и среднеквадратичные отклонения в тестовых сосудах, и данные, демонстрирующие, что измерения соотносятся с истинными концентрациями тестируемого вещества;
- особенности разбавляющей воды (включая рН, жесткость, щелочность, температуру, концентрацию растворенного кислорода, уровни остаточного хлора, общий органический углерод, сухой остаток и любые другие сделанные измерения);
- качество воды в тестовых аквариумах: рН, жесткость, температура и концентрация растворенного кислорода;
- подробная информация относительно кормления (например, тип корма(ов), источник, выданное количество корма и частота кормления, исследования о наличии загрязняющих примесей, если доступны (например, ПХБ, хлорорганические пестициды).
6.2.6 Результаты
- доказательство того, что контроль соответствует применяемым критериям теста;
- данные по смертности для каждой концентрации и контроля;
- использованные статистические методики, обработка данных и объяснение примененных методик;
- данные по биологическим макроскопическим наблюдениям, включая вторичные половые признаки, плодовитость и вителлогенин;
- результаты анализа данных предпочтительно в табличной и графической форме;
- частота любых необычных реакций рыбок и любых видимых эффектов, вызванных исследуемым веществом.
6.3 Руководство по интерпретации и принятии результатов тестирования
6.3.1 В данном разделе обсуждаются параметры, которые необходимо учитывать для интерпретации результатов тестирования в отношении различных измеряемых эффектов. Результаты необходимо интерпретировать с осторожностью, когда кажется, что исследуемое вещество является причиной появления признаков токсичности или влияет на общее состояние экспериментальных животных.
6.3.2 В ходе предварительного теста по определению концентрации для того, чтобы можно было надежно интерпретировать данные, следует обратить внимание на то, чтобы не были превышены максимально переносимые концентрации. Важно применять по меньшей мере одну концентрацию, которая не вызывает каких-либо признаков токсичности. Симптомы заболевания и признаки токсичности анализируют и включают в подробный отчет. Например, возможно, что на образование VTG у самок могут также повлиять общая токсичность и неэндокринные токсические воздействия, например гепатотоксичноть. Интерпретация полученных эффектов может быть дополнена другими уровнями загрязнений, которые не связаны с системной токсичностью.
6.3.3 Есть несколько аспектов, которые необходимо рассмотреть для принятия результатов тестов. Уровни VTG в контрольных группах самцов и самок должны отличаться примерно на три порядка у толстоголового гольяна и данио рерио, и на один порядок у японской медаки. Примерный диапазон значений, с которыми сталкиваются в контрольных группах, доступны в отчетах проверки точности. Высокие значения VTG у контрольных самцов могут поставить под угрозу точность анализа и его способность обнаружить слабых антагонистов эстрогена. Низкие значения VTG у контрольных самок контроля могут поставить под угрозу чувствительность анализа и его способность обнаружить ингибиторы ароматазы и антагонистов эстрогена. Исследования по проверке точности проводились для целей написания руководства.
6.3.4 Что касается количественного определения образования икры, то это тот случай, когда допускаются важные изменения [коэффициент изменчивости (CV) может колебаться от 20% до 60%], которые влияют на способность испытания обнаружить существенное уменьшение образования икры, меньше чем на 70%, поскольку коэффициент изменчивости приближается к 50% или более. Когда коэффициент изменчивости ограничен нижними значениями (приблизительно от 20% до 30%), то у испытания будет приемлемая сила (80%) для обнаружения от 40% до 50% уменьшения образования икры. Вид испытания, используемый для толстоголового гольяна, включая четыре воспроизведения на уровень воздействия, должен придать больше власти итогам испытания репродуктивной способности, по сравнению с видом исследований с двумя воспроизведениями.
6.3.5 Если лаборатория не выполняла ранее этот анализ или были допущены значимые изменения (например, вида рыб или поставщика), желательно, чтобы было проведено исследование технической компетенции. Рекомендуется использовать вещества, охватывающие диапазон воздействий или влияющие на некоторые измеряемые параметры во время теста. Каждой лаборатории рекомендуется разрабатывать свою собственную базу данных по контрольным самцам и самками делать тесты с положительным контролем для эстрогенной активности (например,17-эстрадиола на уровне 100 нг/л, или другим известным слабым агонистом), вызывающим увеличение VTG у самцов, положительным контролем для ингибирования ароматазы (например, фадрозол и прохлораз при 300 мг/л), вызывающим снижение VTG у самок, и положительным контролем для андрогенной активности (17
-тренболона в дозе 5 мг/л), в результате индукции вторичных половых признаков у самок толстоголового гольяна и японской медаки. Все эти данные можно сравнить с имеющимися данными по проверке исследований для обеспечения компетентности лаборатории.
6.3.6 Вообще, измерения вителлогенина должны считаться положительными, если есть статистически значимое увеличение VTG у самцов (0,05), или статистически значимое снижение у самок (
0,05) по крайней мере при самых высоких концентрациях по сравнению с контрольной группой при отсутствии признаков общей токсичности. Положительный результат далее подтверждается демонстрацией биологически вероятной зависимости между дозой и динамической характеристикой. Как упомянуто ранее, уменьшение вителлогенина может не всегда иметь эндокринное происхождение; однако положительный результат должен интерпретироваться как доказательство эндокринной деятельности in vivo и обычно является поводом для дальнейших исследований.
6.3.7 Представление гонадальной гистопатологии не может быть необходимо в тех случаях, когда реакция и вителлогенина, и вторичных половых признаков положительна (то есть увеличение или уменьшение VTG или индукция вторичных половых признаков). Оценка гистопатологии гонад может быть представлена регулирующим органам для определения репродуктивного здоровья подопытных животных и получения данных об их весе в качестве доказательств оценки результатов теста. Представление гистопатологии гонад может не потребоваться в случаях, когда ВТГ или вторичные половые признаки положительны (т.е. увеличение или уменьшение количества ВТГ или индукция вторичных половых признаков).
Приложение А
(справочное)
Условия проведения эксперимента по воздействию вещества на эндокринную систему рыб без репродуктивной функции
Рекомендуемые виды | Тупоголовый гольян (Pimephales promelas) | Японская медака (Oryziaslatipes) | Данио рерио (Danio rerio) |
1 Тип эксперимента | Динамический | Динамический | Динамический |
2 Температура воды | (25±2)°С | (25±2)°С | (26±2)°С |
3 Качество освещения | Флуоресцентные лампы (широкого спектра) | Флуоресцентные лампы (широкого спектра) | Флуоресцентные лампы (широкого спектра) |
4 Интенсивность освещения | 10-20 | 10-20 | 10-20 |
5 Фотопериод (переход - рассвет и закат - опционно, но не явпяется обязательным) | 16 ч освещения | 12-16 ч освещения | 12-16 ч освещения |
6 Величина нагрузки | <5 г/л | <5 г/л | <5 г/л |
7 Объем испытательной камеры | 10 л (минимально) | 2 л (минимально) | 5 л (минимально) |
8 Объем тестируемого раствора | 8 л (минимально) | 1,5 л (минимально) | 4 л (минимально) |
9 Величина обмена тестируемого раствора | Минимально 6 раз/день | Минимально 5 раз/день | Минимально 5 раз/день |
10 Возраст тестируемых организмов | См. пункт 20 | См. пункт 20 | См. пункт 20 |
11 Примерны живой вес взрослых рыб | Самки: 1,5±20% | Самки: 0,35±20% | Самки: 0,65±20% |
12 Количество рыб в кювете | 6 (2 самца и 4 самки) | 10 (5 самцов и 5 самок) | 10 (5 самцов и 5 самок) |
13 Количество проб | = 3 (плюс соответствующий контроль) | = 3 (плюс соответствующий контроль) | = 3 (плюс соответствующий контроль) |
14 Количество повторностей | 4 минимально | 2 минимально | 2 минимально |
15 Количество рыб на тестируемую концентрацию | 16 взрослых самок и 8 самцов (4 самки и 2 самца в каждой повторности) | 10 взрослых самок и 10 самцов (5 самок и 5 самцов в каждой повторности) | 10 взрослых самок и 10 самцов (5 самок и 5 самцов в каждой повторности) |
16 Режим питания | Взрослая артемия или личинки артемии, живые или замороженные, 2-3 раза в день (adlibitum), коммерческие корма или их комбинация | Личинки артемии, живые или замороженные, 2-3 раза в день (adlibitum), коммерческие корма или их комбинация | Личинки артемии, живые или замороженные, 2-3 раза в день (adlibitum), коммерческие корма или их комбинация |
17 Аэрация | Не аэрировать если концентрация кислорода выше 60% от максимальной насыщающей концентрации | Не аэрировать если концентрация кислорода выше 60% от максимальной насыщающей концентрации | Не аэрировать если концентрация кислорода выше 60% от максимальной насыщающей концентрации |
18 Разбавляющая вода | Природная вода, колодезная или дехлорированная водопроводная вода | Природная вода, колодезная или дехлорированная водопроводная вода | Природная вода, колодезная или дехлорированная водопроводная вода |
19 Период преэкспозиции | 7 дней (рекомендуется) | 7 дней (рекомендуется) | 7 дней (рекомендуется) |
20 Длительность экспозиции химического продукта | 21 день | 21 день | 21 день |
21 Измеряемый биологический эффект | - выживаемость | - выживаемость | - выживаемость |
22 Критерии достоверности теста | Концентрация кислорода в воде | Концентрация кислорода в воде | Концентрация кислорода в воде |
НЕКОТОРЫЕ ХИМИЧЕСКИЕ ХАРАКТЕРИСТИКИ ВОДЫ РАЗБАВЛЕНИЯ
ВЕЩЕСТВО | КОНЦЕНТРАЦИИ |
Взвешенные вещества | <20 мг/л |
Общий органический углерод | <2 мг/л |
Аммиак неионизированный | <1 мкг/л |
Остаточный хлор | <10 мкг/л |
Общие фосфорорганические пестициды | <50 нг/л |
Общие хлорорганические пестициды и полихлорированные бифенилы | <50 нг/л |
Общий органический хлор | <25 нг/л |
Приложение B
(рекомендуемое)
Нерестовый субстрат для данио рерио
Нерестовая пластина: пластина из инструментального стекла, например 22x15x5,5 см (дш
в), покрытого сеткой из нержавеющей стали (размер ячейки 2 мм). Основа решетки должна находиться ниже края пластины.
Нерестовый субстрат должен быть установлен на решетке. Он должен давать возможность рыб перемещаться. Например, это могут быть искусственные аквариумные растения, сделанные из зеленого пластика, которые подходят лучше всего (NB: нужно изучить возможную адсорбцию тестируемого вещества к пластику). Искусственные растения должны быть вымыты в теплой воде в течение времени достаточного для того, чтобы гарантировать невозможность внесения в аквариум других загрязняющих веществ. Использование стеклянных материалов должно гарантировать невозможность получения ран рыбами и не должно стеснять их энергичные движения.
Расстояние между пластиной и стенками аквариума не должно превышать 3 см, чтобы избежать нереста вне пластины. Икра, вымеченная на пластину, проваливается сквозь решетку и должна быть отобрана в течение 45-60 мин после начала освещения. Прозрачные икринки не прилипают и могут быть легко подсчитаны с использованием трансверсального света. Для пяти самок в аквариуме, количество отложенных икринок можно считать низким, если оно менее или равно 20 в день, среднее количество до 100 и более 100 икринок в день оценивают как высокую плодовитость. Нерестовую пластину удаляют, собранные икринки и нерестовую пластину перемещают в тестовую емкость по возможности вечером или ранним утром. Повторная установка нерестовой пластины должна быть осуществлена в течение часа, в противном случае нерестовый субстрат вызовет индивидуальное спаривание и нерест в необычное время. Если необходима более поздняя установка нерестовой пластины, то это должно быть сделано не менее чем через 9 часов после начала освещения. Так поздно нерест не осуществляется.
Приложение C
(рекомендуемое)
Нерестовый субстрат для тупоголового гольяна
Две или три нерестовые пластины из пластмассы/керамики/стекла или из нержавеющей стали помещают в каждый тестовый аквариум (например, кусок полукруглого 80 мм водосточного желоба длиной 130 мм) (см. фото). Существует доказательство того, что в качестве нерестового субстрата может быть использована пластина из ПВХ или керамики (Thorpe и др., 2007).

Основа конструкции предназначена для сбора икры, которая не приклеивается к поверхности пластины и падает на дно (где икринки непосредственно располагаются). Весь субстрат вымачивают в течение не менее 12 час перед использованием [33].
Приложение D
(рекомендуемое)
Оценка вторичных половых признаков у толстоголового гольяна для обнаружения некоторых веществ, активных по отношению к эндокринной системе
D.1 Краткий обзор
Потенциально важными признаками физического состояния у взрослых особей толстоголового гольяна при проведении исследований эндокринных нарушений являются: цвет (светлый/темный), рисунок окраски (присутствие или отсутствие вертикальных полос), форма тела (головной и грудной отделы, увеличение брюшка) и специальные вторичные половые признаки (число и размер брачных бугорков, размер спинной подушки и яйцеклада).
Брачные бугорки расположены на голове (спинная подушка) половозрелых самцов толстоголового гольяна как правило билатерально и симметрично (Jensen и др., 2001). Самки и ювенильные особи обоих полов бугорков не имеют (Jensen и др., 2001). Самцы могут иметь до восьми бугорков вокруг глаз и возле ноздрей (Jensen и др., 2001). Самое большое количество и самые большие по размеру бугорки расположены в две параллельные линии ниже ноздрей и выше рта. У многих рыб есть группы бугорков под нижней челюстью; возле рта в основном находятся единичные пары, в то время как брюшко может насчитывать до четырех бугорков. Фактическое количество бугорков редко превышает 30 (обычно, 18-28; Jensen и др., 2001). Бугорки в основном имеют одинаковую форму, обычно округлые, высотой, приблизительно равной радиусу. Большинство репродуктивно активных самцов могут иметь сильно увеличенные бугорки, состоящие из нескольких слившихся в один.
Некоторые типы воздействующих на эндокринную систему химикатов могут вызвать аномальное расположение вторичных половых признаков; например, антагонисты рецептора андрогена, такие как 17-метилтестостерон или 17
-тренболон, могут вызвать развитие брачных бугорков у женских особей гольяна (Smith, 1974; Ankley и др., 2001; 2003), в то время как антагонисты рецептора эстрогена могут привести к уменьшению числа или размера брачных бугорков у самцов (Miles-Richardson и др., 1999; Harries и др., 2000).
Ниже дано описание исследования брачных бугорков у тупоголового гольяна, основанных на процедурах, используемых в американской лаборатории Управления по охране окружающей среды (USEPA) в Дулуте (Миннесота). Некоторые продукты и/или оборудование могут быть замещены на сопоставимые доступные материалы.
Исследования лучше всего проводить, используя лупу с подсветкой или бинокулярный микроскоп с подсветкой (3Х). Рыба находится в дорсальном положении головой к исследователю.
а) Расположите рыбу в малой чашке Петри (например, 100 мм в диаметре) на боку хвостом вперед. Настройте видоискатель для идентификации бугорков. Осторожно и медленно переверните рыбу с одного бока на другой, чтобы идентифицировать области бугорков. Посчитайте и классифицируйте бугорки.
b) Повторите исследование на вентральной задней поверхности тела рыбы, повернув рыбу на спину хвостом вперед в чашке Петри.
с) Наблюдения должны быть проведены в течение 2 мин для каждой рыбы.
D.2 Подсчет и классификация бугорков
Шесть определенных областей должны быть идентифицированы для оценки наличия бугорков и их развития у взрослых особей тупоголового гольяна. Разработана таблица для картирования расположения и количества бугорков (см. приложение А). Число бугорков регистрируется, и их размер количественно оценивается как: с 0 - отсутствие, 1 - наличие, 2 - увеличенный и 3 - явно выраженный для каждого организма (рисунок D.1).
Класс 0 - отсутствие всех бугорков. Класс 1 - бугорки присутствуют, идентифицируются как бугорки, у которых одна вершина, а высота примерно равна ширине (диаметру). Класс 2 - увеличенные бугорки, ткань которых внешне напоминает звездочку, обычно большего диаметра и имеют канавки или борозды, появляющиеся из центра. Высота бугорков часто более иррегулярна, может быть несколько скруглена. Класс 3 - бугорки выраженные, обычно весьма крупные и округлые с менее выраженной структурой. Эти бугорки, иногда сливаются вместе и образуют единую массу на протяжении одной или нескольких областей (В, С и D, см. ниже). Цвет и форма подобны классу 2, но часто менее выражены. Использование этой системы оценки дает общее количество бугорков менее 50. У нормального самца в контроле количество бугорков 18-20 (Jensen и др., 2001).
Некоторые рыбы могут иметь большее количество бугорков, т.к. матрица (см. Приложение А) не включает некоторые зоны. Если это произошло, следует сделать дополнительную оценку направо и налево от области подсчета. Матрица необязательно должна быть симметрично. Другая методика для картирования бугорков, которые соединены попарно или вертикально вдоль линии рта, могла быть привести к двойному учету бугорков*, т.е. подсчету двух слившихся бугорков как один.
________________
* Текст документа соответствует оригиналу. - .

Рисунок D.1
D.3 Зоны картирования:
А - бугорки расположены вокруг глаз, с дорсальной по вентральную часть вокруг внешней границы глаз. Обычно многочисленны у взрослых самцов контроля, отсутствуют у самок контроля, как правило, парны (одна возле каждого глаза) или имеются в единичных количествах у самок, подвергнутых действию андрогенов.
В - бугорки расположены непосредственно между ноздрей (сенсорный канал). В норме парные у самцов контроля, сильно развиты (2 увеличенных или 3 явных). Отсутствуют у самок контроля, но иногда встречаются у самок, подвергнутых действию андрогенов.
С - бугорки, расположенные непосредственно перед ноздрями параллельно рту. Обычно увеличены или выражены у взрослых самцов контроля. Присутствуют или увеличены у менее развитых самцов или у самок, подвергнутых действию андрогенов.
D - бугорки, расположенные параллельно линии рта. Обычно оцениваются как "развитые" у самцов контроля. Отсутствуют у самок контроля, но имеются у подвергнутых действию андрогена самок.
Е - бугорки, расположенные на нижней челюсти как правило маленькие и парные. Изменчивы у самцов контроля или эксперимента и экспонированных самок.
F - Бугорки, расположенные под зоной Е. Обычно маленькие и парные.
Присутствуют у самцов контроля и подвергнутых действию андрогена самок.
Дополнение 1 | |||||||
Матрица картографирования бугорков. Цифровая классификация | |||||||
Идентификационный N | 1 - наличие | ||||||
Дата | 2 - увеличенные | ||||||
Общий счет | 3 - выраженные | ||||||
А | XI | XI | XI | XI |
В | XI | XI | XI | XI |
С | XI | XI | XI | XI | XI | XI | XI | XI | XI | XI | |
D | XI | XI | XI | XI | XI | XI | XI | XI | XI | XI |
Е | XI | XI | |||||
F | XI | XI | XI | XI | |||
Приложение E
(рекомендуемое)
Оценка вторичных половых признаков у японской медаки для обнаружения определенных веществ, воздействующих на эндокринную систему
Ниже дано описание измерения папиллярных бугорков, которые являются вторичными половыми признаками медаки (Oryziaslatipes).
Папиллярные бугорки обычно появляются только у взрослых самцов и расположены между вторым и седьмым или восьмым лучом анального плавника (рисунки E.1 и E.2). Очень редко они могут появляться на первом луче плавника. Это стандартная процедура (СП) позволяет измерять бугорки на первом луче плавника (число лучей считается от в этой СП от хвоста).
1 После иссечения печени (приложение F) тушку помещают в коническую тубу, содержащую приблизительно 10 мл 10%-ного нейтрального буферизованного водного раствора формальдегида (верх головы, низ хвоста). Если гонада фиксирована в другом растворе, кроме 10%-ного нейтрального буферизованного водного раствора формальдегида, леоают* с помощью бритвы поперечный разрез через тушку между областью анального ребра и задним проходом, стараясь не задеть гонопоры и гонады (рисунок E.3). Размещают головную часть тела рыбы в фиксирующем растворе для сохранения гонады и хвостовую часть тела рыбы в 10%-ном нейтральном буферизованном водном растворе формальдегида, как описано выше.
_______________
* Текст документа соответствует оригиналу. - .
2 После размещения тела рыбы в 10%-ном нейтральном буферизованном водном растворе формальдегида, берут область позади анального плавника пинцетом и сгибают ее приблизительно на 30 с, чтобы открыть анальный плавник. Взяв анальный плавник пинцетом, осторожно берут несколько лучей плавника, чтобы не повредить папиллярные бугорки.
3 Подержав анальный плавник открытым приблизительно 30 с, сохраняют тело рыбы в 10%-ном буферизованном растворе формальдегида при комнатной температуре до измерения папиллярных бугорков (измерение должно быть проведено по истечении по крайней мере 24 ч).
Измерение
1 После фиксации тела рыбы в 10%-ном растворе формальдегида в течение по крайней мере 24 ч, вынимают тушку рыбы из конической тубы и удаляют формальдегид на фильтровальной бумаге (или бумажном полотенце).
2 Помещают рыбу на брюшко. Затем аккуратно удаляют анальный плавник, используя малые ножницы рассечения (предпочтительно удаляют анальный плавник с небольшим количеством эндоскелета).
3 Берут заднюю часть отделенного анального плавника пинцетом и помещают его на стеклянную пластину с несколькими каплями воды. Затем покрывают анальное ребро покровным стеклом. Стараются не рассечь папиллярные бугорки во время захватывания анального плавника пинцетом.
4 Подсчитывают количество слившихся папиллярных бугорков, используя счетчик для биологического микроскопа (микроскоп прямого света или инвертированный микроскоп). Папиллярные бугорки учитывают, когда формации бугорков заметны на задней части пластинки. Регистрируют в рабочем журнале количество слившихся папиллярных бугорков в каждом луче плавника (например, первый луч: 0, второй луч: 10, третий луч: 12 и т.д.), и затем рассчитывают сумму с помощью таблицы Excel для каждой рыбы. В случае необходимости, делают фотографию анального плавника и подсчитывают число слившихся папиллярных бугорков на фотографии.
5 После измерения помещают анальный плавник в коническую тубу, описанную в 1 для хранения.

А - самец; В - самка (Ока, Т. В., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218)
Рисунок E.1 - Схема, иллюстрирующая различие в форме и размере анального плавника в зависимости от пола
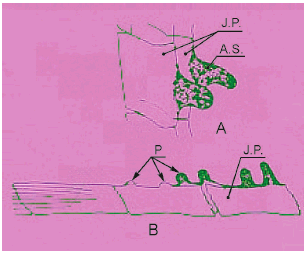
А - папиллярные бугорки, расположенные на сросшихся пластинах лучей анального плавника; J.P. - сросшаяся платина; A.S. - осевое пространство; Р - бугорок; В - дистальный конец анального плавника. Актинотрихии (Act), находятся на конце. (Ока, Т. В., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2:209-218).
Рисунок E.2.
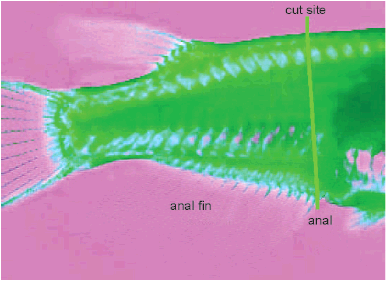
Рисунок E.3
На фотографии, показано место разреза, когда гонада фиксируется в другом растворе, кроме 10%-ного нейтрального буферизованного водного раствора формальдегида. В этом случае тело разрезают между областью, предшествующей анальному плавнику и анусу, с помощью бритвы (стрелка). Голову рыбы помещают в тот же фиксирующий раствор, который используют для сохранения гонад, а хвост рыбы - в 10%-ный нейтральный буферизованный водный раствор формальдегида.
Приложение F
(рекомендуемое)
Рекомендуемые процедуры для типового определения содержания вителлогенина
Следует соблюдать осторожность, чтобы избежать перекрестного загрязнения между образцами VTG самцов и самок.
F.1 Процедура 1А: толстоголовый гольян, забор крови из хвостовой вены/артерии
После анестезии хвостовую часть надрезают скальпелем и собирают кровь из хвостовой вены/артерии с помощью капиллярной пипетки гепариновым микрогематокритом. После того как кровь собрана, быстро отделяют плазму центрифугированием в течение 3 мин при 15000 g (или альтернативно 10 мин при 15000 g при 4°С). Процент гематокрита в конечном итоге может быть определен после центрифугирования. Затем плазму удаляют пипеткой с микрогематокритом и хранят в пробирке центрифуги с 0,13 единицами апротинина (ингибитор протеазы) при минус 80°С, до анализа вителлогенина. В зависимости от размера толстоголового гольяна (который зависит от пола) собранные объемы плазмы колеблются от 5 до 60 мкл на рыбу (Jensens и др., 2001).
F.2 Процедура 1В: тупоголовый гольян, сбор крови пункцией сердца
Альтернативно кровь может быть также собрана проколом сердца с помощью гепаринизированного шприца (1000 единиц гепарина на мл). Кровь переносят в пробирки Эппендорфа (выдержанные на льду) и затем центрифугируют (5 мин, 7000 g, при комнатной температуре). Плазму переливают в чистые пробирки Эппендорфа (аликвотно, если объем плазмы это позволяет) и быстро замораживают при минус 80°С, до проведения анализа (Panteum и др., 1998).
F.3 Процедура 2А: японская медака, удаление печени
F.3.1 Удаление тестируемой рыбы из испытательной камеры
1 Тестируемая рыба должна быть удалена из испытательной камеры с использованием сачка с мелкой сеткой. С осторожностью выпускают тестируемую рыбу в другие испытательные камеры.
2 В принципе тестируемые рыбы должны быть удалены в следующем заказе: контроль, контроль растворителя (если необходимо), самая низкая концентрация, средняя концентрация, самая высокая концентрация и положительный контроль. Кроме того, все самцы должны быть удалены из испытательной камеры раньше самок.
3 Пол каждой тестируемой рыбы идентифицируют по внешним вторичным половым признакам (например, по форме анального плавника).
4 Поместите тестируемую рыбу в контейнер для транспортировки и переносят на рабочее место для удаления печени*. Проверяют этикетки тестовых аквариумов и транспортного контейнера для точности и убеждаются, что количество рыб, которые были удалены из тестового аквариума, и количество выловленных рыб совпадают.
________________
* Текст документа соответствует оригиналу. - .
5 Если пол не может быть идентифицирован по внешнему виду рыбы, удаляют всю рыбу из тестового аквариума. В этом случае пол должен быть идентифицирован по анализу гонад или вторичным половым признакам под бинокулярным микроскопом.
F.3.2 Удаление печени
1 Переносят тестируемую рыбу из транспортного контейнера в анестезирующий раствор, используя сачок с мелкой сеткой.
2 После того как тестируемая рыба обезболена, перекладывают ее на фильтровальную бумагу (или бумажное полотенце) с помощью пинцета (обычного типа). Захватывают тестируемую рыбу пинцетом за боковые поверхности головы, чтобы предотвратить ломку хвоста.
3 Вытирают воду с поверхности тела тестируемой рыбы фильтровальной бумагой (или бумажным полотенцем).
4 Кладут рыбу на спинку. Делают малый поперечный разрез брюшка от проекции затылка до середины брюшной области с помощью препарационных ножниц.
5 Вставляют препарационные ножницы в разрез и расширяют его от задней части жабр до ануса вдоль средней линии живота. Стараются не вставлять ножницы слишком глубоко, чтобы не повредить печень и гонады.
6 Проводят следующие операции под бинокулярным микроскопом.
7 Размещают рыбу на спине на бумажном полотенце (или стеклянной чашкой Петри, или на предметном стекле).
8 Раздвигают стенки брюшной полости тонким пинцетом и вынимают внутренние органы. Также возможно для экстериоризирования внутренних органов удалить одну сторону стенки брюшной полости в случае необходимости.
9 Складывают соединенную часть печени и желчного пузыря, используя другую пару тонких пинцетов. Захватывают желчный проток и отделяют желчный пузырь. Стараются не порвать желчный пузырь.
10 Захватывают пищевод и таким же образом удаляют желудочно-кишечный тракт от печени. Стараются не пролить содержимое желудочно-кишечного тракта. Вырезают прямой кишечник и анус и удаляют желудочно-кишечный тракт из брюшной полости.
11 Удаляют жировые и другие ткани, находящиеся вокруг печени. Стараются не повредить печень.
12 Захватывают печеночную вену с помощью пинцета и удаляют печень из брюшной полости.
13 Помещают печень на покровное стекло. С помощью тонкого пинцета удаляют, если это необходимо, оставшиеся жировые и иные посторонние ткани (например, частицы брюшной стенки) с поверхности печени.
14 Взвешивают печень вместе с микропробиркой на 1,5 мл, используя электронные аналитические весы. Записывают результат в рабочем дневнике (с точностью до 0,1 мг). Проверяют идентификационную надпись на микропробирке.
15 Закрывают крышку микропробирки с печенью. Хранят ее на морозильнике (или емкости со льдом).
16 После удаления одной печени, очищают препарационное оборудование или заменяют его на чистое.
17 Удаляют печень изо всех рыб и размещают ее в соответствующих емкостях, как описано выше.
18 После того как печень удалена у всех рыб (то есть у всех самцов или самок в тестовом аквариуме), помещают все экспериментальные образцы печени в стойку трубы с идентификационными ярлыками и сохраняют в морозильнике. Если печень предполагается использовать для предварительной обработки сразу после удаления, образцы переносят на рабочее место в охлаждающейся стойке (или емкости со льдом).
Оставшийся после удаления печени скелет рыбы используют для измерения вторичных половых признаков.
F.3.3 Образец
Образцы печени, взятые у тестируемых рыб, если их не используют для предварительной обработки вскоре после удаления, хранят при температуре менее минус 70°С.
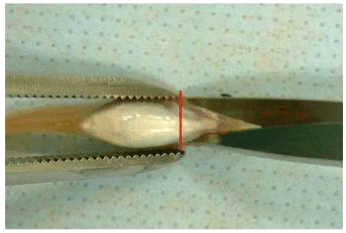
Рисунок F.1
Разрез передней части грудных плавников осуществляют с помощью ножниц.
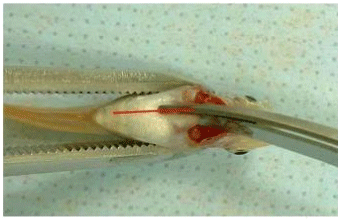
Рисунок F.2
Делают разрез ножницами по средней линии брюшка от точки, расположенной приблизительно в 2 мм от черепной коробки к анусу
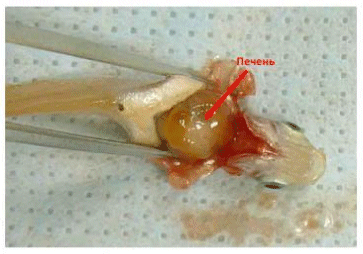
Рисунок F.3
Стенки брюшка раскрывают пинцетом для извлечения печени и других внутренних органов. (Альтернативно брюшные стены могут быть удалены).
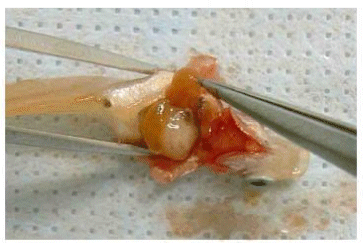
Рисунок F.4
Печень препарируют и удаляют пинцетом.
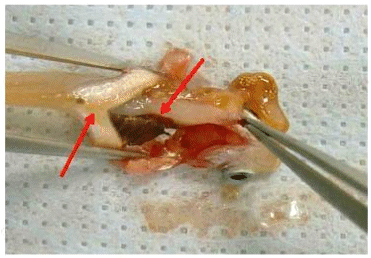
Рисунок F.5
Осторожно отделяют кишечник, используя пинцет.
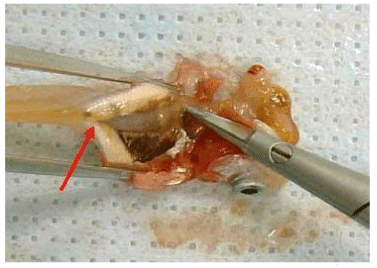
Рисунок F.6
Оба конца кишечника и прилегающую брыжейку отделяют ножницами.
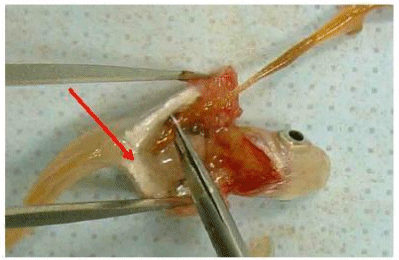
Рисунок F.7 - (самка)
Процедура идентична для самок.
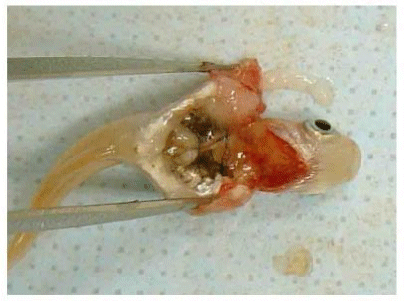
Рисунок F.8 Заключительная процедура.
F.4 Процедура 2В: японская медака (Oryziaslatipes), предварительная подготовка печени для анализа вителлогенина
Берут флакон, содержащий гомогенатный буфер из набора ELISA и охлаждают его с измельченным льдом (температура раствора: не более 4°С). Если используется гомогенатный буфер из набора EnBioELISA, оставляют оттаять раствор при комнатной температуре, затем охлаждают флакон с измельченным льдом.
Рассчитывают объем гомогенатного буфера для печени, исходя из ее веса (используют 50 мкл буфера на 1 мг веса печени для гомогенирования). Например, если вес печени 4,5 мг, объем буфера составит 225 мкл. Подготавливают список необходимых объемов буфера для всех образцов печени.
F.4.1 Подготовка печени для предварительной обработки
F.4.1.1 Берут микропробирку на 1,5 мл, содержащую печень из морозильника перед предварительной обработкой.
F.4.1.2 Предварительная обработка печени самцов должна быть выполнена раньше самок, чтобы предотвратить загрязнение вителлогенином. Кроме того, предварительная обработка для тестируемых групп должна быть проведена в такой последовательности: контроль, контроль растворителя (если применимо), самая низкая концентрация, средняя концентрация, самая высокая концентрация и положительный контроль.
F.4.1.3 Количество микропробирок на 1,5 мл, содержащих образцы печени, взятые из морозильника не должно превысить количество, которое можно центрифугировать.
F.4.1.4 Устанавливают микропробирки на 1,5 мл, содержащие образцы печени в емкости со льдом в последовательности проведения анализа (размораживание печени неважно).
F.4.2 Проведение предварительной обработки
F.4.2.1 Добавляют гомогенатный буферный раствор
Проверяют список объемов гомогенатного буфера, которые будут использованы для каждого образца печени и выставляют микропипетку (диапазон объемов: 100-1000 мкл) на соответствующий объем. Присоединяют чистый наконечник к микропипетке.
Берут гомогенатный буфер из флакона и добавляют буфер в микропробирку на 1,5 мл, содержащую печень.
Добавляют гомогенатный буфер ко всем микропробиркам на 1,5 мл, содержащим печень, согласно процедуре, описанной выше. Нет никакой потребности менять наконечник микропипетки на новый. Однако, если ее конец загрязнен, наконечник необходимо заменить.
F.4.2.2 Гомогенизация печени
1 Присоединяют новый пилон для гомогенизации к гомогенизатору микропробирки.
2 Вставляют пилон в микропробирку на 1,5 мл.
Устанавливают гомогенизатор для раздавливания печени между поверхностью пилона и внутренней стенкой микропробирки на 1,5 мл.
3 Включяют гомогенизатор на 10-20 секунд. Охлаждают микропробирку измельченным льдом во время операции.
4 Вынимают пилон из микропробирки и оставляют ее в покое приблизительно на 10 секунд. Затем осуществляют визуальную проверку состояния суспензии.
5 Если в суспензии наблюдаются частички печени, повторяют операции 3 и 4, чтобы подготовить однородный гомогенат печени.
6 Охлаждают суспендированный гомогенат печени на льду перед центрифугированием.
7 Заменяют пилон на новый для каждого гомогенирования.
8 Гомогенизируют всю печень с гомогенатным буфером согласно процедуре, описанной выше.
F.4.2.3 Центрифугирование суспендированного гомогената печени
1 Устанавливают температуру охлаждающей камеры центрифуги не менее 5°С.
2 Вставляют микропробирки на 1,5 мл, содержащие суспендированный гомогенат печени в охлаждающую центрифугу (отрегулируйте баланс в случае необходимости).
3 Центрифугируют суспендированный гомогенат печени при 13000 g в течение 10 минут при температуре не менее 5°С. Однако, если супернатант корректно отделился, центробежная сила и время центрифугирования могут быть соответственно скорректированы.
4 После центрифугирования проверяют, что супернатант качественно отделился (на поверхности: липиды, промежуточные: супернатант; осадок: ткани печени). Если разделение некачественное, центрифугируют суспензию снова при тех же самых условиях.
5 Удаляют все образцы для испытания из охлаждающей центрифуги и устанавливают их в емкости со льдом в порядке проведения испытания. Стараются не взболтать пробирки.
F.4.2.4 Сбор супернатанта
1 Помещают четыре микропробирки на 0,5 мл в штатив для хранения супернатанта.
2 Берут 30 мкл каждого супернатанта (сформированного как промежуточный слой) микропипеткой и собирают его в одной микропробирке на 0,5 мл. Стараются не собирать липиды с поверхности или ткани печени в осадке.
3 Собирают супернатант и распределяют его на две другие микропробирки на 0,5 мл тем же способом как описано выше.
4 Собирают остальную часть супернатанта микропипеткой (если возможно: не более 100 L). Распределяют супернатант на оставшиеся микропробирки на 0,5 мл. Стараться не собирать липиды с поверхности или ткани печени в осадке
5 Закрывают колпак микропробирки на 0,5 мл и записывают объем супернатанта на ярлыке. Затем немедленно охлаждают микропробирки на льду.
6 Заменяют наконечник микропипетки на новый для каждого образца супернатанта. Если к наконечнику прилипает большое количество липидов немедленно заменяют наконечник, чтобы избежать загрязнения экстракта печени жиром.
7 Распределяют весь центрифугируемый супернатант на четыре микропробирки по 0,5 мл согласно процедуре, описанной выше.
8 После распределения супернатанта на микропробирки по 0,5 мл, помещают их в штатив с идентифицирующими этикетками и затем немедленно замораживают в морозильнике. Если концентрации VTG измеряют непосредственно после предварительной обработки, держат одну микропробирку на 0,5 мл (содержащей 30 мкл супернатанта) в охлаждающем штативе и передают его на рабочее место для проведения анализ ELISA. В этом случае помещают оставшиеся микропробирки в штатив и замораживают их в морозильнике.
9 После сбора супернатанта, утилизируют остаток в соответствии с принятой процедурой.
F.4.2.5 Хранение испытательных образцов.
Хранят микропробирки на 0,5 мл, содержащие супернатант гомогената печени, при температуре менее минус 70°С, до проведения анализа ELISA.
F.5 Процедура 3А: данио рерио, сбор крови из хвостовой артерии/вены
Незамедлительно после анестезии делают рассечение возле хвоста и кровь из хвостовой артерии/вены собирают в микрогематокритные капиллярные трубки с гепарином. Объемы крови колеблются от 5 до 15 микролитров в зависимости от размера рыбы. Равный объем буфера апротинина [6 мкг/мл в фосфатном буферном растворе (ФБР)] добавляют в микрокапиллярные трубки и отделяют плазму от крови центрифугированием (5 мин при 600 g). Плазму собирают в пробирки и хранят при температуре минус 20°С до проведения анализа на вителлогенин или другие белки.
F.6 Процедура 3В: данио рерио, сбор крови пункцией сердца
Чтобы избежать коагуляции крови и разложения белка, образцы собирают в фосфатный буферный раствор, содержащий гепарин (1000 ед./мл) и ингибитор протеазы апротинин (2 TIU/мл). Для приготовления буфера рекомендуются гепарин, соль аммония и лиофилизированный апротинин. Для забора крови рекомендуется шприц (1 мл) с неподвижной тонкой иглой (например, BraunOmnikan-F). Шприц должен быть предварительно наполнен буфером (приблизительно 100 мкл), чтобы полностью элюировать малые объемы крови от каждой рыбы. Образцы крови берутся проколом сердца. Рыба вначале должна быть анестезирована MS 222 (трикаин метанесульфонат) (100 мг/л). Правильно примененная анестезия позволяет различить сердцебиение данио рерио. Прокалывая сердце, держат поршень шприца под небольшим давлением. Собираемые объемы крови составляют 20-40 мкл. После пункции сердца кровь/буферная смесь должна быть перенесены в пробирку. Плазму отделяют от крови центрифугированием (20 мин; 5000 g), и хранят при температуре минус 80°С до проведения анализа.
F.7 Процедура 3С: стандартная операционная процедура: данио рерио, гомогенизация головы и хвоста
F.7.1 Рыбы подвергнуты анестезии и эвтаназии в соответствии с описанием в тесте.
F.7.2 Голову и хвост рыбы отрезают в соответствии с рисунком F.9.
Важно: все инструменты для вскрытия, так же как и препарационный стол, должны быть вымыты и очищены должным образом (например, 96%-ным этиловым спиртом) между обработкой каждой конкретной рыбы, чтобы предотвратить "загрязнение вителлогенином" от самок или чтобы индуцированные самцы не "загрязнили" интактных самцов.
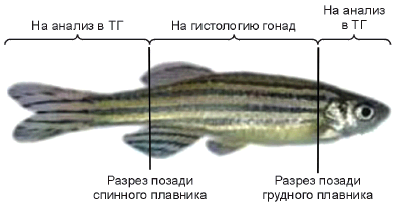
Рисунок F.9
F.7.3 Общий вес головы и хвоста каждой рыбы взвешивают с точностью до миллиграмма.
Е.7.4 После взвешивания части помещают в соответствующие пробирки (например, Эппендорфа на 1,5 мл) и замораживают при температуре минус 80°С до момента гомогенизации или сразу гомогенизируют на льду с двумя пластиковыми пестиками. (Могут быть использованы другие методы, если их проводят на льду и они дают результат - однородную массу). Важно: пробирки должны быть пронумерованы так, чтобы голова и хвост могли быть связаны с соответствующей частью тела, используемой для гистологии гонад.
F.7.5 Для получения однородной массы добавляют ледяной гомогенизационный буфер в количестве четырех от измеренного веса ткани. Продолжают работать с пестиками, пока смесь не станет гомогенной. Важное замечание: используют новые пестики для каждой рыбы.
_______________
Гомогенизационный буфер: [50 ммоль трис-
с рН 7,4; 1% смеси ингибиторов протеаз (Сигма)]: 12 мл трис-
с рН 7,4 +120 мкл смеси ингибиторов протеаз. ТРИС: ТРИС-УЛЬТРА ЧИСТЫЙ (ICN) например, производства Bie&Berntsen (Danemark). Смесь ингибиторов протеаз: производства Sigma (из тканей животных). Номер продукта Р 8340. ВАЖНО. Гомогенизационный раствор используется в день приготовления. Держите раствор на льду во время использования.
F.7.6 Образцы помещают в лед до центрифугирования при температуре 4°С при 50000 g в течение 30 мин.
F.7.7 Используют пипетку для забора 20 мкл супернатанта по крайней мере в двух пробирках, опуская конец пипетки ниже плотного слоя на поверхности и тщательно собирая супернатант без жира или частиц ткани.
F.7.8 Пробирки хранят при температуре минус 80°С до использования.
Приложение G
(справочное)
Усиленные образцы вителлогенина используемые как эталоны при проведении межлабораторного теста
В день выполнения анализов на вителлогенин необходимо сделать усиление пробы с помощью эталонного референтного образца. Вителлогенин, используемый для приготовления эталона, сильно отличается от используемого для проведения рутинных измерений.
Для приготовления усиленной пробы добавляют известное количество эталонного межлабораторного стандарта к образцу плазмы самцов контроля. Образец будет усиливаться до тех пор, пока ожидаемая концентрация вителлогенина не достигнет концентрации, в 10-100 раз превышающей ожидаемую концентрация вителлогенина самцов рыб в контроле. Образец плазмы самцов контроля, в которой увеличена концентрация, может быть взят от индивидуальной рыбы или от нескольких рыб.
Часть плазмы самцов контроля неусиленной пробы анализируется по крайней мере в двух повторностях. Образец с увеличенной концентрацией также анализируется по крайней мере в двух повторностях. Среднюю концентрацию вителлогенина в образцах плазмы двух неусиленных концентрациях самцов контроля добавляют к расчетному количеству вителлогенина в усиленных образцах для определения ожидаемой концентрации. Отношение этой расчетной концентрации к средневзвешенной указывают наряду с результатами для каждой серии анализов, выполненных в этот день.
Приложение H
(рекомендуемое)
Блок-схема проведения статистического анализа
Библиография
[1] | OECD (2006а). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.60, ENV/JM/MONO(2006)27. |
[2] | OECD (2006b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1B). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.61, ENV/JM/MONO(2006)29. |
[3] | OECD (2007). Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Phase 2: Testing Negative Substances. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.78, ENV/JM/MONO(2007)25. |
[4] | Owens JW (2007). Phase 3 report of the validation of the OECD Fish Screening Assay. CEFIC LRI Project, Endocrine. |
[5] | US EPA 2007. Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. Unpublished report dated 15 December 2007. US Environmental Protection Agency, Washington, DC. 104 pp. |
[6] | OECD, 2008. Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.94, ENV/JM/MONO(2008)21. |
[7] | Sumpter and Jobling (1995). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives; 103 Suppl 7:173-8 Review. |
[8] | Pawlowski S, Sauer A, Shears JA, Tyler CR, Braunbeck T (2004). Androgenic and estrogenic effects of the synthetic androgen 17 alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology; 68(3):277-91. |
[9] | Andersen L, Goto-Kazato R, Trant JM, Nash JP, Korsgaard B, Bjerregaard P (2006). Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology; 76(3-4):343-52. |
[10] | Ankley GT, Kahl MD, Jensen KM, Hornung MW, Korte JJ, Makynen EA, Leino RL (2002). |
[11] | Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences; 67(1):121-30. |
[12] | Panter GH, Hutchinson TH, Hurd KS, Sherren A, Stanley RD, Tyler CR (2004). Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology; 70(1):11-21. |
[13] | Parks LG, Cheek АО, Denslow ND, Heppell SA, McLachlan JA, LeBlanc GA, Sullivan CV (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistryand Physiology. Part С Pharmacology, toxicology and endocrinology; 123(2):113-25. |
[14] | Panter GH, Tyler CR, Maddix S, Campbell PM, Hutchinson TH, |
[15] | Fenske M., van Aerie, R.B., Brack, S.C., Tyler, C.R., Segner, H., (2001). Development and validation of a homologous zebrafish (Danio rerio Hamilton-Buchanan) vitellogenin enzymelinked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys. С 129 (3): 217-232. |
[16] | Holbech H, Andersen L, Petersen Gl, Korsgaard B, Pedersen KL, Bjerregaard P. (2001). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part С Pharmacology, toxicology and endocrinology; 130: 119-131 |
[17] | Rose J, Holbech H, Lindholst C, Noerum U, Povlsen A, Korsgaard B, Bjerregaard P. 2002. Vitellogenin induction by 17 |
[18] | Brion F, Nilsen BM, Eidem JK, Goksoyr A, Porcher JM, Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry; vol 21: 1699-1708. |
[19] | Yokota H, Morita H, Nakano N, Kang IJ, Tadokoro H, Oshima Y, Honjo T, Kobayashi K. 2001. Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol 4:87-98. |
[20] | Tatarazako N, Koshio M, Hori H, Morita M and Iguchi Т., 2004. Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science 50:301-308. |
[21] | Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Homung MW, Henry TR, Denny JS, Leino RL Wilson, VS, Cardon MC, Hartig PC, Gray LE (2003). Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry; 22(6): 1350-60. |
[22] | Seki M, Yokota H, Matsubara H, Maeda M, Tadokoro H, Kobayashi К (2004). Fish full lifecycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry; 23(3):774-81. |
[23] | OECD (2009). Draft Guidance Document on Fish Gonadal Histopathology. OECD Environmental Health and Safety Publications Series on Testing and Assessment. |
[24] | OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No.23. Paris |
[25] | Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006a. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; pp.69-92. |
[26] | Hutchinson TH, Ankley GT, Segner H, Tyler CR, 2006b. Screening and testing for endocrine disruption in fish-biomarkers as "signposts," not "traffic lights," in risk assessment. Environmental Health Perspectives; 114 Suppl 1:106-14. |
[27] | Miles-Richardson, SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure to 17B-estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Toxicol. 47, 129-145. |
[28] | Martinovic, D., L.S. Blake, E.J. Durhan, K.J. Greene, M.D. Kahl, K.M., Jensen, E.A. Makynen, D.L. Villeneuve and G.T. Ankley. 2008. Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Environ. Toxicol. Chem. 27, 478-488. |
[29] | OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18 |
[30] | US EPA 2008. Peer-Review Results for the Fish Short-Term Reproduction Assay, dated 30 January 2008. US Environmental Protection Agency, Washington DC. 110 pp. |
[31] | http://www.cefic-lri.org/index.php?page=projects(accessed18/09/08). |
[32] | Thorpe KL, Benstead R, Hutchinson TH, Tyler CR, 2007. An optimised experimental test procedure formeasuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90-98. |
[33] | Ankley GT, Jensen KM, Kahl MD, Korte JJ, Makynen ME. 2001. Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem 20:1276-1290. |
[34] | Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Homung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray EL. 2003. Effects of the androgenic growth promoter 17- |
[35] | Harries JE, Runnalls T, Hill E, Harris CA, Maddix S, Sumpter JP, Tyler CR. 2000. Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ Sci Technol 34:3003-3011. |
[36] | Jensen KM, Korte JJ, Kahl MD, Pasha MS, Ankley GT. 2001. Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp Biochem Physiol С 128:127-141. |
[37] | Kahl MD, Jensen KM, Korte JJ, Ankley GT. 2001. Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol 59:515-523. |
[38] | Miles-Richardson SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat Toxicol 47:129-145. |
[39] | Smith RJF. 1974. Effects of 17-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). CanJ Zoo/52:1031-1038. |
УДК 658.382.3:006.354 | МКС 13.020 | IDT |
Ключевые слова: химическая продукция, воздействие на окружающую среду, репродуктивная способность | ||
Электронный текст документа
и сверен по:
, 2015

