ГОСТ 33637-2015
Группа Т58
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Биоаккумуляция в земляных малощетинковых червях
Testing of chemicals of environmental hazard
Bioaccumulation in Terrestrial Oligochaetes
МКС 13.020.01
Дата введения 2016-09-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский институт стандартизации материалов и технологий" (ФГУП "ВНИИ СМТ") на основе аутентичного перевода на русский язык документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 октября 2015 г. N 81-П)
За принятие стандарта проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 13 ноября 2015 г. N 1779-ст межгосударственный стандарт ГОСТ 33637-2015 введен в действие в качестве национального стандарта Российской Федерации с 1 сентября 2016 г.
5 Настоящий стандарт модифицирован по отношению к международному документу OECD Test No. 317:2010* Bioaccumulation in Terrestrial Oligochaetes (ОЭСР, Тест N 317:2010 Биоаккумуляция в земляных малощетинковых червях) путем изменения структуры.
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Сравнение структуры международного документа со структурой настоящего стандарта приведено в приложении ДА.
Перевод с английского языка (en).
Степень соответствия - модифицированная (MOD)
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
Введение
Настоящий стандарт представляет собой руководство ОЭСР по испытанию химических веществ, связанному с изучением их природы в окружающей среде. "Биоконцентрирование: Проточные испытания на рыбах" (РИ 305) и "Биоаккумуляция в обитающих в осадочных отложениях донных Oligochates (малощетинковых червях)" (РИ 315) опубликованы соответственно в 1996 и 2008 гг. Экстраполяция данных, полученных по биоаккумуляции в воде, затруднительна для почвенных организмов, таких как земляные черви. В настоящее время модельные расчеты, основанные на липофильности вещества [1], [2], используются для оценки биоаккумуляции химических веществ в почве, как описано в Техническом руководстве ЕС [3]. Необходимость метода испытаний для конкретных сред также рассмотрена в [4]. Такой метод особенно важен для оценки вторичного загрязнения почвенных пищевых цепей [5]. Несколько национальных методов испытаний посвящены биоаккумуляции в других организмах, помимо рыб [6] и [7]. Способ оценки биоаккумуляции химических веществ в земляных червях (Eisenia fetida, Savigny) и энхитреусах из загрязненных почв был разработан Американским обществом по тестированию и материалам [3]. Признанный в международном масштабе метод определения биоаккумуляции в истощенной почве улучшит оценку рисков, связанных с химическими веществами, для почвенных экосистем [8], [9].
Питающиеся почвой беспозвоночные подвергаются воздействию находящихся в ней веществ. Среди таких организмов земляные малощетинковые черви играют важную роль в структуре и функции почв [10], [11]. Земляные малощетинковые черви живут в почве и частично на поверхности почвы (особенно в слое перегноя); они представляют собой наиболее многочисленный вид организмов в отношении биомассы [12]. За счет биотурбации почвы и выступая в качестве добычи эти организмы оказывают сильное влияние на биодоступность веществ для других организмов, таких как беспозвоночные (например, хищные клещи и жуки [13]) или позвоночные, относящиеся к хищникам (например, лисы и чайки [14], [15]). В настоящее время некоторые виды земляных малощетинковых червей используются в качестве моделей в экотоксикологических испытаниях, описанных в приложении Г.
Руководство ASTM для проведения испытаний лабораторной токсичности почвы или биоаккумуляции с земляными червями Eisenia fetida и энхитреидами Enchytraeus albidus [16] обеспечивает важные и полезные сведения для выполнения настоящего метода испытания по биоаккумуляции в почве.
Другими документами, на которые приведены ссылки в настоящем стандарте, являются "Руководство по испытаниям ОЭСР 305. Биоконцентрирование: Проточные испытания на рыбах" [17] и "Руководство по испытаниям ОЭСР 315. Биоаккумуляция в обитающих в осадочных отложениях донных малощетинковых червях" [18]. Практический опыт испытаний по биоаккумуляции в почве и публикации, приведенные в [19]-[31], также являются основными источниками информации, необходимой для пользования настоящим стандартом.
1 Область применения
1.1 Настоящий стандарт устанавливает метод определения биоаккумуляции в земляных малощетинковых червях.
1.2 Данный метод испытаний главным образом применим для стабильных, нейтральных органических химических веществ, которые адсорбируются почвой. С использованием этого метода возможно проведение испытаний по оценке биоаккумуляции находящихся в почве стабильных металлоорганических соединений. Он также применим для металлов и других микроэлементов.
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 биоаккумуляция (bioaccumulation): Увеличение концентрации испытуемого вещества в/на организме по отношению к концентрации испытуемого вещества в окружающей среде. Биоаккумуляция является результатом двух процессов: биоконцентрирования и биомагнификации.
2.2 биоконцентрирование (bioconcentration): Увеличение концентрации испытуемого вещества в/на организме исключительно в результате поглощения вещества из окружающей среды (т.е. через поверхность тела и в результате заглатывания почвы) по отношению к концентрации испытуемого вещества в окружающей среде.
2.3 биомагнификация (biomagnification): Увеличение концентрации испытуемого вещества в/на организме, в основном в результате поглощения загрязненной пищи или добычи по отношению к концентрации испытуемого вещества в пище или добыче. Биомагнификация может привести к переносу или накоплению испытуемого вещества в пищевых цепях.
2.4 элиминация (elimination): Элиминация испытуемого вещества из тканей тестовых организмов посредством активных или пассивных процессов происходит независимо от наличия или отсутствия испытуемого вещества в окружающей среде.
2.5 фактор биоаккумуляции (bioaccumulation factor, BAF): Концентрация испытуемого вещества в/на тестовом организме (С рассчитывают в граммах на килограмм сухой массы червей), отнесенная к концентрации вещества в окружающей среде (C
рассчитывают в граммах на килограмм сухой почвы) в любой момент фазы поглощения в данном испытании по биоаккумуляции; BAF вычисляют в килограммах почвы на килограмм червей.
2.6 фактор биоаккумуляции в равновесном состоянии (steady state bioaccumulation factor, BAFss): BAF в равновесном состоянии, существенно не изменяющийся в течение длительного периода времени, концентрация испытуемого вещества в окружающей среде (C рассчитывают в граммах на килограмм сухой почвы), которая является постоянной в течение этого периода времени.
2.7 кинетический фактор биоаккумуляции (kinetic bioaccumulation factor, BAF): Фактор биоаккумуляции, рассчитанный непосредственно из соотношения константы скорости поглощения почвы к константе скорости элиминации (k
и k
).
2.8 фактор аккумуляции биота-почва (biota-soil accumulation factor, BSAF): Нормализованная по липидам концентрация испытуемого вещества в/на тестовых организмах, отнесенная к нормализованной по органическому углероду концентрации испытуемого вещества в почве в равновесном состоянии. С выражается в граммах на килограмм содержания липидов в организме, а C
- в граммах на килограмм содержания органического углерода в почве; BSAF имеет размерность в килограммах органического углерода на кг липидов.
2.9 плато или равновесное состояние (plateau or steady state): Равновесие между процессами поглощения и элиминации, протекающими одновременно во время фазы воздействия. Равновесное состояние достигается на графике зависимости BAF от времени, когда кривая становится параллельной оси времени, и три последовательных анализа BAF, проведенных на пробах, отобранных с интервалом не менее 2 сут, не различаются более чем на 20% друг от друга, и нет статистически значимых различий между данными трех периодов отбора проб. Для испытуемых веществ, которые поглощаются медленно, более подходящим интервалом являются 7 сут [17].
2.10 коэффициент распределения органический углерод-вода (organic carbon-water partitioning coeficient, K): Отношение концентрации вещества в/на фракции органического углерода в почве и концентрации вещества в воде в равновесном состоянии.
2.11 коэффициент распределения октанол-вода (octanol-water partitioning coeficient, K): Отношение растворимости вещества в н-октаноле и воде в равновесном состоянии, также иногда выражается как P
. Логарифм K
(log K
) используется в качестве показателя потенциальной способности вещества к биоаккумуляции в водных организмах.
2.12 фаза поглощения или фаза воздействия (uptake or exposure phase): Время, в течение которого тестовые организмы подвергаются воздействию испытуемого вещества.
2.13 константа скорости поглощения почвы (soil uptake rate constant, k): Числовое значение, определяющее скорость увеличения концентрации испытуемого вещества в/на тестовых организмах в результате его поглощения из почвы; k
выражается в граммах почвы на килограмм червей в сутки.
2.14 фаза элиминации (elimination phase): Время после переноса тестовых организмов из среды с испытуемым веществом в среду без испытуемого вещества, в течение которого исследуется элиминация (или чистые потери) вещества из тестовых организмов.
2.15 константа скорости элиминации (elimination rate constant, k): Числовое значение, определяющее скорость снижения концентрации испытуемого вещества в/на тестовых организмах после переноса тестовых организмов из среды, содержащей испытуемое вещество, в среду без вещества; k
выражается в сутках в минус первой степени.
3 Предварительные условия
3.1 Испытания по измерению биоаккумуляции веществ в земляных малощетинковых червях были проведены с тяжелыми металлами [32] и стойкими органическими веществами, имеющими значения log K от 3,0 до 6,0 [24]. Такие испытания также применяются в отношении:
- веществ, имеющих log K более чем 6,0 (высокогидрофобных веществ);
- веществ, относящихся к классу органических соединений, которые, как известно, обладают способностью к биоаккумуляции в живых организмах, например поверхностно-активных или веществ, обладающих высокой адсорбционной способностью;
- веществ, структурные особенности которых указывают на их способность к биоаккумуляции, например аналоги веществ с известной биоаккумуляцией;
- металлов.
3.2 Информацию об испытуемом веществе, такую как общее название, химическое название (предпочтительно название по ИЮПАК), структурная формула, регистрационный номер CAS, чистота, техника безопасности, надлежащие условия хранения и аналитический метод, следует получить до начала исследования. В дополнение должна быть известна следующая информация:
а) растворимость в воде;
б) коэффициент распределения октанол-вода, K;
в) коэффициент распределения почва-вода, выраженный в K;
г) давление пара;
д) разлагаемость (например, в почве, воде);
е) известные метаболиты.
3.3 Допускается использовать меченное или не меченное радиоактивным изотопом испытуемое вещество. Однако для облегчения анализа рекомендуется использовать меченное радиоактивным изотопом испытуемое вещество. Решение принимается с учетом пределов обнаружения или требований к оценке исходного соединения и метаболитов. Если используется радиоактивное химическое вещество и измеряется общее количество радиоактивных остатков, то важно, чтобы меченые остатки как в почве, так и в тестовых организмах были выражены в процентах исходного вещества и меченого неисходного вещества (продуктов его разложения), например в образцах, отобранных в равновесном состоянии или в конце фазы поглощения, с тем чтобы рассчитать коэффициент биоаккумуляции (фактор биоаккумуляции (BAF) для исходного вещества и метаболитов, образовавшихся в почве (см. 7.7.9). Метод, приведенный в настоящем стандарте, может быть изменен, например, для обеспечения достаточной биомассы, для измерения не меченного радиоактивным изотопом органического испытуемого вещества или металлов. Если измеряется общее количество радиоактивных остатков (методом подсчета импульсов в жидкой фазе после экстракции, сжигания или солюбилизации тканей), то фактор биоаккумуляции основывается на исходном веществе и его метаболитах. Расчет BAF предпочтительно должен базироваться на концентрации исходного вещества в организмах и общем количестве радиоактивных остатков. Затем рассчитывают фактор аккумуляции биота-почва (BSAF), нормализованный по содержанию липидов в червях и содержанию органического углерода (OC) в почве из BAF с учетом сопоставимости результатов различных испытаний биоаккумуляции.
3.4 Токсичность испытуемого вещества для видов, используемых в испытании, должна быть известна, например, эффективная концентрация (EC) или летальная концентрация (LC
) на время фазы поглощения [3]. Выбранная концентрация испытуемого вещества предпочтительно должна составлять около 1% его LC
для острой асимптотической токсичности и должна быть не менее чем в десять раз выше его предела обнаружения в почве аналитическим методом. По возможности предпочтение отдается показателям токсичности, полученным из долгосрочных исследований по сублетальным конечным точкам [33], [34]. Если такие данные отсутствуют, то испытание по определению параметров острой токсичности дает полезную информацию [35].
3.5 Должен быть доступен подходящий аналитический метод с известной точностью, погрешностью и чувствительностью для количественного определения вещества в испытуемых растворах, в почве и в биологическом материале, а также подробная информация о подготовке и хранении проб и паспорт безопасности вещества. Должны быть также известны пределы аналитического определения испытуемого вещества в почве и тканях червей. При использовании С-меченого испытуемого вещества должны быть известны удельная радиоактивность (т.е. Bq
mol
) и процент радиоактивности, связанный с примесями. Удельная радиоактивность испытуемого вещества должна быть достаточно высокой для простоты анализа, а используемые испытуемые концентрации не должны вызывать токсического действия.
3.6 Испытание можно проводить с искусственной или природной почвой. До начала испытания должна быть в наличии информация о характеристиках используемой природной почвы, например: источник почвы или ее составляющие компоненты, рН, содержание органического углерода, распределение частиц по размерам (процент песка, ила и глины) и водоудерживающая способность (WHC) [16], [36].
4 Принцип метода
4.1 Параметры, характеризующие биоаккумуляцию вещества, включают BAF, k и k
. Определения указанных показателей приведены в разделе 2.
4.2 Испытание состоит из двух фаз: фазы поглощения (экспозиции) и фазы элиминации (после экспозиции). Во время фазы поглощения черви подвергаются воздействию почвы с внесенным испытуемым веществом в повторностях. В дополнение к тестовым организмам контрольные черви содержатся в одинаковых условиях, но без испытуемого вещества. Измеряют сухую массу и содержание липидов в тестовых организмах. Это можно выполнить, используя червей из контрольной группы. Аналитические фоновые значения (контроль) можно получить, анализируя пробы контрольных червей и почвы. Для фазы элиминации червей помещают в почву, свободную от испытуемого вещества. Фаза элиминации требуется в тех случаях, если поглощение испытуемого вещества в фазе экспозиции было незначительным. Фаза элиминации дает информацию о скорости, с которой испытуемое вещество выделяется тестовыми организмами [37]. Если равновесное состояние не достигнуто в течение фазы поглощения, то определение кинетических параметров - кинетического фактора биоаккумуляции BAF, константы скорости поглощения и элиминации - предпочтительно должно основываться на одновременном выравнивании результатов фаз поглощения и элиминации. Концентрация испытуемого вещества в/на червях контролируется в обеих фазах испытания.
4.3 В течение фазы поглощения измерения проводятся в период наблюдений до 14 сут (для энхитреид) или 21 сут (для земляных червей), пока достигается равновесное состояние согласно [21], [22], [38]. Равновесное состояние достигнуто, когда график зависимости концентрации испытуемого вещества в червях от времени параллелен оси времени и три последовательные концентрации результатов анализа на образцах, взятых с интервалом не менее 2 сут, не изменяются более чем на ±20% друг от друга на основе статистического сравнения (например, дисперсионный анализ, регрессионный анализ).
4.4 Фаза элиминации включает перенос тестовых организмов в сосуды, содержащие тот же самый субстрат без испытуемого вещества. Во время фазы элиминации измерения проводят в период наблюдений до 14 сут (для энхитреиды) или 21 сут (для земляных червей), если ранее аналитическое определение показало снижение на 90% остатков испытуемого вещества в червях. Концентрация испытуемого вещества в червях в конце фазы элиминации выражается в виде неэлиминированных остатков. BAFss равновесного состояния предпочтительно рассчитывается как соотношение концентрации в червях (Са) и в почве (Cs) при очевидном стабильном состоянии и в виде кинетического фактора биоаккумуляции (BAF), как соотношение k
и k
, предполагая кинетику первого порядка (см. приложение А). Если кинетика первого порядка является, очевидно, неприменимой, то используют другие модели.
4.5 Константа скорости поглощения, константа скорости элиминации (или константы, когда используются другие модели), кинетический фактор биоаккумуляции (BAF) и, по возможности, доверительные интервалы для каждого из этих параметров рассчитываются с использованием компьютерных модельных уравнений (см. приложение А). Критерий соответствия любой модели может быть определен, например, из коэффициента корреляции или коэффициента детерминации (коэффициенты, близкие к единице, указывают на хорошую аппроксимацию) или хи-квадрат. Также размер стандартной ошибки или доверительный интервал для оцениваемых параметров могут указывать на критерий соответствия модели.
4.6 Для снижения вариабельности результатов испытаний с веществами с высокой липофильностью коэффициенты биоаккумуляции выражают по отношению к содержанию липидов и содержанию органического углерода (килограмм органического углерода (ОУ) в почве; килограмм в минус первой степени содержание липидов в червях). Данный подход основан на наличии для некоторых классов химических веществ четкой взаимосвязи между способностью вещества к биоаккумуляции и его липофильностью, например которая была установлена для рыб [39]. Существует взаимосвязь между содержанием липидов в рыбе и биоаккумуляцией подобных веществ. Для донных организмов были установлены аналогичные корреляции [40], [41]. Аналогичная корреляция была показана для земляных олигохет (малощетинковых червей) [20], [42], [43], [1]. При наличии достаточного количества ткани червей содержание липидов в тестовых организмах можно определить на том же биологическом материале, который используют для определения концентрации испытуемого вещества. Кроме того, контрольные организмы могут быть использованы для измерения содержания липидов.
5 Достоверность испытания
Испытание считается достоверным при выполнении следующих критериев для контролей и опытных обработок:
- по окончании испытания общая гибель в течение фаз поглощения и элиминации не должна превышать 10% (для земляных червей) или 20% (для энхитреид) общего количества введенных в испытание червей;
- для Eisenia fetida и Eisenia andrei средняя потеря массы, измеренная в конце фаз поглощения и элиминации, не должна превышать 20% по сравнению с исходной сырой массой (сырая масса, масса сырой ткани) f.w. в начале каждой фазы.
6 Описание метода
6.1 Тестовые виды
Несколько видов земляных олигохет (малощетинковых червей) рекомендуются для использования в испытаниях по биоаккумуляции. Наиболее часто используемые виды Eisenia fetida, или Eisenia andrei (Lumbricidae), или Enchytraeus albidus, или Enchytraeus crypticus, или Enchytraeus luxuriosus (Enchytraeidae) описаны в приложении Г.
6.2 Оборудование
Следует проявлять осторожность, чтобы избежать использования материалов для любых частей оборудования, которые могут растворяться, адсорбировать испытуемое вещество или выщелачивать другие соединения и которые оказывают отрицательное влияние на сами тестовые организмы. Следует использовать стандартные прямоугольные или цилиндрические камеры, изготовленные из химически инертного материала с подходящей вместимостью в соответствии с уровнем загрузки, т.е. количеством тестовых червей. Нержавеющая сталь, пластик или стекло могут быть использованы для любого оборудования, имеющего контакт с испытуемой средой. Испытуемые камеры должны быть надлежащим образом покрыты, чтобы предотвратить выползание червей, допуская при этом достаточную подачу воздуха. Для веществ с высокими коэффициентами адсорбции могут потребоваться, например, синтетические пиретроиды, силанизированное стекло. В этих случаях оборудование следует утилизировать после использования [17]. Необходимо предупредить утечку меченных радиоактивными изотопами испытуемых веществ и летучих химических веществ. Следует использовать ловушки (например, стеклянные бутыли для промывания газа), содержащие подходящие абсорбенты для удерживания всех испаряющихся остатков из испытуемых сосудов.
6.3 Почва
6.3.1 Испытуемая почва должна обеспечивать выживаемость и предпочтительно воспроизводство тестовых организмов во время акклиматизации и испытания, не вызывая каких-либо изменений внешнего вида или поведения червей. Черви должны зарываться в почву.
6.3.2 Искусственная почва, описанная в [36], рекомендуется для использования в испытаниях в качестве субстрата. Подготовка искусственной почвы для использования в испытаниях по биоаккумуляции и рекомендации по хранению искусственной почвы приведены в приложении В. До использования высушенный на воздухе искусственный грунт может храниться при комнатной температуре.
6.3.3 Однако природные почвы из незагрязненных участков могут служить испытуемой и/или культивированной почвой. Природные почвы следует характеризовать, по меньшей мере, по источнику (месту сбора), значению рН, содержанию органического углерода, распределению частиц по размеру (песок, ил и глина в процентах), максимальной водоудерживающей способности (WHC) и процентному содержанию воды [16]. Анализ почвы или ее составляющих на микрозагрязнители перед использованием должен предоставить полезную информацию. Если используется полевая почва с сельскохозяйственных земель, то предъявляются следующие требования: до отбора проб она не должна обрабатываться в течение не менее одного года средствами защиты растений или навозом в качестве удобрения от обработанных препаратами животных и не менее шести месяцев органическими удобрениями [44]. Процедуры обращения с естественной почвой до использования ее в экотоксикологических испытаниях на малощетинковых червях в лаборатории описаны в [16]. Для естественных почв срок хранения в лаборатории должен быть как можно более коротким.
6.4 Внесение испытуемого вещества
6.4.1 Испытуемое вещество вносят в почву. При этом следует учитывать физико-химические свойства испытуемого вещества. Водорастворимое испытуемое вещество должно быть полностью растворено в воде перед смешиванием с почвой. Рекомендуемая процедура внесения плохо растворимого в воде испытуемого вещества включает покрытие одного или более компонентов почвы (искусственной) испытуемым веществом. Например, кварцевый песок или его часть могут быть пропитаны раствором испытуемого вещества в подходящем органическом растворителе, который затем медленно выпаривают досуха. Покрытую фракцию затем смешивают с влажной почвой. Главное преимущество этой процедуры состоит в том, что растворитель не вносится в почву. При использовании природной почвы испытуемое вещество может быть добавлено внесением высушенной на воздухе порции почвы, как описано выше для искусственной почвы, или перемешиванием испытуемого вещества с влажной почвой, с последующей стадией выпаривания, если использовался солюбилизирующий агент. Как правило, контактирования растворителя с влажной почвой следует избегать, насколько это возможно. Необходимо учитывать следующее [16]:
- если используется растворитель иной, чем вода, то он должен смешиваться с водой и/или его можно легко удалить (например, упариванием), оставив в почве только испытуемое вещество;
- если используется контроль на растворитель, то нет необходимости в отрицательном контроле. Контроль на растворитель должен содержать высокую концентрацию внесенного в почву растворителя и должен использоваться растворитель из партии, примененной для изготовления стокового раствора. Токсичность и летучесть растворителя и растворимость испытуемого вещества в выбранном растворителе должны быть основными критериями для выбора подходящего солюбилизирующего агента.
6.4.2 Для веществ, плохо растворимых в воде и в органических растворителях, 2,0-2,5 г тонко измельченного кварцевого песка в испытуемом сосуде смешивают с количеством испытуемого вещества, например с помощью ступки и пестика, для получения требуемой испытуемой концентрации. Эту смесь кварцевого песка и испытуемого вещества добавляют к предварительно увлажненной почве и все тщательно перемешивают с соответствующим количеством деионизированной воды для получения требуемого содержания влаги. Конечную смесь распределяют по испытательным сосудам. Процедуру повторяют для каждой испытуемой концентрации и соответствующих контролей с получением также 2,0-2,5 г тонко измельченного кварцевого песка на испытательный сосуд.
6.4.3 Концентрацию испытуемого вещества в почве определяют после его внесения. Перед внесением тестовых организмов проверяют однородность распределения испытуемого вещества в почве. Следует указывать метод, используемый для внесения тестовых организмов, и причины выбора определенной процедуры внесения [45].
6.4.4 Равновесие между почвой и фазой поровой воды в идеале должно быть установлено перед внесением тестовых организмов; рекомендуемым периодом времени являются 4 сут при температуре 20°С. Для многих органических веществ, плохо растворимых в воде, время, необходимое для достижения истинного равновесия между адсорбированными и растворенными фракциями, может исчисляться в сутках или месяцах в зависимости от цели исследования. Например, когда имитируются условия окружающей среды, то внесенная почва может быть "состаренной" в течение более длительного периода; например, для металлов такой период составляет три недели при температуре 20°С [46].
6.5 Культивирование тестовых организмов
6.5.1 Черви предпочтительно должны поддерживаться в постоянной лабораторной культуре. Руководство по методам лабораторного культивирования видов Eisenia fetida, и Eisenia andrei, и Enchytraeid приведено в приложении Г, [36], [33], [34].
6.5.2 У червей, используемых в испытании, не должно наблюдаться заболеваний, аномалий и паразитов.
7 Проведение испытания
Тестовые организмы подвергаются воздействию испытуемым веществом в течение фазы поглощения. Фаза поглощения должна составлять 14 сут (для энхитреид) или 21 сут (для земляных червей), если было показано, что достигнуто равновесное состояние.
Для фазы элиминации червей переносят в почву без испытуемого вещества. Первую пробу отбирают на 4-24 ч после начала фазы элиминации. Примеры графиков отбора проб для 21-суточной фазы поглощения и 21-суточной фазы элиминации приведены в приложении Б.
7.1 Тестовые организмы
7.1.1 Многие виды земляных энхитреид имеют очень низкую индивидуальную массу (например, 5-10 мг сырой массы для одной особи Enchytraeus albidus и менее для Enchytraeus crypticus или Enchytraeus luxuriosus); для выполнения измерений массы и химического анализа может потребоваться объединение червей из повторностей испытуемых сосудов (т.е. всех червей из параллельных сосудов используют для проведения одного анализа тканей). 20 отдельных энхитреид вносят в каждую повторность и используют не менее трех повторностей. Если предел анализа испытуемого вещества высокий, то может потребоваться больше червей. Для тестовых видов с более высокой индивидуальной массой (Eisenia fetida и Eisenia andrei) используют параллельные сосуды, содержащие одну особь.
Земляные черви, используемые в испытании, должны иметь сравнимую массу (например, Eisenia fetida и Eisenia andrei должны иметь индивидуальную массу в пределах 250-600 мг). Энхитреиды (например, Enchytraeus albidus) должны иметь длину приблизительно 1 см. Все черви, используемые в конкретном испытании, должны поставляться из одного источника, а половозрелые особи должны иметь клителлюм (см. приложение Г). Поскольку масса и возраст червей могут оказывать влияние на значения BAF (например, из-за разного содержания липидов и/или наличия яиц), то эти параметры следует четко регистрировать и учитывать при интерпретации результатов. Кроме того, в период воздействия могут быть занесены коконы, что также будет оказывать влияние на значения BAF. Рекомендуется взвесить подвыборку тестовых червей до проведения испытания для оценки среднего сырой и сухой массы.
7.1.3 Должно использоваться высокое соотношение почва-червь для сведения к минимуму снижения концентрации испытуемого вещества в почве во время фазы поглощения. Для Eisenia fetida и Eisenia andrei рекомендуется использовать минимальное количество 50 г сухой почвы на одного червя, а для энхитреид - как минимум 10-20 г сухой почвы на испытуемый сосуд. Сосуды должны содержать слой почвы высотой 2-3 см (энхитреиды) или 4-5 см (земляные черви).
7.1.4 Черви, используемые в испытании, отбираются из культуры (например, энхитреиды с помощью ювелирного пинцета). Половозрелых особей переносят в необработанную испытуемую почву для акклиматизации и дают корм (см. 7.2.1). Если условия испытаний отличаются от условий культивирования, то 24-72 ч достаточно для фазы акклиматизации в целях адаптации червей к условиям испытаний. После акклиматизации земляных червей промывают переносом в стеклянную посуду (например, чашки Петри), содержащую чистую воду, а затем взвешивают перед внесением в испытуемую почву. Перед взвешиванием избыток воды удаляют с червей, осторожно прикасая их к краю посуды или осторожно промокая их досуха с помощью слегка смоченной бумажной салфетки.
7.1.5 Наблюдают и регистрируют роющее поведение тестовых организмов. В испытаниях с земляными червями особи (в контроле и опыте) обычно зарываются в почву в течение нескольких часов; такое поведение червей проверяют не позднее 24 ч после внесения червей в испытуемые сосуды. Если земляные черви не могут зарываться в почву (например, более чем 10% за более чем половины фазы поглощения), то это означает, что условия испытаний являются неподходящими или тестовые организмы имеют патологические отклонения. В таком случае испытание останавливают и повторяют вновь. Энхитреиды в основном обитают в интерстициальных порах почвы, и часто их кожный покров только частично контактирует с окружающим субстратом; воздействие на роющих и не роющих энхитреид считается равнозначным, и для энхитреид без признаков роения не требуется обязательного повторения испытания.
7.2 Кормление
Кормление проводят, когда используется почва с низким общим содержанием органического углерода. При использовании искусственной почвы для земляных червей рекомендуется еженедельная норма кормления (т.е. червей следует кормить один раз в неделю) из расчета 7мг сухого навоза на г сухой массы почвы, а для энхитреид еженедельная норма составляет 2-2,5 мг хлопьев овсяной крупы на г сухой массы почвы [21]. В первом случае корм смешивают с почвой непосредственно перед добавлением тестовых организмов. Предпочтительно использовать такой же тип корма, что и в культуре (см. приложение Г).
7.3 Освещение и температура
Испытания проводят при контролируемом цикле свет/темнота 16/8 ч, предпочтительно от 400 до 800 лк в области испытуемых сосудов [3]. Температура в испытании должна составлять (20±2)°C в течение всего периода.
7.4 Испытуемые концентрации
Используется одна концентрация. Ситуации, в которых необходима(ы) дополнительная(ые) концентрация(и), должны быть обоснованы. Если токсичность (EC) испытуемого вещества близка к пределу аналитического определения испытуемого вещества, то рекомендуется использовать меченное радиоактивной меткой испытуемое вещество с высокой удельной радиоактивностью. Для металлов концентрация должна быть выше фонового уровня в тканях и почве.
7.5 Повторности
7.5.1 Для кинетических измерений (фазы поглощения и элиминации) минимальное число повторностей обработанных камер должно составлять три на каждую точку отбора проб. Общее количество подготовленных повторностей должно быть достаточным, чтобы охватить все время отбора проб в течение фазы поглощения и элиминации.
7.5.2 Для биологических наблюдений и измерений (например, соотношение сухая/сырая масса, содержание липидов) и для анализа фоновых концентраций в червях и почве должно быть не менее 12 параллельных камер с отрицательным контролем (четыре отобранных в начале, четыре в конце поглощения и четыре в конце элиминации), если не используется растворитель, кроме воды. Если используется солюбилизирующий агент для внесения испытуемого вещества в почву, то в дополнение к параллельным пробам следует включить контроль на растворитель (четыре параллельных камеры должны быть отобраны в начале, четыре в конце фазы поглощения и четыре в конце фазы элиминации), содержащий все компоненты, за исключением испытуемого вещества. В этом случае четыре дополнительные параллельные камеры с отрицательным контролем (без растворителя) также включают в испытание для дополнительного отбора проб в конце фазы поглощения. Эти повторности можно биологически сравнить с контролем на растворитель в целях получения информации о возможном влиянии растворителя на тестовые организмы. Рекомендуется установить достаточное количество дополнительных параллельных камер (например, восемь) для опыта и контроля(ей).
7.6 Частота измерений качества почвы
рН почвы, влажность почвы и температуру (постоянно) в испытательной камере измеряют в начале и в конце фаз поглощения и элиминации. Раз в неделю влажность почвы должна контролироваться взвешиванием испытуемых сосудов и сравнением фактической массы с первоначальной массой в начале испытания. Потери воды должны компенсироваться добавлением деионизированной воды.
7.7 Отбор проб и анализ червей и почвы
7.7.1 Примеры графиков отбора проб для фаз поглощения и элиминации для земляных червей и энхитреид в испытаниях по биоаккумуляции приводятся в приложении Б.
7.7.2 Почва отбирается из испытуемых камер для определения концентрации испытуемого вещества перед внесением червей и во время фаз поглощения и элиминации. В ходе испытания определяют концентрацию испытуемого вещества в червях и почве. В общем, измеряются общие концентрации в почве. Как дополнительный вариант, измеряют концентрации в поровой воде, в этом случае до начала исследования представляют обоснование и соответствующие методы и включают их в отчет.
7.7.3 Червей и почву отбирают не менее шести раз в течение фаз поглощения и элиминации. Если стабильность испытуемого вещества подтверждена, то количество анализов почвы может быть уменьшено. Рекомендуется анализировать не менее трех повторностей в начале и в конце фазы поглощения. Если измеренная концентрация в почве в конце фазы поглощения отклоняется от исходной концентрации более чем на 30%, то также анализируют образцы почвы, отобранные на другие сроки.
7.7.4 Червей из каждой повторности извлекают из почвы во время каждого отбора проб (например, распределением почвы из каждой повторности в мелком лотке и сбором червей с помощью мягкого ювелирного пинцета) и быстро промывают водой в мелком стеклянном или стальном лотке. Удаляют излишки воды (см. 7.1.4). Червей осторожно переносят в предварительно точно взвешенный сосуд и сразу же взвешивают, включая содержимое кишечника.
7.7.5 Земляным червям (Eisenia sp.) дают возможность освободить кишечник в течение ночи, например, используя чашку Петри, покрытую влажной фильтровальной бумагой (см. 7.1.4). После этого определяют массу червей для оценки возможного уменьшения биомассы в ходе испытания (см. критерии достоверности 5.1). Взвешивание и анализ тканей энхитреид осуществляются без освобождения кишечника, так как это технически сложно из-за небольшого размера этих червей. После определения конечной массы червей немедленно умерщвляют с использованием наиболее подходящего метода (например, с помощью жидкого азота или замораживанием при температуре ниже минус 18°C).
7.7.6 Во время фазы элиминации черви замещают загрязненное содержимое кишечника чистой почвой. Это означает, что измерения червей без очистки кишечника (энхитреиды в данном контексте), отобранных непосредственно перед фазой элиминации, включают в себя загрязненную содержимым кишечника почву. Для водных малощетинковых червей предполагается, что после первых 4-24 ч фазы элиминации большинство загрязненного содержимого кишечника было замещено чистым осадком [47]. Подобные результаты были получены для земляных червей в исследованиях по накоплению радиоактивного кадмия и цинка [30]. В энхитреидах с неочищенным кишечником концентрация испытуемого вещества в первой пробе, отобранной в фазе элиминации, может рассматриваться в качестве концентрации в ткани после очистки кишечника. Для учета разбавления концентрации испытуемого вещества незагрязненной почвой во время фазы элиминации массу содержимого кишечника можно определить по соотношению сырая масса червей/масса зольного остатка червя или сухая масса червя/масса зольного остатка червя.
7.7.7 Пробы почвы и червей предпочтительно анализировать сразу же после их отбора (то есть в течение 1-2 сут) для предупреждения деградации или потерь за счет других причин, также рекомендуется рассчитать примерные скорости поглощения и элиминации во время проведения испытания. Если анализ откладывается, то пробы хранят соответствующим образом, например при глубокой заморозке (менее или равно минус 18°C).
7.7.8 Следует убедиться в том, что точность и воспроизводимость химического анализа, а также извлечение испытуемого вещества из проб почвы и червей являются удовлетворительными для данного метода; указывают эффективность экстракции, предел обнаружения (LOD) и предел количественного определения (LOQ). Аналогичным образом следует проверить, что испытуемое вещество не обнаруживают в контрольных сосудах в концентрациях, превышающих фоновый уровень. Если концентрация испытуемого вещества в тестовых организмах С составляет более 0 в контрольных червях, то необходимо включить в расчет кинетические параметры (см. приложение А). Все пробы обрабатывают в течение всего испытания, обеспечивая минимизацию случайного загрязнения и потерь (например, в результате адсорбции испытуемого вещества на устройстве отбора проб).
7.7.9 При работе с меченным радиоактивными изотопами веществом можно анализировать исходную молекулу и метаболиты. Количественное определение исходного соединения и его метаболитов в равновесном состоянии или в конце фазы поглощения предоставляет важную информацию. Пробы следует "очистить" таким образом, чтобы можно было провести отдельный количественный анализ только исходного вещества. Если доля отдельных метаболитов превышает 10% общей радиоактивности в анализируемой пробе(ах), то рекомендуется провести идентификацию этих метаболитов.
7.7.10 Следует регистрировать и документировать общее извлечение и извлечение испытуемого вещества из червей, почвы, а при их использовании - из ловушек, содержащих абсорбенты для удержания испаряющегося испытуемого вещества.
7.7.11 Объединение особей, отобранных из определенной испытуемой камеры, применяется для энхитреид, масса которых меньше, чем у земляных червей. Если объединение приводит к сокращению количества повторностей, то это ограничивает статистические процедуры, которые могут быть применены к полученным данным. Если требуется конкретная статистическая процедура и мощность, то следует включить достаточное количество повторностей испытуемых сосудов в испытание для обеспечения необходимого объединения, обработки и мощности.
7.7.12 Рекомендуется, чтобы BAF был выражен по отношению к общей сухой массе, и, при необходимости (например, для высокогидрофобных веществ), по отношению к содержанию липидов. Для определения содержания липидов используют соответствующие методы (некоторые существующие методы [48], [49] адаптируют для этой цели). В таких методах используется экстракция смесью хлороформ/метанол. Однако, чтобы избежать использования хлорированных растворителей, используют модифицированный метод Блая и Дайера [50], [51]. Так как различные методы могут не дать одинаковых значений, важно предоставить подробную информацию об используемом методе. При возможности, т.е. при наличии достаточного количества тканей червей, анализ липидов в идеале следует проводить на той же пробе или экстракте, которые использовались для анализа испытуемого вещества, поскольку липиды часто удаляются из экстракта перед его анализом хроматографией [17]. Кроме того, контрольные организмы могут использоваться для измерения содержания липидов, которое затем применяют для нормализации значений BAF. Этот последний подход уменьшает загрязнение оборудования испытуемым веществом.
8 Результаты и отчет о проведении испытания
8.1 Обработка результатов
8.1.1 Кривую поглощения испытуемого вещества получают построением графика зависимости его концентрации в/на червях во время фазы поглощения от времени в нелогарифмической шкале. Если кривая достигает плато или равновесного состояния (см. определения в разделе 2), то фактор биоаккумуляции BAF в равновесном состоянии рассчитывают следующим образом:
![]() , (1)
, (1)
где С - концентрация испытуемого вещества в опытных (подопытных, испытуемых) организмах;
C - концентрация испытуемого вещества в почве.
8.1.2 Если равновесное состояние не достигается, то определяют значение BAF на основе констант скорости вместо BAF
, как описано ниже:
- определяют коэффициент аккумуляции (BAF) как соотношение k
/k
;
- скорости поглощения и элиминации предпочтительно рассчитывают одновременно (см. уравнение А.11 в приложении А);
- константа скорости элиминации (k) обычно определяется по кривой элиминации (т.е. графика концентраций испытуемого вещества в червях во время фазы элиминации). Затем вычисляется константа скорости поглощения k
, дающая k
и значение С
, полученные из кривой поглощения. Описание этих методов приведено в приложении А. Предпочтительным методом получения BAF
и констант скорости k
и k
является использование нелинейных методов оценки параметров на компьютере. Если элиминация четко не является элиминацией первого порядка, то следует использовать более сложные модели.
8.2 Отчет о проведении испытания
Отчет о проведении испытания должен содержать следующую информацию:
8.2.1 Испытуемое вещество:
- любая имеющаяся информация об острой или хронической токсичности (например, EC, LC
, NOEC) испытуемого вещества для почвенных малощетинковых червей;
- чистота, физическая природа и физико-химические свойства, например log K, растворимость в воде;
- данные идентификации, источник испытуемого вещества, идентификация и концентрация любого используемого растворителя;
- при использовании меченного радиоактивными изотопами испытуемого вещества, точное положение меченых атомов, удельная радиоактивность и радиохимическая чистота.
8.2.2 Тестовые виды:
- научное наименование, штамм, источник, любая предварительная обработка, акклиматизация, возраст, диапазон размеров и т.д.
8.2.3 Условия испытания:
- используемая процедура испытания;
- тип и характеристики используемого освещения и светового периода;
- дизайн испытания (например, количество и размер испытуемых камер, масса почвы и высота слоя почвы, количество повторностей, количество червей в повторности, количество испытуемых концентраций, продолжительность фаз поглощения и элиминации, частота отбора проб);
- обоснование выбора материала испытуемых камер;
- метод подготовки и внесения испытуемого вещества, а также обоснование выбора конкретного метода;
- номинальные испытуемые концентрации и средние измеренных значений и их стандартные отклонения в испытуемых камерах, и метод, с помощью которого были получены эти значения;
- источник компонентов искусственной почвы или при использовании природной среды - источник почвы, описание любой предварительной обработки, результаты в контроле (выживаемость, увеличение биомассы, воспроизводство), характеристики почвы (рН, общее содержание органического углерода, распределение частиц по размеру (песок, ил и глина в процентах), WHC, содержание воды в процентах в начале и в конце испытания и любые другие выполненные измерения);
- подробная информация об обработке проб почвы и червей, включая информацию о подготовке, хранении, процедурах внесения, экстракции и аналитических процедурах (и точности) для испытуемого вещества в червях и почве, а также о содержании липидов (при измерении) и извлечении испытуемого вещества.
8.2.4 Результаты:
- гибель контрольных червей и червей в каждой испытуемой камере и любое наблюдаемое аномальное поведение (например, выползание из почвы, отсутствие воспроизведения в испытании по биоаккумуляции энхитреид);
- соотношение сухая масса - сырая масса почвы и тестовых организмов (для нормализации);
- сырая масса червей на каждый отбор проб; для земляных червей сырая масса в начале испытания и на каждый отбор проб до и после очистки кишечника;
- содержание липидов в тестовых организмах (если определяется);
- кривые, показывающие кинетику поглощения и элиминации испытуемого вещества у червей, а также время до равновесного состояния;
- С и C
(со стандартным отклонением и диапазоном, при необходимости) на все отборы проб (С
рассчитывают в граммах на килограмм сырой и сухой массы всего организма, C
выражается в граммах на килограмм сырой и сухой массы почвы). Если требуется BSAF (например, для сравнения результатов двух или более испытаний, проведенных на червях с различным содержанием липидов), то С
может быть дополнительно выражена в граммах на килограмм содержания липидов в организме, а C
может быть выражена в граммах на килограмм органического углерода (OC) в почве;
- могут быть представлены дополнительно BAF (в килограммах почвы на килограмм червей), константа скорости поглощения почвы k (в граммах почвы на килограмм червей в сутки) и константа скорости элиминации k
в сутки в минус первой степени; BSAF (в килограммах органического углерода (OC) почвы на килограмм содержания липидов в червях);
- если измеряется: процент исходного соединения, метаболитов, а также связанных остатков (то есть процент испытуемого вещества, который не может быть извлечен общими методами экстракции), обнаруженные в почве и тестовых организмах;
- методы, используемые для статистического анализа данных.
8.2.5 Оценка результатов:
- соответствие результатов критериям достоверности, перечисленным в 5;
- неожиданные или необычные результаты, например неполная элиминация испытуемого вещества из тестовых организмов.
Приложение А
(рекомендуемое)
Расчет параметров поглощения и элиминации
Основной конечной точкой испытания по биоаккумуляции является фактор биоаккумуляции, BAF. Измеренный BAF может быть рассчитан делением концентрации испытуемого вещества в тестовых организмах С на концентрацию в почве C
в равновесном состоянии. Если равновесные условия не достигаются во время фазы поглощения, то по константам скоростей рассчитывается BAF
вместо BAF
. Однако следует указать, основан ли BAF на концентрациях в равновесном состоянии или нет.
Наиболее предпочтительными методами расчета кинетического фактора биоаккумуляции (BAF), константы скорости поглощения почвы (k
) и константы скорости элиминации (выведения) (k
) являются нелинейные методы оценки параметров на компьютере, например на основе моделей [52]. Принимая во внимание совокупность последовательных данных концентрации от времени и модельные уравнения:
![]() ,
, ![]() (А.1)
(А.1)
или
![]() ,
, , (А.2)*
где С - концентрация вещества в червях (г/кг сырой или сухой массы);
k - константа скорости поглощения в тканях (г почвы на кг червей в сутки);
C - концентрация вещества в почве (г/кг сырой или сухой массы);
k - константа скорости элиминации (сутки
);
t* - время в конце фазы поглощения.
_______________
* Здесь и далее формула и экспликация к ней соответствуют оригиналу. - .
Эти компьютерные программы рассчитывают значения для BAFK, k и k
.
Когда фоновая концентрация испытуемого вещества в червях, не подвергшихся его воздействию, например на сутки 0, существенно отличается от нуля (это может быть, например, в случае металлов), то фоновая концентрация (С, 0) должна быть включена в эти уравнения, чтобы сделать их читаемыми:
![]() ,
, ![]() (А.3)
(А.3)
и
![]() ,
, . (А.4)
В случаях, когда значительное уменьшение концентрации испытуемого вещества в почве наблюдается в течение длительного периода во время фазы поглощения, могут быть использованы следующие модели [38], [31]:
![]() , (А.5)
, (А.5)
где C - концентрация вещества в червях (г/кг сырой или сухой массы);
k - константа скорости разложения в почве (сутки
);
C - исходная концентрация вещества в почве (г/кг сырой или сухой массы).
![]() ,
, ![]() , (А.6)
, (А.6)![]() ,
, , (А.7)
где С - концентрация вещества в червях (г/кг сырой или сухой массы);
k - константа скорости поглощения в тканях (г почвы на кг червей в сутки);
k - константа скорости разложения в почве (сутки
);
k - константа скорости элиминации (сутки
);
t - время в конце фазы поглощения.
Когда достигнуто равновесное состояние во время фазы поглощения (т.е. t=), то уравнение
![]() ,
, ![]() (А.1)*
(А.1)*
________________
* Нумерация соответствует оригиналу. - .
может быть уменьшено до
![]() , (А.8)
, (А.8)
тогда k/k
·C
является приближением к концентрации испытуемого вещества в тканях червей в равновесном состоянии (С
).
Фактор аккумуляции биота-почва (BSAF) может быть рассчитан следующим образом:
![]() , (А.9)
, (А.9)
где - относительное содержание органического углерода в почве;
- относительное содержание липидов в червях.
и
предпочтительно определяются на пробах, отобранных в ходе испытания, оба показателя в расчете на сухую массу или сырую массу соответственно.
Кинетика элиминации может быть смоделирована с использованием данных из фазы элиминации и применением следующего модельного уравнения и метода оценки: нелинейный параметр на основе компьютера. Если экспериментальные точки в зависимости от времени указывают на константу экспоненциального снижения концентрации испытуемого вещества в червях, то для описания зависимости элиминации от времени может быть использована однокамерная модель (уравнение А.9).
![]() . (А.10)
. (А.10)
Процессы элиминации иногда оказываются двухфазными, демонстрируя быстрое снижение С на ранних стадиях, которое переходит в более медленное выведение испытуемого вещества на более поздних фазах элиминации [37], [52]. Две фазы могут быть оценены с допущением, что существуют два различных отдела в организме, из которых испытуемое вещество выделяется с разными скоростями. В этих случаях следует изучить специальную литературу [53], [54], [24], [30].
Используя вышеприведенные модельные уравнения, кинетические параметры (k и k
) также могут быть рассчитаны в одном испытании с использованием кинетической модели первого порядка для всех данных, как из фазы поглощения, так и из фазы элиминации одновременно. Для описания метода, позволяющего такой комбинированный расчет констант скорости поглощения и элиминации, можно обратиться к [55], [56] и [57].
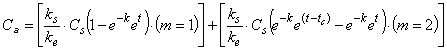 . (А.11)
. (А.11)
Примечание - Когда параметры поглощения и элиминации оцениваются одновременно из данных комбинированного поглощения и элиминации, "m", как показано в уравнении А.11, является идентификатором, позволяющим компьютерной программе определить субтермины уравнения для совокупности данных соответствующей фазы и правильно выполнить оценку (m=1 для фазы поглощения; m=2 для фазы элиминации).
Однако эти модельные уравнения следует использовать с осторожностью, особенно когда происходят изменения в биодоступности или (био)разложении испытуемого вещества во время испытания [31].
Приложение Б
(рекомендуемое)
Примеры графиков для испытаний по биоаккумуляции в почве
Испытание на земляных (дождевых) червях
а) фаза поглощения с 8 датами (восьмидневным) отбора(ом) проб, используемых для расчета кинетики
День | Действия |
-6 | Кондиционирование подготовленной почвы в течение 48 ч. |
-4 | Внесение в почву раствора испытуемого вещества; выпаривание любого растворителя; смешивание компонентов почвы; распределение почвы в испытательные сосуды; уравновешивание в испытуемых условиях в течение 4 сут (3 недели для почвы, в которую были внесены металлы). |
От -3 до -1 | Выделение тестовых организмов из культуры для акклиматизации, подготовка и увлажнение из компонентов почвы. |
0 | Измерение температуры и рН почвы, отбор проб почвы из обработанных сосудов и контролей на растворитель для определения концентрации испытуемого вещества; добавление корма; взвешивание и произвольное распределение червей в испытуемые сосуды; включение в испытание достаточной подпробы червей для аналитического определения фонового значения, сырой и сухой массы и содержания липидов; взвешивание всех испытуемых сосудов для контроля влажности почвы; контроль подачи воздуха, если используются закрытые тест-системы. |
1 | Контроль подачи воздуха, регистрация поведения червей и температуры; отбор проб почвы и червей для определения концентрации испытуемого вещества. |
2 | Те же, что в 1 день. |
3 | Контроль подачи воздуха, поведения червей и температуры. |
4 | То же, что в 1 сут. |
5-6 | То же, что в 3 сут. |
7 | То же, что в 1 сут; добавление корма; контроль влажности почвы повторным взвешиванием испытуемых сосудов и компенсация испарившейся воды. |
8-9 | То же, что в 3 сут. |
10 | То же, что в 1 сут. |
11-13 | То же, что в 3 сут. |
14 | То же, что в 1 сут; добавление корма; контроль влажности почвы повторным взвешиванием испытуемых сосудов и компенсация испарившейся воды. |
15-16 | То же, что в 3 сут. |
17 | То же, что в 1 сут. |
18-20 | То же, что в 3 сут. |
21 | То же, что в 1 сут; измерения температуры и рН почвы; контроль влажности почвы повторным взвешиванием испытуемых сосудов; окончание фазы поглощения; перенос червей из оставшихся повторностей воздействия в сосуды, содержащие чистую почву, для фазы элиминации (без очистки кишечника); отбор проб почвы и червей из контроля на растворитель. Действия перед испытанием (уравновешивание фазы) должны быть запланированы с учетом свойств испытуемого вещества. Действия, описанные для 3 сут, проводятся ежедневно (по крайней мере, по рабочим дням). |
б) фаза элиминации
День | Действия |
-6 | Подготовка и увлажнение компонентов почвы; кондиционирование подготовленной почвы в течение 48 ч. |
-4 | Смешивание компонентов почвы; распределение почвы в испытуемых сосудах; инкубация при условиях испытания в течение 4 сут. |
0 (конец фазы поглощения) | Измерение температуры и рН почвы; взвешивание и произвольное распределение червей в испытуемые камеры; добавление корма; перенос червей из оставшихся повторностей воздействия в камеры, содержащие чистую почву; отбор проб почвы и червей после 4-6 ч для определения концентрации испытуемого вещества. |
1 | Контроль подачи воздуха, регистрация поведения червей и температуры; отбор проб почвы и червей для определения концентрации испытуемого вещества. |
2 | То же, что в 1 сут. |
3 | Контроль подачи воздуха, поведения червей и температуры. |
4 | То же, что в 1 сут. |
5-6 | То же, что в 3 сут. |
7 | То же, что в 1 сут; добавление корма, контроль влажности почвы повторным взвешиванием испытуемых камер и компенсация испарившейся воды. |
8-9 | То же, что в 3 сут. |
10 | То же, что в 1 сут. |
11-13 | То же, что в 3 сут. |
14 | То же, что в 1 сут; добавление корма, контроль влажности почвы повторным взвешиванием испытуемых камер и компенсация испарившейся воды. |
15-16 | То же, что в 3 сут. |
17 | То же, что в 1 сут. |
18-20 | То же, что в 3 сут. |
21 | То же, что в 1 сут; измерение температуры и рН почвы; контроль влажности почвы повторным взвешиванием испытуемых камер; отбор проб почвы и червей из контроля на растворитель. Подготовку почвы перед началом фазы элиминации следует проводить таким же образом, как и перед фазой поглощения. Действия, описанные для 3 сут, следует проводить ежедневно (по крайней мере, по рабочим дням). |
Испытание на энхитреидах
а) фаза поглощения с 8-дневным отбором проб, используемых для расчета кинетики
День | Действия |
-6 | Кондиционирование подготовленной почвы в течение 48 ч. |
-4 | Внесение в почву раствора испытуемого вещества; выпаривание любого растворителя; смешивание компонентов почвы; распределение почвы в испытуемые камеры; уравновешивание в испытуемых условиях в течение 4 сут (3 недели для почвы, в которую были внесены металлы). |
От -3 до -1 | Выделение тестовых организмов из культуры для акклиматизации. Подготовка и увлажнение из компонентов почвы. |
0 | Измерение температуры и рН почвы, отбор проб почвы из обработанных камер и контролей на растворитель для определения концентрации испытуемого вещества; добавление корма; взвешивание и произвольное распределение червей в испытуемые камеры; включение в испытание достаточной подпробы червей для аналитического определения фонового значения, сырой и сухой массы и содержания липидов; взвешивание всех испытуемых камер для контроля влажности почвы; контроль подачи воздуха, если используются закрытые тест-системы. |
1 | Контроль подачи воздуха, регистрация поведения червей и температуры; отбор проб почвы и червей для определения концентрации испытуемого вещества. |
2 | Те же, что в 1 сут. |
3 | Контроль подачи воздуха, поведения червей и температуры. |
4 | То же, что в 1 сут. |
5-6 | То же, что в 3 сут. |
7 | То же, что в 1 сут; добавление корма, контроль влажности почвы повторным взвешиванием испытуемых камер и компенсация испарившейся воды. |
9 | То же, что в 1 сут. |
10 | То же, что в 3 сут. |
11 | То же, что в 1 сут. |
12-13 | То же, что в 3 сут. |
14 | То же, что в 1 сут; добавление корма в почву; измерения температуры и рН почвы; контроль влажности почвы повторным взвешиванием испытуемых камер; конец фазы поглощения; перенос червей из оставшихся повторностей воздействия в камеры, содержащие чистую почву, для фазы элиминации (без очистки кишечника); отбор проб почвы и червей из контроля на растворитель. Действия перед испытанием (уравновешивание фазы) должны быть запланированы с учетом свойств испытуемого вещества. Действия, описанные для 3 сут, следует проводить ежедневно (по крайней мере, по рабочим дням). |
Приложение В
(рекомендуемое)
Подготовка и хранение искусственной почвы
Поскольку природные почвы из определенного источника могут быть недоступны в течение всего года, а местные организмы и наличие микрозагрязнителей могут повлиять на результаты испытания, то для использования в этом испытании рекомендуется искусственный субстрат, искусственная почва в соответствии с Руководством по испытаниям ОЭСР 207 [36]. Некоторые тестовые виды могут выживать, расти и размножаться в этой почве, кроме того, при использовании такой почвы обеспечивается максимальная стандартизация, а также внутри- и межлабораторная сопоставимость испытаний и условий культивирования.
Компоненты почвы
Торф: | 10% | Сфагновый (верховой) торф (сфагнум торф) в соответствии с Руководством ОЭСР 207 [36]. |
Кварцевый песок: | 70% | Промышленный кварцевый песок (воздушная сушка); размер частиц: более 50% частиц должны иметь размер в диапазоне 50-200 мкм, но все частицы должны быть |
Каолинит глины: | 20% | Содержание каолинита |
Карбонат кальция: |
| СаCO |
Как вариант, содержание органического углерода в искусственной почве может быть уменьшено, например, за счет снижения содержания торфа до 4%-5% сухой почвы и соответственно повышения содержания песка. Такое снижение содержания органического углерода может уменьшить возможности адсорбции испытуемого вещества почвой (органический углерод), и может возрасти наличие испытуемого вещества в червях [58]. Было показано, что Enchytraeus albidus и Eisenia fetida могут соответствовать критериям достоверности по воспроизводству при испытаниях в полевых почвах с более низким содержанием органического углерода, например 2,7% [59], [60], и имеется опыт, исходя из которого это также может быть достигнуто в искусственной почве с 5% торфа.
Подготовка
Сухие компоненты почвы тщательно перемешивают (например, в полупромышленном лабораторном смесителе). Это осуществляют примерно за неделю до начала испытания. Смешанные сухие компоненты почвы увлажняют деионизированной водой не менее чем за 48 ч перед внесением испытуемого вещества с целью уравновешивания/стабилизации кислотности. Для определения рН используется смесь почвы и 1 М раствора KCl в соотношении 1:5. Если значение рН не находится в требуемом диапазоне (6,0±0,5), то добавляется достаточное количество CaCO в почву или готовится новая партия почвы.
Максимальная водоудерживающая способность (WHC) искусственной почвы определяется по ISO 11268-2 [61]. По меньшей мере, за 2 сут до начала испытания сухая искусственная почва увлажняется добавлением достаточного количества деионизованной или рекомбинированной воды для получения примерно половины конечного содержания воды. Конечное содержание воды должно находиться в пределах от 40% до 60% максимальной WHC. В начале испытания предварительно увлажненная почва разделяется на количество пакетов, соответствующее количеству испытуемых концентраций и контролей, используемых для испытания, и содержание влаги доводится до 40%-60% WHC раствором испытуемого вещества и/или добавлением деионизированной или рекомбинированной воды. Содержание влаги определяется в начале и в конце испытания (при температуре 105°C). Оно должно быть оптимальным и соответствовать потребностям данного вида организмов (содержание влаги можно также проверить следующим образом: почву нужно мягко сжать в руке, и между пальцами должны появиться маленькие капли воды).
Хранение
Сухие компоненты искусственной почвы можно хранить при комнатной температуре до использования. Подготовленная, предварительно увлажненная почва может храниться в прохладном месте в течение максимум трех суток перед внесением испытуемого вещества; следует соблюдать осторожность для минимизации испарения воды. Почву с внесенным испытуемым веществом используют сразу, если отсутствует информация, указывающая на то, что конкретная почва может храниться, не влияя на токсичность и биодоступность испытуемого вещества. Затем пробы внесенной почвы до анализа хранят в условиях, рекомендованных для конкретного испытуемого вещества.
Приложение Г
(рекомендуемое)
Виды земляных малощетинковых червей, рекомендованные для использования в испытаниях по биоаккумуляции в почве
Земляные черви
Рекомендуемым тестовым видом является Eisenia fetida (Savigny 1826), относящийся к семейству Lumbricidae. С 1972 он подразделяется на два подвида (Eisenia fetida и Eisenia andrei [62]). Согласно Jaenike [63] они являются истинными типичными, отдельными видами. Eisenia fetida легко распознается по его ярким межсегментным желтым полоскам, тогда как Eisenia andrei имеет равномерный, темно-красный цвет. Происходя, вероятно, из региона Черного моря, на сегодняшний день они распространены по всему миру, особенно в антропогенно измененных местах обитания, таких как компостные кучи. Оба вида используются в экотоксикологических испытаниях, а также в исследованиях по биоаккумуляции.
Eisenia fetida и Eisenia andrei являются промышленно доступными, например, как наживка для рыб. По сравнению с другими земляными червями они имеют короткий жизненный цикл, достигая зрелости в течение примерно 2-3 мес (при комнатной температуре). Оптимальная температура для них составляет примерно 20°C-24°C. Они предпочитают сравнительно влажные субстраты с почти нейтральным рН и высоким содержанием органического материала. Так как эти виды широко использовались в стандартных экотоксикологических испытаниях на протяжении примерно 25 лет, то их культивирование хорошо известно [36], [64].
Оба вида могут быть культивированы в широком диапазоне отходов животноводства. Рекомендованной ИСО [61] средой для разведения является смесь 50:50 навоза от лошадей или крупного рогатого скота и торфа. Среда должна иметь значение рН примерно от 6 до 7 (регулируется карбонатом кальция), низкую ионную проводимость (менее 6 мСм/см или менее 0,5% концентрации соли) и не должна быть чрезмерно загрязненной аммиаком или мочой животных. Также может быть использована промышленная садовая почва без добавок или искусственная почва в соответствии с OECD [36], или их смесь в соотношении 50:50. Субстрат должен быть влажным, но не очень мокрым. Для разведения подходят коробки вместимостью от 10 до 50 л.
Для получения червей стандартного возраста и массы лучше всего начинать культуру с коконов. Для этого взрослых червей вносят в коробки, предназначенные для разведения, содержащие свежий субстрат для получения коконов. Практический опыт показывает, что плотность популяции около 100 взрослых червей на кг субстрата (сырой массы) обеспечивает подходящую скорость размножения. Через 28 сут взрослых червей удаляют. Земляные черви, вылупившиеся из коконов, используются для испытания, когда достигают половой зрелости, не менее чем через 2 мес, но менее чем через 12 мес.
Черви видов, описанных выше, можно считать здоровыми, если они активно двигаются в субстрате, не пытаются покинуть субстрат и непрерывно размножаются. Очень медленное движение или желтый задний конец (в случае Eisenia fetida) указывают на истощение субстрата. В этом случае рекомендуется освежить субстрат и/или снизить количество червей в коробке.
Энхитреиды
Рекомендуемым тестовым видом является Enchytraeus albidus Henle 1837 (белые энхитреиды). Enchytraeus albidus является одним из самых крупных (до 15 мм) видов кольчатых малощетинковых червей семейства Enchytraeidae и распространенным во всем мире [65]. Enchytraeus albidus обитают в морской, озерной и наземной среде, в основном в разлагающихся органических веществах (водоросли, компост) и редко в лугах [66]. Эта широкая экологическая толерантность и некоторые морфологические изменения показывают, что могут существовать различные изоляты этого вида.
Enchytraeus albidus является промышленно доступным, продается в качестве корма для рыб. Следует проверить загрязненность культуры другими, как правило, более мелкими видами [67]. Если происходит загрязнение, то всех червей следует промыть водой в чашке Петри. Затем отбирают крупные взрослые особи из Enchytraeus albidus (при помощи стереомикроскопа), чтобы заложить новую культуру. Всех остальных червей отбрасывают. Их жизненный цикл является коротким, так как половозрелое состояние достигается между 33 сут (при 18°C) и 74 сут (при 12°C). Для испытания используют только культуру, которая сохраняется в лаборатории в течение не менее 5 недель (одно поколение) без каких-либо проблем.
Другие виды рода Enchytraeus также подходят, особенно Enchytraeus luxuriosus. Этот вид является типичным обитателем почвы, который был недавно описан в [68]. Если используются другие виды Enchytraeus, то они должны быть четко определены и следует представить обоснование выбора вида.
Enchytraeus crypticus (Westheide & Graefe 1992) является видом, принадлежащим к одной группе с Enchytraeus luxuriosus. Не было с уверенностью установлено его наличие в полевых условиях, его выделяли из культур земляных червей и компостных куч (![]() , 2003). Следовательно, его определенные экологические потребности не известны. Однако недавние лабораторные исследования в различных полевых почвах подтвердили, что этот вид имеет высокую толерантность по отношению к различающимся показателям почвы, таким как рН и структура (
, 2003). Следовательно, его определенные экологические потребности не известны. Однако недавние лабораторные исследования в различных полевых почвах подтвердили, что этот вид имеет высокую толерантность по отношению к различающимся показателям почвы, таким как рН и структура (![]() и др. 2005). В последние годы этот вид часто используется в экотоксикологических исследованиях в результате простоты его размножения и испытания (например, Kuperman и др. 2003). Однако черви этого вида небольшие (3-12 мм, 7 мм в среднем (Westheide &
и др. 2005). В последние годы этот вид часто используется в экотоксикологических исследованиях в результате простоты его размножения и испытания (например, Kuperman и др. 2003). Однако черви этого вида небольшие (3-12 мм, 7 мм в среднем (Westheide & 1996)), и это делает обработку сложнее по сравнению с Enchytraeus albidus. При использовании этого вида вместо Enchytraeus albidus размер испытуемой камеры может, но не обязательно, быть меньше. Кроме того, следует учитывать, что этот вид воспроизводится очень быстро со временем размножения менее 20 сут при (20±2)°C (Achazi и др. 1999) и даже быстрее при более высоких температурах.
Энхитреиды вида Enchytraeus albidus (а также другие виды Enchytraeus) можно культивировать в больших пластиковых коробках (например, 30х60х10 см или 20х12х8 см, подходящих для культивирования червей малого размера), заполненных смесью искусственной почвы и промышленной садовой почвы без добавок. Компостных грунтов следует избегать, поскольку они могут содержать токсичные вещества, такие как тяжелые металлы. Перед использованием фауна должна быть удалена из почвы, предназначенной для разведения, трехразовой глубокой заморозкой. Чистая искусственная почва также может быть использована, но скорость воспроизводства может быть ниже по сравнению с получением смешанных субстратов. Субстрат должен иметь рН 6,0±0,5. Культуру выдерживают в термостате при температуре (15±2)°С без света. В любом случае следует избегать температуры более 23°C. Искусственная/природная почва должна быть влажной, но не слишком мокрой. При легком сжатии почвы рукой должны появиться только небольшие капли воды. В любом случае, следует избегать бескислородных условий (например, если используется крышка, то должно быть достаточно много отверстий, чтобы крышка обеспечивала достаточный обмен воздуха). Почва для разведения должна аэрироваться путем тщательного ее перемешивания один раз в неделю.
Червей кормят вволю не реже одного раза в неделю овсяными хлопьями, которые помещаются в углубление на поверхности почвы и засыпаются почвой. Если корм с последнего кормления остается в контейнере, то количество скармливаемого корма должно быть соответствующим образом скорректировано. Если на оставшемся корме растут грибы, его заменяют новой порцией овсяных хлопьев. Для обеспечения размножения в овсяные хлопья можно добавлять промышленно доступные витаминные добавки протеинового порошка каждые две недели. Через три месяца червей переносят в свежеприготовленную культуру или субстрат для разведения. Овсяные хлопья, которые должны храниться в герметичных сосудах, необходимо обрабатывать в автоклаве или нагревать перед использованием, чтобы избежать заражения мучными клещами (например, Glyzyphagus sр., Astigmata, Acarina) или хищными клещами (например, Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina). После дезинфекции корм измельчают таким образом, чтобы его можно было легко рассыпать по поверхности почвы. Еще одним возможным источником питания являются хлебопекарные дрожжи или корм для рыб TetraMin®.
В общем, условия культивирования являются подходящими, если черви не пытаются покинуть субстрат, быстро двигаются в почве, имеют блестящий наружный покров без частиц почвы, прилипших к нему, более или менее беловатый цвет, и если в культуре находятся черви разного возраста. Фактически черви считаются здоровыми, если они постоянно размножаются.
Приложение ДА
(справочное)
Сравнение структуры международного документа со структурой настоящего стандарта
Таблица ДА.1
Структура настоящего стандарта | Структура международного документа | |||
Раздел | Подраздел | Перечисления | Раздел | Перечисления |
Введение | 1, 2, 3 | - | ||
1 | 1.1 | - | - | - |
1.2 | - | 4 | - | |
2 | 2.1 | - | Приложение 1 | - |
2.2 | - | Приложение 1 | - | |
2.3 | - | Приложение 1 | - | |
2.4 | - | Приложение 1 | - | |
2.5 | - | Приложение 1 | - | |
2.6 | - | Приложение 1 | - | |
2.7 | - | Приложение 1 | - | |
2.8 | - | Приложение 1 | - | |
2.9 | - | Приложение 1 | - | |
2.10 | - | Приложение 1 | - | |
2.11 | - | Приложение 1 | - | |
2.12 | - | Приложение 1 | - | |
2.13 | - | Приложение 1 | - | |
2.14 | - | Приложение 1 | - | |
2.15 | - | Приложение 1 | - | |
3 | 3.1 | - | 5 | - |
3.2 | - | 6 | - | |
3.3 | - | 7 | - | |
3.4 | - | 8 | - | |
3.5 | - | 9 | - | |
3.6 | - | 10 | - | |
4 | 4.1 | - | 11 | - |
4.2 | - | 12 | - | |
4.3 | - | 13 | - | |
4.4 | - | 14 | - | |
4.5 | - | 15 | - | |
4.6 | - | 16 | - | |
5 | - | - | 17 | - |
6 | 6.1 | - | 18 | - |
6.2 | - | 19 | - | |
6.3 | - | - | - | |
6.3.1 | - | 20 | - | |
6.3.2 | - | 21 | - | |
6.3.3 | - | 22 | - | |
6.4 | - | - | - | |
6.4.1 | - | 23 | - | |
6.4.2 | - | 24 | - | |
6.4.3 | - | 25 | - | |
6.4.4 | - | 26 | - | |
6.5 | - | - | - | |
6.5.1 | - | 27 | - | |
6.5.2 | - | 28 | - | |
7 | - | - | 29, 30 | - |
7.1 | - | - | - | |
7.1.1 | - | 31 | - | |
7.1.2 | - | 32 | - | |
7.1.3 | - | 33 | - | |
7.1.4 | - | 34 | - | |
7.1.5 | - | 35 | - | |
7.2 | - | 36 | - | |
7.3 | - | 37 | - | |
7.4 | - | 38 | - | |
7.5 | - | - | - | |
7.5.1 | - | 39 | - | |
7.5.2 | - | 40 | - | |
7.6 | - | 41 | - | |
7.7 | - | - | - | |
7.7.1 | - | 42 | - | |
7.7.2 | - | 43 | - | |
7.7.3 | - | 44 | - | |
7.7.4 | - | 45 | - | |
7.7.5 | - | 46 | - | |
7.7.6 | - | 47 | - | |
7.7.7 | - | 48 | - | |
7.7.8 | - | 49 | - | |
7.7.9 | - | 50 | - | |
7.7.10 | - | 51 | - | |
7.7.11 | - | 52 | - | |
7.7.12 | - | 53 | - | |
8 | 8.1 | - | - | - |
8.1.1 | - | 54 | - | |
8.1.2 | - | 55 | - | |
8.2 | - | 56 | - | |
Приложение А | Приложение 2 | |||
Приложение Б | Приложение 3 | |||
Приложение В | Приложение 4 | |||
Приложение Г | Приложение 5 | |||
Библиография
[1] | Connell, D.W. & Markwell, R.D. (1990), Bioaccumulation in the Soil to Earthworm System, Chemosphere 20, 91-100 |
[2] | Jager, T. (1998), Mechanistic approach for estimating bioconcentration of organic chemicals in earthworms (Oligochaeta), Environ. Toxicol. Chem. 17, 2080-2090 |
[3] | EC (2006), Technical Guidance Document in support of EC Regulation No. 1907/2006 concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH, OJ L 396, 30.12.2006) |
[4] | Phillips, D.J.H. (1993), Bioaccumulation, In: Handbook of Ecotoxicology Vol. 1. Calow, P. (ed.). Blackwell Scientiic Publ., Oxford. 378-396 |
[5] | Beek, B., S.Boehling, U.Bruckmann, C.Franke, U.Joehncke & G.Studinger (2000), The assessment of bioaccumulation, In Hutzinger, O. (editor), The Handbook of Environmental Chemistry, Vol. 2 Part J (Vol. editor: B. Beek): Bioaccumulation - New Aspects and Developments, Springer-Verlag Berlin Heidelberg: 235-276 |
[6] | ASTM (2000), Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, American Society for Testing and Materials, E 1688-00a |
[7] | US EPA (2000), Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates, Second Edition, EPA 600/R-99/064, US, Environmental Protection Agency, Duluth, MN, March 2000 |
[8] | EPPO (2003), Environmental Risk Assessment scheme for plant protection products, Soil organisms and functions, EPPO (European Plant Protection Organization) Standards, Bull, OEPP/EPPO 33: 195-208 |
[9] |
|
[10] | Didden, W.A.M. (1993), Ecology of Terrestrial Enchytraeidae, Pedobiologia 37, 2-29 |
[11] | Edwards, C.A. & Bohlen, P.J. (1996), Biology and ecology of earthworms, Third Edition, Chapman & Hall, London, 426 pp |
[12] | Petersen, H. & Luxton, M. (1982), A comparative analysis of soil fauna populations and their role in decomposition processes, Oikos 39, 287-388 |
[13] | Schlosser H-J. & Riepert F. (1992), Entwicklung eines |
[14] | Dietrich, D.R., Schmid, P., Zweifel, U., Schlatter, C., Jenni-Eiermann, S., Bachmann, H., |
[15] | Romijn, C.A.F.M., Luttik, R., Van De Meent, D., Slooff, W. & Canton, J.H. (1993), Presentation of a General Algorithm to Include Effect Assessment on Secondary Poisoning in the Derivation of Environmental Quality Criteria, Part 2: Terrestrial food chains, Ecotox. Envir. Safety 27, 107-127 |
[16] | ASTM International (2004), Standard guide for conducting laboratory soil toxicity or bioaccumulation tests with the Lumbricid earthworm Eisenia fetida and the Enchytraeid potworm Enchytraeus albidus, ASTM International, E1676-04: 26 pp |
[17] | OECD (1996), Bioconcentration: flow-through fish test, Test Guideline No. 305, Guidelines for the testing of chemicals, OECD, Paris |
[18] | OECD (2008), Bioaccumulation in Sediment-dwelling Benthic Oligochates, Test Guideline No. 315, Guidelines for the testing of chemicals, OECD, Paris |
[19] | Amorim, M. (2000), Chronic and toxicokinetic behavior of Lindane ( |
[20] | Belfroid, A., Sikkenk, M., Seinen, W., Van Gestel, C. & Hermens (1994), The toxicokinetic behavior of chlorobenzenes in earthworms (Eisenia andrei): Experiments in soil, Environ. Toxicol. Chem. 13, 93-99 |
[21] | Bruns, E., Egeler, Ph., Moser, T., Rombke, J., Scheffczyk, A. & Sporlein, P. (2001a), Standardisierung und Validierung eines Bioakkumulationstests mit terrestrischen Oligochaeten, Report to the German Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 298 64 416 |
[22] | Bruns, E., Egeler, Ph., Rombke, J. Scheffczyk, A. & Sporlein, P. (2001b), Bioaccumulation of lindane and hexachlorobenzene by the oligochaetes Enchytraeus luxuriosus and Enchytraeus albidus (Enchytraeidae, Oligochaeta, Annelida), Hydrobiologia 463, 185-196 |
[23] |
|
[24] | Jager, T., Fleuren R.L.J., Hoogendoorn, E. & de Korte, G. (2003b), Elucidating the routes of exposure for organic chemicals in the earthworm, Eisenia andrei (Oligochaeta), Environ. Sci. Technol. 37, 3399-3404 |
[25] | Khalil, A.M. (1990), Aufnahme und Metabolismus von |
[26] | Marinussen, M.P.J.C., Van der Zee, S.E.A.T.M. & De Haan, F.A. (1997), Cu accumulation in Lumbricus rubellus under laboratory conditions compared with accumulation under field conditions, Ecotox. Environ. Safety 36, 17-26 |
[27] | Posthuma, L., Weltje, L. & Anton-sanchez, F.A. (1996), Joint toxic effects of cadmium and pyrene on reproduction and growth of the earthworm Eisenia fetida, RIVM Report No. 607506001, Bilthoven |
[28] |
|
[29] | Van Straalen, N.M., M.H. Donker, M.G. Vijver & C.A.M. van Gestel. (2005), Bioavailability of contaminants estimated from uptake rates into soil invertebrates, Environmental Pollution, 136, 409-417 |
[30] | Vijver, M.G., J.P.M. Vink, T. Jager, H.T. Wolterbeek, N.M. van Straalen, C.A.M. van Gestel (2005), Biphasic elimination and uptake kinetics of Zn and Cd in the earthworm Lumbricus rubellus exposed to contaminated floodplain soil. Soil Biol, Biochem. 37: 1843-1851 |
[31] | Widianarko B. & Van Straalen NM. (1996), Toxicokinetics-based survival analysis in bioassays using nonpersistent chemicals, Environ. Toxicol. Chem. 15, 402-406 |
[32] | Sample, B.E., Suter, D.W., Beauchamp, J.J. & Efroymson, R.A. (1999), Literature-derived bioaccumulation models for earthworms: Development and validation, Environ. Toxicol. Chem. 18, 2110-2120 |
[33] | OECD (2004a), Enchytraeid reproduction test, Test Guideline No. 220, Guidelines for the testing of chemicals, OECD, Paris |
[34] | OECD (2004b), Earthworm reproduction test (Eisenia fetida/Eisenia Andrei), Test Guideline No. 222, Guidelines for the testing of chemicals, OECD, Paris |
[35] | Elmegaard, N. & Jagers op Akkerhuis, G.A.J.M. (2000), Safety factors in pesticide risk assessment, Differences in species sensitivity and acute-chronic relations, National Environmental Research Institute, NERI Technical Report 325: 57 pp |
[36] | OECD (1984), Earthworm, acute toxicity test, Test Guideline No. 207, Guidelines for the testing of chemicals, OECD, Paris |
[37] | Franke, C., Studinger, G., Berger, G., |
[38] | Sousa JP, Loureiro S, Pieper S, Frost M, Kratz W, Nogueira AJA, Soares AMVM (2000) Soil and plant diet exposure routes and toxicokinetics of lindane in a terrestrial isopod, Environ. Toxicol. Chem. 19, 2557-2563 |
[39] | Nendza, M. (1991), QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations, In: R. Nagel and R. Loskill (eds.): Bioaccumulation in aquatic systems, Contributions to the assessment, Proceedings of an international workshop, Berlin 1990, VCH, Weinheim |
[40] | Gabric, A.J., Connell, D.W. & Bell, P.R.F. (1990), A kinetic model for bioconcentration of lipophilic compounds by oligochaetes, Wat. Res. 24, 1225-1231 |
[41] | Landrum, P.F. (1989), Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi, Environ. Sci. Toxicol. 23, 588-595 |
[42] | Belfroid, A., Van Wezel, A., Sikkenk, M., Van Gestel, C., Seinen, W. & Hermens, J. (1993), The toxicokinetic behavior of chlorobenzenes in earthworms (Eisenia andrei): Experiments in water, Ecotox. Environ. Safety 25, 154-165 |
[43] | Belfroid, A., Meiling, J., Drenth, H., Hermens, J., Seinen, W., Van Gestel, C. (1995), Dietary uptake of superlipophilic compounds by earthworms (Eisenia andrei), Ecotox. Environ. Safety 31, 185-191 |
[44] | OECD (2000), Soil Microorganisms: Nitrogen Transformation Test, Test Guideline No. 216, Guidelines for the testing of chemicals, OECD, Paris |
[45] | Environment Canada (1995), Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant, Environmental Protection Series Report EPS 1/RM/30 |
[46] | Egeler, Ph., Gilberg, D., Scheffczyk, A., Moser, Th. & |
[47] | Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999), Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegates, Environ. Toxicol. Chem. 18, 1244-1249 |
[48] | Gardner, W.S., Frez, W.A., Cichocki, E.A. & Parrish, C.C. (1985), Micromethods for lipids in aquatic invertebrates, Limnology and Oceanography 30, 1099-1105 |
[49] | Randall, R.C., Lee II, H., Ozretich, R.J., Lake, J.L. & Pruell, R.J. (1991), Evaluation of selected lipid methods for normalising pollutant bioaccumulation, Environ.Toxicol. Chem. 10, 1431-1436 |
[50] | Bligh, E.G. & Dyer, W.J. (1959), A rapid method of total lipid extraction and purification, Can. J. Biochem. Pysiol. 37, 911-917 |
[51] | De Boer, J., Smedes, F., Wells, D. & Allan, A. (1999), Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish, Round 1 SBT-2, Exercise 1000, EU, Standards, Measurement and Testing Programme |
[52] | Spacie, A., Hamelink, J.L. (1982), Alternative models for describing the bioconcentration of organics in fish, Environ. Toxicol. Chem. 1, 309-320 |
[53] | Jager, T., Sanchez, P.A., Muijs, B., van der Welde, E. & Posthuma, L. (2000), Toxicokinetics of polycyclic aromatic hydrocarbons in Eisenia andrei (Oligochaeta) using spiked soil, Environ. Toxicol. Chem. 19, 953-961 |
[54] | Jager, T., Baerselman, R., Dijkman, E., De Groot, A.C., Hogendoorn, E.A., DeJong, A., Kruitbosch, J.A.W. & Peijnenburg, W. J. G. M (2003a), Availability of polycyclic aromatic hydrocarbons to earthworms (Eisenia andrei, Oligochaeta) in field-polluted soils and soil-sediment mixtures, Environ. Toxicol. Chem. 22, 767-775 |
[55] | Janssen, M.P.M., A Bruins, T.H. De Vries & Van Straalen, N.M. (1991), Comparison of cadmium kinetics in four soil arthropod species, Arch. Environ. Contam. Toxicol. 20: 305-312 |
[56] | Van Brummelen, T.C. & Van Straalen, N.M. (1996), Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber, Arch. Environ. Contam. Toxicol. 31: 277-285 |
[57] | Sterenborg, I., Vork, N.A., Verkade, S.K., Van Gestel, C.A.M. & Van Straalen, N.M. (2003), Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta, Environ. Toxicol. Chemistry 22: 1167-1171 |
[58] | Van Gestel C.A.M. (1992), The influence of soil characteristics on the toxicity of chemicals for earthworms; a review, In: Ecotoxicology of Earthworms (Ed. Becker, H, Edwards, PJ, Greig-Smith, PW & Heimbach, F), Intercept Press, Andover (GB) |
[59] | Hund-Rinke, K. & H. Wiechering (2000), Earthworm avoidance test for soil assessments: An alternative for acute and reproduction tests, J. Soils Sediments 1, 15-20 |
[60] |
|
[61] | ISO (International Standard Organization) (1998), Soil Quality - Effects of pollutants on earthworms (Eisenia fetida), Part 2: Determination of effects on reproduction, No.11268-2. ISO, Geneve |
[62] | Bouche, M. (1972), Lombriciens de France. Ecologie et Systematique, INRA, Annales de Zoologie-Ecologie animale, Paris, 671 p |
[63] | Jaenike, J. (1982), "Eisenia foetida" is two biological species, Megadrilogica 4, 6-8 |
[64] | Venter, J.M., Reinecke, A.J. (1988), The life-cycle of the compost-worm Eisenia fetida (Oligochaeta), South African J. Zool. 23, 161-165 |
[65] | Bell, A.W. (1958), The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus, Ann. Mus. Novitat. 1902, 1-13 |
[66] | Kasprzak, K. (1982), Review of enchytraeid community structure and function in agricultural ecosystems, Pedobiologia 23, 217-232 |
[67] |
|
[68] | Schmelz, R. & Collado, R. (1999), Enchytraeus luxuriosus sp. nov., a new terrestrial oligochaete species (Enchytraeide, Clitellata, Annelida), Carolinea 57: 93-100 |
[69] | Conder, J.M. & Lanno, R.P. (2003), Lethal critical body residues as measures of Cd, Pb, and Zn bioavailability and toxicity in the earthworm Eisenia fetida, J. Soils Sediments 3: 13-20 |
[70] | Didden, W. (2003), Oligochaeta, In: Bioindicators and biomonitors. Markert, B.A., Breure, A.M. & Zechmeister, H.G. (eds.). Elsevier Science Ltd., The Netherlands, pp. 555-576 |
[71] | OECD (2007), Bioaccumulation in sediment-dwelling benthic oligochaetes, Draft Test Guideline, 21 December 2007, Internal working document, Environment Directorate, OECD, Paris |
[72] | Franke, C. (1996), How meaningful is the bioconcentration factor for risk assessment? Chemosphere 32, 1897-1905 |
[73] | Hawker, D.W. & Connell, D.W. (1988), Inluence of partition coeficient of lipophilic compounds on bioconcentration kinetics with fish, Wat. Res. 22, 701-707 |
[74] | Hund-Rinke, K, |
[75] | Pflugmacher, J. (1992), |
[76] | Sims, R.W. & Gerard, B.M. (1985), Earthworms, In: Kermack, D.M. & Barnes, R.S.K. (Hrsg.): Synopses of the British Fauna (New Series) No. 31. 171 S. London: E. J. Brill/Dr. W. Backhuys |
[77] | Stephenson, G.L., Kaushik, A., Kaushik, N.K., Solomon, K.R., Steele, T., Scroggins, R.P. (1998), Use of an avoidance-response test to assess the toxicity of contaminated soils to earthworms, In: Advances in earthworm ecotoxicology. S. Sheppard, J. Bembridge, M. Holmstrup, L. Posthuma (eds.). Setac Press, Pensacola, 67-81 |
[78] | UBA (Umweltbundesamt) (1991), Bioakkumulation - Bewertungskonzept und Strategien im Gesetzesvollzug, UBA-Texte 42/91, Berlin |
[79] | Van Gestel, C.A., Ma, W.-C. (1990), An approach to quantitative structure-activity relationships (QSARs) in earthworm toxicity studies, Chemosphere 21, 1023-1033 |
[80] | Gerard, B.M. (1964), Synopsis of the British fauna, No. 6 Lumbricidae. Linnean Soc. London, 6, 1-58 |
[81] | Graff, O. (1953), Die Regenwr |
[82] |
|
[83] | Rundgren, S. (1977), Seasonality of emergence in lumbricids in southern Sweden. Oikos, 28, 49-55. |
[84] | Satchell, J.E. (1955), Some aspects of earthworm ecology. Soil Zoology (Kevan): 180-201 |
[85] | Sims, R.W., Gerard, B.M. (1985), A synopsis of the earthworms, Linnean Soc. London, 31, 1-171 |
[86] | Tomlin, A.D. (1984), The earthworm bait market in North America. In: Earthworm Ecology - from Darwin to vermiculture. Satchell, J.E. (ed.), Chapman & Hall, London. 331-338 pp |
[87] | Achazi, R.K., Fr |
[88] |
|
[89] | Kuperman, R.G., Checkai, R.T., Simini, M., Phillips, C.T., Kolakowski, J.E., Kurnas, C.W. & Sunahara, G.I. (2003), Survival and reproduction of Enchytraeus crypticus (Oligochaeta, Enchytraeidae) in a natural sandy loam soil amended with the nitro-heterocyclic explosives RDX and HMX, Pedobiologia 47, 651-656 |
[90] |
|
[91] | Westheide, W. & Graefe, U. (1992), Two new terrestrial Enchytraeus species (Oligochaeta, Annelida), J. Nat. Hist. 26, 479-488 |
УДК 658.382.3:006.354 | МКС 13.020.01 | Т58 |
Ключевые слова: химическая продукция, окружающая среда, биоаккумуляция, земляные малощетинковые черви | ||
Электронный текст документа
и сверен по:
, 2016

