ГОСТ Р ИСО 11616-2014
Группа П85
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Информатизация здоровья
ИДЕНТИФИКАЦИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных препаратах
Health informatics. Identification of medicinal products. Data elements and structures for the unique identification and exchange of regulated pharmaceutical product information
ОКС 35.240.80
ОКСТУ 4002
Дата введения 2015-10-01
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным учреждением "Центральный научно-исследовательский институт организации и информатизации здравоохранения" Министерства здравоохранения Российской Федерации (ФГБУ "ЦНИИОИЗ" Минздрава) и обществом с ограниченной ответственностью "Корпоративные электронные системы" на основе собственного перевода на русский язык англоязычной версии международного документа, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 468 "Информатизация здоровья" при ЦНИИОИЗ Минздрава - постоянным представителем ISO ТС 215
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 17 ноября 2014 г. N 1622-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 11616:2012* "Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных препаратах" (ISO 11616:2012 "Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated pharmaceutical product information". IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
6 ПЕРЕИЗДАНИЕ. Январь 2019 г.
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
Настоящий стандарт разработан в связи с широкой мировой потребностью в международной гармонизации описаний лекарственных средств. Он является одним из пяти стандартов, образующих базис уникальной идентификации лекарственных средств. В эту группу стандартов входят:
ISO 11615, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated medicinal product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах);
ISO 11616, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated pharmaceutical product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных препаратах);
ISO 11238, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on substances (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях);
ISO 11239, Health informatics - Identification of medicinal products - Data elements and structures for the unique identifi cation and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых формах дозировки, единицах представления, способах введения и упаковке);
ISO 11240, Health informatics - Identification of medicinal products - Data elements and structures for the unique identifi cation and exchange of units of measurement (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о единицах измерения).
Настоящий стандарт разработан в целях определения элементов и структур данных, а также отношений между элементами данных, необходимых для уникальной и уверенной идентификации лекарственных препаратов и обмена информацией об этих препаратах. В нем описаны точные и согласованные средства полного представления связей идентификаторов лекарственных препаратов PhPID (Pharmaceutical Product Identifier) со следующими элементами:
- идентификатор лекарственного средства MPID (Medicinal Product Identifier);
- идентификатор исследуемого лекарственного средства IMPID (Investigational Medicinal Product Identifier).
Эти стандарты идентификации лекарственных средств (IDMP - Identification of Medicinal Products) предназначены для поддержки деятельности органов контроля обращения лекарственных средств во всем мире, включая контроль за разработкой и регистрацией лекарственных средств, управление их жизненным циклом, а также контроль рисков и фармаконадзор.
Для достижения основных целей контроля обращения лекарственных средств и фармаконадзора необходимо обеспечивать надежный, качественный и согласованный обмен информацией о лекарственных средствах. Поэтому стандарты IDMP регламентируют как минимум следующие обмены информацией:
- между органами контроля;
- от фармацевтической фирмы органу контроля;
- от спонсора клинического исследования органу контроля;
- от органа контроля другим участникам обращения лекарственных средств;
- от органа контроля международным источникам данных.
Уникальные идентификаторы, присвоенные в соответствии со стандартами IDMP, предназначены для использования в тех приложениях, которым необходима надежная идентификация и отслеживание применения лекарственных средств и препаратов.
Составными частями стандартов IDMP являются спецификации сообщений. Они служат для описания и обеспечения целостности указанных выше обменов информацией о регистрируемых лекарственных средствах в контексте уникальной идентификации лекарственных средств и подтверждений приема полученной информации (включая проверку ее правильности).
Для различных целей и разных условий предметной области разработки фармацевтических стандартов и стандартов контроля обращения лекарственных средств используется большое число терминов, описывающих базовые понятия. В настоящем стандарте приведены те термины и определения понятий, которые предназначены для уникальной идентификации регистрируемых лекарственных средств, описания их свойств и передачи соответствующей информации.
Термины и определения, принятые в настоящем стандарте, предназначены для облегчения интерпретации и применения юридических и нормативных требований, но они не должны превалировать над юридически обязывающими документами. В случае сомнения или потенциального конфликта должны применяться термины и определения, принятые в юридически обязывающих документах.
Настоящий стандарт разработан совместно с Общей моделью продукции (Common Product Model) организации HL7. Предполагается, что для специфицированного в нем обмена информацией между участниками обращения лекарственных средств будут использоваться сообщения стандарта HL7 V3.
1 Область применения
Настоящий стандарт предназначен для описания специфичных уровней информации, относящейся к идентификации лекарственного средства или группы лекарственных средств. В нем описаны элементы данных и их структурные отношения, необходимые для уникальной идентификации лекарственных препаратов, применяемой в течение всего их жизненного цикла для обеспечения фармаконадзора, а также регистрационной и другой деятельности в мировом масштабе. Кроме того, положения настоящего стандарта существенны для обеспечения структурированного формата передачи информации о лекарственных препаратах между различными участниками обращения лекарственных средств. Их применение обеспечит взаимную приемлемость и совместимость информации как на стороне ее отправителя, так и получателя.
Настоящий стандарт не должен рассматриваться как научная классификация лекарственных препаратов. Его содержание скорее является формальной ассоциацией конкретных элементов данных, используемых в предписанных сочетаниях и уникально идентифицируемых в условиях неполного структурирования информации. Это позволяет обеспечить недвусмысленную идентификацию лекарственных средств.
В разделе 2 приведены нормативные ссылки на другие стандарты группы IDMP и стандарты сообщений обмена информацией о лекарственных препаратах, применяемые в контексте настоящего стандарта.
Лекарственные средства для ветеринарного применения не входят в область применения настоящего стандарта.
2 Нормативные ссылки
Для применения настоящего стандарта необходимы следующие ссылочные стандарты*. Для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных - последнее издание ссылочного стандарта (включая все изменения к нему):
_______________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ISO 3166-1, Codes for the representation of names of countries and their subdivisions - Part 1: Country codes (Коды для представления названий стран и единиц их административно-территориального деления. Часть 1. Коды стран)
ISO 11615, Health informatics - Identification of Medicinal Products - Data elements and structures for the unique identification and exchange of regulated medicinal l product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах)
ISO 11238, Health informatics - Identification of medicinal products - Data elements and structures for the unique identifi cation and exchange of regulated information on substances (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях)
ISO 11239, Health informatics - Identification of medicinal products - Data elements and structures for the unique identifi cation and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых формах дозировки, единицах представления, способах введения и упаковке)
ISO 11240, Health informatics - Identification of Medicinal Products - Data elements and structures for the unique identifi cation and exchange of units of measurement (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о единицах измерения)
HL7 Version 3 Standard, Common Clinical Product Model (Общая модель продуктов для клинического применения)
HL7 Version 3 Standard, Common Product Model CMETS (Спецификации общих типов элементов сообщений в модели продуктов для клинического применения)
HL7 Version 3 Standard, Regulated Product Submission (Предоставление информации о регистрируемых продуктах)
HL7 Version 3 Standard, Structured Product Labeling (Структурированная информация о продуктах)
3 Термины, определения и сокращения
3.1 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1.1 применяемая дозированная форма (administrable dose form): Применяемая дозированная лекарственная форма, полученная в результате всех необходимых преобразований произведенной дозированной формы.
Примеры - Раствор для инъекций, таблетка для приема внутрь, твердая капсула с порошком для ингаляции.
3.1.2 нежелательная реакция на лекарство (adverse drug reaction): Нежелательная неблагоприятная реакция, связанная с использованием лекарства для медицинского применения.
Примечания
1 Возникновение нежелательной реакции может иметь место после регистрации (нежелательное явление, связанное с применением лекарства, используемого в рекомендованных дозах для профилактики, диагностики или лечения заболеваний, а также для изменения физиологических функций) или до регистрации (нежелательное явление, возникающее при любой дозе, для которого существует хотя бы минимальная возможность наличия причинно-следственной связи с применением лекарства).
2 В правиле FDA 21 CFR 310.305 Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США определение возникновения нежелательной реакции включает в себя любое нежелательное явление, "связанное или не связанное с применением лекарства"). Организация CDISC в настоящее время считает, что понятие нежелательной реакции включает в себя наличие причинно-следственной связи.
3 Настоящее определение адаптировано из Технического отчета ВОЗ 498 (1972); ICH E2A.
3.1.3 клиническое исследование (clinical trial): Научное исследование применения у человека, предназначенное для получения ответов на специфичные вопросы о безопасности и эффективности биомедицинского вмешательства (применения лекарства, лечения, изделия медицинского назначения) или новых способов применения лекарства, лечения, изделия медицинского назначения.
[Словарь терминов ICH E6 Glossary, директива Европейской комиссии 2001/20/ЕС:2002, версия: 1-2009/04/19]
3.1.4 регистрационный номер клинического исследования (clinical trial registration number): Регистрационный номер (идентификатор, предназначенный для контроля), присвоенный уполномоченным органом.
3.1.5 кодовое значение (code value): Результат применения системы кодирования к элементам кодируемого множества.
Примечание - Определение адаптировано из ИСО/МЭК 2382-4:1999.
3.1.6 система кодирования значения (coding scheme): Совокупность правил отображения элементов одного множества на элементы другого множества.
Примечания
1 Система кодирования, применяемая в настоящем стандарте, используется также в следующих стандартах:
- ISO 11615, Health informatics - Identification of medicinal products - Data elements and structures for the unique identifi cation and exchange of regulated medicinal product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах);
- ISO 11616, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated pharmaceutical product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных препаратах);
- ISO 11238, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on substances (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях);
- ISO 11239, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых формах дозировки, единицах представления, способах введения и упаковке);
- ISO 11240, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of units of measurement (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о единицах измерения).
2 Определение адаптировано из ИСО/МЭК 2382-4:1999.
3.1.7 нормативный словарь (controlled vocabulary): Конечное множество допустимых значений элемента данных.
Примечание - Допустимыми значениями могут быть коды, текст или числа.
[CDISC Clinical Research Glossary V8.0, 2009]
3.1.8 идентификатор термина в нормативном словаре (controlled vocabulary term identifier, TermID): Идентификатор понятия, предназначенный для применения в качестве предпочтительного уникального идентификатора данного понятия в данной системе кодирования и опубликованный автором системы кодирования.
Примечания
1 Идентификатор термина не меняется с течением времени, даже если конкретная версия ресурса знаний изменилась.
2 Определение адаптировано из документа HL7 Core Principles.
3.1.9 обозначение (designation): Символьное представление понятия.
Примечание - Определение адаптировано из ИСО 1087-1:2000.
3.1.10 дозированная форма (dose form): Дозированная лекарственная форма (pharmaceutical dose form): материальное проявление продукта, содержащего фармацевтические субстанции и/или вспомогательные вещества, которое должно быть применено к пациенту.
Примечание - Термин "дозированная лекарственная форма" может применяться как к применяемой дозированной лекарственной форме, так и к упакованной дозированной лекарственной форме.
3.1.11 глобально уникальный идентификатор (globally unique identifier): Идентификатор, отличающийся от любого другого такого же идентификатора в любом пространстве имен.
3.1.12 работник здравоохранения (healthcare professional): Лицо, которому доверено прямое или опосредованное оказание определенных услуг в сфере здравоохранения субъекту медицинской помощи или популяции субъектов.
Примеры - Дипломированный медицинский работник, провизор, медицинская сестра, социальный работник, рентгенолаборант, диспетчер или медрегистратор.
[ENV 1613:1995]
3.1.13 идентификатор (identifier): Описание, достаточное для выделения объекта в конкретных условиях.
[ENV 1610]
Примечание - В контексте настоящего стандарта идентификатор представляет собой список идентифицирующих характеристик, которые в совокупности однозначно идентифицируют лекарственное средство, лекарственный препарат, фармацевтическую субстанцию, контролируемую субстанцию, путь введения, дозированную лекарственную форму или любой другой элемент, который необходимо однозначно идентифицировать.
3.1.14 регистрационный код исследования (investigational code, sponsor code): Регистрационный номер, присвоенный уполномоченным органом заявлению спонсора на исследование нового лекарства до начала клинического исследования.
3.1.15 исследуемое лекарственное средство (Investigational Medicinal Product): Лекарственная форма активной субстанции или плацебо, изучаемые или используемые для сравнения в клиническом исследовании. К исследуемым лекарственным средствам относятся также зарегистрированные ранее лекарственные препараты, произведенные в других лекарственных формах, в новой дозировке или упаковке; лекарственные препараты, используемые для показаний, не включенных в регистрационное досье; зарегистрированные лекарственные препараты, исследуемые в целях получения дополнительной информации.
3.1.16 юрисдикция (jurisdiction): Географическая территория или правовая сфера, на которую распространяются полномочия органа государственной регистрации лекарственных средств.
3.1.17 произведенная дозированная форма (manufactured dose form): Лекарственная дозированная форма в упаковке производителя, еще не преобразованная в применяемую дозированную форму.
Пример - Порошок для инъекционного раствора.
Примечание - Во многих случаях произведенная дозированная форма не нуждается в преобразовании, и тогда она идентична применяемой дозированной форме.
3.1.18 медицинское изделие (medical device): Любой инструмент, аппарат, приспособление, программное обеспечение или иной предмет, используемый сам по себе или в сочетании с другим (включая программное обеспечение, предназначенное его производителем для использования в диагностических и/или терапевтических целях и необходимое для правильного применения прибора), который предназначен его производителем для медицинского применения в следующих целях:
- диагностика, профилактика, мониторинг, лечение или облегчение заболевания;
- диагностика, мониторинг, лечение, облегчение или компенсация травмы или инвалидности;
- исследование, замещение или модификация анатомического или физиологического процесса;
- контроля беременности, который достигает своего ожидаемого действия в теле или на теле человека не с помощью фармакологических, иммунологических или метаболических средств, но которому эти средства могут способствовать.
[Директива ЕС 2007/47 об изделиях медицинского назначения (ЕС Directive on Medical Devices 2007/47)]
Примечание - Это определение применяется только для целей настоящего стандарта и других стандартов данной серии (ИСО 11238, ИСО 11239, ИСО 11240, ИСО 11615).
3.1.19 лекарственное средство (medicinal product): Вещество или комбинации веществ, применяемые к организму человека для лечения и профилактики заболеваний с целью диагностики или восстановления, коррекции или изменения физиологических функций.
[ENV 13607, ENV 12610]
Примечания
1 Лекарственное средство может содержать один или несколько произведенных продуктов и один или несколько лекарственных препаратов.
2 В некоторых юрисдикциях лекарственное средство может быть также определено как любое вещество или комбинация веществ, используемых для постановки диагноза.
3.1.20 лекарственный препарат (pharmaceutical product): Качественная и количественная композиция лекарственного средства в дозированной форме, разрешенной к применению уполномоченным органом и указанной в соответствующих документах регистрационного досье.
Примечания
1 Лекарственное средство может содержать один или несколько препаратов.
2 Во многих случаях лекарственный препарат идентичен произведенному продукту. Однако есть примеры, когда произведенный продукт претерпевает преобразование до применения к пациенту (в качестве лекарственного препарата) и тогда он не тождественен лекарственному препарату.
3.1.21 упакованный лекарственный препарат (packaged pharmaceutical product): Качественная и количественная композиция лекарственного препарата, содержащаяся в упаковке лекарственного средства.
Примечание - Во многих случаях упакованный лекарственный препарат тождественен лекарственному средству. Однако в некоторых ситуациях упакованный лекарственный препарат (препараты) должен быть восстановлен до его применения к пациенту (например, порошок и растворитель для инъекционного раствора).
Пример - Каждый флакон фабразима содержит 35 мг агалсидазы бета в номинальном выражении (упакованный лекарственный препарат). После восстановления 7,2 мл воды для инъекций флакон фабразима содержит 5 мг/мл (35 мг/7 мл) агалсидазы бета (лекарственный препарат после восстановления).
3.1.22 идентификатор лекарственного препарата PhPID (Pharmaceutical Product Identifier): Глобально уникальный идентификатор лекарственного препарата.
3.1.23 фармаконадзор (pharmacovigilance): Мероприятия, связанные с научными исследованиями и мониторингом безопасности лекарственных средств и направленные на снижение возможных негативных последствий медицинского применения лекарственных средств и повышение их эффективности.
Примечания
1 Фармаконадзор является важной функцией обеспечения общественного здоровья.
Пример - Фармаконадзор включает в себя:
- сбор и обработку сведений по безопасности лекарственных средств;
- анализ данных в целях выявления "сигналов" (любых новых или изменившихся аспектов безопасности) и принятие решений по вопросам безопасности;
- деятельность по защите общественного здоровья (включая нормативную деятельность) и информационное взаимодействие с участниками обращения лекарственных средств;
- аудит результата предпринятых мероприятий и основных процессов, составляющих эти мероприятия.
2 В число участников фармаконадзора входят:
- пациенты как получатели лекарственных средств;
- врачи, аптечные работники, медицинские сестры и другие медицинские работники, имеющие дело с лекарственными средствами, а также уполномоченные органы, контролирующие безопасность лекарственных средств;
- производители лекарственных средств, а также предприятия, импортирующие или поставляющие лекарственные средства.
3.1.24 количественное значение (quantity value): Числовое значение с единицами измерения, совместно описывающие величину количества.
Примечания
1 Количественное значение является выражением величины количества. Это выражение состоит из числа и единиц измерения. Единицы измерения представляют эталонную количественную шкалу, с помощью которой измеренное (или полученное в результате оценки) значение сравнивается с одним или несколькими эталонными количественными значениями. Числовое значение является результатом сравнения измеренного количества с этой эталонной шкалой.
2 Термин "величина" (magnitude) не используется в руководстве ИСО/МЭК Guide 99. Однако настоящее определение указывает, что "величина" выражается как количественное значение, которое является выражением величины, и та же самая величина может быть выражена с помощью многих количественных значений.
3 Эталоном может служить единица измерения, измерительная процедура, эталонный материал или их сочетание.
3.1.25 радиофармацевтический комплект (radiopharmaceutical kit): Препарат, который должен быть восстановлен или соединен с радионуклидами для получения конечного радиофармацевтического препарата, обычно непосредственно перед его применением.
Примечание - В случае радиофармацевтического комплекта, который должен быть активирован радионуклидами после поставки его производителем, активной (нормированной) субстанцией считается та часть его состава, которая предназначена для переноса радионуклида или связывается с ним.
3.1.26 референтная активность (reference strength): Активность субстанции или нормированной субстанции (субстанций), используемая в качестве эталона, по отношению к которому определяется активность исследуемого или зарегистрированного лекарственного средства.
Примечание - Если активный ингредиент имеет форму соли или гидрата, то референтная активность может быть выражена в терминах активности базового вещества.
3.1.27 нормированная субстанция (specified substance): Фармацевтическая субстанция, характеризуемая группой элементов, которые описывают комплексное вещество или указывают дополнительную информацию о лекарственных средствах.
Примечания
1 Примерами дополнительных элементов описания могут служить качество, единицы измерения, физическая форма, компоненты, производитель, критичные этапы производственного процесса (к примеру, экстрация, процессы синтеза и рекомбинации), спецификация и аналитические методы, используемые для определения соответствия спецификации.
2 Для описания нормированной субстанции могут использоваться четыре различные группы элементов, между которыми существуют определенные отношения.
3.1.28 спонсор (sponsor): Физическое лицо, фирма, институт или организация, несущая ответственность за инициирования, организацию или финансирование клинического исследования.
3.1.29 активность, количественный состав (strength, quantitative composition): Содержание субстанции или нормированной субстанции, выраженное в форме количества в единице дозы, единице объема или массы в соответствии с дозированной формой.
Примечания
1 В описании количественного состава субстанции (субстанций) или нормированной субстанции конечного исследуемого или зарегистрированного лекарственного средства (в зависимости от его лекарственной формы) необходимо указать массу или количество единиц биологической активности в расчете на единицу дозы, массы или объема для каждой субстанции или нормированной субстанции.
2 Субстанция или нормированная субстанция, существующая в форме соединения или производного вещества, обязательно должна быть описана количественно с указанием общей массы и, если это необходимо или уместно, массы активного компонента или компонентов молекулы.
3.1.30 субстанция (substance): Любое вещество биологического, минерального или химического происхождения, способное к отдельному существованию и имеющее определенный состав.
Примечания
1 Субстанции могут быть простыми или смешанными.
2 Простые субстанции описываются с помощью минимально достаточного набора элементов данных и делятся на пять типов: химические, протеины, нуклеиновые кислоты, полимеры и структурно-разнородные субстанции. Субстанция может представлять собой соль, сольват, свободную кислоту, свободное основание, смесь связанных компонентов, которые совместно выделены или синтезированы.
3 По возможности должна использоваться терминология и определяющие характеристики из фармакопейных статей. Определяющие элементы зависят от типа субстанции.
4 Отдельное существование означает способность субстанции существовать отдельно от любой другой субстанции. Субстанции могут представлять собой хорошо определенные вещества, имеющие определенную химическую структуру, синтетические вещества (например, смеси изомеров), встречающиеся в природе смеси химических веществ, имеющих определенные молекулярные структуры (например, конъюгаты эстрогенов), вещества, произведенные из растений, животных, микроорганизмов или неорганических веществ, химическая структура которых может быть неизвестной или трудно определяемой.
3.1.31 единица измерения (unit of measurement): Вещественное скалярное значение физической величины, определенной и одобренной соглашением, с которой может сравниваться любая другая величина того же рода для вычисления отношения двух величин в форме числа.
Примечание - В зависимости от характера эталонной шкалы выражение единицы измерения может представлять либо физическую единицу измерения, связанную с системой величин (например, единицы СИ), либо произвольно определенную единицу измерения, которая может относиться к определенному стандартному образцу, стандартной процедуре измерения, мере материала или даже к их комбинациям.
3.1.32 единица представления (unit of presentation): Качественный термин, описывающий единицу представления и описания активности лекарственного препарата или произведенного продукта.
Примечания
1 Единицы представления используются особенно часто на месте оказания пациенту медицинской помощи, если количественная единица измерения не применима.
2 Единица представления может иметь то же название, что и в другом нормативном словаре данных, например лекарственная дозированная форма, но эти два понятия не эквивалентны и должны иметь в нормативном словаре разные уникальные идентификаторы терминов.
Пример - Таблетка, спрей или доза спрея "содержит 100 мкг в расчете на спрей" (единица представления=спрей).
3.1.33 уникальный идентификатор изделия (UDI, unique device identifier): Уникальный идентификатор, присвоенный изделию медицинского назначения в соответствии с требованиями Международного форума органов регистрации медицинских изделий (International Medical Devices Regulators' Forum).
3.1.34 адъювант (вакцины) ((vaccine) adjuvant): Компонент, усиливающий иммунный ответ к антигену и/или модулирующий его для получения желаемого иммунного ответа.
3.1.35 словарь (vocabulary): Терминологический словарь, содержащий термины и определения из одной или более конкретных областей знаний.
Примечание - Определение адаптировано из ИСО 1087-1:2000, определение 3.7.2.
3.2 Сокращения
3.2.1 КС - нормативный словарь (CV, controlled dictionary)
3.2.2 FDA - Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (United States Food and Drug Administration)
3.2.3 ЕР - Европейская фармакопея (European Pharmacopeia)
3.2.4 IMDRF - Международный форум органов регистрации медицинских изделий (International Medical Devices Regulators' Forum)
3.2.5 ICH - Международная конференция по гармонизации (International Conference on Harmonization)
3.2.6 ICSR - отчет по безопасности применения препарата отдельными пациентами (Individual Case Safety Report)
3.2.7 IMP - исследуемые лекарственные средства (Investigational Medicinal Products)
3.2.8 IMPID - идентификатор исследуемого лекарственного средства (Investigational Medicinal Product Identifier)
3.2.9 MPID - идентификатор лекарственного средства (Medicinal Product Identifier)
3.2.10 PhPID - идентификатор лекарственного препарата (Pharmaceutical Product Identifier)
3.2.11 UoM - единица измерения (Unit of Measurement)
3.2.12 USP - Фармакопея США (United States Pharmacopeia)
3.2.13 UDI - уникальный идентифицирующий код медицинского изделия (Unique Device Identification Code)
3.2.14 HL7 - организация Health Level Seven
3.2.15 TermID - идентификатор термина из нормативного словаря (Term Identifier)
4 Требования
4.1 Элементы, требуемые для уникальной идентификации лекарственных препаратов
В настоящем разделе описаны элементы, необходимые для уникальной идентификации и описания лекарственных препаратов. В нем также приведены требования к обеспечению идентификации лекарственного препарата.
Идентификация лекарственного препарата (PhPID) должна быть основана на следующем подмножестве элементов, описывающих лекарственное средство:
a) субстанция или нормированная субстанция (субстанции);
b) активность, единицы активности (единицы измерения или единицы представления);
c) референтные активности;
d) применяемая дозированная форма;
e) медицинское изделие (являющееся компонентом лекарственного средства).
Детальное описание этих элементов приведено в стандарте ИСО 11615. Кроме того, в этом стандарте описаны элементы информации о произведенных продуктах, которые должны быть восстановлены перед применением.
Идентификаторы лекарственных препаратов и элементы описания этих препаратов должны представлять лекарственные препараты в соответствии с информацией, содержащейся в регистрационном досье соответствующего зарегистрированного лекарственного средства. Использование лекарственных препаратов, не имеющее официального разрешения (off-label usage), не входит в область применения настоящего стандарта.
Настоящий стандарт и связанные с ним стандарты серии IDMP не должны подменять принципы поддержки более широких свидетельств эффективности по отношению к другим лекарственным средствам, которым присвоены идентичные идентификаторы PhPID, упомянутые в стандарте ИСО 11615.
Элементы данных, необходимые для генерации идентификаторов PhPID, опираются на контролируемые словари (КС), описанные в следующих стандартах:
ISO 11615, Health informatics - Identification of Medicinal Products - Data elements and structures for the unique identification and exchange of regulated medicinal product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах);
ISO 11238, Health informatics - Identification of Medicinal Products - Data elements and structures for the unique identification and exchange of regulated information on substances (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях);
ISO 11239, Health informatics - Identification of Medicinal Products - Data elements and structures for the unique identification and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых формах дозировки, единицах представления, способах введения и упаковке);
ISO 11240, Health informatics - Identifiation of Medicinal Products - Data elements and structures for the unique identification and exchange of units of measurement (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о единицах измерения).
4.2 Передача информации о лекарственном препарате
Для обеспечения успешного обмена информацией о регистрируемых лекарственных средствах между участниками, названными во введении, передаваемые сообщения должны иметь структуру и формат, позволяющие обеспечить полную совместимость и взаимную приемлемость реализаций этого обмена.
Учитывая важность стандартизованного обмена информацией, предназначенной для осуществления регуляторной активности и фармаконадзора, для передачи информации о лекарственных средствах следует использовать сообщения, определенные в стандарте HL7 версии 3.
5 Идентифицирующие характеристики лекарственных препаратов
5.1 Слои и уровни идентификации лекарственных препаратов
5.1.1 Общие положения
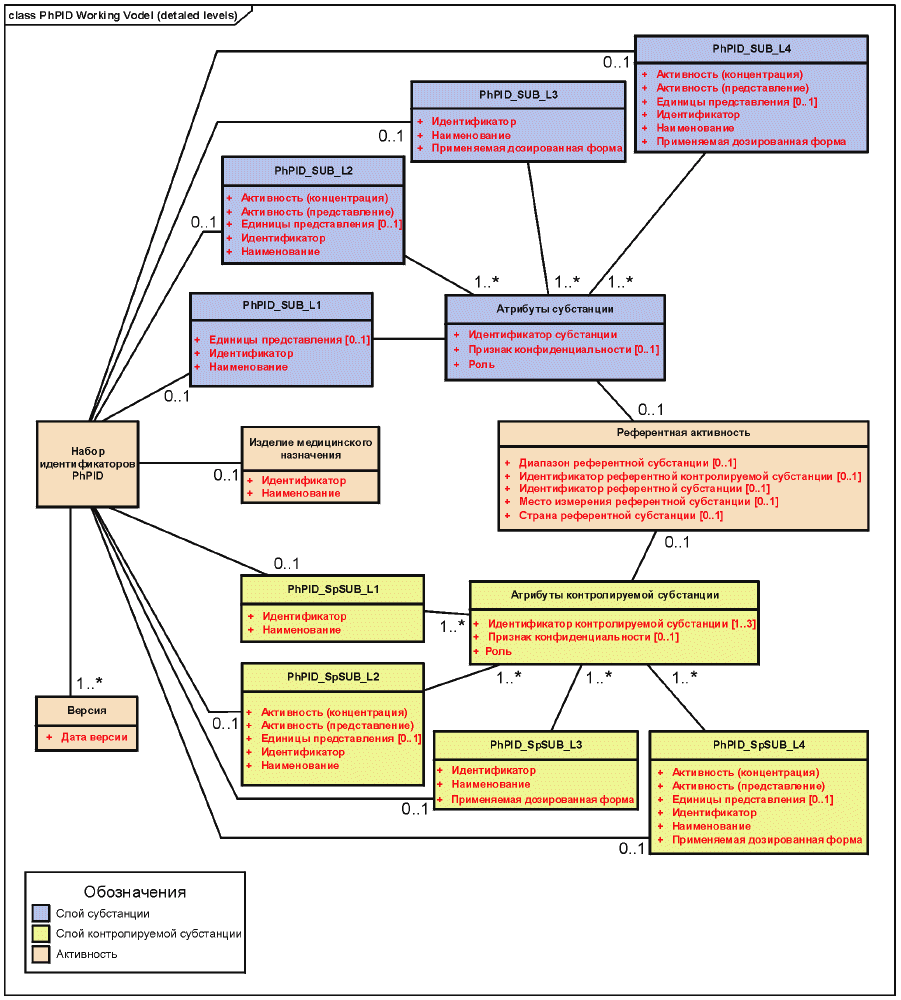
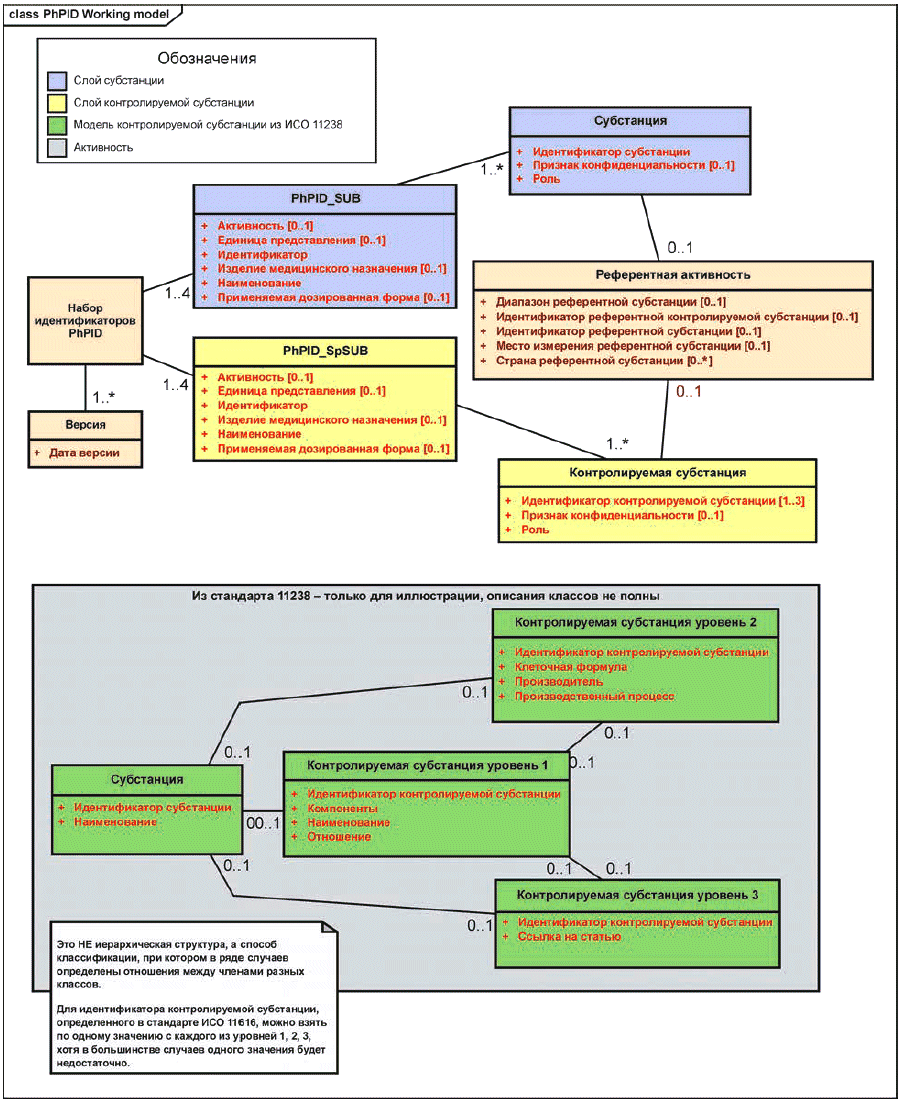
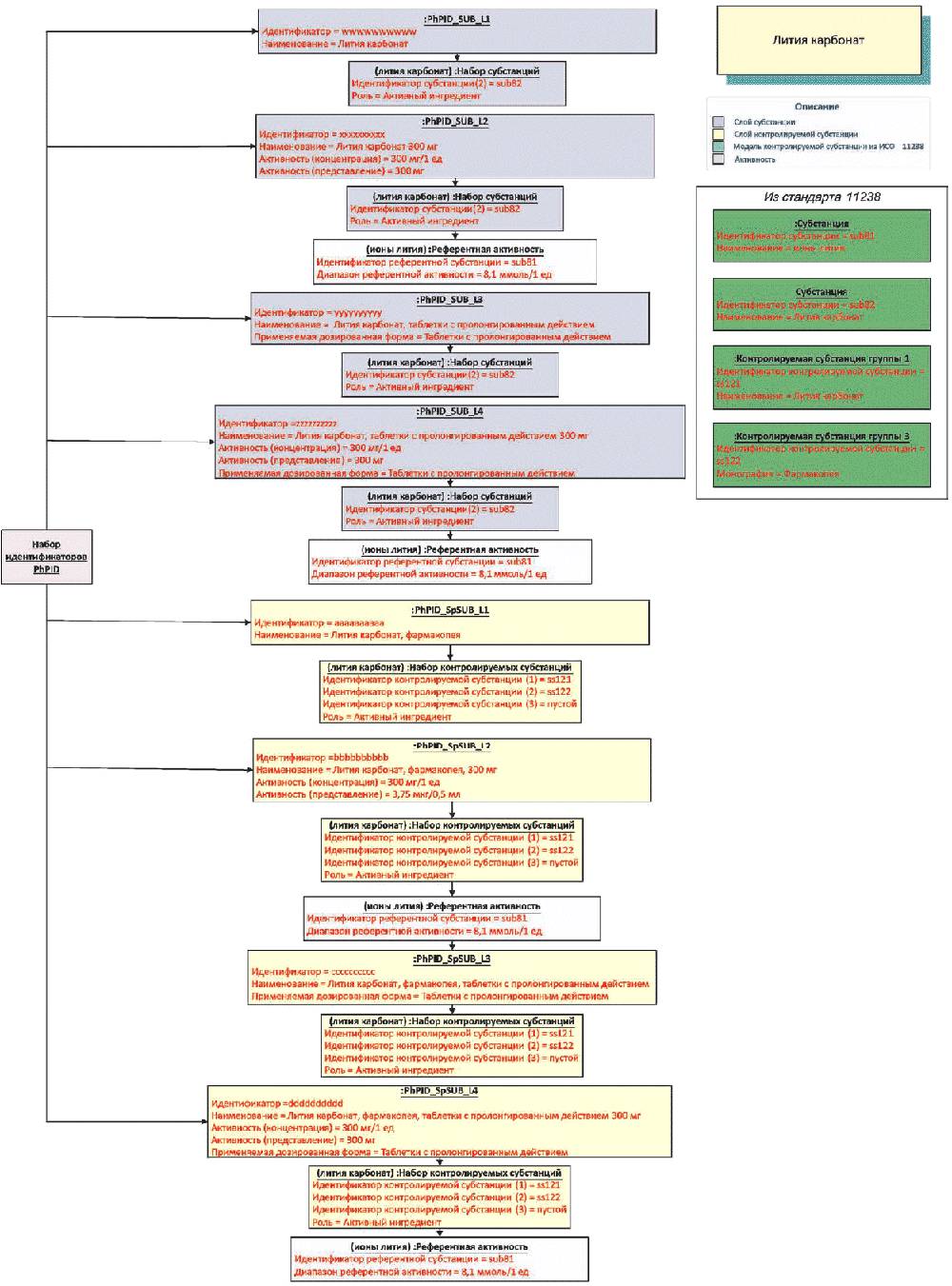
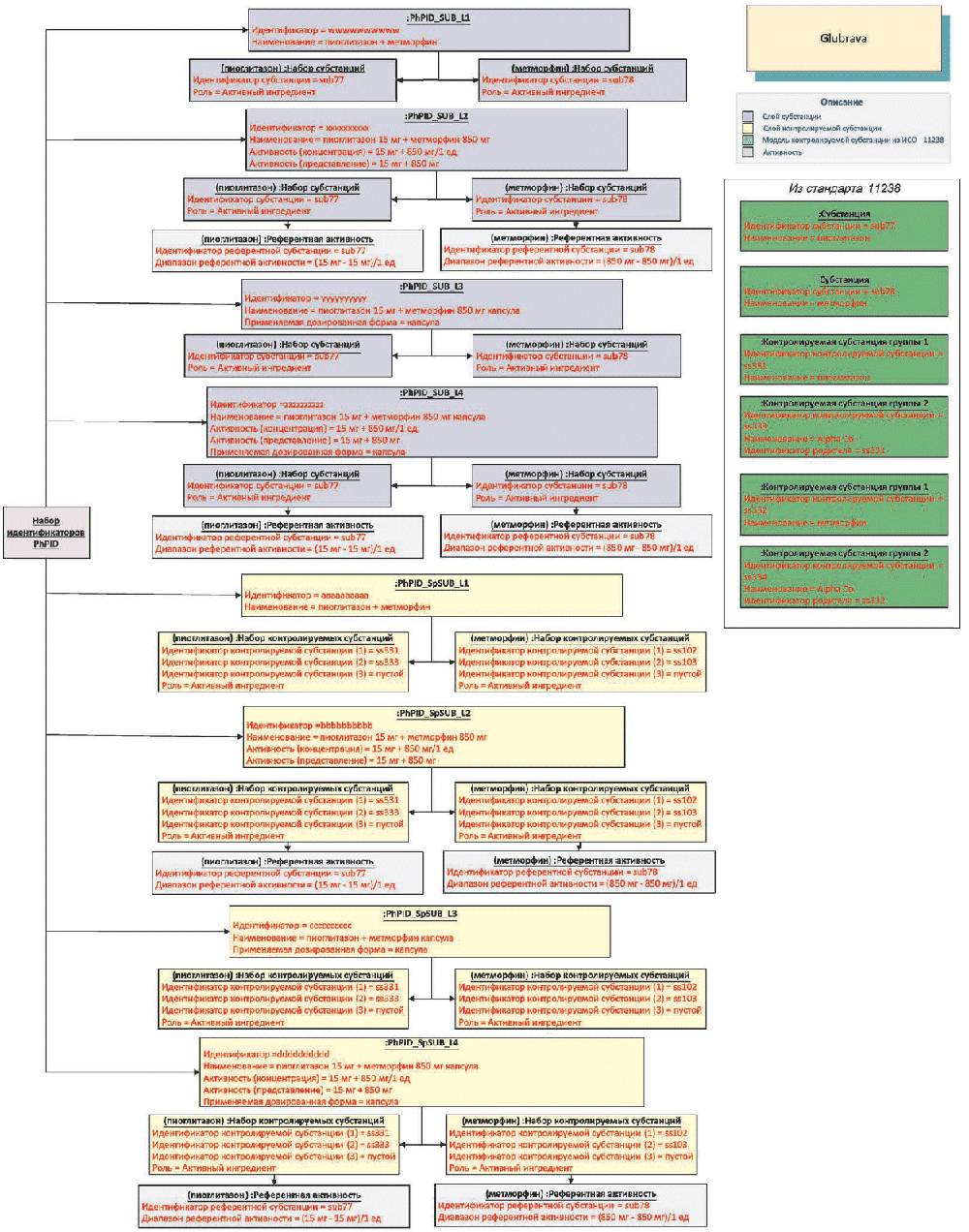
Идентификаторы лекарственных препаратов PhPID должны быть представлены для двух слоев (слой активной субстанции и слой нормированной субстанции), каждый из которых содержит четыре уровня идентификации для каждого лекарственного препарата, содержащегося в лекарственном средстве.
Идентификаторы PhPID должны генерироваться с использованием стандарта описания субстанций (см. стандарт ИСО 11238), положений раздела активности и применяемой дозированной формы (см. стандарт ИСО 11239) и стандарта описания единиц измерения (см. стандарт ИСО 11240), как это иллюстрируется ниже.
Референтная активность должна повторяться на обоих слоях идентификаторов PhPID. Она должна быть произведена из информации об активной субстанции и нормированной субстанции в зависимости от специфических характеристик лекарственного препарата.
Примечание - Все слои идентификаторов PhPID должны быть описаны на четырех различных уровнях, пронумерованных от 1 до 4.
Таблица 1 - Четыре уровня идентификаторов PhPID
Слои | Уровни |
Слой идентификаторов PhPID активной субстанции | PhPID_SUB_L1 |
PhPID_SUB_L2 | |
PhPID_SUB_L3 | |
PhPID_SUB_L4 | |
Слой идентификаторов PhPID нормированной субстанции | PhPID_SpSUB_L1 |
PhPID_SpSUB_L2 | |
PhPID_SpSUB_L3 | |
PhPID_SpSUB_L4 |
Примечания
1 Лекарственный препарат может представлять собой комплекс лекарства с изделием медицинского назначения (например, лекарство/изделие, биологический агент/изделие). В этом случае на всех релевантных уровнях идентификации препарата вместе с терминами субстанции (субстанций) и нормированной субстанции (субстанций) должны быть указаны термин и идентификатор термина изделия медицинского назначения (уникальный идентификатор изделия). Такая связь должна быть описана с помощью прямой ассоциации присвоенных идентификаторов PhPID с лекарственным средством и соответствующих идентификаторов MPID и PCID, как это обрисовано в стандарте ИСО 11615.
2 Понятие активности не применимо к изделию медицинского назначения.
3 Нормативные документы в данной юрисдикции могут уточнять требования, относящиеся к реализации стандарта в части информации об изделии медицинского назначения, например, требовать, чтобы эта информация представлялась только по запросу.
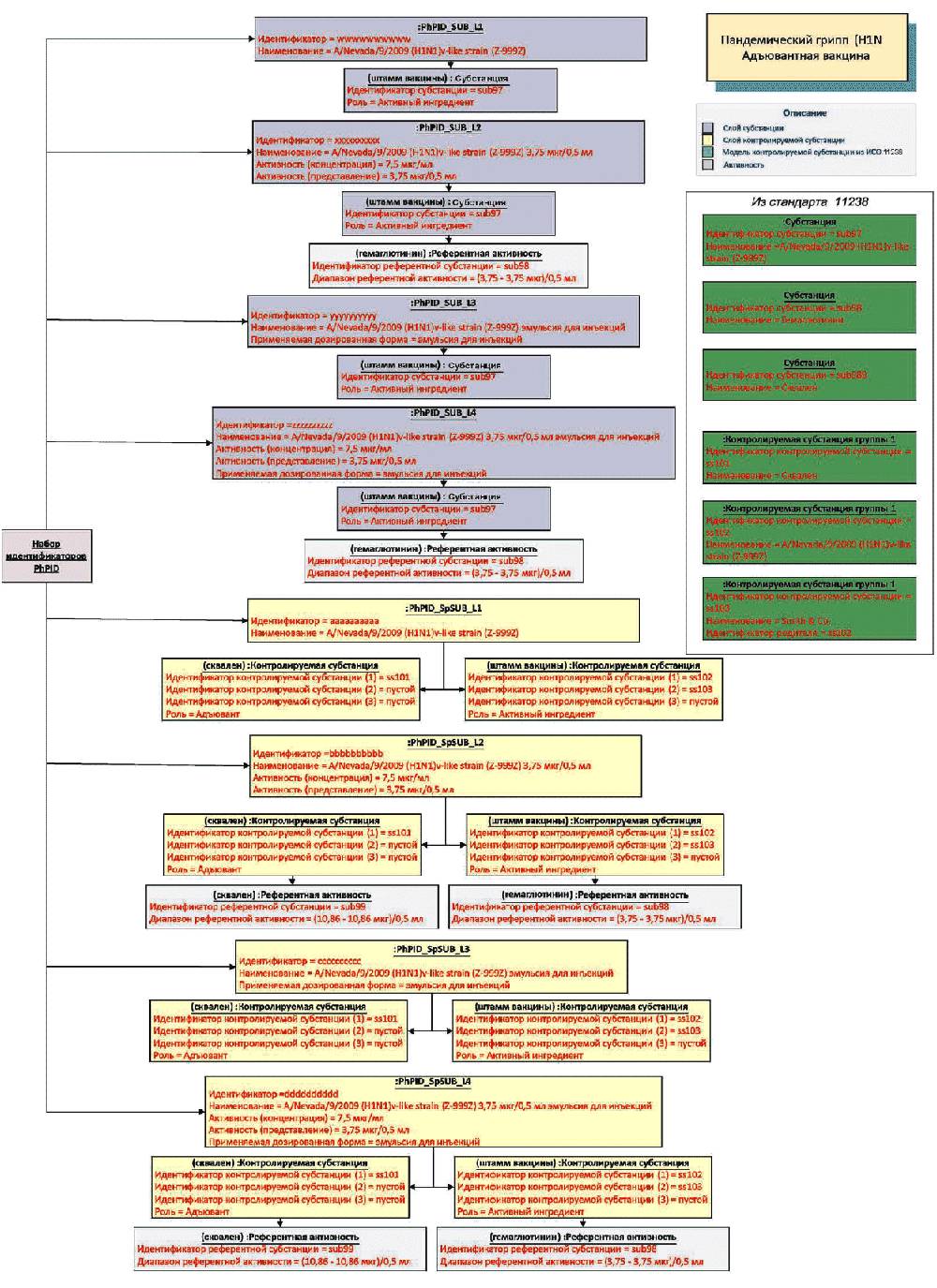
4 Лекарственным препаратом может быть комплекс лекарства с адъювантом (например, вакцина). В этом случае на всех релевантных уровнях идентификации препарата вместе с терминами субстанции (субстанций) и нормированной субстанции (субстанций) должны быть указаны термин и идентификатор термина адъюванта. Такая связь должна быть описана с помощью прямой ассоциации присвоенных идентификаторов PhPID с лекарственным средством и соответствующих идентификаторов MPID и PCID, как это обрисовано в стандарте ИСО 11615.
Для описания активности должны быть указаны количество, единицы измерения и/или единицы представления.
Применяемая дозированная форма производится из описания лекарственного препарата.
5.1.2 Идентификатор PhPID нормированной субстанции
Как описано в стандарте ИСО 11238, информация о нормированной субстанции (субстанциях) должна содержать детальные характеристики отдельной субстанции или состав вещества, содержащего несколько субстанций или несколько физических форм.
Для упрощения реализации элементы, необходимые для описания контролируемых субстанций, должны быть подразделены на четыре группы.
Эти группы определены следующим образом:
а) Нормированная субстанция группы 1. Должны быть использованы элементы, описывающие вещество, содержащее несколько субстанций, растворители, используемые для изготовления растительных или аллергенных экстрактов, специфичные маркеры или иные признаки, присутствующие в веществах растительного или животного происхождения, при необходимости физическую форму субстанции, а также любые свойства, существенные для описания вещества.
Группы элементов, используемых для определения нормированной субстанции группы 1, должны включать в себя составные компоненты, физическую форму и свойство.
Примечание - Такая группировка элементов позволяет давать определения многих промышленно производимых веществ, используемых в составе лекарственных средств.
b) Нормированная субстанция группы 2. Элементы группы 2 должны использоваться для указания сведений о производителе субстанции или нормированной субстанции группы 1 и минимальной информации о производственном процессе.
Минимальная информация о производственном процессе должна включать в себя общую характеристику метода производства (например, синтез, экстракция, восстановление), типа производственной системы (например, клеточную линию, растительные или животные ткани), производственную систему (конкретную клеточную линию).
Примечание - Элементы группы 2 позволяют прослеживать субстанцию до производителя. Они позволяют также отличать синтетические пептиды от рекомбинантных и получать информацию о производимой клеточной линии.
c) Нормированная субстанция группы 3. Элементы группы 3 должны указывать качество вещества, а также источник, регламентирующий данное качество. Элементы группы 3 должны использоваться для различения фармакопейного качества и технического качества вещества.
Если фармакопейные статьи, описывающие субстанцию в разных фармакопеях, не гармонизированы, то соответствующие субстанции должны рассматриваться как разные.
Примечание - Для большинства фармацевтических субстанций используются показатели качества USP (Фармакопея США), ЕР (Европейская фармакопея) и JP (Фармакопея Японии). К растительным субстанциям должны применяться такие показатели качества, как "стандартизованная", "заданный количественный состав", "нестандартизованная".
d) Нормированная субстанция группы 4. Элементы группы 4 должны указывать наиболее детальные сведения о субстанции. Они должны включать в себя информацию о критических производственных процессах, спецификации (для компонентов должны быть указаны примеси и сопутствующие вещества), словесное определение единицы измерения, референтное вещество и аналитические методы, используемые для определения эффективности.
Примечание - Специфичная информация о контролируемых субстанциях группы 4 нередко представляется в регистрационное досье в неструктурированной форме, что затрудняет ее сбор и организацию. Применение полей данных, предложенных в настоящем стандарте, является одним из способов организации и структурирования этой информации, позволяющим облегчить ее использование для составления обзоров и оценки соответствия.
5.1.3 Идентификация нормированной субстанции лекарственного препарата (PhPID SpSub)
Идентификаторы PhPID контролируемых субстанций должны составляться по трем группам из четырех (группы 1-3), описанных в стандарте ИСО 11238.
Группы 1, 2 и 3 содержат элементы данных, необходимые для более детальной идентификации лекарственного препарата, соответствующей назначению и области применения настоящего стандарта.
Группы 1-3, как присваиваемые активным субстанциям, должны использоваться в настоящем стандарте для описания идентификации лекарственного препарата с помощью соответствующих значений идентификаторов PhPID.
Группа 4 предназначена для более тонкого уровня идентификации субстанций, не требуемого для целей идентификации лекарственного препарата, и не должна использоваться при генерации идентификатора PhPID.
Информация о нормированной субстанции должна быть представлена с указанием элементов данных, описывающих активные субстанции лекарственного препарата и контролируемые субстанции группы 1.
Группы 2 и 3 должны быть ассоциированы непосредственно с активными субстанциями лекарственного препарата и с нормированной субстанцией группы 1.
Примечания
1 Присвоение и привязка групп контролируемых субстанций к определенным классам препаратов должны быть описаны в руководстве по реализации стандарта. Детальную информацию об элементах, описывающих субстанции и контролируемые субстанции, см. в стандарте ИСО 11238.
2 Нормативные документы в данной юрисдикции могут уточнять требования, относящиеся к реализации стандарта в части спецификации информации о контролируемых субстанциях, например, требовать, чтобы эта информация представлялась только по запросу.
5.2 Кратность
Отношения между элементами данных, описывающими лекарственный препарат, должны соответствовать следующим требованиям к кратности:
- с одним идентификатором PhPID должна быть связана одна лекарственная дозированная форма (кратность отношения: 1..1);
- с одним идентификатором PhPID может быть связана одна единица представления (кратность отношения: 0..1).
Примечание - Единицы представления используются особенно часто на месте оказания пациенту медицинской помощи, если количественная единица измерения не применима;
- с одним идентификатором PhPID может быть связано несколько активных субстанций (кратность отношения: 1..n);
- с одним идентификатором PhPID может быть связано несколько активных контролируемых субстанций (кратность отношения: 1..n);
- с одним идентификатором PhPID связана одна активность (кратность отношения: 1..1), основанная на отношении один-ко-многим с активными субстанциями или контролируемыми субстанциями (кратность отношения: 1..n); для жидких препаратов должны быть одновременно указаны единица объема (кратность отношения: 1..1) и общий объем контейнера (кратность отношения: 1..1);
- с одним идентификатором PhPID связана одна референтная активность (кратность отношения: 1..1), которая может быть вычислена из значений активности нескольких субстанций или контролируемых субстанций (кратность отношения: 1..n).
5.3 Представление активности в форме концентрации
Активность жидких препаратов должна быть выражена как в форме общей массы вещества в объеме контейнера, указанном в регистрационном досье, так и в форме концентрации (например, в 1 мл). При генерации и присваивании идентификатора PhPID активность должна быть выражена в форме общей массы вещества в объеме контейнера (используя идентификаторы MCID и PCID) с указанием соответствующей концентрации активного вещества, представленной в каждом идентификаторе PhPID уровня 2 или 4. Оба представления должны рассматриваться в качестве обязательных элементов описания лекарственного препарата.
Пример - Если два препарата имеют одинаковую активность в 1 мл, но представлены в контейнерах разного объема (препарат А 25 мг/5 мл и препарат Б 50 мг/мл), то им должны быть присвоены разные идентификаторы PhPID, при этом для идентификаторов PhPID уровней 2 и 4 должны быть указаны значения концентрации препаратов, равные 5 мг/мл.
Активность в форме концентрации должна быть вычислена из значения активности вещества во всем объеме контейнера и должна быть представлена на всех релевантных уровнях идентификаторов PhPID, где активность указана в соответствии с данными из регистрационного досье.
Для обеспечения взаимной приемлемости при обмене данными о лекарственных препаратах активность в форме концентрации должна быть представлена как элемент данных и отображена на активность во всем объеме контейнера на всех релевантных уровнях идентификаторов PhPID.
Вычисление концентрации и ее отображение на активность во всем объеме контейнера на всех релевантных уровнях идентификаторов PhPID должны быть учтены при реализации и сопровождении настоящего стандарта.
5.4 Идентификатор лекарственного препарата (PhPID)
Идентификатор лекарственного препарата PhPID представляет собой уникальный код, присвоенный на уровне лекарственного препарата и включающий в себя описанные ниже характеристики. Для препаратов, которые в соответствии с документацией регистрационного досье должны быть восстановлены перед применением, идентификатор PhPID должен включать в себя характеристики препарата после его восстановления.
Примечание - Более детальная информация об элементах данных, характеризующих конкретные субстанции и контролируемые субстанции, приведена в стандарте ИСО 11238. В состав этой информации входят атрибуты, определяющие идентификацию лекарственного препарата и присваивание идентификаторов PhPID.
|
Рисунок 1 - Характеристики идентификаторов PhPID
5.5 Элементы слоя субстанции лекарственного препарата (PhPID_SUB_Lx)
5.5.1 Состав слоя субстанции лекарственного препарата
В состав слоя субстанции лекарственного препарата входит описание активных субстанций, включающее в себя сведения об активности, применяемой дозированной форме и изделии медицинского назначения (при его наличии).
5.5.2 Субстанция
5.5.2.1 Общее описание
В состав каждого лекарственного препарата должна входить как минимум одна активная субстанция. Для каждой активной субстанции должна быть указана ее идентификация и роль.
5.5.2.2 Идентификатор субстанции
В этом атрибуте должен быть указан идентификатор субстанции, взятый из набора значений, указанного в стандарте ИСО 11238. Для представления идентификатора должен использоваться тип данных CD.
5.5.2.3 Идентификатор термина субстанции
Идентификатор термина субстанции лекарственного препарата должен быть указан, используя элемент множества значений в соответствии со стандартом ИСО 11238. Должен быть описан стандартный идентификатор термина субстанции (см. ИСО 11238).
5.5.2.4 Термин субстанции
Термин субстанции лекарственного препарата должен быть указан, по возможности используя элемент множества значений в соответствии со стандартом ИСО 11238. Должен быть описан стандартный термин субстанции (см. ИСО 11238).
5.5.2.5 Роль
В этом атрибуте должна быть указана роль субстанции в препарате, например, "активный ингредиент", "адъювант".
5.5.3 Применяемая дозированная форма
5.5.3.1 Общее описание
Этот атрибут описывает лекарственную дозированную форму, которая должна быть применена в соответствии с описанием, приведенным в регистрационном досье, после выполнения восстановления, если таковое необходимо. Значение этого атрибута должно быть взято из набора данных, указанного в стандарте ИСО 11239. Для представления этого значения должен использоваться тип данных CD.
Примеры - Таблетка, капсула, оральный раствор, суспензия.
Каждый лекарственный препарат может иметь только одну лекарственную форму.
Примечание - Лекарственное средство может представлять собой два произведенных продукта: один из них имеет произведенную лекарственную форму "порошок", а другое - "раствор", являющийся растворителем. Перед применением они восстанавливаются до применяемой дозированной формы "инъекционный раствор".
5.5.3.2 Идентификатор термина применяемой дозированной формы
Идентификатор термина применяемой дозированной формы должен быть указан, используя элемент множества значений в соответствии со стандартом ИСО 11239. Должен быть описан стандартный идентификатор термина применяемой дозированной формы (см. ИСО 11239).
5.5.3.3 Термин применяемой дозированной формы
Термин применяемой дозированной формы лекарственного препарата должен быть указан, по возможности используя элемент множества значений в соответствии со стандартом ИСО 11239. Должен быть описан стандартный термин применяемой дозированной формы (см. ИСО 11239).
5.5.4 Единицы представления
5.5.4.1 Общие положения
Единицей представления является качественное описание единицы представления и описания активности лекарственного препарата. Единицы представления используются особенно часто на месте оказания пациенту медицинской помощи, если количественная единица измерения не применима. Для описания единицы представления должен использоваться стандартный термин (см. ИСО 11239).
Пример - "Содержит 100 мкг в расчете на спрей" (единица представления - спрей).
5.5.4.2 Идентификатор термина единицы представления
Идентификатор термина единицы представления должен быть указан, используя элемент множества значений в соответствии со стандартом ИСО 11239. Должен быть описан стандартный идентификатор термина единицы представления (см. ИСО 11239).
5.5.4.3 Термин единицы представления
Термин единицы представления лекарственного препарата должен быть указан, по возможности используя элемент множества значений в соответствии со стандартом ИСО 11239. Должен быть описан стандартный термин единицы представления (см. ИСО 11239).
5.5.5 Изделие медицинского назначения
Если медицинское изделие является частью лекарственного препарата, то для его описания используются следующие элементы данных.
5.5.5.1 Идентификатор термина изделия медицинского назначения
Идентификатор термина изделия медицинского назначения должен быть указан, используя элемент, взятый из определенного множества значений. Уникальный идентификатор изделия должен быть присвоен на основе международной справочной терминологии.
5.5.5.2 Термин изделия медицинского назначения
Термин изделия медицинского назначения, являющегося частью лекарственного препарата, должен быть указан, по возможности используя элемент, взятый из определенного множества значений. Термин изделия должен быть присвоен на основе международной справочной терминологии.
5.5.6 Признак конфиденциальности
Категория конфиденциальности информации, присвоенная организацией, может быть указана на всех уровнях идентификаторов PhPID. Она должна быть взята из соответствующего нормативного словаря. Должны быть указаны сам термин и его идентификатор в этом словаре.
Примеры
1 Конфиденциальная.
2 Без ограничений.
5.6 Элементы слоя нормированной субстанции лекарственного препарата (PhPID_SpSUB_Lx)
5.6.1 Состав слоя нормированной субстанции лекарственного препарата
В состав слоя нормированной субстанции лекарственного препарата входит описание контролируемых субстанций, включающее в себя сведения об активности, применяемой дозированной форме и изделии медицинского назначения (при его наличии).
Примечание - Нормативные документы в данной юрисдикции могут ослабить требования, относящиеся к реализации стандарта в части указания контролируемых субстанций, например, требовать, чтобы эта информация представлялась только по запросу.
5.6.2 Нормированная субстанция
В состав каждого лекарственного препарата должна входить как минимум одна нормированная субстанция. Для каждой нормированной субстанции должна быть указана ее идентификация и роль. Нормированная субстанция должна иметь ссылку на одну или несколько субстанций.
5.6.2.1 Идентификатор нормированной субстанции
5.6.2.1.1 Идентификатор термина субстанции
Идентификатор нормированной субстанции должен быть взят из набора значений, указанного в стандарте ИСО 11238. Для представления идентификатора должен использоваться тип данных CD.
Идентификатор термина нормированной субстанции лекарственного препарата должен быть указан, используя элемент множества значений в соответствии со стандартом ИСО 11238. Должен быть описан стандартный идентификатор термина субстанции (см. ИСО 11238).
5.6.2.2 Роль
В этом атрибуте должна быть указана роль субстанции в препарате, например "активный ингредиент", "адъювант".
5.6.3 Применяемая дозированная форма
Этот атрибут описывает лекарственную дозированную форму, которая должна быть применена в соответствии с описанием, приведенным в регистрационном досье, после выполнения восстановления, если таковое необходимо. Значение этого атрибута должно быть взято из набора данных, указанного в стандарте ИСО 11239. Для представления этого значения должен использоваться тип данных CD.
Примеры - Таблетка, капсула, оральный раствор, суспензия. Каждый лекарственный препарат может иметь только одну лекарственную форму.
Примечание - Лекарственное средство может представлять собой два произведенных продукта: один из них имеет произведенную лекарственную форму "порошок", а другое - "раствор", являющийся растворителем. Перед применением они восстанавливаются до применяемой дозированной формы "инъекционный раствор".
5.6.3.1 Идентификатор термина применяемой дозированной формы
Идентификатор термина применяемой дозированной формы должен быть указан, используя элемент множества значений в соответствии со стандартом ИСО 11239. Должен быть описан стандартный идентификатор термина применяемой дозированной формы (см. ИСО 11239).
5.6.3.2 Термин применяемой дозированной формы
Термин применяемой дозированной формы лекарственного препарата должен быть указан, по возможности используя элемент множества значений в соответствии со стандартом ИСО 11239. Должен быть описан стандартный термин применяемой дозированной формы (см. ИСО 11239).
5.6.4 Единицы представления
Единицей представления является качественное описание единицы представления и описания активности лекарственного препарата. Единицы представления используются особенно часто на месте оказания пациенту медицинской помощи, если количественная единица измерения не применима. Для описания единицы представления должен использоваться стандартный термин (см. ИСО 11239).
Пример - "Содержит 100 мкг в расчете на спрей" (единица представления=спрей).
5.6.4.1 Идентификатор термина единицы представления
Идентификатор термина единицы представления должен быть указан, используя элемент множества значений в соответствии со стандартом ИСО 11239. Должен быть описан стандартный идентификатор термина единицы представления (см. ИСО 11239).
5.6.4.2 Термин единицы представления
Термин единицы представления лекарственного препарата должен быть указан, по возможности используя элемент множества значений в соответствии со стандартом ИСО 11239. Должен быть описан стандартный термин единицы представления (см. ИСО 11239).
5.6.5 Изделие медицинского назначения
Если медицинское изделие является частью лекарственного препарата, то для его описания используются следующие элементы данных.
5.6.5.1 Идентификатор термина изделия медицинского назначения
Идентификатор термина изделия медицинского назначения должен быть указан, если необходимо, используя элемент, взятый из определенного множества значений. Уникальный идентификатор изделия должен быть присвоен на основе международной справочной терминологии.
5.6.5.2 Термин изделия медицинского назначения
Термин изделия медицинского назначения, являющегося частью лекарственного препарата, должен быть указан, по возможности используя элемент, взятый из определенного множества значений. Термин изделия должен быть присвоен на основе международной справочной терминологии.
5.7 Идентифицирующие характеристики для описания активности
5.7.1 Описание активности
В зависимости от национальной или региональной практики активность может быть описана как количество содержания активной или нормированной субстанции (например, в единице дозы, единице объема или единице веса, в соответствии с лекарственной формой или единицей представления).
Если лекарственное средство имеет разные дозированные формы до и после восстановления, то в разделе лекарственного препарата должна быть описана активность фактически применяемого лекарственного препарата после восстановления или разведения в соответствии с информацией из регистрационного досье.
Примечания
1 Идентификаторы PhPID не должны содержать информацию, относящуюся к дозировке. Учет фактического количества препарата, примененного поставщиком медицинской помощи или самим пациентом, не входит в область применения настоящего стандарта.
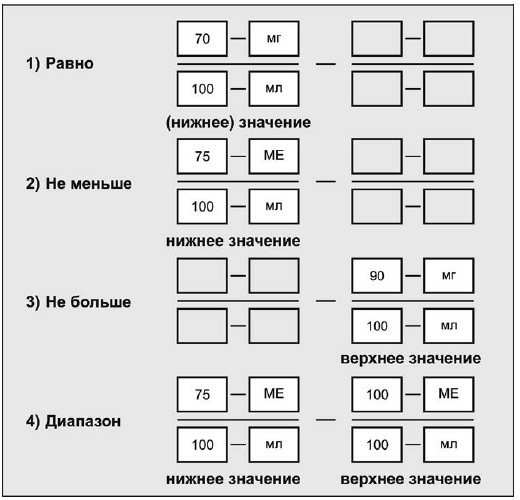
Для некоторых лекарственных препаратов точная активность дозы не может быть указана и в таких случаях должна быть выражена в форме диапазона, например "не больше" или "не меньше" определенного значения.
Значение активности, указанное для лекарственного препарата, должно быть идентично значению активности после восстановления в объеме, указанном в регистрационном досье.
Примеры
1 Концентрат доцетаксела 20 мг/0,5 мл с растворителем 1,5 мл: дозированная форма и активность, используемая для идентификатора PhPID, должны быть "раствор доцетаксела для инъекций 20 мг/2 мл (10 мг/мл).
2 Лиофилизат абатацепта для инфузий не содержит растворителя. Дозированная форма и активность после разведения указаны в инструкции по применению; эти величины должны быть использованы для идентификатора PhPID: лиофилизат абатацепта для инфузий 25 мг/мл.
2 Описание активности приведено в приложении В.
5.7.2 Атрибуты описания активности в элементах слоя идентификаторов PhPID
5.7.2.1 Активность (концентрация)
Активность (концентрация) определяется как количество субстанции/нормированной субстанции, присутствующее в одной единице лекарственного препарата, например, "2 мг/1 мл", "2 мг/1 таблетка". Для твердых дозированных форм она обычно идентична активности (презентации). Для жидких препаратов должны быть приведены общий объем контейнера, указанный в регистрационном досье, и активность (концентрация) в единице объема.
5.7.2.2 Активность (представление)
Активность (концентрация) определяется как количество субстанции/нормированной субстанции, присутствующее в данном количестве лекарственного препарата, например, "10 мг/5 мл", "2 мг/1 таблетка".
5.7.2.3 Значение активности (концентрации и представления)
Значение активности должно быть указано с помощью символа единицы измерения и идентификатора этого символа в соответствии со стандартом ИСО 11240 и его результирующей нормативной терминологией.
Если активность определяется на основе единицы представления, то ее значение должно быть указано с помощью термина и идентификатора этого термина в соответствии со стандартом ИСО 11239 и его результирующей нормативной терминологией.
Величина и единицы диапазона активности должны быть указаны в соответствии с формой представления типа данных RTO <PQ,PQ>. Это позволяет указать значение активности как отношение двух физических величин, в котором и в числителе, и в знаменателе указаны единицы измерения. При этом можно указать нижнее и верхнее значение, а также диапазоны нижних и верхних значений. Если нижнее и верхнее значение одинаково, то интервал эквивалентен единственному значению. Если нижнее значение равно нулю или не указано, то интервал интерпретируется как "не больше верхнего значения". Аналогично, если верхнее значение не указано, то интервал интерпретируется как "не меньше нижнего значения".
Символ единицы измерения и идентификатор этого символа должны быть указаны в соответствии со стандартом ИСО 11240 и его результирующей нормативной терминологией.
Если активность определяется на основе "единицы представления", то ее значение должно быть указано с помощью термина и идентификатора этого термина в соответствии со стандартом ИСО 11239 и его результирующей нормативной терминологией.
5.7.2.3.1 Описание активности препаратов, состоящих из нескольких ингредиентов
Активность препарата, содержащего два ингредиента, может быть описана как количество первого ингредиента плюс количество второго ингредиента в единице представления, например, "15 мг+850 мг/1 таблетка". В соответствии со стандартом ИСО 11615 активность такого препарата будет описана более детально, по отдельности для каждого ингредиента, но в настоящем стандарте такая детализация не требуется. Для текстового представления значения активности в подобных сложных случаях можно использовать тип данных RTO <PQ,PQ>.
5.7.2.4 Референтная активность
5.7.2.4.1 Общее описание
Субстанции и контролируемые субстанции могут выполнять в идентификаторе PhPID две роли:
- активная или нормированная субстанция, добавленная для формирования активной основы препарата;
- однозначная связь с активностью препарата. Для каждого лекарственного препарата должна быть указана активность, ассоциированная с одной или несколькими субстанциями или контролируемыми субстанциями. Кроме того, при наличии возможности референтная активность препарата может быть связана с безводной свободной кислотой, безводным свободным основанием или с субстанцией, "созданной" для описания активности.
Примеры
1 Панкрелипаза служит примером, когда значение активности представляет собой референтную активность. Панкрелипаза (свиная) идентифицируется как активная субстанция, но активность препарата основана на трех различных субстанциях: панкреатическая липаза, панкреатическая протеаза и панкреатическая амилаза (см. приложение Б).
2 Гидрохлорид морфина: инъекция, содержащая 5 мг гидрохлорида морфина в 1 мл, имеет активность 5 мг/мл гидрохлорида морфина и референтную активность 3,8 мг/мл базового морфина.
Субстанции или контролируемые субстанции могут использоваться как референтные при описании активности исследуемого или зарегистрированного лекарственного средства.
Активность референтной субстанции или нормированной субстанции должна быть описана как количество субстанции, присутствующее в данном количестве лекарственного препарата. Ее значение должно быть описано классом "Активность".
5.7.2.4.2 Активность референтной субстанции
Если атрибут активности референтной субстанции указан, то его значение должно быть описано, используя термин и идентификатор термина в соответствии со стандартом ИСО 11238 и его результирующим нормативным словарем.
5.7.2.4.3 Активность референтной нормированной субстанции
Если атрибут активности референтной нормированной субстанции указан, то его значение должно быть описано, используя термин и идентификатор термина в соответствии со стандартом ИСО 11238 и его результирующим нормативным словарем.
5.7.2.4.4 Диапазон референтной активности
Активность референтной субстанции или нормированной субстанции должна быть указана как количество субстанции, присутствующее в данном количестве лекарственного препарата.
Символ единицы измерения и идентификатор этого символа должны быть указаны в соответствии со стандартом ИСО 11240 и его результирующей нормативной терминологией.
Если активность определяется на основе единицы представления, то ее значение должно быть указано с помощью термина и идентификатора этого термина в соответствии со стандартом ИСО 11239 и его результирующей нормативной терминологией.
Величина и единицы диапазона активности должны быть указаны в соответствии с формой представления типа данных RTO <PQ,PQ>. Это позволяет указать значение активности как отношение двух физических величин, в котором и в числителе, и в знаменателе указаны единицы измерения. При этом можно указать нижнее и верхнее значения, а также диапазоны нижних и верхних значений. Если нижнее и верхнее значения одинаковы, то интервал эквивалентен единственному значению. Если нижнее значение равно нулю или не указано, то интервал интерпретируется как "не больше верхнего значения". Аналогично если верхнее значение не указано, то интервал интерпретируется как "не меньше нижнего значения".
Символ единицы измерения и идентификатор этого символа должны быть указаны в соответствии со стандартом ИСО 11240 и его результирующей нормативной терминологией.
5.7.2.4.5 Место измерения референтной активности
При необходимости в этом атрибуте может быть указано место измерения референтной активности.
5.7.2.4.6 Страна референтной активности
В этом атрибуте может быть указана страна или страны, для которых действительны значения диапазона референтной активности и соответствующее место измерения. Код страны выбирается из таблицы двухбуквенных кодов, определенных в стандарте ИСО 3166-1.
Если место измерения указано, то одна или несколько стран также должны быть указаны.
5.7.3 Описание активности пластыря
Активность пластыря может быть выражена "в единицу времени" или "в каждом" пластыре в соответствии с информацией из регистрационного досье. Если значение активности "в единицу времени" не применимо, то она должна быть указана "в каждом".
При указании активности пластыря "в единицу времени" генерация идентификатора PhPID должна осуществляться в соответствии со следующими принципами:
- использовать значение скорости выделения препарата (например, 1 мкг/1 ч), указанное в регистрационном досье;
- использовать количество, выделяемое за все время применения (например, 24 мкг/24 ч).
Если скорость выделения не указана в регистрационном досье, то надо указать количество препарата, содержащееся в пластыре (например, 50 мкг в каждом пластыре), а не выделяемое количество.
6 Взаимосвязь между идентификаторами MPID и PhPID
6.1 Понятия, необходимые для уникальной идентификации лекарственного средства и его ассоциации с идентификаторами PhPID
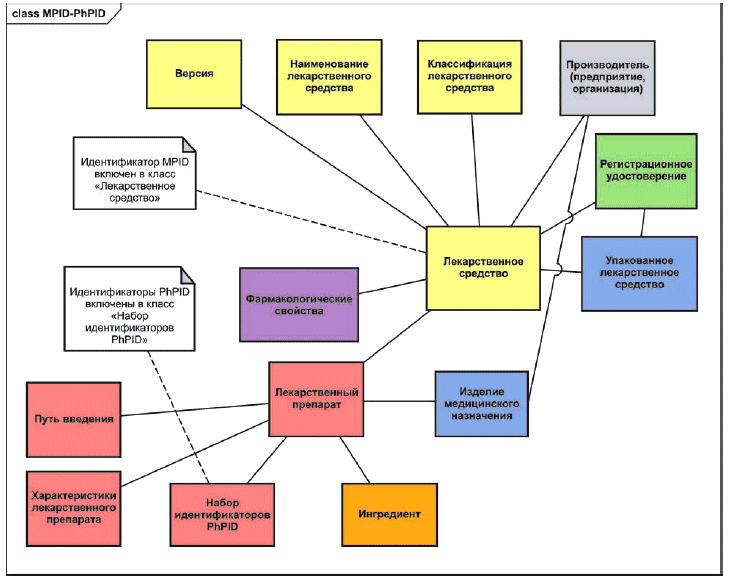
На рисунке 2 показана концептуальная взаимосвязь между идентификаторами МРID и PhPID. Эта диаграмма является фрагментом большей концептуальной диаграммы, приведенной в стандарте ИСО 11615, к которой надо обращаться для получения более детальной информации о классах, показанных на этом рисунке.
|
Рисунок 2 - Концептуальная взаимосвязь между идентификаторами MPID и PhPID
В настоящем стандарте определены понятия, необходимые для установления связи идентификаторов PhPID с регулируемыми лекарственными средствами (зарегистрированными или исследуемыми в клиническом исследовании) в соответствии со стандартом ИСО 11615. При установлении связи необходимо придерживаться следующих принципов:
a) лекарственное средство может быть связано с одним или несколькими лекарственными препаратами как компонентами способа применения (например, комплект из вагинальных таблеток 500 мг и внешнего вагинального крема 10%);
b) лекарственные препараты, содержащие активную субстанцию (субстанции) или контролируемую субстанцию (субстанции), необходимо характеризовать, указывая их (референтную) активность, (применяемую) лекарственную форму препарата, любое изделие медицинского назначения, являющееся неотъемлемой частью лекарственного средства (например, подложка для клеточного лекарственного средства);
c) должно использоваться описание лекарственного препарата (препаратов) в дозированной лекарственной форме, разрешенной для применения, если необходимо, после восстановления, в соответствии с описанием применения в регистрационном досье;
d) связь между зарегистрированным (исследуемым) лекарственным средством и лекарственным препаратом (препаратами) должна быть представлена в форме одного или нескольких идентификаторов PhPID.
Применение стандартных идентификаторов PhPID жизненно важно для установления связи между препаратами на этом уровне детализации, например, чтобы идентифицировать препарат в условиях, когда торговое (патентованное) наименование или идентификатор MPID неизвестны. Элементы, составляющие идентификатор лекарственного средства (MPID), описаны в стандарте ИСО 11615.
Идентификатор PhPID должен быть связан с одним или несколькими лекарственными средствами, содержащими один и тот же применяемый лекарственный препарат.
Лекарственное средство может быть связано с одним или несколькими идентификаторами PhPID, поскольку между идентификаторами PhPID и MPID существует отношение многие-ко-многим.
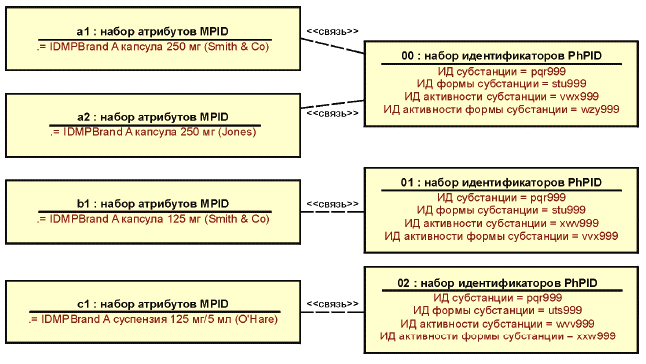
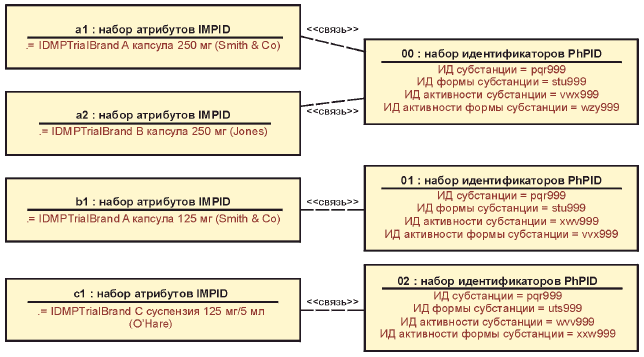
Пример - Если лекарственные средства содержат те же самые элементы, которые определены на конкретном уровне идентификаторов PhPID, то они должны иметь идентичный идентификатор PhPID. Например, лекарственное средство А, содержащее фармацевтическую субстанцию X, должно иметь тот же самый идентификатор PhPID уровня 1, что и лекарственное средство Б, которое содержит ту же самую субстанцию X. Далее, лекарственные средства А и Б, каждое из которых содержит субстанцию X и имеет дозированную лекарственную форму Y, но при этом отличается своей активностью, должны иметь одинаковые идентификаторы PhPID на уровнях 1 и 3, но разные идентификаторы PhPID на уровнях 2 и 4, поскольку активность у них разная.
Идентификаторы PhPID должны быть связаны с лекарственным средством, изучаемым в клиническом исследовании, на всех фазах разработки, а также после его регистрации на данной территории юрисдикции. Изменение любого элемента, входящего в состав идентификатора PhPID, связанное с изменением лекарственного средства, должно гарантировать присвоение нового идентификатора MPID.
|
Рисунок 3 - Иллюстрация связи между идентификаторами MPID и PhPID
6.2 Критерии идентификации лекарственного препарата
6.2.1 Общие положения
В этом подразделе описано, как должны генерироваться идентификаторы PhPID.
6.2.2 Несколько препаратов, упакованных в один набор и применяемых как отдельные препараты
Лекарственному препарату, состоящему из единиц, содержащих разные субстанции либо имеющих разные активности или дозированные формы и предназначенных для применения независимо друг от друга (например, комплект таблеток и крема, которые согласно рецепту должны применяться в разные интервалы времени, или блистер, содержащий таблетки с разной активностью), должно быть присвоено несколько идентификаторов PhPID, по одному на каждый препарат набора (см. А.4 приложения А).
6.2.3 Несколько препаратов, упакованных в набор и предназначенных для восстановления и применения в качестве одного лекарственного средства
Нескольким препаратам, упакованным в набор (комбинированная упаковка), которые должны применяться как одно лекарственное средство, должен быть присвоен один составной идентификатор PhPID лекарственного средства на уровне набора.
Пример - Препарат может поставляться в виде двух компонентов: порошок для инъекционного раствора и растворитель для инъекционного раствора. Один идентификатор PhPID должен быть присвоен применяемой дозированной форме инъекционного раствора (см. приложение Б).
Препараты без растворителей (отдельные препараты) также будут иметь дозированную форму после восстановления. Препаратам, предназначенным для изготовления растворов, например препаратам с дозированной формой "порошок" без растворителя и препаратам с дозированной формой "порошок" с растворителями, у которых восстановленные препараты идентичны, должны присваиваться одинаковые идентификаторы PhPID.
|
Рисунок 4 - Пример набора для восстановления
6.2.4 Компоненты наборов, не упакованные вместе (например, радиофармацевтических наборов)
Лекарственному средству, которое зарегистрировано как набор, все компоненты которого должны быть восстановлены, и которое должно применяться как один препарат (в соответствии с регистрационным досье), должен быть присвоен один идентификатор PhPID, соответствующий восстановленному препарату.
При выпуске радиофармацевтических наборов бывают ситуации, когда по соображениям безопасности компоненты набора вместе не упаковываются. Это не должно приводить к генерации нового идентификатора PhPID, коль скоро препарат был зарегистрирован как радиофармацевтический набор, применяемый как один препарат. Описание процесса производства радиофармацевтического набора должно содержать информацию о производстве набора и о рекомендованной конечной стадии получения радиоактивного лекарственного препарата. Необходимые спецификации радионуклидов должны быть описаны в соответствии с общей или специальной фармакопейной статьей, если таковая имеется. Кроме того, должны быть описаны компоненты, существенные для переноса радиоактивных меток. Должна быть описана также структура этих компонентов, существенных для переноса радиоактивных меток. Для радионуклидов должны быть описаны соответствующие ядерные реакции.
6.2.5 Различные представления активности идентичных препаратов в двух или более регионах
Препарату, зарегистрированному в нескольких регионах с идентичной активностью, но с разными способами ее представления, должен быть присвоен один идентификатор PhPID.
Различные региональные представления, которые с точки зрения идентификации конкретной активности того же самого препарата являются синонимами, должны иметь один и тот же идентификатор PhPID, не зависящий от региона.
Отображение разных синонимичных региональных терминов конкретной активности может учитываться при реализации стандарта и сопровождении информационной системы.
6.2.6 Представление идентификатора PhPID для пластыря
Активность пластыря может быть выражена "в каждом" пластыре или "в единицу времени" (если это применимо). В дополнение к идентификации количества активного вещества в каждом пластыре при генерации идентификатора PhPID для пластыря необходимо придерживаться следующих принципов:
- использовать значение скорости выделения препарата (указанное в регистрационном досье);
- использовать количество, выделяемое в единицу времени (например, 24 мкг/24 ч).
Если скорость выделения не указана в регистрационном досье, то надо указать количество препарата, содержащееся в пластыре (например, 50 мкг в каждом пластыре), а не выделяемое количество.
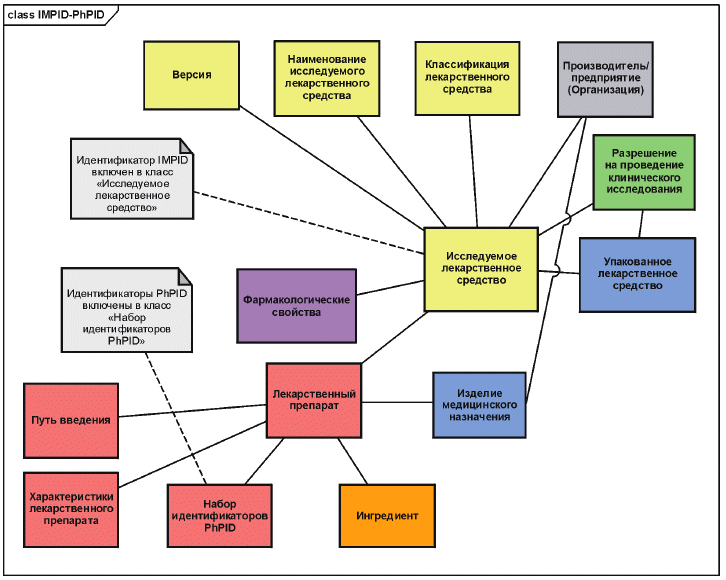
7 Взаимосвязь между идентификаторами IMPID и PhPID
Исследуемыми лекарственными средствами являются те средства, которые изучаются в клиническом исследовании на всех фазах разработки, предшествующих регистрации лекарственного средства в регионе, где оно должно быть введено в оборот.
В идентификаторе IMPID используется общий набор атрибутов исследуемого лекарственного средства. Когда всем этим атрибутам присвоены определенные значения, то в совокупности они представляют конкретное понятие, соответствующее идентификатору IMPID. Шаблон структуры идентификатора содержит:
a) кодированный сегмент страны (двухбуквенный код страны в соответствии со стандартом ИСО 3166-1);
b) кодированный сегмент спонсора (идентификатор организации);
c) кодированный сегмент лекарственного средства; в зависимости от местных требований формируется или спонсором, или уполномоченным органом.
На рисунке 5 показана концептуальная взаимосвязь между идентификаторами IMPID и PhPID. Эта диаграмма является фрагментом большей концептуальной диаграммы, приведенной в стандарте ИСО 11615, к которой надо обращаться для получения более детальной информации о классах, показанных на этом рисунке.
Идентификаторы PhPID должны быть ассоциированы с исследуемыми лекарственными средствами, изучаемыми в клиническом исследовании на всех фазах разработки, предшествующих регистрации лекарственного средства в регионе, где оно должно быть введено в оборот. Изменение любого элемента идентификатора PhPID, вызванное изменением информации о лекарственном средстве, должно приводить к присваиванию нового идентификатора IMPID.
Принципы присваивания идентификатора PhPID исследуемому лекарственному средству идентичны тем, что применяются к зарегистрированным лекарственным средствам. Однако у разных уполномоченных организаций могут быть свои подходы к присваиванию идентификаторов PhPID. Кроме того, имеет значение выбор уровня идентификатора PhPID, который, к примеру, может зависеть от фазы клинического исследования.
В настоящем стандарте описаны общие подходы к генерации и присвоению идентификаторов PhPID исследуемым лекарственным средствам. Выбор того, в какое время какой уровень идентификаторов PhPID будет использоваться для исследуемого лекарственного средства, должен осуществляться на региональном уровне реализации настоящего стандарта.
|
Рисунок 5 - Концептуальная взаимосвязь между идентификаторами IMPID и PhPID
|
Рисунок 6 - Высокоуровневый пример связи между идентификаторами IMPID и PhPID
8 Концептуальная модель
Состав лекарственного средства, зарегистрированный уполномоченным органом, должен передаваться в структурированном формате. Для иллюстрации этого тезиса на рисунке 7 представлена высокоуровневая концептуальная модель информации о лекарственном препарате, а в приложении А приведены представительные примеры присвоения идентификаторов лекарственным препаратам.
|
Рисунок 7 - Высокоуровневая концептуальная модель идентификации лекарственного препарата
Приложение А
(справочное)
Примеры
А.1 Общее положение
Ниже приведены примеры представления базовых элементов данных, используемых при генерации идентификаторов лекарственного препарата (PhPID).
А.2 Модель идентификатора PhPID
На рисунке А.1 показано моделируемое представление элементов идентификатора PhPID для адъювантной вакцины от гриппа H1N1. Детальная информация об элементах данных, образующих идентификатор MPID в этой модели, приведена в приложении В ИСО 11615.
|
Рисунок А.1 - Модель идентификатора PhPID для пандемической адьювантной вакцины от гриппа H1N1
А.3 Твердый оральный препарат (рисунок А.2)
|
Рисунок А.2 - Модель идентификаторов PhPID: LITHDRUG (лития карбонат, фармакопея)
Торговое наименование: LITHDRUG® (лития карбонат, фармакопея), таблетки 300 мг с пролонгированным усвоением, ISO IDMP Manufacturer Alpha.
Компоненты: 1.
Активность/форма выпуска: таблетки 300 мг.
Активные субстанции: лития карбонат.
Референтная активность: ионы лития, 8,1 ммоль.
Таблица А.1 - Слои и уровни
Слои | Уровни |
Идентификаторы PhPID, слой активной субстанции | PhPID_SUB_L1 |
PhPID_SUB_L2 | |
PhPID_SUB_L3 | |
PhPID_SUB_L4 | |
Идентификаторы PhPID, слой нормированной субстанции | PhPID_SpSUB_L1 |
PhPID_SpSUB_L2 | |
PhPID_SpSUB_L3 | |
PhPID_SpSUB_L4 |
Примечания
1 В этом примере активность и референтная активность различны.
2 Детальные элементы данных, описывающих субстанцию/контролируемую субстанцию (например, источник, качество, дополнительная информация о производстве), см. в стандарте ИСО 11238.
А.4 Несколько препаратов, упакованных в один набор и применяемых как отдельные лекарственные препараты
Торговое наименование: COMBIDRUG™ комбинированная упаковка (вагинальные таблетки 500 мг и крем 1%), ISO IDMP Manufacturer Bravo.
Компоненты: 2.
Активность/форма выпуска: таблетки 500 мг и крем 1% для наружного применения
Активные субстанции: клотримазол таблетки /клотримазол крем
Референтная активность: 500 мг клотримазол/1% клотримазол
Таблица А.2 - Слои и уровни
Слои | Уровни |
Идентификаторы PhPID, слой активной субстанции | PhPID_SUB_L1 |
PhPID_SUB_L2 | |
PhPID_SUB_L3 | |
PhPID_SUB_L4 | |
Идентификаторы PhPID, слой нормированной субстанции | PhPID_SpSUB_L1 |
PhPID_SpSUB_L2 | |
PhPID_SpSUB_L3 | |
PhPID_SpSUB_L4 | |
Идентификаторы PhPID, слой активной субстанции | PhPID_SUB_L1 |
PhPID_SUB_L2 | |
PhPID_SUB_L3 | |
PhPID_SUB_L4 | |
Идентификаторы PhPID, слой нормированной субстанции | PhPID_SpSUB_L1 |
PhPID_SpSUB_L2 | |
PhPID_SpSUB_L3 | |
PhPID_SpSUB_L4 |
Примечание - Детальные элементы данных, описывающих субстанцию/контролируемую субстанцию (например, источник, качество, дополнительная информация о производстве), см. в стандарте ИСО 11238.
А.5 Несколько препаратов, упакованных в набор для восстановления и применения как одно лекарственное средство
Торговое наименование: ANTIHEMODRUG© (антигемофилический фактор, человеческий рекомбинантный) набор, ISO IDMP Manufacturer Charlie
Компоненты: 2 (антигемофилический фактор, порошок для разведения и стерильная вода для инъекций)
Активность/форма выпуска: 250 МЕ/10 мл (25 МЕ/мл), раствор для инъекций.
Активные субстанции: антигемофилический фактор, человеческий рекомбинантный.
Референтная активность: антигемофилический фактор, 25 МЕ/мл.
Таблица А.3 - Слои и уровни
Слои | Уровни |
Идентификаторы PhPID, слой активной субстанции | PhPID_SUB_L1 |
PhPID_SUB_L2 | |
PhPID_SUB_L3 | |
PhPID_SUB_L4 | |
Идентификаторы PhPID, слой контролируемой субстанции | PhPID_SpSUB_L1 |
PhPID_SpSUB_L2 | |
PhPID_SpSUB_L3 | |
PhPID_SpSUB_L4 |
Примечания
1 В этом примере активность и референтная активность различны.
2 Детальные элементы данных, описывающих субстанцию/контролируемую субстанцию (например, источник, качество, дополнительная информация о производстве), см. в стандарте ИСО 11238.
А.6 Пластырь
Торговое наименование: NICODRUG© (никотиновый пластырь трансдермальный с пролонгированным выделением), ISO IDMP Manufacturer Delta.
Компоненты: 1.
Активность (каждого и в единицу времени)/форма выпуска: пластырь, 25 мг/24 час.
Активная субстанция: никотин
Референтная активность: никотин, 25 мг
Таблица А.4 - Слои и уровни
Слои | Уровни |
Идентификаторы PhPID, слой активной субстанции | PhPID_SUB_L1 |
PhPID_SUB_L2 | |
PhPID_SUB_L3 | |
PhPID_SUB_L4 | |
Идентификаторы PhPID, слой нормированной субстанции | PhPID_SpSUB_L1 |
PhPID_SpSUB_L2 | |
PhPID_SpSUB_L3 | |
PhPID_SpSUB_L4 |
Примечания
1 В этом примере активность и референтная активность различны.
2 Детальные элементы данных, описывающих субстанцию/контролируемую субстанцию (например, источник, качество, дополнительная информация о производстве), см. в стандарте ИСО 11238.
А.7 Референтная активность
Торговое наименование: PANCREADRUG®, панкрелипаза (липаза, протеаза, амилаза), ISO IDMP Manufacturer Echo.
Компоненты: 1.
Активность /форма выпуска: капсула 200 мг
Активные субстанции: панкрелипаза
Референтная активность: липаза 5000 ME, протеаза 10000 ME, амилаза 15000 ME
Таблица А.5 - Слои и уровни
Слои | Уровни |
Идентификаторы PhPID, слой активной субстанции | PhPID_SUB_L1 |
PhPID_SUB_L2 | |
PhPID_SUB_L3 | |
PhPID_SUB_L4 | |
Идентификаторы PhPID, слой нормированной субстанции | PhPID_SpSUB_L1 |
PhPID_SpSUB_L2 | |
PhPID_SpSUB_L3 | |
PhPID_SpSUB_L4 |
Примечания
1 В этом примере активность и референтная активность различны.
2 Детальные элементы данных, описывающих субстанцию/контролируемую субстанцию (например, источник, качество, дополнительная информация о производстве), см. в стандарте ИСО 11238.
А.8 Многокомпонентный препарат (рисунок А.3)
|
Рисунок А.3 - Модель идентификаторов PhPID: GLUBRAVA (пиоглитазон и метморфин)
Торговое наименование: GLUBRAVA® (пиоглитазон и метморфин), капсулы 15 мг+850 мг, ISO IDMP Manufacturer Foxtrot Co.
Компоненты: 1.
Активность/форма выпуска: пиоглитазон 15 мг+метморфин 850 мг, капсула.
Активные субстанции: пиоглитазон, метморфин.
Референтная активность: таблетка пиоглитазон 15 мг; таблетка метморфин 850 мг.
Таблица А.6 - Слои и уровни
Слои | Уровни |
Идентификаторы PhPID, слой активной субстанции | PhPID_SUB_L1 |
PhPID_SUB_L2 | |
PhPID_SUB_L3 | |
PhPID_SUB_L4 | |
Идентификаторы PhPID, слой нормированной субстанции | PhPID_SpSUB_L1 |
PhPID_SpSUB_ L2 | |
PhPID_SpSUB_L3 | |
PhPID_SpSUB_L4 |
Примечание - Детальные элементы данных, описывающих субстанцию/контролируемую субстанцию (например, источник, качество, дополнительная информация о производстве), см. в стандарте ИСО 11238.
Приложение В
(справочное)
Табличные примеры
В.1 Пример представления активности
|
Рисунок В.1 - Модельный пример представления активности
В.2 Пример представления активности разных типов лекарственных средств
Таблица В.1 - Соглашения по представлению активности
Единица неинъекционной дозы (твердая, жидкая или полужидкая) | |||||||
Вариант | Пример | Значение числителя | Единица измерения числителя | Значение знаменателя | Единицы | ||
Оральная | [единица]/ каждая | 25 [единиц] | Число | [единица] | 1 | Каждая | |
Непрерывная неинъекционная доза (жидкая или полутвердая) | |||||||
Вариант | Пример | Значение числителя | Единица измерения числителя | Значение знаменателя | Единицы | ||
Неинъекци- | [единица]/ мл | 25 [единиц] | Число | [единица] | Число | мл | |
Неинъекци- | [единица]/ мл | 25 [единиц] | Число | [единица] | Число (<1) | мл | |
Непрерывная неинъекционная доза (твердая) | |||||||
Вариант | Пример | Значение числи- | Единица измере- | Значение знамена- | Единицы | ||
Неинъекци- | [единица]/ г | 25 [единиц] 10 г | Число | [единица] | Число | г | |
Неинъекци- | [единица]/ г | 25 [единиц] 0,1 г | Число | [единица] | Число (<1) | г | |
Единица парентеральной дозы (единица дозы приведена в целом) | |||||||
Вариант | Пример | Значение числи- | Единица измере- | Значение знамена- | Единицы | ||
Инъекци- | [единица]/ мл | 25 [единиц] 1 каждая | Число | [единица] | 1 | Каждая | |
Парентеральная единица дозы (включая частичное использование флакона единицы дозы) | |||||||
Вариант | Пример | Значение числи- | Единица измере- | Значение знамена- | Единицы | ||
Инъекции- | [единица]/ мл | 25 [единиц] 10 мл | Число | [единица] | Число | мл | |
Инъекци- | [единица]/ мл | 25 [единиц] 0,1 мл | Число | [единица] | Число (<1) | мл | |
Ингалятор | |||||||
Вариант | Пример | Значение числи- | Единица измере- | Значение знамена- | Единицы | ||
Единица неинъекционной дозы (твердая, жидкая или полужидкая) | |||||||
Ингалятор - порошок | [единица]/ доза | 25 [единиц] 1 каждая | Число | [единица] | 1 | Доза | |
Ингалятор - жидкая разовая доза | [единица]/ каждая | 25 [единиц] 1 каждая | Число | [единица] | 1 | Каждая | |
Ингалятор - жидкая многократ- | [единица]/ мл | 25 [единиц] 10 мл | Число | [единица] | Число | мл | |
Ингалятор - жидкая многократ- | [единица]/ мл | 25 [единиц] 0,1 мл | Число | [единица] | Число (< 1) | мл | |
Местная, пластырь | |||||||
Трансдер- | [единица}/ время или каждый | 25 [единиц] | Число | [единица] | 1 | Время или каждый | |
Примечание - Вычисление и отображение идентификаторов PhPID в случаях, когда активность выражается концентрацией в единице объема, должны рассматриваться при реализации и сопровождении настоящего стандарта.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ISO 3166-1 | - | * |
ISO 11615 | IDT | ГОСТ Р ИСО 11615-2014 "Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах" |
ISO 11238 | IDT | ГОСТ Р ИСО 11238-2014 "Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях" |
ISO 11239 | IDT | ГОСТ Р ИСО 11239-2014 "Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых формах дозировки, единицах представления, путях введения и упаковке" |
ISO 11240 | IDT | ГОСТ Р ИСО 11240-2014 "Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией об единицах измерения" |
HL7 Version 3 Standard | - | * |
HL7 Version 3 Standard | - | * |
HL7 Version 3 Standard | - | * |
HL7 Version 3 Standard | - | * |
* Соответствующий национальный стандарт отсутствует. До его принятия рекомендуется использовать перевод на русский язык данного международного стандарта. Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: - IDT - идентичные стандарты. | ||
Библиография
[1] | ISO 1087-1:2000, Terminology work - Vocabulary - Part 1: Theory and application |
[2] | ISO 1087-2:2000, Terminology work - Vocabulary - Part 2: Computer applications |
_______________
| |
[3] | ISO/IEC 2382-4:1999, Information technology - Vocabulary - Part 4: Organization of data |
[4] | ISO 21090, Health informatics - Harmonized data types for information interchange |
[5] | ISO/HL7 27951, Health informatics - Common terminology services, release 1 |
[6] | HL7 Core Principles |
[7] | ENV 1613:1995, Medical informatics - Messages for exchange of laboratory information |
[8] | ENV 12610:1997, Medical Informatics - Medicinal product identification |
[9] | ENV 13607:2000, Health informatics - Messages for the exchange of information on medicine prescriptions |
[10] | ICH M5 Guideline 2005: Data Elements and Standards for Drug Dictionaries |
[11] | GHTF/AH (PD1)/N2ER1:2009 GHTF Discussion Paper (in view of preparation of a Draft Guidance on UDI for Medical Devices) Title: Unique Device Identification (UDI) System |
[12] | The Food and Drugs Act and Regulations and related Health Canada Guidelines |
[13] | The Natural Health Product Regulations and related Health Canada Guidelines |
[14] | Directive 2001/83/EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to medicinal products for human use as amended by Directive 2002/98/EC, Directive 2004/24/EC and Directive 2004/27/EC |
[15] | The requirements to be fulfilled in the member states of the European Union by medicinal devices and of implantable medicinal devices are respectively defined in Directive 93/42/EEC and Directive 90/385/EEC |
[16] | "Guideline on the categorisation on New applications versus Variations" The Rules governing Medicinal Products in the European Union, Notice to Applicants, Volume 2A and Volume 2C |
[17] | A Guideline on Summary of Product Characteristics, December 1999 (Doc. Ref. Notice to Applicants, Final revision 0) htpp://ec.europa.eu/enterprise/pharmaceuticals/eudralex/vol-2/c/spcguidrev1-oct2005/pdf |
[18] | Directive 2001/20/EC of the European Parliament and of the Council of 4 April 2001 on the approximation of the laws, regulations and administrative provisions of the Member States relating to the implementation of good clinical practice in the conduct of clinical trials on medicinal products for human use |
[19] | Commission Directive 2003/63/EC of 25 June 2003 amending Directive 2001/83/EC of the European Parliament and of the Council on the Community code relating to medicinal products for human use |
[20] | Regulation (EC) No 726/2004 of the European Parliament and of the Council of 31 March 2004 laying down Community procedures for the authorization and supervision of medicinal products for human and veterinary use and establishing a European Medicines Authority |
[21] | Regulation (EC) No 1394/2007 of the European Parliament and of the Council of 13 November 2007 on advanced therapy medicinal products and amending Directive 2001/83/EC and Regulation (EC) No 726/2004 |
[22] | Commission Directive 2003/94/EC of 8 October 2003 laying down the principles and guidelines of good manufacturing practice in respect of medicinal products for human use and investigational medicinal products for human use |
[23] | Guidelines on Pharmacovigilance for Medicinal Products for Human Use, Volume 9A of the Rules Governing Medicinal Products in the European Union |
[24] | Guideline on declaration of herbal substances and herbal preparations in herbal medicinal products/traditional herbal medicinal products in the SPC, 26 July 2007 (Doc. Ref. EMEA/HMPC/CHMP/CVMP/287539/2005) |
[25] | Guideline on adjuvants in vaccines for human use, 20 January 2005 (Doc. Ref. EMEA/CHMP/VEG/134716/2004) |
[26] | Guideline on Similar Biological Medicinal Products, 30 October 2005 (Doc. Ref. CHMP/437/04) |
[27] | Guideline on Pharmaceutical Aspects of the Product Information for Human Vaccines, 26 November 2003 (Doc. Ref. EMEA/CPMP/BWP/2758/02) |
[28] | Guideline on the acceptability of names for human medicinal products processed through the centralised procedure, 11 December 2007 (Doc. Ref. CPMP/328/98, Revision 5) |
[29] | Guideline on the Chemistry of new Active Substances, 17 December 2003 (Doc. Ref. CPMP/QWP/130/96 Rev.1) |
[30] | International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH) Clinical Safety |
[31] | E1 The Extent of Population Exposure to Ass ess Clinical Safety for Drugs Intended for Long-Term Treatment of Non-Life Threatening Conditions |
[32] | Е2А Clinical Safety Data Management: Definitions and Standards for Expedited Reporting |
[33] | E2B(R3) Clinical Safety Data Management: Data Elements for Transmission of Individual Case Safety Reports |
[34] | E2C(R1) Clinical Safety Data Management: Periodic Safety Update Reports for Marketed Drugs |
[35] | Addendum to E2C: Periodic Safety Update Reports for Marketed Drugs [in E2C(R1)] |
[36] | E2D Post-Approval Safety Data Management: Definitions and Standards for Expedited Reporting |
[37] | E2E Pharmacovigilance Planning |
[38] | E2F Development Safety Update Report |
[39] | Standard Terms: Dosage Forms, Routes of Administration and Containers, EDQM, Fifth Edition, December 2004, Version 5.0.0 |
[40] | EudraVigilance Medicinal Product Dictionary (EVMPD) Version 2.0 Technical Specifications, 9 November 2004 (Doc. Ref. EMEA/140190/2004) |
[41] | EudraVigilance Medicinal Product Dictionary (EVMPD) Version 2.0 Message and Acknowledgement Specifications, 8 December 2004 (Doc. Ref. EMEA/178966/2004) |
[42] | EudraVigilance (EV) Access simple Database Version 2.0 8 November 2004 (Doc. Ref: EMEA/140327/2004) |
[43] | EudraVigilance (EV) Access Simple Database Version 2.0 Forms Documentation, 31 January 2005 (Doc. Ref: EMEA/35416/2005) |
[44] | EudraVigilance (EV) Access Simple Database Version 2.0 Step by Step Guide 8 December 2004 (Doc. Ref: EMEA/191986/2004) |
[45] | Evropean Pharmacopeia (Ph. Eur.) |
[46] | Ministry of Health and Welfare, PSB/SD Notification No.37 (29 |
[47] | Appendix: Electronic format of package insert information on ethical drugs (SGML/DTD Ver. 2.0) Appendixl DTD Ver.2.0 |
[48] | Appendix2 Overview of SGML creation |
[49] | Appendix3 DCL Appendix4 Template of SGML |
[50] | Appendix5 Data model (Entities and relationships) |
[51] | Appendix6 List of fields of package insert information |
[52] | Japanese Pharmacopoeia (Fifteenth Edition in English to be published) *the Japanese Pharmacopoeia Fourteenth Edition |
[53] | *the Japanese Pharmacopoeia Fourteenth Edition, supplement I |
[54] | *the Japanese Pharmacopoeia Fourteenth Edition, supplement II |
[55] | United States Pharmacopoeia (USP) |
[56] | United States Department of Agriculture's (USDA) Integrated Taxonomic Information System (ITIS) http://www.it is.usda.gov |
[57] | Guidance for Industry Providing Regulatory Submissions in Electronic Format - Content of Labelling |
[58] | Release Notes for SPL Schema PORR_MT050020 (3.20.05) |
[59] | CaCore 2.0 Technical Guide, National Cancer Institute, Center for Bioinformatics, U.S. Department of Health and Human Services |
[60] | A guide to RxNorm, United States National Library of Medicine, National Institute of Health |
[61] | Substance Registration System (SRS) SRS Substance Definition Manual Version 5b Final Draft.doc |
[62] | The Unified Code for Units of Measure |
[63] | The U.S. Consolidated Healthcare Informatics initiative |
[64] | FDA 21 CFR 310.305 |
[65] | WHO Technical Report 498(1972); ICH E2A |
[66] | CDISC Clinical Research Glossary V8.0, 2009 |
[67] | EC Directive 2007/47 on Medical Devices |
УДК 004:61:006.354 | ОКС 35.240.80 | П85 | ОКСТУ 4002 |
Ключевые слова: здравоохранение, информатизация здоровья, уникальная идентификация, лекарственные средства, структуры данных, передача данных, регистрируемые лекарственные препараты | |||
Электронный текст документа
и сверен по:
, 2019