ГОСТ Р ИСО 11238-2014
Группа П85
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИНФОРМАТИЗАЦИЯ ЗДОРОВЬЯ
Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях
Health informatics. Identification of medicinal products. Data elements and structures for the unique identification and exchange of regulated information on substances
ОКС 35.240.80
ОКСТУ 4002
Дата введения 2015-10-01
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным учреждением "Центральный научно-исследовательский институт организации и информатизации здравоохранения" Министерства здравоохранения Российской Федерации (ФГБУ "ЦНИИОИЗ" Минздрава) и Федеральным бюджетным учреждением "Консультационно-внедренческая фирма в области международной стандартизации и сертификации "Фирма "Интерстандарт" на основе собственного аутентичного перевода на русский язык международного стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 468 "Информатизация здоровья" при ЦНИИОИЗ Минздрава - постоянным представителем ISO ТС 215
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 17 ноября 2014 г. N 1618-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 11238:2012* "Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях" (ISO 11238:2012 "Health informatics - Identification of medicinal products - Data elements and structures for unique identification and exchange of regulated information on substances")
________________
* Доступ к международным и зарубежным документам, упомянутым здесь и далее по тексту, можно получить, перейдя по ссылке на сайт . - .
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
Введение
Настоящий стандарт разработан в связи с широкой мировой потребностью в международной гармонизации описаний лекарственных средств. Он является одним из пяти стандартов, образующих базис уникальной идентификации лекарственных средств. В эту группу стандартов входят:
ISO 11615, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated medicinal product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах);
ISO 11616, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated pharmaceutical product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных препаратах);
ISO 11238, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on substances (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях);
ISO 11239, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых формах дозировки, единицах представления, способах введения и упаковке);
ISO 11240, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of units of measurement (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о единицах измерения).
Эти стандарты идентификации лекарственных средств (IDMP - Identification of Medicinal Products) предназначены для поддержки деятельности органов контроля обращения лекарственных средств во всем мире, включая контроль за разработкой и регистрацией лекарственных средств, управление их жизненным циклом, а также контроль рисков и фармаконадзор.
Для достижения основных целей контроля обращения лекарственных средств и фармаконадзора необходимо обеспечивать надежный, качественный и согласованный обмен информацией о лекарственных средствах. Поэтому стандарты IDMP регламентируют как минимум следующие обмены информацией:
- между органами контроля обращения лекарственных средств, например, между Европейским агентством лекарственных средств и Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (United States Food and Drug Administration);
- между фармацевтической фирмой и органом контроля обращения лекарственных средств, например, между фирмой "Pharma Company А" и организацией Health Canada;
- между спонсором клинического исследования и органом контроля обращения лекарственных средств, например, между университетом "University X" и Австрийским агентством лекарственных средств;
- между органом контроля обращения лекарственных средств и другими участниками обращения лекарственных средств, например, между Регуляторным агентством Великобритании по лекарственным средствам и изделиям медицинского назначения (MHRA - UK Medicines and Health Care Products Regulatory Agency) и Национальной службой здравоохранения (NHS - National Health Service);
- между органами контроля обращения лекарственных средств и международными источниками данных, например, между Агентством Японии по лекарственным средствам и изделиям медицинского назначения (PMDA - Pharmaceutical and Medical Device Agency) и уполномоченной организацией по присваиванию идентификаторов субстанциям.
Составными частями стандартов IDMP являются спецификации сообщений. Они служат для описания и обеспечения целостности указанных выше обменов информацией.
Уникальные идентификаторы, присвоенные в соответствии со стандартами IDMP, предназначены для использования в тех приложениях, которым необходима надежная идентификация и отслеживание применения лекарственных средств и используемых в них материалов.
В настоящем стандарте описана структура данных, способствующая присвоению уникальных идентификаторов всем субстанциям, входящим в состав лекарственных средств, а также упаковочным материалам, а также управлению этими идентификаторами. Настоящий международный стандарт устанавливает общие правила определения и различения субстанций и предлагает высокоуровневую модель, описывающую структуру информации о субстанциях и контролируемых субстанциях, предназначенную для организации и сбора соответствующих данных.
При разработке настоящего стандарта использовалась Общая модель продукции организации HL7 (Common Product Model), и детальное моделирование информации о субстанциях и контролируемых субстанциях осуществлялось в соответствии с ее областью применения. Предполагается, что при реализации настоящего стандарта в целях обеспечения присваиванию каждой субстанции, присутствующей в лекарственном средстве, строгого не смыслового уникального идентификатора будет использовано Руководство HL7 по реализации описания субстанций (HL7 substances implementation guide) и стандарты HL7 по электронному обмену данными. Предполагается также, что за генерацию идентификаторов каждой субстанции будет отвечать единственная организация и что эта организация будет сохранять у себя определяющие элементы, входящие в состав идентификатора субстанции. На уровне контролируемых субстанций может потребоваться учет региональных особенностей, поскольку значительная часть информации, описывающей эти субстанции, имеет местный характер.
Применение идентификатора существенно для описания субстанций, входящих в состав лекарственных средств, в глобальном масштабе. Настоящий стандарт не предполагает разработку номенклатуры субстанций или контролируемых субстанций, но с каждым идентификатором можно связать общераспространенные и официальные текущие наименования субстанции.
Материалы, используемые в лекарственных средствах, варьируются от простых химических соединений до генномодифицированных клеток и тканей животного происхождения. Однозначная идентификация таких субстанций особенно проблематична. В настоящем стандарте субстанции определяются на основе их научной идентичности (то есть, чем они являются), а не на основе способа применения или производственного процесса. Для идентификации субстанций используется молекулярная структура или другие неизменные свойства, например, таксономия, анатомическая информация или информация о фракционировании. В настоящем стандарте приведены пять групп элементов, достаточных для идентификации всех субстанций. Хотя идентифицировать или классифицировать субстанции вполне возможно и другими способами, в настоящем стандарте применен подход минимально структурированных научных понятий, при котором основное внимание уделяется критичным элементам, необходимых для различения двух субстанций друг от друга. Нередко при соединении субстанций происходит их взаимодействие, но в настоящий стандарт такие супрамолекулярные взаимодействия на уровне субстанций намеренно не включены в силу их изменчивой природы и активности. В настоящем стандарте предусмотрена также возможность использования множественных терминов, относящихся к данной субстанции, и многообразной справочной информации, которая может использоваться для классификации субстанций или описания связей между субстанциями.
В дополнение к описанию уровня субстанций в настоящем стандарте предусмотрены также элементы данных, описывающие дополнительную информацию о субстанциях, например, качество, производитель, спецификации производственных процессов, а также информацию о субстанциях, которые часто комбинируются при продаже, но, строго говоря, не образуют одно лекарственное средство. При описании уровня контролируемых субстанций используются четыре группы элементов, предусматривающих информацию, существенную для описания и отслеживания субстанций в лекарственных средствах.
Для различных целей и разных условий предметной области разработки фармацевтических стандартов и стандартов контроля обращения лекарственных средств используется большое число терминов, описывающих базовые понятия. Информационные модели, приведенные в настоящем стандарте, описывают элементы данных и их отношения, которые необходимы для идентификации субстанций. Термины и определения, приведенные в настоящем стандарте, представляют понятия, предназначенные для уникальной идентификации субстанций, описания их свойств и передачи информации о субстанциях, входящих в состав лекарственных средств.
Термины и определения, принятые в настоящем стандарте, предназначены для облегчения интерпретации и применения юридических и нормативных требований, но они не должны превалировать над юридически обязывающими документами. В случае сомнения или потенциального конфликта должны применяться термины и определения, принятые в юридически обязывающих документах.
1 Область применения
В настоящем стандарте представлена информационная модель, предназначенная для идентификации и описания субстанций, входящих в состав лекарственных средств или используемых для медицинских целей, включая биоактивные добавки, пищу и косметику. В нем используются другие релевантные стандарты и внешние терминологические ресурсы.
2 Термины, определения и сокращения
2.1 Термины и определения
Для целей настоящего стандарта используются следующие термины и определения.
2.1.1 активный маркер (active marker): Компонент или группа компонентов растительной субстанции, растительного препарата или лекарственного средства, представляющие интерес для целей контроля и обычно содействующие терапевтической активности.
Примечание - Активные маркеры не эквиваленты аналитическим или индикаторным маркерам, используемым исключительно для идентификации или целей контроля.
2.1.2 аналитические данные (analytical data): Совокупность элементов, описывающих методы и референтные материалы, используемые для определения чистоты или активности субстанции либо для ее идентификации.
Примеры - Раствор для инъекций, таблетка для приема внутрь, твердая капсула с порошком для ингаляции.
2.1.3 химическая связь (chemical bond): Взаимодействие двух или более атомов, приводящее к появлению устойчивого дискретного молекулярного образования.
2.1.4 химическая субстанция (chemical substance): Тип субстанции, которая может быть описана как стехиометрическое или нестехиометрическое единое молекулярное образование и не является ни протеином, ни нуклеиновой кислотой.
Примечание - В качестве химических субстанций обычно рассматриваются "малые" молекулы, которые могут образовывать соли, растворяться или диссоциировать на ионы и могут быть описаны с помощью простой определяющей или представляющей структуры.
2.1.5 хиральная субстанция (chiral substance): Субстанция, чья молекулярная структура не совмещается с ее зеркальным отображением.
2.1.6 компонент (component): Целевая составляющая контролируемой субстанции.
Пример - Диметикон и двуокись кремния являются компонентами симетикона. Инсулин-протамин человеческий и цинк являются компонентами инсулин-изофана человеческого.
Примечание - Компоненты используются для описания субстанций и контролируемых субстанций, которые образуют материал, состоящий из нескольких субстанций.
2.1.7 стехиометрическое уравнение (composition stoichiometry): Количественное соотношение между химическими элементами или частями, образующими субстанцию.
Пример - Натрия фосфат гептагидрат двухосновный и натрия фосфат дигидрат двухосновный являются разными субстанциями.
2.1.8 составляющая (constituent): Субстанция, присутствующая в контролируемой субстанции.
Примечание - Составляющими могут быть загрязнения, ингибиторы, активные или индикаторные маркеры, а также отдельные субстанции, смешиваемые для образования лекарственного средства. Образующие должны выполнять определенную роль и иметь определенное количество. Для описания компонентов, а также предельных значений загрязнений или сопутствующих субстанций должны использоваться спецификации образующих.
2.1.9 нормативный словарь (controlled vocabulary): Конечное множество допустимых значений элемента данных.
Примечания
1 Допустимыми значениями могут быть коды, текст или числа.
2 Определение адаптировано из документа CDISC Clinical Research Glossary V8.0, 2009.
2.1.10 сополимер (copolymer): Полимер, состоящий из нескольких типов повторяющихся ковалентно связанных структурных звеньев.
Примечание - Сополимеры образуются с помощью сополимеризации или последовательной полимеризации двух или более мономеров. Сополимеры могут быть нерегулярными, регулярными, блок-полимерами или привитыми полимерами.
2.1.11 критический шаг процесса (critical process step): Шаг производственного процесса, необходимый для получения контролируемой субстанции.
2.1.12 степень полимеризации (degree of polymerization): Число повторяющихся структурных единиц в полимерном блоке или звене.
Примечание - Этот термин применяется как к гомополимерам, так и блочным сополимерам, где означает степень полимеризации блока.
2.1.13 разное происхождение (diverse origin): Субстанции, которые совместно не выделялись или не являются результатом одного и того же процесса химического синтеза.
Примечание - Вещество, содержащее несколько субстанций, идентифицируется как смешанная субстанция или многокомпонентная контролируемая субстанция (группы 1), основанная на происхождении. Две субстанции, соединенные вместе и не претерпевшие химической реакции, вызывающей возникновение или разрыв специфичных химических связей, должны определяться как отдельные субстанции, даже если они взаимодействовали иным образом, не влияющим на химические связи.
2.1.14 энхансер (enhancer): Регуляторная последовательность нуклеотидов, увеличивающая использование некоторых эукариотических промоторов и способная функционировать в любой ориентации и в любом месте (выше или ниже) по отношению к промотору.
2.1.15 фракция (fraction): Отдельная часть вещества, выделенная из сложного раствора, состав которой отличается от исходного вещества.
Примечание - Это понятие используется для описания исходного вещества и является рекурсивным, то есть следующая фракция может быть выделена из предшествующей фракции, что предполагает определенный порядок перечисления.
Пример - Иммуноглобулины сыворотки крови в поликлональном IgG служат примером рекурсивного фракционирования.
2.1.16 ген (gene): Базовая единица наследственного фактора, которая кодирует первичную структуру белка (белковой субъединицы) и управляет его экспрессией.
2.1.17 элемент гена (gene element): Отдельный элемент гена, например, промотор, энхансер, сайленсер, кодирующая последовательность.
2.1.18 гликозилирование (glycosylation): Ферментативный процесс, связывающий сахариды или олигосахариды с белками, липидами или другими органическими молекулами.
2.1.19 тип гликозилирования (glycosylation type): Значительные отличия гликозилирования в разных типах организмов.
Примечание - Это понятие используется для описания различия гликозилирования у разных типов организмов, например, у человека, млекопитающих, птиц.
2.1.20 качество (grade): Совокупность спецификаций, указывающих качество контролируемой субстанции.
2.1.21 гомополимер (homopolimer): Полимер, состоящий из одинаковых структурных единиц.
2.1.22 изотоп (isotope): Разновидности химического элемента, отличающиеся молекулярной массой.
Примечание - Радионуклиды или нуклиды, у которых относительная атомная масса отличается от природной, показаны в структурном представлении с массовым числом. Изотопы, широко распространенные в природе, представлены символом элемента без массового числа.
Пример - означает атом углерода с атомной массой 13.
2.1.23 производственный процесс (manufacturing): Все стадии изготовления субстанции или лекарственного средства, начиная с получения исходных материалов.
Примечание - В производственный процесс включаются критический процесс, подготовка и обработка материалов, а также критические параметры производства.
2.1.24 вещество (material): Любая сущность, имеющая массу, занимающая определенное пространство и состоящая из одной или нескольких субстанций.
2.1.25 лекарственное средство (medicinal product): Вещество или комбинации веществ, применяемые к организму человека (или животного) для лечения и профилактики заболеваний с целью диагностики или восстановления, коррекции или изменения физиологических функций.
Примечания
1 Лекарственное средство может содержать один или несколько произведенных продуктов и один или несколько лекарственных препаратов.
2 В некоторых юрисдикциях лекарственное средство может быть определено как любое вещество или комбинация веществ, используемых для постановки диагноза.
2.1.26 микрогетерогенность (microheterogeneity): Совместно выделенные субстанции, имеющие незначительные отличия при гликозилировании или посттрансляционной модификации, например, гетерогенность гликозилирования или последовательности.
Примечания
1 Микрогетерогенность не является определяющей характеристикой ни для субстанций, ни для контролируемых субстанций.
2 Микрогетерогенность обусловлена вариабельностью типа гликозилирования (двухантенный, трехантенный), степенью гликозилирования в данном месте (заполнение), гетерогенностью последовательностей вследствие полиморфизма исходного вещества, ошибками трансляции, вариабельностью протеолиза и другими причинами.
2.1.27 смешанная субстанция (mixture substance): Тип полидисперсного вещества, представляющего собой комбинацию простых субстанций, совместно выделенных или полученных в результате одного и того же процесса синтеза.
Примечание - Простые субстанции разного происхождения, соединенные вместе и не претерпевшие химической реакции вследствие этого соединения должны определяться как многокомпонентные вещества (контролируемые субстанции группы 1), а не как смешанные субстанции.
Пример - Гентамицин является смешанной субстанцией, состоящей из гентомицина С1А, гентомицина С1 и гентомицина С2. Моноэфир глицерила является смешанной субстанцией, состоящей из двух простых субстанций, отличающихся положением этерификации. Симетикон, состоящий из диметикона и двуокиси кремния, не считается смешанной субстанцией, поскольку представляет собой два разных вещества, соединенных для получения препарата.
2.1.28 составная часть (moiety): Составная часть субстанции, имеющая полную и непрерывную молекулярную структуру.
Пример - Активность лекарственного средства нередко определяется с помощью сравнения с тем, что называется активной составляющей, которая должна определяться согласованным способом для всех средств. Во избежание неоднозначности в качестве составляющих, по которым определяется активность, следует использовать свободные кислоты и свободные основания.
Примечание - В настоящем стандарте понятие составляющей используется в контексте нестехиометрических химических субстанций и в модификации нуклеиновых кислот, белков, полимеров и структурно-разнородных субстанций. В качестве составляющих должны быть указаны простые субстанции, ионы или молекулы растворителей.
2.1.29 молекулярный фрагмент (molecular fragment): Часть молекулы, имеющая одно или несколько мест соединения с другими фрагментами или составляющими.
Примечание - Понятие молекулярного фрагмента используется при описании полимеров для представления их звеньев и при описании модификаций структуры субстанций.
2.1.30 молекулярная структура (molecular structure): Однозначное представление взаимного расположения атомов.
Примечания
1 Для целей идентификации субстанций сведения о трехмерной конформации не принимаются во внимание. Сведения об отдельных конформациях или конформерах субстанций могут приниматься во внимание или в общем смысле для белков (например, денатурированных), или в случае, когда данное вращение вокруг единственной связи ограничено таким образом, что два разных конформера отделяемы друг от друга и взаимно не преобразуются при комнатной температуре.
2 Представление структуры обычно должно допускать преобразование в графический формат.
2.1.31 молекулярный вес (molecular weight): Масса молекулы однородной субстанции или средняя масса молекул гетерогенной субстанции.
Примечания
1 Единицей молекулярного веса является унифицированная единица атомной массы. Тип молекулярного веса обязательно должен быть указан.
2 При описании полимеров используется несколько разных типов молекулярного веса (средневзвешенный, среднечисловой и т.д.).
2.1.32 многокомпонентное вещество (multi-substance material): Несколько субстанций или контролируемых субстанций разного происхождения, используемые для получения лекарственного средства.
Пример - Многокомпонентными ингредиентами являются инсулин-изофан человеческий, симетикон, алюминиевый лак, никотиновый полакрилекс, натрий-фосфатный буфер.
Примечание - Многокомпонентные вещества являются контролируемыми субстанциями группы 1. Любое лекарственное средство, используемое для изготовления другого лекарственного средства, должно рассматриваться как многокомпонентное вещество.
2.1.33 нуклеиновая кислота (nucleic acid substance): Тип субстанции, представляющей собой линейную последовательность нуклеозидов, обычно связанных между собой эфирами фосфатов.
Примечание - Указывается также тип нуклеиновой кислоты (РНК, ДНК). Олигонуклеотиды и элементы генов (например, промоторы, энхансеры, кодирующие последовательности и сайленсеры) также относятся к нуклеиновым кислотам.
2.1.34 официальное наименование (official name): Наименование, присвоенное официальным уполномоченным органом.
2.1.35 родительский организм (parent organism): Организм, от которого взят исходный биологический материал.
2.1.36 часть (part): Анатомическое происхождение и локализация исходного материала в организме.
2.1.37 лекарственный препарат (pharmaceutical product): Качественная и количественная композиция лекарственного средства в дозированной форме, предназначенная для применения и содержащая информацию о ее государственной регистрации.
Примечания
1 Лекарственное средство может содержать один или несколько препаратов.
2 Во многих случаях лекарственный препарат идентичен произведенному продукту. Однако есть примеры, когда произведенный продукт претерпевает преобразование до применения к пациенту (в качестве лекарственного препарата) и тогда он не тождественен лекарственному препарату.
2.1.38 физическая форма (physical form): Физическое состояние (газ, жидкость или твердое вещество) и тип организации (для твердого вещества).
Примечание - Твердое вещество может быть кристаллическим или аморфным. Может быть также указан полиморфизм.
2.1.39 полидисперсная субстанция (polydisperse substance): Субстанция, содержащая множественные связанные молекулярные компоненты.
Примечание - К полидисперсным субстанциям относятся полимеры и структурно-разнородные вещества, выделенные из одного источника. Химические субстанции, белки и нуклеиновые кислоты с определенными последовательностями к полидисперсным субстанциям не принадлежат.
2.1.40 полидисперсность (polydispersity): Мера разброса молекулярных масс в полимере.
Примечание - Индекс полидисперсности полимера обычно вычисляется как отношение средневзвешенного молекулярного веса к среднечисловому молекулярному весу.
2.1.41 полимер (polymer substance): Тип полидисперсной субстанции, содержащей повторяющиеся структурные единицы, соединенные ковалентными связями.
Примечание - Монодисперсные белки и нуклеиновые кислоты с определенными последовательностями не должны идентифицироваться с помощью элементов данных, описывающих полимеры.
2.1.42 посттрансляционная модификация (post-translational modification): Модификация белка, которая обычно происходит в живом организме во время или после трансляции.
Примечание - Посттрансляционная модификация обычно описывается с помощью структурного представления, а не как модификация белка.
2.1.43 обрабатываемый материал (processing material): Тип вещества, существенного для производственного процесса, но не содержащийся в результирующем веществе.
2.1.44 белковая субстанция (protein substance): Тип субстанции, состоящей из определенной последовательности альфа-аминокислот, соединенных пептидными связями.
Примечание - Синтетические пептиды и белки с определенными последовательностями, рекомбинантные белки и белки высокой чистоты, выделенные из биологических сред, рассматриваются как белковые субстанции. Будучи известными, места гликозилирования, дисульфидные связи и тип гликозилирования (например, грибковый, растительный, у членистоногих, птичий, у млекопитающих, у человека) являются определяющими элементами описания белковых субстанций. В описание всех пептидов, состоящих не более чем из 15 аминокислотных остатков, включается графическое представление их структуры.
2.1.45 белковая последовательность (protein sequence): Порядок и идентичность аминокислот в белковой субъединице.
Примечание - Белковые последовательности представляются однобуквенными кодами Дейхофф от W до C.
2.1.46 белковая субъединица (protein sub-unit): Линейная последовательность аминокислотных остатков, соединенных пептидными связями.
Примечание - Должна собираться информация о повторяющихся субъединицах белков.
Пример - Моноклональные антитела обычно состоят из четырех субъединиц.
2.1.47 результирующий материал (resultant material): Вещество, являющееся результатом критического процесса.
Примечание - Результирующий материал может быть начальным материалом для следующего процесса, конечным материалом или фактической контролируемой субстанцией.
2.1.48 соль (salt): Ионная субстанция, являющаяся продуктом нейтрализации кислоты основанием.
Примечание - Соли являются сложными ионными веществами, состоящими из катионов (положительных ионов) и анионов (отрицательных ионов).
2.1.49 сайленсер (silencer): Последовательность ДНК, подавляющая транскрипцию.
2.1.50 простая субстанция (single substance): Субстанция, которая может быть описана с помощью простого представления или набора описательных элементов.
Примечания
1 Простая субстанция может быть описана, используя один или более элементов следующих пяти типов: химическая субстанция, белок, нуклеиновая кислота, полимер и структурно-разнородная субстанция.
2 Рацематы и субстанции с неизвестной, эпимерной или смешанной хиральностью могут быть причислены к простым субстанциям, поскольку они могут иметь простое структурное представление и стереохимическое описание в форме текста.
2.1.51 сольват (solvate): Субстанция, образуемая путем соединения молекулы растворителя (например, воды или алкоголя) с другой составляющей.
Примечание - Сольваты могут быть как стехиометрическими, так и нестехиометрическими и преимущественно описываются, когда субстанции существуют в твердой форме.
2.1.52 исходный материал (source material): Вещество, из которого получена субстанция. Классифицируется, используя таксономию и анатомическую локализацию.
Примечание - Этот класс используется для описания структурно-разнородных субстанций и полимеров, выделяемых из биологических сред.
2.1.53 контролируемая субстанция (specified substance): Группа элементов, которые описывают многокомпонентное вещество и указывают дополнительную информацию о субстанциях и многокомпонентных материалах, существенную для описания лекарственных средств.
Пример - Дополнительными элементами описания могут служить качество, единицы измерения, физическая форма, компоненты, производитель, критические этапы производственного процесса (к примеру, экстракция, процессы синтеза и рекомбинации), спецификации и аналитические методы, используемые для определения соответствия спецификациям.
Примечание - Для описания контролируемой субстанции могут использоваться четыре различные группы элементов, между которыми существуют определенные отношения.
2.1.54 начальный материал (starting material): Тип вещества, модифицируемого в производственном процессе.
2.1.55 стехиометрическая (stoichiometric): Субстанция, составляющие элементы которой имеют простые целые соотношения.
Примечания
1 Определенная композиционная стехиометрия должна быть представлена в структурном представлении данной субстанции. Чтобы избежать дробных отношений, составляющие элементы должны быть представлены, используя наименьшие общие множители. Субстанции могут быть описаны как стехиометрические или нестехио-метрические.
2 Химические вещества имеют определенную композиционную стехиометрию, если отношения всех составляющих элементов (ионов, противоположных ионов и сольватов) могут быть представлены целыми числами.
2.1.56 стереохимия (stereochemistry): Относительное пространственное расположение атомов в молекулах.
2.1.57 структурно-разнородная субстанция (structurally diverse substance): Тип полидисперсной субстанции, выделенной из одного источника и представляющей собой сложную смесь, которая не может быть описана как смесь ограниченного числа простых субстанций.
Примечание - В описание структурно-разнородных субстанций включаются сведения о неизменных свойствах данного вещества. Модификации, необратимо изменяющие структуру вещества, различные физические свойства или компоненты, вводимые в вещество, например, ген в генно-терапевтических субстанциях, являются определяющими элементами описания структурно-разнородных субстанций. Фракции, выделенные из исходного вещества (масел или соков), также должны быть включены в описание. Белковые смеси, содержащие большое число разных последовательностей, например, поликлональные иммуноглобулины, относятся к структурно-разнородным субстанциям.
2.1.58 субстанция (substance): Любое вещество биологического, минерального или химического происхождения, способное к отдельному существованию и имеющее определенный состав.
Примечания
1 Субстанции могут быть простыми, смешанными или принадлежать к одной из групп контролируемых субстанций. Простые субстанции описываются с помощью минимально достаточного набора данных и делятся на пять типов: химические, белки, нуклеиновые кислоты, полимеры и структурно-разнородные субстанции. Субстанция может представлять собой соль, сольват, свободную кислоту, свободное основание, смесь связанных компонентов, которые совместно выделены или синтезированы. По возможности должны использоваться терминология и определяющие характеристики из фармакопейных статей. Определяющие элементы зависят от типа субстанции.
2 Отдельное существование означает способность субстанции существовать отдельно от любой другой субстанции. Субстанции могут представлять собой хорошо определенные вещества, имеющие определенную химическую структуру, синтетические вещества (например, смеси изомеров), встречающиеся в природе смеси химических веществ, имеющих определенные молекулярные структуры (например, конъюгаты эстрогенов), вещества, произведенные из растений, животных, микроорганизмов или неорганического вещества, химическая структура которых может быть неизвестной или трудно определяемой. Субстанция может представлять собой соль, сольват, свободную кислоту, свободное основание, смесь связанных компонентов, которые совместно выделены или синтезированы.
2.1.59 заместитель (substituent): Молекулярный фрагмент, присоединенный к повторяющейся структурной единице полимера, обычно замещающий атом водорода.
Примечание - Эта информация включается в описание повторяющейся структурной единицы, если замещаемое положение полностью занято. Если оно занято не полностью, то количество заместителя описывается как фрагмент или составляющий элемент структурной модификации.
2.1.60 таутомер (tautomer): Молекулярная структура, способная к обратимому превращению в изомерную молекулярную структуру, обычно включающему в себя свободную миграцию протона между двумя смежными атомами.
Примечание - Предполагается, что с каждой субстанцией будет связана одна таутомерная форма и в руководстве по реализации стандарта будут приведены детальные правила, указывающие таутомерную форму, связанную с каждой химической субстанцией. Если отдельные изомеры могут быть выделены в нормальных условиях и при этом будет известно, что они имеют разные молекулярные свойства, то они должны рассматриваться как разные субстанции.
2.1.61 таксономия (taxonomy): Научная классификация организмов, необходимая для описания источника исходного материала субстанций, выделяемых из биологических сред.
Примечание - Для всех полидисперсных субстанций, выделяемых из биологических сред, должна быть указана таксономическая информация на уровне вида, если такая информация доступна и исходный материал произведен из одного вида организмов. Для идентификации организма-источника необходимо указать таксономическое семейство, род и вид, а также автора таксона. По возможности должны быть указаны также царство, тип, класс и порядок. Промежуточная информация (например, подвид, вариант, штамм) указываются, если соответствующие формы проявляют заметные различия или в составе вещества, или в функции.
2.2 Сокращения
2.2.1 ACS - Американское химическое общество (American Chemical Society)
2.2.2 Номер ASK - Идентификатор фармацевтической субстанции в Германском каталоге Arzneistoffkatalog
2.2.3 BAN - Британское зарегистрированное наименование (British Approved Name)
2.2.4 DCF - Французское зарегистрированное наименование (![]() Communes
Communes ![]() )
)
2.2.5 ЕР - Европейская фармакопея (European Pharmacopeia)
2.2.6 INCI - Международная номенклатура косметических ингредиентов (International Nomenclature of Cosmetic Ingredients)
2.2.7 INN - Международное непатентованное наименование, MHH (International Non-proprietary Name). Известны также аббревиатуры rINN - рекомендованное международное непатентованное наименование (recommended International Non-proprietary Name) и pINN - предложенное международное непатентованное наименование (proposed International Non-proprietary Name)
2.2.8 JAN - Японское зарегистрированное наименование (Japanese Approved Name)
2.2.9 JP - Японская фармакопея (Japanese Pharmacopoeia)
2.2.10 UCUM - Унифицированные коды единиц измерения (Unified Code for Units of Measure)
2.2.11 USAN - Наименование, зарегистрированное в США (United States Adopted Name)
2.2.12 USP - Фармакопея США (United States Pharmacopeia)
3 Требования
3.1 Общие положения
Структурирование описания субстанций и контролируемых субстанций должно быть согласовано с элементами данных и отношениями, представленными на диаграммах, приведенных в настоящем разделе. Дальнейшее уточнение этих элементов и отношений может быть проведено в руководстве по реализации стандарта.
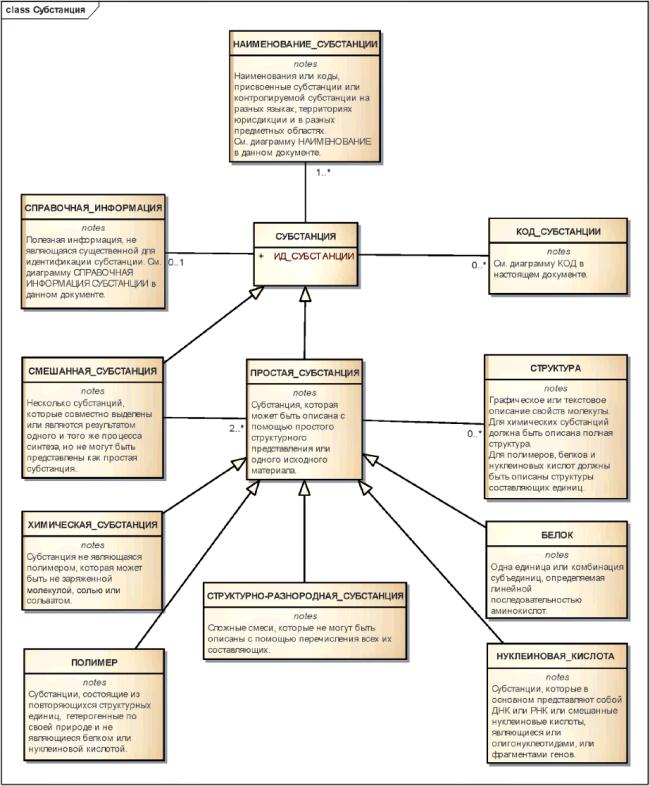
3.2 Понятия, требуемые для уникальной идентификации и описания субстанций
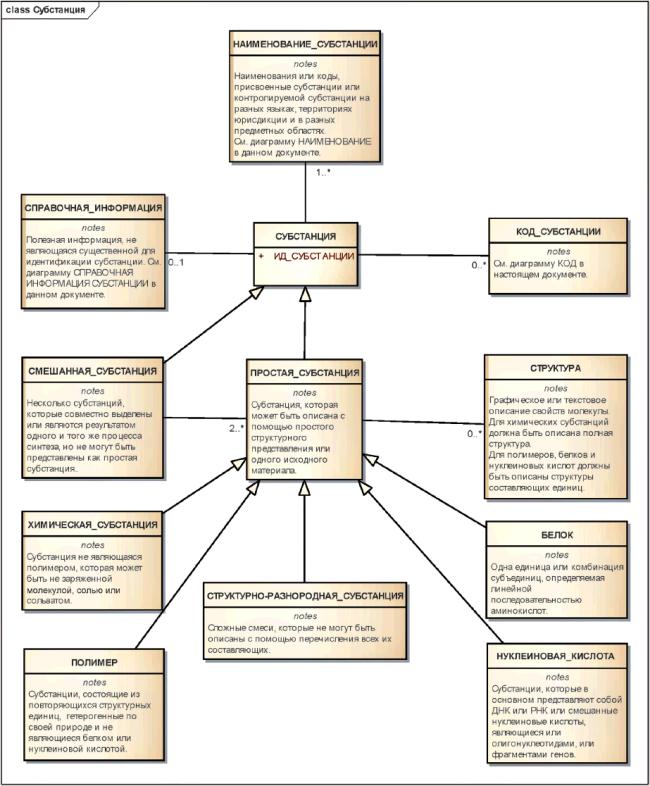
К субстанциям относятся простые, смешанные и контролируемые субстанции.
Примечание - Используемый ниже термин "субстанция" обычно означает простую или смешанную субстанцию. Термин "контролируемая субстанция" обычно относится к субстанции, для которой предоставлено более детальное описание, включающее в себя информацию о производстве, спецификациях, физической форме и многокомпонентных материалах, являющихся компонентами формулы лекарственного средства.
В настоящем стандарте даются определения понятий, необходимых для уникальной идентификации фармацевтических субстанций на международном уровне, когда она необходима.
Такая идентификация должна быть основана на следующих принципах:
a) определение субстанции должно быть основано на том, каким веществом они являются, а не на способе применения или производства;
b) для идентификации субстанции должны использоваться неизменные свойства, не зависящие от физической формы, качества или степени чистоты;
c) субстанциями могут быть простые молекулярные соединения, выделенные или синтезированные совместно;
d) во избежание неоднозначности и для упрощения реализации смешанная субстанция должна определяться как комбинация простых субстанций;
e) в качестве субстанций не должны рассматриваться разнородные вещества, соединенные вместе для получения лекарственного средства или многокомпонентного материала.
Пример - Симетикон не должен быть причислен к субстанциям, поскольку оно состоит из диметикона и двуокиси кремния, имеющих разное происхождение и обычно не выделяемых совместно.
Сложные вещества, выделяемые из биологических сред, и смеси, которые не могут быть определены или представлены как ограниченное число химических структур, определяются на основе таксономии источника, либо на основе части и фракции. Вещества, имеющие неопределенную композиционную стехиометрию и подвергающиеся взаимодействию неопределенного характера, не должны рассматриваться как субстанции.
Примечание - Ввиду сложности определения степени, активности и композиционной стехиометрии не ковалентных взаимодействий, при определении субстанций такие типы взаимодействий не принимаются во внимание. Единственными исключениями служат ионные (соли) и сольватные (гидраты) взаимодействия простых химических соединений и хорошо определенных полимеров. Вещества, составляющие которых взаимодействуют с полимерами, комплексные среды или циклодекстрины обычно не рассматриваются как субстанции. Простые соли полимеров, например, полистирен сульфонат натрия, должны рассматриваться как простые субстанции.
Пример - Никотиновый полакрилекс рассматривается как две разных субстанции: никотин и полакрилекс. Инсулин-изофан человеческий также рассматривается как две разных субстанции: протамин и человеческий инсулин. Однако никотиновый полакрилекс и инсулин-изофан человеческий могут рассматриваться как простые контролируемые субстанции. Липосомальный доксорубицин может рассматриваться как контролируемая субстанция, содержащая доксорубицин и компоненты липосом.
Субстанции могут быть описаны, используя один или более элементов следующих групп:
- химическая субстанция,
- белок,
- нуклеиновая кислота,
- полимер,
- структурно-разнородная субстанция,
- смесь.
Для всех типов субстанций должна иметься возможность указать официальные наименования, синонимы, изотопную и другую справочную информацию.
Рисунок 1 - Высокоуровневая информационная модель субстанции
|
Рисунок 1 - Высокоуровневая информационная модель субстанции
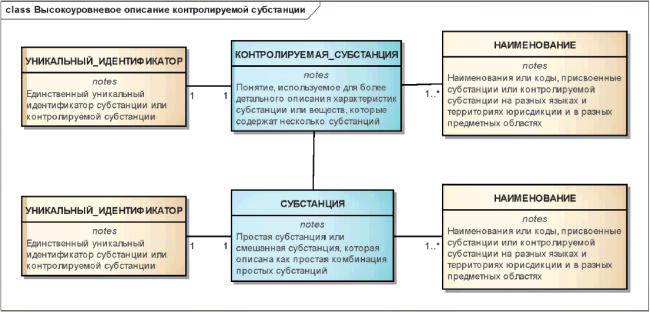
3.3 Понятия, требуемые для описания контролируемых субстанций
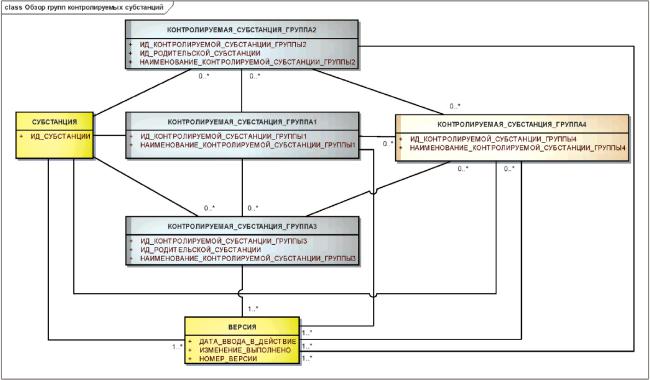
Информация о контролируемых субстанциях должна включать в себя дополнительную информацию о субстанциях и многокомпонентных веществах. При описании контролируемой субстанции должны быть указаны более детальные характеристики простой субстанции или композиции вещества, содержащего несколько субстанций или несколько физических форм.
Для упрощения реализации элементы, необходимые для описания контролируемых субстанций, должны быть подразделены на четыре группы.
Эти группы определены следующим образом:
- Группа 1: составляющие (включая компоненты вещества, содержащего несколько субстанций, маркеры и растворители, используемые для изготовления растительных или аллергенных экстрактов), физическая форма субстанции, а также любые свойства, существенные для описания контролируемой субстанции (например, размер липосомных препаратов);
- Группа 2: ограниченные сведения о производстве, родительской субстанции или контролируемой субстанции группы 1, производитель, высокоуровневая классификация метода производства, общая характеристика производственного процесса (например, синтез, экстракция, восстановление), тип производимой системы (например, клеточная линия, растительная или животная ткань), производимая система (конкретная клеточная линия);
- Группа 3: родительская субстанция или контролируемая субстанция группы 1, качество вещества, а также источник, регламентирующий данное качество (фармакопея, технические условия);
- Группа 4: детальная информация о производственном процессе, составляющие (примеси и очистители, не указанные в информации группы 1), спецификации.
Отношения между элементами описания контролируемых субстанций показаны на рисунке 2.
Рисунок 2 - Высокоуровневая информационная модель контролируемой субстанции
|
Рисунок 2 - Высокоуровневая информационная модель контролируемой субстанции
3.4 Наименование субстанций
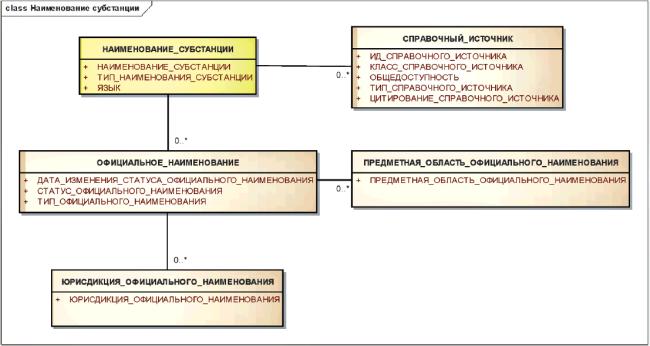
Для каждой субстанции должно быть указано хотя бы одно наименование или фирменный код.
Если наименование является официальным, то должен быть указан уполномоченный орган, присвоивший наименование, язык и территория юрисдикции, где это наименование используется.
Настоящий стандарт должен быть нейтральным по отношению к любой систематизации или официальной номенклатуре.
Примечание - Предполагается, что каждая субстанция будет иметь наименование на английском языке. У этого наименования могут быть синонимы. Переводы английских наименований на другие языки также могут быть предусмотрены в настоящем стандарте. Языки и территории юрисдикции должны быть указаны в соответствии со стандартами ИСО.
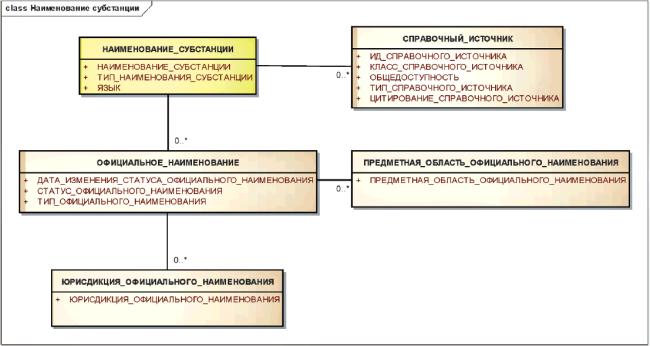
Информационная модель класса "Наименование субстанции" показана на рисунке 3.
Рисунок 3 - Информационная модель наименований субстанции
|
Рисунок 3 - Информационная модель наименований субстанции
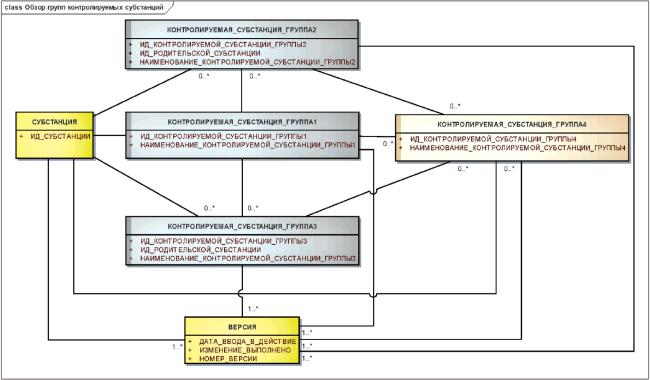
3.5 Требования к уникальным идентификаторам
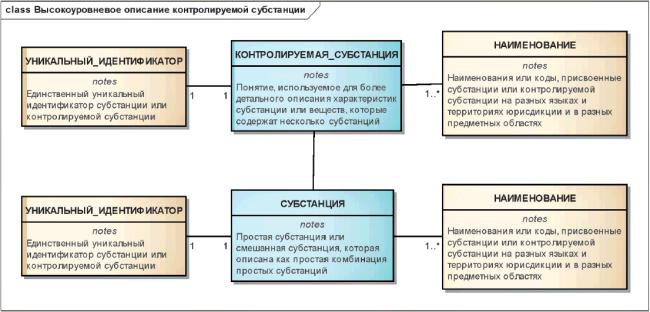
Каждой субстанции и контролируемой субстанции должен быть присвоен единственный уникальный идентификатор, постоянно с ней связанный и не являющийся порядковым номером.
Уникальный идентификатор должен быть не смысловым, случайным, иметь фиксированную длину и встроенные контрольные цифры.
Уникальные идентификаторы должны быть общедоступными и использоваться без авторских отчислений.
Уникальные идентификаторы должны быть присвоены зарегистрированным и исследуемым субстанциям, наполнителям и загрязнениям, сольватам, ионам, фрагментам и составляющим элементам.
Примечание - Разработано большое число химических и биологических номенклатур, описывающих фармакологическое действие лекарств. Функциональные системы именования, например, МНН или USAN, имеют значительную ценность для описания как молекулярной структуры, так и биологического действия субстанции. Однако присвоение уникальных идентификаторов на основе использования таких систем классификации может привести к увеличению требований к их сопровождению, поскольку применение систем классификации нередко требует широкой экспертизы и разработки контролируемых словарей. К тому же перевод любой семантической системы на другой язык всегда представляет значительную проблему.
Когда субстанция описана и ей присвоен уникальный идентификатор, важно обеспечить его постоянную связь с данной субстанцией. Субстанция должна иметь только один уникальный идентификатор. Отсюда вытекает необходимость разработки детальных правил описания субстанций, которые должны быть представлены в руководстве по реализации стандарта.
Примечание - Основной целью уникального идентификатора является его использование при электронной обработке данных. Применение идентификатора фиксированной длины с встроенными контрольными цифрами облегчит его обработку и поможет идентифицировать ошибки ввода, которые могут возникать в системах обработки данных.
Информационная модель, описывающая отношения между наименованиями, уникальными идентификаторами, информацией о субстанции и контролируемой субстанции показана на рисунке 4.
Рисунок 4 - Информационная модель описания субстанции, контролируемой субстанции, наименований и идентификаторов
|
Рисунок 4 - Информационная модель описания субстанции, контролируемой субстанции, наименований и идентификаторов
3.6 Типы субстанций
3.6.1 Общие положения
Если субстанцию можно описать и как простую субстанцию, и как смешанную субстанцию, то она должна быть описана как простая субстанция.
Примечание - Рацемические субстанции будут отнесены к простым субстанциям, поскольку они могут быть описаны с помощью простого структурного представления и отличаются от хиральных субстанций.
3.6.2 Наборы элементов, общие для разных типов субстанций
3.6.2.1 Структура
Описание структуры должно содержать достаточный объем графической и текстовой информации, указывающей атомы, их связи, а также композиционное отношение составляющих частей.
Структурные представления должны описывать полную молекулярную структуру с указанием всех известных стереохимических характеристик. Для описания молекулярных фрагментов и составляющих частей также должны использоваться структурные представления.
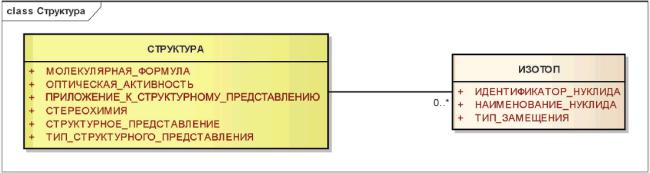
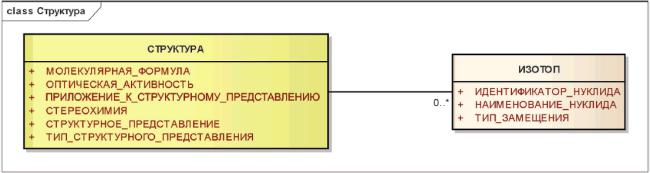
3.6.2.2 Изотоп
Радионуклиды и другие нуклиды, не присутствующие в природе в достаточном количестве, должны быть описаны как изотопы. Описание должно содержать характеристики, использующие контролируемую терминологию, взятую из международно признаваемых справочных источников.
Присутствие изотопов должно быть также указано в структурном представлении.
Радифармацевтические препараты должны идентифицироваться по типу основной субстанции, а не по типу обогащения.
Примечание - Для каждого нуклида должны быть указаны период полураспада, тип и энергия излучения, родительские и дочерние нуклиды.
Пример: ибритумомаб тиуксетан [иттрий-90] должен быть описан как белковая субстанция. Тироксин с йодом-131 должен быть описан как химическая субстанция.
Информационная модель описания структуры и изотопа показана на рисунке 5.
Рисунок 5 - Информационная модель описания структуры и изотопа
|
Рисунок 5 - Информационная модель описания структуры и изотопа
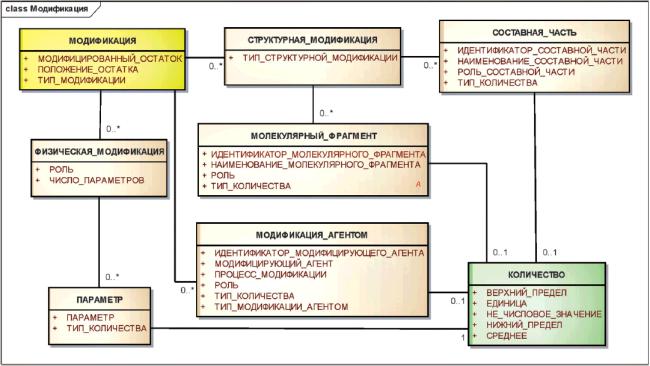
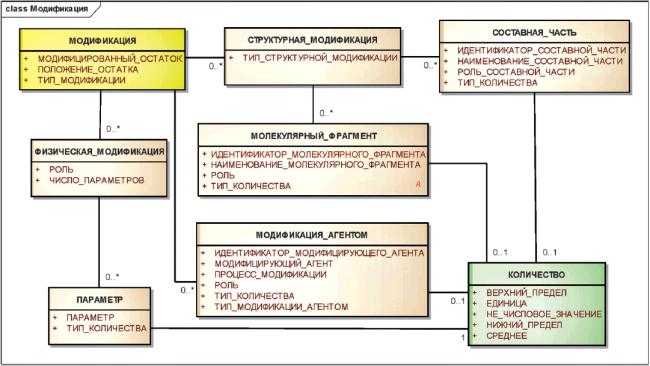
3.6.2.3 Модификация
Необратимые изменения исходной молекулярной структуры субстанции должны быть описаны как модификация предшествующего вещества. Модификация субстанции обычно приводит к новой химической субстанции.
Примечание - Модификации химических субстанций естественным образом отражаются в структурном представлении.
Необратимые изменения исходной структуры полимеров, белков, нуклеиновых кислот и структурно-разнородного вещества должны быть описаны, используя элементы класса "МОДИФИКАЦИЯ". Если происходит модификация окончательной структуры, но фактическое положение замещения неизвестно или меняется, то модификации должны быть описаны как добавление составных частей или молекулярных фрагментов к исходному веществу.
Пример - Модифицирующие процессы, например, термальная обработка, должны быть указаны как модификации. Термально агрегированный альбумин представляет собой субстанцию, отличающуюся от альбумина и альбумина, агрегированного с помощью химических агентов сшивок.
Если модификация окончательной структуры не может быть определена, то должно быть приведено минимальное описание процесса модификации.
Рисунок 6 - Информационная модель описания модификаций
|
Рисунок 6 - Информационная модель описания модификаций
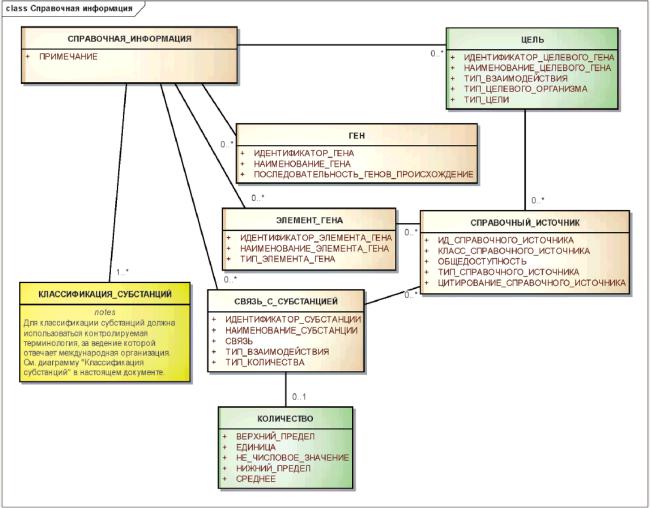
3.6.2.4 Справочная информация
Для каждого типа субстанции должны быть согласованным способом указаны дополнительные типы справочной информации. Такая информация может включать в себя классификацию и целевое назначение активных субстанций.
Настоящий стандарт не содержит указаний по классификации фармакологического действия или определению предполагаемого целевого назначения субстанций или контролируемых субстанций. Он позволяет указывать такую информацию, если она предоставлена или доступна. Эта информация не должна влиять на генерирование нового уникального идентификатора.
Справочная информация должна быть указана для всех типов субстанций и для контролируемых субстанций группы 1.
Примечание - Идентификация генов, от которых произведены белки, информация о целях и коды, взятые из систем кодирования, также представляют собой справочную информацию. В настоящем стандарте предложена согласованная структура, предназначенная для указания такой информации в привязке к субстанции. Особенно важны такие системы классификации, как АТХ ВОЗ, NDF-RT Администрации по делам ветеранов США, которые позволяют кодировать информацию о субстанциях. Информация о целях важна для моноклональных и поликлональных антител и малых молекул, предназначенных для связывания специфичных молекулярных мишеней.
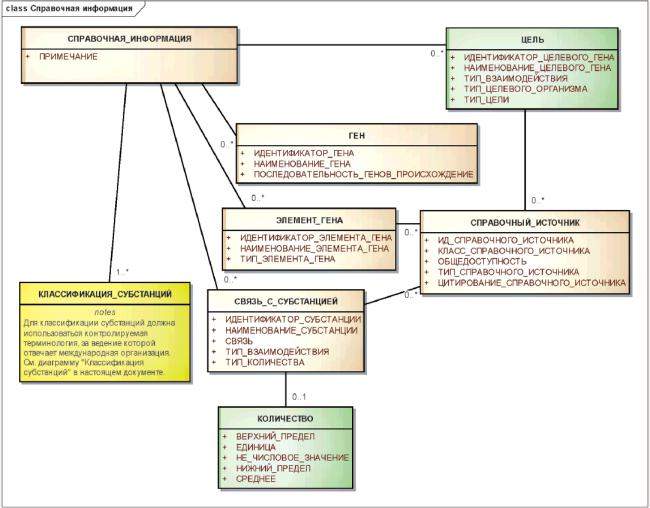
Отношения между элементами справочной информации показаны на рисунке 7.
Рисунок 7 - Информационная модель справочной информации
|
Рисунок 7 - Информационная модель справочной информации
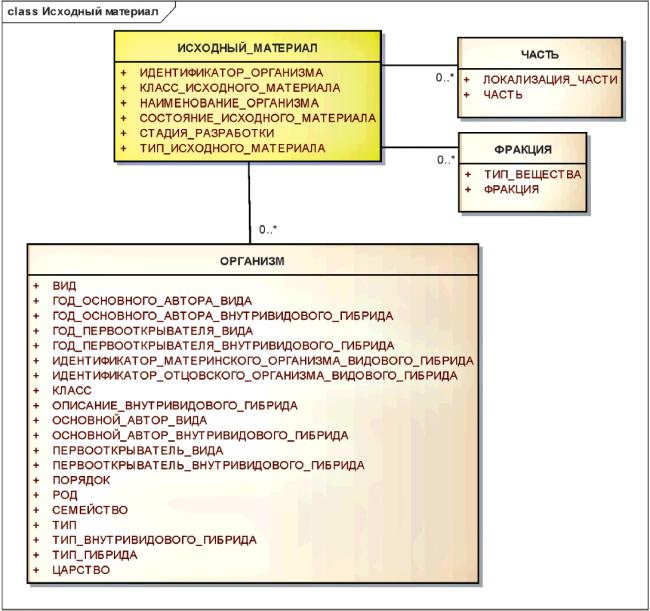
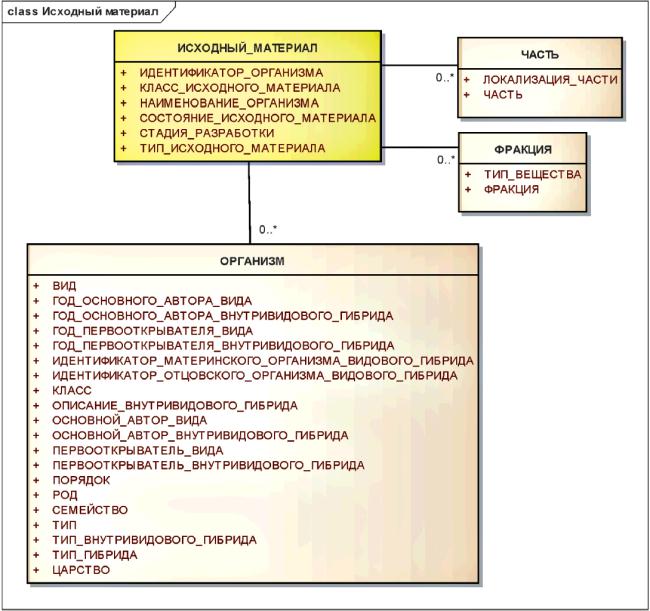
3.6.2.5 Исходный материал
Для исходного материала должна быть описана таксономия и анатомическая локализация, а также фракция вещества, которая может быть получена или модифицирована для производства субстанции. Этот информационный класс должен использоваться для описания структурно-разнородных и полимерных субстанций, выделенных из биологических сред.
При необходимости, используя нормативный словарь, должно быть описано таксономическое и анатомическое происхождение.
Информационная модель для класса исходный материал показана в рисунке 8.
Рисунок 8 - Информационная модель исходного материала
|
Рисунок 8 - Информационная модель исходного материала
3.6.2.6 Таксономия
Таксономическая информация должна быть указана для полимеров и структурно-разнородных веществ, а также для смешанных субстанций, выделенных из биологических сред.
Настоящий стандарт не содержит рекомендаций по генерации или квалификации таксономической информации. Согласованная таксономическая информация должна быть взята из ограниченного числа авторитетных источников.
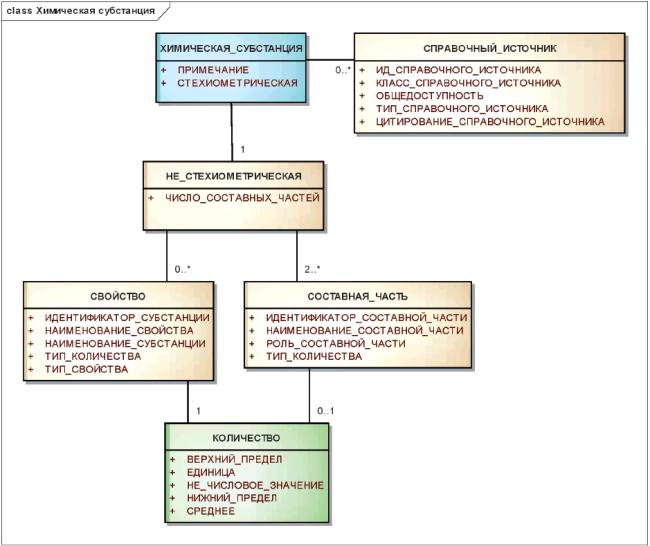
3.6.3 Химические субстанции
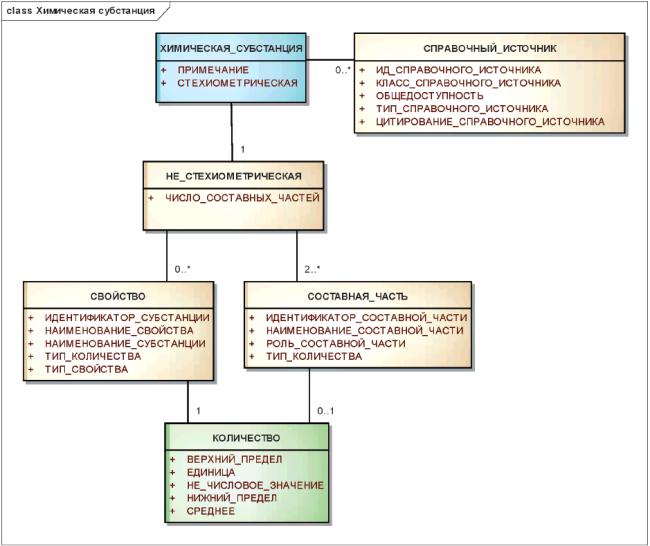
Описание химических субстанций должно включать в себя представление молекулярной структуры, а также, при необходимости, стереохимические и релевантные физические характеристики.
Для каждой химической субстанции должно быть указано простое структурное представление.
Если известна стереохимия, то она должна быть полностью указана. Если она не известна, то должны быть точно идентифицированы положения, для которых стереохимия неизвестна.
Графическое представление структуры должно быть дополнено текстовым описанием атомов и межатомных связей в молекулярной структуре.
Должны быть указаны фиксированные и переменные стехиометрические отношения составных частей субстанции. Для субстанций, составные части которых имеют переменную композиционную стехиометрию, должен быть указан диапазон композиции.
Неизвестная композиционная стехиометрия данной составной части или частей, если таковая имеет место, также должна быть указана. Композиционная стехиометрия должна быть указана как можно полнее, допускается также неизвестная или переменная композиционная стехиометрия.
Физические свойства должны быть указаны только для простых субстанций, имеющих переменную или неизвестную стехиометрию, если с их помощью можно отличить две субстанции друг от друга.
В структурном представлении должны быть описаны изотопы. По возможности должно быть указано положение или положения замещения. Субстанции должны иметь описание, не зависящее от степени изотопного обогащения данным радиоизотопом.
Подобно химическим субстанциям, белковые субстанции (подраздел 3.6.4) и нуклеиновых кислот (подраздел 3.6.5) должны быть описаны как отдельные определенные молекулярные соединения. Микрогетерогенность не должна быть описана вследствие присущей ей вариабельности. Циклические пептиды и те, что в основном произведены из не протеиногенных аминокислот, а также существенно модифицированные олигонуклеотиды должны быть описаны как химические субстанции.
Информационная модель описания химической субстанции показана на рисунке 9.
Рисунок 9 - Информационная модель описания химической субстанции
|
Рисунок 9 - Информационная модель описания химической субстанции
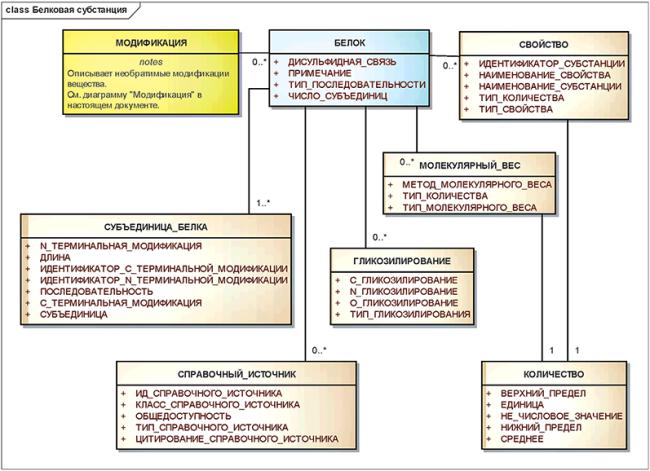
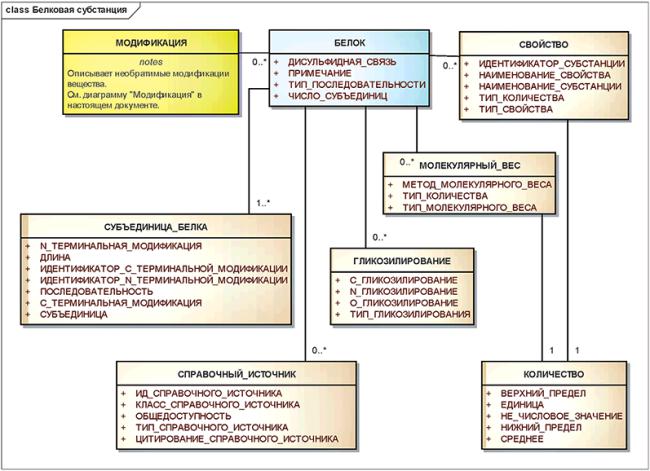
3.6.4 Белковые субстанции
Все субстанции, содержащие определенную последовательность L-альфа-аминокислот, соединенных пептидными связями, должны быть описаны, используя элементы описания белков.
Примечание - Смеси белков, например, иммуноглобулины, имеющие большое число отдельных белков с разными последовательностями, должны быть описаны как структурно-разнородные субстанции.
Белки, у которых отличаются последовательности, тип гликозилирования, дисульфидные связи или положения гликозилирования, должны быть описаны как разные субстанции.
Пример - Интерферон альфа-2а и интерферон альфа-2b, у которых последовательности отличаются одним остатком, должны быть описаны, как отдельные субстанции.
Белки должны состоять из одной или нескольких белковых субъединиц.
Все не гликозилированные белки должны быть описаны независимо от метода синтеза, клеточной линии или биологической среды организма, из которых белок был произведен или выделен.
Белки должны быть описаны без учета микрогетерогенности.
Тип гликозилирования должен отражать существенные различия в гликозилировании и определяться в зависимости от вида клетки или ткани, из которой белок был выделен.
Для описания типа гликозилирования должен использоваться ограниченный набор нормативных терминов.
Белки должны быть описаны как конечная экспрессирующаяся последовательность, прекурсоры белков с сигнальными пептидами и другие прекурсоры белков не должны описываться.
Белки, которые необратимо модифицированы с помощью химического или физического процесса, должны быть описаны как разные белки.
В описаниях модифицированных белков должны быть указаны структурные изменения, произошедшие в результате модификации, если конечная структура известна.
В описаниях модификаций должны быть указаны или составляющие части, или молекулярные фрагменты, присоединяемые к структуре белка. Если же модификация конечной структуры не происходит, то вместо этого должен быть описан процесс модификации.
Молекулярные фрагменты должны иметь функциональную роль, которая должна быть указана с помощью нормативной терминологии.
Для специфичных модификаций должны быть описаны положение и модифицированный остаток.
Пост-трансляционные модификации должны быть указаны только в тех случаях, когда они существенны для активности или присутствуют в доминирующих формах белков.
В некоторых ситуациях модификация не может быть описана конечной структурой. В таких случаях процесс модификации должен быть описан минимальным образом, указывая модифицирующий агент или физические условия, которые вызвали необратимые изменения.
Очищенная кровь или вещества тканей, чья предполагаемая функциональность относится к белку или к ограниченному числу белков с различными известными последовательностями аминокислот, должны быть описаны как белок.
Нековалентные взаимодействия между белками или пептидными звеньями не должны быть указаны. Исключение составляют белковые звенья, тесно ассоциируемые с хорошо определенной композиционной стехиометрией.
Может быть также указана справочная информация, не входящая в состав идентифицирующей, включая:
- тип и подтип белка,
- лиганд, подложку или мишень,
- тип взаимодействия белка,
- ген, продуцирующий белок.
По возможности справочная информация должна быть указана, используя нормативный словарь.
Примечания
1 Моноклональные иммуноглобулины описываются как белки. Соматропин, негликозилированный белок, который вырабатывается в E.Coli, клетках млекопитающих и дрожжевых клетках, должен быть описан как одна и та же субстанция независимо от клеточной линии, на которой он выращен.
2 К текущим типам гликозилирования относятся грибковый, растительный, у членистоногих, птичий, у млекопитающих, у человека.
3 Изменения даже в единственной аминокислоте должны приводить к разным субстанциям. Например, интерферон альфа-2а и интерферон альфа-2b, у которых последовательности отличаются одной аминокислотой, должны быть описаны, как отдельные субстанции. Агрегированный альбумин человека сывороточный, полученный в результате необратимой частичной физической денатурации, должен идентифицироваться как субстанция, отличающаяся от альбумина человека сывороточного.
Информационная модель описания белковой субстанции показана на рисунке 10.
Рисунок 10 - Информационная модель описания белковой субстанции
|
Рисунок 10 - Информационная модель описания белковой субстанции
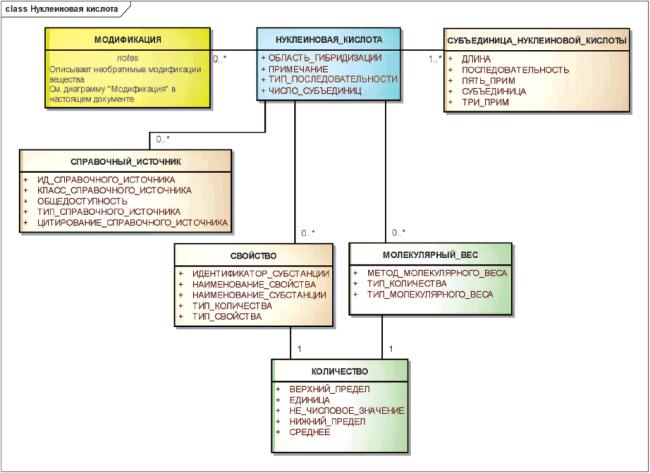
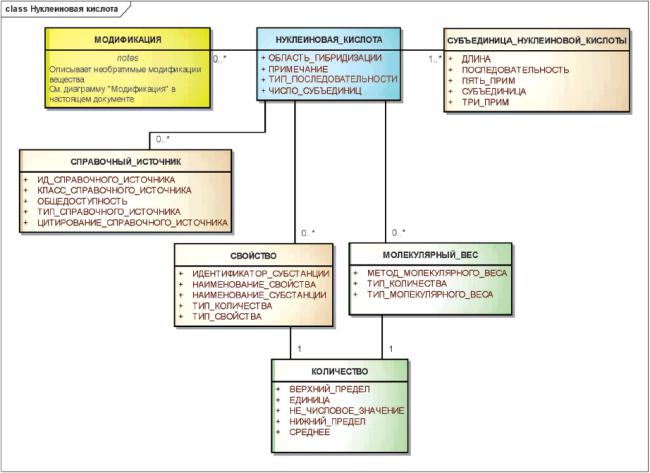
3.6.5 Нуклеиновые кислоты
Идентифицирующими элементами нуклеиновой кислоты должны быть последовательность, тип (РНК, ДНК, смешанный), а также все модификации, повлиявшие на молекулярную структуру.
Гены, плазмиды, части вирусных векторов, используемых в генной терапии, состоящие из аминокислот, должны быть описаны как нуклеиновые кислоты.
Отдельные элементы генов должны быть описаны и идентифицированы как субстанции.
Необратимые модификации, будь то физические или химические, которые необратимо модифицируют исходную молекулярную структуру, должны быть описаны с использованием элементов класса "МОДИФИКАЦИЯ".
Для генной терапии в качестве идентификатора должна использоваться вся последовательность трансформирующего/трансдуцирующего вектора. Каждый элемент гена должен быть указан и определен как субстанция.
Примечание - К элементам генов должны быть отнесены промоторы, энхансеры, сайленсеры и т.д. Для нуклеиновых кислот, используемых в генной терапии, должна быть указана вся последовательность трансформирующего/трансдуцирующего компонента вместе с каждым элементом гена.
Информационная модель описания нуклеиновой кислоты показана на рисунке 11.
Рисунок 11 - Информационная модель описания нуклеиновой кислоты
|
Рисунок 11 - Информационная модель описания нуклеиновой кислоты
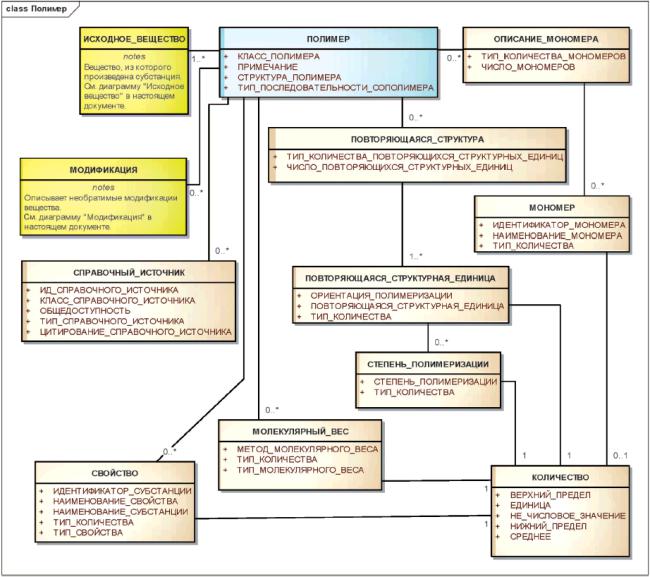
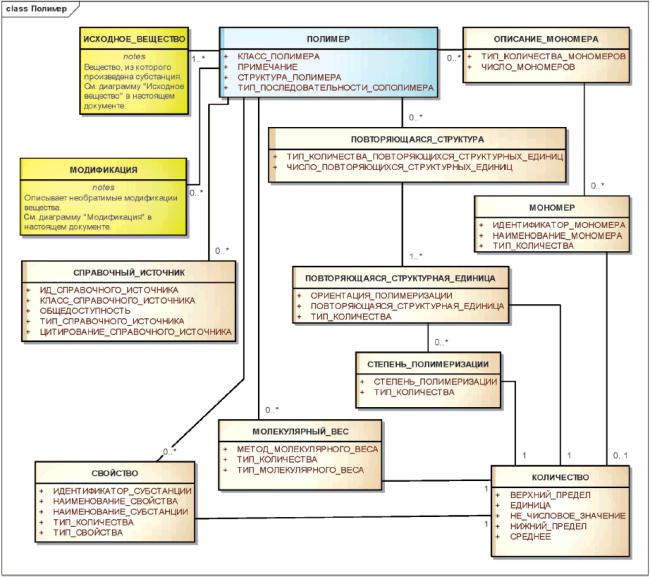
3.6.6 Полимеры
К полимерам относятся вещества, имеющие гетерогенную природу и содержащие повторяющиеся структурные единицы.
Для идентификации полимеров должно использоваться сочетание нормативного словаря с представлениями молекулярной структуры повторяющихся структурных единиц, идентификацией заместителей, которые присоединены к повторяющейся структурной единице и описаны как фрагмент или составляющий элемент модификации, молекулярным весом или полидисперсностью вещества. Степень полимеризации, мономеры, использованные для синтеза синтетических полимеров или сополимеров, исходное вещество для полимеров естественного происхождения, конечные группы полимеров, а также физические или биологические свойства должны быть указаны, если они известны и необходимы для различения вещества. Полимеры должны быть описаны на уровне специфичности, достаточном для различения вещества, и более широкие описания полимеров не должны поощряться.
Примеры - Для идентификации полимеров, содержащих повторяющиеся структурные единицы полиэтиленгликоля, всегда должны использоваться либо степень полимеризации, либо молекулярный вес. Общая субстанция полиэтиленгликоля не должна идентифицироваться как субстанция ввиду значительных вариаций этих типов вещества и соображений безопасности, связанных со степенью полимеризации.
Тип полимера должен определяться по числу повторяющихся структурных единиц и по связям между ними. Должен быть разработан нормативный словарь, требуемый для описания класса полимера, структуры полимера и типа последовательности сополимера.
Физические или биологические свойства должны учитываться при идентификации, если эти сведения необходимы для различения полимерных субстанций друг от друга и связан с молекулярными структурами полимерного ансамбля.
Примечание - Словарные значения класса полимера должны включать в себя гомополимер и сополимер, значения структуры полимера должны включать в себя линейную, разветвленную и пространственную; значения типа последовательности сополимера должны включать в себя нерегулярный, блочный и чередующийся. Индекс полидисперсности полимера обычно вычисляется как отношение средневзвешенного молекулярного веса к среднечисловому молекулярному весу. Такие свойства, как вязкость, светорассеивание или скорость осаждения, являющиеся показателем молекулярного веса, а также биологические свойства, например ингибирование ферментов, также могут служить отличительными признаками.
Информационная модель описания полимера показана на рисунке 12.
Рисунок 12 - Информационная модель описания полимера
|
Рисунок 12 - Информационная модель описания полимера
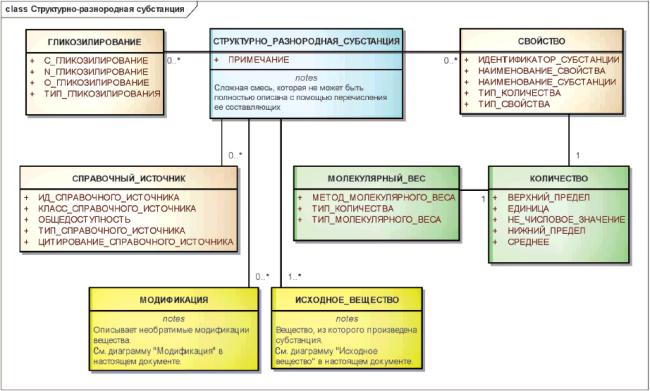
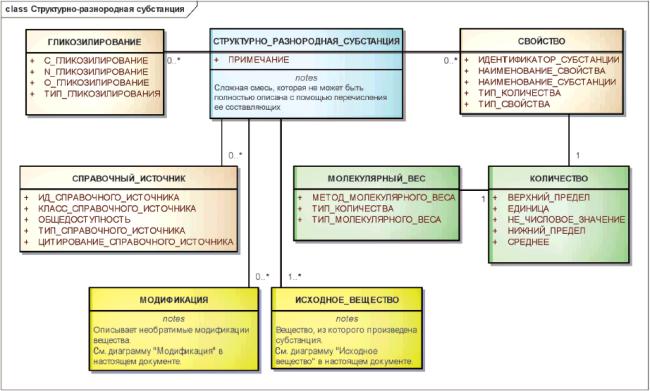
3.6.7 Структурно-разнородные субстанции
Субстанции, которые не могут быть представлены как ограниченное число относительно простых субстанций, то есть смешанных субстанций, должны быть описаны как структурно-разнородные.
Для идентификации структурно-разнородных субстанций должны быть указаны исходное вещество, из которого получена субстанция, модификации, которые привели к необратимым изменениям исходного вещества, и/или физические либо биологические свойства, присущие молекулярной композиции вещества.
Физические или биологические свойства должны быть указаны только в случаях, когда они существенны для идентификации и различения вещества.
Примечание - Большинство структурно-разнородных субстанций получено из биологических организмов. Ими могут быть также сложные природные материалы, например каменноугольная смола или нефть.
Пример - Легкая нефть отличается от нефти свой вязкостью и удельным весом.
Существенным элементом идентификации полидисперсных субстанций биологического происхождения является родительский организм, от которого было получено исходное вещество. Для родительских организмов необходимо указать таксономию от семейства по меньшей мере до вида. Варианты, культуры, штаммы или субштаммы должны участвовать в идентификации, если внутривидовые различия приводят к ощутимым изменениям функциональности или композиции. Царство, тип, класс и порядок могут быть указаны, если они известны, но этот уровень таксономии обычно не является определяющим для идентификации.
Примечание - Для растительных субстанций обычно указывают семейство родительского организма, род, вид и часть или части. Если используются конкретные части растения, то для идентификации необходимо указать списки отдельных частей, например, цветок, лист и стебель. Может потребоваться также указание сегмента жизненного цикла растения, например полное цветение. Ввиду вариабельности составляющих, получаемых в процессах экстракции (растворитель, температура, время) и зависящих от условий роста (сезон, место сбора, тип почвы, использование удобрений, количество дневного света и воды), биологические экстракты должны идентифицироваться своим источником, если только они не представляют собой конкретную фракцию или класс химических соединений, например сеннозиды (гликозиды антрахинона, извлекаемого из Senna alexandrina).
Сорт или разновидность растения должны быть указаны как признак другой субстанции, если существуют различия в составляющих или функциональности. Для других организмов, обычно для бактерий и вирусов, необходимо указывать подвид, вариант, штамм или тип, чтобы обеспечить аккуратное описание и отличить от других субстанций.
Пример - Брокколи и экстракт брокколи должны быть описаны как одна и та же субстанция. Брокколи и цветная капуста, представляющие различные группы сортов или разновидностей Brassica oleracea и отличающиеся внешним видом и составляющими, должны быть описаны как разные субстанции, несмотря на то, что имеют одинаковые гены и принадлежат к одному и тому же виду. Вирусы гриппа должны быть описаны на уровне, позволяющем отличить различные штаммы вакцин.
Поликлональные иммуноглобулины должны быть описаны как структурно-разнородные вещества с указанием типа иммуноглобулина, целевого антигена, а также вида источника.
Клетки и ткани должны быть описаны как структурно-разнородные субстанции. На уровне субстанции указание конкретного донора или степени пулирования не требуется.
Масла, соки и экссудаты растений должны быть отдельными субстанциями. Масла и соки должны быть описаны как фракции вещества, из которого они выделены. Вещества и процессы (например, время, температура, растворитель), используемые для приготовления экстрактов, варьируются. Поэтому эссенции, настойки и отвары не должны служить признаком разных субстанций. Вместо этих характеристик должны быть указаны родительский организм и та его часть, из которой они произведены.
Пример - Оливковое масло является фруктовым маслом, полученным из Olea europaea. Апельсиновый сок является фруктовым соком, полученным из Citrus sinensis. Зеленый чай и экстракты зеленого чая должны быть описаны как листья Camellia sinensis.
Информационная модель описания структурно-разнородной субстанции показана на рисунке 13.
Рисунок 13 - Информационная модель описания структурно-разнородной субстанции
|
Рисунок 13 - Информационная модель описания структурно-разнородной субстанции
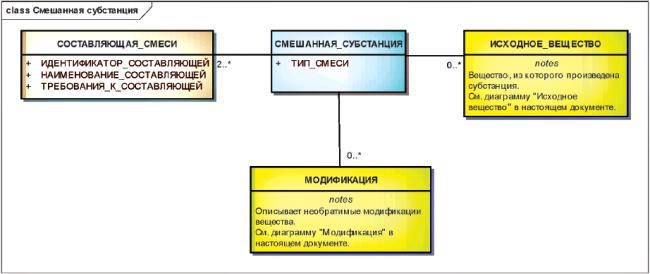
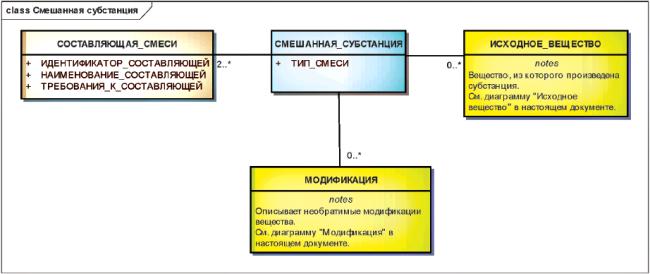
3.6.8 Смешанные субстанции
Смешанные субстанции должны быть описаны как простые комбинации отдельных субстанций, которые или совместно выделены, или являются результатом одного и того же процесса синтеза.
Для смешанных субстанций природного происхождения должно быть указано исходное вещество, из которого они произведены.
К смешанным субстанциям не должны относиться разнородные вещества, соединенные для получения препарата.
Пример - Симетикон не должен быть причислен к субстанциям, поскольку он состоит из диметикона и двуокиси кремния, имеющих разное происхождение и обычно не выделяемых совместно. Он должен быть описан как контролируемая субстанция группы 1.
Выделяются три типа смешанных субстанций:
- "все из", в которых должны присутствовать все отдельные субстанции;
- "любая из", в которых должна присутствовать хотя бы одна из отдельных субстанций;
- "одна из", в которых должна присутствовать только одна из отдельных субстанций.
Настоящий стандарт требует указывать, что отдельная субстанция всегда присутствует в смешанных субстанциях типа "все из". При этом относительное количество субстанции не должно быть указано.
Примечание - Относительные количества субстанций в смешанной субстанции должны быть указаны на уровне контролируемой субстанции способом, согласованным со спецификацией производителя или фармакопеи. Относительные количества не должны быть указаны на уровне субстанции в связи с потенциальными различиями спецификаций производителей и фармакопей.
Все смешанные субстанции должны состоять из отдельных субстанций.
Включение другой смешанной субстанции в состав смешанной субстанции не допускается.
Такое включение должно быть описано как единая смесь всех составляющих субстанций.
Все субстанции, входящие в состав смешанной субстанции в количестве, превышающем один процент, должны быть описаны как составляющие элементы смешанной субстанции.
Загрязнения и очистители обычно не считаются компонентами смешанной субстанции.
Смеси, которые не могут быть описаны как ограниченное число соединенных субстанций, должны быть описаны как структурно-разнородные субстанции.
Информационная модель описания смешанной субстанции показана на рисунке 14.
Рисунок 14 - Информационная модель описания смешанной субстанции
|
Рисунок 14 - Информационная модель описания смешанной субстанции
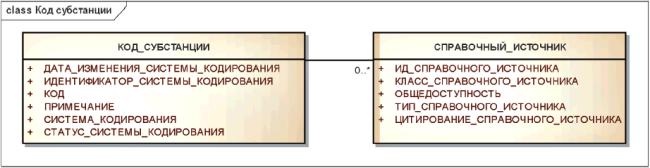
3.6.9 Коды субстанций
Хотя коды субстанций и соответствующие системы кодирования не являются определяющими элементами описания конкретной субстанции, они могут быть указаны в соответствии с представленной ниже информационной моделью.
Пример - К таким кодам относятся регистрационные номера службы CAS (Chemical Abstract Service), коды системы EINECS (European Inventory of Existing Commercial Chemical Substances), Европейские коды лекарств EVMPD (European Drug Codes) и Японские коды лекарств (Japanese Drug Codes).
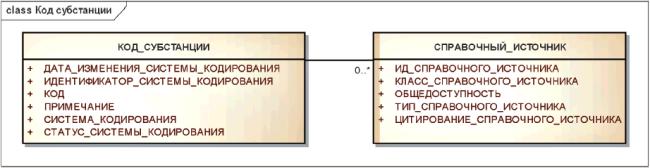
Информационная модель кода субстанции показана на рисунке 15.
Рисунок 15 - Информационная модель кода субстанции
|
Рисунок 15 - Информационная модель кода субстанции
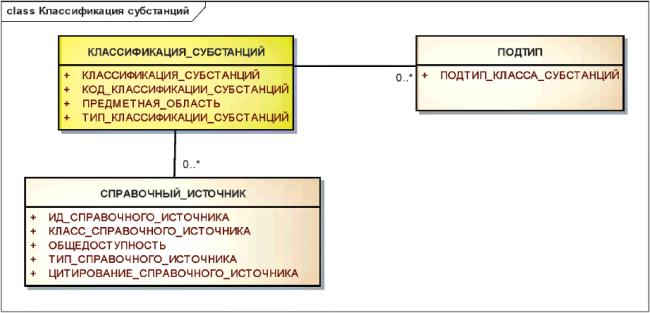
3.6.10 Классификация субстанций
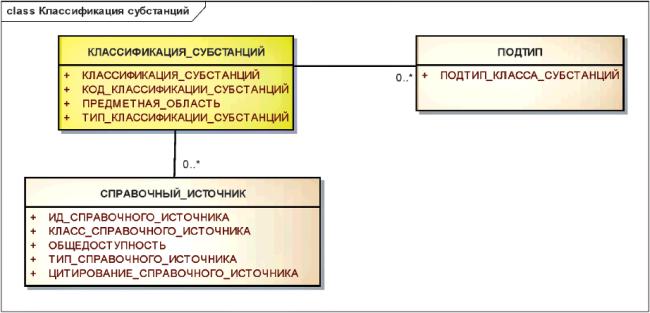
Хотя классификация субстанций не является определяющими элементом описания конкретной субстанции, она может быть указана в соответствии с представленной ниже информационной моделью.
Информационная модель классификации субстанций показана на рисунке 16.
Рисунок 16 - Информационная модель классификации субстанций
|
Рисунок 16 - Информационная модель классификации субстанций
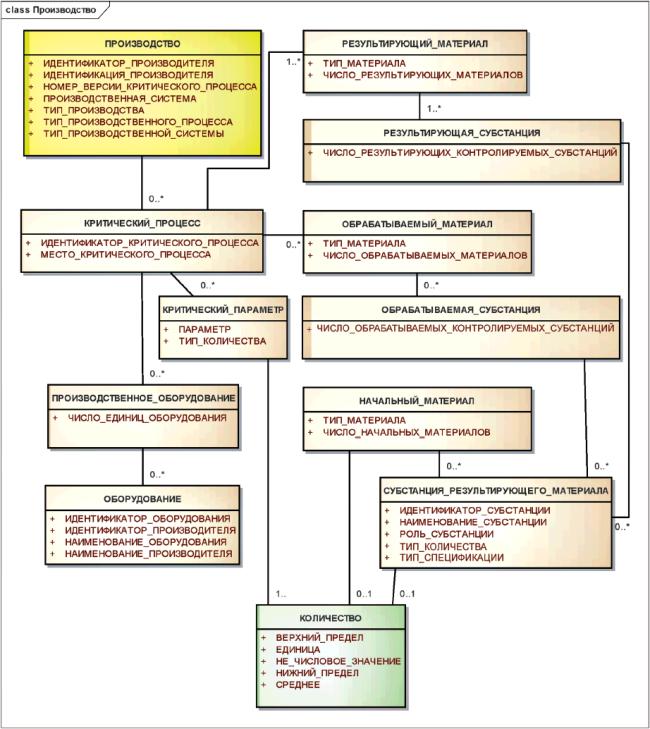
3.7 Описание контролируемых субстанций
3.7.1 Общее описание
Хотя в модели описания субстанций предусмотрена информация, существенная для описания веществ в составе лекарственных средств, нередко регуляторные органы требуют дополнительные сведения, которые не предусмотрены на уровне субстанции. Для более детального описания веществ, присутствующих в лекарственных средствах, должна использоваться общая информационная модель контролируемой субстанции.
Структура описания контролируемой субстанции должна обеспечить согласованное представление различной информации, включая:
- качество или чистоту;
- сведения о производстве, включая информацию о производителе и критических процессах производства;
- аналитические данные,
- составляющие, включая их количества и роль, если она известна и является существенной;
- спецификации (загрязнения и соответствующие предельные значения количества субстанции должны быть указаны в описании составляющих);
- описание единицы измерения;
- референтное вещество;
- аналитические методы, используемые для определения качества.
Для удовлетворения потребностей в идентификации лекарственного средства элементы описания контролируемой субстанции должны быть разделены на четыре группы и идентификатор контролируемой субстанции должен быть связан с каждой группой элементов.
Примечание - Группировка элементов упрощает модель данных и облегчает как региональные, так и итерационные реализации стандарта.
3.7.2 Контролируемые субстанции группы 1
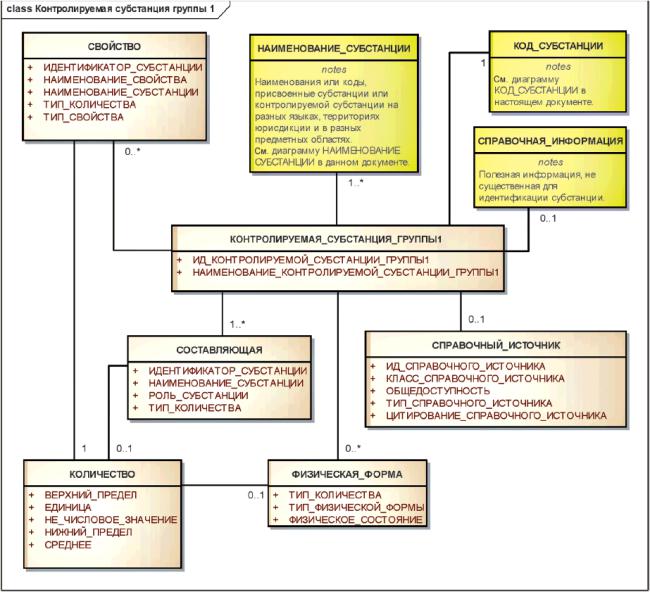
Элементы группы 1 должны использоваться для указания вещества, содержащего несколько субстанций, растворителей, используемых для приготовления растительных или аллергенных экстрактов, специфичных маркеров или иных признаков, присутствующих в веществах биологического происхождения, при необходимости физической формы субстанции, а также любых свойств, существенных для описания вещества.
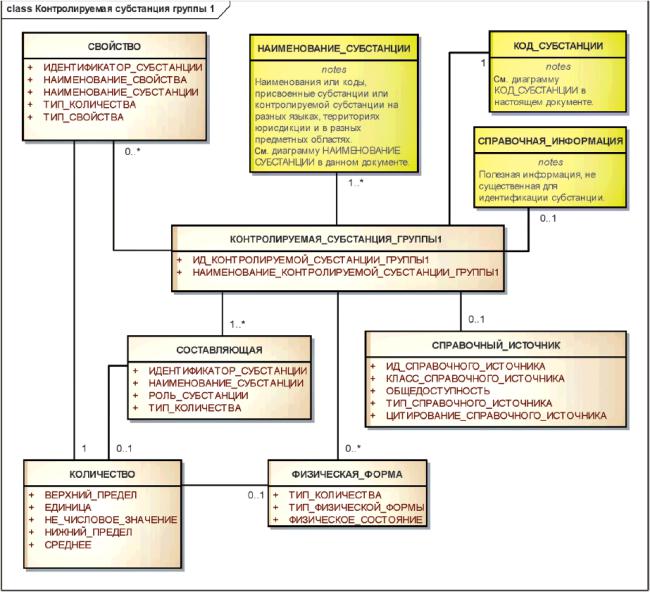
Группы элементов, используемых для определения контролируемой субстанции группы 1, должны включать в себя составляющие, физическую форму и свойство (рисунок 17).
В группу составляющих компонентов должны быть включены субстанции, специально добавленные для получения многокомпонентного вещества, растворители, используемые для приготовления экстрактов, специфичные маркеры или иные признаки, присутствующие в веществах животного происхождения.
Загрязнения или очистители не включаются в число составляющих компонентов контролируемой субстанции группы 1.
Примечания
1 Такая группировка элементов позволяет давать определения многих промышленно производимых веществ, используемых в составе лекарственных средств.
2 Загрязнения или очистители будут включены как элементы описания контролируемой субстанции группы 4.
Информационная модель описания контролируемой субстанции группы 1 показана на рисунке 17.
Рисунок 17 - Информационная модель описания контролируемой субстанции группы 1
|
Рисунок 17 - Информационная модель описания контролируемой субстанции группы 1
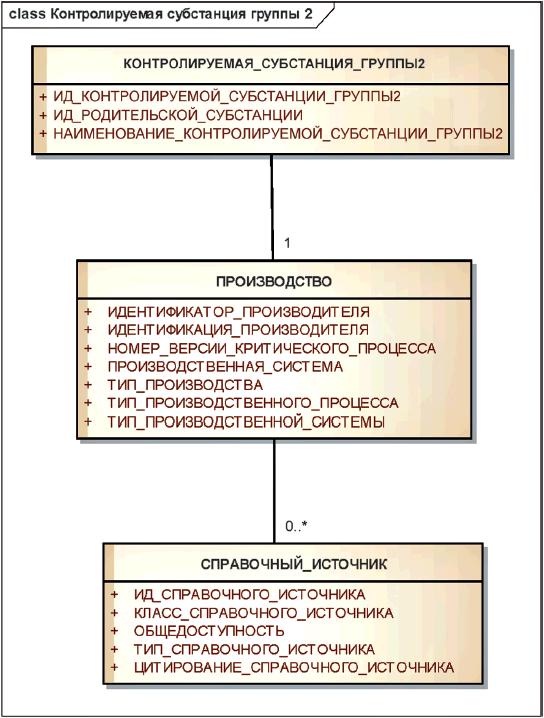
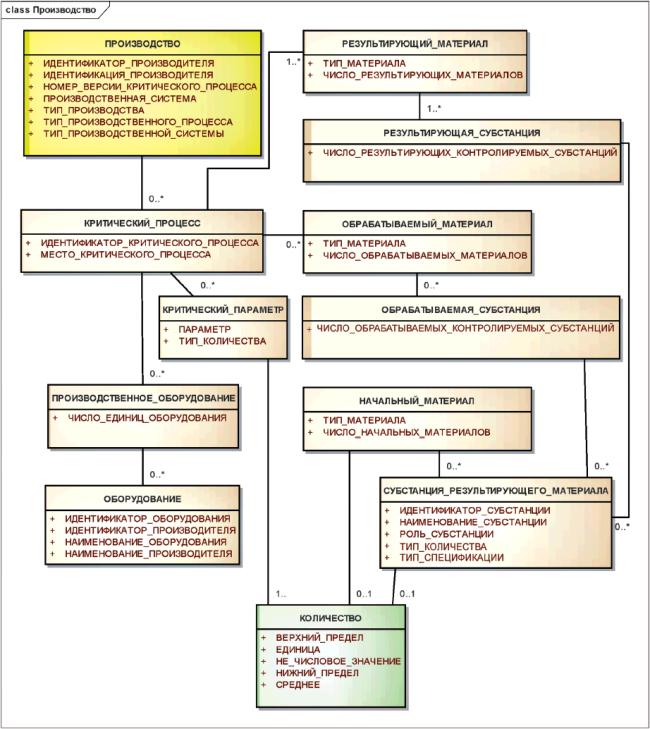
3.7.3 Контролируемые субстанции группы 2
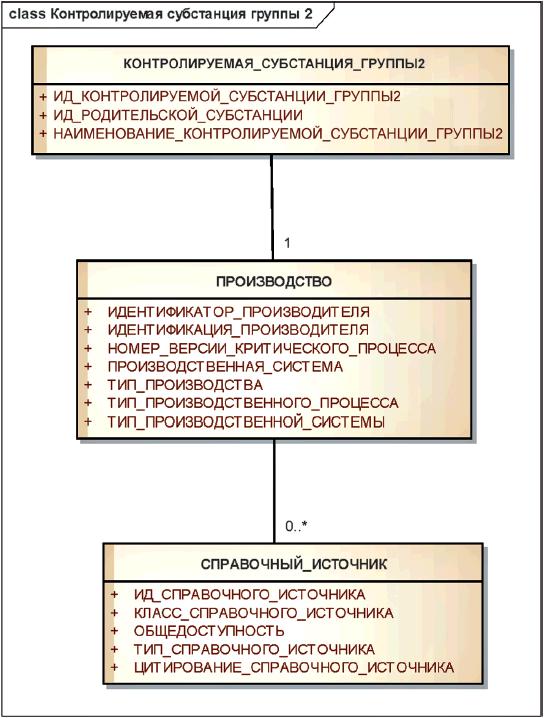
Элементы группы 2 должны использоваться для указания сведений о производителе субстанции или контролируемой субстанции группы 1 и минимальной информации о производственном процессе.
Минимальная информация о производственном процессе должна включать в себя общую характеристику метода производства (например, синтез, экстракция, восстановление), типа производственной системы (например, клеточную линию, растительные или животные ткани), производственную систему (конкретную клеточную линию). Номер версии критического процесса используется для различения контролируемых субстанций группы 2, при производстве которых произошли существенные изменения критических процессов. Начальный номер версии критического процесса должен быть равен 1, а следующие номера присваиваются последовательно.
Примечание - Элементы группы 2 позволяют прослеживать субстанцию до производителя. Они позволяют также отличать синтетические пептиды от рекомбинантных и получать информацию о производимой клеточной линии.
Информационная модель описания контролируемой субстанции группы 2 показана на рисунке 18.
Рисунок 18 - Информационная модель описания контролируемой субстанции группы 2
|
Рисунок 18 - Информационная модель описания контролируемой субстанции группы 2
3.7.4 Контролируемые субстанции группы 3
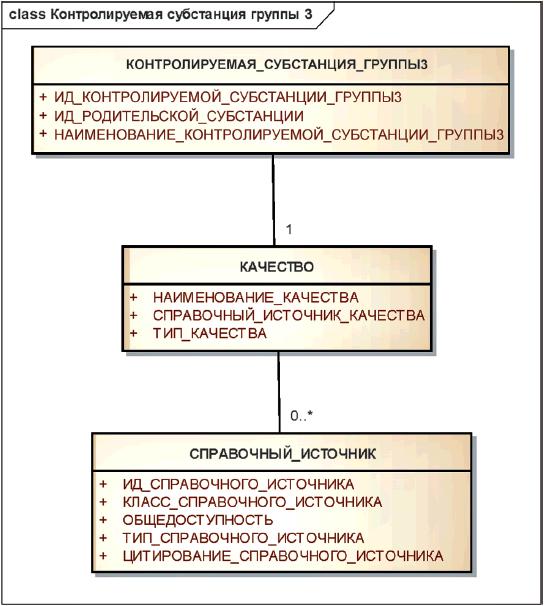
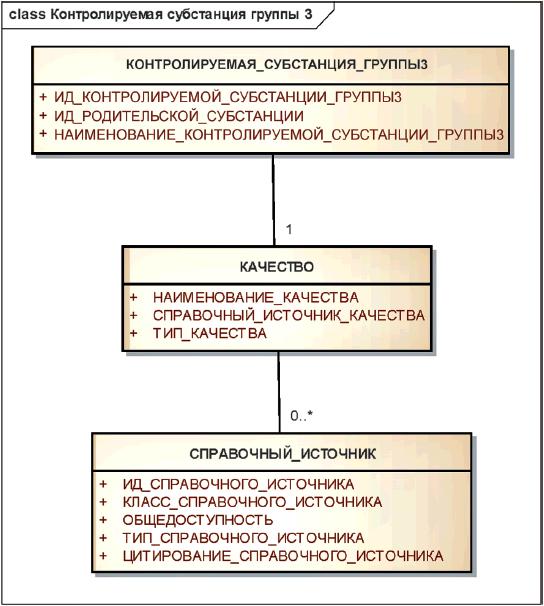
Элементы группы 3 должны указывать качество вещества, а также источник, регламентирующий данное качество.
Элементы группы 3 должны использоваться для различения фармакопейного качества и технического качества вещества.
Если фармакопейные статьи, описывающие субстанцию в разных фармакопеях, не гармонизированы, то субстанции, удовлетворяющие разным фармакопеям, должны рассматриваться как разные контролируемые субстанции группы 3.
В качестве родительской субстанции должна быть указана контролируемая субстанция группы 1, к которой относится указанное качество.
Примечание - Для большинства фармацевтических субстанций используются показатели качества USP (Фармакопея США), ЕР (Европейская фармакопея) и JP (Фармакопея Японии). К растительным субстанциям должны применяться такие показатели качества, как "стандартизованная", "заданный количественный состав", "нестандартизованная".
Пример - Вода является родительской субстанцией для контролируемой субстанции группы 3 "стерильная вода для инъекций USP".
Информационная модель описания контролируемой субстанции группы 3 показана на рисунке 19.
Рисунок 19 - Информационная модель описания контролируемой субстанции группы 3
|
Рисунок 19 - Информационная модель описания контролируемой субстанции группы 3
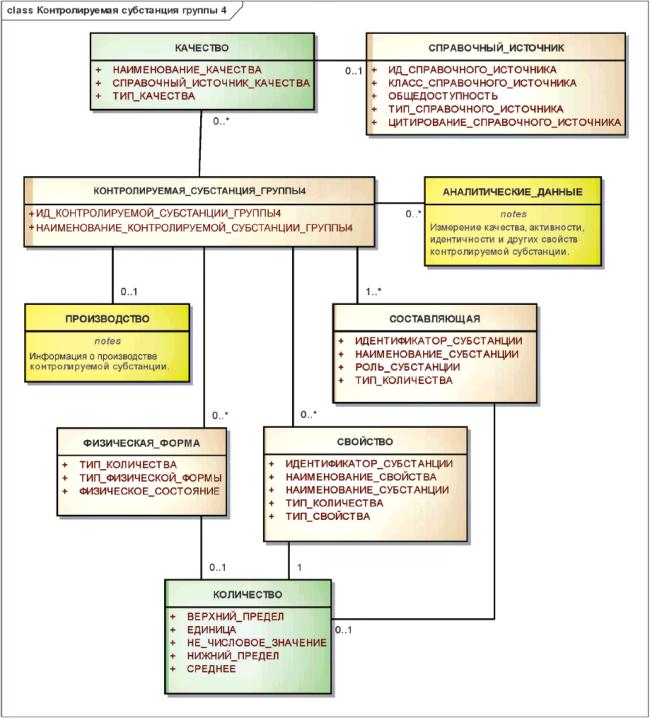
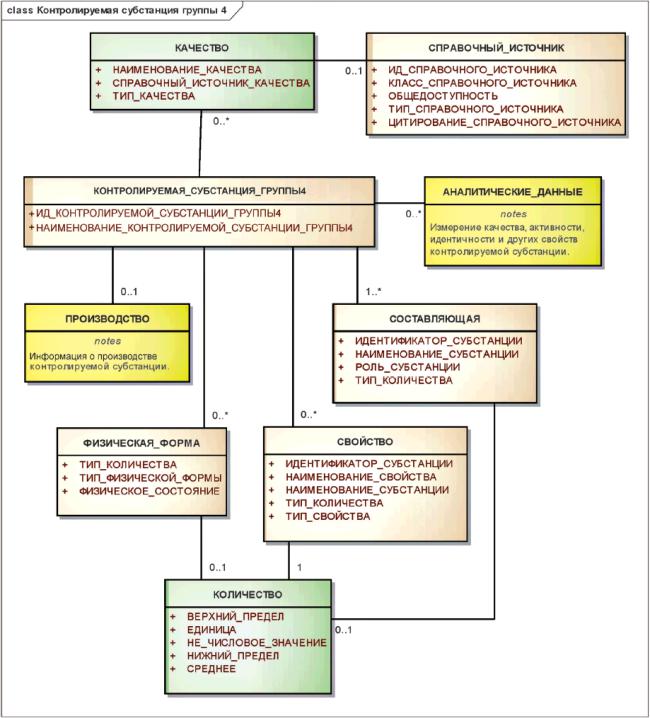
3.7.5 Контролируемые субстанции группы 4
Элементы группы 4 должны указывать наиболее детальные сведения о субстанции. Они должны включать в себя информацию о критических производственных процессах, спецификации (для составляющих должны быть указаны примеси и пределы содержания сопутствующих веществ), словесное определение единицы измерения, референтное вещество и аналитические методы, используемые для определения эффективности и чистоты.
Примечание - Специфичная информация о контролируемых субстанциях группы 4 нередко представляется в регистрационное досье в неструктурированной форме, что затрудняет ее сбор и организацию. Применение полей данных, предложенных в настоящем стандарте, является одним из способов организации и структурирования этой информации, позволяющим облегчить ее использование для составления обзоров и оценки соответствия.
Информационная модель описания контролируемой субстанции группы 4 показана на рисунке 20.
Рисунок 20 - Информационная модель описания контролируемой субстанции группы 4
|
Рисунок 20 - Информационная модель описания контролируемой субстанции группы 4
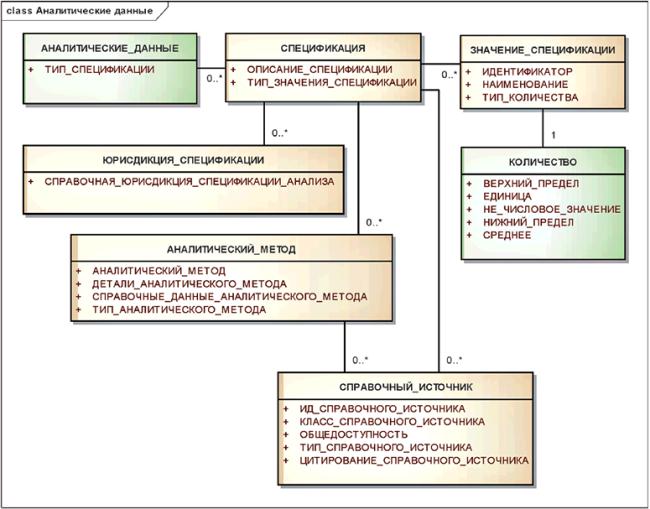
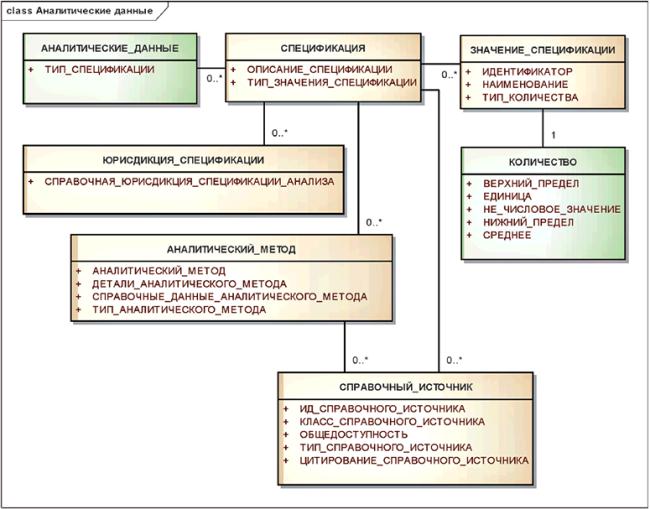
3.7.6 Аналитические данные
Информация об анализах, проведенных для определения активности и соответствия спецификации, может быть представлена в виде группы элементов. Эта информация должна включать в себя сведения об аналитических методах и стандартных образцах, использованных для определения активности. Отдельные стандартные образцы должны быть описаны как контролируемые субстанции. Должны быть описаны или указаны, в том числе по ссылке, различные аналитические методы анализа или стандартные образцы, использованные для определения активности. Настоящий стандарт не содержит указаний, какие аналитические методы или стандартные образцы должны быть использованы для определения активности. В нем предусмотрен только способ сбора такой информации.
Примечание - Единицы измерения активности нередко зависят от аналитического метода и стандартного образца, использованного для определения активности. Во многих случаях единицы измерения могут быть отличаться,* в зависимости от территории юрисдикции и даже у разных производителей на одной и той же территории юрисдикции.
________________
* Текст документа соответствует оригиналу. - .
Пример - Единицы измерения активности панкрелипазы, используемые в фармакопее USP, и те, что используются организацией Federation Internationale Pharmaceutique, отличаются и не могут быть так просто преобразованы друг в друга, поскольку используются разные стандартные образцы и их стандартизация отличается.
Информационная модель описания аналитических данных показана на рисунке 21.
Рисунок 21 - Информационная модель описания аналитических данных
|
Рисунок 21 - Информационная модель описания аналитических данных
3.7.7 Составляющие
Группа элементов, относящихся к составляющим, описывает информацию о субстанциях и контролируемых субстанциях, входящих в состав данной контролируемой субстанции. Описание многокомпонентного вещества должно включать в себя описания его составляющих - субстанций и контролируемых субстанций. Активные маркеры в растительных экстрактах, загрязнения или сопутствующие вещества должны также рассматриваться как составляющие и должны быть привязаны к компонентам, образующим контролируемую субстанцию. Должны быть указаны количество и роль каждой составляющей. Количества должны быть указаны или как пределы окончательных количеств (средние), или как диапазоны концентрации. Составляющие входят в состав элементов, описывающих контролируемые субстанции группы 1 и группы 4.
Примечание - Группа элементов, описывающих составляющие, обладает значительной гибкостью и полезностью для указания связи многих типов сопутствующих субстанций.
3.7.8 Качество
Качество описывает общее качество или группу спецификаций данной контролируемой субстанции.
Качество должны быть указано для контролируемых субстанций групп 3 и 4.
Примечание - Фармакопейное качество или спецификации должны быть указаны, если известны. Конкретная контролируемая субстанция может соответствовать спецификациям нескольких фармакопей. Может быть также указана техническая характеристика качества.
Пример - Фармакопейное качество или спецификации должны быть указаны, если известны. Описание контролируемой субстанции может идентифицировать различное качество воды. Водопроводная вода, стерильная вода для инъекций качества USP, стерильная вода для инъекций качества ЕР, обеззараженная вода качества USP и т.д. должны идентифицироваться как разные контролируемые субстанции.
3.7.9 Производство
Группа элементов, описывающих производство, должна содержать информацию о производителе и критических производственных процессах, необходимую для различения контролируемых субстанций. В состав этой информации могут входить описания начальных материалов, обрабатываемых материалов, параметров критических процессов, используемого оборудования и результирующего материала производственного процесса.
Примечание - Эта группа элементов предназначена для описания не всех деталей производства, а только критических производственных процессов, которые могут влиять на безопасность или эффективность контролируемой субстанции, используемой в лекарственном средстве.
Информационная модель описания производства показана на рисунке 22.
3.7.10 Физическая форма
Физическая форма должна указывать состояние, в котором существует нормативная субстанция. Должен использоваться нормативный словарь, который при необходимости надо разработать.
3.7.11 Свойство
Должны быть указаны физические, химические или биологические свойства, которые могут относиться к использованию или функции контролируемой субстанции и которые могут не зависеть от молекулярной структуры или молекулярного ансамбля, образующего субстанции или контролируемые субстанции, присутствующие в данной контролируемой субстанции. Это группа элементов может использоваться для указания свойств, относящихся к супрамолекулярной организации веществ. Свойства должны использоваться для идентификации контролируемых субстанций групп 1 и 4.
Рисунок 22 - Информационная модель описания производства
|
Рисунок 22 - Информационная модель описания производства
Приложение А (справочное). Существующие идентификаторы и представления молекулярной структуры
Приложение А
(справочное)
А.1 Идентификаторы
А.1.1 Общие положения
В приведенном ниже описании широко используемых идентификаторов отражены сильные и слабые стороны их использования для уникальной идентификации субстанций в лекарственном препарате. Список рассматриваемых типов идентификаторов не является исчерпывающим, но в него вошли те, что активно используются в информационных системах.
А.1.2 Регистрационные номера службы CAS
Регистрационные номера службы CAS представляют собой числовые идентификаторы, которые обычно идентифицируют простые субстанции. Полимеру нередко присваивается единственный номер CAS вне зависимости от различий в молекулярной массе или в других идентифицирующих элементах. Номера присваиваются последовательно по мере внесения субстанций в регистр. Длина номеров не фиксирована и меняется от 5 до 10 цифр. Каждый номер CAS содержит одну контрольную цифру. В регистре службы CAS зарегистрировано свыше 100 миллионов субстанций. Основное назначение регистра состоит в установлении связей между информацией, публикуемой в литературе по химии, а не исключительно в идентификации субстанций. Регистр ведется Химической реферативной службой (Chemical Abstracts Service) - подразделением Американского химического общества (American Chemical Society). Хотя номера CAS широко используются, они не являются общедоступными. Служба CAS выпустила руководство по применению своих регистрационных номеров и попыталась ограничить их использование в общедоступных базах данных. Регистрационный номер CAS для формальдегида имеет значение 50-00-0.
А.1.3 Идентификаторы InChl и InChlKey
Аббревиатура InChl означает международный химический идентификатор, присваиваемый Международным союзом теоретической и прикладной химии (International Union of Pure and Applied Chemistry, IUPAC). Система идентификации была разработана Национальным институтом стандартов и технологий США (National Institute of Standards and Technology). Идентификаторы InChl являются линейными и отражают химическое представление с помощью системы слоев. Идентификатор InChl является общедоступным структурным представлением, и программное обеспечение, предназначенное для генерации идентификаторов InChl, распространяется по открытой лицензии LGPL. Идентификаторы InChlKey имеют фиксированную длину (25 символов) и являются сжатыми цифровыми представлениям идентификаторов InChl. Идентификаторы InChl и InChlKey сконструированы для идентификации простых субстанций, имеющих определенную молекулярную структуру, а не для сложных веществ, например, вакцин, продуктов крови, ботанических или животных препаратов. Номер InChl для морфина имеет значение 1/С17Н19NO3/c1-18-7-6-17-10-3-5-13(20)16(17)21-15-12(19)4-2-9(14(15)17)8-11(10)18/h2-5, 10-11, 13, 16, 19-20Н, 6-8Н2, 1Н3/t10-, 11-, 13-, 16-, 17-/m0/s1, а идентификатор InChlKey - значение BQJCRHHNABKAKUXKUOQXLYBY.
А.1.4 Номера ЕС
Номер EC-No. или ЕС# представляет собой семизначный цифровой код, присваиваемый Европейской комиссией всем коммерчески доступным субстанциям, продаваемым в Европейском Союзе. Седьмая цифра кода является контрольной и код отображается как на торговое, так и непатентованное наименование конкретной субстанции. Область применения номеров ЕС шире, чем у идентификаторов InChl, и охватывает как простые, так и комплексные субстанции. Система номеров ЕС охватывает более 100000 субстанций, но не так уж активно используется в фармацевтическом секторе. Номера в большинстве случаев присваиваются последовательно. Они были позаимствованы из списков регулируемых субстанций, которые ведутся организациями EINECS (European Inventory of Existing Commercial Chemical Substances), ELINCS (European List of Notified Chemical Substances) и другими. Номер EC# для формальдегида имеет значение 200-001-8. Европейская Комиссия больше не присваивает новые номера ЕС#.
А.1.5 Идентификатор UNII
Идентификатор UNII представляет собой 10-символьную случайную алфавитно-цифровую строку, которая в настоящее время используется для идентификации субстанций в лекарственных средствах. Идентификатор UNII генерируется Системой регистрации субстанций, которая ведется организацией FDA и фармакопеей USP и является надежной системой с детально разработанными регламентами ввода данных и генерации идентификаторов UNII, присваиваемых как простым, так и комплексным субстанциям. Первые 9 символов генерируются случайно, а последний является контрольным символом. Контроль целостности идентификаторов UNII является более строгим по сравнению с контрольными цифрами номеров ЕС# и регистрационных номеров CAS, поскольку эти идентификаторы случайно выбираются из большого диапазона возможных значений и для контроля используются 36 возможных символов по сравнению с 10 цифрами у номеров ЕС# и CAS. Идентификаторы UNII являются общедоступными, и существует регламент, по которому производитель может обратиться в организацию FDA c запросом генерации нового идентификатора UNII. Система обеспечивает как публичный, так и ограниченный доступ к информации, и ее можно адаптировать для присваивания идентификаторов контролируемым субстанциям.
А.1.6 Номер ASK
Номер ASK представляет собой пятизначный код (с дополнительной контрольной цифрой). Эти номера ведутся и присваиваются организацией German National Competent Authorities (BfArM, PEI, BVL) в соответствии с §10 Германского закона об обращении лекарственных средств (German Drug Law) и правилами AMIS-Bezeichnungsverordnung. Указание номера ASK обязательно при подаче заявлений на регистрацию лекарственных средств и в переписке между владельцами регистрационных удостоверений и уполномоченными органами. Используемая база данных субстанций охватывает более 35000 субстанций, применяемых в регулируемых лекарственных средствах. В их число входят субстанции химического и биологического происхождения, а также радиофармацевтические, гомеопатические и антропософические препараты. Эта база данных содержит в основном информацию об активных ингредиентах и наполнителях, но в ней есть информация и о газах, упаковочных материалах, химических веществах, используемых для анализов, загрязнениях и веществах, запрещенных законодательством. В дополнение к химическому наименованию, соответствующему номенклатуре IUPAC, приводится большая "коллекция" ссылок на синонимы, используемые в международных и европейских источниках в течение жизненного цикла лекарственного средства. При наличии приводятся регистрационный номер CAS, молекулярная формула и молекулярная масса. Для обеспечения различных аспектов рутинной работы регуляторных органов, в классификацию субстанций добавлено большое число "группирующих атрибутов".
А.2 Представления молекулярной структуры
А.2.1 Общее описание
Существенным моментом для разработки нормативного словаря, предназначенного для описания простых химических субстанций, является представление химической или молекулярной структуры. Система представления должна обеспечивать уникальное и однозначное представление структуры. Конкретная структура должна иметь единственное представление, настолько детальное, чтобы исключить ненамеренную неоднозначность. Представление или его форма должны позволять хранение в химической базе данных для облегчения регистрации и поиска. Те форматы представления, что не описаны ниже, или не используются достаточно широко, или являются частными, принадлежащими одному поставщику.
А.2.2 Формат molfile
Формат molfile был в основном разработан компанией MDL Information Systems. В настоящее время используются две версии: V2000 и расширенный формат V3000. В расширенном формате molfile применяются расширенные стереохимические дескрипторы, позволяющие связать с каждой хиральной молекулой относительные, неизвестные и рацемические обозначения. Формат V2000 широко используется и может быть без труда преобразован в другие форматы. В отличие от других представлений, формат molfile является не линейным, а в основном табличным. Ниже показано представление бензола в формате V2000 molfile.
|
А.2.3 Спецификация SMILES
Спецификация упрощенного представления молекул в строке ввода SMILES (Simplified molecular input line entry specification) предназначена для однозначного линейного представления химических или молекулярных структур в форме строки символов ASCII. Она преимущественно используется компанией Daylight Chemical Information Systems Inc., но недавно появились версии с открытым кодом. Канонический идентификатор SMILES представляет собой строку, уникальную для каждой структуры, и может использоваться для проверки, что в базу данных не вводятся дубликаты структур. К другим форматам линейного представления химических структур относятся нотация SLN (SYBYL line notation) и старая нотация Wiswesser Line Notation, которая была первой строковой нотацией, используемой для представления химических структур. Эти форматы в настоящее время не имеют широкого применения. Ниже показано представление SMILES для бензола.
С1 = СС = СС = С1
А.2.4 Формат InChl
Формат InChl описан в подразделе А.1.3. В нем использовано многоуровневое представление химической структуры. В настоящее время информация имеет четыре слоя:
- конституциональный: описывает только межатомные связи;
- стереохимический: включает в себя традиционную стереохимию состояний sp2 и sp3 атомов углерода;
- изотопный: позволяет различать изотопы;
- таутометрный: реализует простые формы быстрой изомеризации с миграцией протона.
Ниже показано представление InChl для бензола.
1/С6Н6/с1-2-4-6-5-3-1/h1-6 Н
А.2.5 Форматы файлов CDX и CDXML
Эти форматы используются редактором химической графики ChemDraw для хранения описаний структур в виде последовательности вложенных объектов. Так как большинство химиков имеет доступ к редактору ChemDraw и формат CDX является форматом хранения по умолчанию в редакторе ChemDraw, то запросы на идентификацию субстанций должны обеспечивать возможность приема информации в формате CDX. Поскольку формат СОХ является частным, это препятствует будущим обменам информацией, так что может понадобиться преобразование в один из указанных выше общедоступных форматов.
Библиография
[1] | ISO 1087-1, Terminology work - Vocabulary - Part 1: Theory and application |
[2] | ISO 1087-2, Terminology work - Vocabulary - Part 2: Computer applications |
_______________ | |
[3] | ISO 3166-1, Codes for the representation of names of countries and their subdivisions - Part 1: Country codes |
[4] | ISO 8601, Data elements and interchange formats - Information interchange - Representation of dates and times |
[5] | ISO 11615, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated medicinal product information |
[6] | ISO 11616, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated pharmaceutical product information |
[7] | ISO 11239, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging |
[8] | ISO 11240, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of units of measurement |
[9] | ISO/IEC 2382-4, Information technology - Vocabulary - Part 4: Organization of data |
[10] | ISO/IEC 7064, Information technology - Security techniques - Check character systems |
[11] | ISO/HL7 27951, Health informatics - Common terminology services, release 1 |
[12] | ISO/HL7 27953-1, Health informatics - Individual case safety reports (ICSRs) in pharmacovigilance - Part 1: Framework for adverse event reporting |
[13] | ISO/HL7 27953-2, Health informatics - Individual case safety reports (ICSRs) in pharmacovigilance - Part 2: Human pharmaceutical reporting requirements for ICSR |
[14] | HL7 Common Product Model, Substance Model (POCP_MT080100) and Substance Specification Model (POCP_MT090100)[6] |
[15] | HL7 Version 3 Standard, Common Terminology Services HL7 Draft Standard for Trial Use DSTU Release 2, 14 October 2009, HL7 Inc. |
[16] | HL7 Version 3 Standard, Common Clinical Product Model, Release 1, Last Ballot: Normative Ballot 1 - January 2009 |
[17] | HL7 Version 3 Standard, Common Product Model CMETS, Release 10, DSTU Ballot 3 - January 2010 |
[18] | IUPAC, Compendium of Chemical Terminology version 2.1.5 |
[19] | ISBT 128, Standard Technical Specification version 3.6 |
[20] | International Conference on Harmonization (ICH) of Technical Requirements for Registration of Pharmaceuticals for Human Use Draft Consensus Guideline - Data Elements and Standards for Drug Dictionaries - M5 Revision 4, 2 February 2007. http:/www.fda.gov/Cder/guidance/6886dft.pdf |
[21] | Resources related to FDA's Substance Registration system http://www.fda.gov/Forlndustry/DataStandards/SubstanceRegistrationSystem-UniquelngredientldentifierUNII/default.htm |
[22] | NCI Thesaurus (NCIt) and other NCI Enterprise Vocabulary Services (EVS) resources and documentation: http://nciterms.nci.nih.gov/ncitbrowser/pages/multiple_search.jsf±nav_type=terminologies |
[23] | The Integrated Taxonomic Information System http://www.itis.gov/ |
[24] | The Food and Drugs Act and Regulations and related Health Canada Guidelines: http://www.hc-sc.gc.ca/dhp-mps/prodpharma/index-eng.php |
[25] | The Natural Health Product Regulations and related Health Canada Guidelines: |
[26] | Directive 2001/83/EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to medicinal products for human use as amended by Directive 2002/98/EC, Directive 2004/24/EC and Directive 2004/27/EC http://ec.europa.eu/enterprise/ pharmaceuticals/eudralex/vol-1/consol 2004/human code.pdf |
[27] | "Guideline on the categorisation on New applications versus Variations", The Rules governing Medicinal Products in the European Union, Notice to Applicants, Volume 2C |
[28] | The Rules governing Medicinal Products in the European Union, Notice to Applicants, Volume 2A and Volume 2C http://ec.europa.eu/enterprise/pharmaceuticals/eudralex/homev2.htm |
[29] | A Guideline on Summary of Product Characteristics, December 1999, (Doc. Ref. Notice to Applicants, Final - revision 0) |
[30] | Directive 2001/20/EC of the European Parliament and of the Council of 4 April 2001 on the approximation of the laws, regulations and administrative provisions of the Member States relating to the implementation of good clinical practice in the conduct of clinical trials on medicinal products for human use http:// ec.europa.eu/enterprise/pharmaceuticals/eudralex/vol-1/dir 2001 20/dir 2001 20 en.pdf |
[31] | Commission Directive 2003/63/EC of 25 June 2003 amending Directive 2001/83/EC of the European Parliament and of the Council on the Community code relating to medicinal products for human use |
[32] | Regulation (EC) No 726/2004 of the European Parliament and of the Council of 31 March 2004 laying down Community procedures for the authorisation and supervision of medicinal products for human and veterinary use and establishing a European Medicines Agency http://ec.europa.eu/enterprise/ pharmaceuticals/eudralex/vol-1/reg 2004 726/reg 2004 726 en.pdf |
[33] | Regulation (EC) No 1394/2007 of the European Parliament and of the Council of 13 November 2007 on advanced therapy medicinal products and amending Directive 2001/83/EC and Regulation (EC) No 726/2004 |
[34] | Commission Directive 2003/94/EC of 8 October 2003 laying down the principles and guidelines of good manufacturing practice in respect of medicinal products for human use and investigational medicinal products for human use |
[35] | http://ec.europa.eu/enterprise/pharmaceuticals/eudralex/vol-1/dir_2003_94/dir_2003_94_en.pdf |
[36] | Guidelines on Pharmacovigilance for Medicinal Products for Human Use, Volume 9A of the Rules Governing Medicinal Products in the European Union |
[37] | http://ec.europa.eu/enterprise/pharmaceuticals/eudralex/vol-9/pdf/vol9_2007-07_upd07.pdf |
[38] | Guideline on declaration of botanical substances and botanical preparations in botanical medicinal products/traditional |
[39] | Botanical medicinal products in the SPC, 26 July 2007 (Doc. Ref. EMEA/HMPC/CHMP/CVMP/287539/2005) |
[40] | http://www.emea.europa.eu/pdfs/human/hmpc/28753905en2.pdf |
[41] | Guideline on adjuvants in vaccines for human use, 20 January 2005 (Doc. Ref. EMEA/CHMP/VEG/134716/2004) |
[42] | http://www.emea.europa.eu/pdfs/human/vwp/13471604en.pdf |
[43] | Guideline on Similar Biological Medicinal Products, 30 October 2005 (Doc. Ref. CHMP/437/04) |
[44] | http://www.emea.europa.eu/pdfs/human/biosimilar/043704en.pdf |
[45] | GUIDELINE ON PHARMACEUTICAL ASPECTS OF THE PRODUCT INFORMATION FOR HUMAN VACCINES. 26 November 2003 (Doc. Ref. EMEA/CPMP/BWP/2758/02) http://www.emea.europa.eu/pdfs/human/bwp/275802en.pdf |
[46] | Guideline on the acceptability of names for human medicinal products processed through the centralised procedure, 11 December 2007 (Doc. Ref. CPMP/328/98, Revision 5) |
[47] | http://www.emea.europa.eu/pdfs/human/regaffair/032898en.pdf |
[48] | Guideline on the Chemistry of new Active Substances, 17 December 2003 (Doc. Ref. CPMP/QWP/130/96 Rev. 1) http://www.emea.europa.eu/pdfs/human/qwp/013096en.pdf |
[49] | Standard Terms, Dosage Forms, Routes of Administration and Containers, EDQM, Fifth Edition, December 2004, Version 5.0.0 http://st.pheur.org/ |
[50] | EudraVigilance Medicinal Product Dictionary (EVMPD) Version 2.0 Technical Specifications, 9 November 2004 (Doc. Ref. EMEA/140190/2004) http://eudravigilance.emea.europa.eu/human/ docs/EVMPD%20Technical%20Specifications.pdf |
[51] | EudraVigilance Medicinal Product Dictionary (EVMPD) Version 2.0 Message and Acknowledgement Specifications, 8 December 2004 (Doc. Ref. EMEA/178966/2004) http://eudravigilance.emea.europa.eu/human/docs/EVMPD%20Message%20and%20%20Acknowledgem |
[52] | EudraVigilance (EV) Access simple Database Version 2.0 8 November 2004 (Doc. Ref: EMEA/140327/2004) |
[53] | EudraVigilance (EV) Access Simple Database Version 2.0 Forms Documentation, 31 January 2005, (Doc. Ref: EMEA/35416/2005) |
[54] | EudraVigilance (EV) Access Simple Database Version 2.0 Step by Step Guide 8 December 2004, (Doc. Ref: EMEA/191986/2004) |
[55] | Product Information Management http://pim.emea.europa.eu/ |
[56] | European Pharmacopeia (Ph. Eur.): http://online.pheur.org/entry.htm |
[57] | MINISTRY OF HEALTH AND WELFARE. PSB/SD Notification No. 37 (29 |
[58] | Appendix: Electronic format of package insert information on ethical drugs (SGML/DTD Ver.2.0) Appendix1 DTD Ver.2.0 https://skw.info.pmda.go.jp/notice/nt990329dtd.zip |
[59] | Appendix2 Overview of SGML creation https://skw.info.pmda.go.jp/notice/nt990329ol.pdf |
[60] | Appendix3 DCL https://skw.info.pmda.go.jp/notice/nt990329dcl.zip |
[61] | Appendix4 Template of SGML https://skw.info.pmda.go.jp/notice/nt990329smp.zip |
[62] | Appendix5 Data model (Entities and relationships) https://skw.info.pmda.go.jp/notice/nt990329dm.pdf |
[63] | Appendix6 List of fields of package insert information https://skw.info.pmda.go.jp/notice/nt990329lst.pdf |
[64] | THE JAPANESE PHARMACOPOEIA SIXTEENTH EDITION, http://jpdb.nihs.go.jp/jp16/ |
[65] | United States Pharmacopoeia (USP): http://www.usp.org/usp-nf |
[66] | INTEGRATED TAXONOMIC INFORMATION SYSTEM. (ITIS) http://www.itis.gov/ |
[67] | Guidance for Industry Providing Regulatory Submissions in Electronic Format - Content of Labelling http://www.fda.gov/cder/regulatory/guidance |
[68] | Release Notes for SPL Schema PORR_MT050020 (3.20.05) FDA SPL Schema for Implementation http://www.fda.gov/downloads/Forlndustry/DataStandards/StructuredProductLabeling/UCM162024.pdf |
[69] | CaCore 2.0 Technical Guide, National Cancer Institute, Center for Bioinformatics, U.S. Department of Health and Human Services |
[70] | A guide to RXNorm, United States National Library of Medicine, National Institute of Health http://www.nlm.nih.gov/research/umls/rxnorm/docs/2012/rxnorm_doco_full_2012-3.html |
[71] | The Unified Code for Units of Measure |
[72] | Substance Registration System (SRS) SRS Substance Definition Manual Version 5c |
[73] | The U.S. Consolidated Healthcare Informatics initiative |
[74] | CDISC Clinical Research Glossary, http://www.cdisc.org/cdisc-glossary |
УДК 004:61:006.354 | ОКС 35.240.80 | П85 | ОКСТУ 4002 |
Ключевые слова: здравоохранение, информатизация здоровья, уникальная идентификация, лекарственные средства, структуры данных, передача данных, фармацевтические субстанции |
Электронный текст документа
и сверен по:
официальное издание
М.: Стандартинформ, 2015
ГОСТ Р ИСО 11238-2014
Группа П85
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИНФОРМАТИЗАЦИЯ ЗДОРОВЬЯ
Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях
Health informatics. Identification of medicinal products. Data elements and structures for the unique identification and exchange of regulated information on substances
ОКС 35.240.80
ОКСТУ 4002
Дата введения 2015-10-01
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным учреждением "Центральный научно-исследовательский институт организации и информатизации здравоохранения" Министерства здравоохранения Российской Федерации (ФГБУ "ЦНИИОИЗ" Минздрава) и Федеральным бюджетным учреждением "Консультационно-внедренческая фирма в области международной стандартизации и сертификации "Фирма "Интерстандарт" на основе собственного аутентичного перевода на русский язык международного стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 468 "Информатизация здоровья" при ЦНИИОИЗ Минздрава - постоянным представителем ISO ТС 215
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 17 ноября 2014 г. N 1618-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 11238:2012* "Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях" (ISO 11238:2012 "Health informatics - Identification of medicinal products - Data elements and structures for unique identification and exchange of regulated information on substances")
________________
* Доступ к международным и зарубежным документам, упомянутым здесь и далее по тексту, можно получить, перейдя по ссылке на сайт . - .
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
Введение
Настоящий стандарт разработан в связи с широкой мировой потребностью в международной гармонизации описаний лекарственных средств. Он является одним из пяти стандартов, образующих базис уникальной идентификации лекарственных средств. В эту группу стандартов входят:
ISO 11615, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated medicinal product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных средствах);
ISO 11616, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated pharmaceutical product information (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых лекарственных препаратах);
ISO 11238, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on substances (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых фармацевтических субстанциях);
ISO 11239, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о регистрируемых формах дозировки, единицах представления, способах введения и упаковке);
ISO 11240, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of units of measurement (Информатизация здоровья. Идентификация лекарственных средств. Элементы данных и структуры для уникальной идентификации и обмена информацией о единицах измерения).
Эти стандарты идентификации лекарственных средств (IDMP - Identification of Medicinal Products) предназначены для поддержки деятельности органов контроля обращения лекарственных средств во всем мире, включая контроль за разработкой и регистрацией лекарственных средств, управление их жизненным циклом, а также контроль рисков и фармаконадзор.
Для достижения основных целей контроля обращения лекарственных средств и фармаконадзора необходимо обеспечивать надежный, качественный и согласованный обмен информацией о лекарственных средствах. Поэтому стандарты IDMP регламентируют как минимум следующие обмены информацией:
- между органами контроля обращения лекарственных средств, например, между Европейским агентством лекарственных средств и Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (United States Food and Drug Administration);
- между фармацевтической фирмой и органом контроля обращения лекарственных средств, например, между фирмой "Pharma Company А" и организацией Health Canada;
- между спонсором клинического исследования и органом контроля обращения лекарственных средств, например, между университетом "University X" и Австрийским агентством лекарственных средств;
- между органом контроля обращения лекарственных средств и другими участниками обращения лекарственных средств, например, между Регуляторным агентством Великобритании по лекарственным средствам и изделиям медицинского назначения (MHRA - UK Medicines and Health Care Products Regulatory Agency) и Национальной службой здравоохранения (NHS - National Health Service);
- между органами контроля обращения лекарственных средств и международными источниками данных, например, между Агентством Японии по лекарственным средствам и изделиям медицинского назначения (PMDA - Pharmaceutical and Medical Device Agency) и уполномоченной организацией по присваиванию идентификаторов субстанциям.
Составными частями стандартов IDMP являются спецификации сообщений. Они служат для описания и обеспечения целостности указанных выше обменов информацией.
Уникальные идентификаторы, присвоенные в соответствии со стандартами IDMP, предназначены для использования в тех приложениях, которым необходима надежная идентификация и отслеживание применения лекарственных средств и используемых в них материалов.
В настоящем стандарте описана структура данных, способствующая присвоению уникальных идентификаторов всем субстанциям, входящим в состав лекарственных средств, а также упаковочным материалам, а также управлению этими идентификаторами. Настоящий международный стандарт устанавливает общие правила определения и различения субстанций и предлагает высокоуровневую модель, описывающую структуру информации о субстанциях и контролируемых субстанциях, предназначенную для организации и сбора соответствующих данных.
При разработке настоящего стандарта использовалась Общая модель продукции организации HL7 (Common Product Model), и детальное моделирование информации о субстанциях и контролируемых субстанциях осуществлялось в соответствии с ее областью применения. Предполагается, что при реализации настоящего стандарта в целях обеспечения присваиванию каждой субстанции, присутствующей в лекарственном средстве, строгого не смыслового уникального идентификатора будет использовано Руководство HL7 по реализации описания субстанций (HL7 substances implementation guide) и стандарты HL7 по электронному обмену данными. Предполагается также, что за генерацию идентификаторов каждой субстанции будет отвечать единственная организация и что эта организация будет сохранять у себя определяющие элементы, входящие в состав идентификатора субстанции. На уровне контролируемых субстанций может потребоваться учет региональных особенностей, поскольку значительная часть информации, описывающей эти субстанции, имеет местный характер.
Применение идентификатора существенно для описания субстанций, входящих в состав лекарственных средств, в глобальном масштабе. Настоящий стандарт не предполагает разработку номенклатуры субстанций или контролируемых субстанций, но с каждым идентификатором можно связать общераспространенные и официальные текущие наименования субстанции.
Материалы, используемые в лекарственных средствах, варьируются от простых химических соединений до генномодифицированных клеток и тканей животного происхождения. Однозначная идентификация таких субстанций особенно проблематична. В настоящем стандарте субстанции определяются на основе их научной идентичности (то есть, чем они являются), а не на основе способа применения или производственного процесса. Для идентификации субстанций используется молекулярная структура или другие неизменные свойства, например, таксономия, анатомическая информация или информация о фракционировании. В настоящем стандарте приведены пять групп элементов, достаточных для идентификации всех субстанций. Хотя идентифицировать или классифицировать субстанции вполне возможно и другими способами, в настоящем стандарте применен подход минимально структурированных научных понятий, при котором основное внимание уделяется критичным элементам, необходимых для различения двух субстанций друг от друга. Нередко при соединении субстанций происходит их взаимодействие, но в настоящий стандарт такие супрамолекулярные взаимодействия на уровне субстанций намеренно не включены в силу их изменчивой природы и активности. В настоящем стандарте предусмотрена также возможность использования множественных терминов, относящихся к данной субстанции, и многообразной справочной информации, которая может использоваться для классификации субстанций или описания связей между субстанциями.
В дополнение к описанию уровня субстанций в настоящем стандарте предусмотрены также элементы данных, описывающие дополнительную информацию о субстанциях, например, качество, производитель, спецификации производственных процессов, а также информацию о субстанциях, которые часто комбинируются при продаже, но, строго говоря, не образуют одно лекарственное средство. При описании уровня контролируемых субстанций используются четыре группы элементов, предусматривающих информацию, существенную для описания и отслеживания субстанций в лекарственных средствах.
Для различных целей и разных условий предметной области разработки фармацевтических стандартов и стандартов контроля обращения лекарственных средств используется большое число терминов, описывающих базовые понятия. Информационные модели, приведенные в настоящем стандарте, описывают элементы данных и их отношения, которые необходимы для идентификации субстанций. Термины и определения, приведенные в настоящем стандарте, представляют понятия, предназначенные для уникальной идентификации субстанций, описания их свойств и передачи информации о субстанциях, входящих в состав лекарственных средств.
Термины и определения, принятые в настоящем стандарте, предназначены для облегчения интерпретации и применения юридических и нормативных требований, но они не должны превалировать над юридически обязывающими документами. В случае сомнения или потенциального конфликта должны применяться термины и определения, принятые в юридически обязывающих документах.
1 Область применения
В настоящем стандарте представлена информационная модель, предназначенная для идентификации и описания субстанций, входящих в состав лекарственных средств или используемых для медицинских целей, включая биоактивные добавки, пищу и косметику. В нем используются другие релевантные стандарты и внешние терминологические ресурсы.
2 Термины, определения и сокращения
2.1 Термины и определения
Для целей настоящего стандарта используются следующие термины и определения.
2.1.1 активный маркер (active marker): Компонент или группа компонентов растительной субстанции, растительного препарата или лекарственного средства, представляющие интерес для целей контроля и обычно содействующие терапевтической активности.
Примечание - Активные маркеры не эквиваленты аналитическим или индикаторным маркерам, используемым исключительно для идентификации или целей контроля.
2.1.2 аналитические данные (analytical data): Совокупность элементов, описывающих методы и референтные материалы, используемые для определения чистоты или активности субстанции либо для ее идентификации.
Примеры - Раствор для инъекций, таблетка для приема внутрь, твердая капсула с порошком для ингаляции.
2.1.3 химическая связь (chemical bond): Взаимодействие двух или более атомов, приводящее к появлению устойчивого дискретного молекулярного образования.
2.1.4 химическая субстанция (chemical substance): Тип субстанции, которая может быть описана как стехиометрическое или нестехиометрическое единое молекулярное образование и не является ни протеином, ни нуклеиновой кислотой.
Примечание - В качестве химических субстанций обычно рассматриваются "малые" молекулы, которые могут образовывать соли, растворяться или диссоциировать на ионы и могут быть описаны с помощью простой определяющей или представляющей структуры.
2.1.5 хиральная субстанция (chiral substance): Субстанция, чья молекулярная структура не совмещается с ее зеркальным отображением.
2.1.6 компонент (component): Целевая составляющая контролируемой субстанции.
Пример - Диметикон и двуокись кремния являются компонентами симетикона. Инсулин-протамин человеческий и цинк являются компонентами инсулин-изофана человеческого.
Примечание - Компоненты используются для описания субстанций и контролируемых субстанций, которые образуют материал, состоящий из нескольких субстанций.
2.1.7 стехиометрическое уравнение (composition stoichiometry): Количественное соотношение между химическими элементами или частями, образующими субстанцию.
Пример - Натрия фосфат гептагидрат двухосновный и натрия фосфат дигидрат двухосновный являются разными субстанциями.
2.1.8 составляющая (constituent): Субстанция, присутствующая в контролируемой субстанции.
Примечание - Составляющими могут быть загрязнения, ингибиторы, активные или индикаторные маркеры, а также отдельные субстанции, смешиваемые для образования лекарственного средства. Образующие должны выполнять определенную роль и иметь определенное количество. Для описания компонентов, а также предельных значений загрязнений или сопутствующих субстанций должны использоваться спецификации образующих.
2.1.9 нормативный словарь (controlled vocabulary): Конечное множество допустимых значений элемента данных.
Примечания
1 Допустимыми значениями могут быть коды, текст или числа.
2 Определение адаптировано из документа CDISC Clinical Research Glossary V8.0, 2009.
2.1.10 сополимер (copolymer): Полимер, состоящий из нескольких типов повторяющихся ковалентно связанных структурных звеньев.
Примечание - Сополимеры образуются с помощью сополимеризации или последовательной полимеризации двух или более мономеров. Сополимеры могут быть нерегулярными, регулярными, блок-полимерами или привитыми полимерами.
2.1.11 критический шаг процесса (critical process step): Шаг производственного процесса, необходимый для получения контролируемой субстанции.
2.1.12 степень полимеризации (degree of polymerization): Число повторяющихся структурных единиц в полимерном блоке или звене.
Примечание - Этот термин применяется как к гомополимерам, так и блочным сополимерам, где означает степень полимеризации блока.
2.1.13 разное происхождение (diverse origin): Субстанции, которые совместно не выделялись или не являются результатом одного и того же процесса химического синтеза.
Примечание - Вещество, содержащее несколько субстанций, идентифицируется как смешанная субстанция или многокомпонентная контролируемая субстанция (группы 1), основанная на происхождении. Две субстанции, соединенные вместе и не претерпевшие химической реакции, вызывающей возникновение или разрыв специфичных химических связей, должны определяться как отдельные субстанции, даже если они взаимодействовали иным образом, не влияющим на химические связи.
2.1.14 энхансер (enhancer): Регуляторная последовательность нуклеотидов, увеличивающая использование некоторых эукариотических промоторов и способная функционировать в любой ориентации и в любом месте (выше или ниже) по отношению к промотору.
2.1.15 фракция (fraction): Отдельная часть вещества, выделенная из сложного раствора, состав которой отличается от исходного вещества.
Примечание - Это понятие используется для описания исходного вещества и является рекурсивным, то есть следующая фракция может быть выделена из предшествующей фракции, что предполагает определенный порядок перечисления.
Пример - Иммуноглобулины сыворотки крови в поликлональном IgG служат примером рекурсивного фракционирования.
2.1.16 ген (gene): Базовая единица наследственного фактора, которая кодирует первичную структуру белка (белковой субъединицы) и управляет его экспрессией.
2.1.17 элемент гена (gene element): Отдельный элемент гена, например, промотор, энхансер, сайленсер, кодирующая последовательность.
2.1.18 гликозилирование (glycosylation): Ферментативный процесс, связывающий сахариды или олигосахариды с белками, липидами или другими органическими молекулами.
2.1.19 тип гликозилирования (glycosylation type): Значительные отличия гликозилирования в разных типах организмов.
Примечание - Это понятие используется для описания различия гликозилирования у разных типов организмов, например, у человека, млекопитающих, птиц.
2.1.20 качество (grade): Совокупность спецификаций, указывающих качество контролируемой субстанции.
2.1.21 гомополимер (homopolimer): Полимер, состоящий из одинаковых структурных единиц.
2.1.22 изотоп (isotope): Разновидности химического элемента, отличающиеся молекулярной массой.
Примечание - Радионуклиды или нуклиды, у которых относительная атомная масса отличается от природной, показаны в структурном представлении с массовым числом. Изотопы, широко распространенные в природе, представлены символом элемента без массового числа.
Пример - означает атом углерода с атомной массой 13.
2.1.23 производственный процесс (manufacturing): Все стадии изготовления субстанции или лекарственного средства, начиная с получения исходных материалов.
Примечание - В производственный процесс включаются критический процесс, подготовка и обработка материалов, а также критические параметры производства.
2.1.24 вещество (material): Любая сущность, имеющая массу, занимающая определенное пространство и состоящая из одной или нескольких субстанций.
2.1.25 лекарственное средство (medicinal product): Вещество или комбинации веществ, применяемые к организму человека (или животного) для лечения и профилактики заболеваний с целью диагностики или восстановления, коррекции или изменения физиологических функций.
Примечания
1 Лекарственное средство может содержать один или несколько произведенных продуктов и один или несколько лекарственных препаратов.
2 В некоторых юрисдикциях лекарственное средство может быть определено как любое вещество или комбинация веществ, используемых для постановки диагноза.
2.1.26 микрогетерогенность (microheterogeneity): Совместно выделенные субстанции, имеющие незначительные отличия при гликозилировании или посттрансляционной модификации, например, гетерогенность гликозилирования или последовательности.
Примечания
1 Микрогетерогенность не является определяющей характеристикой ни для субстанций, ни для контролируемых субстанций.
2 Микрогетерогенность обусловлена вариабельностью типа гликозилирования (двухантенный, трехантенный), степенью гликозилирования в данном месте (заполнение), гетерогенностью последовательностей вследствие полиморфизма исходного вещества, ошибками трансляции, вариабельностью протеолиза и другими причинами.
2.1.27 смешанная субстанция (mixture substance): Тип полидисперсного вещества, представляющего собой комбинацию простых субстанций, совместно выделенных или полученных в результате одного и того же процесса синтеза.
Примечание - Простые субстанции разного происхождения, соединенные вместе и не претерпевшие химической реакции вследствие этого соединения должны определяться как многокомпонентные вещества (контролируемые субстанции группы 1), а не как смешанные субстанции.
Пример - Гентамицин является смешанной субстанцией, состоящей из гентомицина С1А, гентомицина С1 и гентомицина С2. Моноэфир глицерила является смешанной субстанцией, состоящей из двух простых субстанций, отличающихся положением этерификации. Симетикон, состоящий из диметикона и двуокиси кремния, не считается смешанной субстанцией, поскольку представляет собой два разных вещества, соединенных для получения препарата.
2.1.28 составная часть (moiety): Составная часть субстанции, имеющая полную и непрерывную молекулярную структуру.
Пример - Активность лекарственного средства нередко определяется с помощью сравнения с тем, что называется активной составляющей, которая должна определяться согласованным способом для всех средств. Во избежание неоднозначности в качестве составляющих, по которым определяется активность, следует использовать свободные кислоты и свободные основания.
Примечание - В настоящем стандарте понятие составляющей используется в контексте нестехиометрических химических субстанций и в модификации нуклеиновых кислот, белков, полимеров и структурно-разнородных субстанций. В качестве составляющих должны быть указаны простые субстанции, ионы или молекулы растворителей.
2.1.29 молекулярный фрагмент (molecular fragment): Часть молекулы, имеющая одно или несколько мест соединения с другими фрагментами или составляющими.
Примечание - Понятие молекулярного фрагмента используется при описании полимеров для представления их звеньев и при описании модификаций структуры субстанций.
2.1.30 молекулярная структура (molecular structure): Однозначное представление взаимного расположения атомов.
Примечания
1 Для целей идентификации субстанций сведения о трехмерной конформации не принимаются во внимание. Сведения об отдельных конформациях или конформерах субстанций могут приниматься во внимание или в общем смысле для белков (например, денатурированных), или в случае, когда данное вращение вокруг единственной связи ограничено таким образом, что два разных конформера отделяемы друг от друга и взаимно не преобразуются при комнатной температуре.
2 Представление структуры обычно должно допускать преобразование в графический формат.
2.1.31 молекулярный вес (molecular weight): Масса молекулы однородной субстанции или средняя масса молекул гетерогенной субстанции.
Примечания
1 Единицей молекулярного веса является унифицированная единица атомной массы. Тип молекулярного веса обязательно должен быть указан.
2 При описании полимеров используется несколько разных типов молекулярного веса (средневзвешенный, среднечисловой и т.д.).
2.1.32 многокомпонентное вещество (multi-substance material): Несколько субстанций или контролируемых субстанций разного происхождения, используемые для получения лекарственного средства.
Пример - Многокомпонентными ингредиентами являются инсулин-изофан человеческий, симетикон, алюминиевый лак, никотиновый полакрилекс, натрий-фосфатный буфер.
Примечание - Многокомпонентные вещества являются контролируемыми субстанциями группы 1. Любое лекарственное средство, используемое для изготовления другого лекарственного средства, должно рассматриваться как многокомпонентное вещество.
2.1.33 нуклеиновая кислота (nucleic acid substance): Тип субстанции, представляющей собой линейную последовательность нуклеозидов, обычно связанных между собой эфирами фосфатов.
Примечание - Указывается также тип нуклеиновой кислоты (РНК, ДНК). Олигонуклеотиды и элементы генов (например, промоторы, энхансеры, кодирующие последовательности и сайленсеры) также относятся к нуклеиновым кислотам.
2.1.34 официальное наименование (official name): Наименование, присвоенное официальным уполномоченным органом.
2.1.35 родительский организм (parent organism): Организм, от которого взят исходный биологический материал.
2.1.36 часть (part): Анатомическое происхождение и локализация исходного материала в организме.
2.1.37 лекарственный препарат (pharmaceutical product): Качественная и количественная композиция лекарственного средства в дозированной форме, предназначенная для применения и содержащая информацию о ее государственной регистрации.
Примечания
1 Лекарственное средство может содержать один или несколько препаратов.
2 Во многих случаях лекарственный препарат идентичен произведенному продукту. Однако есть примеры, когда произведенный продукт претерпевает преобразование до применения к пациенту (в качестве лекарственного препарата) и тогда он не тождественен лекарственному препарату.
2.1.38 физическая форма (physical form): Физическое состояние (газ, жидкость или твердое вещество) и тип организации (для твердого вещества).
Примечание - Твердое вещество может быть кристаллическим или аморфным. Может быть также указан полиморфизм.
2.1.39 полидисперсная субстанция (polydisperse substance): Субстанция, содержащая множественные связанные молекулярные компоненты.
Примечание - К полидисперсным субстанциям относятся полимеры и структурно-разнородные вещества, выделенные из одного источника. Химические субстанции, белки и нуклеиновые кислоты с определенными последовательностями к полидисперсным субстанциям не принадлежат.
2.1.40 полидисперсность (polydispersity): Мера разброса молекулярных масс в полимере.
Примечание - Индекс полидисперсности полимера обычно вычисляется как отношение средневзвешенного молекулярного веса к среднечисловому молекулярному весу.
2.1.41 полимер (polymer substance): Тип полидисперсной субстанции, содержащей повторяющиеся структурные единицы, соединенные ковалентными связями.
Примечание - Монодисперсные белки и нуклеиновые кислоты с определенными последовательностями не должны идентифицироваться с помощью элементов данных, описывающих полимеры.
2.1.42 посттрансляционная модификация (post-translational modification): Модификация белка, которая обычно происходит в живом организме во время или после трансляции.
Примечание - Посттрансляционная модификация обычно описывается с помощью структурного представления, а не как модификация белка.
2.1.43 обрабатываемый материал (processing material): Тип вещества, существенного для производственного процесса, но не содержащийся в результирующем веществе.
2.1.44 белковая субстанция (protein substance): Тип субстанции, состоящей из определенной последовательности альфа-аминокислот, соединенных пептидными связями.
Примечание - Синтетические пептиды и белки с определенными последовательностями, рекомбинантные белки и белки высокой чистоты, выделенные из биологических сред, рассматриваются как белковые субстанции. Будучи известными, места гликозилирования, дисульфидные связи и тип гликозилирования (например, грибковый, растительный, у членистоногих, птичий, у млекопитающих, у человека) являются определяющими элементами описания белковых субстанций. В описание всех пептидов, состоящих не более чем из 15 аминокислотных остатков, включается графическое представление их структуры.
2.1.45 белковая последовательность (protein sequence): Порядок и идентичность аминокислот в белковой субъединице.
Примечание - Белковые последовательности представляются однобуквенными кодами Дейхофф от W до C.
2.1.46 белковая субъединица (protein sub-unit): Линейная последовательность аминокислотных остатков, соединенных пептидными связями.
Примечание - Должна собираться информация о повторяющихся субъединицах белков.
Пример - Моноклональные антитела обычно состоят из четырех субъединиц.
2.1.47 результирующий материал (resultant material): Вещество, являющееся результатом критического процесса.
Примечание - Результирующий материал может быть начальным материалом для следующего процесса, конечным материалом или фактической контролируемой субстанцией.
2.1.48 соль (salt): Ионная субстанция, являющаяся продуктом нейтрализации кислоты основанием.
Примечание - Соли являются сложными ионными веществами, состоящими из катионов (положительных ионов) и анионов (отрицательных ионов).
2.1.49 сайленсер (silencer): Последовательность ДНК, подавляющая транскрипцию.
2.1.50 простая субстанция (single substance): Субстанция, которая может быть описана с помощью простого представления или набора описательных элементов.
Примечания
1 Простая субстанция может быть описана, используя один или более элементов следующих пяти типов: химическая субстанция, белок, нуклеиновая кислота, полимер и структурно-разнородная субстанция.
2 Рацематы и субстанции с неизвестной, эпимерной или смешанной хиральностью могут быть причислены к простым субстанциям, поскольку они могут иметь простое структурное представление и стереохимическое описание в форме текста.
2.1.51 сольват (solvate): Субстанция, образуемая путем соединения молекулы растворителя (например, воды или алкоголя) с другой составляющей.
Примечание - Сольваты могут быть как стехиометрическими, так и нестехиометрическими и преимущественно описываются, когда субстанции существуют в твердой форме.
2.1.52 исходный материал (source material): Вещество, из которого получена субстанция. Классифицируется, используя таксономию и анатомическую локализацию.
Примечание - Этот класс используется для описания структурно-разнородных субстанций и полимеров, выделяемых из биологических сред.
2.1.53 контролируемая субстанция (specified substance): Группа элементов, которые описывают многокомпонентное вещество и указывают дополнительную информацию о субстанциях и многокомпонентных материалах, существенную для описания лекарственных средств.
Пример - Дополнительными элементами описания могут служить качество, единицы измерения, физическая форма, компоненты, производитель, критические этапы производственного процесса (к примеру, экстракция, процессы синтеза и рекомбинации), спецификации и аналитические методы, используемые для определения соответствия спецификациям.
Примечание - Для описания контролируемой субстанции могут использоваться четыре различные группы элементов, между которыми существуют определенные отношения.
2.1.54 начальный материал (starting material): Тип вещества, модифицируемого в производственном процессе.
2.1.55 стехиометрическая (stoichiometric): Субстанция, составляющие элементы которой имеют простые целые соотношения.
Примечания
1 Определенная композиционная стехиометрия должна быть представлена в структурном представлении данной субстанции. Чтобы избежать дробных отношений, составляющие элементы должны быть представлены, используя наименьшие общие множители. Субстанции могут быть описаны как стехиометрические или нестехио-метрические.
2 Химические вещества имеют определенную композиционную стехиометрию, если отношения всех составляющих элементов (ионов, противоположных ионов и сольватов) могут быть представлены целыми числами.
2.1.56 стереохимия (stereochemistry): Относительное пространственное расположение атомов в молекулах.
2.1.57 структурно-разнородная субстанция (structurally diverse substance): Тип полидисперсной субстанции, выделенной из одного источника и представляющей собой сложную смесь, которая не может быть описана как смесь ограниченного числа простых субстанций.
Примечание - В описание структурно-разнородных субстанций включаются сведения о неизменных свойствах данного вещества. Модификации, необратимо изменяющие структуру вещества, различные физические свойства или компоненты, вводимые в вещество, например, ген в генно-терапевтических субстанциях, являются определяющими элементами описания структурно-разнородных субстанций. Фракции, выделенные из исходного вещества (масел или соков), также должны быть включены в описание. Белковые смеси, содержащие большое число разных последовательностей, например, поликлональные иммуноглобулины, относятся к структурно-разнородным субстанциям.
2.1.58 субстанция (substance): Любое вещество биологического, минерального или химического происхождения, способное к отдельному существованию и имеющее определенный состав.
Примечания
1 Субстанции могут быть простыми, смешанными или принадлежать к одной из групп контролируемых субстанций. Простые субстанции описываются с помощью минимально достаточного набора данных и делятся на пять типов: химические, белки, нуклеиновые кислоты, полимеры и структурно-разнородные субстанции. Субстанция может представлять собой соль, сольват, свободную кислоту, свободное основание, смесь связанных компонентов, которые совместно выделены или синтезированы. По возможности должны использоваться терминология и определяющие характеристики из фармакопейных статей. Определяющие элементы зависят от типа субстанции.
2 Отдельное существование означает способность субстанции существовать отдельно от любой другой субстанции. Субстанции могут представлять собой хорошо определенные вещества, имеющие определенную химическую структуру, синтетические вещества (например, смеси изомеров), встречающиеся в природе смеси химических веществ, имеющих определенные молекулярные структуры (например, конъюгаты эстрогенов), вещества, произведенные из растений, животных, микроорганизмов или неорганического вещества, химическая структура которых может быть неизвестной или трудно определяемой. Субстанция может представлять собой соль, сольват, свободную кислоту, свободное основание, смесь связанных компонентов, которые совместно выделены или синтезированы.
2.1.59 заместитель (substituent): Молекулярный фрагмент, присоединенный к повторяющейся структурной единице полимера, обычно замещающий атом водорода.
Примечание - Эта информация включается в описание повторяющейся структурной единицы, если замещаемое положение полностью занято. Если оно занято не полностью, то количество заместителя описывается как фрагмент или составляющий элемент структурной модификации.
2.1.60 таутомер (tautomer): Молекулярная структура, способная к обратимому превращению в изомерную молекулярную структуру, обычно включающему в себя свободную миграцию протона между двумя смежными атомами.
Примечание - Предполагается, что с каждой субстанцией будет связана одна таутомерная форма и в руководстве по реализации стандарта будут приведены детальные правила, указывающие таутомерную форму, связанную с каждой химической субстанцией. Если отдельные изомеры могут быть выделены в нормальных условиях и при этом будет известно, что они имеют разные молекулярные свойства, то они должны рассматриваться как разные субстанции.
2.1.61 таксономия (taxonomy): Научная классификация организмов, необходимая для описания источника исходного материала субстанций, выделяемых из биологических сред.
Примечание - Для всех полидисперсных субстанций, выделяемых из биологических сред, должна быть указана таксономическая информация на уровне вида, если такая информация доступна и исходный материал произведен из одного вида организмов. Для идентификации организма-источника необходимо указать таксономическое семейство, род и вид, а также автора таксона. По возможности должны быть указаны также царство, тип, класс и порядок. Промежуточная информация (например, подвид, вариант, штамм) указываются, если соответствующие формы проявляют заметные различия или в составе вещества, или в функции.
2.2 Сокращения
2.2.1 ACS - Американское химическое общество (American Chemical Society)
2.2.2 Номер ASK - Идентификатор фармацевтической субстанции в Германском каталоге Arzneistoffkatalog
2.2.3 BAN - Британское зарегистрированное наименование (British Approved Name)
2.2.4 DCF - Французское зарегистрированное наименование (![]() Communes
Communes ![]() )
)
2.2.5 ЕР - Европейская фармакопея (European Pharmacopeia)
2.2.6 INCI - Международная номенклатура косметических ингредиентов (International Nomenclature of Cosmetic Ingredients)
2.2.7 INN - Международное непатентованное наименование, MHH (International Non-proprietary Name). Известны также аббревиатуры rINN - рекомендованное международное непатентованное наименование (recommended International Non-proprietary Name) и pINN - предложенное международное непатентованное наименование (proposed International Non-proprietary Name)
2.2.8 JAN - Японское зарегистрированное наименование (Japanese Approved Name)
2.2.9 JP - Японская фармакопея (Japanese Pharmacopoeia)
2.2.10 UCUM - Унифицированные коды единиц измерения (Unified Code for Units of Measure)
2.2.11 USAN - Наименование, зарегистрированное в США (United States Adopted Name)
2.2.12 USP - Фармакопея США (United States Pharmacopeia)
3 Требования
3.1 Общие положения
Структурирование описания субстанций и контролируемых субстанций должно быть согласовано с элементами данных и отношениями, представленными на диаграммах, приведенных в настоящем разделе. Дальнейшее уточнение этих элементов и отношений может быть проведено в руководстве по реализации стандарта.
3.2 Понятия, требуемые для уникальной идентификации и описания субстанций
К субстанциям относятся простые, смешанные и контролируемые субстанции.
Примечание - Используемый ниже термин "субстанция" обычно означает простую или смешанную субстанцию. Термин "контролируемая субстанция" обычно относится к субстанции, для которой предоставлено более детальное описание, включающее в себя информацию о производстве, спецификациях, физической форме и многокомпонентных материалах, являющихся компонентами формулы лекарственного средства.
В настоящем стандарте даются определения понятий, необходимых для уникальной идентификации фармацевтических субстанций на международном уровне, когда она необходима.
Такая идентификация должна быть основана на следующих принципах:
a) определение субстанции должно быть основано на том, каким веществом они являются, а не на способе применения или производства;
b) для идентификации субстанции должны использоваться неизменные свойства, не зависящие от физической формы, качества или степени чистоты;
c) субстанциями могут быть простые молекулярные соединения, выделенные или синтезированные совместно;
d) во избежание неоднозначности и для упрощения реализации смешанная субстанция должна определяться как комбинация простых субстанций;
e) в качестве субстанций не должны рассматриваться разнородные вещества, соединенные вместе для получения лекарственного средства или многокомпонентного материала.
Пример - Симетикон не должен быть причислен к субстанциям, поскольку оно состоит из диметикона и двуокиси кремния, имеющих разное происхождение и обычно не выделяемых совместно.
Сложные вещества, выделяемые из биологических сред, и смеси, которые не могут быть определены или представлены как ограниченное число химических структур, определяются на основе таксономии источника, либо на основе части и фракции. Вещества, имеющие неопределенную композиционную стехиометрию и подвергающиеся взаимодействию неопределенного характера, не должны рассматриваться как субстанции.
Примечание - Ввиду сложности определения степени, активности и композиционной стехиометрии не ковалентных взаимодействий, при определении субстанций такие типы взаимодействий не принимаются во внимание. Единственными исключениями служат ионные (соли) и сольватные (гидраты) взаимодействия простых химических соединений и хорошо определенных полимеров. Вещества, составляющие которых взаимодействуют с полимерами, комплексные среды или циклодекстрины обычно не рассматриваются как субстанции. Простые соли полимеров, например, полистирен сульфонат натрия, должны рассматриваться как простые субстанции.
Пример - Никотиновый полакрилекс рассматривается как две разных субстанции: никотин и полакрилекс. Инсулин-изофан человеческий также рассматривается как две разных субстанции: протамин и человеческий инсулин. Однако никотиновый полакрилекс и инсулин-изофан человеческий могут рассматриваться как простые контролируемые субстанции. Липосомальный доксорубицин может рассматриваться как контролируемая субстанция, содержащая доксорубицин и компоненты липосом.
Субстанции могут быть описаны, используя один или более элементов следующих групп:
- химическая субстанция,
- белок,
- нуклеиновая кислота,
- полимер,
- структурно-разнородная субстанция,
- смесь.
Для всех типов субстанций должна иметься возможность указать официальные наименования, синонимы, изотопную и другую справочную информацию.
Рисунок 1 - Высокоуровневая информационная модель субстанции
|
Рисунок 1 - Высокоуровневая информационная модель субстанции
3.3 Понятия, требуемые для описания контролируемых субстанций
Информация о контролируемых субстанциях должна включать в себя дополнительную информацию о субстанциях и многокомпонентных веществах. При описании контролируемой субстанции должны быть указаны более детальные характеристики простой субстанции или композиции вещества, содержащего несколько субстанций или несколько физических форм.
Для упрощения реализации элементы, необходимые для описания контролируемых субстанций, должны быть подразделены на четыре группы.
Эти группы определены следующим образом:
- Группа 1: составляющие (включая компоненты вещества, содержащего несколько субстанций, маркеры и растворители, используемые для изготовления растительных или аллергенных экстрактов), физическая форма субстанции, а также любые свойства, существенные для описания контролируемой субстанции (например, размер липосомных препаратов);
- Группа 2: ограниченные сведения о производстве, родительской субстанции или контролируемой субстанции группы 1, производитель, высокоуровневая классификация метода производства, общая характеристика производственного процесса (например, синтез, экстракция, восстановление), тип производимой системы (например, клеточная линия, растительная или животная ткань), производимая система (конкретная клеточная линия);
- Группа 3: родительская субстанция или контролируемая субстанция группы 1, качество вещества, а также источник, регламентирующий данное качество (фармакопея, технические условия);
- Группа 4: детальная информация о производственном процессе, составляющие (примеси и очистители, не указанные в информации группы 1), спецификации.
Отношения между элементами описания контролируемых субстанций показаны на рисунке 2.
Рисунок 2 - Высокоуровневая информационная модель контролируемой субстанции
|
Рисунок 2 - Высокоуровневая информационная модель контролируемой субстанции
3.4 Наименование субстанций
Для каждой субстанции должно быть указано хотя бы одно наименование или фирменный код.
Если наименование является официальным, то должен быть указан уполномоченный орган, присвоивший наименование, язык и территория юрисдикции, где это наименование используется.
Настоящий стандарт должен быть нейтральным по отношению к любой систематизации или официальной номенклатуре.
Примечание - Предполагается, что каждая субстанция будет иметь наименование на английском языке. У этого наименования могут быть синонимы. Переводы английских наименований на другие языки также могут быть предусмотрены в настоящем стандарте. Языки и территории юрисдикции должны быть указаны в соответствии со стандартами ИСО.
Информационная модель класса "Наименование субстанции" показана на рисунке 3.
Рисунок 3 - Информационная модель наименований субстанции
|
Рисунок 3 - Информационная модель наименований субстанции
3.5 Требования к уникальным идентификаторам
Каждой субстанции и контролируемой субстанции должен быть присвоен единственный уникальный идентификатор, постоянно с ней связанный и не являющийся порядковым номером.
Уникальный идентификатор должен быть не смысловым, случайным, иметь фиксированную длину и встроенные контрольные цифры.
Уникальные идентификаторы должны быть общедоступными и использоваться без авторских отчислений.
Уникальные идентификаторы должны быть присвоены зарегистрированным и исследуемым субстанциям, наполнителям и загрязнениям, сольватам, ионам, фрагментам и составляющим элементам.
Примечание - Разработано большое число химических и биологических номенклатур, описывающих фармакологическое действие лекарств. Функциональные системы именования, например, МНН или USAN, имеют значительную ценность для описания как молекулярной структуры, так и биологического действия субстанции. Однако присвоение уникальных идентификаторов на основе использования таких систем классификации может привести к увеличению требований к их сопровождению, поскольку применение систем классификации нередко требует широкой экспертизы и разработки контролируемых словарей. К тому же перевод любой семантической системы на другой язык всегда представляет значительную проблему.
Когда субстанция описана и ей присвоен уникальный идентификатор, важно обеспечить его постоянную связь с данной субстанцией. Субстанция должна иметь только один уникальный идентификатор. Отсюда вытекает необходимость разработки детальных правил описания субстанций, которые должны быть представлены в руководстве по реализации стандарта.
Примечание - Основной целью уникального идентификатора является его использование при электронной обработке данных. Применение идентификатора фиксированной длины с встроенными контрольными цифрами облегчит его обработку и поможет идентифицировать ошибки ввода, которые могут возникать в системах обработки данных.
Информационная модель, описывающая отношения между наименованиями, уникальными идентификаторами, информацией о субстанции и контролируемой субстанции показана на рисунке 4.
Рисунок 4 - Информационная модель описания субстанции, контролируемой субстанции, наименований и идентификаторов
|
Рисунок 4 - Информационная модель описания субстанции, контролируемой субстанции, наименований и идентификаторов
3.6 Типы субстанций
3.6.1 Общие положения
Если субстанцию можно описать и как простую субстанцию, и как смешанную субстанцию, то она должна быть описана как простая субстанция.
Примечание - Рацемические субстанции будут отнесены к простым субстанциям, поскольку они могут быть описаны с помощью простого структурного представления и отличаются от хиральных субстанций.
3.6.2 Наборы элементов, общие для разных типов субстанций
3.6.2.1 Структура
Описание структуры должно содержать достаточный объем графической и текстовой информации, указывающей атомы, их связи, а также композиционное отношение составляющих частей.
Структурные представления должны описывать полную молекулярную структуру с указанием всех известных стереохимических характеристик. Для описания молекулярных фрагментов и составляющих частей также должны использоваться структурные представления.
3.6.2.2 Изотоп
Радионуклиды и другие нуклиды, не присутствующие в природе в достаточном количестве, должны быть описаны как изотопы. Описание должно содержать характеристики, использующие контролируемую терминологию, взятую из международно признаваемых справочных источников.
Присутствие изотопов должно быть также указано в структурном представлении.
Радифармацевтические препараты должны идентифицироваться по типу основной субстанции, а не по типу обогащения.
Примечание - Для каждого нуклида должны быть указаны период полураспада, тип и энергия излучения, родительские и дочерние нуклиды.
Пример: ибритумомаб тиуксетан [иттрий-90] должен быть описан как белковая субстанция. Тироксин с йодом-131 должен быть описан как химическая субстанция.
Информационная модель описания структуры и изотопа показана на рисунке 5.
Рисунок 5 - Информационная модель описания структуры и изотопа
|
Рисунок 5 - Информационная модель описания структуры и изотопа
3.6.2.3 Модификация
Необратимые изменения исходной молекулярной структуры субстанции должны быть описаны как модификация предшествующего вещества. Модификация субстанции обычно приводит к новой химической субстанции.
Примечание - Модификации химических субстанций естественным образом отражаются в структурном представлении.
Необратимые изменения исходной структуры полимеров, белков, нуклеиновых кислот и структурно-разнородного вещества должны быть описаны, используя элементы класса "МОДИФИКАЦИЯ". Если происходит модификация окончательной структуры, но фактическое положение замещения неизвестно или меняется, то модификации должны быть описаны как добавление составных частей или молекулярных фрагментов к исходному веществу.
Пример - Модифицирующие процессы, например, термальная обработка, должны быть указаны как модификации. Термально агрегированный альбумин представляет собой субстанцию, отличающуюся от альбумина и альбумина, агрегированного с помощью химических агентов сшивок.
Если модификация окончательной структуры не может быть определена, то должно быть приведено минимальное описание процесса модификации.
Рисунок 6 - Информационная модель описания модификаций
|
Рисунок 6 - Информационная модель описания модификаций
3.6.2.4 Справочная информация
Для каждого типа субстанции должны быть согласованным способом указаны дополнительные типы справочной информации. Такая информация может включать в себя классификацию и целевое назначение активных субстанций.
Настоящий стандарт не содержит указаний по классификации фармакологического действия или определению предполагаемого целевого назначения субстанций или контролируемых субстанций. Он позволяет указывать такую информацию, если она предоставлена или доступна. Эта информация не должна влиять на генерирование нового уникального идентификатора.
Справочная информация должна быть указана для всех типов субстанций и для контролируемых субстанций группы 1.
Примечание - Идентификация генов, от которых произведены белки, информация о целях и коды, взятые из систем кодирования, также представляют собой справочную информацию. В настоящем стандарте предложена согласованная структура, предназначенная для указания такой информации в привязке к субстанции. Особенно важны такие системы классификации, как АТХ ВОЗ, NDF-RT Администрации по делам ветеранов США, которые позволяют кодировать информацию о субстанциях. Информация о целях важна для моноклональных и поликлональных антител и малых молекул, предназначенных для связывания специфичных молекулярных мишеней.
Отношения между элементами справочной информации показаны на рисунке 7.
Рисунок 7 - Информационная модель справочной информации
|
Рисунок 7 - Информационная модель справочной информации
3.6.2.5 Исходный материал
Для исходного материала должна быть описана таксономия и анатомическая локализация, а также фракция вещества, которая может быть получена или модифицирована для производства субстанции. Этот информационный класс должен использоваться для описания структурно-разнородных и полимерных субстанций, выделенных из биологических сред.
При необходимости, используя нормативный словарь, должно быть описано таксономическое и анатомическое происхождение.
Информационная модель для класса исходный материал показана в рисунке 8.
Рисунок 8 - Информационная модель исходного материала
|
Рисунок 8 - Информационная модель исходного материала
3.6.2.6 Таксономия
Таксономическая информация должна быть указана для полимеров и структурно-разнородных веществ, а также для смешанных субстанций, выделенных из биологических сред.
Настоящий стандарт не содержит рекомендаций по генерации или квалификации таксономической информации. Согласованная таксономическая информация должна быть взята из ограниченного числа авторитетных источников.
3.6.3 Химические субстанции
Описание химических субстанций должно включать в себя представление молекулярной структуры, а также, при необходимости, стереохимические и релевантные физические характеристики.
Для каждой химической субстанции должно быть указано простое структурное представление.
Если известна стереохимия, то она должна быть полностью указана. Если она не известна, то должны быть точно идентифицированы положения, для которых стереохимия неизвестна.
Графическое представление структуры должно быть дополнено текстовым описанием атомов и межатомных связей в молекулярной структуре.
Должны быть указаны фиксированные и переменные стехиометрические отношения составных частей субстанции. Для субстанций, составные части которых имеют переменную композиционную стехиометрию, должен быть указан диапазон композиции.
Неизвестная композиционная стехиометрия данной составной части или частей, если таковая имеет место, также должна быть указана. Композиционная стехиометрия должна быть указана как можно полнее, допускается также неизвестная или переменная композиционная стехиометрия.
Физические свойства должны быть указаны только для простых субстанций, имеющих переменную или неизвестную стехиометрию, если с их помощью можно отличить две субстанции друг от друга.
В структурном представлении должны быть описаны изотопы. По возможности должно быть указано положение или положения замещения. Субстанции должны иметь описание, не зависящее от степени изотопного обогащения данным радиоизотопом.
Подобно химическим субстанциям, белковые субстанции (подраздел 3.6.4) и нуклеиновых кислот (подраздел 3.6.5) должны быть описаны как отдельные определенные молекулярные соединения. Микрогетерогенность не должна быть описана вследствие присущей ей вариабельности. Циклические пептиды и те, что в основном произведены из не протеиногенных аминокислот, а также существенно модифицированные олигонуклеотиды должны быть описаны как химические субстанции.
Информационная модель описания химической субстанции показана на рисунке 9.
Рисунок 9 - Информационная модель описания химической субстанции
|
Рисунок 9 - Информационная модель описания химической субстанции
3.6.4 Белковые субстанции
Все субстанции, содержащие определенную последовательность L-альфа-аминокислот, соединенных пептидными связями, должны быть описаны, используя элементы описания белков.
Примечание - Смеси белков, например, иммуноглобулины, имеющие большое число отдельных белков с разными последовательностями, должны быть описаны как структурно-разнородные субстанции.
Белки, у которых отличаются последовательности, тип гликозилирования, дисульфидные связи или положения гликозилирования, должны быть описаны как разные субстанции.
Пример - Интерферон альфа-2а и интерферон альфа-2b, у которых последовательности отличаются одним остатком, должны быть описаны, как отдельные субстанции.
Белки должны состоять из одной или нескольких белковых субъединиц.
Все не гликозилированные белки должны быть описаны независимо от метода синтеза, клеточной линии или биологической среды организма, из которых белок был произведен или выделен.
Белки должны быть описаны без учета микрогетерогенности.
Тип гликозилирования должен отражать существенные различия в гликозилировании и определяться в зависимости от вида клетки или ткани, из которой белок был выделен.
Для описания типа гликозилирования должен использоваться ограниченный набор нормативных терминов.
Белки должны быть описаны как конечная экспрессирующаяся последовательность, прекурсоры белков с сигнальными пептидами и другие прекурсоры белков не должны описываться.
Белки, которые необратимо модифицированы с помощью химического или физического процесса, должны быть описаны как разные белки.
В описаниях модифицированных белков должны быть указаны структурные изменения, произошедшие в результате модификации, если конечная структура известна.
В описаниях модификаций должны быть указаны или составляющие части, или молекулярные фрагменты, присоединяемые к структуре белка. Если же модификация конечной структуры не происходит, то вместо этого должен быть описан процесс модификации.
Молекулярные фрагменты должны иметь функциональную роль, которая должна быть указана с помощью нормативной терминологии.
Для специфичных модификаций должны быть описаны положение и модифицированный остаток.
Пост-трансляционные модификации должны быть указаны только в тех случаях, когда они существенны для активности или присутствуют в доминирующих формах белков.
В некоторых ситуациях модификация не может быть описана конечной структурой. В таких случаях процесс модификации должен быть описан минимальным образом, указывая модифицирующий агент или физические условия, которые вызвали необратимые изменения.
Очищенная кровь или вещества тканей, чья предполагаемая функциональность относится к белку или к ограниченному числу белков с различными известными последовательностями аминокислот, должны быть описаны как белок.
Нековалентные взаимодействия между белками или пептидными звеньями не должны быть указаны. Исключение составляют белковые звенья, тесно ассоциируемые с хорошо определенной композиционной стехиометрией.
Может быть также указана справочная информация, не входящая в состав идентифицирующей, включая:
- тип и подтип белка,
- лиганд, подложку или мишень,
- тип взаимодействия белка,
- ген, продуцирующий белок.
По возможности справочная информация должна быть указана, используя нормативный словарь.
Примечания
1 Моноклональные иммуноглобулины описываются как белки. Соматропин, негликозилированный белок, который вырабатывается в E.Coli, клетках млекопитающих и дрожжевых клетках, должен быть описан как одна и та же субстанция независимо от клеточной линии, на которой он выращен.
2 К текущим типам гликозилирования относятся грибковый, растительный, у членистоногих, птичий, у млекопитающих, у человека.
3 Изменения даже в единственной аминокислоте должны приводить к разным субстанциям. Например, интерферон альфа-2а и интерферон альфа-2b, у которых последовательности отличаются одной аминокислотой, должны быть описаны, как отдельные субстанции. Агрегированный альбумин человека сывороточный, полученный в результате необратимой частичной физической денатурации, должен идентифицироваться как субстанция, отличающаяся от альбумина человека сывороточного.
Информационная модель описания белковой субстанции показана на рисунке 10.
Рисунок 10 - Информационная модель описания белковой субстанции
|
Рисунок 10 - Информационная модель описания белковой субстанции
3.6.5 Нуклеиновые кислоты
Идентифицирующими элементами нуклеиновой кислоты должны быть последовательность, тип (РНК, ДНК, смешанный), а также все модификации, повлиявшие на молекулярную структуру.
Гены, плазмиды, части вирусных векторов, используемых в генной терапии, состоящие из аминокислот, должны быть описаны как нуклеиновые кислоты.
Отдельные элементы генов должны быть описаны и идентифицированы как субстанции.
Необратимые модификации, будь то физические или химические, которые необратимо модифицируют исходную молекулярную структуру, должны быть описаны с использованием элементов класса "МОДИФИКАЦИЯ".
Для генной терапии в качестве идентификатора должна использоваться вся последовательность трансформирующего/трансдуцирующего вектора. Каждый элемент гена должен быть указан и определен как субстанция.
Примечание - К элементам генов должны быть отнесены промоторы, энхансеры, сайленсеры и т.д. Для нуклеиновых кислот, используемых в генной терапии, должна быть указана вся последовательность трансформирующего/трансдуцирующего компонента вместе с каждым элементом гена.
Информационная модель описания нуклеиновой кислоты показана на рисунке 11.
Рисунок 11 - Информационная модель описания нуклеиновой кислоты
|
Рисунок 11 - Информационная модель описания нуклеиновой кислоты
3.6.6 Полимеры
К полимерам относятся вещества, имеющие гетерогенную природу и содержащие повторяющиеся структурные единицы.
Для идентификации полимеров должно использоваться сочетание нормативного словаря с представлениями молекулярной структуры повторяющихся структурных единиц, идентификацией заместителей, которые присоединены к повторяющейся структурной единице и описаны как фрагмент или составляющий элемент модификации, молекулярным весом или полидисперсностью вещества. Степень полимеризации, мономеры, использованные для синтеза синтетических полимеров или сополимеров, исходное вещество для полимеров естественного происхождения, конечные группы полимеров, а также физические или биологические свойства должны быть указаны, если они известны и необходимы для различения вещества. Полимеры должны быть описаны на уровне специфичности, достаточном для различения вещества, и более широкие описания полимеров не должны поощряться.
Примеры - Для идентификации полимеров, содержащих повторяющиеся структурные единицы полиэтиленгликоля, всегда должны использоваться либо степень полимеризации, либо молекулярный вес. Общая субстанция полиэтиленгликоля не должна идентифицироваться как субстанция ввиду значительных вариаций этих типов вещества и соображений безопасности, связанных со степенью полимеризации.
Тип полимера должен определяться по числу повторяющихся структурных единиц и по связям между ними. Должен быть разработан нормативный словарь, требуемый для описания класса полимера, структуры полимера и типа последовательности сополимера.
Физические или биологические свойства должны учитываться при идентификации, если эти сведения необходимы для различения полимерных субстанций друг от друга и связан с молекулярными структурами полимерного ансамбля.
Примечание - Словарные значения класса полимера должны включать в себя гомополимер и сополимер, значения структуры полимера должны включать в себя линейную, разветвленную и пространственную; значения типа последовательности сополимера должны включать в себя нерегулярный, блочный и чередующийся. Индекс полидисперсности полимера обычно вычисляется как отношение средневзвешенного молекулярного веса к среднечисловому молекулярному весу. Такие свойства, как вязкость, светорассеивание или скорость осаждения, являющиеся показателем молекулярного веса, а также биологические свойства, например ингибирование ферментов, также могут служить отличительными признаками.
Информационная модель описания полимера показана на рисунке 12.
Рисунок 12 - Информационная модель описания полимера
|
Рисунок 12 - Информационная модель описания полимера
3.6.7 Структурно-разнородные субстанции
Субстанции, которые не могут быть представлены как ограниченное число относительно простых субстанций, то есть смешанных субстанций, должны быть описаны как структурно-разнородные.
Для идентификации структурно-разнородных субстанций должны быть указаны исходное вещество, из которого получена субстанция, модификации, которые привели к необратимым изменениям исходного вещества, и/или физические либо биологические свойства, присущие молекулярной композиции вещества.
Физические или биологические свойства должны быть указаны только в случаях, когда они существенны для идентификации и различения вещества.
Примечание - Большинство структурно-разнородных субстанций получено из биологических организмов. Ими могут быть также сложные природные материалы, например каменноугольная смола или нефть.
Пример - Легкая нефть отличается от нефти свой вязкостью и удельным весом.
Существенным элементом идентификации полидисперсных субстанций биологического происхождения является родительский организм, от которого было получено исходное вещество. Для родительских организмов необходимо указать таксономию от семейства по меньшей мере до вида. Варианты, культуры, штаммы или субштаммы должны участвовать в идентификации, если внутривидовые различия приводят к ощутимым изменениям функциональности или композиции. Царство, тип, класс и порядок могут быть указаны, если они известны, но этот уровень таксономии обычно не является определяющим для идентификации.
Примечание - Для растительных субстанций обычно указывают семейство родительского организма, род, вид и часть или части. Если используются конкретные части растения, то для идентификации необходимо указать списки отдельных частей, например, цветок, лист и стебель. Может потребоваться также указание сегмента жизненного цикла растения, например полное цветение. Ввиду вариабельности составляющих, получаемых в процессах экстракции (растворитель, температура, время) и зависящих от условий роста (сезон, место сбора, тип почвы, использование удобрений, количество дневного света и воды), биологические экстракты должны идентифицироваться своим источником, если только они не представляют собой конкретную фракцию или класс химических соединений, например сеннозиды (гликозиды антрахинона, извлекаемого из Senna alexandrina).
Сорт или разновидность растения должны быть указаны как признак другой субстанции, если существуют различия в составляющих или функциональности. Для других организмов, обычно для бактерий и вирусов, необходимо указывать подвид, вариант, штамм или тип, чтобы обеспечить аккуратное описание и отличить от других субстанций.
Пример - Брокколи и экстракт брокколи должны быть описаны как одна и та же субстанция. Брокколи и цветная капуста, представляющие различные группы сортов или разновидностей Brassica oleracea и отличающиеся внешним видом и составляющими, должны быть описаны как разные субстанции, несмотря на то, что имеют одинаковые гены и принадлежат к одному и тому же виду. Вирусы гриппа должны быть описаны на уровне, позволяющем отличить различные штаммы вакцин.
Поликлональные иммуноглобулины должны быть описаны как структурно-разнородные вещества с указанием типа иммуноглобулина, целевого антигена, а также вида источника.
Клетки и ткани должны быть описаны как структурно-разнородные субстанции. На уровне субстанции указание конкретного донора или степени пулирования не требуется.
Масла, соки и экссудаты растений должны быть отдельными субстанциями. Масла и соки должны быть описаны как фракции вещества, из которого они выделены. Вещества и процессы (например, время, температура, растворитель), используемые для приготовления экстрактов, варьируются. Поэтому эссенции, настойки и отвары не должны служить признаком разных субстанций. Вместо этих характеристик должны быть указаны родительский организм и та его часть, из которой они произведены.
Пример - Оливковое масло является фруктовым маслом, полученным из Olea europaea. Апельсиновый сок является фруктовым соком, полученным из Citrus sinensis. Зеленый чай и экстракты зеленого чая должны быть описаны как листья Camellia sinensis.
Информационная модель описания структурно-разнородной субстанции показана на рисунке 13.
Рисунок 13 - Информационная модель описания структурно-разнородной субстанции
|
Рисунок 13 - Информационная модель описания структурно-разнородной субстанции
3.6.8 Смешанные субстанции
Смешанные субстанции должны быть описаны как простые комбинации отдельных субстанций, которые или совместно выделены, или являются результатом одного и того же процесса синтеза.
Для смешанных субстанций природного происхождения должно быть указано исходное вещество, из которого они произведены.
К смешанным субстанциям не должны относиться разнородные вещества, соединенные для получения препарата.
Пример - Симетикон не должен быть причислен к субстанциям, поскольку он состоит из диметикона и двуокиси кремния, имеющих разное происхождение и обычно не выделяемых совместно. Он должен быть описан как контролируемая субстанция группы 1.
Выделяются три типа смешанных субстанций:
- "все из", в которых должны присутствовать все отдельные субстанции;
- "любая из", в которых должна присутствовать хотя бы одна из отдельных субстанций;
- "одна из", в которых должна присутствовать только одна из отдельных субстанций.
Настоящий стандарт требует указывать, что отдельная субстанция всегда присутствует в смешанных субстанциях типа "все из". При этом относительное количество субстанции не должно быть указано.
Примечание - Относительные количества субстанций в смешанной субстанции должны быть указаны на уровне контролируемой субстанции способом, согласованным со спецификацией производителя или фармакопеи. Относительные количества не должны быть указаны на уровне субстанции в связи с потенциальными различиями спецификаций производителей и фармакопей.
Все смешанные субстанции должны состоять из отдельных субстанций.
Включение другой смешанной субстанции в состав смешанной субстанции не допускается.
Такое включение должно быть описано как единая смесь всех составляющих субстанций.
Все субстанции, входящие в состав смешанной субстанции в количестве, превышающем один процент, должны быть описаны как составляющие элементы смешанной субстанции.
Загрязнения и очистители обычно не считаются компонентами смешанной субстанции.
Смеси, которые не могут быть описаны как ограниченное число соединенных субстанций, должны быть описаны как структурно-разнородные субстанции.
Информационная модель описания смешанной субстанции показана на рисунке 14.
Рисунок 14 - Информационная модель описания смешанной субстанции
|
Рисунок 14 - Информационная модель описания смешанной субстанции
3.6.9 Коды субстанций
Хотя коды субстанций и соответствующие системы кодирования не являются определяющими элементами описания конкретной субстанции, они могут быть указаны в соответствии с представленной ниже информационной моделью.
Пример - К таким кодам относятся регистрационные номера службы CAS (Chemical Abstract Service), коды системы EINECS (European Inventory of Existing Commercial Chemical Substances), Европейские коды лекарств EVMPD (European Drug Codes) и Японские коды лекарств (Japanese Drug Codes).
Информационная модель кода субстанции показана на рисунке 15.
Рисунок 15 - Информационная модель кода субстанции
|
Рисунок 15 - Информационная модель кода субстанции
3.6.10 Классификация субстанций
Хотя классификация субстанций не является определяющими элементом описания конкретной субстанции, она может быть указана в соответствии с представленной ниже информационной моделью.
Информационная модель классификации субстанций показана на рисунке 16.
Рисунок 16 - Информационная модель классификации субстанций
|
Рисунок 16 - Информационная модель классификации субстанций
3.7 Описание контролируемых субстанций
3.7.1 Общее описание
Хотя в модели описания субстанций предусмотрена информация, существенная для описания веществ в составе лекарственных средств, нередко регуляторные органы требуют дополнительные сведения, которые не предусмотрены на уровне субстанции. Для более детального описания веществ, присутствующих в лекарственных средствах, должна использоваться общая информационная модель контролируемой субстанции.
Структура описания контролируемой субстанции должна обеспечить согласованное представление различной информации, включая:
- качество или чистоту;
- сведения о производстве, включая информацию о производителе и критических процессах производства;
- аналитические данные,
- составляющие, включая их количества и роль, если она известна и является существенной;
- спецификации (загрязнения и соответствующие предельные значения количества субстанции должны быть указаны в описании составляющих);
- описание единицы измерения;
- референтное вещество;
- аналитические методы, используемые для определения качества.
Для удовлетворения потребностей в идентификации лекарственного средства элементы описания контролируемой субстанции должны быть разделены на четыре группы и идентификатор контролируемой субстанции должен быть связан с каждой группой элементов.
Примечание - Группировка элементов упрощает модель данных и облегчает как региональные, так и итерационные реализации стандарта.
3.7.2 Контролируемые субстанции группы 1
Элементы группы 1 должны использоваться для указания вещества, содержащего несколько субстанций, растворителей, используемых для приготовления растительных или аллергенных экстрактов, специфичных маркеров или иных признаков, присутствующих в веществах биологического происхождения, при необходимости физической формы субстанции, а также любых свойств, существенных для описания вещества.
Группы элементов, используемых для определения контролируемой субстанции группы 1, должны включать в себя составляющие, физическую форму и свойство (рисунок 17).
В группу составляющих компонентов должны быть включены субстанции, специально добавленные для получения многокомпонентного вещества, растворители, используемые для приготовления экстрактов, специфичные маркеры или иные признаки, присутствующие в веществах животного происхождения.
Загрязнения или очистители не включаются в число составляющих компонентов контролируемой субстанции группы 1.
Примечания
1 Такая группировка элементов позволяет давать определения многих промышленно производимых веществ, используемых в составе лекарственных средств.
2 Загрязнения или очистители будут включены как элементы описания контролируемой субстанции группы 4.
Информационная модель описания контролируемой субстанции группы 1 показана на рисунке 17.
Рисунок 17 - Информационная модель описания контролируемой субстанции группы 1
|
Рисунок 17 - Информационная модель описания контролируемой субстанции группы 1
3.7.3 Контролируемые субстанции группы 2
Элементы группы 2 должны использоваться для указания сведений о производителе субстанции или контролируемой субстанции группы 1 и минимальной информации о производственном процессе.
Минимальная информация о производственном процессе должна включать в себя общую характеристику метода производства (например, синтез, экстракция, восстановление), типа производственной системы (например, клеточную линию, растительные или животные ткани), производственную систему (конкретную клеточную линию). Номер версии критического процесса используется для различения контролируемых субстанций группы 2, при производстве которых произошли существенные изменения критических процессов. Начальный номер версии критического процесса должен быть равен 1, а следующие номера присваиваются последовательно.
Примечание - Элементы группы 2 позволяют прослеживать субстанцию до производителя. Они позволяют также отличать синтетические пептиды от рекомбинантных и получать информацию о производимой клеточной линии.
Информационная модель описания контролируемой субстанции группы 2 показана на рисунке 18.
Рисунок 18 - Информационная модель описания контролируемой субстанции группы 2
|
Рисунок 18 - Информационная модель описания контролируемой субстанции группы 2
3.7.4 Контролируемые субстанции группы 3
Элементы группы 3 должны указывать качество вещества, а также источник, регламентирующий данное качество.
Элементы группы 3 должны использоваться для различения фармакопейного качества и технического качества вещества.
Если фармакопейные статьи, описывающие субстанцию в разных фармакопеях, не гармонизированы, то субстанции, удовлетворяющие разным фармакопеям, должны рассматриваться как разные контролируемые субстанции группы 3.
В качестве родительской субстанции должна быть указана контролируемая субстанция группы 1, к которой относится указанное качество.
Примечание - Для большинства фармацевтических субстанций используются показатели качества USP (Фармакопея США), ЕР (Европейская фармакопея) и JP (Фармакопея Японии). К растительным субстанциям должны применяться такие показатели качества, как "стандартизованная", "заданный количественный состав", "нестандартизованная".
Пример - Вода является родительской субстанцией для контролируемой субстанции группы 3 "стерильная вода для инъекций USP".
Информационная модель описания контролируемой субстанции группы 3 показана на рисунке 19.
Рисунок 19 - Информационная модель описания контролируемой субстанции группы 3
|
Рисунок 19 - Информационная модель описания контролируемой субстанции группы 3
3.7.5 Контролируемые субстанции группы 4
Элементы группы 4 должны указывать наиболее детальные сведения о субстанции. Они должны включать в себя информацию о критических производственных процессах, спецификации (для составляющих должны быть указаны примеси и пределы содержания сопутствующих веществ), словесное определение единицы измерения, референтное вещество и аналитические методы, используемые для определения эффективности и чистоты.
Примечание - Специфичная информация о контролируемых субстанциях группы 4 нередко представляется в регистрационное досье в неструктурированной форме, что затрудняет ее сбор и организацию. Применение полей данных, предложенных в настоящем стандарте, является одним из способов организации и структурирования этой информации, позволяющим облегчить ее использование для составления обзоров и оценки соответствия.
Информационная модель описания контролируемой субстанции группы 4 показана на рисунке 20.
Рисунок 20 - Информационная модель описания контролируемой субстанции группы 4
|
Рисунок 20 - Информационная модель описания контролируемой субстанции группы 4
3.7.6 Аналитические данные
Информация об анализах, проведенных для определения активности и соответствия спецификации, может быть представлена в виде группы элементов. Эта информация должна включать в себя сведения об аналитических методах и стандартных образцах, использованных для определения активности. Отдельные стандартные образцы должны быть описаны как контролируемые субстанции. Должны быть описаны или указаны, в том числе по ссылке, различные аналитические методы анализа или стандартные образцы, использованные для определения активности. Настоящий стандарт не содержит указаний, какие аналитические методы или стандартные образцы должны быть использованы для определения активности. В нем предусмотрен только способ сбора такой информации.
Примечание - Единицы измерения активности нередко зависят от аналитического метода и стандартного образца, использованного для определения активности. Во многих случаях единицы измерения могут быть отличаться,* в зависимости от территории юрисдикции и даже у разных производителей на одной и той же территории юрисдикции.
________________
* Текст документа соответствует оригиналу. - .
Пример - Единицы измерения активности панкрелипазы, используемые в фармакопее USP, и те, что используются организацией Federation Internationale Pharmaceutique, отличаются и не могут быть так просто преобразованы друг в друга, поскольку используются разные стандартные образцы и их стандартизация отличается.
Информационная модель описания аналитических данных показана на рисунке 21.
Рисунок 21 - Информационная модель описания аналитических данных
|
Рисунок 21 - Информационная модель описания аналитических данных
3.7.7 Составляющие
Группа элементов, относящихся к составляющим, описывает информацию о субстанциях и контролируемых субстанциях, входящих в состав данной контролируемой субстанции. Описание многокомпонентного вещества должно включать в себя описания его составляющих - субстанций и контролируемых субстанций. Активные маркеры в растительных экстрактах, загрязнения или сопутствующие вещества должны также рассматриваться как составляющие и должны быть привязаны к компонентам, образующим контролируемую субстанцию. Должны быть указаны количество и роль каждой составляющей. Количества должны быть указаны или как пределы окончательных количеств (средние), или как диапазоны концентрации. Составляющие входят в состав элементов, описывающих контролируемые субстанции группы 1 и группы 4.
Примечание - Группа элементов, описывающих составляющие, обладает значительной гибкостью и полезностью для указания связи многих типов сопутствующих субстанций.
3.7.8 Качество
Качество описывает общее качество или группу спецификаций данной контролируемой субстанции.
Качество должны быть указано для контролируемых субстанций групп 3 и 4.
Примечание - Фармакопейное качество или спецификации должны быть указаны, если известны. Конкретная контролируемая субстанция может соответствовать спецификациям нескольких фармакопей. Может быть также указана техническая характеристика качества.
Пример - Фармакопейное качество или спецификации должны быть указаны, если известны. Описание контролируемой субстанции может идентифицировать различное качество воды. Водопроводная вода, стерильная вода для инъекций качества USP, стерильная вода для инъекций качества ЕР, обеззараженная вода качества USP и т.д. должны идентифицироваться как разные контролируемые субстанции.
3.7.9 Производство
Группа элементов, описывающих производство, должна содержать информацию о производителе и критических производственных процессах, необходимую для различения контролируемых субстанций. В состав этой информации могут входить описания начальных материалов, обрабатываемых материалов, параметров критических процессов, используемого оборудования и результирующего материала производственного процесса.
Примечание - Эта группа элементов предназначена для описания не всех деталей производства, а только критических производственных процессов, которые могут влиять на безопасность или эффективность контролируемой субстанции, используемой в лекарственном средстве.
Информационная модель описания производства показана на рисунке 22.
3.7.10 Физическая форма
Физическая форма должна указывать состояние, в котором существует нормативная субстанция. Должен использоваться нормативный словарь, который при необходимости надо разработать.
3.7.11 Свойство
Должны быть указаны физические, химические или биологические свойства, которые могут относиться к использованию или функции контролируемой субстанции и которые могут не зависеть от молекулярной структуры или молекулярного ансамбля, образующего субстанции или контролируемые субстанции, присутствующие в данной контролируемой субстанции. Это группа элементов может использоваться для указания свойств, относящихся к супрамолекулярной организации веществ. Свойства должны использоваться для идентификации контролируемых субстанций групп 1 и 4.
Рисунок 22 - Информационная модель описания производства
|
Рисунок 22 - Информационная модель описания производства
Приложение А (справочное). Существующие идентификаторы и представления молекулярной структуры
Приложение А
(справочное)
А.1 Идентификаторы
А.1.1 Общие положения
В приведенном ниже описании широко используемых идентификаторов отражены сильные и слабые стороны их использования для уникальной идентификации субстанций в лекарственном препарате. Список рассматриваемых типов идентификаторов не является исчерпывающим, но в него вошли те, что активно используются в информационных системах.
А.1.2 Регистрационные номера службы CAS
Регистрационные номера службы CAS представляют собой числовые идентификаторы, которые обычно идентифицируют простые субстанции. Полимеру нередко присваивается единственный номер CAS вне зависимости от различий в молекулярной массе или в других идентифицирующих элементах. Номера присваиваются последовательно по мере внесения субстанций в регистр. Длина номеров не фиксирована и меняется от 5 до 10 цифр. Каждый номер CAS содержит одну контрольную цифру. В регистре службы CAS зарегистрировано свыше 100 миллионов субстанций. Основное назначение регистра состоит в установлении связей между информацией, публикуемой в литературе по химии, а не исключительно в идентификации субстанций. Регистр ведется Химической реферативной службой (Chemical Abstracts Service) - подразделением Американского химического общества (American Chemical Society). Хотя номера CAS широко используются, они не являются общедоступными. Служба CAS выпустила руководство по применению своих регистрационных номеров и попыталась ограничить их использование в общедоступных базах данных. Регистрационный номер CAS для формальдегида имеет значение 50-00-0.
А.1.3 Идентификаторы InChl и InChlKey
Аббревиатура InChl означает международный химический идентификатор, присваиваемый Международным союзом теоретической и прикладной химии (International Union of Pure and Applied Chemistry, IUPAC). Система идентификации была разработана Национальным институтом стандартов и технологий США (National Institute of Standards and Technology). Идентификаторы InChl являются линейными и отражают химическое представление с помощью системы слоев. Идентификатор InChl является общедоступным структурным представлением, и программное обеспечение, предназначенное для генерации идентификаторов InChl, распространяется по открытой лицензии LGPL. Идентификаторы InChlKey имеют фиксированную длину (25 символов) и являются сжатыми цифровыми представлениям идентификаторов InChl. Идентификаторы InChl и InChlKey сконструированы для идентификации простых субстанций, имеющих определенную молекулярную структуру, а не для сложных веществ, например, вакцин, продуктов крови, ботанических или животных препаратов. Номер InChl для морфина имеет значение 1/С17Н19NO3/c1-18-7-6-17-10-3-5-13(20)16(17)21-15-12(19)4-2-9(14(15)17)8-11(10)18/h2-5, 10-11, 13, 16, 19-20Н, 6-8Н2, 1Н3/t10-, 11-, 13-, 16-, 17-/m0/s1, а идентификатор InChlKey - значение BQJCRHHNABKAKUXKUOQXLYBY.
А.1.4 Номера ЕС
Номер EC-No. или ЕС# представляет собой семизначный цифровой код, присваиваемый Европейской комиссией всем коммерчески доступным субстанциям, продаваемым в Европейском Союзе. Седьмая цифра кода является контрольной и код отображается как на торговое, так и непатентованное наименование конкретной субстанции. Область применения номеров ЕС шире, чем у идентификаторов InChl, и охватывает как простые, так и комплексные субстанции. Система номеров ЕС охватывает более 100000 субстанций, но не так уж активно используется в фармацевтическом секторе. Номера в большинстве случаев присваиваются последовательно. Они были позаимствованы из списков регулируемых субстанций, которые ведутся организациями EINECS (European Inventory of Existing Commercial Chemical Substances), ELINCS (European List of Notified Chemical Substances) и другими. Номер EC# для формальдегида имеет значение 200-001-8. Европейская Комиссия больше не присваивает новые номера ЕС#.
А.1.5 Идентификатор UNII
Идентификатор UNII представляет собой 10-символьную случайную алфавитно-цифровую строку, которая в настоящее время используется для идентификации субстанций в лекарственных средствах. Идентификатор UNII генерируется Системой регистрации субстанций, которая ведется организацией FDA и фармакопеей USP и является надежной системой с детально разработанными регламентами ввода данных и генерации идентификаторов UNII, присваиваемых как простым, так и комплексным субстанциям. Первые 9 символов генерируются случайно, а последний является контрольным символом. Контроль целостности идентификаторов UNII является более строгим по сравнению с контрольными цифрами номеров ЕС# и регистрационных номеров CAS, поскольку эти идентификаторы случайно выбираются из большого диапазона возможных значений и для контроля используются 36 возможных символов по сравнению с 10 цифрами у номеров ЕС# и CAS. Идентификаторы UNII являются общедоступными, и существует регламент, по которому производитель может обратиться в организацию FDA c запросом генерации нового идентификатора UNII. Система обеспечивает как публичный, так и ограниченный доступ к информации, и ее можно адаптировать для присваивания идентификаторов контролируемым субстанциям.
А.1.6 Номер ASK
Номер ASK представляет собой пятизначный код (с дополнительной контрольной цифрой). Эти номера ведутся и присваиваются организацией German National Competent Authorities (BfArM, PEI, BVL) в соответствии с §10 Германского закона об обращении лекарственных средств (German Drug Law) и правилами AMIS-Bezeichnungsverordnung. Указание номера ASK обязательно при подаче заявлений на регистрацию лекарственных средств и в переписке между владельцами регистрационных удостоверений и уполномоченными органами. Используемая база данных субстанций охватывает более 35000 субстанций, применяемых в регулируемых лекарственных средствах. В их число входят субстанции химического и биологического происхождения, а также радиофармацевтические, гомеопатические и антропософические препараты. Эта база данных содержит в основном информацию об активных ингредиентах и наполнителях, но в ней есть информация и о газах, упаковочных материалах, химических веществах, используемых для анализов, загрязнениях и веществах, запрещенных законодательством. В дополнение к химическому наименованию, соответствующему номенклатуре IUPAC, приводится большая "коллекция" ссылок на синонимы, используемые в международных и европейских источниках в течение жизненного цикла лекарственного средства. При наличии приводятся регистрационный номер CAS, молекулярная формула и молекулярная масса. Для обеспечения различных аспектов рутинной работы регуляторных органов, в классификацию субстанций добавлено большое число "группирующих атрибутов".
А.2 Представления молекулярной структуры
А.2.1 Общее описание
Существенным моментом для разработки нормативного словаря, предназначенного для описания простых химических субстанций, является представление химической или молекулярной структуры. Система представления должна обеспечивать уникальное и однозначное представление структуры. Конкретная структура должна иметь единственное представление, настолько детальное, чтобы исключить ненамеренную неоднозначность. Представление или его форма должны позволять хранение в химической базе данных для облегчения регистрации и поиска. Те форматы представления, что не описаны ниже, или не используются достаточно широко, или являются частными, принадлежащими одному поставщику.
А.2.2 Формат molfile
Формат molfile был в основном разработан компанией MDL Information Systems. В настоящее время используются две версии: V2000 и расширенный формат V3000. В расширенном формате molfile применяются расширенные стереохимические дескрипторы, позволяющие связать с каждой хиральной молекулой относительные, неизвестные и рацемические обозначения. Формат V2000 широко используется и может быть без труда преобразован в другие форматы. В отличие от других представлений, формат molfile является не линейным, а в основном табличным. Ниже показано представление бензола в формате V2000 molfile.
|
А.2.3 Спецификация SMILES
Спецификация упрощенного представления молекул в строке ввода SMILES (Simplified molecular input line entry specification) предназначена для однозначного линейного представления химических или молекулярных структур в форме строки символов ASCII. Она преимущественно используется компанией Daylight Chemical Information Systems Inc., но недавно появились версии с открытым кодом. Канонический идентификатор SMILES представляет собой строку, уникальную для каждой структуры, и может использоваться для проверки, что в базу данных не вводятся дубликаты структур. К другим форматам линейного представления химических структур относятся нотация SLN (SYBYL line notation) и старая нотация Wiswesser Line Notation, которая была первой строковой нотацией, используемой для представления химических структур. Эти форматы в настоящее время не имеют широкого применения. Ниже показано представление SMILES для бензола.
С1 = СС = СС = С1
А.2.4 Формат InChl
Формат InChl описан в подразделе А.1.3. В нем использовано многоуровневое представление химической структуры. В настоящее время информация имеет четыре слоя:
- конституциональный: описывает только межатомные связи;
- стереохимический: включает в себя традиционную стереохимию состояний sp2 и sp3 атомов углерода;
- изотопный: позволяет различать изотопы;
- таутометрный: реализует простые формы быстрой изомеризации с миграцией протона.
Ниже показано представление InChl для бензола.
1/С6Н6/с1-2-4-6-5-3-1/h1-6 Н
А.2.5 Форматы файлов CDX и CDXML
Эти форматы используются редактором химической графики ChemDraw для хранения описаний структур в виде последовательности вложенных объектов. Так как большинство химиков имеет доступ к редактору ChemDraw и формат CDX является форматом хранения по умолчанию в редакторе ChemDraw, то запросы на идентификацию субстанций должны обеспечивать возможность приема информации в формате CDX. Поскольку формат СОХ является частным, это препятствует будущим обменам информацией, так что может понадобиться преобразование в один из указанных выше общедоступных форматов.
Библиография
[1] | ISO 1087-1, Terminology work - Vocabulary - Part 1: Theory and application |
[2] | ISO 1087-2, Terminology work - Vocabulary - Part 2: Computer applications |
_______________ | |
[3] | ISO 3166-1, Codes for the representation of names of countries and their subdivisions - Part 1: Country codes |
[4] | ISO 8601, Data elements and interchange formats - Information interchange - Representation of dates and times |
[5] | ISO 11615, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated medicinal product information |
[6] | ISO 11616, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated pharmaceutical product information |
[7] | ISO 11239, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of regulated information on pharmaceutical dose forms, units of presentation, routes of administration and packaging |
[8] | ISO 11240, Health informatics - Identification of medicinal products - Data elements and structures for the unique identification and exchange of units of measurement |
[9] | ISO/IEC 2382-4, Information technology - Vocabulary - Part 4: Organization of data |
[10] | ISO/IEC 7064, Information technology - Security techniques - Check character systems |
[11] | ISO/HL7 27951, Health informatics - Common terminology services, release 1 |
[12] | ISO/HL7 27953-1, Health informatics - Individual case safety reports (ICSRs) in pharmacovigilance - Part 1: Framework for adverse event reporting |
[13] | ISO/HL7 27953-2, Health informatics - Individual case safety reports (ICSRs) in pharmacovigilance - Part 2: Human pharmaceutical reporting requirements for ICSR |
[14] | HL7 Common Product Model, Substance Model (POCP_MT080100) and Substance Specification Model (POCP_MT090100)[6] |
[15] | HL7 Version 3 Standard, Common Terminology Services HL7 Draft Standard for Trial Use DSTU Release 2, 14 October 2009, HL7 Inc. |
[16] | HL7 Version 3 Standard, Common Clinical Product Model, Release 1, Last Ballot: Normative Ballot 1 - January 2009 |
[17] | HL7 Version 3 Standard, Common Product Model CMETS, Release 10, DSTU Ballot 3 - January 2010 |
[18] | IUPAC, Compendium of Chemical Terminology version 2.1.5 |
[19] | ISBT 128, Standard Technical Specification version 3.6 |
[20] | International Conference on Harmonization (ICH) of Technical Requirements for Registration of Pharmaceuticals for Human Use Draft Consensus Guideline - Data Elements and Standards for Drug Dictionaries - M5 Revision 4, 2 February 2007. http:/www.fda.gov/Cder/guidance/6886dft.pdf |
[21] | Resources related to FDA's Substance Registration system http://www.fda.gov/Forlndustry/DataStandards/SubstanceRegistrationSystem-UniquelngredientldentifierUNII/default.htm |
[22] | NCI Thesaurus (NCIt) and other NCI Enterprise Vocabulary Services (EVS) resources and documentation: http://nciterms.nci.nih.gov/ncitbrowser/pages/multiple_search.jsf±nav_type=terminologies |
[23] | The Integrated Taxonomic Information System http://www.itis.gov/ |
[24] | The Food and Drugs Act and Regulations and related Health Canada Guidelines: http://www.hc-sc.gc.ca/dhp-mps/prodpharma/index-eng.php |
[25] | The Natural Health Product Regulations and related Health Canada Guidelines: |
[26] | Directive 2001/83/EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to medicinal products for human use as amended by Directive 2002/98/EC, Directive 2004/24/EC and Directive 2004/27/EC http://ec.europa.eu/enterprise/ pharmaceuticals/eudralex/vol-1/consol 2004/human code.pdf |
[27] | "Guideline on the categorisation on New applications versus Variations", The Rules governing Medicinal Products in the European Union, Notice to Applicants, Volume 2C |
[28] | The Rules governing Medicinal Products in the European Union, Notice to Applicants, Volume 2A and Volume 2C http://ec.europa.eu/enterprise/pharmaceuticals/eudralex/homev2.htm |
[29] | A Guideline on Summary of Product Characteristics, December 1999, (Doc. Ref. Notice to Applicants, Final - revision 0) |
[30] | Directive 2001/20/EC of the European Parliament and of the Council of 4 April 2001 on the approximation of the laws, regulations and administrative provisions of the Member States relating to the implementation of good clinical practice in the conduct of clinical trials on medicinal products for human use http:// ec.europa.eu/enterprise/pharmaceuticals/eudralex/vol-1/dir 2001 20/dir 2001 20 en.pdf |
[31] | Commission Directive 2003/63/EC of 25 June 2003 amending Directive 2001/83/EC of the European Parliament and of the Council on the Community code relating to medicinal products for human use |
[32] | Regulation (EC) No 726/2004 of the European Parliament and of the Council of 31 March 2004 laying down Community procedures for the authorisation and supervision of medicinal products for human and veterinary use and establishing a European Medicines Agency http://ec.europa.eu/enterprise/ pharmaceuticals/eudralex/vol-1/reg 2004 726/reg 2004 726 en.pdf |
[33] | Regulation (EC) No 1394/2007 of the European Parliament and of the Council of 13 November 2007 on advanced therapy medicinal products and amending Directive 2001/83/EC and Regulation (EC) No 726/2004 |
[34] | Commission Directive 2003/94/EC of 8 October 2003 laying down the principles and guidelines of good manufacturing practice in respect of medicinal products for human use and investigational medicinal products for human use |
[35] | http://ec.europa.eu/enterprise/pharmaceuticals/eudralex/vol-1/dir_2003_94/dir_2003_94_en.pdf |
[36] | Guidelines on Pharmacovigilance for Medicinal Products for Human Use, Volume 9A of the Rules Governing Medicinal Products in the European Union |
[37] | http://ec.europa.eu/enterprise/pharmaceuticals/eudralex/vol-9/pdf/vol9_2007-07_upd07.pdf |
[38] | Guideline on declaration of botanical substances and botanical preparations in botanical medicinal products/traditional |
[39] | Botanical medicinal products in the SPC, 26 July 2007 (Doc. Ref. EMEA/HMPC/CHMP/CVMP/287539/2005) |
[40] | http://www.emea.europa.eu/pdfs/human/hmpc/28753905en2.pdf |
[41] | Guideline on adjuvants in vaccines for human use, 20 January 2005 (Doc. Ref. EMEA/CHMP/VEG/134716/2004) |
[42] | http://www.emea.europa.eu/pdfs/human/vwp/13471604en.pdf |
[43] | Guideline on Similar Biological Medicinal Products, 30 October 2005 (Doc. Ref. CHMP/437/04) |
[44] | http://www.emea.europa.eu/pdfs/human/biosimilar/043704en.pdf |
[45] | GUIDELINE ON PHARMACEUTICAL ASPECTS OF THE PRODUCT INFORMATION FOR HUMAN VACCINES. 26 November 2003 (Doc. Ref. EMEA/CPMP/BWP/2758/02) http://www.emea.europa.eu/pdfs/human/bwp/275802en.pdf |
[46] | Guideline on the acceptability of names for human medicinal products processed through the centralised procedure, 11 December 2007 (Doc. Ref. CPMP/328/98, Revision 5) |
[47] | http://www.emea.europa.eu/pdfs/human/regaffair/032898en.pdf |
[48] | Guideline on the Chemistry of new Active Substances, 17 December 2003 (Doc. Ref. CPMP/QWP/130/96 Rev. 1) http://www.emea.europa.eu/pdfs/human/qwp/013096en.pdf |
[49] | Standard Terms, Dosage Forms, Routes of Administration and Containers, EDQM, Fifth Edition, December 2004, Version 5.0.0 http://st.pheur.org/ |
[50] | EudraVigilance Medicinal Product Dictionary (EVMPD) Version 2.0 Technical Specifications, 9 November 2004 (Doc. Ref. EMEA/140190/2004) http://eudravigilance.emea.europa.eu/human/ docs/EVMPD%20Technical%20Specifications.pdf |
[51] | EudraVigilance Medicinal Product Dictionary (EVMPD) Version 2.0 Message and Acknowledgement Specifications, 8 December 2004 (Doc. Ref. EMEA/178966/2004) http://eudravigilance.emea.europa.eu/human/docs/EVMPD%20Message%20and%20%20Acknowledgem |
[52] | EudraVigilance (EV) Access simple Database Version 2.0 8 November 2004 (Doc. Ref: EMEA/140327/2004) |
[53] | EudraVigilance (EV) Access Simple Database Version 2.0 Forms Documentation, 31 January 2005, (Doc. Ref: EMEA/35416/2005) |
[54] | EudraVigilance (EV) Access Simple Database Version 2.0 Step by Step Guide 8 December 2004, (Doc. Ref: EMEA/191986/2004) |
[55] | Product Information Management http://pim.emea.europa.eu/ |
[56] | European Pharmacopeia (Ph. Eur.): http://online.pheur.org/entry.htm |
[57] | MINISTRY OF HEALTH AND WELFARE. PSB/SD Notification No. 37 (29 |
[58] | Appendix: Electronic format of package insert information on ethical drugs (SGML/DTD Ver.2.0) Appendix1 DTD Ver.2.0 https://skw.info.pmda.go.jp/notice/nt990329dtd.zip |
[59] | Appendix2 Overview of SGML creation https://skw.info.pmda.go.jp/notice/nt990329ol.pdf |
[60] | Appendix3 DCL https://skw.info.pmda.go.jp/notice/nt990329dcl.zip |
[61] | Appendix4 Template of SGML https://skw.info.pmda.go.jp/notice/nt990329smp.zip |
[62] | Appendix5 Data model (Entities and relationships) https://skw.info.pmda.go.jp/notice/nt990329dm.pdf |
[63] | Appendix6 List of fields of package insert information https://skw.info.pmda.go.jp/notice/nt990329lst.pdf |
[64] | THE JAPANESE PHARMACOPOEIA SIXTEENTH EDITION, http://jpdb.nihs.go.jp/jp16/ |
[65] | United States Pharmacopoeia (USP): http://www.usp.org/usp-nf |
[66] | INTEGRATED TAXONOMIC INFORMATION SYSTEM. (ITIS) http://www.itis.gov/ |
[67] | Guidance for Industry Providing Regulatory Submissions in Electronic Format - Content of Labelling http://www.fda.gov/cder/regulatory/guidance |
[68] | Release Notes for SPL Schema PORR_MT050020 (3.20.05) FDA SPL Schema for Implementation http://www.fda.gov/downloads/Forlndustry/DataStandards/StructuredProductLabeling/UCM162024.pdf |
[69] | CaCore 2.0 Technical Guide, National Cancer Institute, Center for Bioinformatics, U.S. Department of Health and Human Services |
[70] | A guide to RXNorm, United States National Library of Medicine, National Institute of Health http://www.nlm.nih.gov/research/umls/rxnorm/docs/2012/rxnorm_doco_full_2012-3.html |
[71] | The Unified Code for Units of Measure |
[72] | Substance Registration System (SRS) SRS Substance Definition Manual Version 5c |
[73] | The U.S. Consolidated Healthcare Informatics initiative |
[74] | CDISC Clinical Research Glossary, http://www.cdisc.org/cdisc-glossary |
УДК 004:61:006.354 | ОКС 35.240.80 | П85 | ОКСТУ 4002 |
Ключевые слова: здравоохранение, информатизация здоровья, уникальная идентификация, лекарственные средства, структуры данных, передача данных, фармацевтические субстанции |
Электронный текст документа
и сверен по:
официальное издание
М.: Стандартинформ, 2015