МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
(МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ГОСТ
31659—
2024
(ISO 6579-1:2017)
МИКРОБИОЛОГИЯ ПИЩЕВОЙ ЦЕПИ
Горизонтальный метод обнаружения, подсчета и серотипирования бактерий рода Salmonella
Часть 1
Обнаружение Salmonella spp.
(ISO 6579-1:2017, MOD)
Издание официальное
Москва Российский институт стандартизации 2024
ГОСТ 31659—2024
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным учреждением науки Федеральным исследовательским центром питания, биотехнологии и безопасности пищи (ФГБУН «ФИЦ питания и биотехнологии») на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 31 июля 2024 г. № 175-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166)004—97 | Код страны по МК (ИСО 3166) 004—97 | Сокращенное наименование национального органа по стандартизации |
Армения | АМ | ЗАО «Национальный орган по стандартизации и метрологии» Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узбекское агентство по техническому регулированию |
4 Приказом Федерального агенства по техническому регулированию и метрологии от 11 октября 2024 г. № 1440-ст межгосударственный стандарт ГОСТ 31659—2024 (ISO 6579-1:2017) введен в действие в качестве национального стандарта Российской Федерации с 1 октября 2025 г. с правом досрочного применения
5 Настоящий стандарт является модифицированным по отношению к международному стандарту ISO 6579-1:2017 «Микробиология пищевой цепи. Горизонтальный метод обнаружения, подсчета и се-ротипирования бактерий рода Salmonella. Часть 1. Обнаружение Salmonella spp.» («Microbiology of the food chain — Horizontal method for the detection, enumeration and serotyping of Salmonella — Part 1: Detection of Salmonella spp.», MOD) путем изменения отдельных фраз (слов, значений показателей, ссылок), которые выделены в тексте курсивом, а также путем включения дополнительных положений для учета потребностей национальных экономик, которые выделены подчеркиванием.
Сведения о соответствии ссылочных межгосударственных стандартов международным стандартам, использованным в качестве ссылочных в примененном стандарте, приведены в дополнительном приложении ДА
6 ВЗАМЕН ГОСТ 31659—2012 (ISO 6579:2002)
II
ГОСТ 31659—2024
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге «Межгосударственные стандарты»
© ISO, 2017
© Оформление. ФГБУ «Институт стандартизации», 2024
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
III
ГОСТ 31659—2024
Содержание
1 Область применения..................................................................1
2 Нормативные ссылки..................................................................1
3 Термины и определения................................................................2
4 Сущность метода.....................................................................2
4.1 Общие положения.................................................................2
4.2 Предварительное обогащение в неселективной жидкой среде.............................2
4.3 Обогащение в/на селективных средах.................................................2
4.4 Пересев на селективные агаризованные среды.........................................3
4.5 Подтверждение....................................................................3
5 Питательные среды, реактивы и сыворотки................................................3
6 Оборудование и расходные материалы...................................................3
7 Отбор проб..........................................................................3
8 Подготовка анализируемых проб........................................................4
9 Проведение анализа (схемы в приложении А)..............................................4
9.1 Отбираемая навеска и исходное разведение...........................................4
9.2 Неселективное предварительное обогащение..........................................4
9.3 Селективное обогащение...........................................................4
9.4 Пересев на агаризованные среды....................................................5
9.5 Подтверждение....................................................................7
10 Представление результатов...........................................................11
11 Характеристики метода..............................................................11
11.1 Межлабораторные исследования..................................................11
11.2 Чувствительность...............................................................11
11.3 Специфичность.................................................................11
11.4 Предел обнаружения 50 % образцов (LOD50)........................................11
12 Протокол испытаний.................................................................11
Приложение А (обязательное) Схемы анализа..............................................12
Приложение В (обязательное) Питательные среды и реактивы................................14
Приложение С (справочное) Исследования по валидации методов и рабочие характеристики......22
Приложение D (обязательное) Обнаружение Salmonella enterica подвида enterica сероваров Typhi и Paratyphi.........................................................27
Приложение Е (справочное) Примеры селективных агаризованных сред........................30
Приложение ДА (справочное) Сведения о соответствии ссылочных межгосударственных стандартов международным стандартам, использованным в качестве ссылочных в примененном международном стандарте........................34
Библиография........................................................................35
IV
ГОСТ 31659—2024 (ISO 6579-1:2017)
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МИКРОБИОЛОГИЯ ПИЩЕВОЙ ЦЕПИ
Горизонтальный метод обнаружения, подсчета и серотипирования бактерий рода Salmonella
Часть 1
Обнаружение Salmonella spp.
Microbiology of the food chain. Horizontal method for the detection, enumeration and serotyping of Salmonella. Part 1. Detection of Salmonella spp.
Дата введения — 2025—10—01 с правом досрочного применения
1 Область применения
Настоящий стандарт устанавливает горизонтальный метод обнаружения бактерий рода Salmonella.
Настоящий стандарт распространяется на следующие объекты:
- пищевая продукция, предназначенная для употребления человеком и продукция для кормления животных;
- образцы окружающей среды из зоны производства и переработки пищевых продуктов;
- образцы, отобранные на стадии первичной переработки продовольственного сырья, такие как фекалии животных, пыль и смывы.
Настоящий горизонтальный метод предназначен для обнаружения бактерий рода Salmonella. Для обнаружения отдельных сероваров могут потребоваться дополнительные этапы культивирования. Для выделения Salmonella Typhi и Salmonella Paratyphi процедура приведена в приложении D.
Селективная среда обогащения — модифицированный полужидкий селективный агар Раппопор-та-Василиадиса (MSRV) предназначена для обнаружения подвижных бактерий рода Salmonella и не подходит для обнаружения неподвижных штаммов Salmonella.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 7702.2.0 Продукты убоя птицы, полуфабрикаты из мяса птицы и объекты окружающей производственной среды. Методы отбора проб и подготовка к микробиологическим исследованиям
ГОСТ 26669 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
ГОСТ 26809.1 Молоко и молочная продукция. Правила приемки, методы отбора и подготовка проб к анализу. Часть 1. Молоко, молочные, молочные составные и молокосодержащие продукты
ГОСТ 26809.2 Молоко и молочная продукция. Правила приемки, методы отбора и подготовка проб к анализу. Часть 2. Масло из коровьего молока, спреды, сыры и сырные продукты, плавленые сыры и плавленые сырные продукты
ГОСТ 31904 Продукты пищевые. Методы отбора проб для микробиологических испытаний
ГОСТ ISO 6887-6 Микробиология пищевых продуктов и кормов для животных. Подготовка проб для анализа, исходной суспензии и десятичных разведений для микробиологического исследования. Часть 6. Специальные правила приготовления проб, отобранных на начальной стадии производства
ГОСТ ISO 7218 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
Издание официальное
1
ГОСТ 31659—2024
ГОСТ ISO 11133—2016 Микробиология пищевых продуктов, кормов для животных и воды. Приготовление, производство, хранение и определение рабочих характеристик питательных сред
ГОСТ ISO 16140—2011 Микробиология продуктов питания и кормов для животных. Протокол валидации альтернативных методов
ГОСТ ISO 13307 Микробиология пищевых продуктов и кормов для животных. Начальная стадия производства. Методы отбора проб
ГОСТ ISO/TS 17728 Микробиология пищевой цепи. Методы отбора проб пищевой продукции и кормов для микробиологического анализа
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов и классификаторов на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации (www.easc.by) или по указателям национальных стандартов, издаваемым в государствах, указанных в предисловии, или на официальных сайтах соответствующих национальных органов по стандартизации. Если на документ дана недатированная ссылка, то следует использовать документ, действующий на текущий момент, с учетом всех внесенных в него изменений. Если заменен ссылочный документ, на который дана датированная ссылка, то следует использовать указанную версию этого документа. Если после принятия настоящего стандарта в ссылочный документ, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение применяется без учета данного изменения. Если ссылочный документ отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 бактерии рода Salmonella: Микроорганизмы, которые образуют типичные или не совсем типичные колонии на агаризованных селективных средах и которые проявляют характерные свойства, описанные при проведении подтверждающих испытаний в соответствии с настоящим стандартом.
3.2 выявление бактерий рода Salmonella: Определение бактерий рода Salmonella в определенной массе или объеме образца, участке поверхности или объекта (например, чехлов для обуви/бахил) при проведении испытаний в соответствии с настоящим стандартом.
4 Сущность метода
4.1 Общие положения
Метод обнаружения бактерий рода Salmonella состоит из четырех последовательных этапов (согласно схемам в приложении А).
Примечание — Бактерии рода Salmonella могут присутствовать в продукте в небольшом количестве и зачастую вместе с большим количеством других бактерий из семейства Enterobacteriaceae или других семейств. Предварительное обогащение используется для выявления небольшого числа бактерий рода Salmonella или сублетально поврежденных бактерий рода Salmonella.
4.2 Предварительное обогащение в неселективной жидкой среде
Анализируемый образец вносят в забуференную пептонную воду комнатной температуры, затем инкубируют при температуре от 34 °C до 38 °C в течение 18 ч.
При использовании больших количеств среды для предварительного обогащения (например, 1 дм3 или более) рекомендуется перед внесением анализируемого образца нагреть забуференную пептонную воду до температуры от 34 °C до 38 °C.
4.3 Обогащение в/на селективных средах
Среду Раппопорта-Василиадиса с соей (RVS-бульон) или модифицированный полужидкий агар Раппопорта-Василиадиса (MSRV) и Мюллера-Кауфмана тетратионатно-новобиоциновый бульон (МКТТп-бульон) инокулируют культурой, полученной в 4.2.
RVS-бульон или MSRV-агар инкубируют при температуре 41,5 °C в течение 24 ч, а МКТТп-бульон при температуре 37 °C в течение 24 ч.
Для некоторых продуктов может потребоваться инкубирование селективной среды для обогащения дополнительно в течение 24 ч.
Примечание — MSRV-агар предназначен для обнаружения подвижных штаммов бактерий рода Salmonella и не подходит для обнаружения неподвижных штаммов бактерий рода Salmonella.
2
ГОСТ 31659—2024
4.4 Пересев на селективные агаризованные среды
Культуры, полученные в 4.3, пересевают на две селективные агаризованные среды:
- ксилоза-лизин-дезоксихолатный агар (XLD-arap);
- любая другая агаризованная селективная среда, дополняющая XLD-arap (примеры приведены в приложении Е).
XLD-arap инкубируют при температуре 37 °C в течение 24 ч. Второй селективный агар инкубируют в соответствии с инструкциями производителя.
4.5 Подтверждение
Колонии презумптивных бактерий рода Salmonella пересевают и идентифицируют с помощью биохимических и серологических тестов.
5 Питательные среды, реактивы и сыворотки
Приготовление питательных сред проводят в соответствии с ГОСТ ISO 7218 и ГОСТ ISO 11133.
Состав питательных сред и реактивов и их приготовление описаны в приложении В.
Сыворотки сальмонеллезные агглютинирующие приведены в приложении В.
6 Оборудование и расходные материалы
Одноразовая посуда является приемлемой альтернативой многоразовой стеклянной посуде, если отвечает соответствующим требованиям.
Используют лабораторное оборудование для микробиологических исследований согласно ГОСТ ISO 7218, в частности следующее.
6.1 Аппарат для сухой стерилизации (стерилизационный сушильный шкаф) или влажной стерилизации (автоклав) по ГОСТ ISO 7218.
6.2 Сушильный шкаф, поддерживающий температуру от 25 °C до 50 °C.
6.3 Термостат, поддерживающий температуру в диапазоне от 34 °C до 38 °C, с погрешностью не более 1 °C.
6.4 Термостат, поддерживающий температуру (41,5 ± 1) °C, или водяная баня, поддерживающая температуру (41,5 ± 1) °C.
6.5 Водяная баня, поддерживающая температуру от 47 °C до 50 °C.
6.6 Водяная баня, поддерживающая температуру (37 ± 1) °C.
6.7 Водяная баня, поддерживающая температуру (45 ± 1) °C.
Рекомендуется использовать водяную баню (см. 6.4—6.6), содержащую антибактериальное средство для снижения риска инфицирования бактериями рода Salmonella.
6.8 Холодильник, поддерживающий температуру (5 ± 3) °C.
6.9 Морозильная камера, поддерживающая температуру минус (20 ± 5) °C.
6.10 Стерильные бактериологические петли, диаметром около 3 мм (объем 10 мм3), стерильные бактериологические петли, объемом 1 мм3, и иглы или петли для пересева.
6.11 pH-метр, имеющий точность калибровки ±0,1 ед. pH при температуре от 20 °C до 25 °C.
6.12 Стерильные пробирки, флаконы или колбы с крышками соответствующей вместимости.
6.13 Стерильные градуированные пипетки или автоматические пипетки номинальной вместимостью 25 см3, 10 см3, 1 см3 и 0,1 см3.
6.14 Стерильные чашки Петри, диаметром 90 мм и (при необходимости) большего размера (диаметром 140 мм).
6.15 Микроскоп оптический лабораторный, обеспечивающий просмотр в проходящем свете, с увеличением 900 —1000.
6.16 Стекла предметные и покровные.
7 Отбор проб
Отбор проб не является частью метода, изложенного в настоящем стандарте. Рекомендуемые методы отбора проб приведены в ГОСТ 31904 для пищевых продуктов, в ГОСТ ISO/TS 17728 для пищевых продуктов и кормов для животных, в ГОСТ 26809.1, ГОСТ 26809.2 и в [7] для молока
3
ГОСТ 31659—2024
и молочных продуктов, в ГОСТ 7702.2.0 для продуктов убоя птицы и полуфабрикатов из мяса птицы, в ГОСТ ISO 13307 для отбора проб на стадии первичной переработки продовольственного сырья, в [2] для отбора проб туш, а также в [3] для отбора проб с поверхностей.
Проба для проведения испытаний должна быть представительной, не поврежденной и не измененной в процессе транспортирования и временного хранения.
8 Подготовка анализируемых проб
Подготовку анализируемых проб из лабораторной пробы необходимо осуществлять в соответствии с ГОСТ 26669 или стандартом, устанавливающем подготовку проб соответствующего продукта.
9 Проведение анализа (схемы в приложении А)
9.1 Отбираемая навеска и исходное разведение
Для приготовления исходной суспензии в качестве разбавителя используют среду для предварительного обогащения, указанную в В.2 (забуференная пептонная вода, ЗПВ). Предварительно ЗПВ прогревают до комнатной температуры перед использованием.
Необходимое количество анализируемого образца (масса или объем) добавляют к соответствующему количеству ЗПВ (масса или объем) в соотношении 1:9 таким образом, чтобы получилось десятикратное разведение. Для этого 25 г анализируемого образца смешивают с 225 см3 ЗПВ. Однако для некоторых типов образцов (например, бахил, пыли) может потребоваться использование другого соотношения.
Для конкретных продуктов следуют процедурам, указанным в [4] — [8] и ГОСТ ISO 6887-6.
Настоящий стандарт утвержден для навесок массой 25 г. Навески меньшей массы или объема могут быть использованы без дополнительной валидации/верификации при условии, что сохраняется такое же соотношение между средой для предварительного обогащения и испытуемым образцом (1:9). Навески большей массы или объема, чем первоначально утвержденные, могут быть использованы (при сохранении такого же соотношения между средой для предварительного обогащения и испытуемым образцом), при условии проведения исследований по валидации/верификации, в процессе которых не было выявлено ухудшения рабочих характеристик метода (чувствительность, специфичность).
Примечания
1 Валидация может проводиться в соответствии с ГОСТ ISO 16140. Проверка для объединяемых образцов может проводиться в соответствии с протоколом, описанным в [4].
Для больших количеств среды для предварительного обогащения (например, 1 дм3 или более) рекомендуется предварительно нагреть ЗПВ до 34—38 °C, перед внесением анализируемого образца.
2 Если необходимо исследовать более 25 г навески из определенной партии анализируемого продукта, а также когда имеется свидетельство того, что объединение анализируемых навесок не влияет на результат для этого конкретного продукта, навески могут быть объединены. Более подробная информация об объединении образцов, а также о процедуре проверки влияния объединения на чувствительность метода приведена в [4].
9.2 Неселективное предварительное обогащение
Исходную суспензию по 9.1 инкубируют при температуре от 34 °C до 38 °C (6.3) в течение (18 ± 2) ч. Допускается хранение предварительно обогащенного образца после инкубации при температуре (5 ± 1) °C (6.8) не более 72 ч (см. [9] — [13]).
9.3 Селективное обогащение
9.3.1 Общие положения
Если селективная среда для обогащения RVS-бульон или MSRV-агар (В.З или В.4) и МКТТп-бульон (В.5) хранились в холодильнике, их необходимо прогреть до комнатной температуры.
При пересеве из среды предварительного обогащения в селективную среду обогащения следует избегать переноса твердых частиц инокулированной пробы.
После инкубации допускается хранение селективно обогащенного образца при температуре (5 ± 1) °C (6.8) не более 72 ч (см. [9] — [13]).
Примечание — MSRV-агар предназначен для подвижных штаммов бактерий рода Salmonella и не подходит для обнаружения неподвижных штаммов бактерий рода Salmonella.
4
ГОСТ 31659—2024
9.3.2 Процедура для пищевых продуктов, кормов для животных и проб с поверхности объектов окружающей среды из зоны производства пищевых продуктов
Культуры, полученные после инкубирования по 9.2, пересевают в количестве 0,1 см3 в пробирку, содержащую 10 см3 RVS-бульона (В.З) или на поверхность чашки с MSRV-агаром (В.4). На поверхность MSRV-arapa наносят одну — три равноудаленные капли.
Культуры, полученные после инкубирования по 9.2, пересевают в количестве 1 см3 в пробирку, содержащую 10 см3 MKTTn-бульона (В.5).
Засеянный RVS-бульон и засеянные чашки MSRV-arapa инкубируют при температуре (41,5 ± 1) °C (6.4) в течение (24 ± 3) ч. Чашки MSRV-arapa не переворачивают.
Засеянный MKTTn-бульон инкубируют при температуре (37 ± 1) °C (6.3) в течение (24 ± 3) ч.
На чашках MSRV-arapa, предположительно содержащих сальмонеллы, проявляется серо-белая мутная зона, выходящая за пределы инокулированной капли.
На чашках MSRV-arapa, не содержащих сальмонеллы, зона роста отсутствует или не выходит за пределы инокулированной капли.
В сухих молочных продуктах и сыре бактерии рода Salmonella могут быть сублетально поврежденными. Среды для селективного обогащения таких образцов дополнительно инкубируют в течение (24 ± 3) ч (см. [14]).
Для некоторых других продуктов, например, отобранных при расследовании вспышек заболеваний, также целесообразно дополнительно инкубировать пробы.
9.3.3 Процедура для проб фекалий животных, отобранных на стадии первичной переработки продовольственного сырья
Культуры, полученные после инкубирования проб по 9.2, пересевают в количестве 0,1 см3 на MSRV-arap (В.4), нанося одну — три равноудаленные капли на поверхность среды.
Засеянные чашки MSRV-arapa инкубируют при температуре (41,5 ± 1) °C (6.4) в течение (24 ± 3) ч. Чашки не переворачивают.
На чашках MSRV-arapa, предположительно содержащих сальмонеллы, проявляется серо-белая мутная зона, выходящая за пределы инокулированной капли.
На чашках MSRV-arapa, не содержащих сальмонеллы, зона роста отсутствует или не выходит за пределы инокулированной капли.
Если на чашках через 24 ч отсутствуют признаки роста, их повторно инкубируют еще (24 ± 3) ч.
Примечание — Чувствительность анализа может быть улучшена при использовании параллельно второй процедуры селективного обогащения, например, инкубация MKTTn-бульона при температуре (41,5 ± 1) °C в течение 24 ч (см. [15]).
9.3.4 Процедура для проб окружающей среды, отобранных на стадии первичной переработки продовольственного сырья
Культуры, полученные после инкубирования по 9.2, пересевают в количестве 0,1 см3 на поверхность чашки с MSRV-агаром (В.4), нанося одну — три равноудаленные капли на поверхность среды.
Культуры, полученные после инкубирования по 9.2, пересевают в количестве 0,1 см3 в пробирку, содержащую 10 см3 RVS-бульона (В.З) или в количестве 1 см3 в пробирку, содержащую 10 см3 МКТТп-бульона (В.5).
Засеянный RVS-бульон и засеянные чашки MSRV-arapa инкубируют при температуре (41,5 ± 1) °C (6.4) в течение (24 ± 3) ч. Чашки MSRV-arapa не переворачивают. Засеянный MKTTn-бульон инкубируют при температуре (37 ± 1) °C (6.3) в течение (24 ± 3) ч.
На чашках MSRV-arapa, предположительно содержащих сальмонеллы, проявляется серо-белая мутная зона, выходящая за пределы инокулированной капли.
На чашках MSRV-arapa, не содержащих сальмонеллы, зона роста отсутствует или не выходит за пределы инокулированной капли.
Если на чашках через 24 ч отсутствуют признаки роста, их повторно инкубируют еще (24 ± 3) ч.
9.4 Пересев на агаризованные среды
9.4.1 Общие положения
Из селективно обогащенных культур (9.3) делают пересев на две селективные агаризованные среды выделения. Первой средой выделения является ксилоза-лизин-дезоксихолатный агар (XLD).
В качестве второй селективной среды выделения выбирают такую среду, которая дополняет XLD-агар и основана на диагностических характеристиках, отличных от характеристик XLD-arapa,
5
ГОСТ 31659—2024
для облегчения обнаружения, например, лактозоположительных или Н23-отрицательных бактерий рода Salmonella. Примеры селективных сред выделения приведены в приложении Е.
Если чашки с XLD-агаром и со второй селективной средой хранились в холодильнике, их необходимо прогреть до комнатной температуры. При необходимости поверхность чашек подсушивают перед использованием в соответствии с ГОСТ ISO 11133.
9.4.2 Процедура для пищевых продуктов, кормов для животных и проб с поверхности объектов окружающей среды из зоны производства пищевых продуктов
Из культуры, полученной в RVS-бульоне по 9.3.2, делают пересев с помощью петли объемом 10 мм3 (6.9) на поверхность чашки XLD (В.6), чтобы получить хорошо изолированные колонии. Аналогичным образом поступают со второй селективной агаризованной средой (приложение Е).
При наличии роста на MSRV-arape (9.3.2), определяют самую дальнюю точку непрозрачного роста в местах инокуляции и погружают петлю объемом 1 мм3 (6.9) непосредственно внутри границы непрозрачного роста. Петлю извлекают, убедившись, что не извлекаются большие куски MSRV-arapa. Делают пересев на поверхность чашки с XLD-агаром (В.6), чтобы получить хорошо изолированные колонии. Аналогичным образом поступают со второй селективной агаризованной средой.
Из культуры, полученной в МКТТп-бульоне (9.3.2), делают пересев с помощью петли объемом 10 мм3 (6.9) на поверхность чашки с XLD-агаром (В.6), чтобы получить хорошо изолированные колонии. Аналогичным образом поступают со второй селективной агаризованной средой.
Примечания
1 Для получения хорошо изолированных колоний допускается использование двух чашек Петри стандартного размера (диаметром 90 мм) с селективной средой или чашек Петри большего размера (диаметром 140 мм).
Чашки с XLD-агаром переворачивают вверх дном и инкубируют при температуре (37 ± 1) °C (6.3) в течение (24 ± 3) ч.
Вторую селективную среду для пересева инкубируют в соответствии с инструкциями производителя.
Если среда для селективного обогащения была инкубирована в течение дополнительных 24 часов, выполняют ту же процедуру пересева, описанную выше.
Типичные колонии бактерий рода Salmonella на XLD-агаре имеют черный центр и слегка прозрачную зону красноватого цвета из-за изменения цвета индикатора.
2 Н23-отрицательные штаммы бактерий рода Salmonella образуют на XLD-агаре розовые колонии с более темным розовым центром. Лактозоположительные штаммы Salmonella spp. образуют на XLD-агаре желтые колонии с почернением или без него. Распространенность этих фенотипов приведена в таблице 1.
Проверяют вторую селективную среду для пересева после инкубации на наличие презумптивных колоний бактерий рода Salmonella.
9.4.3 Процедура для проб, отобранных на стадии первичной переработки продовольственного сырья
При наличии роста на MSRV-arape (9.3.2), определяют самую дальнюю точку непрозрачного роста в местах инокуляции и погружают петлю объемом 1 мм3 (6.9) непосредственно внутри границы непрозрачного роста. Петлю извлекают, убедившись, что не захватываются большие куски MSRV-arapa. Делают пересев на поверхность чашки с XLD-агаром, чтобы получить хорошо изолированные колонии. Аналогичным образом поступают со второй селективной агаризованной средой (приложение Е).
Чашки с XLD-агаром переворачивают вверх дном и инкубируют при температуре (37 ± 1) °C (6.3) в течение (24 ± 3) ч.
Вторую селективную среду (приложение Е) инкубируют в соответствии с инструкциями производителя.
При отсутствии роста на MSRV-arape чашки продолжают инкубировать при температуре (41,5 ± 1) °C еще (24 ± 3) ч. Выполняют процедуру селективного пересева, если после 48 ч инкубации на чашках MSRV будут обнаружены признаки роста.
Типичные колонии бактерий рода Salmonella на XLD-агаре имеют черный центр и слегка прозрачную зону красноватого цвета из-за изменения цвета индикатора.
Примечание — Н23-отрицательные варианты сальмонелл образуют на XLD-агаре розовые колонии с более темным розовым центром. Лактозоположительные штаммы образуют на XLD-агаре желтые колонии с почернением или без него. Распространенность этих фенотипов приведена в таблице 1.
Проверяют вторую селективную агаризованную среду (приложение Е) после инкубации на наличие презумптивных колоний бактерий рода Salmonella.
6
ГОСТ 31659—2024
9.5 Подтверждение
9.5.1 Общие положения
Сочетание результатов биохимического и серологического тестирования указывает на принадлежность изолята к роду Salmonella. Для характеристики штаммов бактерий рода Salmonella необходимо полное серотипирование. Руководство по серотипированию описано в [76].
Взамен некоторых диагностических сред и тестов, указанных в 9.5.3 и В.8 — В.12, для биохимического подтверждения принадлежности выделенных колоний к Salmonella spp. допускается использовать альтернативные (коммерческие) препараты, разрешенные к применению в установленном порядке.
Для четкого различия положительных и отрицательных биохимических реакций целесообразна проверка реакции среды каждого биохимического теста с контрольными штаммами, хорошо охарактеризованными на положительный и отрицательный результаты.
Примечания
1 Визуальное выявление колоний сальмонелл в значительной степени зависит от опыта сотрудника, и их внешний вид может несколько различаться не только от серовара к серовару, но также от партии к партии используемой селективной среды.
Допускается использовать миниатюризированные тест-наборы для биохимической идентификации бактерий рода Salmonella в соответствии с ГОСТ ISO 7218.
2 Допускается использовать альтернативные методы идентификации для подтверждении принадлежности выделенных культур к Salmonella spp, при условии подтверждения пригодности метода (в соответствии с требованиями ГОСТ ISO 7218).
9.5.2 Выбор колоний для подтверждения
Отмечают подозрительные колонии на каждой чашке (9.4). Выбирают хотя бы одну типичную или подозрительную колонию для пересева и подтверждения. Если результат окажется отрицательным, выбирают для пересева до четырех подозрительных колоний из различных комбинаций селективных сред обогащения и выделения, имеющих признаки роста.
Пересевают выбранные колонии на поверхность предварительно высушенной неселективной агаризованной среды (В.7) таким образом, чтобы обеспечить рост хорошо изолированных колоний. Инкубируют чашки с пересевами при температуре от 34 °C до 38 °C (6.3) в течение (24 ± 3) ч.
В качестве альтернативы, если на селективной среде для пересева (9.4) имеются хорошо изолированные колонии (чистой культуры), для биохимического подтверждения допускается использовать подозрительную хорошо изолированную колонию с поверхности селективной среды. Стадия культивирования на неселективной агаризованной среде может затем быть выполнена параллельно с биохимическим тестированием, для проверки чистоты колонии, взятой с поверхности селективной агаризованной среды.
Для биохимического и серологического подтверждения необходимо использовать чистые культуры.
Примечание — Для эпидемиологических целей или при расследовании вспышек заболеваний целесообразно проводить подтверждение дополнительных колоний, например, пяти типичных колоний из каждой комбинации селективных сред для обогащения.
9.5.3 Биохимическое тестирование
9.5.3.1 Общие положения
На среды для биохимического подтверждения делают пересев каждой из культур, полученных из колоний, отобранных по 9.4 или 9.5.2. Для подтверждения Salmonella spp. должны быть проведены, как минимум, испытания, указанные в 9.5.3.2 — 9.5.3.4. Испытания, указанные в 9.5.3.5 и 9.5.3.6, также могут проводиться, когда результаты других подтверждающих испытаний не дают четкой идентификации.
9.5.3.2 Трехсахарный железистый агар (TSI-arap) (В.8)
Культуру пересевают штрихом на поверхность скошенного агара и делают укол в столбик агара до дна пробирки. Инкубируют при температуре (37 ± 1) °C (6.3) в течение (24 ± 3) ч.
Интерпретируют изменения в среде следующим образом:
а) столбик:
- желтый: реакция положительная, культура ферментирует глюкозу;
- красный или без изменения цвета среды: реакция отрицательная, культура не ферментирует глюкозу;
- черный: образование сероводорода;
- пузырьки или разрывы: образование газа из глюкозы;
7
ГОСТ 31659—2024
b) скошенная поверхность:
-желтая: реакция положительная, культура ферментирует лактозу и/или сахарозу;
- красная или без изменения цвета среды: реакция отрицательная, культура не ферментирует лактозу и сахарозу.
Большинство типичных культур рода Salmonella имеют щелочные (красные) скошенные поверхности агара и кислые (желтые) столбики с образованием газа (пузырьки) и (примерно в 90 % случаев) с образованием сероводорода (почернение агара) (см. таблицу 1).
При выделении лактозоположительных бактерий рода Salmonella, скошенная часть TSI-arapa желтая. Таким образом, предварительное подтверждение культур Salmonella не должно основываться только на результатах теста на TSI-arape (см. 9.5.3.1).
Примечание — Допускается также применение среды Клиглера, Клиглера-Хайна или других сред аналогичного назначения, зарегистрированных и разрешенных к применению на территории стран, принявших стандарт (например, среды Олькеницкого).
9.5.3.3 Агар с мочевиной (В.9)
Культуру пересевают штрихом на поверхность скошенного агара. Инкубируют при температуре (37 ± 1) °C (6.3) до 24 ч.
При положительной реакции мочевина гидролизуется, выделяя аммиак. Это изменяет цвет фенолового красного на бледно-розовый, а затем на глубокий красно-розовый. Реакция часто становится видимой через 2—4 часа.
Типичные культуры бактерий рода Salmonella не гидролизуют мочевину, поэтому цвет агара с мочевиной останется неизменным (таблица 1).
9.5.3.4 L-Лизин-декарбоксилазная среда (LDC, L-Lysine decarboxylation medium, В.10)
Культуру пересевают чуть ниже поверхности жидкой среды. Инкубируют при температуре (37 ± 1) °C (6.3) в течение (24 ± 3) ч.
Помутнение и фиолетовый цвет после инкубации указывают на положительную реакцию. Желтый цвет указывает на отрицательную реакцию.
Большинство типичных культур бактерий рода Salmonella дают положительную реакцию в LDC-среде (таблица 1).
9.5.3.5 Обнаружение 3-галактозидазы (В.11) (дополнительно)
Тест на р-галактозидазу может быть использован для различения подвидов Salmonella enterica — arizonae и diarizonae и других представителей Enterobacteriaceae (все дают положительную реакцию) от других подвидов Salmonella enterica (как правило, они дают отрицательную реакцию, см. таблицу 1).
Существует несколько процедур для проведения теста на р-галактозидазу. Пример приведен ниже.
Суспендируют петлей испытуемую колонию в пробирке, содержащую 0,25 см3 физиологического раствора (ВИЗ).
Добавляют одну каплю толуола и встряхивают пробирку. Помещают пробирку на водяную баню, установленную на 37 °C (6.6), и оставляют на несколько минут (примерно на 5 мин). Добавляют 0,25 см3 реактива для обнаружения р-галактозидазы (В.11) и перемешивают.
Помещают пробирку в водяную баню, установленную на 37 °C (6.6), и оставляют на 24 ч.
Появление желтого окрашивания указывает на положительную реакцию, свидетельствующую о наличии р-галактозидазы. Реакция в большинстве случаев проявляется через 20 мин.
Если для обнаружения р-галактозидазы используются готовые бумажные диски, следуют инструкциям производителя.
9.5.3.6 Тест образования индола (В.12) (дополнительно)
Тест на образование индола может быть использован при необходимости дифференцировать бактерии рода Salmonella (обычно индол-отрицательные, таблица 1) от Escherichia coli и Citrobacter (индол-положительные), поскольку эти микроорганизмы могут расти и давать типичные реакции на некоторых средах для выделения бактерий рода Salmonella.
Пересевают испытуемую колонию в пробирку, содержащую 5 см3 среды с триптофаном (В.12.1).
Инкубируют при температуре (37 ± 1) °C (6.3) в течение (24 ± 3) ч. После инкубирования добавляют 1 см3 реактива Ковача (В.12.2).
Образование красного кольца на поверхности среды свидетельствует о положительной реакции. Желто-коричневое кольцо указывает на отрицательную реакцию.
8
со
Таблица 1 — Интерпретация биохимических тестов
Тесту> (9.5.3.2—9.5.3.6) | Штамм Salmonella | |||||||||||||
S. Typhi | S. Paratyphi А | S. Paratyphi В | S. Paratyphi С | S. Gallinarum biovar gallinarum2) | S. Gallinarum biovar pullorum2) | Другие штаммы7) | ||||||||
Реакция | %+3> | Реакция | %+3> | Реакция | %+4> | Реакция | %+4> | Реакция | %+3> | Реакция | %+3> | Реакция | %+3> | |
Кислота из глюкозы | + | 100 | + | 100 | + | 100 | + | 100 | + | 100 | + | 100 | + | 100 |
Газ из глюкозы | -5) | 0 | + | 96,1 | + | 96.1 | + | 96,1 | - | 0 | + | 95,1 | + | 92 |
Кислота из лактозы | - | 2 | - | 0 | - | 0 | - | 0 | - | 0 | - | 0 | - | 18) |
Кислота из сахарозы | - | 0 | - | 0,6 | - | 0,6 | - | 0,6 | - | 0,6 | - | 0,6 | - | 1 |
Н23-продукция | + | 97 | - | 10 | + | 100 | + | 100 | v6) | v6) | + | 92 | ||
Гидролиз мочевины | - | 0 | - | 0 | - | 0 | - | 0 | - | 0 | - | 0 | - | 1 |
Лизин декарбоксилаза | + | 98 | - | 0 | + | 95 | + | 100 | + | 95 | + | 95 | + | 95 |
Р-галактозидаза | - | 0 | - | 0 | - | - | - | <10 | - | <10 | - | 28) | ||
Продукция индола | - | 0 | - | 1,2 | - | 1,2 | - | 1,2 | - | 1,2 | - | 1,2 | - | 1 |
^ Согласно [17\, [18]. 2) Согласно [17] — [19]. 3> Процентная доля показывает, что не все изоляты сероваров Salmonella проявляют реакции, отмеченные знаком «+» или «-». Реакции могут также варьироваться в пределах и между сероварами. 4) Пустые клетки: Процентная доля неизвестна из имеющейся литературы. 5> Salmonella Typhi не продуцирует газ. 6) V — вариабельный результат. Информация по дальнейшей дифференциации видов и подвидов Salmonella приведена в [16]. ® Salmonella enterica subsp. arizonae и diarizonae всегда дают положительную реакцию на р-галактосидазу. Некоторые штаммы подвидов arizonae и diari-zonae могут ферментировать лактозу. | ||||||||||||||
ГОСТ 31659—2024
ГОСТ 31659—2024
9.5.4 Серологическое тестирование
9.5.4.1 Общие положения
Чистые культуры, имеющие типичные для бактерий рода Salmonella биохимические реакции (9.5.3), также тестируют на наличие сальмонеллезных О- и Н-антигенов (в регионах, где возможно обнаружение Salmonella Typhi, также на наличие Vi-антигена) с помощью реакции агглютинации на предметном стекле с использованием поливалентных сывороток (В. 14). Чистые культуры культивируют на неселективной агаризованной среде (В.7) и тестируют на самоагглютинацию. Штаммы, которые являются самоагглютинирующими, не могут быть проверены на наличие антигенов сальмонелл. Сыворотки используют в соответствии с инструкцией изготовителя, если есть отличия от метода, описанного ниже.
Тесты по 9.5.4.2—9.5.4.5 являются минимально необходимыми для серологического тестирования Salmonella spp. Дальнейшее руководство по серологическому подтверждению и серотипированию описано в [16].
Э.5.4,2 Исключение самоагглютинирующих штаммов
Помещают одну каплю физиологического раствора (В.13) на чистое предметное стекло. Используя петлю, диспергируют в этой капле часть тестируемой колонии, чтобы получить гомогенную мутную суспензию. Аккуратно покачивают предметное стекло в течение 5—60 с. Просматривают суспензию, поместив стекло на темном фоне. Если наблюдается образование хлопьев или частиц в суспензии, это указывает на самоагглютинацию, и серологическое подтверждение не проводится. Дополнительная информация о тестировании самоагглютинирующихся штаммов приведена в [76].
9.5.4.3 Определение наличия О-антигенов
Чистую колонию, у которой не выявлено самоагглютинации, испытывают согласно 9.5.4.2, используя одну каплю поливалентной сальмонеллезной О-сыворотки (В.14) вместо физиологического раствора. Если происходит агглютинация, реакция считается положительной.
9.5.4.4 Исследование на наличие антигенов Vi (дополнительно)
Чистую колонию, у которой не выявлено самоагглютинации, испытывают, используя одну каплю сальмонеллезной Vi-сыворотки (В. 14) вместо физиологического раствора. Если происходит агглютинация, реакция считается положительной.
9.5.4.5 Исследование на наличие Н-антигенов
Чистую колонию, у которой не выявлено самоагглютинации, испытывают, используя одну каплю, поливалентной сальмонеллезной Н-сыворотки (В.14) вместо физиологического раствора. Если происходит агглютинация, реакция считается положительной.
9.5.5 Интерпретация биохимических и серологических реакций
В таблице 2 приведена интерпретация подтверждающих тестов (9.5.3 и 9.5.4).
Таблица 2 — Интерпретация подтверждающих тестов
Биохимические реакции | Само-агглютинация | Серологические реакции | Интерпретация |
Типичные | Нет | О- и Н-антигены положительные (и Vi положительный, если протестирован) | Штамм относится к бактериям рода Salmonella |
Типичные | Нет | О- и Н-антигены отрицательные | Штамм относится к нетипиру-емым бактериям рода Salmonella |
Типичные | Да | Не тестируется из-за самоагглютинации (см. Э.5.4.2) | |
Нетипичные реакции | — | — | Штамм не относится к бактериям рода Salmonella |
9.5.6 Серотипирование
Штаммы, которые подтверждены как Salmonella spp. (таблица 2) далее могут быть типированы до уровня серовара. Руководство по серотипированию описано в [76].
При необходимости по согласованию штаммы могут быть направлены в специализированный референсный центр для окончательного типирования (серотипирование, фаготипирование, молекулярное типирование). Информация, которой сопровождают штаммы, направляемые в референсный центр, включает данные о результатах исследования, об источнике выделения, относится ли он к изолятам от вспышки.
10
ГОСТ 31659—2024
10 Представление результатов
В соответствии с интерпретацией результатов указывается, обнаружены или не обнаружены бактерии рода Salmonella, в навеске х г или х см3 продукта (см. ГОСТ ISO 7218), или на участке поверхности, или в объекте (например, бахилы).
11 Характеристики метода
11.1 Межлабораторные исследования
Характеристики метода были определены в межлабораторных исследованиях для определения специфичности, чувствительности и LOD50 метода (см. [20], [21]).
Данные суммированы в приложении С. Значения, полученные в результате межлабораторных исследований, могут быть неприменимы к типам матриц, отличным от приведенных в приложении С. Кроме того, рабочие характеристики, указанные в приложении В, были определены для отдельных испытуемых навесок до 25 г (или см3). При использовании навесок большей массы или объема, характеристики могут отличаться.
11.2 Чувствительность
Чувствительность определяется как количество положительных проб, деленное на количество проб, испытанных при данном уровне загрязнения. Таким образом, результаты зависят от уровня загрязнения образца.
11.3 Специфичность
Специфичность определяется как количество отрицательных образцов, деленное на количество пустых проанализированных образцов.
11.4 Предел обнаружения 50 % образцов (LOD50)
LOD50 (уровень обнаружения) — это концентрация (КОЕ/анализируемая проба), для которой вероятность обнаружения составляет 50 %.
12 Протокол испытаний
В протоколе испытаний должно быть указано следующее:
- используемый метод отбора проб, если он известен;
- размер навески и/или характер исследуемого объекта;
- используемый метод испытаний со ссылкой на настоящий стандарт;
- любые использованные отклонения в средах обогащения или условиях инкубации;
- все условия эксплуатации, не указанные в настоящем стандарте или рассматриваемые как дополнительные, вместе с подробной информацией о любых инцидентах, которые могли оказать влияние на результаты испытаний;
- полученные результаты.
11
ГОСТ 31659—2024
Приложение А (обязательное)
Схемы анализа
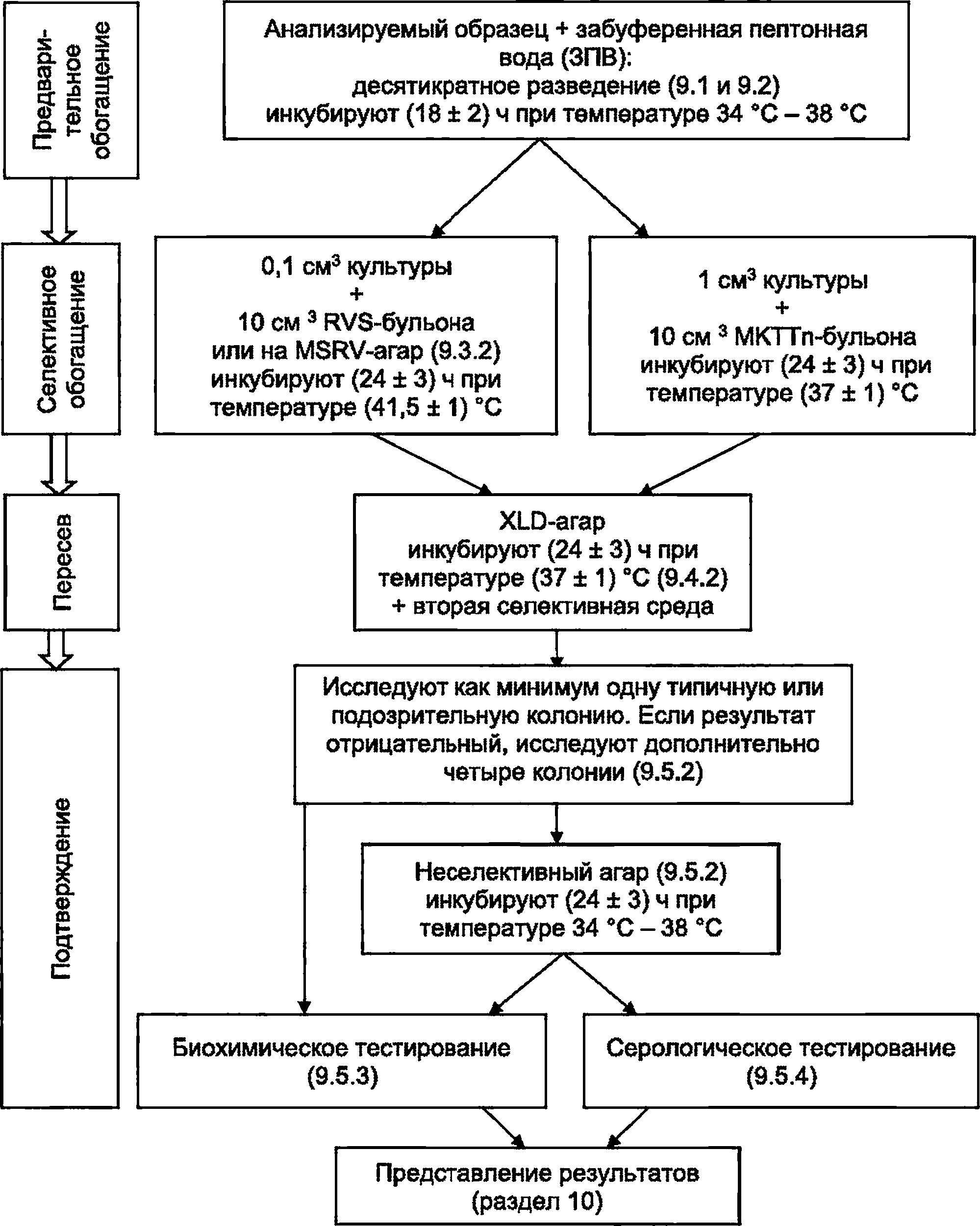
Рисунок А.1 — Схема обнаружения бактерий рода Salmonella в пищевых продуктах, кормах для животных и пробах окружающей среды из зоны производства пищевых продуктов
12
ГОСТ 31659—2024
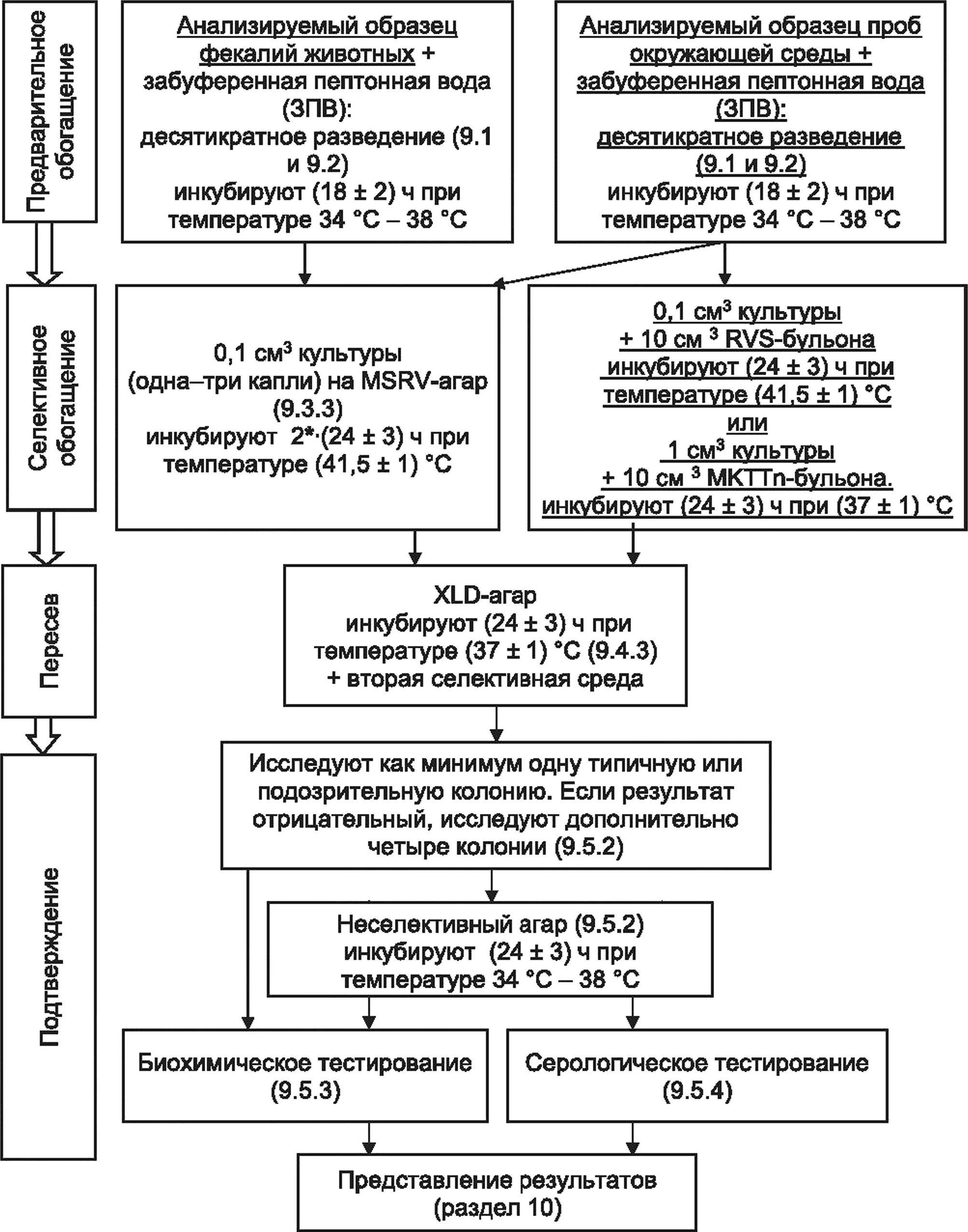
* При отсутствии роста на MSRV-arape чашки продолжают инкубировать при температуре (41,5 ± 1) °C еще (24 ± 3) ч.
Рисунок А.2 — Схема обнаружения бактерий рода Salmonella в фекалиях животных и в пробах окружающей среды, отобранных на стадии первичной переработки продовольственного сырья
13
ГОСТ 31659—2024
Приложение В (обязательное)
Питательные среды и реактивы
В.1 Общие положения
Общие положения ГОСТ ISO 11133 применимы к подготовке и испытаниям питательных сред, описанным в этом приложении. Если питательные среды или реактивы готовятся из сухих сред/реактивов или если используются готовые среды/реактивы, следуют инструкциям производителя относительно приготовления, условий хранения, срока годности и использования.
Допускается применение питательных сред (реактивов) аналогичного назначения, зарегистрированных и разрешенных к применению на территории государств, принявших стандарт, обеспечивающих соответствующую ГОСТ ISO 11133 специфическую активность (показатели чувствительности среды, скорости роста и стабильности основных биологических свойств микроорганизмов), дифференцирующие и ингибирующие свойства.
Сроки годности сред, приведенные в данном приложении, были установлены в некоторых исследованиях. Пользователь должен проверить (верифицировать) срок годности в собственных условиях хранения (согласно ГОСТ ISO 11133).
Определение рабочих характеристик для обеспечения качества питательных сред описано в В.15.
В.2 Забуференная пептонная вода (ЗПВ)
В.2.1 Состав: пептон1).....................................................................................................................................10,0 г;
натрий хлористый.....................................................................................................................5,0 г;
натрий фосфорнокислый двузамещенный 12-водный (Na2HPO4 • 12Н2О)2).....................9,0 г;
калий фосфорнокислый однозамещенный (КН2РО4)...........................................................1,5 г;
вода...........................................................................................................................................1000 см3.
В.2.2 Приготовление
Компоненты растворяют в воде, при необходимости, нагревают. При необходимости устанавливают pH, чтобы после стерилизации он составлял (7,0 ± 0,2) при температуре 25 °C.
Среду разливают в колбы (6.11) подходящей вместимости, чтобы получить порции, необходимые для анализа. Стерилизуют автоклавированием при температуре (121 ± 1) °C в течение 15 мин. Среду хранят в закрытых колбах (6.11) при температуре (5 ± 1) °C (6.7) не более шести месяцев.
В.З Среда Раппопорта-Василиадиса с соей (RVS-бульон)
В.3.1 Раствор А
В.3.1.1 Состав: ферментативный гидролизат сои............................................................................................5,0 г;
натрий хлористый.....................................................................................................................8,0 г;
калий фосфорнокислый однозамещенный (КН2РО4)...........................................................1,4 г.
калий фосфорнокислый двузамещенный (К2НРО4)..............................................................0,2 г;
вода...........................................................................................................................................1000 см3.
В.3.1.2 Приготовление
Компоненты растворяют в воде, при необходимости нагревают до температуры около 70 °C. Раствор должен быть подготовлен в день приготовления полной среды RVS.
В.3.2 Раствор В
В.3.2.1 Состав: магний хлористый 6-водный (MgCI2 • 6Н2О)..........................................................................400 г;
вода ..........................................................................................................................................1000 см3.
В.3.2.2 Приготовление
Магний хлористый растворяют в воде.
Поскольку эта соль очень гигроскопична, рекомендуется растворить все содержимое MgCI2 • 6Н2О из вновь открытого контейнера в соответствии с формулой. Например, к 250 г МдС12 • 6Н2О добавляют 625 см3 воды, получая раствор с общим объемом 788 см3 и массовой концентрацией около 31,7 г на 100 см3.
Раствор хранят в бутылке из темного стекла с плотной пробкой при комнатной температуре не более двух лет.
В.3.3 Раствор С
В.3.3.1 Состав: малахитовый зеленый оксалат................................................................................................0,4 г;
вода...........................................................................................................................................1000 см3.
1) Например, ферментативный гидролизат казеина.
2) Если используется гидрофосфат натрия двузамещенный с другим содержанием воды, необходимо изменить массу ингредиента соответственно. Например, в случае безводного гидрофосфата натрия двухзамещенного (Na2HPO4) используют 3,57 г.
14
ГОСТ 31659—2024
В.3.3.2 Приготовление
Малахитовый зеленый оксалат растворяют в воде. Раствор хранят в бутылке из темного стекла при комнатной температуре не более восьми месяцев.
В.3.4 Полный состав среды
В.3.4.1 Состав: раствор А (В.3.1)....................................................................................................................... 1000 см3;
раствор В (В.3.2).......................................................................................................................100 см3;
раствор С (В.3.3).......................................................................................................................10 см3.
В.3.4.2 Приготовление
К 1000 см3 раствора А прибавляют 100 см3 раствора В и 10 см3 раствора С.
При необходимости устанавливают такой pH, чтобы после стерилизации он составлял (5,2 ± 0,2) при температуре от 20 °C до 25 °C.
Среду разливают в пробирки или колбы (6.11) подходящей емкости, чтобы получить порции, необходимые для анализа, например, 10 см3 раствора.
Стерилизуют автоклавированием при температуре (115 ± 1) °C в течение 15 мин.
Среду хранят в закрытых пробирках или колбах при 5 °C (6.7) не более трех месяцев.
Примечание — Конечный состав среды: ферментативный гидролизат сои 4,5 г/дм3, натрий хлористый 7,2 г/дм3, калий фосфорнокислый (КН2РО4 + К2НРОл) 1,44 г/дм3, магния хлорид безводный (MgCI2) 13,4 г/дм3 или магний хлористый 6-водный (MgCI2 • 6Н2О) 28,6 г/дм3 и оксалат малахитового зеленого 0,036 г/дм3.
В.4 Модифицированный полужидкий селективный агар Раппопорта-Василиадиса (MSRV)
Примечание — Согласно [22].
В.4.1 Раствор А
В.4.1.1 Состав: ферментативный гидролизат животных и растительных тканей..........................................4,6 г;
кислотный гидролизат казеина................................................................................................4,6 г;
натрий хлористый.....................................................................................................................7,3 г;
калий фосфорнокислый однозамещенный (КН2РО4)...........................................................1,5 г;
вода...........................................................................................................................................890 см3.
В.4.1.2 Приготовление
Компоненты растворяют в воде, при необходимости нагревают до температуры 70 °C.
Растворить компоненты в воде, нагревая до 70 °C, если это необходимо. Раствор готовят в день приготовле
ния полного агара MSRV.
В.4.2 Раствор В
В.4.2.1 Состав:
магний хлористый 6-водный (MgCI2 • 6Н2О)..........................................................................400 г;
вода...........................................................................................................................................1000 см3.
В.4.2.2 Приготовление
Магний хлористый растворяют в воде.
Поскольку эта соль очень гигроскопична, рекомендуется растворить все содержимое MgCI2 • 6Н2О из вновь открытого контейнера в соответствии с формулой. Например, к 250 г МдС12 ■ 6Н2О добавляют 625 см3 воды, получая раствор с общим объемом 788 см3 и массовой концентрацией около 31,7 г на 100 см3.
Раствор хранят в бутылке из темного стекла с плотной пробкой при комнатной температуре не более двух лет.
В.4.3 Раствор С
В.4.3.1 Состав: малахитовый зеленый оксалат................................................................................................0,4 г;
вода........................................................................................................................................... 1000 см3.
В.4.3.2 Приготовление
Малахитовый зеленый оксалат растворяют в воде. Раствор хранят в бутылке из темного стекла при комнатной температуре не более восьми месяцев.
В.4.4 Основа среды
В.4.4.1 Состав: раствор А (В.4.1).......................................................................................................................890 см3;
раствор Б (В.4.2).......................................................................................................................100 см3;
раствор С (В.4.3).......................................................................................................................10 см3;
агар............................................................................................................................................2,7 г.
Может потребоваться экспериментальное определение концентрации агара, необходимой для оптимального роения бактерий рода Salmonella (например, при использовании партии агара с неизвестной гелеобразующей способностью).
15
ГОСТ 31659—2024
В.4.4.2 Приготовление
К 890 см3 раствора А прибавляют 100 см3 раствора В и 10 см3 раствора С, взбалтывают.
Добавляют агар и перемешивают. При необходимости устанавливают такой pH, чтобы после стерилизации он составлял 5,2 (от 5,1 до 5,4) при температуре от 20 °C до 25 °C. Нагревают до кипения при помешивании. Не автоклавируют. Не допускают длительного перегревания среды. Среду охлаждают до температуры от 47 °C до 50 °C (6.5).
В.4.5 Раствор новобиоцина
В.4.5.1 Состав: новобиоцина натриевая соль..................................................................................................0,05 г;
вода...........................................................................................................................................10 см3.
В.4.5.2 Приготовление
Растворяют новобиоцина натриевую соль в дистиллированной воде. Раствор стерилизуют фильтрацией через фильтр с размером пор 0,22 мкм. Раствор может храниться до четырех недель при температуре (5 ± 1) °C (6.7) или в небольших объемах (например, 2 см3) при минус (20 ± 1) °C (6.8) не более одного года.
В.4.6 Готовая среда
В.4.6.1 Состав: основа среды (В.4.4)................................................................................................................1000 см3;
раствор новобиоцина (В.4.5)...................................................................................................2 см3.
В.4.6.2 Приготовление
В асептических условиях прибавляют 2 см3 раствора новобиоцина (В.4.5) к 1000 см3 основы среды (В.4.4) с температурой от 47 °C до 50 °C. Тщательно перемешивают.
Конечная концентрация новобиоцина в готовой среде составляет 10 мг/дм3. Конечный pH должен составлять 5,2 (от 5,1 до 5,4) при температуре 20 °C — 25 °C.
Среду разливают в стерильные чашки Петри (6.13) по 15—20 см3 в чашки диаметром 90 мм.
Среде дают затвердеть, прежде чем двигать чашки, со средой обращаются с осторожностью.
Среду хранят в чашках крышкой вверх, защищая от высыхания, не более двух недель при температуре (5 ± 1) °C (6.7) в темноте.
Чашки не переворачивают, поскольку данный агар является слишком жидким для этого.
Чашки, в которых полужидкий агар разжижен или раздроблен, не должны использоваться.
Непосредственно перед использованием, и только в том случае, если явно выражена видимая влажность, поверхность агара аккуратно высушивают, например, поместив чашки Петри с открытыми крышками и поверхностью агара вверх в шкаф с ламинарным потоком воздуха, не допуская пересушивания среды.
Примечания
1 В составе MSRV-arapa, согласно [22], содержится 20 мг/дм3 новобиоцина. Однако с научной точки зрения предпочтительным является 10 мг/дм3 новобиоцина. Исследования показали увеличение зон миграции на агаре MSRV с более низкой концентрацией новобиоцина [23] и (отрицательным) влиянием новобиоцина на бактериальную подвижность [24].
2 Конечный состав среды — ферментативный гидролизат животных и растительных тканей 4,6 г/дм3, кислотный гидролизат казеина 4,6 г/дм3, натрий хлористый (NaCI) 7,3 г/дм3, калий фосфорнокислый однозамещенный (КН2РО4). 1,5 г /дм3, магний хлористый безводный (MgCI2) 10,9 г/дм3 или магний хлористый 6-водный (MgCI2 ■ 6Н2О) 28,6 г/дм3, оксалат малахитового зеленого 0,04 г/дм3, новобиоцина натриевая соль 0,01 г/дм3 и агар 2,7 г/дм3.
В.5 Мюллера-Кауфмана тетратионатно-новобиоциновый бульон (МКТТп-бульон)
Примечание —Согласно [18].
В.5.1 Основа среды
В.5.1.1 Состав: мясной экстракт........................................................................................................................4,3 г;
ферментативный гидролизат казеина....................................................................................8,6 г;
натрий хлористый (NaCI).........................................................................................................2,6 г;
кальций углекислый (СаСО3)..................................................................................................38,7 г;
натрия тиосульфат (Na2S2O3 • 5Н2О).....................................................................................47,8 г;
бычья желчь микробиологическая..........................................................................................4,78;
бриллиантовый зеленый..........................................................................................................9,6 мг;
вода...........................................................................................................................................1000 см3.
В.5.1.2 Приготовление
Компоненты или сухую среду растворяют в воде, нагревая ее при частом перемешивании до тех пор, пока среда не начнет кипеть, избегая перегревания. При необходимости устанавливают такой pH, чтобы он составлял (8,0 ± 0,2) при температуре 25 °C. Среду тщательно перемешивают. Основа среды может храниться в закрытых колбах (6.11) при температуре (5 ± 1) °C (6.7) не более трех месяцев.
16
ГОСТ 31659—2024
В.5.2 Йод-йодистый раствор
В.5.2.1 Состав: йод.............................................................................................................................................20,0 г;
калий йодистый (KI)..................................................................................................................25,0 г;
вода...........................................................................................................................................100 см3.
В.5.2.2 Приготовление
Калий йодистый полностью растворяют в 10 см3 воды, затем добавляют йод и разбавляют до 100 см3 стерильной водой. Не нагревают.
Приготовленный раствор хранят в (плотно) закрытом контейнере (6.11) в темноте не более одного года.
В.5.3 Раствор новобиоцина
В.5.3.1 Состав: новобиоцина натриевая соль..................................................................................................0,04 г;
вода...........................................................................................................................................5 см3.
В.5.3.2 Приготовление
Растворяют новобиоцина натриевую соль в дистиллированной воде. Раствор стерилизуют фильтрацией через фильтр с размером пор 0,22 мкм.
Раствор может храниться до четырех недель при температуре (5 ± 1) °C (6.7) или в небольших объемах (например, 5 см3) при минус (20 ± 1) °C (6.8) не более одного года.
В.5.4 Готовая среда
В.5.4.1 Состав: основа среды (В.5.1)................................................................................................................1000 см3;
йод-йодистый раствор (В.5.2)..................................................................................................20 см3;
раствор новобиоцина (В.5.3)...................................................................................................5 см3.
В.5.4.2 Приготовление
В асептических условиях прибавляют 5 см3 раствора новобиоцина (В.5.3) к 1000 см3 основы среды (В.5.1). Перемешивают, затем добавляют 20 см3 йод-йодистого раствора (В.5.2), тщательно перемешивают. Конечная концентрация новобиоцина в готовой среде составляет 40 мг/дм3.
Разливают среду асептически в емкости (6.11) подходящей вместимости, чтобы получить порции, необходимые для анализа, например, 10 см3 бульона, разлитые в пробирки. После приготовления pH готового МКТТп-бульона составляет примерно 8,0. Если готовая среда не используется непосредственно после приготовления, ее хранят в темноте при температуре (5 ± 1) °C (6.7). pH может снизиться во время хранения из-за химических реакций. Не допускается использование готовой среды, если pH снижается ниже 7,0.
В.6 Ксилоза-лизин-дезоксихолатный агар (XLD-arap)
Примечание —Согласно [18].
В.6.1 Состав: дрожжевой экстракт.................................................................................................................3,0 г;
натрий хлористый (NaCI).........................................................................................................5,0 г;
ксилоза......................................................................................................................................3,75 г;
лактоза......................................................................................................................................7,5 г;
сахароза....................................................................................................................................7,5 г;
L-лизина гидрохлорид..............................................................................................................5,0 г;
натрия тиосульфат (Na2S2O3 ■ 5Н2О).....................................................................................6,8 г;
железо (III) аммоний цитрат.....................................................................................................0,8 г;
феноловый красный.................................................................................................................0,08 г;
натрия дезоксихолат................................................................................................................1,0 г;
агар............................................................................................................................................ 9—18 г1);
вода...........................................................................................................................................1000 см3.
В.6.2 Приготовление
Компоненты или сухую среду растворяют в воде, нагревая ее при частом перемешивании до тех пор, пока среда не начнет кипеть, избегая перегревания.
При необходимости устанавливают такой pH, чтобы после прогрева он составлял (7,4 ± 0,2) при температуре 25 °C. Разливают основу среды в пробирки или колбы (6.11) соответствующей вместимости.
В.6.3 Приготовление чашек с агаром
Среду охлаждают до температуры от 47 °C до 50 °C на водяной бане (6.5), перемешивают и разливают в стерильные чашки Петри (6.13), дают застыть. Непосредственно перед использованием чашки подсушивают (предпочтительно с открытыми крышками и поверхностью агара вниз) в шкафу (6.2), при температуре от 25 °C до 50 °C, до тех пор, пока поверхность агара не станет сухой.
Разлитые чашки хранят, не допуская пересыхания, при температуре (5 ± 1) °C (6.7) не более четырех недель.
1> В зависимости от гелеобразующей способности агара.
17
ГОСТ 31659—2024
В.7 Питательный агар (пример неселективной среды)
В.7.1 Состав: мясной экстракт........................................................................................................................3,0 г;
пептон........................................................................................................................................5,0 г;
натрий хлористый (NaCI) (дополнительно)............................................................................5,0 г;
агар............................................................................................................................................9—18 г1);
вода........................................................................................................................................... 1000 см3.
В.7.2 Приготовление
Компоненты или сухую среду растворяют в воде, нагревая ее при частом перемешивании. При необходимости устанавливают такой pH, чтобы после стерилизации он составлял (7,0 ± 0,2) при 25 °C. Среду разливают в пробирки или колбы (6.11) соответствующей вместимости. Стерилизуют автоклавированием (6.1) при температуре (121 ± 1) °C в течение 15 мин.
В.7.3 Приготовление чашек с питательным агаром
Среду охлаждают до температуры от 47 °C до 50 °C на водяной бане (6.5), перемешивают и разливают в стерильные чашки Петри (6.13), дают застыть. Непосредственно перед использованием чашки подсушивают (предпочтительно с открытыми крышками и поверхностью агара вниз) в шкафу (6.2), при температуре от 25 °C до 50 °C, до тех пор, пока поверхность агара не станет сухой.
Разлитые чашки хранят, не допуская пересыхания, при температуре (5 ± 1) °C (6.7) не более четырех недель.
В.8 Трехсахарный агар с железом (TSI-arap)
В.8.1 Состав: мясной экстракт........................................................................................................................3,0 г;
дрожжевой экстракт.................................................................................................................3,0 г;
пептон........................................................................................................................................20,0 г;
натрий хлористый (NaCI).........................................................................................................5,0 г;
лактоза......................................................................................................................................10,0 г;
сахароза....................................................................................................................................10,0 г;
глюкоза......................................................................................................................................1,0 г;
железо (III) цитрат.....................................................................................................................0,3 г;
натрия тиосульфат (Na2S2O3 • 5Н2О).....................................................................................0,3 г;
феноловый красный.................................................................................................................0,024 г;
агар............................................................................................................................................9—18 г1);
вода........................................................................................................................................... 1000 см3.
В.8.2 Приготовление
Компоненты или сухую среду растворяют в воде, нагревая ее при частом перемешивании. При необходимости устанавливают такой pH, чтобы после стерилизации он составлял (7,4 ± 0,2) при 25 °C. Среду разливают в пробирки или флаконы (6.11) по 10 см3. Стерилизуют автоклавированием (6.1) при температуре (121 ± 1) °C в течение 15 мин.
Пробирки оставляют в наклонном положении так, чтобы высота столбика среды составляла около 2,5—5 см, а скошенная поверхность над ним — 5 см.
Разлитые пробирки хранят, не допуская пересыхания, при температуре (5 ± 1) °C (6.7) не более четырех недель.
Примечание — В качестве альтернативы можно использовать двухсахарный агар с железом (Клиглер-Хайна).
В.9 Агар с мочевиной (Кристенсена)
В.9.1 Основа среды
В.9.1.1 Состав: пептон2).....................................................................................................................................1,0 г;
глюкоза......................................................................................................................................1,0 г;
натрий хлористый (NaCI).........................................................................................................5,0 г;
калий фосфорнокислый однозамещенный (КН2РО4)...........................................................2,0 г;
феноловый красный.................................................................................................................0,012 г;
агар............................................................................................................................................9—18 г1>;
вода........................................................................................................................................... 1000 см3.
В.9.1.2 Приготовление
Компоненты или сухую среду растворяют в воде, нагревая ее при частом перемешивании. При необходимости устанавливают такой pH, чтобы после стерилизации он составлял (6,8 ± 0,2) при 25 °C. Среду разливают в пробирки или флаконы (6.11) соответствующей вместимости. Стерилизуют автоклавированием (6.1) при температуре (121 ± 1) °C в течение 15 мин.
Основа среды может храниться в закрытых пробирках или колбах при температуре (5 ± 1) °C не более трех месяцев.
1) В зависимости от гелеобразующей способности агара.
2) Например, ферментативный гидролизат желатина.
18
ГОСТ 31659—2024
В.9.2 Раствор мочевины
В.9.2.1 Состав: мочевина...................................................................................................................................400 г;
вода, до конечного объема......................................................................................................1000 см3.
В.9.2.2 Приготовление
Мочевину растворяют в воде. Раствор стерилизуют фильтрацией через фильтр с размером пор 0,22 мкм.
См. ГОСТ/SO 11133.
В.9.3 Готовая среда
В.9.3.1 Состав: основа среды (В.9.1)................................................................................................................950 см3;
раствор мочевины (В.9.2)........................................................................................................50 см3.
В.9.3.2 Приготовление
В асептических условиях прибавляют раствор мочевины к основе среды, предварительно расплавленной и охлажденной до температуры от 47 °C до 50 °C. Готовую среду разливают по 10 см3 в стерильные пробирки (6.11), которые затем устанавливают в наклонном положении. Пробирки со средой хранят, не допуская пересыхания, при температуре (5 ± 1) °C (6.7) не более четырех недель.
В.10 L-лизин-декарбоксилазная среда (LDC, L-Lysine decarboxylation medium)
В. 10.1 Состав:
L-лизин моногидрохлорид.......................................................................................................5,0 г;
дрожжевой экстракт.................................................................................................................3,0 г;
глюкоза......................................................................................................................................1,0 г;
бромкрезоловый пурпурный....................................................................................................0,015 г;
вода........................................................................................................................................... 1000 см3.
В.10.2 Приготовление
Компоненты растворяют в воде, при необходимости нагревают. При необходимости устанавливают такой pH, чтобы после стерилизации он составлял (6,8 ± 0,2) при 25 °C. Среду разливают в количестве 2—5 см3 в узкие пробирки (6.11) с завинчивающимися крышками. Стерилизуют автоклавированием (6.1) при температуре (121 ± 1) °C в течение 15 мин. Пробирки со средой хранят при температуре (5 ± 1) °C (6.7) не более трех месяцев.
В.11 Реактив ^-галактозидазы (дополнительно)
В дополнение к реактивам, описанным ниже, для теста на р-галактозидазу необходим толуол.
В.11.1 Буферный раствор
В. 11.1.1 Состав:
натрий фосфорнокислый однозамещенный (NaH2PO4).......................................................6,9 г;
натрия гидроокись (NaOH), раствор 10 моль/дм3..................................................................примерно 3 см3;
вода, до конечного объема......................................................................................................50 см3.
В.11.1.2 Приготовление
Натрий фосфорнокислый однозамещенный растворяют в приблизительно 45 см3 воды в мерной колбе. Устанавливают pH до (7,0 ± 0,2) при температуре 25 °C с помощью раствора натрия гидроокиси. Добавляют воду до конечного объема 50 см3. Буферный раствор может храниться в закрытых колбах при температуре (5 ± 1) °C (6.7)
не более шести месяцев.
В.11.2 Раствор ONPG
В.11.2.1 Состав: о-Нитрофенил P-D-галактопиранозид (ONPG).......................................................................0,08 г;
вода, до конечного объема......................................................................................................15 см3.
В.11.2.2 Приготовление
Растворяют ONPG в воде при температуре приблизительно 50 °C. Охлаждают раствор.
В.11.3 Готовый реактив
В.11.3.1 Состав:
буферный раствор (В.11.1) .....................................................................................................5 см3;
раствор ONPG (В.11.2).............................................................................................................15 см3.
В.11.3.2 Приготовление
Добавляют буферный раствор к раствору ONPG. Готовый реактив хранят в закрытых колбах (6.11) при температуре (5 ± 1) °C (6.7) не более трех месяцев. При изменении цвета на желтый, реактив утилизируют.
В.12 Среда и реактив для индольной реакции (дополнительно)
В.12.1 Триптон/триптофановая среда
В.12.1.1 Состав: триптон......................................................................................................................................10 г;
натрий хлористый (NaCI).........................................................................................................5,0 г;
DL-триптофан...........................................................................................................................1,0 г;
вода...........................................................................................................................................1000 см3.
19
ГОСТ 31659—2024
В.12.1.2 Приготовление
Компоненты растворяют в кипящей воде. При необходимости устанавливают такой pH, чтобы после стерилизации он составлял (7,5 ± 0,2) при 25 °C. Среду разливают в пробирки (6.11) по 5 см3. Стерилизуют автоклавированием (6.1) при температуре (121 ± 1) °C в течение 15 мин. Пробирки со средой хранят при температуре (5 ± 1) °C
(6.7) не более трех месяцев.
В.12.2 Реактив Ковача
В.12.2.1 Состав: 4-Диметиламинобензальдегид................................................................................................5 г;
соляная кислота плотностью р = 1,18—1,19 г/см3.................................................................25 см3;
2-Метил-2-бутанол....................................................................................................................75 см3.
В.12.2.2 Приготовление
Компоненты смешивают, готовый реактив хранят в закрытых колбах (6.11) в темноте при температуре (5 ± 1) °C (6.7) не более шести месяцев.
В.13 Физиологический раствор
В. 13.1 Состав:
натрий хлористый (NaCI).........................................................................................................8,5 г;
вода ..........................................................................................................................................1000 см3.
В. 13.2 Приготовление
Хлористый натрий растворяют в воде. При необходимости устанавливают такой pH, чтобы после стерилизации он составлял (7,0 ± 0,2) при 25 °C. Раствор разливают в колбы или пробирки (6.11) подходящей вместимости, чтобы получить порции, необходимые для анализа. Стерилизуют автоклавированием (6.1) при температуре (121 ± 1) °C в течение 15 мин. Раствор хранят в закрытых колбах/пробирках при температуре (5 ± 1) °C (6.7) не более шести месяцев.
В.14 Сыворотки
Существует несколько типов агглютинирующих сывороток, содержащих антитела к одному или нескольким О-антигенам, т.е. сыворотки, содержащие одну или несколько «О» групп (моновалентные или поливалентные О-сыворотки), анти- Vi сыворотки и сыворотки, содержащие антитела к одному или нескольким Н-факторам (моновалентные или поливалентные Н-сыворотки).
В.15 Определение рабочих характеристик при контроле качества питательных сред
Определение селективности и производительности (ростовые свойства) приведено в ГОСТ ISO 11133. В целом, следуют процедурам для определения рабочих характеристик, описанным в ГОСТ ISO 11133. Для определения рабочих характеристик селективных жидких сред и MSRV-arapa, используют тот же объем инокулята, который указан в 9.3.2. Для MSRV-arapa инокулят должен содержать 103—104 КОЕ для определения производительности и 104—106 КОЕ для определения селективности (см. ГОСТ ISO 11133). Для других сред уровни содержания целевых и нецелевых организмов в инокуляте определены в ГОСТ ISO 11133—2016, подраздел 5.4.
Таблица В.1 — Определение рабочих характеристик при контроле качества питательных сред
Среда | Функция | Инкубация | Контрольные штаммы О | Номера WDCM | Критерий2* |
ЗПВ | Производительность | (18±2)ч/ 34 °C — 38 °C | Salmonella Typhimurium3)’4) Salmonella Enteritidis3)’ 4> | 00031 00030 | Помутнение (1—2) |
МКТТп-бульон | Производительность | (24 ± 3) ч/ (37±1)°С | Salmonella Typhimurium3)' 4^ Salmonella Enteritidis3)’ 4^ + Escherichia coli4'> + Pseudomonas aeruginosa | 00031 00030 00012 или 00013 00025 | >10 характерных колоний на XLD-arape или другой выбранной среде |
Селективность | Escherichia coli4^ | 00012 или 00013 | Частичное ингибирование <100 колоний на питательном агаре | ||
Enterococcus faecalis 4> | 00009 или 00087 | <10 колоний на питательном агаре |
20
Окончание таблицы В. 1
ГОСТ 31659—2024
Среда | Функция | Инкубация | Контрольные штаммы7) | Номера WDCM | Критерий2) |
RVS-бульон | Производительность | (24 ± 3) ч/ (41,5 ± 1) °C | Salmonella Typhimurium3^ 4^ Salmonella Enteritidis3}'4} + Escherichia coli4) + Pseudomonas aeruginosa | 00031 00030 00012 или 00013 00025 | >10 характерных колоний на XLD-arape или другой выбранной среде |
Селективность | Escherichia co/i4^ | 00012 или 00013 | Частичное ингибирование <100 колоний на питательном агаре | ||
Enterococcus faecalis4'> | 00009 или 00087 | <10 колоний на питательном агаре | |||
MSRV-arap | Производительность | 2(24 ± 3 )ч/ (41,5 ± 1) °C | Salmonella Typhimurium3)’4) Salmonella Enteritidis3)’4) | 00031 00030 | Серо-белая мутная зона, выходящая за пределы инокулированной капли. После 24—48 ч мутная зона будет продвигаться (почти) полностью по всей чашке. Возможное дополнение: характерные колонии после пересева на агар XLD |
Селективность | Escherichia coH4) | 00012 или 00013 | Возможен рост в месте инокулированной капли без мутной зоны | ||
Enterococcus faecalis4'> | 00009 или 00087 | Отсутствие роста | |||
XLD-arap | Производительность | (24 ± 3) ч/ (37± 1)°С | Salmonella Typhimurium3)’4^ Salmonella Enteritidis3)’4) | 00031 00030 | Хороший рост колоний с черным центром и слегка прозрачной зоной красноватого цвета из-за изменения цвета среды |
Селективность | Escherichia coH4} | 00012 или 00013 | Рост или частичное ингибирование (0—1) желтых колоний | ||
Enterococcus faecalis4'> | 00009 или 00087 | Полное ингибирование (0) | |||
Питательный агар | Производительность | (2 ± 3) ч/ 34—38 °C | Salmonella Typhimurium3)’4) Salmonella Enteritidis3)-4^ | 00031 00030 | Хороший рост |
у) В качестве контрольных штаммов используют референсные тест-штаммы в соответствии с номерами WDCM (Всемирный центр данных по микроорганизмам, «www.wfcc.info»), или контрольные эталонные штаммы из национальных коллекций микробных культур, или другие штаммы в соответствии с ГОСТ ISO 11133.
2i Рост классифицируется как 0: без роста, 1: слабый рост (частичное ингибирование) и 2: хороший рост (см. ГОСТ ISO 11133).
3) Для некоторых национальных ограничений и указаний может потребоваться использование другого серо-вара. Необходимо ссылаться на национальные требования, касающиеся выбора сероваров Salmonella.
4> Штаммы на выбор; необходимо использовать как минимум один из штаммов.
21
ГОСТ 31659—2024
Приложение С (справочное)
Исследования по валидации методов и рабочие характеристики
С.1 Рабочие характеристики RVS-бульона и МКТТп-бульона
Международные межлабораторные исследования были организованы в 2000 году в рамках европейского проекта SMT СТ 96 2098 [25], [26]. В этих исследованиях было задействовано 11 лабораторий в девяти странах Европы и 10 лабораторий в США. Работы проводились с использованием образцов сырого творога, сухого яичного порошка, сырого мяса птицы и стандартных образцов. Каждый образец пищевого продукта был исследован как с низкими, так и с высокими уровнями заражения, а также исследовался отрицательный контроль.
Метод, представленный для межлабораторных исследований, соответствовал [27], включая селективное обогащение в RVS-бульоне и МКТТп- бульоне. Процедура обнаружения бактерий рода Salmonella в пробах пищевых продуктов, приведенная в [27], сопоставима с процедурой, описанной в настоящем документе.
Значения рабочих характеристик, полученные в результате этого совместного теста, приведены для каждого типа образцов в таблицах С.1 — С.4. Данные, полученные некоторыми лабораториями, были исключены из расчетов только на основании четко определенных технических причин (отклонений от протокола).
Таблица С.1 — Результаты анализа данных, полученных при анализе образцов сырого творога
Параметр | Сырой творог (незараженный) | Сырой творог (низкий уровень заражения)7) | Сырой творог (высокий уровень заражения)7) |
Количество участвующих лабораторий | 23 | 23 | 23 |
Количество образцов на лабораторию | 5 | 5 | 5 |
Количество лабораторий, отобранных после оценки данных | 21 | 21 | 21 |
Количество образцов, отобранных после оценки данных | 105 | 105 | 105 |
Размер анализируемой навески, г | 25 | 25 | 25 |
Специфичность, % | 100 | — | — |
Чувствительность, % | — | 74,3 | 83,8 |
LOD50 (95 %-ный доверительный интервал), КОЕ/навеску | — | 5,7 | 4,0—8,1 |
7) Образцы творога были искусственно заражены Salmonella Montevideo (лактозаположительный штамм). Наиболее вероятное число (НВЧ) при анализе искусственно зараженных образцов: НВЧ/25г Низкий уровень 0,7 (от 0,2 до 2,4) Высокий уровень 37,2 (от 7,5 до 95,0) | |||
Таблица С.2 — Результаты анализа данных, полученных при анализе образцов сухого яичного порошка
Параметр | Испытание I. Сухой яичный порошок (незараженный) | Испытание I. Сухой яичный порошок (низкий уровень заражения)7) | Испытание I. Сухой яичный порошок (высокий уровень заражения)7) | Испытание II. Сухой яичный порошок (низкий уровень заражения)7) |
Количество участвующих лабораторий | 26 | 26 | 26 | 9 |
Количество образцов на лабораторию | 5 | 5 | 5 | 5 |
Количество лабораторий, отобранных после оценки данных | 21 | 21 | 21 | 8 |
Количество образцов, отобранных после оценки данных | 105 | 105 | 104 | 40 |
22
Окончание таблицы С. 2
ГОСТ 31659—2024
Параметр | Испытание I. Сухой яичный порошок (незараженный) | Испытание I. Сухой яичный порошок (низкий уровень заражения)7) | Испытание I. Сухой яичный порошок (высокий уровень заражения)7) | Испытание II. Сухой яичный порошок (низкий уровень заражения)7) |
Размер анализируемой навески, г | 25 | 25 | 25 | 25 |
Специфичность, % | 100 | — | — | н/о |
Чувствительность,% | — | 98,1 | 99 | н/о |
LOD50 (95 %-ный доверительный интервал), КОЕ/навеску | — | 6,0 (4,7—7,7) | ||
н/о — не определено. 7) Образцы сухого яичного порошка были искусственно заражены Salmonella Panama. Наиболее вероятное число (НВЧ) при анализе искусственно зараженных образцов: НВЧ/25 г Испытание I (низкий уровень) 9,6 (2,2—26) Испытание I (высокий уровень) 115 (22,5—495) Испытание II (низкий уровень) 0,7 (0,2—2,3) | ||||
Таблица С.З — Результаты анализа данных, полученных при анализе образцов сырого мяса птицы
Параметр | Испытание I. Сырое мясо птицы (неза-раженное) | Испытание I. Сырое мясо птицы (низкий уровень заражения)’) | Испытание I. Сырое мясо птицы (высокий уровень заражения)7) | Испытание II. Сырое мясо птицы (низкий уровень заражения)7) | Испытание II. Сырое мясо птицы (высокий уровень заражения)7) |
Количество участвующих лабораторий | 25 | 25 | 25 | 13 | 13 |
Количество образцов на лабораторию | 5 | 5 | 5 | 6 | 6 |
Количество лабораторий, отобранных после оценки данных | 20 | 20 | 20 | 13 | 13 |
Количество образцов, отобранных после оценки данных | 100 | 99 | 100 | 78 | 78 |
Размер анализируемой навески, г | 25 | 25 | 25 | 25 | 25 |
Специфичность, % | 100 | — | — | н/о | н/о |
Чувствительность, % | — | 98 | 100 | н/о | н/о |
LOD50 (95 %-ный доверительный интервал), КОЕ/навеску | — | н/о | н/о | 2,2 (1,5—3,2) | |
н/о — не определено. 1) Образцы сырого мяса птицы были искусственно заражены Salmonella Typimurium при проведении испытания I, и естественным образом заражены Salmonella spp. при проведении испытания II. Наиболее вероятное число (НВЧ) при анализе искусственно зараженных образцов: НВЧ/25 г Испытание I (низкий уровень) 3,7 (1—9,5) Испытание I (высокий уровень) 5,8 (1—25) Испытание II (низкий уровень) 0,2 (0,04—0,9) Испытание II (высокий уровень) 1,0 (2,2—4,5) | |||||
Таблица С.4 — Результаты анализа данных, полученных при анализе стандартных образцов
Параметр | Стандартные образцы (капсулы, содержащие приблизительно 5 КОЕ S. Typhimurium) |
Количество лабораторий, представивших результаты анализа | 26 |
Количество образцов на лабораторию | 5 |
23
ГОСТ 31659—2024
Окончание таблицы С. 4
Параметр | Стандартные образцы (капсулы, содержащие приблизительно 5 КОЕ S. Typhimurium) |
Количество исключенных лабораторий | 1 |
Количество лабораторий, отобранных после оценки данных | 25 |
Количество принятых образцов | 125 |
Специфичность, % | — |
Чувствительность, % | 94,4 |
С.2 Рабочие характеристики MSRV-arapa для обнаружения Salmonella spp. в пищевых продуктах и кормах
В 2003 году было проведено валидационное исследование в соответствии с ГОСТ ISO 16140 (см. [28]) по сравнению выделения Salmonella spp., используя только MSRV агар, с методом, описанным в [27] (с использованием селективной среды обогащения, RVS бульона и бульона МКТТп). Результаты части настоящего исследования по сравнению методик кратко изложены в таблице С.5 и С.6. В рамках исследования было также проведено межлабораторное сравнительное исследование, результаты которого кратко изложены в таблицах С.5 и С.6.
Таблица С.5 — Количество проанализированных образцов в исследовании по валидации MSRV агара при сравнении методов
Категории пищевых продуктов | Положительные | Отрицательные | Всего | ||
з. е. | з. и. | всего | |||
Мясо и мясные продукты | 26 | 13 | 39 | 40 | 79 |
Молочные продукты | 13 | 18 | 31 | 36 | 67 |
Рыба, морепродукты, овощи | 4 | 28 | 32 | 64 | |
Продукты переработки яиц, мучные кондитерские изделия | 3 | 29 | 32 | 34 | 66 |
Пробы окружающей среды | 0 | 30 | 30 | 31 | 61 |
Всего | 46 | 118 | 164 | 173 | 337 |
з. е. — зараженные естественным образом; з. и. — зараженные искусственно
Таблица С.6 — Результаты исследований по валидации MSRV-arapa при сравнении методов
Категории пищевых продуктов | Относительная погрешность, % | Относительная специфичность, % | Относительная чувствительность, % |
Мясо и мясные продукты | 96 | 98 | 95 |
Молочные продукты | 100 | 100 | 100 |
Рыба, морепродукты, овощи | 95 | 94 | 97 |
Продукты переработки яиц, мучные кондитерские изделия | 98 | 100 | 97 |
Пробы окружающей среды | 98 | 100 | 97 |
Все образцы | 98 | 98 | 97 |
Другие результаты исследований по сравнению методов:
- восемь отклоняющихся результатов (пять отрицательных отклонений и три положительных отклонения), несущественные;
- относительный уровень обнаружения для пяти матриц составил от 0,49 до 0,78 клеток бактерий рода Salmonella на 25 г или см3;
- инклюзивность была проанализирована на 55 изолятах бактерий рода Salmonella из пищи (от 10 КОЕ/см3 до 90 КОЕ /см3 в ЗПВ);
24
ГОСТ 31659—2024
- эксклюзивность была проанализирована на 48 штаммах, не относящихся к бактериям рода Salmonella, которые препятствуют детекции бактерий рода Salmonella (от 104 до 106 КОЕ/см3 в ЗПВ);
- результаты инклюзивности/эксклюзивности исследований показали специфичность метода. Три штамма бактерий рода Salmonella не были обнаружены (2 штамма S. paratyphi А, 1 штамм S. enteritidis), а два штамма Enterobacter cloacae дали презумптивно положительные результаты.
Результаты межлабораторного сравнительного исследования:
- 29 лабораторий-участников из 10 разных стран;
- каждой лабораторией было проанализировано 24 пробы сухого обезжиренного молока с искусственным заражением при трех разных уровнях загрязнения (0 КОЕ/25 г, 10 КОЕ/25 г, 30 КОЕ/25 г). Было проанализировано восемь повторяющихся образцов на каждый уровень заражения;
-дублирующие испытания с использованием MSRV-arapa и [27];
- 240 результатов на метод;
- выбросы значений отсутствуют;
-для всех уровней заражения: относительная погрешность, относительная чувствительность, относительная специфичность составили 100 %, доверительный интервал — 98 %;
-два ложноположительных результата, вероятно, по причине перекрестной контаминации.
С.З Рабочие характеристики агара MSRV для обнаружения Salmonella spp. в фекалиях животных и в пробах окружающей среды, отобранных на стадии первичной переработки продовольственного сырья
Точные данные, касающиеся MSRV-arapa для обнаружения Salmonella spp. в фекалиях животных и в пробах окружающей среды, отобранных на стадии первичной переработки продовольственного сырья, были рассчитаны на основе трех различных межлабораторных исследований, организованных EURL-Salmonella, RIVM, Нидерланды. Это касалось исследований, организованных в 2008 году [29], 2012 году [30] и 2013 году [31]. Образцы, проанализированные в трех исследованиях, представляли собой, соответственно, куриные фекалии, свиные фекалии и бахилы. Каждый из образцов анализировался при двух разных уровнях заражения, плюс отрицательный контроль. Все исследования финансировались Европейской комиссией, и последнее исследование также было выполнено в рамках мандата CEN М381. Метод, представленный для межлабораторных исследований, соответствовал методу [32] для обнаружения сальмонелл в образцах, отобранных на стадии первичной переработки продовольственного сырья, включая селективное обогащение на MSRV-агаре. Этот метод был включен в настоящий документ. Значения рабочих характеристик, полученные в межлабораторных исследованиях, приведены для каждого типа выборки в таблицах С.7—С.9. Данные, полученные некоторыми сотрудниками, были исключены из расчетов только на основании четко определенных технических причин (отклонения от протокола).
Таблица С.7 — Результаты анализа данных, полученных при анализе образцов куриных фекалий
Параметр | Куриные фекалии | ||||
Незараженные | STM 57) | STM 44’> | SE 77> | SE 910 | |
Количество участвующих лабораторий | 32 | 32 | 32 | 32 | 32 |
Количество образцов на лабораторию | 5 | 5 | 5 | 5 | 5 |
Количество лабораторий, отобранных после оценки данных | 19 | 19 | 19 | 19 | 19 |
Количество образцов, отобранных после оценки данных | 95 | 95 | 95 | 95 | 95 |
Размер анализируемой навески, г | 10 | 10 | 10 | 10 | 10 |
Специфичность, % | 100 | — | — | — | — |
Чувствительность на серовар и уровень, % | — | 96,8 | 100 | 67,4 | 100 |
LOD50 на серовар (95 %-ный доверительный интервал), КОЕ/навеску | — | 1,0 (0,7—1,4) | 4,3 (3,3—5,6) | ||
LOD50 общий (95 %-ный доверительный интервал), КОЕ/навеску | — | 2,5 (2,1—3,0) | |||
7> Образцы куриных фекалий были искусственно заражены эталонными образцами со следующими штам
мами и уровнями:
Salmonella Typhimurium (STM) в количестве 5 КОЕ/навеску и 44 КОЕ/навеску;
Salmonella Enteritidis (SE) в количестве 7 КОЕ/навеску и 91 КОЕ/навеску.
25
ГОСТ 31659—2024
Таблица С.8 — Результаты анализа данных, полученных при анализе образцов свиных фекалий
Параметр | Свиные фекалии | ||||
Незараженные | SD6O | SD37O | STM10O | STM580 | |
Количество участвующих лабораторий | 33 | 33 | 33 | 33 | 33 |
Количество образцов на лабораторию | 5 | 5 | 5 | 5 | 5 |
Количество лабораторий, отобранных после оценки данных | 26 | 26 | 26 | 26 | 26 |
Количество образцов, отобранных после оценки данных | 130 | 130 | 130 | 130 | 130 |
Размер анализируемой навески, г | 25 | 25 | 25 | 25 | 25 |
Специфичность, % | 99,2 | — | — | — | — |
Чувствительность на серовар и уровень, % | — | 88,5 | 97,7 | 91,5 | 98,5 |
LOD50 на серовар (95 %-ный доверительный интервал), КОЕ/навеску | — | 2,8 (2,2—3,5) | 3,8 (3,0—4,7) | ||
LOD50 общий (95 %-ный доверительный интервал), КОЕ/навеску | — | 3,2 (2,8—3,8) | |||
^Образцы свиных фекалий были искусственно заражены эталонными образцами со следующими штамма
ми и уровнями:
Salmonella Derby (SD) в количестве 6 КОЕ/навеску в количестве 37 КОЕ/навеску;
Salmonella Typhimurium (STM) в количестве 10 КОЕ/навеску и в количестве 58 КОЕ/навеску.
Таблица С.9 — Результаты анализа данных, полученных при анализе образцов бахил
Параметр | Бахилы + 10 г проб окружающей среды кур-несушек | ||
Незараженные | STM э?) | STM 81 h | |
Количество участвующих лабораторий | 36 | 36 | 36 |
Количество образцов на лабораторию | 8 | 8 | 8 |
Количество лабораторий, отобранных после оценки данных | 33 | 33 | 33 |
Количество образцов, отобранных после оценки данных | 264 | 264 | 264 |
Размер анализируемой навески, г | Бахилы | Бахилы | |
Специфичность, % | 99.6 | — | — |
Чувствительность на серовар и уровень, % | — | 94,7 | 98,1 |
LOD50 общий (95 %-ный доверительный интервал), КОЕ/навеску | — | 3,8 (3.2—4.4) | |
^ Образцы бахил были искусственно заражены разведенной культурой Salmonella Typhimurium (STM) в количестве 9 КОЕ/образец и в количестве 81 КОЕ/образец.
26
ГОСТ 31659—2024
Приложение D (обязательное)
Обнаружение Salmonella enterica подвида enterica сероваров Typhi и Paratyphi
D.1 Общие положения
Некоторые серовары бактерий рода Salmonella не всегда могут быть обнаружены методами, приведенными в настоящем стандарте. В данном приложении приведены дополнительные меры, которые необходимо предпринять, когда особое значение имеет обнаружение Salmonella enterica подвида enterica сероваров Typhi и Paratyphi. Также должна быть выполнена в полном объеме методика, приведенная в настоящем стандарте.
Примечание — Штаммы серовара Gallinarum (биоваров gallinarum и pulorum) не имеют значимости для здоровья человека, поэтому их выделение не включено в настоящий документ [33]. Однако, если необходимо выявление этих биоваров, в дополнение к RVS-бульону и MKTTn-бульону можно использовать селенит-цистиновую среду (SC), как указано в данном приложении.
D.2 Обнаружение Salmonella Typhi и Salmonella Paratyphi
D.2.1 Сущность метода
ПРЕДУПРЕЖДЕНИЕ — Salmonella Typhi и Salmonella Paratyphi относятся к микроорганизмам третьей группы патогенности. При работе с этими штаммами необходимо осуществлять соответствующие защитные мероприятия.
D.2.1.1 Общие положения
Согласно 4.1.
D.2.1.2 Предварительное обогащение в неселективной жидкой среде
Согласно 4.2.
D.2.1.3 Обогащение в селективных жидких средах
Согласно 4.3. Селенит-цистиновую среду (SC) инокулируют культурой, полученной в 4.2, в дополнение к ино-кулированию в RVS-бульон и МКТТп-бульон. Селенит-цистиновую среду инкубируют при температуре (37 ± 1) °C (6.3) в течение 24 ч и 48 ч.
D.2.1.4 Пересев и идентификация
Согласно 4.4 висмут-сульфит агар (BS) инокулируют культурами, полученными в 4.3 и D.2.1.3, в дополнение к XLD-arapy. Висмут-сульфит агар инкубируют при температуре (37 ± 1) °C (6.3) и исследуют через 24 ч, и снова, если необходимо, через 48 ч.
D.2.1.5 Подтверждение видовой принадлежности
Согласно 4.5.
D.3 Питательные среды
D.3.1 Селенит-цистиновая среда (SC)
ПРЕДУПРЕЖДЕНИЕ — Натрия гидроселенит является потенциально тератогенным соединением. При подготовке и обращении с данной средой должны быть приняты соответствующие меры предосторожности.
D.3.1.1 Основа среды
D.3.1.1.1 Состав: пептон^.....................................................................................................................................5,0 г;
лактоза......................................................................................................................................4,0 г;
натрий фосфорнокислый двузамещенный 12-водный (Na2HPO4 • 12Н2О)2^.....................10,0 г;
натрия гидроселенит................................................................................................................4,0 г;
вода...........................................................................................................................................1000 см3.
D.3.1.1.2 Приготовление
Натрия гидроселенит растворяют в воде, затем добавляют оставшиеся ингредиенты. Растворяют, нагревая
среду до кипения.
D.3.1.2 Раствор L-цистина
D.3.1.2.1 Состав
L-Цистин....................................................................................................................................0,1 г;
натрия гидроокись (NaOH), раствор 1 моль/дм3....................................................................15 см3;
стерильная вода (приблизительно).........................................................................................85 см3.
D.3.1.2.2 Приготовление
Компоненты добавляют в стерильную мерную колбу вместимостью 100 см3. Разводят до отметки стерильной водой. Не стерилизуют.
1) Например, ферментативный гидролизат казеина.
^ Если используется гидрофосфат натрия двузамещенный с другим содержанием воды, необходимо изменить массу ингредиента соответственно. Например, в случае безводного гидрофосфата натрия двухзамещенного (Na2HPO4) используют 3,57 г.
27
ГОСТ 31659—2024
D.3.1.3 Готовая среда
D.3.1.3.1 Состав: основа среды (D.3.1.1).............................................................................................................1000 см3;
раствор L-цистина (D.3.1.2).....................................................................................................100 см3.
D.3.1.3.2 Приготовление
Раствор L-цистина в асептических условиях добавляют к основе среды. При необходимости устанавливают такой pH, чтобы он составлял (7,0 ± 0,2) при температуре 25 °C. Среду разливают в асептических условиях в стерильные пробирки или колбы (6.11) столбиком не менее 5 см. Стерилизуют паром в течение 15 мин, не автоклавируют. Разлитые пробирки хранят при температуре (5 ± 1) °C (6.7). Среда может быть использована до тех пор, пока
не появится красный осадок.
D.3.2 Висмут-сульфит агар
D.3.2.1 Состав: ферментативный гидролизат животных тканей.....................................................................10 г;
мясной экстракт........................................................................................................................5,0 г;
декстроза...................................................................................................................................5,0 г;
натрий фосфорнокислый двузамещенный безводный (Na2HPO4)......................................4,0 г;
сульфат железа (безводный)...................................................................................................0,3 г;
сульфит висмута (индикатор)..................................................................................................8,0 г;
бриллиантовый зеленый..........................................................................................................0,025 г;
агар............................................................................................................................................20,0 г;
вода...........................................................................................................................................1000 см3.
D.3.2.2 Приготовление
Компоненты добавляют в воду и нагревают при частом помешивании до кипения. Слегка кипятят в течение 30—60 с для растворения агара и получения однородной суспензии (осадок не растворяется). Охлаждают до температуры от 47 °C до 50 °C, затем осторожно перемешивают, чтобы суспендировать осадок. При необходимости устанавливают pH (7,7 ± 0,2) при 25 °C.
Среду разливают в стерильные чашки Петри (6.13) в количестве 20—25 см3, дают застыть.
Правильно приготовленная среда в чашках имеет бледно-соломенный цвет с гладкой кремообразной непрозрачностью.
Чашки со средой готовят за день до использования и хранят в темноте при температуре окружающей среды.
При необходимости чашки просушивают перед использованием, не допуская пересушивания.
D.3.3 Определение рабочих характеристик
Определение селективности и производительности приведено в ГОСТ ISO 11133. Объем инокулята должен быть таким же, как и в методе для данной среды, и должен содержать количество целевых или нецелевых организмов, указанных в ГОСТ ISO 11133—2016, подраздел 5.4.
Таблица D.1 — Определение рабочих характеристик при контроле качества питательных сред
Среда | Функция | Инкубация | Контрольные штаммы | Номера WDCMd | Критерий4-* |
Селенит-ци-стиновая среда | Производительность | (24 ± 3) ч/ (37± 1)°С | Salmonella Typhimurium^ ^ Salmonella Enteritidis2)’ 3) + Escherichia coll3) +Pseudomonas aeruginosa | 00031 00030 00012 или 00013 00025 | >10 характерных колоний на XLD-агаре или другой выбранной среде |
Селективность | Escherichia coli3^ | 00012 или 00013 | Частичное ингибирование <100 колоний на питательном агаре | ||
Enterococcus faecalis3) | 00009 или 00087 | <10 колоний на питательном агаре | |||
Висмут-сульфит агар | Производительность | 2 • (24 ± 3) ч/ (37± 1)°С | Salmonella Typhimurium2^' 3) Salmonella Enteritidis2^ 3) | 00031 00030 | Хороший рост (2) коричневых, серых или черных колоний, обычно с металлическим блеском через 24 ч, равномерно черных через 48 ч |
28
Окончание таблицы D. 1
ГОСТ 31659—2024
Среда | Функция | Инкубация | Контрольные штаммы | Номера WDCM7/ | Критерий4/ |
Висмут-сульфит агар | Селективность/ специфичность | 2 • (24 ± 3) ч/ (37± 1)°С | Escherichia соН3) | 00012 или 00013 | Рост или частичное торможение (от 0 до 1) бледных зеленых или коричневых колоний без металлического блеска |
Селективность | Enterococcus faecalis3^ | 00009 или 00087 | Полное ингибирование (0) | ||
1) В качестве контрольных штаммов используют референсные тест-штаммы в соответствии с номерами WDCM (Всемирный центр данных по микроорганизмам, «www.wfcc.info»), или контрольные эталонные штаммы из национальных коллекций микробных культур, или другие штаммы в соответствии с ГОСТ ISO 11133. | |||||
2^ Для некоторых национальных ограничений и указаний может потребоваться использование другого серо-вара. Необходимо ссылаться на национальные требования, касающиеся выбора сероваров Salmonella. 3) Штаммы на выбор; необходимо использовать как минимум один из штаммов. 4) Рост классифицируется как 0 — без роста, 1 — слабый рост (частичное ингибирование) и 2 — хороший рост (см. ГОСТ ISO 11133). | |||||
D.4 Оборудование и расходные материалы
D.4.1 Общие положения
В дополнение к оборудованию и расходным материалам, описанным в разделе 6, необходимо добавить следующее.
D.4.2 Колбы мерные, стерильные, номинальная вместимость 100 см3.
0.5 Процедура
D.5.1 Общие положения
В дополнение к процедуре, описанной в разделе 9, необходимо добавление шагов, приведенных ниже.
0.5.2 Обогащение в селективных жидких средах
Переносят 1 см3 культуры, полученной в 9.2, в пробирку, содержащую 10 см3 селенит-цистиновой среды (D.3.1). Инкубируют засеянную среду при температуре (37 ± 1) °C (6.3) в течение (24 ± 3) ч и (48 ± 3) ч.
D.5.3 Пересев
D.5.3.1 После инкубации в течение (24 ± 3) ч и (48 ± 3) ч из культуры, полученной в селенит-цистиновой среде (D.5.2), с использованием микробиологической петли (6.9) делают пересев из верхней трети части бульона на поверхность чашки с XLD-агаром (В.6), чтобы получить хорошо изолированные колонии.
D.5.3.2 Аналогичным образом поступают с висмут-сульфит агаром.
D.5.3.3 Инкубируют чашки с XLD-агаром и висмут-сульфит агаром при температуре (37 ± 1) °C (6.3) в течение (24 ± 3) ч.
D.5.3.4 После инкубации в течение (24 ± 3) ч при температуре (37 ± 1) °C (6.3), исследуют чашки с висмут-сульфит агаром на наличие типичных колоний бактерий рода Salmonella, которые должны быть черными, серыми или коричневыми с металлическим блеском или без него. Окружающая среда, как правило, сначала коричневого цвета и становится черной с увеличением времени инкубации. Отмечают их положение на дне чашки Петри. Если на чашке присутствуют типичные колонии, выбирают пять колоний для подтверждения. Повторно инкубируют чашки с висмут-сульфит агаром еще 24 ч [всего (48 ± 3) ч] и снова исследуют типичные или нетипичные колонии, зеленого цвета с небольшим потемнением или без потемнения окружающей среды.
D.5.3.5 После инкубации в течение (24 ± 3) ч при температуре (37 ± 1) °C просматривают чашки с XLD-агаром, согласно 9.4.2. Типичные колонии имеют черный центр и слегка прозрачную зону красноватого цвета из-за изменения цвета индикатора. Н23-негативные варианты бактерий рода Salmonella, такие как Salmonella Paratyphi А, розовые с более темным розовым центром. Отмечают их положение на дне чашки Петри. Если не обнаруживается типичных и нетипичных колоний, чашки повторно инкубируют в течение дополнительных 24 ч при температуре (37 ± 1) °C (6.3) [всего (48 ± 3) ч] и снова просматривают.
Примечание — Не все хромогенные агаризованные среды могут способствовать восстановлению Salmonella Typhi и Salmonella Paratyphi.
D.6 Подтверждение
D.6.1 Общие положения
Согласно 9.5.
D.6.2 Интерпретация биохимических тестов
Salmonella Typhi и Salmonella Paratyphi обычно демонстрируют реакции, приведенные в таблице 1.
29
ГОСТ 31659—2024
Приложение Е (справочное)
Примеры селективных агаризованных сред
Е.1 Примеры селективных агаризованных сред приведены в [30]. Данный список селективных питательных сред не является исчерпывающим. Состав селективных агентов и индикаторных систем в средах Плоскирева, Эндо, Левина, лактозный ТТХ агар с тергитолом 7 и других средах аналогичного назначения приведен в инструкциях изготовителей.
30
Таблица Е.1 — Селективные агенты (г/дм3), используемые в некоторых средах для выделения Salmonella spp.
Среда7-1 | Желчь | Висмут-сульфит | Бриллиантовый зеленый | Цефсулодин | Железо (III) цитрат | Цитрат натрия | Дезоксихолат натрия | Ново-биоцин | Тергитол 4 | Тиосульфат натрия |
ABC^ | 0,5 | 8,5 | 5,0 | |||||||
BGA | 0,012 5—0,005 | |||||||||
BS | 8,0 2) | 0,016—0,025 | 0,005 | |||||||
BSA™ (OSCM II)3/-5/ | 0,012 | |||||||||
CHROMagar™ Salmonella10) | 2 | 2,5 | 0,01 | |||||||
CHROMagar™ Salmonella Plus10) | 1,5 | 0,15 | 1,5 | |||||||
CSE | 0,5 | 0,07 | ||||||||
DCLS | 10,5 | 2,5 | 5,0 | |||||||
DCA | 1,0 | 6,0 | 3,0 | 5,4 | ||||||
HE | 9,0 | 1,5 | 5,0 | |||||||
MLCB | 0,012 5 | 1,0 | 4,0 | |||||||
MM | 0,8 | 4,5 мл | 6,8 | |||||||
Onoz6/ | 3,825 | 0,001 66 | 0,5 | 9,3 | 4,25 | |||||
Rambach TM Agar70/ | 1,0 | |||||||||
chromID ® Salmonella (SMID2)7/ | 1,5 | 0,000 3 | ||||||||
SS | 8,5 | 0,000 33 | 1.0 | 8,5 | 8,5 | |||||
XLD | 0,8 | 1,0 | 6,8 | |||||||
XLT4 | 0.8 | 4,6 мл | 6,8 | |||||||
IBISA®7/ | 2,5 | 0,02 | ||||||||
ASAP®7/ | 0,025 | 5 | ||||||||
IRIS Salmonella®8) | 0,010 | 7,0 | ||||||||
Rapid’Salmonella9) | 0,010 | 5,0 |
1) АВС: оф-Хромогенная среда; BGA: агар с бриллиантовым зеленым; BS: висмут-сульфит агар; BSA: Brilliance™ Salmonella Agar (ранее называемый OSCM II: Oxoid Salmonella Chromogenic medium II); CSE: Chromogenic Salmonella Esterase [31]; DCLS: дезоксихолатный цитратный агар с лактозой (Desoxycholate Citrate Lactose agar); DCA: дезоксихолат цитратный агар Лейфсона (Leifson agar); HE: агар гектоеновый для энтеробактерий (Hektoen Enteric agar); MLCB: агар селективный с маннитом, лизином, кристалл-виолетом и бриллиантовым зеленым (Mannitol Lysine Crystal Violet Brilliant green agar); MM: arap Миллера и Маллинсона [32]; chromID® Salmonella (также называемый SMID2: Salmonella Identification medium II); SS: Salmonella Shigella agar; XLD: ксилоза-лизин-дезоксихолатный arap; XLT4: ксилоза-лизин-тергитол-4 агар (Xylose Lysine Tergitol 4 agar).
ГОСТ 31659—2024
“ Окончание таблицы Е. 1
2/ Сульфит натрия: 6,15 г/дм3 и висмут аммония цитрат: 1,85 г/дм3.
3/ BSAтакже содержит «Inhibigen™» для селективного ингибирования роста Escherichia coli.
Нижеследующая информация приведена для удобства использования настоящего стандарта. Аналогичные продукты допускаются к использованию при условии доказательства, что они дают одинаковые результаты
4/ LABM является примером специального поставщика среды АВС.
5/ BSATM —торговая марка продукта, доступного на рынке и поставляемого компанией Oxoid.
6/ Merck является примером поставщика среды «Опбг».
7/ chromID® Salmonella, ASAP®, IBISA® являются торговыми марками продуктов, доступных на рынке и поставляемых компанией BioMerieux.
8) IRIS Salmonella® — торговая марка продукта, доступного на рынке и поставляемого компаниями SOLABIA S.A.S. и BIOKAR Diagnostics.
9/ Biorad является примером поставщика среды «Rapid’Salmonella».
1°) CHROMagar™ Salmonella, CHROMagar™ Salmonella Plus, Rambach™ Agar — торговые марки продукции, доступной на рынке и поставляемой CHROMagar™.
ГОСТ 31659—2024
Таблица Е.2 — Индикаторные системы, используемые в некоторых средах для выделения Salmonella spp.
Приведены реакции большинства штаммов Salmonella spp., в скобках приведена концентрация соответствующего агента (г/дм3)
Среда7/ | a-галактозидаза положит. | р-галакто-зидаза отри цат. | Р-глюкоз ид аза отри цат. | Эстераза положит. | Целлобиоза отри цат. | H2s положит. | Лактоза отри цат. | Лизинде-карбоксилаза положит.2/ | Манни-тол положит. | Про-пилен-гликоль положит. | Салицин отри цат. | Сахароза отри-цат. | Трегалоза отри цат. | Ксилоза положит. |
АВС3/ | X | X | ||||||||||||
BGA | X (10) | X (10) | ||||||||||||
BS | X | |||||||||||||
BSA™ (OSCM II)4/ | X | X | ||||||||||||
CHROMagar™ Salmonella9^ | X | X | X | X | ||||||||||
CHROMagar™ Salmonella Plus9/ | X | X | ||||||||||||
CSE | X | X (14,6) | ||||||||||||
DCLS | X (5,0) | X (5,0) | ||||||||||||
DCA | X | X (10,0) | ||||||||||||
HE | X | X (12,0) | X (2,0) | X (12,0) | ||||||||||
MLCB | X | X (5,0) | X (3,0) | |||||||||||
MM | X | Х(5,0) | X | X (10,0) | Х(1,2) | Х(1,33) | ||||||||
Onoz5/ | X | X (11,5) | X (13,0) |
Окончание таблицы Е.2
СредаЛ | «-галактозидаза положит. | Р-галакто-зидаза отри цат. | Р-глюкоз ид аза отри цат. | Эстераза положит. | Целлобиоза отри цат. | H2S положит. | Лактоза отри цат. | Лизинде-карбоксилаза положит. ^ | Манни-тол положит. | Про-пилен-гликоль положит. | Салицин отри цат. | Сахароза отри-цат. | Трегалоза отри цат. | Ксилоза положит. |
Rambach™ Agar9-1 | X | X (10,5) | ||||||||||||
chromID® Salmonella (SMID2)6^ | X | X | X | X (6,0) | ||||||||||
SS | X | X (10,0) | ||||||||||||
XLD | X | X (7,5) | X (5,0) | X (7,5) | X (3,75) | |||||||||
XLT4 | X | X (7,5) | X (5,0) | Х(7,5) | X (3,75) | |||||||||
ASAP®6^ | X | X | ||||||||||||
IBISA®6^ | X | X | ||||||||||||
IRIS Salmonella®7) | X | X | ||||||||||||
Rapid'Salmonella8) | X | X | ||||||||||||
1) ABC: аР-Хромогенная среда; BGA: агар с бриллиантовым зеленым; BS: висмут-сульфит arap; BSA: Brilliance™ Salmonella Agar (ранее называемый OSCM II; Oxoid Salmonella Chromogenic medium II); CSE: Chromogenic Salmonella Esterase [31]’, DCLS: дезоксихолатный цитратный агар с лактозой (Desoxycholate Citrate Lactose agar); DCA: дезоксихолат цитратный агар Лейфсона (Leifson agar); HE: гектоеновый arap (Hektoen Enteric agar); MLCB: Arap селективный с маннитом, лизином, кристалл-виолетом и бриллиантовым зеленым (Mannitol Lysine Crystal Violet Brilliant green agar); MM: Miller Mallinson agar [32]; chromID® Salmonella (также называемый SMID2: Salmonella Identification medium II); SS: Salmonella Shigella agar; XLD: ксилоза-лизин-дезоксихолатный arap; XLT4: ксилоза-лизин-тергитол-4 arap (Xylose Lysine Tergitol 4 agar). 2) Агент — гидрохлорид L-лизина. Нижеследующая информация приведена для удобства использования настоящего стандарта. Аналогичные продукты допускаются к использованию при условии доказательства, что они дают одинаковые результаты. 3) LABM является примером специального поставщика среды АВС. 4) BSATM —торговая марка продукта, доступного на рынке и поставляемого компанией Oxoid. 5) Merck является примером поставщика среды Onoz. 6) chromID® Salmonella, ASAP®, IBISA® являются торговыми марками продуктов, доступных на рынке и поставляемых компанией BioMerieux. 7) IRIS Salmonella® — торговая марка продукта, доступного на рынке и поставляемого компаниями SOLABIA S.A.S. и BIOKAR Diagnostics. 8) Biorad является примером поставщика среды «Rapid’Salmonella». 9) CHROMagar™ Salmonella, CHROMagar™ Salmonella Plus, Rambach™ Agar — торговые марки продукции, доступной на рынке и поставляемой CHROMagar™. | ||||||||||||||
ГОСТ 31659—2024
ГОСТ 31659—2024
Приложение ДА (справочное)
Сведения о соответствии ссылочных межгосударственных стандартов международным стандартам, использованным в качестве ссылочных в примененном международном стандарте
Таблица ДА.1
Обозначение ссылочных межгосударственных стандартов | Степень соответствия | Обозначение и наименование ссылочных международных стандартов |
ГОСТ ISO 6887-6—2015 | IDT | ISO 6887-6:2013 «Микробиология пищевых продуктов и кормов для животных. Подготовка проб для анализа, исходной суспензии и десятичных разведений для микробиологического исследования. Часть 6. Специальные правила приготовления проб, отобранных на начальной стадии производства» |
ГОСТ ISO 7218—2015 | IDT | ISO 7218:2007 «Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям» |
ГОСТ ISO 11133—2016 | IDT | ISO 11133:2014 «Микробиология пищевых продуктов, кормов для животных и воды. Приготовление, производство, хранение и определение рабочих характеристик питательных сред» |
ГОСТ ISO 13307—2015 | IDT | ISO 13307:2013 «Микробиология пищевых продуктов и кормов для животных. Начальная стадия производства. Методы отбора проб» |
ГОСТ ISO 16140—2011 | IDT | ISO 16140:2003 «Микробиология продуктов питания и кормов для животных. Протокол валидации альтернативных методов» |
ГОСТ ISO/TS 17728—2017 | IDT | ISO/TS 17728:2015 «Микробиология пищевой цепи. Методы отбора проб пищевой продукции и кормов для микробиологического анализа» |
Примечание — В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: - IDT — идентичные стандарты. | ||
34
ГОСТ 31659—2024
Библиография
[7] ISO 707:2008
[2] ISO 17604:2015
[3] ISO 18593:2004
[4] ISO 6887-1:2017
[5] ISO 6887-2:2017
[6] ISO 6887-3:2017
[7] ISO 6887-4:2017
[8] ISO 6887-5:2017
Milk and milk products — Guidance on sampling (Молоко и молочные продукты. Руководство по отбору проб)
Microbiology of the food chain — Carcass sampling for microbiological analysis (Микробиология пищевой цепи. Отбор проб с туши для микробиологического анализа)
Microbiology of food and animal feeding stuffs — Horizontal methods for sampling techniques from surfaces using contact plates and swabs (Микробиология пищевых продуктов и кормов для животных. Горизонтальные методы отбора проб с поверхностей с помощью контактных пластинок и тампонов)
Microbiology of the food chain — Preparation of test samples, initial suspension and decimal dilutions for microbiological examination — Part 1: General rules for the preparation of the initial suspension and decimal dilutions (Микробиология пищевой цепи. Подготовка проб, исходной суспензии и десятикратных разведений для микробиологического исследования. Часть 1. Общие правила подготовки исходной суспензии и десятичных разведений)
Microbiology of the food chain — Preparation of test samples, initial suspension and decimal dilutions for microbiological examination — Part 2: Specific rules for the preparation of meat and meat products (Микробиология пищевой цепи. Подготовка проб, исходной суспензии и десятикратных разведений для микробиологического исследования. Часть 2. Специальные правила подготовки мяса и мясных продуктов)
Microbiology of the food chain — Preparation of test samples, initial suspension and decimal dilutions for microbiological examination — Part 3: Specific rules for the preparation offish and fishery products (Микробиология пищевой цепи. Подготовка проб, исходной суспензии и десятичных разведений для микробиологического исследования. Часть 3. Специальные правила подготовки рыбы и рыбных продуктов)
Microbiology of the food chain — Preparation of test samples, initial suspension and decimal dilutions for microbiological examination — Part 4: Specific rules for the preparation of miscellaneous products (Микробиология пищевой цепи. Подготовка проб, исходной суспензии и десятикратных разведений для микробиологического исследования. Часть 4. Специальные правила подготовки прочих продуктов)
Microbiology of the food chain — Preparation of test samples, initial suspension and decimal dilutions for microbiological examination — Part 5: Specific rules for the preparation of milk and milk products (Микробиология пищевой цепи. Подготовка проб для анализа, исходной суспензии и десятичных разведений для микробиологического исследования. Часть 5. Специальные правила подготовки молока и молочных продуктов)
[9] D’aoust J.Y. Maishment С., Brugener D.M., Conley D.R., Loit A., Milling M. and Purvis U. Detection of Salmonella in refrigerated preenrichment and enrichment broth cultures. J. Food Prot. 1980, 43 (5) pp. 343—345
[10] D’aoust J.Y. Beckers H.J., Boothroyd M., Mates A., Mckee C.R., Moran A.B., Sado P., Spain G.E., Sperber W.H., Vas-siliadis P., Wagner D.E. and Wiberg C. ICMSF methods studies. XIV. Comparative study on recovery of Salmonella from refrigerated preenrichment and enrichment broth cultures. J. Food Prot. 1983, 46 (5) pp. 391—399
[11] Beckers H.J., Van Leusden F.M. and Peters R. Het effect van koelen van bebroede voorophopings- en selectieve ophopingsbouillon op de isolatie van Salmonella, (in Dutch). De Ware(n). Chemicus. 1984, 14 pp. 75—80
[12] Davies R.H., Bedford S. and Shankster S. Enhanced culture techniques for the detection of Salmonella. Vet. Rec. 2001, pp. 539—540
[13] COMMUNITY REFERENCE LABORATORY FOR SALMONELLA. Newsletter 2008, Vol. 14, no. 2, page 8
(https://archief09.archiefweb.eu/archives/archiefweb/20180724133314/https://www.eurlsa/mone//a.eu/dsresource?ty pe=pdf&disposition=inline&objectid=rivmp:181223&versionid=&subobjectname=)
[14] Becker H., Eberhardt S., Martlbauer E. Comparative studies on the detection of Salmonellae in milk and milk products using a horizontal (ISO 6579:2002) and a vertical (ISO 6785/IDF 93:2001) International Standard. Arch. Lebensmittelhyg. 2003, 54 pp. 118—121
[15] European Union Reference Laboratory for Salmonella. Newsletter 2015, Vol. 21, no. 4, page 4
(https://archief09.archiefweb.eu/archives/archiefweb/20180724133314/https://www.eurlsalmonella.eu/dsresource? type=pdf&disposition=inline&objectid=rivmp:299850&versionid=&subobjectname=)
35
ГОСТ 31659—2024
[16] ISO/TR 6579-3:2014 Microbiology of the food chain — Horizontal method for the detection, enumeration
and serotyping of Salmonella — Part 3: Guidelines for serotyping of Salmonella spp. (Микробиология пищевой цепи. Горизонтальный метод обнаружения, подсчета и серотипирования сальмонеллы. Часть 3. Руководящие указания по серотипиро-ванию Salmonella spp.)
[17] Ewing W.H. Edwards and Ewing’s Identification of Enterobacteriaceae. Elsevier Science publishing Co., Inc, New York, Fourth Edition, 1986
[18] Ewing, W.H. and Ball, M.M. The biochemical reactions of the genus Salmonella. National Center for Disease Control and Prevention, Atlanta, 1996
[19] Culture Media for Food Microbiology. In: Progress in Industrial Microbiology. (Corry J.E.L., Curtis G.D.W., Baird R.M. eds.). Elsevier, Amsterdam, Vol. 34, 1995
[20] ISO 16140-1:2016 Microbiology of the food chain — Method validation — Part 1: Vocabulary (Микробио
логия пищевой цепи. Валидация метода. Часть 1. Словарь)
[21] ISO 16140-2:2016 (Микробиология пищевой цепочки. Метод валидации. Часть 2. Протокол валида
ции альтернативных (собственных) методов в сравнении с контрольным методом)
[22] Smedt De J.M., Bolderdijk R.F., Rappold H., Lautenschlaeger D. Rapid Salmonella detection in foods by motility enrichment on a modified semi-solid Rappaport-Vassiliadis medium. J. Food Prot. 1986, 49 (7) pp. 510—514
[23] Veenman C., Korver H., Mooijman K.A. Improvements in the method for detection of Salmonella spp. in animal faeces. National Institute for Public Health and the Environment, Bilthoven, The Netherlands. RIVM report 330300 010, 2007. (http://www.rivm.nl/bibliotheek/ rapporten/330300010.pdf)
[24] Soutourina O.A., Semenova E.A., Parfenova V.V., Danchin A., Bertin P. Control of bacterial motility by environmental factors in polarly flagellated and peritichous bacteria isolated from Lake Baikal. Appl. Environ. Microbiol. 2001, 67 (9) pp. 3852—3859
[25] AFSSA, 2001. Evaluation of microbiological methods for detection and for enumeration of microbiological contaminants in food. Final report Contract SMT4/CT96 2098. Coordination byAgence Frangaise de Securite Sanitaire des Aliments. AFSSA, France, February 2001
[26] Feldsine P. Recovery of Salmonella in Selected Foods by the ISO 6579 Salmonella Culture Procedure and theAOAC International Official Method of Analysis: Collaborative Study. J. AOAC Int. 2001
[27] ISO 6579:2002 Microbiology of food and animal feeding stuffs — Horizontal method for the detection
of Salmonella spp. (Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод для обнаружения Salmonella spp.)
[28] Colombo S., Crociani J., Horry H. ISO 16140 validation of the MSRV method for Salmonella spp. Detection in food and environ-mental samples. Poster at IAFP, Rome, 2007
[29] Kuijpers A.F.A., Veenman C., Mooijman K.A. EU Interlaboratory comparison study Veterinary-XI, 2008. Bacteriological detection of Salmonella in chicken faeces. National Institute for Public Health and the Environment, Bilthoven, The Netherlands. RIVM Report no.: 330604 011/2008. (https://www.rivm.nl/bibliotheek/rapporten/330604011.pdf)
[30] Kuijpers A.F.A. and Mooijman K.A. 2013. EU Interlaboratory comparison study Veterinary-XV (2012) — Detection of Salmonella in pig faeces. National Institute for Public Health and the Environment, Bilthoven, The Netherlands. RIVM Report no.: 330604 028/2013. (http://www.rivm.nl/bibliotheek/rapporten/330604028.pdf)
[31] Kuijpers A.F.A. and Mooijman K.A. EU Interlaboratory comparison study primary production-XVI (2013) — Detection of Salmonella in chicken faeces adhering to boot socks. National Institute for Public Health and the Environment, Bilthoven, The Netherlands. RIVM Report no.: 330604 031/2014. (http://www.rivm.nl/bibliotheek/rapporten/330604031.pdf)
[32] ISO 6579:2002/Amd 1:2007 Microbiology of food and animal feeding stuffs — Horizontal method for the detection of Salmonella spp. / Amendment 1: Annex D: Detection of Salmonella spp. in animal faeces and in environmental samples from the primary production stage (Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод для обнаружения Salmonella spp. Поправка 1. Приложение D: обнаружение Salmonella spp. в фекалиях животных и в экологических образцах от стадии первичной продукции)
[33] Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. 2009 (OIE Terrestrial Manual) Chapter 2.3.11 Fowl Typhoid and Pullorum Disease, pp. 538—48. (http://www.oie.int/manual-of-diagnostic-tests-and-vaccines-for-terrestrial-animals/)
[34] Mooijman K.A. Culture media for the isolation of Salmonella. In: Handbook of Culture media for Food and Water Microbiology, (Corry J.E.L., Curtis G.D.W., Baird R.M. eds.). Third Edition, 2012
36
ГОСТ 31659—2024
[35] Cooke V.M., Miles R.J., Price R.G., Richardson A.C. A novel chromogenic ester agar medium for detection of salmonellae. Appl. Environ. Microbiol. 1999, 65 pp. 807—812
[36] Mallinson E.T., Miller R.G., de Rezende C.E., Ferris K.E., deGrafr-Hanson J., Joseph S.W. Improved plating media for the detection of Salmonella species with typical and atypical hydrogen sulfide production. J. Vet. Diagn. Invest. 2000, 12 pp. 83—87
37
ГОСТ 31659—2024
УДК 579.67:006.354
МКС 07.100.30
MOD
Ключевые слова: Salmonella, неселективное обогащение, селективное обогащение, селективно-диагностические среды, биохимическое тестирование
Редактор Л.В. Каретникова
Технический редактор В.Н. Прусакова
Корректор И.А. Королева
Компьютерная верстка Е.О. Асташина
Сдано в набор 15.10.2024. Подписано в печать 23.10.2024. Формат 60x847s. Гарнитура Ариал.
Усл. печ. л. 4,65. Уч.-изд. л. 4,28.
Подготовлено на основе электронной версии, предоставленной разработчиком стандарта
Создано в единичном исполнении в ФГБУ «Институт стандартизации» , 117418 Москва, Нахимовский пр-т, д. 31, к. 2.

