ГОСТ Р 52770-2023
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Изделия медицинские
СИСТЕМА ОЦЕНКИ БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ
Общие требования безопасности
Medical devices. Biological impact evaluation system. General requirements for safety
ОКС 07.100.10
Дата введения 2024-03-01
Предисловие
1 РАЗРАБОТАН Автономной некоммерческой организацией "Институт медико-биологических исследований и технологий" (АНО "ИМБИИТ")
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 422 "Оценка биологического действия медицинских изделий"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 26 декабря 2023 г. N 1663-ст
4 ВЗАМЕН ГОСТ Р 52770-2016
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
Введение
Целью настоящего стандарта является установление общих требований к медицинским изделиям (МИ) и материалам, подтверждение которых обеспечивает их безопасное применение при использовании по назначению в надлежащих условиях (предусмотренное применение/назначение).
Настоящий стандарт является руководством для оценки биологического действия МИ на всех этапах жизненного цикла. Результаты оценки позволяют сделать заключение о биологической совместимости МИ.
Настоящий стандарт является основополагающим, применимым для широкой номенклатуры МИ. В дополнение к настоящему стандарту даны ссылки на стандарты безопасности на конкретные МИ.
Применять стандарты на виды МИ следует тогда, когда основополагающие стандарты не поддерживают все необходимые требования безопасности, относящиеся к оценке биологического действия и эксплуатационным характеристикам МИ.
Настоящий стандарт конкретизирует и дополняет некоторые положения стандартов серии ГОСТ ISO 10993, содействует сотрудничеству между испытательными лабораториями (центрами) и другими заинтересованными организациями в части обмена информацией и опытом, гармонизации стандартов на МИ.
При планировании исследований следует учитывать новизну МИ (при выведении на рынок нового продукта), при планировании испытаний - результаты ранее проведенных исследований и опыт применения МИ в клинической практике.
Содержание в МИ лекарственного средства (ЛС), фармацевтической субстанции, материала биологического происхождения и/или иного активного вещества, является важным фактором, который следует учитывать при предусмотренном применении МИ.
Для абсорбируемых МИ важно учитывать время и степень деградации и оценить возможный вред продуктов деградации во временном аспекте.
Пирогенность вновь синтезируемых или природных химических веществ, отличных от микробных компонентов, недостаточно изучена. В настоящем стандарте более подробно раскрыты понятие пирогенности и методы определения в зависимости от природы пирогена.
МИ отнесены к социально значимой продукции, поэтому оценка риска их применения основана на критериях, отражающих непосредственное влияние компонентов конечного продукта на здоровье наиболее чувствительных групп населения, что требует обеспечения гарантии значительного запаса надежности допустимых значений санитарно-химических показателей.
Настоящий стандарт предназначен как для специалистов, планирующих и проводящих исследования и испытания, так и для производителей МИ и материалов, применяемых при их изготовлении, а также при разработке МИ.
Соблюдение положений стандартов серии "Изделия медицинские. Система оценки биологического действия" позволит обеспечить единый подход к оценке биологического действия МИ/материалов.
В настоящее время в эту серию входят следующие стандарты:
ГОСТ ISO/TS 21726, ГОСТ 34901.
1 Область применения
Настоящий стандарт устанавливает общие требования безопасности медицинских изделия (МИ) и материалов, применяемых для их изготовления.
Настоящий стандарт устанавливает общие требования к биологической совместимости МИ/материалов.
Настоящий стандарт устанавливает общие требования к оценке биологического действия в форме исследований (испытаний).
Настоящий стандарт распространяется на МИ/материалы прямого или опосредованного контакта на всех этапах их жизненного цикла, кроме аспектов утилизации:
- с организмом пациента при использовании их по назначению (клиническом применении);
- с организмом пользователя, если МИ/материал предназначен для защиты от заражения (например, перчатки медицинские, маски и др.).
В настоящем стандарте приведены допустимые значения интегральных показателей и предельно допустимые концентрации (ПДК) некоторых экстрагируемых веществ в зависимости от природы материала МИ, его состава и категории МИ, обусловленной характером и продолжительностью контакта с организмом человека (см. приложение А).
В настоящем стандарте приведены общие подходы к исследованиям и испытаниям МИ/материалов, общие требования к приготовлению экстрактов из МИ/материалов (см. приложение Б, В).
В настоящем стандарте установлены критерии оценки и правила интерпретации результатов исследований и испытаний (см. раздел 8) в рамках оценки биологического действия.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ ISO 10993-1 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента риска
ГОСТ ISO 10993-6 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации
ГОСТ ISO 10993-7 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации
ГОСТ ISO 10993-11 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 11. Исследования общетоксического действия
ГОСТ ISO 10993-12 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и контрольные образцы
ГОСТ ISO 10993-17 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 17. Установление пороговых значений для вымываемых веществ
ГОСТ ISO 10993-18 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 18. Исследование химических свойств материалов
ГОСТ ISO/TR 10993-22 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 22. Руководство по наноматериалам
ГОСТ ISO 11135 Стерилизация медицинской продукции. Этиленоксид. Требования к разработке, валидации и текущему управлению процессом стерилизации медицинских изделий
ГОСТ ISO 11137-1 Стерилизация медицинской продукции. Радиационная стерилизация. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий
ГОСТ ISO 11607-1 Упаковка для медицинских изделий, подлежащих финишной стерилизации. Часть 1. Требования к материалам, барьерным системам для стерилизации и упаковочным системам
ГОСТ ISO 14971 Изделия медицинские. Применение менеджмента риска к медицинским изделиям
ГОСТ ISO/IEC 17025 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ ISO/TS 21726 Изделия медицинские. Система оценки биологического действия. Руководство по применению порога токсической опасности для оценки биосовместимости компонентов медицинских изделий
ГОСТ EN 556-1 Стерилизация медицинских изделий. Требования к медицинским изделиям категории "стерильные". Часть 1. Требования к медицинским изделиям, подлежащим финишной стерилизации
ГОСТ 1770 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 23932 Посуда и оборудование лабораторные стеклянные. Общие технические условия
ГОСТ 31209 Контейнеры для крови и ее компонентов. Требования химической и биологической безопасности и методы испытаний
ГОСТ 31576 Оценка биологического действия медицинских стоматологических материалов и изделий. Классификация и приготовление проб
ГОСТ 34901 Изделия медицинские. Система оценки биологического действия. Общие требования к проведению исследований (испытаний)
ГОСТ Р ИСО 13022 Продукты медицинские, содержащие жизнеспособные человеческие клетки. Применение менеджмента риска и требований к методикам обработки
ГОСТ Р ИСО 17665-1 Стерилизация медицинской продукции. Влажное тепло. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий
ГОСТ Р ИСО 22442-1 Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 1. Менеджмент риска
ГОСТ Р ИСО 22442-2 Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 2. Контроль отбора, сбора и обработки
ГОСТ Р ИСО 22442-3 Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 3. Валидация уничтожения и/или дезактивации вирусов и агентов инфекционной губчатой энцефалопатии
ГОСТ Р ИСО 29701 Нанотехнологии. Наноматериалы для испытаний в тест-системах in vitro. Метод определения содержания эндотоксинов с использованием лизата амебоцитов Limulus (ЛАЛ-тест)
ГОСТ Р 52501 Вода для лабораторного анализа. Технические условия
ГОСТ Р 58144 Вода дистиллированная. Технические условия
ГОСТ Р 58972 Оценка соответствия. Общие правила отбора образцов для испытаний продукции при подтверждении соответствия
ГОСТ Р 58975 Оценка соответствия. Рекомендации по выбору методик исследований (испытаний) и измерений при проведении оценки соответствия
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется принять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется принять в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены термины по стандартам серии ГОСТ ISO 10993, по ГОСТ ISO 14971, а также следующие термины с соответствующими определениями:
3.1 безопасность МИ: Отсутствие неприемлемого (недопустимого) биологического риска в условиях предусмотренного применения/назначения МИ.
3.2 биологическая совместимость [биосовместимость]: Способность МИ или материала выполнять свои функции, не оказывая неприемлемого вредного воздействия.
3.3
биологический риск: Сочетание вероятности вреда здоровью, происходящего в результате негативных реакций, обусловленных взаимодействием организма человека с МИ или материалом, и степени тяжести этого вреда. |
[ГОСТ ISO 10993-1-2021, пункт 3.2] |
3.4 биологическое действие: Ответные реакции организма человека на системном, органном, тканевом и молекулярном уровнях при контакте с МИ или материалом, выполняющими свои функции.
3.5 оценка биологического действия: Процесс рассмотрения и оценки существующих наборов данных из всех источников с выбором и проведением, при необходимости, дополнительных исследований (испытаний), позволяющих охарактеризовать биологические ответы на МИ/материал, относящиеся к их безопасности при использовании.
3.6
набор данных: Информация, например физическая и/или химическая характеристика, сведения о токсичности и т.д., полученная из разнообразных источников и необходимая для характеристики биологического ответа на МИ. |
[ГОСТ ISO 10993-1-2021, статья 3.5] |
3.7 жизненный цикл МИ: Все стадии существования МИ от первоначальной концепции до вывода из эксплуатации и утилизации.
Примечания
1 Для жизненного цикла МИ приняты следующие стадии: исследование, разработка, изготовление (производство) и снятие с производства [см. ГОСТ Р 15.013].
2 Настоящий стандарт не рассматривает аспекты утилизации МИ.
3.8 исследование: Оригинальные и запланированные изыскания, предпринятые с целью получения новых сведений и знаний о МИ/материале.
3.9
испытание: Определение одной или более характеристик объекта оценки соответствия согласно процедуре. |
[ГОСТ ISO/IEC 17000-2012, статья 4.2] |
3.10 исследуемый образец: МИ, компонент, материал (или их репрезентативный образец, изготовленный и обработанный эквивалентными способами) или их экстракт, или его часть, которые испытывают при оценке биологического действия.
3.11 пирогенность: Способность химического вещества или другого активного агента в составе МИ/материала вызывать фибрильную реакцию организма.
Примечание - Пирогенность, обусловленная материалом, рассмотрена в ГОСТ ISO 10993-11, пирогенность, обусловленная эндотоксином, см. 7.4.
3.12 предельно допустимая концентрация, ПДК: Предельно допустимая концентрация экстрагируемых веществ, которая не оказывает вредного действия на организм человека и не вызывает неблагоприятных последствий у его потомства.
3.13 физико-химические характеристики: Показатели, характеризующие физические и химические свойства МИ/материала.
3.14 информация о химических свойствах: Качественная и количественная информация по составу, природе и количеству химических компонентов, присутствующих в материалах и изделии.
3.15 исследование химических свойств: Процесс получения информации о химических характеристиках, осуществляемый путем сбора информации, например из обзоров литературы или по результатам проведенных исследований химических свойств МИ/материала.
3.16 интегральный показатель: Обобщенный показатель качества и безопасности МИ/материала, определяемый в экстракте.
3.17 санитарно-химические показатели: Гигиенические показатели, характеризующие содержание химических веществ в экстракте из МИ/материала, представляющих токсикологическую опасность.
3.18
токсикологическая опасность (опасность токсического действия): Потенциальное возникновение негативной биологической реакции на химическое вещество или материал, учитывая характер реакции и дозу, требуемую для ее получения. |
[ГОСТ ISO 10993-1, статья 3.23] |
3.19 компонент: Элемент (деталь, предмет), являющийся частью МИ, но не представляющий из себя МИ.
3.20 химический компонент [составляющая]: Химическое вещество, присутствующее в готовом МИ или его конструкционных материалах.
Примечание - Составляющие могут присутствовать преднамеренно (например, такая добавка как антиоксидант) или непреднамеренно (например, примесь или продукт деградации).
3.21 экстракт (вытяжка): Раствор, полученный в результате экстракции.
3.22 экстрагент (экстрагирующая жидкость): Жидкость (среда, раствор или растворитель, модельная среда), применяемая для экстракции.
3.23 экстрагируемое вещество: Химическое вещество или соединение, высвобождаемое из МИ/материала в условиях лабораторной экстракции.
4 Общие требования
4.1 Для оценки биологического действия любого материла или МИ, которое прямо или опосредованно контактирует с организмом человека, следует применять системный подход в процессе менеджмента риска (см. ГОСТ ISO 14971).
Процесс оценки биологического действия включает в том числе:
- анализ существующих наборов данных, основанных на установленных научных сведениях и физической и/или химической характеристике и исследованиях (испытаниях) МИ/материалов методами in vitro (в том числе установленных в НТД производителя),
- обоснование, почему не требуется дополнительного набора данных для определения приемлемости (пригодности) МИ/материалов для предполагаемого использования,
- исследования (испытания) методами in vivo в случае необходимости заполнения пробелов в информации о МИ/материале или необходимости в дополнительном наборе данных для определения приемлемости (пригодности) МИ/материалов для предполагаемого использования.
В ГОСТ ISO 10993-1 приведено руководство по оценке биологического действия МИ в процессе менеджмента риска.
Планирование, проведение (включая исследования и испытания) и документирование оценки биологического действия должен выполнять квалифицированный персонал (см. ГОСТ ISO/IEC 17025).
4.2 МИ должны соответствовать требованиям настоящего стандарта по физико-химическим характеристикам с учетом природы материала МИ, его состава и категории МИ, обусловленной характером и продолжительностью контакта с организмом человека. Данные о химических свойствах материала МИ могут быть получены с использованием процедур по ГОСТ ISO 10993-18.
4.3 МИ должны соответствовать требованиям настоящего стандарта по интегральным показателям с учетом природы материала МИ, его состава и категории МИ, обусловленной характером и продолжительностью контакта с организмом человека.
4.4 МИ должны соответствовать требованиям настоящего стандарта по санитарно-химическим показателям с учетом природы материала МИ, его состава и категории МИ, обусловленной характером и продолжительностью контакта с организмом человека.
4.5 МИ должны соответствовать требованиям безопасного применения по показателям биологического действия в условиях in vitro и in vivo, см. соответствующие стандарты серии ГОСТ ISO 10993.
4.6 МИ должны соответствовать установленным требованиям по микробиологическим показателям.
4.7 Для МИ, в состав которых входит вещество, представляющее собой лекарственный препарат или другое биологически активное средство и воздействующее на человеческий организм в дополнение к воздействию МИ, оценку биологического действия МИ проводят с учетом действия (свойств) данного вещества.
4.8 МИ, содержащие ткани человеческого происхождения, оценивают с учетом частных требований стандартов на соответствующую продукцию (см. ГОСТ Р ИСО 13022).
4.9 МИ, содержащие ткани животного происхождения, оценивают с учетом требований стандартов на соответствующую продукцию (см. ГОСТ Р ИСО 22442-1 - ГОСТ Р ИСО 22442-3).
4.10 МИ, контактирующее с системой кровообращения, кровью и ее компонентами, препаратами для внутрисосудистого введения, испытывают на пирогенность, опосредованную материалом (см. ГОСТ ISO 10993-11).
4.11 Упаковка должна быть оценена, если:
- она прямо контактирует с медицинским изделием, и материалы которой могут перенести химические вещества на медицинское изделие и затем опосредованно на пациента или медицинский персонал. Необходимо оценить санитарно-химические показатели в соответствии с настоящим стандартом и ГОСТ ISO 10993-1;
- предназначена для медицинских изделий, подлежащих финишной стерилизации, и находится в прямом контакте с изделием. Необходимо оценить санитарно-химические показатели в соответствии с настоящим стандартом и показатели биологического действия, руководствуясь ГОСТ ISO 10993-1 и ГОСТ ISO 11607-1.
4.12 Для проведения исследований (испытаний) представляют образцы готового МИ, единообразные по характеру и качеству, изготовленные в определенном цикле производства, прошедшие все производственные этапы, установленные изготовителем, или репрезентативную часть изделия либо его компонент (или его типичный образец, произведенный и обработанный эквивалентными методами).
Правила отбора образцов приведены в ГОСТ Р 58972 и НД на конкретный вид МИ или метод (методику) исследований (испытаний).
4.13 Повторную оценку биологического действия проводят при изменении:
- источника поступления или любой характеристики материалов, применяемых при изготовлении МИ;
- состава материала МИ;
- обработки в процессе производства;
- упаковки, которая прямо контактирует с медицинским изделием;
- способа или условий (режимов) проведения стерилизации МИ;
- назначения МИ,
а также при выявлении негативного (вредного) воздействия на организм человека.
4.14 Объем испытаний для изделий, обращающихся на рынке, определяют исходя из оценки риска.
5 Физические и химические характеристики
5.1 Требования к физическим и химическим характеристикам
5.1.1 Сбор информации о физических и/или химических характеристиках (свойствах) материала является начальным этапом оценки биологического действия МИ.
5.1.2 Анализ биологического риска зависит от того, что известно о составе материала, какие доклинические и клинические данные по безопасности и токсикологии существуют, а также от характера и продолжительности контакта организма с МИ (см. ГОСТ ISO 14971 и ГОСТ ISO 10993-1).
5.1.3 При отсутствии информации о материалах в документации на МИ или если собранной информации недостаточно, необходимо провести исследования состава МИ/материала для устранения любых пробелов в информации по материалам и их химическому составу (см. ГОСТ ISO 10993-1).
5.1.4 При исследовании химических свойств материалов, при необходимости, химические компоненты определяют количественно, что позволяет идентифицировать их биологические опасности (см. ГОСТ ISO 10993-18) и установить их пригодность в предполагаемом клиническом применении (см. ГОСТ ISO 10993-1 и ГОСТ ISO 10993-18).
5.1.5 В ГОСТ ISO 10993-18 изложены требования, предназначенные для получения химических характеристик материалов, которые будут полезны при оценке биологической реакции на них.
5.1.6 Значения физико-химических характеристик, приведеные в стандартах на конкретные МИ (например, pH, осмоляльность, буферность) и стандартах серии ГОСТ ISO 10993 (например, pH), должны быть оценены.
5.1.7 Анализ продуктов экстракции проводят для идентификации и количественного определения экстрагируемых веществ с целью оценки токсикологического риска (см. ГОСТ ISO 10993-17).
5.2 Санитарно-химические показатели
5.2.1 Санитарно-химические испытания являются обязательными для всех групп МИ и предваряют исследования (испытания) на биологических тест-объектах.
Оценка МИ/материалов по санитарно-химическим показателям позволяет количественно охарактеризовать некоторые экстрагируемые из МИ/материалов химические вещества, которые будут воздействовать на организм пациента.
5.2.2 МИ/материалы должны соответствовать:
- значениям интегральных показателей, приведенным в приложении А;
- значениям по санитарно-химическим показателям (ПДК экстрагируемых веществ), приведенным в приложении А.
Если обнаружено превышение значений вышеуказанных показателей, см. пункт 8.
5.2.3 Результаты санитарно-химических исследований могут служить основанием для:
- прекращения дальнейших исследований (испытаний) МИ/материала в случае обнаружения в экстрактах из них веществ с известной токсикологической характеристикой в количествах, превышающих ПДК;
- осуществления коррекции в подборе материалов и оптимизации технологического процесса изготовления МИ, включая способ и режим стерилизации, что позволит создать продукт, отвечающий требованиям безопасности;
- проведения исследований с целью обоснования, выбора и применения порога токсической опасности (ПТО).
_______________
5.2.5 Условия приготовления экстрактов, т.е. виды экстрагирующей жидкости, температура и продолжительность экстракции, соотношение поверхности или массы исследуемого материала к объему экстрагирующей жидкости выбирают в зависимости от категории МИ (см. приложения Б).
5.2.6 При приготовлении экстрактов необходимо учитывать требования, установленные в стандартах на конкретные МИ.
5.2.7 При пробоподготовке должны быть учтены все процедуры обращения с МИ, предусмотренные инструкцией по применению. Выбор экстрагирующей жидкости следует проводить с учетом свойств материала/МИ, условий их применения и (или) метода исследований (испытаний). Как правило, для МИ/материала из полимерных материалов экстракцию проводят в дистиллированной воде. Экстрагирующая жидкость для МИ из металлов и керамики - 0,9%-ный раствор хлорида натрия для инъекций, если в нормативной документации изготовителя не установлены другие требования (см. приложение Б).
Примечания
1 Водные экстракты готовят с использованием дистиллированной воды или воды для лабораторного анализа (см. ГОСТ Р 58144, ГОСТ Р 52501).
2 Для определения остаточного содержания этиленоксида (ЭО) и этиленхлоргидрина (ЭХГ) в МИ после стерилизации необходимо руководствоваться ГОСТ ISO 10993-7.
5.2.8 Жидкие формы МИ испытывают "per se" (в чистом виде).
5.2.9 Посуда и оборудование лабораторное стеклянное должны соответствовать требованиям ГОСТ 23932, ГОСТ 1770.
5.2.10 При выборе материалов, разработке новых МИ, отсутствии информации о характеристиках в отношении безопасности, экстракты готовят в соотношении между массой испытуемого материала и объемом модельной среды по формуле
где M - максимально возможное количество материала в МИ, г;
V - объем крови в организме человека (из расчета/или принимаемого 5 л);
K - коэффициент аггравации, равный 10.
Сроки экспозиции экстрактов определяют продолжительностью и характером контакта МИ с организмом человека. При применении динамического режима приготовления экстракта необходимо регламентировать и документировать сроки обновления модельной среды и проводить анализ полученных экстрактов на каждом этапе.
5.2.11 Необходимо применять соответствующие методы и методики для всех видов исследований (испытаний) и измерений. Требования к аналитическим методам изложены в ГОСТ ISO 10993-18.
5.2.12 Общие требования к выбору, верификации и валидации методов и методик установлены в ГОСТ ISO/IEC 17025. Рекомендации по выбору методик (методов) для целей оценки соответствия изложены в ГОСТ Р 58975.
5.2.13 Для определения санитарно-химических показателей, показателей биологического действия и микробиологических показателей с целью оценки биологического действия МИ следует применять пригодные методы и методики (см. ГОСТ ISO/IEC 17025).
6 Показатели биологического действия
6.1 Оценка биологического действия позволяет обнаружить вредное воздействие МИ в условиях in vitro и/или in vivo. Результаты оценки позволяют сделать заключение о биологической совместимости МИ.
Основные положения оценки биологического действия приведены в соответствующих стандартах серии ГОСТ ISO 10993.
6.2 Общие требования к выбору образцов для исследований (испытаний) установлены в ГОСТ ISO 10993-12 и в стандартах на конкретное МИ.
6.3 Если в стандартах на конкретное имплантируемое МИ нет требований к выбору образцов для исследований (испытаний), то рекомендуется руководствоваться следующим правилом.
Изучению подлежит такое количество материала, которое рассчитано по формуле
где M - максимальное количество материала, имплантируемое человеку, г;
P - масса тела человека (из расчета/или принимаемая 70 кг);
K - коэффициент аггравации, равный 20.
6.4 Образцы для испытаний имплантируемых МИ подготавливают в соответствии с ГОСТ ISO 10993-6.
6.5 Исследуемые и контрольные образцы следует обрабатывать в условиях, исключающих контаминацию.
6.6 МИ/материалы, представляющие собой жидкие формы (растворы, гели) испытывают "per se" (в чистом виде).
6.7 Общие требования к приготовлению экстрактов, используемых для оценки биологического действия МИ/материалов, установлены в ГОСТ ISO 10993-12 и других НД на конкретный вид МИ или метод (методику) исследований (испытаний).
Примечание - Экстракты для исследования на лабораторных животных, в том числе и для испытания на пирогенность, готовят на 0,9%-ном стерильном апирогенном растворе хлорида натрия для инъекций.
6.8 Общие требования к выбору, верификации и валидации методов и методик установлены в ГОСТ ISO/IEC 17025. Рекомендации по выбору методик (методов) с целью оценки соответствия изложены в ГОСТ Р 58975.
6.9 Методы и методики исследования биологического действия изложены в соответствующих стандартах (см. стандарты серии ГОСТ ISO 10993, ГОСТ 34901).
6.10 Специалист, планирующий исследования и составляющий программу, вправе выбрать альтернативный метод испытаний, соответствующий применению МИ, при условии его валидации.
6.11 Пирогенность, опосредованная материалом, должна быть оценена путем анализа научных данных, а при их отсутствии результатами исследований.
В зависимости от происхождения пирогена лихорадочную реакцию можно разделить на три группы:
а) пирогенность, обусловленная материалом, вызванная химическими агентами;
б) пирогенность, опосредованная эндотоксином (структурные компоненты грамотрицательных бактерий, высвобождаемые только при лизисе бактериальной клетки);
в) пирогенность, опосредованная микробными компонентами, отличными от эндотоксина.
6.11.1 Материалы, содержащие новые химические вещества или вещества, которые ранее вызывали пирогенный эффект, должны быть оценены на предмет пирогенности, опосредованной материалом (см. ГОСТ ISO 10993-11).
Перечень веществ, которые вызывают пирогенную реакцию, не являясь эндотоксинами, приведен в ГОСТ ISO 10993-11.
Микросферы и наночастицы, в том числе продукты разрушения имплантатов, могут действовать как пирогены. Микросферы, частицы и наночастицы могут фагоцитироваться и активировать высвобождение провоспалительных цитокинов.
6.11.2 Для определения пирогенности, опосредованной материалом, рекомендуется испытание на кроликах, так как оно основано на непосредственной оценке лихорадочной реакции в организме, чего нельзя добиться методами in vitro.
Для определения пирогенности, опосредованной материалом, ЛАЛ-тест не применим.
7 Микробиологические показатели
7.1 Общие положения
Целью микробиологических исследований является обнаружение микроорганизмов, их идентификация и изучение свойств.
7.2 Стерильность
Одним из критериев биологической безопасности МИ является их стерильность.
Требования к МИ, прошедшим финишную стерилизацию, которые будут отнесены к категории "СТЕРИЛЬНЫЕ", установлены в ГОСТ EN 556-1.
Стерильность МИ подтверждают:
а) валидацией процесса стерилизации и последующими валидациями, показывающими, что данный процесс приемлем (см. ГОСТ Р ИСО 17665-1, ГОСТ ISO 11135, ГОСТ ISO 11137-1);
б) информацией, собранной во время текущего контроля стерильности и мониторинга процесса, показывающего, что валидированный процесс эффективно применен.
Требования к разработке, валидации и текущему контролю процесса стерилизации МИ изложены в соответствующих стандартах.
7.3 Микробиологическая чистота
Испытаниям на микробиологическую чистоту подвергают нестерилизуемые МИ с установленными микробиологическими характеристиками, например МИ в форме исполнения крем или гель, руководствуясь технической документацией изготовителя.
7.4 Пирогенность, опосредованная эндотоксинами
Бактериальными эндотоксинами являются структурные компоненты грамотрицательных бактерий, высвобождаемые только при лизисе бактериальной клетки. В природе грамотрицательные бактерии широко распространены в воде (реках и море), воздухе, почве, а также в организме человека. Поэтому МИ из материалов природного происхождения могут быть загрязнены бактериями и их компонентами. Контаминация бактериальными эндотоксинами возможна также в процессе производства МИ.
7.4.1 Контаминация МИ бактериальными эндотоксинами должна быть оценена.
7.4.2 Пирогенность этого типа определяют, измеряя количество эндотоксина эндотоксин-специфичным ЛАЛ-тестом (тест лизата амебоцитов мечехвоста).
Описание метода определения содержания эндотоксинов (ЛАЛ-тест) для образцов материалов/МИ, содержащих наноматериалы, изложено в ГОСТ Р ИСО 29701.
Следует учитывать, что использование ЛАЛ-реактива имеет ограничения: на реакцию влияют температура и pH раствора образца, а также реакция усиливается или ингибируется различными соединениями, такими как протеаза, ингибиторы протеаз, ионы металлов, поверхностно-активные вещества, хелаты, соли и сахара. Применение ЛАЛ-теста для конкретного МИ (например, для биополимерных гелей) должно быть обосновано, валидировано, документировано и представлено в технической документации производителя МИ.
8 Оценка и интерпретация результатов
8.1 Если на этапе исследования МИ в экстрактах из МИ/материалов обнаружено превышение значений ПДК экстрагируемых веществ, приведенных в приложении А, необходимо оценить их токсикологическую опасность в условиях предусмотренного применения/назначения МИ (см. ГОСТ ISO/TS 21726, ГОСТ ISO 10993-17).
Все результаты исследований, подтверждающих безопасность, должны быть документированы и представлены в технической документации производителя МИ.
8.2 Если в экстрактах из МИ/материалов обнаружено превышение значений интегральных показателей, то решение о безопасном применении МИ принимают на основании результатов исследований (испытаний) на тест-объектах в условиях in vitro и in vivo.
8.3 Решение о биологической совместимости и соответствии МИ требованиям безопасного применения принимают на основании имеющихся результатов, подтверждающих отсутствие вредного биологического воздействия (см. стандарты серии ГОСТ ISO 10993).
9 Представление отчетов о результатах
9.1 Результаты исследований (испытаний) должны быть представлены точно, четко, недвусмысленно и объективно (см. ГОСТ ISO/IEC 17025).
Выводы, содержащиеся в отчетах о результатах, должны быть однозначными и понятными, см. ГОСТ ISO/IEC 17025.
9.2 Отчеты о результатах могут сопровождаться экспертными заключениями, протоколами испытаний, пояснительными записками в зависимости от требований организации, в которую предоставляют результаты.
Приложение А
(справочное)
Допустимые значения интегральных показателей и ПДК экстрагируемых веществ из МИ/материалов в зависимости от их природы и характера контакта
Таблица А.1 - Допустимое значение интегральных показателей
Наименование показателя (характеристики) | Допустимое значение, не более |
1 Восстановительные примеси, мл, 0,02 Н раствора | 1,0 |
2 Изменение pH ( pH), ед.pH | ±1,0 |
3 Ультрафиолетовое поглощение, ед.О.П. в диапазоне длин волн, нм: | |
3.1 от 220 до 360 включительно; | 0,30 |
3.2 от 230 до 360 включительно; | 0,20 |
3.3 от 250 до 320 включительно | 0,10 |
В некоторых случаях допустимые значения могут быть более "жесткими", например для интраокулярных линз: ±0,2 ед.pH. Для контейнеров для крови и ее компонентов. Для укупорочных пробок и устройств, комплектных эксфузионных, инфузионных и трансфузионных однократного применения. | |
Таблица А.2 - ПДК экстрагируемых веществ из МИ/материалов в зависимости от их природы и вида контакта
Наименование МИ/материалов в зависимости от их природы | Наименование показателя (характеристики) | ПДК, мг/дм , не более |
1 Материалы полимерные синтетические | ||
1.1 Материалы полимерные синтетические, общие показатели | Интегральные показатели | см. таблицу А.1, пункты 1, 2, 3 |
Формальдегид | 0,10 | |
2 Дополнительные показатели, в зависимости от состава | ||
2.1 Материалы полимерные синтетические, в зависимости от состава | Железо (Fe) | 0,30 |
Кадмий(Cd) | 0,001 | |
Медь (Cu) | 1,0 | |
Хром (Cr /Cr , суммарно) | 0,10 | |
Свинец (Pb) | 0,030 | |
Олово (Sn) | 1,0 | |
2.2 Полиэтилен, полипропилен и другие материалы на основе полиолефинов | Ацетальдегид | 0,20 |
Ацетон | 0,10 | |
Изопропанол | 0,10 | |
Метанол | 0,20 | |
Пропанол | 0,10 | |
2.3 Полистирол и сополимеры на основе | Стирол | 0,010 |
стирола | Метанол | 0,20 |
2.4 Поливинилхлорид | Ацетальдегид | 0,20 |
Ацетон | 0,10 | |
Винилхлорид | 0,010 | |
Изопропанол | 0,10 | |
Метанол | 0,20 | |
Пропанол | 0,10 | |
Диоктилфталат (ДОФ) | 2,0 10 мг/100 мл | |
2.5 Полиорганосилоксаны (силиконы) | Ацетальдегид | 0,20 |
Метанол | 0,20 | |
Фенол | 0,050 | |
2.6 Полиакрилаты | Акрилонитрил | 0,020 |
Бутилакрилат | 0,010 | |
Метилакрилат | 0,020 | |
Метилметакрилат | 0,250 | |
2.7 Полиамиды: | -капролактам | 0,50 |
Бензол | 0,010 | |
- капрон (полиамид 6, поликапроамид); | Фенол | 0,050 |
- нейлон (полиамид 66, | Гексаметилендиамин | 0,010 |
полигексаметиленадипамид) | Метанол | 0,20 |
2.8 Полиакриламид | Акриламид | 0,010 |
2.9 Полиуретан | Ацетальдегид | 0,20 |
Ацетон | 0,10 | |
Изопропанол | 0,10 | |
Метанол | 0,20 | |
Пропанол | 0,10 | |
Этиленгликоль | 1,0 | |
2.10 Полиэфиры: | Ацетальдегид | 0,20 |
Ацетон | 0,10 | |
полиэтилентерефталат и сополимеры на | Изопропанол | 0,10 |
основе терефталевой кислоты; | Метанол | 0,20 |
Пропанол | 0,10 | |
Этиленгликоль | 1,0 | |
- поликарбонат; | Фенол | 0,050 |
Дифенилолпропан | 0,010 | |
- полисульфон; | Дифенилолпропан | 0,010 |
- эпоксидные смолы | Дифенилолпропан | 0,010 |
Фенол | 0,050 | |
Эпихлоргидрин | 0,10 | |
2.11 Фторопласт (фторопласт-3, фторопласт-4, тефлон) | Формальдегид | 0,10 |
3 Резины и латексы синтетические | ||
3.1 Резины и латексы синтетические, общие показатели | Интегральные показатели | см. таблицу А.1, пункты 1, 2, 3 |
Кадмий (Cd) | 0,001 | |
Свинец (Pb) | 0,030 | |
Цинк (Zn) | 1,0 | |
Формальдегид | 0,10 | |
3.2 Дополнительные показатели, в | Акрилонитрил | 0,050 |
зависимости от состава | Ацетальдегид | 0,20 |
Агидол-2 (2,2-метилен-бис (4-метил-6-трет- бутил-фенол) | 2,0 | |
Изопрен | 0,01 | |
Тиурам Д (тетраметилти- урамдисульфид) | 0,050 | |
Тиурам Е (тетраэтилтиурам- дисульфид) | 0,050 | |
Дифенилгуанидин | 0,150 | |
Альтакс (2,2- дибензтиазолдисульфид) | 0,40 | |
Каптакс (2-меркаптобензтиазол) | 0,40 | |
Сульфенамид Ц (циклогексил-2-бензтиазол- сульфенамид) | 0,40 | |
Неозон Д (нафтам-2, -фенилнафтиламин) | 0,20 | |
4 Материалы природного происхождения | ||
4.1 Биологические ткани и их производные в зависимости от способа обработки, состава, | Интегральные показатели | см. таблицу А.1, пункты 1, 2 |
общие показатели. | Формальдегид | 0,10 |
Биологические ткани и их производные | Ацетальдегид | 0,20 |
человеческого происхождения в | Ацетон | 0,10 |
нежизнеспособном состоянии. | Изопропанол | 0,10 |
Биологические ткани и их производные | Метанол | 0,20 |
животного происхождения в нежизнеспособном состоянии. | Пропанол | 0,10 |
4.2 Латекс натурального каучука, общие | Интегральные показатели | см. таблицу А.1, пункт 1 |
показатели | Кадмий (Cd) | 0,001 |
Свинец (Pb) | 0,030 | |
Цинк (Zn) | 1,0 | |
Формальдегид | 0,10 | |
4.3 Дополнительные показатели, в | Акрилонитрил | 0,050 |
зависимости от состава | Ацетальдегид | 0,20 |
Агидол-2 (2,2-метилен-бис (4-метил-6-трет-бутил- фенол) | 2,0 | |
Изопрен | 0,01 | |
Тиурам Д (тетраметилти- урамдисульфид) | 0,050 | |
Дифенилгуанидин | 0,150 | |
Альтакс (2,2-дибензтиазолди- сульфид) | 0,40 | |
Каптакс (2-меркаптобензти- азол) | 0,40 | |
Сульфенамид Ц (циклогексил-2-бензтиазол- сульфенамид) | 0,40 | |
Неозон Д (нафтам-2, -фенилнафтиламин) | 0,20 | |
4.4 Целлюлоза, вискоза, хлопок, общие показатели | Интегральные показатели | см. таблицу А.1, пункты 1, 2, 3 |
Кадмий (Cd) | 0,001 | |
Свинец (Pb) | 0,030 | |
4.5 Дополнительные показатели, в | Ацетон | 0,10 |
зависимости от состава | Этилацетат | 0,10 |
5 Металлы и сплавы | ||
5.1 Металлы и сплавы, в зависимости от | Интегральные показатели | см. таблицу А.1, пункт 2 |
состава | Алюминий (AI) | 0,50 |
Ванадий (V) | 0,10 | |
Вольфрам (W) | 0,050 | |
Железо (Fe) | 0,30 | |
Кобальт (Co) | 0,10 | |
Марганец (Mn) | 0,10 | |
Медь (Cu) | 1,0 | |
Молибден (Mo) | 0,25 | |
Никель (Ni) | 0,10 | |
Титан (Ti) | 0,10 | |
Хром (Cr /Cr , суммарно) | 0,10 | |
Цинк (Zn) | 1,0 | |
6 Стекло и керамика | ||
6.1 Стекло и керамика, в зависимости от | Интегральные показатели | см. таблицу А.1, пункт 2 |
состава | Алюминий (AI) | 0,50 |
Бор (B) | 0,50 | |
Кадмий(Cd) | 0,001 | |
Кобальт (Co) | 0,10 | |
Марганец (Mn) | 0,10 | |
Медь (Cu) | 1,0 | |
Мышьяк (As) | 0,050 | |
Олово (Sn) | 2,0 | |
Ртуть (Hg) | 0,005 | |
Серебро (Ag) | 0,050 | |
Свинец (Pb) | 0,030 | |
Титан (Ti) | 0,10 | |
Хром (Cr /Cr , суммарно) | 0,10 | |
Цинк (Zn) | 1,0 | |
7 Агенты стерилизующие и консервирующие, пластификаторы, рентгеноконтрастные вещества | ||
Барий (Ba) | 0,10 | |
Глутаровый альдегид | 0,070 | |
Формальдегид | 0,10 | |
Этиленоксид | - | |
8 Растворители для склеивания деталей и узлов изделий | ||
Ацетон | 0,10 | |
Метилэтилкетон (Бутан-2-он) | 1,0 | |
Тетрагидрофуран | 20,0 | |
Циклогексанон | 2,50 | |
Для контейнеров для крови и ее компонентов. Для укупорочных пробок и устройств, комплектных эксфузионных, инфузионных и трансфузионных однократного применения. Для изделий, контактирующих с кровью. ПДК установлены в ГОСТ ISO 10993-7. Примечания 1 Если в МИ содержание вышеперечисленных веществ (компонентов) превышает значение ПДК, то их количество должно быть обосновано. 2 В таблице приведены вещества, наиболее часто встречающиеся в МИ. В МИ могут находиться вещества, не указанные в таблице. Определение веществ в конкретном МИ осуществляют с учетом результатов анализа риска. | ||
Приложение Б
(справочное)
Условия приготовления экстрактов
Таблица Б.1 - Условия приготовления экстрактов для групп изделий из полимеров (экстрагирующая жидкость - вода дистиллированная)
Категория изделия | Соотношение площади поверхности к объему экстрагента (S/V), см /см | Соотношение массы изделия к объему экстрагента (M/V), г/см | Соотношение количества образцов к объему экстрагента (N/V), шт./см | Темпе- ратура экстрак- ции, °С | Продол- житель- ность экстрак- ции, ч | Примечание |
1 Изделия поверхностного контакта | ||||||
1.1 Средства перевязочные, контактирующие с неповрежденной кожей, в том числе: - повязки, - пленки, - бинты, - пластыри фиксирующие, - гигиенические салфетки, - бандажи, - ортезы, - шины, - корсеты, - ремни-фиксаторы | 1/1 | - | - | 37±1 | 24±2 | - |
- вата медицинская гигроскопическая | - | 1/500 | - | 37±1 | 24±2 | - |
- гипсовые бинты | 1/5 | - | - | 37±1 | 24±2 | - |
1.2 МИ эластичные компрессионные | 1/1 | - | - | 37±1 | 24±2 | - |
1.3 Средства перевязочные, контактирующие с поврежденными кожей и слизистыми оболочками, в том числе: - противоожоговые повязки, гемостатические рассасывающиеся и др.; - ватно-марлевые средства (салфетки, бинты, перевязочные пакеты); | 1,6/1 | 37±1 | 24±2 | |||
- клеи, сорбенты, гемостатические порошки | - | М/250 | - | 37±1 | 24±2 | М - максимальная разовая доза |
- средства перевязочные пластырного типа | 1,6/1 | - | - | 37±1 | 24±2 | - |
1.4 Гели для УЗИ | - | 5/100 | - | 37±1 | 2,0±0,1 | - |
1.5 Линзы очковые для коррекции зрения | 1/1 | - | - | 37±1 | 24±2 | - |
1.6 Оправы очковые | - | - | 3/500 | 37±1 | 24±2 | - |
1.7 Протезы глазные (экзопротезы), эктопротезы лица | - | - | 1/50 | 37±1 | 24±2 | - |
1.8 Одежда и белье, применяемые как МИ | 1/1 | - | - | 37±1 | 24±1 | - |
1.9 Одежда и белье хирургические, применяемые как МИ для пациентов, хирургического персонала и оборудования | 1/1 | - | - | 37±1 | 24±2 | - |
1.10 Изделия рентгенозащитные (фартуки, нагрудники, перчатки, бахилы) | 1/10 | - | - | 37±1 | 2,0±0,1 | - |
1.11 Медицинские гигиенические прокладки, подгузники, пеленки | 1/1 | - | - | 37±1 | 24±2 | После полного водопог- лощения |
1.12 Презервативы | - | - | 1/50 | 37±1 | 2,0±0,1 | - |
1.13 Перчатки медицинские | 1/1 | - | - | 37±1 | 8±1 | - |
1.14 Перчатки медицинские из латекса натурального каучука | 1/1 | - | - | 37±1 | 8±1 | - |
1.15 Спринцовки, кружки Эсмарха, клизменные наконечники | - | - | 1/V | 37±1 | 2,0±0,1 | Заполняют номинальным объемом |
1.16 Молокоотсосы | - | - | 1/V | 37±1 | 24±2 | Заполняют номинальным объемом |
1.17 Моче- и калоприемники, подкладные судна, грелки, пузыри для льда | 1/5 | - | - | 37±1 | 2,0±0,1 | - |
1.18 Экзопротезы грудной железы, изделия протезно-ортопедические и полуфабрикаты к ним | 1/2 | - | - | 37±1 | 24±2 | - |
1.19 Внутриматочные контрацептивы, кольца | - | - | 1/50 | 37±1 | 72±2 | - |
1.20 Линзы контактные | 1/1 | - | - | 37±1 | 24±2 | - |
1.21 Гинекологические инструменты, в том числе: | ||||||
- зеркало по Куско; | - | - | 1/500 | 37±1 | 2,0±0,1
| - |
- шпатель, ложка Фолькмана, цервикальная щетка | - | - | 1/100 | 37±1 | 2,0±0,1 | - |
1.22 Датчики, электроды и другие устройства, контактирующие с кожей | - | - | 1/250 | 37±1 | 2,0±0,1 | - |
1.23 Камеры неонатальных инкубаторов | 1/1 | - | - | 37±1 | 24±2 | - |
1.24 Ингаляторы | - | - | 1/V | 37±1 | 24±2 | Заполняют номинальным объемом |
1.25 Слуховые аппараты | - | - | 1/50 | 37±1 | 24±2 | - |
1.26 Криопакеты | - | - | 1/250 | 37±1 | 2,0±0,1 | - |
1.27 Микросферы для противоожоговых кроватей | - | 1/10 | - | 37±1 | 24±2 | - |
2 Изделия, присоединяемые извне | ||||||
2.1 Устройства комплектные эксфузионные, инфузионные и трансфузионные | - | - | 3/250 | 37±1 | 2,0±0,1 | По приложению В |
2.2 Аппараты и устройства для замещения функций органов и систем организма, в том числе: - аппараты искусственного кровообращения, искусственной почки, для гемосорбции в комплекте с магистралями или без них и их функциональные элементы; - магистрали кровопроводящие | - | - | 1/500 | 37±1 | 2,0±0,1 | По приложению В |
2.3 Катетеры внутрисосудистые, трубки медицинские для переливания крови, препаратов из крови, кровезаменителей и инфузионных растворов | - | - | 1/250 | 37±1 | 24±2 | - |
2.4 Шприцы инъекционные однократного применения | - | - | 1/V | 37±1 | 24±2 | Заполняют через иглу номинальным объемом |
2.5 Контейнеры для крови, препаратов из крови, кровезаменителей и инфузионных растворов, в том числе: | ||||||
- 500 мл; | - | - | 1/100 | 70±2 | 24±2 | По ГОСТ 31209
|
- 300 мл | - | - | 1/50 | 70±2 | 24±2 | По ГОСТ 31209 |
2.6 Катетеры, зонды, дренажи, бужи различных типов | - | - | 1/250 | 37±1 | 24±2 | - |
3 Имплантируемые изделия | ||||||
3.1 Клапаны сердца, перикард, опорные кольца, кардио- и нервно-мышечные стимуляторы; протезы кровеносных сосудов, грудной железы, гортани, яичка, фаллопротезы; имплантаты для челюстно-лицевой хирургии, протезы мягких тканей, имплантируемые датчики и устройства для постоянного дозируемого введения лекарственных веществ | - | - | 1/500 | 37±1 | 72±2 | - |
3.2 Костные цементы, имплантируемые гели | - | М/500 | - | 37±1 | 72±2 | М - максимальная разовая доза |
3.3 Нити хирургические | - | - | - | 37±1 | 24±2 | Отношение длины нити, см, к объему дистилли- рованной воды, мл, 0,4/1 |
3.4 Имплантаты для офтальмохирургии | - | 1/1 | - | 37±1 | 72±2 | М - максимальная разовая доза |
3.5 Интраокулярные линзы | - | - | 1/1 | 37±1 | 72±2 | - |
3.6 Изделия офтальмологические вискохирургические | - | 1/1 | - | 37±1 | 8±1 | М - максимальная разовая доза |
4 Медицинские стоматологические изделия и материалы | ||||||
4.1 Медицинские стоматологические изделия и материалы | - | - | - | - | - | По ГОСТ 31576 |
* Дополнительная экстрагирующая жидкость, которую используют в зависимости от применяемого метода (методики).
| ||||||
Таблица Б.2 - Условия приготовления экстрактов для групп изделий из металлов, сплавов, керамики и стекла
Категория изделия | Экстрагирующая жидкость (среда) | Соотно- шение площади поверхности к объему модельной среды (S/V), см /см | Соотно- шение массы изделия к объему модельной среды (M/V), г/см | Соотно- шение количества образцов к объему модель- ной среды (N/V), шт./ см | Темпе- ратура экстрак- ции, °С | Продол- житель- ность экстрак- ции, ч | Примечание |
1 Изделия поверхностного контакта | |||||||
1.1 Оправы очковые | Вода дистиллированная | - | - | 3/500 | 37±1 | 24±2 | - |
1.2 Линзы очковые | Вода дистиллированная | 1/1 | - | - | 37±1 | 24±2 | - |
1.3 Пипетки глазные | Вода дистиллированная | - | - | 1/V | 37±1 | 2,0±0,1 | Заполняют номинальным объемом |
1.4 Датчики, электроды, контактирующие с кожей, слизистыми | 0,9%-ный раствор хлорида натрия | - | - | 1/250 | 37±1 | 2,0±0,1 | - |
2 Изделия, присоединяемые извне | |||||||
2.1 Шприцы медицинские инъекционные многократного применения | Вода дистиллированная | - | - | 1/V | 37±1 | 24±2 | Заполняют номинальным объемом |
2.2 Иглы инъекционные, скарификаторы | 0,9%-ный раствор хлорида натрия | - | - | 1/5 | 37±1 | 2,0±0,1 | - |
2.3 Автономные желудочно- кишечные электростимуляторы | 0,9%-ный раствор хлорида натрия | - | - | 1/100 | 37±1 | 24±2 | - |
2.4 Иглы атравматические без нитей | 0,9%-ный раствор хлорида натрия | - | - | 1/5 | 37±1 | 2,0±0,1 | - |
2.5 Хирургические, гинекологические и другие инструменты: | |||||||
- многократного применения; | 0,9%-ный раствор хлорида натрия
| - | - | 1/150 | 37±1 | 24±2 | - |
- однократного применения | 0,9%-ный раствор хлорида натрия | - | - | 1/150 | 37±1 | 2,0±0,1 | |
2.6 Кардио- стимуляторы, изделия для ортопедии (пластины для остеосинтеза, спицы и другие приспособления), протезы суставов, внутрисосудистые стенты | 0,9%-ный раствор хлорида натрия | - | - | 1/500 | 37±1 | 336±2 | - |
3 Имплантируемые изделия | |||||||
3.1 Нейрохирурги- ческие и сосудистые клипсы, скобы сшивающие | 0,9%-ный раствор хлорида натрия | - | - | 1/50 | 37±1 | 336±2 | - |
3.2 Материалы хирургические шовные (нити металлические) | 0,9%-ный раствор хлорида натрия | - | - | - | 37±1 | 336±2 | Отношение длины нити, см, к объему экстрагирую- щей жидкости, мл, 0,4/1 |
3.3 Автономные желудочно- кишечные электростимуляторы | 0,9%-ный раствор хлорида натрия | - | - | 1/100 | 37±1 | 24±2 | - |
4 Медицинские стоматологические изделия и материалы | |||||||
4.1 Медицинские стоматологические изделия и материалы | - | - | - | - | - | - | По ГОСТ 31576 |
Примечания 1 Условия экстракции, приведенные в приложение Б, могут быть изменены, если эти изменения обоснованы и задокументированы. 2 Если МИ не вошли в настоящее приложение, то экстракцию проводят в соответствии с НТД на конкретное МИ или по ГОСТ ISO 10993-12. | |||||||
Таблица Б.3 - Условия приготовления экстрактов из образцов упаковки, находящейся в контакте с медицинским изделием (материалом) (экстрагирующая жидкость - вода дистиллированная)
Категория изделия | Соотно- шение площади поверхности к объему модельной среды (S/V), см /см | Соотно- шение массы изделия к объему модельной среды ( M/V ), г/см | Соотно- шение количества образцов к объему модельной среды (N/V), шт./см | Темпе- ратура экстрак- ции, °С | Продол- житель- ность экстрак- ции, ч | Примечание |
1 Пробки для укупоривания емкостей стерилизуемых влажным теплом (для МИ/материалов) | 1/2 | - | - | 121±1 | 1,0±0,1 | Автокла- вирование (P=1 атм) |
2 Емкости (контейнеры) для МИ | - | - | - | 37±1 | 24±2 | Заполняют номинальным объемом |
3 Упаковка/ материалы для упаковки МИ | 1/10 | - | - | 37±1 | 2±0,1 | - |
Примечание - Приведенные условия экстракции могут быть изменены, если эти изменения обоснованы и задокументированы. | ||||||
Приложение В
(рекомендуемое)
Условия приготовления экстракта с использованием стенда
В.1 Назначение стенда
Стенд предназначен для приготовления экстракта из МИ, применяемого при санитарно-химических исследованиях (испытаниях) и оценке биологического действия МИ: устройств комплектных эксфузионных, инфузионных и трансфузионных, аппаратов и устройств для замещения функций органов и систем организма (аппаратов искусственного кровообращения, искусственной почки, аппаратов для гемосорбции в комплекте с магистралями или без них и их функциональных элементов, а также магистралей к перечисленным аппаратам).
В.2 Описание стенда
Функциональная схема стенда должна соответствовать схеме, приведенной на рисунке В.1.
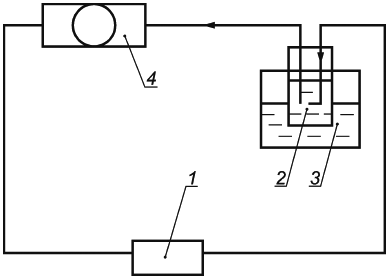 |
1 - испытуемое изделие (при испытании эксфузионных, инфузионных и трансфузионных устройств последовательно соединяются три изделия); 2 - стеклянная емкость, заполненная 500 мл дистиллированной воды для всех видов изделий (для эксфузионных, инфузионных и трансфузионных устройств - 250 мл, для оксигенаторов - 1000 мл); 3 - термостат, поддерживающий температуру дистиллированной воды в испытательном контуре (37±1)°С; 4 - перистальтический насос, подключенный к испытательному контуру через силиконовую трубку минимально возможной длины и обеспечивающий циркуляцию дистиллированной воды в контуре со скоростью потока 1 л/ч для эксфузионных, инфузионных и трансфузионных устройств; для остальных изделий скорость потока указана в инструкции по применению изделия
Рисунок В.1 - Функциональная схема стенда для приготовления экстракта
В.3 Приготовление экстракта
Через замкнутый контур в режиме рециркуляции в течение 2 ч с указанной скоростью потока пропускают соответствующий объем дистиллированной воды при температуре (37±1)°С. Через 2 ч, не нарушая герметичности контура, извлекают колбу из термостата, охлаждают до комнатной температуры. В первую очередь непосредственно из контура проводят отбор проб для определения этиленоксида, циклогексанона, тетрагидрофурана и 2-бутанона методами хроматографии путем прокола иглой шприца полимерной трубки устройства. Остальную часть экстракта сливают в стеклянную емкость со шлифом.
В качестве контрольного раствора используют соответствующий объем дистиллированной воды, пропущенной через замкнутый контур в тех же условиях, но без присоединения испытуемых МИ.
УДК 658.347:003:054:006.354 | ОКС 07.100.10 |
Ключевые слова: медицинское изделие, санитарно-химические испытания, токсикологические испытания, физико-химические исследования, исследуемый материал, компонент, стерилизация, валидация | |

