ГОСТ Р 54330-2011
Группа Н09
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕРМЕНТНЫЕ ПРЕПАРАТЫ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
Методы определения амилолитической активности
Enzyme preparations for food industry. Methods for determination of amylase activity
ОКС 07.100.30
ОКСТУ 9291
Дата введения 2013-01-01
Предисловие
1 РАЗРАБОТАН Государственным научным учреждением Всероссийским научно-исследовательским институтом пищевой биотехнологии Россельхозакадемии (ГНУ ВНИИПБТ Россельхозакадемии)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 176 "Спиртовая, дрожжевая и ликероводочная продукция"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 15 июня 2011 г. N 128-ст
4 ВВЕДЕН ВПЕРВЫЕ
5 ИЗДАНИЕ (апрель 2018 г.) с Изменениями N 1 (ИУС 7-2015), N 2 (ИУС 1-2018), Поправкой (ИУС 9-2015)
Изменение N 1 утверждено и введено в действие Приказом Федерального агентства по техническому регулированию и метрологии от 25.03.2015 N 159-ст
Изменение N 2 утверждено и введено в действие Приказом Федерального агентства по техническому регулированию и метрологии от 04.10.2017 N 1322-ст
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
1 Область применения
Настоящий стандарт распространяется на ферментные препараты и ферментсодержащие смеси (источники -амилазы и глюкоамилазы с использованием в качестве субстрата крахмал), используемые в пищевой промышленности, и устанавливает методы определения амилолитической активности.
Примечания
1 Амилолитическую активность исследуемых ферментных препаратов (ФП) обеспечивают ферменты: -амилаза и глюкоамилаза, катализирующие гидролиз крахмала.
2 Системные названия ферментов:
- -1,4-глюкан-4-глюканогидролаза (ЕС 3.2.1.1) [1] -
-амилаза - фермент с эндогенным механизмом действия, катализирующий гидролиз
-1,4-гликозидных связей крахмала с образованием
-декстринов, олигосахаридов и мальтозы;
- -1,4-глюкан-глюкогидролаза (ЕС 3.2.1.3) [1] - глюкоамилаза - фермент с экзогенным механизмом действия, катализирующий гидролиз
-1,4 и
-1,6-гликозидных связей крахмала, декстринов, олигосахаридов, последовательно отщепляя при этом остатки молекулы глюкозы от нередуцирующих концов субстрата с образованием глюкозы.
Раздел 1. (Измененная редакция, Изм. N 2).
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р ИСО 5725-1-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 1. Основные положения и определения
ГОСТ Р ИСО 5725-2-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 2. Основной метод определения повторяемости и воспроизводимости стандартного метода измерений
ГОСТ 61-75 Реактивы. Кислота уксусная. Технические условия
ГОСТ 199-78 Реактивы. Натрий уксуснокислый 3-водный. Технические условия
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
ГОСТ 4159-79 Реактивы. Йод. Технические условия
ГОСТ 4172-76 Реактивы. Натрий фосфорнокислый двузамещенный 12-водный. Технические условия
ГОСТ 4198-75 Реактивы. Калий фосфорнокислый однозамещенный. Технические условия
ГОСТ 4207-75 Реактивы. Калий железистосинеродистый 3-водный. Технические условия
ГОСТ 4232-74 Реактивы. Калий йодистый. Технические условия
ГОСТ 6038-79 Реактивы. D-глюкоза. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 10163-76 Реактивы. Крахмал растворимый. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 18481-81 Ареометры и цилиндры стеклянные. Общие технические условия
ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ Р 53228-2008 Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ Р 55802-2013 Крахмал. Методы определения влаги
ГОСТ Р 57248-2016 Препараты ферментные. Правила приемки и методы отбора проб
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
Раздел 2. (Измененная редакция, Изм. N 1, 2).
3 Термины и определения
В настоящем стандарте применяют следующие термины с соответствующими определениями:
3.1 гидролиз: Расщепление исходного соединения на более простые в присутствии молекул воды.
3.2 ферментативный гидролиз: Расщепление высокомолекулярных соединений при участии катализаторов белковой природы - гидролитических ферментов.
3.3 субстрат: Соединение или вещество, на которое воздействует данный фермент.
3.4 крахмал: Высокомолекулярный полисахарид, в котором остатки глюкозы соединены -гликозидными связями, состоящий из амилозы и амилопектина.
3.5 прогидролизованный крахмал: Крахмал, подвергнутый действию амилолитических ферментов, различной степени деструкции в зависимости от активности фермента.
3.6 системные названия ферментов: Названия, указывающие природу химической реакции, катализируемой данным ферментом, в соответствии с современной классификацией (КФ), принятой Международной комиссией по ферментам.
3.7 амилолитический комплекс: -амилазы микробного происхождения, катализирующие гидролиз крахмала, продуцентами которых являются бактерии и мицелиальные грибы.
3.8 бактериальные -амилазы: Ферменты, которые катализируют гидролиз крахмала до декстринов различной степени полимеризации.
Примечание - Оптимум действия мезофильных -амилаз проявляется при температуре 60°С-70°С; термостабильных
-амилаз - при температуре более 80°С.
3.9 грибные -амилазы: Ферменты, которые катализируют расщепление субстрата с более глубокой степенью гидролиза, чем бактериальные; при этом образуются как низкомолекулярные декстрины, так и мальтоза и глюкоза.
3.10 Ферментативная активность: Количество фермента, катализирующее гидролиз 1 мкмоля субстрата в определенных условиях.
4 Метод определения амилолитической активности ферментных препаратов - источников  -амилазы (АС)
-амилазы (АС)
4.1 Сущность метода
4.1.1 Метод основан на количественном определении прогидролизованного крахмала в результате его гидролиза ферментами амилолитического комплекса до декстринов различной молекулярной массы в стандартных условиях (температура 30°С, значение рН 6,0 - для бактериальных и 4,7 - для грибных -амилаз, продолжительность гидролиза 10 мин).
4.1.2 За единицу амилолитической активности (АС) принято такое количество фермента, которое при определенных значениях рН (6,0 - для бактериальных и 4,7 - для грибных -амилаз) и температуре 30°С за 1 ч катализирует гидролиз 1 г крахмала до декстринов различной молекулярной массы, что составляет 30% крахмала, введенного в реакцию. Активность выражается в ед. АС/г (для порошкообразного) или в ед. АС/см
(для жидкого) анализируемого ферментного препарата.
(Измененная редакция, Изм. N 1).
4.1.3 Количество прогидролизованного крахмала определяется колориметрическим методом по степени окраски остаточного крахмала раствором йода.
4.2 Средства измерений, вспомогательное оборудование, посуда, реактивы, материалы
4.2.1 Для определения амилолитической активности используют следующие средства измерений, вспомогательное оборудование, посуду, реактивы, материалы:
- весы неавтоматического действия по ГОСТ Р 53228 с пределами абсолютной допускаемой погрешности не более ±0,5 мг, а также весы с пределами допускаемой абсолютной погрешности ±0,02 мг;
- фотоэлектроколориметр (ФЭК) или спектрофотометр любого типа, обеспечивающий измерения при длине волн 440 и 670 нм с погрешностью измерения коэффициента пропускания ±1% в кюветах с толщиной поглощающего свет слоя 10 мм;
- рН-метр любого типа для измерения в диапазоне рН от 0 до 14 с пределом допускаемой погрешности в эксплуатации ±0,1 единицы рН;
- холодильник бытовой;
- мешалку магнитную любой марки, которая обеспечивает скорость вращения до 800 мин;
- ультратермостат или водяной термостат с точностью регулирования температуры ±1°С;
- баню водяную любого типа, которая обеспечивает поддержание температуры (100±1)°С с точностью регулирования температуры ±1°С;
- секундомер с емкостью шкалы счетчика 1 мин, ценой деления 1 с и погрешностью ±1,5 с;
- пипетки автоматические емкостью от 0,1 до 1,0 см и от 0,2 до 5,0 см
с наконечниками;
- встряхиватель V-3 типа Вортекс или аналогичный для перемешивания жидкости со скоростью вращения от 50 до 3400 об./мин;
- термометры ртутные стеклянные лабораторные от 0°С до 50°С и от 0°С до 100°С с ценой деления шкалы 0,5°С по ГОСТ 28498;
- ареометры общего назначения по ГОСТ 18481;
- стаканы и колбы стеклянные лабораторные В-1-150 ТС, В-1-800 ТС, Кн-1-100-14/23 ТС по ГОСТ 25336;
- стаканчики для взвешивания (бюксы) СВ-19/9 по ГОСТ 25336;
- воронки В-75-140 ХС по ГОСТ 25336;
- пробирки П1-14-120, П1-16-150, П1-21-200 по ГОСТ 25336;
- колбы мерные 1-25-2, 1-50-2, 1-100-2, 1-200-2, 1-250-2, 2-1000-2 по ГОСТ 1770;
- цилиндры 1-25-2, 1-50-2, 1-100-2, 1-250-2 по ГОСТ 1770;
- пипетки стеклянные 1-2-2-1, 1-2-2-2, 1-2-2-5, 1-2-2-10 по ГОСТ 29227;
- бумагу фильтровальную лабораторную по ГОСТ 12026;
- крахмал растворимый по ГОСТ 10163;
- натрий уксуснокислый по ГОСТ 199;
- кислоту уксусную по ГОСТ 61;
- натрий фосфорнокислый двузамещенный 12-водный по ГОСТ 4172;
- калий фосфорнокислый однозамещенный по ГОСТ 4198;
- кислоту соляную по ГОСТ 3118;
- йод кристаллический по ГОСТ 4159;
- калий йодистый по ГОСТ 4232;
- воду дистиллированную по ГОСТ 6709.
4.2.2 Все реактивы должны относиться к подгруппе чистоты 2 (х.ч.) или 3 (ч.д.а.).
4.2.3 Допускается применение средств измерений, вспомогательного оборудования с аналогичными метрологическими и техническими характеристиками, а также реактивов по качеству не хуже вышеуказанных.
4.3 Подготовка к анализу
4.3.1 Приготовление раствора крахмала с массовой долей 1,0% (субстрат)
1,00 г крахмала в пересчете на абсолютно сухое вещество, учитывая влагу по ГОСТ Р 55802, помещают в мерную колбу вместимостью 100 см, добавляют 25 см
дистиллированной воды и перемешивают. Затем добавляют в колбу еще 25 см
дистиллированной воды, помещают колбу в кипящую водяную баню не менее чем на 15-20 мин, непрерывно перемешивая содержимое до полного растворения крахмала. После этого содержимое колбы охлаждают, добавляют 10 см
ацетатного буферного раствора с рН 4,7 по 4.3.2 (для препаратов грибного происхождения) или фосфатного буферного раствора с рН 6,0 по 4.3.3 (для препаратов бактериального происхождения), объем жидкости доводят до метки дистиллированной водой при температуре 20°С и содержимое колбы перемешивают. Для полученного раствора крахмала характерна легкая опалесценция.
Раствор крахмала готовят в день проведения анализа.
(Измененная редакция, Изм. N 2).
4.3.2 Приготовление ацетатного буферного раствора молярной концентрации 1,0 моль/дм с рН 4,7 из растворов уксуснокислого натрия и уксусной кислоты
4.3.2.1 Приготовление раствора уксуснокислого натрия молярной концентрации 1,0 моль/дм (раствор А)
В мерную колбу вместимостью 1 дм помещают (82,00±0,01) г (или (136,00±0,01) г CH
COONa·3Н
О) безводного уксуснокислого натрия и растворяют приблизительно в 300 см
дистиллированной воды. Затем доводят до метки дистиллированной водой при температуре 20°С и перемешивают.
Срок хранения раствора в закрытой стеклянной посуде при температуре 4°С - не более четырех недель.
4.3.2.2 Приготовление раствора уксусной кислоты молярной концентрации 1,0 моль/дм (раствор Б)
В мерную колбу вместимостью 1 дм вносят 58 см
ледяной уксусной кислоты, приливают около 300 см
дистиллированной воды, доводят до метки дистиллированной водой при температуре 20°С и снова перемешивают.
Срок хранения раствора в закрытой стеклянной посуде при температуре 4°С - не более четырех недель.
4.3.2.1, 4.3.2.2. (Измененная редакция, Изм. N 2).
4.3.2.3 Для приготовления ацетатного буферного раствора в колбе смешивают растворы уксуснокислого натрия (раствор А) и уксусной кислоты (раствор Б) в равных объемах, создавая значение рН смеси, равное 4,7. При необходимости доводят рН раствора до 4,7 одним из исходных растворов.
Срок хранения буферного раствора в закрытой стеклянной посуде при температуре 4°С - не более четырех недель.
4.3.3 Приготовление фосфатного буферного раствора молярной концентрации 1/15 моль/дм с рН 6,0 из растворов натрия фосфорнокислого двузамещенного и калия фосфорнокислого однозамещенного
4.3.3.1 Приготовление раствора фосфорнокислого натрия двузамещенного 12-водного молярной концентрации 1/15 моль/дм (раствор А)
В мерную колбу вместимостью 1 дм помещают (23,87±0,01) г натрия фосфорнокислого двузамещенного, содержащего 12 молекул воды, растворяют в 300 см
дистиллированной воды и доводят объем до метки дистиллированной водой при температуре 20°С.
4.3.3.2 Приготовление раствора фосфорнокислого калия однозамещенного молярной концентрации 1/15 моль/дм (раствор Б).
В мерную колбу вместимостью 1 дм помещают (9,087±0,001) г калия фосфорнокислого однозамещенного, растворяют в 300 см
дистиллированной воды и доводят объем до метки дистиллированной водой при температуре 20°С.
4.3.3.1-4.3.3.2. (Измененная редакция, Изм. N 2).
4.3.3.3 Для приготовления фосфатного буферного раствора молярной концентрации 1/15 моль/дм с рН 6,0 растворы А и Б смешивают в соотношении 1:9.
Величину рН проверяют на рН-метре. В случае отклонения рН фосфатного буферного раствора от 6,0 его доводят до нужного значения раствором А или Б.
Срок хранения буферного раствора в закрытой стеклянной посуде при температуре 4°С - не более четырех недель.
4.3.4 Приготовление раствора соляной кислоты молярной концентрации 0,5 моль/дм
41,0 см концентрированной соляной кислоты наливают в мерную колбу вместимостью 1 дм
и доводят объем до метки при температуре 20°С дистиллированной водой.
(Измененная редакция, Изм. N 2).
4.3.5 Приготовление раствора йода
4.3.5.1 Приготовление основного раствора йода
(0,50±0,01) г йода и (5,0±0,01) г йодистого калия растворяют в стаканчике для взвешивания с притертой пробкой в небольшом количестве воды. Содержимое перемешивают на магнитной мешалке при плотно закрытой крышке бюкса.
Раствор после полного растворения йода переносят количественно в мерную колбу с притертой крышкой вместимостью 200 см и объем доводят дистиллированной водой при температуре 20°С до метки.
Раствор йода хранят в склянке из темного стекла с притертой пробкой - не более 1 мес.
4.3.5.2 Приготовление рабочего раствора йода
20 см основного раствора йода (см. 4.3.5.1) разводят раствором соляной кислоты (см. 4.3.4) молярной концентрации 0,5 моль/дм
при анализе препаратов грибного и бактериального происхождения в мерной колбе объемом 1 дм
.
Перед употреблением рабочего раствора проверяют его оптическую плотность на фотоэлектроколориметре или спектрофотометре в диапазоне длин световых волн 440 нм в кюветах с толщиной поглощающего свет слоя 10 мм. Оптическая плотность рабочего раствора йода, измеренная в сравнении с дистиллированной водой, должна иметь значение 0,22±0,01. В случае отклонения от этого значения добавляют раствор соляной кислоты молярной концентрации 0,5 моль/дм
или основного раствора йода до достижения нужной величины оптической плотности.
(Измененная редакция, Изм. N 2).
4.4 Подготовка пробы
4.4.1 Отбор проб - по ГОСТ Р 57248.
Анализируемые пробы ферментных препаратов в форме порошка или жидком виде используют без предварительной подготовки.
(Измененная редакция, Изм. N 2).
4.4.2 Приготовление основного раствора анализируемой пробы ферментного препарата
В стаканчик для взвешивания помещают 0,100 г порошкообразного ферментного препарата или 1,00 г жидкого ферментного препарата и суспендируют в небольшом количестве дистиллированной воды. Суспензию количественно переносят в мерную колбу вместимостью 100 см, доводят объем до метки дистиллированной водой при температуре 20°С и тщательно перемешивают.
4.4.3 Приготовление рабочего раствора анализируемой пробы ферментного препарата
Рабочий раствор анализируемого ферментного препарата готовят из основного раствора по 4.4.2 путем дальнейшего разведения его в дистиллированной воде таким образом, чтобы при определении активности коэффициент С (см. 4.6.1), характеризующий степень гидролиза крахмала, находился в пределах 0,02-0,07.
Каждую пробу ферментного препарата анализируют дважды при соблюдении условий повторяемости по ГОСТ Р ИСО 5725-1-2002 (пункт 3.14).
Раствор готовят в день определения. Длительность использования рабочего раствора ферментного препарата не должна превышать 1 ч с момента приготовления во избежание потерь его ферментативной активности.
(Измененная редакция, Изм. N 2).
4.5 Проведение анализа
4.5.1 В две пробирки размером 21200 мм вносят по 10 см
субстрата 1%-ного раствора крахмала по 4.3.1. Содержимое пробирок прогревают в ультратермостате при температуре (30,0±1,0)°С в течение 5 мин.
(Измененная редакция, Изм. N 2).
4.5.2 В две пробирки с субстратом добавляют по 5,0 см рабочего раствора анализируемой пробы ферментного препарата по 4.4.3, предварительно прогретого при температуре 30°С, тщательно перемешивают и включают секундомер, отмечая начало ферментативной реакции. Реакционную смесь инкубируют при температуре (30,0±1,0)°С в течение 10 мин (с точностью, определяемой по секундомеру от начала ферментативной реакции).
4.5.3 По окончании реакции отбирают 0,5 см инкубационной смеси и вносят в колбу с 50 см
рабочего раствора йода по 4.3.5.2. Содержимое колбы перемешивают и измеряют оптическую плотность на фотоэлектроколориметре или спектрофотометре при длине световой волны
670 нм в кюветах при толщине поглощающего свет слоя 10 мм в сравнении с дистиллированной водой, получая значение оптической плотности
(см. 4.6.1).
4.5.4 В качестве контроля используют 1%-ный раствор крахмала объемом 10 см, в который вместо раствора анализируемого фермента добавляют 5,0 см
дистиллированной воды. Полученную смесь прогревают при температуре 30°С в течение 10 мин. Затем все дальнейшие действия проводят аналогично 4.5.3, получая значение оптической плотности
(см. 4.6.1).
4.5.5 После добавления к рабочему раствору йода инкубационной смеси раствор приобретает фиолетовую окраску различной интенсивности в зависимости от количества непрогидролизованного крахмала; цвет контрольного раствора - синий.
4.6 Обработка результатов
4.6.1 Степень гидролиза крахмала определяют по разности оптической плотности контрольного раствора (см. 4.5.4) и анализируемого раствора (см. 4.5.3). С вычисляют по формуле
![]() , (1)
, (1)
где - оптическая плотность контрольного раствора;
- оптическая плотность анализируемого раствора;
0,1 - масса крахмала, взятого на анализ (см. 4.5.1), г.
Если коэффициент , характеризующий степень гидролиза крахмала, меньше 0,02 или больше 0,07, то анализ повторяют, подбирая другое разведение анализируемой пробы так, чтобы раствор содержал большее или меньшее количество фермента соответственно.
4.6.2 Расчет амилолитической активности в анализируемой пробе
4.6.2.1 Расчет амилолитической активности в анализируемом препарате бактериального происхождения
а) Амилолитическую активность препаратов бактериальной мезофильной -амилазы (
![]() ), ед. АС/г (для порошкообразного препарата) или ед. АС/см
), ед. АС/г (для порошкообразного препарата) или ед. АС/см (для жидкого препарата), рассчитывают по формуле
![]() , (2)
, (2)
где 5,885; 0,0017 - коэффициенты расчетного уравнения, полученные при математической обработке экспериментальных данных зависимости массы прогидролизованного крахмала от массы фермента, взятого для анализа, в пересчете на 1 ч действия фермента;
- коэффициент, характеризующий степень гидролиза крахмала (см. 4.6.1);
- масса ферментного препарата с учетом разведения по 4.4.3, взятая для испытания, г;
- плотность ферментного препарата по ГОСТ 18481 (для жидкого препарата), г/см
.
б) Амилолитическую активность для препаратов бактериальной термостабильной -амилазы (
), ед. АС/г (для порошкообразного препарата) или ед. АС/см
(для жидкого препарата), рассчитывают по формуле
![]() , (3)
, (3)
где 6,6138; 0,0192 - коэффициенты расчетного уравнения, полученные при математической обработке экспериментальных данных зависимости массы прогидролизованного крахмала от массы фермента, взятого для анализа, в пересчете на 1 ч действия фермента;
- коэффициент, характеризующий степень гидролиза крахмала (см. 4.6.1);
- масса ферментного препарата с учетом разведения по 4.4.3, взятая для испытания, г;
- плотность ферментного препарата по ГОСТ 18481 (для жидкого препарата), г/см
.
4.6.2.2 Расчет амилолитической активности в анализируемом препарате грибной -амилазы
Амилолитическую активность для препаратов грибной -амилазы (
), ед. АС/г (для порошкообразного препарата) или ед. АС/см
(для жидкого препарата), рассчитывают по формуле
![]() , (4)
, (4)
где 7,264; 0,0377 - коэффициенты расчетного уравнения, полученные при математической обработке экспериментальных данных зависимости массы прогидролизованного крахмала от массы фермента, взятого для анализа, в пересчете на 1 ч действия фермента.
Вычисления проводят до второго десятичного знака с последующим округлением до первого десятичного знака, если полученное значение амилолитической активности 100 ед. АС/г (см) и менее. Вычисления проводят до первого десятичного знака с последующим округлением до целого числа, если полученное значение амилолитической активности более 100 ед. АС/г (см
).
(Измененная редакция, Изм. N 2).
4.6.3 Оформление результатов измерений
За окончательный результат принимают среднеарифметическое значение результатов двух параллельных определений, выполненных в условиях повторяемости, если выполняется условие приемлемости.
Результат анализа представляют в виде
![]() при
при 0,95,
где - среднеарифметическое значение результатов двух параллельных определений, признанных приемлемыми (4.7.1), ед. АС/г (для порошкообразного препарата) или ед. АС/см
(для жидкого препарата);
- значение границ абсолютной погрешности измерений, ед. АС/г (для порошкообразного препарата) или ед. АС/см
(для жидкого препарата), определяемое по формуле
![]() , (5)
, (5)
где - границы относительной погрешности результата анализа амилолитической активности в анализируемой пробе при
0,95 составляют ±8%.
4.7 Сходимость и воспроизводимость результатов
4.7.1 Результаты измерений, полученные в условиях повторяемости (сходимости), признаются удовлетворительными, если выполняется условие приемлемости
![]() , (6)
, (6)
где и
- результаты двух параллельных определений, полученные в условиях повторяемости при
0,95, ед. АС/г (для порошкообразного препарата) или ед. АС/см
(для жидкого препарата);
- среднеарифметическое значение результатов двух параллельных определений, ед. АС/г (для порошкообразного препарата) или ед. АС/см
(для жидкого препарата);
- предел повторяемости (сходимости) при
0,95, равный 8%.
4.7.2 Результаты измерений, полученные в условиях воспроизводимости по ГОСТ Р ИСО 5725-2, признаются удовлетворительными, если выполняется условие приемлемости
![]() , (7)
, (7)
где и
- окончательные результаты измерений, полученные в двух лабораториях в точном соответствии с методикой, ед. АС/г (для порошкообразного препарата) или ед. АС/см
(для жидкого препарата);
- среднеарифметическое значение двух окончательных результатов измерений, полученных в условиях воспроизводимости, ед. АС/г (для порошкообразного препарата) или ед. АС/см
(для жидкого препарата);
![]() - критическая разность, равная 10%.
- критическая разность, равная 10%.
(Измененная редакция, Изм. N 1).
5 Метод определения глюкоамилазной активности (ГлС)
5.1 Характеристика метода
5.1.1 Метод основан на количественном определении глюкозы, образующейся при гидролизе крахмала глюкоамилазой в стандартных условиях (температура 30°С, значение рН 4,7, продолжительность гидролиза 10 мин).
5.1.2 Глюкоамилазная активность (ГлС) характеризует способность ферментного препарата катализировать расщепление растворимого крахмала до глюкозы и выражается числом единиц активности в 1 г (1 см) препарата.
5.1.3 За единицу глюкоамилазной активности принято такое количество фермента, которое способно катализировать гидролиз растворимого крахмала при температуре 30°С и значении рН 4,7, высвобождая за 1 мин 1 мкмоль глюкозы. Активность выражается в ед. ГлС/г (для порошкообразного) или ед. ГлС/см (для жидкого) анализируемого ферментного препарата.
5.1.4 Количество глюкозы, образующейся в результате ферментативного гидролиза крахмала, определяют глюкозооксидазным методом, основанным на действии ферментов глюкозооксидазы и пероксидазы.
Фермент глюкозооксидаза катализирует окисление -D-глюкозы кислородом воздуха до глюконовой кислоты с образованием перекиси водорода. Оба конечных продукта образуются в количествах, эквимолярных окисленной глюкозе. Перекись водорода под действием фермента пероксидазы окисляет ферроцианид калия (калий железистосинеродистый), который переходит в феррицианид калия, окрашенный в лимонно-желтый цвет, интенсивность окраски которого пропорциональна количеству глюкозы.
5.2 Средства измерений, вспомогательное оборудование, посуда и реактивы
5.2.1 Для определения глюкоамилазной активности применяют средства измерений, аппаратуру, лабораторную посуду, материалы, реактивы, указанные в 4.2.1, со следующими дополнениями:
- фотоэлектроколориметр (ФЭК) или спектрофотометр любого типа, которые обеспечивают измерения при длине волны 400 нм с погрешностью измерения коэффициента пропускания ±1% (не более 0,01 единицы оптической плотности) в кюветах с толщиной поглощающего свет слоя 10 мм;
- калий железистосинеродистый по ГОСТ 4207;
- D(+)-глюкозу по ГОСТ 6038;
- натрий уксуснокислый по ГОСТ 199;
- калия гидроокись (кали едкое) по ГОСТ 24363;
- глюкозооксидазу с активностью 100000-250000 ед./г;
- пероксидазу с активностью 250000-300000 ед./г;
- воду дистиллированную по ГОСТ 6709.
5.2.2 Все реактивы должны относиться к подгруппе чистоты 2 (х.ч.) или 3 (ч.д.а.).
5.2.3 Допускается применение средств измерений, вспомогательного оборудования с аналогичными метрологическими и техническими характеристиками, а также реактивов по качеству не хуже вышеуказанных.
5.3 Подготовка к анализу
5.3.1 Приготовление раствора крахмала массовой долей 1,0% (субстрат)
1,00 г крахмала в пересчете на абсолютно сухое вещество, учитывая влагу по ГОСТ Р 55802, помещают в мерную колбу вместимостью 100 см, добавляют 25 см
дистиллированной воды и перемешивают. Затем добавляют в колбу еще 25 см
воды, помещают колбу с содержимым в кипящую водяную баню не менее чем на 15-20 мин, непрерывно перемешивая содержимое до полного растворения крахмала. После этого содержимое колбы охлаждают, добавляют 10 см
ацетатного буферного раствора с рН 4,7 по 5.3.2, объем жидкости доводят до метки дистиллированной водой при температуре 20°С и содержимое колбы перемешивают. Для полученного раствора крахмала характерна легкая опалесценция.
Раствор крахмала готовят в день проведения анализа.
5.3.2 Приготовление ацетатного буферного раствора молярной концентрации 1 моль/дм с pH 4,7 из растворов уксуснокислого натрия и уксусной кислоты
Приготовление ацетатного буферного раствора молярной концентрации 1 моль/дм с рН 4,7 из растворов уксуснокислого натрия и уксусной кислоты проводят по 4.3.2.
(Измененная редакция, Изм. N 2).
5.3.3 Приготовление фосфатного буферного раствора молярной концентрации 1,0 моль/дм с рН 7,5 из растворов калия фосфорнокислого однозамещенного и едкого калия
5.3.3.1 Приготовление раствора с (![]() ) молярной концентрации 1,0 моль/дм
) молярной концентрации 1,0 моль/дм (раствор А)
(136,00±0,01) г безводного фосфорнокислого однозамещенного калия растворяют в 500 см дистиллированной воды, доводят объем раствора при температуре 20°С до 1 дм
и тщательно перемешивают.
5.3.3.2 Приготовление раствора гидроокиси калия молярной концентрации 1,0 моль/дм (раствор Б)
(56,00±0,01) г едкого калия растворяют в мерной колбе вместимостью 1 дм приблизительно в 500 см
дистиллированной воды, перемешивают, доводят объем до метки дистиллированной водой при температуре 20°С и тщательно перемешивают.
(Измененная редакция, Изм. N 2).
5.3.3.3 Для приготовления фосфатного буферного раствора молярной концентрации 1,0 моль/дм с рН 7,5 растворы А и Б смешивают в равных объемах.
Величину рН проверяют на рН-метре. В случае отклонения рН фосфатного буферного раствора от 7,5 его доводят до нужного значения растворами А или Б.
Срок хранения буферного раствора в закрытой стеклянной посуде при температуре 4°С - не более четырех недель.
5.3.4 Приготовление глюкозооксидазного реактива
Глюкозооксидазный реактив готовят, используя раствор железистосинеродистого калия массовой долей 0,1% и раствор глюкозооксидазы.
5.3.4.1 Приготовление раствора железистосинеродистого калия массовой долей 1,0% (раствор А)
(0,050±0,001) г железистосинеродистого калия количественно переносят в мерную колбу вместимостью 50 см и растворяют в дистиллированной воде. Объем раствора доводят до метки дистиллированной водой при температуре 20°С и перемешивают.
Раствор готовят непосредственно перед определением.
5.3.4.2 Приготовление раствора глюкозооксидазы (раствор Б)
(5,0-6,0) мг глюкозооксидазы растворяют фосфатным буферным раствором с рН 7,5 по 5.3.3 в мерной колбе вместимостью 50 см и затем добавляют 2,0 мг пероксидазы. Объем доводят до метки фосфатным буферным раствором.
Количество окисляемых ферментов с учетом их активности берут из такого расчета, чтобы в 50 см содержалось 500-600 ед. активности глюкозооксидазы, а пероксидазы - 600 ед. активности.
Срок хранения полученного раствора в темной склянке в холодильнике - не более 3 сут.
5.3.4.3 Приготовление рабочего раствора С
Рабочий раствор С готовят смешиванием равных объемов растворов А и Б.
Срок хранения полученного раствора в темной склянке в холодильнике - не более 3 сут.
5.3.5 Приготовление градуировочных растворов глюкозы
5.3.5.1 Приготовление основного градуировочного раствора глюкозы массовой концентрации 1 мг/см
В мерную колбу вместимостью 100 см помещают (0,1000±0,0001) г глюкозы, растворяют в дистиллированной воде, тщательно перемешивают и доводят объем до метки дистиллированной водой при температуре 20°С.
(Измененная редакция, Изм. N 2).
5.3.5.2 Приготовление рабочих градуировочных растворов глюкозы
Из основного раствора глюкозы отбирают поочередно по 5, 10 и 15 см в мерные колбы вместимостью 100 см
каждая и доводят объем до метки дистиллированной водой при температуре 20°С. Полученные растворы соответствуют содержанию глюкозы 50, 100 и 150 мкг глюкозы в 1 см
соответственно.
Эти растворы используют для построения градуировочного графика.
Рабочие градуировочные растворы глюкозы готовят в день построения градуировочного графика, при этом берут по три параллельных разведения для приготовления раствора глюкозы каждой концентрации.
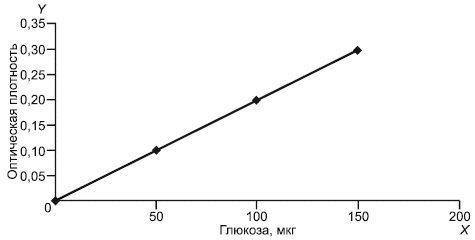
5.3.6 Построение градуировочного графика
В три пробирки размером 16150 мм вносят по 1,0 см
рабочих градуировочных растворов глюкозы различных массовых концентраций, добавляют по 3 см
рабочего раствора С (см. 5.3.4.3). В контрольную пробу (контроль на реактив С) вместо раствора глюкозы вносят 1 см
дистиллированной воды. Оставляют пробирки на 45 мин при температуре 20°С для развития окраски. Интенсивность окраски растворов глюкозы измеряют на фотоэлектроколориметре или спектрофотометре в диапазоне длины световой волны 400 нм в кюветах с толщиной поглощающего свет слоя 10 мм в сравнении с контрольной пробой на реактив С.
Рабочая зона градуировочного графика должна находиться в области содержания глюкозы в промеряемых растворах 50-150 мкг.
Оптическая плотность раствора должна быть близка к значениям 0,10±0,01; 0,20±0,01; 0,30±0,01.
По полученным значениям строят градуировочный график зависимости оптической плотности (поглощения) от содержания глюкозы в промеряемых растворах (мкг).
Для построения каждой точки градуировочного графика вычисляют среднеарифметическое значение оптической плотности трех параллельных измерений.
На оси абсцисс () откладывают содержание глюкозы в промеряемых растворах (
) в мкг; на оси ординат (
) - соответствующие значения оптической плотности (
) при
400 нм.
|
Градуировочный график строят каждый раз при приготовлении нового глюкозооксидазного реактива по 5.3.4, раствора глюкозы по 5.3.5, а также при замене прибора.
5.4 Подготовка пробы
5.4.1 Отбор проб - по ГОСТ Р 57248.
Анализируемые пробы порошкообразных или жидких ферментных препаратов допускается использовать без предварительной подготовки.
5.4.2 Приготовление основного раствора анализируемой пробы ферментного препарата
В стаканчик для взвешивания помещают 0,100 г порошкообразного ферментного препарата или 1,00 г жидкого ферментного препарата и суспендируют в небольшом количестве дистиллированной воды. Суспензию количественно переносят в мерную колбу вместимостью 100 см, доводят объем до метки дистиллированной водой при температуре 20°С и тщательно перемешивают.
5.4.3 Приготовление рабочего раствора анализируемой пробы ферментного препарата
Рабочий раствор анализируемого ферментного препарата готовят из основного раствора по 5.4.2 путем разведения его дистиллированной водой в зависимости от предполагаемой активности таким образом, чтобы при ее определении оптическая плотность раствора после проведения реакции с глюкозооксидазным реактивом находилась в пределах градуировочной зависимости.
Каждую пробу ферментного препарата анализируют дважды при соблюдении условий повторяемости по ГОСТ Р ИСО 5725-1-2002 (пункт 3.14).
Растворы готовят в день определения.
5.4.1-5.4.3. (Измененная редакция, Изм. N 2).
5.5 Проведение анализа
5.5.1 В две пробирки размером (16150) мм вносят по 2,0 см
субстрата (см. 5.3.1). Содержимое пробирок прогревают в ультратермостате при температуре (30,0±1,0)°С в течение 5 мин.
5.5.2 В пробирки с субстратом добавляют по 1,0 см рабочего раствора анализируемой пробы ферментного препарата (см. 5.4.3), предварительно прогретого при температуре 30°С, тщательно перемешивают и включают секундомер, отмечая начало ферментативной реакции. Реакционную смесь инкубируют при температуре (30,0±1,0)°С в течение 10 мин, отмечая время точно по секундомеру от начала ферментативной реакции.
5.5.3 По окончании реакции 1 см смеси переносят в другую сухую пробирку, помещают в кипящую водяную баню, выдерживают в течение 3 мин (для инактивации фермента) по секундомеру, после чего содержимое пробирки охлаждают холодной водой. Затем к смеси добавляют 3 см
раствора С, перемешивают и выдерживают 45 мин при комнатной температуре для развития окраски.
5.5.4 Интенсивность желтой окраски соединения, образующегося в результате действия глюкозооксидазного реактива (см. 5.3.4), измеряют на фотоэлектроколориметре или спектрофотометре в диапазоне длин волн 400 нм в кюветах с толщиной поглощающего свет слоя 10 мм против контрольной пробы на фермент (см. 5.5.5). Значение оптической плотности должно лежать в пределах, соответствующих массе глюкозы в промеряемом растворе от 25 до 125 мг*.
________________
* Текст документа соответствует оригиналу. - .
Если при измерении интенсивности окраски анализируемой пробы полученные значения не соответствуют указанному диапазону, то опыт повторяют с меньшим или большим количеством основного раствора ферментного препарата (см. 5.4.2), используемого для приготовления рабочего раствора (см. 5.4.3).
5.5.5 Контрольная проба на фермент
Около 2 см рабочего раствора ферментного препарата (см. 5.4.3) выдерживают в кипящей водяной бане в течение 1 ч (для инактивации фермента). К 2 см
раствора крахмала по 5.3.1 добавляют охлажденного после инактивации 1 см
рабочего раствора анализируемой пробы ферментного препарата и выдерживают в термостате в течение 10 мин. Затем в сухую пробирку отбирают 1 см
содержимого контрольной пробирки и последующие операции осуществляют по 5.5.3.
(Измененная редакция, Изм. N 1).
5.6 Обработка результатов
5.6.1 Глюкоамилазную активность ГлС в анализируемой пробе, ед. ГлС/г (для порошкообразного препарата) или ед. ГлС/см (для жидкого препарата), вычисляют по формуле
![]() , (8)
, (8)
где - масса глюкозы, образовавшейся в реакционной смеси за счет действия фермента, найденная по градуировочному графику, мкг;
3 - коэффициент, учитывающий трехкратное разбавление рабочего раствора ферментного препарата непосредственно в реакционной смеси;
- масса ферментного препарата с учетом разведения по 5.4.3, взятая для испытания, г;
180 - молекулярная масса глюкозы, мкг/мкмоль;
10 - время гидролиза, мин;
- плотность ферментного препарата по ГОСТ 18481 (для жидкого препарата), г/см
.
Вычисления проводят до второго десятичного знака с последующим округлением до первого десятичного знака, если полученное значение глюкоамилазной активности 100 ед. ГлС/г (см) и менее. Вычисления проводят до первого десятичного знака с последующим округлением до целого числа, если полученное значение глюкоамилазной активности более 100 ед. ГлС/г (см
).
(Измененная редакция, Изм. N 2).
5.6.2 Оформление результатов измерений
За окончательный результат принимают среднеарифметическое значение двух параллельных определений, выполненных в условиях повторяемости, если выполняется условие приемлемости.
Результат анализа в документах, предусматривающих его использование, представляют в виде
![]() при
при 0,95,
где - среднеарифметическое значение результатов двух параллельных определений, признанных приемлемыми (5.7.1), ед. ГлС/г (для порошкообразного препарата) или ед. ГлС/см
(для жидкого препарата);
- значение границ абсолютной погрешности измерений, ед. ГлС/г (для порошкообразного препарата) или ед. ГлС/см
(для жидкого препарата), определяемое по формуле
![]() , (9)
, (9)
где - границы относительной погрешности результата анализа глюкоамилазной активности в анализируемом образце при
0,95 составляют ±8%.
5.7 Сходимость и воспроизводимость результатов
5.7.1 Результаты измерений, полученные в условиях повторяемости (сходимости), признаются удовлетворительными, если выполняется условие приемлемости
![]() , (10)
, (10)
где и
- результаты двух параллельных определений, полученные в условиях повторяемости при
0,95, ед. ГлС/г (для порошкообразного препарата) или ед. ГлС/см
(для жидкого препарата);
- среднеарифметическое значение двух параллельных определений, ед. ГлС/г (для порошкообразного препарата) или ед. ГлС/см
(для жидкого препарата);
- предел повторяемости (сходимости), равный 8%.
5.7.2 Результаты измерений, полученные в условиях воспроизводимости по ГОСТ Р ИСО 5725-2, признаются удовлетворительными, если выполняется условие приемлемости
![]() , (11)
, (11)
где и
- окончательные результаты измерений, полученные в двух лабораториях в точном соответствии с методикой, ед. ГлС/г (для порошкообразного препарата) или ед. ГлС/см
(для жидкого препарата);
- среднеарифметическое значение двух окончательных результатов измерений, полученных в условиях воспроизводимости, ед. ГлС/г (для порошкообразного препарата) или ед. ГлС/см
(для жидкого препарата);
![]() - критическая разность, равная 10%.
- критическая разность, равная 10%.
(Измененная редакция, Изм. N 1).
6 Требования к условиям измерений
При выполнении измерений в лаборатории должны соблюдаться следующие условия:
температура окружающего воздуха | (20±1)°С; |
относительная влажность воздуха | (70±10)%; |
атмосферное давление | (84,0 |
напряжение в сети | (220±10) В. |
Библиография
[1] | Enzyme Nomenclature, recommendations of the nomenclature Committee of the IUB//N.Y., Academic Press - 1984 |
[2] | Полыгалина Г.В., Чередниченко B.C., Римарева Л.В. Определение активности ферментов: справочник. - М.: ДеЛи принт, 2003 |
УДК 577.15:543.06:006.354 | ОКС 07.100.30 | Н09 | ОКСТУ 9291 |
Ключевые слова: препараты ферментные, активность | |||
Электронный текст документа
и сверен по:
, 2018