ГОСТ ISO 6785-2015
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МОЛОКО И МОЛОЧНАЯ ПРОДУКЦИЯ
Обнаружение Salmonella spp.
Milk and milk products. Detection of Salmonella spp.
МКС 07.100.30
Дата введения 2017-07-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-2015 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2015 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН научно-производственным республиканским унитарным предприятием "Белорусский государственный институт стандартизации и сертификации" (БелГИСС) на основе собственного перевода на русский язык англоязычной версии указанного в пункте 4 стандарта
2 ВНЕСЕН Государственным комитетом по стандартизации Республики Беларусь
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 февраля 2015 г. N 75-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Украина | UA | Минэкономразвития Украины |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 7 июня 2016 г. N 550-ст межгосударственный стандарт ГОСТ ISO 6785-2015 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2017 г.
5 Настоящий стандарт идентичен международному стандарту ISO 6785:2001/IDF 93:2001* "Молоко и молочные продукты. Обнаружение Salmonella spp." ("Milk and milk products - Detection of Salmonella spp.", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Международный стандарт разработан подкомитетом SC 5 "Молоко и молочные продукты" Технического комитета по стандартизации ISO/TC 34 "Пищевые продукты" Международной организации по стандартизации (ISO) и Международной молочной федерацией (IDF) совместно с Международной ассоциацией химиков-аналитиков (AOAC International).
Официальные экземпляры международного стандарта, на основе которого подготовлен настоящий межгосударственный стандарт, и международного стандарта, на который дана ссылка, имеются в Федеральном агентстве по техническому регулированию и метрологии.
Наименование настоящего стандарта изменено относительно наименования международного стандарта в связи с особенностями системы межгосударственной стандартизации.
В разделе "Нормативные ссылки" и тексте стандарта ссылки на международный стандарт актуализированы.
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
1 Область применения
Настоящий стандарт устанавливает метод обнаружения Salmonella spp. (далее - сальмонеллы) в молоке и молочной продукции.
2 Нормативные ссылки
Для применения настоящего стандарта необходим следующий ссылочный стандарт*:
_______________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ISO 8261:2001/IDF 122:2001 Milk and milk products - General guidance for the preparation of test samples, initial suspensions and decimal dilutions for microbiological examination (Молоко и молочные продукты. Общие руководства по подготовке испытательных проб, исходных суспензий и десятикратных разведений для микробиологического исследования)
________________
Действует только для применения настоящего стандарта.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 сальмонеллы (Salmonella): Микроорганизмы, образующие типичные колонии на плотных селективных питательных средах и имеющие биохимические и серологические характеристики, описанные в настоящем стандарте.
3.2 обнаружение сальмонелл (detection of Salmonella): Определение присутствия или отсутствие этих микроорганизмов в конкретной массе или объеме по методу, установленному в настоящем стандарте.
4 Сущность метода
4.1 Общие положения
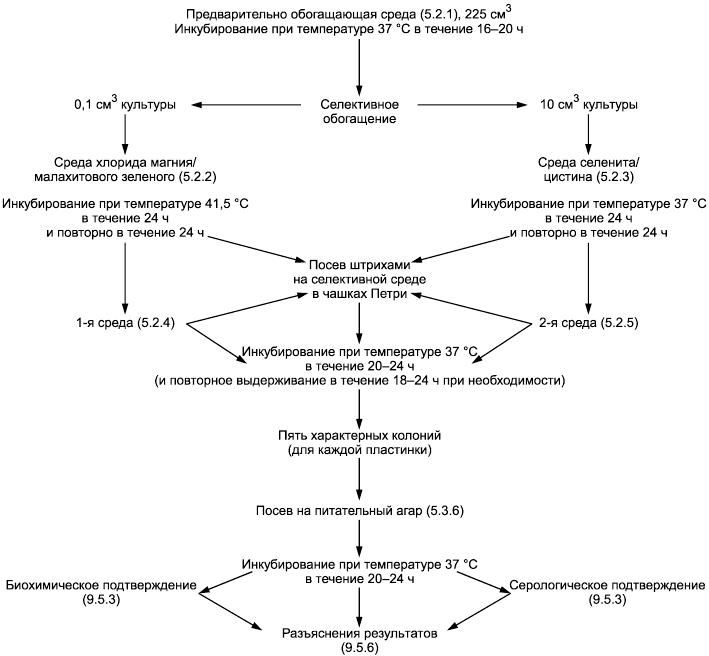
Обнаружение сальмонелл проходит в четыре этапа (см. приложение A).
4.2 Предварительное обогащение в жидкой неселективной среде
Для предварительного обогащения среду инокулируют рабочей частью пробы и инкубируют при температуре 37°C в течение 16-20 ч.
4.3 Обогащение в селективной жидкой среде
Модифицированные среды хлорида магния/малахитового зеленого Раппапорта - Вассилиадиса и селенита/цистина инокулируют культурой, полученной после инкубирования по 4.2.
Инкубирование модифицированной среды хлорида магния/малахитового зеленого Раппапорта - Вассилиадиса на водяной бане или в термостате (6.4) осуществляют при температуре 41,5°C в течение 24 ч, а затем еще в течение 24 ч.
Инкубирование среды селенита/цистина в термостате (6.3) осуществляют при температуре 37°C в течение 24 ч, а затем еще в течение 24 ч.
4.4 Посев штрихами и идентификация
Полученные культуры (4.3) высевают в две плотные селективные среды (малахитовый зеленый/феноловый красный агар и любую другую подходящую плотную селективную среду).
Примечание - Соответствующие среды позволяют выявить лактозо-ферментирующие штаммы сальмонелл.
Инкубирование посевов на агаре с бриллиантовым зеленым и феноловым красным осуществляют в термостате (6.3) при температуре 37°C и контролируют через 20-24 ч, а при необходимости - еще раз через 40-48 ч и отмечают присутствие типичных колоний, которые по своим характеристикам могут быть сальмонеллами.
Инкубирование второй плотной селективной среды осуществляют при соответствующей температуре и в течение соответствующего времени, через которое отмечают присутствие колоний, по своим характеристикам рассматривающихся как предполагаемые сальмонеллы.
4.5 Подтверждение
Проводят субкультивирование колоний предполагаемых сальмонелл (4.4) и подтверждают посредством соответствующих биохимических и серологических испытаний.
5 Питательная среда, реактивы и сыворотки
Для получения сопоставимых результатов при приготовлении питательных сред следует использовать безводные основные компоненты или безводные готовые среды и четко следовать инструкциям изготовителя. Используют только реактивы признанного аналитического качества.
Значения pH измеряют при температуре 25°C. При необходимости осуществляют регулирование pH посредством добавления соляной кислоты [c (HCl)=1 моль/дм] или раствора едкого натрия [c (NaOH)=1 моль/дм
].
Приготовленную питательную среду и реактивы, если их не применяют сразу же, хранят при условиях, которые не вызывают никаких изменений в их составе, в темном месте при температуре от 0°C до 5°C не более 1 мес, если не установлено иное.
5.1 Вода
Должна использоваться дистиллированная или деминерализованная вода или вода эквивалентной чистоты. В ней не должны присутствовать вещества, которые могут препятствовать росту микроорганизмов в условиях, установленных для испытаний в настоящем стандарте.
5.2 Питательные среды
5.2.1 Предварительно обогащенная среда. Забуферная пептонная вода
5.2.1.1 Состав
Пептон, г | 10,0 |
Хлорид натрия (NaCl), г | 5,0 |
Гидрофосфат натрия (Na | 9,0 |
Дигидрофосфат калия (KH | 1,5 |
Вода, мл | 1000 |
5.2.1.2 Приготовление
Растворяют все компоненты в воде, при нагревании. Устанавливают pH так, чтобы после стерилизации его значение составляло 7,0±0,1 ед. pH.
Среду разливают по 225 см в колбы (6.9) вместимостью 500 см
(или в количестве, кратном 225 см
, помещают в другие колбы соответствующей вместимости). Стерилизуют в автоклаве (6.1) при температуре 121°C в течение 15 мин. Охлаждают до комнатной температуры.
5.2.2 Первая селективная обогащающая среда. Модифицированная среда хлорида магния/малахитового зеленого Раппапорта - Вассилиадиса (RVS-бульон)
5.2.2.1 Раствор A
5.2.2.1.1 Состав
Ферментативный гидролизат соевой муки, г | 5,0 |
Хлорид натрия (NaCl), г | 8,0 |
Дигидрофосфат калия (KH | 1,4 |
Гидрофтофосфат калия (K | 0,2 |
Вода, см | 1000 |
5.2.2.1.2 Приготовление
Компоненты растворяют в воде, нагревая ее приблизительно до температуры 70°C. Раствор A готовят в день приготовления RVS-бульона.
5.2.2.2 Раствор B
5.2.2.2.1 Состав
Гексагидрат хлорида магния (MgСl | 400,0 |
Вода, см | 1000 |
5.2.2.2.2 Приготовление
Гексагидрат хлорида магния растворяют в воде. Так как эта соль является очень гигроскопичной, то все содержимое MgСl·6H
O растворяют непосредственно после открытия контейнера. Например, 250 г MgСl
·6H
O добавляют к 625 см
воды, получают раствор объемом 795 см
с концентрацией приблизительно 0,3 г/см
MgСl
·6H
O.
Раствор B можно хранить в герметичной бутылке из темного стекла при комнатной температуре в течение двух лет.
5.2.2.3 Раствор C
5.2.2.3.1 Состав
Малахитовый зеленый оксалат, г | 0,4 |
Вода, см | 100 |
5.2.2.3.2 Приготовление
Растворяют малахитовый зеленый оксалат в воде.
Раствор C можно хранить в герметичной бутылке из темного стекла при комнатной температуре в течение 8 мес.
5.2.2.4 Готовая среда
5.2.2.4.1 Состав
Раствор A (5.2.2.1), см | 1000 |
Раствор B (5.2.2.2), см | 100 |
Раствор C (5.2.2.3), см | 10 |
5.2.2.4.2 Приготовление
К 1000 см раствора A добавляют 100 см
раствора B и 10 см
раствора C. Устанавливают pH так, чтобы после стерилизации его значение составляло 5,2±0,1 ед. pH. Полученный таким образом раствор в количестве 10 см
помещают в пробирки (6.9) или стерильные колбы (6.8) подходящей вместимости, чтобы получить пробы, необходимые для испытания. Стерилизуют в автоклаве (6.1) при температуре 115°C в течение 15 мин.
Хранят приготовленную среду в холодильнике при температуре (3±2)°C.
5.2.3 Вторая селективная обогащающая среда. Среда селенита/цистина
Предупреждение - Особую осторожность следует проявлять при лабораторном использовании селенитовых растворов из-за их токсичности. Запрещается набирать жидкость в пипетку ртом.
5.2.3.1 Состав
Триптон, г | 5,0 |
Лактоза, г | 4,0 |
Гидрофосфат натрия (Na | 10,0 |
Натрий гидрогенселенит, г | 4,0 |
Вода, см | 1000 |
5.2.3.2 Приготовление
Первые три основных компонента растворяют в воде путем кипячения в течение 5 мин. После охлаждения добавляют натрий гидрогенселенит. Устанавливают pH так, чтобы его значение составляло 7,0±0,1 ед. pH. Не стерилизуют.
5.2.3.3 Раствор L-цистина
5.2.3.3.1 Состав
L-Цистин, г | 0,1 |
Раствор гидроксида натрия, с (NaOH)=1 моль/дм | 15 |
Стерильная вода, см | 85 |
5.2.3.3.2 Приготовление
Компоненты помещают в стерильную мерную колбу с одним делением вместимостью 100 см. Разбавляют до метки стерильной водой. Не стерилизуют.
5.2.3.4 Готовая среда
5.2.3.4.1 Состав
Основа (5.2.3.1), см | 1000 |
Раствор L-цистина (5.2.3.2), см | 10 |
5.2.3.4.2 Приготовление
Раствор L-цистина добавляют к основе с соблюдением правил асептики. Устанавливают pH 7,0±0,1 ед. pH. Разливают среду с соблюдением правил асептики в стерильные колбы подходящей вместимости, чтобы получить пробы, необходимые для испытания.
Среду можно использовать до тех пор, пока не появится осадок красного цвета.
5.2.4 Первая плотная селективная среда. Агар с бриллиантовым зеленым/феноловым красным (Эделя - Кампельмахера)
5.2.4.1 Состав
Порошок мясного экстракта, г | 5,0 |
Пептон, г | 10,0 |
Порошок дрожжевого экстракта, г | 3,0 |
Гидроортофосфат натрия (Na | 1,0 |
Дигидрофосфат натрия (NaH | 0,6 |
Агар, г | 12-18 |
Вода, см | 900 |
| |
5.2.4.2 Приготовление
Компоненты или безводную готовую основу растворяют в воде, при необходимости нагревая. Устанавливают pH так, чтобы после стерилизации его значение составляло 7,0 ±0,1 ед. pH. Основу переносят в пробирки (6.9) или колбы (6.8) соответствующей вместимости. Стерилизуют в автоклаве (6.1) при температуре 121°C в течение 15 мин.
5.2.4.3 Раствор сахара/фенолового красного
5.2.4.3.1 Состав
Лактоза, г | 10,0 |
Сахароза, г | 10,0 |
Феноловый красный, г | 0,09 |
Вода, см | 80 |
5.2.4.3.2 Приготовление
Компоненты растворяют в 50 см воды в мерной колбе с одной меткой вместимостью 100 см
. Добавляют воды до метки. Раствор нагревают на водяной бане (6.5) при температуре 70°C в течение 20 мин. Охлаждают на другой водяной бане (6.5) при температуре 55°C. Используют раствор сразу после его охлаждения.
5.2.4.4 Раствор бриллиантового зеленого
5.2.4.4.1 Состав
Бриллиантовый зеленый (см. спецификацию в приложении B), г | 0,5 |
Вода, см | 100 |
5.2.4.4.2 Приготовление
Бриллиантовый зеленый растворяют в воде. Хранят раствор не менее одних суток в темном месте, чтобы произошла самостерилизация.
5.2.4.5 Готовая среда
5.2.4.5.1 Состав
Основа (5.2.4.1), см | 900 |
Раствор сахара/фенолового красного (5.2.4.2), см | 100 |
Раствор бриллиантового зеленого (5.2.4.3), см | 1 |
5.2.4.5.2 Приготовление
Раствор бриллиантового зеленого (5.2.4.3) добавляют с соблюдением правил асептики к раствору сахара/фенолового красного (5.2.4.2), охлажденному на водяной бане (6.5), примерно при температуре 55°C. Все это добавляют к основе, предварительно нагретой в водяной бане до температуры 55°C, и перемешивают. Во время перемешивания температура водяной бани должна поддерживаться в диапазоне от 50°C до 55°C.
5.2.4.5.3 Подготовка агаровых пластинок
Помещают в каждую из соответствующего количества больших чашек Петри (6.12) приблизительно 40 см свежеприготовленной готовой среды (5.2.4.4). При отсутствии больших чашек среду в объеме приблизительно 15 см
помещают в маленькие чашки Петри (6.12). Дают затвердеть. Если агаровые пластинки были приготовлены заранее, то их хранят не более 4 ч при комнатной температуре или в течение не более 1 недели при температуре от 0°C до 5°C.
Непосредственно перед использованием агаровые пластинки тщательно просушивают (желательно со снятыми крышками и агаровой поверхностью вниз) в печи (6.2) при температуре 50°C или в ламинарном вытяжном шкафу (6.2) до тех пор, пока поверхность не станет сухой.
5.2.5 Вторая селективная плотная среда
Выбор второй среды остается за испытательной лабораторией.
5.2.6 Питательный агар
5.2.6.1 Состав
Мясной экстракт, г | 3,0 |
Пептон, г | 5,0 |
Агар, г | 12-18 |
Вода, см | 1000 |
| |
5.2.6.2 Приготовление
Компоненты или безводную готовую среду растворяют в воде, при необходимости нагревая. Устанавливают pH так, чтобы после стерилизации его значение составляло 7,0±0,1 ед. рН. Питательную среду переносят в пробирки (6.9) или бутылки (6.8) соответствующей емкости. Стерилизуют в автоклаве (6.1) при температуре 121°C в течение 15 мин.
5.2.6.3 Подготовка агаровых пластинок
Переносят приблизительно 15 см расплавленной среды в стерильные мелкие чашки Петри (6.12) и выполняют действия в соответствии с 5.2.4.4.3.
5.2.7 Трехсахарный железистый агар (TSI-агар)
5.2.7.1 Состав
Мясной экстракт, г | 3,0 |
Дрожжевой экстракт, г | 3,0 |
Пептон, г | 20,0 |
Хлорид натрия, г | 5,0 |
Лактоза, г | 10,0 |
Сахароза, г | 10,0 |
Глюкоза, г | 1,0 |
Цитрат железа (III), г | 0,3 |
Тиосульфат натрия, г | 0,3 |
Феноловый красный, г | 0,024 |
Агар, г | 12-18 |
Вода, см | 1000 |
| |
5.2.7.2 Приготовление
Компоненты или безводную готовую среду растворяют в воде, при необходимости нагревая. Устанавливают pH так, чтобы после стерилизации его значение составляло 7,4±0,1 ед. рН. Разливают среду по 10 см в пробирки (6.9) диаметром 17-18 мм. Стерилизуют в автоклаве (6.1) при температуре 121°C в течение 15 мин. Допускается устанавливать пробирки в наклонном положении так, чтобы получился столбик высотой 2,5 см и уклоном 4-5 см.
5.2.8 Агар с мочевиной (Кристенсена)
5.2.8.1 Состав
Пептон, г | 1,0 |
Глюкоза, г | 1,0 |
Хлорид натрия, г | 5,0 |
Дигидофосфат калия (KH | 2,0 |
Феноловый красный, г | 0,012 |
Агар, г | 12-18 |
Вода, см | 1000 |
| |
5.2.8.1.1 Приготовление
Компоненты или безводную готовую основу растворяют в воде, при необходимости нагревая. Устанавливают pH так, чтобы после стерилизации его значение составляло 6,8±0,1 ед. рН. Стерилизуют в автоклаве (6.1) при температуре 121°C в течение 15 мин.
5.2.8.2 Раствор мочевины
5.2.8.2.1 Состав
Мочевина, г | 400 |
Вода до общего объема, см | 1000 |
5.2.8.2.2 Приготовление
Мочевину растворяют в воде, стерилизуют фильтрованием и проверяют стерильность. (Подробности способа стерилизации фильтрованием можно найти в соответствующем руководстве по микробиологии).
5.2.8.3 Готовая среда
5.2.8.3.1 Состав
Основа (5.2.8.1), г | 950 |
Раствор мочевины (5.2.8.2), см | 50 |
5.2.8.3.2 Приготовление
Раствор мочевины добавляют с соблюдением правила септики к основе, предварительно расплавленной и затем охлажденной в водяной бане (6.5) до температуры 45°C. Готовую среду распределяют в стерильные пробирки (6.9) в количестве 10 см. Пробирки устанавливают в наклонном положении.
5.2.9 L-лизин декарбоксилазная среда
5.2.9.1 Состав
Моногидрохлорид L-лизина, г | 5,0 |
Дрожжевой экстракт, г | 3,0 |
Глюкоза, г | 1,0 |
Брокрезоловый пурпурный, г | 0,015 |
Вода, см | 1000 |
5.2.9.2 Приготовление
Компоненты растворяют в воде, при необходимости нагревая. Устанавливают pH так, чтобы после стерилизации его значение составляло 6,8±0,1. Среду переносят в количестве 5 см в узкие пробирки для среды (6.9). Стерилизуют в автоклаве (6.1) при температуре 121°C в течение 15 мин.
5.3 Реактивы
5.3.1 Солевой раствор
5.3.1.1 Состав
Хлорид натрия, г | 8,5 |
Вода, см | 1000 |
5.3.1.2 Приготовление
Хлорид натрия растворяют в воде, при необходимости нагревая. Устанавливают pH так, чтобы после стерилизации его значение составляло 7,0±0,1 ед. рН. Раствор переносят в колбы (6.8) или пробирки (6.9) так, чтобы после стерилизации его количество составляло 90-100 см. Стерилизуют в автоклаве (6.1) при температуре 121°C в течение 15 мин.
5.3.2 Реактив -галактозидазы
5.3.2.1 Толуол
5.3.2.2 Буферный раствор
5.3.2.2.1 Состав
Дигидрофосфат натрия (NaН | 6,9 |
Гидроксид натрия, раствор 10 моль/дм | 3 |
Вода, см | 50 |
5.3.2.2.2 Приготовление
Дигидрофосфат натрия растворяют в 45 см воды в мерной колбе вместимостью 50 см
с одной меткой. Регулируют pH раствором гидроокисида натрия так, чтобы его значение составляло 7,0±0,1 ед. рН. Добавляют воды до метки.
5.3.2.3 Раствор ONPG
5.3.2.3.1 Состав
о-Нитрофенил | 0,08 |
Вода, см | 15 |
5.3.2.3.2 Приготовление
Растворяют ONPG в воде, предварительно нагрев ее до температуры (50±0,1)°C. Охлаждают раствор до комнатной температуры.
5.3.2.4 Готовый реактив
5.3.2.4.1 Состав
Буферный раствор (5.3.2.2), см | 5 |
Раствор ONPG (5.3.2.3), см | 15 |
5.3.2.4.2 Приготовление
Буферный раствор добавляют в раствор ONPG.
5.3.3 Реактивы для реакции Фогеса - Проскауэра (VP)
5.3.3.1 Среда VP
5.3.3.1.1 Состав
Пептон, г | 7,0 |
Глюкоза, г | 5,0 |
Гидроортофосфат калия (K | 5,0 |
Вода, см | 1000 |
5.3.3.1.2 Приготовление
Компоненты растворяют в воде, при необходимости нагревая. Устанавливают pH так, чтобы после стерилизации его значение составляло 6,9±0,1 ед. рН. Переносят 3 см полученной таким образом VP-среды в каждую из нескольких пробирок (6.9). Стерилизуют в автоклаве (6.1) при температуре 115°C в течение 20 мин.
5.3.3.2 Раствор креатина (N-амидиносаркозина)
5.3.3.2.1 Состав
Моногидрат креатина, г | 0,5 |
Вода, см | 1000 |
5.3.3.2.2 Приготовление
Моногидрат креатина растворяют в воде.
5.3.3.3 1-нафтол, спиртовой раствор
5.3.3.3.1 Состав
1-нафтол, г | 6 |
Этанол, 96% (объемная доля), см | 100 |
5.3.3.3.2 Приготовление
Растворяют 1-нафтол в этиловом спирте.
5.3.3.4 Раствор гидроксида калия
5.3.3.4.1 Состав
Гидроксид калия, г | 40 |
Вода, см | 100 |
5.3.3.4.2 Приготовление
Растворяют гидроксид калия в воде.
5.3.4 Реактивы для индоловой реакции
5.3.4.1 Триптоновая/триптофановая среда
5.3.4.1.1 Состав
Триптон, г | 10 |
Хлорид натрия, г | 5 |
DL-триптофан, г | 1 |
Вода, см | 1000 |
5.3.4.1.2 Приготовление
Компоненты растворяют в воде при температуре 100°C на кипящей водяной бане (6.5). При необходимости устанавливают pH так, чтобы после стерилизации его значение составляло 7,5±0,1 ед. рН. Приготовленную таким образом среду распределяют по 5 см в каждую из нескольких пробирок (6.9). Стерилизуют в автоклаве (6.1) при температуре 121°C в течение 15 мин.
5.3.4.2 Реактив Ковача
5.3.4.2.1 Состав
4-диметиламинобензальдегид, г | 5 |
Соляная кислота, | 25 |
3-Метилбутан-2-ол, см | 75 |
5.3.4.2.2 Приготовление
Вышеуказанные компоненты смешивают.
5.3.5 Полужидкий питательный агар
5.3.5.1 Состав
Мясной экстракт, г | 3,0 |
Пептон, г | 5,0 |
Агар, г | 4-9 |
Вода, см | 1000 |
|
5.3.5.2 Приготовление
Компоненты растворяют в воде, при необходимости нагревая. При необходимости устанавливают pH так, чтобы после стерилизации его значение составляло 7,0±0,1 ед. рН. Среду переносят в колбы (6.8) соответствующей емкости. Стерилизуют в автоклаве (6.1) при температуре 121°C в течение 15 мин.
5.3.5.3 Подготовка агаровых пластинок
В маленькие стерильные чашки Петри (6.12) помещают приблизительно 15 см свежеприготовленной среды. Агаровые пластинки не высушивают.
5.4 Сыворотки
Некоторые агглютинирующие сыворотки, содержащие антитела для одного или нескольких O-антигенов, продаются в готовом виде, а именно: антисыворотка, содержащая одну или несколько "O"-групп (так называемая моно- или поливалентная анти-O-сыворотка), анти-Vi-сыворотка и сыворотка, содержащая антитела для одного или нескольких H-антигенов (так называемая моно- или поливалентная анти-H-сыворотка). Следует обеспечить использование соответствующих антисывороток, которые позволяют обнаружить все серологические характеристики сальмонелл.
6 Оборудование и стеклянная посуда
Одноразовая посуда является приемлемой альтернативой лабораторной посуде многократного использования, если она имеет соответствующие технические характеристики.
Для проведения измерений используют стандартное микробиологическое лабораторное оборудование, в том числе перечисленное ниже.
6.1 Аппаратура для влажной стерилизации (автоклав), способная выполнять стерилизацию при температуре (121±1)°C и (115±1)°C.
6.2 Печь с конвекторной вентиляцией, способная поддерживать температуру (50±5)°C, или ламинарный вытяжной шкаф.
6.3 Термостат, способный поддерживать температуру (37±1)°C.
6.4 Водяная баня или термостат, способные поддерживать температуру (41,5±1)°C.
6.5 Водяные бани, способные поддерживать температуру (37±1)°C, (45±1)°C, (55±1)°C, (70±1)°C соответственно и обеспечивать кипение.
6.6 Петли, изготовленные из платины/иридия или никеля/хрома, диаметром приблизительно 3 мм.
6.7 Измеритель pH, имеющий точность калибровки ±0,1 единицы pH при 25°C.
6.8 Бутылки или колбы для среды, с нетоксическими металлическими или пластиковыми закручивающимися крышками.
6.9 Пробирки для среды диаметром 8 мм и длиной 160 мм или других соответствующих размеров.
6.10 Мерные цилиндры.
6.11 Градуированные пипетки или автоматизированные пипетки номинальной вместимостью 10 и 1 см с ценой деления 0,5 и 0,1 см
соответственно.
6.12 Чашки Петри, маленькие (диаметром 90-100 мм) и/или большие (диаметром 140 мм).
7 Отбор проб
Отбор проб не является частью метода, установленного в настоящем стандарте. Рекомендуемый метод отбора проб установлен в [1].
В лабораторию должна быть доставлена представительная проба. Во время транспортирования и хранения не допускается какое-либо ее изменение или порча.
8 Подготовка пробы для испытания
Пробу для испытания подготавливают в соответствии с ISO 8261/IDF 122.
9 Проведение испытания
9.1 Меры предосторожности
В соответствии с разделом 12.
9.2 Рабочая часть пробы и предварительное обогащение
9.2.1 Общие положения
Для подготовки первичного разбавления 25 г пробы для испытания (раздел 8) добавляют к 225 см предварительно обогащенной среды (5.2.1). Если проба для испытания меньше, чем 25 г, используют необходимое количество предварительно обогащенной среды, исходя из соотношения 1:10.
9.2.2 Продукты из сырого молока, пастеризованного молока и цельного молока
25 см пробы для испытания (раздел 8) пипеткой переносят в колбу (6.8), содержащую 225 см
предварительно обогащенной среды (5.2.1), и перемешивают.
9.2.3 Сухие продукты из молока
Подготавливают закрывающуюся колбу (6.8) с 225 см предварительно обогащенной среды (5.2.1).
Взвешивают 25 г пробы для испытания (раздел 8) с соблюдением правил антисептики и выливают ее на поверхность жидкости в колбе. Колбу закрывают крышкой, но не встряхивают. Дают постоять в спокойном состоянии при комнатной температуре в течение (60 ± 10) мин перед инкубированием. Регулировка pH не требуется.
Если спустя час сухой продукт по-прежнему не растворился, содержимое колбы встряхивают вручную или перемешивают с помощью стерильного шпателя.
9.2.4 Лактоза
Взвешивают 25 г пробы для испытания (раздел 8) с соблюдением правил антисептики и помещают в закрывающуюся колбу (6.8), содержащую 225 см предварительно обогащенной среды (5.2.1), и встряхивают с целью ее растворения.
9.2.5 Казеин, казеинаты, сыр
Взвешивают 25 г пробы для испытания (раздел 8) с соблюдением правил антисептики и переносят в стерильный контейнер высокоскоростного миксера или миксера перистальтического типа. Добавляют 225 см предварительно обогащенной среды (5.2.1), предварительно нагретой до температуры 45°C. Смешивают до тех пор, пока проба для испытания не диспергируется равномерно (1-3 мин).
Температура диспергирования не должна превышать 45°C.
9.2.6 Сливочное масло
Встряхивают расплавленную пробу для испытания (раздел 8). 25 см пробы для испытания, предварительно нагретой до температуры приблизительно 45°C, переносят пипеткой в колбу (6.8), содержащую 225 см
предварительно обогащенной среды (5.2.1) и перемешивают.
9.2.7 Замороженные молочные продукты (включая пищевой лед)
25 см растопленной пробы для испытания (раздел 8), предварительно нагретой до температуры не более 37°C, переносят пипеткой в колбу (6.8), содержащую 225 см
предварительно обогащенной среды (5.2.1), и перемешивают.
9.2.8 Кисломолочные продукты, йогурт, крема, десерты
Взвешивают 25 г пробы для испытания (раздел 8) с соблюдением правил антисептики в закрывающуюся колбу (6.8), содержащую стеклянные шарики и 225 см предварительно обогащенной среды (5.2.1), и перемешивают с целью диспергирования.
Для уменьшения объема работы, когда необходимо проверить более чем 25 г из конкретной партии молока или молочной продукции и когда очевидно, что объединение (смешивание рабочих частей проб) не влияет на результат испытания, рабочие части проб для испытания объединяют. Например, если необходимо проверить 10 проб для испытания по 25 г, их объединяют в общую пробу для испытания массой 250 г и растворяют или диспергируют в 2,25 дм предварительно обогащенной среды.
В качестве альтернативы 0,1 см (RV-среды) и 10 см
(среды селенит/цистина) проб предварительно обогащенных бульонов для 10 отдельных проб могут быть объединены для обогащения с 0,1 дм
и 1 дм
селективной среды соответственно.
Проверяют pH суспензии и устанавливают pH 6,8±0,1 ед. рН.
9.3 Обогащение
9.3.1 Неселективное предварительное обогащение
Колбы, подготовленные в соответствии с 9.2.2-9.2.8, инкубируют в термостате (6.3) при температуре 37°C в течение 16-20 ч.
9.3.2 Селективное обогащение
9.3.2.1 0,1 см культуры, полученной в соответствии с 9.3.1, переносят в пробирку, предназначенную для среды (6.9), которая содержит 10 см
RVS-бульона (5.2.2). Переносят 10 см
культуры, полученной в соответствии с 9.3.1, в колбу (6.8), содержащую 100 см
среды селенита/цистина (5.2.3).
9.3.2.2 Инкубируют RVS-бульон (9.3.2.1) на водяной бане или в термостате (6.4) при температуре 41,5°C в течение 18-24 ч. Инокулированную среду селенита/цистина (9.3.2.1) инкубируют в термостате (6.3) при температуре 37°C в течение 18-24 ч.
9.4 Посев штрихами и идентификация
9.4.1 Культуру, полученную на RVS (9.3.2.2) (после инкубирования в течение 18-24 ч), высевают с помощью петли (6.6) на поверхность одной большой чашки Петри (6.12), содержащей бриллиантовый зеленый/феноловый красный агар (5.2.4), таким образом, чтобы были получены хорошо изолированные колонии.
При отсутствии больших чашек используют две маленькие чашки одну за другой, используя одну и ту же петлю.
9.4.1.1 Метод посева штрихами при использовании бриллиантового зеленого/фенолового красного агара.
Используют одну петлю (6.6) для двух чашек. Берут одну каплю с края поверхности жидкости. Осуществляют посев на обе чашки в соответствии с рисунком C.1, перечисления a) и b). Используют всю поверхность чашки; штрихи должны располагаться на расстоянии 0,5 см друг от друга. (Не стерилизуют петлю прокаливанием и не подкрепляют ее после первого штриха, а также тогда, когда ее переносят на вторую чашку.) Если используется только одна большая чашка, метод посева штрихами должен быть таким, как показано на рисунке C.1, перечисление a).
9.4.1.2 Таким же образом осуществляют посев второй селективной плотной среды (5.2.5), используя новую петлю и чашки Петри соответствующего размера.
9.4.2 Используя культуру, полученную после инкубирования в течение 18-24 ч среды селенита/цистина (9.3.2.2), повторяют описанную в 9.4.1 процедуру с двумя селективными плотными средами.
9.4.3 Инкубируют пластинки (перевернув вверх дном) в термостате (6.3) при температуре 37°C в течение 20-24 ч.
9.4.4 После инкубирования RVS-бульона и среды селенита/цистина в течение 18-24 ч повторяют процедуры штрихования и инкубирования, описанные в 9.4.1-9.4.3.
9.4.5 После каждого инкубирования (9.4.3 и 9.4.4) пластинки проверяют на наличие типичных колоний сальмонелл. Если рост слабый, а типичные колонии сальмонелл присутствуют, чашки инкубируют повторно в термостате (6.3) при температуре 37°C в течение 18-24 ч и повторно проверяют чашки на наличие типичных колоний сальмонелл.
9.4.6 На бриллиантовом зеленом/феноловом красном агаре (5.2.4) типичные колонии сальмонелл - розовые с ярко-красной окружающей средой.
Примечание - Поскольку распознавание колоний сальмонелл в большой степени является вопросом практического опыта, а внешний вид колоний изменяется не только в зависимости от разновидностей, но и от партий среды, для подтверждения выбирают предполагаемые колонии, а также типичные колонии.
9.5 Подтверждение
9.5.1 Выбор колоний для подтверждения
Из каждой пластинки с каждой селективной плотной средой (9.4.1) выбирают пять типичных или предполагаемых колоний. Если имеется менее пяти таких колоний, для подтверждения берут все имеющиеся колонии.
9.5.2 Инкубирование
Осуществляют посев штрихами отобранных колоний на поверхность пластинки с питательным агаром (5.2.6) так, чтобы обеспечить развитие хорошо изолированных колоний. Инкубируют пластинки в термостате (6.3) при температуре 37°C в течение 18-24 ч.
После инкубирования в термостате для биохимического и серологического подтверждения отбирают чистые, хорошо изолированные колонии.
9.5.3 Биохимическое подтверждение
9.5.3.1 Общие положения
Инкубируют чистыми колониями (9.5.2), осуществляя посев петлей в среды, указанные в 9.5.3.2-9.5.3.7.
9.5.3.2 Трехсахарный железистый агар с железом (5.2.7)
Осуществляют посев штрихами сначала на поверхности, а затем в глубь столбика агара. Инкубируют в термостате (6.3) при температуре 37°C в течение 24 ч.
Интерпретируют изменения среды следующим образом:
a) столбик:
- желтый - глюкоза-положительный (ферментация глюкозы);
- красный или без изменений - глюкоза отрицательный (ферментация глюкозы отсутствует);
- черный - образование сероводорода;
- пузырьки или трещинки - образование газа из глюкозы.
b) скошенная поверхность:
- желтая - лактоза- и/или сахароза-положительная (ферментация глюкозы и/или сахарозы);
- красный или без изменений - лактоза- и сахароза-отрицательная (ферментация лактозы и/или сахарозы отсутствует).
Типичные культуры сальмонелл показывают щелочные (красные) скосы с образованием газа и кислотные (желтые) столбики (в 90% всех случаев) с образованием сероводорода (потемнение агара).
Если лактозо-положительные сальмонеллы изолированы, то скошенная поверхность TSI желтая. Следовательно, предварительное подтверждение культур сальмонелл не должно основываться на результатах только TSI-испытаний.
9.5.3.3 Агар с мочевиной (5.2.8)
Осуществляют посев штрихами на скошенную поверхность агара. Инкубируют в термостате (6.3) при температуре 37°C в течение 24 ч. В результате положительной реакции при расщеплении мочевины выделяется аммиак, который изменяет окраску фенолового красного на светло-розовую, а затем на темно-вишневую. Реакция проявляется через 2-4 ч.
9.5.3.4 L-лизин декарбоксилазная среда (5.2.9)
Инокулируют снизу жидкую среду. Инкубируют в термостате (6.3) при температуре 37°C в течение 24 ч.
Фиолетовый цвет, появившийся после роста, показывает на положительную реакцию. Желтая окраска указывает на отрицательную реакцию.
9.5.3.5 Реакция -галактозидазы (5.3.2)
Суспендируют петлей предполагаемую колонию в пробирке (6.9), содержащей 0,25 см солевого раствора (5.3.1). Добавляют одну каплю толуола (5.3.2.1) и встряхивают пробирку. Пробирку помещают на водяную баню (6.5) при температуре 37°C и оставляют на несколько минут. Добавляют 0,25 см
реактива
-галактозидазы и перемешивают. Снова помещают пробирку на водяную баню при температуре 37°C на 24 ч. Желтая окраска указывает на положительную реакцию. Реакция часто становится видимой через 20 мин.
9.5.3.6 Реакция Фогеса - Проскауэра (5.3.3)
В две пробирки (6.9), содержащие по 0,2 см VP-среды (5.3.3.1), петлей осуществляют посев предполагаемой колонии. Одну из пробирок инкубируют при комнатной температуре, а другую в термостате (6.3) - при 37°C в течение 24 ч. Затем в каждую пробирку добавляют по 2 капли раствора креатина (5.3.3.2), три капли спиртового раствора 1-нафтола (5.3.3.3) и 2 капли реактива гидроксида калия (5.3.3.4), встряхивают после каждого добавления. Изменение розового цвета на ярко-красный в течение 15 мин указывает на положительную реакцию.
Необходимо строго следовать вышеуказанному порядку. Если, например, гидроксид калия добавлен к спиртовому раствору 1-нафтола при присутствии пептона, то результатом может быть раствор розоватого цвета, который может скрывать возможную положительную реакцию.
9.5.3.7 Индоловая реакция (5.3.4)
Осуществляют посев предполагаемой колонии в пробирку с 5 см триптоновой/триптофановой среды (5.3.4.1). Инкубируют в термостате при 37°C в течение 24 ч. Затем добавляют 1 см
реактива Ковача (5.3.4.2).
Образование красного кольца указывает на положительную реакцию. Желтовато-коричневое кольцо указывает на отрицательную реакцию.
9.5.3.8 Анализ данных биохимических испытаний
Обрабатывают результаты в соответствии с таблицей 1.
Таблица 1 - Обработка результатов
Реакция, указывающая на присутствие сальмонелл | Положительная или отрицательная реакция | Процентное содержание штампов сальмонелл, дающих реакцию |
TSI-глюкоза (образование кислоты) (9.5.3.2) | + | 100 |
TSI-глюкоза (образование газа) (9.5.3.2) | + | 91,9 |
TSI-лактоза (9.5.3.2) | - | 99,2 |
TSI-сахароза (9.5.3.2) | - | 99,5 |
TSI-сероводород (9.5.3.2) | + | 91,6 |
Разложение мочевины (9.5.3.3) | - | 100 |
L-лизин декарбоксилазная (9.5.3.4) | + | 94,6 |
Реакция на | - | 98,5 |
Реакция Фогеса - Проскаэра (9.5.3.6) | - | 100 |
Индоловая реакция (9.5.3.7) | - | 98,9 |
| ||
9.5.4 Готовые диагностические системы
Допускается использовать имеющиеся в продаже готовые наборы для распознавания, которые позволяют обнаруживать сальмонеллы.
9.5.5 Серологическое подтверждение
9.5.5.1 Общие положения
Определение присутствия O-, Vi- или H-антигенов сальмонелл в изолированных колониях (см. 9.5.2) проводят путем реакции агглютинации с соответствующими сыворотками после исключения самоагглютинирующих штаммов (9.5.5.2).
9.5.5.2 Исключение самоагглютинирующих штаммов
На тщательно очищенное предметное стекло помещают одну каплю солевого раствора (5.3.1). Диспергируют в этой капле часть исследуемой колонии (9.5.2) до получения однородной мутной суспензии. Осторожно покачивают стекло в течение 30-60 с. Помещают стекло на темный фон и рассматривают через лупу.
Штаммы считают самоагглютинирующими, если бактерии собрались в более или менее обособленные группы. Серологическое подтверждение таких самоагглютинирующих штаммов в соответствии с процедурами, приведенными в 9.5.5.3, 9.5.5.4 и 9.5.5.5, провести невозможно.
9.5.5.3 Проверка на O-антигены
Используют чистые несамоагглютинирующие (см. 9.5.5.2) штаммы. Проводят анализ, как указано в 9.5.5.2, используя 1 каплю O-антисыворотки (5.4) вместо солевого раствора (5.3.1). Одновалентную или многовалентную сыворотки используют одну за другой.
9.5.5.4 Проверка на Vi-антигены
Проводят анализ, как указано в 9.5.5.3, но вместо солевого раствора (5.3.1) используют 1 каплю Vi-антисыворотки (5.4).
9.5.5.5 Проверка на H-антигены
Инкубируют чистой несамоагглютинирующей колонией (9.5.5.2) полужидкий питательный агар (5.3.5). Инкубируют в термостате (6.3) при температуре 37°C в течение 18-24 ч. Проверяют полученную культуру на H-антигены, как указано в 9.5.5.3, но вместо солевого раствора (5.3.1) используют 1 каплю H-антисыворотки (5.4).
9.5.5.6 Анализ серологических реакций
Если происходит агглютинация, то реакции считаются положительными.
9.5.6 Анализ биохимических и серологических реакций
В таблице 2 приведена обработка результатов испытаний подтверждения (9.5.3 и 9.5.5), проводимых с использованием колоний (9.5.2).
Таблица 2 - Обработка результатов испытаний на подтверждение
Биохимические реакции | Самоагглюти- | Серологические реакции | Выводы |
Типичные реакции | Нет | O-, Vi или H-антигены положительные | Штаммы относят к роду сальмонелл |
Типичные реакции | Нет | Все реакции отрицательные | Могут быть отнесены к сальмонеллам |
Типичные реакции | Да | Не испытывались (см. 9.5.3.2) | |
Типичные реакции отсутствуют | Нет | O-, Vi или H-антигены положительные | |
Типичные реакции отсутствуют | Нет | Все реакции отрицательные | Не относят к роду сальмонелл |
9.5.7 Окончательное подтверждение
Штаммы, отнесенные к роду сальмонелл или предположительно отнесенные к роду сальмонелл (см. таблицу 2), направляют в официальный центр по идентификации сальмонелл для окончательного подтверждения, сопровождая подробной информацией о штаммах.
10 Контрольные культуры
Для проверки способности обогащающей и идентифицирующей среды поддерживать рост сальмонелл недавно изолированные культуры сальмонелл или штаммы сальмонелл из совокупности культур, признанных центром, помещают в контрольные колбы с двумя обогащающими средами (см. 9.3.2). С контрольными пробирками проводят те же операции, что и с испытуемыми культурами, для подтверждения того, что контролируемая культура восстанавливается.
11 Выражение результатов
В соответствии с результатами, полученными по 9.5.7 и 10, указывают наличие или отсутствие сальмонелл в испытуемой пробе, указывая массу в граммах или объем в см.
12 Меры предосторожности
12.1 Процедуру, установленную в настоящем стандарте, проводят только в лабораториях с соответствующим оборудованием и под контролем опытного микробиолога.
12.2 Эти процедуры не должны проводиться в лабораториях по контролю качества или на предприятиях по производству или обработке пищевых продуктов, на которых существует риск загрязнения окружающей среды.
12.3 Бактериологические меры предосторожности необходимо предпринимать постоянно и в полной мере при проведении процедуры, указанной в настоящем стандарте. Особое внимание следует уделять стерилизации использованного оборудования и среды после испытания образцов и до их утилизации или повторного использования.
12.4 Особую осторожность необходимо проявлять в лаборатории, использующей растворы селенита, по причине их потенциальной токсичности. Запрещается набирать жидкость в пипетку ртом.
Примечание - Другие меры предосторожности указаны более подробно в ISO 7218 в основных положениях и в разделах 3, 4 и 7.
13 Протокол испытаний
В протоколе испытаний указывают:
- вся информация, необходимая для полной идентификации пробы;
- применяемый метод отбора проб;
- применяемый метод испытаний со ссылкой на настоящий стандарт;
- все рабочие подробности, не указанные в настоящем стандарте или рассматриваемые как произвольные вместе с подробностями каких-либо инцидентов, которые могли повлиять на результат(ы);
- полученный(e) результат(ы) испытаний или, если проводилась проверка повторяемости, окончательный полученный результат(ы).
Приложение А
(обязательное)
Схема процедуры
Приложение В
(обязательное)
Требования к бриллиантовому зеленому
В.1 Бактериологические характеристики
Бриллиантовый зеленый будет подавлять распространение Proteus на агаре с бриллиантовым зеленым/феноловым красным (5.2.4), но не будет препятствовать росту сальмонелл.
В.2 Метод испытания
В.2.1 Среда
Готовят агаровые пластинки с бриллиантовым зеленым и феноловым красным в соответствии с 5.2.4, но с различной концентрацией бриллиантового зеленого в пределах 4,5-6 мг/дм.
В.2.2 Проведение испытания
На одной серии агаровых пластинок с различной концентрацией бриллиантового зеленого чистой культурой Proteus, а на другую такую же серию - чистой культурой сальмонелл и инкубируют их при температуре 37°С в течение не более 24 ч.
Достаточная концентрация бриллиантового зеленого обеспечит рост типичных розовых колоний сальмонелл диаметром 1-2 мм и ограничит рост Proteus, т.е. нераспространение. Концентрация бриллиантового зеленого, которая даст вышеуказанный результат, может быть использована при приготовлении его раствора (см. 5.2.4.3).
Приложение С
(справочное)
Стандартный метод штрихования агаровых пластинок
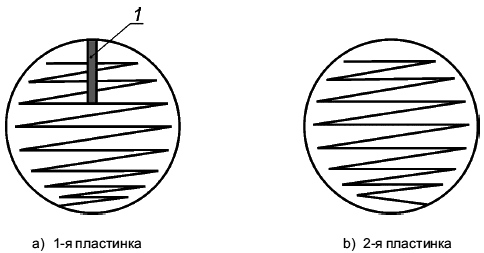
1 - главный штрих
Рисунок С.1
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
Таблица ДА.1
Обозначение международного стандарта | Степень соответствия | Обозначение и наименование межгосударственного стандарта |
ISO 707:2008 | - | *, |
ISO 7218:2007 | IDT | ГОСТ ISO 7218-2011 "Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям" |
* Соответствующий межгосударственный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов. Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандарта: IDT - идентичный стандарт. | ||
________________
На территории Российской Федерации действует ГОСТ Р ИСО 707-2010 "Молоко и молочные продукты. Руководство по отбору проб"
Библиография
[1] | ISO 707:2008 | Milk and milk products - Guidance on sampling (Молоко и молочные продукты. Руководство по отбору проб) |
[2] | ISO 7218:2007 | Microbiology of food and animal feeding stuffs - General rules for microbiological examinations (Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям) |
УДК 637.12.055:579.842.14(083.74)(476) | МКС 07.100.30 | IDT |
Ключевые слова: молочная продукция, сальмонеллы, методы отбора проб, неселективные среды, посев штрихами | ||
Электронный текст документа
и сверен по:
, 2016

