ГОСТ Р 52816-2007
Группа Н09
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРОДУКТЫ ПИЩЕВЫЕ
Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий)
Food products. Methods for detection and quantity determination of coliformes
ОКС 07.100.30
ОКСТУ 9109
Дата введения 2009-01-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 года N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 РАЗРАБОТАН Государственным научным учреждением "Всероссийский научно-исследовательский институт консервной и овощесушильной промышленности" (ГНУ ВНИИКОП) на основе аутентичных переводов стандартов, указанных в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 93 "Продукты переработки фруктов, овощей и грибов"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 27 декабря 2007 г. N 443-ст
4 Настоящий стандарт является модифицированным по отношению к международным стандартам*:
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
- ИСО 4831:2006 "Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод для выявления и подсчета количества колиформ. Метод наиболее вероятного числа" (ISO 4831:2006 "Microbiology of food and animal feeding stuffs - Horizontal mеthod for the detection and enumeration of coliforms - Most probable number technique", MOD);
- ИСО 4832:2006 "Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод подсчета колиформ. Метод подсчета колоний" (ISO 4832:2006 "Microbiology of food and animal feeding stuffs - Horizontal mеthod for the enumeration of coliforms - Colony-count technique", MOD) в части пищевых продуктов.
При этом дополнительные положения и требования, включенные в текст стандарта для учета потребностей национальной экономики Российской Федерации и особенностей российской национальной стандартизации, выделены в тексте стандарта курсивом*.
_______________
* В бумажном оригинале обозначения и номера стандартов и нормативных документов в разделе "Предисловие" и таблице В.1 приложения В приводятся обычным шрифтом, остальные по тексту документа выделены курсивом. - .
Сопоставление структуры настоящего стандарта со структурой указанных международных стандартов приведено в дополнительном приложении Б.
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ Р 1.5-2004* (подраздел 3.5).
________________
* На территории Российской Федерации в части разд.8 и приложений Ж, И, К действует ГОСТ Р 1.7-2008.
При применении настоящего стандарта рекомендуется использовать сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации, использованным в настоящем стандарте в качестве нормативных ссылок, указанные в приложении В
5 ВВЕДЕН ВПЕРВЫЕ
6 ИЗДАНИЕ (апрель 2010 г.) с Поправкой (ИУС 8-2009)
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
Настоящий стандарт распространяется на пищевые продукты, кроме молока и молочных продуктов, и устанавливает метод выявления в определенной навеске пищевого продукта колиформных бактерий и три метода определения их количества: метод наиболее вероятного числа (НВЧ) и методы посева в или на агаризованные селективно-диагностические среды.
Метод определения НВЧ колиформных бактерий предназначен для пищевых продуктов, содержащих в 1 г твердого продукта менее 150 или в 1 см жидкого продукта менее 15 клеток колиформных бактерий.
Метод определения количества колиформных бактерий посевом в агаризованные селективно-диагностические среды предназначен для пищевых продуктов, содержащих в 1 г твердого продукта более 150 или в 1 см жидкого продукта более 15 колониеобразующих единиц (КОЕ) колиформных бактерий.
Метод определения количества колиформных бактерий посевом на агаризованные селективно-диагностические среды предназначен для пищевых продуктов, содержащих в 1 г твердого продукта более 1500 или в 1 см жидкого продукта более 150 КОЕ колиформных бактерий.
Допускается использование хромогенных сред для предварительного выявления количества бактерий группы кишечных палочек (колиформных бактерий) в масложировой продукции.
(Поправка).
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р ИСО 7218-2008 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 24104-2001 Весы лабораторные. Общие технические требования*
________________
* На территории Российской Федерации действует ГОСТ Р 53228-2008.
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 26668-85 Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов
ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов
ГОСТ 29184-91 Продукты пищевые. Методы выявления и определения количества бактерий семейства Enterobacteriaceae
ГОСТ 30425-97 Консервы. Метод определения промышленной стерильности
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 колиформные бактерии: Бактерии, которые при температуре 37 °С ферментируют лактозу с образованием газа по методам, приведенным в настоящем стандарте.
3.2 выявление колиформных бактерий: Определение присутствия или отсутствия колиформных бактерий в определенной массе или объеме продукта в соответствии с настоящим стандартом.
3.3 определение количества колиформных бактерий:
3.3.1 Количество бактерий, содержащееся в 1 см или 1 г продукта, определенное путем посева продукта и (или) его разведений в или на агаризованную селективно-диагностическую среду, подсчете после инкубирования при температуре 37 °С типичных и атипичных колоний и определении возможности бактерий из этих колоний ферментировать лактозу с образованием газа по методам, приведенным в настоящем стандарте.
При необходимости, подтверждают по биохимическим признакам принадлежность выделенных колоний к колиформным бактериям.
3.3.2 Количество бактерий, содержащееся в 1 см или 1 г продукта, определенное по методу НВЧ, указанному в настоящем стандарте.
4 Метод выявления колиформных бактерий и определение количества по методу НВЧ
Сущность методов
Методы выявления и определения НВЧ колиформных бактерий основаны на высеве определенного количества продукта и (или) разведений навески продукта в жидкую селективную среду с лактозой, инкубировании посевов, учете положительных пробирок, пересеве культуральной жидкости в жидкую селективную среду для учета газообразования или пересева, при необходимости, культуральной жидкости на поверхность агаризованной селективно-диагностической среды для подтверждения по биохимическим и культуральным признакам роста принадлежности выделенных колоний к колиформным бактериям.
4.1 Метод выявления колиформных бактерий
4.1.1 Пробирку с селективной обогатительной средой инокулируют продуктом или разведением навески продукта и инкубируют при температуре 37 °С 24 или 48 ч.
4.1.2 Пробирку с подтверждающей средой инокулируют из пробирки, полученной по 4.1.1, где отмечено образование газа и/или помутнение и инкубируют при температуре 37 °С 24 или 48 ч.
4.1.3 Присутствие колиформных бактерий считается подтвержденным, в случае если отмечено помутнение и образование газа после осмотра пробирки, полученной по 4.1.2.
4.2 Метод НВЧ - определение количества колиформных бактерий
4.2.1 Три пробирки с жидкой селективной обогатительной средой двойной концентрации инокулируют определенным количеством продукта, если исходный продукт жидкий, или определенным количеством исходной суспензии в случае другого продукта.
4.2.2 Три пробирки с жидкой селективной обогатительной средой нормальной концентрации инокулируют определенным количеством продукта и/или разведением продукта, если исходный продукт жидкий, или определенным количеством исходной суспензии и/или разведением в случае другого продукта.
4.2.3 Посевы в пробирках, содержащие обогатительную среду двойной концентрации, инкубируют при температуре 37 °С 24 ч. Посевы в пробирках со средой нормальной концентрации, инкубируют 24 или 48 ч, после этого в этих пробирках отмечают наличие газа и/или помутнения, мешающего выявлению образования газа.
4.2.4 Пробирки с подтверждающей средой инокулируют культурами из пробирок с обогатительной селективной средой двойной концентрации и культурами из пробирок с обогатительной селективной средой нормальной концентрации, в которых отмечено образование газа и/или помутнение.
Посевы в пробирках с подтверждающей средой инкубируют при температуре 37 °С 24 или 48 ч, после этого в пробирках отмечают образование газа.
4.2.5 Наиболее вероятное число колиформных бактерий в 1 см или 1 г пробы продукта (НВЧ) рассчитывают исходя из числа пробирок с подтверждающей средой (4.2.4), показавших образование газа. Для определения наиболее вероятного числа пользуются таблицей ГОСТ 26670.
5 Методы определения количества колиформных бактерий - подсчет колоний
Сущность методов
Методы определения количества колиформных бактерий посевом в или на агаризованные селективно-диагностические среды основаны на высеве определенного количества продукта и/или его разведений в или на агаризованную селективно-диагностическую среду с лактозой, инкубировании посевов, подсчете типичных и атипичных колоний, пересеве типичных и атипичных колоний в жидкую селективную среду с лактозой для определения газообразования, подтверждения, при необходимости, по биохимическим признакам принадлежности выделенных колоний к колиформным бактериям.
5.1 Метод посева в агаризованную селективно-диагностическую среду
5.1.1 Для определения количества колиформных бактерий по 1 см продукта, если продукт жидкий, или по 1 см
исходного разведения в случае другого продукта вносят в две стерильные чашки Петри.
Другую пару чашек используют для других количеств - исходной суспензии и/или десятикратных разведений продукта.
Чашки с внесенным в них продуктом или его разведением заливают агаризованной питательной средой.
Посевы в чашках инкубируют при температуре 37 °С в течение 24 ч.
5.1.2 Типичные и атипичные колонии подсчитывают и определяют у бактерий из типичных и атипичных колоний возможность ферментации лактозы.
5.1.3 Число колоний на 1 см или на 1 г продукта рассчитывают по ГОСТ 26670 исходя из числа подтвержденных типичных и атипичных колоний, выросших на чашках.
5.2 Метод посева на агаризованную селективно-диагностическую среду
5.2.1 На подсушенную поверхность агаризованной селективно-диагностической среды в двух чашках Петри наносят 0,1-0,2 см продукта, если продукт жидкий, или исходной суспензии в случае другого продукта.
Другую пару чашек используют для других количеств - исходной суспензии или десятикратных разведений продукта.
Внесенный в чашки продукт или его разведения распределяют по поверхности агаризованной питательной среды стерильным шпателем.
Посевы в чашках инкубируют при температуре 37 °С в течение 24 ч.
5.2.2 Типичные и атипичные колонии подсчитывают и определяют у бактерий из этих колоний возможность ферментации лактозы.
5.2.3 Число колоний на 1 см или на 1 г продукта рассчитывают по ГОСТ 26670 исходя из числа подтвержденных типичных и атипичных колоний, выросших на чашках.
6 Питательные среды и реактивы
Химические вещества, используемые для приготовления питательных сред и реактивов, должны быть аналитического качества.
6.1 Селективная обогатительная среда (лаурил сульфат триптозный бульон)
6.1.1 Состав среды приведен в таблице 1.
Таблица 1
Состав среды | а) | б) |
Ферментативный перевар молока и животных протеинов, г | 40 | 20 |
Лактоза (С | 10 | 5 |
Двузамещенный фосфорнокислый калий (K | 5,5 | 2,75 |
Однозамещенный фосфорнокислый калий (KН | 5,5 | 2,75 |
Натрий хлористый, г | 10 | 5 |
Натрий лаурил сульфат, г | 0,2 | 0,1 |
Вода, см | 1000 | 1000 |
6.1.2 Приготовление
При нагревании растворяют компоненты или дегидратированную готовую среду в воде. Устанавливают рН так, чтобы после стерилизации он составлял (6,8±0,2) при температуре 25 °С.
Разливают среду по 10 см в пробирки размером приблизительно 16х160 мм, содержащие пробирки Дархама (поплавки), в случае использования среды нормальной концентрации, и в пробирки размером приблизительно 20х200 мм, не содержащие пробирки Дархама (поплавки), в случае использования среды двойной концентрации.
Стерилизуют среду в автоклаве при температуре (121±1)°С в течение 15 мин. Пробирки Дархама (поплавки) после стерилизации не должны содержать пузырьков воздуха.
6.2 Бриллиантовый зеленый лактозный желчный бульон
6.2.1 Состав:
ферментативный перевар казеина | 10 г; | |||
лактоза (С | 10 г; | |||
желчь | 20 г; | |||
бриллиантовый зеленый | 0,0133 г, | |||
(или 2,66 см | ||||
вода | 1000 см | |||
6.2.2 Приготовление
При нагревании растворяют компоненты или дегидратированную готовую среду в воде. Устанавливают рН так, чтобы после стерилизации он составлял (7,2±0,2) при температуре 25 °С. Разливают и стерилизуют среду по 6.1.2.
6.2.3 Раствор бриллиантового зеленого
6.2.3.1 Состав:
бриллиантовый зеленый | 0,5 г; | |||
вода | 100 см | |||
6.2.3.2 Приготовление
Бриллиантовый зеленый переносят в фарфоровую ступку и постепенно растворяют в дистиллированной воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят водой до метки.
6.3 Селективная обогатительная среда (бульон Мак-Конки)
6.3.1 Состав бульона Мак-Конки приведен в таблице 2.
Таблица 2
Состав среды | а) | б) |
Пептон, г | 40 | 20 |
Лактоза (С | 20 | 10 |
Желчь, г | 10 | 5 |
Раствор бромкрезолового пурпурового, см | 2 | 1 |
Натрий хлористый, г | 10 | 5 |
Вода, см | 1000 | 1000 |
6.3.2 Приготовление
При нагревании растворяют компоненты в воде. Нагревают на слабом огне до кипения, кипятят 1-2 мин, фильтруют через ватно-марлевый фильтр, доводят объем до 1 дм, охлаждают до 45 °С - 55 °С и устанавливают рН так, чтобы после стерилизации он составлял при температуре 25 °С (7,2±0,1). Разливают и стерилизуют среду по 6.1.2.
6.3.3 Раствор бромкрезолового пурпурового
6.3.3.1 Состав:
бромкрезоловый пурпуровый | 1 г; | |||
раствор гидроокиси натрия | 19 см | |||
вода | 80 см | |||
6.3.3.2 Приготовление
Бромкрезоловый пурпуровый переносят в фарфоровую ступку с 19 см раствора гидроокиси натрия c(NaOH)=0,1 моль/дм
и после растворения добавляют воду.
6.4 Селективная обогатительная среда (среда Кесслера)
6.4.1 Состав среды Кесслера приведен в таблице 3.
Таблица 3
Состав среды | а) | б) |
Пептон, г | 20 | 10 |
Лактоза (С | 5 | 2,5 |
Желчь, г | 10 | 5 |
Раствор кристаллического фиолетового, см | 4 | 2 |
Вода, см | 1000 | 1000 |
6.4.2 Приготовление
При нагревании растворяют компоненты в воде. Нагревают на слабом огне до кипения, кипятят 1-2 мин, фильтруют через ватно-марлевый фильтр, доводят объем до 1 дм, охлаждают до 45 °С - 55 °С и устанавливают рН так, чтобы после стерилизации он составлял при температуре 25 °С (7,2±0,1).
Разливают среду по 6.1.2 и стерилизуют в автоклаве при температуре (115±1) °С в течение 20 мин.
6.4.3 Раствор кристаллического фиолетового
6.4.3.1 Состав:
кристаллический фиолетовый | 1 г; | |||
вода | 100 см | |||
6.4.3.2 Приготовление
Кристаллический фиолетовый переносят в фарфоровую ступку и постепенно растворяют в воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят водой до метки.
6.5 Кристалл виолет нейтральный красный желчный лактозный агар (VRBL-агар)
6.5.1 Состав:
ферментативный перевар животных тканей | 7 г; | |||
дрожжевой экстракт | 3 г; | |||
лактоза (С | 10 г; | |||
хлористый натрий | 5 г; | |||
желчные соли | 1,5 г; | |||
нейтральный красный | 0,03 г | |||
(или 1 см | ||||
кристаллический фиолетовый | 0,002 г | |||
(или 0,2 см | ||||
агар | 12-18 г | |||
(зависит от желирующей способности агара); | ||||
вода | 1000 см | |||
6.5.2 Приготовление
Основная цель правильного приготовления среды - получение необходимой селективной способности и специфичности среды.
Тщательно размешивают компоненты или дегидратированную готовую среду в воде и оставляют на несколько минут. Устанавливают рН так, чтобы после кипения он составлял (7,4±0,2) при температуре 25 °С. Нагревают до кипения, помешивая время от времени. После 2 мин кипения немедленно охлаждают в водяной бане при температуре 44 °С - 47 °С. Избегают перегрева среды, не применяя вторичного нагревания. Среду не стерилизуют в автоклаве. Контролируют стерильность среды во время использования. Используют среду в течение 4 час после приготовления.
6.5.3 Раствор нейтрального красного
6.5.3.1 Состав:
нейтральный красный | 3 г; | |||
вода | 100 см | |||
6.5.3.2 Приготовление
Нейтральный красный переносят в фарфоровую ступку и постепенно растворяют в дистиллированной воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят водой до метки.
6.6 Агар лактозный с бриллиантовым зеленым и феноловым красным
6.6.1 Состав:
мясной экстракт | 3 г; | |||
пептон | 10 г; | |||
лактоза (С | 10 г; | |||
хлористый натрий | 5 г; | |||
двузамещенный фосфорнокислый калий (K | 0,5 г; | |||
раствор фенолового красного по 6.6.3 | 40 см | |||
раствор бриллиантового зеленого по 6.2.3 | 2 см | |||
агар | 12-18 г | |||
(зависит от желирующей способности агара); | ||||
вода | 1000 см | |||
6.6.2 Приготовление
При нагревании растворяют в воде компоненты. При отсутствии мясного экстракта допускается использовать вместо мясного экстракта, пептона и дистиллированной воды мясопептонный бульон, приготовленный по ГОСТ 10444.1. Смесь нагревают до полного растворения компонентов, доводят объем до 1 дм, охлаждают до 45 °С - 55 °С, устанавливают рН так, чтобы после стерилизации он составлял при температуре 25 °С (7,0±0,1), разливают мерно в колбы или флаконы. Среду стерилизуют при температуре (115±1) °С в течение 20 мин, затем охлаждают до 45 °С - 55 °С. После стерилизации прибавляют раствор фенолового красного и раствор бриллиантового зеленого.
6.6.3 Раствор фенолового красного
6.6.3.1 Состав:
феноловый красный | 0,2 г; | |||
вода | 100 см | |||
6.6.3.2 Приготовление
Феноловый красный переносят в фарфоровую ступку и постепенно растворяют в дистиллированной воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят водой до метки.
6.7 Агар Эндо
Среду готовят по инструкции на этикетке.
6.8 Среда Гисса с лактозой
Среду готовят по инструкции на этикетке или по ГОСТ 10444.1.
6.9 ГРМ-агар (сухой питательный агар на основе гидролизата рыбной муки для культивирования бактерий)
Среду готовят по инструкции на этикетке.
6.10 Мясопептонный агар
Среду готовят по ГОСТ 10444.1.
6.11 При использовании для приготовления питательных сред натуральной говяжьей желчи ей заменяют сухую (1 г сухой желчи равен 10 см натуральной желчи). При этом количество дистиллированной воды, используемой для приготовления сред, уменьшают на количество натуральной желчи (т.е. общий объем среды должен быть равен 1 дм
).
6.12 Растворы, приготовленные по 6.2.3, 6.3.3, 6.4.3, 6.5.3 и 6.6.3, хранят в закрытых сосудах из темного стекла при комнатной температуре не более 3 мес.
6.13 Растворы и реактивы для окраски по Граму готовят по ГОСТ 10444.1.
6.14 Допускается использование готовых и дегидратированных питательных сред, в т.ч. хромогенных, отечественного и импортного производства, зарегистрированных в Российской Федерации.
7 Аппаратура, посуда, материалы и реактивы
Приемлемой альтернативой посуде многоразового применения является одноразовая посуда, если она отвечает соответствующим требованиям.
Используют обычное лабораторное оборудование и реактивы для микробиологических исследований по ГОСТ Р ИСО 7218, ГОСТ 10444.1 со следующими дополнениями:
- весы лабораторные с наибольшим пределом взвешивания 200 г (для взвешивания реактивов) с пределом допускаемой абсолютной погрешности однократного взвешивания не более ±0,01 мг по ГОСТ 24104;
- весы лабораторные с наибольшим пределом взвешивания 1 кг (для взвешивания продукта) с пределом допускаемой абсолютной погрешности однократного взвешивания не более ±20 мг по ГОСТ 24104;
- микроскоп биологический, обеспечивающий просмотр в проходящем свете, с увеличением 900- 1000
;
- прибор для мембранной фильтрации;
- бактериологическая петля платино-иридиевая или никель-хромовая приблизительно 3 мм в диаметре;
- стекла предметные по ГОСТ 9284;
- пробирки размером приблизительно 16х160 мм и 20х200 мм по ГОСТ 25336;
- пробирки Дархам (поплавки) размером, подходящим для использования в пробирках размером 16х160 мм;
- термостат с диапазоном рабочих температур 28 °С - 55 °С, позволяющий поддерживать заданную температуру с допустимой погрешностью ±1°С;
- бриллиантовый зеленый;
- желчь говяжья сухая или натуральная;
- мясной экстракт;
- нейтральный красный;
- триптический гидролизат желатины;
- триптоза;
- феноловый красный;
- ферментативный перевар животных тканей;
- ферментативный перевар казеина;
- ферментативный перевар молока и животных протеинов;
- дрожжевой экстракт.
8 Отбор и подготовка проб
Отбор и подготовка проб по ГОСТ 26668, ГОСТ 26669.
Важно, чтобы для испытания поступила представительная проба, не поврежденная и не измененная в ходе транспортирования или хранения.
9 Проведение испытания
Схема проведения испытания приведена в приложении А.
9.1 Метод выявления колиформных бактерий
9.1.1 Навеска и исходное разведение
Отбор навесок и приготовление исходного разведения - по ГОСТ 26669.
9.1.2 Инокуляция и инкубация
9.1.2.1 В зависимости от требуемых пределов выявления см
жидкой пробы или
см
исходной суспензии при использовании других продуктов переносят в пробирку, содержащую 10 см
обогатительной селективной среды двойной концентрации [см. таблицы 1а, 2а, 3а], когда 1 см
10 см
, или в пробирку, содержащую 10 см
обогатительной селективной среды нормальной концентрации [см. таблицы 1б, 2б, 3б], если
1 см
.
При испытании высококислотных продуктов для предотвращения резкого снижения рН (на 0,5 и более) питательных сред после внесения в них продукта или его разведения рН питательных сред доводят до допустимых значений с помощью стерильного раствора гидроокиси натрия, приготовленного по ГОСТ 10444.1, или при приготовлении питательных сред рН устанавливают выше заданного с учетом его последующего снижения при внесении продукта. Количество добавляемого стерильного раствора гидроокиси натрия или величину, на которую необходимо увеличить рН при приготовлении питательных сред, устанавливают опытным путем.
Допускается доводить рН до нейтрального значения с помощью стерильного раствора гидроокиси натрия в самом высококислотном продукте.
9.1.2.2 Пробирки с посевами в среду двойной концентрации (см. 9.1.2.1) инкубируют при температуре (37±1) °С в течение (24±2) ч.
9.1.2.3 Пробирки с посевами в среду нормальной концентрации (см. 9.1.2.1) инкубируют при температуре (37±1) °С в течение (24±2) ч. Если нет образования газа или помутнения, затрудняющего выявление газа, продолжают инкубацию еще (24±2) ч.
9.1.3 Подтверждение
9.1.3.1 Из пробирок (см. 9.1.2.2) после инкубации инокулируют петлей подтверждающую среду нормальной концентрации (см. 6.1-6.4). Посевы инкубируют в термостате при температуре (37±1) °С в течение (24±2) ч, если нет образования газа, то продолжают наблюдение до (48±2) ч.
В качестве арбитражной среды используют бриллиантовый зеленый лактозный желчный бульон.
9.1.3.2 Повторяют процедуру, описанную в 9.1.3.1, для пробирок после инкубации по 9.1.2.3, в которых отмечено образование газа или помутнение, препятствующее выявлению образования газа, после (24±2) ч или после (48±2) ч инкубирования.
9.1.4 Оценка результатов
Возможные случаи оценки результатов приведены в приложении А.
Пробирки по 9.1.3.1 или 9.1.3.2, в которых отмечено образование газа после (24±2) ч или после (48±2) ч, считают положительными.
При выявлении колиформных бактерий отмечают присутствие или отсутствие их в навеске г или
см
продукта.
9.2 Метод НВЧ - определение количества колиформных бактерий
При определении количества колиформных бактерий по методу НВЧ высевают не менее трех последовательных навесок продукта и (или) его разведений, отличающиеся по количеству продукта в них в 10 раз.
9.2.1 Навеска, исходная суспензия и разведения
Отбор навесок, приготовление исходного разведения и десятикратных разведений проводят по ГОСТ 26669.
Готовят достаточное число разведений по ГОСТ 26669, гарантируя, что все пробирки, соответствующие конечному разведению, покажут отрицательный результат.
9.2.2 Инокуляция и инкубация
9.2.2.1 Используют три пробирки для каждой навески продукта и(или) его разведения.
9.2.2.2 Стерильной пипеткой переносят в каждую из трех пробирок с одной из селективных обогатительных сред двойной концентрации [см. таблицы 1а, 2а, 3а] 10 см пробы, если она жидкая, или 10 см
исходной суспензии при использовании других продуктов.
Каждую навеску продукта в трехкратной повторности высевают в среду двойной концентрации в пробирки размером 20х200 мм.
Соотношение между количеством высеваемого продукта и питательной средой двойной концентрации 1:1.
9.2.2.3 Другой стерильной пипеткой переносят в каждую из трех пробирок с одной из селективных обогатительных сред нормальной концентрации [см. таблицы 1б, 2б, 3б] 1 см пробы, если продукт жидкий, или 1 см
исходной суспензии при использовании других продуктов.
Каждую навеску продукта и (или) его разведения в трехкратной повторности высевают в пробирки размером 16х160 мм.
Соотношение между количеством высеваемого продукта или его разведением и питательной средой 1:10.
9.2.2.4 Каждое последующее разведение высевают в соответствии с 9.2.2.3, используя новую стерильную пипетку. Осторожно перемешивают инокулум и среду.
9.2.2.5 Пробирки с посевами в среду двойной концентрации (см. 9.2.2.2) инкубируют при температуре (37±1) °С в течение (24±2) ч.
9.2.2.6 Пробирки с посевами в среду нормальной концентрации (см. 9.2.2.3 и 9.2.2.4) инкубируют при температуре (37±1) °С в течение (24±2) ч. Если нет образования газа и/или помутнения, препятствующего выявлению образования газа, продолжают инкубирование еще (24±2) ч.
9.2.3 Подтверждение
9.2.3.1 Из каждой пробирки после инкубации по 9.2.2.5 инокулируют петлей подтверждающую среду (6.1б-6.4б). Посевы инкубируют в термостате при температуре (37±1) °С в течение (24±2) ч. Если нет образования газа и/или помутнения, то продолжают инкубирование еще (24±2) ч.
В качестве арбитражной среды используют бриллиантовый зеленый лактозный желчный бульон.
9.2.3.2 Повторяют процедуру, описанную в 9.2.3.1 для пробирок после инкубации по 9.2.2.6, показавших образование газа и/или помутнение после (24±2) ч или после (48±2) ч.
Допускается не проводить пересев на жидкую подтверждающую среду при явном газообразовании на жидких средах нормальной концентрации, считая при этом эти посевы положительными.
9.2.4 Оценка результатов
Возможные случаи оценки результатов приведены в приложении А.
Для каждой навески продукта и/или его разведения подсчитывают число пробирок, в которых обнаружено образование газа (положительные пробирки) после (24±2) ч и (если использовали) после (48±2) ч.
9.2.5 Подсчет и выражение результатов
Подсчитывают наиболее вероятное число, исходя из числа положительных пробирок в каждой навеске продукта и/или его разведении. По ГОСТ 26670 определяют НВЧ колиформных бактерий в 1 г или 1 см продукта.
9.3 Метод определения количества колиформных бактерий - подсчет колоний
9.3.1 Навеска и исходное разведение
Отбор навесок и приготовление исходного разведения - по ГОСТ 26669.
9.3.2 Инокуляция и инкубация
9.3.2.1 Для посева жидкого продукта и/или каждого разведения используют две параллельные чашки Петри. Переносят стерильной пипеткой 1 см жидкого продукта или соответствующего разведения в центр каждой чашки. При посеве жидкого продукта и/или каждого разведения в чашку Петри используют отдельную стерильную пипетку.
9.3.2.2 В каждую чашку Петри (9.3.2.1) наливают около 15 см одной из сред (6.5-6.7) температурой 44 °С - 47 °С. Время, прошедшее между посевом продукта и/или его разведения в чашку Петри и заливкой среды, не должно превышать 15 мин.
Аккуратно перемешивают инокулят со средой и оставляют смесь для застывания, для этого чашки Петри помещают на холодную горизонтальную поверхность.
В качестве арбитражной среды используют VRBL-агар.
Параллельно для контроля стерильности агаризованной среды в стерильную чашку Петри наливают приблизительно 15 см среды и инкубируют вместе с посевами.
9.3.2.3 После застывания среды в чашках Петри на ее поверхность наливают около 4 см использованной агаризованной среды (6.5-6.7) температурой 44 °С - 47 °С для создания второго слоя. Добавленная среда должна затвердеть, как описано в 9.3.2.2.
9.3.2.4 При определении колиформных бактерий посевом на агаризованные селективно-диагностические среды (6.5-6.7) по 0,1 или 0,2 см навески продукта или его разведения наносят на поверхность одной из этих сред, разлитых в две параллельные чашки Петри. Подготовку чашек Петри со средой к посеву и посев проводят по ГОСТ 26670.
При применении метода мембранных фильтров по ГОСТ 26670 фильтры переносят на поверхность агаризованной селективно-диагностической среды, избегая образования пузырьков воздуха между средой и фильтром. Поверхность фильтра с осевшими на ней бактериями должна быть обращена вверх.
При посеве методом мембранных фильтров на них подсчитывают количество колоний и в том случае, если их менее 15.
9.3.2.5 Переворачивают крышкой вниз приготовленные чашки по 9.3.2.3 и 9.3.2.4 и инкубируют в термостате при температуре (37±1) °С в течение (24±2) ч.
9.3.3 Подсчет количества колоний
После инкубации по 9.3.2.5 отбирают чашки, на которых выросло от 15 до 150 колоний. Посевы просматривают и отмечают рост типичных и атипичных колоний.
На VRBL-arape типичные колонии колиформных бактерий пурпурно-красные диаметром не менее 0,5 мм, иногда окружены красноватой зоной преципитата (осадка) желчи.
На агаре с бриллиантовым зеленым и феноловым красным типичные колонии колиформных бактерий зеленоватые, окруженные яркой желто-зеленой зоной.
На среде Эндо типичные колонии колиформных бактерий от розового до красного цвета, часто с металлическим блеском.
Атипичные колонии отличаются от типичных по цвету и размеру. К атипичным относят также все типичные колонии, выросшие в результате ферментации сахаров, за исключением лактозы, содержащихся в пищевых продуктах. Такие колонии не будут принадлежать к колиформным бактериям.
Подсчитывают на агаризованных средах отдельно количество типичных и атипичных колоний.
9.3.4 Подтверждение принадлежности бактерий из колоний к колиформным бактериям
Отбирают не менее чем по пять атипичных и типичных колоний. Каждую отобранную колонию пересевают в пробирки с одной из жидких питательных сред, приготовленной по 6.1-6.4.
В качестве арбитражной среды используют лактозный бульон с бриллиантовым зеленым и желчью.
Рост с газообразованием при температуре (37±1) °С в течение 24 ч указывает на принадлежность бактерий из атипичных и типичных колоний к колиформным.
9.3.5 Подсчет и выражение результатов
Если при подтверждении типичных или атипичных колоний в 80% случаев, то есть не менее чем в четырех из пяти колоний, подтвержден рост колиформных бактерий, то считают, что все колонии, выросшие на чашке Петри (см. 9.3.3), принадлежат к колиформным бактериям. В остальных случаях количество колиформных бактерий определяют, исходя из процентного отношения подтвержденных колоний к общему количеству колоний, взятых для подтверждения.
Пересчет количества колиформных бактерий, определенного посевом в или на агаризованные среды, на 1 г (см) продукта проводят по ГОСТ 26670.
Результаты определения количества колиформных бактерий и выявления их в определенной навеске продукта записывают по ГОСТ 26670.
9.3.6 Допускается также выявление колиформных бактерий проводить посевом в или на агаризованную среду при условии, что навеску продукта, в которой предусматривается выявление, возможно посеять по этому методу.
При выявлении колиформных бактерий посевом в или на агаризованную среду подсчета количества колоний не проводят.
10 Дополнительное подтверждение принадлежности выявленных бактерий к колиформным бактериям
10.1 При необходимости, для дополнительного подтверждения принадлежности бактерий, выросших на жидких средах (там, где отмечено газообразование), к колиформным бактериям делают пересевы по ГОСТ 26670 на поверхность одной из агаризованных селективно-диагностических сред (6.5-6.7). Посевы инкубируют при температуре (37±1) °С в течение (24±3) ч. После термостатирования отмечают рост типичных и атипичных колоний.
10.2 Для дополнительного подтверждения принадлежности выросших бактерий к колиформным бактериям отбирают не менее чем по пять типичных и атипичных колоний из чашек Петри с посевами по 9.3.3.
Атипичные колонии отбирают те, в которых подтверждено наличие колиформных бактерий посевом в жидкую подтверждающую среду.
10.3 Каждую отобранную для подтверждения колонию пересевают на поверхность скошенного питательного агара по 6.9 или 6.10, посевы термостатируют при температуре (31±1) °С в течение (24±3) ч.
Принадлежность к колиформным бактериям определяют по отношению к окраске по Граму, по отсутствию оксидазы, по ферментации лактозы на среде Гисса.
10.3.1 Окраска по Граму
Приготовление мазков из культур, выросших на скошенной поверхности питательного агара, и окраску их по Граму, проводят по ГОСТ 30425. Колиформные бактерии являются грамотрицательными палочками.
Допускается окраску по Граму заменять тестом Грегорсена, для этого на предметном стекле в капле 3%-ного водного раствора калия гидроокиси эмульгируют петлей культуру микроорганизмов, взятую из колонии с плотной среды. Если через несколько секунд за петлей тянутся слизистые нити, то это указывает на принадлежность испытуемой культуры к грамотрицательному виду. У грамположительных бактерий слизистых нитей не образуется.
10.3.2 Определение отсутствия оксидазы
Определение отсутствия оксидазы проводят по ГОСТ 29184.
Для определения оксидазы допускается использование дисков и растворов отечественного и импортного (зарегистрированных в Российской Федерации) промышленного производства. Для контроля качества дисков и растворов используют музейные оксидазоположительные и оксидазоотрицательные культуры.
10.3.3 Определение ферментации лактозы
Для определения ферментации лактозы испытуемую культуру высевают уколом в среду Гисса с лактозой.
Посевы термостатируют при температуре (37±1) °С в течение (24±3) ч.
Колиформные бактерии ферментируют лактозу с образованием кислоты (цвет среды меняется) и газа.
10.4 По результатам дополнительного подтверждения к колиформным бактериям относят аэробные и факультативно-анаэробные не образующие спор грамотрицательные оксидазоотрицательные палочки, сбраживающие лактозу с образованием кислоты и газа.
11 Протокол испытания*
_______________
* Наименование пункта 11 в бумажном оригинале выделено курсивом. - .
Результаты оценивают по каждой пробе отдельно.
Протокол испытания должен включать:
- всю информацию, необходимую для полной идентификации продукта;
- используемый метод в соответствии с настоящим стандартом;
- все детали испытания, не установленные настоящим стандартом;
- полученный(е) результат(ы).
Приложение А
(справочное)
Схема выявления колиформных бактерий
А.1 Схема выявления колиформных бактерий приведена на рисунке А.1.
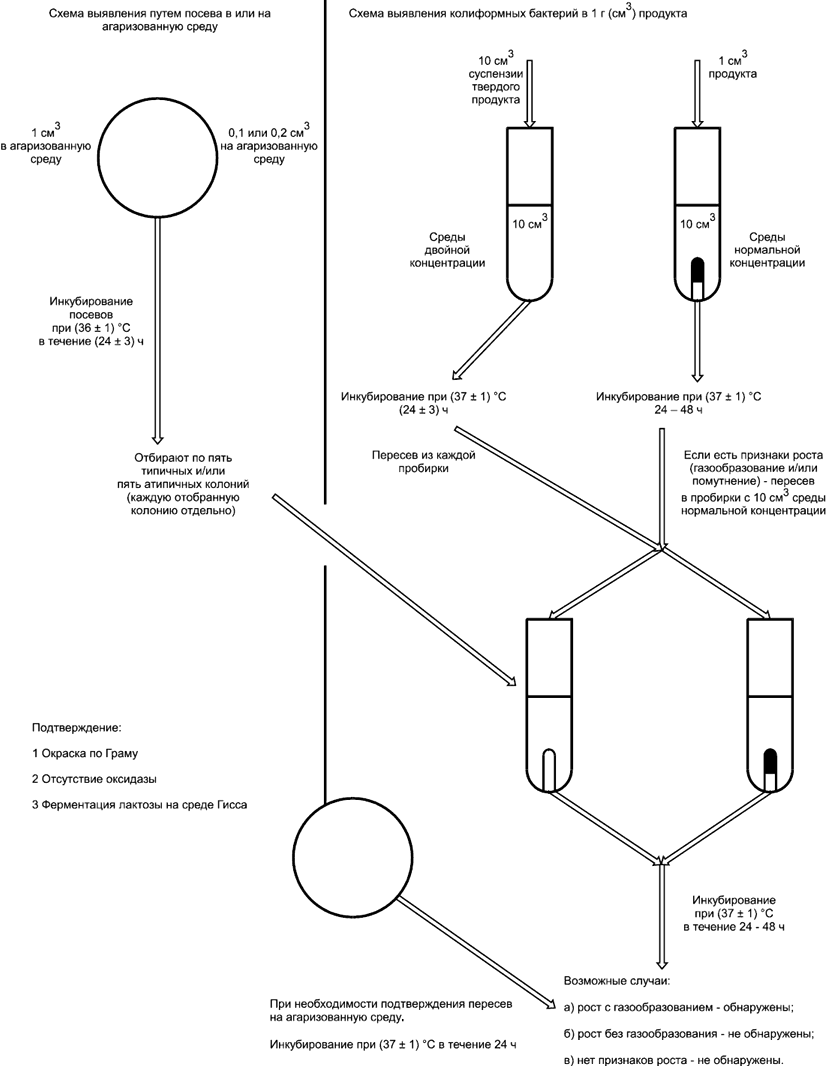
Рисунок А.1
Приложение Б
(справочное)
Сопоставление структуры настоящего стандарта со структурой примененных в нем международных стандартов
Б.1 Сопоставление структуры настоящего стандарта со структурой ИСО 4831:2006 приведено в таблице Б.1
Таблица Б.1
Структура международного стандарта | Структура настоящего стандарта | ||||
Раздел | Пункты | Подпункты | Раздел | Пункты | Подпункты |
1 Область распространения | - | - | 1 Область применения | - | - |
2 Нормативные ссылки | - | - | 2 Нормативные ссылки | - | - |
3 Термины и определения | 3.1-3.3 | - | 3 Термины и определения | 3.1-3.3 | 3.3.1, 3.3.2 |
4 Сущность метода | 4.1, 4.2 | 4.1.1-4.1.3, 4.2.1-4.2.6 | 4 Метод выявления колиформных бактерий и определение количества по методу НВЧ | 4.1, 4.2 | 4.1.1-4.1.3, 4.2.1-4.2.5 |
5 Питательные среды и разведения | 5.1-5.4 | - | 6 Питательные среды и реактивы | 6.1-6.14 | - |
6 Аппаратура и посуда | 6.1-6.7 | - | 7 Аппаратура, посуда, материалы и реактивы | - | - |
7 Отбор проб | - | - | 8 Отбор и подготовка проб | - | - |
8 Приготовление проб | - | - | |||
9 Испытание | 9.1, 9.2 | 9.1.1-9.1.4, 9.2.1-9.2.4 | 9 Проведение испытания | 9.1, 9.2 | 9.1.1-9.1.4, 9.2.1-9.2.5 |
10 Подсчет и выражение результатов | - | - | 10 Дополнительное подтверждение принадлежности выявленных бактерий к колиформным бактериям | 10.1-10.4 | - |
11 Точность | - | - | - | - | - |
12 Протокол испытания | - | - | 11 Протокол испытания | - | - |
Приложение А | - | - | Приложение А | - | - |
Б.2 Сопоставление структуры настоящего стандарта со структурой ИСО 4832:2006 приведено в таблице Б.2
Таблица Б.2
Структура международного стандарта | Структура настоящего стандарта | ||||
Раздел | Пункты | Подпункты | Раздел | Пункты | Подпункты |
1 Область распространения | - | - | 1 Область применения | - | - |
2 Нормативные ссылки | - | - | 2 Нормативные ссылки | - | - |
3 Термины и определения | 3.1 | - | 3 Термины и определения | 3.1-3.3 | - |
4 Сущность метода посева в агаризованную среду | 4.1-4.4 | - | 5 Методы определения количества колиформных бактерий - подсчет колоний | 5.1, 5.2 | 5.1.1-5.1.3, 5.2.1-5.2.3 |
5 Питательные среды и разведения | 5.1-5.4 | - | 6 Питательные среды и реактивы | 6.1-6.14 | - |
6 Аппаратура и посуда | 6.1-6.11 | - | 7 Аппаратура, посуда, материалы и реактивы | - | - |
7 Отбор проб | - | - | 8 Отбор и подготовка проб | - | - |
8 Подготовка проб | - | - | |||
9 Испытание с подтверждением принадлежности только атипичных колоний к колиформным бактериям | 9.1-9.4 | 9.2.1-9.2.4 | 9 Проведение испытания | 9.3 | 9.3.1-9.3.6 |
10 Выражение результатов | - | - | 10 Дополнительное подтверждение принадлежности выявленных бактерий к колиформным бактериям | 10.1-10.4 | - |
11 Точность | - | - | - | - | - |
12 Протокол испытания | - | - | 11 Протокол испытания | - | - |
- | - | - | Приложение А | - | - |
Приложение В
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации, использованным в настоящем стандарте в качестве нормативных ссылок
Таблица В.1
Обозначение ссылочного межгосударственного и национального стандарта Российской Федерации | Обозначение и наименование ссылочного международного стандарта и условное обозначение степени его соответствия ссылочному национальному стандарту |
ГОСТ Р 51446-99* (ИСО 7218-96) | ИСО 7218:1996 "Микробиология продуктов питания и кормовых продуктов. Общие правила микробиологических исследований" (MOD) |
ГОСТ 9284-75 | - |
ГОСТ 10444.1-84 | - |
ГОСТ 24104-2001 | - |
ГОСТ 25336-82 | - |
ГОСТ 26668-85 | - |
ГОСТ 26669-85 | - |
ГОСТ 26670-91 | - |
ГОСТ 29184-91 | - |
ГОСТ 30425-97 | - |
* С 1 января 2010 г. введен в действие ГОСТ Р ИСО 7218-2008. Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: - MOD - модифицированный стандарт. | |
УДК 663/.664:543.9:006.354 | ОКС 07.100.30 | Н09 | ОКСТУ 9109 |
Ключевые слова: колиформные бактерии, колониеобразующие единицы (КОЕ), типичные и атипичные колонии, питательные сферы, инкубирование посевов, оксидаза, окраска по Граму, наиболее вероятное число (НВЧ) | |||
Электронный текст документа
и сверен по:
Продукты пищевые, консервы.
Методы микробиологического анализа:
Сб. ГОСТов. - , 2010

