ГОСТ ISO 13307-2015
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
Микробиология пищевых продуктов и кормов для животных
НАЧАЛЬНАЯ СТАДИЯ ПРОИЗВОДСТВА
Методы отбора проб
Microbiology of food and animal feed. Primary production stage. Sampling techniques
МКС 07.100.30
Дата введения 2017-01-01
Предисловие
Цели, основные принципы и порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Открытым акционерным обществом Всероссийский научно-исследовательский институт сертификации (ОАО "ВНИИС") на основе собственного аутентичного перевода на русский язык международного стандарта, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 29 мая 2015 г. N 77-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Украина | UA | Минэкономразвития Украины |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 10 августа 2015 г. N 1117-ст межгосударственный стандарт ГОСТ ISO 13307-2015 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2017 г.
5 Настоящий стандарт идентичен международному стандарту ISO 13307:2013* Microbiology of food and animal feed - Primary production stage - Sampling techniques (Микробиология пищевых продуктов и кормов для животных. Начальная стадия производства. Методы отбора проб)
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Международный стандарт разработан подкомитетом ISO/ТС 34/SC 9 "Микробиология" Технического комитета по стандартизации ISO/TC 34 "Пищевые продукты" Международной организации по стандартизации (ISO).
Перевод с английского языка (en).
Официальные экземпляры международного стандарта, на основе которого подготовлен настоящий межгосударственный стандарт, и международных стандартов, на которые даны ссылки, имеются в Федеральном информационном фонде технических регламентов и стандартов.
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам приведены в дополнительном приложении ДА.
Степень соответствия - идентичная (IDТ)
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
Настоящий стандарт устанавливает методы отбора проб на начальной стадии производства продукции животного происхождения с целью выявления и подсчета жизнеспособных микроорганизмов, особенно пищевых патогенов.
Настоящий стандарт не предназначен для диагностики болезней животных.
2 Нормативные ссылки
Для применения настоящего стандарта необходимы следующие ссылочные документы*. Для недатированных ссылок применяют последнее издание ссылочного документа (включая все его изменения).
________________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ISO 6887-1 Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 1: General rules for the preparation of the initial suspension and decimal dilutions (Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 1. Общие правила приготовления исходной суспензии и десятичных разведений)
ISO 7218 Microbiology of food and animal feeding stuffs - General requirements and guidance for microbiological examinations (Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 начальная стадия производства (primary production stage): Совокупность этапов производства пищевой продукции, включая все стадии - от фермы до сбора урожая или поставки животных на бойню.
3.2 лабораторная проба (laboratory sample): Проба, готовая для отправки в лабораторию и предназначенная для контроля или анализа.
4 Общая информация
4.1 Общие положения
Заинтересованным сторонам, а также их представителям предоставляется возможность присутствовать при отборе проб.
В том случае, когда при отборе проб или конкретном виде анализа необходимо выполнять определенные (например, диктуемые законом) требования, эти требования всегда выполняют.
4.2 Персонал, осуществляющий отбор проб
Отбор проб для микробиологических исследований проводит персонал, прошедший надлежащее обучение и имеющий опыт отбора проб.
4.3 Упаковка и маркировка проб
Пробы упаковывают таким образом, чтобы не допустить перекрестного загрязнения, просачивания жидкости или ее испарения. Пробы должны легко идентифицироваться.
Минимальная информация, которую прилагают к пробам, включает природу материала пробы, ее идентификацию, фамилию или инициалы лица, ответственного за отбор проб, а также дату, время (при необходимости) и место отбора проб.
Данную информацию приводят на бланке. Для нескольких проб допускается использовать один бланк при условии, что каждая проба имеет однозначную идентификацию и к пробам приложен бланк отбора проб, в котором перечислены данные о пробах с их отличительными идентификационными кодами.
4.4 Подготовка акта отбора проб
К пробам прилагают акт, представляемый лабораторией, правильно и полностью заполненный по стандартной форме, на котором проставлена подпись или инициалы персонала, проводившего отбор проб. Акт содержит следующую информацию:
- место, дату и время (при необходимости) отбора проб;
- фамилии персонала, проводившего отбор проб;
- источник, количество и идентификационный код проб, входящих в партию;
- цель отбора проб и наименование микроорганизмов, которые предполагается выявлять.
При необходимости в акт включают информацию о любых условиях или обстоятельствах, а также любую дополнительную информацию о материале, отбор проб которого проводят, например трудности в получении представительных проб.
Акт также должен содержать сведения о любых дополнительных вспомогательных веществах - разбавителях, транспортных средах или нейтрализующих средствах, если они использовались.
5 Разбавители и дезинфицирующие средства
5.1 Разбавители
5.1.1 Общие положения
Разбавитель, используемый для пропитывания всех видов тампонов (тампонов для обуви, палочковых тампонов и т.д.):
- раствор пептонный солевой, приготовленный по ISO 6887-1;
- вода буферная пептонная, приготовленная по ISO 6887-1;
- вода стерильная;
- питьевая вода для проб при условии, что ее испытание не повлияет на проведение анализа, пригодная, например, для тампонов для обуви.
5.1.2 Транспортные среды
Основная задача данных сред - обеспечение выживания искомой популяции микроорганизмов. Например, Campylobacter особо чувствительны к высушиванию.
Примеры транспортных сред:
- вода буферная пептонная, предназначенная для Salmonella, приготовленная по ISO 6887-1;
- среда транспортная Cary-Blair или аналогичная;
- среда транспортная Amies с активированным углем или аналогичная.
В том случае, когда пробы имеют выраженную кислотность или щелочность, либо приобретают данное свойство в процессе транспортирования, допускается применение буферного разбавителя.
При проведении подсчета микроорганизмов необходимо учитывать возможность размножения целевых или конкурирующих микроорганизмов.
5.2 Дезинфицирующие средства для обеззараживания упаковки, инструментов и поверхности проб
5.2.1 Этанол, объемной долей 70%.
5.2.2 Салфетки влажные, пропитанные спиртом.
5.3 Нейтрализующие средства для удаления остатков дезинфицирующих средств
5.3.1 Общие положения
Поскольку каждое дезинфицирующее средство эффективно нейтрализуется конкретным химическим реагентом (см. таблицу 1), не существует нейтрализующего средства, пригодного для всех случаев применения. Вместе с тем, если предполагают использование дезинфицирующего средства, состав которого не известен, используют нейтрализующее средство общего применения (см. 5.3.2).
Таблица 1 - Компоненты нейтрализующих средств и нейтрализуемые вещества
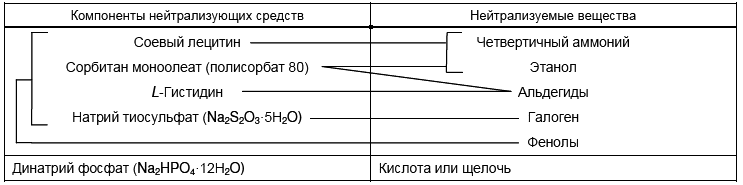
5.3.2 Нейтрализующее средство общего применения
5.3.2.1 Состав:
- соевый лецитин - 3,0 г;
- сорбитан моноолеат (полисорбат 80) - 30,0 г;
- L-Гистидин - 1,0 г;
- натрий тиосульфат (NaS
О
·5H
О) - 7,8 г;
- динатрий фосфат (NaHPО
·12H
О) - 100,8 г;
- вода - 1000 см.
5.3.2.2 Приготовление
Компоненты растворяют в воде при нагревании. Стерилизуют в течение 15 мин в автоклаве при температуре 121°C. Готовую среду хранят при температуре (5±3)°C в течение 3 мес в герметичном, защищенном от света контейнере.
Данную нейтрализующую жидкость, как правило, добавляют в разбавитель (5.1) в количестве 10% (по объему).
6 Оборудование и материалы
6.1 Оборудование и средства для отбора проб (включая описание)
6.1.1 Общие положения
Многоразовое оборудование для отбора проб стерилизуют перед использованием, например влажным жаром (в автоклаве) или сухим теплом (в сушильном шкафу), в соответствии с ISO 7218. В некоторых случаях может потребоваться химическое обеззараживание. После данной обработки оборудование становится чистым, стерильным и не содержит ингибирующих веществ. В том случае, когда при отборе проб оборудование предполагается использовать повторно, стерилизацию предпочтительно проводить фламбированием (см. 6.1.10), этанолом объемной долей 70% либо любым другим подходящим дезинфицирующим средством (см. ISO 7218). При отборе проб продукции на начальной стадии производства требуются запечатанные контейнеры, содержащие различные одноразовые полимерные средства (например, перчатки, бахилы, пластиковые мешки). Используют новый контейнер при каждой новой процедуре отбора проб (например, для каждой отдельной фермы). При отборе проб предпринимают все меры предосторожности с целью недопущения загрязнения неиспользованного одноразового оборудования (или материалов).
6.1.2 Перчатки: одноразовые, водонепроницаемые, используемые при отборе проб, обеспечивающие защиту персонала, проводящего отбор проб, и предотвращающие перекрестное загрязнение. В качестве альтернативы используют пластиковые мешки, вывернутые наизнанку и надетые на руку(и).
6.1.3 Бахилы: прочные чистые пластиковые мешки подходящего размера или пластиковые чехлы, имеющие форму ботинка, специально предназначенные для надевания на обувь. Бахилы используют со следующими целями: в качестве биозащиты при посещении фермы для предотвращения загрязнения; для использования при отборе проб тампонами для обуви (6.1.6).
6.1.4 Тканевые тампоны: как правило, большие стерильные куски ткани, такой как марля, целлюлозная губка, тканый и нетканый текстильный материал. Используют для взятия пробы с больших площадей поверхности.
6.1.5 Палочковые тампоны: тампоны из хлопка и все виды тампонов, содержащие малые куски хлопка или синтетического материала, закрепленные на конце деревянной, металлической или пластиковой палочки. Данные тампоны часто хранят в стерильных пробирках, которые могут содержать определенную среду, например транспортную среду Amies с активированным углем. Используемые материалы не должны содержать ингибирующих веществ, если только это не требуется для целевого выделения конкретного микроорганизма.
6.1.6 Тампоны для обуви (для подошвы обуви): приспособления из тканевого тампона, предназначенные для ношения поверх обуви для того, чтобы лицо, проводящее отбор проб, могло отбирать пробы, передвигаясь по зоне отбора проб и занимаясь другой деятельностью. Тампоны для обуви должны обладать достаточной способностью поглощать влагу. Они могут быть изготовлены из трубчатого эластичного материала, используемого для перевязки, который нарезают на куски подходящей длины и надевают на обувь. В качестве альтернативы используют имеющиеся в продаже тканевые бахилы (за исключением бахил с пластиковой подошвой) либо иной подходящий и стерильный материал, который покрывает подошву ноги - например, стерильные тканевые чепцы. В целях предотвращения возможного загрязнения, источником которого является обувь лица, проводящего отбор проб, после входа в зону отбора проб тампоны для обуви надевают на новые пластиковые бахилы (6.1.3).
6.1.7 Тампоны для протирки (используют главным образом в птицеводстве): комплект, состоящий из четырех больших увлажненных кусков ткани (например, впитывающие подушечки, не содержащие противомикробных веществ), прикрепленных к палке, которой проводят по подстилке, щелевым поверхностям или углублениям, содержащим экскременты. Допускается также применение малых губчатых тампонов для протирки, однако их рабочая поверхность ограничена по сравнению с обычными тампонами.
6.1.8 Тампоны Moore: обычно представляют собой составные тканевые тампоны из нескольких слоев марли или ваты, вшитой в марлю. Часто используют гигиенические полотенца (не содержащие противомикробных веществ). Также используют большие целлюлозные губки.
6.1.9 Тампоны из веревки: комплект мягких, стерильных пеньковых веревок диаметром 1-2 мм (например, семь веревок на большой загон для кормления скота), помещенных горизонтально непосредственно над кормушками и корытами с водой, чтобы скот, содержащийся в загоне, их задевал и имел возможность жевать веревки.
6.1.10 Горелка переносная газовая или лампа паяльная.
6.1.11 Пинцеты стерильные, скальпели, ножницы.
6.1.12 Ножницы или шпатели стерильные.
6.1.13 Щетки жесткие стерильные.
6.1.14 Сумка-холодильник с теплоизоляцией, имеющая встроенную систему охлаждения, или термостатическая сумка, способные обеспечить сохранение проб при пониженной температуре (не ниже 0°C) в процессе транспортирования в лабораторию.
6.2 Контейнеры для проб
Материалы и конструкция контейнеров для проб и крышек должны обеспечивать сохранность пробы и препятствовать ее изменению, что могло бы повлиять на результаты последующих анализов. Контейнеры представляют собой пластиковые мешки или жесткие емкости (пластиковые или стеклянные бутылки или банки с завинчивающимися крышками). Контейнеры и крышки должны быть сухими, чистыми, герметичными и стерильными.
Форма и вместимость контейнеров должны соответствовать конкретным требованиям к продукту, отбор проб которого проводят. Контейнеры (кроме пластиковых мешков) должны надежно закрываться при помощи подходящих пробок или крышек.
7 Методы отбора проб - Общие рекомендации
Отбор проб от животных и из окружающей их среды, в том числе в процессе транспортирования и на бойне осуществляют в целях мониторинга переноса зоонозных микроорганизмов живыми животными.
Отбор проб проводят таким образом, чтобы были получены представительные пробы анализируемых материалов.
Отбор проб проводят в стерильных условиях, при помощи оборудования и материалов (контейнеры, указанные в разделе 6, также должны быть стерильными).
Выбранный метод отбора проб, а также масса (или объем) отбираемой пробы зависят от природы материала и целей, для которых требуются пробы. Подробные требования изложены в разделах 8 и 11. Контейнер с пробой закрывают немедленно после ее отбора.
8 Методы отбора проб, применяемые в условиях фермы
8.1 Пробы, отбираемые после чистки и дезинфекции
Проведение отбора проб с дезинфицированных поверхностей затруднено, поскольку могут присутствовать остатки дезинфицирующего средства, и наименование данного средства часто неизвестно. Допускается использовать особое или "универсальное" нейтрализующее средство, однако некоторые из них оказывают непредсказуемое влияние на рост микроорганизмов, подверженных негативному воздействию, и конкурирующую флору, что приводит к ложным отрицательным тестам.
При отборе проб со стойла, прошедшего дезинфекцию, оптимальным вариантом является взятие проб после того, как все поверхности были высушены, с целью минимизации ингибирующего влияния дезинфицирующих средств, отбираемых вместе с пробами. Пробы отбирают со стен, пола, поилок, кормушек, гнезд, перегородок, передвижного оборудования (такого как весы), вентиляционного трубопровода, балок и выступов, панелей управления, а также с пола тамбура или зон подсобных помещений. Допускается также отбор проб с системы конвейера, проходящей через птичники для клеточных несушек.
Рекомендуется (когда это целесообразно) непосредственно после отбора проб перенести тампон в избыток (не менее 1 массовой части к 100 объемным частям) подходящего бульона для обогащения или предварительного обогащения (например, тканевый тампон в 225 см BPW для Salmonella или в другую конкретную среду), в результате чего дезинфицирующее средство будет разбавлено и/или инактивировано. В данном случае лабораторные пробы культивируют в день их отбора.
Если нет возможности проводить анализ в тот же день, что и отбор проб, перед проведением отбора проб тампон увлажняют разбавителем с нейтрализующим средством.
Если дезинфицирующее средство известно, к подходящему разбавителю (5.1) добавляют соответствующее нейтрализующее средство (см. таблицу 1).
Если имеются подозрения, что дезинфицирующее средство использовалось, но его природу установить нельзя, добавляют "универсальное" нейтрализующее средство (5.3.2).
8.2 Отбор проб с поверхности
8.2.1 Отбор проб тканевыми тампонами
При работе с каждой новой пробой данный тип тампона (6.1.4) допускается держать в новой перчатке (6.1.2) либо использовать "метод вывернутого наизнанку мешка", когда полиэтиленовый мешок (6.1.2), которым держат тканевый тампон, вывернут наизнанку и тампон выставлен наружу; затем тампоном отбирают пробу с поверхности. Каждым тампоном энергично протирают выбранные поверхности, чтобы захватить всю поверхность и чтобы загрязнение тампона наблюдалось невооруженным глазом. Минимальная поверхность, с которой проводят отбор проб, составляет 1 м. Далее мешок выворачивают, приводя в исходное положение, запечатывают и используют для транспортирования тампона. При отборе проб с сухих поверхностей тампоны смачивают подходящим разбавителем (5.1). Для максимального охвата поверхности, с которой проводят отбор проб, и максимального перехода отбираемого материала в тампон используют обе стороны тампона. Тампон прикладывают к различным частям поверхности, отбор проб с которой проводят.
При отборе проб с поверхностей, имеющих трещины и борозды, тканевые тампоны допускается складывать и прикреплять к стерильному деревянному шпателю или аналогичному инструменту и с усилием проводить им по трещинам, совершая движения как при нарезании (например, пирога).
8.2.2 Отбор проб палочковыми тампонами
С целью обеспечения максимального сбора микроорганизмов, палочковые тампоны (6.1.5) должны быть достаточно большими (насколько это целесообразно).
При отборе проб с очень влажных поверхностей тампоны допускается использовать сухими; если поверхности сухие (например, пробы окружающей среды), тампоны смачивают подходящей жидкостью-разбавителем (см. 5.1).
Тампон извлекают из стерильной оболочки и смачивают кончик путем погружения в пробирку с жидкостью-разбавителем. Кончик тампона отжимают о стенку пробирки с целью удаления избытка жидкости.
При отборе проб с поверхностей проводят тампоном по достаточно большой площади поверхности, чтоб обеспечить обильное покрытие отбираемым материалом всех частей тампона. Оптимально отбирают пробы тампоном с нескольких разных мест либо используют несколько тампонов с целью достижения максимального сбора искомого микроорганизма. При отборе проб с поверхностей, имеющих трещины и борозды, стараются отобрать органический материал с максимальной глубины и собрать на тампон как можно больше материала. После процедуры отбора проб палочку обламывают или отрезают в стерильных условиях. При необходимости помещают ее в транспортную среду (см. 12).
8.3 Отбор проб с пола
8.3.1 Отбор проб тампонами для обуви
Следует убедиться в том, что площадь поверхности тампонов для обуви (6.1.6) максимальна, и они достаточно увлажнены до использования. Тампоны для обуви носят поверх чистых бахил (6.1.3). Ни бахилы, ни тампоны для обуви не должны контактировать с дезинфицирующими средствами. Таким образом, в зону отбора проб необходимо входить через дезинфицирующее средство до того, как будут надеты бахилы и тампоны для обуви. Тампоны для обуви допускается использовать при отборе проб с любого типа поверхности пола. Тампоны для обуви для отбора проб от группы животных используют до произведения изменений или обновления подстилок для животных.
Тампоны для обуви допускается смачивать питьевой водой или другим подходящим разбавителем (см. 5.1) либо используют тампоны, предварительно увлажненные. Важно пройти по большой представительной области пространства для отбора проб. Например, в птичнике делают не менее 100 шагов, принимая во внимание полную длину и ширину птичника и охватывая любые зоны, где имеются подстилки и углубления, а также зоны накопления экскрементов или мокрых подстилок под поилками.
Перед входом в каждую новую зону надевают новые бахилы.
8.3.2 Отбор проб тампонами для протирки
Тампоны для протирки (6.1.7) допускается использовать в тех же ситуациях, что и тампоны для обуви, и принцип отбора проб аналогичен, т.е. важно адекватно представить поверхности, отбор проб с которых проводят. Оптимальным является применение нескольких тампонов для одной поверхности. Для повышения их эффективности на тампон для протирки наступают через определенные интервалы, при этом на ногах носят бахилы (6.1.3).
8.3.3 Пробы с подстилок
8.3.3.1 Описание
Подстилка - принадлежность, на которой располагается животное, загрязненная экскрементами.
8.3.3.2 Методика отбора проб
Подстилка для домашней птицы, расположенная на уровне пола, является весьма удобным объектом для взятия проб. Однако данная процедура часто отличается малой репрезентативностью, в результате чувствительность метода будет недостаточной. Оптимальным является вариант сбора большой пробы и последующий отбор анализируемых проб на ферме. Наилучший способ отбора проб с подстилок состоит в передвижении по всему помещению для животных, отбирая пробы с подстилок с не менее чем 60 отдельных поверхностей в помещении, с целью сбора совокупного количества, равного приблизительно 2 кг. Данную пробу направляют в лабораторию либо тщательно перемешивают и отбирают из нее анализируемую пробу массой не менее 25 г, которую направляют в лабораторию. Пробы с подстилок отбирают до произведения обновлений принадлежностей.
8.3.4 Пробы экскрементов, отобранные с пола и объединенные искусственно
8.3.4.1 Описание
Экскременты с пола - экскременты, собираемые с пола в помещении, в котором размещены животные.
8.3.4.2 Методика отбора проб
Допустимо объединение 5-20 отдельных кусков экскрементов без существенного снижения чувствительности выявления Salmonella, что является результатом конкуренции между конкурирующей флорой и действием ингибирующих веществ, таких как органические кислоты, бактериоцинов или бактериофагов. Вместе с тем, от домашней птицы часто отбирают объединенные пробы большего размера, перемешивают и отбирают из них анализируемую пробу. Это может повысить риск чрезмерного разбавления и привести к неудачной попытке выявления требуемого материала в объединенной пробе, когда частота заболеваний в пределах стаи низкая; но это также может повысить вероятность включения экскрементов особей, распространяющих большое число микроорганизмов. Как правило, идеальными являются пробы экскрементов, перемешанных естественным образом, накапливающихся на скребках в навозной зоне, или на дощатом настиле в птичниках, или на скатах для жижи, скребках и навозоразбрасывателях на фермах, где содержатся свиньи и крупный рогатый скот. Таким образом, экскременты от большого числа животных образуют пробу, которая накапливается в течение длительного времени. Важно гарантировать, что распределение отобранных проб является репрезентативным для стаи или стада. В больших пробах экскрементов (например, крупного рогатого скота) искомый патогенный микроорганизм может быть неоднородно распределен по отдельной пробе экскрементов. Таким образом, чтобы обеспечить максимальную вероятность выявления искомого микроорганизма, отбирают достаточное количество анализируемых проб.
Не рекомендуется проводить объединение отдельных проб экскрементов при выявлении микроорганизмов, для которых культуральные тесты на выявление недостаточно чувствительны, поскольку конкурирующее влияние другой флоры превышает предел обнаружения искомого микроорганизма, который относительно высок.
8.3.5 Пробы экскрементов, перемешанные естественным образом
8.3.5.1 Описание
Это экскременты, скопившиеся в естественных условиях, выделенные животными, которых содержат группами. Накопление экскрементов может происходить в течение значительного периода времени, либо они могут быть сконцентрированы при помощи операций очистки от навоза, проводимых вручную или автоматически.
8.3.5.2 Методика отбора проб
Экскременты, перемешанные естественным образом и находящиеся в отдельных загонах или выделенные группами животных (например, свиньями или крупным рогатым скотом), допускается собирать вручную при помощи шпателей или ложек (6.1.12), которые могут быть встроены в сосуд для отбора проб, или рукой, на которую надета перчатка. В качестве альтернативы экскременты допускается собирать с земли рукой, на которую надет вывернутый наизнанку пластиковый пакет (с чистыми стенками). После процедуры отбора проб пакет снимают с руки и выворачивают в нормальное положение, при этом проба экскрементов оказывается внутри. Далее пакет запечатывают. В качестве альтернативы допускается использовать тканевый тампон (6.1.4) для протирки поверхности, на которой скопились свежие экскременты.
Пробы свежих экскрементов, перемешанных естественным образом - это перемешанные скопления экскрементов, которые накапливаются на настиле для помета или скребках после запуска скребков или ленточного транспортера для уборки помета в птичниках для клеточных несушек; это материал, накапливаемый в загоне, на автоматических скребках или скатах для навоза и навозоразбрасывателях в свиноводстве; это навоз в совместных зонах кормления и поения в помещениях для стада молочного скота. Нет возможности провести отбор данных проб в системах содержания на глубокой подстилке, однако в этом случае может иметь место протечка жидкости, которую можно собрать из подстилки при помощи тканевых тампонов. В качестве альтернативы при отборе проб с подстилок допускается использовать тампоны для обуви.
8.4 Пробы пыли
8.4.1 Описание
Пыль образуется в результате оседания частиц в воздухе, главным источником которых являются высушенные экскременты животных, а также частицы кожи, волос или шерсти животных и высушенные фрагменты материала окружающей среды (например, сухие частицы подстилки) и мелкие частицы кормов.
Пробы пыли нельзя использовать для мониторинга микроорганизмов, чувствительных к высушиванию (например, Campylobacter).
8.4.2 Методика отбора проб
Пыль собирают вручную при помощи перчатки либо с пола при помощи стерильных жестких щеток (6.1.13) подходящего размера. Если при сборе пыли возникают трудности, в качестве вспомогательного средства используют скребки. В том случае, когда пыль слишком сильно рассеяна, для сбора тонких слоев пыли с поверхностей допускается использовать увлажненные тканевые тампоны (6.1.4). Как и для большинства видов проб, чем большее количество пыли будет собрано, тем более чувствительным будет дальнейший анализ. Следует избегать отбора проб пыли из зон, которые располагаются вблизи систем подачи корма, так как пылевые частицы корма преобладают в составе пыли, которая накапливается в данных зонах. Пыль отбирают в основном с лопастей вытяжных вентиляторов, выступов, площадок и балок помещения для животных или оборудования (передвижного или стационарного), и с проходов между загонами. Допускается также для сбора пыли размещать временные полки в ключевых зонах, если имеющаяся планировка не подходит для данной цели. Используют также электростатические устройства. Пыль не отбирают с обогревательных и осветительных приборов, которые недавно использовали, поскольку тепло и свет приводят к сокращению количества бактерий в пробе.
8.5 Пробы воды
8.5.1 Описание
Пробы воды содержат осадок (если он имеется) и тампоны из систем подачи воды.
8.5.2 Методика отбора проб
Пробу воды отбирают сухим тканевым тампоном (6.1.4), при этом захватывают осадок, находящийся в поилках конусного и корытообразного типа, и проводят тампоном по границе между корытом и контейнером с водой, избегая по возможности касания зон, в которых имеются водоросли или простейшие организмы. В ходе данной процедуры тампон впитывает 20-30 см воды.
Как правило, не проводят отбор проб тампоном с капельных поилок или с их чашек для разбрызгивания в помещениях для животных, так как в этом случае будет выявлено лишь общее загрязнение окружающей среды. Когда животные пьют из природных источников на выпасе, оптимальным является отбор таких проб, как осадок воды, медленно текущей по руслу реки, или ручья, или во впадинах родников, где этот осадок накапливается. Данный осадок отбирают в банку или собирают тканевым тампоном.
При отборе проб из главного водопровода, когда вода еще не доставлена к животным, оптимальным является отбор больших количеств воды (5-10 дм).
Альтернативный подход заключается в установке встроенного фильтра в системе подачи воды, который периодически тестируют, либо в прикреплении стерильной целлюлозной губки или тампона в цистерне с водой; при этом микроорганизмы активно оседают на губку или тампон. Затем их извлекают и культивируют in situ через 1-2 сут.
8.6 Тампоны Moore для сточных вод
Тампоны Moore для сточных вод (6.1.8) используют для концентрирования микроорганизмов в жидкостях, проходящих через системы очистки, такие как сточные трубы или водотоки.
Данные средства полезно использовать для отбора проб в целях выявления Salmonella на месте. Как правило, тампоны прикрепляют внутри сточных труб или каналов, где осуществляют обработку жидких отходов, на период 5-7 сут, по истечении которого их удаляют и культивируют.
8.7 Тампоны из веревки
Данный метод успешно используют для выявления штамма Escherichia соli O157 (VTEС), продуцирующего веротоксин, в группах крупного рогатого скота; вместе с тем, аналогичный принцип применим к большинству микроорганизмов, устойчивых в окружающей среде.
Шкура крупного рогатого скота, как правило, загрязнена экскрементами. Животные часто лижут свою шкуру во время чистки. При этом происходит загрязнение языка и ротовой полости. При подвешивании стерильных веревок (6.1.9) непосредственно над кормушкой и поилкой животные в загоне трутся о них и жуют их, в результате чего бактерии попадают на веревки. По истечении 24 ч in situ веревки удаляют и культивируют путем погружения в бульон для обогащения с целью выявления искомых микроорганизмов.
8.8 Одноразовые встроенные фильтры для молока
Одноразовые встроенные фильтры для молока, как правило, устанавливают между молочным оборудованием и цистерной с целью удаления из молока крупных посторонних частиц, в том числе экскрементов. Фильтры являются одноразовыми, и их обычно изготавливают из бумаги. Материал, накапливающийся на фильтрах, позволяет провести эффективную общую оценку микробиологического статуса и стандарта гигиены на ферме, поскольку на фильтрах оседает материал из различных источников, из которого отбирают единичную пробу.
Если одноразовый фильтр отсутствует, допускается отбор промывных вод со статических фильтров, получаемых путем ополаскивания фильтра разбавителем, которые затем могут быть использованы для различных микробиологических анализов.
9 Методика отбора проб с животных
9.1 Отбор проб с животных на ферме
9.1.1 Отбор проб палочковыми тампонами
Часто требуется фиксация животного. При отборе ректальных, клоачных или назальных проб тампонами (6.1.5) принимают меры, чтобы не допустить нанесения повреждений животному при попытке изъятия максимального количества материала тампонами. Данную процедуру проводят путем осторожного вращения тампона вокруг своей оси, в то же время тщательно исследуя края полости животного, отбор проб с которой проводят. Тампоны с деревянной палочкой не используют для отбора проб ректально. Тампон перед использованием смачивают изотоническим раствором, стерильной водой или любой средой, не ингибирующей бактерии и безопасной для животных.
9.1.2 Экскременты
9.1.2.1 Описание
Свежие экскременты отбирают с пола или непосредственно из прямой кишки животного. Как правило, оптимальным вариантом является сбор свежих экскрементов через короткий интервал времени после кормления, поскольку кормление способствует дефекации.
9.1.2.2 Методика отбора проб
Составная проба экскрементов состоит из смеси свежего материала экскрементов, собранного с не менее пяти различных точек на полу загона, и характеризующая распределение экскрементов в загоне.
При отборе проб экскрементов конкретного животного часто требуется его фиксация. Пробы экскрементов осторожно извлекают из прямой кишки пальцами, на которые надеты новые или стерильные перчатки (6.1.2); при проведении процедур с каждой новой особью животного перчатки меняют.
9.1.3 Тампоны для отбора проб кожи, шкуры или перьев
9.1.3.1 Описание
Кожа, шкура и перья бывают загрязнены экскрементами, поэтому они являются подходящим объектом отбора проб, который может указать на присутствие патогенных микроорганизмов в группе.
Используют большие смоченные тампоны, состоящие из кусков ткани (см. 6.1.4).
9.1.3.2 Методика отбора проб
Часто требуется фиксация животного, однако отбор проб нередко проводят во время кормления, когда внимание животного отвлечено. На один загон отбирают репрезентативное количество животных.
Последовательно отбирают тампоном пробы со спины животных или другой загрязненной области (с не более пяти животных при использовании одного тампона). При работе со свиньями вполне эффективен отбор проб со спины, от области плеч до хвоста, используя один тампон. Для других животных более подходящим является отбор проб с зоны промежности и брюшной зоны.
9.1.4 Пробы, отобранные тампонами с ректоанального соединения
9.1.4.1 Описание
Различные исследования подтвердили факт предпочтительного размножения VTEC О157 в зоне ректоанального соединения у крупного рогатого скота. Таким образом, отбор проб тампоном вручную с ректоанального соединения может дать более точный результат, чем отбор экскрементов. Используют марлевые тампоны (6.1.4).
9.1.4.2 Методика отбора проб
Пробы из отдельных особей отбирают вручную, прикладывая пальцами марлевый тампон к слизистой оболочке, располагающейся непосредственно внутри ануса. В случае взрослых особей крупного рогатого скота тампон оборачивают вокруг руки и в процессе ректального исследования руку вращают.
9.2 Отбор проб животных на бойне
9.2.1 Содержимое прямой кишки
9.2.1.1 Описание
Содержимое прямой кишки, отбираемое на бойне, отбирают после смерти животного путем взятия прямой кишки или ее содержимого после потрошения, или в некоторых случаях допускается отбор проб прямой кишки до потрошения.
9.2.1.2 Методика отбора проб
При помощи переносной газовой горелки прижигают внешнюю поверхность прямой кишки или дезинфицируют этанолом или спиртовыми салфетками (5.2); дезинфицирующему средству дают испариться.
Собирают не менее 25 г содержимого прямой кишки в стерильные запечатанные мешки или в стерильные контейнеры с завинчивающимися крышками.
9.2.2 Содержимое слепой кишки или целая слепая кишка
9.2.2.1 Описание
Содержимое слепой кишки отбирают из кишечника после потрошения.
Наилучшей пробой в птицеводстве является неповрежденная слепая кишка. Закрытый конец слепой кишки свиней и других видов животных обрезают и направляют в лабораторию, либо внешнюю поверхность слепой кишки тщательно дезинфицируют и ее содержимое отбирают на месте.
9.2.2.2 Методика отбора проб
9.2.2.2.1 Домашняя птица
Кишечник, проксимальный и дистальный по отношению к слепой кишке, отделяют путем приложения усилий или отрезания, и оба цекальных мешка, все еще соединенных, помещают в стерильный контейнер. В качестве альтернативы осторожно удаляют один заполненный цекальный мешок, не допуская разлива содержимого.
9.2.2.2.2 Свиньи и другие животные
Берут кишечник и блокируют вход в слепую кишку рукой. Содержимое слепой кишки путем надавливания перемещают по кишке по направлению к закрытому концу. При помощи переносной газовой горелки прижигают поверхность кишки или дезинфицируют этанолом (5.2); этанолу дают испариться.
При помощи стерильного скальпеля в стенке слепой кишки делают отверстие в форме петли длиной приблизительно 0,5 см. Слепую кишку поворачивают таким образом, чтобы петля была направлена вниз. Как правило, не требуется прилагать давление к слепой кишке для извлечения содержимого через петлеобразное отверстие, но в случае необходимости данную процедуру проводят. Содержимое кишки не должно касаться нестерилизованных зон слепой кишки; не допускается попадание капель жидкости с внешней стороны кишечника в пробу.
Пробы собирают в мешки или в большие стерильные контейнеры с плотно завинчивающимися крышками.
9.2.3 Брыжеечные лимфатические узлы
9.2.3.1 Описание
Изолируют кишку. Идентифицируют илеоцекальное соединение.
Илеоцекальную брыжейку разрывают рукой, чтобы были доступны илеоцекальные лимфатические узлы.
9.2.3.2 Методика отбора проб
Используют новые чистые перчатки (оптимальным вариантом являются плотно прилегающие пластиковые перчатки). Отрывают узлы от брыжейки и прилегающей жировой ткани вручную. Для получения 25 г объединенной пробы, как правило, требуется отбор проксимальных тощекишечных лимфатических узлов.
Пробы помещают в стерильные запечатанные мешки или контейнеры с завинчивающимися крышками.
9.2.4 Миндалины
9.2.4.1 Описание
В некоторых случаях для получения доступа к глотке необходимо удалить нижнюю челюсть (или подклювье). Язычные миндалины расположены парно в области корня языка; небная миндалина расположена в области неба, ниже слизистой оболочки мягкого неба. Язычные миндалины часто удаляют путем отрывания, либо их оставляют прикрепленными к голове.
9.2.4.2 Методика отбора проб
При помощи стерильных инструментов (скальпеля или пинцета) (6.1.11) осторожно вырезают две язычные миндалины, не допуская разрезания самих миндалин. В случае отсутствия язычных миндалин отбирают небную миндалину. Материал помещают в закрытый стерильный мешок или стерильный контейнер с завинчивающейся крышкой.
10 Методы отбора проб в птицеводстве
10.1 Общие положения
Данный вид отбора проб применяют главным образом для выявления Salmonella.
10.2 Пробы с вкладышей корзин инкубаторного цеха
10.2.1 Описание
Вкладыши корзин инкубаторного цеха - это листы бумаги, используемые для обкладки пластиковых или металлических подносов, в которых инкубируют яйца.
10.2.2 Методика отбора проб
Отбирают для пробы вкладыши с как можно большей площадью поверхности (в сумме - приблизительно 1 м). Это означает, что конечные большие пробы подлежат культивированию в больших мешках или в контейнерах, в которые они могут поместиться. Когда это уместно, в пробу также включают поврежденную яичную скорлупу, которую измельчают внутри вкладышей. Пробы вкладышей аккуратно собирают в стерильные мешки таким образом, чтобы на них осталось как можно больше налипшего материала.
10.3 Поврежденная яичная скорлупа
10.3.1 Описание
К данному типу проб относят пустую скорлупу, которая осталась после инкубирования и удаления из нее цыплят.
10.3.2 Методика отбора проб
Поврежденную яичную скорлупу, оставшуюся от инкубированных яиц, собирают при помощи систем, в которых не используют вкладыши для корзин. Фрагменты яиц, находящиеся в как можно большем количестве корзин в инкубаторе, собирают в большие мешки.
10.4 Пух в инкубаторе
10.4.1 Описание
Данный вид проб представляет собой легкий пылеобразный материал, источником которого является, главным образом, кожный покров цыплят, а также частицы сухого мекония и пыль, находящаяся на поверхностях внутри инкубатора.
10.4.2 Методика отбора проб
Хотя в процессе инкубирования, как правило, образуется значительное количество пуха, некоторые виды материала более пригодны для анализа, чем другие. Как правило, пух с пола инкубатора - наиболее подходящий материал для проб, но когда он содержит много влаги из-за высокой влажности в инкубаторе и должен быть доставлен в лабораторию, иногда лучше отбирать пробы более сухого пуха с более высоко расположенных зон, в частности пуха, который скапливается в вентиляционном трубопроводе инкубатора. Данную процедуру проводят при помощи руки, на которую надета перчатка, или тканевого тампона.
Для того чтобы не допустить распыления пуха по лаборатории и избежать последующего риска перекрестного загрязнения, рекомендуется собрать требуемое количество пуха, предназначенного для анализа, в достаточно большие мешки или сосуды таким образом, чтобы питательную среду можно было добавить непосредственно в емкость, в которой собрана проба. Также допускается сбор требуемого количества пуха (или пыли) в нежесткий марлевый мешочек с тем, чтобы избежать распространения мелких частиц материала при выполнении лабораторных процедур.
10.5 Меконий
10.5.1 Описание
Данные пробы представляют собой ранние кишечные выделения только что инкубированных цыплят, собранные путем выжимания клоаки вручную.
10.5.2 Методика отбора проб
Данную операцию, как правило, проводят при определении пола цыплят, когда клоаку исследуют вручную, что является частью обычной процедуры производства цыплят. Меконий накапливают в контейнере до получения объединенной пробы из не менее 250 цыплят. Более оптимальным вариантом является отбор проб из не менее 300 цыплят таким образом, чтобы было надежно выявлено загрязнение мекония на уровне 1%.
10.6 Тампоны для корзин инкубаторов
10.6.1 Описание
Данные пробы отбирают тканевыми тампонами (6.1.4).
10.6.2 Методика отбора проб
См. 8.2.1.
10.7 Измельченные отходы инкубаторов
10.7.1 Описание
Данная проба содержит все виды материала, который образовался в результате инкубирования партии яиц: яичную скорлупу, замершие эмбрионы, мертвых цыплят и отбракованных цыплят, которые были переработаны оборудованием для измельчения перед выбрасыванием в качестве отходов.
10.7.2 Методика отбора проб
Применение тканевых тампонов внутри оборудования для измельчения, а также для взятия проб разлитого и разбрызгавшегося материала внутри данного оборудования используют для оценки загрязнения измельченного материала.
10.8 Замершие эмбрионы
10.8.1 Описание
Данный вид материала - это эмбрионы цыплят, которые не смогли быть инкубированы. Их используют для посмертного анализа с целью выявления Salmonella, которая передается от родительского стада.
Поскольку яйца все еще являются неповрежденными, данные эмбрионы являются достаточно четким индикатором вероятной инфекции, вызванной Salmonella, в племенной стае. Существует проблема, что вероятность внутренней передачи микроорганизма от яйца, как правило, очень невелика; таким образом, вероятность выявления инфекции будет оставаться низкой до тех пор, пока не будет исследовано большое количество проб. При работе с данными пробами также не учитывают передачу Salmonella путем загрязнения поверхности скорлупы, через трещины и мембрану скорлупы.
10.8.2 Методика отбора проб
Как правило, отбирают и направляют в лабораторию не менее 60 яиц. Пробы внутренних органов и желточных мешков отбирают в стерильных условиях из эмбрионов и объединяют.
10.9 Отбракованные цыплята
10.9.1 Описание
Живые инкубированные цыплята, которые по причине своего пола (особи мужского пола из кладки яиц) или физических дефектов не подходят для разведения; их, как правило, бракуют на инкубаторе.
10.9.2 Методика отбора проб
Отбор проб проводят, следуя тем же принципам, что при отборе проб замерших эмбрионов. Как правило, отбирают и направляют в лабораторию не менее 60 цыплят.
10.10 Отбор проб при транспортировании цыплят на ферму
10.10.1 Описание
Данной пробой является лист бумаги, который укладывают на дно ящиков с цыплятами при их транспортировании на ферму. Цыплята загрязняют бумагу меконием. Если в качестве вкладыша используют тонкую древесную стружку, отбираемая проба будет менее подходящей по причине значительного объема стружки. В данном случае целесообразно отбирать пробы стружкового материала со дна большого количества ящиков при помощи тканевых тампонов.
10.10.2 Методика отбора проб
Оптимально данный вид проб отбирать до того, как цыплята будут перемещены в помещения на ферме. Однако это не всегда является практичным. Пробы отбирают с большой аккуратностью, чтобы минимизировать загрязнение, вносимое в помещениях на ферме или с рук лица, проводящего отбор проб.
На одну стаю отбирают не менее пяти вкладышей корзин (общая площадь поверхности должна быть не менее 1 м) в стерильный пластиковый мешок и помещают данную пробу во второй мешок, после чего направляют пробу в лабораторию.
11 Методы отбора проб с транспортных средств для животных, отсеков и ящиков
11.1 Общие положения
Отбор проб тампонами с транспортного средства для животных проводят незамедлительно после извлечения из него животных.
11.2 Транспортные средства для крупных животных (крупный рогатый скот, овцы, свиньи, лошади)
Для отбора проб остатков экскрементов на полу используют большие ручные тканевые тампоны (6.1.4) или, когда это целесообразно (в грузовиках для перевозки крупного рогатого скота), тампоны для обуви (6.1.6). Отбор проб проводят со всех участков поверхности пола, чтобы проба была репрезентативной. Как и в случае любого отбора проб с поверхностей, чем больше площадь поверхности, с которой отбирают пробу, и чем больше количество отдельных отбираемых и анализируемых проб, тем выше вероятность выявления искомого микроорганизма.
11.3 Транспортные ящики и отсеки для домашней птицы
Эффективная чистка и дезинфекция ящиков, используемых для поставки мясных птиц на бойню, проблематичны, поскольку загрязнение, выявленное использованием тампонов, может быть обусловлено предыдущими партиями птиц. Тем не менее отбор проб тампонами остатков экскрементов в ящиках и на полу транспортного средства может быть полезным для оценивания возможного загрязнения партией, поставляемой на бойню. Как и в случае любого отбора проб с поверхностей, чем больше количество ящиков, из которых отбирают пробу тампонами репрезентативно от всей партии, тем выше вероятность выявления микроорганизмов. Пробы отбирают тампонами только со дна ящиков, и более оптимальным является отбор проб из большого количества ящиков в течение короткого интервала времени, чем доскональный отбор проб из малого количества ящиков.
В том случае, когда ящики и отсеки используют для транспортирования птицы между зонами выращивания, убоя или размещения яиц (разведения или коммерческого производства яиц) между поставкой партий, оборудование эффективно обеззараживают таким образом, чтобы отбор проб тампонами более репрезентативно характеризовал статус текущей партии.
11.4 Отбор проб с транспортных средств после очистки и дезинфекции
Для наиболее досконального отбора проб с поверхностей, которых касались животные, а также с основных поверхностей внутри транспортного средства (в том числе с вентиляторов) используют ручные тканевые тампоны (6.1.4).
Для оценки потенциала транспортных средств переносить загрязнения (после очистки и дезинфекции) отбирают пробы тампонами с ниши для ног, колесной ниши и материала на поверхностях.
12 Хранение и транспортирование проб
12.1 Общие рекомендации
Основные требования изложены в ISO 7218.
Пробы транспортируют в соответствии с нормативными документами, касающимися биологической безопасности.
Интервал времени между отбором проб и анализом должен быть минимальным. Оптимальным является охлаждение проб перед их помещением в изолированные транспортные контейнеры, при транспортировании проб поддерживают низкую температуру. Если пробы транспортируют при комнатной температуре, их анализируют в сроки не более 24 ч с момента отбора. Пробы, охлажденные при транспортировании, анализируют в сроки не более 72 ч.
В случае проб экскрементов и проб окружающей среды, используемых для выявления Salmonella, их транспортирование допускается проводить при комнатной температуре при условии отсутствия избыточного тепла (выше 25°C) или воздействия солнечного света. Данные пробы анализируют в сроки не более 72 ч.
12.2 Рекомендации, касающиеся чувствительных микроорганизмов
В случае чувствительных микроорганизмов (например, Campylobacter) все тампоны смачивают, транспортируют и анализируют в течение 24 ч при комнатной температуре, либо в охлажденном состоянии - в течение 48-72 ч, в зависимости от вида пробы (см. таблицу 2). Следует принять меры предосторожности, не допуская замораживания охлажденных проб. В некоторых случаях полезно использовать транспортную среду, например среду Amies для палочковых тампонов или среду Саrу-Blair для тампонов для обуви (5.1.2). Лабораторные пробы, анализ которых нельзя проводить в день их доставки, до проведения анализа хранят в холодильнике.
В таблице 2 приведены рекомендации, касающиеся различных видов проб, отбираемых для анализа чувствительных микроорганизмов.
Таблица 2 - Рекомендации, касающиеся хранения, транспортирования, значений температуры и времени хранения для чувствительных микроорганизмов
Вид пробы | Транспортная среда | Температура, °C | Максимальное время до анализа, ч |
Экскременты (выбирают свежие и влажные пробы) | Не является необходимой (проба влажная в естественных условиях) | 2-10 | 72 |
2-25, температура окружающей среды | 24 | ||
Тампоны для обуви Тампоны с пробами окружающей среды (смоченные до использования) | Приводят во влажное состояние путем добавления подходящей транспортной среды или собирают в контейнер со средой, используемой для культивирования | 2-10 | 48 или в день сбора, если пробу собирали в целый объем, используемый для обогащения |
2-25, температура окружающей среды | 24 | ||
Содержимое слепой кишки (только для выявления) | Не является необходимой при использовании неповрежденной слепой кишки (проба влажная в естественных условиях) | 2-10 | 72 |
2-25, температура окружающей среды | 48 | ||
Содержимое слепой кишки для подсчета | Не является необходимой при использовании неповрежденной слепой кишки (проба влажная в естественных условиях) | 2-10 | 48 |
2-25, температура окружающей среды | 24 | ||
Палочковые тампоны с ректальным, клоачным или цекальным содержимым либо свежие экскременты | Среда Amies | 2-10 | 72 |
2-25, температура окружающей среды | 48 |
Для получения информации о дополнительных требованиях к транспортированию и хранению см. также конкретные стандарты на анализируемые микроорганизмы.
Приложение ДА
(справочное)
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам
Таблица ДА.1
Обозначение и наименование международного стандарта | Степень соответствия | Обозначение и наименование соответствующего межгосударственного стандарта |
ISO 6887-1 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 1. Общие правила приготовления исходной суспензии и десятичных разведений | - | * |
ISO 7218:2007 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям | IDT | ГОСТ ISO 7218-2011 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям |
* Соответствующий межгосударственный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов. Примечание - в настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: - IDT - идентичные стандарты. | ||
УДК 579.67:006.354 | МКС 07.100.30 | IDT |
Ключевые слова: микробиология пищевых продуктов и кормов для животных, начальная стадия производства, метод отбора проб, продукция животного происхождения, выявление и подсчет микроорганизмов, жизнеспособные микроорганизмы, пищевые патогены, лабораторная проба, разбавитель, дезинфицирующее средство | ||
Электронный текст документа
и сверен по:
, 2016

