ГОСТ 31746-2012
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКТЫ ПИЩЕВЫЕ
Методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus
Food products. Methods for detection and quantity determination of coagulase-positive staphylococci and Staphylococcus aureus
МКС 07.100.30
Дата введения 2013-07-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Государственным научным учреждением "Всероссийский научно-исследовательский институт консервной и овощесушильной промышленности" (ГНУ "ВНИИКОП") на основе аутентичных переводов на русский язык международных стандартов, указанных в пункте 4
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 15 ноября 2012 г. N 42)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Кыргызстан | KG | Кыргызстандарт |
Российская Федерация | RU | Росстандарт |
Украина | UA | Госпотребстандарт Украины |
Казахстан | KZ | Госстандарт Республики Казахстан |
Таджикистан | TJ | Таджикстандарт |
Туркмения | TM | Главгосслужба "Туркменстандартлары" |
(Поправка. ИУС N 6-2019), (Поправка. ИУС N 1-2023).
4 Настоящий стандарт модифицирован по отношению к международным стандартам*:
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
- ISO 6888-1:1999 Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of coagulase-positive staphylococci (Staphylococcus aureus and other species) - Part 1: Technique using Baird-Parker agar medium (Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод подсчета коагулазоположительных стафилококков (Staphylococcus aureus и другие виды). Часть 1. Метод с применением агаровой среды Байрд-Паркера);
- ISO 6888-2:1999 Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of coagulase-positive staphylococci (Staphylococcus aureus and other species) - Part 2: Technique using rabbit plasma fibrinogen agar medium (Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод подсчета коагулазоположительных стафилококков (Staphylococcus aureus и другие виды.). Часть 2. Метод с применением агаровой среды с кроличьей плазмой и бычьим фибриногеном);
- ISO 6888-3:2003 Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of coagulase-positive staphylococci (Staphylococcus aureus and other species) - Part 3: Detection and MPN technique for low numbers (Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод подсчета коагулазоположительных стафилококков (Staphylococcus aureus и другие виды). Часть 3. Выявление и НВЧ метод для малых количеств) в части пищевых продуктов.
При этом дополнительные положения и требования, включенные в текст стандарта для учета потребностей национальной экономики указанных выше государств и особенностей межгосударственной стандартизации, выделены в тексте стандарта курсивом*.
_______________
* В бумажном оригинале обозначения и номера стандартов и нормативных документов в разделе "Предисловие" приводятся обычным шрифтом, остальные по тексту документа выделены курсивом. - .
Наименование настоящего стандарта изменено относительно наименования указанных международных стандартов для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6).
Сравнение структуры настоящего стандарта со структурой указанных международных стандартов приведено в дополнительном приложении ДА.
Степень соответствия - модифицированная (MOD).
Стандарт подготовлен на основе применения ГОСТ Р 52815-2007
5 Приказом Федерального агентства по техническому регулированию и метрологии от 29 ноября 2012 г. N 1773-ст межгосударственный стандарт ГОСТ 31746-2012 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2013 г.
6 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта публикуется в ежемесячно издаваемом информационном указателе "Национальные стандарты".
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемом информационном указателе "Национальные стандарты". В случае пересмотра или отмены настоящего стандарта соответствующая информация будет опубликована в ежемесячно издаваемом информационном указателе "Национальные стандарты"
ВНЕСЕНЫ: поправка, опубликованная в ИУС N 6, 2019 год с учетом уточнения, опубликованного в ИУС 11-2019; поправка, опубликованная в ИУС N 1, 2023 год
Поправки внесены изготовителем базы данных
1 Область применения
Настоящий стандарт распространяется на пищевые продукты, кроме молока и молочных продуктов, и устанавливает методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus (S. aureus) посевом: в жидкую селективную среду (с предварительным обогащением) и на (в) агаризованные селективно-диагностические среды.
Допускается использование хромогенных сред предварительного выявления количества коагулазоположительных стафилококков и Staphylococcus aureus в масложировой продукции.
Метод определения наиболее вероятного числа (НВЧ) коагулазоположительных стафилококков и S. aureus посевом в жидкую селективную среду предназначен для пищевых продуктов, содержащих в 1 г твердого продукта менее 150 или в 1 см жидкого продукта менее 15 колониеобразующих единиц (КОЕ) коагулазоположительных стафилококков и S. aureus.
Метод определения количества коагулазоположительных стафилококков и S. aureus посевом на агаризованные селективно-диагностические среды предназначен для пищевых продуктов, содержащих в 1 г твердого продукта более 1500 или в 1 см жидкого продукта более 150 колониеобразующих единиц (КОЕ) коагулазоположительных стафилококков и S. aureus.
Метод определения количества коагулазоположительных стафилококков и S. aureus посевом в агаризованную селективно-диагностическую среду предназначен для пищевых продуктов, содержащих в 1 г твердого продукта более 150 или в 1 см жидкого продукта более 15 колониеобразующих единиц (КОЕ) коагулазоположительных стафилококков и S. aureus.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 450-77 Кальций хлористый технический. Технические условия
ГОСТ 5962-67 Спирт этиловый ректификованный. Технические условия
ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
ГОСТ ISO 7218-2011 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 24104-2001 Весы лабораторные. Общие технические требования
ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия
ГОСТ 26668-85 Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов
ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов
ГОСТ 30425-97 Консервы. Метод определения промышленной стерильности
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов по указателю "Национальные стандарты", составленному по состоянию на 1 января текущего года, и по соответствующим информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 коагулазоположительные стафилококки: Грамположительные, каталазоположительные микроорганизмы, которые образуют типичные и/или атипичные колонии на (в) селективно-диагностической питательной среде, дающие положительную реакцию на коагулазу или специфичную для кроличьей плазмы реакцию на агаре с кроличьей плазмой и фибриногеном при определении по методам, приведенным в настоящем стандарте.
3.2 Staphylococcus aureus (S. aureus): Коагулазоположительные стафилококки, образующие ацетоин и ферментирующие мальтозу в аэробных условиях при определении этих биохимических тестов по методам, приведенным в настоящем стандарте.
3.3 выявление коагулазоположительных стафилококков и S. aureus: Определение присутствия или отсутствия коагулазоположительных стафилококков и S. aureus в определенной массе или объеме продукта по методам, приведенным в настоящем стандарте.
3.4 определение количества коагулазоположительных стафилококков и S. aureus: Количество коагулазоположительных стафилококков или S. aureus, содержащееся в 1 см или 1 г продукта и определенное по методам, приведенным в настоящем стандарте.
4 Методы выявления и определения количества коагулазоположительных стафилококков и S. aureus*
________________
* Слова "S. aureus" в наименовании раздела 4 в бумажном оригинале выделены курсивом. - .
4.1 Метод выявления и метод НВЧ - определение количества коагулазоположительных стафилококков и S. aureus* с предварительным обогащением
________________
* Слова "и S. aureus" в наименовании подраздела 4.1 в бумажном оригинале выделены курсивом. - .
Сущность методов
Метод выявления и метод НВЧ - определение количества коагулазоположительных стафилококков и S. aureus посевом с предварительным обогащением основаны на высеве навески продукта и (или) разведений навески продукта в жидкую селективную среду, инкубировании посевов, пересеве культуральной жидкости на поверхность агаризованной селективно-диагностической среды, подтверждении по биохимическим признакам принадлежности выделенных типичных и (или) атипичных колоний к коагулазоположительным стафилококкам и S. aureus.
При пересеве на агаризованную среду с кроличьей плазмой и бычьим фибриногеном выросшие типичные колонии без подтверждения по биохимическим признакам относят к коагулазоположительным стафилококкам.
4.1.1 Метод выявления коагулазоположительных стафилококков и S. aureus
4.1.1.1 Определенное количество жидкого продукта или определенное количество исходной суспензии при использовании продукта другой консистенции вносят в жидкую селективную питательную среду.
Перед посевом анаэробные условия в среде создают кипячением при (100±1) °С в течение 15 мин, наслоением агара или парафина в каждую пробирку после посева, а также с помощью альтернативной процедуры - инкубирования пробирок в емкости или инкубаторе в анаэробных условиях.
4.1.1.2 Пробирки с посевами инкубируют при температуре 37 °С в течение 24-48 ч. Предположительное присутствие коагулазоположительных стафилококков на Жиолитти-Кантони бульоне определяется по редукции теллурита калия, а на глюкозном или солевом бульоне - по помутнению среды.
4.1.1.3 Поверхность одной из агаризованных селективно-диагностических сред (Байрд-Паркер агара, молочно-солевого агара, яично-желточно-азидного агара, яично-желточно-солевого агара, агара с кроличьей плазмой и бычьим фибриногеном), инокулируют из предположительно положительных пробирок (см. 4.1.1.4) после 24 ч и все оставшееся пробирки после 48 ч.
4.1.1.4 Чашки Петри с посевами инкубируют при температуре 37 °С в течение 24-48 ч.
Предположительное присутствие коагулазоположительных стафилококков определяется по редукции теллурита калия и яично-желточной реакции (лецитиназной активности).
На агаре с кроличьей плазмой и бычьим фибриногеном после инкубирования присутствие коагулазоположительных стафилококков определяется по типичным колониям, показавшим специфичную реакцию (бычий фибриноген/кроличья плазма).
4.1.1.5 Подтверждение принадлежности типичных и (или) атипичных колоний к коагулазоположительным стафилококкам проводят по изучению отношения выявленных микроорганизмов к окраске по Граму, определению присутствия у них каталазы и коагулазы.
Подтверждение принадлежности коагулазоположительных стафилококков к S. aureus проводят по определению образования ацетоина, определению ферментации в аэробных условиях мальтозы и, при необходимости, определению термостабильной нуклеазы и гемолитической активности.
4.1.1.6 Результаты выявления коагулазоположительных стафилококков и S. aureus выражают: "обнаружены" или "не обнаружены" в см
или
граммах продукта.
4.1.2 Метод НВЧ - определение количества коагулазоположительных стафилококков и S. aureus
4.1.2.1 Навески продукта и (или) серию разведений навески продукта вносят в жидкую селективную питательную среду. Инкубирование посевов и подтверждение присутствия в них коагулазоположительных стафилококков и S. aureus проводят по 4.1.1.3-4.1.1.6.
4.1.2.2 Наиболее вероятное число коагулазоположительных стафилококков и S. aureus в 1 см или в 1 г продукта определяют для подтвержденных посевов, пользуясь НВЧ-таблицей по ГОСТ 26670.
4.2 Методы определения количества коагулазоположительных стафилококков и S. aureus* посевом на (в) агаризованные селективно-диагностические среды
_______________
* Слова "и S. aureus" в наименовании подраздела 4.2 в бумажном оригинале выделено курсивом. - .
Сущность методов
Методы определения количества коагулазоположительных стафилококков и S. aureus посевом на (в) агаризованные селективно-диагностические среды основаны на высеве навески продукта и/или разведения навески продукта на (в) агаризованную селективно-диагностическую среду, инкубировании посевов, подсчете типичных и (или) атипичных колоний, подтверждении по биохимическим признакам принадлежности выделенных колоний к коагулазоположительным стафилококкам и S. aureus.
4.2.1 Проводят посев определенного количества жидкого продукта или определенное количество исходной суспензии при использовании продукта другой консистенции на (в) агаризованную селективно-диагностическую питательную среду на две параллельные чашки Петри.
Аналогично проводят посев десятикратных разведений испытуемого продукта.
4.2.2 Посевы в чашках Петри инкубируют при температуре 37 °С в течение 24-48 ч.
4.2.3 Количество коагулазоположительных стафилококков в 1 см или 1 г продукта определяют по числу типичных и/или атипичных колоний, выросших на чашках Петри, принадлежность которых к коагулазоположительным стафилококкам подтверждена путем определения отношения микроорганизмов из этих колоний к окраске по Граму, наличия у них каталазы и коагулазы.
При посеве в (на) агаризованную среду с кроличьей плазмой и бычьим фибриногеном определяют только типичные колонии и без подтверждения по биохимическим признакам их относят к коагулазоположительным стафилококкам.
Количество S. aureus в 1 см или 1 г продукта определяют исходя из количества коагулазоположительных стафилококков, принадлежность которых к S. aureus подтверждена по образованию ацетоина, определению ферментации в аэробных условиях мальтозы и, при необходимости, определению термостабильной нуклеазы и гемолитической активности.
5 Питательные среды, растворы реактивов, эмульсии и дефибринированная кровь
Химические вещества, используемые для приготовления питательных сред, растворов реактивов, эмульсий, должны быть аналитического качества.
5.1 Агаризованная среда Байрд-Паркера
5.1.1 Основа среды
5.1.1.1 Состав:
ферментативный гидролизат казеина | 10,0 г; |
дрожжевой экстракт | 1,0 г; |
мясной экстракт | 5,0 г; |
пируват натрия | 10,0 г; |
L-глицин | 12,0 г; |
хлорид лития | 5,0 г; |
агар | от 12 до 22 г*; |
вода | 1000 см |
_______________
* В зависимости от желирующей способности агара.
5.1.1.2 Приготовление
При нагревании растворяют в воде все компоненты или дегидратированную основу. Устанавливают рН так, чтобы после стерилизации он составлял (7,2±0,2) при температуре 25 °С.
Разливают среду по 100 см в колбы или флаконы соответствующей вместимости.
Стерилизуют среду в автоклаве при температуре (121±1) °С в течение 15 мин.
5.1.2 Раствор теллурита калия
5.1.2.1 Состав:
теллурит калия | 1,0 г; |
вода | 100 см |
Примечание - Необходимо предварительно убедиться, что имеющийся в наличии теллурит калия пригоден для данного испытания.
5.1.2.2 Приготовление
Полностью растворяют теллурит калия в воде при минимальном нагревании.
Твердое вещество должно легко растворяться. Если в воде присутствует белый нерастворимый осадок, то такой порошок не используют.
Стерилизуют приготовленный раствор теллурита калия путем фильтрации через мембранный фильтр с размером пор 0,22 мкм.
Раствор можно хранить не более 1 мес при температуре (3±2) °С.
Если при хранении раствора образуется белый осадок, то такой раствор не используют.
5.1.3 Эмульсия яичного желтка (приблизительно 20%-ной концентрации)
Свежие куриные яйца с неповрежденной скорлупой моют щеткой с применением жидких моющих средств, ополаскивают проточной водой, дезинфицируют погружением на 30 с в 70%-ный (объем/объем) этиловый спирт с последующим просушиванием на воздухе или, после того как раствор спирта стечет, яйца фламбируют в пламени горелки. С соблюдением правил асептики разбивают скорлупу яйца и отделяют желток от белка, поочередно перенося желток из одной половинки скорлупы в другую. Желтки помещают в стерильную колбу и добавляют 4-кратное количество (по объему) стерильной воды. Смесь тщательно перемешивают, выдерживают на водяной бане при температуре (47±1) °С в течение 2 ч, а затем оставляют на 18-24 ч при температуре (3±2) °С для образования осадка.
Для использования собирают в асептических условиях в стерильную колбу надосадочную жидкость. Приготовленную эмульсию можно хранить при температуре (3±2) °С не более 72 ч.
Допускается использование готовой эмульсии промышленного производства, в этом случае эмульсию применяют в соответствии с инструкцией изготовителя.
Допускается проводить приготовление желточной эмульсии по ГОСТ 10444.1.
5.1.4 Раствор сульфаметазина (сульфамезатина, сульфадимидина)
Раствор используют только в случае подозрения присутствия в испытуемом продукте бактерий рода Proteus или при испытании сильно обсемененных продуктов, например, из сырого мяса.
5.1.4.1 Состав:
сульфаметазин | 0,2 г; |
раствор гидроксида натрия, | 10 см |
вода | 90 см |
5.1.4.2 Приготовление
Растворяют сульфаметазин в растворе гидроксида натрия. Доводят объем водой до 100 см.
Стерилизуют путем фильтрации через мембранный фильтр с размером пор 0,22 мкм.
Приготовленный раствор допускается хранить не более 1 мес при температуре (3±2) °С.
5.1.5 Готовая питательная среда
5.1.5.1 Состав:
основа среды (см. 5.1.1) | 100 см |
раствор теллурита калия (см. 5.1.2) | 1,0 см |
эмульсия яичного желтка (см. 5.1.3) | 5,0 см |
раствор сульфаметазина (см. 5.1.4) (если необходимо) | 2,5 см |
5.1.5.2 Приготовление
Расплавляют основу, затем охлаждают до температуры примерно 47 °С на водяной бане. В асептических условиях добавляют два других раствора и, если необходимо, раствор сульфаметазина (см. 5.1.4). Предварительно каждый раствор подогревают на водяной бане при 47 °С, тщательно перемешивая среду после каждого прибавления раствора.
5.1.6 Приготовление чашек Петри с агаризованной средой Байрд-Паркера
Разливают соответствующее количество готовой среды (см. 5.1.5) в стерильные чашки Петри, чтобы получить агаровый слой толщиной примерно 4 мм, и дают застыть. Приготовленные чашки можно хранить до использования 24 ч при температуре (3±2) °С.
Перед применением среду в чашках подсушивают в сушильном шкафу при температуре от 25 °С до 50 °С до тех пор, пока с поверхности среды не исчезнут капельки влаги. Предпочтительней подсушивать среду при снятых крышках и поверхностью среды вниз.
5.2 Бульон на основе вытяжки из сердца и мозга
5.2.1 Состав:
продукт ферментативного гидролиза животных тканей | 10,0 г; |
дегидратированная вытяжка мозга теленка | 12,5 г; |
дегидратированная вытяжка сердца теленка | 5,0 г; |
глюкоза | 2,0 г; |
хлорид натрия | 5,0 г; |
двузамещенный фосфорнокислый натрий, безводный | 2,5 г; |
вода | 1000 см |
5.2.2 Приготовление
При нагревании растворяют компоненты или дегидратированную основу среды в воде.
Устанавливают рН таким образом, чтобы после стерилизации он составлял при температуре 25 °С (7,4±0,2).
Разливают питательную среду по 5-10 см в пробирки. Стерилизуют среду в течение 15 мин при температуре (121±1) °С.
5.3 Плазма крови кролика
5.3.1 Свежеполученную в асептических условиях из сердца кролика кровь тщательно смешивают в соотношении 4:1 со стерильным раствором лимоннокислого натрия (цитрата натрия). Полученную смесь центрифугируют в течение 15 мин при 3000 об/мин или отстаивают на холоде при температуре (3±2) °С, затем плазму отсасывают пипеткой и разводят ее из расчета 1 см плазмы на 4 см
физиологического раствора. Разведенную плазму по 0,5 см
разливают в стерильные пробирки.
Если в качестве антикоагулянта плазмы использовались цитраты калия или натрия, то к плазме добавляют раствор ЭДТА (этилендиаминтетрауксусная кислота) до концентрации ЭДТА в плазме 0,1%. В плазму, содержащую оксалат или гепарин ЭДТА, не добавляется.
Для приготовления агара с кроличьей плазмой и бычьим фибриногеном к плазме добавляют трипсин из расчета 30 мг трипсина на 30 см плазмы. Плазму готовят непосредственно перед применением.
Если используется готовая обезвоженная плазма, то восстановление и использование такой плазмы проводят в соответствии с прилагаемой к ней инструкцией. Плазма готовится непосредственно перед применением.
Качество плазмы тестируется с помощью коагулазоположительных и коагулазоотрицательных штаммов стафилококков.
5.3.2 Раствор лимоннокислого натрия
5.3.2.1 Состав:
лимоннокислый натрий | 5,0 г; |
вода | 100 см |
5.3.2.2 Приготовление
Лимоннокислый натрий помещают в колбу, растворяют в воде. Раствор доводят до метки, разливают по колбам или пробиркам и стерилизуют при температуре (121±1) °С в течение 20 мин.
5.4 Агаризованная среда с кроличьей плазмой и бычьим фибриногеном
Следует учитывать опыт использования готовых партий добавок. Рекомендуется каждую партию раствора бычий фибриноген/кроличья плазма подвергать тестированию путем постановки положительного и отрицательного контроля.
5.4.1 Основа среды
Основу среды готовят по 5.1, но перед стерилизацией среду разливают по 90 см в колбы или флаконы.
5.4.2 Раствор бычьего фибриногена
5.4.2.1 Состав:
бычий фибриноген | 5-7 г*; |
стерильная вода | 100 см |
_______________
* Зависит от чистоты бычьего фибриногена.
5.4.2.2 Приготовление
С соблюдением правил асептики растворяют бычий фибриноген в воде непосредственно перед использованием.
5.4.3 Кроличья плазма и трипсин ингибирующий раствор
5.4.3.1 Состав:
кроличья плазма с ЭДТА для коагулазы (ЭДТА коагулазная плазма) | 30 см |
трипсин ингибитор | 30 мг. |
5.4.3.2 Приготовление
Раствор готовят с соблюдением правил асептики, растворяют компоненты в воде непосредственно перед использованием.
Если используют готовый раствор бычий фибриноген/кроличья плазма, то необходимо соблюдать инструкцию по приготовлению данного раствора и готовой среды. Особенно надо обращать внимание на температуру основы среды. При несоблюдении температуры среда может потерять свою активность.
5.4.4 Готовая среда
5.4.4.1 Состав:
основа среды (см. 5.4.1) | 90 см |
раствор теллурита калия (см. 5.1.2) | 0,25 см |
раствор фибриногена (см. 5.4.2) | 7,5 см |
кроличья плазма и трипсин ингибирующий раствор (см. 5.4.3) | 2,5 см |
5.4.4.2 Приготовление
Расплавляют основу среды, охлаждают в водяной бане до температуры (47±1) °С. С соблюдением правил асептики прибавляют три раствора, предварительно подогретых до (47±1) °С в водяной бане. Тщательно перемешивают среду вращением после каждого прибавления, минимизируя вспенивание.
Используют готовую среду непосредственно после приготовления, тем самым избегая преципитации плазмы.
5.5 Модифицированный Жиолитти-Кантони бульон
5.5.1 Основа среды
5.5.1.1 Состав модифицированного Жиолитти-Кантони бульона приведен в таблице 1.
Таблица 1
Наименование компонента | Среда двойной концентрации | Среда нормальной концентрации |
Ферментативный гидролизат казеина | 20,0 г | 10,0 г |
Мясной экстракт | 10,0 г | 5,0 г |
Дрожжевой экстракт | 10,0 г | 5,0 г |
Хлористый литий | 10,0 г | 5,0 г |
Маннит | 40,0 г | 20,0 г |
Хлористый натрий | 10,0 г | 5,0 г |
Глицин | 2,4 г | 1,2 г |
Пируват натрия | 6,0 г | 3,0 г |
Полиоксиэтилен сорбитан моноолеат (твин-80) | 2,0 г | 1,0 г |
Вода | 1000 см | 1000 см |
5.5.1.2 Приготовление
При нагревании и помешивании растворяют компоненты или дегидратированную основу в воде. Охлаждают до комнатной температуры и устанавливают рН так, чтобы после стерилизации он составлял (6,9±0,2) при температуре 25 °С.
Разливают среду в соответствующем количестве в пробирки соответствующего объема - 16х160 мм для среды нормальной концентрации и 20х200 мм - для среды двойной концентрации.
Стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
5.5.2 Готовая среда
Перед использованием в водяной бане прогревают основу среды 15 мин при 100 °С для удаления воздуха.
Охлаждают до 44 °С - 47 °С, асептически прибавляют раствор теллурита калия по 5.1.2, внося 0,1 см на пробирку в среду нормальной концентрации и 0,2 см
в пробирку со средой двойной концентрации.
5.6 Голодный агар
Голодный агар готовят по ГОСТ 10444.1.
Перед использованием охлаждают до 44 °С - 47 °С. Наливают в пробирки соответствующего объема.
5.7 Молочно-солевой агар
Молочно-солевой агар готовят по ГОСТ 10444.1.
5.8 Мясопептонный агар (бульон)
Мясопептонный агар (бульон) готовят по ГОСТ 10444.1.
5.9 Солевой или сахарный бульон
5.9.1 Состав:
мясопептонный бульон по ГОСТ 10444.1 | 100 см |
хлористый натрий | 6,0 г; |
или глюкоза | 1,0 г. |
5.9.2 Приготовление
В мясо-пептонном бульоне растворяют 6,0 г хлористого натрия или 1,0 г глюкозы, устанавливают рН так, чтобы после стерилизации он составлял при температуре 25 °С (6,9±0,1). Бульон разливают в колбы или пробирки и стерилизуют при температуре (121±1) °С в течение 15 мин.
5.10 ГРМ-агар (сухой питательный агар для культивирования микроорганизмов на основе гидролизата рыбной муки)
Среду готовят по инструкции, указанной на этикетке.
5.11 Среда с ДНК
5.11.1 Состав:
трисаминометан | 6,1 г; |
дезоксирибонуклеиновая кислота (ДНК) | 0,3 г; |
хлористый натрий | 10,0 г; |
раствор хлористого кальция | 1,1 см |
агар | 15,0 г; |
раствор толуидина синего | 9,2 см |
5.11.2 Приготовление
В воде растворяют трисаминометан и доводят по ГОСТ 10444.1 рН раствора до (9,0±0,1).
К раствору добавляют ДНК, хлористый натрий, раствор хлористого кальция, агар нагревают до полного расплавления агара. К охлажденной до температуры 65 °С - 55 °С среде добавляют раствор толуидина синего "С", тщательно перемешивают и разливают по стерильным чашкам Петри.
Допускается хранение среды при температуре (3±2) °С не более 7 сут.
5.11.3 Раствор хлористого кальция
5.11.3.1 Состав:
хлористый кальций | 0,1 г; |
вода | 100 см |
5.11.3.2 Приготовление
Хлористый кальций переносят в колбу вместимостью 100 см, растворяют в воде. Раствор доводят водой до метки.
5.11.4 Раствор толуидина синего "С"
5.11.4.1 Состав
толуидин синий "С" | 1,0 г; |
вода | 100 см |
5.11.4.2 Приготовление
Толуидин синий "С" переносят в колбу вместимостью 100 см, растворяют в воде. Раствор доводят водой до метки.
5.12 Спиртовой раствор -нафтола
Спиртовой раствор -нафтола готовят по ГОСТ 10444.1.
5.13 Раствор перекиси водорода
Раствор с объемной долей перекиси водорода 3% готовят по ГОСТ 10444.1.
5.14 Яично-желточно-азидный агар
Яично-желточно-азидный агар готовят по ГОСТ 10444.1.
5.15 Яично-желточно-солевой агар
Яично-желточно-солевой агар готовят по ГОСТ 10444.1.
5.16 Кровяной агар
5.16.1 Состав:
мясопептонный агар | 100 см |
дефибринированная кровь | 5-10 см |
5.16.2 Приготовление
К расплавленному и охлажденному до 45 °С - 50 °С мясопептонному агару прибавляют 5%-10% дефибринированной крови животного (барана, кролика, крупного рогатого скота). Агар с кровью тщательно перемешивают, избегая вспенивания, и разливают по чашкам.
5.16.3 Дефибринированная кровь
Кровь животных собирают в стерильную посуду со стеклянными бусами и дефибринируют путем встряхивания в течение 10-15 мин. В результате встряхивания находящийся в крови фибрин выпадает в осадок, обволакивая бусы, а дефибринированная кровь, слитая в другую колбу, утрачивает способность свертываться.
5.17 Физиологический раствор
Физиологический раствор готовят по ГОСТ 10444.1.
5.18 Среда Гисса с мальтозой
Выпускается в сухом виде и готовится по инструкции, указанной на этикетке.
5.19 Растворы и реактивы для окраски по Граму
Растворы и реактивы для окраски по Граму готовят по ГОСТ 10444.1.
5.20 Раствор гидроокиси калия (KОН)
5.20.1 Состав:
гидроокись калия (KОН) | 40,0 г; |
вода | до 100 см |
5.20.2 Приготовление
Гидроокись калия переносят в мерную колбу вместимостью 100 см и растворяют в воде. Раствор доводят водой до метки.
5.21 Среда Кларка
5.21.1 Состав:
пептон | 5,0 г; |
глюкоза | 5,0 г; |
фосфорнокислый двузамещенный калий | 5,0 г; |
вода | 1000 см |
5.21.2 Приготовление
При нагревании растворяют компоненты в воде, затем охлаждают до 45 °С - 47 °С и устанавливают рН таким образом, чтобы после стерилизации он составлял при температуре 25 °С (7,2±0,1). Среду разливают по 5-7 см в пробирки и стерилизуют при температуре (121±1) °С в течение 15 мин или дробным методом - текучим паром по 30 мин три дня подряд.
5.22 Допускается использование готовых и дегидратированных, в том числе хромогенных, питательных сред, зарегистрированных на территории государства, принявшего стандарт.
6 Аппаратура, посуда, материалы, реактивы
Допускается применять одноразовую посуду, если она отвечает соответствующим требованиям.
Обычное лабораторное оборудование и реактивы для микробиологических исследований по ГОСТ 10444.1 со следующими дополнениями:
- весы лабораторные общего назначения с метрологическими характеристиками по ГОСТ 24104 с наибольшим пределом взвешивания 200 г (для взвешивания реактивов) с пределом допускаемой абсолютной погрешности однократного взвешивания не более ±0,01 мг*;
________________
* Письмом Росстандарта от 16.04.2021 г. N 1312-ОГ/03 сообщается о наличии опечатки "в разделе 6 ГОСТ 31746-2012 в части предела допускаемой абсолютной погрешности однократного взвешивания для лабораторных весов с наибольшим пределом взвешивания 200 г: вместо "не более ±0,01 мг" должно быть "не более ±0,01 г". - .
- весы лабораторные общего назначения с метрологическими характеристиками по ГОСТ 24104 с наибольшим пределом взвешивания 1 кг (для взвешивания продукта) с пределом допускаемой абсолютной погрешности однократного взвешивания не более ±20 мг;
- лупа с увеличением 5-10
;
- микроскоп биологический, обеспечивающий просмотр в проходящем свете, с увеличением 90-1000
;
- бактериологическая петля диаметром около 3 мм;
- прибор для мембранной фильтрации;
- стекла предметные по ГОСТ 9284;
- стекла покровные по ГОСТ 6672;
- термостат с диапазоном рабочих температур 28 °С - 55 °С, позволяющий поддерживать заданную температуру с допустимой погрешностью ±1 °С;
- бычий фибриноген;
- дезоксирибонуклеиновая кислота (ДНК);
- дефибринированная кровь;
- сухой дрожжевой экстракт;
- калия гидроокись по ГОСТ 24363;
- кальций хлористый по ГОСТ 450;
- коагулазоположительный и коагулазоотрицательный штаммы стафилококков;
- сухой мясной экстракт;
- панкреатический гидролизат казеина;
- сульфаметазин;
- сухая вытяжка мозга теленка;
- сухая вытяжка сердца теленка;
- сухая кроличья плазма;
- твин-80;
- толуидин синий "С";
- трисаминометан;
- ферментативный гидролизат казеина;
- ферментативный гидролизат животных тканей;
- этилендиаминтетрауксусная кислота (ЭДТА).
7 Отбор и подготовка проб
Отбор и подготовка проб - по ГОСТ 26668, ГОСТ 26669.
Важно, чтобы для испытания поступила представительная проба продукта, не поврежденная и не измененная в ходе транспортирования или хранения.
8 Проведение испытания
8.1 Метод выявления коагулазоположительных стафилококков
8.1.1 При выявлении коагулазоположительных стафилококков в определенной навеске исследуемого продукта или его эквивалентном разведении с предварительным обогащением эту навеску или разведение вносят в одну из питательных сред, приготовленных по 5.5 или 5.9.
Перед использованием Жиолитти-Кантони бульон прогревают кипячением при (100±1) °С в течение 15 мин для удаления воздуха. Охлаждают до 44 °С - 47 °С и с соблюдением правил асептики прибавляют раствор теллурита калия.
В 10 см модифицированного Жиолитти-Кантони бульона нормальной концентрации или сред (см. 5.9) вносят 1 см
жидкого продукта или 1 см
исходной суспензии (т.е. 0,1 г или 0,1 см
продукта) или в 10 см
Жиолитти-Кантони бульона двойной концентрации вносят 10 см
жидкого продукта или 10 см
исходной суспензии (т.е. 1 г или 1 см
продукта). Для посева больших объемов навески испытуемого продукта приготавливают исходную суспензию, для этого
см
или
г продукта прибавляют к 9
см
разбавителя. Затем прибавляют всю исходную суспензию к 9
10 см
модифицированного Жиолитти-Кантони бульона нормальной концентрации (например, 5 см
или 5 г вносят в 45 см
разбавителя и затем эту всю исходную суспензию вносят в 450 см
модифицированного Жиолитти-Кантони бульона нормальной концентрации). Оставляют минимум воздушного пространства в пробирке или флаконе.
После посева навески продукта и (или) его разведений на поверхность Жиолитти-Кантони бульона осторожно наслаивают слой стерильного голодного агара или слой стерильного парафина, приготовленных по ГОСТ 10444.1 и охлажденных до температуры 44 °С - 47 °С, дают полученному слою агара или парафина застыть и герметично закрывают.
Соотношение между количеством высеваемого продукта или его разведением и питательной средой нормальной концентрации 1:10. При использовании среды двойной концентрации соотношение между количеством высеваемого продукта или его разведением и питательной средой 1:1.
Если при последующем подтверждении принадлежности коагулазоположительных стафилококков к S. aureus не определяют наличие термостабильной нуклеазы и гемолитической активности, то допускается проводить посев в Жиолитти-Кантони бульон без прогрева перед посевом и без наслаивания голодного агара или парафина после посева.
При испытании высококислотных продуктов для предотвращения резкого снижения рН (на 0,5 и более) питательных сред рН питательных сред после внесения в них продукта или его разведений доводят до допустимых значений с помощью стерильного раствора гидроокиси натрия, приготовленного по ГОСТ 10444.1, или при приготовлении питательных сред рН устанавливают выше заданного с учетом его последующего снижения при внесении продукта. Количество добавляемого раствора гидроокиси натрия или величину, на которую необходимо увеличить рН при приготовлении питательных сред, устанавливают опытным путем.
Допускается доводить рН до нейтрального значения с помощью стерильного раствора гидроокиси натрия в самом высококислотном продукте.
При анализе пищевых продуктов с большим содержанием хлористого натрия (NaCI) посев исследуемого продукта или его исходного разведения в солевой бульон не проводят. Содержание хлористого натрия (NaCI) в посевах не должно быть более 6,5%-7%.
8.1.2 Посевы инкубируют при температуре (37±1) °С в течение (24±2) ч. Если появилось почернение или черный осадок в Жиолитти-Кантони бульоне или помутнение в солевом или сахарном бульоне, то проводят подтверждение принадлежности выросших микроорганизмов к коагулазоположительным стафилококкам. Если почернения, черного осадка или помутнения нет, то посевы инкубируют еще (24±2) ч.
8.1.3 Для получения изолированных колоний стерильной петлей делают пересевы культур из каждого посева (см. 8.1.2) на поверхность чашки Петри с одной из агаризованных селективно-диагностических сред: Байрд-Паркер агара, Байрд-Паркер агара с кроличьей плазмой и бычьим фибриногеном, молочно-солевого агара, яично-желточно-азидного агара или яично-желточно-солевого агара (см. раздел 5).
Пересевы проводят также из пробирок, в которых нет видимых признаков роста.
Если на поверхность Жиолитти-Кантони бульона наслаивали голодный агар или парафин, то перед пересевом, с соблюдением правил асептики, их удаляют, используя для этого стерильный шпатель. Шпателем режут слой агара на четыре части вдоль и, если необходимо, вставляют шпатель в пробирку и проводят по окружности агара для освобождения его от стекла пробирки. Взбалтывают пробирку, вызывая разбивание слоя и выпадения его на дно пробирки для обеспечения ровной поверхности культуральной суспензии.
Чашки Петри с пересевами инкубируют в термостате при температуре (37±1) °С в течение (24±2) ч или (48±2) ч.
8.1.4 После 24 ч инкубирования чашек Петри по 8.1.3 отмечают на дне чашек присутствие типичных и атипичных для коагулазоположительных стафилококков колоний.
На Байрд-Паркер агаре после инкубирования в течение 24 ч коагулазоположительные стафилококки образуют типичные колонии черного или серого цвета, блестящие и выпуклые, окруженные прозрачной зоной, диаметр колоний около 1,0-1,5 мм и до 1,5-2,5 мм после инкубирования в течение 48 ч. После инкубирования в течение 24 ч непосредственно около колонии в прозрачной зоне может появиться опалесцирующее кольцо, окружающее колонию.
На Байрд-Паркер агаре с кроличьей плазмой и бычьим фибриногеном коагулазоположительные стафилококки образуют черные или серые, или ровные белые мелкие колонии, окруженные зоной преципитации, указывающей на коагулазную активность.
Бактерии рода Proteus могут вырастать и в начале инкубирования быть похожими на коагулазоположительные стафилококки, но после 24 или 48 ч инкубирования появляются стелющиеся культуры разного оттенка коричневого цвета, что позволяет отличить их от стафилококков.
На молочно-солевом агаре колонии коагулазоположительных стафилококков круглые, слегка возвышающиеся над поверхностью агара, с ровными краями, диаметром 2,0-2,5 мм, окрашены в желтый, золотистый, лимонно-желтый, кремовый, палевый или белый цвет.
На яично-желточно-азидном и яично-желточно-солевом агаре колонии коагулазоположительных стафилококков окружены зоной лецитиназной активности.
Кроме типичных, коагулазоположительные стафилококки могут образовывать атипичные колонии.
Атипичные колонии на Байрд-Паркер агаре могут представлять одну из следующих морфологий:
а) блестящие черные колонии с узкой белой кромкой или без нее; прозрачная зона отсутствует или едва видима, а опалесцирующее кольцо отсутствует или трудно различимо;
б) серые колонии без прозрачных зон.
Все колонии, возможно присутствующие на чашках Петри и не показавшие типичных и атипичных признаков, относятся к фоновой флоре.
Микроорганизмы, принадлежащие к родам, отличным от коагулазоположительных стафилококков, могут образовывать колонии, которые по внешнему виду похожи на колонии коагулазоположительных стафилококков. Исследование под микроскопом препаратов, окрашенных по Граму, и определение наличия каталазы облегчает отличие стафилококков от других родов.
После дополнительной инкубации всех чашек Петри при температуре 37 °С в течение (24±2) ч фиксируют появление новых типичных и атипичных колоний.
8.1.5 Для подтверждения принадлежности типичных и атипичных колоний к коагулазоположительным стафилококкам отбирают не менее пяти типичных и/или атипичных колоний.
Для подтверждения принадлежности отобранных типичных и атипичных колоний к коагулазоположительным стафилококкам пересевают каждую отобранную колонию отдельно в жидкую среду, приготовленную по 5.2, и на поверхность одной из скошенных питательных сред - мясопептонного агара, приготовленного по 5.8, или среды, приготовленной из сухого ГРМ-агара по 5.10.
Посевы инкубируют при температуре (37±1) °С в течение (24±3) ч.
8.2 Метод НВЧ - определение количества коагулазоположительных стафилококков
8.2.1 Каждую навеску исследуемого продукта и (или) его разведение в трехкратной повторности высевают в пробирки с одной из сред, приготовленных по 5.5 или 5.9.
8.2.2 При определении количества коагулазоположительных стафилококков по методу НВЧ высевают не менее трех последовательных навесок исследуемого продукта и (или) его разведения, отличающиеся по количеству продукта в них в 10 раз.
В каждую из трех пробирок со средой двойной концентрации вносят по 10 см пробы жидкого продукта или по 10 см
первого разведения (т.е. 1 г пробы) продукта другой консистенции.
В каждую из трех пробирок со средой нормальной концентрации вносят по 1 см пробы жидкого продукта или 1 см
первого разведения (т.е. 0,1 г пробы) других продуктов.
Для каждого последующего разведения (т.е. 10, 10
, 10
- для жидких продуктов или 10
, 10
или 10
для продуктов другой консистенции), процедуру повторяют, как указано выше, используя свежую стерильную пипетку для каждого разведения.
Готовят такое число разведений, чтобы в конечном разведении получить три отрицательных результата.
Осторожно перемешивают инокулят со средой, избегая внесения воздуха.
Подготовка Жиолитти-Кантони бульона к посеву, создание анаэробных условий для роста микроорганизмов - по 8.1.1.
8.2.3 Инкубирование пробирок с посевами, пересев выросших культур на селективно-диагностические среды, отбор типичных и атипичных колоний, их пересев для подтверждения присутствия коагулазоположительных стафилококков проводят по 8.1.2-8.1.5.
8.3 Метод определения количества коагулазоположительных стафилококков посевом на агаризованную среду
8.3.1 Из навески продукта готовят исходное и ряд десятикратных разведений по ГОСТ 26669, таких, чтобы можно было определить в 1 г (см) продукта предполагаемое количество коагулазоположительных стафилококков или их допускаемое количество, указанное в документе на исследуемый продукт.
Переносят с помощью стерильной пипетки 0,1-0,2 см продукта, если продукт жидкий, или 0,1-0,2 см
исходной суспензии в случае продуктов другой консистенции, на поверхность одной из сред, указанных в 8.1.3.
Байрд-Паркер агар с кроличьей плазмой и бычьим фибриногеном используют для посева сильно обсемененных продуктов, например, приготовленных из сырого мяса.
Для посева продукта или каждого его разведения используют две параллельные чашки Петри со средой. Подготовку чашек Петри со средой к посеву и посев проводят по ГОСТ 26670 и 5.1.6.
Если необходимо, повторяют процедуру для исходного разведения, если продукт жидкий, или для десятикратного разведения других продуктов, а также для последующих десятикратных разведений.
Для посева в качестве арбитражной среды используют Байрд-Паркер агар.
8.3.2 Если для некоторых продуктов необходимо определить небольшое количество коагулазоположительных стафилококков, то пределы обнаружения метода можно повысить в 10 раз за счет посева 1 см продукта, если продукт жидкий, или 1 см
исходной суспензии в случае других продуктов. По 1 см
высевают на поверхность среды в одной большой чашке Петри (диаметром 140 мм) либо на поверхность среды в трех маленьких чашках Петри (диаметром 90 мм). В обоих случаях высевают параллельные навески, используя для этого две большие чашки Петри или шесть маленьких.
8.3.3 С помощью стерильного шпателя осторожно и быстро распределяют посевной материал по поверхности агаризованной среды в чашке Петри, стараясь не касаться стенок чашки. Примерно в течение 15 мин дают подсохнуть поверхности среды под крышками по ГОСТ 26670.
8.3.4 Чашки Петри с посевами переворачивают крышками вниз и инкубируют в термостате при температуре (37±1) °С в течение 24-48 ч.
8.3.5 После инкубирования в течение (24±2) ч чашки Петри с посевами просматривают и отмечают на обратной стороне чашки положение типичных и атипичных для коагулазоположительных стафилококков колоний.
Характеристика типичных и атипичных колоний - по 8.1.4.
8.3.6 Все чашки Петри с посевами по 8.3.5 продолжают инкубировать при температуре (37±1) °С в течение еще (24±2) ч, после чего отмечают появление новых типичных и атипичных колоний.
Для подсчета берут чашки Петри, на которых выросло максимум 300 колоний, по 150 типичных и/или атипичных колоний для двух последовательных разведений. В посевах на чашках Петри не должно быть менее 15 колоний. Выбирают для подтверждения на каждой чашке Петри пять типичных колоний, если присутствуют только типичные колонии, и пять атипичных колоний, если присутствуют только атипичные колонии, или пять типичных колоний и пять атипичных, если присутствуют оба типа колоний. Если на чашках Петри, засеянных неразбавленным жидким продуктом или самым меньшим разведением других продуктов, имеется менее 15 типичных и (или) атипичных колоний, то отбирают все параллельные чашки Петри, на которых имеются типичные или атипичные колонии. Отбирают колонии для подтверждения в количествах, указанных выше.
8.3.7 Каждую отобранную колонию отдельно пересевают по 8.1.5. Посевы инкубируют при температуре (37±1) °С в течение (24±3) ч.
8.3.8 Если 1 см посевного материала распределили по трем чашкам по 8.3.2, то принимают эти чашки Петри за одну при всех последующих подсчетах и процедурах подтверждения.
8.4 Метод определения количества коагулазоположительных стафилококков посевом в агаризованную среду
8.4.1 В каждую из двух чашек Петри вносят с помощью стерильной пипетки 1 см продукта, если продукт жидкий, или 1 см
исходной суспензии в случае продуктов другой консистенции.
В две другие стерильные чашки Петри вносят по 1 см исходной суспензии жидкого исследуемого продукта или первого десятикратного разведения в случае продуктов другой консистенции.
Повторяют эту процедуру для последующих разведений, используя для каждого разведения новую стерильную пипетку.
Посевы заливают Байрд-Паркер агаром с кроличьей плазмой и бычьим фибриногеном или одной из агаризованных сред, указанных в 8.1.1, слоем приблизительно 3-4 мм.
Осторожно перемешивают инокулят со средой и для застывания оставляют чашки Петри в спокойном состоянии на холодной горизонтальной поверхности.
8.4.2 Чашки Петри с посевами после застывания среды переворачивают и помещают в термостат при температуре (37±1) °С на 18-24 ч. Если необходимо, продолжают инкубирование еще 18-24 ч.
8.4.3 После инкубирования подсчитывают типичные и атипичные для коагулазоположительных стафилококков колонии, в соответствии с 8.1.5.
Для подтверждения принадлежности выросших типичных и (или) атипичных колоний к коагулазоположительным стафилококкам отбирают колонии в соответствии с 8.3.6.
8.4.4 Каждую отобранную колонию отдельно пересевают по 8.1.5.
Посевы инкубируют при температуре (37±1) °С в течение (24±3) ч.
8.4.5 Допускается также выявление коагулазоположительных стафилококков проводить посевом в или на агаризованную среду при условии, что навеску продукта, в которой предусматривается выявление, возможно посеять по этому методу.
При выявлении коагулазоположительных стафилококков посевом в или на агаризованную среду подсчета количества колоний не проводят.
9 Подтверждение принадлежности выявленных микроорганизмов к коагулазоположительным стафилококкам
Для подтверждения принадлежности к коагулазоположительным стафилококкам у выросших микроорганизмов и отобранных по 8.1.5, 8.2.3, 8.3.7 и 8.4.4 определяют отношение к окраске по Граму, способность коагулировать плазму крови кролика и способность образовывать каталазу.
9.1 Окраска по Граму*
_________________
* Наименование подраздела 9.1 в бумажном оригинале выделено курсивом. - .
Из культур готовят мазки, окрашивают их по Граму по ГОСТ 30425 и микроскопируют.
Коагулазоположительные стафилококки положительно окрашиваются по Граму, имеют шарообразную форму, клетки диаметром 0,6-1,0 мкм, располагающиеся чаще (но не всегда) в виде скоплений, напоминающих гроздья винограда.
9.2 Определение каталазы*
_________________
* Наименование подраздела 9.2 в бумажном оригинале выделено курсивом. - .
Способность выросших микроорганизмов образовывать каталазу определяют по ГОСТ 30425. Коагулазоположительные стафилококки образуют каталазу.
9.3 Определение способности коагулировать плазму крови кролика
9.3.1 Способность коагулировать плазму крови кролика определяют у микроорганизмов, окрашивающихся положительно и образующих каталазу.
9.3.2 На Байрд-Паркер агаре с кроличьей плазмой и бычьим фибриногеном подсчитывают количество типичных колоний с зоной преципитации, указывающей на коагулазную активность, и эти колонии без дальнейшего подтверждения считают относящимися к коагулазоположительным стафилококкам.
9.3.3 Соблюдая правила асептики, в стерильные пробирки подходящего размера (например, 10х75 мм) добавляют 0,1 см каждой культуры, выросшей на среде (см. 5.2) по 8.1.5, 8.2.3, 8.3.7 и 8.4.4, и 0,3 см
плазмы кролика (если изготовителем кроличьей плазмы не установлены другие количества) и инкубируют при температуре 37 °С.
Опрокидывая пробирку, исследуют плазму на свертывание после 4-6 ч инкубирования и, если тест отрицательный, просматривают через 24 ч инкубирования или исследуют после инкубационного периода продолжительностью, установленной изготовителем кроличьей плазмы.
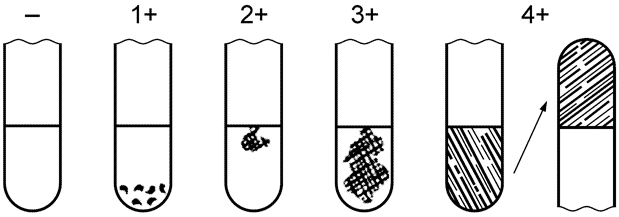
Тест на коагулазу считают положительным, если культура показала, по крайней мере, 3+ - оценку коагулазной реакции, отмеченной на рисунке 1. Реакцию на 1+ или 2+ оценивают как промежуточную.
- отрицательная оценка: не отмечено образования фибрина;
1+ положительная оценка: небольшие несформировавшиеся комочки;
2+ положительная оценка: небольшой сформировавшийся комок;
3+ положительная оценка: большой сформировавшийся комок;
4+ все содержимое пробирки скоагулировано и не меняет своего положения при переворачивании пробирки.
Рисунок 1 - Результаты коагулазного теста
Для контроля качества каждой партии плазмы добавляют 0,1 см стерильного бульона на основе вытяжки из сердца и мозга к рекомендуемому количеству плазмы кролика и инкубируют без посева культуры микроорганизмов при температуре 37 °С, при этом в контролируемой плазме не должно быть признаков свертывания.
9.3.4 Допускается к плазме крови кролика, приготовленной и разлитой по пробиркам, добавлять по одной петле испытуемых культур с агаризованных сред, оставляя одну пробирку с разведенной плазмой в качестве контроля незасеянной.
Внесенную культуру тщательно размешивают и помещают в термостат при температуре (37±1) °С. Если через 6 ч коагуляции плазмы не произошло, то пробирки оставляют при температуре (30±1) °С на 24 ч. Если и через 24 ч плазма не скоагулировала, то испытуемую культуру стафилококка относят к коагулазоотрицательной. Оценка степени коагулирования плазмы - по 9.3.3.
9.3.5 С целью ускорения выявления коагулазоположительных стафилококков вместо суточных культур, выросших на агаризованных средах, допускается использовать культуру, выращенную на мясо-пептонном или сердечно-мозговом бульоне, и использовать ее для постановки реакции плазмокоагуляции спустя 2 ч после появления видимых признаков роста микроорганизмов. При постановке реакции плазмокоагуляции к 0,5 см разведенной плазмы добавляют две капли бульонной культуры. Учет результатов коагуляции плазмы в данном случае проводят в сроки от 30 мин до 2-4 ч. Оценка степени коагулирования плазмы - по 9.3.3.
9.4 Оценка результатов подтверждения принадлежности характерных колоний к коагулазоположительным стафилококкам
Если при испытании типичных и атипичных колоний в них обнаружены грамположительные кокки, образующие каталазу, способные коагулировать плазму крови, то считают, что выявленные микроорганизмы относятся к коагулазоположительным стафилококкам.
9.5 Подтверждение принадлежности выявленных коагулазоположительных стафилококков к S. aureus*
_________________
* Наименование подраздела 9.5 в бумажном оригинале выделено курсивом. - .
Принадлежность выявленных коагулазоположительных стафилококков к S. aureus проводят по определению их способности образовывать ацетоин и ферментировать мальтозу в аэробных условиях.
Дифференциация коагулазоположительных видов и подвидов стафилококков по двум признакам - образованию ацетоина и ферментации мальтозы в аэробных условиях приведена в приложении А.
9.5.1 Определение образования ацетоина (реакция Фогес-Проскауера)
Культуру высевают в пробирки со средой Кларка. Посевы инкубируют при температуре (37±1) °С в течение 48 ч.
После инкубирования посевов к 1 см отобранной культуральной жидкости прибавляют 0,6 см
раствора
-нафтола, приготовленного по 5.1, и 0,2 см
раствора гидроокиси калия, приготовленного по 5.20.
После прибавления каждого реактива пробирку встряхивают. Появление розового окрашивания через 15-60 мин указывает на положительную реакцию.
S. aureus образует ацетоин.
9.5.2 Определение ферментации мальтозы в аэробных условиях
Способность ферментации мальтозы в аэробных условиях определяют с целью дифференциации S. aureus от других коагулазоположительных видов S. intermedius и S. hyicus subsp hyicus.
Для определения ферментации мальтозы в аэробных условиях культуры, подлежащие исследованию, высевают уколом петлей в среду Гисса с мальтозой.
Посевы инкубируют при температуре (37±1) °С в течение 48 ч.
При ферментации мальтозы в аэробных условиях с образованием кислоты цвет среды Гисса изменяется.
S. aureus ферментирует мальтозу в аэробных условиях.
9.6 Определение способности S. aureus образовывать термостабильную нуклеазу и наличия у него гемолитической активности*
_________________
* Наименование подраздела 9.6 в бумажном оригинале выделено курсивом. - .
Способность S. aureus образовывать термостабильную нуклеазу и наличие у него гемолитической активности устанавливают при необходимости для определения его потенциальной энтеротоксигенности по эпидпоказаниям.
9.6.1 Определение термостабильной нуклеазы
Для определения термостабильной нуклеазы в среде по 5.11, разлитой по стерильным чашкам Петри, вырезают с соблюдением правил асептики колодцы диаметром не более 4 мм, расстояние между которыми должно быть не менее 7-8 мм. Культуры, выросшие на мясопептонном бульоне после инкубирования при температуре (37±1) °С в течение 24 ч, прогревают в кипящей водяной бане в течение 15 мин, охлаждают до комнатной температуры и вносят в приготовленные в среде колодцы пастеровской пипеткой по 1-2 капли. Засеянные чашки Петри помещают в термостат при температуре (37±1) °С, результаты учитывают через 1, 2 и 5 ч. При наличии термостабильной нуклеазы появляется ярко-розовая зона вокруг колодца на синем фоне среды.
9.6.2 Определение гемолитической активности
Культуру высевают на поверхность кровяного агара. Посевы инкубируют при температуре (37±1) °С в течение 24 ч. После инкубирования посевов чашки Петри просматривают в проходящем свете, отмечая наличие зон гемолиза.
Наличие термостабильной нуклеазы и гемолитической активности подтверждает энтеротоксигенные свойства S. aureus.
9.7 Оценка результатов подтверждения принадлежности коагулазоположительных стафилококков к S. aureus*
_________________
* Наименование подраздела 9.7 в бумажном оригинале выделено курсивом. - .
9.7.1 Если коагулазоположительные стафилококки образуют ацетоин и сбраживают мальтозу в аэробных условиях, то считают, что выявленные коагулазоположительные стафилококки относятся к S. aureus.
9.7.2 Для биохимической идентификации допускается использование тест-систем промышленного производства, зарегистрированных на территории государства, принявшего стандарт.
10 Обработка результатов
10.1 Результаты оценивают по каждой пробе отдельно.
10.2 Оценка результатов посевов в жидкие среды
При определении НВЧ коагулазоположительных стафилококков или S. aureus или при их выявлении в определенной навеске продукта посевы считают положительными (то есть коагулазоположительные стафилококки или S. aureus выявлены в испытуемой навеске продукта), если при последующем пересеве на агаризованные селективно-диагностические среды и подтверждении типичных и (или) атипичных колоний, выросших на этих средах, хотя бы в одной колонии будут обнаружены коагулазоположительные стафилококки или S. aureus.
НВЧ коагулазоположительных стафилококков или S. aureus в 1 г (см) продукта определяют исходя из количества положительных посевов по ГОСТ 26670.
Результаты выявления коагулазоположительных стафилококков или S. aureus записывают:
обнаружены (не обнаружены) в г (см
) продукта;
- масса или объем продукта, в котором выявляли коагулазоположительные стафилококки или S. aureus.
10.3 Оценка результатов посевов на или в агаризованные селективно-диагностические среды
Число коагулазоположителыных стафилококков для каждой чашки Петри , на которой подсчитывали количество выросших колоний, рассчитывают по формуле
![]() , (1)
, (1)
где - число типичных колоний, в которых подтверждено наличие коагулазоположительных стафилококков;
- число типичных колоний, отобранных для подтверждения;
- общее количество типичных колоний, подсчитанное на чашке Петри;
- число атипичных колоний, в которых подтверждено наличие коагулазоположительных стафилококков;
- число атипичных колоний, отобранных для подтверждения;
- общее количество атипичных колоний, подсчитанное на чашке Петри.
Результат округляют и записывают по ГОСТ 26670.
При посеве в Байрд-Паркер агар с кроличьей плазмой и бычьим фибриногеном подтверждения принадлежности к коагулазоположительным стафилококкам не проводят. В этом случае коагулазоположительными стафилококками на чашке Петри считают все типичные колонии.
Формула для подсчета коагулазоположительных стафилококков относится и к подсчету S. aureus, но при этом в расчет вносят следующие данные:
- число колоний коагулазоположительных стафилококков, в которых подтверждено наличие S. aureus;
- число колоний коагулазоположительных стафилококков, отобранных для подтверждения;
- общее количество колоний коагулазоположительных стафилококков, подсчитанное на чашке Петри;
- число атипичных колоний коагулазоположительных стафилококков, в которых подтверждено наличие S. aureus;
- число атипичных колоний коагулазоположительных стафилококков, отобранных для подтверждения;
- общее количество атипичных колоний коагулазоположительных стафилококков, подсчитанное на чашке Петри.
Рассчитанные значения используют для подсчета количества коагулазоположительных стафилококков или S. aureus в 1 г или 1 см
продукта по формуле
![]() , (2)
, (2)
где - сумма колоний коагулазоположительных стафилококков или S. aureus на всех чашках;
- объем посевного материала, внесенного в каждую чашку Петри, см
;
- число чашек Петри в разведении, выбранном для подсчета;
- степень разведения, соответствующая разведению, выбранному для подсчета.
Согласно ГОСТ 26670 дня подсчета отбирают чашки, на которых выросло не более 300 колоний, при этом число типичных и (или) атипичных колоний должно находиться в пределах 15-150 колоний. Если в двух последовательных разведениях количество выросших типичных и (или) атипичных колоний находится в пределах 15-150, то в этом случае расчет количества коагулазоположительных стафилококков или S. aureus проводят по формуле
![]() , (3)
, (3)
где - сумма колоний коагулазоположительных стафилококков или S. aureus на всех чашках;
- объем посевного материала, внесенного в каждую чашку Петри, см
;
- число чашек с посевами первого разведения;
- число чашек с посевами второго разведения;
- степень разведения, соответствующая первому разведению (исходное разведение также учитывается).
Результаты определения количества коагулазоположительных стафилококков или S. aureus на 1 г (см) продукта округляют и записывают по ГОСТ 26670.
10.4 Пример
Подсчет количества колоний коагулазоположительных стафилококков или S. aureus при посеве 0,1 см исследуемого продукта дал следующие результаты:
- для первого выбранного разведения (10): 140 типичных колоний и 125 типичных колоний, атипичных колоний нет;
- для второго выбранного разведения (10): 16 типичных колоний и 14 типичных колоний, атипичных колоний нет.
Для подтверждения было отобрано следующее число колоний:
- из 140 колоний было взято пять колоний, и все пять подтверждены как коагулазоположительные стафилококки, 140;
- из 125 колоний было взято пять колоний, три из которых подтверждены как коагулазоположительные стафилококки, 75;
- из 16 колоний было взято пять колоний, и все они подтверждены как коагулазоположительные стафилококки, 16;
- из 15 колоний было взято пять колоний, три из которых подтверждены как коагулазоположительные стафилококки, 9.
![]() .
.
Результат после округления будет 1,1·10.
10.5 Оценка малых количеств выросших колоний
10.5.1 Если на каждой из двух чашек Петри, соответствующих посеву навески исследуемой пробы (жидкие продукты) или исходной суспензии (продукты другой консистенции), обнаружено менее 15 колоний коагулазоположительных стафилококков или S. aureus, то результат рассчитывают и выражают следующим образом:
а) при посеве жидких продуктов количество коагулазоположительных стафилококков или S. aureus на см рассчитывают по формуле
![]() , (4)
, (4)
где - сумма колоний коагулазоположительных стафилококков или S. aureus на двух чашках Петри;
- объем посевного материала, внесенного в каждую чашку Петри.
б) при посеве продуктов другой консистенции количество коагулазоположительных стафилококков или S. aureus на г рассчитывают по формуле
![]() , (5)
, (5)
где - сумма колоний коагулазоположительных стафилококков и S. aureus на двух чашках Петри;
- объем посевного материала, внесенного в каждую чашку Петри;
- степень разведения исходной суспензии.
10.5.2 Если на двух чашках Петри при посеве 0,1 см исследуемой пробы жидкого продукта или исходной суспензии продукта другой консистенции не обнаружено колоний коагулазоположительных стафилококков или S. aureus, то результат выражают следующим образом:
- менее 10 КОЕ коагулазоположительных стафилококков или S. aureus в 1 см жидкого продукта;
- менее 10 КОЕ коагулазоположительных стафилококков или S. aureus в 1 г продукта другой консистенции (
- степень разбавления исходной суспензии).
Если высевали 1 см пробы, то результат выражают следующим образом:
- менее 1 КОЕ коагулазоположительного стафилококков или S. aureus в 1 см жидкого продукта;
- менее 1/ КОЕ коагулазоположительных стафилококков или S. aureus в 1 г продукта другой консистенции.
11 Протокол испытания
Результаты оценивают по каждой пробе отдельно.
Протокол испытания должен включать:
- всю информацию, необходимую для полной идентификации испытуемого продукта;
- используемый метод отбора проб;
- используемый метод испытания в соответствии с настоящим стандартом;
- все детали операций, не установленных настоящим стандартом;
- полученный(е) результат(ы).
Приложение А
(справочное)
Дифференциация коагулазоположительных видов и подвидов стафилококков по двум признакам - образованию ацетоина и ферментации мальтозы в аэробных условиях
Таблица А.1
Наименование тестов | S. aureus | S. delphini | S. hyicus | S. intermedius | S. schleiferi subsp. coagulans | |
subsp. anaerobius | subsp. aureus | |||||
Образование ацетоина | - | + | - | - | - | + |
Ферментация мальтозы в аэробных условиях | + | + | - | w | - | |
Примечание - "+" означает, что 90% или более штаммов положительные; "-" означает, что 90% или более штаммов отрицательные; "w" означает, что реакция слабая; "отсутствие обозначения" означает, что определение показателя не проводилось. | ||||||
Приложение ДА
(справочное)
Сравнение структуры настоящего стандарта со структурой примененных в нем международных стандартов
ДА.1 Сопоставление структуры настоящего стандарта со структурой ISO 6888-1:1999 приведено в таблице ДА.1.
Таблица ДА.1
Структура международного стандарта ISO 6888-1:1999 | Структура настоящего стандарта | ||||
Раздел | Пункты | Подпункты | Раздел | Пункты | Подпункты |
1 Область распространения | 1 | - | 1 Область применения | 1 | - |
2 Нормативные ссылки | 2 | - | 2 Нормативные ссылки | 2 | - |
3 Термины и определения | 3 | 3.1, 3.2 | 3 Термины и определения | 3 | 3.1, 3.2 |
4 Сущность метода | 4 | 4.1-4.3 | 4 Методы выявления и определения количества коагулазоположительных стафилококков и S. aureus | 4.1, 4.3 | 4.1.1-4.3.2 |
5 Питательные среды и разведения | 5 | - | 5 Питательные среды, растворы, эмульсии, реактивы и фибринированная кровь | 5 | 5.1.1-5.21.1 |
6 Аппаратура и посуда | 6 | - | 6 Аппаратура, посуда, материалы, реактивы | 6 | - |
7 Отбор проб | 7 | 7 Отбор и подготовка проб | 7 | - | |
8 Приготовление проб | 8 | ||||
9 Испытание | 9 | 9.1-9.5 | 8 Проведение испытания | 8.1-8.4 | 8.1.1-8.4.3 |
10 Подсчет и выражение результатов | 10 | 10.1, 10.2 | 9 Подтверждение принадлежности выявленных микроорганизмов к коагулазоположительным стафилококкам | 9.1-9.7 | 9.1.1-9.7.1 |
11 Точность | 11 | - | 10 Обработка результатов | 10.1-10.4 | - |
12 Протокол испытания | 12 | - | 11 Протокол испытания | 11 | - |
- | - | - | Приложение А | - | - |
ДА.2 Сопоставление структуры настоящего стандарта со структурой ISO 6888-2:1999 приведено в таблице ДА.2.
Таблица ДА.2
Структура международного стандарта ISO 6888-2:1999 | Структура настоящего стандарта | ||||
Раздел | Пункты | Подпункты | Раздел | Пункты | Подпункты |
1 Область распространения | 1 | - | 1 Область применения | 1 | - |
2 Нормативные ссылки | 2 | - | 2 Нормативные ссылки | 2 | - |
3 Термины и определения | 3 | 3.1, 3.2 | 3 Термины и определения | 3 | 3.1, 3.2 |
4 Сущность метода | 4 | 4.1-4.3 | 4 Методы выявления и определения количества коагулазоположительных стафилококков и S. aureus | 4.1-4.3 | 4.1.1-4.3.2 |
5 Питательные среды и разведения | 5 | - | 5 Питательные среды, растворы, эмульсии, реактивы и дифибринированная кровь | 5 | 5.1.1-5.21.1 |
6 Аппаратура и посуда | 6 | - | 6 Аппаратура, посуда, материалы, реактивы | 6 | - |
7 Отбор проб | 7 | - | 7 Отбор и подготовка проб | 7 | - |
8 Приготовление проб | 8 | ||||
9 Испытание | 9 | 9.1-9.3 | 8 Проведение испытания | 8.1-8.4 | 8.1.1-8.4.3 |
10 Подсчет и выражение результатов | 10 | 10.1, 10.2 | 9 Подтверждение принадлежности выявленных микроорганизмов к коагулазоположительным стафилококкам | 9.1-9.7 | 9.1.1-9.7.2 |
11 Точность | 11 | - | 10 Обработка результатов | 10.1-10.4 | - |
12 Протокол испытания | 12 | - | 11 Протокол испытания | 11 | - |
- | - | - | Приложение А | - | - |
ДА.3 Сопоставление структуры настоящего стандарта со структурой ISO 6888-3:2003 приведено в таблице ДА.3.
Таблица ДА.3
Структура международного стандарта ISO 6888-3:2003 | Структура настоящего стандарта | ||||
Раздел | Пункты | Подпункты | Раздел | Пункты | Подпункты |
1 Область распространения | 1 | - | 1 Область применения | 1 | - |
2 Нормативные ссылки | 2 | - | 2 Нормативные ссылки | 2 | - |
3 Термины и определения | 3 | - | 3 Термины и определения | 3 | 3.1, 3.2 |
4 Сущность метода | 4 | 4.1-4.3 | 4 Методы выявления и определения количества коагулазоположительных стафилококков и S. aureus | 4.1-4.3 | 4.1.1-4.3.2 |
5 Питательные среды и разведения | 5 | - | 5 Питательные среды, растворы, эмульсии, реактивы и дифибринированная кровь | 5 | 5.1.1-5.21.1 |
6 Аппаратура и посуда | 6 | - | 6 Аппаратура, посуда, материалы, реактивы | 6 | - |
7 Отбор проб | 7 | - | 7 Отбор и подготовка проб | 7 | - |
8 Приготовление проб | 8 | ||||
9 Испытание | 9 | 9.1-9.3 | 8 Проведение испытания | 8.1-8.4 | 8.1.1-8.4.3 |
10 Подсчет и выражение результатов | 10 | 10.1, 10.2 | 9 Подтверждение принадлежности выявленных микроорганизмов к коагулазоположительным стафилококкам | 9.1-9.7 | 9.1.1-9.7.2 |
11 Точность | 11 | - | 10 Обработка результатов | 10.1-10.4 | - |
12 Протокол испытания | 12 | - | 11 Протокол испытания | 11 | - |
- | - | - | Приложение А | - | - |
УДК 663.664.001.4:006.354 | МКС 07.100.30 |
| MOD |
Ключевые слова: коагулазоположительные стафилококки и S. aureus, колониеобразующие единицы (KOE), типичные и атипичные колонии, питательные среды, инкубирование посевов, реакция Фогес-Проскауера, термостабильная нуклеаза, окраска по Граму, наличие каталазы и коагулазы, наиболее вероятное число (НВЧ) | |||
Редакция документа с учетом
изменений и дополнений подготовлена