ГОСТ Р 71139-2023
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕРМЕНТНЫЕ ПРЕПАРАТЫ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
Метод определения липолитической активности
Enzyme preparations for the food industry. Method for determining lipolytic activity
ОКС 07.100.30
Дата введения 2024-03-01
Предисловие
1 РАЗРАБОТАН Ассоциацией "Технологическая платформа БиоТех2030" (Ассоциация "ТП БиоТех2030")
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 326 "Биотехнологии"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 6 декабря 2023 г. N 1526-ст
4 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
1 Область применения
Настоящий стандарт распространяется на ферментные препараты для пищевой промышленности и устанавливает метод определения ферментативной активности липаз (триацилглицерин ацилгидролаз) и их ферментных препаратов.
Стандарт разработан с целью сравнительной оценки липазной активности коммерчески доступных липаз (триацилглицерин ацилгидролаз) и не распространяется на липазы и их ферментные препараты с неизвестными оптимальными значениями pH и температуры.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 8.135-2014* Государственная система обеспечения единства измерений. Стандарт-титры для приготовления буферных растворов - рабочих эталонов pH 2-го и 3-го разрядов. Технические и метрологические характеристики. Методы их определения
ГОСТ 61 Реактивы. Кислота уксусная. Технические условия
ГОСТ 199 Реактивы. Натрий уксуснокислый 3-водный. Технические условия
ГОСТ 245 Реактивы. Натрий фосфорнокислый однозамещенный 2-водный. Технические условия
ГОСТ 1770 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 4172 Реактивы. Натрий фосфорнокислый двузамещенный 12-водный. Технические условия
ГОСТ 4328 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 5962 Спирт этиловый ректификованный из пищевого сырья. Технические условия
ГОСТ 25336 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25794.1 Реактивы. Методы приготовления титрованных растворов для кислотно-основного титрования
ГОСТ OIML R 76-1 Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ Р 57248 Препараты ферментные. Правила приемки и методы отбора проб
ГОСТ Р 58144 Вода дистиллированная. Технические условия
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 гидролиз: Расщепление исходного соединения на более простые в присутствии молекул воды.
3.2
ферментативный гидролиз: Гидролиз высокомолекулярных соединений под воздействием катализаторов белковой природы - гидролитических ферментов (гидролиз, класс 3 [1]). [ГОСТ 31488-2012, пункт 3.2] |
3.3
субстрат: Соединение или вещество, на которое воздействует данный фермент. [ГОСТ 31488-2012, пункт 3.3] |
3.4 триацилглицерин ацилгидролазы (липазы): Ферменты класса гидролаз, катализирующие расщепление сложноэфирных связей в молекулах триглицеридов; код фермента в соответствии с международной классификацией: ЕС 3.1.1.3 триацилглицерин ацилгидролаза.
3.5 единица активности липазы, ILU, ME, U: Количество фермента в мг, которое обеспечивает высвобождение 1 мкмоль свободной жирной кислоты за 1 мин при заданных условиях.
4 Сущность метода
Метод основан на гидролизе высокоолеинового подсолнечного или оливкового масел липазой или ферментным препаратом липазы в течение заданного периода времени с последующей остановкой реакции этиловым спиртом и определении полученных свободных жирных кислот (СЖК) титриметрическим (потенциометрическим) методом.
Примечание - Активность фермента является относительной характеристикой, свойственной ферменту в конкретных условиях проведения измерения (температура, pH, тип субстрата и эмульгатора).
Активность фермента, измеренную согласно настоящей методике, допускается использовать для сравнения только с активностью других ферментов, измеренной по данной методике.
Активности ферментов, подлежащие сравнению, должны быть измерены в строго идентичных условиях. Неточное соблюдение условий измерения, указанных в данном стандарте, их изменение, замена реактивов и/или использование реактивов с чистотой хуже указанных может привести к получению невоспроизводимых или недостоверных результатов сравнения.
5 Условия проведения измерений
При выполнении измерений соблюдают следующие условия: температура воздуха (20±5)°C, относительная влажность не более 80% (условия измерений должны соответствовать требованиям, изложенным в паспортах или иных документах на используемое оборудование и материалы).
6 Средства измерений, вспомогательное оборудование, посуда, реактивы и материалы
6.1 Средства измерений
Весы неавтоматического действия по ГОСТ OIML R 76-1 с пределами допускаемой абсолютной погрешности ±0,001 г.
Весы неавтоматического действия по ГОСТ OIML R 76-1 с пределами допускаемой абсолютной погрешности ±0,01 г.
Секундомер механический второго класса точности.
pH-электрод для водного титрования для прямого измерения рН в диапазоне от 0 до 14 ед.
Термометр любого исполнения, обеспечивающий измерение температуры в диапазоне 0°C-25°C, с ценой деления шкалы 1°C, с пределом допускаемой погрешности не более ±1°C.
6.2 Реактивы и материалы
Спирт этиловый 96% по ГОСТ 5962.
Гексан, х.ч., с содержанием основного вещества не менее 99%.
Масло рафинированное дезодорированное: высокоолеиновое подсолнечное (ВП) или оливковое (О) с содержанием триолеина не менее 70%.
Камедь аравийская (гуммиарабик), с содержанием влаги и летучих веществ не более 15%, представляющая собой желтовато-белый или янтарный порошок, или хлопья.
Соль поваренная пищевая.
Кислота ледяная уксусная по ГОСТ 61.
Натрий уксуснокислый 3-водный по ГОСТ 199.
Растворы буферные калибровочные (не менее трех), позволяющие провести калибровку электрода в диапазоне проведения измерений таким образом, чтобы измеряемые значения рН находились между нижней и верхней точками калибровочных значений. Буферные растворы готовят из стандарт-титров по ГОСТ 8.135-2014 (пункт 3.4) с погрешностью ±0,03 рН или согласно рекомендациям изготовителя.
Вода дистиллированная по ГОСТ Р 58144.
6.3 Вспомогательное оборудование
Мешалка магнитная с магнитным вкладышем для перемешивания с термоплитой или водяная баня любого типа, оборудованная магнитным перемешивающим устройством, которая обеспечивает поддержание температуры в диапазоне 35°C-50°C с точностью до 1°C.
Диспергатор лабораторный верхнеприводный, обеспечивающий скорость вращения не менее 2000 об/мин.
Баня ледяная, рециркуляционный охладитель или другое охлаждающее оборудование.
6.4 Допускается применение других средств измерений, вспомогательного оборудования и посуды, не уступающих вышеуказанным по метрологическим и техническим характеристикам и обеспечивающих необходимую точность измерения, а также реактивов и материалов, по качеству не ниже указанных.
7 Подготовка к анализу
7.1 Подготовка автоматического титратора к работе
Автоматический титратор готовят к работе и проверяют правильность измерений pH в соответствии с руководством по эксплуатации. Проводят градуировку электрода в соответствии с руководством по эксплуатации с использованием буферных калибровочных растворов непосредственно в день анализа.
После каждого измерения электрод промывают сначала в гексане, затем в дистиллированной воде.
Примечание - Допускается использование стандарт-титра для изготовления данного раствора.
7.6 Приготовление буферного раствора с заданным значением pH
7.6.1 Приготовление 50 мМ натрий-ацетатного буферного раствора с pH 4,0 или pH 5,0
7.6.2 Приготовление 50 мМ натрий-фосфатного буферного раствора с pH 6,0
7.6.3 Приготовление 50 мМ натрий-фосфатного буферного раствора с pH 7,0
7.6.4 Приготовление 50 мМ натрий-фосфатного буферного раствора с pH 8,0
7.7 Приготовление эмульсии высокоолеинового подсолнечного или оливкового масла с гуммиарабиком
7.7.1 Приготовление раствора гуммиарабика
7.7.2 Приготовление охлаждающей смеси
В подходящей посуде смешивают три части снега или толченого льда с одной частью поваренной соли. Смесь хранят в морозильной камере при температуре не более минус 18°C.
Примечание - Вместо охлаждающей смеси допускается использование рециркуляционных охладителей или другого охлаждающего оборудования, позволяющего поддерживать температуру при приготовлении эмульсии от 5°C до 25°C.
7.7.3 Приготовление исходной эмульсии
7.7.4 Приготовление рабочей эмульсии
Примечания
1 Указанные объемы компонентов для приготовления рабочей эмульсии приведены из расчета на проведение одного измерения. Проведение повторного измерения требует повторения процедуры, описанной в данном пункте.
2 Тип используемого субстрата оказывает влияние на относительную активность липазы. Если существует необходимость сравнить активности липаз (триацилглицерин ацилгидролаз) с использованием типа субстрата, отличного от предложенных масел, анализ следует проводить с использованием этого типа субстрата. В данном случае при оформлении протокола анализа необходимо указать использованный тип субстрата.
7.8 Приготовление раствора сухого фермента/ферментного препарата
Примечание - Сухие и жидкие ферменты/ферментные препараты хранят согласно рекомендациям изготовителя.
8 Отбор проб
Отбор проб проводят по ГОСТ Р 57248.
9 Проведение анализа
Примечание - Этанол используют для ингибирования липазы. Семь стаканов для титрования или колб используют в качестве шести проб, характеризующих строго определенное время взаимодействия системы фермент-субстрат и одной контрольной пробы (пробы без добавления фермента).
Примечание - Возможно уменьшение временного интервала отбора смеси фермента и эмульсии для последующего ингибирования до одной минуты при необходимости экономии времени, если известна та концентрация раствора фермента, которая позволяет добиться графика, аналогичного приведенному в 10.2.
Примечание - Перед титрованием допускается внесение известного объема титранта ко всем пробам, например, если использовался буферный раствор с рН ниже 7,0.
10 Обработка результатов
N - измеренная нормальность используемого титранта NaOH (приблизительно 0,05 н);
Примечание - Тип используемого диспергатора, скорость и продолжительность диспергирования, используемые реактивы и опыт оператора могут оказывать влияние на конечный результат. Поэтому, при необходимости проведения сравнительных анализов различных липаз (триацилгидролаз) и ферментных препаратов, содержащих указанные активности, эти анализы следует проводить строго в условиях повторяемости.
_______________
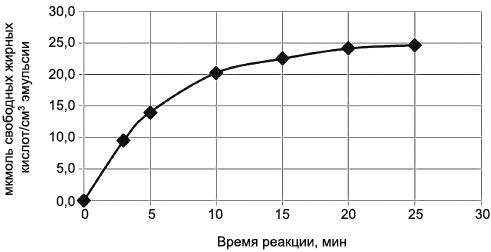 |
Рисунок 1 - Общий вид графика нарастания содержания свободных жирных кислот в зависимости от времени взаимодействия фермента с субстратом (нарастающая кривая с логарифмическим ускорением до точки перегиба с дальнейшим выходом на плато)
Примечание - Если при построении графика его вид не соответствует рисунку 1, то проводят повторное исследование с использованием большей или меньшей концентрации фермента в растворе, приготовленном по 7.8. В частности, вид графика, близкий к линейному, может свидетельствовать о недостаточной концентрации фермента.
10.3 Полученные значения времени и содержания СЖК преобразуют путем вычисления двойных обратных координат (замене полученных значений на обратные):
_______________
Примечания
1 Более высокая или более низкая активность фермента относительно ожидаемой, как правило, приводит к отклонению графика от линейности. В частности, вид графика, близкий к линейному, может свидетельствовать о недостаточной концентрации фермента. В этом случае для более точных результатов следует провести повторный анализ с использованием более разбавленного или концентрированного фермента, по процедуре, описанной в 7.8.
2 Перемешивание в процессе инкубирования системы фермент/субстрат, проводимое на магнитной мешалке с магнитным вкладышем, и/или другие отклонения от описанной процедуры анализа могут приводить к получению нетипичных графиков и затруднять получение линии тренда с заданным коэффициентом корреляции.
1000 - коэффициент переведения размерности из мг в г.
Примечания
1 m вычисляют путем деления навески сухого порошка липазы или отобранного объема ферментного препарата на объем мерной колбы, равный 25. Значение корректируют соответственно, если использовали более разбавленный или концентрированный раствор.
2 Возможно выражение удельной активности в пересчете на грамм белка, если известно его содержание в сухом ферменте или ферментном препарате. В этом случае вместо m необходимо подставить известное содержание белка в препарате. При этом при оформлении протокола анализа обязательно следует указать единицы измерения и что использовали в качестве знаменателя (массу навески препарата или массу белка в нем).
За окончательный результат измерений липазной активности или удельной активности липазы принимают среднеарифметическое двух параллельных определений, выполненных в условиях повторяемости.
11 Контроль точности результатов измерений
11.1 Повторяемость
Расхождение между результатами двух независимых единичных определений, выполненных на идентичном испытуемом материале, в одной лаборатории, одним оператором, на одном оборудовании за короткий промежуток времени, не должно превышать 74,8% среднеарифметического значения результатов анализа при доверительной вероятности 0,95.
11.2 Воспроизводимость
Расхождение между результатами двух единичных определений, выполненных одним методом, на идентичном испытуемом материале, в разных лабораториях, разными аналитиками, на различном оборудовании, не должно превышать 31,4% при доверительной вероятности 0,95.
11.3 Точность
Правильность и точность настоящего метода должна устанавливаться в каждой отдельно взятой лаборатории с использованием любого коммерчески доступного образца фермента (контрольная проба или стандартный образец лаборатории). Оценку необходимо проводить в соответствии с требованиями ГОСТ Р ИСО 5725-6-2002 (раздел 6).
УДК 577.15:543.06:006.354 | ОКС 07.100.30 |
Ключевые слова: ферментные препараты, липаза, ферментативный гидролиз, субстрат, свободные жирные кислоты, триацилглицерин ацилгидролаза | |

