ГОСТ Р ИСО 21871-2010
Группа Н09,
С19
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ ДЛЯ ЖИВОТНЫХ
Метод обнаружения и подсчета наиболее вероятного числа Bacillus cereus
Microbiology of food and animal feeding stuffs. Most probable number count and detection method for Bacillus cereus
ОКС 07.100.30
ОКСТУ 9109;
9209
Дата введения 2012-01-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 ПОДГОТОВЛЕН Государственным научным учреждением Всероссийским научно-исследовательским институтом консервной и овощесушильной промышленности (ГНУ ВНИИКОП) и ОАО "Всероссийский научно-исследовательский институт сертификации" (ОАО "ВНИИС") на основе собственного аутентичного перевода на русский язык международного стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 335 "Методы испытаний агропромышленной продукции на безопасность"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 29 ноября 2010 г. N 557-ст
4 Настоящий стандарт является идентичным по отношению к международному стандарту ИСО 21871:2006* "Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод определения малых количеств презумптивных палочек Bacillus cereus. Метод подсчета и обнаружения наиболее вероятного количества" (ISO 21871:2006 "Microbiology of food and animal feeding stuffs - Horizontal method for the determination of low numbers of presumptive Bacillus cereus - Most probable number technique and detection method".
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ Р 1.5 (пункт 3.5).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
Настоящий стандарт распространяется на пищевые продукты и корма для животных и устанавливает методы выявления и подсчета наиболее вероятного количества жизнеспособных презумптивных Bacillus cereus.
Данный метод не предусматривает дифференциации Bacillus cereus от других близких видов рода Bacillus, таких как Bacillus weihenstephanensis, Bacillus anthracis, Bacillus thuringiensis, Bacillus mycoides и Bacillus pseudomycoides.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ИСО 6887-1:1999 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 1. Общие правила приготовления исходной суспензии и десятичных разведений
ИСО 6887-2:2003 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 2. Специальные правила для приготовления мяса и мясных продуктов
ИСО 6887-3:2003 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 3. Специальные правила для приготовления рыбы и рыбных продуктов
ИСО 6887-4:2003 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 4. Специальные правила для приготовления продуктов, кроме молока и молочных продуктов, мяса и мясных продуктов и рыбы и рыбопродуктов
ИСО 7218:2007 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
ИСО 8261:2001 Молоко и молочные продукты. Общие правила приготовления проб для анализа, исходных суспензий и десятичных разведений для микробиологических исследований
ИСО/ТУ 11133-1:2009 Микробиология пищевых продуктов и кормов для животных. Правила приготовления и производства питательных сред. Часть 1. Общие правила по обеспечению качества приготовления питательных сред в лаборатории
ИСО/ТУ 11133-2:2003 Микробиология пищевых продуктов и кормов для животных. Правила приготовления и производства питательных сред. Часть 2. Практическое руководство по определению эффективности питательных сред
3 Термины и определения
В настоящем стандарте применен следующий термин с соответствующим определением:
3.1 презумптивные Bacillus cereus (presumptive Bacillus cereus): Микроорганизм, который образует типичные или атипичные колонии на поверхности селективной питательной среды и дает положительные реакции по морфологическим и биохимическим свойствам, установленным в настоящем стандарте.
Примечание - Для реализации метода испытаний данное определение презумптивных Bacillus cereus применяют для установленной процедуры идентификации.
4 Сущность метода
4.1 Метод подсчета
4.1.1 Инокуляция трех пробирок с жидкой селективной обогащенной средой двойной концентрации [5.3.1.1 а)] установленным количеством первичного разбавления разведения (исходная суспензия).
4.1.2 Инокуляция трех пробирок с жидкой селективной обогащенной средой единичной нормальной концентрации [5.3.1.1 b)] установленным количеством первичного разбавления (начальная суспензия). Затем, в тех же условиях, инокуляция жидкой селективной обогащенной среды единичной концентрации [5.3.1.1 b)] установленными количествами десятичных разбавлений десятикратных разведений первичного разбавления (начальная суспензия).
4.1.3 Инкубация пробирок с жидкой селективной обогащенной средой двойной и единичной концентрации (5.3) в течение 48 ч при температуре 30 °С.
4.1.4 Инокуляция твердой селективной среды (5.4 или 5.5) из жидкой селективной обогащенной среды (5.3).
4.1.5 Инкубация твердой селективной среды (5.4 или 5.5) в течение 18-48 ч при температуре 37 °С (5.4) или 30 °С (5.5) и исследование чашек с целью проверки присутствия колоний, которые, согласно своим характеристикам, должны быть презумптивными бактериями Bacillus cereus.
4.1.6 Подтверждение принадлежности типичных колоний к презумптивным Bacillus cereus и наличия предполагаемых колоний при помощи гемолиза (9.1.5.3) или исследования под микроскопом (9.1.5.4).
4.1.7 Расчет наиболее вероятного количества презумптивных бактерий Bacillus cereus в выражении на грамм или на миллилитр пробы выбранных разбавлений с использованием таблиц наиболее вероятного количества.
4.2 Метод обнаружения
4.2.1 Инокуляция жидкой селективной обогащенной среды (5.3) установленным объемом начальной суспензии пробы для испытаний.
4.2.2 Инкубация пробирки в течение 48 ч при температуре 30 °С.
4.2.3 Инокуляция твердой селективной среды (5.4 или 5.5) из жидкой селективной обогащенной среды (5.3).
4.2.4 Инкубация твердой селективной среды (5.4 или 5.5) в течение 18-48 ч при температуре 37 °С (5.4) или 30 °С (5.5) и исследование чашек с целью проверки присутствия колоний, которые, согласно своим характеристикам, могут соответствовать презумптивным бактериям Bacillus cereus.
4.2.5 Подтверждение наличия предполагаемых колоний при помощи гемолиза (9.1.5.3) или исследования под микроскопом (9.1.5.4).
4.2.6 Результат приводится в форме "присутствие" или "отсутствие" презумптивных бактерий Bacillus cereus в граммах или миллилитрах (см) продукции.
5 Питательные среды и реагенты
5.1 Общие положения
В лабораторной практике применяют ИСО 7218, ИСО/ТУ 11133-1 и ИСО/ТУ 11133-2.
5.2 Разведение - по ИСО 6887 (все части), ИСО 8261 и любому конкретному стандарту, распространяющемуся на исследуемую продукцию.
5.3 Жидкая селективная обогащенная среда: триптон-соевый полимиксиновый бульон (TSPB) по [1].
5.3.1 Основа среды
5.3.1.1 Состав
Наименование компонента | а) Среда двойной концентрации | b) Среда единичной концентрации |
Ферментативный продукт переваривания казеина, г | 34,0 | 17,0 |
Ферментативный продукт переваривания сои, г | 6,0 | 3,0 |
Хлорид натрия (NaCI), г | 10,0 | 5,0 |
Глюкоза, г | 5,0 | 2,5 |
Фосфорнокислый калий двузамещенный (K | 5,0 | 2,5 |
Вода, см | 1000 | 1000 |
5.3.1.2 Приготовление
Ингредиенты или готовую базовую среду растворяют в колбе вместимостью 1 дм воды, нагревают на слабом огне до кипения и кипятят 2-3 мин при постоянном перемешивании. При необходимости корректируют рН так, чтобы после стерилизации он был равен 7,3±0,2 при температуре 25 °С.
Среды распределяют в объеме по 10 см [среда двойной концентрации (5.3.1.1 а)] и по 9 см
[среда единичной концентрации (5.3.1.1 b)] в пробирки размером 16х160 мм (6.7).
Стерилизуют в автоклаве (6.1) при температуре 121 °С в течение 15 мин.
5.3.2 Раствор полимиксина В сульфата
5.3.2.1 Состав
Полимиксина В сульфат, ЕД (или г) | 500000 (или 0,05) |
Вода, см | 50 |
5.3.2.2 Приготовление
Полимиксина В сульфат растворяют в воде. Стерилизуют путем фильтрации.
5.3.3 Полная среда
Непосредственно перед использованием добавляют 200 мкл (для среды двойной концентрации) или 100 мкл (для среды единичной концентрации) раствора полимиксина В сульфата (5.3.2) в каждую пробирку, содержащую базовую среду (5.3.1).
5.3.4 Проверка эксплуатационных характеристик с целью гарантии качества питательной среды
Определение селективности и продуктивности - по ИСО/ТУ 11133-1. Тестирование эффективности питательного триптон-соевого полимиксинового бульона (TSPB) проводится по ИСО/ТУ 11133-2 и в соответствии с таблицей 1.
Таблица 1 - Результаты проверки эксплуатационных характеристик триптон-соевого полимиксинового бульона (TSPB)
Функция | Инкубация | Контрольные штаммы | Метод контроля | Критерии | Характерные реакции |
Производи- тельность | 48 ч при 30 °С | В. cereus АТСС 11778 или тот же штамм, зарегистрированный в других коллекциях | Полуколи- |
| Характерные колонии на РЕМВА или MYP (см. 5.4.5 или 5.5.6) |
Функция | Инкубация | Контрольные штаммы | Метод контроля | Критерии | Характерные реакции |
Селектив- ность | 48 ч при 30 °С | Е. coli АТСС 25922 или 8739 или тот же штамм, зарегистрированный в других коллекциях | Полуколи- | Полное ингибирование | - |
5.4 Твердая селективная среда: агар с полимиксином, пируватом, яичным желтком, маннитом и бромтимоловым синим (РЕМВА) по [2]
5.4.1 Базовая среда
5.4.1.1 Состав
Ферментативный продукт переваривания казеина, г | 1,0 |
D-Маннит, г | 10,0 |
Пируват натрия, г | 10,0 |
Сульфат магния (MgSO | 0,1 |
Хлорид натрия, г | 2,0 |
Гидрофосфат динатрия (Na | 2,5 |
Дигидрофосфат калия (KН | 0,25 |
Бромтимоловый синий, г | 0,12 |
Агар, г | 9-18 |
Вода, см | 940 |
| |
5.4.1.2 Приготовление
Компоненты или готовую обезвоженную базовую среду растворяют в колбе вместимостью 1 дм воды, нагревают на слабом огне до кипения и кипятят 2-3 мин при постоянном перемешивании.
При необходимости корректируют рН так, чтобы после стерилизации он был равен 7,2±0,2 при температуре 25 °С.
Стерилизуют в автоклаве (6.1) при температуре 121 °С в течение 15 мин.
5.4.2 Раствор полимиксина В сульфата
Готовят по 5.3.2.
5.4.3 Эмульсия яичного желтка
Используют свежие чистые куриные яйца с неповрежденной скорлупой. Яйца промывают в жидком моющем средстве, используя щетку. Ополаскивают в проточной воде, погружают в 70%-ный (по объему) раствор этилового спирта на 30 с и высушивают. Соблюдая стерильность, разбивают каждое яйцо и отделяют желток от белка путем многократного переноса желтка с одной половины яичной скорлупы на другую. Желтки помещают в стерильный мерный цилиндр и добавляют четыре объемные части стерильной воды. Соблюдая стерильность, переносят содержимое в колбу для стерилизации (6.7) и интенсивно перемешивают.
Смесь нагревают в течение 2 ч на водяной бане (6.4) при температуре 47 °С. Затем оставляют на 18-24 ч при температуре (3±2) °С для образования осадка.
Надосадочную эмульсию собирают в стерильных условиях.
Эмульсию можно хранить при температуре (3±2) °С не более 72 ч.
Обе твердые селективные среды, описываемые в настоящем стандарте, были первоначально приготовлены из 20%-ной эмульсии яичного желтка, как это изложено в [3]. Допускается использовать готовые эмульсии яичного желтка с различной концентрацией. Вместе с тем необходимо следовать инструкциям производителя, особенно касающихся времени хранения. Следует принять меры для обеспечения того, чтобы данная эмульсия была пригодна для использования в питательных средах, описанных в 5.4 и 5.5.
5.4.4 Готовая среда (агар РЕМВА)
5.4.4.1 Состав
Базовая среда (5.4.1), см | 940 |
Раствор полимиксина В сульфата (5.4.2), см | 10 |
Эмульсия яичного желтка (5.4.3), см | 50 |
5.4.4.2 Приготовление
В базовую среду (5.4.1), расплавленную и охлажденную до температуры 47 °С, добавляют другие компоненты раздельно при непрерывном перемешивании.
5.4.4.3 Приготовление чашек Петри с агаром
Переносят около 12,5 см аликвоты полной среды в чашки Петри (6.9) и дают им затвердеть.
Примечание - Ввиду технических причин [2], вместо обычного количества 15 см используют 12,5 см
.
Чашки можно хранить при температуре (3±2) °С до четырех дней.
Непосредственно перед использованием чашки с агаром подсушивают, при снятых крышках и наклонив поверхность агара вниз, в сушильном шкафу или термостате (6.2) при температуре от 25 °С до 50 °С, до тех пор пока с поверхности агара не исчезнут капли влаги, но не более 20-30 мин.
5.4.5 Проверка качества питательной среды
Проверка качества питательной среды - по ИСО/ТУ 11133-2. В таблице 2 представлены результаты проверки качества агара с полимиксином, пируватом, яичным желтком, маннитом и бромтимоловым синим.
Таблица 2
Функция | Инкубация | Контрольные штаммы | Метод контроля | Критерии | Характерные реакции |
Производи- тельность | 18-48 ч при 37 °С | В. cereus АТСС 11778 или тот же штамм, зарегистрированный в других коллекциях | Качественный | Значительный рост | Колонии бирюзового цвета с ореолом осадка |
Селектив- ность | 18-48 ч при 37 °С | Е. coli АТСС 25922, или 8739, или тот же штамм, зарегистрированный в других коллекциях | Качественный | Полное ингибирование | - |
5.5 Твердая селективная среда: агар с маннитом, яичным желтком и полимиксином (MYP) по [4]
5.5.1 Базовая среда
5.5.1.1 Состав
Мясной экстракт, г | 1,0 |
Ферментативный продукт переваривания казеина, г | 10,0 |
D-Маннитол, г | 10,0 |
Хлорид натрия (NaCI), г | 10,0 |
Феноловый красный, г | 0,025 |
Агар, г | 9-18 |
Вода, см | 900 |
| |
5.5.1.2 Приготовление
Компоненты или готовую обезвоженную базовую среду растворяют в колбе вместимостью 1 дм воды, нагревают на слабом огне до кипения и кипятят 2-3 мин при постоянном перемешивании.
При необходимости корректируют рН так, чтобы после стерилизации он был равен 7,2±0,2 при температуре 25 °С.
Разливают среду по 90 см в колбы (6.7) вместимостью 250 см
.
Стерилизуют в автоклаве (6.1) при температуре 121 °С в течение 15 мин.
5.5.2 Раствор полимиксина В сульфата
Готовят по 5.3.2.
5.5.3 Эмульсия яичного желтка
Готовят по 5.4.3.
5.5.4 Полная среда (агар MYP)
5.5.4.1 Состав
Базовая среда (5.5.1), см | 90,0 |
Раствор полимиксина В сульфата (5.5.2), см | 1,0 |
Эмульсия яичного желтка (5.5.3), см | 10,0 |
5.5.4.2 Приготовление агара MYP
Базовую среду (5.5.1), расплавленную и охлажденную до температуры 47 °С, добавляют другие компоненты раздельно при непрерывном перемешивании.*
_______________
* Текст документа соответствует оригиналу. - .
5.5.5 Приготовление чашек Петри с агаром MYP
Готовый агар MYP (5.5.4) разливают по 15-20 см в стерильные чашки Петри (6.9) и дают затвердеть.
Чашки можно хранить при температуре (3±2) °С до четырех дней.
Непосредственно перед использованием чашки с агаром подсушивают, при снятых крышках и наклонив поверхность агара вниз, в сушильном шкафу или термостате (6.2) при температуре от 25 °С до 50 °С, до тех пор пока с поверхности агара не исчезнут капли влаги, но не более 20-30 мин.
5.5.6 Проверка качества питательной среды - по ИСО/ТУ 11133-2 и в соответствии с таблицей 3.
Таблица 3 - Результаты проверки эксплуатационных характеристик агара с маннитолом, яичным желтком и полимиксином (MYP)
Функция | Инкубация | Контрольные штаммы | Метод контроля | Критерии | Характерные реакции |
Производи- тельность | 24-18 ч при 30 °С | В. cereus АТСС 11778 или тот же штамм, зарегистрированный в других коллекциях | Качественный | Значительный рост | Колонии розового цвета с ореолом осадка |
Селектив- ность | 48 ч при 30 °С | Е. coli АТСС 25922, или 8739, или тот же штамм, зарегистрированный в других коллекциях | Качественный | Полное ингибирование | - |
5.6 Окрашивающие растворы для микроскопической идентификации
5.6.1 Раствор оксалата малахитового зеленого
5.6.1.1 Состав
Оксалат малахитового зеленого, г | 5,0 |
Вода, см | 100 |
5.6.1.2 Приготовление
Оксалат малахитового зеленого растворяют в воде.
5.6.2 Раствор Судана черного В
5.6.2.1 Состав
Судан черный В, г | 0,3 |
Этиловый спирт, 70%-ный (по объему), см | 100 |
5.6.2.2 Приготовление раствора Судана черного В
Судан черный В растворяют в этиловом спирте.
5.6.3 Ксилол
5.6.4 Раствор сафранина
5.6.4.1 Состав
Сафранин, г | 0,5 |
Вода, см | 100 |
5.6.4.2 Приготовление раствора сафранина
Сафранин растворяют в дистиллированной воде.
5.7 Агар с бараньей кровью
5.7.1 Базовая среда
5.7.1.1 Состав
Ферментативный продукт переваривания казеина, г | 15 |
Ферментативный продукт переваривания сои, г | 5 |
Хлорид натрия (NaCI), г | 5 |
Агар, г | 9-18 |
Вода, см | 1000 |
| |
5.7.1.2 Приготовление агара с бараньей кровью
В базовую среду (5.7.1) добавляют другие компоненты раздельно при непрерывном перемешивании. Компоненты или полную обезвоженную среду растворяют в воде и доводят до кипения.
При необходимости корректируют рН так, чтобы после стерилизации он был равен 7,3±0,2 при температуре 25 °С.
Распределяют в колбы (6.7) и стерилизуют в автоклаве (6.1) при температуре 121 °С в течение 15 мин.
5.7.2 Баранья кровь без фибрина
5.7.3 Полная среда
5.7.3.1 Состав
Базовая среда (5.7.1), см | 100 |
Баранья кровь без фибрина (5.7.2), см | 5-7 |
5.7.3.2 Приготовление
В базовую среду (5.7.1), расплавленную и охлажденную до температуры 47 °С, добавляют баранью кровь без фибрина (5.7.2) и перемешивают.
5.7.3.3 Приготовление чашек Петри с агаром с бараньей кровью
Готовую среду хорошо перемешивают, разливают в чашки Петри (6.9) и дают ей затвердеть.
Чашки можно хранить при температуре (3±2) °С до четырех дней.
6 Оборудование и стеклянная посуда
Применяют микробиологическое лабораторное оборудование по ИСО 7218.
6.1 Оборудование для сухой стерилизации (сушильный шкаф) или влажной стерилизации (автоклав).
6.2 Шкаф сушильный или термостат, проветриваемый конвекционными потоками, для сушки агарового слоя, работающий при температуре в диапазоне от 25 °С до 50 °С.
6.3 Термостат, работающий при температуре (30±1) °С или (37±1) °С.
6.4 Баня водяная, работающая при температуре (47±2) °С и приблизительно 80 °С.
6.5 Петли, изготовленные из платиново-иридиевой или никеле-хромовой проволоки или пластмассы с размером диаметра приблизительно 3 мм.
6.6 рН-метр, с точностью ±0,1 единицы рН при температуре 25 °С.
6.7 Пробирки достаточных размеров (например, 16х160 мм), вместимостью 20 см и колбы для стерилизации культур и сохранности питательной среды.
6.8 Мешалка вихревая.
6.9 Чашки Петри, изготовленные из стекла или пластмассы, с размером диаметра от 90 до 100 мм или 140 мм, при необходимости.
6.10 Пипетки градуированные, номинальной вместимостью 10 см или 1 мл, соответственно, градуированные на 0,5 или 0,1 см
.
6.11 Микроскоп с объективом для масляно-иммерсионной микроскопии.
6.12 Стекла предметные для микроскопа с размерами 76х26 мм.
6.13 Бумага мелкопористая фильтровальная.
6.14 Колбы соответствующей вместимости.
7 Отбор проб
В лабораторию необходимо доставить представительную пробу. Проба не должна быть повреждена или модифицирована при транспортировании или хранении.
Отбор проб не является частью метода, устанавливаемого в настоящем стандарте. В случае отсутствия конкретного стандарта на отбор проб продукта рекомендуется, чтобы заинтересованные стороны достигли согласия по процедуре отбора проб.
8 Приготовление анализируемой пробы
Анализируемую пробу приготовляют в соответствии с ИСО 6887 или ИСО 8261 или конкретным стандартом, распространяющимся на конкретный продукт. Допускается в случае отсутствия конкретного стандарта, чтобы заинтересованные стороны достигли согласия по процедуре отбора проб.
9 Методика проведения испытания
9.1 Метод подсчета
9.1.1 Анализируемая проба, исходная суспензия и порядок разбавления разведения - по ИСО 6887, в зависимости от конкретного продукта, или ИСО 8261.
Примечание - Для подсчета только презумптивных бактерий Bacillus cereus исходное разбавление может быть нагрето на водяной бане (6.4) при температуре 80 °С в течение 10 мин.
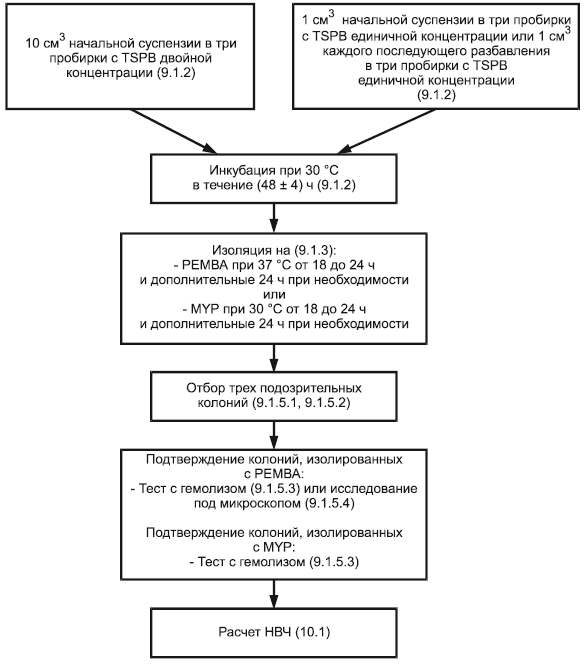
9.1.2 Инокуляция и инкубация
Инокулируют три пробирки, каждая из которых содержит среду двойной концентрации [5.3.1.1 а)], в каждую добавляют по 10 см исходного разбавления (начальная суспензия) (равной 1 г пробы в каждой пробирке) и перемешивают пробы со средой при помощи перемешивающего устройства для пробирок (6.8).
Инокулируют три пробирки, каждая из которых содержит среду единичной концентрации [5.3.1.1 b)], 1 см в каждую пробирку исходного разбавления (начальная суспензия) (равной 0,1 г пробы в каждой пробирке) или последующих разбавлений (равных 0,01 г, 0,001 г и т.д. пробы в каждой пробирке) и перемешивают пробы со средой при помощи перемешивающего устройства для пробирок (6.8).
Инкубируют пробирки в термостате (6.3) при температуре 30 °С в течение (48±4) ч.
9.1.3 Выделение чистой культуры
После тщательного перемешивания с использованием перемешивающего устройства для пробирок (6.8) делают посев культуры инокуляционной петли петлей из каждой пробирки на поверхность агара с полимиксином, пируватом, яичным желтком, маннитом и бромтимольным синим (РЕМВА) (5.4) или агара с маннитом, яичным желтком и полимиксином (MYP) (5.5).
Инкубируют чашки Петри с питательной средой крышками вниз при температуре 37 °С (РЕМВА) или 30 °С (MYP) 18-24 ч. Если колонии нельзя четко определить, продолжают выращивание в термостатах дополнительно в течение 24 ч. При использовании агара РЕМВА, дальнейшая инкубация может быть продолжена при комнатной температуре.
9.1.4 Отбор чашек Петри
9.1.4.1 Общие положения
После завершения инкубации чашки Петри исследуют на наличие типичных или атипичных колоний.
9.1.4.2 Типичные колонии
На РЕМВА типичные колонии презумптивных бактерий Bacillus cereus с размерами от 2 до 5 мм имеют неровные края с зазубринами и разветвлениями на гладкой стеклянной поверхности, имеют цвет от бирюзового до голубого (допускается беловато-серый цвет в центре колонии с синим фоном) и имеют ореол осадка (реакция на яичный желток) шириной до 5 мм.
На MYP типичные колонии имеют размеры от 2 до 5 мм и имеют зазубрины. Они обладают розовой окраской, темно-красным фоном и окружены ореолом осадка (реакция на яичный желток) шириной до 5 мм.
9.1.4.3 Атипичные колонии
Если на чашках Петри имеется неоднородный рост бактерий, которые ферментируют маннит, характерная окраска колоний и фон могут быть ослаблены или стать невидимыми.
Некоторые штаммы презумптивных бактерий Bacillus cereus обладают слабой реакцией на яичный желток или не обладают никакой реакцией. В подобных случаях и в других сомнительных случаях такие колонии подлежат дополнительной проверке.
9.1.5 Подтверждение
9.1.5.1 Общие положения
Типичные колонии (9.1.4.2) и атипичные колонии (9.1.4.3) на РЕМВА или MYP должны быть подтверждены посредством испытания с помощью гемолиза на агаре с бараньей кровью. В качестве альтернативы типичные колонии на среде РЕМВА или среде MYP проверяют с использованием микроскопа.
9.1.5.2 Отбор и очистка колоний для подтверждения
Отбирают по три колонии с каждой чашки Петри, выбранные по 9.1.4. Если на поверхности агара находится менее трех колоний, отбирают все имеющиеся колонии. Это очень спорное утверждение. Данные колонии проверяются по 9.1.5.3 или 9.1.5.4.
Если на чашках Петри получен сплошной рост микроорганизмов по линии пересева, то отбирают посевной материал из трех точек этого пересева и проводят посев на другие чашки Петри, содержащие твердую селективную среду (5.4 или 5.5). Эффективней предварительно перед посевом отобранный материал развести. Если слои переполнены колониями и нет возможности отобрать четко изолированные колонии, отбирают материал колоний из трех точек и производят посев на слоях, содержащих твердую селективную среду (5.4 или 5.5). Инкубируют в термостате (6.3) при температуре 37 °С (РЕМВА) или при 30 °С (MYP) от 18 до 24 ч. Отбирают с каждого слоя по меньшей мере одну четко изолированную колонию. Подтверждают эти колонии, как это указано в 9.1.5.3 или 9.1.5.4.
9.1.5.3 Подтверждение тестом с гемолизом на агаре с бараньей кровью (MYP или РЕМВА)
Проводят посев отобранных (9.1.4.2 или 9.1.4.3) с MYP или РЕМВА колоний на поверхность агара с бараньей кровью (5.7) таким образом, чтобы получить рост изолированных колоний и дать возможность четко разделенным колониям развиваться.
Инкубируют при температуре 30 °С в течение 24 ч и фиксируют реакцию гемолиза.
Каждая колония, окруженная чистой зоной, рассматривается как гемолиз-положительная.
9.1.5.4 Подтверждение с использованием микроскопа (РЕМВА)
9.1.5.4.1 Окрашивание
Переносят часть материала из центра колонии в случае, если возраст культуры составляет 24 ч, или с периферии, если культуры более старые; переносят, используя петлю для инокуляции (6.5), на обезжиренное предметное стекло (6.12) и растирают в малой капле воды. Высушивают на воздухе и фиксируют путем нагрева. Затем окрашивают споры над кипящей водой раствором малахитового зеленого (5.6.1) или нагревают в течение одной минуты до появления паров жидкости. Через две минуты смывают избыток красителя водой, высушивают предметное стекло и покрывают его слоем раствора Судана черного В (5.6.2) для окрашивания внутриклеточного жира. Процедуру проводят 15 мин, затем промывают ксилолом (5.6.3), высушивают при помощи фильтровальной бумаги (6.13) и окрашивают снова раствором сафранина (5.6.4) для окрашивания спорангий и вегетативных клеток спор. Через 20 с сливают избыток красителя, промывают водой и сушат на воздухе.
9.1.5.4.2 Исследование с помощью микроскопа
Окрашенный препарат на предметном стекле. Предметное стекло исследуют под микроскопом (6.11), используя иммерсионное масло. Клетки презумптивных бактерий Bacillus cereus в форме кирпичиков располагаются цепочками и имеют длину от 4 до 5 мкм, ширину - от 1 до 1,5 мкм и содержат довольно большие количества внутриклеточного жира, который окрашен в черный цвет. Окрашенные в зеленый цвет споры могут быть в центре или почти в конце, но они никогда не раздувают спорангии, окрашенные в красный цвет.
9.2 Метод определения
9.2.1 Анализируемую пробу и начальную суспензию готовят по ИСО 6887 в зависимости от конкретного продукта или ИСО 8261.
9.2.2 Инокуляция и инкубация
1 см начальной суспензии добавляют к 9 см
TSPB (5.3) единичной концентрации (т.е. 0,1 г или 0,1 см
пробы) или 10 см
начальной суспензии к 10 см
TSPB (5.3) двойной концентрации (т.е. 1 г или 1 см
пробы). Для больших объемов анализируемые пробы готовят начальную суспензию* добавлением
см
или
г к 9
см
разбавителя (см. соответствующую часть ИСО 6887 или ИСО 8261), затем добавляют все количество начальной суспензии к 90
см
TSPB (5.3) единичной концентрации (например, добавляют 5 см
или 5 г пробы к 45 см
разбавителя и затем добавляют весь объем этой начальной суспензии к 450 см
TSPB единичной концентрации).
_______________
* Текст документа соответствует оригиналу. - .
Инокулированную пробирку (6.7) или колбу (6.14) инкубируют в термостате (6.3) при температуре 30 °С в течение (48±4) ч.
9.2.3 Чистая культура
После тщательного перемешивания проводят посев культуры инокуляционной петлей из пробирки или колбы на поверхность агара с полимиксином, пируватом, яичным желтком, маннитом и бромтимоловым синим (РЕМВА) (5.4) или агара с маннитом, яичным желтком и полимиксином (MYP) (5.5). Далее поступают, как это указано в 9.1.3.
9.2.4 Отбор чашек Петри
Отбор чашек Петри - по 9.1.4.
9.2.5 Подтверждение
Подтверждение - по 9.1.5.
10 Обработка результатов
10.1 Метод подсчета для определения наиболее вероятного числа (НВЧ)
Для каждого разведения инокулированной (9.1.2) жидкой селективной обогащенной среды фиксируют количество пробирок, в которых было подтверждено (9.1.5) присутствие презумптивных бактерий Bacillus cereus. Обозначают данные пробирки как положительные.
Выражение результатов определения наиболее вероятного числа (НВЧ) - по ИСО 7218.
10.2 Метод определения
В соответствии с обработкой результатов, фиксируют "присутствие" или "отсутствие" презумптивных Bacillus cereus в анализируемой пробе, указывая массу в граммах или объем в миллилитрах (см).
Приложение А
(обязательное)
Диаграмма процедуры подсчета
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов ссылочным национальным стандартам Российской Федерации (и действующим в этом качестве межгосударственным стандартам)
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень | Обозначение и наименование соответствующего национального стандарта |
ИСО 6887-1:1999 | - | * |
ИСО 6887-2:2003 | - | * |
ИСО 6887-3:2003 | - | * |
ИСО 6887-4:2003 | - | * |
ИСО 7218:2007 | IDT | ГОСТ Р ИСО 7218-2008 "Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям" |
ИСО 8261:2001 | - | * |
ИСО 11133-1:2003 | IDT | ГОСТ Р ИСО 11133-1-2008 "Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления культурных сред в лаборатории" |
ИСО 11133-2:2003 | IDT | ГОСТ Р ИСО 11133-2-2008 "Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 2. Практические руководящие указания по эксплуатационным испытаниям культуральных сред" |
* Соответствующий национальный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов.
| ||
Библиография
[1] | Lancette G.А. и Harmon S.М. Подсчет и подтверждение Bacillus cereus в пищевых продуктах: совместное исследование. J.Assoc. Off. Anal. Chem., 63, 1980, с.581-586 |
[2] | Holbrook R. и Anderson J.M. Усовершенствованная селективная и диагностическая среда для изоляции и подсчета Bacillus cereus в пищевых продуктах. Can. J. Microbiol., 26, 1980, с.753-759 |
[3] | Billing Е. и Luckhurst E.R. Упрощенный метод приготовления сред с яичным желтком. J. Appl. Bact., 20, 1957, с.90 |
[4] | Mossel D.A.A., Koopman M.J. и Jongerius E. Подсчет Bacillus cereus в пищевых продуктах. Appl. Microbiol., 15, 1967, с.650-653 |
Электронный текст документа
и сверен по:
, 2011

