ГОСТ Р 52814-2007
(ИСО 6579:2002)
Группа Н09
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРОДУКТЫ ПИЩЕВЫЕ
Метод выявления бактерий рода Salmonella
Food products. Method for the detection of Salmonella
ОКС 07.100.30
ОКСТУ 9109
Дата введения 2009-01-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 года N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 РАЗРАБОТАН Государственным научным учреждением "Всероссийский научно-исследовательский институт консервной и овощесушильной промышленности" (ГНУ ВНИИКОП) на основе аутентичного перевода стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 93 "Продукты переработки фруктов, овощей и грибов"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 27 декабря 2007 г. N 441-ст
4 Настоящий стандарт является модифицированным по отношению к международному стандарту ИСО 6579:2002 "Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод выявления Salmonella spp." (ISO 6579:2002 "Microbiology of food and animal feeding stuffs - Horizontal method for the detection of Salmonella spp.") в части пищевых продуктов. При этом дополнительные положения и требования, включенные в текст стандарта для учета потребностей национальной экономики Российской Федерации и особенностей российской национальной стандартизации, выделены в тексте стандарта курсивом.
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ Р 1.5-2004* (подраздел 3.5).
________________
* На территории Российской Федерации в части разд.8 и приложений Ж, И, К действует ГОСТ Р 1.7-2008.
При применении настоящего стандарта рекомендуется использовать сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации, использованным в настоящем стандарте в качестве нормативных ссылок, указанные в приложении Г
5 ВВЕДЕН ВПЕРВЫЕ
6 ИЗДАНИЕ (апрель 2010 г.) с Поправкой (ИУС 8-2009)
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
Настоящий стандарт распространяется на пищевые продукты и устанавливает метод выявления в определенной массе или объеме продукта бактерий рода Salmonella, включая Salmonella Typhi и Salmonella Paratyphi.
Допускается использование хромогенных сред для предварительного выявления бактерий рода Salmonella в масложировой продукции.
(Поправка).
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р ИСО 7218-2008 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
ГОСТ Р 51652-2000 Спирт этиловый ректификованный из пищевого сырья. Технические условия
ГОСТ 4209-77 Реактивы. Магний хлористый 6-водный. Технические условия
ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
ГОСТ 6691-77 Реактивы. Карбамид. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 9536-79 Спирт изобутиловый технический. Технические условия
ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 24104-2001 Весы лабораторные. Общие технические требования*
________________
* На территории Российской Федерации действует ГОСТ Р 53228-2008.
ГОСТ 24363-80 Реактивы. Калия гидроокись. Технические условия
ГОСТ 26668-85 Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов
ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов
ГОСТ 30425-97 Консервы. Метод определения промышленной стерильности
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, а также по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 бактерии рода Salmonella: Микроорганизмы, которые на агаризованных селективно-диагностических средах образуют типичные или не совсем типичные колонии.
Примечание - Описание и методы определения биохимических и серологических характеристик этих микроорганизмов приведены в настоящем стандарте.
3.2 выявление бактерий рода Salmonella: Определение присутствия или отсутствия бактерий рода Salmonella в определенной массе или объеме продукта в соответствии с настоящим стандартом.
4 Сущность метода
4.1 Общие положения
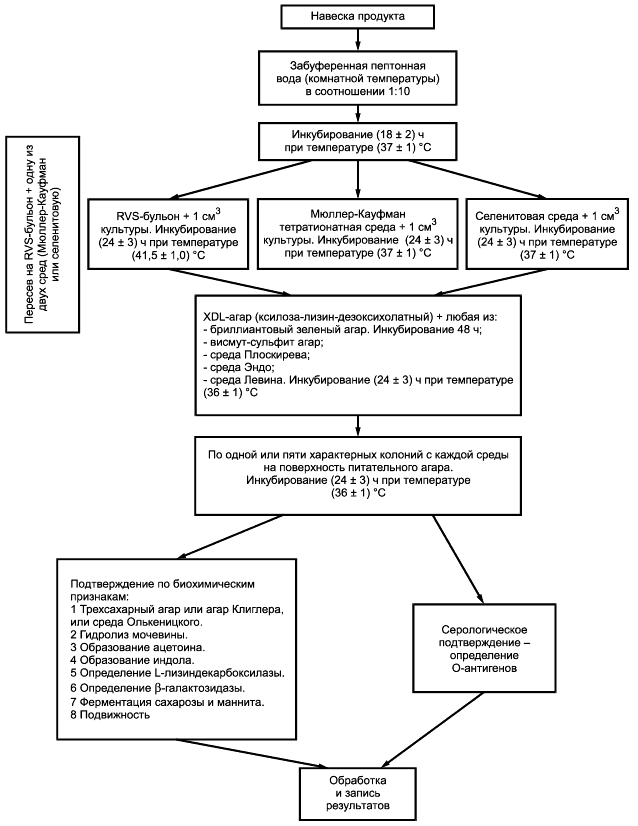
Метод выявления бактерий рода Salmonella в определенной массе или объеме продукта состоит из четырех этапов (см. 4.2; 4.3; 4.4; 4.5 и приложение А).
4.2 Предварительное обогащение в неселективной жидкой среде
Бактерии рода Salmonella могут присутствовать в продукте в небольшом количестве вместе с большим количеством других бактерий из семейства Enterobacteriaceae или других семейств. Поэтому предварительное обогащение необходимо для выявления небольшого числа бактерий рода Salmonella или сублетально поврежденных бактерий рода Salmonella.
Забуференную пептонную воду инокулируют при комнатной температуре навеской продукта, затем инкубируют при температуре (37±1) °С в течение (18±2) ч.
Для некоторых пищевых продуктов используют другое предварительное обогащение (см. 8.1.2).
Для большего эффекта перед внесением навески продукта забуференную пептонную воду нагревают до температуры (37±1) °С.
4.3 Обогащение в селективной жидкой среде
Среду Раппапорта-Вассилиадиса с соей (RVS-бульон) и одну из двух сред: Мюллер-Кауфман тетратионатный бульон (МКТ-бульон) или селенитовую среду - инокулируют культурой, полученной по 4.2. После посева RVS-бульон инкубируют при температуре (41,5±1,0) °С в течение (24±3) ч, а МКТ-бульон и селенитовую среду - при температуре (37±1) °С в течение (24±3) ч.
4.4 Пересев на чашки для идентификации
Культуры, полученные по 4.3, пересевают на две селективные агаризованные среды:
- ксилоза-лизин-дезоксихолатный агар (XLD-aгap) и
- на одну из следующих агаризованных сред: висмут-сульфит агар, среду Плоскирева, среду Эндо, среду Левина или бриллиантовый зеленый агар.
Посевы на агаризованных средах инкубируют при температуре (37±1) °С в течение (24±3) ч.
4.5 Проведение идентификации
Колонии, предположительно относящиеся к бактериям рода Salmonella, полученные на чашках по 4.4, идентифицируют с помощью биохимических и серологических тестов.
5 Питательные среды, реактивы и сыворотки
5.1 Общие положения
Химические вещества, используемые для приготовления питательных сред и реактивов, должны быть аналитического качества.
5.2 Питательные среды и реактивы
Состав и приготовление питательных сред и реактивов указаны в приложении В.
5.2.1 Среда для неселективного предварительного обогащения: забуференная пептонная вода по В.1.
5.2.2 Первая селективная обогатительная среда: среда Раппапорта-Вассилиадиса с соей (RVS-бульон) по В.2.
5.2.3 Вторая селективная обогатительная среда: селенитовая среда по В.3.
5.2.4 Третья селективная обогатительная среда: тетратионатный бульон Мюллер-Кауфмана (МКТ-бульон) по В.4.
5.2.5 Агаризованные селективные среды для чашек.
5.2.5.1 Первая среда: ксилоза-лизин-деоксихолатный агар (XLD-aгap) по В.5.
5.2.5.2 Вторая среда по В.6.
5.2.6 Питательный агар по В.7.
5.2.7 Мясо-пептонный агар или ГРМ-агар (питательный агар для культивирования микроорганизмов на основе гидролизата рыбной муки) по В.8.
5.2.8 Мясо-пептонный бульон с глюкозой по В.9.
5.2.9 Среды с углеводами (среды Гисса) по В.10.
5.2.10 Трехсахарный железистый агар (TSI-aгap) или агар Клиглера, или агар Олькеницкого по В.11.
5.2.11 Агар с мочевиной (Кристенсена) по В.12.
5.2.12 L-лизин-декарбоксилазная среда по В.13.
5.2.13 Реактив для определения -галактозидазы (или используются в соответствии с инструкцией изготовителя готовые бумажные диски) по В.14.
5.2.14 Реактив для реакции Фогес-Проскауера (VP) по В.15.
5.2.15 Реактивы для индольной реакции по В.16.
5.2.16 Триптон/триптофановая среда по В.17.
5.2.17 Бульон Хоттингера по В.18.
5.2.18 Мясо-пептонный бульон с 0,05% L-триптофана по В.19.
5.2.19 Полужидкий питательный агар по В.20.
5.2.20 Полужидкий мясо-пептонный агар по В.21.
5.2.21 Физиологический раствор по В.22.
5.3 Сыворотки
Имеется несколько типов агглютинирующих сывороток, содержащих антитела для одного или нескольких О-антигенов, т.е. антисыворотки, содержащие одну или более "О" групп (моновалентные или поливалентные анти-О-сыворотки), анти-Vi-сыворотки и антисыворотки, содержащие антитела для одного или нескольких Н-факторов (моновалентные или поливалентные анти-Н-сыворотки).
Каждое опытное определение должно давать гарантию, что используемая антисыворотка пригодна для выделения всех серотипов бактерий рода Salmonella.
Сухие агглютинирующие адсорбированные О-, Vi-, Н-сальмонеллезные сыворотки промышленного производства готовят перед употреблением по прилагаемой к ним инструкции.
6 Аппаратура, материалы и реактивы
Приемлемой альтернативой посуде многоразового применения является одноразовая посуда, если она отвечает соответствующим требованиям.
Обычное лабораторное оборудование и реактивы для микробиологических исследований по ГОСТ Р ИСО 7218, ГОСТ 10444.1 со следующими дополнениями:
Аппарат для сухой стерилизации (стерилизационный сушильный шкаф) или влажной стерилизации (автоклав) по ГОСТ Р ИСО 7218 (подразделы 4.5 и 4.10).
Термостат, поддерживающий температуру (37±1) °С по ГОСТ Р ИСО 7218 (подраздел 4.6).
Водяная баня, поддерживающая температуру (41,5±1,0) °С, или термостат, поддерживающий температуру (41,5±1,0) °С по ГОСТ Р ИСО 7218 (подраздел 4.9).
Водяная баня, поддерживающая температуру 44 °С - 47 °С и (37±1) °С, по ГОСТ Р ИСО 7218 (подраздел 4.9).
Прибор для мембранной фильтрации.
Весы лабораторные общего назначения по ГОСТ 24104 с наибольшим пределом взвешивания 200 г (для взвешивания реактивов) с пределом допускаемой абсолютной погрешности однократного взвешивания не более ±0,01 мг.
Весы лабораторные общего назначения по ГОСТ 24104 с наибольшим пределом взвешивания 1 кг (для взвешивания продукта) с пределом допускаемой абсолютной погрешности однократного взвешивания не более ±20,0 мг.
Микроскоп биологический, обеспечивающий просмотр в проходящем свете, с увеличением 900-1000
.
Бактериологическая петля диаметром около 3 мм.
рН-метр с точностью калибровки ±0,1 рН при температуре 20 °С - 25 °С по ГОСТ Р ИСО 7218 (подраздел 4.4).
Стекла предметные по ГОСТ 9284.
Стекла покровные по ГОСТ 6672.
Пробирки или флаконы соответствующей вместимости.
Могут быть использованы бутылки или флаконы с нетоксичными металлическими или пластиковыми завинчивающимися крышками.
Градуированные или автоматические пипетки вместимостью 10, 2 и 1 см с градуировкой на 0,5 и 0,1 см
.
Чашки Петри среднего размера (диаметр 90 или 100 мм) и/или большие (диаметр 140 мм).
Спирт изобутиловый по ГОСТ 9536.
Бриллиантовый зеленый.
Вода дистиллированная по ГОСТ 6709.
Желчь бычья сухая или натуральная.
Железо (III) аммоний цитрат.
Железо (III) цитрат.
Калия гидроокись по ГОСТ 24363.
Карбамид (мочевина) по ГОСТ 6691.
Контрольный штамм бактерий рода Salmonella, не относящихся к тифозной группе.
Креатин моногидрат.
Ксилоза.
L-лизин гидрохлорид.
4-диметиламинобензальдегид.
Магний хлористый по ГОСТ 4209.
Натрий кислый селенистокислый (NaHSeO).
Натрий гипосульфит (NaS
O
·5 Н
О).
Натрий деоксихолат.
о-нитрофенил -D-галактопиранозид (ONPG).
Новобиоцин натриевая соль.
Сухие агглютинирующие адсорбированные поливалентные сальмонеллезные О-сыворотки основных групп А, В, С, Д, Е и редких групп.
Vi- и Н-агглютинирующие сыворотки.
Толуол.
Феноловый красный.
Ферментативный гидролизат сои.
Экстракт мясной.
Допускается применение средств измерений, вспомогательного оборудования с аналогичными метрологическими и техническими характеристиками, а также материалов и реактивов по качеству не хуже указанных.
7 Отбор и подготовка проб
Отбор и подготовка проб - по ГОСТ 26668, ГОСТ 26669.
Важно, чтобы для испытания поступила представительная проба, не поврежденная и не измененная в ходе транспортирования или хранения.
8 Проведение испытания
Схема проведения испытания приведена в приложении Б.
8.1 Навеска и исходное разведение
8.1.1 Общие положения
Для приготовления исходной суспензии используют как разбавитель неселективную среду, указанную в 5.2.1 и 4.2 (забуференную пептонную воду).
Если масса пробы иная, чем 25 г, используют необходимое количество неселективной среды, исходя из соотношения 1:10.
Для уменьшения объема работы, когда испытывают больше одной пробы от определенного продукта и когда очевидно, что объединенная навеска не влияет на результат испытания, - навески объединяют.
Пример. Если необходимо исследовать 10 навесок по 25 г, их объединяют и к 250 г добавляют 2,25 дм неселективной среды.
8.1.2 Специфичность приготовления исходной суспензии для некоторых продуктов
Указанная специфичность приготовления может быть применена только для выявления бактерий рода Salmonella.
8.1.2.1 Какао и какаосодержащие продукты (массовая доля какао более 20%)
Добавляют в забуференную пептонную воду (см. 5.2.1) 50 г некислого казеина или 100 г/дм обезжиренного молочного порошка и, если пищевые продукты предположительно содержат большое количество грамположительных микроорганизмов, прибавляют после 2 ч инкубирования 0,018 г/дм
бриллиантового зеленого (3,6 см
/дм
раствора, приготовленного по В.4.4). Казеин и молочный порошок добавляют при приготовлении забуференной пептонной воды до стерилизации.
8.1.2.2 Кислые и кислотосодержащие пищевые продукты
При неселективном обогащении должна быть гарантия того, что рН не будет ниже 4,5.
рН кислых и кислотосодержащих продуктов стабилизируют путем использования забуференной пептонной воды двойной концентрации.
Допускается также при высеве жидких высококислотных продуктов для предотвращения снижения рН сред на 0,5 и более рН продукта перед посевом доводить до (7,0±0,2).
При высеве твердых высококислотных продуктов доводят рН до (7,0±0,2) в посевах.
Доведение рН проводят с соблюдением правил асептики с помощью стерильных растворов гидроокиси натрия и соляной кислоты, приготовленных по ГОСТ 10444.1. Количество добавляемых растворов устанавливают опытным путем.
8.2 Неселективное обогащение
Инкубируют исходную суспензию (см. 8.1.1) при температуре (37±1) °С в течение (18±2) ч.
8.3 Селективное обогащение
Культуры, полученные после инкубирования по 8.2, пересевают в среды для селективного обогащения. Для этого по 1 см культуры пересевают в 10 см
RVS-бульона и в 10 см
селенитовой среды или в 10 см
тетратионатного бульона Мюллер-Кауфмана.
Посевы на RVS-бульоне инкубируют при температуре (41,5±1,0) °С в течение (24±3) ч (следят за тем, чтобы температура не превышала 42,5 °С), а на тетратионатном бульоне и селенитовой среде посевы инкубируют при температуре (37±1) °С в течение (24±3) ч.
Если из одного пищевого продукта проведен высев нескольких навесок (каждой отдельно) для выявления бактерий рода Salmonella, то допускается из каждого посева по 8.2 пересев проводить в один флакон с каждой селективной питательной средой (RVS-бульоном, тетратионатным бульоном Мюллер-Кауфмана, селенитовой средой). При этом количество селективной среды во флаконе должно быть увеличено по сравнению с 10 см во столько раз, из скольких посевов проводят пересев.
Свежие продукты, не содержащие поврежденных микроорганизмов, подвергнутые каким-либо воздействиям, например сушке, заморозке и другим, допускается высевать непосредственно в селективные среды, минуя этап неселективного обогащения. Соотношение между количеством высеваемого продукта и средой должно быть не менее 1:10.
8.4 Пересев на чашки и идентификация
8.4.1 Культуры через 24 ч инкубирования на селективных средах пересевают по ГОСТ 26670 так, чтобы получить хорошо изолированные колонии, на XLD-aгap и на одну из агаризованных сред: висмут-сульфит агар, среду Плоскирева, среду Эндо, среду Левина или бриллиантовый зеленый агар.
При отсутствии больших чашек используют для посева петлей две средние чашки (одну за другой).
8.4.2 Чашки переворачивают (см. 8.4.1) вверх дном и помещают в термостат при температуре (37±1) °С.
8.4.3 После инкубирования в течение (24±3) ч, а на бриллиантовом зеленом агаре - 48 ч, просматривают чашки (см. 8.4.2) и отмечают присутствие типичных колоний бактерий рода Salmonella и не совсем типичных колоний, которые могут быть бактериями рода Salmonella. Отмечают их местоположение на дне чашки.
Типичные колонии бактерий рода Salmonella, вырастающие на XLD-aгape, имеют черный центр и слегка прозрачную зону красноватого цвета, что принадлежит цвету индикатора.
Бактерии рода Salmonella НS-отрицательные варианты (например S. Paratyphi А) образуют на XLD-aгape розовые колонии с темным розовым центром, лактозоположительные бактерии рода Salmonella на XLD-aгape - желтые колонии с почернением или без него.
На висмут-сульфит агаре бактерии рода Salmonella образуют черные колонии с характерным металлическим блеском, а также зеленоватые с темно-зеленым ободком и с пигментированием среды под колониями.
На среде Эндо бактерии рода Salmonella образуют круглые бесцветные или слегка розоватые, прозрачные колонии.
На среде Плоскирева бактерии рода Salmonella образуют бесцветные прозрачные, но более плотные, чем на среде Эндо, колонии.
На среде Левина бактерии рода Salmonella образуют прозрачные, слабо-розовые или розовато-фиолетовые колонии.
На бриллиантовом зеленом агаре бактерии рода Salmonella образуют красноватые или розовые, почти белые колонии (их цвет зависит от штамма и срока инкубирования). Лактозоположительные и сахарозоположительные микроорганизмы образуют зеленоватые колонии, окруженные яркой желто-зеленой зоной.
Агар с бриллиантовым зеленым применяют для выделения сальмонелл, кроме Salmonella Туphi и Salmonella Paratyphi.
Отсутствие в посевах на селективно-диагностических средах типичных или не совсем типичных колоний для бактерий рода Salmonella свидетельствует об отсутствии бактерий рода Salmonella в анализируемой навеске (объеме) продукта.
При наличии хотя бы на одной селективно-диагностической среде типичных или не совсем типичных колоний для бактерий рода Salmonella проводят их дальнейшую идентификацию.
8.5 Идентификация
8.5.1 Общие положения
Для определения биохимических признаков бактерий рода Salmonella допускается использование наборов тест-систем. Эти наборы используют в соответствии с инструкцией изготовителя.
Для биохимической идентификации допускается использование тест-систем промышленного производства, зарегистрированных в Российской Федерации, например "API 20E", "Rapid 20E".
8.5.2 Выделение колоний для идентификации
Для идентификации берут с каждой чашки (две чашки среднего или одну большого размера) каждой селективной среды (см. 8.4.3) сначала одну колонию типичную или не совсем типичную, а затем четыре колонии, если первая окажется отрицательной.
Рекомендуется брать сразу пять колоний для идентификации в случае эпидемиологической ситуации. Если на одной чашке менее пяти типичных или не совсем типичных колоний, то для идентификации берут все колонии.
Переносят отобранные колонии на поверхность предварительно подсушенного питательного агара (см. 5.2.6) или мясо-пептонного агара, или ГРМ-агара (см. 5.2.7) в чашках Петри или на скошенную поверхность среды в пробирках. Для подтверждения берут полностью изолированные колонии. Инкубируют инокулированные чашки или пробирки при температуре (37±1) °С в течение (24±3) ч.
Используют только чистые культуры для биохимической и серологической идентификации.
8.5.2.1 Окраска по Граму
Из отобранных для биохимической идентификации колоний готовят мазки и окрашивают по Граму по ГОСТ 30425.
Бактерии рода Salmonella являются грамотрицательными палочками с закругленными концами.
8.5.3 Биохимическая идентификация
У отобранных и предварительно пересеянных грамотрицательных культур изучают характер роста на трехсахарном железистом агаре (TSI-aгape) или агаре Клиглера, или среде Олькеницкого, возможность расщепления мочевины, образования ацетоина, индола, -галактозидазы, L-лизиндекарбоксилазы, ферментации сахарозы и маннита, а также подвижность.
8.5.3.1 Общие положения
Петлей инокулируют специфические среды, указанные в 8.5.3.2-8.5.3.9, каждой культурой, полученной из колоний по 8.5.2.
8.5.3.2 TSI-aгap (см. 5.2.10), среда Олькеницкого или агар Клиглера
Засевают штрихом скошенную поверхность агара (среды Олькеницкого) и уколом - столбик. Инкубируют при температуре (37±1) °С в течение (24±3) ч.
Интерпретируют изменения в среде следующим образом:
а) столбик агара (среды Олькеницкого)
- желтый - глюкоза положительная (глюкозу ферментирует);
- красный или неизменившийся - глюкоза отрицательная (глюкозу не ферментирует);
- черный - образование сероводорода;
- пузырьки или разрывы - образование газа из глюкозы;
б) скошенная поверхность агара (среды Олькеницкого)
- желтая - лактоза и/или сахароза положительные (лактозу и/или сахарозу ферментирует);
- красная или неизменившаяся - лактоза и сахара* отрицательные (ни лактозу, ни сахарозу не ферментирует).
_______________
* Вероятно ошибка оригинала. Следует читать "сахароза". - .
Агар Клиглера содержит два сахара, поэтому по скошенной поверхности учитывают только ферментацию лактозы.
Типичные культуры бактерий рода Salmonella показывают щелочную (красную) поверхность и кислый (желтый) столбик с образованием газа (пузырьков) и примерно в 90% случаев образуется сероводород (черный агар).
Если изолированы лактозоположительные бактерии рода Salmonella, то поверхность TSI-aгapa желтая. Предварительное определение культур бактерий рода Salmonella не может основываться только на результатах теста на TSI-aгape.
Дальнейшему изучению подвергают также лактозоположительные бактерии или бактерии, не образующие сероводород, но обязательно ферментирующие глюкозу с образованием или без образования газа.
8.5.3.3 Агар с мочевиной (агар Кристенсена) (см. 5.2.11)
Культуры пересевают штрихом на поверхность агара Кристенсена с мочевиной. Посевы инкубируют при температуре (37±1) °С в течение (24±3) ч, наблюдая за посевами через определенные промежутки времени.
При положительной реакции - расщеплении мочевины с выделением аммония цвет фенолового красного меняется от розового до светло-вишневого.
Для уреазоположительных бактерий реакция часто становится видимой после 2 ч инкубирования.
Бактерии рода Salmonella не расщепляют мочевину.
8.5.3.4 L-лизиндекарбоксилазная среда (см. 5.2.12)
Инокулируют снизу жидкую среду. Посевы инкубируют при температуре (37±1) °С в течение (24±3) ч.
Помутнение и пурпурный цвет среды после инкубирования указывают на положительную реакцию. Желтый цвет указывает на отрицательную реакцию.
Salmonella Paratyphi А не образует L-лизиндекарбоксилазу, остальные образуют.
8.5.3.5 Определение -галактозидазы (5.2.13)
Суспендируют петлей культуру в 0,25 см физиологического раствора, прибавляют одну каплю толуола и встряхивают пробирку. Помещают пробирку в водяную баню при температуре 37 °С и оставляют примерно на 5 минут. Затем добавляют 0,25 см
реактива для определения
-галактозидазы и перемешивают.
Оставляют пробирку в водяной бане при температуре 37 °С в течение (24±3) ч, наблюдая за изменением цвета через определенные промежутки времени.
Желтый цвет указывает на положительную реакцию. Изменение цвета обнаруживается примерно через 20 мин.
Бактерии рода Salmonella, кроме S.arizonae, не обладают -галактозидазой.
Для определения -галактозидазной активности допускается использование ONPG-дисков. Для этого испытуемые культуры высевают на среду, содержащую лактозу в концентрации 0,1%, или агар Клиглера, или трехсахарный агар, или агар Олькеницкого. Посевы инкубируют в течение (18±2) ч при температуре (37±1) °С. Петлей отбирают выросшую культуру и готовят из нее густую суспензию в 0,5 см
стерильной дистиллированной воды. К полученной суспензии добавляют один ONPG-диск и помещают в водяную баню при температуре (37±1) °С. Желтое окрашивание, появившееся через 15-20 мин, указывает на положительную реакцию. Для окончательного учета отрицательного результата посевы продолжают инкубировать в течение 2, 4 и 24 ч.
8.5.3.6 Определение образования ацетоина (реакция Фогес-Проскауера) (5.2.14)
Суспендируют петлей испытуемую культуру в стерильной пробирке, содержащей 3 см VP среды или мясо-пептонного бульона с глюкозой.
Посевы инкубируют при температуре (37±1) °С в течение (24±3) ч.
После инкубации прибавляют две капли раствора креатина, три капли спиртового раствора 1-нафтола и две капли раствора гидроокиси калия, перемешивают содержимое пробирки после прибавления каждого реактива.
Появление через 15 мин от розового до светло-красного окрашивания указывает на положительную реакцию.
Бактерии рода Salmonella не образуют ацетоина (реакция Фогес-Проскауера отрицательная).
Допускается определение ацетоина проводить без применения раствора креатина. Для этого после инкубирования к 1 см отобранной культуральной жидкости прибавляют 0,6 см
раствора 1-нафтола и 0,2 см
раствора гидроокиси калия. После прибавления каждого реактива пробирку встряхивают. Появление розового окрашивания через 15 мин указывает на положительную реакцию.
8.5.3.7 Определение образования индола (см. 5.2.15)
Культуры пересевают в пробирку, содержащую 5 см триптон/триптофановой среды, или в бульон Хоттингера, или в мясо-пептонный бульон с L-триптофаном. Посевы инкубируют при температуре (37±1) °С в течение (24±3) ч.
После инкубирования к посевам прибавляют по каплям 1 см реактива Эрлиха или Ковача, содержимое пробирки перемешивают.
Образование красного кольца указывает на положительную реакцию. Желто-коричневое кольцо указывает на отрицательную реакцию.
Бактерии рода Salmonella не образуют индол.
8.5.3.8 Определение ферментации маннита и сахарозы
Культуры пересевают в среды Гисса с маннитом или сахарозой. Посевы инкубируют при температуре (37±1) °С в течение (24±3) ч.
Бактерии рода Salmonella не ферментируют сахарозу, но ферментируют маннит. При сбраживании маннита цвет среды изменяется, образуется или не образуется газ.
8.5.3.9 Определение подвижности
Культуры пересевают уколом в полужидкий питательный агар или полужидкий мясо-пептонный агар.
Посевы инкубируют при температуре (37±1) °С в течение (24±3) ч.
При росте подвижных культур отмечается диффузионный рост по всему столбику агара, при росте неподвижных культур - вокруг места укола.
Бактерии рода Salmonella подвижны, кроме S. gallinarum и S. pullorum.
8.5.3.10 Интерпретация биохимических тестов приведена в таблице А.1 (приложение А).
8.5.4 Серологическая идентификация
8.5.4.1 Общие положения
Определение присутствия соматического О-антигена, антигена вирулентности Vi-, жгутикового Н-антигена в изолированных колониях (см. 8.5.2) проводят с помощью реакции агглютинации на предметном стекле с соответствующими сыворотками после исключения самоагглютинирующих штаммов. Сыворотки используют в соответствии с инструкцией изготовителя, если есть отличие от описания, приведенного ниже.
Серологическую идентификацию для подтверждения принадлежности к бактериям рода Salmonella проводят с культурами, предварительно пересеянными на поверхность мясо-пептонного агара или ГРМ-агара.
8.5.4.2 Исключение самоагглютинирующих штаммов
Помещают каплю физиологического раствора на тщательно очищенное предметное стекло. Диспергируют в этой капле часть тестируемой колонии так, чтобы получилась гомогенная и густая суспензия.
Допускается размешивание части колонии в капле воды и перемешивание этого раствора с одной каплей физиологического раствора.
Покачивают осторожно стекло в течение 30-60 с. Отмечают результаты на темном фоне, лучше с помощью увеличительного стекла. Если наблюдается в разной степени склеивание бактерий, то есть образование осадка, то считают, что тестируемые штаммы обладают самоагглютинацией.
Штаммы бактерий, обладающие самоагглютинацией, не подвергают дальнейшей серологической идентификации.
8.5.4.3 Определение наличия О-антигенов
Штаммы, у которых не выявлено самоагглютинации, испытывают в реакции агглютинации с агглютинирующими адсорбированными поливалентными сальмонеллезными О-сыворотками основных групп А, В, С, D, Е, а затем, если не выявлено О-антигенов с сыворотками основных групп, ставят реакцию с сыворотками редких групп.
Подготовка сывороток к постановке реакции агглютинации и методика ее проведения указаны в инструкции, прилагаемой к сывороткам.
Агглютинация (наличие О-антигенов) проявляется в виде склеивания бактериальной массы и полного или частичного просветления жидкости.
При отрицательной реакции агглютинации культура после тщательного смешивания с каплей сыворотки образует гомогенную смесь.
Используют поли- и моновалентные сыворотки, одну после другой.
8.5.4.4 Определение Vi- и Н-антигенов
Наличие Vi- и Н-антигенов определяют при необходимости по санитарно-эпидемиологическим показаниям.
Перед выявлением Н-антигенов испытуемой культурой инокулируют полужидкий агар. Посевы инкубируют при температуре (37±1) °С в течение (24±2) ч. Полученную культуру используют для выявления Н-антигенов.
Наличие Vi- и Н-антигенов определяют, пользуясь указаниями, приведенными в 8.5.4.3.
8.5.5 Интерпретация биохимических и серологических реакций
Интерпретация подтверждающих тестов (см. 8.5.3 и 8.5.4) для испытанных колоний (см. 8.5.2) приведена в таблице 1.
Таблица 1 - Интерпретация подтверждающих тестов
Биохимические реакции | Самоагглютинация | Серологические реакции | Интерпретация |
Типичные | Нет | О-, Vi- или Н-антигены положительные | Штамм относится к бактериям рода Salmonella |
Типичные | Нет | Все реакции отрицательные | Могут быть бактерии рода Salmonella |
Типичные | Да | Не тестируется (см. 8.5.4.2) | |
Нетипичные реакции | Нет/Да | О-, Vi- или Н-антигены положительные | |
Нетипичные реакции | Нет/Да | Все реакции отрицательные | Не относятся к бактериям рода Salmonella |
При определении биохимических и серологических характеристик выделенных культур в качестве контроля используют типичный по этим показателям штамм бактерий рода Salmonella, указанный в разделе 6.
Культуры, предположительно отнесенные к бактериям рода Salmonella, передают в компетентные аккредитованные центры по изучению этих бактерий для окончательной идентификации. Культуру при этом сопровождают всей полученной информацией с указанием наименования продукта, из которого выделен штамм.
В этом случае результаты выявления бактерий рода Salmonella выдают после получения ответа по окончательной идентификации.
При выявлении бактерий рода Salmonella используют схему, указанную в приложении Б.
9 Обработка результатов
9.1 Результаты оценивают по каждой пробе в отдельности.
9.2 Результаты выявления бактерий рода Salmonella в определенной массе или объеме продукта записывают: "бактерии рода Salmonella обнаружены или не обнаружены в г (см
) продукта" (
- масса (объем) продукта, в котором выявляли бактерии рода Salmonella).
10 Протокол испытания
Протокол испытания должен содержать информацию:
- об используемом методе отбора проб;
- использовании каких-либо отклонений в методе обогащения или инкубирования;
- обо всех условиях испытания, не указанных в настоящем стандарте, или считающихся необязательными, со всеми деталями, которые могли повлиять на результаты;
- о полученных результатах.
Протокол испытания включает также информацию о том, с использованием какой среды для чашек (см. 5.2.5) получен положительный результат.
Приложение А
(обязательное)
Интерпретация биохимических тестов
Таблица А.1 - Количество положительных реакций для штаммов бактерий рода Salmonella
В процентах
Тесты | Штаммы сальмонелл | |||||
S. typhi | S. paratyphi A | Другие штаммы | ||||
S. arizonae | S. choleraesuis | S. gallinarum | S. pullorum | |||
Кислота из глюкозы | 100 | 100 | 100 | 100 | 100 | 100 |
Газ из глюкозы | 10 и менее | 90 и более | 90 и более | 90 и более | 100 и менее | 90 и более |
Кислота из лактозы | 10 и менее | 10 и менее | 10-25 | 10 и менее | 10 и менее | 10 и менее |
Кислота из сахарозы | 0 | 0 | 1 | 0 | 0 | 0 |
Н | 8 | 1 | 99 | 64 | 25 | 85 |
Гидролиз мочевины | 0 | 0 | 0 | 0 | 0 | 0 |
Лизиндекарбоксилоза | 99 | 0 | 97 | 99 | 100 | 75 |
| 0 | 0 | 98 | 0 | 0 | 0 |
Продукция ацетона* | 0 | 0 | 0 | 0 | 0 | 0 |
________________ | ||||||
Продукция индола | 0 | 0 | 1 | 0 | 0 | 0 |
Подвижность | 97 | 95 | 99 | 95 | 0 | 0 |
Кислота из маннита | 90 и более | 90 и более | 90 и более | 90 и более | 90 и более | 90 и более |
Приложение Б
(справочное)
Схема выявления бактерий рода Salmonella
Приложение В
(обязательное)
Состав и приготовление питательных сред и реактивов
В.1 Забуференная пептонная вода
В.1.1 Состав:
- пептон - 10,0 г;
- хлористый натрий - 5,0 г;
- двузамещенный фосфорнокислый натрий 12-водный (NaHPO
·12Н
О) - 9,0 г;
- однозамещенный фосфорнокислый калий (KНРО
) - 1,5 г;
- вода - 1000 см.
В.1.2 Приготовление
При нагревании компоненты растворяют в воде. Устанавливают такой рН, чтобы после стерилизации он составлял (7,0±0,2) при температуре 25 °С. Среду разливают во флаконы подходящей вместимости с учетом добавления необходимой навески продукта. Если навеска равна 25 г, то забуференную пептонную воду разливают по 225 см. Стерилизуют 15 мин в автоклаве при температуре (121±1) °С.
В.2 Среда Раппапорта-Вассилиадиса с соей (RVS-бульон)
В.2.1 Раствор А
В.2.1.1 Состав:
- ферментативный гидролизат сои - 5,0 г;
- хлористый натрий - 8,0 г;
- фосфорнокислый однозамещенный калий (KНРО
) - 1,4 г;
- фосфорнокислый двузамещенный калий (KНРО
) - 0,2 г;
- вода - 1000 см.
В.2.1.2 Приготовление
Компоненты растворяют в воде при нагревании до температуры около 70 °С. Раствор готовят за день до приготовления RVS-бульона.
В.2.2 Раствор В
В.2.2.1 Состав:
- хлористый магний 6-водный (MgCI·6Н
О) - 400 г;
- вода - 1000 см.
В.2.2.2 Приготовление
Хлористый магний растворяют в воде. Поскольку эта соль очень гигроскопична, рекомендуется из новой открытой упаковки растворять ее по определенной схеме. Например, к 250 г хлористого магния 6-водного добавляют 625 см воды, получая раствор объемом 788 см
массовой концентрации 31,7 г/100 см
. Состав раствора соответствует В.2.2.1. Раствор переносят в бутылку из темного стекла с притертой пробкой и хранят при комнатной температуре не более двух лет.
В.2.3 Раствор С
В.2.3.1 Состав:
- малахитовый зеленый оксалат - 0,4 г;
- вода - 100 см.
В.2.3.2 Приготовление
Малахитовый зеленый оксалат переносят в фарфоровую ступку и постепенно растворяют в воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят водой до метки. Раствор переносят в бутылку из темного стекла, хранят при комнатной температуре не более 8 мес.
В.2.4 Готовая среда
В.2.4.1 Состав
- раствор А (см. В.2.1) - 1000 см;
- раствор В (см. В.2.2) - 100 см;
- раствор С (см. В.2.3) - 10 см.
В.2.4.2 Приготовление
Прибавляют к 1000 см раствора А 100 см
раствора В и 10 см
раствора С. Устанавливают такой рН, чтобы после стерилизации он составлял (5,2±0,2). Перед использованием среду разливают по пробиркам по 10 см
. Стерилизуют 15 мин в автоклаве при температуре (115±1) °С. Рекомендуется использовать среду в день приготовления. При необходимости допускается готовую среду хранить по ГОСТ 10444.1.
Следует учитывать, что на этой среде не растет S. Typhi.
Примечание - Конечный состав среды: ферментативный гидролизат сои - 4,5 г/дм; хлористый натрий - 7,2 г/дм
; фосфорнокислый однозамещенный калий - 1,26 г/дм
; фосфорнокислый двузамещенный калий - 0,18 г/дм
; хлористый магний безводный - 13,4 г/дм
или хлористый магний 6-водный - 28,6 г/дм
; малахитовый зеленый оксалат - 0,036 г/дм
.
В.3 Селенитовая среда
Селенитовую среду готовят из двух растворов.
В.3.1 Раствор 1
В.3.1.1 Состав:
- пептон - 5,0 г;
- двузамещенный фосфорнокислый натрий безводный - 7,0 г;
- однозамещенный фосфорнокислый натрий - 3,0 г;
- лактоза - 4,0 г;
- вода - 1000 см.
В.3.1.2 Приготовление
При нагревании растворяют компоненты в воде. Путем изменения соотношения фосфатных солей устанавливают рН (7,0±0,1). Среду разливают по 100 см в колбы или флаконы и стерилизуют текучим паром по 30 мин в течение двух дней или при температуре (112±1) °С в течение 30 мин.
В.3.2 Раствор 2
В.3.2.1 Состав:
- кислый селенистокислый натрий (NaHSeO) - 10,0 г;
- вода - 100 см.
Кислый селенистокислый натрий растворяют с соблюдением правил асептики в стерильной дистиллированной воде. Раствор готовят непосредственно перед употреблением.
В.3.3 Готовая среда
В.3.3.1 Состав:
- раствор 1 - 100 см;
- раствор 2 - 4 см.
В.3.3.2 Приготовление среды
К раствору 1 прибавляют раствор 2, среду разливают по 10 см в пробирки.
Стерилизация приготовленной среды не допускается, так как при этом происходит редукция кислого селенистокислого натрия, выпадает осадок красного цвета и среда становится непригодной для использования.
Селенитовую среду выпускают в сухом виде и готовят по инструкции, указанной на этикетке.
В.4 Тетратионатный бульон Мюллер-Кауфман
В.4.1 Основа среды
В.4.1.1 Состав:
- мясо-пептонный бульон - 100 см;
- углекислый кальций - 4,5 г.
В.4.1.2 Приготовление среды
В мясо-пептонный бульон, приготовленный по ГОСТ 10444.1, помещают стерильный углекислый кальций. Углекислый кальций стерилизуют по ГОСТ 10444.1.
Приготовленную основу стерилизуют в автоклаве при температуре (121±1) °С в течение 20 мин.
В.4.2 Раствор 1
В.4.2.1 Состав:
- гипосульфит натрия (NaS
O
·5Н
О) - 50 г;
- вода - до 100 см.
В.4.2.2 Приготовление
Гипосульфит натрия помещают в колбу вместимостью 100 см, растворяют в дистиллированной воде и доводят дистиллированной водой до метки. Раствор переливают в колбу или флакон и стерилизуют текучим паром в течение 30 мин или при температуре (121±1) °С в течение 20 мин. Раствор хранят не более 1 мес при температуре (3±2) °С.
В.4.3 Раствор 2
В.4.3.1 Состав:
- йодистый калий - 25 г;
- йод кристаллический - 20 г;
- вода - до 100 см.
В.4.3.2 Приготовление
Йодистый калий помещают в колбу вместимостью 100 см, растворяют в небольшом количестве дистиллированной воды, прибавляют кристаллический йод, растворяют его. Объем раствора доводят дистиллированной водой до метки. Раствор хранят при комнатной температуре в плотно закрытом сосуде из темного стекла.
В.4.4 Раствор 3
В.4.4.1 Состав:
- бриллиантовый зеленый - 0,5 г;
- вода - 100 см.
В.4.4.2 Приготовление
Бриллиантовый зеленый переносят в фарфоровую ступку и постепенно растворяют в дистиллированной воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят дистиллированной водой до метки. Раствор хранят в закрытом сосуде из темного стекла при комнатной температуре не более 3 мес.
В.4.5 Раствор 4
В.4.5.1 Состав:
- сухая бычья желчь - 10 г;
- вода - до 100 см.
В.4.5.2 Приготовление
Сухую желчь растворяют в 100 см дистиллированной воды или используют 100 см
натуральной желчи. Раствор желчи или натуральную желчь стерилизуют при температуре (121±1) °С в течение 20 мин. Раствор хранят не более 1 мес при температуре (3±2) °С.
В.4.6 Готовая среда
В.4.6.1 Состав:
- основа среды по В.4.1 - 100 см;
- раствор 1 - 10 см;
- раствор 2 - 2 см;
- раствор 3 - 0,2 см;
- раствор 4 - 5 см.
В.4.6.2 Приготовление
Указанные растворы прибавляют к основе среды в приведенном выше порядке, перемешивая смесь после каждого прибавления, среду разливают по 10 см в пробирки.
Среду используют в день приготовления.
Для повышения селективности среды допускается добавлять к среде раствор новобиоцина натриевой соли из расчета 0,5 см раствора новобиоцина натриевой соли на 100 см
основы среды.
В.4.7 Раствор новобиоцина
В.4.7.1 Состав:
- новобиоцин натриевая соль - 0,04 г;
- вода - 5 см.
В.4.7.2 Приготовление
Новобиоцин натриевую соль растворяют в дистиллированной воде. Раствор стерилизуют фильтрацией по ГОСТ 26670 через мембранный фильтр размером пор 0,22 мкм, хранят при температуре (3±2) °С в течение четырех недель.
В.5 Ксилоза-лизин-деоксихолатный агар (XLD-aгap)
В.5.1 Основа среды
В.5.1.1 Состав:
- дрожжевой экстракт (порошок) - 3,0 г;
- хлористый натрий (NaCI) - 5,0 г;
- ксилоза - 3,75 г;
- лактоза - 7,5 г;
- сахароза - 7,5 г;
- L-лизин гидрохлорид - 5,0 г;
- тиосульфат натрия - 6,8 г;
- железо III аммоний цитрат - 0,8 г;
- феноловый красный - 0,08 г (или 20 см раствора, приготовленного по 5.2, если среда состоит из отдельных компонентов);
- деоксихолат натрия - 1,0 г;
- агар - от 9 до 18 г*;
________________
* Зависит от желирующих свойств.
- вода - 1000 см.
В.5.1.2 Приготовление
При нагревании растворяют дегидратированные компоненты основы или дегидратированную основу в воде при частом помешивании. Доводят до кипения, но не кипятят, избегая перегрева.
Устанавливают рН так, чтобы после прогрева он составлял (7,4±0,2) при температуре 25 °С. Разливают основу в пробирки или флаконы подходящей вместимости. Затем прогревают на кипящей водяной бане около 5 мин.
В.5.2 Раствор фенолового красного
В.5.2.1 Состав:
- феноловый красный - 0,4 г;
- вода - 100 см.
В.5.2.2 Приготовление
Феноловый красный переносят в фарфоровую ступку и постепенно растворяют в дистиллированной воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят дистиллированной водой до метки. Раствор хранят в закрытом сосуде из темного стекла при комнатной температуре.
В.5.3 Приготовление чашек со средой
Среду после прогрева переносят в водяную баню при температуре от 44 °С до 47 °С, перемешивают и разливают в чашки, дают затвердеть. Перед использованием среду в чашках предпочтительно с открытой крышкой и поверхностью среды вниз подсушивают в шкафу с температурой от 37 °С до 55 °С до тех пор, пока поверхность среды не станет сухой. Допускается хранить чашки со средой при температуре (3±2) °С не более пяти дней.
В.6 Дифференциально-диагностические среды
В.6.1 Висмут-сульфит агар (агар Вильсон-Блера).
В.6.2 Среда Плоскирева.
В.6.3 Среда Эндо.
В.6.4 Среда Левина.
Среды готовят по инструкции, указанной на этикетке.
В.6.5 Бриллиантовый зеленый агар
В.6.5.1 Состав:
- дрожжевой экстракт - 3 г;
- пептон - 10 г;
- хлористый натрий - 5 г;
- лактоза - 10 г;
- сахароза - 10 г;
- феноловый красный - 0,08 г (или 20 см раствора, приготовленного по В.5.2, если среда состоит из отдельных компонентов);
- агар - 20 г;
- бриллиантовый зеленый - 0,0125 г (или 2,5 см раствора, приготовленного по В.4.4);
- вода - 1000 см.
В.6.5.2 Приготовление
При нагревании растворяют дегидратированные компоненты основы или дегидратированную основу в воде при частом помешивании. Доводят до кипения, кипятят 1 мин.
Устанавливают рН так, чтобы после стерилизации он составлял (6,9±0,1) при температуре 25 °С. Разливают среду во флаконы подходящей вместимости. Стерилизуют 15 мин в автоклаве при температуре (121±1) °С. Охлаждают до температуры от 45 °С до 50 °С и разливают в чашки Петри.
В.7 Питательный агар
В.7.1 Состав:
- мясной экстракт - 3 г;
- пептон - 5 г;
- агар - от 9 до 18 г;
- вода - 1000 см.
В.7.2 Приготовление
Компоненты растворяют в воде при нагревании. Устанавливают рН так, чтобы после стерилизации он составлял (7,4±0,2) при температуре 25 °С. Переносят питательную среду в пробирки или флаконы, стерилизуют 15 мин в автоклаве при температуре (121±1) °С.
В.7.3 Приготовление чашек с питательным агаром
Переносят приблизительно 15 см расплавленной среды в стерильные чашки Петри и поступают по В.5.3.
В.8 Мясо-пептонный агар
Мясо-пептонный агар готовят по ГОСТ 10444.1 или используют ГРМ-агар.
ГРМ-агар готовят по инструкции, указанной на этикетке.
В.9 Мясо-пептонный бульон с глюкозой
Мясо-пептонный бульон с глюкозой готовят по ГОСТ 10444.1. Для посевов используют среду, разлитую в пробирки по 6-7 см.
В.10 Среды с углеводами (среды Гисса)
Среды с углеводами (среды Гисса) готовят по ГОСТ 10444.1 или используют сухие среды с углеводами, которые готовят по инструкции, указанной на этикетке.
В.11 Трехсахарный железистый агар (TSI-aгap)
В.11.1 Состав:
- мясной экстракт - 3,0 г;
- дрожжевой экстракт - 3,0 г;
- пептон - 20,0 г;
- хлористый натрий (NaCI) - 5,0 г;
- лактоза - 10,0 г;
- сахароза - 10,0 г;
- глюкоза - 1,0 г;
- железо (III) цитрат- 0,3 г;
- тиосульфат натрия - 0,3 г;
- феноловый красный - 0,024 г (или 6 см раствора, приготовленного по В.5.2, если среда состоит из отдельных компонентов);
- агар - от 9 до 18 г;
- вода - 1000 см.
В.11.2 Приготовление
При нагревании растворяют компоненты или дегидратированную основу среды в воде. Устанавливают такой рН, чтобы после стерилизации он составлял (7,4±0,2) при температуре 25 °С. Переносят среду в пробирки по 7-8 см. Стерилизуют 15 мин в автоклаве при (121±1) °С. Затем пробирки оставляют в наклонном положении так, чтобы высота столбика среды составляла около 2,5 см, а скошенная поверхность над ним - 5 см.
Допускается использование агара Клиглера или среды Олькеницкого. Среды готовят по инструкциям, указанным на этикетках.
В.12 Агар с мочевиной (агар Кристенсена)
В.12.1 Основа среды
В.12.1.1 Состав:
- пептон - 1,0 г;
- глюкоза - 1,0 г;
- хлористый натрий (NaCI) - 5,0 г;
- однозамещенный фосфорнокислый калий (KНРО
) - 2,0 г;
- феноловый красный - 0,012 г (или 3 см раствора, приготовленного по В.5.2, если среда состоит из отдельных компонентов);
агар - от 9 до 18 г;
вода - 1000 см.
В.12.1.2 Приготовление
При нагревании растворяют компоненты или дегидратированную основу среды в воде. Устанавливают такой рН, чтобы после стерилизации он составлял (6,8±0,2) при температуре 25 °С. Основу среды в определенных объемах разливают в колбы или флаконы и стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
В.12.2 Раствор мочевины
В.12.2.1 Состав:
- мочевина - 40 г;
- вода до конечного объема - 100 см.
В.12.2.2 Приготовление
Мочевину помещают в колбу вместимостью 100 см, растворяют в воде, объем раствора доводят водой до метки. Раствор мочевины стерилизуют фильтрацией по ГОСТ 26670 через фильтры с размером пор 0,22 мкм или текучим паром в течение 30 мин.
В.12.3 Раствор фенолового красного
В.12.3.1 Состав и приготовление - по В.5.2.
В.12.4 Готовая среда
В.12.4.1 Состав:
- основа (см. В.12.1) - 950 см;
- раствор мочевины (см. В.12.2) - 50 см.
В.12.4.2 Приготовление
Прибавляют с соблюдением правил асептики раствор мочевины к основе, предварительно расплавленной и охлажденной до температуры от 44 °С до 47 °С. Разливают готовую среду в стерильные пробирки 7-8 см. После стерилизации среду скашивают по В.11.2.
В.13 L-лизиндекарбоксилазная среда
В.13.1 Состав:
- L-лизин моногидрохлорид - 5,0 г;
- дрожжевой экстракт - 3,0 г;
- глюкоза - 1,0 г;
- бромкрезоловый пурпуровый - 0,015 г (или 5 см раствора, приготовленного по В.13.3);
- вода - 1000 см.
В.13.2 Приготовление
Компоненты растворяют в воде при нагревании.
Устанавливают рН так, чтобы после стерилизации он составлял (6,8±0,2) при температуре 25 °С.
Переносят среду в пробирки по 2-5 см.
Стерилизуют 15 мин в автоклаве при температуре (121±1) °С.
В.13.3 Раствор бромкрезолового пурпурового
В.13.3.1 Состав:
- бромкрезоловый пурпуровый - 0,3 г;
- вода - 100 см.
В.13.3.2 Приготовление
Бромкрезоловый пурпуровый переносят в фарфоровую ступку и постепенно растворяют в воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят водой до метки. Раствор хранят в закрытом сосуде из темного стекла при комнатной температуре не более 3 мес.
В.14 -галактозидазный реактив
В.14.1 Буферный раствор
В.14.1.1 Состав:
- фосфорнокислый однозамещенный натрий (NaHPO
) - 6,9 г;
- гидроксид натрия (NaOH) концентрации 10 моль/дм - около 3 см
;
- вода до конечного объема - 50 см.
В.14.1.2 Приготовление
Растворяют фосфорнокислый однозамещенный натрий приблизительно в 45 см воды в мерном флаконе.
Устанавливают рН с помощью раствора гидроксида натрия (7,0±0,2) при температуре 25 °С. Добавляют воду до объема 50 см.
В.14.2 ONPG-раствор
В.14.2.1 Состав:
- о-нитрофенил -D-галактопиранозид (ONPG) - 0,08 г;
- вода - 15 см.
В.14.2.2 Приготовление
Растворяют ONPG в воде температурой около 50 °С. Раствор охлаждают.
В.14.3 Готовый реактив
В.14.3.1 Состав:
- буферный раствор (см. В.14.1) - 5 см;
- ONPG-раствор (см. В.14.2) - 15 см.
В.14.3.2 Приготовление
Готовят свежий раствор, прибавляя буферный раствор к ONPG-раствору.
В.15 Среда и реактивы для реакции Фогес-Проскауера (VP)
В.15.1 VP-среда
В.15.1.1 Состав:
- пептон - 7 г;
- глюкоза - 5 г;
- фосфорнокислый двузамещенный калий (KНРО
) - 5 г;
- вода - 1000 см.
В.15.1.2 Приготовление
Компоненты растворяют в воде при нагревании. Устанавливают такой рН, чтобы после стерилизации он составлял (6,9±0,2) при температуре 25 °С. Среду разливают в пробирки по 3 см. Стерилизуют 15 мин в автоклаве при температуре (121±1) °С.
В.15.2 Раствор креатина (N-амидиносаркозина)
В.15.2.1 Состав:
креатин моногидрат - 0,5 г;
вода - 100 см.
В.15.2.2 Приготовление
Креатин моногидрат растворяют в воде.
В.15.3 1-нафтол, спиртовой раствор
В.15.3.1 Состав:
- 1-нафтол - 6 г;
- спирт этиловый ректификованный из пищевого сырья объемной долей 96% - 100 см.
В.15.3.2 Приготовление
Растворяют 1-нафтол в этаноле.
В.15.4 Раствор гидроксида калия
В.15.4.1 Состав:
- гидроксид калия (KОН) - 40 г;
- вода - 100 см.
В.15.4.2 Приготовление
Гидроксид калия растворяют в воде.
В.16 Реактивы для индольной реакции
В.16.1 Реактив Ковача
В.16.1.1 Состав:
- 4-диметиламинобензальдегид - 5 г;
- соляная кислота плотностью 1,18 г/см
1,19 г/ см
- 25 см
;
- 2-метилбутан-2-ол (изобутиловый спирт) - 75 см.
В.16.1.2 Приготовление
Компоненты перемешивают.
В.16.2 Реактив Эрлиха
В.16.2.1 Состав:
- парадиметиламинобензальдегид - 1 г;
- этиловый спирт объемной долей 96% - 95 см;
- соляная кислота плотностью 1,18 г/см
1,19 г/см
- 80 см
.
В.16.2.2 Приготовление
Компоненты перемешивают.
В.17 Триптон/триптофановая среда
В.17.1 Состав:
- триптон - 10 г;
- хлористый натрий (NaCI) - 5 г;
- DL-триптофан - 1 г;
- вода - 1000 см.
В.17.2 Приготовление
Компоненты растворяют в горячей воде. Устанавливают такой рН, чтобы после стерилизации он составлял (7,5±0,2) при температуре 25 °С. Разливают среду по 5 см в пробирки. Стерилизуют 15 мин в автоклаве при температуре (121±1)°С.
В.18 Бульон Хоттингера
Бульон Хоттингера готовят по ГОСТ 10444.1. Для посевов используют среду, разлитую в пробирки по 6-7 см.
В.19 Мясо-пептонный бульон с 0,05% L-триптофана
В.19.1 Состав:
- L-триптофан - 0,05 г;
- мясо-пептонный бульон - 100 см.
В.19.2 Приготовление
L-триптофан растворяют в мясо-пептонном бульоне, приготовленном по ГОСТ 10444.1, разливают в пробирки по 6-7 см и стерилизуют при температуре (121±1) °С в течение 20 мин.
В.20 Полужидкий питательный агар
В.20.1 Состав:
- мясной экстракт - 3,0 г;
- пептон - 5,0 г;
- агар - от 4 до 9 г*;
________________
* Зависит от желирующих свойств.
- вода - 1000 см.
В.20.2 Приготовление
Компоненты растворяют в воде при нагревании. Устанавливают такой рН, чтобы после стерилизации он составлял (7,0±0,2) при температуре 25 °С. Разливают среду во флаконы подходящей вместимости. Стерилизуют 15 мин в автоклаве при температуре (121±1) °С.
В.20.3 Приготовление пробирок с агаром
В стерильные пробирки наливают по 6-7 см свежеприготовленного агара.
В.21 Полужидкий мясо-пептонный агар
Готовят по ГОСТ 10444.1 так же, как мясо-пептонный агар, но при приготовлении добавляют 4,0-9,0 г агара на 1 дм мясо-пептонного бульона, перед стерилизацией среду разливают по 6-7 см
в пробирки.
В.22 Физиологический раствор
В.22.1 Состав:
- хлористый натрий (NaCI) - 8,5 г;
- вода - 1000 см.
В.22.2 Приготовление
Хлористый натрий растворяют в воде. Устанавливают такой рН, чтобы после стерилизации он составлял (7,0±0,2) при температуре 25 °С. Разливают во флаконы подходящей вместимости, стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
Допускается использование готовых и дегидратированных, в том числе хромогенных, питательных сред аналогичного состава, и зарегистрированных на территории Российской Федерации.
Приложение Г
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации, использованным в настоящем стандарте в качестве нормативных ссылок
Таблица Г.1
Обозначение ссылочного межгосударственного и национального стандарта Российской Федерации | Обозначение и наименование ссылочного международного стандарта и условное обозначение степени его соответствия ссылочному национальному стандарту |
ГОСТ Р 51446-99* (ИСО 7218-96) | ИСО 7218:1996 "Микробиология продуктов питания и кормовых продуктов. Общие правила микробиологических исследований" (MOD) |
ГОСТ Р 51652-2000 | - |
ГОСТ 4209-77 | - |
ГОСТ 6672-75 | - |
ГОСТ 6691-77 | - |
ГОСТ 6709-72 | - |
ГОСТ 9284-75 | - |
ГОСТ 9536-79 | - |
ГОСТ 10444.1-84 | - |
ГОСТ 24104-2001 | - |
ГОСТ 24363-80 | - |
ГОСТ 26668-85 | - |
ГОСТ 26669-85 | - |
ГОСТ 26670-91 | - |
ГОСТ 30425-97 | - |
* с 1 января 2010 г. введен в действие ГОСТ Р ИСО 7218-2008. Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: - MOD - модифицированные стандарты. | |
__________________________________________________________________________
УДК 663.664.001.4:006.354 ОКС 07.100.30 H09 ОКСТУ 9109
Ключевые слова: неселективное обогащение, селективно-диагностические среды, ферментация углеводов, индол, реакция агглютинации, инкубирование посевов, -галактозидаза
__________________________________________________________________________
Электронный текст документа
и сверен по:
Продукты пищевые, консервы.
Методы микробиологического анализа:
Сб. ГОСТов. - , 2010

