ГОСТ Р 58173-2018
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
СРЕДСТВА ЛЕКАРСТВЕННЫЕ ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ
Исследования иммунотоксичности лекарственных средств, предназначенных для человека
Immunotoxicity investigations intended for humans pharmaceuticals
ОКС 11.120
Дата введения 2019-03-01
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский институт стандартизации материалов и технологий" (ФГУП "ВНИИ СМТ") на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 458 "Разработка, производство и контроль качества лекарственных средств"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 10 июля 2018 г. N 402-ст
4 Настоящий стандарт идентичен руководству ICH S8:2005* "Исследования иммунотоксичности лекарственных средств, предназначенных для человека" (ICH S8:2005, Immunotoxicity Studies for Human Pharmaceuticals, IDT) Международной конференции по гармонизации технических требований для регистрации лекарственных средств для медицинского применения (International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use; ICH).
________________
С 25 октября 2015 г. переименована в Международный совет по гармонизации.
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Наименование настоящего стандарта изменено относительно наименования указанного международного документа для приведения в соответствие с ГОСТ Р 1.5-2012 (пункт 3.5)
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
Цели
Целями настоящего стандарта является предоставление рекомендаций по доклиническим исследованиям, направленным на выявление компонентов потенциально обладающих иммунотоксичностью, и обеспечение руководства по подходу к принятию решений на основе имеющихся доказательств в области исследований иммунотоксичности. В рамках настоящего стандарта под иммунотоксичностью понимается непредусмотренная иммуносупрессия или усиление иммунных реакций. Лекарственно обусловленная гиперчувствительность и аутоиммунные реакции не входят в область рассмотрения настоящего стандарта.
Справочная информация
Оценка потенциального нежелательного действия лекарственных препаратов на иммунную систему человека должна включаться в стандартный процесс разработки лекарственных средств. Токсическое воздействие на иммунную систему включает подавление или усиление иммунного ответа. Подавление иммунного ответа может приводить к снижению сопротивляемости организма к возбудителям инфекции или опухолевым клеткам. Усиление иммунного ответа может приводить к обострению аутоиммунных заболеваний или гиперчувствительности. Лекарственное средство или аддукты белкового препарата могут быть распознаны как чужеродные и стимулировать иммунный ответ, направленный против лекарственного средства. Последующее применение препарата может стать причиной аллергических реакций. Значительная часть научных работ и усилия по валидации в прошлом сосредоточены на оценке препаратов-кандидатов, находящихся в разработке, на предмет потенциального риска вызывать иммуносупрессию либо контактную аллергию. В настоящее время отсутствуют стандартные подходы к исследованию лекарственных препаратов, предназначенных для человека в отношении респираторной или системной аллергенности (антигенности), лекарственных аутоиммунных реакций.
Иммуносупрессия или усиление иммунных реакций могут быть вызваны двумя группами лекарственных средств:
1) предназначенными для модуляции иммунной функции в терапевтических целях (например, для профилактики отторжения органов), если нежелательная иммуносупрессия может рассматриваться в качестве избыточной фармакодинамики;
2) не предназначенными для воздействия на иммунитет, но вызывающими иммунотоксичность, например, в связи с некрозом или апоптозом иммунных клеток либо взаимодействием с клеточными рецепторами, общими для целевых тканей или нецелевых клеток иммунной системы.
В качестве примера препаратов, вызывающих нежелательную иммуносупрессию, можно назвать антипролиферативные препараты, используемые для лечения рака. В этих случаях нежелательные результаты доклинических исследований достаточно прямо указывают на иммунотоксичность у человека. Поэтому проведение специальных анализов для определения иммунотоксичности, скорее всего, не целесообразно при оценке риска, поскольку целевые ткани обычно представляют собой быстро делящиеся клетки, например клетки-предшественники иммунной системы из костного мозга. Поэтому нежелательное действие на иммунную систему может быть спрогнозировано на основании фармакологической активности и может быть достоверно изучено в рамках доклинических исследований. Что касается других типов веществ, не предназначенных для подавления иммунного ответа, различение между избыточной фармакодинамикой и нецелевыми эффектами менее очевидно. Например, некоторые противовоспалительные препараты могут повлиять на определенные врожденные иммунные функции, но не обязательно на адаптивный иммунный ответ.
1 Область применения
Настоящий стандарт распространяется на предоставление рекомендаций по доклиническим исследованиям иммунотоксичности лекарственных средств, предназначенных для человека. Область применения настоящего стандарта ограничивается нежелательной иммуносупрессией или избыточным иммунным ответом, не включая случаев аллергенности или лекарственно-обусловленных аутоиммунных реакций.
Настоящий стандарт применим ко всем новым лекарственным средствам, предназначенным для человека, а также к зарегистрированным препаратам при расширении списка показаний либо внесения иных изменений в существующую инструкцию, если подобное изменение может приводить к новым значимым иммунотоксическим реакциям. Кроме того, настоящий стандарт также распространяется на препараты, в отношении которых клинические признаки иммунотоксичности отмечались при проведении клинических исследований и после регистрации и выведения на рынок.
Настоящий стандарт не распространяется на лекарственные средства, полученные биотехнологическим путем, и на другие биологические препараты.
Существующие методические документы о сенсибилизации и гиперчувствительности остаются в силе, настоящий стандарт на них не влияет. Настоящий стандарт не ставит себе целью предоставить специфические рекомендации относительно того, как следует проводить каждое исследование иммунотоксичности. Общие методические рекомендации даны в приложении.
В рамках настоящего стандарта под иммунотоксичностью понимаются непредусмотренная иммуносупрессия или усиление иммунных реакций. Лекарственно обусловленная гиперчувствительность и аутоиммунные реакции не входят в область рассмотрения настоящего стандарта.
2 Общие принципы
К настоящему стандарту применимы следующие общие принципы:
- все новые лекарственные средства, предназначенные для человека, следует оценивать с точки зрения потенциальной способности вызывать иммунотоксические реакции;
- методики включают стандартные исследования токсичности (СИТ) или дополнительные исследования токсичности, проводимые в установленном порядке. Вопрос о целесообразности проведения дополнительных исследований иммунотоксичности решается на основании совокупного анализа факторов, изложенных в 2.1.
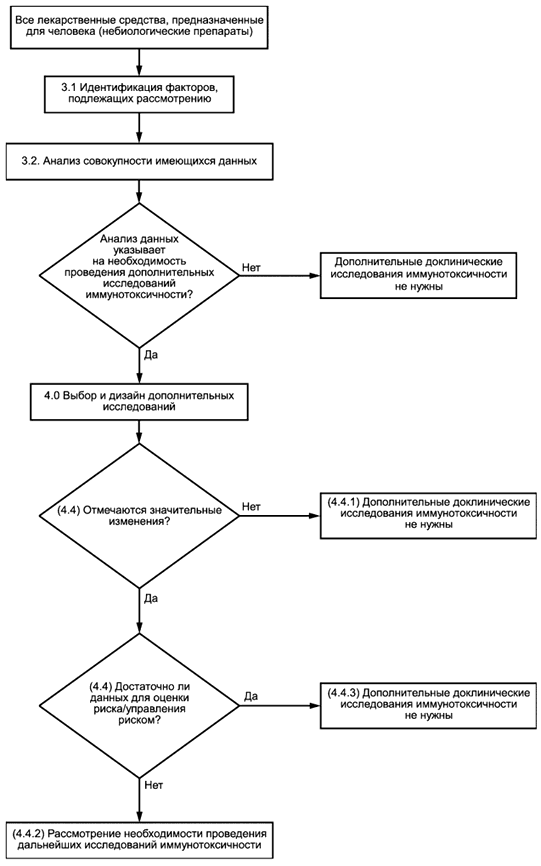
Содержание настоящего стандарта изложено в соответствии с рекомендованным процессом принятия решений в рамках оценки иммунотоксичности, как показано на блок-схеме (рисунок 1). Более подробное описание методов проведения испытаний представлено в приложении.
|
Рисунок 1 - Блок-схема рекомендованной оценки иммунотоксичности
3 Методическая инструкция
3.1 Факторы, учитываемые при оценке потенциальной иммунотоксичности
Выделяют следующие факторы, которые обусловливают необходимость дальнейших исследований иммунотоксичности: 1) результаты СИТ; 2) фармакологические свойства препарата; 3) целевая категория пациентов; 4) структурное сходство с известными иммуномодуляторами; 5) распределение лекарственного средства и 6) клиническая информация.
Начальный скрининг на потенциальную иммунотоксичность включает стандартные исследования токсичности. При этом следует учитывать данные исследований на грызунах и животных, относящихся к другим отрядам, как краткосрочных, так и долгосрочных. Дополнительная информация по изучаемым параметрам и правила сообщения о результатах гистопатологического анализа представлены в приложении.
3.1.1 Стандартные исследования токсичности
Данные СИТ следует анализировать с точки зрения наличия признаков иммунотоксичности. Необходимо учитывать следующие признаки:
- изменение гематологических параметров, таких как лейкоцитопения/лейкоцитоз, гранулоцитопения/гранулоцитоз либо лимфопения/лимфоцитоз;
- изменение массы органов иммунной системы и/или гистологические изменения (например, изменения тимуса, селезенки, лимфатических узлов и/или костного мозга);
- изменение сывороточного глобулина;
- повышение частоты инфекций;
- повышение частоты опухолей как признак иммуносупрессии в отсутствие других вероятных причин, таких как генотоксичность, гормональные эффекты либо индукция ферментов печени.
Изменения по этим параметрам могут отражать наличие иммуносупрессии либо повышенную активацию иммунной системы. Иммуносупрессия, как правило, выражается в виде снижения значений по параметрам иммунной функции, а усиление иммунного ответа - в виде роста по данным параметрам. Однако данная взаимосвязь не абсолютная и в некоторых случаях может быть нарушена.
Оценку иммунотоксичности должны проводить с учетом следующих факторов:
- статистическая и биологическая значимость изменений;
- степень тяжести эффектов;
- взаимосвязь доза/воздействие;
- фактор безопасности сверх ожидаемой клинической дозы;
- продолжительность терапии;
- количество использованных биологических видов животных и конечные точки;
- изменения, которые могут происходить под воздействием других факторов (например, стресса, см. 1.4 приложения);
- возможные клеточные мишени и/или механизм действия;
- дозы, при которых проявляются эти изменения, относительно доз, при которых проявляются другие виды токсичности;
- обратимость эффектов.
3.1.2 Фармакологические свойства
Если фармакологические свойства исследуемого вещества свидетельствуют о его потенциальной способности воздействовать на иммунную функцию (например, в случае противовоспалительных препаратов), следует рассмотреть возможность проведения дополнительных анализов иммунотоксичности. Информация, полученная в рамках доклинических фармакологических исследований о способности препарата воздействовать на иммунную систему, может быть использована в рамках подхода с учетом совокупности доказательств при принятии решения о необходимости проведения дополнительных исследований иммунотоксичности.
3.1.3 Предполагаемые категории больных
Проведение дополнительных исследований иммунотоксичности целесообразно в том случае, если большинство пациентов, которым показан препарат, имеют иммунодефициты, обусловленные спецификой заболевания или проводимой терапией.
3.1.4 Структурное подобие
Вещества, сходные по своей структуре с веществами, обладающими подтвержденными иммуно-супрессивными свойствами, также должны быть рассмотрены в качестве возможных кандидатов для проведения анализа иммунотоксичности.
3.1.5 Распределение препарата
Если препарат и/или его метаболиты сохраняются в высоких концентрациях в клетках иммунной системы, следует рассмотреть вопрос о проведении дополнительного исследования иммунотоксичности.
3.1.6 Признаки, наблюдаемые в клинических исследованиях или в ходе клинического применения препарата
Результаты клинических исследований, свидетельствующие об иммунотоксичности у пациентов, получающих препарат, могут свидетельствовать о необходимости проведения дополнительных доклинических исследований иммунотоксичности.
3.2 Анализ совокупности имеющихся данных
Необходимо проводить анализ совокупности имеющихся данных, учитывающих все факторы, описанные выше, для установления вероятного основания для беспокойства. Обоснованные результаты в одной области могут повлечь за собой необходимость проведения дополнительных исследований иммунотоксичности. Результаты анализа двух и более факторов, каждый из которых по отдельности был бы недостаточен, также могут обусловить необходимость проведения дополнительных исследований. Если дополнительные исследования иммунотоксичности не проводятся, спонсор должен предоставить соответствующее обоснование этого факта.
4 Выбор и дизайн дополнительных исследований иммунотоксичности
4.1 Цели
При обоснованном беспокойстве в отношении результатов анализа должны быть проведены дополнительные исследования иммунотоксичности для уточнения иммунотоксического потенциала препарата. Такие исследования могут выявить обратимость эффектов в подвергнутых изменениям типах клеток, а также механизм действия. Подобная информация также может указывать на потенциальный риск и, возможно, приводить к выбору биомаркеров для клинических исследований.
4.2 Выбор анализов
Если имеющиеся сведения указывают на необходимость проведения дополнительных исследований иммунотоксичности, можно использовать различные анализы. При наличии изменения в данных стандартных исследований токсичности, свидетельствующих о наличии иммунотоксичности, тип дополнительных исследований иммунотоксичности, который можно считать подходящим, будет зависеть от наблюдаемых иммунологических изменений и от токсичности, характерной для препаратов данного класса. Рекомендуется проводить исследование иммунной функции, например Т-зависимого ответа антител (ТЗОА). Если конкретные типы клеток, выявленные в СИТ, не участвуют в анализе ТЗОА, можно рассмотреть возможность проведения анализов по измерению функции клеток данного типа (см. приложение). Если конкретная мишень не определена, рекомендовано исследование иммунной функции, например ТЗОА.
Кроме того, иммунофенотипирование популяций лейкоцитов, нефункциональный анализ, можно проводить с целью идентификации определенных затронутых проблемой популяций клеток, что может обеспечить получение полезных клинических биомаркеров.
4.3 Дизайн исследования
Для оценки лекарственно обусловленной иммунотоксичности общепринятый дизайн исследования на грызунах предполагает исследование продолжительностью 28 дней с последовательным ежедневным дозированием. Описаны случаи адаптации дизайна анализа иммунотоксичности, предполагающие использование животных, не относящихся к отряду грызунов. Вид животных, штаммы, дозы, продолжительность терапии и путь введения в дополнительных исследованиях иммунотоксичности должны по возможности соответствовать используемым для стандартного исследования токсичности, в котором отмечались нежелательные эффекты со стороны иммунной системы. Обычно в таких исследованиях принимают участие животные обоих полов, за исключением случаев проведения исследований на приматах. Если при проведении исследований на животных других видов берут животных только одного пола, этому должно быть представлено обоснование. Высокая доза лекарственных средств должна превышать уровень, не вызывающий неблагоприятных изменений (NOAEL), но должна быть ниже уровня, приводящего к изменениям, вызванным стрессом (см. 1.4 приложения). Для определения взаимосвязи доза-ответ и дозы, при которой наблюдается иммунотоксичность, рекомендовано в исследовании использовать несколько уровней доз.
4.4 Оценка дополнительных исследований иммунотоксичности и необходимость проведения дальнейших исследований
Результаты дополнительных исследований иммунотоксичности следует оценивать с точки зрения наличия достаточного объема данных, позволяющих в достаточной степени установить риск иммунотоксичности:
4.4.1 Дополнительные исследования могут указать на отсутствие возможности выявления риска иммунотоксичности и отсутствие необходимости проведения дальнейших испытаний.
4.4.2 Дополнительные исследования могут указывать на риск иммунотоксичности, но не обеспечивать получение достаточных данных для принятия рационального решения относительно соотношения риск/польза. В этом случае дополнительные анализы могут обеспечить получение достаточной информации для принятия решения о соотношении польза/риск.
4.4.3 Если общий анализ риск/польза указывает на приемлемость риска иммунотоксичности и/или может быть учтен в плане управления рисками, дальнейшего испытания на животных может не потребоваться.
5 Сроки проведения исследований иммунотоксичности относительно клинических исследований
Если анализ совокупности имеющихся данных указывает на необходимость проведения дополнительных исследований иммунотоксичности, они должны быть проведены до начала применения препарата в больших популяциях пациентов, обычно в рамках исследований III фазы. Это позволит соответствующим образом включить мониторинг параметров функции иммунной системы в программу клинических исследований. Время проведения дополнительных анализов иммунотоксичности определяется в зависимости от особенностей эффектов исследуемого вещества и типа клинических испытаний, которые необходимы в случае положительного результата анализа дополнительных исследований иммунотоксичности. Если целевые категории пациентов имеют иммунодефицитные состояния, анализ иммунотоксичности может быть начат на более раннем этапе разработки препарата.
Приложение
(справочное)
Методы оценки иммунотоксичности
1 Стандартные исследования токсичности
В таблице перечислены параметры, которые следует оценивать в рамках стандартных исследований токсичности на предмет признаков иммунотоксичности.
Таблица - Оцениваемые параметры в рамках стандартных исследований токсичности
Параметр | Специфический компонент |
Гематология | Общее и абсолютное дифференциальное количество лейкоцитов |
Клиническая химия | Уровень глобулина |
Макропатология | Лимфоидные органы и ткани |
Масса органов | Тимус, селезенка (необязательно: лимфатические узлы) |
Гистология | Тимус, селезенка, дренирующий лимфатический узел и минимум один дополнительный лимфатический узел, костный мозг |
| |
1.1 Гематология и клиническая химия
Подсчет общего числа лейкоцитов и абсолютный дифференцированный подсчет лейкоцитов необходимы для оценки иммунотоксичности. При оценке изменения уровня глобулина следует учитывать другие факторы (например, токсическое воздействие на печень, нефротоксичность). Изменение уровня глобулина в сыворотке может свидетельствовать о наличии изменения уровня иммуноглобулинов в сыворотке. Несмотря на то, что уровень иммуноглобулинов в сыворотке не является чувствительным индикатором иммуносупрессии, изменение уровня иммуноглобулина может быть полезным в некоторых ситуациях, обеспечивая более точное понимание популяций клеток-мишеней и механизма действия препарата.
1.2 Макропатология и масса органов
При вскрытии необходимо исследовать лимфоидные ткани на предмет макроскопических изменений и регистрировать массу тимуса и селезенки. При некропсии у собак и обезьян рекомендовано полное обескровливание животных для сведения к минимуму вариабельности массы селезенки.
1.3 Гистопатологическое обследование
Гистопатологические изменения селезенки и тимуса следует оценивать в качестве индикатора системной иммунотоксичности. Должна быть исследована лимфоидная ткань, осуществляющая дренаж либо контактирующая с участком введения препарата (а следовательно, подверженная наибольшим концентрациям препарата). К таким участкам относятся пейеровы бляшки и мезентерические лимфатические узлы в случае препаратов, принимаемых внутрь, и лимфоидная ткань, ассоциированная с бронхами (BALT), - для препаратов, вводимых в виде ингаляции, и назально-ассоциированная лимфоидная ткань (NALT) для препаратов, вводимых путем ингаляции или интраназально (если это возможно), и наиболее проксимальные регионарные дренажные лимфатические узлы для препаратов, применяемых накожно, внутримышечно, внутрикожно, интратекально или подкожно. Выбор конкретного лимфатического узла и дополнительного лимфатического узла происходит по усмотрению спонсора на основании имеющегося у него опыта. Для препаратов, вводимых внутривенно, в качестве дренажной лимфоидной ткани рассматривают селезенку.
При регистрации изменений и сообщении о лекарственно-обусловленном изменении лимфоидных тканей рекомендовано проводить полуколичественное описание изменений в компартментах лимфоидных тканей.
1.4 Интерпретация изменений, вызванных стрессом
При проведении стандартных исследований токсичности дозы, близкие к максимально переносимой дозы, могут приводить к стресс-обусловленному изменению иммунной системы (например, к избыточному фармакодинамическому действию). Воздействия на иммунную систему могут быть опосредованы усиленным высвобождением кортикостерона либо кортизола или других медиаторов. К частым стресс-опосредованным иммунным изменениям относят рост уровня циркулирующих нейтрофилов, снижение уровня лимфоцитов в циркулирующей крови, массы тимуса, клеточности коркового вещества тимуса и связанные с ним гистопатологические изменения, а также изменения клеточного содержимого селезенки и лимфатических узлов. Также отмечен рост массы надпочечников и/или гистологических признаков гиперплазии коры надпочечников. Снижение массы тимуса при наличии клинических признаков, таких как снижение массы тела и физической активности, также относили на стрессовые ситуации. Эти результаты сами по себе не являются достаточным свидетельством стресс-опосредованной иммунотоксичности. Признаки стресса должны быть достаточно убедительными, чтобы представлять собой достаточное основание для отказа от проведения дополнительных исследований иммунотоксичности.
Обычно наблюдаемые, связанные со стрессом иммунные изменения включают: увеличение циркулирующих нейтрофилов, уменьшение циркулирующих лимфоцитов, снижение массы тимуса, снижение тимозной кортикальной клеточности и связанные с ней гистопатологические изменения и изменения клеточной плотности селезенки и лимфатических узлов.
2 Дополнительные исследования иммунотоксичности
2.1 Характеристика и валидация анализа
Обычно выбирают широко применяемые методики проведения теста иммунотоксичности, показавшие достаточную чувствительность и специфичность по отношению к иммуносупрессивным веществам. Однако в некоторых ситуациях методики могли не пройти достаточной валидации, а анализ мог не быть широко используемым. В таких ситуациях необходимо научное/механистическое основание для использования данного метода анализа; при необходимости следует использовать положительный контроль.
Могут существовать колебания ответа для каждого типа испытания иммунотоксичности, используемого различными лабораториями. В большинстве случаев изменения не влияют на способность к оценке иммунотоксичности. Однако для обеспечения необходимого качества выполнения анализа и профессионализма лаборатории следует соблюдать несколько стандартных технических параметров валидации. Эти параметры включают определение прецизионности внутри одного опыта и в серии опытов, прецизионность при проведении анализа разными лаборантами, предел количественного определения, линейный участок количественного определения и стабильность исследуемого образца. Кроме того, следует установить чувствительность анализа к известным веществам с иммуносупрессивным действием. Рекомендовано проводить каждый лабораторный тест с положительным контрольным препаратом параллельно экспериментальным либо проводить такие испытания периодически для подтверждения эффективности методики, кроме исследований, проводимых на приматах. При иммунофенотипировании, при условии надлежащей технической валидации, включение положительных контрольных образцов в каждое исследование может не потребоваться.
Исследования иммунотоксичности должны проводить в соответствии с требованиями надлежащей лабораторной практики. Некоторые специализированные анализы, например из числа описанных ниже, могут не соответствовать полностью требованиям GLP.
2.2 Т-клеточно зависимый гуморальный иммунный ответ (TDAR)
Анализ TDAR следует проводить при помощи установленного Т-клеточно зависимого антигена [например, эритроциты овцы (SRBC) или гемоцианин лимфы улитки (KLH)], приводящего к достижению стойкого ответа антител. Выбранная конечная точка должна быть обоснована в качестве наиболее подходящей для выбранного анализа и биологического вида.
Антигены для иммунизации не следует использовать с адъювантами без надлежащего основания. Алюминий можно использовать только в исследованиях на приматах. Относительный ответ TDAR может зависеть от линии животных, особенно в случае исследований на мышах. В случае аутбредных крыс может иметь место значительная вариабельность между крысами внутри одной группы. Инбредные линии крыс можно использовать при условии достаточных данных для сопоставления с линиями животных в СИТ.
Антитела можно определять при помощи ELISA или других методик иммунного анализа. Одним из преимуществ данного метода над ответом со стороны антителообразующих клеток является то, что образцы можно собирать периодически в течение всего периода проведения исследования. У обезьян серийный сбор клеток крови играет большую роль благодаря высокой вариабельности кинетических параметров ответа у разных животных. В этих исследованиях данные могут быть выражены в виде суммы ответа антител для нескольких дней сбора (например, площадь под кривой).
Если для анализа ELISA используют антигены SRBC, использование иммобилизованного антигена в плашках - критически важный момент. В качестве иммобилизованного антигена SRBC можно использовать цельные фиксированные эритроциты или мембранные препараты. Результаты анализа ELISA следует выражать либо в виде концентрации, либо в виде титра, а их выражение в единицах оптической плотности не рекомендовано.
2.3 Иммунофенотипирование
Иммунофенотипирование - это идентификация и/или подсчет групп лейкоцитов при помощи антител. Иммунофенотипирование, как правило, проводят методом флоуцитометрического анализа или иммуногистохимических методов.
Проточная цитометрия, используемая для подсчета определенных популяций клеток, не является функциональным методом анализа. Однако проточную цитометрию можно применять для определения антиген-специфического иммунного ответа со стороны лимфоцитов. Данные периферической крови могут представлять собой полезный мост для клинических исследований, в которых также проводят оценку лейкоцитов периферической крови. Рекомендовано при оценке изменений, обусловленных терапией, учитывать абсолютное количество подгрупп лимфоцитов, а также процентные соотношения.
Одним из преимуществ иммуногистохимического анализа над проточной цитометрией является то, что ткани стандартных исследований токсичности могут быть подвержены ретроспективному анализу при наличии признаков иммунотоксичности. Некоторые маркеры лимфоцитов для определенных видов чувствительны к фиксации формалином и могут быть локализованы только в тканях, фиксированных определенными фиксаторами, либо в быстрозамороженных тканях. Количественное определение лейкоцитов и интенсивность окрашивания оценить при использовании иммуногистохимического метода гораздо труднее.
УДК 615.038:615.012:006.354 | ОКС 11.120 | |
Ключевые слова: лекарственные средства, иммунотоксичность лекарственных средств | ||
Электронный текст документа
и сверен по:
, 2018