ГОСТ Р 53699-2009
(ИСО 15378:2006)
Группа Р19
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПЕРВИЧНЫЕ УПАКОВОЧНЫЕ МАТЕРИАЛЫ ДЛЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Частные требования по применению ГОСТ Р ИСО 9001-2008 с учетом правил GMP
Primary packaging materials for medicinal products. Particular requirements for the application of ISO 9001:2008, with reference to Good Manufacturing Practice (GMP)
ОКС 11.120
ОКП 94 6000
Дата введения 2010-08-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 ПОДГОТОВЛЕН Общероссийской общественной организацией "Ассоциация инженеров по контролю микрозагрязнений" ("АСИНКОМ") на основе собственного аутентичного перевода стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 458 "Производство и контроль качества лекарственных средств"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 9 декабря 2009 г. N 622-ст
4 Настоящий стандарт является модифицированным по отношению к международному стандарту ИСО 15378:2006 "Первичные упаковочные материалы для медицинской продукции. Частные требования по применению ИСО 9001-2000 с учетом правил GMP" (ISO 15378:2006 "Primary packaging materials for medicinal products - Particular requirements for the application of ISO 9001:2000, with reference to Good Manufacturing Practice (GMP)"). При этом дополнительные положения и требования, включенные в текст стандарта для учета потребностей национальной экономики Российской Федерации и особенностей российской национальной стандартизации, выделены в тексте стандарта курсивом*.
_______________
* В бумажном оригинале обозначения и номера стандартов и нормативных документов в разделах "Предисловие", "Библиография" и приложении Д приводятся обычным шрифтом, остальные по тексту документа выделены курсивом. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомления и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
Введение
Общие положения
Данный стандарт определяет принципы и требования "Правил производства лекарственных средств" (GMP) для систем обеспечения качества при производстве материалов первичной упаковки лекарственных средств. Реализация принципов GMP при производстве и контроле первичной упаковки имеет большое значение для безопасности лекарственных средств, так как упаковочные материалы находятся в прямом контакте с ними. Применение принципов GMP должно обеспечить соответствие данных упаковочных материалов всем требованиям производства лекарственных средств.
Стандарт ИСО 15378 был подготовлен Техническим комитетом ИСО/ТК 76 "Аппараты для переливания крови, вливаний и инъекций медицинского назначения".
Данный стандарт содержит требования ГОСТ Р ИСО 9001-2008.
В стандарте использованы следующие обозначения:
- пункты и подпункты, являющиеся цитатами из ГОСТ Р ИСО 9001-2008, даны в рамках;
- текст, выделенный курсивом, соответствует дополнительным требованиям GMP к материалам для первичной упаковки;
- термины и определения GMP включены в раздел 3 (источник указан в квадратных скобках).
_______________
* ТК 458 не несет ответственность за содержание разделов ГОСТ Р ИСО 9001-2008, приведенных в данном стандарте в рамках.
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Для создания системы менеджмента качества необходимо стратегическое решение организации. На разработку и внедрение системы менеджмента качества организации влияют: а) ее внешняя среда, изменения или риски, связанные с этой средой; b) изменяющиеся потребности; с) конкретные цели; d) выпускаемая продукция; е) применяемые процессы; f) размер и структура организации. Настоящий стандарт не предполагает единообразия в структуре систем менеджмента качества или документации. Требования к системе менеджмента качества, установленные настоящим стандартом, являются дополняющими по отношению к требованиям к продукции. Информация, обозначенная как "Примечание", носит характер методических указаний для понимания или разъяснения соответствующего требования. Настоящий стандарт может использоваться внутренними и внешними сторонами, включая органы по сертификации, в целях оценки способности организации выполнять требования потребителей, требования к продукции, являющиеся обязательными к исполнению в соответствии с действующим законодательством (далее - обязательные требования), и собственные требования. При разработке настоящего стандарта были учтены принципы менеджмента качества, установленные в ИСО 9000:2005 и ИСО 9004:2001. |
Основной целью данного стандарта является определение гармонизированных требований к материалам для первичной упаковки. Стандарт включает некоторые специальные требования к материалам для первичной упаковки, содержащиеся в правилах GMP для производства лекарственных средств, их контроля и т.д.
Процессный подход
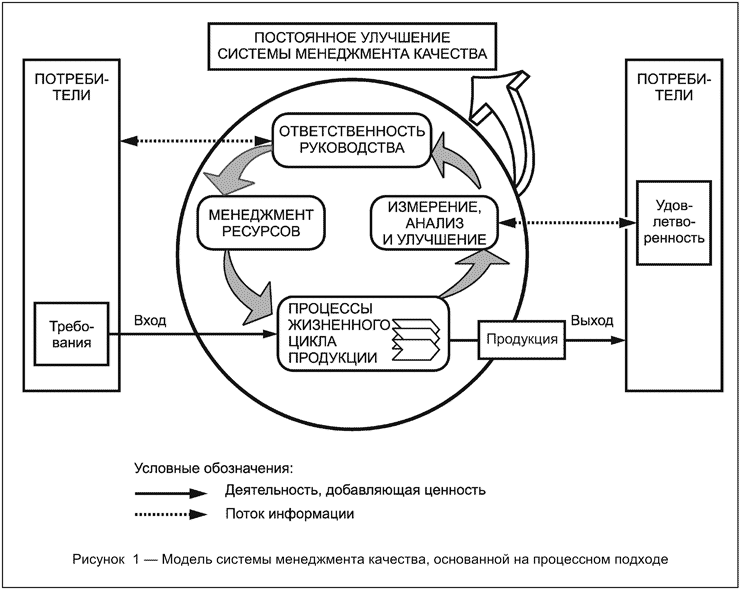
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Настоящий стандарт направлен на применение "процессного подхода" при разработке, внедрении и улучшении результативности системы менеджмента качества в целях повышения удовлетворенности потребителей путем выполнения их требований. Для успешного функционирования организация должна определять и осуществлять менеджмент многочисленных взаимосвязанных видов деятельности. Деятельность, использующая ресурсы и управляемая в целях преобразования входов в выходы, может рассматриваться как процесс. Часто выход одного процесса образует непосредственно вход следующего. Применение в организации системы процессов наряду с их идентификацией и взаимодействием, а также менеджмент процессов, направленный на получение желаемого результата, могут быть определены как "процессный подход". Преимущество процессного подхода состоит в непрерывности управления, которое он обеспечивает на стыке отдельных процессов в рамках их системы, а также при их комбинации и взаимодействии. При применении в системе менеджмента качества такой подход подчеркивает важность: а) понимания и выполнения требований; b) необходимости рассмотрения процессов с точки зрения добавляемой ими ценности; с) достижения запланированных результатов выполнения процессов и обеспечения их результативности; d) постоянного улучшения процессов, основанного на объективном измерении. Приведенная на рисунке 1 модель системы менеджмента качества, основанной на процессном подходе, иллюстрирует связи между процессами, представленными в разделах 4-8. Эта модель показывает, что потребители играют существенную роль в установлении требований, рассматриваемых в качестве входов. Мониторинг удовлетворенности потребителей требует оценки информации о восприятии потребителями выполнения их требований. Приведенная на рисунке 1 модель охватывает все основные требования настоящего стандарта, но не показывает процессы на детальном уровне. Примечание - Кроме того, ко всем процессам может быть применен цикл "Plan - Do - Check - Act" (PDCA). Цикл PDCA можно кратко описать так: - планирование (plan) - разработка целей и процессов, необходимых для достижения результатов в соответствии с требованиями потребителей и политикой организации; - осуществление (do) - внедрение процессов; - проверка (check) - постоянные контроль и измерение процессов и продукции в сравнении с политикой, целями и требованиями на продукцию и сообщение о результатах; - действие (act) - принятие действий по постоянному улучшению показателей процессов. |
Связь с ИСО 9004
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования ИСО 9001 и ИСО 9004 являются стандартами на системы менеджмента качества, которые дополняют друг друга, но их можно применять также независимо. ИСО 9001 устанавливает требования к системе менеджмента качества, которые могут быть использованы для внутреннего применения организациями, а также в целях сертификации или заключения контрактов. Стандарт направлен на результативность системы менеджмента качества при выполнении требований потребителей и соответствующих законодательных и других обязательных требований. Ко времени публикации стандарта ИСО 9001:2008 стандарт ИСО 9004 находился на стадии пересмотра. Новая версия ИСО 9004 будет содержать рекомендации для менеджмента по достижению устойчивого успеха любой организации в сложной, требовательной и постоянно изменяющейся среде. ИСО 9004 представляет более широкий взгляд на менеджмент качества, чем ИСО 9001; он нацеливает на удовлетворение потребностей и ожиданий всех заинтересованных сторон на основе систематического и постоянного улучшения деятельности организации. Однако этот стандарт не предназначен для целей сертификации, заключения контрактов и выполнения обязательных требований. |
Совместимость с другими системами менеджмента
Стандарт включает требования ГОСТ Р ИСО 9001-2008 и дополнительно частные требования к материалам для первичной упаковки в соответствии с правилами производства и контроля качества лекарственных средств.
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования При разработке настоящего стандарта должное внимание было уделено положениям ИСО 14001:2004 для улучшения совместимости этих двух стандартов в интересах сообщества пользователей. Приложение А показывает соответствие между ИСО 9001:2008 и ИСО 14001:2004. Настоящий стандарт не содержит конкретных требований к другим системам менеджмента, таким, как менеджмент охраны окружающей среды, менеджмент профессионального здоровья и безопасности, финансовый менеджмент или менеджмент рисков. Однако стандарт позволяет организации согласовать или интегрировать свою собственную систему менеджмента качества с другими системами менеджмента с соответствующими требованиями. Организация может адаптировать действующую(ие) систему(ы) менеджмента для создания системы менеджмента качества, соответствующей требованиям настоящего стандарта. |
1 Область применения
1.1 Общие положения
Стандарт устанавливает требования к системе обеспечения качества при производстве первичных упаковочных материалов для лекарственных средств с учетом требований потребителя и нормативных документов.
Словосочетание "при необходимости", используемое в настоящем стандарте, означает, что требование следует выполнять, за исключением случаев, когда ненужность этого требования подтверждена документально.
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Настоящий стандарт устанавливает требования к системе менеджмента качества в тех случаях, когда организация: а) нуждается в демонстрации своей способности всегда поставлять продукцию, отвечающую требованиям потребителей и соответствующим обязательным требованиям; b) ставит своей целью повышение удовлетворенности потребителей посредством эффективного применения системы менеджмента качества, включая процессы постоянного ее улучшения, и обеспечение соответствия требованиям потребителей и соответствующим обязательным требованиям. Примечания 1 В настоящем стандарте термин "продукция" применим только: а) к предназначаемой для потребителя или затребованной им продукции; b) к любым заданным результатам процессов жизненного цикла. 2 Законодательные и другие обязательные требования могут быть выражены как правовые требования. |
1.2 Применение
Стандарт применяется при разработке, изготовлении и поставке первичных упаковочных материалов для лекарственных средств, а также для целей сертификации.
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Требования настоящего стандарта являются общими и предназначены для применения всеми организациями независимо от их вида, размера и поставляемой продукции. Если какое-либо требование(я) настоящего стандарта нельзя применить вследствие специфики организации и ее продукции, допускается его исключение. При допущенных исключениях заявления о соответствии настоящему стандарту приемлемы, если эти исключения подпадают под требования раздела 7 и не влияют на способность или ответственность организации обеспечивать продукцией, отвечающей требованиям потребителей и соответствующим обязательным требованиям. |
2 Нормативные ссылки
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Указанный ниже ссылочный документ необходим для использования настоящего стандарта. Для датированных ссылок применяют только ту версию, которая была упомянута в тексте. Для недатированных ссылок необходимо использовать самое последнее издание документа (включая любые поправки). ИСО 9000:2005 Системы менеджмента качества. Основные положения и словарь |
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования
ГОСТ Р ИСО 14644-1-2002 Чистые помещения и связанные с ними контролируемые среды. Часть 1. Классификация чистоты воздуха
ГОСТ Р ИСО 14644-2-2007* Чистые помещения и связанные с ними контролируемые среды. Часть 2. Требования к контролю и мониторингу для подтверждения постоянного соответствия ГОСТ Р ИСО 14644-1
_______________
* На территории Российской Федерации действует ГОСТ Р ИСО 14644-2-2001 (Указатель "Национальные стандарты" 2010 год). - .
ГОСТ Р ИСО 14644-3-2007 Чистые помещения и связанные с ними контролируемые среды. Часть 3. Методы испытаний
ГОСТ Р ИСО 14644-4-2002 Чистые помещения и связанные с ними контролируемые среды. Часть 4. Проектирование, строительство и ввод в эксплуатацию
ГОСТ Р ИСО 14644-5-2005 Чистые помещения и связанные с ними контролируемые среды. Часть 5. Эксплуатация
3 Термины и определения
В настоящем документе используются термины и определения ГОСТ Р ИСО 9000, а также следующие.
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования В настоящем стандарте применяют термины и определения, данные в ИСО 9000. В тексте настоящего стандарта термин "продукция" может означать также "услугу". |
Примечания
1 Дополнительно в данном стандарте использованы термины субподрядчик (см. 3.61) и субподряд (см. 3.34).
2 Термин "субподрядчик" может использоваться вместо термина "поставщик".
Другие термины и определения настоящего стандарта отражают специфику производства первичных упаковочных материалов для лекарственных средств:
3.1 воздушный шлюз* (air-lock): Ограниченное пространство с двумя или несколькими дверями между двумя или несколькими помещениями (например, различных классов чистоты), предназначенное для разделения воздушных сред помещений при входе в них. Воздушный шлюз служит для перехода персонала или перемещения материалов.
_______________
* Определение дано по ГОСТ Р 52249-2009 (прим. ТК 458).
3.2 утвержденный (approved): Имеющий статус соответствия.
Примечание - Соответствие может подтверждаться на любом этапе (для исходных материалов, для характеристик процессов, для материала упаковки, для готовой продукции).
3.3 сборка (assembly): Соединение вместе материалов первичной упаковки и/или их частей.
Примечание - Например, сборка пипеток, сборка систем для инъекций, установка игл на предварительно наполненные шприцы.
3.4 автоматический контроль (automated inspection): Оценка соответствия, осуществляемая оборудованием без участия человека.
Примечание - Оборудование может включать в себя оптоэлектронные элементы (камеры), лазерные системы, ультразвуковые системы и системы анализа данных и др.
3.5 серия (batch, lot): Определенное количество первичных упаковочных материалов (3.35.1), изготовленных в ходе одного или нескольких процессов, имеющих неизменные характеристики и стабильное качество.
Примечания
1 Для удовлетворения требований потребителя серия может быть разделена на подсерии, объединенные впоследствии в однородную серию продукции.
2 При непрерывном производстве понятие серии должно относиться к определенной части продукции, характеризуемой однородностью.
3.6 протокол на серию* (batch document, batch record): Документ, отражающий процесс производства каждой серии продукции, в т.ч. разрешение на ее реализацию, и все факторы, имеющие отношение к качеству готовой продукции.
_______________
* Определение дано по ГОСТ Р 52249-2009 (прим. ТК 458).
3.7 номер серии* (batch number, lot number): Определенное сочетание цифр и/или букв, обозначающее серию продукции.
_______________
* Определение дано по ГОСТ Р 52249-2009 (прим. ТК 458).
3.8 выпуск серии (batch release): Решение о выпуске серии для продажи или поставки, принятое на основе рассмотрения протокола на серию в отделе качества или представителем отдела качества.
3.9 калибровка (поверка)* (calibration): Операции, устанавливающие при определенных условиях зависимость между значениями, регистрируемыми контрольно-измерительными приборами (системами) и соответствующими стандартными величинами (эталонами).
_______________
* Определение дано по ГОСТ Р 52249-2009 (прим. ТК 458).
3.10 контроль изменений (change control): документированный контроль изменений.
Примечание - Изменения могут включать в себя, например, изменения исходных материалов, инструкций, условий производства, оборудования, производственных процессов и методов контроля.
3.11 чистое помещение (cleanroom): Помещение, в котором контролируется концентрация взвешенных в воздухе частиц, построенное и используемое так, чтобы свести к минимуму поступление, выделение и удержание частиц внутри помещения, и позволяющее, по мере необходимости, контролировать другие параметры, например температуру, влажность и давление [ГОСТ ИСО 14644-1, 2.1.1].
3.12 чистая зона (clean zone): Пространство, в котором контролируется концентрация взвешенных в воздухе частиц, построенное и используемое так, чтобы свести к минимуму поступление, выделение и удержание частиц внутри зоны, и позволяющее, по мере необходимости, контролировать другие параметры, например температуру, влажность и давление [ГОСТ ИСО 14644-1, 2.1.2].
Примечание - Чистая зона может быть открытой или замкнутой и находиться как внутри, так и вне чистого помещения.
3.13 загрязнение (contamination): Содержание любого постороннего вещества в первичном упаковочном материале.
Примечания
1 Готовая продукция может быть загрязнена частицами, химическими или биологическими (био- или эндотоксинами) загрязнениями.
2 Загрязнение может произойти из воздуха в ходе производства, упаковки, хранения и/или поставки по вине персонала, от оборудования, материалов, контейнеров и мест промежуточного хранения.
3.14 контролируемая среда (controlled area, controlled environment): Среда, созданная и эксплуатируемая таким образом, чтобы контролировать уровень потенциальных источников загрязнения.
Примечания
1 Данная среда используется для контроля уровня потенциальных источников загрязнения и последствий случайного загрязнения живыми организмами.
2 Создание перепада давления является эффективным методом удаления загрязнений из воздуха, недопущения попадания загрязнений в контролируемую среду и устранения последствий случайного загрязнения.
3.15 перекрестное загрязнение* (cross-contamination, mix-up contamination): Загрязнение материалов или продукции другими материалами или продукцией.
_______________
* Определение дано по ГОСТ Р 52249-2009 (прим. ТК 458).
3.16 претензия потребителя (customer complaint): Информация от потребителя о недостатках и/или несоответствиях.
Примечания
1 Информация может быть передана как устно, так и письменно.
2 Предметом информации могут являться качество, количество или условия поставки первичного упаковочного материала.
3.17 дата изготовления (date of manufacture): Дата начала изготовления, упаковки или поставки продукции, которая может устанавливаться по согласованию с потребителем.
3.18 отклонение (deviation): Отступление от требований инструкций или стандартов.
3.19 инструкция (documented procedure): Утвержденная, документированная процедура, рабочие инструкции или инструкции по проверке при производстве и контроле.
3.20 повторный контроль (double-check): Контроль процесса, результата или протокола, выполненный вторым лицом или системой.
Примечание - Повторный контроль может быть частью процесса аттестации. Протокол повторной проверки подписывается вторым лицом.
3.21 срок годности (expiration date): Допустимый интервал времени до использования продукции. См. срок хранения (3.56).
Примечание - Под этим подразумевается срок, в течение которого материал первичной упаковки остается пригодным для использования при условии правильного хранения.
3.22 выходной контроль (final inspection): Контроль готовой продукции для установления ее соответствия требованиям спецификации.
3.23 готовая продукция (finished product): Первичный упаковочный материал, прошедший все этапы производства.
3.24 Good Manufacturing Practice, GMP: Правила производства лекарственных средств.
Примечания
1 Для определений контроля и обеспечения качества см. также ГОСТ Р ИСО 9000 (3.2.10 и 3.2.11).
2 Требования GMP даны в ГОСТ Р 52249.
3 Правила GMP для первичных упаковочных материалов устанавливают дополнительные требования к помещениям, персоналу, оборудованию, системе обеспечения качества, включая входной контроль, производство, документацию, гигиену, выходной контроль, документацию по реализации продукции, анализ претензий потребителей и порядок самоинспекций.
4 Термины "правила GMP" и "текущие правила GMP (c GMP)" эквивалентны. Правила GMP постоянно обновляются, что иногда обозначают как c GMP.
3.25 однородность, гомогенность (homogeneity): Единообразие значений характеристик материала для его определенного количества.
Примечание - Однородность может включать единообразие только по определенным наиболее существенным характеристикам.
3.26 внутрипроизводственный контроль* (in-process control): Контроль, выполняемый в ходе технологического процесса с целью проверки соответствия продукции заданным требованиям, по результатам которого может выполняться корректировка параметров технологического процесса. Контроль состояния окружающей среды или оборудования рассматривается как элемент внутрипроизводственного контроля.
_______________
* Определение дано по ГОСТ Р 52249-2009 (прим. ТК 458).
3.27 промежуточный продукт* (intermediate product): Частично обработанный материал, который должен пройти дальнейшие стадии производства, прежде чем он станет нерасфасованным готовым продуктом.
_______________
* Определение дано по ГОСТ Р 52249-2009 (прим. ТК 458).
3.28 очистка оборудования (line clearance): Удаление всего, что связано с предыдущим производством.
Примечание - Очистка оборудования выполняется для предотвращения ошибок и перекрестного загрязнения. При этом требуется удаление материалов, отходов, продуктов, образцов, документов и т.п., которые были использованы в предыдущем производстве. Очистка проводится до подачи материалов, продуктов, образцов, документов и т.п. нового производства.
3.29 производство* (manufacturing): Все операции и виды контроля, связанные с получением, приемкой и обработкой исходных материалов, упаковкой, выпуском в реализацию, хранением и отгрузкой лекарственных средств.
_______________
* Определение дано по ГОСТ Р 52249-2009 (прим. ТК 458).
3.30 лекарственное средство* (medicinal product): Любое вещество или комбинация веществ, предназначенное для лечения или профилактики заболеваний у человека или животных. Любое вещество или комбинация веществ, вводимое человеку или животным с диагностическими целями для восстановления, корректировки или изменения физиологических функций человека или животных, также рассматривается как лекарственное средство.
_______________
* Определение дано по ГОСТ Р 52249-2009 (прим. ТК 458).
3.31 организация (organization): Предприятие, производящее материалы для первичной упаковки*.
_______________
* В контексте данного стандарта (прим. ТК 458).
3.32 разработка внешнего вида упаковки (origination, artwork): Все подготовительные работы перед печатными работами.
Примечание - Эти работы включают разработку концепции, дизайна, графических материалов, пленок, клише и цифровых файлов.
3.33 выход за пределы спецификаций (out of specification, OOS): Результаты контроля, не соответствующие требованиям спецификаций.
3.34 субподряд (outsourcing): Передача всего процесса или его части на исполнение другой организации.
3.35 упаковочные материалы (packaging materials):
3.35.1 первичные упаковочные материалы (primary packaging materials): Упаковочные материалы, которые применяются для помещения, герметизации или дозирования лекарственных средств и находятся в прямом контакте с ними.
Примечания
1 Первичными упаковочными материалами могут быть, например, стекло, резина, пластмассы, алюминий, пленка, фольга и пр. Может использоваться комбинация материалов (например, шприцы, аэрозольные баллоны).
2 Настоящий стандарт распространяется также на материалы для первичной упаковки, находящиеся в непродолжительном контакте с лекарственным средством, например пипетки и шприцы.
3 На первичные упаковочные материалы могут наноситься печатная информация и декоративные элементы.
3.35.2 вторичные упаковочные материалы (secondary packaging materials): Упаковочные материалы, не вступающие в контакт с лекарственным средством, например картон, этикетки, бумага, обертки и пр.
3.36 сопутствующие материалы (process aids): Материалы, используемые в технологическом процессе.
Примечание - Эти материалы не входят в состав изделия и должны быть удалены перед или в ходе завершающей стадии производства.
Пример - Остатки, образующиеся при литье, сжатый воздух, смазка.
3.37 технологический процесс (production): Процесс, результатом которого является первичный упаковочный материал.
Примечание - Этот процесс включает в себя все операции, начиная от приема исходных материалов и заканчивая готовой продукцией.
3.38 аттестация (qualification process): Подтверждение соответствия заданным требованиям.
Примечание - Аттестация (см. 3.64) включает аттестацию проекта (конструкторской документации), пуско-наладочные испытания (аттестацию установленного оборудования, аттестацию функционирующего оборудования и аттестацию в эксплуатации), а также повторные аттестации (при необходимости). Данные работы могут проводиться одновременно, а также с использованием предшествующих материалов.
3.39 контроль качества (quality control): Часть управления качеством, связанная с проверкой выполнения требований к качеству.
Примечание - Контроль качества включает в себя проверки и испытания на соответствие требованиям спецификаций.
3.40 критический параметр (quality critical): Параметр, влияющий на качество материала для первичной упаковки.
Примечание - Материал, операция, условия процесса, требования к испытаниям и другие параметры могут рассматриваться как критические в случае, если их невыполнение приводит к существенному ущербу.
3.41 отдел качества (quality unit): Отдел в организации, на который возложена ответственность по обеспечению и контролю качества.
Примечание - Отдел качества может состоять из подразделений по обеспечению и контролю качества и может зависеть от размера и структуры организации.
3.42 карантин* (quarantine): Статус исходных или упаковочных материалов, промежуточной, нерасфасованной или готовой продукции, изолированных физически или иным образом до вынесения решения об их выпуске или отклонении.
_______________
* Определение дано по ГОСТ Р 52249-2009 (прим. ТК 458).
3.43 реализация (realization): Общий термин, определяющий все процессы для достижения желаемых результатов от разработки до поставки.
3.44 сопоставление; выход продукции* (reconciliation): Сравнение ожидаемого и фактического объемов произведенной или использованной продукции с учетом стандартных отклонений.
_______________
* Определение дано по ГОСТ Р 52249-2009 (прим. ТК 458).
3.45 пересмотр условий (reconditioning): Изменения, вносимые в процессы, для обеспечения соответствия требованиям спецификаций.
3.46 отклоненный (rejected): Статус исходных материалов, сопутствующих материалов, промежуточной или готовой продукции, результаты испытаний которых не удовлетворяют одному или более требованиям спецификаций и которые сочтены (обычно отделом качества) не пригодными для использования.
3.47 отклонение (rejection): Процесс установления, выполняемый обычно отделом качества, того, что исходные материалы, сопутствующие материалы, промежуточная или готовая продукция не пригодны для использования.
3.48 переработка (reprocessing): Повторение части технологического процесса.
Примечание - Продолжение технологического процесса после того, как внутрипроизводственный контроль показал, что процесс не завершен, является нормальной практикой и не относится к переработке.
3.49 архивные образцы (retained samples): Материалы или готовая продукция, сохраненные для сравнения в будущем.
Примечание - Эти образцы обычно отбираются в достаточном количестве и хранятся в определенных условиях в течение заданного времени.
3.50 возврат (return): Процесс отправки первичных упаковочных материалов обратно в организацию.
3.51 переделка (rework): Действие, предпринятое в отношении несоответствующей продукции для того, чтобы она соответствовала требованиям [ГОСТ Р ИСО 9000, 3.6.7].
Примечание - Сортировка может рассматриваться как доработка.
3.52 анализ риска (risk analysis): Систематическое использование информации для выявления опасности и количественной оценки риска [Руководство ИСО/МЭК 51, 3.10].
3.53 оценка риска (risk assessment): Общий процесс анализа риска и оценивания риска [Руководство ИСО/МЭК 51, 3.12].
3.54 оценивание риска (risk evaluation): Основанная на результатах анализа риска процедура проверки, устанавливающая, не превышен ли допустимый риск [Руководство ИСО/МЭК 51, 3.11].
3.55 менеджмент риска (risk management): Систематическое применение политики, процедур и практических методов менеджмента для решения задач анализа, оценивания и управления риском [ГОСТ Р ИСО 14971*, 2.18].
_______________
* На территории Российской Федерации с 01.01.2011 г. действует ГОСТ Р ИСО 14971-2009. - .
3.56 срок хранения (shelf-life): Период времени, в течение которого первичные упаковочные материалы должны соответствовать требованиям спецификации при выполнении установленных условий хранения и по истечении которого материалы не должны быть использованы (см. срок годности, 3.21).
3.57 спецификация (specification): Документ, устанавливающий требования.
3.58 инструкция, методика (standard operating procedure, SOP): Инструкция по выполнению операций или проведению контроля.
3.59 исходный материал (starting material): Сырье, компоненты, субстанции, используемые в производстве первичных упаковочных материалов.
3.60 стерильность (sterile): Отсутствие живых микроорганизмов [ИСО 14937:2000, 3.24].
3.61 субподрядчик (subcontractor): Третья сторона, которая выполняет часть или всю работу по изготовлению первичных упаковочных материалов.
3.62 обработка поверхности (surface treatment): Процесс, направленный на улучшение поверхности материалов для первичной упаковки.
Пример - Покрытие силиконом и другая обработка поверхности стекла, покрытие внутренней или внешней поверхности стеклянных контейнеров или резиновых частей.
3.63 прослеживаемость (traceability): Возможность проследить историю, применение или местонахождение того, что рассматривается.
Примечания
1 Прослеживаемость применительно к продукции может относиться к:
- происхождению материалов и комплектующих;
- истории обработки;
- распределению и местонахождению продукции после поставки.
2 В области метрологии принято определение, приведенное в VIM - 1993, 6.10. [ГОСТ Р ИСО 9000:2008*, 3.5.4].
_______________
* Соответствует оригиналу. - .
3.64 аттестация, испытания* (validation): Доказательство того, что методика, процесс, оборудование, материал, операция или система соответствуют заданным требованиям и их использование действительно дает ожидаемые результаты (см. также 3.38).
_______________
* Определение дано по ГОСТ Р 52249-2009 (прим. ТК 458).
3.65 верификация (verification): Синоним терминов аттестация (3.38) и испытания (3.64).
4 Система обеспечения качества
4.1 Общие требования
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна разработать, задокументировать, внедрить и поддерживать в рабочем состоянии систему менеджмента качества, постоянно улучшать ее результативность в соответствии с требованиями настоящего стандарта. Организация должна: а) определять процессы, необходимые для системы менеджмента качества, и их применение во всей организации (1.2); b) определять последовательность и взаимодействие этих процессов; с) определять критерии и методы, необходимые для обеспечения результативности как при осуществлении этих процессов, так и при управлении ими; d) обеспечивать наличие ресурсов и информации, необходимых для поддержки этих процессов и их мониторинга; е) осуществлять мониторинг, измерение, там, где это возможно, и анализ этих процессов; f) принимать меры, необходимые для достижения запланированных результатов и постоянного улучшения этих процессов. |
g) описать общую политику цели и подход к обеспечению качества продукции.
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна осуществлять менеджмент процессов, необходимых для системы менеджмента качества, в соответствии с требованиями настоящего стандарта. Если организация решает передать сторонней организации выполнение какого-либо процесса, влияющего на соответствие продукции требованиям, она должна обеспечить со своей стороны управление таким процессом. Вид и степень управления процессами, переданными сторонним организациям, должны быть определены в системе менеджмента качества. Примечания 1 Упомянутые выше процессы, необходимые для системы менеджмента качества, включают в себя процессы управленческой деятельности руководства, обеспечения ресурсами, процессы жизненного цикла продукции, измерения, анализа и улучшения. 2 Процесс, переданный другой организации, является процессом, необходимым для системы менеджмента организации, но по выбору организации выполняемым внешней для нее стороной. 3 Обеспечение управления процессами, переданными сторонним организациям, не освобождает организацию от ответственности за соответствие всем требованиям потребителей и обязательным требованиям. Выбор вида и степени управления процессом, переданным сторонней организации, зависит от таких факторов, как: а) возможное влияние переданного сторонним организациям процесса на способность организации поставлять продукцию, соответствующую требованиям; b) степень участия в управлении процессом, переданным сторонней организации; с) возможность обеспечения необходимого управления посредством применения требований 7.4. |
4.2 Требования к документации
4.2.1 Общие требования
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Документация системы менеджмента качества должна включать в себя: а) документально оформленные заявления о политике и целях в области качества; b) руководство по качеству; с) документированные процедуры и записи, требуемые настоящим стандартом; d) документы, включая записи, определенные организацией как необходимые ей для обеспечения эффективного планирования, осуществления процессов и управления ими; Примечания 1 Там, где в настоящем стандарте встречается термин "документированная процедура", это означает, что процедура разработана, документально оформлена, внедрена и поддерживается в рабочем состоянии. Один документ может содержать требования одной или более процедуры. Требование о наличии документированной процедуры может быть реализовано более чем одним документом. 2 Степень документированности системы менеджмента качества одной организации может отличаться от степени документированности другой в зависимости: а) от размера организации и вида деятельности; b) сложности и взаимодействия процессов; с) компетентности персонала. 3 Документация может быть в любой форме и на любом носителе. |
4 В настоящем стандарте используются термины "инструкция", "методика", являющиеся переводом на русский язык английского термина "standard operating procedure - SOP".
4.2.1.1 Организация должна документально оформить свою общую политику, цели и подход к аттестации.
4.2.2 Руководство по качеству
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна разработать и поддерживать в рабочем состоянии руководство по качеству, содержащее: а) область применения системы менеджмента качества, включая подробности и обоснование любых исключений (1.2); b) документированные процедуры, разработанные для системы менеджмента качества, или ссылки на них; с) описание взаимодействия процессов системы менеджмента качества. |
4.2.2.1 Организация должна определить степень применимости настоящего стандарта к ее деятельности.
Примечание - Организация может определить, что стандарт применим ко всей ее продукции или только к продукции фармацевтического назначения.
4.2.2.2 Руководство по качеству должно определить структуру документации системы обеспечения качества.
4.2.3 Документация
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Документы системы менеджмента качества должны быть управляемыми. Записи, представляющие собой специальный вид документов, должны быть управляемыми согласно требованиям 4.2.4. Для определения необходимых средств управления должна быть разработана документированная процедура, предусматривающая: а) официальное одобрение документов с точки зрения их достаточности до выпуска; b) анализ и актуализацию по мере необходимости и повторное официальное одобрение документов; с) обеспечение идентификации изменений и статуса пересмотра документов; d) обеспечение наличия соответствующих версий документов в местах их применения; е) обеспечение сохранения документов четкими и легко идентифицируемыми; f) обеспечение идентификации и управление рассылкой документов внешнего происхождения, определенных организацией как необходимые для планирования и функционирования системы менеджмента качества; g) предотвращение непреднамеренного использования устаревших документов и применение соответствующей идентификации таких документов, оставленных для каких-либо целей. |
4.2.3.1 Внесение изменений в документы и их утверждение должны выполняться в установленном порядке.
4.2.3.2 Организация должна определить срок хранения копий отмененных документов (см. также 4.2.4.8).
4.2.3.3 При использовании электронных подписей на документах следует ввести контроль, обеспечивающий безопасность и соответствие рукописной подписи.
4.2.3.4 Документы должны иметь четкую систему обозначений (например, название/номер документа, версия, количество страниц).
4.2.4 Протоколы серий
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Записи, установленные для представления свидетельств соответствия требованиям и результативного функционирования системы менеджмента качества, должны находиться под управлением. Организация должна установить документированную процедуру для определения средств управления, требуемых при идентификации, хранения, защиты, восстановления, сохранения и изъятия записей. Записи должны оставаться четкими, легко идентифицируемыми и восстанавливаемыми. |
Примечание - Протоколы серий содержат данные, относящиеся к производству серии, а также данные о любых отклонениях и проведенном анализе.
4.2.4.1 На протоколы, выполняемые в электронной форме, распространяются те же требования, что и на другие протоколы (см. 4.2.4 и 7.5.2.9).
4.2.4.2 Протоколы должны быть четкими, нестираемыми и осуществляться сразу же по выполнении работы (в порядке ее выполнения), должны иметь дату, инициалы и подпись лица, оформившего протокол. Исправления в протоколах должны иметь дату, инициалы и подпись, а также, при необходимости, содержать обоснование исправления, при этом первоначальная запись должна оставаться читаемой.
4.2.4.3 Организация должна определить критические для качества процессы и параметры, где необходим повторный контроль при выпуске серии. Если какой-либо контроль выполняется с помощью электронных средств, то это должно быть ясно указано.
4.2.4.4 Каждая критическая для качества операция или параметр при производстве и контроле должны быть определены и подлежат повторному контролю.
4.2.4.5 Для каждой серии первичного упаковочного материала организация должна вести и поддерживать в рабочем состоянии документы, достаточные для прослеживаемости и определения количества произведенных и принятых к выпуску материалов.
4.2.4.6 Организация должна определить параметры в документации серии, которые подлежат проверке.
4.2.4.7 Документация на серию должна быть проверена и утверждена.
4.2.4.8 Все документы о производстве, контроле, испытаниях, поставке и исследованиях должны храниться, по меньшей мере, в течение пяти лет после производства или по согласованию с потребителем, или, по крайней мере, один год после истечения срока годности материала для первичной упаковки, установленного организацией, если иное не согласовано с потребителем.
Примечание - Может потребоваться хранить записи о материалах для первичной упаковки до конца срока хранения лекарственных средств, как установлено потребителем.
5 Ответственность руководства
5.1 Обязательства руководства
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Высшее руководство должно обеспечивать наличие свидетельств принятия своих обязательств по разработке и внедрению системы менеджмента качества, а также постоянному улучшению ее результативности посредством: а) доведения до сведения персонала организации важности выполнения требований потребителей, а также законодательных и обязательных требований; b) разработки политики в области качества; с) обеспечения разработки целей в области качества; d) проведения анализа со стороны руководства; е) обеспечения необходимыми ресурсами. |
5.2 Ориентация на потребителя
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Высшее руководство должно обеспечивать определение и выполнение требований потребителей для повышения их удовлетворенности (7.2.1 и 8.2.1). |
5.2.1 Аудиты со стороны потребителя
Организация должна разрешить потребителю или его представителям (по взаимному согласию) проводить аудиты для оценки системы менеджмента качества.
Основные требования потребителя к организации включают в себя наличие необходимых помещений и оборудования, подготовленного персонала и процессов, построенных так, чтобы обеспечить безопасность продукции и исключить перекрестное загрязнение, которые обеспечивают стабильное производство продукции в соответствии с требованиями потребителя.
5.3 Политика в области качества
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Высшее руководство должно обеспечивать, чтобы политика в области качества: а) соответствовала целям организации; b) включала в себя обязательство соответствовать требованиям и постоянно повышать результативность системы менеджмента качества; с) создавала основы для постановки и анализа целей в области качества; d) была доведена до сведения персонала организации и понятна ему; е) анализировалась на постоянную пригодность. |
5.4 Планирование
5.4.1 Цели в области качества
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Высшее руководство организации должно обеспечивать, чтобы цели в области качества, включая необходимые для выполнения требований к продукции [7.1 перечисление а)], были установлены в соответствующих подразделениях и на соответствующих уровнях организации. Цели в области качества должны быть измеримыми и согласуемыми с политикой в области качества. |
5.4.2 Планирование создания и развития системы обеспечения качества
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Высшее руководство должно обеспечивать: а) планирование создания, поддерживания и улучшения системы менеджмента качества для выполнения требований 4.1, а также для достижения целей в области качества; b) сохранение целостности системы менеджмента качества при планировании и внедрении в нее изменений. |
5.5 Ответственность, полномочия и обмен информацией
5.5.1 Ответственность и полномочия
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Высшее руководство должно обеспечивать определение и доведение до сведения персонала организации ответственности и полномочий. |
5.5.1.1 Организация должна иметь образцы подписей (см. 4.2.4) ответственных лиц.
Следует иметь список всех лиц, осуществляющих проверки или повторные проверки, внутрипроизводственный контроль и т.п., с образцами подписей.
5.5.1.2 Отделы качества, которые несут ответственность за принятие критических решений, должны принимать эти решения независимо от производства.
5.5.2 Представитель руководства
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Высшее руководство должно назначить представителя из состава руководства организации, который независимо от других обязанностей должен нести ответственность и иметь полномочия, распространяющиеся: а) на обеспечение разработки, внедрения и поддержания в рабочем состоянии процессов, требуемых системой менеджмента качества; b) представление отчетов высшему руководству о функционировании системы менеджмента качества и необходимости ее улучшения; с) содействие распространению понимания требований потребителей по всей организации. Примечание - В ответственность представителя руководства может быть включено поддержание связи с внешними сторонами по вопросам, касающимся системы менеджмента качества. |
5.5.3 Внутренний обмен информацией
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Высшее руководство должно обеспечивать разработку в организации соответствующих процессов обмена информацией, включая информацию, относящуюся к результативности системы менеджмента качества. |
5.5.3.1 Положения GMP, включенные в настоящий стандарт, и нормативные требования должны, в необходимой степени, быть доведены до сведения каждого подразделения.
5.5.3.2 Руководство предприятия должно быть своевременно информировано о критических ситуациях в области качества.
Примечание - Примерами процессов обмена информацией являются процессы, связанные с обменом информацией о политике в области качества, анализе со стороны руководства, результатах внутренних проверок качества, а также о корректирующих и профилактических действиях.
5.6 Анализ со стороны руководства
5.6.1 Общие положения
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Высшее руководство должно анализировать через запланированные интервалы времени систему менеджмента качества организации в целях обеспечения ее постоянной пригодности, достаточности и результативности. Этот анализ должен включать в себя оценку возможностей улучшений и потребности в изменениях в системе менеджмента качества организации, в том числе в политике и целях в области качества. Записи об анализе со стороны руководства должны поддерживаться в рабочем состоянии (4.2.4). |
5.6.2 Исходные данные для анализа
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Входные данные для анализа со стороны руководства должны включать в себя следующую информацию: а) результаты аудитов (проверок); b) обратную связь от потребителей; с) функционирование процессов и соответствие продукции; d) статус предупреждающих и корректирующих действий; е) последующие действия, вытекающие из предыдущих анализов со стороны руководства; f) изменения, которые могли бы повлиять на систему менеджмента качества; g) рекомендации по улучшению. |
h) данные об эффективности обучения.
5.6.3 Результаты анализа
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Выходные данные анализа со стороны руководства должны включать в себя все решения и действия, относящиеся: а) к повышению результативности системы менеджмента качества и ее процессов; b) улучшению продукции по отношению к требованиям потребителей; с) потребности в ресурсах. |
6 Управление ресурсами
6.1 Обеспечение ресурсами
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна определить и обеспечивать ресурсы, требуемые: а) для внедрения и поддержания в рабочем состоянии системы менеджмента качества, а также постоянного повышения ее результативности; b) повышения удовлетворенности потребителей путем выполнения их требований. |
6.2 Персонал
6.2.1 Общие положения
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Персонал, выполняющий работу, влияющую на соответствие продукции требованиям, должен быть компетентным на основе полученного образования, подготовки, навыков и опыта. Примечание - На соответствие продукции требованиям прямо или косвенно может влиять персонал, выполняющий любую работу в рамках системы менеджмента качества. |
6.2.2 Компетентность, осведомленность и подготовка
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна: а) определять необходимую компетентность персонала, выполняющего работу, которая влияет на соответствие требованиям к качеству продукции; b) где это возможно, обеспечивать подготовку или предпринимать другие действия в целях достижения необходимой компетентности; с) оценивать результативность принятых мер; d) обеспечивать осведомленность своего персонала об актуальности и важности его деятельности и вкладе в достижение целей в области качества; е) поддерживать в рабочем состоянии соответствующие записи об образовании, подготовке, навыках и опыте (4.2.4). |
6.2.2.1 Обучение по GMP
6.2.2.1.1 Следует организовать дополнительное обучение, которое должно проводиться регулярно и включать изучение принципов GMP, а также всех инспекций и факторов, влияющих на качество продукции и на систему обеспечения качества. Такое обучение должно включать в себя рассмотрение:
a) рисков загрязнения и перекрестного загрязнения;
b) потенциальной опасности для конечного пользователя/ пациента в случае загрязнения продукции;
c) влияния любых отклонений от установленных инструкций, процессов или спецификаций на качество продукции для потребителя или конечного пользователя.
6.2.2.1.2 Особое внимание следует уделять обучению персонала, работающего в производстве стерильных материалов или материалов, предназначенных для последующей стерилизации.
6.2.2.1.3 Следует проводить специальное обучение по вопросам предотвращения микробиологического загрязнения и загрязнения частицами, а также потенциальной опасности таких загрязнений для пациента.
6.2.2.1.4 Повторное обучение должно осуществляться через установленные промежутки времени.
6.2.2.2 Временный персонал должен пройти обучение или находиться под наблюдением обученного персонала.
6.2.2.3 В случае привлечения консультантов по вопросам качества следует вести их учет, включая данные об их квалификации и типах оказанных услуг.
6.3 Помещения, оборудование и материальное обеспечение
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна определять, обеспечивать и поддерживать в рабочем состоянии инфраструктуру, необходимую для достижения соответствия требованиям к продукции. Инфраструктура может включать в себя, если применимо: а) здания, рабочее пространство и связанные с ним средства труда; b) оборудование для процессов (как технические, так и программные средства); с) службы обеспечения (такие как транспорт, связь или информационные системы). |
6.4 Производственная среда
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна создавать производственную среду, необходимую для достижения соответствия требованиям к продукции, и управлять ею. Примечание - Термин "производственная среда" относится к условиям, в которых выполняют работу, включая физические, экологические и другие факторы (такие как шум, температура, влажность, освещенность или погодные условия). |
6.4.1 Требования к производственной среде
6.4.1.1 Организация должна установить и документально оформить требования к состоянию здоровья, чистоте, одежде и контролю над доступом персонала в случае, если контакт этого персонала с первичным упаковочным материалом или с производственной средой может негативно сказаться на качестве материала.
6.4.1.2 В случае, если условия производственной среды могут негативно влиять на качество первичного упаковочного материала, организация должна определить требования к производственной среде и разработать систему эффективного наблюдения и управления условиями производственной среды.
6.4.1.3 При необходимости следует установить специальные требования для обращения с загрязненными первичными упаковочными материалами для предотвращения загрязнения других первичных упаковочных материалов, производственной среды или персонала.
6.4.2 Классификация чистых зон/чистых помещений
Чистые зоны (чистые помещения) должны быть классифицированы в соответствии с ГОСТ ИСО 14644-1. Их контроль и эксплуатация должны быть организованы в соответствии с ГОСТ Р ИСО 14644-2, ГОСТ Р ИСО 14644-3 и ГОСТ Р ИСО 14644-5 или аналогичными документами.
Порядок проектирования, строительства и монтажа чистых помещений приведен в ГОСТ Р ИСО 14644-4.
Контроль биозагрязнений может быть организован в соответствии с ГОСТ Р ИСО 14698-1 и ГОСТ Р ИСО 14698-2.
6.4.3 Факторы риска, влияющие на загрязнения
Организация должна определить и контролировать факторы, которые могут привести к загрязнению первичных упаковочных материалов, например:
a) гигиена и состояние здоровья персонала;
b) одежда персонала, ювелирные украшения (включая пирсинг), косметика;
c) курение, прием пищи, употребление жевательной резинки, напитков, использование лекарственных средств;
d) обращение и утилизация мусора;
e) микробиологическое загрязнение.
6.4.4 Борьба с насекомыми
Следует разработать и внедрить инструкции по борьбе с насекомыми.
6.4.5 Технические и вспомогательные системы
6.4.5.1 Следует провести оценку влияния технических систем (например, подготовки воздуха, пара, газов, воды) на качество первичных упаковочных материалов. Должны храниться документы, относящиеся к такой оценке (см. 4.2.4).
Следует также проводить оценку и других систем и факторов (например, смазки, охлаждающих жидкостей, масла и др.), которые могут случайно войти в контакт с первичными упаковочными материалами.
Может быть рассмотрена возможность использования жидкостей пищевого качества (с учетом фактора риска).
6.4.5.2 При необходимости, для снижения загрязнений следует предусмотреть вентиляцию и местные отсосы. Особое внимание следует уделить системам рециркуляции.
6.4.5.3 Следует задать и выполнять требования к воде, если она находится в прямом контакте с первичными упаковочными материалами, исходными материалами или используется для очистки оборудования, находящегося в прямом контакте с материалами.
6.5 Обслуживание
6.5.1 Организация должна установить требования к техническому обслуживанию (например, для производственных процессов, систем и оборудования) в случае, если такое обслуживание или его отсутствие может влиять на качество продукции.
6.5.2 Следует вести документацию (планы-графики, журналы) технического обслуживания.
6.5.3 Организация должна обеспечить эксплуатацию, уборку и техническое обслуживание помещений и оборудования в соответствии с GMP для исключения загрязнения продукции (включая контроль частиц и микробиологический контроль, при необходимости).
6.5.4 Системы с компьютерным управлением, которые могут влиять на качество первичного упаковочного материала, должны предусматривать контроль при монтаже, эксплуатации, обслуживании, внесении изменений.
6.5.5 Следует поддерживать в рабочем состоянии комплект технической документации на оборудование, оказывающее влияние на качество.
7 Процессы жизненного цикла продукции
7.1 Планирование процессов жизненного цикла продукции
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна планировать и разрабатывать процессы, необходимые для обеспечения жизненного цикла продукции. Планирование процессов жизненного цикла продукции должно быть согласовано с требованиями к другим процессам системы менеджмента качества (4.1). При планировании процессов жизненного цикла продукции организация должна установить, подходящим для нее образом: а) цели в области качества и требования к продукции; b) потребность в разработке процессов и документов, а также в обеспечении ресурсами для конкретной продукции; с) необходимую деятельность по верификации и валидации, мониторингу, измерению, контролю и испытаниям для конкретной продукции, а также критерии приемки продукции; d) записи, необходимые для обеспечения свидетельства того, что процессы жизненного цикла продукции и продукция соответствуют требованиям (4.2.4). Результат этого планирования должен быть представлен в форме, соответствующей практике организации. Примечания 1 Документ, определяющий процессы системы менеджмента качества (включая процессы жизненного цикла продукции) и ресурсы, которые предстоит применять к конкретной продукции, проекту или контракту, может рассматриваться как план качества. 2 При разработке процессов жизненного цикла продукции организация может также применять требования 7.3. |
7.1.1 Следует учитывать особенности непрерывных процессов выпуска первичных упаковочных материалов. Следует также предусмотреть порядок отбора и сохранения в надлежащих условиях архивных образцов продукции.
7.1.2 Организация должна проводить анализ риска на всех этапах жизненного цикла продукции и поддерживать соответствующую документацию в рабочем состоянии.
7.2 Процессы, связанные с потребителями
7.2.1 Определение требований, относящихся к продукции
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна определить: а) требования, установленные потребителями, включая требования к поставке и деятельности после поставки; b) требования, не определенные потребителем, но необходимые для конкретного или предполагаемого использования, когда оно известно; с) законодательные и другие обязательные требования, относящиеся к продукции; d) любые дополнительные требования, рассматриваемые организацией как необходимые. Примечание - Деятельность после поставки может включать в себя действия по гарантийному обеспечению, контрактным обязательствам, таким как услуги по техническому обслуживанию, и дополнительные услуги, как утилизация или полное уничтожение. |
7.2.1.1 Следует определить требования к продукции, включая характер изменений, при которых требуется обязательное уведомление.
7.2.1.2 Следует определить требования потребителя по предотвращению несанкционированного использования отходов первичных упаковочных материалов (включая образцы, полиграфические материалы, этикетки).
7.2.2 Анализ требований, относящихся к продукции
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна анализировать требования, относящиеся к продукции. Этот анализ должен проводиться до принятия организацией обязательства поставлять продукцию потребителю (например, участия в тендерах, принятие контрактов или заказов, принятие изменений к контрактам или заказам) и должен обеспечивать: а) определение требований к продукции; b) согласование требований контракта или заказа, отличающихся от ранее сформулированных; с) способность организации выполнять определенные требования. Записи результатов анализа и последующих действий, вытекающих из анализа, должны поддерживаться в рабочем состоянии (4.2.4). Если потребители не выдвигают документированных требований, организация должна подтвердить их у потребителя до принятия к исполнению. Если требования к продукции изменены, организация должна обеспечить, чтобы соответствующие документы были исправлены, а заинтересованный персонал был поставлен в известность об изменившихся требованиях. Примечание - В некоторых ситуациях, таких как продажи, осуществляемые через Интернет, практически нецелесообразно проводить официальный анализ каждого заказа. Вместо этого анализ может распространяться на соответствующую информацию о продукции, такую как каталоги или другие рекламные материалы. |
7.2.3 Связь с потребителями
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна определять и осуществлять эффективные меры по поддержанию связи с потребителями, касающиеся: а) информации о продукции; b) прохождения запросов, контракта или заказа, включая поправки; с) обратной связи от потребителей, включая жалобы потребителей. |
7.2.3.1 Организация должна разработать и поддерживать систему документированной обратной связи с целью раннего информирования о возможных или существующих проблемах с качеством и учета замечаний потребителей при принятии корректирующих и предупреждающих действий.
7.2.3.2 По требованию потребителя организация должна согласовать перечень изменений, для которых следует получить письменное согласие до их утверждения или требуется только оповещение. Информация о вносимых изменениях должна сообщаться своевременно. Процесс внесения изменений должен быть согласован (см. 7.2.1).
Рекомендуется оформить соглашение между организацией и потребителем о требованиях к продукции и включить в него порядок действий в случае отклонений от установленных требований.
7.3 Проектирование и разработка
7.3.1 Планирование проектирования и разработки
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна планировать проектирование и разработку и управлять этими процессами. В ходе планирования проектирования и разработки организация должна устанавливать: а) стадии проектирования и разработки; b) проведение анализа, верификации и валидации, соответствующих каждой стадии проектирования и разработки; с) ответственность и полномочия в области проектирования и разработки. Организация должна управлять взаимодействием различных групп, занятых проектированием и разработкой, с целью обеспечения эффективной связи и четкого распределения ответственности. Результаты планирования должны актуализироваться, если это необходимо в процессе проектирования и разработки. Примечание - Анализ, верификация и валидация проектирования и разработки имеют разные цели, поэтому их можно проводить и записи по ним вести как отдельно, так и в любых сочетаниях, подходящих для продукции и организации. |
7.3.1.1 Организация должна разработать инструкции по проведению проектных и конструкторских работ. Эти инструкции должны включать в себя оценку риска с учетом соответствующих требований GMP и любых потенциальных опасностей для потребителя и, в особенности, для пациента.
Ответственность за проектирование и оценку риска должна быть согласована между потребителем и организацией.
В процессе проектирования (разработки) следует предусмотреть проверку того, что результат работы соответствует заданным требованиям. Эта проверка должна быть выполнена до завершения разработки.
7.3.2 Исходные данные для проектирования и разработки
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Входные данные, относящиеся к требованиям к продукции, должны быть определены, а записи должны поддерживаться в рабочем состоянии (4.2.4). Входные данные должны включать в себя: а) функциональные и эксплуатационные требования; b) соответствующие законодательные и другие обязательные требования; с) там, где это возможно, информацию, взятую из предыдущих аналогичных проектов; d) другие требования, важные для проектирования и разработки. Входные данные должны анализироваться на достаточность. Требования должны быть полными, недвусмысленными и непротиворечивыми. |
7.3.3 Результат проектирования и разработки
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Выходные данные проектирования и разработки должны быть представлены в форме, подходящей для проведения верификации относительно входных требований к проектированию и разработке, а также должны быть официально одобрены до их последующего использования. Выходные данные проектирования и разработки должны: а) соответствовать входным требованиям к проектированию и разработке; b) обеспечивать соответствующей информацией по закупкам, производству и обслуживанию; с) содержать критерии приемки продукции или ссылки на них; d) определять характеристики продукции, существенные для ее безопасного и правильного использования. Примечание - Информация по производству и обслуживанию может включать в себя подробные данные о сохранении продукции. |
7.3.4 Анализ проекта и разработки
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования На соответствующих стадиях должен проводиться систематический анализ проекта и разработки в соответствии с запланированными мероприятиями (7.3.1) в целях: а) оценивания способности результатов проектирования и разработки удовлетворять требованиям; b) выявления любых проблем и внесения предложений по необходимым действиям. В состав участников такого анализа должны включаться представители подразделений, имеющих отношение к анализируемой(ым) стадии(ям) проектирования и разработки. Записи результатов анализа и всех необходимых действий должны поддерживаться в рабочем состоянии (4.2.4). |
7.3.5 Верификация проекта и разработки
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Верификация должна осуществляться в соответствии с запланированными мероприятиями (7.3.1) с целью удостовериться, что выходные данные проектирования и разработки соответствуют входным требованиям. Записи результатов верификации и всех необходимых действий должны поддерживаться в рабочем состоянии (4.2.4). |
7.3.6 Аттестация проекта и разработки
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Валидация проекта и разработки должна осуществляться в соответствии с запланированными мероприятиями (7.3.1) с целью удостовериться, что полученная в результате продукция соответствует требованиям к установленному или предполагаемому использованию, если оно известно. Где это практически возможно, валидация должна быть завершена до поставки или применения продукции. Записи результатов валидации и всех необходимых действий должны поддерживаться в рабочем состоянии (4.2.4). |
7.3.7 Управление изменениями проекта и разработки
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Изменения проекта и разработки должны быть идентифицированы, а записи должны поддерживаться в рабочем состоянии. Изменения должны быть проанализированы, верифицированы и валидированы соответствующим образом, а также одобрены до внесения. Анализ изменений проекта и разработки должен включать в себя оценку влияния изменений на составные части и уже поставленную продукцию. Записи результатов анализа изменений и любых необходимых действий должны поддерживаться в рабочем состоянии (4.2.4). |
7.3.7.1 Оповещение
Об изменениях, затрагивающих какие-либо ранее представленные данные, необходимо сообщить потребителю и, в случае представления организацией технического досье, непосредственно уполномоченным надзорным органам.
7.3.7.2 Изменения в проекте
В случае внесения изменений следует провести повторную аттестацию измененной документации, при необходимости организовать повышение квалификации персонала.
Примечания
1 Результаты проектирования и разработки могут включать в себя документацию (спецификации, технологические процессы, чертежи, исследовательские отчеты), а также образцы.
2 Конфиденциальная научная и техническая информация (принадлежащая организации) может быть передана в составе досье непосредственно уполномоченному надзорному органу (например, техническое досье).
7.4 Снабжение исходными материалами
7.4.1 Процесс закупок
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна обеспечивать соответствие закупленной продукции установленным требованиям к закупкам. Тип и степень управления, применяемые по отношению к поставщику и закупленной продукции, должны зависеть от ее воздействия на последующие стадии жизненного цикла продукции или готовую продукцию. Организация должна оценивать и выбирать поставщиков на основе их способности поставлять продукцию в соответствии с требованиями организации. Должны быть разработаны критерии отбора, оценки и повторной оценки. Записи результатов оценивания и любых необходимых действий, вытекающих из оценки, должны поддерживаться в рабочем состоянии (4.2.4). |
7.4.1.1 Организация должна утвердить поставщиков:
a) исходных материалов,
b) средств обеспечения процессов, критических для качества,
c) упаковочных материалов для использования в чистых помещениях.
7.4.1.2 Организация должна оповестить потребителя перед тем, как отдавать какую-либо часть процесса производства на субподряд.
7.4.1.3 Все услуги субподрядчиков (включая предоставление исходных материалов, лабораторные услуги, стерилизацию, услуги по калибровке и аттестации, обслуживанию, уборке, транспортированию, контролю над вредителями (насекомыми и пр.) и вывоз мусора), влияющие на качество продукции, следует контролировать с учетом фактора риска.
7.4.1.4 Консультанты по вопросам производства и контроля материалов для первичной упаковки должны рассматриваться как поставщики.
7.4.1.5 Поставщики материалов и услуг, критических для качества, должны быть утверждены отделом качества или представителем отдела качества.
7.4.1.6 Организация должна оценивать и вести записи о компетентности лабораторий, выполняющих работы, критически важные для качества. Организация должна пользоваться услугами только тех лабораторий, которые она признала компетентными для выполнения работ, критически важных для качества.
7.4.1.7 В случае, если процесс стерилизации отдан на субподряд, организация должна убедиться, что процесс соответствует требованиям 7.5.1 и 7.5.2.
7.4.1.8 Изменение поставщиков исходных материалов, критически важных для качества, должно осуществляться в соответствии с инструкцией по внесению изменений.
7.4.2 Информация по закупкам
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Информация по закупкам должна описывать заказанную продукцию, включая, где это необходимо, требования: а) к официальному одобрению продукции, процедур, процессов и оборудования; b) квалификации персонала; с) системе менеджмента качества. Организация должна обеспечивать достаточность установленных требований к закупкам до их сообщения поставщику. |
7.4.2.1 В пределах, необходимых для прослеживаемости, указанных в 7.5.3, организация должна сохранять информацию по снабжению, т.е. документы (см. 4.2.3) и записи (см. 4.2.4).
7.4.3 Контроль за полученными материалами
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна разработать и осуществлять контроль или другую деятельность, необходимую для обеспечения соответствия закупленной продукции установленным требованиям к закупкам. Если организация или ее потребитель предполагают осуществить верификацию у поставщика, то организация должна установить меры по верификации и порядок выпуска продукции в информации по закупкам. |
7.4.3.1 Полученные исходные материалы должны быть физически или административно изолированы до тех пор, пока они не будут допущены к использованию.
Примечание - В исключительных обстоятельствах может быть использован материал, проверка которого не завершена, при условии, что действуют инструкции безопасности, гарантирующие, что произведенные первичные упаковочные материалы не будут выпущены на рынок до тех пор, пока статус исходных материалов не будет подтвержден.
7.4.3.2 Следует хранить документацию по контролю над исходными материалами (см. 4.2.4).
7.4.3.3 Отбор образцов должен производиться по инструкции с использованием оборудования и выполнением мер, позволяющих предотвратить загрязнение.
7.5 Производство и обслуживание
7.5.1 Управление производством и обслуживанием
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна планировать и осуществлять производство и обслуживание в управляемых условиях. Управляемые условия должны включать в себя там, где это применимо: а) наличие информации, описывающей характеристики продукции; b) наличие рабочих инструкций в случае необходимости; с) применение подходящего оборудования; d) наличие и применение контрольного и измерительного оборудования; е) проведение мониторинга и измерений; f) осуществление выпуска, поставки и действий после поставки продукции. |
g) определение даты производства с учетом используемых процессов;
h) особое внимание к операциям маркировки, этикетирования и упаковки с целью эффективного контроля и предотвращения ошибок;
i) инструкцию, определяющую управление отклонениями в процессах. Отклонения, критические для качества, должны быть исследованы, а результаты исследований оформлены документально (см. 4.2.4).
7.5.1.1 Чистота продукции и контроль загрязнения
7.5.1.1.1 Организация должна разработать требования к чистоте первичных упаковочных материалов и методам предотвращения загрязнения оборудования или продукции.
Следует оценить потенциальные риски, связанные с материалами или средствами обеспечения процессов, которые могут угрожать безопасности пациента, например, наличие переносимой губчатой энцефалопатии.
7.5.1.1.2 Все процессы производства в чистых и контролируемых зонах, включая контроль окружающей среды, производство, внутрипроизводственный контроль и упаковку первичных упаковочных материалов, должны соответствовать установленным требованиям. Чистые помещения должны иметь воздушные шлюзы.
7.5.1.1.3 Процессы производства в контролируемых условиях должны быть согласованы между потребителем и организацией.
7.5.1.1.4 Организация должна разработать требования к чистоте первичных упаковочных материалов, если
a) этот материал проходит окончательную очистку перед стерилизацией и/или перед его непосредственным использованием или
b) этот материал поставляется в нестерильном виде, но его чистота имеет значение для его использования, или
c) вещества, использованные в процессах производства, должны быть удалены из продукции при производстве.
7.5.1.1.5 Следует маркировать контейнеры для хранения и связанные с ними линии по расфасовке, загрузке и разгрузке.
7.5.1.1.6 Особое внимание (например, к маркировке, безопасности, чистоте) следует уделять перед загрузкой или разгрузкой контейнеров/бункеров.
7.5.1.1.7 Должны быть разработаны инструкции по очистке оборудования, используемого при производстве первичных упаковочных материалов. Следует вести документацию по очистке оборудования, критически важного для качества для первичных упаковочных материалов (см. 4.2.4).
7.5.1.1.8 Производственное(ые) оборудование/зоны должны иметь обозначения с указанием их назначения и статуса чистоты.
7.5.1.1.9 Повторная переработка материалов характерна для производства, например, стекла, алюминия, бумаги, термопластика. Требования к повторной переработке должны быть определены и согласованы с потребителем.
7.5.1.1.10 Термопластические материалы не должны перерабатываться и применяться повторно, за исключением случаев, согласованных с потребителем.
7.5.1.1.11 Должна проводиться проверка очистки линии между выпусками различных серий, с тем чтобы удалить все материалы и документацию, не участвующие в последующей операции. Следует оформлять документально работы по очистке линии (см. 4.2.4).
7.5.1.2 Управление изменениями
7.5.1.2.1 Организация должна разработать порядок контроля за изменениями. Изменения не должны оказывать негативного влияния на качество продукции и должны соответствовать потребностям и ожиданиям заинтересованных сторон.
7.5.1.2.2 Изменения должны быть оформлены документально. Следует выполнить анализ возможного влияния изменений на другие процессы.
7.5.1.2.3 Следует определить порядок, кому может принадлежать инициатива по внесению изменений, кто должен проводить анализ изменений и утверждать их.
7.5.1.3 Специальные требования для стерильных первичных упаковочных материалов
Организация должна вести документацию (см. 4.2.4) по параметрам процесса стерилизации, проведенного для каждой серии. Эта документация должна обеспечивать прослеживаемость для каждой серии первичного упаковочного материала.
7.5.2 Аттестация процессов производства и обслуживания
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна валидировать все процессы производства и обслуживания, результаты которых не могут быть верифицированы последующим мониторингом или измерениями, из-за чего недостатки становятся очевидными только после начала использования продукции или после предоставления услуги. Валидация должна продемонстрировать способность этих процессов достигать запланированных результатов. Организация должна разработать меры по этим процессам, в том числе там, где это применимо: а) определенные критерии для анализа и утверждения процессов; b) утверждение соответствующего оборудования и квалификации персонала; с) применение конкретных методов и процедур; d) требования к записям (4.2.4); е) повторную валидацию. |
7.5.2.1 Организация должна определить критические процессы в производстве для качества первичных упаковочных материалов. Процесс должен быть аттестован, если нельзя обеспечить контроль его параметров.
7.5.2.2 При отнесении процессов к критическим и при определении объема аттестации следует выполнять анализ рисков. Анализ рисков должен рассматривать аспекты, связанные с качеством продукции.
7.5.2.3 Технические системы (например, оборудование, линии, производственные модули и т.п.), используемые для производства первичных упаковочных материалов, должны быть аттестованы в соответствии с результатами анализа рисков, оформленными документально.
7.5.2.4 Аттестация должна быть проведена в случае внесения существенных изменений в условия, оборудование и процессы, которые могут влиять на качество продукции.
Примечание - Контроль изменений в методах аттестации является частью системы контроля за изменениями.
7.5.2.5 При необходимости, аттестация каждого процесса должна проводиться по согласованию с потребителем.
7.5.2.6 Результаты аттестации следует оформлять документально (см. 4.2.4). Документацию по аттестации следует хранить в течение всего срока службы оборудования плюс два года после его списания, или срок хранения документации должен быть согласован с потребителем.
7.5.2.7 Для программного обеспечения, используемого в критических процессах, должно быть проведено достаточное количество тестов для обеспечения прослеживаемости, передачи и хранения данных. Систему следует проверить путем введения корректных и некорректных данных, чтобы определить прослеживаемость, передачу и хранение данных или записей.
7.5.2.8 Результаты контроля следует оформлять документально (см. 4.2.4).
7.5.2.9 Документы на электронных носителях должны быть защищены от стирания и случайной порчи, а также должны предусматривать восстановление; в случае, если это невозможно, следует хранить распечатки, по крайней мере, в течение двух лет после списания оборудования или по согласованию с потребителем (см. 4.2.4.1).
Примечание - Более подробная информация по защите данных, управлению и аттестации программного обеспечения дана в IEC 60601-1-4, GAMP (Good Automated Manufacturing Practice) Guide и CFR 21 part 11.
7.5.2.10 Если критический процесс выполняется субподрядчиком, организация должна убедиться в соответствии процесса требованиям настоящего стандарта.
7.5.2.11 Для стерильной продукции организация должна разработать методику аттестации процесса стерилизации. Процессы стерилизации должны быть аттестованы до начала применения. Документация об аттестации процессов стерилизации должна храниться в течение установленного времени (см. 4.2.4, ГОСТ Р ИСО 11135, ГОСТ Р ИСО 11137).
7.5.2.12 Для стерильной продукции организация должна применять аттестованный процесс стерилизации первичных упаковочных материалов и регистрировать контрольные параметры процесса стерилизации. В случае, если процесс стерилизации выполняется субподрядчиком, организация должна обеспечить его соответствие требованиям настоящего стандарта (см. ИСО 14937:2000).
7.5.3 Идентификация и прослеживаемость
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Если это возможно и целесообразно, организация должна идентифицировать продукцию при помощи соответствующих средств на всех стадиях ее жизненного цикла. Организация должна идентифицировать статус продукции по отношению к требованиям мониторинга и измерений на всех стадиях ее жизненного цикла. Если прослеживаемость является требованием, то организация должна управлять специальной идентификацией продукции и поддерживать записи в рабочем состоянии (4.2.4). Примечание - В ряде отраслей промышленности менеджмент конфигурации является средством поддержания идентификации и прослеживаемости. |
7.5.3.1 Организация должна разработать и поддерживать систему для прослеживания всей продукции от исходных материалов до поставки потребителю, определяя глубину прослеживаемости и требуемую документацию на основании оценки риска (см. 4.2.4, 8.3 и 8.5).
7.5.3.2 Протоколы на серию продукции должны иметь номер партии или ссылочный номер.
7.5.3.3 Следует хранить документацию об использовании критического оборудования (см. 4.2.4). Она должна также включать в себя мероприятия по очистке и обслуживанию с указанием этапов производства. Мероприятия по обслуживанию должны быть оформлены документально и обеспечивать прослеживаемость до конкретной производственной операции или оборудования.
7.5.3.4 Организация должна разработать и внедрить инструкции по обращению с первичными упаковочными материалами, возвращенными в организацию, например, для переработки. Эти материалы должны быть идентифицированы и отделены от обычной продукции.
7.5.4 Собственность потребителя
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна проявлять заботу о собственности потребителя, пока она находится под управлением организации или используется ею. Организация должна идентифицировать, верифицировать, защищать и сохранять собственность потребителя, предоставленную для использования или включения в продукцию. Если собственность потребителя утеряна, повреждена или признана не пригодной для использования, организация должна известить об этом потребителя и поддерживать записи в рабочем состоянии (4.2.4). Примечание - Собственность потребителя может включать в себя интеллектуальную собственность и сведения личного характера. |
7.5.5 Сохранение соответствия продукции
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна сохранять продукцию в ходе внутренней обработки и в процессе поставки к месту назначения в целях поддержания ее соответствия установленным требованиям. Если это применимо, сохранение соответствия продукции должно включать в себя идентификацию, погрузочно-разгрузочные работы, упаковку, хранение и защиту. Требование сохранения соответствия должно быть также применимо и к составным частям продукции. |
7.5.5.1 Организация должна разработать и поддерживать систему для обращения с продукцией с ограниченным сроком хранения или требующей специальных условий хранения. Такие специальные условия хранения должны контролироваться и регистрироваться (см. 4.2.4). Срок хранения должен быть обоснован.
7.5.5.2 Продукция должна быть ясно маркирована, разделена и надежно храниться, быть защищенной от попадания посторонних веществ или загрязнений. Упаковка, используемая для производства и хранения продукции, должна быть чистой и пригодной для применения. Реализуемая продукция должна иметь сопроводительную документацию, соответствующую данной серии продукции.
7.5.5.3 При повторном использовании упаковочных контейнеров следует удалить предыдущую маркировку. Контейнеры должны быть очищены и проверены на чистоту в соответствии с инструкцией.
7.5.5.4 При необходимости на этикетке должны быть указаны специальные условия транспортирования или хранения первичных упаковочных материалов.
7.6 Управление устройствами для мониторинга и измерений
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования _______________ * Требования раздела 7.6 применяют наряду с метрологическими правилами и нормами, имеющими обязательную силу на территории Российской Федерации, которые содержатся в нормативных документах по обеспечению единства измерений, утверждаемых Федеральным агентством по техническому регулированию и метрологии в соответствии с Федеральным законом "Об обеспечении единства измерений" (от 26 июня 2008 года N 102-ФЗ). Организация должна определить мониторинг и измерения, которые предстоит осуществлять, а также оборудование для мониторинга и измерений, необходимое для обеспечения свидетельства соответствия продукции установленным требованиям. Организация должна установить процессы для обеспечения того, чтобы мониторинг и измерения могли быть выполнены и в действительности были выполнены в соответствии с требованиями к ним. Там, где необходимо обеспечивать имеющие законную силу результаты, измерительное оборудование должно быть: а) откалибровано и/или поверено в установленные периоды или перед его применением по эталонам, передающим размеры единиц в сравнении с международными или национальными эталонами. При отсутствии таких эталонов база, использованная для калибровки или поверки, должна быть зарегистрирована; b) отрегулировано или повторно отрегулировано по мере необходимости; с) идентифицировано в целях установления статуса калибровки; d) защищено от регулировок, которые сделали бы недействительными результаты измерения; е) защищено от повреждения и ухудшения состояния в ходе обращения, технического обслуживания и хранения. Кроме того, организация должна оценить и зарегистрировать правомочность предыдущих результатов измерения, если обнаружено, что оборудование не соответствует требованиям. Организация должна предпринять соответствующее действие в отношении такого оборудования и любой измеренной продукции. Записи результатов калибровки и поверки должны поддерживаться в рабочем состоянии (4.2.4). Если при мониторинге и измерении установленных требований используют компьютерные программные средства, их способность удовлетворять предполагаемому применению предварительно должна быть подтверждена и повторно подтверждена по мере необходимости. Примечание - Подтверждение соответствия компьютерного программного обеспечения предполагаемому применению обычно предусматривает его верификацию и менеджмент конфигурации в целях поддержания его пригодности для использования. |
7.6.1 Следует регулярно проводить и регистрировать проверки оборудования для автоматизированного контроля (например, всех систем видеонаблюдения или систем считывания штрихкода) для подтверждения их исправности.
7.6.2 Данные о продукции и контроле, связанные с продукцией для потребителя (за исключением конфиденциальной интеллектуальной собственности организации), должны быть представлены по требованию потребителя или его представителя для проверки того, что процесс производства, порядок внутрипроизводственного и выходного контроля, а также испытательное оборудование соответствуют установленным требованиям.
7.6.3 Испытательное оборудование, используемое при контроле качества критических процессов (параметров), должно пройти калибровку и аттестацию, если это необходимо.
8 Измерения, анализ и улучшение
8.1 Общие положения
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна планировать и применять процессы мониторинга, измерения, анализа и улучшения, необходимые для: а) демонстрации соответствия продукции. |
Данное требование применяется как к продукции на промежуточных стадиях производства, так и к готовой продукции;
b) обеспечения соответствия системы менеджмента качества; с) постоянного повышения результативности системы менеджмента качества. Указанная деятельность должна включать в себя определение применимых методов, в том числе статистических, и область их использования. |
8.2 Измерения
8.2.1 Удовлетворенность потребителя
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна проводить мониторинг информации, касающийся восприятия потребителем выполнения организацией его требований как одного из способов измерения работы системы менеджмента качества. Должны быть установлены методы получения и использования этой информации. Примечание - Мониторинг восприятия потребителями может включать в себя получение информации из таких источников, как исследования удовлетворенности потребителей, данные от потребителей о качестве поставленной продукции, исследования мнений пользователей, анализ оттока клиентов, благодарности, претензии по гарантийным обязательствам и отчеты распространителей. |
8.2.2 Внутренние аудиты
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна проводить внутренние аудиты (проверки) через запланированные интервалы времени в целях установления того, что система менеджмента качества: а) соответствует запланированным мероприятиям (7.1), требованиям настоящего стандарта и требованиям к системе менеджмента качества, разработанным организацией; b) внедрена результативно и поддерживается в рабочем состоянии. Программа аудитов (проверок) должна планироваться с учетом статуса и важности процессов и участков, подлежащих аудиту, а также результатов предыдущих аудитов. Критерии, область применения, частота и методы аудитов должны быть определены. Выбор и проведение аудитов должны обеспечивать объективность и беспристрастность процесса аудита. Аудиторы не должны проверять свою собственную работу. Должна быть установлена документированная процедура для определения ответственности и требований, связанных с планированием и проведением аудитов, введением записей и составлением отчетов о результатах. Записи об аудитах и их результатах должны поддерживаться в рабочем состоянии (4.2.4). Руководство, ответственное за проверяемые области деятельности, должно обеспечить, чтобы все необходимые коррекции и корректирующие действия предпринимались без излишней отсрочки для устранения обнаруженных несоответствий и вызвавших их причин. Последующие действия должны включать в себя верификацию принятых мер и отчет о результатах верификации (8.5.2). Примечание - См. ИСО 19011 для руководства. |
8.2.3 Контроль параметров процессов
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна использовать подходящие методы мониторинга и, где это применимо, измерения процессов системы менеджмента качества. Эти методы должны демонстрировать способность процессов достигать запланированных результатов. Если запланированные результаты не достигаются, то должны предприниматься необходимые коррекции и корректирующие действия. Примечание - При определении подходящих методов организация должна учитывать тип и объем мониторинга или измерений, подходящих для каждого из таких процессов, в отношении их влияния на соответствие требованиям к продукции и на результативность системы менеджмента качества. |
8.2.3.1 Отдел качества должен организовать работу по расследованию и документальному оформлению критических отклонений.
8.2.4 Контроль параметров продукции
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна осуществлять мониторинг и измерять характеристики продукции в целях верификации соблюдения требований к продукции. Это должно осуществляться на соответствующих стадиях процесса жизненного цикла продукции согласно запланированным мероприятиям (7.1). Свидетельства соответствия критериям приемки должны поддерживаться в рабочем состоянии. Записи должны указывать лицо(а), санкционировавшее(ие) выпуск продукции (4.2.4). Выпуск продукции и предоставление услуги потребителю не должны осуществляться до тех пор, пока все запланированные действия (7.1) не будут удовлетворительно завершены, если не утверждено иное соответствующим полномочным лицом или органом и, где это применимо, потребителем. |
8.2.4.1 Расследование случаев выхода за пределы спецификаций
Любой результат, вышедший за пределы спецификаций, должен быть расследован в соответствии с инструкцией, и результаты расследования должны быть оформлены документально (см. 4.2.4).
8.2.4.2 Контроль исходных материалов
Следует разработать требования ко всем исходным материалам. Эти материалы должны быть проверены, или другим способом должна быть получена информация, что установленные к ним требования выполнены.
8.2.4.3 Внутрипроизводственный контроль
8.2.4.3.1 Организация должна контролировать процесс производства в соответствии с требованиями инструкций.
8.2.4.3.2 Должен быть определен порядок отбора образцов, обеспечивающий представительность выборки образцов в зависимости от оцениваемого процесса. Если образцы перемещены для испытаний в другую зону, они не должны возвращаться назад в производственную зону.
8.2.4.3.3 Дополнительный внутрипроизводственный контроль должен проводиться после отказов оборудования или незапланированных остановок процесса.
8.2.4.4 Контроль готовой продукции
Если предусмотрен контроль готовой продукции, то он должен быть завершен до выпуска серии продукции.
Примечание - При контроле готовой продукции могут проверяться не все требования.
8.2.4.5 Архивные образцы
Архивные образцы должны быть отобраны в соответствии с требованиями организации и/или потребителя.
8.2.4.6 Выпуск серии
Выпуск серии производится после анализа документации на серию продукции.
8.3 Обращение с продукцией, не соответствующей требованиям
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна обеспечивать идентификацию продукции, не соответствующей требованиям, и управление ею в целях предотвращения непреднамеренного использования или поставки такой продукции. Должна быть установлена документированная процедура для определения средств управления и соответствующей ответственности и полномочий для действий с несоответствующей продукцией. Если применимо, организация должна предпринимать в отношении несоответствующей продукции следующие действия (одно или несколько): а) устранение обнаруженного несоответствия; b) санкционирование использования, выпуска или приемки продукции, если получено разрешение на отклонение от соответствующего полномочного лица или органа и, где это применимо, потребителя; с) предотвращение ее первоначального предполагаемого использования или применения; d) действия, адекватные последствиям (или потенциальным последствиям) несоответствия, если несоответствующая продукция выявлена после поставки или начала использования. После того как несоответствующая продукция исправлена, она должна быть подвергнута повторной верификации для подтверждения соответствия требованиям. Записи о характере несоответствий и любых последующих предпринятых действиях, включая полученные разрешения на отклонения, должны поддерживаться в рабочем состоянии (4.2.4). |
8.3.1 Материалы или продукция, не соответствующие заданным требованиям, должны быть помещены в изолятор до принятия решения по ним. При рассмотрении возможности переработки продукции следует провести и документально оформить оценку рисков и любых нежелательных эффектов, связанных с такой переработкой (см. 4.2.4 и 7.5.1).
8.3.2 Переработка должна проводиться в соответствии с инструкцией, утвержденной отделом качества. Переработка должна быть согласована с потребителем, если такое требование установлено.
8.3.3 Если первичный упаковочный материал был произведен в условиях чистого помещения, то его переработка должна быть осуществлена в тех же условиях.
8.3.4 Выпуск продукции, не соответствующей требованиям, возможен только с письменного согласия потребителя.
8.3.5 В случае отклонения первичного упаковочного материала он должен быть утилизирован (уничтожен) в соответствии с инструкцией.
8.4 Анализ данных
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна определять, собирать и анализировать соответствующие данные для демонстрации пригодности и результативности системы менеджмента качества, а также оценивания, в какой области возможно постоянное повышение результативности системы менеджмента качества. Данные должны включать в себя информацию, полученную в результате мониторинга и измерения и из других соответствующих источников. Анализ данных должен предоставлять информацию, относящуюся: а) к удовлетворенности потребителей (8.2.1); b) соответствию требованиям к продукции (8.2.4); с) характеристикам и тенденциям процессов и продукции, включая возможности проведения предупреждающих действий (8.2.3 и 8.2.4); d) поставщикам. |
8.4.1 Организация должна разработать инструкции по анализу данных, выявлению существующих и возможных причин отклонения продукции от заданных требований и других проблем качества.
8.5 Улучшение
8.5.1 Постоянное улучшение
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна постоянно повышать результативность системы менеджмента качества посредством использования политики и целей в области качества, результатов аудитов, анализа данных, корректирующих и предупреждающих действий, а также анализа со стороны руководства. |
8.5.1.1 Изменения, вносимые при совершенствовании процессов (продукции), должны быть оценены с точки зрения анализа рисков.
8.5.2 Корректирующие действия
ГОСТ Р ИСО 9001-2008 Системы менеджмента качества. Требования Организация должна предпринимать корректирующие действия в целях устранения причин несоответствий для предупреждения повторного их возникновения. Корректирующие действия должны быть адекватными последствиям выявленных несоответствий. Должна быть разработана документированная процедура для определения требований: а) к анализу несоответствий (включая жалобы потребителей); b) установлению причин несоответствий; с) оцениванию необходимости действий, чтобы избежать повторения несоответствий; d) определению и осуществлению необходимых действий; е) записям результатов предпринятых действий (4.2.4); f) анализу результативности предпринятых корректирующих действий. |
8.5.2.1 Организация должна своевременно расследовать все претензии потребителей и извещать о корректирующих действиях все производственные и вспомогательные участки. Действие(я) должно(ы) быть реализовано(ы), по возможности, быстро и в соответствии с согласованным графиком. Документацию о расследовании следует хранить (см. 4.2.4).
8.5.2.2 Если по претензии потребителя не принимаются корректирующие и/или предупреждающие действия, то это должно быть документально обосновано.
8.5.3 Предупреждающие действия
ГОСТ Р ИСО 9001:2008 Системы менеджмента качества. Требования Организация должна определять действия в целях устранения причин потенциальных несоответствий для предупреждения их появления. Предупреждающие действия должны соответствовать возможным последствиям потенциальных проблем. Должна быть разработана документированная процедура для определения требований: а) к установлению потенциальных несоответствий и их причин; b) оцениванию необходимости действий с целью предупреждения появления несоответствий; с) определению и осуществлению необходимых действий; d) записям результатов предпринятых действий (4.2.4); е) анализу результативности предпринятых предупреждающих действий. |
Приложение А
(обязательное)
Требования GMP к печатным материалам первичной упаковки
А.1 Средства печати
А.1.1 Общие положения
Все средства печати должны быть:
a) четко и точно идентифицированы методом сравнения с оригинал-макетами;
b) изготовлены в соответствии с оригинал-макетами, представленными заказчиками;
c) проверены на соответствие оригинал-макетов заказчика, представленных на бумажном носителе или в электронном виде с документальным подтверждением (согласованием) (см. 4.2.4);
d) в отдельной зоне с обеспечением сохранности и определенной системой выдачи и возвращения на хранение.
А.1.2 Комплекты печатных форм
При использовании более одной печатной формы должна быть разработана документированная система, обеспечивающая использование всех печатных форм комплекта. Если в комплект входят печатные формы различного назначения, то каждая печатная форма должна быть четко и точно идентифицирована и документально оформлена.
А.1.3 Изменение оригинал-макета (дизайна)
Если в соответствии с изображением требуется несколько печатных форм, и при изменении оригинал-макета или дизайна некоторые из них заменяются, то должен быть разработан документированный порядок замены одних печатных форм и сохранения других средств комплекта. Измененные печатные формы должны пройти переидентификацию.
А.1.4 Проверка
Проверка дизайна средств печати должна проводиться во время подготовки печатной машины и должна быть завершена до решения о начале печати продукции.
А.1.4.1 Карантинное хранение и уничтожение
Организация должна иметь:
a) документированный порядок, обеспечивающий изолированное хранение оригинал-макета и средств печати, дизайн которых находится на стадии изменения;
b) документированную систему, подробно описывающую порядок уничтожения ненужных оригинал-макетов и средств печати. Данные материалы должны быть представлены как не пригодные к использованию и утилизированы контролируемым и безопасным способом.
А.2 Печать и переналадка
А.2.1 Подготовка печатной машины
А.2.1.1 Первоначальная подготовка машины к печати должна проводиться с использованием чистых компонентов и материалов (на которые не нанесен текст).
А.2.1.2 При последующих подготовках машины могут использоваться материалы, напечатанные в начале работы для той же партии.
А.2.1.3 Материалы, применяемые для первоначальной подготовки машины, могут использоваться повторно в процессе регулирования цвета.
А.2.1.4 Материалы, использованные для подготовки машины, должны быть изолированы и утилизированы как производственные отходы.
А.2.2 Системы переналадки
Для систем переналадки, разработанных для уменьшения времени подготовки (например, автоматизированная система замены печатной формы) и не требующих полной разборки линии, должен проводиться документированный анализ рисков. Переналадка должна проводиться под контролем с целью обеспечения защиты продукции. Все печатные материалы, изготовленные в предыдущем цикле работы, должны быть удалены с линии до того, как будет дано документально оформленное разрешение на начало новой печати. Следует регистрировать (документально) все контролируемые параметры (см. 4.2.4).
А.2.3 Архивные образцы
А.2.3.1 Все архивные образцы печатной продукции должны четко маркироваться и храниться с соблюдением мер сохранности.
А.2.3.2 Образцы, используемые для других целей (например, для рекламы, информации и пр.), должны помечаться как недействительные, если они уходят из-под контроля организации.
А.2.4 Замена средств печати
А.2.4.1 Если в течение процесса производства выполнена замена печатной формы по существующему утвержденному макету (например, негативу, или при использовании компьютера для технологии получения пластин из существующего дискретного изображения), работа может быть продолжена после того, как будет произведена проверка первого нового оттиска.
А.2.4.2 Если в течение процесса производства продукции печатная форма создается по новому макету (например, по дискретно измененному изображению), текущая работа должна быть прекращена и измененная печатная форма должна рассматриваться в качестве нового оригинал-макета. Последующее производство рассматривается как производство новой партии. Все замены средств печати должны оформляться документально (см. 4.2.4).
А.2.5 Совместная печать
Совместная печать (процесс печати более одного изображения на материале в течение одного производственного цикла) запрещается, так как существует риск перепутывания (брака).
А.2.6 Формирование партий и складское хранение продукции
А.2.6.1 Формирование партий и складское хранение продукции должно осуществляться в соответствии с условиями договора.
А.2.6.2 Хранение продукции должно быть организовано с обеспечением ее сохранности и целостности. Документация на партию должна давать возможность проследить весь процесс, начиная с получения материалов и производства.
А.2.7 Цифровая печать
А.2.7.1 Цифровая печать вводит новые операции, которые следует контролировать и документировать для обеспечения точности изготовления и безопасности печатной продукции.
А.2.7.2 Использование цифровой печати и любые другие специальные условия, применяемые при изготовлении продукции, должны быть согласованы с заказчиком.
А.2.7.3 Следует создать систему защиты файлов и доступа к ним, разработанную для предотвращения случайного использования неверных файлов оригинал-макетов.
А.2.7.4 Если альтернативная система безопасности не разработана, компьютер, управляющий цифровой печатной машиной, должен иметь в памяти единственный файл оригинал-макета для текущего печатного цикла. Удаление этого файла должно приводить к остановке линии и оформляться документально.
А.2.7.5 Операционные настройки для получения нужных цветов должны выполняться по инструкции и оформляться документально (см. 4.2.4).
А.3 Системы штрихкодов для обеспечения безопасности
А.3.1 Общие положения
Для обеспечения безопасности продукта и предотвращения перепутывания в дизайн печатных упаковочных материалов могут быть включены штрихкоды безопасности, что позволяет осуществлять контроль в процессе производства организацией и/или заказчиком при использовании упаковки.
Организация может добавить собственные идентификационные коды в дизайн продукции, если это оговорено в договоре.
Если организация наносит штрихкод безопасности, она берет на себя ответственность за то, что каждый цвет дизайна должен быть включен в штрихкод. Заказчика следует извещать обо всех случаях, когда цвет не соответствует требованиям сканирующего оборудования.
А.3.2 Проверка методов или оборудования
А.3.2.1 По возможности каждый штрихкод безопасности должен проверяться сканирующим оборудованием, встроенным в линию, для подтверждения того, что коды читаемы и продукция производится в соответствии с установленными требованиями.
Сканирование штрихкодов должно выполняться на заключительном этапе производственного процесса.
А.3.2.2 Программное обеспечение сканирующего оборудования или системные настройки контроля должны загружаться независимым методом (например, стандартным или подтвержденным проверкой). Сразу после введения кода и проверки сканирующее оборудование должно быть надежно заблокировано (например, с использованием механической блокировки или защиты паролем) для предотвращения несанкционированного доступа.
А.3.2.3 Должна существовать эффективная система для отбраковки любых продуктов, которые не проходят проверку сканированием. Каждый продукт, забракованный сканирующей системой, работающей в режиме реального времени, должен изучаться для выявления причины брака, а забракованные компоненты впоследствии должны быть отправлены в места хранения брака. Причины отбраковки должны быть указаны в отчете и проанализированы до реализации продукции.
А.3.2.4 Сканирующая система, работающая в составе линии, и связанный с ней механизм отбраковки должны подвергаться контролю в ходе производства с целью определения эффективности их работы по распознаванию и изъятию материалов с неверным штрихкодом. Такой контроль должен осуществляться в начале процесса и повторяться через регулярные промежутки времени, а результаты оформляться документально (см. 4.2.4).
А.3.2.5 Любой продукт, который при производстве должен проходить электронное сканирование, при невыполнении данного требования должен тщательным образом проверяться и указываться в отчетах по качеству. Об этом следует информировать заказчика и получить его согласие, оформленное документально, до реализации продукции.
А.3.2.6 При рулонном многополосном производстве все линии должны быть проверены на предмет правильности штрихкода. В случае, если это не может быть выполнено, по согласованию с заказчиком может быть проверена только одна линия.
А.3.2.7 Если контроль выполняется вне линии, то следует проверять образцы штрихкодов со всех линий.
А.3.3 Штрихкоды "места продажи"
В случае, если штрихкоды "места продажи" (EAN, Code 39, PZN и т.п.) включены в дизайн, проверку образцов следует выполнять в ходе процесса производства и оформлять ее документально.
А.3.4 Рулонные материалы и продукция
А.3.4.1 Место склеивания должно отвечать следующим требованиям (если заказчиком не определено иное):
a) выполнено с применением ярко окрашенной клейкой ленты на обеих сторонах полотна и
b) обе стороны должны быть проверены для гарантии того, что присоединен идентичный материал и это зарегистрировано в документе.
Может быть указано максимально допустимое число мест склеивания.
А.3.4.2 Количество материала (длина, ширина или числовое значение), произведенного в каждом рулоне, должно быть определено с точностью, согласованной с заказчиком, и указано на рулоне.
А.3.4.3 На внутренней стороне стержня каждого рулона следует указывать номер партии, номер рулона и дату изготовления.
А.3.4.4 Для предотвращения перепутывания полотно должно заканчиваться материалом без нанесения печати в конце прогона для гарантии того, что в оборудовании не осталось печатного материала.
А.3.4.5 Если печатный материал необходимо оставлять в оборудовании из-за сложности перематывания рулонов (например, в устройствах для продольной резки) перед началом печати нового изображения (дизайна), то материалы, использованные для оттиска, должны быть удалены с документальным оформлением.
А.3.4.6 Если из-за особенностей дизайна или эксплуатации печатного оборудования может быть произведен материал с пропущенной печатью, то следует иметь надежную систему для определения и удаления продукции, произведенной с пропущенным цветом или текстом.
Приложение В
(справочное)
Требования к аттестации и контролю производства первичных упаковочных материалов
В.1 Общие положения
Аттестацию следует проводить, когда недостаточно ограничиваться контролем производства первичных упаковочных материалов. В данном приложении рассматриваются требования к аттестации согласно 7.5.2 (7.5.2.1) и требования к проектированию и разработке согласно 7.3.
Аттестация проводится для следующих объектов (если недостаточно ограничиваться контролем):
- производственного оборудования;
- контрольно-испытательного оборудования для проверки критических исходных, промежуточных материалов и готовой продукции;
- отдельных видов продукции в необходимых случаях или по соглашению с заказчиками.
Целью аттестации является документальное подтверждение того, что в процессе производства и контроля качества неизменно обеспечивается выпуск первичных упаковочных материалов, соответствующих заданным требованиям.
Если предусмотрен только контроль производства (без аттестации), то следует провести пуско-наладочные испытания с документальным оформлением и разработать порядок текущего контроля в ходе производства.
В.2 Основные принципы
В соответствии с 7.5.2 аттестация требуется только в тех случаях, когда критические параметры не могут быть проверены при текущем контроле. В данном разделе рассматриваются случаи, когда требуется проводить аттестацию.
Калибровка приборов выполняется независимо от аттестации.
В.2.1 Подготовка к проведению аттестации (испытаний)
До проведения аттестации (испытаний) процесса производства первичных упаковочных материалов следует:
- разработать спецификации на исходные материалы, отражающие их состав;
- подготовить документацию на оборудование для производства и упаковки;
- определить роли и ответственность организации (поставщика) и заказчика;
- установить возможное влияние первичного упаковочного материала на лекарственные средства и безопасность пациента;
- определить критические параметры процесса;
- создать систему обучения персонала (операторов, работников службы качества, инженерно-технического персонала и т.д.);
- разработать технологические инструкции, инструкции по эксплуатации и техническому обслуживанию и т.д.
В.3 Аттестация (контроль, проверка) программного обеспечения
Проверка программного обеспечения выполняется с помощью функциональных тестов. Производитель первичных упаковочных материалов не выполняет аттестацию программного обеспечения, если не оговорено иное.
В.4 Функциональные тесты
Функциональные тесты выполняются для программного обеспечения, связанного с критическими параметрами, с целью проверки прослеживаемости и точности его работы, обработки и сохранения данных. Тесты должны проводиться в достаточном объеме и при надлежащих условиях. С этой целью в систему могут вводиться, например, правильные и неправильные данные. Результаты проверки оформляются документально.
Для критических параметров (операций) выполняются дублирующие тесты.
В.5 Контроль изменений
Контроль изменений выполняется в документальной форме и проводится на всех этапах создания и эксплуатации оборудования, начиная от аттестации проекта (конструкторской документации). Контроль изменений входит в состав работ по аттестации (контролю процессов и оборудования).
В.6 Действия после проведения аттестации
После проведения аттестации функционирующего оборудования (В.15) и аттестации в эксплуатации (В.17) и при возникновении непредвиденных обстоятельств следует принимать необходимые меры, оформляя их документально.
В.7 Поддержание работоспособного состояния
Следует организовать систему технического обслуживания, которая обеспечивает работоспособность оборудования. Любые, даже незначительные, изменения следует оценивать в плане их влияния на работоспособность оборудования и, при необходимости, выполнять аттестацию в эксплуатации в требуемом объеме (В. 17).
Изменения в методиках аттестации следует учитывать при проведении повторной аттестации.
В.8 Аттестация
В.8.1 Перспективная аттестация
До начала серийного производства продукции следует выполнить перспективную аттестацию (испытания) процессов и оборудования. Могут использоваться и другие методы аттестации (В.21).
На рисунке В.1 показана типовая схема аттестации процессов и оборудования.
_______________
Дополнительно может проводиться оценка продукции:
- по решению организации;
- по требованию заказчика.
Рисунок В.1 - Схема аттестации нового оборудования
В.8.2 Роли и ответственность сторон
Возможные зоны ответственности показаны на рисунке В.1. Лица, ответственные за проведение аттестации (испытаний) и утверждение их результатов, должны быть назначены заблаговременно.
Решение о выпуске продукции возлагается на службу (отдел) контроля качества.
В.8.3 Планирование
В.8.3.1 Общие положения
Все стадии процессов аттестации (испытаний) следует планировать и оформлять документально. Порядок и формы документального оформления должны быть определены до начала работы, например, если с заказчиком согласовано проведение контроля параметров, то перечень параметров может быть расширен по сравнению со спецификацией.
Следует указать, что целью аттестации является подтверждение соответствия процессов и оборудования требованиям заказчика.
В.8.3.2 Программа аттестации (испытаний)
Порядок проведения аттестации (испытаний) излагается в программе аттестации (испытаний)*.
_______________
* Применение термина "валидационный мастер-план", являющегося заменой латинских букв кириллицей в английском термине "validation master plan", не допускается. Идентичным переводом этого термина на русский язык является термин "программа аттестации (испытаний)" (прим. ТК 458).
В программе аттестации указываются обязанности исполнителей, состав и последовательность выполнения работ. Особое внимание уделяется критическим факторам (параметрам) процессов, оборудования и окружающей среды.
Программа испытаний содержит следующие разделы:
- перечень работ;
- организация выполнения работ (исполнители, их обязанности);
- перечень процессов и оборудования;
- порядок оформления документации, включая формы документов;
- план-график выполнения работ;
- ссылки на документы, при необходимости;
- порядок контроля измерений.
Если требуется провести аттестацию процессов или оборудования, которые по результатам анализа рисков признаны эквивалентными, то может использоваться метод вынесения за скобки или матричный метод, что должно быть указано в программе аттестации.
Эти методы могут применяться при достаточно полном знании процессов и наличии обоснования.
"Вынесение за скобки" означает, что испытания могут проводиться только при экстремальных значениях параметров. Метод матриц означает такое планирование аттестации, при котором сокращается число серий продукции, необходимых для аттестации.
В.9 Анализ рисков
Анализ рисков проводится при принятии решения, например, о необходимости проведения аттестации или контроля в ходе аттестации проекта (конструкторской документации) для оценки опасности влияния на персонал или окружающую среду и т.д. При анализе рисков оцениваются возможность доступа к оборудованию, потоки материалов, излучение лазеров и т.д. На рисунке В.1 показаны две стадии, на которых может потребоваться проведение анализа рисков.
В.10 Спецификация требований заказчика
При планировании работы следует предусмотреть разработку спецификации требований заказчика (User requirement specification - URS).
Спецификация является утвержденным документом, в котором указываются все функциональные, эксплуатационные и другие требования к процессу или оборудованию, необходимые для изготовления данного материала. При этом может потребоваться разработка планировочных решений для размещения оборудования и наличия достаточного места для перемещения материалов и персонала, размещения запасных частей, достаточного места для уборки (очистки). Эта информация может быть приведена и в другой документации*.
_______________
* Спецификация требований заказчика может быть представлена в виде задания на проектирование или технического задания на разработку оборудования (прим. ТК 458).
В.11 Спецификация к контракту. Приемо-сдаточные испытания
Спецификация к контракту подписывается организацией или поставщиком и содержит предмет и условия поставки. Если предусматривается проведение приемо-сдаточных испытаний (Factory acceptance test - FAT), mo следует указать виды, место проведения испытаний и кто проводит испытания.
В.12 Этапы аттестации
Возможны различные подходы к проведению:
- аттестации проекта или конструкторской документации (В.13);
- аттестации установленного оборудования (В.14);
- аттестации функционирующего оборудования (В.15);
- пуско-наладочных испытаний - Site acceptance test - SAT (В.16);
- аттестации в эксплуатации (В.17);
- анализа рисков, которые могут выполняться организацией и/или поставщиком.
Эта работа должна быть оформлена документально. При проведении испытаний организация должна учитывать опыт поставщика.
Ниже рассматриваются этапы проведения аттестации. Целью аттестации является подтверждение того, что продукция неизменно выпускается в соответствии с заданными требованиями.
В.13 Аттестация проекта (конструкторской документации)
При аттестации проекта (конструкторской документации) проверяется его соответствие заданным требованиям. При этом может использоваться анализ рисков, анализ спецификации требований заказчика, спецификации к контракту, результатов приемо-сдаточных испытаний, чтобы оценить возможность поставки продукции заказчику и необходимость доработок до проведения пуско-наладочных испытаний (В.16).
Аттестация конструкторской документации не требуется при поставках стандартной продукции.
При проведении приемо-сдаточных испытаний может потребоваться учет условий окружающей среды, например тепловыделений, шума, освещенности, загрязненности.
В.14 Аттестация установленного оборудования
Аттестация установленного оборудования проводится для подтверждения того, что оборудование установлено в соответствии с заданными требованиями и документацией, калибровано (при необходимости) и эксплуатационная документация имеется в наличии. Результаты аттестации оформляются документально и утверждаются.
В.15 Аттестация функционирующего оборудования
Аттестация функционирующего оборудования проводится для подтверждения того, что процесс или оборудование работают в соответствии с заданными требованиями, в том числе при предельных значениях параметров (нижних и верхних) с учетом влияния изменений в исходных материалах (сырье) и параметров окружающей среды.
Методика испытаний и результаты испытаний должны быть оформлены документально и утверждены. План проведения испытаний, протоколы испытаний (В. 19.3.2), отчеты о проведении испытаний (В.19.3.4) и заключения (В.19.3.5) могут быть оформлены в виде отдельных документов.
При завершении аттестации функционирующего оборудования должны быть представлены методики калибровки, инструкции по эксплуатации (включая внутрипроизводственный контроль), уборке (очистке), порядок обучения персонала и инструкции по техническому обслуживанию.
Для простого оборудования может составляться единый документ, включающий протокол (В.19.3.2) и отчет об испытаниях (В.19.3.4), в котором также указывается критерий приемлемости.
В.16 Пуско-наладочные испытания
При проведении пуско-наладочных испытаний выполняется пробное изготовление продукции из предусмотренных материалов. Это может служить подтверждением результатов аттестаций установленного и функционирующего оборудования. Следует контролировать параметры продукции, на основании чего может быть принято решение о проведении аттестации в эксплуатации. Пуско-наладочные испытания могут быть эквивалентны одному циклу аттестации в эксплуатации.
Для проверки контрольно-измерительного оборудования также могут проводиться пуско-наладочные испытания с целью проверки калибровки оборудования и неизменности его показаний.
В.17 Аттестация в эксплуатации
При аттестации в эксплуатации проводятся испытания всего комплекса технологического оборудования с целью подтверждения неизменного соответствия продукции заданным требованиям. При аттестации в эксплуатации используются предусмотренные материалы. Испытания проводятся, как минимум, для трех серий продукции. Результаты испытаний должны быть оформлены документально и утверждены.
Исключение из требования об испытаниях трех серий делается для длительных непрерывных процессов (например, в течение нескольких недель), когда допускается ограничиться одной серией исходных материалов. В этом случае испытания могут проводиться для трех подсерий, каждая из которых изготавливается, как минимум, в течение одного дня.
В.18 Аттестация продукции
Аттестация продукции необязательна и может выполняться по решению организации либо по требованию заказчика (рисунок В.1).
В особых случаях рекомендуется выполнять аттестацию критических стадий процесса для заданного вида первичного упаковочного материала. При этом проводятся испытания критических стадий процесса при значениях критических параметров, выбранных путем анализа рисков.
Соответствие параметров заданным требованиям при определенном числе серий (циклов работы оборудования) означает, что аттестация продукции (процесса) прошла успешно (ГОСТ Р 52249, приложение 15).
В.19 Документация, используемая при аттестации (испытаниях)
В.19.1 Общие положения
Методики проведения и результаты аттестации (испытаний) должны быть оформлены документально.
В.19.2 Испытания
Результаты приемо-сдаточных и/или пуско-наладочных испытаний могут быть оформлены в виде одного документа, который содержит:
- данные об оборудовании или результаты последних испытаний (контроля);
- данные о методах испытаний;
- критерии приемлемости;
- перечень проводимых испытаний;
- результаты испытаний;
- оценку результатов испытаний и заключение;
- последующие действия;
- контроль измерений;
- утверждающую подпись.
В.19.3 Аттестация
В.19.3.1 Состав документации
В основной состав документации по аттестации входят:
- данные об анализе рисков;
- план проведения и содержание протокола аттестации;
- отчет о проведении аттестации;
- заключение и утверждающая подпись.
В.19.3.2 План проведения и содержание протокола аттестации
Эта документация включает в себя:
- данные об основных стадиях (параметрах), которые могут быть критическими;
- данные об аттестации и методах ее проведения;
- критерии приемлемости;
- подписи исполнителей и утверждающую подпись.
В.19.3.3 Протокол аттестации
В содержание протокола аттестации входят:
- результаты аттестации по принятой методике;
- критерии приемлемости;
- подписи исполнителей и утверждающая подпись.
В.19.3.4 Отчет о проведении аттестации
Отчет о проведении аттестации может оформляться в одном документе с протоколом аттестации.
В.19.3.5 Заключение
В краткой форме приводятся результаты аттестации с указанием цели аттестации, предъявляемых требований и заключение о соответствии им результатов испытаний. При наличии отклонений решение по ним должно быть обосновано.
В.19.3.6 Сводный отчет по результатам аттестации
Сводный отчет содержит данные обо всех этапах аттестации и испытаний:
- ссылки на протоколы, заключения и рекомендации;
- обоснование изменений;
- утверждающую подпись.
В.20 Хранение документации
Документация о проведении аттестации (контроля, испытаний) должна храниться в течение всего периода эксплуатации оборудования плюс два года после его вывода из эксплуатации.
В.21 Другие методы аттестации
В.21.1 Общие положения
В В.1-В.20 рассмотрена перспективная аттестация, т.е. аттестация до начала серийного выпуска продукции. Этот вид аттестации для фармацевтической промышленности является предпочтительным.
В то же время организация может применять другие методы аттестации, соответствующие конкретной ситуации, и с учетом затрат на проведение аттестации.
К другим методам аттестации относятся:
- текущая аттестация;
- ретроспективная аттестация;
- вынесение за скобки (метод матриц).
В.21.2 Текущая аттестация
Текущая аттестация проводится в ходе серийного производства, когда выпуск продукции был начат до принятия решения об аттестации. Текущая аттестация выполняется в объеме аттестации в эксплуатации по той же схеме.
В.21.3 Ретроспективная аттестация
Ретроспективная аттестация проводится, когда продукция выпускалась до принятия решения о проведении аттестации. В данном случае используются предшествующие данные о параметрах процессов и исходных материалах. Анализируются также данные о текущем обслуживании и ремонте оборудования, материалы отдела контроля качества и рекламации заказчиков.
Результаты оформляются документально с заключением по всем ключевым параметрам.
В.21.4 Вынесение за скобки (метод матриц)
Если ряд видов продукции или процессов являются эквивалентными, то объем работ по аттестации может быть уменьшен за счет сокращения числа серий испытуемой продукции или за счет сокращения объема испытаний для нескольких идентичных единиц оборудования или процессов.
В.21.5 Дополнительные условия для производства циклами
Производство первичных упаковочных материалов может быть организовано циклами, разделенными во времени. В этом случае текущая аттестация может быть приостановлена по завершении цикла и возобновлена при следующем цикле.
Приложение С
(справочное)
Анализ рисков при производстве первичных упаковочных материалов
С.1 Введение
В данном приложении рассматривается порядок анализа рисков при проектировании (разработке) производства и отгрузке первичных упаковочных материалов с целью обнаружения фактора риска, его оценки, принятия мер по его устранению и контроля эффективности принятия мер. Требования к уровням риска не устанавливаются ввиду разнообразия первичных упаковочных материалов и требований заказчика.
Приложение дает общие принципы анализа рисков при проектировании (разработке), производстве и отгрузке первичных упаковочных материалов. Пользуясь этими принципами, и на основе собственного опыта следует организовать систематическую работу по анализу рисков.
Термины и определения см. в ИСО 14971:2000 и/или Руководстве ИСО/МЭК 51:1999.
С.2 Общие принципы анализа рисков
При анализе рисков следует оценить:
- вероятность нанесения ущерба, т.е. как часто может происходить событие, наносящее вред;
- последствия этого события (тяжесть последствий).
Допустимость риска зависит от этих факторов, а также от характера проявления риска.
Анализ рисков позволяет принимать обоснованные решения и входит составной частью в систему обеспечения качества продукции.
При проведении анализа рисков следует, как правило, руководствоваться системным подходом, однако это не всегда возможно и целесообразно с учетом сложности процессов и их критичности.
Организация работы по повышению качества на основе анализа рисков показана на рисунке С.1 и включает в себя анализ рисков, оценку рисков, разработку и внедрение мероприятий по снижению риска и оценку эффективности. Решения, принимаемые на каждой стадии этого процесса, и мероприятия должны быть оформлены документально. В состав документации должно входить, по крайней мере, следующее:
- описание продукта или процесса;
- список ответственных лиц или владельцев процессов;
- дата выполнения каждой стадии.
Рисунок С.1 - Схема организации работы по повышению качества на основе анализа рисков
Анализ рисков выполняется, как правило, специалистами разного профиля, имеющими отношение к рассматриваемой задаче. Группа по анализу рисков может включать в себя инженерно-технических работников и специалистов, владеющих методикой анализа рисков.
Руководящий персонал несет ответственность за проведение работ по анализу рисков.
С.3 Процесс оценки риска
Оценка риска является систематизированным процессом подготовки информации для принятия решения в отношении рисков (7.5.2.2).
С этой целью проводятся анализ рисков и оценка допустимости риска.
При оценке рисков определяются процессы, критические для качества продукции, а также объем работ по аттестации этих процессов.
С.3.1 Анализ рисков
Анализ рисков может быть количественным и качественным.
С.3.1.1 Определение критических стадий процесса
Анализ рисков должен охватывать все стадии процесса, включая материалы (в пределах возможности контроля организации), взаимосвязи между поставщиками и заказчиками, конструкцию оборудования, производство и отгрузку (7.1 и 7.5.2). Следует учитывать совместную работу с другими организациями, включая субподрядные отношения.
При анализе критических стадий следует учитывать работу с исходными и промежуточными материалами, готовой продукцией, специальные требования заказчика, а также наличие оперативного обмена информацией.
С.3.2 Определение опасностей, влияющих на качество продукции
При составлении перечня опасностей следует учесть все факторы риска, рекламации заказчиков и чувствительность продукции. Эту работу следует проводить с учетом приоритетов организации и требований к продукции или процессу.
При составлении перечня опасностей и анализе рисков нужно учитывать следующие факторы:
С.3.2.1 Окружающая среда:
температура, время года, влажность, осадки, атмосферное давление, освещенность, вибрация, насекомые и грызуны, перекрестные загрязнения, пожар и затопление.
С.3.2.2 Оборудование:
тип и конструкция оборудования, техническое состояние, мощность, место расположения, монтаж, порядок эксплуатации, техническое обслуживание и калибровка.
С.3.2.3 Помещение:
планировочные решения, энергоносители, техническое обслуживание, назначение помещения и требование гигиены.
С.3.2.4 Информационное обеспечение:
вопросы интеллектуальной ответственности и объем информации, доступной для пользователя.
С.3.2.5 Юридические вопросы:
возможность нарушения действующего законодательства.
С.3.2.6 Материалы:
соответствие материала спецификации, статус в плане контроля качества, количество, порядок обращения, требования спецификации, условия безопасности, контроль подделок и состояние материала.
С.3.2.7 Персонал:
личные качества, профессиональная подготовка, образование, компетентность, взаимоотношения в коллективе, коммуникабельность, характер, честность и заменяемость.
С.3.2.8 Процессы и инструкции:
проверки, содержание изменения, рассылка (выдача), уничтожение, состояние, контроль измерений, хранение, тенденции, плановые и внезапные перерывы в работе (в том числе для повторной обработки).
С.3.2.9 Технология:
информационные системы, системы электронной обработки данных, безопасность информации, защита данных.
С.3.3 Оценка риска
Следует определить меры контроля для каждого вида опасности и оценить эффективность этих мер. К ним, например, относятся:
- анализ договоров;
- внутрипроизводственный контроль;
- контроль изменений;
- рассмотрение результатов аудита и последующих действий по устранению недостатков;
- анализ рекламаций заказчиков;
- показатели качества;
- предложения, исходящие от персонала.
С.3.4 Оценка допустимости риска
По каждому виду опасности, для которой не предусмотрены меры по ее предотвращению, следует оценить вероятность ее появления и возможные последствия (при участии заказчика, если требуется) (Рисунок С.2).
Рисунок С.2 - Примеры опасностей и возможных последствий
Следует сделать заключение о тяжести последствий и их вероятности с учетом принятия предусмотренных мер по их недопущению.
Для оценки тяжести последствий может использоваться следующий простой подход.
Следует классифицировать каждую опасность как "низкую", "среднюю" или "высокую" и оценить ее вероятность присвоением условного числа. Эти числа следует перемножить, чтобы получить числовую характеристику риска и определить уровень риска.
Результаты оценки допустимости риска могут быть представлены в виде таблицы, как показано на рисунке С.3.
Рисунок С.3 - Обозначение результатов оценки рисков
Размеры таблицы (матрица) должны быть удобными для работы с нею. Важно, чтобы риск можно было отнести к одной из следующих групп:
- требуется немедленное действие;
- действие может быть выполнено позже;
- риск незначителен, и никаких действий предпринимать не нужно.
На рисунке С.4 приведен еще один пример оценки риска.
С.3.5 Другие методы анализа рисков
С.3.5.1 Анализ вида и последствий отказа
Анализ вида и последствий отказа (Failure mode effect analysis - FMEA) является качественным методом оценки риска и его последствий. Следуя ему, нужно найти точки возможных отказов, расставить вероятности отказов (приоритеты) и разработать меры по ослаблению последствий отказов.
С.3.5.2 Анализ дерева отказов
Анализ дерева отказов (Fault tree analysis - FTA) использует данные по определению опасностей, полученные другими методами. Результаты наглядно представляются в виде дерева отказов. Этот метод используется при оценке вероятностей отказов и позволяет получить удобную для восприятия картину поведения системы и влияющих факторов.
С.3.5.3 Анализ опасностей и эксплуатации
Метод анализа опасностей и эксплуатации (Hazard and operability study - HAZOP) близок FMEA и основан на теории, которая предполагает, что причиной отказов являются отклонения параметров от проектных или заданных значений. Он является системным методом обнаружения опасностей и проблем в эксплуатации. HAZOP может применяться для процессов, используемых для производства первичных упаковочных материалов (например, стерилизации), оказывающих существенное влияние на качество материалов.
Целью метода является полное описание первичного упаковочного материала и порядка его использования для получения систематизированной картины влияния каждого элемента на качество материала. Это позволяет понять, из-за чего произошли отклонения эксплуатационных параметров и конструкции оборудования от заданных требований, и оценить, могут ли эти отклонения привести к опасным ситуациям и нарушениям в работе.
С.3.5.4 Анализ риска в критических контрольных точках
Анализ риска в критических контрольных точках (Hazard analysis of critical control points - HACCP) предназначен для определения (обнаружения) и оценки риска и тяжести его последствий для опасностей биологической, химической и физической природы, связанных с конкретными процессами.
После определения стадий процесса, где могут иметь место существенные опасности, следует определить критические контрольные точки. Для каждой из этих точек следует установить допустимые (критические) пределы изменения параметров и организовать контроль этих изменений. При отклонении параметров за установленные пределы следует принять необходимые меры, оформить их документально и проверить результаты.
С.3.6 Мероприятия по результатам анализа риска
После принятия решения по результатам анализа рисков следует принять меры по уменьшению риска.
На предшествующих этапах обнаруживается любое слабое место. На данном этапе следует разработать меры по устранению этих слабых мест.
При разработке мероприятий нужно учитывать следующие факторы (указаны в порядке снижения важности):
a) обеспечение безопасности за счет конструкции;
b) разработка технологического процесса;
c) проведение внутрипроизводственного контроля;
d) контроль промежуточной и готовой продукции.
Следует определить дополнительные меры, направленные на снижение риска и, по возможности, устранить опасность. Если это невозможно, то следует предусмотреть меры, чтобы снизить вероятность опасности события, и обнаруживать любую опасность с целью своевременного принятия мер.
При рассмотрении дополнительных или более совершенных мер контроля нужно учитывать следующее:
- сложность (простоту) реализации этих мер;
- вероятность, что принимаемые меры дадут эффект;
- тяжесть последствий, если меры по предотвращению опасной ситуации не будут приняты;
- вероятность наступления опасной ситуации, если ограничиться существующими мерами.
Для проверки эффективности внедренных в практику мер риск может быть создан искусственно.
В первую очередь следует снизить опасность, приводящую к тяжелым последствиям, или часто повторяющуюся опасность.
При низком уровне риска или при невозможности принятия действий по снижению уровня риска анализ риска может не проводиться. В таких случаях решение о непроведении анализа риска должно быть обосновано, оформлено документально и, при необходимости, согласовано с заказчиком.
С.3.7 Снижение риска
Следует составить план внедрения новых мероприятий, указать дату и исполнителей. Далее следует контролировать выполнение этого плана и эффективность мероприятий после их внедрения.
После достижения существенного снижения риска следует повторить весь процесс анализа риска для следующего уровня рисков. Этот процесс следует повторять до устранения всех опасных ситуаций.
С.3.8 Оценка эффективности
Следует периодически оценивать эффективность анализа риска и оформлять эту оценку в виде отчета.
Рисунок С.4 - Таблица оценки риска
Приложение Д
(обязательное)
Сведения о соответствии национальных стандартов Российской Федерации ссылочным международным (региональным) стандартам
Обозначение ссылочного международного стандарта | Обозначение и наименование соответствующего национального стандарта |
ИСО 10012:2003 | ГОСТ Р ИСО 10012-2008 "Менеджмент организации. Системы менеджмента измерений. Требования к процессам измерений и измерительному оборудованию" |
ИСО 11137-1:2006 | ГОСТ Р ИСО 11137-1-2008 "Стерилизация медицинской продукции. Радиационная стерилизация. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий" |
ИСО 11137-2:2006 | ГОСТ Р ИСО 11137-2-2008 "Стерилизация медицинской продукции. Радиационная стерилизация. Часть 2. Установление стерилизующей дозы" |
ИСО 14971:2000 | ГОСТ Р ИСО 14971-2006* "Изделия медицинские. Применение менеджмента риска к медицинским изделиям" |
_______________ * На территории Российской Федерации с 01.01.2011 действует ГОСТ Р ИСО 14971-2009. - . | |
ИСО 14001:2004 | ГОСТ Р ИСО 14001-2007 "Системы экологического менеджмента. Требования и руководство по применению" |
Библиография
[1] | ГОСТ Р ИСО 9004-2001 | Системы менеджмента качества. Рекомендации по улучшению деятельности |
[2] | ISО 10012:2003 | Measurement management systems - Requirements for measurement processes and measuring equipment |
[3] | ISO 11135-1:2007 | Sterilization of health care products - Ethylene oxide - Part 1: Requirements for development, validation and routine control of a sterilization process for medical devices |
[4] | ISO 11137-1:2006 | Sterilization of health care products - Radiation - Part 1: Requirements for development, validation and routine control of a sterilization process for medical devices |
[5] | ISO 11137-2:2006 | Sterilization of health care products - Radiation - Part 2: Establishing the sterilization dose |
[6] | ГОСТ Р ИСО 13485-2004 | Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования |
[7] | ГОСТ Р ИСО 14001-2007 | Системы экологического менеджмента. Требования и руководство по применению |
[8] | ГОСТ Р ИСО 14644-7-2007 | Чистые помещения и связанные с ними контролируемые среды. Часть 7. Изолирующие устройства (укрытия с чистым воздухом, боксы перчаточные, изоляторы и мини-окружения) |
[9] | ГОСТ Р ИСО 14644-8-2008 | Чистые помещения и связанные с ними контролируемые среды. Часть 8. Классификация молекулярных загрязнений в воздухе |
[10] | ГОСТ Р ИСО 14698-1-2005 | Чистые помещения и связанные с ними контролируемые среды. Контроль биозагрязнений. Часть 1. Общие принципы и методы |
[11] | ГОСТ Р ИСО 14698-2-2005 | Чистые помещения и связанные с ними контролируемые среды. Контроль биозагрязнений. Часть 2. Анализ данных о биозагрязнениях |
[12] | ISO 14937:2009 | Sterilization of health care products - General requirements for characterization of a sterilizing agent and the development, validation and routine control of a sterilization process for medical devices |
[13] | ГОСТ Р ИСО 14971-2006 | Изделия медицинские. Применение менеджмента риска к медицинским изделиям |
[14] | ГОСТ Р ИСО 19011-2003 | Руководящие указания по аудиту систем менеджмента качества и/или систем экологического менеджмента |
[15] | ISO/IEC 90003:2004 | Software engineering - Guidelines for the application of ISO 9001:2000 to computer software |
[16] | ISO/IEC Guide 2:1996 | Standardization and related activities - General vocabulary |
[17] | ISO/IEC Guide 51:1999 | Safety aspects - Guidelines for their inclusion in standards |
[18] | VIM:1993 | International vocabulary of basic and general terms in metrology (VIM). BIPM, IEC, IFCC, ISO, IUPAC, IUPAP, OIML, 2 |
[19] | IEC 60601-1-4:2000 | Medical electrical equipment - Part 1: General requirements for safety - 4. Collateral standard: Programmable electrical medical systems |
[20] | IEC 60812:2006 | Analysis techniques for system reliability - Procedure for failure mode and effects analysis (FMEA) |
[21] | IEC 61025:2006 | Fault tree analysis (FTA) |
[22] | IEC 61882:2001 | Hazard and operability studies (HAZOP studies). Application guide |
[23] | EC Guide to Good Manufacturing Practice for Medicinal Products | |
[24] | US/FDA Code of Federal Regulations | |
[25] | Good Automatic Manufacturing Practice (GAMP) Guide for Validation of Automatic Systems, 2001, International Society for Pharmacoepidemiology (ISPE). ISPE/GAMP Forum Publication | |
[26] | PIC documents 4/93 Explanatory notes for industry on the preparation of a Site Master File to be part of the information requested under Article 2 of the Pharmaceutical Inspection Convection | |
[27] | Good Manufacturing Practice for active pharmaceutical ingredients (ICH Q7A) | |
[28] | Global Harmonization Task Forces (GHTF) - Study Group 1 (SG1), Document No N029R11, Feb.2, 2002 | |
Электронный текст документа
и сверен по:
, 2010






