ГОСТ 32369-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Оценка биоразлагаемости в аэробных условиях методом моделирования поверхностных вод
Testing of chemicals of environmental hazard. Evaluation of aerobic biodegradation by surface water modeling method
МКС 71.100.01
Дата введения 2014-08-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ" (ФГУП "ВНИЦСМВ") на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 18 октября 2013 г. N 60-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Азербайджан | AZ | Азстандарт |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узстандарт |
Украина | UA | Минэкономразвития Украины |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г. N 808-ст межгосударственный стандарт ГОСТ 32369-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 августа 2014 г.
5 Настоящий стандарт идентичен международному документу OECD, Test No. 309:2004* "Аэробная минерализация в природной воде. Тест моделирования биологического разложения" ("Aerobic Mineralisation in Surface Water - Simulation Biodegradation Test", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Наименование настоящего стандарта изменено относительно наименования указанного международного документа для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6)
6 ВВЕДЕН ВПЕРВЫЕ
7 ИЗДАНИЕ (апрель 2019 г.) с Поправкой* (ИУС 2-2015)
_________________________
* См. ярлык "Примечания".
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
Целью данного стандарта является измерение периода действия биоразлагаемости исследуемого вещества при низкой концентрации в аэробной природной воде и количественное определение результатов наблюдения в виде выражений кинетической скорости. Данное имитационное испытание представляет собой периодический лабораторный тест с встряхиваемой колбой для определения скорости аэробного биоразложения органических веществ в пробах природной поверхностной воды (пресной, солоноватой или морской). Он основан на стандарте ISO/DIS 14592-1 [1], а также включает в себя элементы из руководств ОЭСР 307 и 308 [2], [3]. По выбору, из-за длительного времени проведения испытаний, полунепрерывную операцию заменяют периодической обработкой, чтобы предотвратить ухудшение тестирования в микрокосмах. Основной целью имитационного испытания является определение минерализации исследуемого вещества в поверхностных водах. Минерализация составляет основу для выражения кинетики разложения. Тем не менее, дополнительной второй целью испытаний является получение информации о первичном разложении и образовании основных продуктов превращения. Идентификация продуктов превращения и, если возможно, количественное определение их концентраций, особенно важны для веществ, которые являются слабо минерализованными (например, с периодом полураспада для общего остаточного , превышающим 60 дней). Из-за аналитических ограничений должны использоваться повышенные концентрации исследуемого вещества (например, >100
г/л), как правило, для идентификации и количественного определения основных продуктов превращения.
В данном испытании низкая концентрация означает концентрацию (например, менее 1 г/л до 100
г/л), которая является достаточно низкой, чтобы достичь соответствия между кинетикой биоразложения, полученной при испытании, и ожидаемой кинетикой биоразложения в окружающей среде. По сравнению с общей массой биоразлагаемых углеродных субстратов в природных водах, используемых для испытания, исследуемое вещество, присутствующее в низких концентрациях, будет служить в качестве вторичного субстрата. Это означает, что ожидаемая кинетика биоразложения имеет первый порядок (кинетика "отсутствия роста") и что исследуемое вещество может разлагаться "сометаболизмом". Кинетика первого порядка подразумевает, что скорость разложения (мг/л/сут) пропорциональна концентрации субстрата, которая снижается со временем. В отношении истинной кинетики первого порядка, константа удельной скорости разложения,
, не зависит от времени и концентрации. То есть
в ходе эксперимента и при добавлении концентрации между экспериментами не меняется существенно. По определению, константа удельной скорости разложения равна относительному изменению концентрации за единицу времени:
![]() . Несмотря на то, что кинетика первого порядка обычно ожидается при определенных условиях, могут сложиться обстоятельства, когда другие кинетики окажутся более подходящими. Отклонения от кинетики первого порядка можно наблюдать, например, если такое явление массопередачи, как скорость диффузии, в большей степени, чем скорость биологической реакции, ограничивает скорость биопревращения. Однако данные почти всегда характеризуются псевдокинетикой первого порядка, предполагающей константу зависимости скорости от концентрации.
. Несмотря на то, что кинетика первого порядка обычно ожидается при определенных условиях, могут сложиться обстоятельства, когда другие кинетики окажутся более подходящими. Отклонения от кинетики первого порядка можно наблюдать, например, если такое явление массопередачи, как скорость диффузии, в большей степени, чем скорость биологической реакции, ограничивает скорость биопревращения. Однако данные почти всегда характеризуются псевдокинетикой первого порядка, предполагающей константу зависимости скорости от концентрации.
Информация о биоразложении исследуемого вещества при его высоких концентрациях (например, стандартные скрининг-тесты), а также информация об абиотическом разложении, продуктах превращения и соответствующих физико-химических свойствах должна быть доступна до начала испытания, чтобы составить план проведения экспериментов и интерпретации результатов. Использование меченых исследуемых веществ и определение фазового распределения
в конце испытания позволяют оценить конечную биоразлагаемость. Когда используется немеченое исследуемое вещество, то полное биоразложение можно определить лишь при условии, что испытывается вещество в более высоких концентрациях и что известны все основные продукты превращения.
См. раздел 3 для терминов и определений.
1 Область применения
Целью данного испытания является измерение периода действия биоразложения исследуемого вещества при низкой концентрации в аэробной природной воде и количественное определение результатов наблюдения в виде выражений кинетической скорости. Данное имитационное испытание представляет собой периодический лабораторный тест методом встряхивания для определения скорости аэробного биоразложения органических веществ в пробах природной поверхностной воды (пресной, солоноватой или морской).
2 Термины и определения
В настоящем стандарте используются следующие термины с соответствующими определениями:
2.1 первичное биоразложение (primary biodegradation): Изменение молекулярной структуры вещества микроорганизмами до такой степени, что исчезает его химическая идентичность.
2.2 функциональное биоразложение (functional biodegradation): Изменение молекулярной структуры вещества микроорганизмами до такой степени, что исчезает его какое-либо специфическое свойство.
2.3 полное аэробное биоразложение (ultimate aerobic degradation): Полное разложение химического соединения или органического материала под действием микроорганизмов в присутствии кислорода с образованием диоксида углерода, воды и минеральных солей любых присутствующих элементов (минерализация), образование новой биомассы и органических продуктов микробного биосинтеза.
2.4 минерализация (mineralization): Распад химического вещества или органического материала в присутствии кислорода до образования двуокиси углерода, воды и гидридов, окисей или минеральный солей любых других присутствующих элементов.
2.5 лаг-фаза (латентная фаза) (lag phase): Период от начала испытания до адаптации деградирующих микроорганизмов и возрастания степени биоразложения химического вещества или органического материала до определяемого уровня (например, 10% от максимального теоретического биоразложения или меньше в зависимости от точности методики измерения).
2.6 максимальная степень биологического разложения (maximum level of biodegradation): Уровень разложения химического вещества или органического материала в определенном тесте, выраженный в процентном соотношении, сверх которого не происходит дальнейшего биоразложения во время теста.
2.7 первичный субстрат (primary substrate): Смесь природных источников углерода и энергии, которые обеспечивают рост и поддержание микробной биомассы.
2.8 вторичный субстрат (secondary substrate): Компонент субстрата, присутствующий в таких низких концентрациях, что при его разложении лишь незначительное количество углерода и энергии становится доступным для микроорганизмов, по сравнению с количеством углерода и энергии, получаемым при разложении основных компонентов субстрата (первичных субстратов).
2.9 константа скорости разложения (degradation rate constant): Кинетическая константа первого или псевдопервого порядка, ![]() , которая отражает скорость процесса разложения. При исследовании партий
, которая отражает скорость процесса разложения. При исследовании партий определяется из начального отрезка кривой разложения после завершения лаг-фазы.
2.10 период полураспада , дни (half-life): Данный термин используется для описания скорости реакции первого порядка. Он характеризует промежуток времени, который соответствует уменьшению концентрации в 2 раза. Период полураспада и константа скорости деградации связаны уравнением
![]() . [1]
. [1]
2.11 период полуразложения, , дни (degradation half time): Данный термин используется для количественной оценки результатов испытаний биоразложения. Он характеризует промежуток времени, в том числе латентной фазы, необходимой для достижения значения 50% биоразложения.
2.12 расчетный нижний предел чувствительности LOD и предел количественного определения LOQ (Limit of detection (LOD) and limit of quantification (LOQ)): Расчетный нижний предел чувствительности LOD - концентрация химического вещества, ниже которого невозможно отличить данное вещество от аналитических артефактов. Предел определения количества LOQ является концентрацией вещества, ниже которого концентрация не может быть определена с приемлемой точностью.
2.13 растворенный органический углерод; РОУ (dissolved organic carbon, DOC): Количество органического углерода, присутствующего в растворе после фильтрования через мембранный фильтр с размером пор от 0,2 до 0,45 мкм или после центрифугирования с ускорением порядка 4000 g (40000 м/с) в течение 15 минут.
2.14 общая активность органического (total organic
activity, ТОА): Общая активность атомов
, ассоциированная с органическим углеродом.
2.15 активность органического в растворе (dissolved organic
activity, DOA): Общая активность атомов
, ассоциированная с растворенным органическим углеродом.
2.16 активность органического взвеси (particulate organic
activity, РОА): Общая активность атомов
, ассоциированная с органическим углеродом в виде взвеси.
3 Основные положения
3.1 Общий принцип метода
3.1.1 Испытание проводят периодически путем инкубирования исследуемого вещества только в поверхностных водах ("тест с океаническими отложениями", пелагический тест) или поверхностных водах с внесенными взвешенными веществами/наносами от 0,01 до 1 г/л сухого веса ("тест с взвешенными наносами") для моделирования водной массы с взвешенными твердыми веществами или повторно взвешенным осадком. Во многих поверхностных водах концентрация взвешенных твердых веществ/осадка находится обычно в самом низком диапазоне этого интервала. Испытательные колбы инкубируют в темноте при температуре окружающей среды в аэробных условиях и при помешивании. Необходимо использовать хотя бы две разные концентрации исследуемого вещества, чтобы определить кинетику разложения. Концентрации должны отличаться друг от друга в 5-10 раз и представлять собой ожидаемый диапазон концентраций в окружающей среде. Максимальная концентрация исследуемого вещества не должна превышать 100 г/л, но в испытании предпочтительны максимальные концентрации ниже 10
г/л, чтобы обеспечить биоразложение, следующее кинетике первого порядка. Самая низкая концентрация не должна превышать 10
г/л, но в испытании самые низкие концентрации, от 1 до 2
г/л или менее 1
г/л, являются предпочтительными. Обычно, точный анализ такой низкой концентрации может быть достигнут путем использования коммерчески доступных
меченых веществ. Из-за аналитических ограничений зачастую невозможно измерить концентрацию исследуемого вещества с требуемой точностью, если исследуемое вещество применяется с концентрацией
100
г/л (см. подпункт 3.5.2.1). Более высокие концентрации исследуемого вещества (>100
г/л, а иногда и >1 мг/л) могут быть использованы с целью идентификации и количественной оценки основных продуктов превращения или когда не доступен определенный метод анализа с низким пределом обнаружения. При тестировании высоких концентраций исследуемого вещества не всегда можно использовать результаты определения константы разложения первого порядка и период полураспада, так как разложение, возможно, не будет следовать кинетике первого порядка.
3.1.2 Разложение в определенные интервалы времени сопровождается измерением остаточной или остаточной концентрации исследуемого вещества, когда применяется конкретный химический анализ.
-метка самой устойчивой части молекулы позволяет определить общую минерализацию, в то время как
метка менее устойчивой части молекулы, а также использование специального анализа, дает оценку только первичной биоразлагаемости. Однако самая устойчивая часть не обязательно включает соответствующие функциональные части молекулы (которые могут быть связаны с конкретным свойством, как, например, токсичность, биоаккумуляция и т.д.). Если это так, то можно использовать исследуемое вещество, которое имеет
метку в функциональной части, чтобы сопровождаться устранением конкретного свойства.
3.2 Применимость метода
3.2.1 Данное имитационное испытание применяется к нелетучим или слаболетучим органическим веществам, тестируемым при низкой концентрации. Используя фляги, открытые для проникновения атмосферы (например, закупоренные ватной пробкой), вещества с константами закона Генри менее, чем примерно 1 Па·м/моль (приблизительно 10
атм·м
/моль), практически, могут считаться нелетучими. Используя закрытые фляги со свободным пространством, слаболетучие вещества (с константами закона Генри <100 Па·м
/моль или <10
атм·м
/моль) можно протестировать без потерь в испытательной системе. Потеря
-меченых веществ может происходить в случае несоблюдения соответствующих мер предосторожности при удалении
. В таких ситуациях, необходимо проводить улавливание
во внутренний поглотитель с щелочью или использовать внешнюю систему поглотителя
(прямое определение
![]() ; см. приложение В). Для определения кинетики биоразложения, концентрации исследуемого вещества должны быть ниже их уровня растворимости в воде. Однако следует отметить, что в литературе показатели растворимости в воде могут быть значительно выше растворимости исследуемого вещества в природных водах. Вдобавок растворимость особо труднорастворимых в воде исследуемых веществ может быть установлена с помощью исследуемых природных вод.
; см. приложение В). Для определения кинетики биоразложения, концентрации исследуемого вещества должны быть ниже их уровня растворимости в воде. Однако следует отметить, что в литературе показатели растворимости в воде могут быть значительно выше растворимости исследуемого вещества в природных водах. Вдобавок растворимость особо труднорастворимых в воде исследуемых веществ может быть установлена с помощью исследуемых природных вод.
3.2.2 Метод может быть использован для моделирования биоразложения в поверхностных водах, не содержащих крупные частицы ("тест с океаническими отложениями"), или в мутных поверхностных водах, которые, например, находятся на границе раздела вода/осадок ("тест с взвешенными наносами").
3.3 Испытуемое вещество
3.3.1 В этом испытании могут быть использованы и меченые, и немеченые исследуемые вещества. Рекомендуется использовать технику нанесения метки, и метка, как правило, должна находиться в самой устойчивой(ых) части (частях) молекулы (см. также подпункт 3.1.2). Для веществ, содержащих более одного ароматического кольца, один или несколько атомов углерода в каждом кольце должны иметь, предпочтительно,
метку. Кроме того, предпочтительно, чтобы один или несколько атомов углерода на обеих концах легко разрываемых связей имели
метку. Химическая и/или радиохимическая чистота исследуемого вещества должна составлять >95%. Для меченых веществ предпочтительнее удельная активность около 50
Ci/мг (1,85 МБк) или больше, чтобы упростить
измерения в испытаниях, проводимых с низкими первоначальными концентрациями.
Об исследуемом веществе должна быть доступна следующая информация:
- растворимость в воде [4];
- растворимость в органическом(их) растворителе(ях) (веществах, применяемых вместе с растворителем или с низкой растворимостью в воде);
- константа диссоциации (рКа), если вещество способно к протонированию или депротонированию [4];
- давление пара [4] и константа закона Генри;
- химическая устойчивость к воде и в темное время суток (гидролиз) [4].
Когда труднорастворимые в воде вещества проходят испытания в морской воде, важно знать константу высаливания (или "константу Сеченова") , которая определяется выражением:
![]() , (2)
, (2)
где и
- растворимость вещества в пресной и морской воде соответственно и
- молярная концентрация соли.
3.3.2 Если испытание выполняют подобно "тесту с взвешенным осадком", должна быть доступна следующая информация:
- коэффициент разделения н-октанол/вода [4];
- коэффициент адсорбции [4].
3.3.3 Другая полезная информация может включать:
- концентрацию в окружающей среде, если известно или установлено;
- токсичность исследуемого вещества по отношению к микроорганизмам [4];
- полное и/или присущее биоразложение [4];
- исследования процессов превращения в условиях аэробного или анаэробного биоразложения в почве и осадке/воде [4].
3.4 Стандартное вещество
Вещество, которое обычно легко разлагается при аэробных условиях (например, анилин или бензоат натрия), должно быть использовано в качестве стандартного вещества. Ожидаемый период времени для разложения анилина и бензоата натрия составляет обычно менее двух недель. Назначение стандартных веществ заключается в обеспечении микробиологической активности исследуемой воды в определенных пределах, то есть, чтобы в воде присутствовала активная популяция микроорганизмов.
3.5 Критерии качества
3.5.1 Уровень извлечения
Сразу после добавления опытного образца, следует проверить каждую первоначальную концентрацию опытного образца измерением активности или химическими анализами; в тех случаях, когда вещества не имеют метки, - анализами хотя бы дублирующих образцов. Полученная информация дает основание судить о применимости и повторяемости аналитического способа, об однородности распределения опытного вещества. В норме, в последующих анализах данных используют установленную первоначальную активность
или концентрацию опытного образца, а не номинальную концентрацию, поскольку это позволяет компенсировать потери, возникающие из-за сорбции и погрешности при дозировке. Что касается опытного образца с меткой
, извлекаемый в конце испытания уровень дается как баланс массы (см. также пункт 5.4.5). В идеале, меченый баланс массы должен находиться в диапазоне от 90% до 110%, в то время как об аналитической точности можно говорить, только если первоначальное извлечение опытных образцов, без метки, находится в пределах от 70% до 110%. Такие диапазоны интерпретируют как целевые, они не должны использоваться, как критерии на соответствие теста. Кроме этого, определить аналитическую точность можно для опытного образца с концентрацией ниже, чем первоначальная концентрация, а также для большинства продуктов трансформации.
3.5.2 Повторяемость и чувствительность аналитического метода
3.5.2.1 Повторяемость аналитического метода (включая эффективность первоначальной экстракции) для оценки опытного вещества, продуктов трансформации должна проверяться по пяти дублирующим анализам отдельных экстрактов поверхностной воды.
3.5.2.2 Предел обнаружения (LOD) аналитического метода для опытного образца и для продуктов трансформации должен составлять, по меньшей мере, 1% от первоначального количества, применяемого к опытной системе, если возможно. Уровень чувствительности метода (LOQ) должен обеспечивать определение концентрации, составляющей до 10%. Очень часто для химических анализов многих органических веществ и продуктов их трансформации необходимо, чтобы опытное вещество применялось при достаточно высоких концентрациях, т.е. >100 мкг/л.
4 Описание метода
4.1 Оборудование
Тест может выполняться с использованием конических или цилиндрических колб нужной емкости (например, 0,5 или 1,0 л) с пробками из силикона или каучука, либо в колбах с мембраной с непроницаемыми для крышками (например, с перегородками из бутилкаучука). Другой способ выполнения теста основан на использовании колб с несколькими горлышками для сбора содержимого колб целиком, по меньшей мере, в двух экземплярах, в каждом интервале отбора пробы (см. пункт 5.1.3). Для нелетучих опытных образцов, не имеющих радиоактивную метку, газонепроницаемые крышки или пробки не нужны; для них подходят ватные тампоны, для предотвращения попадания примесей из воздуха (см. пункт 5.1.2). Малолетучие вещества испытывают в системе биометрического типа при аккуратном перемешивании поверхностной воды. Дабы избежать попадания бактерий, сосуды могут быть подвергнуты стерилизации нагреванием или обработкой в автоклаве, прежде чем будут использованы. Кроме того, может использоваться следующее стандартное лабораторное оборудование:
- магнитные мешалки или шейкер для непрерывного перемешивания содержимого тестовых колб;
- центрифуга;
- рН метр;
- турбидиметр для измерения нефелометрической мутности;
- печь или микроволновая печь для определения сухого веса;
- аппарат для мембранной фильтрации;
- автоклав или печь для стерилизации стеклянной посуды;
- средства для обработки меченных веществ;
- оборудование для количественного определения активности в образцах, отобранных из ловушек с раствором
и, если необходимо, из образцов отложений;
- аналитическое оборудование для определения исследуемого (и стандартного) вещества, если необходимо проведение конкретного химического анализа (например, газовый хроматограф, жидкостной хроматограф высокого давления).
4.2 Исходные растворы испытуемого вещества
Для исходных растворов исследуемого и стандартного вещества используют деионизированную воду (см. также пункт 4.7.1). Деионизированная вода не должна содержать вещества, токсичные для микроорганизмов, а концентрация растворенного органического углерода DOC не должна превышать 1 мг/л [5].
4.3 Сбор и транспортировка поверхностной воды
Место отбора пробы для сбора поверхностных вод выбирают в соответствии цели испытания, исходя из конкретной ситуации. При выборе мест отбора проб следует учитывать историю возможных сельскохозяйственных, производственных и бытовых сбросов. Если известно, что водная среда загрязнялась исследуемым веществом или его структурным аналогом на протяжении последних четырех лет, то данное место не следует использовать для сбора исследуемой воды, если только целью исследования не является изучение скорости распада вещества в местах, ранее подвергнутых его воздействию. Уровень рН и температуру воды измеряют на месте отбора пробы. Кроме того, записывают глубину, на которой происходил отбор пробы, а также ее внешние характеристики (см. подраздел 7.4). Обязательно измеряют концентрацию кислорода и/или окислительно-восстановительный потенциал как в поверхностном слое воды, так и отложениях, дабы подтвердить аэробные условия, если только это не является очевидным исходя из внешних характеристик и опыта, связанных с историей места отбора. Транспортировка поверхностной воды должна осуществляться в тщательно промытом контейнере. При транспортировке температура образца не должна значительно превышать температуру, используемую при испытании. Если время транспортировки составит более 2 ч, рекомендуют охладить образцы до 4°С. Образец воды замораживанию не подвергать.
4.4 Хранение и подготовка поверхностной воды
Тест предпочтительно должен быть начат в течение одного дня после типовой коллекции. Хранение воды, если нужно, должно быть минимизировано и не должно в любом случае превысить максимум - 4 недели. Водный образец должен быть сохранен в 4°С с проветриванием до использования. До использования грубые частицы должны быть удалены, например, фильтрацией через фильтр нейлона приблизительно со 100 размерами петли m, или грубый бумажный фильтр, или отложение осадка.
4.5 Подготовка воды с добавлением ила (дополнительно)
Для испытания суспендированного ила поверхностный ил добавляют в колбы, содержащие природную воду (фильтрованную для удаления грубых частиц, как описано в подразделе 4.4) для приготовления суспензии; концентрация суспендированных твердых частиц должна находиться в пределах от 0,01 до 1 г/л. Поверхностный ил должен быть собран в том же месте, где был отобран образец воды. В зависимости от особенности водной среды, поверхностный ил может различаться высоким содержанием органического углерода (от 2,5% до 7,5%) и мелкой текстурой, или низким содержанием органического углерода (от 0,5% до 2,5%) и грубой текстурой [2]. Образец поверхностного ила готовят следующим образом: экстрагируют несколько срединных порций ила с помощью трубки из прозрачной пластмассы, срезают верхние аэробные слои (с поверхности на глубину примерно до 5 мм) сразу же после отбора пробы, а затем соединяют. Полученный образец ила переносят в контейнер с большим пространством для воздушной подушки, дабы ил находился в аэробных условиях (охлаждают до 4°С, если продолжительность перевозки превышает 2-3 ч). Образец ила суспендируют в воде, используемой в испытании, при отношении 1:10 и хранят при 4°С в вентилируемой емкости до момента использования. Период хранения ила, если в этом есть необходимость, должен быть минимальным и ни в коем случае не превышать 4 недель.
4.6 Полунепрерывная (дополнительная) процедура
Пролонгированная инкубация (до нескольких месяцев) может понадобиться, если произошел продолжительный разрыв во времени, прежде чем было установлено значительное разложение исследуемого образца. Если данный факт известен из предыдущего испытания вещества, испытание может быть начато с использования полунепрерывной процедуры, которая позволяет периодически обновлять часть исследуемой воды или суспензии (см. приложение Б). Либо нормальный периодический тест может быть заменен на полунепрерывный, если не был достигнут распад исследуемого вещества в течение 60 дней испытания при использовании периодической процедуры (см. также подпункт 4.8.3.1).
4.7 Добавление исследуемого (или стандартного) вещества
4.7.1 Маточный раствор веществ с высокой растворимостью в воде (>1 мг/л) и низкой летучестью (константы Генри <1 Па·м/моль или <10
атм·м
/моль) может быть приготовлен в деионизированной воде (см. подраздел 4.2); соответствующий объем маточного раствора добавляют в тестовые сосуды до нужной концентрации. Объем любого добавляемого маточного раствора должен исходить из используемого на практике минимума (<10% от конечного объема жидкости, по возможности). Другая процедура, в которой исследуемое вещество растворяют в большем объеме воды, используемой при испытании, может рассматриваться как альтернатива использованию органических растворителей.
4.7.2 Если неизбежно, маточные растворы малолетучих веществ с плохой растворимостью в воде готовят с использованием летучего органического растворителя, но количество добавляемого в тестовую систему растворителя не должно превышать 1% об./об. и не должно оказывать отрицательного воздействия на микробную активность. Растворитель не должен влиять на стабильность исследуемого вещества в воде. Следует произвести испарение растворителя до чрезвычайно малого количества, так чтобы он не увеличил значительно концентрацию DOC воды или суспензии, используемых в испытании. Это необходимо проверить конкретным анализом по веществу или, если возможно, анализом DOC [5]. Следует ограничить количество растворителя до того уровня, при котором происходит его трансформация до абсолютно необходимого уровня, чтобы удостовериться, что количество исследуемого вещества способно растворяться в конечном объеме воды, используемой в испытании. Поместить исследуемое вещество в тестовые сосуды можно иными способами, описанными в [6] и [7]. При использовании органического растворителя с исследуемым веществом, с контрольными образцами растворителя, содержащими воду, используемую при испытании (без добавлений), и воду для испытания с добавлением стандартного вещества, поступают так же, как и с активными тестовыми сосудами, с добавленным количеством исследуемого вещества в носителе растворителя. Цель контрольных образцов растворителя - изучить возможное отрицательное воздействие, вызванное растворителем по отношению к микробной популяции, на что показывает разложение стандартного вещества.
4.8 Условия испытания
4.8.1 Температура проведения испытания
Инкубацию проводят в темном месте (предпочтительное условие) или при рассеянном свете при регулируемой температуре (±2°С), которая может быть либо полевой, либо стандартной температурой от 20°С до 25°С. Полевая температура - это либо реальная температура образца в момент отбора, либо средняя полевая температура в месте отбора пробы.
4.8.2 Перемешивание
Для поддержания частиц и микроорганизмов во взвешенном состоянии прибегают к использованию перемешивающих устройств, таких как непрерывный шейкер или мешалка. Перемешивание также способствует переносу кислорода из незаполненного пространства над образцом в жидкость, что обеспечивает нужные аэробные условия. Колбы помещают на столик шейкера (скорость перемешивания примерно 100 об/мин), либо используют магнитную мешалку. Перемешивание должно быть непрерывным. Тем не менее встряхивание или перемешивание должны выполняться как можно мягче, одновременно сохраняя гомогенное состояние суспензии.
4.8.3 Продолжительность испытания
4.8.3.1 Продолжительность испытания в норме не должна превышать 60 дней, только если не используется полунепрерывная процедура с периодическим обновлением исследуемой суспензии (см. приложение Б). Между тем период испытания периодического теста может быть максимально увеличен до 90 дней, если первоначально разложение исследуемого вещества началось в шестидесятидневный период. Разложение отслеживают, придерживаясь графика временных интервалов, определением остаточной активности или выделившимся
![]() (см. пункты 5.4.1-5.4.5), и/или химическим анализом (пункты 5.5.1-5.5.3). Инкубационный период должен быть достаточно продолжительным для оценки процесса разложения. Степень разложения в предпочтительном варианте должна превышать 50%; для медленно разлагаемых веществ степень разложения должна быть достаточной (в норме более 20%), дабы обеспечить расчет кинетической константы скорости разложения.
(см. пункты 5.4.1-5.4.5), и/или химическим анализом (пункты 5.5.1-5.5.3). Инкубационный период должен быть достаточно продолжительным для оценки процесса разложения. Степень разложения в предпочтительном варианте должна превышать 50%; для медленно разлагаемых веществ степень разложения должна быть достаточной (в норме более 20%), дабы обеспечить расчет кинетической константы скорости разложения.
4.8.3.2 Обязательно выполняют периодические измерения рН и концентрации кислорода в исследуемой системе, если только предыдущий опыт, приобретенный в предыдущих схожих испытаниях с использованием образцов воды и ила, полученных в тех же местах, не делает такие измерения необязательными. В некоторых условиях метаболизм первичных субстратов при более высоких концентрациях, присутствующих в воде или иле, может привести к достаточному выделению и истощению кислорода, что значительно изменяет экспериментальные условия в ходе испытания.
5. Процедура проведения испытания
5.1 Подготовка колб для пелагического исследования
5.1.1 Помещают нужный объем воды, используемой в испытании, в опытные сосуды примерно на треть от объема самой колбы, но не менее 100 мл. При использовании колб с несколькими горлышками (которые позволяют собирать полностью содержимое колб каждый раз при отборе проб) соответствующий объем воды, используемой в испытании, должен также составлять 100 мл, поскольку малые объемы образца могут влиять на продолжительность лаг-фазы. Исследуемый образец добавляют из маточного раствора, как описано в параграфах 4.2, 4.7. Для определения кинетики распада и для расчета кинетической константы скорости распада используют как минимум две различные концентрации исследуемого вещества, отличающиеся на коэффициент от 5 до 10. Обе выбранные концентрации должны составлять менее 100 г/л, и желательно в диапазоне от 1 до 10
г/л.
5.1.2 Закупоривают колбы пробками или крышками, непроницаемыми для воздуха и . Для немеченых
, нелетучих исследуемых веществ для закупоривания подходят ватные тампоны, которые предотвращают попадание примесей из воздуха (см. подраздел 4.1), при условии, что основные продукты разложения не являются летучими, а также при условии использования косвенных определений
(см. приложение В).
5.1.3 Выдерживают колбы при выбранной температуре (см. подпункт 4.8.1). Извлекают образцы для химического анализа или для измерения активности в начале испытания (т.е. до начала биоразложения; см. пункт 4.5.1), а затем в нужные временные интервалы в течение всего испытания. Отбор образца может осуществляться извлечением частей пробы (например, 5 мл аликвотная проба) из каждого дублирующего образца либо сбором всего содержимого колбы при каждом отборе. Минерализация исследуемого вещества может быть определена как прямым, так и косвенным способом (см. приложение В). Обычно, как минимум, требуется пять точек отбора проб в ходе фазы разложения (т.е. после завершенной лаг-фазы), дабы достоверно рассчитать константу скорости, если только не имеется обоснование, что отбор проб в трех точках является достаточным для быстроразлагаемых веществ. Для веществ, которые не склонны к быстрому разложению, проводят большее число измерений в ходе фазы разложения, расчет k выполняется с помощью большего числа данных. Фиксированного графика отбора проб не существует, поскольку скорость биоразложения различна; все же отбор проб рекомендуют проводить раз в неделю, если разложение протекает медленно. Если исследуемое вещество разлагается быстро, отбор проб должен проводиться раз в день в течение первых трех дней и на каждый второй или третий день после этого. При определенных обстоятельствах, таких как вещества быстрого гидролиза, может потребоваться отбирать пробы через несколько часов. По этой причине рекомендуют проводить предварительный тест перед проведением исследования, дабы определить необходимые интервалы отбора проб. Если образец необходим для дополнительных специфичных анализов, рекомендуют подготовить большее количество образцов и выбрать те, которые будут проанализированы в конце эксперимента, следуя обратной стратегии, т.е. последние образцы анализируют первыми (см. пункт 5.5.2) относительно стабильности образцов при хранении.
5.2 Число колб и образцов
5.2.1 Определяют нужное число опытных колб, чтобы обеспечить процедуру:
- тестовыми колбами; по меньшей мере, дублирующее количество колб для каждой концентрации исследуемого вещества (желательно как минимум три) или тестовые колбы с несколькими горлышками для каждой концентрации, если собирают все содержимое колбы при каждом отборе проб (обозначение );
- холостой пробой, без исследуемого вещества; по меньшей мере, одну колбу с холостой пробой, содержащей только воду, используемую в испытании (обозначение );
- стандартным контрольным образцом; две колбы со стандартным веществом (например, анилин или бензоат натрия, 10 µг/л) (обозначение ). Цель сравнительного контрольного образца - подтвердить минимум микробной активности. Если удобно, может использоваться меченое стандартное вещество также и при отслеживании разлагаемости исследуемого вещества в ходе химического анализа;
- стерильным контрольным образцом; одна или две колбы, содержащие стерилизованную воду, исследуемую в анализе, для изучения возможного абиотического разложения или другого небиологического удаления исследуемого вещества (обозначение ). Остановить биологическую активность можно обработкой воды, используемой в испытании, в автоклаве (при 121°С, 20 мин), либо добавлением яда (например, азид натрия
![]() в концентрации от 10 до 20 г/л, хлорида ртути
в концентрации от 10 до 20 г/л, хлорида ртути ![]() в концентрации 100 мг/л или формалина, 100 мг/л), либо гамма-излучением. Если используют
в концентрации 100 мг/л или формалина, 100 мг/л), либо гамма-излучением. Если используют ![]() , то его ликвидирование должно выполняться как ликвидация токсичных отходов. В том случае, когда в воду добавляют большое количество ила, добиться стерильных условий достаточно нелегко; в этом случае рекомендуют повторную обработку в автоклаве (например, до трех раз). Необходимо учитывать, что обработка в автоклаве может изменить сорбирующие свойства ила;
, то его ликвидирование должно выполняться как ликвидация токсичных отходов. В том случае, когда в воду добавляют большое количество ила, добиться стерильных условий достаточно нелегко; в этом случае рекомендуют повторную обработку в автоклаве (например, до трех раз). Необходимо учитывать, что обработка в автоклаве может изменить сорбирующие свойства ила;
- контрольными образцами растворителя, содержащими тестовую воду и тестовую воду со стандартным веществом; колбы в двух экземплярах, обработанные одинаковым количеством растворителя, с использованием той же процедуры, которая применяется для исследуемого вещества. Цель - изучить возможность отрицательного воздействия растворителя, прибегая к разложению стандартного вещества.
5.2.2 При планировании испытания исследователь должен учитывать относительную важность возросших экспериментальных повторений в сравнении с увеличившимся числом интервала отбора проб. Точное необходимое число колб будет зависеть от метода, используемого для измерения разложения (см. пункты 5.1.3 и 5.4.1-5.4.5 и приложение В).
5.2.3 Две части образца (например, 5 мл аликвотной пробы) извлекают из каждой тестовой колбы в каждом интервале отбора проб. При использовании колб с несколькими горлышками для сбора всего содержимого колбы, как минимум две колбы должны быть использованы при каждом отборе проб (см. пункт 5.1.1).
5.3 Подготовка фляг для приостановленного (дополнительного) теста осадка
Добавляют необходимые объемы тестовой воды и ила, если это необходимо, в тестовые сосуды (см. подраздел 4.5). Подготовка колб для суспендированного ила является той же, что и для пелагического исследования (см. пункты 5.1.1-5.2.3). Рекомендуют использовать бутыли в мембранным крышками или колбы схожей формы. Помещают закрытые колбы горизонтально на столик шейкера. Открытые колбы, содержащие немеченые , нелетучие вещества, должны быть установлены вертикально; для этого случая рекомендуют использовать магнитную мешалку, у которой магниты покрыты стеклом. Если необходимо, проводят аэрацию бутылей для поддержания соответствующих аэробных условий.
5.4 Определение радиохимическими способами
5.4.1 Выделившийся ![]() определяют прямым и косвенным способом (см. приложение В).
определяют прямым и косвенным способом (см. приложение В). ![]() определяют косвенно, определив разницу между начальной активностью
определяют косвенно, определив разницу между начальной активностью ![]() в изучаемом образце воды или суспензии и общей остаточной активностью в момент отбора пробы, установленную после того, когда образец подвергли окислению до уровня от 2 до 3 рН и отгонке
в изучаемом образце воды или суспензии и общей остаточной активностью в момент отбора пробы, установленную после того, когда образец подвергли окислению до уровня от 2 до 3 рН и отгонке испарением. Таким образом, происходит удаление неорганического углерода; измеренную же остаточную активность рассчитывают на основе органического материала. Метод косвенного определения
![]() не используется, если большая часть летучих продуктов трансформации образована в ходе трансформации опытного вещества (см. приложение В). Где возможно, рост
не используется, если большая часть летучих продуктов трансформации образована в ходе трансформации опытного вещества (см. приложение В). Где возможно, рост ![]() должен устанавливаться прямым способом (см. приложение В) при каждом отборе проб и хотя бы с использованием одного образца; данная процедура позволяет проверить баланс массы и процесс разложения, но подходит только для тех испытаний, где используются закрытые колбы.
должен устанавливаться прямым способом (см. приложение В) при каждом отборе проб и хотя бы с использованием одного образца; данная процедура позволяет проверить баланс массы и процесс разложения, но подходит только для тех испытаний, где используются закрытые колбы.
5.4.2 Если задействованный ![]() измеряют прямым способом в ходе испытания, в самом его начале следует подготовить большее количество колб. Прямое определение
измеряют прямым способом в ходе испытания, в самом его начале следует подготовить большее количество колб. Прямое определение ![]() рекомендуют в том случае, если большая часть летучих продуктов трансформации образуется в ходе трансформации опытного вещества. В каждой точке измерения содержимое колб с дополнительным образцом окисляют до уровня от 2 до 3 рН,
рекомендуют в том случае, если большая часть летучих продуктов трансформации образуется в ходе трансформации опытного вещества. В каждой точке измерения содержимое колб с дополнительным образцом окисляют до уровня от 2 до 3 рН, собирают во внутренний или внешний абсорбер (см. приложение В).
5.4.3 Дополнительно, концентрации опытного вещества с радиационной меткой и основные продукты трансформации могут быть определены радиационно-химической хроматографией (например, тонкослойной хроматографией, RAD-TLC) или жидкостной хроматографией высокого давления с радиационным детектированием.
5.4.4 Дополнительно могут быть определены такие показатели, как фазовое распределение оставшейся радиоактивности (см. приложение А), оставшееся количество опытного вещества и продуктов трансформации.
5.4.5 В конце испытания баланс массы должен быть определен прямым измерением ![]() , с использованием отдельные колбы с образцами, из которых не извлекали образцы в ходе испытания (см. приложение В).
, с использованием отдельные колбы с образцами, из которых не извлекали образцы в ходе испытания (см. приложение В).
5.5 Специальный химический анализ
5.5.1 При наличии чувствительного специально разработанного аналитического метода оценка первичного разложения может быть выполнена измерением общей остаточной концентрации опытного вещества вместо использования способов с радиационной маркировкой. При использовании в испытании вещества с радиационной маркировкой (для измерения общей минерализации), допускается параллельное проведение специальных химических анализов, дабы получить дополнительную информацию и проверить саму процедуру. Специальные химические анализы могут также использоваться для измерения продуктов трансформации, образующихся при распаде опытного вещества, данный способ особенно подходит для веществ, которые минерализуются с периодом полураспада, составляющим более 60 дней. Каждый раз при отборе проб требуется измерять и указывать в отчете концентрацию опытного вещества и продуктов трансформации (как концентрацию и как ее процентное содержание). Продукты трансформации, установленные при концентрации 10%, требуют идентификации при каждом отборе проб, при отсутствии иных разумных контраргументов. Те продукты трансформации, чьи концентрации непрерывно растут в ходе исследования, следует также учитывать, даже если их концентрации не превышают указанного выше предела, поскольку это может указывать на их устойчивость. В том случае, если допускается возможность быстрой абиотической трансформации опытного вещества (например, гидролиз), прибегают к анализам продуктов трансформации в стерильных контрольных образцах. Потребность в определении количества и идентификации продуктов трансформации определяется исходя из каждого конкретного случая, обоснования должны быть указаны в отчете. Способы экстракции, в которых используются органические растворители, должны применяться в соответствии с руководствами, содержащимися в соответствующих аналитических процедурах.
5.5.2 Все образцы должны храниться при температуре от 2°С до 4°С и в герметичных условиях, если анализ будет выполнен в течение 24 ч (что является предпочтительным вариантом). Для более длительного хранения образцы замораживают до температуры ниже минус 18°С или консервируют химическим способом. Для консервации образцов не рекомендуется прибегать к окисления, поскольку окисленные образцы могут стать нестабильными. Если образец не будет испытан в течение 24 ч и подлежит более длительному хранению, следует провести исследование на его стабильность при хранении, дабы удостовериться, что стабильность интересуемых химических веществ при хранении в условиях консервации или при минус 18°С сохраняется. Если в аналитическом методе прибегают к экстракции растворителем или экстракции твердой фазы, то ее выполняют сразу после отбора пробы или после хранения образца в замороженном состоянии, максимальное время которого составляет 24 ч.
5.5.3 В зависимости от чувствительности аналитического метода могут понадобиться образцы большего объема, чем те, что указаны в подразделе 4.1. Испытания могут легко выполняться с образцами объемом 1 л в колбах вместимостью от 2 до 3 л, благодаря чему становится возможным отбирать образцы в количестве 100 мл.
6 Данные и отчет о проведении испытания
6.1 Обработка результатов
6.1.1 График с нанесенными данными
6.1.1.1 Округляют время отбора проб до целых чисел, т.е. до часов (если только минуты не играют значительной роли для значительного распада вещества), округлять число как сутки недопустимо. Наносят на график оценочные значения остаточной активности опытного вещества (веществ с маркировкой ) или остаточной концентрации (веществ без маркировки) в зависимости от времени, как на линейном, так и на полулогарифмическом графике (см. рисунки 1a и 1b). Если имел место распад, то результаты, полученные для образцов из колб
, сравнивают с теми, что были получены для образцов из колб
. Если средние значения результатов для образцов из колб с опытным веществом
и колб со стерильными образцами
отклоняются менее чем на 10%, то можно предположить, что наблюдаемое разложение преимущественно носит абиотический характер. Если полученные значения разложения в колбах
ниже, то для коррекции можно прибегнуть к значениям, что были получены для образцов из колб
, дабы оценить степень биоразлагаемости. При выполнении дополнительных анализов для основных продуктов трансформации графики с кривыми их образования и снижения должны дополнять кривую снижения опытного вещества.
|
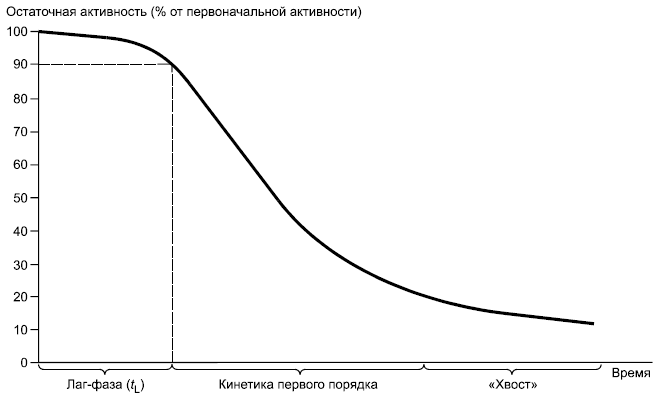
Рисунок 1a - Пример арифметического графика с данными (остаточная активность в зависимости от времени)
|
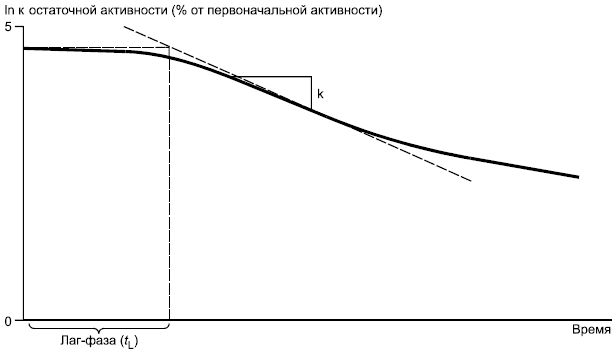
Рисунок 1b - Пример полулогарифмического графика с данными (отношение к остаточной активности на протяжении времени)
6.1.1.2 Определяют продолжительность лаг-фазы по кривой разложения (полулогарифмический график) путем экстраполяции линейной части на нулевое значение распада или же определением времени, когда распад составляет примерно 10% (см. рисунки 1a и 1b). С помощью полулогарифмического графика определяют константу скорости первого порядка
и ее стандартную погрешность с помощью линейной регрессии
(активности остаточного вещества с маркировкой
или концентрации опытного вещества) в зависимости от времени. Выполняя, в частности, оценку с помощью веществ с маркировкой
, используют только те данные, что принадлежат первоначальной линейной части кривой после завершенной lag-фазы, предпочтение отдают выбору нескольких репрезентативных данных, а не в пользу большего числа менее достоверных данных. Под недостоверностью в данном случае понимают присущие погрешности, возникающие при рекомендуемом прямом использовании установленных значений остаточной активности
(см. ниже). Иногда может оказаться полезным рассчитать две различные константы скорости, если распад происходит по двухфазной модели. Для этого определяют две различные фазы кривой распада. Расчеты константы скорости
и периода полураспада
![]() должны выполняться для всех отдельных дублирующих колб, когда часть пробы отбирают из одной и той же колбы, или путем использования средних значений, когда содержимое колб отбирается целиком в положенный момент времени отбора проб (см. пункт 5.2.3). При использовании первой упомянутой процедуры, константа скорости и период полураспада указывают в отчете для каждой отдельной дублирующей колбы, а также как среднее значение с учетом стандартной погрешности. При использовании высоких концентраций опытного вещества, кривая распада может значительно отклоняться от прямой линии (полулогарифмического графика), а значение кинетики первого порядка может оказаться неверным. Поэтому определение периода полураспада не имеет значения. Тем не менее при ограниченном диапазоне данных может применяться псевдокинетика первого порядка, и становится возможным определить время полураспада DT50 (время, необходимое для распада 50% вещества). Следует помнить, что период времени распада, выходящий за рамки диапазона выбранных данных, не может быть предсказан с помощью DT50, который является просто описанием (дескриптором) данного комплекта данных. Существует большое количество высокоточных программных продуктов, упрощающих выполнение статистических расчетов и подгонки кривой, рекомендованных к использованию.
должны выполняться для всех отдельных дублирующих колб, когда часть пробы отбирают из одной и той же колбы, или путем использования средних значений, когда содержимое колб отбирается целиком в положенный момент времени отбора проб (см. пункт 5.2.3). При использовании первой упомянутой процедуры, константа скорости и период полураспада указывают в отчете для каждой отдельной дублирующей колбы, а также как среднее значение с учетом стандартной погрешности. При использовании высоких концентраций опытного вещества, кривая распада может значительно отклоняться от прямой линии (полулогарифмического графика), а значение кинетики первого порядка может оказаться неверным. Поэтому определение периода полураспада не имеет значения. Тем не менее при ограниченном диапазоне данных может применяться псевдокинетика первого порядка, и становится возможным определить время полураспада DT50 (время, необходимое для распада 50% вещества). Следует помнить, что период времени распада, выходящий за рамки диапазона выбранных данных, не может быть предсказан с помощью DT50, который является просто описанием (дескриптором) данного комплекта данных. Существует большое количество высокоточных программных продуктов, упрощающих выполнение статистических расчетов и подгонки кривой, рекомендованных к использованию.
6.1.1.3 При выполнении специфических химических анализов количественную оценку констант скорости и периодов полураспада первичного разложения определяют, как описано ранее для общей минерализации. Если первичное разложение является ограниченным процессом, то иногда можно использовать показатели всего периода распада. Это возможно благодаря тому, что измерения носят прямой характер по сравнению с измерениями активности .
6.1.1.4 Если используются вещества с маркировкой, то массовый баланс выражают как процентное содержание применяемой первоначальной концентрации, хотя бы в конце испытания.
6.1.2 Остаточная активность
Когда -маркированная часть органического вещества разложена, главная часть
преобразована в
![]() , в то время как другая часть используется для роста биомассы и/или синтеза внеклеточных метаболитов. Поэтому "окончательный" биологический распад вещества не приводит к 100%-ному преобразованию его углерода в
, в то время как другая часть используется для роста биомассы и/или синтеза внеклеточных метаболитов. Поэтому "окончательный" биологический распад вещества не приводит к 100%-ному преобразованию его углерода в ![]() .
. , встроенный в продукты, сформированные биосинтезом, впоследствии выпускается медленно, как
![]() , из-за "вторичной минерализации". Вследствие этого на графиках остаточной активности органического
, из-за "вторичной минерализации". Вследствие этого на графиках остаточной активности органического (измерена после удаления
) или графиках зависимости
![]() от времени будет наблюдаться "хвост" после завершения разложения. Это усложняет кинетическую интерпретацию данных, и с этой целью только начальная часть кривой (после того, как законченная фаза задержки приблизительно перед 50 %-ной деградацией достигнута) должна обычно использоваться для оценки константы скорости разложения. Если исследуемое вещество подверглось разложению, то суммарная активность
от времени будет наблюдаться "хвост" после завершения разложения. Это усложняет кинетическую интерпретацию данных, и с этой целью только начальная часть кривой (после того, как законченная фаза задержки приблизительно перед 50 %-ной деградацией достигнута) должна обычно использоваться для оценки константы скорости разложения. Если исследуемое вещество подверглось разложению, то суммарная активность будет всегда выше, чем активность
, связанная с остающимся интактным исследуемым веществом. Если исследуемое вещество подвергается разложению в соответствии с кинетикой первого порядка и постоянная фракция
минерализируется в
, начальный угол наклона кривой исчезновения
(общее количество, органическое
против времени) будет равен
, умноженной на угол наклона кривой соответствующей концентрации исследуемого вещества (или, более точно, части исследуемого вещества, меченого
). Используя измерения общей нескорректированной органической активности
значение рассчитанной константы скорости будет консервативным. Процедуры по оценке концентраций исследуемого вещества на основе измеренной радиоактивности и различных при упрощениях были описаны в литературе [1], [8], [9], [10]. Такие процедуры легче всего применить к быстро разлагающимся веществам.
6.2 Интерпретация результатов
6.2.1 Если установлено, что k не зависит от введенной концентрации (т.е. если расчетный k составляет примерно то же самое при разных концентрациях исследуемого вещества), можно предположить, что константа скорости первого порядка представляет условия используемого испытания, т.е. исследуемое вещество, образец воды и температуру испытания. Экспертная оценка должна определить, до какой степени результаты могут быть обобщены или экстраполированы к другим системам. Если используется высокая концентрация исследуемого вещества и поэтому разложение не следует за кинетикой первого порядка, данные не могут быть использованы для прямой оценки константы скорости первого порядка или соответствующего периода полураспада. Однако данные, полученные из испытания с использованием высокой концентрации исследуемого вещества, по-прежнему могут быть пригодны для оценки степени полной минерализации и/или обнаружения и определения количества продуктов превращения.
6.2.2 Если известны скорости потерь иных процессов, кроме биоразложения (например, гидролиз или улетучивание), они могут быть вычтены из скорости чистой потери, наблюдаемой при испытании, чтобы получить приблизительную оценку скорости биоразложения. Данные по гидролизу, например, могут быть получены из испытания стерильного контрольного образца или из параллельного испытания, проводимого с использованием повышенной концентрации исследуемого вещества.
6.2.3 Косвенное и прямое определение ![]() (пункты 5.4.1-5.4.5 и приложение В) может использоваться только для измерения степени минерализации исследуемого вещества по отношению к
(пункты 5.4.1-5.4.5 и приложение В) может использоваться только для измерения степени минерализации исследуемого вещества по отношению к . Хроматография с радиометрическим детектированием (RAD-TLC) или высокоэффективная жидкостная хроматография (HPLC) может использоваться для анализа концентрации
меченого исследуемого вещества и образования основных продуктов превращения (параграф 37). Чтобы получить прямую оценку полураспада, необходимо, чтобы основные продукты превращения (определено как
10% используемого исследуемого вещества) отсутствовали. Если основные продукты превращения, как определено здесь, присутствуют, требуется подробная оценка данных. Сюда может включаться повторное испытание и/или идентификация продуктов превращения, если доля продуктов превращения не может быть правильно оценена с помощью опыта (например, информация о цикле разложения). Поскольку пропорция исследуемого вещества углерода, превращенного в
, изменяется (в зависимости в основном от концентрации исследуемого вещества и других имеющихся субстратов, условий испытания и микробной популяции), данное испытание не позволяет выполнить прямую оценку окончательного биоразложения, как в испытании на отмирание бактерий в присутствии растворенного органического углерода (DOC), но результат подобен полученному с помощью спирометрического испытания. Степень минерализации, таким образом, будет меньше или равна минимальному уровню окончательного биоразложения. Чтобы получить более полную картину окончательного биоразложения (минерализация и введение в биомассу), анализ распределения фазы
должен быть выполнен в конце испытания (см. приложение А).
в макрочастицах будет состоять из суммарного количества
, введенного в бактериальную биомассу, и
, поглощенного органическими частицами.
6.3 Достоверность испытания
6.3.1 Если стандартное вещество не разлагается в пределах ожидаемого периода времени (для анилина и бензоата натрия, обычно менее двух недель), достоверность испытания подвергается сомнению и в дальнейшем должна быть проверена, или альтернативно испытание необходимо повторить с новым образцом воды. В методе ISO группового испытания, где участвуют семь лабораторий, расположенных по всей Европе, подходящие константы скорости разложения для анилина находились в диапазоне от 0,3 до 1,7 дней со средним значением 0,8
при температуре 20°С и стандартной погрешностью ±0,4
(
=0,9 дня). Типичные периоды лаг-времени составляли от 1 до 7 дней. Сообщали, что бактериальная биомасса в исследованных водах соответствовала от 10
до 10
колониеобразующим единицам CFU на мл. Скорость разложения в богатых питательными веществами центрально-европейских водах была выше, чем в скандинавских олиготрофных водах, что может быть обусловлено разностью трофического статуса или предшествующим воздействием химических веществ.
6.3.2 Полное извлечение (баланс массы) в конце эксперимента должно быть от 90% до 110% для меченых веществ, в то время как первоначальное извлечение (в начале эксперимента) от 70% до 110% - для немеченых веществ. Однако обозначенные диапазоны должны интерпретироваться только как целевые и не должны использоваться как критерии достоверности испытания.
6.4 Отчет об испытании
Тип исследования, т.е. испытание с океаническим или взвешенным осадком, должен быть ясно изложен в отчете о проведении испытания, который должен также содержать хотя бы следующую информацию:
Исследуемое(ые) и стандартное(ые) вещество(а):
- общие названия, химические названия (названия, рекомендованные по IUPAC и/или CAS), номера CAS, структурные формулы (с указанием позиции , если используется меченое вещество) и соответствующие физико-химические свойства исследуемого и стандартного веществ (см. пункты 3.3-3.4);
- химические названия, номера CAS, структурные формулы (с указанием позиции , если используется меченое вещество) и соответствующие физико-химические свойства веществ, используемых в качестве стандартов для идентификации и количественного определения продуктов превращения;
- чистота (примеси) исследуемых и стандартных веществ;
- радиохимическая чистота меченых химических веществ и удельная активность (если имеется).
Поверхностные воды:
необходима следующая минимальная информация об отборе пробы воды:
- расположение и описание места отбора пробы, в том числе, если возможно, история загрязнения;
- дата и время выборки образцов;
- питательные вещества (общее количество , аммоний, нитрит, нитрат, общее количество
, растворенный ортофосфат);
- глубина отбора;
- внешний вид образца (например, цвет и мутность);
- растворенный общий углерод (DOC) и общий органический углерод (ТОС);
БПК (BOD);
- температура и рН на месте и время отбора;
- кислород или окислительно-восстановительный потенциал (обязательно только в случае, если аэробные условия не очевидны);
- соленость или проводимость (в случае морской воды и соленой воды);
- взвешенные твердые вещества (в случае мутного образца);
- возможна другая важная информация о месте отбора проб во время выполнения отбора (например, фактические или исторические данные о скорости речного или морского течения вблизи основных пунктов сброса, а также тип сбросов, погодные условия, предшествующие времени отбора проб);
и дополнительно:
- микробная биомасса (например, прямой подсчет акридинового оранжевого или колониеобразующие единицы);
- неорганический углерод;
- концентрация хлорофилла-а в качестве специальной оценки водорослевой биомассы.
Кроме того, в случае выполнения испытания со взвешенным осадком должна быть предоставлена следующая информация об осадке:
- глубина отбора осадка;
- внешний вид осадка (например, окрашенный, запачканный, илистый или песчаный);
- текстура (например, процент крупных частиц песка, мелкого песка, ила и глины)
- сухой вес в г/л взвешенных твердых частиц, концентрация ТОС или потеря веса при воспламенении как измерение содержания органического вещества;
- фактор рН;
- кислород или окислительно-восстановительный потенциал (обязательно только в случае, если аэробные условия не очевидны).
Условия испытания:
- задержка между отбором и использованием в лабораторном испытании, хранение образца и предварительная обработка образца, даты выполнения исследований;
- используемое количество исследуемого вещества, концентрация исследуемого и стандартного веществ;
- метод применения исследуемого вещества, включая любое использование растворителей;
- используемый объем поверхностной воды и осадка (если используется) и объем отобранного образца в каждом интервале времени для анализа;
- описание используемой системы испытания.
Если условия темноты не являются обязательными, указывают информацию об использовании "рассеянного света";
- информация о методе(ах), используемом(ых) для создания контрольных стерильных образцов (например, температура, время и число обработок в автоклаве);
- температура инкубации;
- информация об аналитических методах и методе(ах), используемом(ых) для радиохимических измерений и для проверки баланса массы, а также измерений распределения фазы (если проводятся);
- число параллельных проб.
Результаты:
- процент извлечения (см. пункт 4.5.1);
- воспроизводимость и чувствительность используемых аналитических методов, включая предел обнаружения LOD и предел определения количества LOQ (см. пункт 4.5.2);
- все результаты измерений (включая моменты времени отбора проб) и вычисленные значения в форме таблицы и кривые разложения. Для каждой исследуемой концентрации и для каждой дублирующей колбы указывают линейный коэффициент корреляции наклона в логарифмическом графике, рассчитанную лаг-фазу и константу скорости первого порядка или псевдопервого порядка (если возможно) и соответствующий полураспад (или период полураспада, );
- указывают соответствующие значения как среднее значение результатов, наблюдаемых в отдельных параллельных пробах, например период лаг-фазы, константу скорости разложения и период полураспада (или );
- классифицируют систему на неадаптированную или адаптированную, учитывая вид кривой разложения и возможное воздействие исследуемой концентрации;
- результаты окончательной проверки баланса массы и результаты измерений распределения фазы (если таковые имеются);
- фракция -меченого вещества и, при применении специальных анализов, конечная степень первичного разложения;
- идентификация, молярная концентрация и процент используемых основных продуктов превращения (см. пункт 5.5.1), если уместно;
- предложенный цикл превращения, если уместно;
- обсуждение результатов.
Приложение А
(справочное)
Фазовое распределение
Для проверки процедуры повторяющиеся измерения оставшейся общей активности органического (ТОА) должны сопровождаться измерениями материального баланса, включающих прямое определение выделившегося
![]() , после его улавливания на абсорбере (см. приложение 4*). По своей сущности образование
, после его улавливания на абсорбере (см. приложение 4*). По своей сущности образование ![]() является прямым свидетельством факта биоразложения, в отличие от процессов абиотического разложения или других потерь, таких как испарительный перенос или сорбция. Дополнительные ценные данные, характеризующие характер биоразложения, можно получить из измерений распределения общей активности органического
является прямым свидетельством факта биоразложения, в отличие от процессов абиотического разложения или других потерь, таких как испарительный перенос или сорбция. Дополнительные ценные данные, характеризующие характер биоразложения, можно получить из измерений распределения общей активности органического (ТОА) между растворенным состоянием (активность органического
в растворе DOA) и твердым состоянием (активность органического
взвеси РОА) после отделения твердых частиц методом мембранной фильтрации или центрифугированием. РОА отражает испытуемое вещество, абсорбированное на микробной биомассе и других частицах в дополнение к углероду испытуемого вещества, который был использован для синтеза клеточного материала и, таким образом, был встроен в частицы биомассы. Образование растворенного
органического материала может быть оценено как DOA в конце процесса биоразложения (плато на кривой зависимости разложения от времени).
________________
* В оригинале приложение 4 не приводится. Здесь и далее по тексту. - .
Оценить распределение остаточного по фазам в выбранных образцах можно с помощью фильтрации образцов через 0,22 мкм или 0,45 мкм мембранный фильтр, сделанный из материала, не абсорбирующего значительное количество испытуемого вещества (для данных целей могут подойти поликарбонатные фильтры). Если сорбция испытуемого вещества на фильтре слишком значительна, чтобы ее не учитывать (необходимо проверить до начала эксперимента), вместо фильтрации можно использовать метод высокоскоростного центрифугирования (2000 g, 10 мин).
Дальнейшие манипуляции с фильтратом или центрифугатом рекомендуется проводить по методу для нефильтрованных образцов, описанном в приложении 4. Мембранные фильтры погружают в соответствующий сцинтиллятор и проводят измерения по обычной методике, обычно используя метод сравнения с эталонными образцами для учета процесса гашения, или используют окислитель. Если проводилось центрифугирование, необходимо ресуспендировать осадок, сформированный из дисперсного осадка, в 1-2 мл дистиллированной воды и перенести его в сцинтилляционный флакон. Необходимо промыть осадок последовательно, дважды, в 1 мл дистиллированной воды. При необходимости суспензию можно заключить в гель для проведения жидкостного сцинтилляционного считывания.
Приложение Б
Полунепрерывная процедура
Для разложения устойчивых веществ может потребоваться пролонгированная инкубация, до нескольких месяцев. Длительность испытания в норме не должна превышать 60 дней, если только свойства исходного образца воды не сохраняют обновлением исследуемой суспензии. Тем не менее период испытания может быть увеличен максимально до 90 дней без обновления исследуемой суспензии в том случае, если распад исследуемого вещества впервые начался в шестидесятидневный период.
При продолжительной инкубации разнообразие микробного сообщества может сократиться из-за различных механизмов потерь, а также из-за возможного истощения водного образца, важных питательных веществ и первичных углеродных субстратов. Поэтому для адекватного определения скорости разложения медленно разлагаемых веществ рекомендуют использовать полунепрерывный тест. Испытание начинают с использования полунепрерывной процедуры, если, основываясь на предыдущем опыте, для разложения 20 % вещества потребуется инкубационный период продолжительностью три месяца. Либо обычный периодический тест может быть заменен на полунепрерывный, если за 60 дней не произошло разложение исследуемого вещества, при использовании периодической процедуры. Полунепрерывная процедура может быть остановлена, а испытание можно продолжить как периодический эксперимент, как только случится значительное разложение (например, >20%).
В ходе полунепрерывного испытания каждые две недели проводят замену одной трети объема исследуемой суспензии свежесобранной водой, содержащей исследуемое вещество, до первоначальной концентрации. Таким же образом добавляют ил в подготовленную воду, до первоначальной концентрации (от 0,01 до 1 г/л), при выполнении испытания с суспендированным илом. При выполнении испытания с суспендированными твердыми частицами ила очень важно сохранить систему полностью суспендированной при обновлении воды, и что время пребывания является одинаковым и для твердых частиц и для воды, поскольку в противном случае будет утеряна сходность с гомогенной водной системой, не имеющей фиксированных фаз. По этим причинам при использовании полунепрерывного способа предпочтительно, чтобы диапазон первоначальной концентрации суспендированного ила был ниже указанного интервала.
Предписанное добавление исследуемого вещества подразумевает, что частичное обновление исследуемой суспензии не увеличивает ее первоначальную концентрацию, благодаря чему избегают адаптации, которую часто наблюдают при повышенных концентрациях исследуемого вещества. Поскольку процедура также включает и повторную инокуляцию и компенсацию истощенных питательных веществ и первичных субстратов, сохраняется исходное микробное разнообразие, а продолжительность испытания может увеличиваться в принципе до бесконечности. При использовании полунепрерывной процедуры важно заметить, что остаточная концентрация исследуемого вещества требует поправки на добавляемое и удаляемое количество исследуемого вещества в каждой процедуре обновления. Общая концентрация и концентрация растворенного вещества взаимозаменяемы для соединений с низкой сорбцией. Сорбция не имеет значения (<5%) в определенных условиях (от 0,1 до 1 г твердого вещества/л) для веществ, у которых ![]() <3 (это действительно в отношении нейтральных, липофильных соединений). Это можно продемонстрировать на следующем примере расчета.
<3 (это действительно в отношении нейтральных, липофильных соединений). Это можно продемонстрировать на следующем примере расчета.
Пример.
0,1 г/л твердых вещества можно грубо соотнести с 10 мг углерода на 1 л (фракция углерода, =0,01).
Полагая что:
![]() (исследуемого вещества) =3
(исследуемого вещества) =3
![]()
Коэффициент разделения ![]()
Тогда растворенная доля в общей концентрации -вода/
-общая
![]() составит:
составит:
![]()
Приложение В
Определение ![]()
Косвенное определение ![]()
В общепринятой практике измерения косвенный способ обычно является наименее затратным по времени и наиболее точным, если вещество нелетучее и не трансформируется в летучие продукты трансформации. Нефильтрованные образцы объемом примерно 5 мл помещают в сцинтилляционные пробирки. Подходящая активность для образцов составляет от 5000 dpm до 10000 dpm (от 80 до 170 Bq) на первоначальном уровне, минимальная первоначальная активность составляет примерно 1000 dpm. отгоняют после окисления образца до уровня от 2 до 3 рН с помощью одной-двух капель концентрированной
![]() или
или . Отгонку
можно выполнить барботированием воздуха на протяжении
-1 ч. Либо содержимое пробирок перемешивают энергичным встряхиванием в течение от 1 до 2 ч (к примеру, на микропланшете шейкера) или в течение ночи, но при более мягком встряхивании. Эффективность отгонки
проверяют в обязательном порядке (пролонгированием периода аэрации или встряхивания). Затем добавляют сцинтилляционную жидкость, подходящую для отсчета водных образцов, образец делают однородным вихревым перемешиванием и его радиоактивность определяют отсчетом жидкостной сцинтилляции, вычитая фоновую активность, обнаруживаемую в холостых пробах
. Если только тестовая вода не сильно окрашена или не содержит высокую концентрацию частиц, образцы, в норме, будут обнаруживать равномерное гашение, и поправка гашения с помощью внешнего стандарта будет достаточной. Если же тестовая вода окрашена сильно, для поправки гашения может потребоваться добавление внутреннего стандарта. Если концентрация частиц высокая, то это не позволит получить однородный раствор или гель, или же разница в гашении между образцами может быть серьезной. Для таких случаев, как исследуемые взвеси, предлагают к использованию метод отсчета. Если испытание проводят в виде испытания суспендированного ила, измерение
![]() выполняют косвенно, используя для этого однородный образец объемом 10 мл и тестовую воду/суспензию с разделением фаз центрифугированием при подходящей скорости (например, при 40000 м/с
выполняют косвенно, используя для этого однородный образец объемом 10 мл и тестовую воду/суспензию с разделением фаз центрифугированием при подходящей скорости (например, при 40000 м/с в течение 15 мин). Затем с водной фазой действуют так же, как описано выше. Активность
в фазе с частицами РОА определяют повторным суспендированием ила в небольшом количестве дистиллированной воды, размещая затем в сцинтилляционные пробирки, и с добавлением сцинтилляционной жидкости для образования геля (для этих целей имеются специальные сцинтилляционные жидкости). В зависимости от природы частиц (например, от содержания в них органических металлов) растворяют образец в течение ночи с помощью солюбилизатора ткани, а затем делают его однородным вихревым перемешиванием перед добавлением сцинтилляционной жидкости. В качестве альтернативы РОА можно определить сжиганием избыточного кислорода, используя окислитель образца. При отсчете всегда включают внутренние стандарты, кроме того, может возникнуть необходимость в поправках гашения, для этого внутренний стандарт прибавляют ко всем образцам в индивидуальном порядке.
Прямое определение ![]()
Если выделившейся ![]() измеряют прямым способом, то для этого устанавливают большее число колб в начале испытания, собирая опытные колбы в каждой точке измерения, окисляя для этого тестовые колбы до уровня от 2 до 3 рН и собирая
измеряют прямым способом, то для этого устанавливают большее число колб в начале испытания, собирая опытные колбы в каждой точке измерения, окисляя для этого тестовые колбы до уровня от 2 до 3 рН и собирая ![]() во внутренний (установленный в каждой тестовой колбе вначале опыта) или внешний абсорбер. Для абсорбции среды используют либо щелочь (например, раствор 1
во внутренний (установленный в каждой тестовой колбе вначале опыта) или внешний абсорбер. Для абсорбции среды используют либо щелочь (например, раствор 1 ![]() или таблетку
или таблетку ![]() ) этаноламин, или же широко распространенные абсорберы на основе этаноламина. При прямых измерениях
) этаноламин, или же широко распространенные абсорберы на основе этаноламина. При прямых измерениях ![]() колбы должны быть закрыты мембранами из бутилового каучука.
колбы должны быть закрыты мембранами из бутилового каучука.
Библиография
[1] | ISO/DIS 14592-1 (1999) Water quality - Evaluation of the aerobic biodegradability of organic compounds at low concentrations - Part 1: Shake flask batch test with surface water or surface water/sediment suspensions. - ISO/DIS 14592-1 (1999) Оценка способности к биологическому разложению органических соединений при низких концентрациях в аэробных условиях. Часть 1. Испытание партии колб с поверхностной водой или суспензиями поверхностной воды и осадка методом взбалтывания. |
[2] | OECD draft (1999). Guidelines for testing of chemicals. Aerobic and anaerobic transformation in aquatic sediment. OECD, Paris. Проект ОЭСР (1999). Рекомендации no проведению испытаний химических веществ. Аэробные и анаэробные преобразования в водных отложениях. ОЭСР, Париж. |
[3] | OECD draft (1999). Guidelines for the testing of chemicals. Aerobic and anaerobic transformation in soil. OECD, Paris. Проект ОЭСР (1999). Рекомендации по проведению испытаний химических веществ. Аэробные и анаэробные преобразования в почве. ОЭСР, Париж. |
[4] | OECD (1993). Guidelines for the Testing of Chemicals. OECD, Paris. - ОЭСР (1993). Рекомендации по проведению испытаний химических веществ. ОЭСР, Париж. |
[5] | ISO 8245 (1999). Water quality - Guidelines on the determination of total organic carbon (TOC) and dissolved organic carbon (DOC). - ИСО 8245 (1999). Качество воды. Руководство по определению общего органического углерода (ТОС) и растворенного органического углерода (DOC). |
[6] | ISO 10634 (1995). Water quality - Guidance for the preparation and treatment of poorly watersoluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium. - ИСО 10634 (1995). Руководящие указания по подготовке и обработке малорастворимых в воде органических соединений для последующей оценки их способности к биоразложению в водной среде. |
[7] | OECD (2000). Guidance Document on aquatic toxicity testing of difficult substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No 23. - ОЭСР (2000). Руководство по испытанию на токсичность для водной среды сложных химических веществ и смесей. Публикации по вопросам состояния и безопасности окружающей среды. Серия по испытаниям и оценке. N 23. |
[8] | Simkins, S. and Alexander, М. (1984). Models for mineralisation kinetics with the variables of substrate concentration and population density. Appl. Environ. Microbiol.47, 394-401. - Симкинс С., Александр M. (1984). Модели для кинетики минерализации с переменными параметрами концентрации субстрата и плотности популяций. Прикладная и экологическая микробиология, 47, стр.394-401. |
[9] | Ingerslev, F. and N.Nyholm. (2000). Shake-flask test for determination of biodegradation rates of 14C-labeled chemicals at low concentrations in surface water systems. Ecotoxicol. Environ. Saf. 45, 274-283. - Ингерслив Ф., Найхольм H. (2000). Испытание для определения скорости биоразложения низких концентраций 14С - меченных химических веществ в поверхностных водах методом взбалтывания. |
[10] | ISO/CD 14592-1 (1999). Ring test report: Water Quality - Evaluation of the aerobic biodegradability of organic compounds at low concentrations part 1 - report of 1998/1999 ringtest. Shake flask batch test with surface water or surface water/sediment suspensions. - ISO/CD 14592-1 (1999). Отчет о кольцевой реакции: Качество вод - Оценка способности к биологическому разложению органических соединений при низких концентрациях в аэробных условиях. Часть 1 - отчет о кольцевой реакции 1998/1999. Испытание партии колб с поверхностной водой или суспензиями поверхностной воды и осадка методом взбалтывания. |
УДК 628.543:543:006.354 | МКС 71.100.01 | |
Ключевые слова: биоразложение, метод моделирования поверхностных вод, аэробное биоразложение | ||
Электронный текст документа
и сверен по:
, 2019