ГОСТ 25382-82
(СТ СЭВ 2702-80,
СТ СЭВ 6284-88)*
______________________
* Обозначение стандарта.
Измененная редакция, Изм. N 1.
Группа С79
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
КРУПНЫЙ РОГАТЫЙ СКОТ
Методы лабораторной диагностики лейкозов
Domestic animals. Methods of laboratory diagnostics of leucosus
Дата введения 1983-01-01
Постановлением Государственного комитета СССР по стандартам от 11 января 1982 г. N 3153 срок действия установлен с 01.01.83 до 01.01.88*
________________
* Ограничение срока действия снято по протоколу Межгосударственного Совета по стандартизации, метрологии и сертификации (ИУС N 2, 1993 год). - .
РАЗРАБОТАН Министерством сельского хозяйства СССР
ИСПОЛНИТЕЛИ
Л.Г.Бурба; А.Ф.Валихов; Е.А.Дун; Л.А.Зиневич; М.П.Кудрявцева; В.М.Нахмансом; Г.А.Симонян
ВНЕСЕН Министерством сельского хозяйства СССР
УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 11 августа 1982 г. N 3153
ВНЕСЕНО Изменение N 1, утвержденное и введенное в действие с 01.01.90 Постановлением Госстандарта СССР от 23.06.89 N 1957
Изменение N 1 внесено изготовителем базы данных по тексту ИУС N 10, 1989 год
Настоящий стандарт распространяется на крупный рогатый скот и устанавливает методы лабораторной диагностики лейкозов.
Стандарт предназначается для научно-исследовательских учреждений.
Стандарт полностью соответствует СТ СЭВ 2702-80.
1. МЕТОДЫ ОТБОРА ПРОБ
1.1. Для гематологического исследования берут с соблюдением правил асептики пробы крови из вены животного в пробирки с антикоагулянтом - 10%-ным раствором динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА) - из расчета 0,02 см на 1 см
крови. Из свежей или стабилизированной крови на предметных обезжиренных стеклах, подогретых до 25 °С, готовят тонкие мазки крови.
Пробы стабилизированной крови для исследования направляют в лабораторию и исследуют не позднее чем через 36 ч после взятия. Пробы для исследований отбирают не ранее чем через 15 суток после введения животным вакцин и аллергенов, за 15 суток до отела и через 15 суток после отела.
1.2. Для серологического исследования пробы крови берут из вены в стерильные пробирки. При длительном хранении проб сыворотку крови отделяют от сгустка. Сыворотку хранят при температуре минус 20 °С и ниже. При исследовании на наличие антител против антигенов онкорнавируса крупного рогатого скота в реакции диффузной преципитации (РИД) используют плазму стабилизированной крови, взятой в соответствии с п.1.1.
1.3. Пробы, взятые для гематологических и серологических исследований крови, маркируют и отправляют в лабораторию с сопроводительным документом, в котором указывают наименование хозяйства (отделение, ферма), номер или кличку, пол и возраст животного.
1.4. Для гистологического и цитологического исследований берут патологический материал от трупов не позднее чем через 8 ч после смерти или убоя животного. Пробы помещают в фиксирующий раствор в соотношении 1:30.
Для гистологического исследования вырезают кусочки органов и тканей (лимфатические узлы, селезенка, печень, почки, сердце, мышцы, грудная кость, стенка органов пищеварения и другие ткани) размером 2x2x1 см. Вырезают кусочки так, чтобы рядом с нормальной тканью были участки измененной и смежной ткани. Материал для исследования помещают в герметично закрывающийся сосуд с 8-10%-ным водным раствором формальдегида. Сосуд маркируют и с сопроводительным документом направляют в лабораторию.
1.5. Для цитологического исследования готовят мазки из свежей крови и препараты-отпечатки из кроветворных и других органов, полученных при биопсии или убое животного. Для этого с помощью пункционной иглы, соблюдая правила асептики и антисептики, берут у животных пунктат из костного мозга (грудная кость) и лимфоузлов и готовят мазки на предметных стеклах. Препараты-отпечатки готовят путем прикосновения предметным стеклом к поверхности разреза кусочка органа.
1.6. Для иммуноферментного анализа используют свежие пробы крови, но не ранее, чем через сутки после взятия. Недостаточно просветленные сыворотки крови центрифугируют. При длительном хранении проб сыворотку крови отделяют от кровяного сгустка. При хранении проб при плюс 4 °С сыворотки годны к исследованию в течение 10 сут. При хранении сыворотки при температуре минус 20 °С срок пригодности сыворотки для исследований - 1 год. Разложившиеся и сильно гемолизированные сыворотки для исследования не пригодны.
(Введен дополнительно, Изм. N 1).
2. МЕТОДЫ ИССЛЕДОВАНИЙ
2.1. Гематологический метод
Сущность метода заключается в обнаружении в периферической крови повышенного количества лейкоцитов, в основном лимфоидного ряда, и слабодифференцированных клеток (родоначальные, пролимфоциты, лимфобласты), а также полиморфных, атипичных клеток кроветворных органов.
2.1.1. Аппаратура, материалы и реактивы
2.1.1.1. Для проведения исследования применяют:
счетчик частиц электронный;
дилютер автоматический;
счетчик для подсчета лейкоцитарной формулы;
фильтр микропористый стеклянный по ГОСТ 23932-79*;
________________
* На территории Российской Федерации действует ГОСТ 23932-90. - .
микроскопы биологические марки МБИ или МРБ по ГОСТ 8284-78;
пипетки вместимостью 1, 2, 5, 10 см по ГОСТ 20292-74*;
________________
* На территории Российской Федерации действуют ГОСТ 29169-91, ГОСТ 29227-91-ГОСТ 29229-91, ГОСТ 29251-91-ГОСТ 29253-91,здесь и далее по тексту. - .
микропипетки вместимостью 0,02; 0,03; 0,05; 0,1; 0,2 см по ГОСТ 20292-74;
цилиндры мерные вместимостью 50, 100, 500, 1000 см по ГОСТ 20292-74;
весы лабораторные;
стекла предметные по ГОСТ 9284-75;
камеру для подсчета клеток крови (камеру Горяева, Бюркера или других марок);
аппарат для фиксации и окраски мазков на предметных стеклах;
масло иммерсионное по ГОСТ 13739-78;
раствор Гимза красильный;
раствор Майн-Грюнвальда красильный;
раствор Тюрка;
спирт метиловый по ГОСТ 6995-77;
ксилол по ГОСТ 9949-76;
натрий хлористый по ГОСТ 4233-77;
формалин технический (формальдегид) по ГОСТ 1625-75*;
________________
* На территории Российской Федерации действует ГОСТ 1625-89. - .
раствор электролита изотонический; готовят следующим образом: берут 0,9%-ный раствор хлористого натрия, фильтруют его через микропористый фильтр (фильтр Г-4), рН контролируют индикаторной бумагой. При добавлении трис-буфера доводят рН до 6-7,2. При использовании раствора в течение более 2 ч добавляют 5 см 35%-ного раствора формальдегида на 1000 см
электролита.
Для эритроцитолиза используют 1%-ный водный раствор сапонина, смешивая его в соотношении 1000:5 с 35%-ным раствором формальдегида. Раствор, свободный от пены, фильтруют сразу же после приготовления;
раствор стабилизирующий; готовят следующим образом: берут 50 г динатриевой соли этилендиаминтетрауксусной кислоты, 50 см 35%-ного раствора формальдегида, 2 см
1%-ного раствора метиленового синего и 50 см
дистиллированной воды. Раствор нагревают до полного растворения и фильтруют через микропористый стеклянный фильтр.
2.1.2. Проведение исследования
Исследование проводят путем:
подсчета количества лейкоцитов с помощью электронного счетчика частиц;
подсчета количества лейкоцитов в счетной камере;
дифференцированного подсчета лейкоцитов.
2.1.2.1. Подсчет количества лейкоцитов с помощью электронного счетчика частиц проводят в соответствии с правилами, прилагаемыми к каждому аппарату.
2.1.2.2. Подсчет количества лейкоцитов в счетной камере проводят в соответствии с ее техническими параметрами.
2.1.2.3. Дифференцированный подсчет лейкоцитов (определение лейкоцитарной формулы) проводят в окрашенном мазке под микроскопом с иммерсионным объективом с увеличением 90. При этом подсчитывают не менее 100 клеток, просматривая равномерно все участки мазка. Дифференциальный подсчет лейкоцитов проводят в случае, если установленное количество лейкоцитов в 1 см
крови превышает показатели, указанные для здоровых животных с учетом их возраста по "лейкозному ключу".
Результаты исследований оценивают по "лейкозному ключу" в соответствии с требованиями, указанными в таблице.
Возраст животных, лет | Гематологически неподозрительные животные | Гематологически подозрительные по заболеванию лейкозом животные | Гематологически положительные по заболеванию лейкозом животные | |||
Количество лейкоцитов в 1 см | Абсолютное количество лимфоцитов в 1 см | Абсолютное количество лимфоцитов в 1 см | ||||
Св. 1 до 2 | До 12000 | От 9000 до 11000 | Св. 11000 | |||
" 2 " 4 | " 11000 | " 8000 " 10000 | " 10000 | |||
" 4 " 6 | " 10000 | " 6500 " 9000 | " 9000 | |||
" 6 | " 9000 | " 5500 " 8000 | " 8000 | |||
2.1.3. Обработка результатов
Если количество лейкоцитов у животного будет ниже числа, указанного в таблице, то результат исследования на лейкоз считают отрицательным (-).
Если число лимфоцитов будет в пределах норм, указанных в таблице, то результат оценивают как подозрительный (+), если ниже, чем наименьший показатель в таблице, то результат оценивают как отрицательный (-). Если число лимфоцитов в 1 см крови будет больше, чем указано в таблице, то результат оценивают как положительный (+).
Животных, подозреваемых в заболевании лейкозом, подвергают двух-трехкратному исследованию с интервалом между ними 30 дней. Если при втором и третьем дополнительных исследованиях будут получены отрицательные результаты, таких животных признают здоровыми, а при установлении изменений в крови, характерных для больных или подозреваемых в заболевании, животных считают больными.
2.2. Цитологический метод
Сущность метода заключается в обнаружении в периферической крови и кроветворных органах (красный костный мозг, лимфатические узлы, селезенка) накопления морфологически измененных, преимущественно незрелых (родоначальные, слабодифференцированные, лимфобласты, пролимфоциты, миелобласты и др.) или патологических (опухолевых) клеток.
2.2.1. Аппаратура и реактивы
2.2.1.1. Для проведения исследований применяют аппаратуру и реактивы, указанные в п.2.1.1, и дополнительно:
иглу для пункции кроветворных органов;
шприц вместимостью 20 см по ГОСТ 18137-77;
скальпель по ГОСТ 21240-77*;
________________
* На территории Российской Федерации действует ГОСТ 21240-89. - .
ножницы;
натрий лимоннокислый по ГОСТ 22280-76, 3,8%-ный раствор;
спирт этиловый ректификованный по ГОСТ 5962-67*.
________________
* На территории Российской Федерации действует ГОСТ Р 51652-2000, здесь и далее по тексту. - .
2.2.2. Проведение исследования
2.2.2.1. Мазки, приготовленные на предметных стеклах из свежей крови, пунктатов кроветворного костного мозга, селезенки, лимфоузлов и других органов и опухолей, а также препараты-отпечатки, приготовленные из материала, взятого при биопсии, или из кусочков органов при вскрытии животного, фиксируют в метиловом спирте, окрашивают по Паппенгейму и исследуют под микроскопом с иммерсионным объективом с увеличением 90.
2.2.3. Обработка результатов
2.2.3.1. Результат исследования считают положительным:
на лейкоз - при обнаружении в мазках крови более 3% и в кроветворных органах более 10% родоначальных слабодифференцированных (пролимфоциты, лимфобласты, миелобласты) или опухолевых клеток при нормальных показателях абсолютного количества лимфоцитов;
на слабодифференцированную форму лейкоза - при обнаружении в гемограммах и цитограммах кроветворных органов повышенного процента родоначальных, слабодифференцированных клеток макро-, мезо- и микрогенерации лимфобластов и пролимфоцитов;
на лимфоидный лейкоз - если отмечают увеличение количества клеток лимфоидного ряда различной степени зрелости (пролимфоциты и лимфобласты) в мазках крови, селезенки, лимфатических узлов, костного мозга (лимфоидная метаплазия) и других органах;
на гематосаркому (лимфосаркомы различных степеней зрелости) - если в гемограммах и цитограммах превалируют атипичные (опухолевые) клетки, которые отличаются от нормальных по форме, величине, структуре и тождественны клеткам, образующим опухоли;
на лимфогрануломатоз - при установлении в мазках крови лимфоцитоза в препаратах из лимфатических узлов - лимфоидной гиперплазии, с обнаружением в них эозинофилов, нейтрофилов, базофилов, фибробластов, плазматических, атипичных, недифференцированных и гигантских клеток Березовского-Штернберга.
2.3. Серологический метод
Сущность метода заключается в выявлении в сыворотке крови животных с помощью реакции иммунодиффузии (РИД) преципитирующих антител против антигенов онкорнавируса типа С крупного рогатого скота.
2.3.1. Аппаратура и материалы
2.3.1.1. Для проведения исследования применяют:
чашки биологические Петри;
рН-метр;
штамп для приготовления лунок;
баню водяную, обеспечивающую температуру нагрева 50 °С и более;
раствор буферный, рН 7,2;
агар очищенный по ГОСТ 17206-71;
антиген двойной, состоящий из гликопротеидного (гп) и полипетидного (р24) антигенов онкорнавируса типа С крупного рогатого скота.
Антиген хранят при минус 20 °С или лиофилизируют.
Перед постановкой РИД приготовленный антиген сравнивают со стандартным антигеном, проверенным на специфичность и активность;
сыворотку положительную с преципитирующими антителами с титром антител к гп-антигену от 1:16 до 1:32 в РИД. Сыворотку получают от естественно или экспериментально зараженного крупного рогатого скота или овец;
сыворотку контрольную отрицательную.
2.3.2. Подготовка к исследованию
2.3.2.1. Расплавленный 0,8%-ный раствор агара наносят равномерным слоем толщиной 2-3 мм на плоские стекла, чашки Петри или пластинки. После застывания агара специальным штампом делают лунки, не допуская образования трещин между ними и отслоения агара от дна чашки. Если в лунках до постановки реакции скапливается жидкость, то ее удаляют. Лунки для иммунодиффузии сразу после их образования закапывают агаром для предотвращения проникновения антигена или сыворотки под агаровый слой.
2.3.3. Проведение исследования
2.3.3.1. Антиген и контрольную сыворотку вносят в лунки в соответствии с чертежом. Антиген (А) вносят в центральную лунку, две диаметрально противоположные лунки заполняют контрольной сывороткой (КС). Оставшиеся четыре периферические лунки (1, 2, 3, 4) заполняют испытуемыми сыворотками. Точкой, относительно которой идет нумерация лунок с испытуемыми сыворотками, служит отметка в геле верхней части чашки.
Схема постановки и оценки реакции иммунодиффузии в геле агара (РИД)
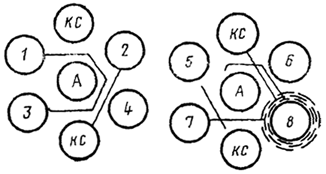
1 - отрицательно реагирующая сыворотка; 2 - положительно реагирующая сыворотка; 3 - слабоположительно реагирующая сыворотка; 4 - положительно реагирующая сыворотка со второй линией преципитации; 5 - резкоположительно реагирующая сыворотка; 6 - положительно реагирующая сыворотка с неспецифической линией преципитации; 7 - отрицательно реагирующая сыворотка с неспецифической линией преципитации; 8 - отрицательно реагирующая сыворотка с зоной опалесценции; А - антиген онкорнавируса у крупного рогатого скота; КС - контрольная сыворотка против гликопротеидного антигена онкорнавируса крупного рогатого скота
Для внесения компонентов в лунки используют стерильные пипетки, не допуская при этом контаминацию реагентов и сывороток бактериями и другими веществами. Лунки заполняют до исчезновения мениска. После заполнения всех лунок чашки закрывают крышками и хранят во влажной камере при температуре от 18 до 27 °С.
Реакцию учитывают через 48-72 ч. Чашки просматривают на темном фоне, направляя сфокусированный луч осветителя на дно чашки под углом 30-45°. Реакцию оценивают по контрольной линии преципитата. Если она отсутствует или слабо выражена, то реакцию считают неудавшейся и ее следует повторить. Линия преципитации, формируемая контрольной сывороткой и антигеном, должна быть четкой, иметь форму прямой, концы которой должны доходить до лунок с испытуемыми сыворотками, располагаться на одинаковом расстоянии от лунок (А и КС).
2.3.4. Обработка результатов
2.3.4.1. В зависимости от наличия и титра специфических антител против антигенов онкорнавируса сыворотки квалифицируются на положительно, отрицательно и сомнительно реагирующие.
Положительно реагирующей считают сыворотку:
если между лунками с антигеном и испытуемой сывороткой образуется полоса преципитации, которая соединяется с контрольной линией, - позиция 2 (см. чертеж);
если линия преципитации между лунками с сывороткой и антигеном отсутствует, но контрольная линия образует вблизи лунки с испытуемой сывороткой изгиб, направленный в сторону лунки с антигеном, - позиция 3;
если образуется вторая линия преципитации, которая располагается ближе к лунке с испытуемой сывороткой и указывает на наличие в сыворотке преципитирующих против второго антигена антител (р24) онкорнавируса типа С крупного рогатого скота, - позиция 4;
если контрольная линия значительно укорочена со стороны лунки с испытуемой сывороткой и имеет размытый изгиб в сторону лунки с антигеном или расположена очень близко к лунке с антигеном - позиция 5;
Примечание. Более четкая линия образуется, если такую сыворотку разбавить в соотношении 1:4 или 1:8;
если образовалась неспецифическая линия преципитации - позиция 6.
Отрицательно реагирующей считают сыворотку:
если контрольная линия преципитации продолжается до лунки с испытуемой сывороткой без загибов или с небольшим загибом в сторону лунки с контрольной сывороткой - позиция 1;
если сформировалась неспецифическая линия преципитации - позиция 7; при этом она перекрещивается с контрольной линией.
Сомнительно реагирующей считают сыворотку, если контрольная линия преципитации плохо просматривается вследствие наличия неспецифической линии преципитации. В этом случае проводят повторное взятие крови у этого животного и исследование сыворотки.
Если сомнительная реакция была зафиксирована дважды, с интервалом 1 месяц между исследованиями, сыворотку считают положительно реагирующей.
Сомнительная реакция может быть в результате подтекания положительно реагирующей сыворотки под слой агара к лунке с отрицательно реагирующей сывороткой или контаминации образца отрицательно реагирующей сыворотки - положительно реагирующей. В этом случае исследование повторяют.
2.4. Гистологический метод
Сущность метода заключается в обнаружении у больных лейкозами животных разрастаний (пролиферация), нарушивших нормальное созревание и дифференцировку кроветворных клеток, как в органах кроветворения (костный мозг, селезенка, лимфатические узлы), так и в соединительной ткани других органов.
2.4.1. Аппаратура, материалы и реактивы
2.4.1.1. Для проведения исследования применяют:
микротом для парафиновых срезов;
микротом для целлоидиновых срезов:
микроскоп по ГОСТ 8284-78;
стекла предметные и покровные по ГОСТ 9284-75;
блоки деревянные или из другого материала;
термостат, обеспечивающий регулирование температуры 80 °С;
парафин с точкой плавления 58 °С;
формальдегид 8-10%-ный, нейтральный, водный раствор;
спирт этиловый ректификованный по ГОСТ 5962-67;
целлоидин: 2-3, 4-5 и 8-10%-ные растворы в эталоне с эфиром сернокислым в соотношении 1:1;
хлороформ по ГОСТ 20015-74*;
________________
* На территории Российской Федерации действует ГОСТ 20015-88. - .
бальзам пихтовый по ГОСТ 2290-76;
ксилол по ГОСТ 9949-76;
кислоту соляную по ГОСТ 3118-77, 1%-ный спиртовый раствор;
эозин, 0,5%-ный раствор или гематоксилин 10%-ный раствор;
кислоту азотную по ГОСТ 4461-77, 5%-ный раствор;
эфир сернокислый;
карбол-ксилол.
2.4.2. Подготовка к исследованию
2.4.2.1. Отобранные пробы органов фиксируют в формальдегиде в течение 48 ч и затем промывают в течение 10-24 ч в проточной воде. Затем из кусочков органов вырезают пластинки толщиной 3 мкм, площадью 1,5-2,5 см, которые последовательно выдерживают в этиловом спирте с концентрацией 70%, 80%, 96%.
В спирте каждой указанной концентрации обезвоживание длится 24 ч при температуре от 15 до 20 °С.
2.4.2.2. Для приготовления и окраски целлоидиновых срезов обезвоженные кусочки патологического материала заключают в целлоидин. Вынутые из раствора целлоидина кусочки органов наклеивают на деревянные или из другого материала блоки, подсушивают и помещают в банку со спиртом 70%-ной концентрации. Из кусочков органов, наклеенных на блоки, приготовляют целлоидиновые срезы толщиной 5-10 мкм и окрашивают их гематоксилин-эозином или другими красителями, заключают в бальзам и покрывают покровным стеклом. Вместо целлоидиновых можно готовить парафиновые срезы.
2.4.2.3. Для приготовления и окраски парафиновых срезов кусочки органов, обезвоженные согласно п.2.4.2.1, заливают в парафин. Из парафиновых блоков посредством парафинового микротома готовят срезы толщиной 3-5 мкм, которые для расплавления помещают в теплую воду. Затем срезы переносят на предметные стекла, сушат в термостате при температуре 37-40 °С и окрашивают гематоксилин-эозином или другим красителем.
2.4.3. Проведение исследования
Приготовленные срезы просматривают под микроскопом при естественном или искусственном освещении. При окуляре с увеличением 10 и объективе с увеличением 10
определяют общую структуру исследуемых органов с учетом изменения ткани в отдельных ее участках в результате инфильтративных процессов (состояние фолликулов, межфолликулярных зон в селезенке и лимфатических узлах, присутствие клеток в просвете сосудов, паренхиме и интерстиции органов и пр.).
При окуляре с увеличением 20 и объективе с увеличением 40
выявляют детали изменений, обращая внимание на характер пролиферирующих клеток (тип, степень дифференцировки, зрелость) и интенсивность (выраженность) патогистологических изменений. Одновременно определяют наличие сопутствующих заболеваний нелейкозного характера с целью проведения дифференциальной диагностики или признаков, отягощающих основное заболевание (отеки, дистрофии, некрозы, кровоизлияния и прочее в скелетной мускулатуре, сердце, печени, почках и других органах).
2.4.4. Обработка результатов
Результаты анализа считают положительными:
на лимфоидный лейкоз - если в селезенке и лимфатических узлах наблюдают полное стирание рисунка за счет диффузной инфильтрации клетками лимфоидного ряда, среди которых в основном выявляют зрелые лимфоциты, в меньшем количестве обнаруживают пролимфоциты, лимфобласты, среди которых иногда отмечают ретикулярные клетки;
в костном мозге строма сохранена, выявляется значительное истончение и рассасывание балок, скопления лимфоцитов могут располагаться в виде очагов или диффузно, заполняя все костно-мозговые пространства (лимфоидная метаплазия); в почках, печени, сердце, сычуге и других органах обычно выявляют скопления лимфоцитов в просвете капилляров и инфильтрацию лимфоидными клетками интерстициальной ткани;
на слабодифференцированный лейкоз (гемоцитобластоз) - если в костном мозге, селезенке, лимфатических узлах и других органах наблюдают очаговые и диффузные пролифераты, клеточный состав которых представлен недифференцированными или слабодифференцированными клетками типа гемоцитобласта (родоначальная клетка);
на миелоидный лейкоз - если обнаруживают в селезенке незрелые элементы гранулоцитарного ряда, мегакариоциты, клетки типа гемоцитобластов, ретикулярные клетки, фрагментацию и распад аргирофильных волокон, в костном мозге - скопления зрелых и незрелых клеток гранулоцитарного ряда; в лимфатических узлах, печени, почках, легких и других органах наблюдают очаговые диффузные разрастания миелоидных элементов;
на лимфосаркому (слабодифференцированная лимфобластическая, лимфоцитарная, гистиоцитарная) - если в лимфатических узлах, органах пищеварения, воспроизведения, сердечной, скелетной мышцах, других органах и тканях отмечают разрастание опухолей из недифференцированных или слабодифференцированных клеток лимфоидного типа (селезенка и костный мозг не изменены);
на лимфогрануломатоз - если выявляют гиперплазию лимфоидных клеток или полиморфно-клеточную пролиферацию, склеротические изменения и некрозы в лимфатических узлах, селезенке, печени и других органах; среди полиморфных клеток ретикулярного типа выявляют многоядерные гигантские клетки типа Березовского-Штернберга, плазматические клетки, эозинофилы и нейтрофилы в различной степени зрелости, а также фибробласты.
2.5. Иммуноферментный метод
Сущность метода заключается в адсорбции антигеном противовирусных антител на поверхности пластины при инкубировании испытуемой сыворотки с антивидовыми антителами, меченными ферментом, с последующей модификацией субстрата.
2.5.1. Аппаратура, материалы, реактивы
Фотометр одно- или многоканальный с минимальным пределом показаний 1,5 экстинционных единиц и с автоматической регистрацией результатов.
Автоматическое или полуавтоматическое оборудование для промывания пластин.
Термостат, обеспечивающий температуру (37±0,5) °С.
Микропипетки одноканальные автоматические.
Микропипетки восьми- или двенадцатиканальные автоматические.
Микротитровальные пластмассовые пластины с 96 лунками.
Стаканы химические вместимостью 500 см по ГОСТ 1770-74.
Колбы мерные вместимостью 100 см по ГОСТ 1770-74.
Колбы Эрленмейера вместимостью 100 см по ГОСТ 25336-82.
Пробирки по ГОСТ 25336-82.
Пипетки градуированные вместимостью 1 и 10 см по ГОСТ 20292-71.
Буферный раствор карбонатный с рН 8,8-9,6.
Буферный раствор физиологический фосфатный с рН 7,2-7,4, содержащий твин 20 или 80 (промывающий раствор).
Растворитель - промывающий раствор, содержащий инертный белок.
Антиген ВЛКРС для иммуноферментного анализа (ИФА), изготовленный из культуральной жидкости инфицированной ВЛКРС культуры клеток селезенки ягнят-эмбрионов (FLS) или почки ягнят-эмбрионов (FLK), содержащий компоненты вируса GP 51 и р 24, разведенный в карбонатном буферном растворе.
Сыворотка контрольная положительная, разведенная в растворителе.
Сыворотка контрольная отрицательная, представляющая собой смесь не менее чем из 10 отрицательных сывороток крупного рогатого скота, разведенная в растворителе.
Конъюгат - антитела против иммуноглобулинов крупного рогатого скота, меченные пероксидазой или другим ферментом, разведенные в растворителе.
Испытуемая сыворотка из крови крупного рогатого скота.
Субстрат ферментативной реакции.
2.5.2. Проведение исследования
В лунки микротитровальной пластины (панели) вносят по 0,05 или 0,1 или 0,2 см раствора антигена. Пластину закрывают и инкубируют в течение 18 ч во влажной камере при температуре плюс 4 °С.
После этого пластину четыре раза промывают физиологическим фосфатным буферным раствором так, чтобы лунки заполнялись полностью, выдерживают в течение 3 мин и затем раствор из лунок тщательно удаляют.
Готовят исходные разведения испытуемых сывороток.
Испытуемые сыворотки в исходном разведении вносят параллельно в две соседние лунки микротитровальной пластины в количестве 0,05 или 0,1 или 0,2 см. Таким же способом в каждую пластину вносят разведенные контрольные положительную и отрицательную сыворотки. На каждой пластине оставляют несколько лунок заполненных только растворителем (без сыворотки). Количество лунок с растворителем на пластине определяется конструкцией фотометра и используется для установки нулевого положения шкалы прибора.
Пластину закрывают и инкубируют при температуре от 20 до 37 °С во влажной камере в течение 60-120 мин.
Промывают пластину четыре раза промывающим раствором.
В лунки вносят по 0,05 или 0,1 или 0,2 см раствора конъюгата, пластины закрывают и инкубируют при температуре от 20 до 37 °С во влажной камере в течение 60-120 мин.
Промывают пластину четыре раза промывающим раствором.
В каждую лунку вносят по 0,05 или 0,1, или 0,2 см раствора субстрата и инкубируют при температуре от 20 до 37 °С в течение 50-60 мин. При необходимости в лунки добавляют карбонатный буферный раствор, останавливающий реакцию, и измеряют оптическую плотность в каждой лунке на фотометре при длине волны, характерной для выбранного субстрата.
2.5.3. Обработка результатов
Результат считают положительным, если оптическая плотность исследуемой пробы в обеих лунках в два или более раза превышает среднюю арифметическую величину оптической плотности для отрицательной пробы в соответствующем разведении.
2.5-2.5.3. (Введены дополнительно, Изм. N 1).
Электронный текст документа
и сверен по:
М.: Издательство стандартов, 1982
Редакция документа с учетом
изменений и дополнений
подготовлена

