ГОСТ Р ИСО 7198-2013
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Имплантаты для сердечно-сосудистой системы
ТРУБЧАТЫЕ СОСУДИСТЫЕ ПРОТЕЗЫ
Cardiovascular implants - Tubular vascular prostheses
ОКС 11.040.40
Дата введения 2015-03-01
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным учреждением "Научный Центр сердечно-сосудистой хирургии им. А.Н.Бакулева" РАМН (ФГБУ "НЦССХ им. А.Н.Бакулева" РАМН) на основе собственного аутентичного перевода на русский язык международного стандарта, указанного в пункте 4
2 ВНЕСЕН Управлением технического регулирования и стандартизации Федерального агентства по техническому регулированию и метрологии
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 08 ноября 2013 г. N 1490-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 7198:1998* "Имплантаты для сердечно-сосудистой системы. Трубчатые сосудистые протезы" (ISO 7198:1998 "Cardiovascular implants - Tubular vascular prostheses").
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном формационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (gost.ru)
1 Область применения
1.1 В настоящем стандарте установлены требования к проведению испытаний, упаковке, маркировке, а также определены термины, относящиеся к протезам кровеносных сосудов (ПКС), предназначенным для замещения, обведения или создания шунта между сегментами сосудистой системы человека.
Настоящий стандарт применим к ПКС, изготовленным из материалов биологического происхождения, синтетических тканей и синтетических нетекстильных материалов. Также приведено руководство по описанию составных и комбинированных протезов. Стандарт содержит требования к обозначению материалов и конструкции ПКС, а также к обозначению характерных и габаритных размеров ПКС. Стандарт также включает ссылки на требования к биосовместимости материалов и конструкций, изготовленных ПКС с учетом соответствующих частей ИСО 10993.
В настоящем стандарте также определены механические характеристики ПКС и установлены методы измерения и верификации размеров и механических характеристик, определенных изготовителем. Стандарт включает аспекты стерилизации ПКС и определяет требования к маркировке и упаковке.
1.2 В настоящем стандарте определены не все эксплуатационные характеристики и характерные размеры ПКС, но установлены достаточные методы верификации того, что номинальные значения, определенные изготовителем, находятся в допустимых пределах. Возможно, что данные методы должны быть дополнены другими методами при формировании программы испытаний для изделий конкретных типов.
Настоящий стандарт не применим к ПКС из тканей человека-донора, таким как ПКС с криоконсервацией. Также из области действия настоящего стандарта исключены сосудистые заплаты, тампоны и стенты.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие международные стандарты*. Для датированных ссылок применяют только указанные издания. Для недатированных ссылок применяют самые последние издания (включая любые изменения и поправки).
________________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ИСО 472:1998 Пластмассы. Словарь (ISO 472:1998, Plastics - Vocabulary)
ИСО 2076:1989 Ткани. Искусственные волокна. Родовые наименования (ISO 2076:1989, Textiles - Man-made fibres - Generic names)
ИСО 2859-1:1989 Процедуры отбора образцов для контроля по характеристикам. Часть 1. Схемы отбора образцов, для которых указан приемлемый уровень качества для последовательного контроля партий (ISO 2859-1:1989, Sampling procedures for inspection by attributes - Part 1: Sampling plans indexed by acceptable quality level (AQL) for lot-by-lot inspection)
ИСО 2859-2:1985 Процедуры отбора образцов для контроля по характеристикам. Часть 2. Схемы отбора образцов, для которых указан предельный уровень качества для контроля отдельных партий (ISO 2859-2:1985, Sampling procedures for inspection by attributes - Part 2: Sampling plans indexed by limiting quality (LQ) for isolated lot inspection)
ИСО 2960:1974 Ткани. Определение прочности на разрыв и растяжения при разрыве. Диафрагмальный метод (ISO 2960:1974, Textiles - Determination of bursting strength and bursting distension - Diaphragm method)
ИСО 5081:1977 Ткани. Тканые материалы. Определение предела прочности и удлинения (метод полос) [(ISO 5081:1977, Textiles - Woven fabrics - Determination of breaking strength and elongation (Strip method)]
ИСО 5084:1977 Ткани. Определение толщины тканых и трикотажных материалов (кроме тканых напольных покрытий) [(ISO 5084:1977, Textiles - Determination of thickness of woven and knitted fabrics (other than textile floor coverings)]
ИСО 10993-1:1997 Биологическая оценка медицинских изделий. Часть 1. Оценка и испытания (ISO 10993-1:1997, Biological evaluation of medical devices - Part 1: Evaluation and testing)
ИСО 14155:1996 Клиническая оценка медицинских изделий (ISO 14155:1996, Clinical investigation of medical devices)
ASTM D 76-93 Спецификации разрывных машин для тканей (ASTM D 76-93, Specification for tensile testing machines for textiles)
ASTM D 123-94 Терминология, касающаяся тканей (ASTM D 123-94, Terminology relating to textiles)
3 Термины и определения
В настоящем стандарте применены термины по ASTM D 76-93, ASTM D 123-94, а также следующие термины с соответствующими определениями:
3.1 аллотрансплантат: Имплантируемый материал, полученный из тканей животного того же вида.
3.2 бифуркация: Место разделения единого сосудистого русла (торса или всего тела сосуда) на два ответвления (конечности).
3.3 биологический материал: Материал животного или растительного происхождения, который может быть изменен или обработан с помощью химических процессов, за исключением любых ископаемых материалов биологического происхождения (например, нефти).
3.4 биостабильность: Способность материала поддерживать свою физическую и химическую целостность после имплантации в живые ткани.
3.5 покрытие: Любой органический или неорганический материал, кроме живых клеток, специально наносимый изготовителем на основу протеза.
Примечание - Такое покрытие может быть предусмотрено как постоянное или как временное; оно может быть нанесено на внешние и/или внутренние поверхности и/или быть введено в структуру основы.
3.6 податливость: Способность протеза упруго расширяться и сжиматься по окружности в ответ на пульсирующее изменение давления.
3.7 компонент: Материал, используемый во время производства, независимо от того, должен ли он остаться как соответствующий элемент изделия.
3.8 составной протез: Сосудистый протез, конструкция и/или материалы конструкции которого меняются от сегмента к сегменту на протяжении длины протеза (сравните 3.9).
Пример - Протез, проксимальная часть которого выполнена из трикотажного полотна с витыми нитями, а дистальная часть из кровеносного сосуда животного, обработанного альдегидом.
3.9 комбинированный протез: Однородный по длине сосудистый протез, стенки которого выполнены из нескольких материалов (сравните 3.8).
3.10 конфигурация: Геометрическая форма, конфигурация протеза.
Пример - Прямой, бифуркационный, конический.
3.11 конструкция: Тип основы протеза.
Пример - Трикотажный, тканый, нетканый, из пористого полимера.
3.12 гофрирование: Создание на протезе складок или изгибов для обеспечения возможности удлинения и снижения вероятности перегиба.
3.13 волокно: Нить материала, выходящая из одного или более узла и заканчивающаяся в одном или более узле.
3.14 реципиент: Лицо, которому имплантируется протез.
3.15 состояние готовности к имплантации: Состояние протеза, который перед имплантацией был подготовлен в соответствии с инструкциями изготовителя, а также состояние материала протеза, который был подвергнут соответствующим процессам стерилизации и/или иной подготовки.
Примечание - Подготовка не включает процедуры предварительной коагуляции (см. 3.20), но включает любые рекомендованные методы промывки или вымачивания.
3.16 общая проницаемость для воды: Объем чистой фильтрованной жидкости (с вязкостью, соответствующей вязкости воды), который проходит через стенки протеза за определенное время при определенном давлении.
3.17 утечка: Объем чистой фильтрованной жидкости (с вязкостью, соответствующей вязкости воды), который проходит через зазоры водонепроницаемого сосудистого протеза за определенный промежуток времени при определенном давлении.
Примечание - Утечка может происходить либо через мелкие дефекты стенок непрерывной трубки, либо через анастомоз, предусмотренный изготовителем.
3.18 узел: Твердая область на материале, с которой начинаются и в которой собираются волокна.
3.19 пористость: Значение отношения объема пустот в материале к общему объему, занимаемому материалом, включая пустоты.
Примечание 1 - Пористость может быть выражена как процентное отношение объема пустот к общему объему материала на данной площади, как среднее расстояние между узлами, или как средний диаметр поры.
Примечание 2 - Пористость - не то же самое, что утечка (см. 3.17) или проницаемость для воды (см. 3.34).
3.20 предварительная пропитка кровью: Процедура, в ходе которой осуществляется прохождение крови через стенки протеза и свертывание крови или отдельных ее фракций в порах протеза для снижения проницаемости стенки.
3.21 первичный компонент: Вещество, включенное в изготовленный протез, добавление которого предусмотрено изготовителем для улучшения характеристик ПКС.
3.22 протез: Любое изделие, заменяющее или замещающее анатомическую структуру или дефект в ней.
3.23 остаточный материал: Вещество, которое используется при изготовлении протеза, но для которого предусмотрено удаление или наличие которого не требуется в изготовленном протезе.
3.24 вторичный компонент: Вещество, которое может быть включено в изготовленный протез, но которое не определяет основные функциональные характеристики ПКС.
3.25 основа протеза: Сосудистый протез, на который наносится покрытие, соответствующее определению 3.5.
3.26 синтетический материал: Вещество небиологического происхождения, которое изготовляется и/или полимеризуется с помощью химических или физических средств.
Примечание - Химически измененные материалы, полученные из ископаемых биологического происхождения, например, из нефти, считаются синтетическими.
3.27 синтетический не текстильный протез: Сосудистый протез, изготовленный с использованием не текстильных материалов.
Пример - Протезы, изготовленные из экструдированного полимера, пористого полимера.
3.28 синтетический текстильный протез: Сосудистый протез, изготовленный из синтетических нитей с применением технологий текстильного производства.
Пример - Протезы, изготовленные с помощью вязания, тканья, плетения синтетических нитей.
3.29 используемая длина: Длина протеза, готового к имплантации, измеренная при определенной фиксированной нагрузке.
Примечание - Для некоторых протезов нагрузка может быть нулевой.
3.30 сосудистый протез, сосудистый графт: Протез, используемый для замены, обхождения или создания шунта между сегментами сосудистой системы.
3.31 велюр: Ткань с отрезным или петлевым ворсом или с ворсованной поверхностью.
3.32 пустоты: Часть стенки или сосудистого протеза, не занятая материалом конструкции (сравните 3.19).
Примечание - Это нечто иное, нежели пустоты в вязаной или тканой структуре.
3.33 давление просачивания воды: Давление, под которым вода проникает со стороны внутренней стенки на внешнюю стенку сосудистого протеза.
3.34 проницаемость для воды, пористость для воды: Объем чистой фильтрованной воды, проходящей за определенный период времени через единицу площади материала протеза под определенным давлением.
Примечание 1 - Проницаемость для воды обычно определяется как мл·см·мин
при приложении давления 16 кПа (120 мм рт.ст.).
Примечание 2 - Проницаемость для воды это не то же самое, что и пористость (см. 3.19).
3.35 сенотрансплантат, гетеротрансплантат: Имплантируемый материал, выполненный из тканей животного вида, отличного от реципиента.
4 Общие требования
Следующие требования применимы ко всем сосудистым протезам, независимо от вида материала.
4.1 Обозначение конфигурации и размеров
Конфигурация сосудистых протезов должна определяться его геометрической структурой, например, прямой, бифуркационный или конический.
Примечание - Некоторые протезы могут быть изготовлены для специального применения, например, бифуркационный аорто-бедренный протез. Такие протезы следует обозначать с указанием их предполагаемого клинического использования, а не просто как "бифуркационные".
4.1.1 Прямые сосудистые протезы постоянного сечения
Размеры прямых сосудистых протезов постоянного сечения должны определяться следующими характеристиками:
а) номинальный внутренний диаметр изделия в ненагруженном состоянии, выраженный в миллиметрах;
b) номинальный внутренний диаметр ПКС под давлением, выраженный в миллиметрах, при внутреннем давлении по крайней мере 16 кПа (120 мм рт.ст.), если данный диаметр изменяется под давлением более чем на 10% (см. 5.6);
c) минимальная используемая длина, выраженная в сантиметрах.
4.1.2 Бифуркационные сосудистые протезы постоянного сечения
Размеры бифуркационных сосудистых протезов постоянного сечения должны определяться значением номинального внутреннего диаметра изделия в ненагруженном состоянии и минимальной используемой общей длиной основной трубчатой части протеза и ее ответвлений, выраженных в сантиметрах. При необходимости должен быть также указан внутренний диаметр изделия под давлением [см. 4.1.1, перечисление b)].
4.1.3 Конические сосудистые протезы
Размер конических сосудистых протезов должен определяться номинальными внутренними диаметрами его концов в ненагруженном состоянии и минимальной используемой длиной, выраженными в сантиметрах. При необходимости должен быть также указан номинальный внутренний диаметр изделия под давлением [см. 4.1.1, перечисление b)].
4.1.4 Другие конфигурации
Для других конфигураций должны быть указаны основная длина (длины), номинальный внутренний диаметр(ы) в ненагруженном состоянии, номинальный внутренний диаметр(ы) под давлением, выраженные, при необходимости в миллиметрах или сантиметрах.
4.2 Указание предполагаемого клинического применения
Предполагаемое клиническое применение должно быть сформулировано с указанием одного или нескольких пунктов из следующих перечислений:
a) для грудного отдела аорты и/или торакально-абдоминальный;
b) для абдоминального отдела аорты и/или подвздошной артерии, и/или бедренной артерии;
c) для периферических артерий, включая дополнительные к анатомическим (например, подвздошно-бедренная артерия);
d) для коронарных артерий;
e) для артериовенозного шунтирования для сосудистого доступа;
f) прочие сосуды.
4.3 Материалы и конструкция
4.3.1 Классификация
Протезы классифицируют путем отнесения к одной из следующих групп:
a) тканый синтетический (например, трикотажный, тканый);
b) нетканый синтетический (например, полученный из экструдированного полимера, пористого полимера);
c) биологический (например, аллотрансплантат, ксенотрансплантат);
d) составной;
e) комбинированный.
4.3.2 Номенклатура
4.3.2.1 Синтетические материалы
Описание синтетических материалов должно включать следующее:
a) родовое или химическое наименование в соответствии с ИСО 472 или ИСО 2076;
b) природу их химической обработки или модификации.
4.3.2.2 Биологические материалы
Описание биологических материалов должно включать в себя следующую информацию:
a) происхождение материала, т.е. род животного-донора;
b) тип и место расположения ткани (например, пупочная вена; сонная артерия) или тип материала (например, коллаген, альбумин);
c) общий тип химической обработки или химической модификации материала;
d) специальные характеристики любых биологических материалов (например, степень образования поперечных связей - "сшивки").
4.3.2.3 Покрытия
Для покрытий должны быть определены их объем, стойкость и однородность.
Описание покрытий должно включать в себя следующую информацию, если применимо:
a) номенклатуру любых синтетических компонентов в соответствии с 4.3.2.1;
b) номенклатуру любых биологических компонентов в соответствии с 4.3.2.2.
4.3.2.4 Жидкости для хранения
Описание жидкости для хранения должно включать в себя следующую информацию:
a) родовое или химическое наименование основных компонентов;
b) природу и тип возможных токсических воздействий.
4.3.2.5 Остаточные химические вещества
Примечание - Остаточными химическими веществами считаются те жидкости для обработки или хранения протезов или их производные, которые могут быть выделены с протеза в состоянии его готовности к имплантации (см. 3.15).
Описание остаточных химических веществ должно включать их специальные химические наименования, если это возможно; в противном случае следует использовать их общее химическое наименование.
4.4 Биосовместимость и биостабильность
4.4.1 Биосовместимость
Материалы, из которых изготовлены протезы, должны быть оценены на биосовместимость в состоянии готовности протеза к имплантации либо отдельно, либо как часть изготовленного протеза в соответствии с принципами и методами, рекомендованными в ИСО 10993-1.
При изменении материалов и/или основных методов обработки следует проводить повторную оценку ПКС на биосовместимость.
4.4.2 Биостабильность
Если конструкция протеза и его предполагаемое использование в качестве постоянного имплантата требуют, чтобы протез поддерживал некоторый минимальный уровень физической и химической целостности после имплантации в живые ткани в течение определенного периода времени, материалы, из которых выполнен протез, должны быть испытаны на биостабильность или отдельно, либо в составе изготовленного протеза.
Обоснование методов испытания и полученных значений биостабильности может включать:
a) оценку долговечности материалов, используемых в настоящее время при данных показаниях;
b) продолжительность ожидаемого времени работы протеза при данных показаниях к использованию с учетом функциональных и клинических характеристик других протезов и других видов лечения, доступных в настоящее время для использования при данных показаниях.
В некоторых случаях эти вопросы должны быть рассмотрены при анализе соотношения риска и пользы применения изделия.
4.5 Стерильность
Протезы следует поставлять в стерильном виде.
Примечание - При валидации процессов стерилизации необходимо принимать во внимание риски, обусловленные переносом патогенов протезами, изготовленными из тканей животных, включая человека.
4.6 Общая информация и инструкция по применению
Каждый индивидуальный контейнер или общая упаковка, содержимое которых однородно, должны сопровождаться инструкцией по применению протеза. Инструкция по применению должна включать следующее:
a) показания к применению;
b) противопоказания, предупреждения и предостережения по применению;
c) рекомендуемые методы асептической обработки и подготовки протеза к имплантации, включая любые виды предварительной обработки, такие как предварительную промывку, предварительную коагуляцию и/или методы имплантации, если применимо;
d) выделенное утверждение "СТЕРИЛЬНО. НЕ СТЕРИЛИЗОВАТЬ ПОВТОРНО. ТОЛЬКО ДЛЯ ОДНОКРАТНОГО ПРИМЕНЕНИЯ", если применимо;
e) информацию по повторной стерилизации, если применимо;
f) предупреждение о наличии консервантов и/или вымываемых компонентов, если применимо;
g) рекомендации по хранению, если применимо;
h) дату публикации или номер редакции инструкции, отражающей изменения.
4.7 Упаковка
4.7.1 Индивидуальная упаковка
Каждый протез должен быть упакован в индивидуальную упаковку. Индивидуальная упаковка должна быть сконструирована таким образом, чтобы было четко видно, была ли упаковка когда-либо ранее вскрыта.
Индивидуальная упаковка должна быть сконструирована таким образом, чтобы обеспечивать сохранение стерильности протеза при нормальных условиях обращения, транспортирования и хранения и обеспечивать извлечение содержимого асептическим путем.
4.7.2 Внешняя упаковка
Каждая индивидуальная упаковка должна быть уложена во внешнюю упаковку, которая должна обеспечивать защиту внутренней упаковки от повреждений при хранении.
4.7.3 Транспортная упаковка
Каждая внешняя упаковка или несколько внешних упаковок, необязательно одного типа, могут быть упакованы в транспортную упаковку для защиты содержимого от повреждений при нормальных условиях обращения, транспортирования и хранения.
4.8 Маркировка
4.8.1 Этикетка упаковки
Каждый протез должен сопровождаться этикеткой (этикетками) на соответствующей упаковке (упаковках). На этикетке (этикетках) должна быть приведена, по меньшей мере, следующая информация:
a) наименование, адрес и/или торговое наименование изготовителя;
b) материал конструкции и тип конструкции (см. 4.3);
c) конфигурация (см. 4.1). Вместо письменного описания протеза может быть использован символ (например, | = прямой, = бифуркационный,
= подвздошно-бедренный протез);
d) номинальная используемая длина (см. 5.4);
е) номинальный внутренний диаметр(ы) в ненагруженном состоянии (см. 5.5);
f) если применимо, номинальный внутренний диаметр(ы) под давлением (см. 5.6);
g) если применимо, пористость, средняя проницаемость для воды, общая проницаемость для воды/утечки и/или давление просачивания воды (см. 5.2);
h) выделенное утверждение "СТЕРИЛЬНО. НЕ СТЕРИЛИЗОВАТЬ ПОВТОРНО. ТОЛЬКО ДЛЯ ОДНОКРАТНОГО ПРИМЕНЕНИЯ" или эквивалентные фразы или символы, если применимо (см. 4.5);
i) номер партии или серии в системе изготовителя;
j) номер партии стерилизации;
Примечание - Если номер партии или серии в системе изготовителя, [перечисление i)], и номер партии стерилизации, [перечисление j)], указывают на одну и ту же информацию, допускается указывать только один номер.
k) дату стерилизации со сроком хранения или срок годности;
I) предостережение от использования устройства при вскрытой или поврежденной упаковке;
m) рекомендации изготовителя по хранению, если применимо;
n) химические свойства всех жидкостей для хранения в индивидуальной упаковке с соответствующими предупреждениями об опасности;
о) если применимо, выделенное утверждение, касающееся требований или ограничений по предварительной коагуляции.
4.8.2 Стикеры для истории болезни пациента
Каждая упаковка протеза должна содержать, по меньшей мере, три этикетки-стикера для вклеивания в историю болезни пациента, получившего имплантат. Стикер должен включать следующую информацию:
a) наименование и адрес изготовителя;
b) наименование продукта;
c) номер партии в системе изготовителя и серийный номер стерилизации [см. примечание к 4.8.3, перечисление j)];
d) референтный номер модели протеза (номер по каталогу изготовителя).
4.9 Отчеты об испытаниях
Примечание - Для некоторых испытаний отчет не требуется.
4.9.1 Общие положения
В отчете об испытаниях должна быть приведена, по меньшей мере, следующая информация:
a) наименование изготовителя или дистрибьютора;
b) место и дата проведения испытаний;
c) номер партии и/или серийный номер;
d) спецификации изготовителя и/или дистрибьютора;
e) результаты испытаний;
f) утверждение о соответствии или несоответствии методам испытаний, определенным в соответствующих разделах настоящего стандарта.
4.9.2 Дополнительная информация
В дополнение к отчету об испытаниях в протокол следует внести следующую информацию:
a) материал(ы) изготовления в соответствии с 4.3;
b) конфигурацию и тип конструкции протеза;
c) размеры протеза в соответствии с 4.1, 4.1.2, 4.1.3, 4.1.4;
d) утверждение, указывающее на то, был ли каждый образец протеза стерилизован или нет, и, если применимо, использованный метод стерилизации;
e) метод(ы) испытания в соответствии с содержанием разделов настоящего стандарта;
f) условия, включая средние значения и допуски для контролируемых сред, в которых выдерживался и/или испытывался протез;
g) число образцов и результаты для каждого образца;
h) минимальные и максимальные зарегистрированные значения.
5 Требования к изготовленным протезам
Примечание - В таблице 1 приведены рекомендации к объемам квалификационных испытаний, испытаний при выборочном и сплошном контроле качества.
Таблица 1 - Рекомендуемые виды испытаний для оценки соответствия
Вид испытания | Квалификационные испытания | Приемо-сдаточные испытания: | Приемо-сдаточные испытания: |
выборки изделий | каждого изделия | ||
Качество поверхности | х | х | |
Пористость | В зависимости от конкретного типа ПКС | В зависимости от конкретного типа ПКС | В зависимости от конкретного типа ПКС |
Проницаемость для воды | |||
Общая проницаемость для воды | |||
Утечка | |||
Давление просачивания воды | |||
Прочность после нанесения многократных проколов | x | - | |
Прочность при растяжении | x | В зависимости от конкретного типа ПКС | |
Прочность при разрыве | x | ||
Используемая длина | x | x | |
Внутренний диаметр в ненагруженном состоянии | x | x | |
Внутренний диаметр под давлением | x | - | |
Толщина стенок | x | - | |
Прочность удержания нитей стенкой протеза | x | - | |
Сопротивление перегибу | x | - | |
Примечание - Знак "х" означает обязательность выполнения требования проведения испытания. | |||
Методы испытания могут быть применимы не ко всем конструкциям протезов (см. примечание 1 в разделе 8).
Должно быть приведено обоснование для исключения из оценки соответствия отдельных свойств ПКС при описании их характеристик.
Для описания характеристик новых протезов на основе развивающихся технологий могут также потребоваться испытания, выходящие за область применения настоящего стандарта. При определении соответствующих испытаний необходимо учитывать режимы отказа протеза и их влияние на функциональные характеристики ПКС. Для комбинированных протезов, несмотря на возможность проведения некоторых испытаний отдельно на компонентах протеза, приведенных в настоящем стандарте, также требуется испытание изделия целиком. Кроме того, если комбинированный протез частично состоит из биодеградируемых компонентов, биостабильная (недеградируемая) часть изделия также должна быть испытана, как и изделие в целом.
Должен быть испытан каждый сегмент составного протеза. Кроме того, любой выполненный анастомоз должен удовлетворять требованиям настоящего стандарта, касающихся утечки (5.2.3) и прочности анастомоза (8.3.2 или 8.3.3.3).
При существенных изменениях материалов, конструкции, конфигурации, методов применения и обработки должны быть проведены повторные квалификационные испытания ПКС.
Методы испытания, определенные в настоящем стандарте, должны применяться во всех случаях, кроме случаев, когда конструкция протеза требует использования других методов испытаний. Альтернативные методы должны быть валидированы и описаны изготовителем протезов с обоснованием выбора метода.
5.1 Оценка внешнего вида
Протезы не должны иметь разрывов в конструкции, а также не должно иметь загрязнений, пятен, следов травления, эрозии или других дефектов, приводящих к тому, что протез становится непригодным для своего предполагаемого использования.
Испытания следует проводить в соответствии с 8.1.
5.2 Пористость, проницаемость для воды, общая проницаемость для воды/утечка, давление просачивания воды
Пористость, проницаемость для воды, общая проницаемость для воды/утечка и/или давление просачивания воды должны быть оценены, если это необходимо для данного изделия. Должно быть приведено обоснование выбора проверяемых характеристики(ик).
5.2.1 Пористость
Среднее значение пористости образца протеза должно быть оценено с помощью одного из методов, приведенных в 8.2.1.
Среднее значение пористости образца протеза должно находиться в пределах диапазона значений, определенных изготовителем.
5.2.2 Проницаемость для воды
Среднее значение проницаемости для воды образца протеза должно быть оценено с помощью одного из методов, приведенных в 8.2.2.
Примечание - Если применимо, изготовитель должен привести рекомендации по тому, может ли проницаемость для воды быть снижена с помощью предварительной коагуляции.
Среднее значение проницаемости для воды образца протеза должно быть менее максимального значения, указанного изготовителем, или находиться в пределах диапазона значений, определенных изготовителем.
5.2.3 Общая проницаемость для воды
Среднее значение общей проницаемости для воды/утечки и/или утечки через анастомоз образца протеза должно быть оценено с помощью одного из методов, приведенных в 8.2.3.
Общая проницаемость для воды/утечка образца протеза не должна превышать максимального значения, указанного изготовителем.
5.2.4 Давление просачивания воды
Среднее значение давления просачивания воды для образца протеза должно быть оценено с помощью одного из методов, приведенных в 8.2.4.
Давление просачивания воды для образца протеза должно превышать минимальное значение, указанное изготовителем, или находиться в пределах диапазона значений, определенных изготовителем.
5.3 Прочность
Образец протеза должен быть испытан на продольную прочность при растяжении в соответствии с 8.3.2, на прочность при разрыве - в соответствии с 8.3.3 и на прочность анастомоза - в соответствии с 8.3.2 или 8.3.3.3, если применимо. Прочность в окружном направлении при растяжении (см. 8.3.1) требуется определять только в том случае, если прочность на разрыв нельзя оценить надежным путем.
Значения прочности при растяжении, прочности при разрыве и прочности анастомоза должны превышать минимальные значения, определенные изготовителем.
Примечание - Несмотря на то, что методы испытаний, приведенные в 8.3.3.1 и 8.3.3.2, могут быть в равной степени пригодными для целей контроля качества, они не являются эквивалентными. Для протезов многих видов зависимость деформации от напряжения различается для одноосного и двухосного режимов нагружения.
Для сосудистых протезов с указанным предполагаемым клиническим применением должна быть определена прочность протеза при наличии проколов. Значение прочности после нанесения многократных проколов образца протеза должно быть установлено изготовителем.
5.4 Длина
Используемая длина должна быть измерена и приведена. Используемая длина протеза не должна быть менее значений, указанных изготовителем.
Испытания следует проводить в соответствии с 8.4.
5.5 Внутренний диаметр в ненагруженном состоянии
Установленные изготовителем пределы отклонения при оценке соответствия протеза внутреннему диаметру должны находиться в следующих пределах:
а) для протезов с номинальным внутренним диаметром в ненагруженном состоянии, равным 10 мм или менее, измеренный внутренний диаметр в ненагруженном состоянии должен быть равен номинальному внутреннему диаметру в ненагруженном состоянии, указанному изготовителем, с допуском ±0,5 мм;
b) для протезов с номинальным внутренним диаметром в ненагруженном состоянии, равным 20 мм или менее, но не менее 10 мм, измеренный внутренний диаметр в ненагруженном состоянии должен быть равен номинальному внутреннему диаметру в ненагруженном состоянии, указанному изготовителем, с допуском ±1,0 мм;
с) для протезов с номинальным внутренним диаметром в ненагруженном состоянии, превышающим 20 мм, измеренный внутренний диаметр в ненагруженном состоянии должен быть равен номинальному внутреннему диаметру в ненагруженном состоянии, указанному изготовителем, с допуском ±5%.
Иные пределы соответствия должны быть обоснованы.
Испытания следует проводить в соответствии с 8.5.
5.6 Внутренний диаметр под давлением
Если внутренний диаметр под давлением превышает номинальный внутренний диаметр в ненагруженном состоянии, указанный изготовителем, более чем на 10%, номинальный внутренний диаметр под давлением должен быть установлен изготовителем [см. 4.8.1, перечисление f)].
Испытания следует проводить в соответствии с 8.6.
5.7 Толщина стенок
Толщину стенок следует измерять в соответствии с 8.7.
Толщина стенок должна быть в пределах допусков, указанных изготовителем.
5.8 Прочность удержания нитей
Прочность удержания шовных нитей стенкой протеза следует измерять в соответствии с 8.8. При этом прочность удержания нитей должна превышать минимальное значение, установленное изготовителем.
5.9 Диаметр/радиус перегиба
Диаметр/радиус перегиба сосудистого протеза должен быть измерен и установлен изготовителем.
Испытания следует проводить в соответствии с 8.9.
Примечание - Данное испытание может быть не применимо к сосудистым протезам некоторых видов (например, к гофрированным текстильным протезам).
5.10 Податливость
Податливость должна быть измерена и указана так, как это принято для данного изделия и в соответствии с 8.10.
6 Требования к in vivo доклинической и клинической оценкам*
_________________
* Слова "in vivo" в наименовании раздела 6 в бумажном оригинале выделены курсивом. - .
Доклиническая и клиническая оценки in vivo могут оказаться необходимыми, если безопасность и эффективность не могут быть подтверждены при in vitro испытаниях.
Примечание - Инновационные протезы и/или протезы специального назначения, включая новые виды клинического применения, могут потребовать большего числа испытаний, включая анализ видов отказа и оценку конструктивного решения ПКС.
6.1 In vivo доклинические испытания
Целью доклинических in vivo испытаний является оценка краткосрочного ответа и проходимости протеза, реакции окружающих тканей после имплантации в сосудистую систему и любых значимых изменений физических, химических и биологических свойств материала (материалов) ПКС, включая покрытия, если применимо. Данные испытания не предназначены для оценки долгосрочных функциональных характеристик протеза.
Каждый тип протеза испытывают имплантацией в предполагаемый или аналогичный участок сосудистого русла, по меньшей мере, на шести животных на срок не менее 20 недель для каждого животного, если не приведено обоснование более короткого срока наблюдения. Должны быть использованы соответствующие контрольные доклинические исследования in vivo для получения сравнительных данных, если не обосновано отсутствие контрольной группы. Состояние проходимости каждого протеза должно быть проконтролировано с помощью периодически проводимых наблюдений (например, с помощью ангиографии, Доплер исследований), результаты должны быть запротоколированы. Нарушение проходимости до окончания предусмотренного периода исследования не обязательно исключает животное из исследуемой популяции, используемой для оценки протеза и реакции окружающих тканей. Все животные, которым был имплантирован испытуемый или контрольный протез, включая исключенных из итогового анализа, должны быть учтены и включены в отчет.
Протезы не следует испытывать на животных тех видов, из которых они были получены, если не обосновано иное.
Результаты испытаний протезов должны подтверждать, что протезы соответствуют требованиям своего предполагаемого применения, основываясь на данных, приведенных и обоснованных в протоколе по доклиническим испытаниям in vivo (см. 9.1.2).
Испытания следует проводить в соответствии с 9.1 или в соответствии с иными валидированными методами испытаний, которые должны быть указаны изготовителем протеза. Порядок проведения доклинических испытаний in vivo должен быть обоснован, в частности, форма протокола эксперимента, методы измерения и анализ данных. При обосновании необходимо учитывать цели исследования.
6.2 Клиническая оценка
Целью клинической оценки является оценка краткосрочной (минимум один год) безопасности и эффективности сосудистого протеза при клиническом применении. Данная оценка не предназначена для оценки долгосрочных функциональных характеристик протеза.
Исследования должны быть проведены для каждого нового протеза или нового клинического применения протеза до выпуска изделия на рынок, используя принципы, установленные в ИСО 14155 или эквивалентных публикациях. На момент начала клинической оценки протезы должны соответствовать всем применимым требованиям разделов 4, 5 и 6.1 настоящего стандарта.
Примечание 1 - Клиническая оценка, проводимая в области имплантации, соответствующей грудному отделу аорты, может быть использована для обоснования применения в прямом сегменте брюшного отдела аорты.
Клиническая оценка должна быть проведена, по меньшей мере, в трех учреждениях, в каждом из которых следует имплантировать не менее 10 протезов. В клиническую оценку необходимо включить протез наименьшего диаметра, а также представительский образец для всех других диаметров, выпускаемых для соответствующего клинического применения (см. примечания).
Для протезов, которые редко используются, должна быть проведена клиническая оценка как минимум в трех учреждениях с использованием соответственно меньшего числа пациентов. Должно быть приведено обоснование объема исследований.
Примечание 2 - Расширение диапазона диаметров протезов для того же клинического применения может потребовать дополнительной клинической оценки.
Примечание 3 - Для протезов комбинированных видов, состоящих из биологически деградируемых компонентов и их основы (в виде, например, трикотажного или тканого волокна), уже известных на текущий момент времени на рынке, наименьший диаметр протеза можно не включать в клиническую оценку, если гарантировано, что основа этого диаметра представлена на рынке.
Клиническую оценку следует продолжать в течение, по меньшей мере, 12 месяцев для каждого пациента. Нарушение проходимости до окончания предполагаемой продолжительности исследования не обязательно исключает пациента из исследуемой популяции, используемой для оценки функции протеза. Все пациенты, которым имплантирован исследуемый или контрольный протез, включая исключенных из итогового анализа, должны быть учтены и включены в отчет.
Примечание 4 - Рекомендуется продолжать наблюдение до 24 мес после последней имплантации протеза.
Примечание 5 - Для новых протезов, выполненных из биологически деградируемых компонентов с использованием протезов, уже представленных в текущий момент времени на рынке, и различных основ, также известных на рынке, может быть достаточно продолжительности исследований 6 мес.
Должны быть получены объективные свидетельства безопасности и эффективности. Эти данные необходимо сравнить с данными, собранными и проанализированными эквивалентным образом для пациентов, получающих принятое в настоящее время медицинское и/или хирургическое лечение (контрольной группой). Должно быть приведено обоснование выбора контрольной группы, метода измерений и используемых методов статистического анализа.
Клинические данные должны быть собраны, проанализированы и зарегистрированы в соответствии с 9.2 или в соответствии с иными валидированными методами испытания, описание которых должно быть представлено изготовителем.
Порядок клинической оценки должен быть обоснован: общее число пациентов, которым имплантирован протез, форма протокола, методы измерений и анализ данных в соответствии со статистическими методами их обработки. При этом следует учитывать цели исследования.
7 Отбор образцов
При разработке ПКС следует использовать порядок отбора образцов, гарантирующий, что результаты, получаемые для каждого оцениваемого параметра, адекватно представляют данный параметр ПКС.
7.1 Отбор образцов для описания характеристик
Характеристики конструкции сосудистых протезов должны быть верифицированы таким образом, чтобы полученные результаты были представительными для всех типоразмеров изделий, отобранных для испытания. Для оценки характеристик необходимо использовать как минимум по три случайно выбранных образца по каждой из трех случайно выбранных партий поставки или серии.
7.2 Отбор образцов для контроля качества
7.2.1 Случайный отбор образцов
Если протезы изготавливают путем прерывающихся или отдельных процессов (т.е. если процессом изготовления обеспечивается выпуск серии или партии изделий), случайные (отобранные "вслепую") образцы должны быть взяты из каждой серии или партии.
7.2.2 Отбор образцов через определенный интервал времени
Если протезы изготавливают в ходе непрерывного процесса, то партия может быть сформирована на основе уже пройденного интервала времени путем отбора образцов через фиксированные промежутки времени в ходе производства.
7.2.3 Количество образцов
Число образцов, отобранных для испытания, должно соответствовать требованиям ИСО 2859-1 и ИСО 2859-2 с учетом заявленного предела среднего уровня выходного качества - AOQL (Average Outgoing Quality Limit) и числа изделий в партии или серии (см. примечания).
Примечание 1 - В иных случаях может оказаться предпочтительнее использовать уровень приемлемого качества - AQL (Acceptance Quality Level) вместо AOQL.
Примечание 2 - Любое иное число образцов может быть определено изготовителем, если план отбора образцов основан на валидированных процессах с данными ретроспективных исследований, свидетельствующими о применимости данного порядка отбора образцов.
8 Методы испытания сосудистых протезов
Примечание 1 - Методы испытания могут быть применимы не ко всем конструкциям протезов. Коды, приведенные ниже, указывают на то, какие методы являются применимыми:
А протезы всех типов;
В биологический;
С с покрытием;
N нетканый синтетический;
Т тканый синтетический;
Примечание 2 - Составные или комбинированные протезы могут входить в одну и более категорий, перечисленных выше.
8.1 Осмотр внешнего вида (протезы категории А)
8.1.1 Принцип осмотра
Протезы визуально исследуются на наличие дефектов.
8.1.2 Средства
Используемые средства должны включать:
a) контролируемую воздушную среду, например, чистую комнату или кабинет;
b) источник диффузного заднего освещения и/или прямого освещения.
8.1.3 Отбор образцов
Выборка должна составлять 100%.
8.1.4 Порядок испытаний
Протез исследуют с помощью средств визуализации без увеличения и дополнительного освещения на наличие разрывов или других нарушений целостности или производственных дефектов, а также на наличие загрязненных, запачканных областей, пятен, следов травления, потерь частиц материала или других дефектов, которые приводят к тому, что протез становится непригодным для своего предполагаемого использования.
8.1.5 Представление результатов
Должно быть записано число принятых и отбракованных единиц изделий.
8.1.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях обычно не требуется (см. примечание в 4.9).
8.2 Определение пористости, проницаемости для воды, общей проницаемости для воды/утечки и давления просачивания воды
8.2.1 Определение пористости (протезы категории N)
Следует использовать один из следующих методов:
a) метод планиметрической пористости;
b) метод гравиметрической пористости;
c) метод микроскопической пористости.
Примечание - Планиметрический и гравиметрический методы представляют собой прямое измерение пористости, а микроскопический метод позволяет определить индекс пористости в терминах расстояния между узлами или среднего диаметра пор.
Могут использоваться иные, альтернативные, методы, если приведено документальное подтверждение того, что они эквивалентны.
8.2.1.1 Планиметрическое определение пористости
8.2.1.1.1 Принцип
Данное испытание предназначено для определения площади пустот и/или площади материала образца протеза с помощью измерений, выполняемых на микроснимках, полученных с помощью сканирующего электронного микроскопа или оптического микроскопа. Если существует различие между внутренней и внешней поверхностями, должны быть описаны обе поверхности, если не приведено обоснование выбора поверхности, на которой проводят измерения.
8.2.1.1.2 Аппаратура
Используемая аппаратура должна включать:
a) оборудование для получения микроснимков участка протеза с помощью сканирующего электронного микроскопа или оптического микроскопа;
b) устройство, такое как микропланиметр, микрометр или стол с компьютерной оцифровкой с погрешностью измерения не более ±1% среднего диаметра пор, определенного изготовителем, или расстояния между узлами.
8.2.1.1.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.2.1.1.4 Порядок испытаний
Для каждого образца протеза либо
a) готовят микроснимок (микроснимки), полученный с помощью сканирующего электронного микроскопа либо
b) готовят фотографию (фотографии) для оптического исследования поверхности образца (см. примечание). Должна быть записана исследуемая поверхность (внешняя или внутренняя).
Примечание - Степень увеличения зависит от вида образца и доступной измерительной аппаратуры (см. 8.2.1.1.2).
Исследуют микроснимки, полученные с помощью сканирующего электронного микроскопа, или фотографии, используя измерительную аппаратуру (см. 8.2.1.1.2), и определяют размер пустот, число пустот на квадратный миллиметр и площадь материала.
8.2.1.1.5 Представление результатов
Пористость должна быть выражена в процентах. Вычисляют и записывают пористость , % каждого испытательного образца с помощью формулы:
![]() .
.
Вычисляют и записывают среднеквадратичное отклонение пористости.
8.2.1.1.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать исследуемые поверхности, их размеры, среднее значение и стандартное отклонение пористости образцов протезов, а также данные согласно 4.9.1.
Дополнительная информация должна быть записана в соответствии с 4.9.2.
8.2.1.2 Гравиметрическое определение пористости
8.2.1.2.1 Принцип
Измеренную массу на единицу площади образца протеза сравнивают с плотностью продукта и толщиной стенок образца.
8.2.1.2.2 Средства
Используемые средства должны включать:
а) весы погрешностью измерения не более ±0,1% средней массы образца;
b) оборудование для измерения площади поверхности образца погрешностью измерения не более ±2% исследуемой площади поверхности;
Примечание - Значение площади может быть получено с помощью отдельного определения длины и диаметра, как описано в 8.4 и 8.5 или 8.6; альтернативно могут быть использованы вырезанные плоские образцы. Следует использовать только внутренний диаметр под давлением, если он указан в соответствии с 5.6.
с) оборудование для измерения толщины стенок, как описано в 8.7;
d) оборудование для определения изменения плотности.
8.2.1.2.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.2.1.2.4 Порядок испытаний
Длина каждого образца должна быть не менее 100 мм. Определяют следующее:
a) общую массу , в граммах;
b) общую площадь поверхности , в квадратных миллиметрах;
Примечание - Если используемая длина и внутренний диаметр
измеряют по отдельности, то
![]() .
.
c) толщину стенок обоих образцов, в миллиметрах, используя метод, приведенный в 8.7;
d) плотность волокнистых или полимерных материалов в каждом образце, в граммах на кубический сантиметр, с помощью подходящего метода определения плотности.
8.2.1.2.5 Представление результатов
Пористость должна быть выражена в процентах.
Вычисляют и записывают пористость , %, каждого образца с помощью формулы:
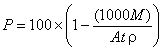 .
.
Вычисляют и записывают среднее значение и стандартное отклонение пористости.
8.2.1.2.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать среднее значение и стандартное отклонение пористости образцов протезов, а также данные согласно 4.9.1.
Дополнительная информация должна быть записана в соответствии с 4.9.2.
8.2.1.3 Микроскопическое определение пористости
8.2.1.3.1 Принцип
Данное испытание предназначено для определения основного расстояния между узлами в изделиях, полученных с помощью растягивания или расширения полимеров, или среднего диаметра пор и числа пор на квадратный миллиметр в изделиях, полученных литьем полимеров, с помощью измерений, выполненных на микроснимках, полученных с помощью сканирующего электронного микроскопа или оптического микроскопа. Если существует различие между внутренней и внешней поверхностью, должны быть описаны обе поверхности, если не приведено обоснование выбора поверхности, на которой проводятся измерения.
Примечание - В ходе данного испытания определяют индекс пористости, а не измеряют пористость напрямую.
8.2.1.3.2 Аппаратура
Используемая аппаратура должна включать:
a) оборудование для получения микроснимка участка протеза с помощью сканирующего электронного микроскопа или оптического микроскопа;
b) устройство, такое как стальная линейка, микрометр, измерительное стекло или стол с компьютерной оцифровкой с погрешностью измерения не более ±1% среднего диаметра пор, определенного изготовителем, или расстояния между узлами.
8.2.1.3.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.2.1.3.4 Порядок испытаний
Готовят микроснимок участка испытательного образца с помощью сканирующего электронного микроскопа или исследуют и фотографируют исследуемый участок с помощью оптического микроскопа.
Примечание 1 - Степень увеличения зависит от вида образца и доступной измерительной аппаратуры (8.2.1.3.2).
Определяют расстояние между внутренними кромками соседних пустот в направлении нитей или волокон. Выполняют данное измерение, по крайней мере, в шести областях каждого микроснимка.
Альтернативно определяют диаметр пор. Повторяют данное измерение, по крайней мере, для шести характерных пор на каждом микроснимке. Подсчитывают число пор в области с известной площадью.
Примечание 2 - Расстояние между узлами 5 мкм или менее не считается разделением узлов, т.е. необходимо записывать только расстояние между узлами 6 мкм или более.
8.2.1.3.5 Представление результатов
Среднее значение и стандартное отклонение расстояния между узлами или среднее значение и стандартное отклонение диаметра пор должны быть выражены в микрометрах (мкм).
Вычисляют и записывают среднее значение и стандартное отклонение расстояния между узлами или среднее значение и стандартное отклонение диаметра пор, и число пор на единицу площади.
8.2.1.3.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать описание поверхности, для которой проводили исследование, размеры поверхности, а также среднее значение и стандартное отклонение расстояния между узлами в образце протезов или среднее значение и стандартное отклонение диаметра пор в образцах протезов, а также данные согласно 4.9.1.
Дополнительная информация, включая, если применимо, среднее значение и стандартное отклонение числа пор на единицу площади, должна быть записана в соответствии с 4.9.2. Если поры не круглые, должно быть приведено описание измеряемого диаметра.
8.2.2 Определение проницаемости для воды (протезы категории Т, С)
8.2.2.1 Принцип
Данное испытание предназначено для измерения потока воды через заданную площадь образца протеза при заданном гидростатическом давлении.
8.2.2.2 Аппаратура
Используемая аппаратура должна включать:
a) устройство для измерения потока, такое как интегральный расходомер или расходомер с приемной емкостью известного объема, способное обеспечивать показания в пределах 2% полного диапазона и имеющее точность ±2% полного диапазона показаний.
Примечание - Для покрытия всего диапазона скоростей потока, встречающегося во время испытаний, может потребоваться более одного устройства;
b) устройство для измерения давления, такое как датчик давления, манометр или пьезометр, способное измерять гидростатическое давление до 19 кПа (140 мм рт.ст.) с точностью ±0,3 кПа (±2 мм рт.ст.);
c) устройство для фиксации образца, разработанное таким образом, чтобы:
1) площадь апертуры фиксирующего устройства была от 0,5 до 1,0 см при измерении с точностью ±1%;
2) апертура была круглой (см. примечание).
Примечание - Если испытывают узкий образец, апертура может быть прямоугольной. Если используют апертуру такого вида, это должно быть отмечено в отчете, а также указаны размеры, полученные с точностью ±1%. Также необходимо отметить ориентацию образца;
3) не было изгибов или изменения диаметра на пути потока на расстоянии шести диаметров испытательной области от испытуемого образца;
4) не наблюдалось утечек вокруг образца.
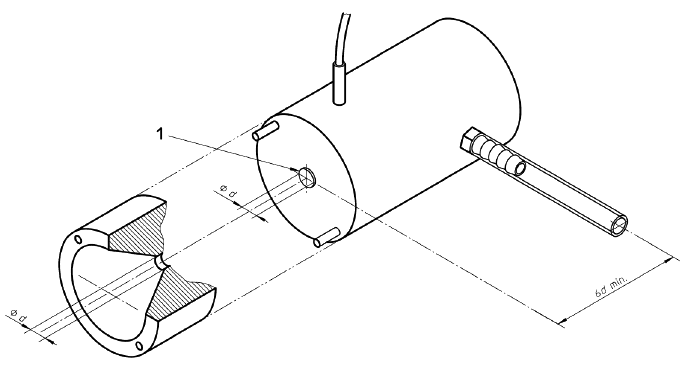
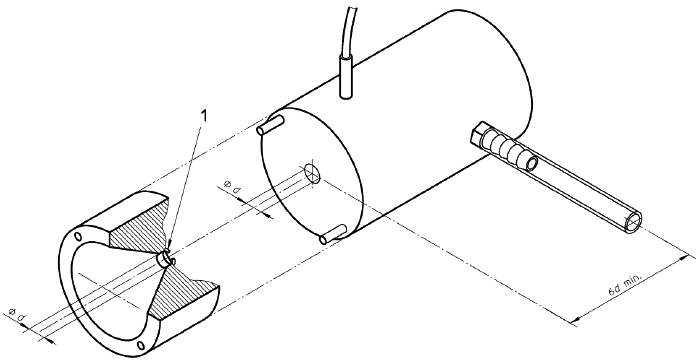
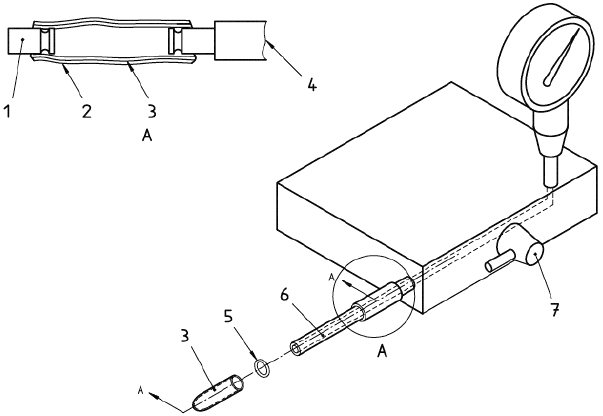
Примечание - Примеры соответствующих фиксирующих устройств приведены на рисунках 1, 2 и 3;
с) средства подачи чистой фильтрованной воды комнатной температуры на устройство для фиксации образца под давлением 16,0 кПа (120 мм рт.ст.) в течение всего испытания.
1 - Втулка
Рисунок 1 - Устройства для испытания на проницаемость для воды. Устройство для фиксации образца
(пример 1)
1 - Шайба
Рисунок 2 - Устройства для испытания на проницаемость для воды. Устройство для фиксации образца
(пример 2)
1 - натянутые пружины; 2 - открытый промежуток 0,5 см или 0,798 см в диаметре; 3 - сжатые пружины; 4 - испытуемая ткань
Рисунок 3 - Устройства для испытания на проницаемость для воды. Устройство для фиксации образца
(пример 3).
Основная сборка
8.2.2.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.2.2.4 Порядок испытаний
Для смачивания образца перед испытанием образец протеза может быть погружен в чистую фильтрованную воду при комнатной температуре.
Закрепляют образец в устройстве для фиксации образца, достаточно растянув образец без деформации материала.
Примечание - Растяжение может обеспечиваться с помощью зажимов и грузов или с помощью выравнивания образца узким шпателем. Данное натяжение образца должно примерно соответствовать условиям, соответствующим используемой длине (см. 8.4) и, в случае гофрированной конструкции, должно удалять большую часть складок.
Включают систему подачи воды и регулируют давление до уровня (16,0±0,3) кПа [(120±2) мм рт.ст.] согласно показаниям устройства для измерения давления. Измеряют скорость потока воды, проходящей через образец в течение (60±1) с, в течение которых система работает в условиях стационарного потока (стационарное состояние).
8.2.2.5 Представление результатов
Проницаемость для воды должна быть выражена в миллилитрах на квадратный сантиметр в минуту (мл·см мин
).
Вычисляют и записывают проницаемость для воды на основании следующей формулы:
![]() ,
,
где - скорость потока через образец в миллилитрах в минуту;
- площадь поперечного сечения апертуры устройства для фиксации образца, в квадратных сантиметрах.
Записывают площадь и, если применимо, размеры апертуры.
8.2.2.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать среднее значение и стандартное отклонение измеренной проницаемости воды для образцов протезов, размеры апертуры, если она прямоугольная, а также данные согласно 4.9.1.
Должна быть указана дополнительная информация, включая площадь апертуры и данные согласно 4.9.2.
8.2.3 Определение общей проницаемости для воды/утечки (протезы категории В, С)
8.2.3.1 Принцип
Данное испытание предназначено для измерения скорости утечки воды через все стенки протеза или через характерный сегмент в виде трубки под давлением 16 кПа (120 мм рт.ст.). Испытуемый сегмент должен включать все области, утечка из которых представляет интерес (например, фабричные анастомозы). Испытание должно подходить как для прямых, так и для бифуркационных конструкций.
8.2.3.2 Аппаратура
Следует использовать чистую фильтрованную воду комнатной температуры.
Примечание - Могут быть использованы другие растворы, например, фильтрованный солевой раствор.
Для крепления образцов следует использовать набор адаптеров, подходящих для внутренних диаметров испытуемых протезов. Изоляция между образцом протеза и адаптерами должна быть водонепроницаемой. Сборку протеза и адаптеров крепят в фиксаторе, который допускает свободное расширение одного конца протеза при подаче давления. Фиксатор соединяют с системой регулировки давления, способной подавать воду под давлением более 16 кПа (120 мм рт.ст.). Устройства для измерения давления, например, датчики, манометры или пьезометры, располагают таким образом, чтобы измерять давление в просвете протеза во время испытания. Следует использовать средства измерения объемного расхода воды через стенку протеза и/или средства сбора утечки через фабричный анастомоз. Это может быть реализовано использованием расходомера, метода смещений или метода сбора. Для фиксации времени испытания используют таймер. Используют средства определения испытательной длины протеза, в сантиметрах, от изоляции до изоляции.
8.2.3.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.2.3.4 Порядок испытаний
Протез следует испытывать в состоянии готовности к имплантации.
Изолируют дистальный конец (концы) с помощью затычки или плотного перегиба или сворачивают дистальный конец (концы) примерно на 2 см и закрепляют скобой для поддержания водонепроницаемой изоляции.
Соединяют образец протеза с адаптером, соответствующим внутреннему диаметру, используя методы, обеспечивающие водонепроницаемую изоляцию. Соединяют адаптеры и протез с устройствами подачи и измерения давления. Постепенно увеличивают давление в просвете образца, выгоняя захваченный воздух. Доводят давление до (16,0±0,3) кПа (120 мм рт.ст. ±2 мм рт.ст.). Дают потоку стабилизироваться и измеряют утечку через стенку протеза за 60 с. Если используется метод сбора воды, утечки через основание и ветви бифуркационного протеза могут быть измерены по отдельности.
8.2.3.5 Представление результатов
Вычисляют площадь поверхности протеза или сегмента и проницаемость для воды выражают в миллилитрах на квадратный сантиметр в минуту. Для утечки через анастомоз утечка в области анастомоза должна быть выражена в миллилитрах в минуту.
8.2.3.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать среднее значение и стандартное отклонение проницаемости для воды и/или утечки через анастомоз для образцов протезов, а также данные согласно 4.9.1.
Дополнительная информация должна быть записана в соответствии с 4.9.2.
8.2.4 Определение давления просачивания воды (протезы категории N)
8.2.4.1 Принцип
Данное испытание предназначено для определения давления просачивания воды для сосудистого протеза.
8.2.4.2 Аппаратура
Используемая аппаратура включает установку, способную подавать ступенчато увеличивающееся давление на образец до возникновения утечки. Также следует использовать соответствующий датчик давления.
8.2.4.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.2.4.4 Порядок испытаний
Образцы заполняют водой, и подают начальное давление, равное значению, определенному изготовителем. Затем давление постепенно увеличивают. Как только на внешней поверхности появляется вода, записывают давление, и испытание прекращают. Это и есть давление просачивания воды.
8.2.4.5 Представление результатов
Давление должно быть записано в килопаскалях (миллиметрах ртутного столба).
8.2.4.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать среднее значение и стандартное отклонение давления просачивания воды для образцов протезов, а также данные согласно 4.9.1.
Должна быть указана дополнительная информация, включая скорость увеличения давления и данные согласно 4.9.2.
8.3 Определение прочности
Примечание - Для определения продольной прочности и прочности в окружном направлении при растяжении образца протеза требуются отдельные испытания с приложением ненаправленной нагрузки. Если необходимо, должны быть выполнены оба испытания.
8.3.1 Определение прочности в окружном направлении при растяжении (протезы категории А)
8.3.1.1 Принцип
Образец протеза в виде трубки крепят на двух круглых ножках. Затем его растягивают с постоянной скоростью до достижения предела текучести или разрыва. Данное испытание является модификацией ИСО 5081.
8.3.1.2 Аппаратура
Используемая аппаратура должна включать:
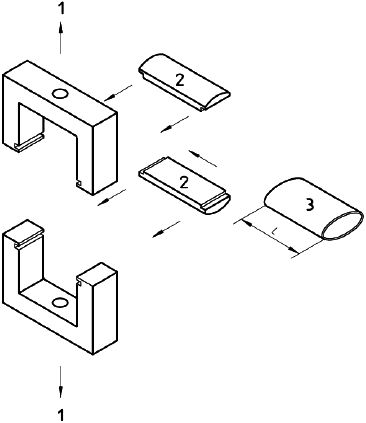
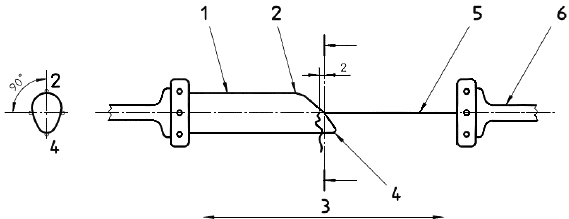
a) разрывную испытательную машину, соответствующую требованиям ИСО 5081, имеющую постоянную скорость перемещения, а также ножки соответствующего размера и подходящие держатели, на которые может быть насажен протез; пример разрывной испытательной машины приведен на рисунке 4 а) и b);
b) измеряющее устройство точностью ±0,5 мм, например, линейка или штангенциркуль;
c) аппаратуру для измерения внутреннего диаметра в ненагруженном состоянии (см. 8.5).
а) Схематично
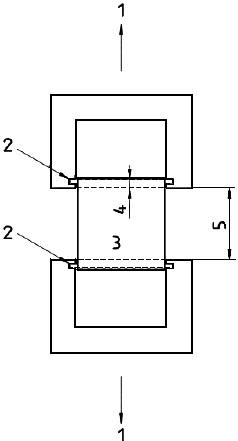
b) Вид спереди
1 - прибор для испытания на растяжение; 2 - разъемный брусок; 3 - образец; 4 - диаметр ножек; 5 - расстояние между ножками
Рисунок 4 - Устройства для испытания с разъемными брусками
8.3.1.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.3.1.4 Порядок испытаний
Вырезают испытательный образец из образца протеза длиной не менее номинального внутреннего диаметра в ненагруженном состоянии (см. 8.5). После аккуратного удаления всех изгибов измеряют и записывают длину образца в миллиметрах с точностью ±0,5 мм. Натягивают образец на две ножки. Необходимо обратить внимание на то, чтобы образец не растягивался и не перекручивался, а провисание должно быть минимальным. Растягивают образец с постоянной скоростью от 50 до 200 мм·мин
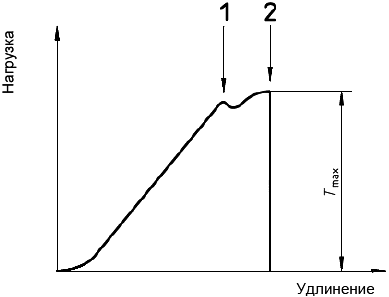
до достижения точки разрыва. Определяют нагрузку в точке начала текучести или разрыва, т.е. максимальную нагрузку (
) с точностью ±2% и записывают скорость удлинения (см. рисунок 5), если применимо.
1 - текучесть материала; 2 - разрыв
Рисунок 5 - Кривая зависимости нагрузки от удлинения
8.3.1.5 Представление результатов
Вычисляют прочность в окружном направлении при растяжении каждого образца, выраженную в килоньютонах на миллиметр, разделив максимальную нагрузку на исходную длину образца.
![]() .
.
8.3.1.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать среднее значение и стандартное отклонение прочности в окружном направлении при растяжении образца протеза, обоснование скорости деформирования, если она находится за пределами определенного диапазона (см. 8.3.1.4), а также данные согласно 4.9.1.
Дополнительная информация должна быть записана в соответствии с 4.9.2.
8.3.2 Определение продольной прочности на растяжение (протезы категории А)
8.3.2.1 Принцип
Концы образца протеза в виде трубки помещаются в соответствующие зажимы. Затем его растягивают с постоянной скоростью до достижения предела текучести или разрыва. Данное испытание является модификацией ИСО 5081.
8.3.2.2 Аппаратура
Используемая аппаратура должна включать:
a) разрывную испытательную машину, соответствующую требованиям ИСО 5081, имеющую постоянную скорость перемещения, а подходящие зажимы для надежной фиксации образца протеза без повреждения его структуры (т.к. такое повреждение может вызвать преждевременный разрыв на границе с зажимами);
b) измеряющее устройство точностью ±0,5 мм, например, линейка или штангенциркуль.
8.3.2.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.3.2.4 Порядок испытаний
Если испытывают прочность фабричного анастомоза, должна быть испытана область, включающая анастомоз.
Вымачивают образец протеза согласно рекомендациям изготовителя, если применимо. Перед испытанием удаляют синтетическую сетку, покрывающую протез, если применимо.
Помещают концы образца протеза в зажимы с начальным расстоянием между ними в диапазоне от 50 до 150 мм. Необходимо обратить внимание на то, чтобы образец не растягивался, не перекручивался и не повреждался зажимами, а провисание должно быть минимальным. Растягивают образец с постоянной скоростью от 50 до 200 мм·мин до достижения точки разрыва. Определяют нагрузку в точке начала текучести или разрыва, т.е. максимальную нагрузку (
) с точностью ±2% и записывают скорость удлинения (см. рисунок 5), если применимо.
8.3.2.5 Представление результатов
Продольная прочность на растяжение каждого образца выражается в килоньютонах как:
![]() .
.
8.3.2.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать среднее значение и стандартное отклонение продольной прочности образца протеза, скорость деформирования (с обоснованием, если она находится за пределами определенного диапазона, см. 8.3.2.4), а также данные согласно 4.9.1.
Дополнительная информация должна быть записана в соответствии с 4.9.2.
8.3.3 Определение прочности на разрыв (протезы категории А)
Примечание - Испытания, описанные в настоящем пункте, являются альтернативными для испытаний по 8.3.1. Обратите внимание на примечание в 8.3.
Следует использовать один из следующих методов:
а) прочность на разрыв давлением плоского образца (является модификацией метода, определенного в ИСО 2960);
b) прочность на разрыв пуансоном плоского образца;
c) прочность на разрыв давлением цельного образца.
Все эти методы имеют одинаковую достоверность, однако прочность на разрыв давлением цельного образца (см. 8.3.3.3) должна быть предпочтительным методом описания характеристик.
8.3.3.1 Определение прочности на разрыв давлением плоского образца
8.3.3.1.1 Принцип
Участок испытуемого образца протеза фиксируют поверх эластичной мембраны с помощью плоского круглого зажимного кольца и к задней стороне диафрагмы прикладывают увеличивающееся давление жидкости до разрыва образца.
Примечание - Данный метод обычно не применяется к плотным тканым материалам.
8.3.3.1.2 Аппаратура
Используемая аппаратура включает испытательную установку для определения разрывной прочности, соответствующую ИСО 2960, но с зажимным кольцом такого диаметра, чтобы испытуемая площадь в нормальных условиях составляла 100 мм. Для протезов с малым номинальным внутренним диаметром в ненагруженном состоянии может быть необходимым использование испытательной установки с меньшим размером отверстия. Размер отверстия должен быть указан в отчете.
8.3.3.1.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.3.3.1.4 Порядок испытаний
Разрезают образец протеза вдоль продольной оси и расправляют его для получения плоского листа. Помещают плоский образец поверх отверстия в основании испытательной установки таким образом, чтобы образец полностью покрывал диафрагму и для гофрированных моделей разглаживают складки, не нарушая фабричной структуры. Закрепляют зажимное кольцо. Увеличивают давление с постоянной скоростью. Записывают разрывное давление.
8.3.3.1.5 Представление результатов
Разрывное давление каждого образца должно быть выражено в килопаскалях, размер отверстия в квадратных миллиметрах и номинальный внутренний диаметр испытуемого протеза в миллиметрах.
8.3.3.1.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать среднее значение и стандартное отклонение разрывного давления образцов протеза и размер отверстия, если испытуемая площадь была менее 100 мм, а также данные согласно 4.9.1.
Должна быть указана дополнительная информация, включая метод испытания, скорость увеличения давления и размер отверстия, если они не указаны в данном отчете об испытаниях, и данные согласно 4.9.2.
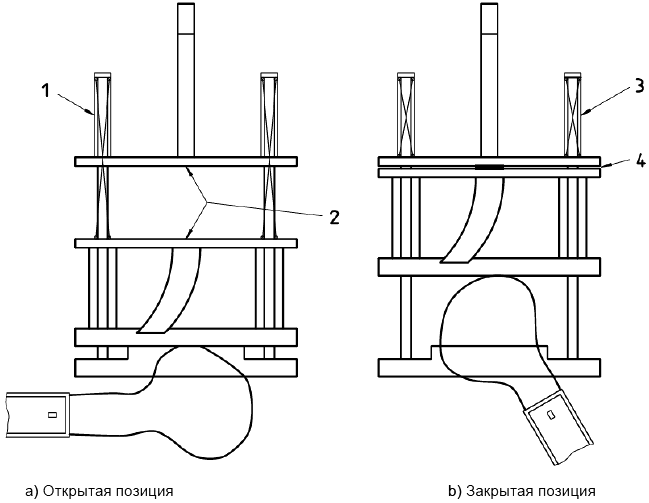
8.3.3.2 Определение прочности на разрыв пуансоном плоского образца
8.3.3.2.1 Принцип
Участок испытуемого образца протеза фиксируют над отверстием с помощью плоского круглого зажимного кольца, и цилиндрический пуансон с полусферической головкой проходит через образец до прокола. Прикладываемую нагрузку измеряют непрерывно во время данной процедуры.
8.3.3.2.2 Аппаратура
Используемая аппаратура должна включать:
a) разрывную испытательную машину, имеющую постоянную скорость перемещения, соответствующую требованиям ИСО 5081 и способную работать в режиме сжатия или снабженную соответствующими зажимными опорами;
b) крепежное устройство для образцов с зажимным кольцом и перемещающимся пуансоном. Соответствующая аппаратура и размеры приведены на рисунках 6 и 7.
Размеры в дюймах
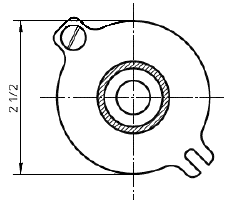
а) Основание держателя, вид сверху
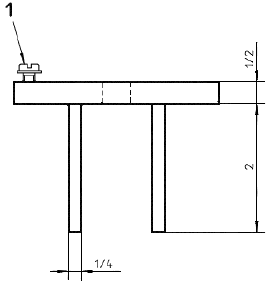
b) Основание держателя, вид сбоку
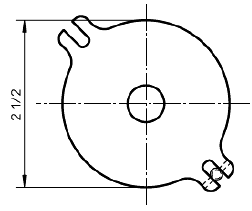
с) Верх держателя, вид сверху
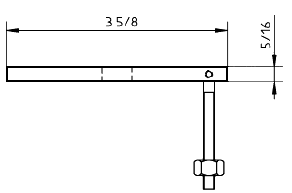
d) Верх держателя, вид сбоку
е) Пуансон
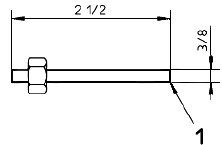
Примечание - 3 5/8 дюйма = 92 мм; 2 дюйма = 51 мм; 5/16 дюйма = 7,9 мм; 21/2 дюйма = 64 мм; 3/8 дюйма = 9,5 мм; 1/4 дюйма = 6,4 мм.
1 - 1/4 резьба, кромки сглажены; 2 - поверните полусферу и отполируйте
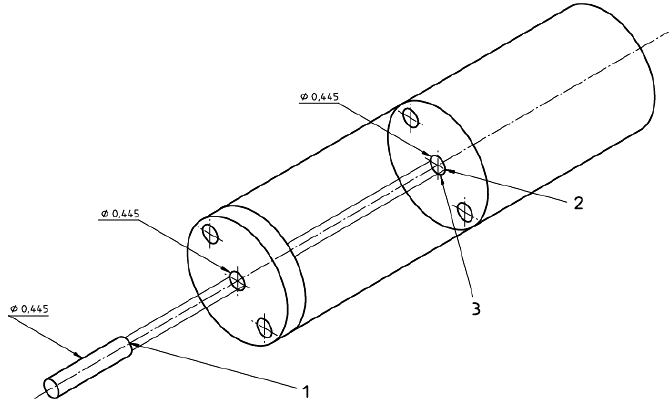
Рисунок 6 - Пример крепежного устройства для образца при испытании на разрыв пуансоном. Прокладка из волоконно-резиновой смеси с внешним диаметром 1, внутренним диаметром 3/4 с центральным отверстием диаметром 0,445
Размеры в дюймах
1 - радиус полусферы; 2 - прокладка; 3 - острые кромки скруглить
Примечание - 0,445 дюйма = 11,3 мм.
Рисунок 7 - Пример схематического изображения установки для испытания на разрыв пуансоном
Все испытательное оборудование должно иметь точность в пределах ±5%.
8.3.3.2.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.3.3.2.4 Порядок испытаний
Разрезают образец протеза вдоль продольной оси и расправляют его для получения плоского листа. Помещают плоский образец поверх отверстия в основании испытательной установки таким образом, чтобы образец полностью покрывал отверстие. Для гофрированных поверхностей убирают складки, не нарушая фабричной структуры. Закрепляют зажимное кольцо. Выставляют основание и пуансон либо в зажимах разрывной испытательной машины, либо в зажимных опорах так, чтобы два отверстия и зонд были концентрическими. Опускают пуансон так, чтобы он коснулся испытательного образца. Проводят пуансон через образец с постоянной скоростью до разрыва. Записывают диаметр пуансона, скорость перемещения и максимальную разрывную нагрузку для каждого образца.
8.3.3.2.5 Представление результатов
Диаметр пуансона должен быть выражен в миллиметрах, скорость перемещения в миллиметрах в минуту, разрывная нагрузка в килоньютонах.
8.3.3.2.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать среднее значение и стандартное отклонение разрывной нагрузки, диаметр и скорость перемещения пуансона, а также данные согласно 4.9.1.
Дополнительная информация должна быть записана в соответствии с 4.9.2.
8.3.3.3 Определение прочности на разрыв давлением цельного протеза
8.3.3.3.1 Принцип
Образец протеза раздувают одним из следующих способов:
a) непосредственным заполнением протеза жидкостью;
b) помещением баллона внутрь протеза и заполнением баллона жидкостью с измеряемой скоростью изменения давления до разрыва образца протеза.
8.3.3.3.2 Аппаратура
Используемая аппаратура включает систему, способную измерять и регистрировать давление, превышающее давление разрыва образца, либо
a) аппаратуру, способную обеспечивать постоянно увеличивающееся давление жидкости или газа внутри образца протеза, растянутого до своей используемой длины; либо
b) аппаратуру для расширения баллона, как описано в 8.6.2.
Примечание - Для любого метода может потребоваться несколько устройств, чтобы покрыть весь диапазон образцов, на которых выполняются измерения.
8.3.3.3.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.3.3.3.4 Порядок испытаний
Аккуратно вводят баллон в образец протеза или прикрепляют образец протеза непосредственно к аппарату для подачи давления.
Примечание - Может потребоваться смазать баллон простой силиконовой смазкой для облегчения введения.
Прикрепляют устройство для измерения давления так, чтобы оно записывало давление внутри образца протеза. Подают жидкость или газ так, чтобы получить равномерное увеличение давления. Измеряют давление внутри образца протеза. Записывают скорость увеличения давления и давление, при котором либо порвется образец протеза, либо испытание будет прервано.
8.3.3.3.5 Представление результатов
Скорость увеличения давления должна быть выражена в килопаскалях в секунду, а разрывное давление в килопаскалях.
Вычисляют и записывают среднее значение и стандартное отклонение разрывного давления.
8.3.3.3.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать среднее значение и стандартное отклонение разрывного давления образцов протеза, а также данные согласно 4.9.1.
Должна быть указана дополнительная информация, включая метод испытания, скорость увеличения давления и данные согласно 4.9.2.
8.3.4 Определение прочности после многократных проколов (протезы категории А, если применимо)
8.3.4.1 Принцип
Данное испытание предназначено для определения прочности протеза после многократных проколов для моделирования использования при диализе. Образцы многократно прокалывают, а затем испытывают на прочность на разрыв давлением в соответствии с 8.3.3.3 или прочность в окружном направлении при растяжении в соответствии с 8.3.1.
8.3.4.2 Аппаратура
Для многократных проколов протеза следует использовать иглу для диализа 16-го размера. На предмет другого испытательного оборудования см. соответствующие испытания на прочность (см. 8.3.1 или 8.3.3.3).
8.3.4.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.3.4.4 Порядок испытаний
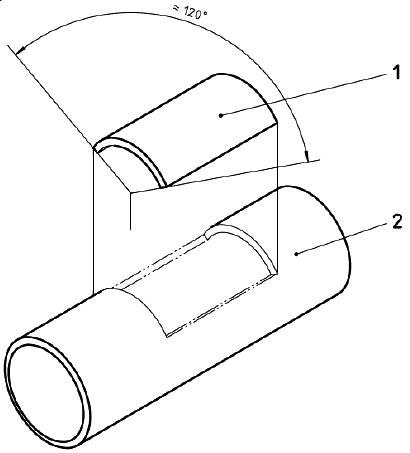
Образцы прокалывают 0, 8, 16 и 24 раза на квадратный сантиметр внешней поверхности протеза (см. примечание). Проколы должны быть ограничены 1/3 контура протеза (см. рисунок 8).
1 - область испытания на проколы; 2 - протез
Рисунок 8 - Схематическое изображение испытания на прокол протеза
Примечание - Значения 8, 16 и 24 прокола на квадратный сантиметр внешней поверхности соответствуют примерно 6, 12 и 18 месяцам клинического использования. Это подразумевает шесть проколов в неделю на 1/3 внешней поверхности протеза длиной 30 см.
Образцы должны быть испытаны на прочность.
8.3.4.5 Представление результатов
Значения прочности до и после нанесения проколов регистрируют в отчете таким образом, как описано в части, касающейся соответствующего испытания.
8.3.4.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать среднее значение и стандартное прочности образцов протеза до и после проколов, а также данные согласно 4.9.1.
Должна быть указана дополнительная информация, включая метод испытания и число образцов, а также данные согласно 4.9.2.
8.4 Определение используемой длины (протезы категории А)
8.4.1 Принцип
Должна быть измерена используемая длина протеза. Длина должна быть измерена при заранее определенной нагрузке, которая может быть нулевой.
8.4.2 Аппаратура
Используемая аппаратура должна включать:
a) ленту или линейку достаточной длины с точностью измерений не менее ±1 мм, градуированную в миллиметрах, для измерения протезов различной длины;
b) если применимо, подходящее устройство для зажима протеза с одного конца (фиксирующий зажим) и средства, позволяющие приложить определенную нагрузку (например, за счет двигающегося зажима) к другому концу образца, такие как:
1) ручной зажим;
2) пружинные весы или балансировочные весы и набор грузов, имеющих точность ±0,5 г.
8.4.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.4.4 Порядок испытаний
Если применимо, помещают образец протеза в фиксирующий зажим таким образом, чтобы в зажиме находился минимальный объем образца. Прикладывают нагрузку к другому концу образца с помощью соответствующих средств (например, с помощью двигающегося зажима), захватывая минимальный объем образца. Дают образцу растянуться. Прикладываемая нагрузка не должна превышать нагрузку, предусмотренную при имплантации.
Записывают прикладываемую нагрузку и длину.
8.4.5 Представление результатов
Используемая длина каждого протеза должна быть выражена в сантиметрах, а прикладываемая нагрузка в ньютонах.
8.4.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать среднее значение и стандартное отклонение используемой длины образцов протеза, а также данные согласно 4.9.1.
Должна быть указана дополнительная информация, включая прикладываемую нагрузку и данные согласно 4.9.2.
8.5 Определение внутреннего диаметра в ненагруженном состоянии (протезы категории А)
8.5.1 Принцип
Данное испытание предназначено для определения внутреннего диаметра протеза в ненагруженном состоянии либо с помощью натягивания его на конический калибр, либо с помощью использования набора цилиндрических калибров.
8.5.2 Аппаратура
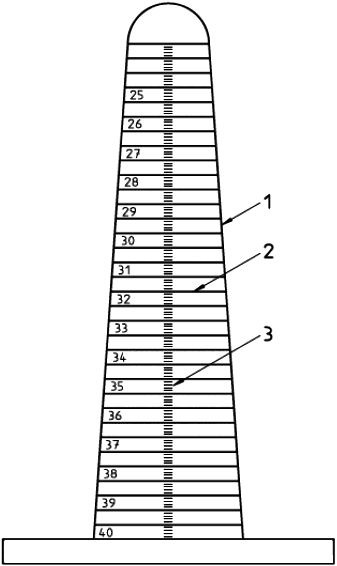
Используемая аппаратура должна включать конический калибр или цилиндрические калибры размерами, позволяющими проводить измерения с точностью, указанной в 5.5 (см. рисунок 9).
1 - конус
1 к 10; 2 - 0,5 мм кольца; 3 - 0,1 мм калибровочные отметки
Рисунок 9 - Конический калибр для определения внутреннего диаметра протеза в ненагруженном состоянии
8.5.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.5.4 Порядок испытаний
Либо:
а) помещают образец протеза или образец протеза малой длины свободно на конический калибр без натяжения;
либо:
b) начиная с малого размера, вставляют калибры в образец протеза, увеличивая диаметр до тех пор, пока не будет достигнут максимальный размер, который не вызывает растяжения.
Измеряют и записывают внутренний диаметр в ненагруженном состоянии.
8.5.5 Представление результатов
Внутренний диаметр каждого протеза в ненагруженном состоянии должен быть выражен в миллиметрах.
Записывают внутренний диаметр в ненагруженном состоянии.
8.5.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать используемый метод измерения (т.е. конический калибр или цилиндрические калибры), среднее значение и стандартное отклонение внутреннего диаметра образцов протезов в ненагруженном состоянии, а также данные согласно 4.9.1.
Должна быть указана дополнительная информация, включая число наблюдений и данные согласно 4.9.2.
8.6 Определение внутреннего диаметра под давлением (протезы категории А)
8.6.1 Принцип
Данное испытание предназначено для определения внутреннего диаметра протеза в условиях, близких к условиям использования, т.е. при используемой длине и с расширяющим давлением, значение которого того же порядка, что и артериальное давление крови - 16 кПа (120 мм рт.ст.).
8.6.2 Аппаратура
Используемая аппаратура должна включать:
a) специальные стенды или методику, позволяющую создавать заданное давление внутри протеза, растянутого до используемой длины. Задание используемой длины протеза может быть обеспечено либо приложением нагрузки (см. 8.4) без фиксации дистального конца образца протеза, либо фиксацией обоих концов образца протеза после растяжения до его используемой длины.
Схематическое изображение баллонного устройства для испытания на разрыв приведено на рисунке 10 и включает цилиндрический баллон диаметром при давлении 16 кПа (120 мм рт.ст.) не менее 1,05 от номинального диаметра измеряемого протеза, находящегося под давлением. Данный баллон надевают на цилиндрическую оправку, наибольший диаметр которой (исключая элементы, фиксирующие баллон) не превышает 0,95 номинального внутреннего диаметра в ненагруженном состоянии;
b) устройство для измерения давления, такое как датчик или манометр с погрешностью измерения давления до 26,7 кПа (200 мм рт.ст.) не менее ±0,3 кПа (±2 мм рт.ст.);
c) устройство с погрешностью измерения диаметра не более ±0,02 мм.
1 - заглушка; 2 - сосудистый протез; 3 - баллон; 4 - источник давления; 5 - шайба; 6 - оправка; 7 - клапан
Рисунок 10 - Схема баллонного устройства для испытания на разрыв
8.6.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.6.4 Порядок испытаний
Отрезают от образца протеза образец длиной не менее 50 мм или не менее, чем в пять раз превышающей номинальный внутренний диаметр образца протеза в ненагруженном состоянии, в зависимости от того, что больше. |
Измеряют и записывают толщину стенок образца протеза (см. 8.7).
Если необходимо, наносят на баллон простую силиконовую смазку и осторожно вводят его в образец. Растягивают образец до размера его используемой длины (определенной, как указано в 8.4) и надувают баллон до 16 кПа (120 мм рт.ст.). Измеряют и записывают внешний диаметр , округлив до 0,1 мм, в четырех точках, равноудаленных друг от друга по контуру образца.
8.6.5 Представление результатов
Внутренний диаметр каждого протеза под давлением должен быть выражен в миллиметрах.
Вычисляют значение внутреннего диаметра под давлением согласно формуле:
![]() ,
,
где - измеренное значение внешнего диаметра надутого протеза, мм;
- это измеренное значение толщины стенок протеза, мм.
Записывают значение внутреннего диаметра под давлением.
8.6.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать используемый метод измерения, среднее значение и стандартное отклонение измеренного внутреннего диаметра образцов протезов под давлением, а также данные согласно 4.9.1.
Должна быть указана дополнительная информация, включая число наблюдений и данные согласно 4.9.2.
8.7 Определение толщины стенок (протезы категории А)
8.7.1 Принцип
Данное испытание предназначено для определения толщины стенок протеза в ненагруженном состоянии или с минимальной нагрузкой.
8.7.2 Аппаратура
Используемая аппаратура должна включать:
a) микроскоп с калиброванным окуляром или с верньером и визирной сеткой на окуляре с погрешностью измерения не более 5,0 мкм, с прямым или диффузным освещением;
b) или калибр для измерения толщины при постоянной нагрузке, как определено в ИСО 5084, с площадью опоры не менее 0,5 см и давлением 981 Па (10 г·см
);
c) калиброванный датчик для измерения толщины с площадью и давлением опоры, соответствующими испытуемому образцу.
8.7.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.7.4 Порядок испытаний
Для определения толщины стенок следует использовать один из двух методов, приведенных ниже.
8.7.4.1 Определение толщины стенок с помощью микроскопа
С помощью острого лезвия выполняют поперечный разрез образца протеза и помещают испытуемый образец на столик микроскопа так, чтобы разрезанный конец был перпендикулярно к оси микроскопа, а источник света расположен был сверху. Используя шкалу окуляра или визирные линии и верньер, измеряют толщину стенок.
Выполняют как минимум четыре измерения для каждого испытуемого образца.
Записывают отдельные измерения толщины стенок и вычисляют среднее значение и стандартное отклонение значений для каждого образца протеза.
Для биологических сосудистых трубок области измерения должны включать самые тонкие и самые толстые области стенок испытуемого образца.
8.7.4.2 Определение толщины стенок с помощью калибров с постоянной нагрузкой
Проводят испытания, как описано в ИСО 5084, используя калибры для определения толщины при постоянной нагрузке.
Выполняют как минимум четыре измерения для каждого испытуемого образца.
Записывают отдельные измерения толщины стенок и вычисляют среднее значение и стандартное отклонение значений для каждого образца протеза.
8.7.5 Представление результатов
Толщина стенок должна быть выражена в микрометрах или миллиметрах.
8.7.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать номинальную толщину стенок, среднее значение и стандартное отклонение измеренной толщины стенок, общее среднее значение и стандартное отклонение для результатов для образца протеза, а также данные согласно 4.9.1.
Должна быть указана дополнительная информация, включая детали используемого измерительного оборудования и данные согласно 4.9.2.
8.8 Определение прочности удержания нити (протезы категории А)
8.8.1 Принцип
Данное испытание предназначено для определения силы, необходимой для вытягивания нити из протеза или для повреждения стенки протеза.
8.8.2 Аппаратура
Следует использовать разрывную машину, оборудованную соответствующим датчиком напряжения и соответствующим механизмом захвата, как показано на рисунке 11. Выбирают нить, настолько близкую по размеру к типичным клиническим инструментам, насколько возможно. Нить должна быть достаточно прочной, чтобы ее можно было протянуть через протез и не порвать (изготовленная, например, из полипропилена, полиэстера или нержавеющей стали).
1 - сосудистый протез; 2 - верхняя часть скоса; 3 - сила; 4 - нижняя часть откоса; 5 - нить; 6 - зажим
Рисунок 11 - Схема испытания на прочность удержания нити. Вид сбоку
8.8.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.8.4 Порядок испытаний
Для протезов, усиленных, например, внешней сеткой, если усиление не предназначено для включения в анастомоз, усиление не следует включать в область прохождения нити.
8.8.4.1 Порядок испытаний при перпендикулярном разрезе
Протез разрезают перпендикулярно к продольной оси. Если протез гофрирован, конец протеза необходимо аккуратно растянуть, чтобы удалить складки. Нить вставляют на расстоянии 2 мм от конца растянутого протеза через одну стенку протеза для формирования полупетли. Вытягивают нить со скоростью от 50 до 200 мм·мин. Записывают силу, необходимую для вытягивания нити из протеза или вызывающую повреждение стенки протеза, а также размер нити. Должно быть проведено как минимум три испытания для каждого образца.
8.8.4.2 Порядок испытаний при наклонном разрезе
Повторяют испытание, как описано в 8.8.4.1, для протезов разрезанных под углом 45° к продольной оси. Одну нить помещают в основании (верхней части) среза; для последующих испытаний нить помещают под углом ±90° к основанию и в нижней части среза (см. рисунок 11). Записывают силу, необходимую для вытягивания нити из протеза или вызывающую повреждение стенки протеза, а также размер нити. Должно быть проведено как минимум три испытания для каждого образца.
8.8.5 Представление результатов
Сила должна быть выражена в граммах.
8.8.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать среднее значение и стандартное отклонение прочности удержания нити для образцов протеза, тип и размер используемой нити, а также данные согласно 4.9.1.
Должна быть указана дополнительная информация, включая число образцов и данные согласно 4.9.2.
8.9 Определение диаметра/радиуса перегиба (протезы категории А)
8.9.1 Принцип
Данное испытание предназначено для определения радиуса кривой, необходимой для начала перегиба сосудистого протеза.
8.9.2 Аппаратура
Используют калибры радиусов в диапазоне от 4 до 50 мм с шагом 1,5 мм. Также могут быть использованы цилиндрические калибры известного диаметра.
8.9.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.9.4 Порядок испытаний
Радиус перегиба, как ближайшее большее значение калибра, определяют до и во время подачи давления, если применимо.
Так как на устойчивость к перегибу может влиять давление, протезы, непроницаемые для воды, следует испытывать при внутреннем давлении 100 мм рт.ст. Если на параметры перегиба не влияет температура, должна быть использована вода комнатной температуры. Конструкции, проницаемые для воды, могут быть испытаны при давлении окружающей среды. Записывают радиус калибра, первым вызвавшего перегиб трансплантата.
Образцы помещают на калибр с радиусом, не вызывающим перегиб или сужение. Радиус калибра снижают до выявления небольшого сужения или перегиба.
Альтернативно, для определения радиуса перегиба могут быть использованы цилиндрические калибры. Это реализуется формированием петли из испытательного образца и затягиванием концов образца в противоположных направлениях для уменьшения петли до обнаружения перегиба. Внутрь петли помещают цилиндрический калибр соответствующего размера для измерения радиуса перегиба.
8.9.5 Представление результатов
Радиус перегиба выражают в миллиметрах.
8.9.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать среднее значение и стандартное отклонение радиуса перегиба образцов протеза, условия испытаний - температуру и давление, а также данные согласно 4.9.1.
Должна быть указана дополнительная информация, включая число образцов и метод испытания, а также данные согласно 4.9.2.
8.10 Определение динамической податливости (протезы категории А)
8.10.1 Принцип
Данная процедура кратко описывает методы измерения динамической податливости сосудистого протеза в окружном направлении. Это реализуется измерением изменения диаметра (или прямым измерением изменения объема/длины и вычислением диаметра) при динамической циклической модельной нагрузке сосуда. В принципе, протез должен быть испытан в условиях, которые максимально близки доклинической in vivo среде.
8.10.2 Аппаратура
Используемая аппаратура должна включать:
a) специальные стенды или методику, позволяющую создавать заданное динамическое давление внутри протеза с постоянным напряжением (изотоническое испытание) или фиксированной длины (изометрическое испытание) при температуре (37±2) °С, растянутого до используемой длины. Аппаратура должна иметь возможность поддерживать температуру испытуемого образца и раствора на уровне (37±2) °С.
Пример аппаратуры с использованием баллона показан на рисунке 10 и включает цилиндрический баллон диаметром не менее 1,05 от номинального диаметра измеряемого протеза под давлением при давлении 16 кПа (120 мм рт.ст.). Данный баллон одевают на цилиндрическую оправку, наибольший диаметр которой (исключая элементы, фиксирующие баллон) не превышает 0,95 от номинального внутреннего диаметра в ненагруженном состоянии;
b) устройство для измерения давления, такое как датчик, способное измерять динамическое давление до 26,7 кПа (200 мм рт.ст.) с точностью ±0,3 кПа (±2 мм рт.ст.);
c) устройство, способное измерять диаметр с точностью ±0,02 мм;
d) аппаратура должна иметь возможность прямого измерения изменения диаметра в нескольких областях на испытуемом образце или возможность изменения объема внутри просвета и изменения длины, тем самым, позволяя вычислить средний диаметр.
Примечание - Для имплантатов, выполненных из биологических материалов, объемный метод, который дает среднюю податливость, не подходит из-за существенной биологической вариабельности.
е) испытательной жидкостью должна быть дистиллированная вода, однако могут использоваться альтернативные растворы, если это обосновано.
8.10.3 Отбор образцов
Отбор образцов следует проводить в соответствии с разделом 7.
8.10.4 Порядок испытаний
Применяют следующий порядок испытаний:
a) длина испытуемого сегмента должна быть больше диаметра не менее чем в 10 раз;
b) испытание следует проводить при температуре (37±2) °С, если не обосновано использование альтернативной температуры;
c) к испытуемому сегменту прикладывают продольную предварительную нагрузку в диапазоне от 0,294 до 0,588 Н (что соответствуют диапазону от 30 до 60 г);
d) если радиус вычисляют на основании изменения объема, до подачи давления необходимо выполнить измерения начального внутреннего диаметра и длины. Для объемного метода вычисляют начальный объем просвета, используя начальный внутренний диаметр и начальную длину образца;
e) подают циклическое давление на испытуемый образец со скоростью (60±10) ударов в минуту. Для оценки нелинейного характера работы образца испытания должны быть проведены при трех диапазонах изменения давления: от 7 до 12 кПа (от 50 до 90 мм рт.ст.), от 10,7 до 16 кПа (от 80 до 120 мм рт.ст.) и от 14,7 до 20 кПа (от 11 до 150 мм рт.ст.).
8.10.5 Представление результатов
a) Если измеряется непосредственно внешний диаметр, то внутренний радиус может быть вычислен, как
![]() ,
,
где - внутренний радиус под давлением;
- измеренный внешний диаметр под давлением;
- толщина стенок сосудистого протеза.
Примечание - У биологических протезов толщина стенок может существенно изменяться с давлением. Если стенки являются несжимаемыми, их толщина при любом давлении может быть вычислена с использованием изоволюметрического допущения.
b) Если измеряются объем и длина, то радиус под давлением для определенного диапазона давлений должен быть вычислен на основании объема и длины.
c) Когда внутренний радиус в определенном диапазоне давлений вычислен, податливость в окружном направлении может быть получена по следующей формуле:
![]() ,
,
где - нижнее значение давления, мм рт.ст.;
- верхнее значение давления, мм рт.ст.
Податливость в окружном направлении, вычисленную как указано выше, выражают в процентах изменения диаметра на 100 мм рт.ст.
8.10.6 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать отдельное среднее значение и стандартное отклонение измеренной податливости в каждом диапазоне давлений, общее среднее значение и стандартное отклонение податливости образца протезов, а также данные согласно 4.9.1.
Должна быть указана дополнительная информация, включая используемый метод испытания и данные согласно 4.9.2.
9 In vivo доклинические и клинические методы испытания сосудистых протезов*
___________________
* Слова "In vivo" в наименовании раздела 9 в бумажном оригинале выделены курсивом. - .
9.1 Порядок испытаний, сбор данных и анализ данных при in vivo доклинических исследованиях на лабораторных животных
9.1.1 Общие положения
Данные испытания предназначены для сбора и анализа данных исследований на животных для оценки возможности протеза поддерживать физиологическую функцию при использовании в сосудистой системе и для определения реакции реципиента, и ответа протеза.
9.1.2 Протокол испытания
При выборе животной модели необходимо учитывать предполагаемое клиническое применение и биологические характеристики животного. При выборе соответствующей животной модели также необходимо обратить внимание на предполагаемую длину(ы) и диаметр(ы).
Специальный вопрос или ряд вопросов, на который должно ответить исследование, должен быть определен заранее (т.е. должны быть четко поставлены цели). Эти вопросы должны определять соответствующие измеряемые критические параметры.
9.1.3 Сбор данных
Для каждого животного, которому имплантируют протез для какого-либо клинического применения, должны быть зарегистрированы, по меньшей мере, следующие данные:
a) идентификация животного;
b) дооперационные данные:
1) пол и масса;
2) проверка соответствующего состояния здоровья;
3) принимаемые лекарства (например, антибиотики с целью профилактики);
c) операционные данные:
1) дата процедуры;
2) хирург, выполняющий имплантацию;
3) описание хирургической процедуры, включая тип проксимального и дистального анастомозов, а также ближайший послеоперационный уход, включая любые отклонения от протокола исследований;
4) идентификационный номер протеза;
5) длина и диаметр протеза in situ;
6) неблагоприятные события в ходе операции (например, трансмуральное кровотечение);
d) послеоперационные данные:
1) принимаемые лекарства, включая те, которые влияют на коагуляцию;
2) оценка проходимости, метод и дата;
3) неблагоприятные события, дата происшествия, терапия, результат;
4) любые отклонения от протокола;
e) окончательные данные:
1) оценка проходимости, метод;
2) оценка патологий эксплантированного протеза.
9.1.4 Отчет об испытаниях и дополнительная информация
Отчет об испытаниях должен включать следующее:
a) протокол испытания;
b) обоснование выбора следующего:
1) вида животных;
2) области имплантации;
3) способов контроля;
4) метода оценки проходимости;
5) интервалов наблюдения;
6) размера выборки (т.е. числа животных и имплантатов);
c) суммарные результаты:
1) учет животных, включая обоснования исключения данных;
2) значения проходимости;
3) неблагоприятные события;
4) мнение исследователя о характеристиках удобства обращения;
5) существенные и/или относительные отклонения от протокола;
6) суммарная информация о патологиях, включая характерные фотографии и микроснимки;
7) сравнение результатов испытательной и контрольной группы;
8) выводы из исследования;
9) суммарные данные о процедурах проверки.
9.2 Схема испытаний, сбор данных и анализ данных при клинической оценке
9.2.1 Общие положения
Сбор и анализ дооперационных, операционных и послеоперационных данных в ходе начальной клинической оценки новых протезов или нового клинического применения протезов для определения краткосрочной безопасности и эффективности до выпуска на рынок.
9.2.2 Протокол испытания
Специальный вопрос или ряд вопросов, на который должно ответить исследование для демонстрации безопасности и эффективности, должен быть определен заранее (т.е. должны быть четко поставлены цели). Эти вопросы должны определять соответствующие измеряемые критические параметры и включать определение успеха или отказа для каждого критического параметра.
Должны быть четко определены критерии выбора и исключения пациентов. Критерии должны определять целевую популяцию (т.е. лиц, для которых предназначено устройство) и доступную популяцию (т.е. лиц, которые согласны принимать участие в исследованиях). При выборе субъектов для минимизации тренда необходимо использовать эпидемиологический подход.
9.2.3 Сбор данных
Для каждого пациента, которому имплантируют протез, должна быть зарегистрирована, по меньшей мере, следующая информация:
a) идентификационные данные:
1) идентификация пациента;
2) пол и дата рождения;
3) фамилия, инициалы специалиста;
4) наименование института;
b) дооперационные данные (от 0 до 25 дней до операции):
1) факторы риска, такие как гипертензия, диабет, гиперлипидемия, табакокурение, ожирение и любые другие факторы риска, касающиеся сердечно-сосудистой системы, а также способы интенсивного и текущего лечения;
2) отчет о предыдущих сосудистых вмешательствах, включая нехирургические вмешательства, а также об имплантации сосудистых протезов;
Примечание - Для артериовенозных анастомозов отчет должен включать отчет о предыдущих шунтах для диализа. Например:
- материал;
- область и затрагиваемые сосуды анастомоза;
- дата имплантации;
- частота использования;
- дата (даты) и тип ревизии;
- дата и вид отказа;
3) срочность вмешательства (т.е. экстренное или плановое);
4) показания для процедуры;
5) критерии диагностики:
- клиническая оценка (например, неинвазивная гемодинамическая оценка);
- объективная оценка (например, КТ-сканирование, магниторезонансная томография, ультразвуковое исследование, ангиография, дуплексное Доплеровское исследование).
Примечание - Для артериовенозных анастомозов объективная оценка может не подходить;
c) операционные данные:
1) фамилия, инициалы хирурга;
2) дата процедуры;
3) идентификационные данные протеза, включая идентификационный номер, конфигурацию (как поставляется, а также как используется, если они отличаются), и диаметр;
4) идентификация естественного сосуда (сосудов), который подвергается обработке, или положения протеза артериовенозного доступа;
5) данные об анастомозе [тип (например, стык концом к концу, положение, длина, размер и материал нити, тип строчки (например, непрерывная, прерывающаяся, оба типа), сведения об укреплении];
6) длина имплантируемого протеза;
7) данные, касающиеся процедуры (например, положение, реимплантация ответвлений, вспомогательное кровообращение, дополнительные сосудистые процедуры);
8) прием соответствующих лекарств;
9) оценка функции протеза (например, ангиография, Доплер в ходе операции);
10) неблагоприятные события в ходе операции (например, трансмуральное кровотечение, разрушение протеза, кровотечение по шву);
d) послеоперационные данные для артериовенозного доступа (первое использование протеза при диализе и спустя 1, 3, 6 и 12 мес после первого использования протеза):
1) дата диализа;
2) часто использования с момента последнего наблюдения;
3) состояние участка над областью имплантации;
4) проходимость протеза;
5) диализ:
- размер и тип игл;
- скорость тока крови (мл/мин);
- продолжительность диализа (ч);
- давление в венозной линии;
- продолжительность сжатия области извлечения иглы;
6) суммарные данные о сосудистых вмешательствах с момента последнего наблюдения;
7) прием соответствующих лекарств;
8) неблагоприятные события;
9) повторная оценка факторов риска, таких как гипертензия, диабет, гиперлипидемия, табакокурение, ожирение и любые другие факторы риска, касающиеся сердечно-сосудистой системы, а также способы интенсивного и текущего лечения, необходимо отметить улучшение/ухудшение относительно уровня до операции;
e) послеоперационные данные для любого клинического использования (при выписке или через 7-14 дней после операции и через 3, 6 и 12 мес после операции):
1) дата визита для контроля;
2) повторная оценка факторов риска, таких как гипертензия, диабет, гиперлипидемия, табакокурение, ожирение и любые другие факторы риска, касающиеся сердечно-сосудистой системы, а также способы интенсивного и текущего лечения, необходимо отметить улучшение/ухудшение относительно уровня до операции;
3) суммарные данные о сосудистых вмешательствах и не хирургических сосудистых процедурах, включая минимально инвазивные процедуры, с момента последнего наблюдения;
4) клиническая оценка:
- клиническая оценка (например, неинвазивная гемодинамическая оценка), включая прогрессирование сосудистого заболевания;
- объективная оценка протеза (например, КТ-сканирование, магниторезонансная томография, ультразвуковое исследование, ангиография, дуплексное Доплеровское сканирование) через один год.
Примечание - Если ожидаются неблагоприятные события, должна быть проведена соответствующая объективная оценка;
5) прием соответствующих лекарств;
6) неблагоприятные события;
f) данные о неблагоприятных событиях:
1) определения осложнений;
2) осложнение, дата происшествия, тяжесть, принимаемые меры, результат;
3) документальное подтверждение вовлеченности протеза (т.е. вовлечен ли физически протез в осложнение?);
4) документальное подтверждение связи с протезом (т.е. вызвано ли осложнение протезом, пациентом или техническими факторами?), обоснованное патогенезом;
g) прекращение участия пациента в исследовании:
1) дата;
2) число целых месяцев в исследовании;
3) статус:
- невозможность наблюдения;
- отказ протеза;
- смерть (включая и причину смерти, и состояние протеза).
9.2.4 Отчет об испытаниях
Отчет об испытаниях должен включать следующее:
a) протокол исследования;
b) обоснование выбора следующего:
1) объема исследования;
2) способов контроля;
3) метода измерения;
4) используемых статистических методов;
c) обобщенные результаты:
1) учет пациентов, включая обоснования исключения данных;
2) существенные и/или относительные отклонения от протокола;
3) суммарные данные о пациентах, не завершивших исследование (включая невозможность наблюдения, смерть или эксплантацию протеза);
4) суммарные данные о неблагоприятных событиях;
5) суммарные данные о смертях;
6) суммарные данные о патологиях, если применимо, включая характерные фотографии и микроснимки;
7) коэффициенты проходимости и коэффициент неблагоприятных событий;
Примечание - Для данного послеоперационного периода (как минимум 1 год) коэффициенты должны вычисляться как простые проценты. Для более позднего послеоперационного периода необходимо вычислить оценку среднего коэффициента. В отчете должен быть указан линеаризованный коэффициент, как число событий за 100 лет наблюдения пациентов. Должна быть выполнена оценка рисков для всех отмеченных осложнений (т.е. ранних и отложенных). Для создания таблицы для отображения оцененной вероятности отсутствия осложнений в конце каждого временного интервала должен использоваться актуарный анализ;
8) сравнение результатов испытательной и контрольной группы;
9) выводы из исследования.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ИСО 472:1998 | - | * |
ИСО 2076:1989 | - | * |
ИСО 2859-1:1989 | IDT | ГОСТ Р ИСО 2859-1-2007 "Статистические методы. Процедуры выборочного контроля по альтернативному признаку. Часть 1. Планы выборочного контроля последовательных партий на основе приемлемого уровня качества" |
ИСО 2859-2:1985 | - | * |
ИСО 2960:1974 | IDT | ГОСТ Р ИСО 2960-99 "Материалы текстильные. Определение прочности при продавливании и растяжения продавливанием методом диафрагмы" |
ИСО 5081:1977 | - | * |
ИСО 5084:1977 | - | * |
ИСО 10993-1:1997 | IDT | ГОСТ Р ИСО 10993-1-2009 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования" |
ИСО 14155:1996 | IDT | ГОСТ Р ИСО 14155-1-2008 "Руководство по проведению клинических испытаний медицинских изделий. Часть 1. Общие требования" |
ASTM D 76-93 | - | * |
ASTM D 123-94 | - | * |
Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: - IDT - идентичные стандарты. | ||
__________________________________________________________________________
УДК 615.477:006.354 ОКС 11.040.40
Ключевые слова: неактивные хирургические имплантаты, требования, сердечно-сосудистая, хирургия, кровеносные сосуды
__________________________________________________________________________
Электронный текст документа
и сверен по:
, 2014