ГОСТ Р ИСО 25539-2-2012
Группа Р23
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИМПЛАНТАТЫ СЕРДЕЧНО-СОСУДИСТЫЕ
Внутрисосудистые имплантаты
Часть 2
Сосудистые стенты
Cardiovascular implants. Endovascular devices. Part 2. Vascular stents
ОКС 11.040.40
Дата введения 2014-01-01
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным учреждением "Научный Центр сердечно-сосудистой хирургии им.А.Н.Бакулева" РАМН (ФГБУ "НЦССХ им.А.Н.Бакулева" РАМН) на основе собственного аутентичного перевода на русский язык международного стандарта, указанного в пункте 4
2 ВНЕСЕН Управлением технического регулирования и стандартизации Федерального агентства по техническому регулированию и метрологии
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 30 августа 2012 года N 264-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 25539-2:2008* "Имплантаты сердечно-сосудистые. Внутрисосудистые имплантаты. Часть 2. Сосудистые стенты" (ISO 25539-2:2008 "Cardiovascular implants - Endovascular devices - Part 2: Vascular stents").
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении ДА
5 ВЗАМЕН ГОСТ Р 52732-2007
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (gost.ru)
1 Область применения
1.1 Настоящий стандарт устанавливает требования к сосудистым стентам, основываясь на современных знаниях в области медицины. В нем приведены требования к предполагаемым рабочим характеристикам, особенностям дизайна конструкции, материалам, оценке конструкции, производству, стерилизации, упаковке и информации, предоставляемой изготовителем. Стандарт следует рассматривать как дополнение к ИСО 14630, в котором определены общие требования функционирования неактивных хирургических имплантатов.
Примечание - В связи с разнообразием конструкций имплантатов, охватываемых настоящим стандартом и, в некоторых случаях, в связи с относительно недавней разработкой имплантатов новых видов (например, биодеградируемые стенты, полимерные стенты) не всегда доступны принятые стандартизированные испытания in vitro и клинические результаты. Как только будут доступны новые научные и клинические данные, появится необходимость в пересмотре настоящего стандарта.
1.2 Область применения настоящего стандарта включает сосудистые стенты, используемые для лечения сосудистых повреждений или стенозов, или других сосудистых аномалий. Эти устройства могут включать или не включать модификации поверхности стента, такие как нанесение лекарственных и/или иных покрытий. Стенты, покрытые материалами, которые существенно изменяют их проницаемость по сравнению с непокрытыми стентами, относятся к области действия ИСО 25539-1. Конструктивное решение стента может потребовать оценки соответствия функциональным требованиям, приведенным как в ИСО 25539-1, так и в настоящем стандарте.
1.3 Системы доставки включены в область действия настоящего стандарта, если они представляют собой неотъемлемые компоненты раскрытия сосудистого стента.
1.4 Процедуры и устройства для баллонной ангиопластики не входят в область действия настоящего стандарта.
1.5 Некоторые фармакологические аспекты применения стентов с лекарственным покрытием рассматриваются в настоящем стандарте, однако настоящий стандарт не является исчерпывающим для фармакологической оценки стентов.
1.6 Биодеградация и другие характеристики биодеградируемых и полимерных стентов и покрытий не рассматриваются в настоящем стандарте.
1.7 За исключением методов стерилизации настоящий стандарт не содержит требований по оценке изделий, содержащих ткани животного происхождения.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты*. Для датированных ссылок применяют только указанные издания. Для недатированных ссылок применяют самые последние издания (включая любые изменения и поправки).
________________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ИСО 10993 (все части) Биологическая оценка медицинских изделий [ISO 10993 (all parts), Biological evaluation of medical devices]
ИСО 11135-1 Стерилизация медицинской продукции. Этилен оксид. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий (ISO 11135-1, Sterilization of health care products - Ethylene oxide - Part 1: Requirements for development, validation and routine control of a sterilization process for medical devices)
ИСО 11137-1 Стерилизация медицинской продукции. Радиация. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий (ISO 11137-1, Sterilization of health care products - Radiation - Part 1: Requirements for development, validation and routine control of a sterilization process for medical devices)
ИСО 11607 (все части) Упаковка для медицинских изделий, подлежащих финишной стерилизации [ISO 11607 (all parts), Packaging for terminally sterilized medical devices]
ИСО 14155 (все части) Клинические испытания медицинских изделий для людей [ISO 14155 (all parts), Clinical investigation of medical devices for human subjects]
ИСО 14160 Стерилизация одноразовых медицинских изделий, содержащих материалы животного происхождения. Валидация и текущий контроль стерилизации с помощью жидких стерилизующих средств (ISO 14160, Sterilization of single-use medical devices incorporating materials of animal origin - Validation and routine control of sterilization by liquid chemical sterilants)
ИСО 14630 Неактивные хирургические имплантаты. Общие требования (ISO 14630, Non-active surgical implants - General requirements)
ИСО 14937 Стерилизация медицинской продукции. Общие требования для определения характеристик стерилизующего агента и разработки, валидации и текущего контроля процессов стерилизации медицинских изделий (ISO 14937, Sterilization of health care products - General requirements for characterization of a sterilizing agent and the development, validation and routine control of a sterilization process)
ИСО 14971 Изделия медицинские. Применение менеджмента рисков к медицинским изделиям (ISO 14971, Medical devices - Application of risk management to medical devices)
ИСО 17665-1 Стерилизация медицинской продукции. Стерилизация паром. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий (ISO 17665-1, Sterilization of health care products - Moist heat - Part 1: Requirements for the development, validation and routine control of a sterilization process for medical devices)
3 Термины и определения
В настоящем стандарте применены термины по ИСО 14630, а также следующие термины с соответствующими определениями:
Примечание - Описания стендовых испытаний и аналитических расчетов приведены в приложении В. Перечень клинических неблагоприятных событий, подлежащих регистрации, приведен в приложении С.
3.1 раскрытие с помощью баллона: Использование баллона для обеспечения полноты раскрытия стента.
3.2 крыльчатая форма баллона: Измененная форма поперечного сечения баллона после спуска воздуха, которая может затруднить его удаление.
Примечание - Крыльчатая форма баллона может также вызвать миграцию стента, повреждение сосуда или баллона и невозможность удаления баллона.
3.3 система доставки: Система или механизм, используемые для доставки стента в предусмотренную для имплантации позицию и для раскрытия стента.
Примечание - Систему доставки удаляют после размещения стента. Системы доставки включают в себя баллонные катетеры или системы, приводимые в действие механически.
3.4 определять: Количественно оценивать или анализировать.
Примечание - См. также 3.8.
3.5 расширение концевых участков баллона: Гантелеообразная форма баллона, наблюдающаяся при раскрытии стента, в случае если свободные концы баллона при расширении выходят за пределы диаметра раскрываемого стента.
3.6 покрытие: Органический или неорганический материал, отличный по составу от живых клеток, наносимый при изготовлении стента на его основу.
Примечание - Покрытие может служить постоянно или временно и может быть нанесено на внешнюю и/или внутреннюю поверхность стента.
3.7 содержание лекарств: Количество лекарств, содержащихся на поверхности (поверхностях) покрытия, как составная часть покрытия, либо изнутри стента.
3.8 оценивать: Качественно оценивать или анализировать.
Примечание - См. также 3.4.
3.9 сужение просвета: Уменьшение диаметра проходного отверстия стента, наблюдаемое средствами визуализации.
3.10 клиническое событие, подлежащее регистрации: Осложнение, отказ, обусловленные конструкцией устройства, имеющие неблагоприятные последствия или негативное влияние, наблюдаемые при клиническом использовании стент-систем.
Примечание - Примеры видов осложнений приведены в приложении С. Эти события могут не иметь клинического значения и быть не обусловлены конструкцией устройств.
3.11 конфигурация стента: Форма стента, например, цилиндрическая, коническая, расширенная, спиральная, сегментированная, разветвленная.
3.12 внешняя площадь поверхности стента: Площадь контакта стента с сосудом.
3.13 площадь поверхности, свободной от стента: Площадь поверхности цилиндра в процентах, образованная телом имплантата, которая не содержит собственно имплантируемого материала.
3.14 стент-система: Сосудистый стент и его система доставки или сосудистый стент, установленный на баллон в соответствии с инструкцией по применению.
3.15 сосудистый стент, стент, имплантат: Транслюминально располагающийся самораскрывающийся или расширяемый баллоном имплантат, используемый для лечения сосудистых повреждений путем создания механической поддержки (опоры) для обеспечения или сохранения целостности сосуда.
Примечание 1 - Стенты могут иметь модификации, например, в виде лекарственных или покрытий других видов.
Примечание 2 - Стенты нижеследующих типов относятся к области действия настоящего стандарта.
3.15.1 матричный стент: Стент, сконструированный из соединенных между собой сегментов.
3.15.2 голометаллический стент: Стент без покрытия или оболочки.
Примечание - Стент без покрытия или оболочки может быть изготовлен из одного или нескольких материалов.
3.15.3 биодеградируемый стент: Стент, сконструированный таким образом, чтобы служить определенный период времени без необходимости последующего удаления (эксплантации).
3.15.4 стент, расширяемый баллоном: Стент, у которого увеличение диаметра раскрытия достигается с помощью баллонного катетера.
3.15.5 стент с покрытием: Стент с поверхностным слоем дополнительного материала (материалов), который не служит существенной (т.е. более 5%) опорой сосудистой стенки или заметно не снижает проницаемость стента.
3.15.6 композитный стент: Стент, состоящий из более чем одного материала или соединений материалов, обеспечивающих существенную (т.е. более 5%) опору сосуда при раскрытии стента.
3.15.7 стент-графт: Стент, покрытый дополнительным материалом (материалами), который существенно снижает проницаемость и/или уменьшает площадь поверхности голометаллического стента.
Примечание - Стент-графты попадают под действие ИСО 25539-1. При конструировании таких стентов требуется учитывать функциональные требования, приведенные в ИСО 25539-1 и ИСО 25539-2.
3.15.8 стент с лекарственным покрытием: Стент, выделяющий лекарственное средство (средства) в течение определенного периода времени.
3.15.9 самораскрывающийся стент: Стент, у которого увеличение диаметра достигается без наполнения баллона или другой механической помощи.
Примечание - Самораскрывающиеся стенты попадают под действие ИСО 25539-1. При конструировании такого стента следует учитывать требования, приведенные в ИСО 25539-1 и ИСО 25539-2.
4 Общие требования
4.1 Классификация
В описание стента должна входить его конфигурация (см. 3.11), тип (см. 3.15), материалы конструкции и любые модификации поверхности, наличие покрытий и/или содержание лекарственных средств.
4.2 Размер
При описании размера должны быть использованы следующие характеристики:
a) внешний диаметр;
1) саморасширяющиеся стенты:
- свободный внешний диаметр устройства, в миллиметрах;
- диапазон предполагаемых диаметров просвета сосуда, в миллиметрах;
2) стенты, расширяемые баллоном: диапазон предполагаемых расширенных внутренних диаметров стента;
b) минимальная и максимальная полезные длины, выраженные в миллиметрах или сантиметрах.
4.3 Описание предполагаемого клинического использования
При клиническом использовании должно быть указано одно или больше следующих назначений:
a) брюшная аорта;
b) артериовенозное шунтирование для обеспечения сосудистого доступа;
c) сонная артерия;
d) коронарная артерия;
e) бедренная артерия;
f) подвздошная артерия;
g) подколенная артерия;
h) почечная артерия;
i) грудная аорта;
j) торакоабдоминальная аорта;
k) большеберцовая артерия;
I) артерии других видов;
m) вены других видов.
5 Функциональные характеристики
Требования к функциональным характеристикам должны соответствовать ИСО 14630.
6 Особенности конструктивного решения
6.1 Общие положения
При разработке конструктивного решения следует применять ИСО 14630. Кроме того, дополнительно необходимо учитывать следующие факторы функционирования стента:
a) возможность окисления, вероятность контактной коррозии, коррозия на частях стента;
b) развитие гальванической, точечной, фретинг-коррозии (при трении);
c) взаимодействия между имплантируемым стентом и организмом:
1) при фиксации стента с помощью крючков;
2) возможность относительных перемещений стента и ткани;
3) уровень усилия, передаваемого стентом на окружающие ткани;
4) уровень усилия, необходимого для деформации стента;
d) ожидаемое врастание стента, проникание в ткани, перфорирование тканей, смещение и миграция стента; воздействия со стороны систем ввода и доставки.
Примечание - Названные дополнительные пункты взяты из ЕН 12006-3 [15], раздел 5.
Особенности конструкций сосудистых стентов (с системой или без системы доставки) приведены в таблице А.2 со ссылками на методы испытаний, касающиеся оценки дизайна конструкции (см. раздел 8). Не все виды испытаний необходимы для каждого стента и/или системы доставки. Обоснование выбора вида испытания должно быть изложено.
6.2 Система доставки и стент-система
Особенности конструкции стента должны соответствовать предназначенным рабочим характеристикам системы доставки и учитывать, по крайней мере, следующее:
a) способность системы обеспечивать последовательный, точный и безопасный доступ в предполагаемую область размещения;
b) способность системы обеспечивать последовательное, точное и безопасное раскрытие стента;
c) способность системы обеспечивать последовательное и безопасное удаление системы доставки;
d) соответствие системы требованиям биосовместимости по ИСО 10993-1 и соответствующим другим частям серии стандартов ИСО 10993;
e) способность системы минимизировать потери крови (гемостаз);
f) визуализацию системы при рентгеноскопии или других методах контроля.
6.3 Имплантат
6.3.1 Стент
При оценке соответствия рабочих характеристик конструкции стента предназначенному применению следует учитывать, по крайней мере, следующие параметры:
a) способность стента быть последовательно, точно и безопасно раскрытым;
b) способность стента обеспечивать надежную фиксацию и примыкание к предполагаемому месту сосудистой системы;
c) способность стента сохранять достаточную целостность;
d) соответствие размеров стента и его конструктивной формы для использования в сосудах определенных диаметров;
e) способность стента обеспечивать адекватный поток крови через просвет (проходимость);
f) совместимость стента с действием магнитных полей при магнитно-резонансной томографии (МРТ);
g) соответствие стента требованиям биосовместимости по ИСО 10993-1 и соответствующим другим частям серии стандартов ИСО 10993;
h) визуализация стента при рентгеноскопии или других методах контроля.
6.3.2 Покрытие
При оценке соответствия покрытия предназначенному применению следует дополнительно учитывать, по крайней мере, следующие факторы:
a) способность покрытия сохранять адекватную целостность с течением времени в соответствии со спецификацией конструкции (например, отсутствие признаков значимого существенного расслоения покрытия, оголенных участков);
b) обеспечивать взаимодействие между покрытием и стентом (например, с целью защиты материала стента от коррозии);
c) способность покрытия обеспечивать адекватное сопротивление к непредусмотренному выделению частиц материала стента;
d) соответствие размеров и других параметров покрытия (например, пористость, плотность, размещение) спецификации конструкции;
e) влияние МРТ на состояние покрытия стентов (например, нагрев стента).
6.3.3 Лекарственные средства
При оценке соответствия дизайна конструкции предназначенному применению стента с покрытием, если покрытием служит собственно лекарственное средство или таковое входит в состав стента или покрытия, следует дополнительно учитывать, по крайней мере, следующие факторы:
a) способность воспроизводимо наносить требуемый вид и количество лекарства на стент;
b) способность выделять требуемое количество лекарства за определенный промежуток времени;
c) соответствие остаточного количества лекарства спецификации конструкции;
d) отсутствие вредных примесей и деградации лекарств(а) при производстве и хранении;
е) возможность взаимодействия между лекарством и покрытием и/или стентом, на который наносится лекарство;
f) влияние МРТ на лекарства в составе покрытия стента (например, нагрев).
7 Материалы
Должны быть соблюдены требования к материалам в соответствии с ИСО 14630. Должны быть проведены дополнительные испытания, установленные для определенных материалов (например, металлов, полимеров, лекарственных средств), с целью оценки их пригодности для использования в конструкции. Например, материалы на основе нитинола, зависящие от свойств памяти формы, следует испытывать для оценки возможности их трансформации. Кроме того, для стентов с лекарственным покрытием должны быть проведены испытания по оценке качества лекарственного средства, включая идентификацию примесей и деградирующих материалов (компонентов). Возможности электрохимических реакций различающихся между собой металлов (стентов, проводников, прочих вспомогательных устройств) могут потребовать проведения других видов испытаний.
8 Оценка дизайна конструкции
8.1 Общие положения
Следует применять требования к оценке конструкции в соответствии с ИСО 14630. Анализ риска должен быть проведен в соответствии с требованиями ИСО 14971.
Следует привести обоснование того, что оценка некоторых свойств не была проведена.
Примечание 1 - Не все виды испытаний могут подходить для всех конструктивных решений стент-систем.
Невозможно принять во внимание все технологии, развивающиеся в настоящее время, и технологии будущего. Стент-системам на основе инновационных технологий должна быть дана оценка в соответствии с основными требованиями настоящего стандарта. При оценке эффективности этих стент-систем могут потребоваться испытания, выходящие за область действия настоящего стандарта. При выборе соответствующих испытаний следует обращать внимание на виды отказов стент-систем и их влияние на работу имплантата.
При внесении изменений в материалы, конструкцию, конфигурацию, методы обработки следует выполнять соответствующий анализ потенциального влияния изменений на виды отказа и значения рабочих характеристик стент-системы. При необходимости следует проводить соответствующие испытания.
Необходимо использовать определенные контрольные референтные изделия для сравнения с целью оценки некоторых параметров конструкции.
Если при клиническом использовании возникает ситуация, когда стенты "находят" друг на друга (например, при стентировании поверхностной бедренной, коронарной артерий), следует оценить сохранение целостности и функциональности испытуемого стента. Если возможность перекрытия стентов принимается во внимание, то испытания должны включать соответствующую оценку.
Испытания по установлению строка годности следует проводить путем повторения соответствующих тестов. Должно быть приведено обоснование выбора испытаний. Для стентов с лекарственным покрытием для определения свойств лекарства относительно срока его годности должны проводиться испытания в реальном времени и ускоренные испытания.
Примечание 2 - Дополнительные сведения по оценке стабильности лекарственных средств можно найти в руководствах международных конференций по гармонизации стандартов [1], [35], [36], [37].
8.2 Отбор образцов
При отборе образцов следует руководствоваться планом отбора, гарантирующим, что для каждого измеряемого параметра будет получена адекватная выборка данных. Конструктивные характеристики стента (включая лекарства и/или покрытия), системы доставки и стент-системы должны быть верифицированы на предмет того, что они являются характерными для устройств, включенных в распределение с учетом всех типоразмеров, форм и набора компонентов.
В выборке должен быть представлен весь диапазон конструктивных решений устройств, при этом обязательное испытание каждого типоразмера может не потребоваться. Размеры стента, выбранного для испытания, должны представлять самый неблагоприятный случай (случаи) комбинации диаметра и длины для каждого испытания. Должно быть приведено обоснование отбора образцов. Может потребоваться оценка определения размера (размеров) устройства для идентификации изделия с наибольшей вероятностью отказа.
Выборка должна обеспечивать адекватное представление ожидаемой вариабельности изделий при их изготовлении.
Для испытаний с определенными параметрами достоверности и надежности объем выборки должен иметь статистическое обоснование. Число образцов должно быть обосновано для испытаний всех видов.
8.3 Соблюдение условий работы образцов при испытании
Все образцы должны быть подвергнуты стерилизации, включая многократную стерилизацию, если таковая допустима. Использование нестерилизованных продуктов должно быть обосновано.
При работе с образцами следует воссоздавать те условия, которые встречаются при их нормальном использовании и могут повлиять на результаты испытания. Соблюдение условий может включать размещение стента на или в катетере при доставке (в соответствии с рекомендациями инструкции по применению), однократное или многократное прохождение стент-системы через анатомическую модель и пробное раскрытие стента.
При необходимости следует использовать рабочую физиологическую среду (например, водяную баню с контролем температуры).
8.4 Составление отчета
В рамках настоящего стандарта отчет составляется по запросу национальных контролирующих органов или органов, ответственных за оценку соответствия.
Отчет по испытаниям для доклинических испытаний in vitro должен включать отчет о выполнении всех испытаний. Этот отчет должен содержать описание испытаний с обоснованием отказа от проведения какого-либо из испытаний, приведенных в приложении В, или выбора альтернативных видов испытаний. Информация, предоставляемая в каждом отчете по испытаниям, должна быть представлена на основе заранее определенной формы протокола испытания.
Сводка результатов должна включать критерии оценки и любые вероятные клинические значения результатов испытаний; она может быть представлена в виде таблицы. При определении критериев следует учитывать анатомические, физиологические и морфологические условия предполагаемого использования изделия. Должны быть приведены обоснование и клиническая применимость критериев оценки для каждого испытания. Отчет должен содержать оглавление; все страницы текста должны быть последовательно пронумерованы.
Отчет по испытанию должен включать в себя следующую информацию:
a) цель: определение цели испытания в соответствии с настоящим стандартом;
b) материалы: перечень всех материалов (например, стендовые образцы с номером лота/серийным номером или другими соответствующими знаками для обеспечения отслеживаемости комплектности), используемых при проведении испытания, с указанием рисунков и схем;
c) отбор образцов: план отбора образцов, включая обоснование выбора и количества испытуемых образцов;
d) критерии оценки: определение критериев оценки результатов испытания;
e) метод испытания: подробное описание метода испытания, используемого при проведении испытания, включая предварительно разработанные процедуры контроля и значения критических параметров испытания;
f) отклонения от протокола: описание любых отклонений и их вероятная значимость для интерпретации результатов;
g) представление результатов: описание результатов испытания, выраженных в тех единицах измерения, которые обусловлены данным методом испытания;
h) заключение, основанное на сравнении результатов с критериями оценки, включая вероятную клиническую значимость этих результатов.
8.5 Система доставки и стент-система
8.5.1 Возможность доступа
8.5.1.1 Общие положения
В настоящем разделе оценивается способность системы обеспечивать последовательный, точный и безопасный доступ в предполагаемую область размещения имплантируемого изделия.
Для оцениваемых рисков учитывают следующие виды опасностей, но не ограничиваются только ими:
a) проводник не выходит за область поражения;
b) интродьюсер и система доставки не позволяют осуществить доступ к месту размещения изделия (ввиду несоответствия размеров);
d) система доставки не может достичь места целевого расположения;
e) эмболизация, включая газовую;
f) смещение (сдвиг) стента.
Эти опасности могут привести к развитию подлежащих регистрации негативных клинических событий, включая следующие виды событий, но не ограничиваясь только ими:
- ошибка доступа;
- травма сосуда;
- неврологические расстройства;
- ишемия;
- спинальные неврологические расстройства;
- эмболизация;
- кровотечения, обусловленные выполнением процедуры.
Испытания должны быть проведены в соответствии с требованиями 8.5.1.2-8.5.1.13, если таковые соответствуют дизайну конструкции стент-системы.
8.5.1.2 Прочность соединения
Определяют продольное усилие соединения между отдельными частями системы доставки. Все соединения должны оставаться неповрежденными при соблюдении рекомендуемых условий применения. Результаты должны быть оценены по значениям усилий, необходимых для доставки стента в предполагаемую область размещения.
8.5.1.3 Совместимость размеров компонентов
Определяют размеры стент-системы и проверяют на соответствие размерам рекомендуемых принадлежностей. Все компоненты должны быть совместимы по размерам. Необходимо учитывать возможность введения контраста для того, чтобы проволочный проводник или интродьюсер вместе со стент-системой могли пройти через просвет сосудистого русла.
8.5.1.4 Проверка размеров
Проверяют размеры на соответствие спецификации конструкции.
8.5.1.5 Усилие отсоединения (предварительно собранные стенты, расширяемые баллоном)
Определяют усилие, необходимое для вывода предварительно закрепленного стента из сжатого положения на нерасширенном баллоне и для полного отсоединения стента от нерасширенного баллона при клиническом использовании.
8.5.1.6 Изгиб/перегиб
Оценивают способность стент-системы к изгибу на предварительно установленное значение клинически обоснованного радиуса или угла изгиба, который может потребоваться при выполнении доступа и доставки.
8.5.1.7 Оценка профиля/диаметра
Определяют максимальный диаметр определенного сегмента стент-системы.
8.5.1.8 Возможность проталкивания
Оценивают способность стент-системы к проталкиванию или размещению оператором без нежелательного изгиба или перегиба.
8.5.1.9 Моделирование использования
Оценивают работу стент-системы, используя модель (модели), воспроизводящую предполагаемые условия использования.
8.5.1.10 Возможность вращения
Оценивают способность стент-системы обеспечивать достаточную свободу поворота дистального отдела для доставки стента в соответствующую анатомическую позицию.
8.5.1.11 Прочность соединения при кручении
Определяют значение крутящего момента, приводящее к разрушению соединений и/или материалов в соответствующих компонентах системы доставки, если это допустимо для предполагаемого клинического использования. Результаты должны быть оценены по значению крутящего момента.
8.5.1.12 Возможность продвижения
Оценивают способность стент-системы продвигаться по сосудам до предполагаемой области размещения, используя соответствующие принадлежности. Оценивают вероятность перемещений проводника во время продвижения стент-системы, если это необходимо для клинических целей (например, при невозможности доступа в боковые ответвления сосуда во время стентирования).
8.5.1.13 Визуализация
Оценивают возможность визуализации системы доставки и/или стент-системы во время выполнения доступа с помощью рентгеноскопии. Использование других методик визуализации должно быть обосновано.
8.5.2 Способность к раскрытию
8.5.2.1 Общие положения
В этом разделе оценивается способность системы обеспечивать последовательное, точное и безопасное раскрытие стента.
Для оцениваемых рисков учитывают следующие виды опасностей, но не ограничиваются только ими:
a) невозможность полного и должного раскрытия стента;
b) смещение или сдвиг стента;
c) отказ (разрушение) баллона;
d) повреждение стента или системы доставки;
e) некорректная визуализация;
f) образование эмбол.
Эти опасности могут привести к подлежащим регистрации негативным клиническим событиям, включающим следующие события, но не ограничиваясь только ими:
- отказ системы доставки;
- сбой раскрытия;
- спинальные неврологические расстройства;
- неврологические расстройства;
- травма сосуда;
- ишемия;
- эмболизация;
- повреждения стента;
- кровотечения, обусловленные выполнением процедуры.
Испытания должны быть проведены в соответствии с требованиями 8.5.2.2-8.5.2.13, если таковые соответствуют дизайну конструкции стент-системы.
8.5.2.2 Прочность соединения
Определяют продольное усилие соединения между частями системы доставки. Все соединения должны оставаться неповрежденными при соблюдении инструкции по применению. Результаты должны быть оценены по значению усилия, необходимого для раскрытия стента.
8.5.2.3 Время наполнения баллона (стенты, расширяемые баллоном или с помощью баллона)
Определяют время, необходимое для наполнения баллона до максимального рекомендуемого давления, объема или диаметра наполнения. При испытании следует использовать стент-систему, если предполагается, что во время наполнения стент закреплен на баллоне.
8.5.2.4 Время спуска баллона (стенты, расширяемые баллоном)
Определяют время, необходимое для спуска баллона, и оценивают возможность удаления спущенного баллона из области стентирования.
8.5.2.5 Номинальное давление разрыва баллона (стенты, расширяемые баллоном)
Определяют значение разрыва баллона с соответствующим коэффициентом запаса. При испытании следует использовать стент-систему, если известно, что во время наполнения стент закреплен на баллоне.
Фиксируют максимальное значение рекомендуемого давления наполнения. Оно не должно превышать номинальное значение давления разрыва баллона.
8.5.2.6 Номинальный износ баллона (стенты, расширяемые баллоном)
Оценивают способность баллона выдерживать клинически обоснованное число повторяющихся циклов наполнения до достижения номинального значения давления разрыва. При испытании следует использовать стент-систему, если известно, что во время наполнения стент закреплен на баллоне.
Фиксируют максимальное рекомендуемое число циклов наполнения.
8.5.2.7 Совместимость размеров компонентов
Определяют размеры стент-системы и проверяют на соответствие размерам рекомендуемых принадлежностей. Все компоненты должны быть совместимы по размерам. Необходимо учитывать возможность введения контраста для того, чтобы проводник или интродьюсер со стент-системой могли пройти через просвет сосуда.
8.5.2.8 Проверка размеров
Проверяют размеры на соответствие спецификации конструкции.
8.5.2.9 Усилие отсоединения
Определяют усилие, необходимое для вывода предварительно закрепленного стента из сжатого положения на нерасширенном баллоне и для полного отделения стента с нерасширенного баллона при клиническом использовании.
8.5.2.10 Расширение концов (стенты, расширяемые баллоном)
Определяют диаметр(ы) части баллона, выходящей за пределы стента, превышающей внешний(е) диаметр(ы) стента при максимальном рекомендуемом значении давления наполнения.
8.5.2.11 Усилие, необходимое для раскрытия (саморасширяющиеся стенты)
Определяют усилие, необходимое для раскрытия стента с системой доставки.
8.5.2.12 Моделирование работы стент-системы
Оценивают работу стент-системы, используя модель, воспроизводящую предполагаемые условия ее использования.
8.5.2.13 Визуализация
Оценивают возможность визуализации стента и системы доставки во время размещения и раскрытия с помощью рентгеноскопии. Использование других методик визуализации должно быть обосновано.
8.5.3 Возможность удаления
8.5.3.1 Общие положения
В этом разделе оценивается способность системы обеспечивать безопасное и последовательное удаление системы доставки.
Для оцениваемых рисков учитывают следующие виды опасностей, но не ограничиваются только ими:
a) недостаточный спуск баллона (для стентов, расширяемых баллоном);
b) образование у баллона "крыльев" (для стентов, расширяемых баллоном);
c) нарушение структурной целостности;
d) образование эмбол;
e) ошибка в диаметре;
f) смещение или сдвиг имплантата;
g) повреждение стента или системы доставки;
h) зацепление или прилипание системы доставки к стенту;
i) некорректная визуализация.
Эти опасности могут привести к подлежащим регистрации негативным клиническим событиям, включающим следующие события, но не ограничиваясь ими:
- отказ системы доставки;
- сбой раскрытия;
- неврологические расстройства;
- травма сосуда;
- ишемия;
- спинальные неврологические расстройства;
- эмболизация;
- повреждения стента;
- кровотечения, обусловленные выполнением процедуры.
Испытания должны быть проведены в соответствии с требованиями 8.5.3.2-8.5.3.9, если таковые соответствуют дизайну конструкции стент-системы.
8.5.3.2 Прочность соединения
Определяют продольное усилие соединения между частями системы доставки. Все соединения должны оставаться неповрежденными при рекомендуемых условиях применения. Результаты следует оценить по значению усилия, необходимого для удаления системы.
8.5.3.3 Совместимость размеров компонентов
Определяют размеры стент-системы и проверяют на соответствие размерам рекомендуемых принадлежностей. Все компоненты должны быть совместимы по размерам. Необходимо учитывать возможность введения контраста для того, чтобы проводник или интродьюсер со стент-системой могли пройти через просвет сосуда.
8.5.3.4 Проверка размеров
Проверяют размеры на соответствие значениям, приведенным в спецификации конструкции.
8.5.3.5 Изгиб/перегиб
Оценивают способность стент-системы к изгибу на предварительно установленное значение клинически обоснованного радиуса или угла изгиба, который может потребоваться при выполнении доступа и доставки.
8.5.3.6 Моделирование работы
Оценивают рабочие характеристики стент-системы, используя модель, воспроизводящую предполагаемые условия использования устройства.
8.5.3.7 Прочность соединения при кручении
Определяют значение крутящего момента/угла поворота, приводящее к разрушению соединений и/или материалов в соответствующих компонентах системы доставки. Результаты должны быть оценены по значению крутящего момента, необходимого для удаления системы.
8.5.3.8 Прочность трубок при растяжении
Определяют прочность трубок, используемых в системе доставки, с учетом их материала.
8.5.3.9 Визуализация
Оценивают возможность визуализации системы доставки во время удаления, используя рентгеноскопию. Использование других методик визуализации должно быть обосновано.
8.5.4 Биосовместимость
Биосовместимость следует оценивать в соответствии с требованиями ИСО 10993-1 и соответственно других частей серии стандартов ИСО 10993. Для оценки материала и выделяемых веществ стенты следует испытывать отдельно от системы доставки.
8.5.5 Гемостаз
8.5.5.1 Общие положения
В этом разделе оценивается способность системы минимизировать потери крови.
Для оцениваемых рисков учитывают следующие виды опасностей, но не ограничиваются только ими:
a) несовпадение компонентов по размерам (мисмэтч размеров);
b) недостаточная плотность герметизации;
c) другие утечки.
Эти опасности могут привести к подлежащим регистрации негативным клиническим событиям, включающим следующие события, но не ограничиваясь только ими:
- кровотечение во время проведения процедуры;
- гематомы.
Испытания должны быть проведены в соответствии с требованиями 8.5.5.2-8.5.5.4, если таковые соответствуют дизайну конструкции стент-системы.
8.5.5.2 Совместимость размеров компонентов
Оценивают совместимость размеров стент-системы с размерами рекомендуемых принадлежностей. Все компоненты должны быть совместимы по размерам.
8.5.5.3 Проверка размеров
Проверяют соответствующие размеры на соответствие спецификации конструкции.
8.5.5.4 Оценка гемостаза
Оценивают способность всех уплотнений или клапанов системы доставки обеспечивать достаточное кровоостанавливающее действие при использовании с соответствующими вспомогательными устройствами.
8.6 Стент
8.6.1 Способность к точному раскрытию
8.6.1.1 Общие положения
В этом разделе оценивается способность системы обеспечивать последовательное, точное и безопасное раскрытие стента в предполагаемой области повреждения.
Для оцениваемых рисков учитывают следующие виды опасностей, но не ограничиваются только ими:
a) неточное размещение или ориентация;
b) некорректная конфигурация раскрытия;
c) неполное раскрытие;
d) некорректная визуализация.
Эти опасности могут привести к подлежащим регистрации негативным клиническим событиям, включающим следующие события, но не ограничиваясь ими:
- окклюзия ответвлений сосуда;
- отказ системы доставки;
- сбой раскрытия;
- миграция стента;
- интрапроцедурная окклюзия сосуда;
- ишемия;
- травма сосуда.
Испытания должны быть проведены в соответствии с требованиями 8.6.1.2-8.6.1.5, если они соответствуют дизайну конструкции стент-системы.
8.6.1.2 Соотношение длины и диаметра стента
Определяют соотношение длины и диаметра раскрытого стента.
8.6.1.3 Влияние профиля/расширение (стенты, расширяемые баллоном)
Определяют изменение расстояния между внешним диаметром стента и внешним диаметром баллона после прохождения по извитым участкам.
8.6.1.4 Моделирование работы
Оценивают рабочие характеристики стента, используя модель, воспроизводящую предполагаемые условия использования.
8.6.1.5 Визуализация
Оценивают качество и возможность визуализации стента во время раскрытия и после удаления системы доставки, используя рентгеноскопию. Использование других методик должно быть обосновано.
8.6.2 Эффективность фиксации
8.6.2.1 Общие положения
В этом разделе оценивается способность стента оставаться в его раскрытом положении.
Для оцениваемых рисков учитывают следующие виды опасностей, но не ограничиваются только ими:
a) неполное прилегание к стенкам сосуда;
b) чрезмерная или некорректная внешняя радиальная сила.
Эти опасности могут привести к подлежащим регистрации негативным клиническим событиям, включающим следующие события, но не ограничиваясь ими:
- миграция стента;
- обструкция просвета;
- интрапроцедурная окклюзия сосуда;
- травма сосуда;
- травма прилегающих структур;
- окклюзия ответвлений сосуда.
Испытания должны быть проведены в соответствии с требованиями 8.6.2.2-8.6.2.8, если таковые соответствуют дизайну конструкции стент-системы.
Примечание - Ниже перечислены четыре вида испытаний, в которых оцениваются усилия, приводящие к деформации стента. Несмотря на их схожесть, при испытаниях на устойчивость к разрушению при радиально прикладываемой нагрузке, на устойчивость к разрушению при плоскопараллельной нагрузке, на локальное сжатие и радиальное усилие оценивают разные параметры стента, а именно:
- в испытании на устойчивость к разрушению при радиально прикладываемой нагрузке оценивают способность стента, расширяющегося с помощью баллона, выдерживать постоянную деформацию при воздействии круговой однородной радиальной нагрузки;
- в испытании на устойчивость к разрушению при плоскопараллельной нагрузке оценивают способность стента выдерживать постоянную деформацию по всей длине устройства при воздействии однородной нагрузки, прикладываемой по всей длине устройства;
- в испытании на локальное сжатие оценивают способность стента выдерживать постоянную деформацию при локальной (например, точечной) нагрузке;
- в испытании на радиальное усилие оценивают усилие, прикладываемое саморасширяющимся стентом на сосуд в раскрытом состоянии во время расширения и сжатия.
8.6.2.2 Контакт с сосудистой стенкой
Оценивают способность стента обеспечивать достаточный контакт со стенками сосуда при раскрытии.
8.6.2.3 Устойчивость к разрушению при радиально прикладываемой нагрузке (стенты, расширяемые баллоном)
Определяют характеристики нагружения/деформации стента в окружном направлении при воздействии однородной радиальной нагрузки.
8.6.2.4 Устойчивость к разрушению при плоскопараллельной нагрузке
Определяют нагрузку, необходимую для того, чтобы вызвать клинически значимый изгиб, достигающий по крайней мере 50% изначального расстояния между стенками стента, и нагрузку, необходимую для постоянной деформации или полного разрушения стента. Это испытание требуется для стентов, которые могут подвергаться сжатию при клиническом использовании.
8.6.2.5 Локальное сжатие
Определяют характеристики нагрузки/деформации стента в ответ на локальное сжатие, приложенное перпендикулярно к продольной оси устройства, и способность стента восстанавливать исходную геометрию. Смещение стенок должно быть снижено по крайней мере до 50% в зоне контакта. Это испытание требуется для стентов, для дизайна конструкции которых характерна вероятность другой реакции на локальное сжатие по сравнению с радиальным направлением приложения сжимающей нагрузки или плоскопараллельной схемой нагружения, и для которых этот вид испытания клинически значим.
8.6.2.6 Радиальное усилие
Определяют усилие (расширения и сжатия), вызванное саморасширяющимся стентом как функцию от диаметра стента.
8.6.2.7 Отдача (стенты, расширяемые баллоном)
Определяют в процентах изменение внешнего диаметра стента от максимального значения внешнего диаметра, полученного при наполненном баллоне, до конечного внешнего диаметра после удаления баллона. Рекомендуемая схема определения размера стента должна учитывать эту отдачу.
8.6.2.8 Моделирование работы
Оценивают рабочие характеристики стента, используя модель, воспроизводящую предполагаемые условия работы устройства.
8.6.3 Целостность стента
8.6.3.1 Общие положения
В настоящем разделе оценивается способность стента противостоять разрушению.
Для оцениваемых рисков учитывают следующие виды опасностей, но не ограничиваются только ими:
a) разрушение конструкции стента, включая покрытие, если применимо;
b) нарушение полноты прилегания к стенкам сосуда;
c) излишняя непредусмотренная неравномерность расширения стента.
Эти опасности могут привести к подлежащим регистрации негативным клиническим событиям, включающим следующие события, но не ограничиваясь ими:
- разрушение стента;
- остаточный стеноз;
- рестеноз в сегменте стента;
- рестеноз в стенте;
- окклюзия просвета во время выполнения процедуры;
- окклюзия просвета после процедуры;
- окклюзия просвета в отдаленные сроки;
- миграция стента;
- травма сосуда;
- ишемия, вызванная эмболией или тромбообразованием на стенте;
- повреждение прилежащих структур.
Испытания должны быть проведены в соответствии с требованиями 8.6.3.2-8.6.3.6, если таковые соответствуют дизайну конструкции стент-системы.
8.6.3.2 Целостность покрытия
Оценивают любые повреждения покрытия, вызванные нагрузкой, перемещением, раскрытием и удалением системы доставки.
8.6.3.3 Размеры покрытия и другие параметры покрытия (например, пористость, распределение плотности)
Определяют соответствующие размеры покрытия стента и оценивают их соответствие спецификации конструкции.
8.6.3.4 Коррозия
Оценивают подверженность стента коррозии в реальной или рабочей моделируемой среде. Коррозия может включать различные виды, в том числе контактную и электрохимическую коррозию.
Артефакты покрытия и процессы производства покрытия могут влиять на потенциал коррозии конечного продукта и должны учитываться.
8.6.3.5 Долговечность
8.6.3.5.1 Общие положения
Должна быть выполнена оценка длительной прочности при ожидаемых физиологических условиях. Если оценке подвергаются не все типоразмеры и конфигурации, то испытуемые типоразмеры и конфигурации должны быть выбраны таким образом, чтобы не только представлять наибольшую вероятность отказа вследствие усталости, но и чтобы можно было сделать заключение, касающееся прогноза долговечности для других, не испытуемых типоразмеров и конфигураций. Результаты испытания и результаты анализа оценки долговечности стента являются дополняющими друг друга и должны интерпретироваться как по отдельности, так и в комбинации.
При оценке долговечности следует учитывать следующие факторы:
- наложение стентов один на другой;
- вероятные виды отказа, такие как образование трещин, износ, наличие постоянной деформации, нарушение целостности покрытия (например, в виде расслоений и пр.);
- нагрузки in vivo на соответствующую область имплантации (изгибная, радиальная, осевая нагрузки, крутящий момент, разрушающее нагружение);
- ограничения при проведении испытания и связанные с этим возможные артефакты.
В настоящее время не стандартизированы методы испытания для оценки влияния физиологических видов нагрузки, кроме радиальной силы. Для полноты оценки всех физиологических нагрузок и вероятных видов отказа могут потребоваться испытания и/или анализ, дополняющие перечисленные ниже. При определении соответствующих граничных условий для испытания и/или анализа необходимо учитывать анатомическую вариабельность и морфологические изменения после имплантации.
8.6.3.5.2 Анализ напряженно-деформированного состояния
Определяют критические напряжения и/или деформации на стенте, связанные с производством, нагрузкой катетера, доставкой, раскрытием и нагрузками in vivo, используя соответствующие методы, такие как метод конечных элементов. Свойства материалов должны быть подобраны таким образом, чтобы соответствовать определенному анализируемому этапу производства и раскрытия. Результаты данного анализа напряженно-деформированного состояния могут использоваться для определения соответствующих коэффициентов безопасности конструкции стента, для установления соответствующих условий испытания и для выбора соответствующих параметров испытания (например, размеров стента) при испытании на долговечность.
8.6.3.5.3 Определение коэффициента запаса усталостной прочности
Проводят соответствующий анализ усталости. Оценка коэффициента запаса усталостной прочности стента требует инженерного подхода, такого как анализ усталостной прочности в зависимости от уровня деформаций и/или уровня напряжений. Обычно должны быть проанализированы все типоразмеры и конфигурации, если нет обоснования того, что существует наихудший случай. Анализ усталостной прочности в зависимости от уровня деформаций и/или уровня напряжений требует определения средних и пиковых значений напряжения или деформации с использованием анализа напряженно-деформированного состояния и сравнения с соответствующими свойствами материала (например, предельная и усталостная деформация или напряжение). Коэффициент безопасности может быть получен, исходя из значений напряжения, деформации или срока службы до наступления усталостного разрушения.
8.6.3.5.4 Испытание на усталостную прочность
Оценивают долгосрочную конструктивную целостность стента при приложении наихудшего случая физиологического нагружения. Прочность должна быть оценена для всех соответствующих режимов усталостного нагружения на основе предполагаемого клинического использования (положения имплантата) и условий его работы (например, расширение, наложении стентов). Испытания стента на усталость должны включать in vitro испытания продолжительностью, по крайней мере, до тех пор, пока не будет достигнуто число циклов, эквивалентное десяти годам работы для каждого испытуемого стента. Если предполагаемый срок работы стента составляет менее десяти лет, то можно прибегнуть к более короткой продолжительности испытания на усталость, что должно быть обосновано. Частота нагружения при испытании должна быть такой, чтобы деформация испытуемого стента была не менее чем деформация стента в определенных физиологических условиях. Испытания на усталость следует проводить в соответствующих рабочих средах, таких, например, как физиологический раствор с фосфатным буфером, если не может быть обосновано испытание с использованием других сред, таких как дистиллированная вода. Испытания следует проводить при нормальной физиологической температуре, если не предусмотрено иное.
Условия испытания должны быть зафиксированы и обоснованы и должны включать число образцов, размеры испытуемых стентов, частоту нагружения и другие параметры, используемые при моделировании физиологических условий. Виды и значения нагружения/деформации и требуемое число циклов нагружения должны быть обоснованы соответствующими физиологическими моделями и расчетами. Типоразмер(ы) и конфигурация испытуемых стентов должны быть выбраны таким образом, чтобы достигалась наибольшая вероятность отказа вследствие усталости и чтобы можно было сделать достоверные заключения, касающиеся долговечности других не испытанных типоразмеров и конфигураций изделий.
8.6.3.5.5 Долговечность покрытия
Оценивают способность покрытия сопротивляться расслоению (например, частично прикрепленные участки покрытия, оголенные участки) при условиях моделирования наихудшего случая физиологического нагружения, сходного с приведенным в 8.6.3.5.4.
Надлежит провести исследование покрытия в ускоренных условиях испытаний. Результаты контроля должны быть сопоставлены с основными характеристиками для определения эффективного срока службы устройства. Результаты должны быть проанализированы с учетом доступных доклинических in vivo и клинических данных о рабочих характеристиках.
Необходимо проводить исследования с учетом заранее установленных интервалов времени.
8.6.3.5.6 Образование частиц покрытия
Оценивают размеры и число частиц отделившегося материала покрытия при испытаниях в моделируемых условиях in vivo.
8.6.3.6 Визуальный осмотр
Стент должен соответствовать требованиям спецификации изготовителя в отношении дефектов поверхности и загрязнения. На стенте не должно быть дефектов, которые делают его непригодным для предполагаемого использования.
8.6.4 Определение размеров
8.6.4.1 Общие положения
В настоящем разделе оценивается способность стента оставаться в том положении, в котором его разместили, в пределах сосудистого русла, за счет корректно выбранных размеров.
Для оцениваемых рисков рассматриваемые опасности включают следующие факторы, но не ограничиваются ими:
а) некорректные размеры.
Эти опасности могут привести к подлежащим регистрации негативным клиническим событиям, включающим следующие виды, но не ограничиваясь ими:
- миграция стента;
- тромбоз стента;
- окклюзия ответвлений сосуда;
- травма сосуда;
- повреждение прилежащих структур;
- остаточный стеноз;
- рестеноз в сегменте;
- рестеноз в стенте;
- окклюзия просвета в течение процедуры;
- окклюзия просвета после процедуры;
- отдаленная окклюзия просвета;
- ишемия.
При испытании следует учитывать положения 8.6.4.2-8.6.4.6, если таковые соответствуют конструкции стента.
8.6.4.2 Проверка размеров
Проверяют размеры на соответствие спецификации конструкции.
8.6.4.3 Соотношение диаметра и давления наполнения баллона (стенты, расширяемые баллоном)
Для стентов, расширяемых баллоном, определяют соотношение между диаметром стента и давлением наполнения баллона.
8.6.4.4 Отдача (стенты, расширяемые баллоном)
Определяют изменение внешнего диаметра стента в процентах от максимального внешнего диаметра, полученного при наполненном баллоне, до конечного внешнего диаметра после удаления баллона. Схема определения размера стента, рекомендуемая в инструкции по применению, должна учитывать эту отдачу.
8.6.4.5 Моделирование использования
Оценивают рабочие характеристики стента, используя какую-либо модель, воспроизводящую предполагаемые условия его работы.
8.6.4.6 Соотношение длины и диаметра стента
Определяют соотношение между длиной стента и диаметром в расширенном состоянии.
8.6.5 Проходимость
8.6.5.1 Общие положения
В настоящем разделе оценивается способность стента поддерживать просвет в открытом состоянии.
Для оцениваемых рисков рассматриваемые опасности включают следующие виды, но не ограничиваются ими:
a) перегиб;
b) перекручивание;
c) неточное раскрытие;
d) деформация, включая закрытие стента;
e) образование тромбов.
Эти опасности могут привести к подлежащим регистрации негативным клиническим событиям, включающим следующие виды, но не ограничиваясь ими:
- тромбоз стента;
- остаточный стеноз;
- рестеноз в сегменте;
- рестеноз в стенте;
- рестеноз;
- окклюзия просвета во время процедуры;
- окклюзия просвета после выполнения процедуры;
- отдаленная окклюзия просвета;
- стенокардия;
- рецидив портальной гипертензии;
- инфаркт миокарда;
- ишемия;
- образование эмбол;
- неврологические расстройства.
При испытании следует учитывать положения 8.6.5.2-8.6.5.8, если таковые соответствуют конструкции стента.
Примечание - В перечисленных ниже четырех видах испытания определяют усилия, приводящие к деформации стента. При всей схожести испытаний на устойчивость к разрушению при радиально действующей нагрузке, на устойчивость к разрушению при сжатии стента между параллельными пластинами, на локальное сжатие и радиальное усилие они оценивают разные параметры стента, а именно:
- при испытании на устойчивость к разрушению при радиально прикладываемой нагрузке определяют способность стента, расширяющегося с помощью баллона, выдерживать постоянную деформацию при воздействии круговой однородной радиальной нагрузки;
- при испытании на устойчивость к разрушению при сжатии стента параллельно расположенными пластинами определяют способность стента выдерживать постоянную деформацию по всей длине устройства при воздействии однородной нагрузки, прикладываемой по всей длине устройства;
- при испытании на локальное сжатие определяют способность стента выдерживать постоянную деформацию при локальной (например, точечной) нагрузке;
- при испытании на радиальное усилие измеряют усилие, прикладываемое саморасширяющимся стентом на сосуд в раскрытом состоянии во время расширения и сжатия.
8.6.5.2 Устойчивость к разрушению при радиально прикладываемой нагрузке (стенты, расширяемые баллоном)
Определяют нагрузку, необходимую для того, чтобы вызвать клинически значимый перегиб или уменьшение диаметра стента по крайней мере на 50%.
8.6.5.3 Устойчивость к разрушению при сжатии между параллельными пластинами
Определяют нагрузку, необходимую для того, чтобы вызвать клинически значимый перегиб или деформацию, эквивалентную уменьшению диаметра (уменьшение просвета) по крайней мере, на 50% и нагрузку, необходимую для постоянной деформации или полного разрушения стента. Это испытание требуется для стентов, которые при клиническом использовании могут испытывать непосредственное сжатие.
8.6.5.4 Перегиб/скручивание
Определяют минимальный радиус изгиба, который может выдерживать стент без перегиба или уменьшения диаметра (уменьшение просвета) более чем на 50% при условии, что стент восстанавливает свою первоначальную геометрию после испытания.
8.6.5.5 Локальное сжатие
Определяют деформацию стента в ответ на локальное усилие сжатия, приложенное перпендикулярно к продольной оси устройства. Это испытание требуется для стентов, для конструкции которых есть вероятность другого ответа на локальное сжатие по сравнению с радиальным или плоскопараллельным усилием сжатия и для которых это испытание соответствует клинической практике.
8.6.5.6 Радиальная сила
Определяют усилие, вызванное саморасширяющимся стентом как функцию внешнего диаметра стента.
8.6.5.7 Моделирование использования
Оценивают рабочие характеристики стента, используя какую-либо модель, воспроизводящую предполагаемые условия использования.
8.6.5.8 Площадь свободной от стента поверхности и площадь внешней поверхности стента
Определяют площадь поверхности, открытой или свободной от стента, как функцию от диаметра стента и площади контактной зоны между стентом и сосудом.
8.6.6 Безопасность и совместимость с магнитно-резонансной томографией (МРТ)
Оценивают безопасность и совместимость стента при использовании МРТ.
Для оцениваемых рисков рассматриваемые опасности включают следующие факторы, но не ограничиваются ими:
a) индуцированные магнитным полем усилия смещения, скручивания стента и радиальные усилия, вызванные нагревом стента;
b) низкое качество изображения (артефакты изображения).
Примечание 1 - Для дополнительного руководства по оценке магнитно-индуцированного смещения, кручения, поворота, радиальной нагрузки от нагрева и по артефактам изображения см. ASTM F2052 [21], ASTM F2213 [27], ASTM F2182 [26] и ASTM F2119 [24].
Эти опасности могут привести к подлежащим регистрации негативным клиническим событиям, включающим следующие виды, но не ограничиваясь ими:
- травма сосуда;
- миграция стента.
Примечание 2 - Наблюдаемые артефакты у стентов некоторых видов могут ограничивать использование МРТ у пациентов с этими видами имплантируемых изделий.
8.6.7 Биосовместимость
Биосовместимость надлежит оценивать в соответствии с требованиями ИСО 10993-1 и другими частями серии стандартов ИСО 10993. Для стентов, выделяющих лекарства, могут потребоваться дополнительные испытания на токсичность лекарственных средств и компонентов покрытия. Для испытаний по оценке выделяемых веществ стенты должны быть испытаны отдельно от системы доставки.
8.6.8 Выделение лекарств
8.6.8.1 Общие положения
В этом разделе оценивается способность стента выделять лекарства согласно спецификации конструкции при производстве и хранении.
Для оцениваемых рисков рассматриваемые опасности включают следующие виды, но не ограничиваются ими:
a) избыточное выделение лекарства;
b) неадекватное выделение лекарства;
c) непредусмотренная вариабельность локального выделения лекарства.
Эти опасности могут привести к подлежащим регистрации негативным клиническим событиям, включающим следующие виды, но не ограничиваясь ими:
- нежелательные биологические реакции (токсичность);
- аневризма стенок сосуда или некроз (при аномальном положении стента);
- остаточный стеноз;
- рестеноз в сегменте;
- рестеноз в стенте;
- рестеноз;
- окклюзия просвета во время процедуры;
- окклюзия просвета после выполнения процедуры;
- отдаленная окклюзия просвета;
- образование эмбол;
- ишемия;
- тромбоз стента.
При испытании следует учитывать положения 8.6.8.2-8.6.8.4, если таковые соответствуют конструкции стента.
8.6.8.2 Содержание/количество лекарства
Определяют количество лекарства на стенте.
8.6.8.3 Интенсивность выделения
Определяют количество лекарства, выделяемого за определенный период времени.
8.6.8.4 Идентификация лекарства
Идентифицируют тип и определяют чистоту лекарства и описывают вид и степень деградации компонентов лекарственного средства.
8.7 Доклиническая оценка in vivo*
_______________
* Слова "in vivo" в наименовании пункта 8.7 в бумажном оригинале выделены курсивом. - .
8.7.1 Цель
Целью доклинических in vivo испытаний является оценка доставки и раскрытия стента и удаления системы доставки в соответствии с инструкцией по эксплуатации, определение ответов как пациента, так и стента. В частности, доклинические испытания должны обеспечивать получение данных, касающихся безопасности. Испытание должно оценивать соответствие стента предполагаемому использованию при клинической оценке.
8.7.2 Специальные цели
Должны быть установлены специальные цели исследования, включая следующее:
a) оценка возможности доступа в предполагаемую область с использованием системы доставки;
b) оценка обслуживания и визуализации системы доставки и визуализации стента;
c) проверка точности и эффективности раскрытия;
d) описание возможности удаления системы доставки;
e) оценка применимости определения размеров стента;
f) оценка функционального гемостаза системы доставки;
g) оценка положения, целостности и функциональности стента;
h) для стентов, выделяющих лекарства, оценка присутствия лекарства в крови, в обрабатываемом сосуде и других соответствующих тканях в течение времени;
i) оценка биологического ответа (например, образование тромбов, раздражение, эндотелизация, некроз, образование аневризмы), влияния на ткани, расположенные ниже по течению, и системных эффектов (например, образование эмбол, инфаркт) за счет оценки гистологии и патологии эксплантатов и соответствующих тканей/органов;
j) регистрация неблагоприятных клинических событий и вероятных действующих факторов (например, стент или система доставки).
Примечание - Для достижения всех специальных целей может потребоваться не одно исследование.
8.7.3 Протокол
Стент-система каждого типа должна быть испытана имплантацией стента в предполагаемую или аналогичную область сосуда у обоснованного числа лабораторных животных по крайней мере в течение 26 недель для каждого из животных, если не приведено обоснование для более короткого периода наблюдений. Надлежит определить и обосновать тип и интервалы периодических наблюдений. Для оценки инновационных технологий могут оказаться доказательными острые условия проведения эксперимента, а также более длительные исследования. Для исследования стентов, выделяющих лекарства, при установлении продолжительности сроков наблюдения (имплантации) необходимо учитывать кинетику доставки лекарств и время их выведения из тканей. В той степени, которая достижима, учитывая ограничения животной модели, все используемые устройства должны иметь клиническое качество, размеры и конструкцию, предназначенные для клинического использования.
Оценка безопасности стентов, выделяющих лекарство, должны включать оценку дозозависимых эффектов, включая влияние передозировки (например, отсутствие лекарства, номинальная доза лекарства, трехкратная передозировка). Необходимо оценивать местную, региональную (ниже по кровотоку) и системную токсичности.
Для стентов с лекарственным покрытием, по крайней мере, в одном исследовании необходимо измерять уровень содержания действующего вещества в плазме, а также оценивать уровень лекарства в тканях в течение определенного периода времени.
Интерпретация результатов исследования на животных может быть проведена с использованием, по крайней мере, небольшого числа контрольных устройств с целью сравнения. Если в исследовании не используются контрольные устройства, должно быть приведено обоснование. Для стентов, выделяющих лекарство, в качестве контрольного образца должны использоваться как голые металлические стенты, так и при возможности стенты с покрытием (без лекарства).
Всех животных, участвующих в исследовании, следует регулярно обследовать. Все животные должны быть подвергнуты посмертному обследованию, включая погибших до окончания предполагаемого срока исследования. Надлежит регистрировать причины гибели или болезни и степень причастности к этому собственно имплантата. Должна быть проведена гистологическая и патологическая оценка эксплантатов и соответствующих тканей и органов.
Надлежит разработать проект проведения доклинических испытаний in vivo, включая протоколы экспериментов, методы измерения и анализ данных. Дополнительно в соответствии с целями исследования должен быть обоснован выбор животной модели с учетом таких параметров, как разновидность животных, пол, возраст и необходимость моделирования патологии.
Имплантация должна соответствовать рекомендуемым инструкциям по клиническому использованию в той степени, которая достижима с учетом ограничений, присущих животной модели, включая при возможности и нахождение стентов один на другой при имплантации.
Примечание - См. ИСО/МЭК 17025 [13] в качестве руководства по надлежащей лабораторной практике.
8.7.4 Сбор данных
Для каждого лабораторного животного с имплантированным стентом должны быть собраны, как минимум, следующие данные:
a) данные идентификации животного:
1) происхождение животного;
2) идентификация животного;
3) пол;
4) возраст;
5) масса тела;
b) предоперационные данные:
1) проверка состояния здоровья, включая соответствующие исследования крови;
2) назначение лекарственных веществ (например, профилактика антибиотиками);
c) операционные данные:
1) дата выполнения процедуры;
2) имя лица, выполнившего процедуру;
3) описание процедуры имплантации, включая:
- идентификацию стент-системы и вспомогательных устройств;
- идентификационный номер стента;
- длина и диаметр стента in situ;
- диаметр(ы) сосудов, в которые произведена имплантация;
- использование антитромбоцитарной терапии;
- хирургический подход;
- положение имплантата;
4) оценка параметров, содержащихся в протоколе, таких как:
- точность и эффективность ввода системы доставки и раскрытия стента;
- порядок обращения с системой доставки, визуализация системы доставки и стента;
- эффективность удаления системы доставки;
- удобство определения размеров и схемы размеров;
- объем потери крови и локализация кровотечения;
- положение, целостность и функциональность имплантата;
- неблагоприятные события во время операции;
d) данные послеоперационных наблюдений:
1) продолжительность послеоперационного наблюдения;
2) назначение лекарственных веществ, в т.ч. влияющих на коагуляцию;
3) используемые методы и результаты оценок, предусмотренных в протоколе, такие как:
- сохранение целостности, функциональной эффективности и положения имплантата в сосудистом русле;
- неблагоприятные события, дата возникновения, терапия и последствия;
- для стентов, выделяющих лекарства, уровень содержания лекарства в крови,
- если это требуется протоколом;
4) любые существенные отклонения от протокола;
e) данные на момент окончания эксперимента:
1) дата смерти;
2) причина более раннего окончания эксперимента или смерти, если применимо;
3) оценки, предусмотренные протоколом (например, сохранение целостности, функциональной эффективности, проходимости и положения имплантата);
4) тщательное обследование эксплантированного стента и окружающих тканей;
5) патологоанатомическая оценка соответствующих тканей и/или органов, если это требуется по протоколу;
6) для стентов, выделяющих лекарства, уровень лекарства в тканях, если это требуется по протоколу.
8.7.5 Отчет об испытаниях и дополнительная информация
Результаты для всех животных, внесенных в протокол испытаний, должны быть зарегистрированы и записаны, даже если животные исключены из конечного анализа.
Отчет об испытаниях должен включать следующее:
a) протокол исследования;
b) обоснование выбора:
1) вида животного;
2) области имплантации;
3) периода имплантации;
4) метода оценки;
5) типа и интервалов промежуточной оценки;
6) объема выборки (т.е. число животных и имплантатов);
7) контроля, если применимо;
c) причины отказа от использования контрольной группы, если применимо;
d) результаты:
1) учет животных, включая причины исключения ряда данных;
2) сводка неблагоприятных событий;
3) сводка данных о случаях ранней смерти или острого прерывания эксперимента, сгруппированных по причинам;
4) значимые и/или обусловленные ходом испытания отклонения от протокола;
5) сводка результатов, обсуждений и заключений для каждой отдельной цели исследования;
6) патологоанатомическая оценка соответствующих тканей и/или органов, включая фотоизображения и микроснимки, если требуется по протоколу;
7) сводка данных о процедурах обеспечения качества и аудита данных, включая положения, касающиеся оценки соответствия нормативным документам (стандартам).
8.8 Клиническая оценка
8.8.1 Цель
Целью клинической оценки является обеспечение достаточного уровня уверенности в безопасности и эффективности стент-системы. Клинические исследования должны быть проведены для любой стент-системы с характеристиками конструкции, для которых до этого не были продемонстрированы безопасность и эффективность. Исследования следует проводить с учетом требований ИСО 14155, принимая во внимание специфичные аспекты сосудистых стентов, перечисленные ниже. Стенты должны удовлетворять всем применимым требованиям доклинических испытаний по настоящему стандарту перед началом клинических исследований.
Примечание - В серии международных стандартов ИСО 14155 приведены требования, касающиеся проведения клинических исследований. В нижеследующих подразделах приведены подробные сведения, касающиеся клинических исследований сосудистых стентов.
8.8.2 Специфичные цели
Надлежит определить специфичные цели исследования; они могут включать по возможности следующие:
a) оценка возможности доступа в предполагаемую область с использованием системы доставки;
b) оценка обслуживания и визуализации системы доставки и визуализации стента;
c) проверка точности и эффективности раскрытия;
d) описание возможности удаления системы доставки;
e) оценка применимости определения размеров стента;
f) оценка точности и постоянства положения, целостности конструкции и эффективности функционирования;
g) контроль характеристик повреждения и положения стента (в течение времени);
h) оценка всех эксплантатов;
i) оценка патофизиологии всех соответствующих тканей/органов;
j) запись клинических событий, подлежащих регистрации.
8.8.3 План клинических исследований
Должны быть проведены многоцентровые исследования (как минимум, в трех исследовательских центрах). Должно быть приведено обоснование числа исследовательских центров. Также должно быть приведено статистическое обоснование числа пациентов для исследования на основе клинических предположений. При определении числа пациентов в группе необходимо учитывать влияние сопутствующих заболеваний у пациентов на ожидаемую продолжительность их жизни.
Продолжительность наблюдения за пациентами должна быть определена исходя из цели клинического исследования. Все пациенты, которым имплантирован либо испытуемый, либо контрольный стент, включая пациентов, исключенных из заключительного анализа, должны быть зафиксированы и записаны. Заключительный отчет должен содержать текущие данные наблюдений всех пациентов с учетом данных наблюдений, продолжительность которых установлена планом клинических исследований, вплоть до последнего зарегистрированного пациента. Интервалы наблюдения пациентов должны включать, как минимум, оценку при выписке и при завершении клинических наблюдений. Требуется обосновать продолжительность интервалов наблюдения.
Если надлежащий контроль не определен или не может быть определен, а параллельный контроль представляется излишним, заранее надлежит определить и обосновать метод оценки клинических данных. Контроль должен соответствовать задачам исследования.
Перед началом исследования должна быть сформулирована одна специфичная задача или ряд задач. Эти задачи должны охватывать необходимые конечные точки исследования и содержать определения критериев успеха и отказа для каждой конечной точки. Критерии успеха и отказа должны содержать количественные параметры, совместимые с методами отображения результатов или любыми другими методами их оценки, используемыми в исследовании.
Для клинических испытаний стентов, выделяющих лекарства, до начала клинических исследований могут потребоваться предварительные исследования по определению безопасности лекарства при использовании у человека.
Должны быть четко установлены критерии включения и исключения пациентов. Критерии должны определять целевую популяцию (тех, для кого предназначен стент) и допустимую популяцию (тех, кто согласен принимать участие в исследованиях). Надлежит использовать соответствующий эпидемиологический подход при отборе пациентов для минимизации отклонений.
8.8.4 Сбор данных во время клинических исследований
Для каждого пациента в исследовании следует собрать, как минимум, следующие данные:
Перечень исключений для контрольной группы приведен ниже:
a) данные идентификации:
1) идентификация пациента;
2) пол;
3) дата рождения;
4) фамилия и инициалы исследователя;
5) наименование института;
b) предоперационные данные:
1) факторы риска, такие как гипертоническая болезнь, диабет, гиперлипидемия, курение, ожирение, риски аллергических реакций при анестезии, любые другие факторы риска сердечно-сосудистого генеза, оценка риска проводимого лечения;
2) сводка данных о предыдущих сердечно-сосудистых вмешательствах, включая нехирургические вмешательства, данные о наличии имплантированных сердечно-сосудистых устройств;
3) неотложность вмешательства (т.е. экстренное, неотложное или плановое);
4) диагностические критерии:
- клиническая оценка;
- объективная оценка патологии, оценка доступа к сосудам и другие факторы (размеры, степень кальциноза, наличие извитостей, изгиба в примыкаемых к области размещения устройства сосудах и пр.);
c) операционные данные:
1) фамилия и инициалы врача, выполнявшего имплантацию;
2) дата вмешательства;
3) данные идентификации стента(ов), включая номер модели, наличие стикеров для обеспечения отслеживаемости стента, его размеры и конфигурация;
4) подробности процедуры, включая любые дополнительные проводимые процедуры на сосудах;
5) применявшаяся медикаментозная терапия;
6) оценка выполнения процедуры, визуализации, раскрытия и удаления;
7) оценка проходимости, размещения и целостности стента;
8) клинические события, подлежащие регистрации (см. приложение С);
- тяжесть, предпринятые действия, последствия;
- сведения о степени вовлечения стент-системы (т.е. затронули ли осложнения стент-систему);
- сведения о вероятных причинах осложнения (т.е. вызвано ли осложнение стент-системой, факторами, связанными с пациентом, техническими причинами или другим);
9) сравнение планируемого и реального расположения стента;
10) диаметр просвета стента;
11) подтверждение надлежащего размещения стента в сосуде;
12) дата выписки пациента;
d) послеоперационные данные:
1) дата каждого визита пациента для наблюдения;
2) сводка данных о сердечно-сосудистых вмешательствах с момента последнего наблюдения;
3) клиническая оценка (протокол оценки может отличаться для контрольной группы и рабочей группы):
- клиническая оценка;
- объективная оценка функционирования стента (смещение, проходимость, процент уменьшения диаметра, целостность стента);
- объективная оценка характеристик имеющегося повреждения сосуда и расположения стента;
- для стентов, выделяющих лекарство, необходимо определить уровень содержания лекарства в крови пациентов с течением времени;
4) соответствующая медикаментозная терапия при стентировании, такая как антикоагулянты или антибиотики;
5) клинические события, подлежащие регистрации:
- событие, дата происшествия, тяжесть, предпринятые действия, последствия;
- фиксация степени вовлечения стента;
- фиксация возможных факторов, послуживших причиной (т.е. вызвано ли осложнение самим стентом, факторами, связанными с пациентом, техническими причинами или другими);
е) выведение пациента из исследования:
1) дата;
2) продолжительность завершенных наблюдений в месяцах;
3) причины выведения (отказ пациента от наблюдений, летальный исход).
8.8.5 Заключительный отчет
Заключительный отчет должен содержать следующие сведения:
a) протокол исследования;
b) определения клинических событий, подлежащих регистрации;
c) обоснование выбора:
1) объема исследования;
2) выбора способа контроля;
3) методов измерения;
4) метода статистического анализа;
5) интервалов наблюдения пациентов;
d) процедурные данные и данные наблюдения сразу после процедуры (30 суток после операции или раньше) и отдаленные (более чем через 30 суток после процедуры):
1) учет пациентов, включая обоснование исключения данных;
2) существенные и/или относительные отклонения от протокола;
3) сводка данных о пациентах, не завершивших исследование (т.е. отказавшихся от наблюдения или умерших);
4) сводка данных о клинических событиях, подлежащих регистрации:
- по типу события, включая время события относительно процедуры (т.е. во время процедуры, после процедуры и в течение каждого интервала наблюдения);
- по пациентам, включая время события;
5) сводка данных о рабочих характеристиках системы доставки;
6) сводка данных о рабочих характеристиках стента в течение времени (например, миграция, проходимость, целостность стента, изменения формы);
7) для стентов, выделяющих лекарства, если требуется протоколом, сводка уровней содержания лекарства в крови в течение времени;
8) сводка данных о характеристиках повреждения, касающихся рабочих характеристик стента в течение времени;
9) сводка данных о процедурных, дополнительных и последующих повторных вмешательствах (например, атероктомии, последующем расширении сосуда), необходимых после стентирования, если какие-либо из них служат цели улучшения результата;
10) сводка данных о переходе к открытой хирургии;
11) сводка данных о процедурной и более поздней летальности;
12) сводка данных о патофизиологии, если применимо, включая характерные фотографии и микроснимки;
13) сопоставление результатов испытуемой и контрольной групп;
14) заключения по каждой специальной цели исследования.
9 Маркетинг
Должны быть предусмотрены систематические процедуры контроля данных продаж и клинических результатов, полученных для имплантатов, с использованием принципов, приведенных в ИСО 14630 и ИСО 14971.
10 Производство
Стент-системы должны быть изготовлены таким образом, чтобы достигались специфические особенности дизайна конструкции. Требования определены и в других международных стандартах.
Примечание - Могут применяться требования ИСО 13485 [10].
11 Стерилизация
11.1 Изделия, поставляемые стерильными
11.1.1 Стенты и/или стент-системы, маркированные "СТЕРИЛЬНО", должны соответствовать международным, национальным или региональным стандартам. Стенты и/или стент-системы, маркированные "СТЕРИЛЬНО", должны иметь уровень обеспечения стерильности 10.
11.1.2 Процессы стерилизации должны быть валидированы и контролироваться в текущем режиме следующим образом:
a) если стенты и/или стент-системы стерилизуют этилен оксидом, применяют стандарт ИСО 11135-1;
b) если стенты и/или стент-системы стерилизуют паром - ИСО 17665-1;
c) если стенты и/или стент-системы стерилизуют радиацией - ИСО 11137-1;
d) если одноразовые стенты и/или стент-системы, содержащие материалы животного происхождения, стерилизуют в жидких средах - ИСО 14160-1;
e) если стенты и/или стент-системы стерилизуют любым другим методом стерилизации - ИСО 14937.
11.2 Изделия, поставляемые нестерильными
Применяют требования ИСО 14630.
11.3 Остаточные вещества после стерилизации
Применяют требования ИСО 14630.
12 Упаковка
12.1 Защита от повреждений при хранении и транспортировании
12.1.1 Общие положения
Применяют требования ИСО 14630.
12.1.2 Индивидуальный контейнер
Каждый стент и/или стент-система должен быть упакован в индивидуальный контейнер, обеспечивающий стерильный барьер, если необходимо. Должно быть ясно видно, если индивидуальный контейнер был вскрыт.
12.1.3 Внешний контейнер
Каждый индивидуальный контейнер должен быть упакован во внешний контейнер. Этот внешний контейнер должен быть разработан таким образом, чтобы защищать индивидуальный контейнер от повреждений при хранении.
12.1.4 Транспортный контейнер
Каждый внешний контейнер или несколько внешних контейнеров необязательно одного типа должны быть упакованы в транспортный контейнер, разработанный таким образом, чтобы защищать содержимое при нормальных условиях обслуживания, транспортирования и хранения.
12.1.5 Поддержание стерильности при транспортировании
Для стентов и/или стент-систем, поставляемых в стерильном виде, индивидуальный контейнер должен быть разработан таким образом, чтобы поддерживать стерильность стента и/или стент-системы при нормальных условиях обслуживания, транспортирования и хранения и обеспечивать извлечение содержимого асептическим путем.
Упаковка должна соответствовать требованиям ИСО 11607.
12.2 Маркировка
12.2.1 Этикетка контейнера
Каждый стент и/или стент-система должны снабжаться этикеткой(ами) на соответствующем контейнере(ах).
12.2.2 Стенты без системы доставки
По крайней мере следующая информация должна быть представлена в виде слов, фраз, символов или рисунков на этикетке(ах):
- описание и/или список содержимого упаковки;
- наименование и/или торговое наименование, адрес и контактная информация изготовителя;
- наименование устройства (если применимо);
- номер модели/ссылочный номер;
- номер лота/серийный номер;
- метод стерилизации и предупреждение "СТЕРИЛЬНО", если применимо;
- предупреждение об одноразовом использовании;
- срок годности/дата окончания срока годности;
- предупреждение или указание прочитать инструкцию (символ);
- размеры: длина и внешний диаметр (свободный внешний диаметр и диапазон диаметров, если применимо) после расширения;
- рекомендации изготовителя по хранению, если применимо;
- химическая природа любых консервантов в индивидуальном контейнере, с любыми соответствующими предупреждениями об опасности.
12.2.3 Стент-системы (стенты с системой доставки)
По крайней мере следующая информация должна быть представлена в виде слов, фраз, символов или рисунков на этикетке (этикетках):
a) информация, приведенная в 12.2.2;
b) информация по системе доставки, как минимум:
- размеры: минимальный требуемый размер интродьюсера (внутренний диаметр), максимальный размер проволочного направителя и эффективная длина катетера;
- номинальное давление разрыва и максимальное рекомендуемое давление наполнения.
12.2.4 Стикеры
Каждый стент и/или стент-система должны быть снабжены клейкими этикетками учета и отслеживаемости изделия - стикерами, необходимыми для прикрепления к истории болезни и другим записям пациента, которому имплантирован стент. Стикер должен содержать следующую информацию:
a) идентификация изготовителя;
b) наименование продукта;
c) номер партии при производстве и/или лота при стерилизации;
d) номер партии или модели (номер по каталогу изготовителя).
12.3 Информация, предоставляемая изготовителем
12.3.1 Общие положения
Применяют требования ИСО 14630. Более подробная информация представлена в форме таблиц в приложении А и может быть включена в информацию, предоставляемую изготовителем. Включают также и специфическую информацию для стентов и стент-систем.
12.3.2 Информация и инструкция по использованию
Каждый индивидуальный контейнер или внешний контейнер с идентичным содержимым должен быть снабжен инструкцией по использованию стента. Инструкция должна включать следующее:
- показания к использованию;
- противопоказания, предостережения и предупреждения;
- для стентов, выделяющих лекарства, - вероятность взаимодействия лекарств, получаемых пациентом, с таковыми, выделяемыми стентом;
- рекомендации по определению размера стента, учитывая диаметры сосудов, длину повреждения и диаметр стента как функцию от давления наполнения, если применимо;
- вероятные неблагоприятные события;
- данные клинических исследований, если применимо;
- рекомендуемые методы асептического доступа и подготовки стента и системы доставки;
- рекомендуемые методы подготовки сосуда, такие как предварительное расширение, и методы доступа, доставки стента и удаления системы доставки;
- выделенные прописными буквами надписи "СТЕРИЛЬНО - НЕ СТЕРИЛИЗОВАТЬ ПОВТОРНО - ТОЛЬКО ОДНОРАЗОВОЕ ИСПОЛЬЗОВАНИЕ", если применимо;
- информация по повторной стерилизации, если применимо;
- уведомление о добавках и/или вымываемых компонентах, если применимо;
- рекомендации по хранению, если применимо;
- данные или ссылка на них, касающиеся публикации текста, показывающие, если текст был пересмотрен;
- рекомендации по визуализации;
- информация по безопасности и совместимости с МРТ.
Примечание - Рекомендации по этикеткам, касающимся МРТ, см. в ASTM F2503 [30];
- материалы конструкции стента;
- идентификация материала (материалов) покрытия, если применимо;
- идентификация количества лекарств(а), если применимо;
- тип конструкции стента (саморасширяющийся или расширяемый баллоном).
Приложение А
(справочное)
Свойства эндоваскулярных устройств. Сосудистые стенты. Технические и клинические вопросы
В таблицах А.1-А.3 в логической последовательности содержится идентификация серии испытаний на биосовместимость, стендовых испытаний, испытаний на животных и клинических испытаний для оценки рабочих характеристик устройства. В приложении В в формате таблицы приведен перечень стендовых испытаний с описанием цели каждого из испытаний; в приложении С приведены определения видов осложнений и отказов, подлежащих регистрации.
Заголовки таблицы и их разъяснение приведены в таблице А.1. В дополнение приведена форма, помогающая обеспечить соответствующий контекст для информации, содержащейся в таблице.
Таблица А.1 - Заголовки таблицы и их объяснение
Номер колонки | Заголовок | Объяснение | Контекст |
1 | Свойство имплантата/процедуры | Специальные задачи разработки дизайна конструкции | Имплантат должен иметь адекватный ______ (колонка 1) |
2 | Проблема(ы) | Сложности, с которыми можно столкнуться и которые могут не привести к достижению специальных задач конструирования | Если имплантат не обладает адекватным ______ (колонка 1), причиной могут быть проблемы с ______ (колонка 2) |
3 | Клинические события, подлежащие регистрации | Осложнения или отказы, которые могут наблюдаться при клиническом использовании, если возникает проблема | Если проблема с ______ (колонка 2), ______ (колонка 3) может возникнуть и должен быть зафиксирован |
4 | Стендовые испытания и аналитические расчеты | Список испытаний, за исключением испытаний на животных, и клинических испытаний, которые могут быть проведены для валидации специальных задач разработки | Следующие испытания могут быть проведены для оценки адекватности ______ (колонка 1): ______ (колонка 4) |
5 | Исследования на лабораторных животных | Специальные цели исследований на животных для валидации и верификации специальных задач разработки конструктивного решения | Для того чтобы оценить адекватность ______ (колонка 1) в среде in vivo, должны проводиться исследования на животных ______ (колонка 5) |
6 | Клинические исследования | Специальные цели клинических исследований для верификации специальных задач разработки дизайна | Для того чтобы оценить адекватность ______ (колонка 1) в клинической среде, должны проводиться клинические исследования ______ (колонка 6) |
7 | Информация, предоставляемая изготовителем | Информация, предоставляемая изготовителем с целью минимизации вероятности того, что произойдет сбой | Для минимизации риска ______ (колонка 2) или ______ (колонка 3) изготовителем должна предоставляться ______ (колонка 7) |
Таблица А.2 - Свойства эндоваскулярных устройств. Сосудистые стенты. Технические и клинические факторы оценки системы доставки
Система доставки | ||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 |
Возможность доступа | Проволочный проводник не перекрывает область поражения. | Ошибка доступа. | Совместимость размеров компонентов. | Оценка возможности доступа. | Оценка возможности доступа. | Профиль имплантата, размеры проволочного направителя, совместимые с системой доставки. |
Возможность раскрытия: расширяемые баллоном | Невозможность активации механизма раскрытия. | Отказ системы раскрытия. | Совместимость размеров компонентов. | Проверка эффективности раскрытия. | Проверка эффектив- | Для имплантатов, устанавливаемых пользователем, информация, предоставляемая изготовителем, должна включать рекомендации или спецификацию компонентов доставки. |
Смещение стента. | Номинальный износ баллона. | Информация должна включать рекомендации или спецификации вспомогательных устройств | ||||
Возможность раскрытия: саморасши- | Невозможность активации механизма раскрытия. | Отказ системы раскрытия. | Совместимость размеров компонентов. | Проверка эффективности раскрытия. | Проверка эффектив- | Для имплантатов, устанавливаемых пользователем, информация, предоставляемая изготовителем, должна включать рекомендации или спецификацию компонентов доставки. |
Возможность удаления: расширяемые баллоном | Некорректный спуск баллона. | Отказ системы доставки. | Прочность трубок при растяжении. | Проверка эффективности удаления. | Проверка эффектив- | Информация должна включать рекомендации или спецификации вспомогательных устройств |
Несоответствие диаметра. | Ишемия. | Прочность соединения при кручении. | Оценка неблагоприят- | Оценка клинических событий, подлежащих регистрации | ||
Возможность удаления: саморас- | Несоответствие диаметра. | Отказ системы доставки. | Прочность трубок при растяжении. | Проверка эффективности удаления. | Проверка эффектив- | Информация должна включать рекомендации или спецификации вспомогательных устройств |
Биосовмес- | Нарушение соответствую- | Осложнения, приводящие к нарушению биосовмести- | Серия ИСО 10993 | Серия ИСО 10993. | Оценка клинических событий, подлежащих регистрации | Н/П |
Оценка неблагоприят- | ||||||
Стерильность | Нестерильный продукт | Инфекция | Надежность стерилизации | Н/П | Оценка клинических событий, подлежащих регистрации | Соответствующие инструкции по обслуживанию. |
Гемостаз | Несоответствие размеров компонентов (ошибка в размерах). | Гематомы. | Оценка гемостаза. | Оценка соответствия размеров. | Оценка соответствия размеров. | Рекомендации по выбору размеров. |
Таблица А.3 - Свойства эндоваскулярных устройств. Сосудистые стенты. Технические и клинические факторы оценки стентов
Стент | ||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 |
Возможность точного раскрытия | Неточное расположение или ориентация. | Окклюзия ответвлений сосуда. | Моделирова- | Оценка визуализации. | Оценка визуализа- | Расположение и описание отметок контрастным веществом при их наличии |
Эффектив- | Неполное прилегание к стенкам сосуда. | Смещение стента. | Радиальная сила. | Оценка положения, целостности и функциональ- | Оценка положения, целостности и функцио- | Указания, касающиеся ограничений и требований к оценке соответствия фиксации |
Целостность стента | Разрушение конструкции стента, включая покрытие, если применимо. | Разрушение стента. | Усталость и прочность. | Оценка положения, целостности и функциональ- | Оценка положения, целостности и функцио- | Н/П |
Разрушение конструкции стента, включая покрытие, если применимо. | Обструкция просвета. | Визуальный осмотр. | Оценка неблагоприятных событий с особенным вниманием к событиям, перечисленным в колонке 3 | Оценка клинических событий, подлежащих регистрации | ||
Соответствие размеров | Некорректные размеры | Смещение стента. | Моделирова- | Проверка схемы определения размеров. | Оценка клинических событий, подлежащих регистрации | Рекомендации по определению размеров |
Проходи- | Перегиб. | Тромбоз стента. | Радиальная сила. | Оценка положения, целостности и функциональ- | Оценка положения, целостности и функцио- | Н/П |
Совмести- | Низкое качество изображения (артефакты). | Травма сосуда. | Совместимость с МРТ | Н/П | Оценка клинических событий, подлежащих регистрации | Описание безопасности при МРТ и совместимости устройства |
Биосовмес- | Потеря соответствую- | Нежелатель- | Серия ИСО 10993 | Серия ИСО 10993. | Оценка клинических событий, подлежащих регистрации | Список используемых материалов |
Стерильность | Нестерильный продукт | Инфекция | Обеспечение стерильности | Н/П | Оценка клинических событий, подлежащих регистрации | Соответствующие инструкции по обслуживанию. |
Выделение лекарств | Излишняя доставка лекарств. | Нежелатель- | Содержание/ | Оценка неблагоприятных событий с особенным вниманием к событиям, перечисленным в колонке 3. | Оценка клинических событий, подлежащих регистрации. | Наименование лекарства. |
Приложение В
(справочное)
Стендовые испытания и аналитические расчеты
Таблица В.1 - Стендовые испытания и аналитические расчеты
Испытания | Описание испытания и требований | Вид оценки конструкции |
Полная целостность покрытия | Оценивают способность покрытия выдерживать повреждения, связанные с загрузкой, прохождением, раскрытием и удалением системы доставки | 8.6.3 Целостность стента |
Оценка биосовместимости | Биосовместимость должна быть оценена в соответствии с ИСО 10993-1 и соответствующими другими частями серии международных стандартов ИСО 10993 | 8.5.4 Биосовместимость |
Оценка гемостаза | Оценивают способность всей изоляции или клапанов системы доставки поддерживать достаточную гемостатическую изоляцию при использовании с соответствующими вспомогательными устройствами | 8.5.5 Гемостаз |
Время спуска баллона | Оценивают время, необходимое для спуска баллона, и возможность удаления спущенного баллона | 8.5.2 Способность к раскрытию |
Время наполнения баллона | Определяют время, необходимое для наполнения баллона до максимального рекомендуемого давления, объема или диаметра наполнения | 8.5.2 Способность к раскрытию |
Среднее давление разрыва баллона | Определяют среднее давление разрыва | 8.5.2 Способность к раскрытию |
Номинальное давление разрыва баллона | Определяют номинальное давление разрыва с соответствующим коэффициентом запаса, учитывая параметры надежности баллона при использовании со стентом | 8.5.2 Способность к раскрытию |
Номинальный износ баллона | Оценивают способность баллона выдерживать клинически обоснованное число повторяющихся циклов наполнения до номинального давления разрыва | 8.5.2 Способность к раскрытию |
Прочность соединения | Определяют продольную силу соединения между частями системы доставки. Все соединения должны оставаться неповрежденными при рекомендуемых условиях эксплуатации | 8.5.1 Возможность доступа |
Размеры покрытия | Определяют соответствующие размеры покрытия стента и оценивают их соответствие спецификации конструкции | 8.6.3 Целостность стента |
Долговечность покрытия | Оценивают способность покрытия сопротивляться расслоению (например, свободные куски ткани и оголенные участки) при воздействии моделируемого худшего случая физиологического нагружения | 8.6.3 Целостность стента |
Образование частиц покрытия | Оценивают размер и число частиц, выделенных из покрытия при воздействии моделируемых условий in vivo | 8.6.3 Целостность стента |
Совместимость размеров компонентов | Определяют размеры системы доставки стента и проверяют на соответствие размерам рекомендуемых аксессуаров. Все компоненты должны быть совместимы по размерам | 8.5.1 Возможность доступа |
Соответствие стенкам сосуда | Оценивают способность имплантата поддерживать достаточный контакт - прилегание со стенками сосуда | 8.6.2 Эффективность фиксации |
Коррозия | Оценивают подверженность стента коррозии в моделируемой физиологической среде | 8.6.3 Целостность стента |
Длительная прочность при сжатии между двумя параллельно расположенными пластинами | Определяют нагрузку, необходимую для того, чтобы вызвать клинически значимый перегиб или смещение, эквивалентное уменьшению диаметра по крайней мере на 50%, и нагрузку, необходимую для постоянной деформации или полного разрушения стента | 8.6.2 Эффективность фиксации |
Длительная прочность при радиально прикладываемой нагрузке | Определяют характеристики нагружения/деформации для стента при воздействии круговой однородной радиальной нагрузки | 8.6.2 Эффективность фиксации |
Проверка размеров | Проверяют соответствующие размеры на соответствие спецификации конструкции | 8.5.1 Возможность доступа |
Сила отсоединения | Определяют силу, необходимую для вывода стента из исходного сжатого положения и полного отделения стента с нерасширенного баллона при моделировании условий клинического использования | 8.5.1 Возможность доступа |
Расширение концов | Определяют диаметр выходящей за пределы стента части баллона, превышающей внешний диаметр стента при максимальном рекомендуемом давлении наполнения | 8.5.2 Способность к раскрытию |
Содержание/количество лекарства | Определяют количество лекарства на стенте | 8.6.8 Выделение лекарств |
Идентификация лекарства | Определяют тип и чистоту лекарства и описывают тип и величину деградации при производстве и хранении | 8.6.8 Выделение лекарств |
Интенсивность выделения | Определяют количество лекарства, выделяемого за определенный период времени | 8.6.8 Выделение лекарств |
Испытание на усталостную прочность | Оценивают долгосрочную размерную и структурную целостность стента и покрытия | 8.6.3 Целостность стента |
Перегиб/скручивание | Оценивают способность стент-системы к изгибу на заранее определенный клинически обоснованный радиус или угол, который может потребоваться во время доступа и доставки | 8.5.1 Возможность доступа |
Сила, необходимая для раскрытия | Определяют силу, необходимую для раскрытия стента из системы доставки | 8.5.2 Способность к раскрытию |
Локальное сжатие | Определяют деформацию стента в ответ на локальное усилие сжатия, перпендикулярно приложенное к продольной оси устройства, если стент восстанавливает исходную геометрию после испытания | 8.6.2 Эффективность фиксации |
Безопасность и совместимость с МРТ | Оценивают безопасность и совместимость с МРТ | 8.6.6 Безопасность и совместимость с МРТ |
Профиль/диаметр | Определяют максимальный диаметр среди всех секций стент-системы | 8.5.1 Возможность доступа |
Влияние профиля/расширение | Определяют изменение расстояния между внешним диаметром стента и внешним диаметром баллона после прохождения по извилистым путям | 8.6.1 Способность к точному раскрытию |
Возможность проталкивания | Определяют способность проталкивания стент-системы или ее размещения оператором без существенного изгиба или перегиба | 8.5.1 Возможность доступа |
Радиальная сила | Сила, воздействующая на саморасширяющиеся стенты, должна быть измерена как функция от диаметра стента | 8.6.2 Эффективность фиксации |
Отдача | Определяют процентное изменение внешнего диаметра стента от максимального внешнего диаметра, полученного при наполненном баллоне, до конечного внешнего диаметра после удаления баллона. Рекомендуемая в ИПЭ схема определения размера стента должна учитывать эту отдачу | 8.6.2 Эффективность фиксации |
Моделирование использования | Оценивают рабочие характеристики стент-системы, используя модель, воспроизводящую предполагаемые условия использования | 8.5.1 Возможность доступа |
Соотношение диаметра и давления наполнения баллона | Для стентов, расширяемых баллоном, определяют соотношение между диаметром стента и давлением наполнения баллона | 8.6.4 Определение размеров |
Площадь поверхности, свободной от стента, и площадь внешней поверхности стента | Определяют площадь поверхности, открытой или свободной от стента, как функцию от диаметра стента и площадь контакта между стентом и сосудом | 8.6.5 Проходимость |
Соотношение длины и диаметра стента | Определяют соотношение между длиной стента и диаметром в расширенном состоянии | 8.6.1 Способность к точному раскрытию |
Исследование напряженно-деформированного состояния (например, методом конечных элементов) | Определяют критические напряжения и/или деформации на стенте, связанные с производством, загрузкой катетера, доставкой, раскрытием и нагрузками in vivo, используя соответствующие методы, такие как метод конечных элементов (Finite Element Analysis, FEA) | 8.6.3 Целостность стента |
Возможность вращения | Оценивают способность стент-системы обеспечивать достаточный поворот дистального (ведущего) окончания стента для доставки стента с учетом анатомии | 8.5.1 Возможность доступа |
Прочность соединения при кручении | Определяют крутящий момент/угол поворота, необходимый для разрушения соединений и/или материалов в соответствующих компонентах системы доставки | 8.5.1 Возможность доступа |
Возможность следования | Оценивают способность стент-системы следовать по сосудам в предполагаемую область, используя рекомендуемые принадлежности. | 8.5.1 Возможность доступа |
Прочность трубок при растяжении | Определяют прочность трубок, используемых в системе доставки, с учетом их материала (ИСО 10551-1 или близкие) | 8.5.3 Возможность удаления |
Видимость | Оценивают возможность визуализации системы доставки и/или стент-системы во время доступа, используя рентгеноскопию или методы визуализации, определенные в инструкции по использованию. Использование других методик визуализации должно быть обосновано | 8.5.1 Возможность доступа |
Визуальный осмотр | Оценивают возможность стента соответствовать спецификациям производителя относительно поверхностных дефектов и загрязнения, которые делают стент непригодным для его предполагаемого использования | 8.6.3 Целостность стента |
Приложение С
(справочное)
Определения клинических событий, подлежащих регистрации
В данном приложении приведен перечень клинических событий, подлежащих регистрации (перечень может быть не полным).
Таблица С.1 - Определения клинических событий, подлежащих регистрации
Событие | Определение |
Ошибка доступа | Сбой при достижении стентом предполагаемой области размещения, обусловленный механическим сбоем или анатомическими особенностями пациента |
Отказ вспомогательного устройства | Невозможность использования вспомогательного устройства по назначению из-за механического сбоя или анатомических особенностей пациента. Определяют, явились ли обстоятельства причиной неудачного раскрытия имплантата |
Неблагоприятная биологическая реакция (токсичность) на покрытие стента или выделение лекарств (если применимо) | Местная, локальная и/или системная токсическая реакция, обусловленная покрытием стента или выделением лекарств. Тип реакции должен быть зафиксирован |
Аневризма | Для истинных аневризм: расширение всего или стентированной части сосуда в два раза относительно исходного диаметра после процедуры; расширение менее чем в два раза относительно диаметра после процедуры также должно быть зафиксировано. |
Стенокардия | Боль, связанная с острым снижением коронарного кровотока и возникающая за грудиной или в областях иррадиации |
Аритмия | Развитие частых единичных и групповых предсердных и желудочковых экстрасистолий в течение 30 сут после процедуры, требующих лекарственной или электроимпульсной терапии |
Ателектаз/пневмония | Ателектаз или пневмония, подтвержденные исследованием с помощью рентгена, в течение 30 сут после процедуры и требующие лечения антибиотиками, ингаляциями, интубацией или отсасыванием. Надлежит зафиксировать вид необходимого лечения |
Окклюзия боковых ответвлений | Клинически значимое, незапланированное исключение основных боковых ответвлений |
Коагулопатия | Развитие неконтролируемого кровотечения, зафиксированное соответствующими лабораторными исследованиями в течение 30 сут после процедуры. Необходимо также отметить наличие специфических синдромов и лабораторных показателей крови |
Острая сердечная недостаточность | Развитие приступа острого снижения сердечного выброса или внезапное усугубление хронически сниженного сердечного выброса с развитием отека легких и дистальными отеками. Следует фиксировать начало, тип лечения, продолжительность и эффективность |
Повреждение стента | Повреждение стента, вызванное вспомогательным оборудованием или системой доставки |
Тромбоз глубоких вен | Тромбоз глубоких вен, зафиксированный дуплексным сканированием, флебографией или другими методами визуализации |
Сбой раскрытия (отказ системы раскрытия) | Невозможность полного раскрытия стента в предполагаемой области и/или удаления системы доставки, связанная с механическим сбоем или анатомическими особенностями пациента. Должно быть зафиксировано, успешно ли произошло раскрытие стента |
Эмболизация. | Перемещение в просвете сосудов инородных веществ, сопровождаемое клиническими проявлениями. Это категория, подлежащая регистрации, может охватывать диагностические и лечебные мероприятия, зафиксированные в других категориях |
Гематома | Развитие гематом, обусловленное эндоваскулярной процедурой, требующее хирургического вмешательства, удаления содержимого и/или переливания крови. Если пациенту требуется переливание, необходимо зафиксировать объем замещенной крови. Если требуется хирургическое вмешательство, это также должно быть зафиксировано |
Печеночная энцефалопатия | Неврологические нарушения, связанные с неадекватным метаболизмом печени |
Гипотензия | Низкое кровяное давление |
Импотенция | Субъективные заявления о невозможности вернуться к уровню сексуальной активности, зафиксированной до операции, в течение 6 мес после процедуры |
Рестеноз в сегменте | Существенное уменьшение диаметра просвета в любой точке по длине стента в дополнение к любому снижению диаметра просвета в пределах нестентированного прилегающего участка сосуда по сравнению с контрольным диаметром после процедуры. Должны быть определены степень сужения и метод визуализации |
Инфекция в области введения, глубокая | Инфекция области чрескожного или хирургического доступа, потребовавшая хирургической обработки раны или восстановления сосуда и проявившаяся в течение 30 сут после процедуры |
Инфекция в области введения, поверхностная | Инфекция области чрескожного или хирургического доступа, не включающая сосуд, через который осуществлялся доступ или глубокие мышцы и проявившаяся в течение 30 сут после процедуры |
Рестеноз в стенте | Существенное уменьшение диаметра просвета в любой точке по длине стента по сравнению с контрольным диаметром после процедуры. Должны быть определены степень сужения и метод визуализации |
Ишемия | Развитие клинической картины острой или хронической ишемии в течение 30 сут после процедуры. Причина ишемии должна быть определена и зафиксирована (т.е. эмболизация, тромбоз или расслоение). Примеры включают, но не ограничиваются, ишемию конечностей, брыжейки, почек |
Обструкция просвета | Непредусмотренная обструкция потока через просвет сосуда из-за перегиба или скручивания протеза, неправильного размера, нарушения полного открытия имплантата или другой причины |
Отдаленная летальность | Смерть, наступившая более чем через 30 сут после процедуры, обусловленная стентом |
Кистозная лимфангиома/лимфатическая фистула | Кистозное накопление лимфы или нарушение дренирования раны, возникающее в области разреза. Любые вмешательства с целью улучшения дренирования раны |
Неправильное расположение стента | Существенная часть стента не находится в прямом контакте со стенками сосуда. Отмечают время с момента выполнения процедуры |
Инфаркт миокарда | Инфаркт миокарда, подтвержденный клинически, электрокардиографически (ЭКГ) и по содержанию ферментов в крови в течение 30 сут после процедуры. Клинические симптомы и данные ЭКГ необходимо фиксировать |
Неврологические расстройства | Развитие преходящих или постоянных неврологических расстройств, возникающих и фиксируемых в течение 30 сут после процедуры. Нарушения диагностируются сканированием КТ и МРТ на фоне клинических проявлений |
Процедурная госпитальная летальность | Смерть от любых причин, наступившая в течение 30 сут после процедуры |
Постоперационное кровотечение | Кровотечение, связанное с процедурой, требующее переливания крови, возникшее после того, как пациент покинул операционную. Необходимо зафиксировать объем замещенной крови, источник кровотечения и потребовалось или нет хирургическое вмешательство для остановки кровотечения |
Операционное кровотечение | Любая потеря крови, связанная с хирургическим вмешательством. Необходимо определить объем кровопотери во время процедуры на основании отчета об операции. Необходимо зафиксировать необходимость переливания и источник (банк крови, аутологическая или аутотрансфузионная) переливаемой крови |
Легочная эмболия | Клинические свидетельства легочной эмболии, подтвержденные ВП сканированием или ангиографией, возникшие в течение 30 сут после процедуры |
Рецидив портальной гипертензии | Повторное развитие высокого кровяного давления в системе портальных вен |
Отказ почек | Рост креатинина более чем на 50% выше дооперационного уровня и верхней границы нормы, не восстанавливающийся спонтанно самостоятельно. Необходимо также зафиксировать необходимость и продолжительность диализа |
Остаточный стеноз | Сужение просвета более 30% по сравнению с нормальным диаметром сосуда сразу после завершения процедуры стентирования. Определяют степень сужения и метод визуализации |
Отказ легких | Необходимость искусственной вентиляции через сутки после процедуры и необходимость повторной интубации с искусственной вентиляцией легких в любое время от первых суток до 30 сут после операции (за исключением пациентов, зависимых от искусственной вентиляции легких, при включении в исследование). Необходимо зафиксировать продолжительность искусственной вентиляции легких |
Рестеноз | Существенное снижение диаметра просвета относительно контрольного диаметра после процедуры. Определяют степень сужения и метод визуализации |
Спинномозговые неврологические расстройства | Неврологические расстройства, связанные с ишемией спинного мозга, развившиеся в течение 30 сут после процедуры |
Разрушение стента | Разлом на части или разрушение любой части стента |
Инфицирование стента | Развитие хронической инфекции на стенте, произошедшее в любое время после размещения стента. Следует зафиксировать этиологию (стерильность устройства, эндокардиты и т.д.) |
Смещение стента | Продольное смещение всех частей стента, приводящее к клиническим симптомам |
Тромбоз стента | Гемодинамически значимое образование тромбов в просвете стента, случившееся в любое время после размещения стента. Определяют степень сужения, время начала тромбообразования относительно времени выполнения процедуры и метод визуализации |
Повреждение прилежащих структур | Повреждение прилежащих структур, связанное с травмой сосуда (см. определение ниже) |
Травма сосуда | Повреждение сосудов в результате эндоваскулярных процедур, включая отсечение или перфорацию, ложные и истинные аневризмы. Определенное место или источник повреждения, а также клинические осложнения должны быть зафиксированы. Необходимо также зафиксировать все необходимые хирургические или иные вмешательства, необходимые для восстановления повреждения |
Окклюзия сосуда, процедурная | Препятствие кровотоку. Может быть вызвано перегибом или скручиванием стента, сбоем полного раскрытия стента, расслоением или любыми другими причинами. Определяют метод визуализации |
Окклюзия сосуда, отдаленная | Окклюзия потока, случившаяся через более чем 30 сут после процедуры. Может быть вызвана перегибом или скручиванием стента, гиперплазией интимы, расслоением или любыми другими причинами. Определяют время окклюзии и метод визуализации |
Окклюзия сосуда, процедурная | Окклюзия потока в пределах целевого или другого сосуда, для которого предварительно зафиксирована проходимость, случившаяся в течение 30 сут после процедуры. Может быть вызвана перегибом или скручиванием стента, расслоением или любыми другими причинами. Определяют время окклюзии и метод визуализации |
Приложение D
(справочное)
Методы испытаний
D.1 Общие положения
Информация, включенная в данное приложение, предназначена для руководства по доклиническим испытаниям in vitro, выполняемым для верификации конструкции стент-системы, и оформлению отчета. Общепризнано, что не все испытания, приведенные в данном приложении, применимы ко всем конструкциям стент-систем. Кроме того, испытания, предназначенные для проверки того, что устройство соответствует требованиям настоящего стандарта при производстве, могут быть проведены не в соответствии с деталями, приведенными в данном приложении.
Для обеспечения согласованности при испытании устройства рекомендуется использовать методы, рекомендуемые в данном приложении. Если используются альтернативные методы, их следует обосновать.
В некоторых случаях один или более методов испытаний, приведенные в тексте настоящего стандарта, объединены в один метод. При разработке данных методов испытания было выявлено, что их следует объединить для отражения способа, которым обычно проводятся данные испытания. Также было выявлено, что дополнительные методы могут быть объединены, если проводятся испытания специфичных устройств. Для испытаний, проводимых одновременно, отчет должен включать отдельные результаты испытания для каждого испытания, приведенного в тексте настоящего стандарта.
Некоторые из требований в тексте настоящего стандарта не связаны с методами испытания в данном приложении: или не стандартизирована методика, либо они рассматриваются другими стандартами (например, совместимость с МРТ, фармакокинетика для стентов, выделяющих лекарства).
Использование глагола "должен" указывает на то, что требования должны строго выполняться при оценке соответствия рекомендуемому методу испытания.
D.2 Отбор образцов
Должен быть применен план отбора образцов, гарантирующий, что для каждого измеряемого параметра будет получена корректная выборка данных. Конструктивные характеристики испытательного образца должны быть проверены на то, что они являются характерными для устройств с учетом всех размеров, конфигурации и компонентов.
Выборка должна представлять весь диапазон конструкций устройств и не обязательно требует испытания каждого размера. Размеры стента, выбранного для испытания, должны представлять худший случай (случаи) комбинации диаметра и длины для каждого испытания. Должно быть приведено обоснование отбора образцов. Может потребоваться проведение анализа для идентификации размера(ов) устройств с наибольшей вероятностью отказа.
Выборка должна обеспечивать корректное представление ожидаемой вариабельности при изготовлении устройств.
Для испытаний с определенными параметрами достоверности и надежности объем выборки должен иметь статистическое обоснование. Для всех испытаний число образцов должно быть обосновано.
Дополнительные рекомендации по отбору образцов включены в каждый метод испытания, если это необходимо.
D.3 Воздействие определенных условий на испытуемые образцы
Все образцы должны быть подвергнуты стерилизации, включая многократную стерилизацию, если применимо, если не приведено обоснование использования нестерилизованных продуктов.
Образцы следует подвергнуть условиям, которые встречаются при нормальном использовании и могут повлиять на результаты испытания. Воздействие условий может включать загрузку стента на или в катетер для доставки, предварительное воздействие условий на стент-систему в соответствии с рекомендациями в инструкции по применению (ИПП), однократное или многократное прохождение по анатомической модели и раскрытие стента.
Если необходимо, следует использовать искусственную физиологическую среду (например, водяная баня с температурным контролем).
D.4 Составление отчета
В рамках данного приложения составление отчета определено требованиями национальных контролирующих органов.
Отчет по испытаниям для доклинических испытаний in vitro должен включать в себя резюме выполненных испытаний. Резюме должно содержать описание испытаний с обоснованием пропуска какого-либо из испытаний, определенного в приложении В, или выбора альтернативных испытаний. Информация, содержащаяся в каждом отчете по испытаниям, должна базироваться на заранее согласованной форме протокола испытания.
Должна быть составлена сводка результатов с критериями приемки и любыми вероятными клиническими значениями результатов; она может быть представлена в виде таблицы. При определении критериев приемки следует учитывать анатомические, физиологические и морфологические условия предполагаемого использования. Должны быть приведены обоснование и клиническая применимость критериев приемки для каждого проводимого испытания. Должно быть приведено содержание, страницы должны быть последовательно пронумерованы.
Отдельный отчет по испытанию должен включать следующую информацию:
a) цель: определение цели испытания в соответствии с настоящим стандартом;
b) материалы: перечень всех материалов (например, стендовые образцы с номером лота/серийным номером или другими соответствующими средствами прослеживаемости, оборудование), применяемые при проведении испытаний с использованием рисунков и схем, если необходимо;
c) отбор образцов: определение плана отбора образцов, включая обоснование выбора и число испытуемых образцов; выбор стендовых образцов следует обосновать (например, по размерам, состоянию);
d) критерии приемки: определение критериев приемки результатов испытания;
e) метод испытания: подробное описание метода испытания, используемого при проведении испытания, включая любые предварительно определенные процедуры инспекции и обоснование критических параметров испытания;
f) отклонения от протокола: описание любых отклонений и их вероятная значимость при интерпретации результатов;
g) представление результатов: описание результатов испытания, выраженных в единицах, получаемых при данном методе испытания;
h) заключение: заключение, основанное на сравнении результатов с критериями приемки, учитывая любую вероятную клиническую значимость этих результатов.
D.5 Методы испытаний
Примечание - В контексте D.5 глагол "должен" показывает, что требования должны быть строго выполнены для соответствия рекомендуемому методу испытания.
D.5.1 Стент-система
D.5.1.1 Проверка размеров и совместимости компонентов по размерам
D.5.1.1.1 Цель
Целью данного испытания является определение размеров стент-системы, включая, но не ограничиваясь, внешний диаметр, диаметр просвета проводника и его необходимую длину, для верификации спецификации конструкции и для оценки совместимости по размерам между стент-системой и рекомендуемыми вспомогательными устройствами, перечисленными в ИПП. При оценке дизайна конструкции следует учитывать положения 8.5.1, 8.5.2, 8.5.3, 8.5.5.
D.5.1.1.2 Материалы
D.5.1.1.2.1 Стент-система.
D.5.1.1.2.2 Вспомогательные устройства, необходимые для выполнения раскрытия в соответствии с ИПП.
D.5.1.1.2.3 Оборудование для измерения диаметров (например, микрометр, оптический проектор профиля, лазерный микрометр, соответствующие калибры профиля), способное выполнять измерения с точностью до 10% определенного допуска или до 1% измеренного значения. Если определен допуск, следует использовать меньшее из полученных в процентах значений.
D.5.1.1.2.4 Оборудование для измерения длины, способное выполнять измерения с точностью 10% определенного допуска или 1% измеренного значения. Если определен допуск, следует использовать меньшее из полученных в процентах значений.
D.5.1.1.2.5 Проволочный сердечник/концевой калибр (для внутреннего просвета системы доставки), способный выполнять измерения с точностью до 10% определенного допуска или до 1% измеренного значения. Если определен допуск, то следует использовать меньшее из полученных в процентах значений.
D.5.1.1.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.1.1.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3.
D.5.1.1.5 Метод испытаний
Следует разработать метод испытания на основе следующих процедур:
a) вставляют соответствующий проволочный направитель или соответствующий по размеру сердечник в просвет стент-системы для проверки диаметра просвета и совместимости проволочного направителя;
b) измеряют максимальный внешний диаметр стент-системы, используя соответствующие измерительные инструменты, или проверяют соответствие внешнего диаметра калибру профиля соответствующего размера; необходимо измерить только ту область стент-системы, которая должна проходить через определенную оболочку интродьюсера, и следует учитывать возможную ассиметрию;
c) измеряют длину стент-системы; необходимо измерить только ту область стент-системы, которая должна проходить через определенную оболочку интродьюсера;
d) измеряют все другие необходимые размеры;
e) проверяют совместимость с рекомендуемыми вспомогательными компонентами всех типов.
D.5.1.1.6 Представление результатов
Длина должна быть выражена в сантиметрах. Другие размеры должны быть выражены в миллиметрах. Должны быть зафиксированы результаты, касающиеся совместимости рекомендуемых вспомогательных устройств, и результаты проверки диаметра просвета и внешнего диаметра, если применимо.
D.5.1.1.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать максимум, минимум, среднее и стандартное отклонения всех измеренных размеров, результаты любых проверок размеров и результаты наблюдения совместимости вспомогательных устройств.
Примечание - Для дополнительного руководства см. ASTM F2081-01 [23].
D.5.1.2 Испытание профиля/диаметра
D.5.1.2.1 Цель
Целью данного испытания является определение максимального диаметра среди всех частей стент-системы для оценки совместимости по размерам между стент-системой и сосудами, включая обрабатываемую область повреждения. При оценке конструкции учитывают положения 8.5.1.
D.5.1.2.2 Материалы
D.5.1.2.2.1 Стент-система.
D.5.1.2.2.2 Оборудование для измерения диаметров (например, микрометр, оптический проектор профиля, лазерный микрометр), способное выполнять измерения с точностью 10% определенного допуска или 1% измеренного значения. Если определен допуск, следует использовать меньшее из полученных значений в процентах.
D.5.1.2.2.3 Рекомендуемый тип проводника или его эквивалент, если применимо.
D.5.1.2.3 Отбор образцов
Отбор образцов должен проводиться в соответствии с положениями D.2.
D.5.1.2.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3.
D.5.1.2.5 Метод испытаний
Должен быть разработан метод испытаний на основе следующих действий:
a) если применимо, вставляют соответствующий проволочный направитель в стент-систему так, чтобы он выходил за окончание стент-системы;
b) измеряют максимальный внешний диаметр стент-системы. Следует обратить внимание на возможность асимметрии; необходимо измерить область, которая должна проходить по сосуду и/или через область повреждения, и область, содержащую стент.
D.5.1.2.6 Представление результатов
Измеренные диаметры должны быть выражены в миллиметрах.
D.5.1.2.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать максимум, минимум, среднее и стандартное отклонения измеренного внешнего диаметра стент-системы и диаметра области, содержащей стент каждого испытуемого размера.
Примечание - Для дополнительного руководства см. ASTM F2081-01 [23].
D.5.1.3 Моделирование использования
D.5.1.3.1 Цель
Целью данного испытания является оценка рабочих характеристик стент-системы с использованием модели(ей), которая моделирует условия предполагаемого использования. Испытание касается требований к качественной оценке моделирования использования, перегиба/перекручивания, возможности проталкивания, возможности кручения и возможности следования стент-системы. Также должна быть оценена совместимость раскрытого стента со стенками сосуда. При оценке конструкции учитывают положения 8.5.1, 8.5.2, 8.5.3, 8.6.1, 8.6.2, 8.6.4 и 8.6.5.
D.5.1.3.2 Материалы
D.5.1.3.2.1 Стент-система.
D.5.1.3.2.2 Вспомогательные устройства, необходимые для выполнения раскрытия в соответствии с ИПП.
D.5.1.3.2.3 Анатомическая модель, которая включает пути доставки и место раскрытия. При разработке модели необходимо учитывать искривленность и извитость предполагаемой области размещения стента и путей доставки. Необходимо учитывать использование деформируемой модели.
D.5.1.3.2.4 Контур с возможностью подачи воды, способный подавать воду или соответствующую жидкость при физиологической температуре (37±2) °С с пульсирующим давлением, с антеградным или ретроградным потоком, если применимо.
D.5.1.3.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.1.3.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3.
D.5.1.3.5 Метод испытаний
Следует разработать метод испытаний на основе следующих действий:
a) подсоединяют анатомическую модель к контуру с водой и позволяют испытательной системе стабилизироваться (например, по температуре, давлению);
b) вставляют соответствующие вспомогательные устройства (например, проволочный направитель, тело интродьюсера) в контур;
c) используют ИПП, вводят, доставляют и раскрывают стент в модели и удаляют систему доставки;
d) оценивают легкость продвижения системы доставки в модели (возможность проталкивания), возможность передачи поворота с проксимального на дистальный конец катетера (возможность поворота), если применимо, и возможность системы доставки следовать по проводнику во время введения в области изгибов модели (возможность следования);
e) отмечают любые отклонения от нормы, такие как перекручивание или перегиб системы, невозможность полного и точного раскрытия стента, смещение стента во время удаления системы доставки и любые другие соответствующие наблюдения;
f) осматривают раскрытый стент в анатомической модели; отмечают соответствие стенкам сосуда модели, точность размещения, перекручивание, перегиб, непредусмотренный изгиб, чрезмерное непредусмотренное неоднородное расширение стента, отделение компонентов, любые повреждения и любые другие критические наблюдения;
g) осматривают систему доставки, отмечают любые повреждения и любые другие критические наблюдения;
h) для оценки доставки и раскрытия составных стентов повторяют этапы с)-g) с дополнительными стент-системами.
D.5.1.3.6 Представление результатов
Для каждого испытания должны быть зафиксированы все критические наблюдения и параметры возможности доступа, раскрытия и удаления стент-системы.
D.5.1.3.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать в себя все критические наблюдения и параметры возможности доступа, раскрытия и удаления стент-системы. Должны быть зафиксированы критические наблюдения, касающиеся составных или находящих друг на друга стентов при необходимости. Должна быть определена испытательная жидкость. Должны быть отдельно зафиксированы результаты для перегиба/перекручивания, возможности проталкивания, возможности кручения (если применимо) и возможности следования стент-системы, а также соответствие стента стенкам сосуда. Отчет должен содержать описание используемой анатомической модели, включая геометрию и материалы конструкции.
D.5.1.4 Визуализация
D.5.1.4.1 Цель
Целью данного испытания является оценка возможности визуализации стент-системы и/или стента с использованием методов получения изображения, определенных в ИПП. При оценке конструкции учитывают положения 8.5.1, 8.5.2, 8.5.3 и 8.6.1.
D.5.1.4.2 Материалы
D.5.1.4.2.1 Стент-система.
D.5.1.4.2.2 Фантом как модель тканей или эквивалент, с соответствующими вспомогательными устройствами, такими как радиоизотопные маркеры и линейка.
D.5.1.4.2.3 Система визуализации, способная работать на уровнях энергии, соответствующих клиническому использованию.
Примечание - Визуализация существенно зависит от различного оборудования и параметров настройки. При выборе оборудования, используемого для данной оценки, следует учитывать эту вариабельность.
D.5.1.4.2.4 Вспомогательные устройства, необходимые для выполнения раскрытия в соответствии с ИПП.
D.5.1.4.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.1.4.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3.
D.5.1.4.5 Метод испытаний
Следует разработать метод испытаний на основе следующего алгоритма действий:
a) располагают стент-систему и модельный фантом ткани так, чтобы моделировать клинические условия;
b) используют систему визуализации для визуализации стент-системы и любых радиоизотопных маркеров;
c) качественно оценивают уровень видимости изображения; например, степень видимости можно оценить по расположению четких концов, ориентации критических точек и/или частей стент-системы; альтернативно, степень видимости можно сравнить с определенным контрольным устройством;
d) повторяют этапы а)-с) для стента во время раскрытия и после удаления системы доставки.
D.5.1.4.6 Представление результатов
Это качественная оценка. Следует зафиксировать степень видимости всех применимых компонентов на различных этапах испытания и любые сравнения, проведенные при определенном контроле.
D.5.1.4.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать в себя оценку видимости и визуальные результаты (например, характерные флюорографические изображения). Отчет по испытаниям должен также включать марку и модель оборудования для визуализации, параметры настроек и подробное описание модельного фантома ткани.
D.5.1.5 Усилие раскрытия
D.5.1.5.1 Цель
Целью данного испытания является определение силы, необходимой для раскрытия саморасширяющихся стентов. Должны быть оценены все применимые этапы процесса раскрытия. При оценке конструкции учитывают положения 8.5.2.
D.5.1.5.2 Материалы
D.5.1.5.2.1 Стент-система.
D.5.1.5.2.2 Вспомогательные устройства, необходимые для выполнения раскрытия в соответствии с ИПП.
D.5.1.5.2.3 Анатомическая модель, которая включает пути доставки и место раскрытия. При разработке модели необходимо учитывать искривленность и извитость предполагаемой области размещения стента и путей доставки.
D.5.1.5.2.4 Устройства для измерения силы (например, датчики силы, универсальная механическая испытательная система), способные измерять силу с точностью до ±5% полученного (измеренного) значения.
D.5.1.5.2.5 Зажимной фиксатор.
D.5.1.5.2.6 Среда с контролируемой температурой (37±2) °С.
D.5.1.5.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2. Испытуемые устройства должны представлять худший случай условий для силы раскрытия (например, наибольший объем оболочки или покрытия, максимальное значение сжатия). При выборе устройства для испытания следует учитывать диаметр и длину устройства.
D.5.1.5.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3.
D.5.1.5.5 Метод испытания
Следует разработать метод испытаний на основе следующего алгоритма действий:
a) подготавливают стент-систему в соответствии с ИПП;
b) вставляют стент-систему в анатомическую модель;
c) фиксируют центр или проксимальный конец стент-системы таким образом, чтобы она оставалась стационарной во время испытания;
d) соединяют механизм раскрытия с оборудованием, измеряющим нагрузку;
e) дают устройству стабилизироваться при физиологических температурах;
f) начинают и завершают раскрытие в соответствии с ИПП со скоростью, моделирующей клиническое использование, измеряя силу, необходимую для раскрытия саморасширяющегося стента;
g) фиксируют любые отклоняющиеся от нормы наблюдения (например, перегиб) для каждого испытательного образца.
D.5.1.5.6 Представление результатов
Максимальная сила на каждом этапе, необходимая для раскрытия стента, должна быть зафиксирована в ньютонах. Также фиксируют все критические наблюдения (например, перегиб) для каждого испытанного образца.
D.5.1.5.7 Отчет о проведении испытаний
Отчет по испытаниям должен соответствовать положениям D.4 и включать максимум, минимум, среднее и стандартное отклонения силы, необходимой для раскрытия, и любые критические наблюдения.
D.5.1.6 Время наполнения и спуска баллона (стенты, расширяемые баллоном или с помощью баллона)
D.5.1.6.1 Цель
Целью данного испытания является определение времени, необходимого для наполнения баллона до максимального рекомендуемого давления, объема или диаметра наполнения, и измерение времени, необходимого для спуска баллона. Это испытание предоставляет информацию, которая может быть клинически полезной при планировании лечения (например, вероятное время окклюзии). При оценке конструкции учитывают положения 8.5.2.
Примечание - Это испытание также может быть важным при оценке возможности удаления.
D.5.1.6.2 Материалы
D.5.1.6.2.1 Стент-система.
D.5.1.6.2.2 Рекомендуемый проволочный направитель или эквивалент.
D.5.1.6.2.3 Водяная баня с контролем температуры (37±2) °С.
D.5.1.6.2.4 Контрастная среда в соответствии с инструкцией по эксплуатации (ИПП).
D.5.1.6.2.5 Устройство наполнения, шприц или эквивалент, снабженное средствами измерения давления или объема с точностью до ±5% полученного значения и поддержания давления или объема наполнения.
D.5.1.6.2.6 Жесткая трубка, диаметр которой соответствует максимальному диаметру стента или сосуда, рекомендуемым для соответствующего испытуемого баллона. Трубок не требуется при испытании полу- и недеформируемых баллонов.
D.5.1.6.2.7 Таймер с точностью до ±0,2 с.
D.5.1.6.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.1.6.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3.
D.5.1.6.5 Метод испытаний
Следует разработать метод испытаний на основе следующего алгоритма действий:
a) подготавливают стент-систему;
b) вставляют соответствующий проводник в устройство;
c) погружают устройство в водяную баню и вставляют в жесткую трубку, если применимо;
d) дают ему достичь равновесия при температуре испытания;
e) наполняют баллон в соответствии в ИПП с определенной скоростью, моделируя клиническую практику использования;
f) определяют время наполнения баллона до максимального давления, объема или диаметра наполнения в соответствии с ИПП;
g) спускают баллон в соответствии с ИПП и определяют время спуска баллона.
D.5.1.6.6 Представление результатов
Время наполнения и спуска баллона должно быть выражено в секундах.
D.5.1.6.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать максимум, минимум, среднее и стандартное отклонения времени наполнения и спуска баллона. Также необходимо зафиксировать определение конечных точек наполнения и спуска. Должны быть зафиксированы жидкость, используемая для наполнения, давление и скорость наполнения. Должны быть зафиксированы любые отклонения.
D.5.1.7 Номинальное давление разрыва баллона (стенты, раскрываемые баллоном или с помощью баллона)
D.5.1.7.1 Цель
Целью данного испытания является определение номинального давления разрыва баллона при использовании со стентом. При оценке конструкции учитывают положения 8.5.2.
D.5.1.7.2 Материалы
D.5.1.7.2.1 Стент-система.
D.5.1.7.2.2 Водяная баня с контролем температуры (37±2) °С.
D.5.1.7.2.3 Жидкость для наполнения, например, вода комнатной температуры.
D.5.1.7.2.4 Механизм определения утечки, например, краска в жидкости для испытания, устройство, контролирующее падение давления, устройство, контролирующее скорость потока.
D.5.1.7.2.5 Устройство наполнения, шприц или эквивалент, снабженное средствами измерения давления с точностью до ±5% полученного значения и поддержания давления наполнения.
D.5.1.7.2.6 Таймер с точностью до ±1 с.
D.5.1.7.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.1.7.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3.
D.5.1.7.5 Метод испытания
Следует разработать метод испытаний на основе следующего алгоритма действий:
a) подготавливают стент-систему;
b) погружают устройство в водяную баню;
c) дают ему достичь равновесия при температуре испытания;
d) наполняют баллон с надетым стентом или в пределах соответствующего стента для раскрытия с помощью баллона до значения менее чем оцененное номинальное давление разрыва; выдерживают давление наполнения постоянным в течение не менее 10 с и осматривают баллон на предмет утечек или разрыва;
e) если не отмечено утечек, увеличивают давление на шаг увеличения, соответствующий испытуемому баллону, и выдерживают давление в течение 10 с;
f) повторяют этап е), пока не возникнет утечка или разрыв; любая устойчивая утечка или снижение давления, связанные с повреждением баллона, корпуса, проксимальной или дистальной изоляции, в рамках данного испытания должны считаться отказом ("разрывом"); фиксируют давление разрыва и описывают положение и вид отказа (например, утечка через изоляцию, разрыв баллона, разделение на части);
g) повторяют это испытание с достаточным числом образцов;
h) вычисляют номинальное давление разрыва; для стентов, расширяемых баллоном, номинальное давление разрыва основывается на результатах данного испытания, которое статистически показывает, что с достоверностью по крайней мере 95% 99,9% баллонов не разорвутся при данном значении давления или ниже.
Номинальное давление разрыва может быть вычислено следующим образом.
Используют односторонний критерий значимости для нормального распределения:
![]() ,
,
где - коэффициент одностороннего критерия значимости для нормального распределения (
находится по статистическим таблицам и зависит от
,
и
);
= 0,999 (99,9%);
= 0,95 (95% достоверность);
- число испытанных баллонов;
- среднее давление разрыва баллона;
- стандартное отклонение давления разрыва баллона.
Для стентов, раскрываемых с помощью баллона, можно обойтись меньшей надежностью.
D.5.1.7.6 Представление результатов
Отдельные давления разрыва и номинальное давление разрыва должны быть выражены в килопаскалях. Вычисляют среднее и стандартное отклонения давления разрыва. Для определения номинального давления разрыва необходимо использовать соответствующие параметры достоверности и надежности.
D.5.1.7.7 Отчет о проведении испытаний
D.5.1.7.8 Отчет по испытанию должен соответствовать положениям D.4 и включать в себя среднее давление разрыва, вычисленное номинальное давление разрыва, максимум, минимум и стандартное отклонение давления разрыва и все наблюдаемые виды отказа. Если определены меньшие параметры надежности, должно быть приведено обоснование выбора этих параметров.
Примечание - Дополнительные руководства можно найти в ИСО 10555-4 [5].
D.5.1.8 Номинальный износ баллона (стенты, расширяемые баллоном или с помощью баллона)
D.5.1.8.1 Цель
Целью данного испытания является определение способности баллона выдерживать повторяющиеся циклы наполнения. При оценке конструкции учитывают положения 8.5.2.
Примечание - Это испытание также может быть важным при оценке возможности удаления.
D.5.1.8.2 Материалы
D.5.1.8.2.1 Стент-система.
D.5.1.8.2.2 Водяная баня с контролем температуры (37±2) °С.
D.5.1.8.2.3 Жидкость для наполнения, например, вода комнатной температуры.
D.5.1.8.2.4 Механизм определения утечки, например краска в жидкости для испытания, устройство, контролирующее падение давления, устройство, контролирующее скорость потока.
D.5.1.8.2.5 Устройство наполнения, шприц или эквивалент, снабженное средствами измерения давления с точностью до ±5% измеренного значения, способное поддерживать давление наполнения.
D.5.1.8.2.6 Податливая трубка (с соответствующей клинической податливостью), диаметр которой соответствует максимальному диаметру испытуемой стент-системы для того, чтобы удерживать стент от излишнего перемещения во время цикла наполнения.
D.5.1.8.2.7 Таймер с точностью ±1 с.
D.5.1.8.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.1.8.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3.
D.5.1.8.5 Метод испытаний
Следует разработать метод испытаний на основе следующих действий:
a) подготавливают стент-систему;
b) погружают устройство в водяную баню и вставляют в податливую трубку;
c) дают ему достичь равновесия при температуре испытания;
d) используя скорость наполнения, соответствующую клиническому использованию, наполняют баллон до максимального давления, объема или диаметра, как указано в ИПП, как минимум, на 30 с или на время, установленное в ИПП.
Примечание - Если в ИПП установлен более длительный промежуток времени, чем 30 с, для испытания должен использоваться определенный промежуток времени, если не приведено адекватное обоснование меньшей продолжительности;
e) спускают баллон, используя скорость, соответствующую клиническому использованию;
f) повторяют этапы d) и е) для баллона внутри стента минимум 10 циклов;
g) если во время испытания возникает постоянная утечка или падение давления или объема, записывают число циклов и вид отказа; любая подобная утечка или падение давления, связанные с отказом баллона, корпуса, проксимальной или дистальной изоляции, в рамках данного испытания должны считаться отказом.
D.5.1.8.6 Представление результатов
Использованный максимальный диаметр или давление наполнения должны быть выражены: диаметр - в миллиметрах, давление - в килопаскалях или атмосферах.
D.5.1.8.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать число успешно завершенных циклов, максимальное число циклов, ожидаемое при клиническом использовании, любые наблюдаемые виды отказа и максимальный диаметр или давление наполнения.
Примечание - Для дополнительного руководства см. ИСО 10555-4 [5].
D.5.2 Система доставки
D.5.2.1 Прочность соединения
D.5.2.1.1 Цель
Целью данного испытания является определение прочности соединения шарнирных и/или неподвижных соединений системы доставки. При оценке конструкции учитывают положения 8.5.1, 8.5.2 и 8.5.3.
D.5.2.1.2 Материалы
D.5.2.1.2.1 Система доставки или соответствующие компоненты с шарнирными и/или неподвижными соединениями.
D.5.2.1.2.2 Универсальная механическая испытательная система, оборудованная соответствующим датчиком силы, способным измерять силу с точностью до ±5% измеренного значения, с постоянной скоростью перемещения траверсы и соответствующими зажимными фиксаторами.
D.5.2.1.2.3 Среда с контролируемой температурой (37±2) °С, если применимо.
D.5.2.1.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.2.1.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3.
D.5.2.1.5 Метод испытаний
Для соединений, подвергаемых воздействию физиологических температур, испытание следует проводить при температуре (37±2) °С или сразу после выдержки при данной температуре.
Следует разработать метод испытаний на основе следующих действий:
a) используя механическую испытательную систему с соответствующей скоростью перемещения траверсы (захватов), например, 200 мм/мин, прилагают нагрузку к соединению до тех пор, пока не разрушится соединение или не нарушится функциональная целостность;
b) записывают пиковое усилие, при котором произошел отказ, и описывают вид и расположение отказа.
D.5.2.1.6 Представление результатов
Сила соединения должна быть выражена в ньютонах.
D.5.2.1.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать тип и положение отказа, максимум, минимум, среднее и стандартное отклонения силы соединения.
Примечание - Для дополнительного руководства см. ИСО 10555-1 [2].
D.5.2.2 Прочность соединения при кручении
D.5.2.2.1 Цель
Целью данного испытания является определение прочности соединения при кручении шарнирных и/или неподвижных соединений системы доставки. При оценке конструкции учитывают положения 8.5.1 и 8.5.3.
D.5.2.2.2 Материалы
D.5.2.2.2.1 Система доставки или соответствующие компоненты с шарнирными и/или неподвижными соединениями.
D.5.2.2.2.2 Рекомендуемый проволочный проводник или эквивалент, если применимо.
D.5.2.2.2.3 Испытательная система на кручение, оборудованная соответствующим датчиком, способным проводить измерения с точностью до ±5% измеренного значения.
D.5.2.2.2.4 Среда с контролируемой температурой (37±2) °С, если применимо.
D.5.2.2.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.2.2.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3.
D.5.2.2.5 Метод испытаний
Для соединений, которые подвергаются воздействию физиологических температур, испытания должны проводиться при (37±2) °С.
Следует разработать метод испытаний на основе следующих действий:
a) вставляют проводник в систему доставки или ее компоненты, если применимо;
b) фиксируют один конец испытуемого образца в зажимах аппарата;
c) подсоединяют другой конец испытуемого образца к датчику крутящего момента;
d) прикладывают крутящий момент (силу скручивания) с характеристиками скорости, используемыми при типичном клиническом раскрытии, к одному концу образца до тех пор, пока не сломается соединение и/или система доставки или не нарушится функциональная целостность;
e) записывают значение крутящего момента, при котором произошел отказ, вид и расположение отказа.
D.5.2.2.6 Представление результатов
Сила соединения на кручение должна быть выражена в ньютонах на метр.
D.5.2.2.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать тип и положение отказа, максимум, минимум, среднее и стандартное отклонения силы соединения на кручение.
D.5.3 Стент
D.5.3.1 Соотношение диаметра стента и давления наполнения баллона
D.5.3.1.1 Цель
Целью данного испытания является определение соотношения между диаметром стента и давлением наполнения баллона для стентов, расширяемых баллоном. При оценке конструкции учитывают положения 8.6.4.
D.5.3.1.2 Материалы
D.5.3.1.2.1 Стент-система.
Примечание - Испытание не предназначено для оценки всей системы; система требуется лишь для раскрытия испытуемого стента.
D.5.3.1.2.2 Устройство наполнения, шприц или эквивалент, снабженное средствами измерения давления с точностью до ±5% измеренного значения, способное поддерживать давление наполнения.
D.5.3.1.2.3 Жидкость для наполнения, например, вода комнатной температуры.
D.5.3.1.2.4 Оборудование для измерения диаметров (например, микрометр, оптический проектор профиля, лазерный микрометр), способное выполнять измерения с точностью до 10% определенного допуска или до 1% измеренного значения. Если определен допуск, следует использовать меньшее из полученных значений в процентах.
D.5.3.1.2.5 Среда с контролируемой температурой (37±2) °С, если применимо.
D.5.3.1.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.3.1.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3 и включать нагружение, выдержку под нагрузкой и раскрытие.
D.5.3.1.5 Метод испытаний
Следует разработать метод испытаний на основе следующего алгоритма действий:
a) наполняют ступенчато баллон, позволяя системе стабилизироваться между этапами наполнения; давления должны быть выбраны таким образом, чтобы определить диаметр стента через соответствующие интервалы (например, 1 атмосферу или 1 бар) во всем указанном диапазоне диаметров;
b) определяют средний внешний диаметр стента при давлении на каждом этапе в соответствующих областях по всей длине стента; эти измерения следует проводить непосредственно после стабилизации;
c) наполнение следует остановить, когда баллон достигнет номинального давления разрыва.
Все испытание следует проводить быстро для минимизации влияния вязкоупругих свойств и для лучшего моделирования метода наполнения, используемого клинически.
D.5.3.1.6 Представление результатов
Диаметр стента должен быть выражен в миллиметрах, а связанное давление - в килопаскалях и/или атмосферах.
D.5.3.1.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать максимум, минимум, среднее и стандартное отклонения измерений диаметра стента (внутреннего или внешнего) и связанных давлений. Эти данные могут быть представлены в виде таблицы или кривых.
D.5.3.2 Проверка размеров и соотношение длины и диаметра стента
D.5.3.2.1 Цель
Целью данного испытания является определение соотношения между длиной и диаметром стента и свободной длины саморасширяющегося стента и толщины стенок стента (см. соответствующие положения 8.6.1 и 8.6.4).
Для полной проверки размеров конкретных стентов может потребоваться проведение других измерений.
D.5.3.2.2 Материалы
D.5.3.2.2.1 Стент-система.
Примечание - Испытание не предназначено для оценки всей системы; система требуется лишь для раскрытия испытуемого стента.
D.5.3.2.2.2 Оборудование для измерения диаметров (например, микрометр, оптический проектор профиля, лазерный микрометр, штангенциркуль), способное выполнять измерения с точностью до 10% определенного допуска или до 1% измеренного значения. Если определен допуск, следует использовать меньшее из полученных значений в процентах.
D.5.3.2.2.3 Оборудование для измерения толщин(ы) стенок (например, микроскоп с калиброванным зрительным стеклом, толщиномер, оптический проектор профиля, лазерный микрометр), способное выполнять измерения с точностью до ±5% измеренного значения.
D.5.3.2.2.4 Измерительное оборудование для определения длины, способное выполнять измерения с точностью до 10% определенного допуска или до 1% измеренного значения. Если определен допуск, следует использовать меньшее из полученных значений в процентах.
D.5.3.2.2.5 Чистая жесткая трубка, внутренний диаметр которой соответствует минимальному и максимальному диаметрам сосуда, указанным в ИПП для каждого размера испытуемого стента.
D.5.3.2.2.6 Вспомогательные устройства, необходимые для раскрытия в соответствии с ИПП.
D.5.3.2.2.7 Среда с контролируемой температурой (37±2) °С для стентов размерами, чувствительными к разнице физиологической температуры и температуры окружающей среды.
D.5.3.2.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.3.2.4 Выдержка при определенных условиях
Выдержка при определенных условиях должна соответствовать положениям D.3.
D.5.3.2.5 Метод испытаний
Следует разработать метод испытаний на основе следующих действий:
Примечание 1 - Для стентов, расширяемых баллоном, с ощутимой отдачей может быть сложно получить соответствующее прилегание стента к стенкам трубки. Может потребоваться разработка альтернативной методики для корректной оценки свойств подобных устройств.
a) измеряют длину стента в сложенном состоянии;
b) раскрывают стент в соответствии с ИПП в жесткой трубке, представляющей минимальный номинальный диаметр для каждой конфигурации стента, следуя ИПП;
c) измеряют длину стента в пределах трубки.
Примечание 2 - При необходимости можно измерять длину стентов, расширяемых баллоном, при наполненном баллоне;
d) повторяют этапы b) и с), используя жесткую трубку, представляющую максимальный номинальный диаметр для каждой конфигурации стента; для саморасширяющихся стентов также раскрывают стент, не ограничивая диаметр, и измеряют внешний(е) диаметр(ы) и длину; внешний(е) диаметр(ы) должны быть измерены на обоих концах стента и в середине стента в двух взаимо-перпендикулярных направлениях после раскрытия в соответствии с ИПП.
Примечание 3 - Для сечений некруглой формы может потребоваться измерять и фиксировать максимальное и минимальное значения;
е) для стентов, расширяемых баллоном, удаляют стент из жесткой трубки максимального диаметра;
f) для стентов обоих типов измеряют толщину (толщины) стенок свободного стента в разных областях по оси и по окружности; если толщина стенок неоднородна согласно конструкции, должна быть измерена толщина стенок каждой характерной области стента, и результаты для каждой области должны быть зафиксированы отдельно.
Примечание 4 - Устройство может использоваться повторно, если это применимо и обосновано.
На соотношение длины и диаметра стента могут влиять угловые искривления. Необходимо учитывать дополнительные испытания и анализы для оценки влияния угловых искривлений на данный параметр, если применимо.
D.5.3.2.6 Представление результатов
Длина стента, диаметр и толщина стенок должны быть выражены в миллиметрах. Кроме того, все изменения длины, полученные после раскрытия, должны быть зафиксированы в процентах от нераскрытой длины.
D.5.3.2.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать максимум, минимум, среднее и стандартное отклонения всех измеренных и вычисленных значений. Соотношение длины и диаметра должно быть представлено в виде таблицы, включая как абсолютные значения, так и относительные в процентах.
Примечание - Для дополнительного руководства см. ASTM F2081 [23].
D.5.3.3 Отдача
D.5.3.3.1 Цель
Целью данного испытания является определение значения упругой отдачи после раскрытия стентов, расширяемых баллоном, при отсутствии внешней нагрузки для определения диаметра стента в раскрытом состоянии. При оценке конструкции следует учитывать положения 8.6.2 и 8.6.4.
D.5.3.3.2 Материалы
D.5.3.3.2.1 Стент-система.
Примечание - Испытание не предназначено для оценки всей системы; тем не менее система требуется для раскрытия испытуемого стента.
D.5.3.3.2.2 Вспомогательные устройства, необходимые для обеспечения соответствующего расширения стента.
D.5.3.3.2.3 Устройство наполнения, шприц или эквивалент, снабженное средствами измерения давления с точностью до ±5% измеренного значения, способное поддерживать давление наполнения.
D.5.3.3.2.4 Жидкость для наполнения, например, вода комнатной температуры.
D.5.3.3.2.5 Оборудование для измерения диаметров (например, микрометр, оптический проектор профиля, лазерный микрометр), способное выполнять измерения с точностью до 10% определенного допуска или до 1% измеренного значения. Если определен допуск, следует использовать меньшее из полученных значений в процентах.
D.5.3.3.2.6 Среда с контролируемой температурой (37±2) °С для стентов с материалами, свойства которых чувствительны к разнице физиологической температуры и температуры окружающей среды.
D.5.3.3.2.7 Таймер точностью ±1 с.
D.5.3.3.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.3.3.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3 и включать нагружение, выдержку под нагрузкой и раскрытие.
D.5.3.3.5 Метод испытаний
Следует разработать метод испытаний на основе следующего алгоритма действий:
a) наполняют баллон для расширения стента, используя рекомендуемое давление наполнения, и выдерживают давление, чтобы дать баллону и стенту стабилизироваться (примерно в течение 30 с);
b) определяют средний внешний диаметр стента в соответствующих областях по всей длине; внешний(е) диаметр(ы) должен(ы) быть измерен(ы) на обоих концах стента и в середине стента в двух перпендикулярных направлениях после раскрытия в соответствии с ИПП;
c) спускают и удаляют баллонный катетер;
d) дают стенту стабилизироваться (примерно в течение 30 с);
e) повторяют шаг с) в тех же областях;
f) вычисляют средний процент отдачи в каждой продольной области и/или по всей длине стента, если применимо; вычисляют отдачу стента по следующей формуле:

D.5.3.3.6 Представление результатов
Отдача стента должна быть выражена в процентах (%).
D.5.3.3.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать максимум, минимум, среднее и стандартное отклонения процентов отдачи в каждой продольной области и/или по всей длине стента, если применимо.
Примечание - Для дополнительного руководства см. ASTM F2079-02 [22].
D.5.3.4 Устойчивость к разрушению при радиальном нагружении
D.5.3.4.1 Цель
Целью данного испытания является определение характеристик нагружения/деформации стента при воздействии круговой однородной радиальной нагрузки. При оценке дизайна конструкции учитывают положения 8.6.2.
Примечание - Несмотря на схожесть испытаний на устойчивость к разрушению при радиально прикладываемой нагрузке, на устойчивость к разрушению при плоскопараллельной нагрузке, на местное (локальное) сжатие и радиальное усилие, они оценивают разные параметры стента, а именно:
- в испытании на устойчивость к разрушению при радиально прикладываемой нагрузке измеряют способность стента, расширяющегося с помощью баллона, выдерживать постоянную деформацию при воздействии круговой однородной радиальной нагрузки;
- в испытании на устойчивость к разрушению при плоскопараллельной нагрузке измеряют способность стента выдерживать постоянную деформацию по всей длине устройства при воздействии однородной нагрузки, прикладываемой по всей длине устройства;
- в испытании на локальное сжатие измеряют способность стента выдерживать постоянную деформацию при локальной (например, сосредоточенной) нагрузке;
- в испытании на радиальное усилие измеряют усилие, вызываемое воздействием саморасширяющегося стента на стенку сосуда в раскрытом состоянии во время расширения и сжатия.
D.5.3.4.2 Материалы
D.5.3.4.2.1 Стент-система.
Примечание - Испытание не предназначено для оценки всей системы; тем не менее система потребуется для раскрытия испытуемого стента.
D.5.3.4.2.2 Универсальная механическая испытательная система, оборудованная соответствующим датчиком силы, способным измерять усилие с точностью до ±5% полученного значения, с постоянной скоростью перемещения и соответствующими фиксирующими зажимами и устройствами для растяжения в окружном направлении (например, скоба, петля).
D.5.3.4.2.3 Универсальная механическая испытательная система радиального нагружения (например, "ирисовое" испытательное устройство), оборудованная соответствующим датчиком силы, способным измерять усилие или давление с точностью до ±5% полученного значения, с постоянной скоростью перемещения захватов.
D.5.3.4.2.4 Среда с контролируемой температурой (37±2) °С для стентов из материалов, свойства которых чувствительны к разнице между физиологической температурой и температурой окружающей среды.
D.5.3.4.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.3.4.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3, включая нагружение, выдержку под нагрузкой и раскрытие.
D.5.3.4.5 Метод испытаний
Следует разработать метод испытаний на основе следующего алгоритма действий:
a) помещают стент в испытательные фиксаторы;
b) сжимают стент, используя постоянную скорость сжатия; начинают с диаметра, равного максимальному указанному диаметру сосуда;
c) записывают силу и соответствующий диаметр во время сжатия стента, пока не возникнет существенное снижение силы или не появится сужение диаметра по крайней мере на 50%;
d) повторяют данное испытание, используя минимальный номинальный указанный диаметр сосуда для каждой конфигурации стента.
D.5.3.4.6 Представление результатов
Выражают нагрузку (давление или усилие) на единицу длины в килопаскалях на миллиметр или ньютонах на миллиметр, как применимо, и диаметры в миллиметрах.
D.5.3.4.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать описание метода, используемого для определения силы и диаметра. Фиксируют максимум, минимум, среднее и стандартное отклонения пиковой нагрузки и диаметра при пиковой нагрузке. Фиксируют длину испытуемого сегмента стента. Данные также должны быть представлены в виде кривой нагружения в зависимости от диаметра образцов в диапазоне испытанных значений.
D.5.3.5 Устойчивость к разрушению при нагружении с помощью параллельно расположенных пластин
D.5.3.5.1 Цель
Целью данного испытания является определение нагрузки, необходимой для того, чтобы вызвать клинически значимый перегиб или деформацию, эквивалентную уменьшению диаметра по крайней мере до 50%, и нагрузки, необходимой для появления остаточной деформации или полного разрушения стента. Целью данного испытания является также определение того, восстанавливает ли стент исходную геометрию после испытания. При оценке конструкции учитывают положения 8.6.2 и 8.6.5.
Примечание - Несмотря на схожесть испытаний на устойчивость к разрушению при радиальном нагружении, при нагружении между параллельных пластин, на локальное сжатие и радиальное усилие, они оценивают разные параметры стента, исходя из следующего:
- в испытании на устойчивость к разрушению при радиально прикладываемой нагрузке измеряют способность стента, расширяющегося с помощью баллона, выдерживать постоянную деформацию при воздействии однородной радиальной нагрузки в направлении по окружности;
- в испытании на устойчивость к разрушению при плоскопараллельной нагрузке измеряют способность стента выдерживать постоянную деформацию по всей длине устройства при воздействии однородной нагрузки, прикладываемой по всей длине устройства;
- в испытании на локальное сжатие измеряют способность стента выдерживать постоянную деформацию при локальной (например, сосредоточенной) нагрузке;
- в испытании на радиальное усилие измеряют усилие, вызываемое саморасширяющимся стентом на сосуд в раскрытом состоянии во время расширения и сжатия.
D.5.3.5.2 Материалы
D.5.3.5.2.1 Стент-система.
Примечание - Испытание не предназначено для оценки всей системы; тем не менее система требуется для раскрытия испытуемого стента.
D.5.3.5.2.2 Универсальная механическая испытательная система, оборудованная соответствующим датчиком силы, способным измерять силу с точностью до ±5% полученного значения, с постоянной скоростью перемещения траверсы и соответствующими параллельно расположенными фиксаторами (т.е. длина которых больше длины испытательного образца).
D.5.3.5.2.3 Среда с контролируемой температурой (37±2) °С для стентов из материалов, свойства которых чувствительны к разнице физиологической температуры и температуры окружающей среды.
D.5.3.5.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.3.5.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3, включая нагружение, выдержку под нагрузкой и раскрытие.
D.5.3.5.5 Метод испытаний
Следует разработать метод испытаний на основе следующего алгоритма действий:
a) помещают стент в испытательные фиксаторы, располагая его таким образом, чтобы он предположительно был наименее устойчивым к разрушению;
b) сжимают стент, используя постоянную скорость сжатия; для стентов, расширяемых баллоном, начинают с диаметра, равного максимальному указанному диаметру сосуда; для саморасширяющихся стентов начинают с диаметра свободно расширенного стента;
c) записывают значения нагрузки и соответствующей деформации во время сжатия стента до тех пор, пока не возникнет клинически значимый изгиб или деформация, эквивалентная уменьшению диаметра по крайней мере до 50%; определяют нагрузку, необходимую для остаточной деформации или полного разрушения стента;
d) разгружают стент и фиксируют, восстанавливает ли он свою исходную геометрию;
e) для стентов, расширяемых баллоном, раскрывают стент до минимального номинального указанного диаметра сосуда для каждой конфигурации стента и повторяют этапы а)-d).
Примечание - Метод определения усилия и деформации, при которых появляется остаточная пластическая деформация, не определен в настоящем стандарте, т.к. этот метод определяется конструктивной формой испытуемого устройства.
D.5.3.5.6 Представление результатов
Выражают нагрузку (силу) на единицу длины в ньютонах на миллиметр, как применимо, и деформацию (включая эквивалентный диаметр) в миллиметрах.
D.5.3.5.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать описание метода, используемого для определения усилия и деформации (диаметра). Фиксируют максимум, минимум, среднее и стандартное отклонения нагрузки и деформации, необходимых для образования клинически значимого изгиба или деформации, эквивалентной уменьшению диаметра по крайней мере до 50%, а также нагрузку и деформацию, необходимые для появления остаточной постоянной деформации или полного разрушения стента. Фиксируют, восстанавливает или нет стент свою исходную геометрию после испытания. Данные испытаний также должны быть представлены в виде кривой нагружения в зависимости от деформации. Должна быть обоснована схема расположения стента во время нагружения.
D.5.3.6 Перекручивание/перегиб
D.5.3.6.1 Цель
Целью данного испытания является определение минимального радиуса, на который может быть изогнут раскрытый стент без перегиба или уменьшения диаметра более чем на 50% при условии, что стент восстанавливает свою геометрию после испытания. Если при клиническом использовании ожидается наложение стентов один на другой (например, при стентировании поверхностной бедренной артерии), то следует оценить радиус изгиба исследуемого стента в конфигурации предполагаемого наложения. В настоящем стандарте приведены два альтернативных метода испытания (метод А и метод В), которые могут быть применены в зависимости от конструктивной формы устройства. При оценке конструкции учитывают положения 8.6.5.
D.5.3.6.2 Материалы
D.5.3.6.2.1 Стент-система.
Примечание - Испытание не предназначено для оценки всей системы; тем не менее система требуется лишь для раскрытия испытуемого стента.
D.5.3.6.2.2 Вспомогательные устройства, необходимые для помощи при раскрытии в соответствии с ИПП.
D.5.3.6.2.3 Упругие трубки, диаметр которых представляет наименьший и наибольший рекомендуемые диаметры сосудов, как применимо, для испытуемого стента. Применимо только для метода А.
D.5.3.6.2.4 Цилиндрические калибры с постепенно увеличивающимся радиусом. Применимо только для метода А.
D.5.3.6.2.5 Жесткая модель изгиба, представляющая собой наименьший и наибольший рекомендуемые диаметры сосудов, как применимо, для испытуемого стента с постепенно увеличивающимся радиусом изгиба. Применимо только для метода В.
Испытательное устройство для моделирования изгиба должно быть выполнено из прозрачного материала для возможности наблюдения за изгибом стента/протрузией распорки или опоры и должно состоять из двух половинок плит или половинок оболочек, которые могут быть разобраны для удаления стента после раскрытия, с тем чтобы можно было оценить восстановление стента до первоначальных формы и размера.
D.5.3.6.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.3.6.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3 и включать нагружение образцов и выдержку под нагрузкой.
D.5.3.6.5 Метод испытания А
a) раскрывают отдельно взятый стент в прямолинейной трубке диаметром, равным минимальному номинальному значению диаметра сосуда для каждой конфигурации стентов в соответствии с ИПП;
b) располагают стент, загруженный в трубку, на цилиндрическом калибре; испытывают наихудший случай ориентации стента;
c) изгибают стент, загруженный в трубку, вокруг калибра так, чтобы стент контактировал с калибром по всей длине, или максимум на 180°;
d) фиксируют радиус; отмечают: имеется ли перегиб или значительное сужение.
Примечание - Радиус вычисляют суммированием толщины стенки трубки с радиусом калибра;
e) записывают нагрузку, прикладываемую к стенту, и отмечают, восстанавливается ли исходная геометрия стента;
f) повторяют этапы с) и d), используя постепенно уменьшающиеся радиусы устройства, пока не появится перегиб или уменьшение диаметра стента по крайней мере на 50%;
g) повторяют этапы а)-f) для различных положений по длине стента, если применимо;
h) повторяют этапы а)-g), используя упругую трубку максимального номинального определенного диаметра сосудов;
i) повторяют этапы а)-h), используя стенты в конфигурации наложения, если применимо.
D.5.3.6.6 Метод испытания В
a) раскрывают отдельный стент в модели изгиба минимального номинального определенного диаметра сосудов для каждой конфигурации стентов в соответствии с ИПП; испытывают наихудший случай ориентации стента;
b) записывают радиус изгиба и отмечают наличие перегиба или значительного сужения;
c) удаляют стент из модели изгиба и записывают, восстанавливает ли стент исходную геометрию;
d) повторяют этапы а)-с), используя постепенно уменьшающиеся значения радиусов изгиба, пока не появится перегиб или уменьшение диаметра стента не достигнет по крайней мере 50%;
e) повторяют этапы а)-d) для различных положений по длине стента, если применимо;
f) повторяют этапы а)-е), используя модель изгиба максимального номинального определенного диаметра сосудов;
g) повторяют этапы а)-f), используя стенты в конфигурации наложения, если применимо.
D.5.3.6.7 Представление результатов
Радиус перегиба должен быть выражен в миллиметрах.
D.5.3.6.8 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать максимум, минимум, среднее и стандартное отклонения наименьшего радиуса, при которых не наблюдается ни перегиба, ни уменьшения диаметра стента по крайней мере на 50% для каждых условий испытания (т.е. минимального и максимального диаметров трубки, с нахождением стентов один на другой или без нахождения). Записывают максимальный радиус и положение стента, при котором наблюдается перегиб или уменьшение его диаметра. Фиксируют, наблюдается ли остаточная деформация, или фиксируют значение радиуса, при котором наблюдается постоянная остаточная деформация. Регистрируют все необычные наблюдения (например, разделение наложенных друг на друга стентов, разломы, выход опор в просвет сосуда и пр.). Обосновывают тип используемых упругих трубок при необходимости.
D.5.3.7 Местное (локальное) сжатие
D.5.3.7.1 Цель
Целью данного испытания является определение деформации устройства, в ответ на местное усилие сжатия, прикладываемое перпендикулярно к продольной оси устройства, и определение того, восстанавливает ли стент свою исходную геометрию после испытания. Это испытание требуется для стентов, для конструкций которых есть вероятность другого ответа на местное сжатие по сравнению с радиальным или плоскопараллельным сжатием и для которых это испытание клинически значимо.
При оценке конструкции учитывают положения 8.6.2 и 8.6.5.
Примечание - Несмотря на схожесть испытаний на устойчивость к разрушению при радиально прикладываемой нагрузке, при нагружении между параллельно расположенных плит, на локальное (местное) сжатие и радиальное усилие, они оценивают разные параметры стента, а именно:
- в испытании на устойчивость к разрушению при радиально прикладываемой нагрузке оценивают способность стента, расширяющегося с помощью баллона, выдерживать постоянную деформацию при воздействии однородной радиальной нагрузки в окружном направлении;
- в испытании на устойчивость к разрушению при плоскопараллельной нагрузке (между плит) оценивают способность стента выдерживать постоянную деформацию по всей длине устройства при воздействии однородной нагрузки, прикладываемой по всей длине устройства;
- в испытании на локальное (местное) сжатие оценивают способность стента выдерживать постоянную деформацию при локальной (например, сосредоточенной) нагрузке;
- в испытании на радиальное усилие измеряют усилие, прикладываемое саморасширяющимся стентом на сосуд в раскрытом состоянии во время расширения и сжатия.
D.5.3.7.2 Материалы
D.5.3.7.2.1 Стент-система.
Примечание - Испытание не предназначено для оценки всей системы; тем не менее система требуется лишь для раскрытия испытуемого стента.
D.5.3.7.2.2 Универсальная механическая испытательная система с возможностью сжатия, оборудованная соответствующим датчиком силы, способным измерять силу с точностью до ±5% измеренного значения, с постоянной скоростью перемещения траверсы и соответствующими зажимными фиксаторами.
D.5.3.7.2.3 Зонд для приложения силы сжатия. Конструкция зонда (например, форма, площадь поперечного сечения) должна соответствовать конструкции стента и возможным локальным силам сжатия in vivo.
D.5.3.7.2.4 Среда с контролируемой температурой (37±2) °С для стентов из материалов, свойства которых чувствительны к разнице физиологической температуры и температуры окружающей среды.
D.5.3.7.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.3.7.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3 и должна включать нагружение, выдержку под нагрузкой и раскрытие.
D.5.3.7.5 Метод испытаний
Следует разработать метод испытаний на основе следующего алгоритма действий:
a) измеряют внешний диаметр стента;
b) сжимают стент, используя постоянную скорость сжатия до тех пор, пока не появится деформация, эквивалентная уменьшению диаметра по крайней мере до 50%; приложение нагрузки должно осуществляться в пределах области на стенте, считающейся наиболее подверженной деформации при приложении фокальной нагрузки;
c) разгружают стент и измеряют минимальный диаметр стента после испытания.
D.5.3.7.6 Представление результатов
Диаметры должны быть выражены в миллиметрах.
D.5.3.7.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать приложениям D.4 и включать начальные и конечные измеренные диаметры и обоснования испытуемой области стента.
D.5.3.8 Радиальная сила
D.5.3.8.1 Цель
Целью данного испытания является определение силы, вызванной саморасширяющимися стентами, как функции от диаметра стента, при условиях расширения и сжатия. При оценке конструкции учитывают положения 8.6.2 и 8.6.5.
Примечание - Несмотря на схожесть испытаний на устойчивость к разрушению при радиально прикладываемой нагрузке, на устойчивость к разрушению при сжатии между плит, на локальное сжатие и радиальное усилие схожи, они оценивают разные параметры стента, а именно:
- в испытании на устойчивость к разрушению при радиально прикладываемой нагрузке измеряют способность стента, расширяющегося с помощью баллона, выдерживать постоянную деформацию при воздействии круговой однородной радиальной нагрузки;
- в испытании на устойчивость к разрушению при плоскопараллельной нагрузке измеряют способность стента выдерживать постоянную деформацию по всей длине устройства при воздействии однородной нагрузки, прикладываемой по всей длине устройства;
- в испытании на локальное сжатие измеряют способность стента выдерживать постоянную деформацию при локальной (например, точечной) нагрузке;
- в испытании на радиальное усилие измеряют усилие, прикладываемое саморасширяющимся стентом на сосуд в раскрытом состоянии во время расширения и сжатия.
D.5.3.8.2 Материалы
D.5.3.8.2.1 Стент-система.
Примечание - Испытание не предназначено для оценки всей системы; тем не менее система требуется для раскрытия испытуемого стента.
D.5.3.8.2.2 Универсальная механическая испытательная система, оборудованная соответствующим датчиком силы, способным измерять силу с точностью до ±5% измеренного значения, с постоянной скоростью смещения и соответствующими зажимными фиксаторами.
D.5.3.8.2.3 Расширяющие и сжимающие хомуты/фиксаторы, такие как двухстворчатое зажимное устройство, V-образный блок или устройство кольцевой нагрузки, такое как хомут или петля. Диаметр/размеры фиксатора должны соответствовать испытуемому стенту.
D.5.3.8.2.4 Среда с контролируемой температурой (37±2) °С для стентов из материалов, свойства которых чувствительны к разнице физиологической температуры и температуры окружающей среды.
Примечание - При выборе фиксаторов для испытания следует обращать внимание на исследуемую ширину или площадь, влияние трения и влияние геометрии фиксаторов на измерительные датчики.
D.5.3.8.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.3.8.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3 и должна включать нагружение и выдержку под нагрузкой.
D.5.3.8.5 Метод испытаний
Следует разработать метод испытаний на основе следующего алгоритма действий:
а) раскрывают стент в фиксаторах таким образом, чтобы начальный диаметр был меньше или равен минимальному диаметру сосуда, указанному в ИПП;
b) измеряют радиальную силу как функцию диаметра при расширении стента до максимального указанного диаметра сосуда; скорость испытания должна быть такой, чтобы результаты представляли статистические условия;
c) измеряют радиальную силу как функцию диаметра при сжатии стента до минимального указанного диаметра сосуда; скорость испытания должна быть такой, чтобы результаты представляли статистические условия;
d) вычисляют радиальное давление, основываясь на измеренной силе и площади испытуемого цилиндра.
D.5.3.8.6 Представление результатов
Радиальная сила должна быть выражена в ньютонах на единицу длины в миллиметрах. Длина должна быть определена как длина стента внутри фиксаторов. Радиальное давление должно быть выражено в килопаскалях.
D.5.3.8.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать описание испытанного положения (положений) стента, минимум, максимум, среднее и стандартное отклонения радиальной силы и радиального давления при минимальном и максимальном диаметрах для каждого испытанного размера устройства. Должны быть зафиксированы результаты как для расширения, так и для сжатия с соответствующими используемыми при испытании скоростями.
D.5.3.9 Оценка коррозионной стойкости
D.5.3.9.1 Цель
Целью данной оценки является оценка подверженности металлических компонентов стента коррозии в моделируемой физиологической среде в течение предполагаемой продолжительности стентирования. При оценке конструкции учитывают положения 8.6.3.
D.5.3.9.2 Материалы
D.5.3.9.2.1 Стент или соответствующие испытуемые образцы стента (например, сегменты, секции, компоненты, в том числе частично собранные). Испытательные образцы должны соответствовать типу оцениваемой коррозии (например, контактная, точечная, фреттинг-коррозия, электрохимическая).
D.5.3.9.2.2 Материалы, аппаратура и условия испытания, определенные в выбранном для данной оценки методе испытания.
D.5.3.9.2.3 Подходящие контрольные образцы.
D.5.3.9.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.3.9.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3 и включать нагрузку, выдержку под нагрузкой и раскрытие. Оцениваемые материалы следует подвергнуть всем производственным, фабричным и конечным процессам, а также постпроизводственным этапам, таким как чистка. Для стентов с покрытием часть основания, находящаяся ниже, должна быть открыта для испытания для моделирования вероятного клинического воздействия в течение времени. Следует быть аккуратным, чтобы не повредить основание, находящееся ниже, во время выдержки при определенных условиях. Для стентов с покрытием могут потребоваться дополнительные этапы предварительной выдержки при определенных условиях.
D.5.3.9.5 Метод испытаний
Следует разработать метод испытаний на основе следующих действий:
a) оценивают все металлические компоненты стента, используя соответствующие методы испытания и оценки коррозии. В случае если возможен контакт различных металлов из-за особенностей конструкции или согласно ИПП, они должны находиться в таком же контакте во время оценки (например, радиоизотопные маркеры). В случае если конструкция стента позволяет ожидать наличие относительных микросмещений между компонентами, такими как проволочная сетка, или при наложении стентов один на другой при клиническом использовании (например, при стентировании поверхностной бедренной артерии, коронарных артерий), должна быть оценена вероятность образования фреттинг-коррозии;
b) оценка коррозии включает, но не ограничивается, оценку результатов испытания, просмотр литературы и учет исторически известных клинических характеристик оцениваемых материалов. Руководства по оценке коррозии можно найти в различных источниках (например, литературе, учебниках, стандартах, нормативных документах). Библиография содержит частный список ссылок, относящихся к терминологии, оборудованию, испытательным процедурам и методам оценки коррозионной стойкости.
Примечание - Для дополнительного руководства см. ИСО 17475 [14]; ASTM B117 [18], ASTM F746 [20], ASTM F2129 [25], ASTM G5 [31], ASTM G15 [32], ASTM G61 [33] и ASTM G102 [34].
D.5.3.9.6 Представление результатов
Данные испытания должны быть выражены в единицах, соответствующих выбранному методу.
D.5.3.9.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать полную оценку коррозии, включая сводку всех данных испытания, анализ и ссылочную информацию, сравнение с применимыми уровнями контроля, любые соответствующие сравнения между рабочими характеристиками in vivo и in vitro и заключение, касающееся ожидаемой устойчивости коррозии стента. Для количественных данных должны быть включены минимум, максимум, среднее и стандартное отклонения. Также должны быть включены существующие требования, указанные в руководящих документах, используемых при испытании.
D.5.3.10 Испытание на усталостную прочность
D.5.3.10.1 Цель
Целью данного испытания является оценка параметров долгосрочной целостности стента и всех покрытий при условиях циклической радиальной нагрузки. Если при клиническом использовании ожидается нахождение стентов один на другой (например, при стентировании поверхностной бедренной артерии, коронарных артерий), необходимо оценить целостность исследуемого стента при конфигурации предполагаемого нахождения стентов, если не может быть приведено обоснования испытания отдельных стентов. При оценке конструкции учитывают положения 8.6.3, 8.6.3.5, 8.6.3.5.4 и 8.6.3.5.5.
Вероятные виды отказа, которые можно определить в данном испытании, включают следующие, но не ограничиваются ими: разрушение стента, связанное с усталостью, и истирание или абразивное истирание между стентами. Вероятные виды отказа покрытия, которые можно определить в данном испытании, включают разрушение покрытия, такое как расслоение, образование разрывов и оголенных участков и образование трещин. Данное испытание не предназначено для полной оценки вероятных отказов, связанных с коррозией, абразивным истиранием между стентом и артерией или смещением стента. Известно, что эти виды отказа могут наблюдаться во время испытания, следует учитывать, что такие наблюдения указывают на увеличенный риск появления такого вида отказа при клиническом использовании.
Это испытание может быть изменено так, чтобы включать оценку видов отказа, вызванных изгибом, прогибом, поворотом, нагружением, сжатием или раскрытием в извитой артерии. Кроме того, испытание может быть изменено для оценки выделения частиц покрытием. Для полной оценки всех возможных видов отказа будут необходимы другие типы испытания или оценки устройства или компонентов.
При разработке данного метода испытания следует учитывать результаты испытаний компонентов и предварительных испытаний.
D.5.3.10.2 Материалы
D.5.3.10.2.1 Стент-система.
Примечание - Испытание не предназначено для оценки всей системы; тем не менее система требуется для раскрытия испытуемого стента.
D.5.3.10.2.2 Вспомогательные устройства, необходимые для помощи при раскрытии в соответствии с ИПП.
D.5.3.10.2.3 Модель артерии, с геометрией, диаметрами и свойствами, подходящими для моделирования худшего случая распределения сил и диаметров, ожидаемых для устройства в предполагаемом месте имплантации. Для обеспечения того, что модель артерии имеет соответствующий диаметр во время испытания, при определении диаметра модели артерии необходимо учитывать рабочие давления. Если применимо, податливость модели артерии должна быть определена и измерена методами, сходными с приведенными в ИСО 7198. Податливость естественной артерии должна учитываться при разработке модели артерии. Для оценки покрытия необходимо учитывать артефакты, связанные с трением.
D.5.3.10.2.4 Пульсирующая установка для испытаний на усталость, способная прикладывать циклическую деформацию модели артерии с раскрытым стентом. Испытательное оборудование должно включать средства для любых прямых и непрямых измерений внутреннего диаметра модели артерии , при испытательной частоте поддержания физиологической температуры (37±2) °С испытательной сборки и подсчета числа циклов.
D.5.3.10.2.5 Соответствующее оборудование для инспекции (например, оптический микроскоп, просветленное увеличительное стекло, сканирующий электронный микроскоп).
D.5.3.10.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2. Размер(ы) устройства должен быть выбран так, чтобы представлять наибольшую вероятность каждого оцениваемого вида отказа, основываясь на соответствующем инженерном анализе, таком как анализ напряженно-деформированного состояния.
Для испытания долговечности покрытия могут потребоваться различные образцы для инспекции различных временных интервалов.
D.5.3.10.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3. Испытания следует проводить в соответствующем испытательном растворе, таком как физиологический раствор с фосфатным буфером или эквивалентном, если не обосновано проведение испытаний в другой среде (например, дистиллированной воде). Стент следует поддерживать при физиологической температуре (37±2) °С. До испытания на усталость должно быть выполнено моделирование извитости и угловатости, обусловленных необходимостью доставки стента в предполагаемую область имплантации.
D.5.3.10.5 Метод испытаний
Следует разработать метод испытаний на основе следующего алгоритма действий:
Примечание - Может потребоваться определение различных методов испытания для оценки целостности покрытия стента и целостности стента.
а) определяют условия, при которых будут испытываться образцы. Эти условия включают определение системы с моделью артерии для испытания, метод определения диаметра устройства и частоты нагружения при испытании.
Примечание - На диаметр модели артерии, толщину стенок и податливость может существенно влиять работа системы крепления трубок.
1) Определяют систему с моделью артерии.
Испытания проводят с использованием модели артерии, которая обеспечивает физиологическую деформацию устройства во время испытания.
Примеры
1 Испытания могут быть проведены с использованием модели артерии, моделирующей податливость естественной артерии. Этот тип испытания может быть проведен при физиологических давлениях с увеличенной скоростью, обеспечивающей поддержание ожидаемой физиологической деформации. Если применимо, податливость модели артерии должна быть измерена методами, сходными с приведенными в ИСО 7198, до и после раскрытия;
2 Испытания могут быть проведены с использованием модели артерии с нефизиологической податливостью при контроле деформации устройства для воспроизведения условий in vivo. Давления и податливость при испытательной частоте корректируются для достижения этой деформации и не обязательно являются физиологическими. Для определения среднего диаметра и деформации устройства при испытании могут быть использованы рабочие характеристики устройства в модели артерии с физиологической податливостью при физиологических условиях. Средний диаметр и изменение диаметра по длине стента должны оставаться в заранее определенных пределах на протяжении всего испытания. Если применимо, податливость модели артерии должна быть измерена методами, сходными с приведенными в ИСО 7198, до и после раскрытия.
2) Определяют метод определения податливости модели артерии или диаметра стента.
Для определения деформации диаметр модели артерии не может быть вычислен простым вычитанием удвоенной толщины стенок из внешнего диаметра
, модели артерии, т.к. толщина стенок меняется в результате изменения диаметра.
может быть непосредственно измерен или, альтернативно, вычислен на основании измерения
с использованием соответствующих выражений или взаимосвязей, таких как указаны в приложении Е.
Некоторые вопросы должны быть учтены при подготовке к определению диаметра либо аналитически, либо путем непосредственных измерений.
Для аналитического определения на основании измерения
эти вопросы могут включать, но не ограничиваться, следующее:
- может присутствовать ошибка в измерении из-за калибровки, разрешения, частоты и точности измерения измерительной системы;
- неравномерность расширения устройства и вариабельность конструкции устройства по его длине должны быть учтены при выборе области измерения;
- неравномерность реакции устройства на испытательные условия должна быть рассмотрена и учтена при выборе области измерения; например, концы устройства могут показывать большую деформацию, чем тело устройства, и деформация может отличаться по окружности устройства;
- допущения при нагрузке модели артерии влияют на методы вычисления, используемые для определения на основании измерений
(например, продольное напряженно-деформированное состояние, граничные условия);
- точность начальных размеров модели артерии (т.е. и
) влияет на точность вычисления
;
- необходимо учитывать влияние геометрии модели артерии на методы вычисления, используемые для определения на основании измерений
(например, некруглое поперечное сечение, бифуркация, изменения толщины стенок);
- точность свойств материала модели артерии может быть важной при вычислении на основании измерений
(например, коэффициент Пуассона и модуль упругости);
- стент должен оставаться в контакте с внутренней поверхностью модели артерии во время испытания для того, чтобы вычисленный модели артерии использовался как
устройства.
Для прямых измерений модели артерии или диаметра устройства эти вопросы могут включать, но не ограничиваться, следующее:
- может присутствовать ошибка в измерении диаметра из-за калибровки, разрешения, частоты и точности измерения измерительной системы;
- неравномерность расширения устройства и вариабельность конструкции устройства по его длине должны быть учтены при выборе области измерения;
- неравномерность реакции устройства на испытательные условия должна быть рассмотрена и учтена при выборе области измерения; например, концы устройства могут показывать большую деформацию, чем тело устройства, и деформация может отличаться по окружности устройства;
- может присутствовать ошибка в измерении диаметра из-за оптических искажений, связанных с оптическими свойствами модели артерии (например, нелинейность, рефракция, дисперсия);
- может присутствовать ошибка в измерении диаметра из-за сложности определения границы модели артерии или диаметра устройства;
- при выборе метода, используемого для измерения модели артерии или
устройства, необходимо учитывать геометрию модели артерии (например, некруглое поперечное сечение, бифуркация и геометрия аневризмы, изменения толщины стенок);
- воздух внутри испытательной системы может влиять на точность измерения (например, на определение границы) и реакцию модели артерии на давление (например, на податливость);
- устройства крепления и расположение датчиков измерения диаметра на или в модели артерии могут влиять на деформацию модели артерии и/или точность измерений;
- стент должен оставаться в контакте с внутренней поверхностью модели артерии во время испытания, для того чтобы вычисленный модели артерии использовался как
устройства.
Податливость, если ее вычисляют, должна быть выражена как процент изменения диаметра на 100 мм рт.ст. и определена в соответствии с ИСО 71988*.
_______________
* Вероятно, ошибка оригинала. Следует читать: ИСО 7198. - .
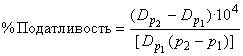 ,
,
где - внутренний диаметр при давлении
;
- внутренний диаметр при давлении
;
- максимальное значение давления (систолическое), мм рт.ст.;
- минимальное значение давления (диастолическое), мм рт.ст.
Если при использовании модели артерии с физиологической податливостью однородность расширения/податливости модели артерии по длине, по окружности и в течение периода расширения сохраняется при раскрытии стента, должна быть проверена податливость при частоте нагружения.
3) Определяют частоту нагружения.
Испытательная частота должна быть такой, чтобы средний диаметр и диаметральная деформация устройства или податливость модели артерии оставались в необходимых пределах на протяжении всего испытания. Максимальная частота может быть ограничена влиянием скорости деформирования на механические свойства материалов. Например, при высокой частоте устройство может не повторять деформацию модели артерии или модель артерии может не отвечать соответствующим образом на давление. Кроме того, частота нагружения может быть ограничена испытательным оборудованием.
При некоторых частотах могут возникать возбуждения вторичных гармоник. Вероятное влияние этих гармоник на условия испытания должно быть тщательно оценено.
b) Определяют оборудование и подготовку образцов к испытанию.
1) Раскрывают стент в модели артерии, как описано в ИПП. Расположение устройства в модели артерии должно включать соответствующее наложение, если применимо. Расположение по отношению к бифуркации или другим моделируемым в модели артерии анатомическим особенностям должно быть сравнимо с ожидаемым при клиническом использовании. Важно убедиться, что стент находится в области, в которой требуемый средний диаметр и диаметральная деформация и/или податливость являются валидными (т.е. на них не влияют никакие краевые эффекты, характерные для испытания на усталость). Должно быть определено начальное положение стента в пределах модели артерии для обеспечения возможности контроля во время испытания.
2) Осматривают раскрытое устройство, используя соответствующие визуальные средства, и записывают положение и тяжесть любых отклонений (например, неоднородное расширение устройства).
c) Начало испытания.
1) Устанавливают частоту на определенное значение и регулируют испытательную систему для достижения предполагаемого среднего диаметра и диаметральной деформации стента. Когда выполнена окончательная регулировка, запускают подсчет числа циклов пульсации.
2) Проверяют средний диаметр, деформацию и положение стента в модели артерии через регулярные промежутки времени (например, еженедельно) для проверки того, что поддерживаются определенные значения. Регулируют систему по мере необходимости для поддержания описанного рабочего диапазона. Например, регулировка может включать замену модели артерии, регулировку оборудования и повторное раскрытие устройства. Потенциальное влияние данной регулировки на результаты испытания должно быть рассмотрено в отчете по испытанию. Положение и метод измерения диаметра и деформации должны быть определены и обоснованы.
3) Если применимо, останавливают испытание через определенные интервалы времени для инспекции устройства, используя определенный протокол, минимизирующий повреждения при обслуживании (например, оптический датчик, чистые трубки, рентген или удаление устройства из испытательной системы).
Если предусмотрено удаление устройства из модели артерии, следует принять меры по удалению и повторному раскрытию таким образом, чтобы минимизировать влияние на результаты испытания.
4) Продолжают испытание до тех пор, пока не будет выполнено число циклов, эквивалентное 10 годам (по крайней мере, 380 млн циклов) для каждого устройства. Если предполагаемый срок службы устройства меньше 10 лет, может быть обоснована более короткая продолжительность испытания на усталость. Для стентов с покрытием могут потребоваться кратковременное испытание на усталость или инспекция через короткие промежутки времени для оценки устойчивости покрытия.
5) Осматривают все компоненты устройства, как определено в протоколе испытания. Обычно необходимо осмотреть все устройство на наличие макроскопических повреждений. Дальнейший осмотр устройства может включать использование оптического микроскопа, сканирующего электронного микроскопа или рентгеновского аппарата с особым вниманием на области высокого напряжения, предсказанные анализом напряженно-деформированного состояния или другими видами анализа. Должны быть зафиксированы любые найденные отклонения, такие как трещины или изломы, абразивные повреждения стента и разрушения любых покрытий, в том числе расслаивание, образование разрывов или оголенных участков и образование трещин.
D.5.3.10.6 Представление результатов
Частота нагружения должна быть выражена в циклах в секунду.
Все давления должны быть выражены в килопаскалях и миллиметрах ртутного столба.
Все диаметры и деформации должны быть выражены в миллиметрах.
Увеличение диаметра выше испытательного диапазона выражают как процентное изменение диаметра (%) и вычисляют по формуле
![]() .
.
Податливость (при частоте) выражается в процентах от изменения диаметра на 100 мм рт.ст.
Должны быть зафиксированы отклонения, такие как трещины, изломы или абразивные повреждения стента и разрушения любого покрытия, в том числе образование разрывов или оголенных участков и образование трещин. Должны быть зафиксированы все результаты осмотра, включая число циклов, при котором проведен осмотр, и число и точное положение любых обнаруженных отклонений.
D.5.3.10.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4. Должны быть зафиксированы наблюдения, такие как трещины, изломы или абразивные повреждения, образование разрывов или оголенных участков и образование трещин. Должны быть зафиксированы все результаты осмотра, включая число циклов, при котором проведен осмотр, и число и точное положение любых обнаруженных отклонений. Отчет по испытанию должен включать обоснование рассмотрения негативных находок среди артефактов испытания и/или снижения их клинической значимости, если применимо. Результаты должны быть рассмотрены и интерпретированы в зависимости от применимых данных in vivo.
Примечание - Для дополнительного руководства см. ASTM F2477 [29].
D.5.3.11 Анализ напряженно-деформированного состояния (например, анализ методом конечных элементов)
D.5.3.11.1 Цель
Целью данного анализа является определение положения и значения критического напряжения и/или деформации на стенте, связанного с производством, раскрытием и нагрузками in vivo. Эту информацию следует использовать для определения соответствующих коэффициентов запаса для конструкции и для определения соответствующих испытательных условий для испытания на усталость и долговечность. При оценке конструкции учитывают положения 8.6.3.
D.5.3.11.2 Материалы
D.5.3.11.2.1 Структурная схема (например, файл системы автоматизированного проектирования) стента.
D.5.3.11.2.2 Свойства материалов, соответствующие каждому этапу анализа для всех материалов.
D.5.3.11.2.3 Информация, необходимая для определения граничных условий, характерных при производстве (например, сжатый диаметр для загрузки стента в систему доставки) и при раскрытии (например, диаметр расширенного баллона).
D.5.3.11.2.4 Информация, необходимая для определения граничных условий, характерных при предполагаемом клиническом использовании (например, диаметр сосудов, деформация, физиологические давления, извитость, кривизна).
D.5.3.11.2.5 Соответствующие средства моделирования, такие как программное обеспечение, реализующее метод конечных элементов, и система автоматизированного проектирования для моделирования стента.
D.5.3.11.3 Отбор образцов
Анализ следует проводить на всех размерах, конфигурациях и компонентах, для которых важно проверить полное распределение характеристик напряжения и/или деформации стента.
D.5.3.11.4 Методика анализа
Следует разработать анализ на основе следующего алгоритма действий:
a) Определение свойств материалов
1) Свойства материалов должны быть выбраны так, чтобы соответствовать определенным анализируемым этапам производства и раскрытия, т.е. отражать все предшествующие влияния температурных или механических процессов. Свойства материалов, используемых в данном анализе, должны быть получены на основании механических испытаний материалов того же состава и такой же конечной формы (например, провод, трубка, лист), что и материалы, используемые для создания устройства. Испытания материалов следует проводить при физиологической температуре (37±2) °С, если применимо.
b) Определение граничных условий
1) Определяют граничные условия для геометрии конструкции стента.
2) Определяют граничные условия для анализа производства (например, сжатый диаметр для загрузки протеза в систему доставки) и при раскрытии (например, диаметр расширенного баллона).
3) Определяют граничные условия для анализа in vivo (например, диаметр сосудов, деформация, степень кривизны, физиологические давления).
c) Выполнение анализа
1) Для каждого набора граничных условий должен быть проведен анализ для определения положения (положений) и значения максимального напряжения или деформации, если применимо;
2) Для каждого анализа in vivo также должны быть определены критическое среднее и циклическое напряжение и/или деформации.
d) Интерпретация анализа
1) Анализ должен быть интерпретирован в свете усталостных свойств материала (например, видоизмененная диаграмма Гудмана). Могут потребоваться испытания усталости материала и/или устройства для определения этих усталостных характеристик, а также конструктивных коэффициентов запаса.
2) При интерпретации анализа следует учитывать существенные различия между наблюдаемыми и моделируемыми деформациями, например, если наблюдается излишняя неравномерность расширения стента, но моделируется равномерное расширение стента, необходимо выяснить ограничения анализа и обратить особое внимание на другие средства обеспечения целостности стента.
D.5.3.11.5 Представление результатов
Напряжение должно быть выражено в мегапаскалях. Деформация должна быть выражена в процентах (%). Коэффициент(ы) запаса конструкции должны быть выражены в численном виде, основываясь на напряжении, деформации или сроке службы до усталостного разрушения.
D.5.3.11.6 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и должен включать свойства материалов, описание допущений анализа, методики и результатов и конструктивные коэффициент(ы) запаса. Должно быть зафиксировано обоснование допущений условий in vivo, используемой модели материала, процесса определения свойств материала и вычисления конструктивных коэффициентов запаса. При использовании анализа методом конечных элементов должны быть определены программное обеспечение и типы используемых элементов.
Критическое напряжение и/или деформация должны быть представлены для каждого анализируемого набора условий. Для условий in vivo должно быть зафиксировано значение и положение минимального усталостного коэффициента запаса. Область(и) на устройстве с критическим напряжением и/или деформацией должна(ы) быть представлены графически для каждого анализа.
D.5.3.12 Сила отсоединения (предварительно закрепленные стенты, расширяемые баллоном)
D.5.3.12.1 Цель
Целью данного испытания является определение силы, необходимой для вывода стента из исходного сжатого положения и полного отделения стента с нерасширенного баллона при моделировании условий клинического использования.
При оценке конструкции учитывают положения 8.5.1, 8.5.2 и 8.5.3.
D.5.3.12.2 Материалы
D.5.3.12.2.1 Стент-система.
D.5.3.12.2.2 Универсальная механическая испытательная система, оборудованная соответствующим датчиком силы, способным измерять силу с точностью до ±5% зафиксированного значения, с постоянной скоростью смещения и соответствующими зажимными фиксаторами для баллонного катетера.
D.5.3.12.2.3 Соответствующие зажимные фиксаторы для стента, удерживающие стент, минимизируя радиальное усилие и позволяя баллону вытягиваться из области стента, такие как:
a) фиксаторы, включающие механическую фиксацию стента, которые могут быть использованы для приложения осевого усилия;
b) фиксаторы, включающие склеивание для крепления стента, которые могут быть использованы для приложения осевого усилия;
c) диск с отверстием, сходным по диаметру с ненаполненным баллоном, но меньшим, чем внешний диаметр сжатого стента, который позволяет выскользнуть баллону с минимальными помехами, но не позволяет стенту пройти через него.
Примечание - Выбор фиксаторов должен быть основан на моделируемом клиническом сценарии (например, удаление ведущего катетера, пересекая стеноз).
D.5.3.12.2.4 Вспомогательные устройства, необходимые для выполнения раскрытия в соответствии с ИПП.
D.5.3.12.2.5 Анатомическая модель, которая включает пути доставки и место раскрытия. При разработке модели необходимо учитывать искривленность и извитость предполагаемой области размещения стента и путей доставки.
D.5.3.12.2.6 Среда с контролируемой температурой (37±2) °С для стент-систем с материалами, свойства которых чувствительны к разнице физиологической температуры и температуры окружающей среды.
D.5.3.12.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2. Размеры стентов, выбранных для испытания, должны представлять наихудший случай комбинации диаметра и длины (или других параметров, таких как гибкость стент-системы) для силы отсоединения. Для проксимального или дистального отсоединения наихудшим случаем могут быть различные размеры стент-системы.
D.5.3.12.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3 и должна включать выдержку под нагрузкой при определенных условиях и продвижение по извитой анатомической модели, используя соответствующие вспомогательные устройства (например, интродьюсер). Испытания следует проводить в жидкой среде, если эта среда может влиять на силу, необходимую для отсоединения стента.
D.5.3.12.5 Метод испытаний
Следует разработать метод испытаний на основе следующих действий:
a) фиксируют стент в зажимных фиксаторах стента;
b) прикрепляют кончик или окончание системы доставки к другому зажиму испытательной системы;
c) активируют испытательную систему на отсоединение и полное отделение стента от системы доставки, используя постоянную скорость смещения (например, 200 мм/мин);
d) фиксируют силу, необходимую для начала отсоединения;
e) фиксируют пиковое усилие, необходимое для полного отделения стента от системы доставки;
f) повторяют этапы а)-е), используя новый образец, изменив направление приложения нагрузки (т.е. оценивают проксимальную и дистальную силу отсоединения).
D.5.3.12.6 Представление результатов
Сила должна быть выражена в ньютонах.
D.5.3.12.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать минимум, максимум, среднее и стандартное отклонения силы начала отсоединения и пикового усилия как проксимального, так и дистального отсоединения.
D.5.3.13 Расширение концов (стенты, расширяемые баллоном)
D.5.3.13.1 Цель
Целью данного испытания является определение разницы в диаметре баллона доставки при максимальном рекомендуемом давлении наполнения и расширенного стента. Это испытание предоставляет информацию по возможному повреждению сосуда за пределами стента. При оценке конструкции учитывают положения 8.5.2.
D.5.3.13.2 Материалы
D.5.3.13.2.1 Стент-система.
D.5.3.13.2.2 Среда с контролируемой температурой (37±2) °С, если применимо.
D.5.3.13.2.3 Рекомендуемый проводник или эквивалент, если применимо.
D.5.3.13.2.4 Оборудование для измерения диаметров (например, микрометр, оптический проектор профиля, лазерный микрометр, соответствующие калибры профиля), способное выполнять измерения с точностью 10% определенного допуска или 1% измеренного значения. Если определен допуск, следует использовать меньшее из полученных значений в процентах.
D.5.3.13.2.5 Жидкость для наполнения, например, вода комнатной температуры.
D.5.3.13.2.6 Устройство наполнения, шприц или эквивалент, снабженное средствами измерения давления или объема с точностью до ±5% измеренного значения и поддержания давления или объема наполнения.
D.5.3.13.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.3.13.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3.
D.5.3.13.5 Метод испытаний
Следует разработать метод испытаний на основе следующего алгоритма действий:
a) подготавливают стент-систему;
b) вставляют соответствующий проволочный проводник в устройство, как применимо в соответствии с ИПЭ;
c) погружают устройство в среду с контролируемой температурой;
d) дают устройству достичь равновесия при температуре испытания;
e) наполняют баллон, используя скорость, соответствующую клиническому использованию, до максимального давления, указанного в ИПП, минимум на 30 с или на промежуток времени, установленный в ИПП.
Примечание - Если в ИПП установлен промежуток времени, превышающий 30 с, для данного испытания следует использовать установленный промежуток, если не приведено адекватное обоснование более короткого промежутка времени;
f) пока баллон находится при максимальном рекомендуемом давлении наполнения, определяют максимальный внешний диаметр баллона на обоих концах; для каждого конца стента измеряют внешний диаметр стента в двух перпендикулярных направлениях и определяют среднее, затем вычисляют разницу между внешними диаметрами стента и баллона для каждого конца.
D.5.3.13.6 Представление результатов
Разница между внешними диаметрами стента и баллона должна быть выражена в миллиметрах.
D.5.3.13.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать в себя минимум, максимум, среднее и стандартное отклонения измеренной разницы диаметров на концах баллона. Должно быть определено максимальное давление наполнения, при котором выполняют измерения.
D.5.3.14 Влияние профиля/расширение
D.5.3.14.1 Цель
Целью данного испытания является определение расстояния между внешним диаметром стента и внешним диаметром баллона, до и после прохождения извитой части кровеносного сосуда. При оценке конструкции учитывают положения 8.6.1.
D.5.3.14.2 Материалы
D.5.3.14.2.1 Стент-система.
D.5.3.14.2.2 Анатомическая модель, которая включает пути доставки и место раскрытия. При разработке модели необходимо учитывать искривленность и извитость предполагаемой области размещения стента и путей доставки. Необходимо учитывать использование податливой модели.
D.5.3.14.2.3 Оборудование для измерения диаметров (например, микрометр, оптический проектор профиля, лазерный микрометр, соответствующие калибры профиля), способное выполнять измерения с точностью до 10% определенного допуска или до 1% измеренного значения. Если определен допуск, следует использовать меньшее из полученных значений в процентах.
D.5.3.14.2.4 Вспомогательные устройства, необходимые для выполнения раскрытия в соответствии с ИПП.
D.5.3.14.2.5 Среда с контролируемой температурой (37±2) °С для стентов с материалами, свойства которых чувствительны к разнице физиологической температуры и температуры окружающей среды.
D.5.3.14.2.6 Соответствующее оборудование для осмотра, например, оптический микроскоп с камерой.
D.5.3.14.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.3.14.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3 и должна включать нагружение катетера (незакрепленные стенты) и выдержку при определенных условиях.
D.5.3.14.5 Метод испытаний
Следует разработать метод испытаний на основе следующего алгоритма действий:
a) измеряют внешний диаметр стента, закрепленного на баллоне, на проксимальном и дистальном окончаниях и внешний диаметр незаполненного баллона на проксимальном и дистальном окончаниях стента, используя соответствующие по размерам измерительные инструменты; измерение профиля должно быть получено поворотом стент-системы до тех пор, пока не будет получен максимальный диаметр;
b) записывают измерения профиля и вычисляют различие между диаметром стента и диаметром баллона (проксимальным и дистальным) для каждого устройства;
c) вставляют соответствующие вспомогательные устройства (например, проволочный проводник, интродьюсер) в анатомическую модель;
d) проводят стент-систему по анатомической модели, удаляют систему через моделируемые изгибы и повторяют эту процедуру обоснованное число циклов;
e) повторяют этапы а) и b) и вычисляют изменения измерений до и после прохождения;
f) помещают стент-систему на кривую известного (обоснованного) радиуса и измеряют расстояние между внешним диаметром стента и внешним диаметром ненаполненного баллона на проксимальном и дистальном окончаниях стента;
g) фиксируют любые отклоняющиеся от нормы наблюдения (например, перегиб, отсоединение) для каждого испытуемого образца.
D.5.3.14.6 Представление результатов
Диаметры, расстояния и радиусы должны быть выражены в миллиметрах.
D.5.3.14.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать критические размеры извитой анатомической модели и минимум, максимум, среднее и стандартное отклонения всех измеренных и вычисленных значений. Должны быть зафиксированы любые наблюдения, отклоняющиеся от нормы.
D.5.3.15 Площадь поверхности, свободная от стента, и внешняя площадь поверхности стента
D.5.3.15.1 Цель
Целью данного испытания является определение процента контактирующей и неконтактирующей площади по длине стента при указанном диаметре имплантата относительно цилиндрической поверхности, образованной расширенным стентом. При оценке конструкции учитывают положения 8.6.5.
D.5.3.15.2 Материалы
D.5.3.15.2.1 Структурная схема [например, файл системы автоматизированного проектирования (АП)] стента.
D.5.3.15.3 Отбор образцов
Анализ следует проводить на всех размерах и конфигурациях, необходимых для обеспечения полного представления характеристик площади поверхности.
D.5.3.15.4 Метод испытаний
Следует разработать метод испытаний на основе следующих действий:
a) вычисляют проектируемую внешнюю площадь поверхности стента непосредственно на основании данных о конструкции (например, данных о геометрии АП);
b) вычисляют процент площади поверхности сосуда, контактирующей с материалом стента, разделив проектные данные о внешней площади поверхности стента на общую цилиндрическую площадь поверхности стентированного сосуда и умножив на 100 для получения процентов;
c) вычисляют процент площади поверхности, свободной от стента, вычтя процент площади поверхности, контактирующей с материалом стента, из 100 процентов.
D.5.3.15.5 Представление результатов
Площадь поверхности должна быть выражена в процентах.
D.5.3.15.6 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать процент площади поверхности, свободной от стента, для каждого диаметра стента и площадь внешней поверхности стента.
Примечание - Для дополнительного руководство см. ASTM F2081 [23].
D.5.3.16 Полная целостность покрытия
D.5.3.16.1 Цель
Целью данного испытания является определение способности покрытия быть устойчивым к повреждениям, связанным с загрузкой, следованием, раскрытием и удалением системы доставки. При оценке конструкции учитывают положения 8.6.3.
D.5.3.16.2 Материалы
D.5.3.16.2.1 Стент-система.
Примечание - Испытание не предназначено для оценки всей системы; тем не менее система потребуется для раскрытия испытуемого стента.
D.5.3.16.2.2 Вспомогательные устройства, необходимые для помощи при раскрытии в соответствии с ИПП.
D.5.3.16.2.3 Соответствующее оборудование для осмотра с камерой для наблюдения повреждений покрытия (например, оптический микроскоп, просветленное увеличительное стекло, сканирующий электронный микроскоп).
D.5.3.16.2.4 Оборудование для измерения длины и площади (например, микрометр, оптический проектор профиля, лазерный микрометр), способное выполнять измерения с точностью 10% определенного допуска или 1% измеренного значения. Если определен допуск, следует использовать меньшее значение соответствующих процентов.
D.5.3.16.2.5 Анатомическая модель, которая включает пути доставки и место раскрытия. При разработке модели необходимо учитывать искривленность и извитость предполагаемой области размещения стента и путей доставки. Необходимо учитывать использование деформируемой модели.
D.5.3.16.2.6 Водяная баня с контролем температуры (37±2) °С.
D.5.3.16.3 Отбор образцов
Отбор образцов следует проводить в соответствии с положениями D.2.
D.5.3.16.4 Подготовка образцов к испытаниям
Подготовка образцов к испытаниям должна соответствовать положениям D.3.
D.5.3.16.5 Метод испытаний
Следует разработать метод испытаний на основе следующего алгоритма действий:
а) погружают анатомическую модель в водяную баню и дают испытательной системе стабилизировать температуру;
b) вставляют соответствующие вспомогательные устройства (например, проволочный проводник, интродьюсер) в анатомическую модель;
c) проводят систему доставки по модели;
d) раскрывают стент в участке трубки, диаметр которой представляет наименьший диаметр обрабатываемого сосуда в соответствии с ИПП; трубка должна быть сконструирована таким образом, чтобы ее можно было удалить из анатомической модели.
Примечание - Следует учитывать расширение устройства баллоном после раскрытия, если оно соответствует клинической практике;
e) удаляют сборку стента и трубки;
f) осматривают внутреннюю поверхность стента на предмет появившихся изменений;
g) повторяют испытание, раскрыв другой стент за пределами трубки; для стентов, расширяемых баллоном, раскрывают до наибольшего ожидаемого увеличения диаметра, для саморасширяющихся стентов раскрывают свободно;
h) осматривают внутреннюю и наружную поверхности стента и фиксируют любые появившиеся изменения.
D.5.3.16.6 Представление результатов
Должны быть зафиксированы все критические наблюдения.
D.5.3.16.7 Отчет о проведении испытаний
Отчет по испытанию должен соответствовать положениям D.4 и включать описание метода, используемого для осмотра поверхности, положение осмотра стента и любые появившиеся изменения покрытия. Должна быть определена испытательная жидкость. Отчет должен содержать описание используемой анатомической модели, включая геометрию и материалы конструкции.
Приложение Е
(справочное)
Дополнение к аналитическому подходу при испытании на усталостную прочность
Примечание 1 - В следующих разделах приведены примеры соотношений между внутренним и внешним диаметрами трубки на основе механики упругой линейной деформации. Могут быть применимы и альтернативные методы описания взаимосвязей.
Примечание 2 - Результаты, полученные с использованием следующего аналитического подхода, могут отличаться от данных измерений из-за возможной неточности при определении коэффициента Пуассона. Аналитические методы должны быть скорректированы экспериментальными данными.
Е.1 Условия нулевой продольной деформации (постоянной длины). Примеры формулы внутреннего диаметра (или радиуса) на основании внешнего диаметра (или радиуса) для условий нулевой продольной деформации (постоянной длины)
Формулы (Е.1)-(Е.4) представляют взаимосвязь между внутренним и внешним диаметрами трубки при различных состояниях расширения (например, без давления и под давлением, систолическим и диастолическим). Эти формулы могут быть получены с использованием стандартных инженерных формул, таких как Cook и Young [70]. Например, если известны начальные внутренний и внешний радиусы модели артерии и необходимо определить изменение внутреннего радиуса, связанное с изменением внешнего радиуса, может использоваться формула (Е.4). Аналогично, если известны начальные внутренний и внешний радиусы модели артерии и необходимо определить внешний радиус, связанный с необходимым внутренним радиусом, можно использовать формулу (Е.2). Формула (Е.1) может быть использована для определения изменения , если известно изменение
. Формула (Е.3) может быть применена для определения изменения
, если известно изменение
.
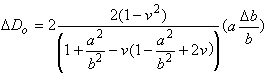 ; (Е.1)
; (Е.1)
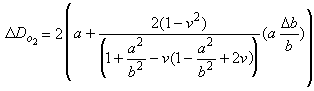 ; (Е.2)
; (Е.2)
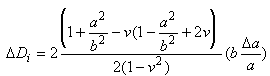 ; (Е.3)
; (Е.3)
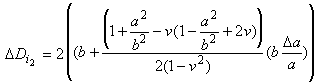 , (Е.4)
, (Е.4)
гдe - изменение внешнего диаметра, связанное с подачей давления;
- начальный внешний радиус (например, при условиях отсутствия или нижнего значения давления);
- начальный внутренний радиус (например, при условиях отсутствия или нижнего значения давления);
- коэффициент Пуассона;
- изменение внутреннего радиуса, связанное с изменением давления
![]() ;
;
- изменение внешнего радиуса, связанное с изменением давления
![]() ;
;
- изменение внутреннего диаметра, связанное с подачей давления;
- внутренний диаметр под давлением;
- внешний диаметр под давлением.
Е.2 Условия нулевого продольного напряжения (свободной длины). Примеры формул для вычисления внутреннего диаметра (или радиуса) на основании внешнего диаметра (или радиуса) для условий нулевого продольного напряжения (свободной длины)
Следующие формулы представляют взаимосвязь между внутренним и внешним диаметрами трубки при различных состояниях расширения (например, без давления и под давлением, систолическим и диастолическим). Эти выражения могут быть получены с использованием стандартных инженерных формул, таких как в работе Young [22] для случая 1а (цилиндр с однородным внутренним радиальным давлением с нулевым продольным давлением или сбалансированным за счет внешнего напряжения продольным давлением).
Например, если известны начальные внутренний и внешний радиусы модели артерии и необходимо определить изменение внутреннего радиуса, связанное с изменением внешнего радиуса, может быть применена формула (Е.8).
Аналогично, если известны начальные внутренний и внешний радиусы модели артерии и необходимо определить внешний радиус, связанный с необходимым внутренним радиусом, может быть применена формула (Е.6).
Формула (Е.5) может быть применена для определения изменения , если известно изменение
. Формула Е.7 может использоваться для определения изменения
, если известно изменение
.
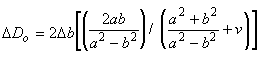 ; (Е.5)
; (Е.5)
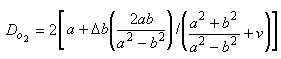 ; (Е.6)
; (Е.6)
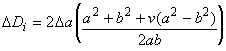 ; (Е.7)
; (Е.7)
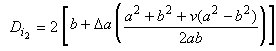 , (Е.8)
, (Е.8)
где - изменение внешнего диаметра, связанное с подачей давления;
- начальный внешний радиус (например, при условиях отсутствия или нижнего значения давления);
- начальный внутренний радиус (например, при условиях отсутствия или нижнего значения давления);
- коэффициент Пуассона;
- изменение внутреннего радиуса, связанное с изменением давления
![]() ;
;
- изменение внешнего радиуса, связанное с изменением давления
![]() ;
;
- изменение внутреннего диаметра, связанное с подачей давления;
- внутренний диаметр под давлением;
- внешний диаметр под давлением.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ИСО 10993 | IDT | ГОСТ Р ИСО 10993-2009 "Изделия медицинские. Оценка биологического действия медицинских изделий" |
ИСО 11135-1 | IDT | ГОСТ Р ИСО 11135-2000 "Медицинские изделия. Валидация и текущий контроль стерилизации оксидом этилена" |
ИСО 11137-1 | IDT | ГОСТ Р ИСО 11137-1-2008 "Стерилизация медицинской продукции. Радиационная стерилизация. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий" |
ИСО 11607 | IDT | ГОСТ Р ИСО 11607-2003 "Упаковка для медицинских изделий, подлежащих финишной стерилизации. Общие требования" |
ИСО 14155 | IDT | ГОСТ Р ИСО 14155-1-2008 "Руководство по проведению клинических испытаний медицинских изделий. Часть 1. Общие требования" |
ИСО 14160 | IDT | ГОСТ Р ИСО 14160-2003 "Стерилизация одноразовых медицинских изделий, содержащих материалы животного происхождения. Валидация и текущий контроль стерилизации с помощью жидких стерилизующих средств" |
ИСО 14630 | IDT | ГОСТ Р ИСО 14630-2011 "Имплантаты хирургические неактивные. Общие требования" |
ИСО 14937 | IDT | ГОСТ Р ИСО 14937-2012 "Стерилизация медицинской продукции. Общие требования к определению характеристик стерилизующего агента и к разработке, валидации и текущему контролю процесса стерилизации медицинских изделий" |
ИСО 14971 | IDT | ГОСТ Р ИСО 14971-2009 "Изделия медицинские. Применение менеджмента риска к медицинским изделиям" |
ИСО 17665-1 | IDT | ГОСТ Р ИСО 11134-2000 "Стерилизация медицинской продукции. Требования к валидации и текущему контролю. Промышленная стерилизация влажным теплом" |
ИСО 17665-1 | - | * |
* Соответствующий национальный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов. Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: - IDT - идентичные стандарты. | ||
Библиография
Международные стандарты на медицинские изделия | |
[1] | ISO 7198, Cardiovascular implants - Tubular vascular prostheses |
[2] | ISO 10555-1, Sterile, single-use intravascular catheters - Part 1: General requirements; Amendment 1:1999; Amendment 2:2004 |
[3] | ISO 10555-2, Sterile, single-use intravascular catheters - Part 2: Angiographic catheters |
[4] | ISO 10555-3, Sterile, single-use intravascular catheters - Part 3: Central venous catheters |
[5] | ISO 10555-4, Sterile, single-use intravascular catheters - Part 4: Balloon dilatation catheters |
[6] | ISO 11070, Sterile single-use intravascular catheter introducers |
[7] | ISO 11134, Sterilization of health care products - Requirements for validation and routine control - Industrial moist heat sterilization |
[8] | ISO/TS 11135-2, Sterilization of health care products - Ethylene oxide - Part 2: Guidance on the application of ISO 11135-1 |
[9] | ISO 11607-1, Packaging for terminally sterilized medical devices - Part 1: Requirements for materials, sterile barrier systems and packaging systems |
[10] | ISO 13485, Medical devices - Quality management systems - Requirements for regulatory purposes |
[11] | ISO/TR 14969, Medical devices - Quality management systems - Guidance on the application of ISO 13485:2003 |
[12] | ISO/TS 15539, Cardiovascular implants - Endovascular prostheses |
[13] | ISO/IEC 17025, General requirements for the competence of testing and calibration laboratories |
[14] | ISO 17475, Corrosion of metals and alloys - Electrochemical test methods - Guidelines for conducting potentiostatic and potentiodynamic polarization measurements |
Европейские стандарты на медицинские изделия | |
[15] | EN 12006-3, Non-active surgical implants - Particular requirements for cardiac and vascular implants - Part 3: Endovascular devices |
[16] | EN 14299, Non-active surgical implants - Particular requirements for cardiac and vascular implants - Specific requirements for arterial stents |
Американские стандарты на медицинские изделия | |
[17] | AAMI ST67, Sterilization of health care products - Requirements for products labeled 'sterile' |
[18] | ASTM B117, Standard Practice for operating salt spray (Fog) Apparatus |
[19] | ASTM D638, Standard test method for tensile properties of plastics |
[20] | ASTM F746, Standard test method for pitting or crevice corrosion of metallic surgical implant materials |
[21] | ASTM F2052-06e1, Standard test method for measurement of magnetically induced displacement force on medical devices in the magnetic resonance environment |
[22] | ASTM F2079, Standard test method for measuring intrinsic elastic recoil of balloon expandable stents |
[23] | ASTM F2081, Standard guide for characterization and presentation of the dimensional attributes of vascular stents |
[24] | ASTM F2119-01, Standard test method for evaluation of MR image artifacts from passive implants |
[25] | ASTM F2129, Standard test method for conducting cyclic potentiodynamic polarization measurements to determine the corrosion susceptibility of small implant devices |
[26] | ASTM F2182-02a, Standard test method for measurement of radio frequency induced heating near passive implants during magnetic resonance imaging |
[27] | ASTM F2213-06, Standard test method for measurement of magnetically induced torque on medical devices in the magnetic resonance environment |
[28] | ASTM F2394-04, Standard guide for measuring securement of balloon expandable stent mounted on delivery system |
[29] | ASTM F2477, Standard test methods for in vitro pulsatile durability testing of vascular stents |
[30] | ASTM F2503-05, Standard practice for marking medical devices and other items for safety in the magnetic resonance environment |
[31] | ASTM G5-94, Standard reference test method for making potentiostatic and potentiodynamic anodic polarization measurements |
[32] | ASTM G15-02, Standard terminology relating to corrosion and corrosion testing |
[33] | ASTM G61, Standard test method for conducting cyclic potentiodynamic polarization measurements for localized corrosion susceptibility of iron-, nickel-, or cobalt-based alloys |
[34] | ASTM G102, Standard practice for calculation of corrosion rates and related information from electrochemical measurements |
Руководства международной конференции по гармонизации | |
[35] | ICH Q1A (R2), Stability testing of new drug substances and products |
[36] | ICH Q1B, Photostability testing of new drug substances and medicinal products |
[37] | ICH Q1D, Bracketing and matrixing designs for stability testing of new drug substances and products |
Предполагаемое клиническое использование | |
[38] | Sapoval, M.R., Chatellier, G., Long, A.L., Rovani, C., Pagny, J.Y., Raynaud, A.C., Beyssen, B.M. and Gaux, J.C., Self-expandable stents for the treatment of iliac artery obstructive lesions: long-term success and prognostic factors, AJR Am. J. Roentgenol. 166(5), pp.1173-1179, 1996 |
[39] | Chastain, H.D., Gomez, C.R., lyer, S., Roubin, G.S., Vitek, J.J., Terry, J.B., and Levine, R.L., Influence of age upon complications of carotid artery stenting, UAB Neurovascular Angioplasty Team [In Process Citation]. J. Endovasc. Surg., 6, pp.217-222, 1999 |
[40] | Higashida, R.T., Meyers, P.M., Connors, J.J., Sacks, D., Strother, C.M., Barr, J.D., Wojak, J.C. and Duckwiler, G.R., Intracranial angioplasty & stenting for cerebral atherosclerosis: a position statement of the American Society of Interventional and Therapeutic Neuroradiology, Society of Interventional Radiology and the American Society of Neuroradiology, J. Vasc. Interv. Radiol. 16(10), pp.1281-1285, 2005 |
[41] | Itkin, M., Kraus, M.J. and Trerotola, S.O., Extrinsic Compression of the Left Innominate Vein in Hemodialysis Patients, J. Vasc. Interv. Radio. 15(1), pp.51-56, 2004 |
[42] | Qanadli, S.D., EL Hajjam, M., Mignon, F., de Kerviler, E., Rocha, P., Barre, O., Chagnon, S., and Lacombe, P., Subacute and chronic benign superior vena cava obstructions: endovascular treatment with self-expanding metallic stents, AJR Am. J. Roentgenol., 173(1), pp.159-164, 1999 |
Оценка конструкции системы доставки | |
[43] | Schroder, J., The mechanical properties of guidewires. Part II: Kinking resistance, Cardiovasc. Intervent. Radiol., 16(1), pp.47-48, 1993 |
[44] | Duda, S.H., Wiskirchen, J., Tepe, G., Bitzer, M., Kaulich, T.W., Stoeckel, D. and Claussen, C.D., Physical properties of endovascular stents: an experimental comparison, J. Vasc. Interv. Radiol. 11(5), pp.645-654, 2000 |
[45] | Slonim, S.M., Dake, M.D., Razavi, M.K., Kee, S.T., Samuels, S.L., Rhee, J.S. and Semba, C.P., Management of misplaced or migrated endovascular stents [In Process Citation], J. Vasc. Interv. Radiol., 10, pp.851-859, 1999 |
Оценка конструкции стента. Стендовые испытания | |
[46] | Kalmar, G., Hubner, F., Voelker, W., Hutzenlaub, J., Teubner, J., Poerner, T., Suselbeck, T., Borggrefe, M. and Haase, K.K., Radial force and wall apposition of balloon-expandable vascular stents in eccentric stenoses: an in vitro evaluation in a curved vessel model, J. Vasc. Interv. Radiol., 13(5), pp.499-508, 2002 |
[47] | Berry, J.L., Newman, V.S., Ferrario, C.M., Routh, W.D. and Dean, R.H., A method to evaluate the elastic behavior of vascular stents, J. Vasc. Interv. Radiol. 7(3), pp.381-385, 1996 |
[48] | Duerig, T.W., Tolomeo, D.E. and Wholey, M., An Overview of Superelastic Stent Design, Min. Invas. Ther. Allied Technol. 9(3/4), pp.235-246, 2000 |
[49] | Lossef, S.V., Lutz, R.J., Mundorf, J. and Barth, K.H., Comparison of mechanical deformation properties of metallic stents with use of stress-strain analysis, J. Vasc. Interv. Radiol. 5(2) pp.341-349, 1994 |
[50] | Rieu, R., Barragan, P., Masson, C., Fuseri, J., Garitey, V., Silvestri, M., Roquebert, P. and Sainsous, J., Radial force of coronary stents: a comparative analysis, Catheter Cardiovasc. Interv. 46, pp.380-391, 1999 |
[51] | Fallone, B.G., Wallace, S. and Gianturco, C., Elastic characteristics of the self-expanding metallic stents, Invest. Radiol. 23(5), pp.370-376, 1988 |
[52] | Venugopalan, R. and Tr |
[53] | Berry, J.L., Manoach, E., Mekkaoui, C., Rolland, P.H., Moore, J.E. and Rachev, A., Hemodynamics and wall mechanics of a compliance matching stent: in vitro and in vivo analysis, J. Vasc. Interv. Radiol., 13(1), pp.97-105, 2002 |
[54] | Strunk, H.M. and Schild, H.H., Luminal changes in downsteam arteries after percutaneous interventions in iliac arteries: implications for balloon or stent size determination, J. Vasc. Interv. Radiol. 7(3), pp.361-366, 1996 |
[55] | Barragan, P., Rieu, R., Garitey, V., Roquebert, P.O., Sainsous, J., Silvestri, M. and Bayet, G., Elastic recoil of coronary stents: a comparative analysis, Catheter Cardiovasc. Interv., 50, pp.112-119, 2000 |
[56] | De Jaegere, P., Serruys, P.W., Van Es, G.A., Bertrand, M., Wiegand, V., Marquis, J.F., Vrolicx, M., Piessens, J., Valeix, B. and Kober, G., Recoil following Wiktor stent implantation for restenotic lesions of coronary arteries, Cathet. Cardiovasc. Diagn, 32(2), pp.147-156, 1994 |
[57] | Dyet, J.F., Watts, W.G., Ettles, D.F. and Nicholson, A.A., Mechanical properties of metallic stents: how do these properties influence the choice of stent for specific lesions? Cardiovasc. Intervent. Radiol., 23, pp.47-54, 2000 |
[58] | Garasic, J.M., Edelman, E.R., Squire, J.C., Seifert, P., Williams, M.S. and Rogers, C., Stent and artery geometry determine intimal thickening independent of arterial injury, Circulation, 101, pp.812-818, 2000 |
[59] | Newman, V.S., Berry, J.L., Routh, W.D., Ferrario, C.M. and Dean, R.H., Effects of vascular stent surface area and hemodynamics on intimal thickening [see comments], J. Vasc. Interv. Radiol., 7, pp.387-393, 1996 |
Доклинические испытания | |
[60] | Hug, J., Nagel, E., Bornstedt, A., Schnackenburg, В., Oswald, H. and FlecK, E., Coronary Arterial Stents: Safety and Artifacts during MR Imaging, Radiology, 216, pp.781-787, 2000 |
[61] | Drevet, D., Beck, F., Streichenberger, Т., Liebgott, M., Russier, S., Celarier, C., Champion, M. and Joffre, P., Magnetic resonance angiography of stents, J. Radiol., 81(9), pp.965-970, 2000 |
[62] | Shellock, F.G. and Shellock, V.J., Metallic stents: evaluation of MR imaging safety, AJR Am. J. Roentgenol., 173, pp.543-547, 1999 |
[63] | Schurmann, K., Lahann, J., Niggemann, P., Klosterhalfen, В., Meyer, J., Kulisch, A., Klee, D., Gunther, R.W. and Vorwerk, D., Biologic response to polymer-coated stents: in vitro analysis and results in an iliac artery sheep model, Radiology, 230(1), pp.151-162, 2004 |
Клинические оценки | |
[64] | Gershlick, A., de Scheerder, I., Chevalier, В., Stephens-lloyd, A., Camenzind, E., Vrints, C., Reifart, N., Missault, L., Goy, J.J., Urban, P., Heldman, A., brinker, J. and Raizner, A.E., Inhibition of restenosis with a paclitaxel-eluting, polymer-free coronary stent: the European Evaluation of pacliTaxel Eluting Stent (ELUTES) trial, Circulation, 109, pp.487-493, 2004 |
[65] | Colombo, A., Drzewiecki, J., Banning, A., Grube. E., Hauptmann, K., Silber, S., Dudek, D., Fort, S., Schiele, F., Zmudka, K., Guagliumi, G., Russell, M.E. and Taxus II Study Group, Randomized study to assess the effectiveness of slowand moderate-release polymer-based paclitaxel-eluting stents for coronary artery lesions, Circulation, 108(7), pp.788-794, 2003 |
[66] | Balcon, R., Beyar, R., Chierchia, S., de Scheerder, I., Hugenholtz, P.G., Kiemeneij, F., Meier, В., Meyer, J., Monassier, J.P. and Wijns, W., Recommendations on stent manufacture, implantation and utilization, Study Group of the Working Group on Coronary Circulation, Eur. Heart J., 18(10), pp.1536-1547, 1997 |
[67] | Sacks, D., Marinelli, D.L., Martin, L.G. and Spies, J.В., Reporting standards for clinical evaluation of new peripheral arterial revascularization devices, Technology Assessment Committee, J. Vasc. Interv. Radiol., 8(1 Pt 1), pp.137-149, 1997 |
[68] | Gaines, P.A., A comment on the CE marking of iliac artery stents, Eur. J. Vasc. Endovasc. Surg., 29(2), p.105, 2005 |
[69] | Croft, R.J., CE mark for iliac stents, Eur. J. Vasc. Endovasc. Surg., 30(4), p.451, 2005 |
Различные документы | |
[70] | Cook, R. and Young, W.C., Advanced mechanics of materials, 2nd ed., 1999 |
[71] | Young, W.C., Roark's formulas for stress and strain. Case 1A, 6th ed, 1989 |
__________________________________________________________________________
УДК 616-089.843:006.354 ОКС 11.040.40 Р23
Ключевые слова: сердечно-сосудистые имплантаты, внутрисосудистые имплантаты, сосудистые стенты
__________________________________________________________________________
Электронный текст документа
и сверен по:
М. , 2014

