ГОСТ Р ИСО 14729-2010
Группа П46
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Оптика офтальмологическая
СРЕДСТВА УХОДА ЗА КОНТАКТНЫМИ ЛИНЗАМИ
Микробиологические требования и методы испытаний. Схемы гигиенической обработки контактных линз
Ophthalmic optics. Contact lens care products. Microbiological requirements and test methods. Regimens for hygienic management of contact lenses
ОКС 11.040.70
ОКП 94 8100
Дата введения 2012-06-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 ПОДГОТОВЛЕН Открытым акционерным обществом "ТКС-оптика" совместно с рабочей группой ПК 7 "Офтальмологическая оптика и приборы" Технического комитета ТК 296 "Оптика и оптические приборы" на основе собственного аутентичного перевода на русский язык стандарта, указанного в пункте 4
2 ВНЕСЕН Управлением технического регулирования и стандартизации Федерального агентства по техническому регулированию и метрологии
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 12 ноября 2010 г. N 451-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 14729:2001* "Офтальмологическая оптика. Средства ухода за контактными линзами. Микробиологические требования, методы испытаний этих средств и схемы гигиенической обработки контактных линз" (ISO 14729:2001 "Ophthalmic optics - Contact lens care products - Microbiological requirements and test methods for products and regimens for hygienic management of contact lenses").
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные и межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
Введение
Средства для дезинфекции контактных линз химическим путем предназначены для уменьшения бактериального заражения во время ношения линз и очистки их при хранении, следовательно, эти средства должны содержать противомикробные вещества для достижения поставленной задачи.
Очень важно, чтобы все жидкие средства по уходу за контактными линзами сохраняли стерильность до вскрытия. Твердые средства (таблетки, гранулы и т.д.) необходимо подвергнуть контролю на микробное обсеменение и растворить в соответствующем растворителе непосредственно перед использованием. Средства по уходу за контактными линзами многократного использования следует хранить надлежащим образом или упаковывать в контейнеры (специально предназначенные и промаркированные для сведения к минимуму риска заражения).
Между периодами ношения контактные линзы необходимо чистить и дезинфицировать. Для этой цели обычно используют водные растворы, очищающие и дезинфицирующие вещества. Данные средства могут быть в виде растворов или таблеток, которые необходимо растворять непосредственно перед употреблением в соответствующем растворителе, например солевом растворе.
В течение последних 20 лет использования и регламентации средств, предназначенных для дезинфекции контактных линз, были выдвинуты различные критерии антимикробной дезинфекции для медицинских изделий данного класса. Вопросы, связанные с офтальмотоксикологией, полезностью процесса и комфортностью средств для глаз, ознаменовали эволюцию изделий, обеспечивающих низкий уровень распространения глазной инфекции, связанной с контактными линзами, при использовании в соответствии с инструкциями изготовителя. В настоящем стандарте представлены различные критерии по антимикробной дезинфекции контактных линз, в приложениях дается объяснение, почему вирусы (приложение С) и Acanthamoeba (приложение D) не включены в качестве тест-культур. Искусственные слезы не требуются при оценивании дезинфицирующих средств по уходу за контактными линзами, но их можно использовать; в справочном приложении Е обсуждаются искусственные слезы в контексте, связанном с контактными линзами и средствами по уходу за контактными линзами.
Приложения А-Е являются справочными.
1 Область применения
Настоящий стандарт устанавливает два метода испытаний по оценке антимикробной активности средств, предназначенных для дезинфекции контактных линз химическим способом, и средств, которые являются частью программы ухода за контактными линзами.
Настоящий стандарт не применяют к гигиеническому контролю пробных линз.
Примечание - Стандарты на общие дезинфицирующие средства, например ЕН 1040, ЕН 1275, не распространяются на средства по уходу за контактными линзами.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие международные стандарты:
ИСО 8320-1* Контактные линзы и средства по уходу за контактными линзами. Словарь. Часть 1. Контактные линзы
ИСО 8320-2* Контактные линзы и средства по уходу за контактными линзами. Словарь. Часть 2. Средства по уходу за контактными линзами
______________
* Заменен на ИСО 18369-1:2006 "Офтальмологическая оптика. Контактные линзы. Часть 1. Словарь, системы классификации и рекомендации по установке требований к этикетированию".
3 Термины и определения
В настоящем стандарте применены термины по ИСО 8320, а также следующие термины с соответствующими определениями:
3.1 средство для дезинфекции контактных линз (contact lens disinfecting product): Средство, которое проявляет обеззараживающую активность (убивает, разрушает и/или инактивирует бактерии), удовлетворяющее главным критериям автономного испытания, установленного в настоящем стандарте.
3.2 программа дезинфекции контактных линз (contact lens disinfecting regimen): Программа ухода за контактными линзами, удовлетворяющая вспомогательным критериям автономного и программного испытаний, установленным в настоящем стандарте.
3.3 дезинфекция контактных линз (contact lens disinfection): Химический или физический процесс уменьшения числа жизнеспособных микроорганизмов в соответствии с требованиями к характеристикам, установленными в настоящем стандарте.
4 Принцип
4.1 Общие положения
Автономное испытание предназначено для оценки отдельных растворов, обладающих соответствующей противомикробной активностью, в качестве средств для дезинфекции контактных линз. Программное испытание предназначено для оценки отдельных растворов как части программы дезинфекции контактных линз. Средства, отвечающие критериям программного испытания, должны также удовлетворять минимальным эксплуатационным требованиям автономного испытания. Очень важно, чтобы такие средства (невскрытые контейнеры) удовлетворяли требованиям испытания на протяжении всего срока годности при хранении.
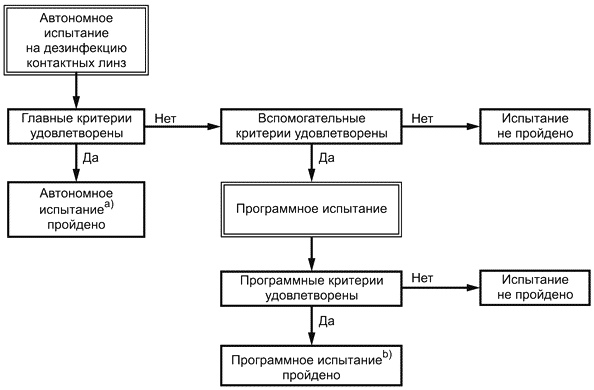
Как показано на рисунке 1, средства по уходу за контактными линзами, которые должны обладать дезинфицирующими свойствами, сначала должны пройти автономное испытание. Если главные соответствующие критерии выполняются (см. 5.1), средство можно считать дезинфицирующим. Если средство не удовлетворяет главным критериям автономного испытания, то оно должно обладать достаточной противомикробной активностью, чтобы удовлетворять вспомогательным критериям автономного испытания, как указано в 5.2. Если эти критерии удовлетворяются, должно быть проведено программное испытание, чтобы оценить средство как часть программы дезинфекции контактных линз путем выполнения программных критериев (см. 5.3). Если средство удовлетворяет вспомогательным критериям автономного и программного испытаний, но не удовлетворяет главным критериям автономного испытания, то его следует считать частью программы дезинфекции контактных линз.
При разработке средств по уходу за контактными линзами для чистки и дезинфекции следует учитывать требования совместимости с пациентом и вероятность несовместимости. Например, время дезинфекции должно быть приемлемым для ношения контактных линз пациентом.
Примечание - Использование смешанных тест-культур микроорганизмов может оказать влияние на очевидную дезинфицирующую способность конкретного средства. Оценка таких изменений наряду с испытанием при большем числе микроорганизмов и испытанием средств из частично использованных контейнеров может иметь значение при разработке средства по уходу за контактными линзами, но это уже находится за пределами сферы действия настоящего стандарта (см. приложения С и D).
_______________
Средство можно считать средством для дезинфекции контактных линз.
Средство можно считать частью программы дезинфекции контактных линз.
Рисунок 1 - Диаграмма процесса проведения автономного и программного испытаний
4.2 Автономное испытание [внесение тест-культуры (тест-штамма)]
При проведении автономного испытания в дезинфицирующее средство вводят стандартный штамм из коллекции микроорганизмов и определяют степень потери их жизнеспособности в заданные интервалы времени, сравнимые с интервалами, в течение которых средство может быть использовано. Вводимая микробная проба, выбранная для данного испытания, должна иметь определенное количество колониеобразующих единиц (далее - КОЕ) микроорганизмов, на основании чего определяют скорость и степень потери их жизнеспособности.
При проведении испытания на противомикробную активность необходимо установить количественные и качественные составы средства к моменту начала испытания путем проведения методов аналитической проверки или экстраполяции.
Необходимо предпринять соответствующие меры для инактивации или удаления остаточных противомикробных веществ во время культивирования и подсчета количества выживших микроорганизмов, а эффективность этих мер должна быть оценена. Действие этого процесса во время проведения испытания должно быть подтверждено соответствующими органами контроля.
Примечание - Информация об испытании на наличие вируса представлена в приложении С, а на наличие Acanthamoeba - в приложении D.
4.3 Программное испытание
Это испытание, при котором в многофункциональную дезинфицирующую программу вводят стандартный набор штаммов из коллекции микроорганизмов и определяют степень потери их жизнеспособности в заданные интервалы времени; культуру тест-штаммов переносят в соответствии с программой нанесением на контактную линзу.
Данная процедура применима к многофункциональным дезинфицирующим программам, которые могут включать в себя этапы чистки, промывания и пропитывания. При проведении процедуры программного испытания средства используют в количествах, рекомендованных на этикетках и/или в инструкциях для пациента.
Этап многофункциональной дезинфицирующей программы контактной линзы, оцениваемый посредством проведения данного испытания, должен удовлетворять минимальным требованиям автономного испытания, как показано на рисунке 1. Только те средства, которые удовлетворяют минимальным требованиям, предъявляемым к характеристикам автономного испытания, могут быть введены в программу дезинфекции.
При проведении испытания качественный и количественный состав всех средств, используемых в программе испытания, необходимо установить методом аналитического испытания или экстраполяции к началу проведения испытания. Должны быть приняты соответствующие меры для снижения и/или устранения остаточной противомикробной активности во время культивирования и подсчета количества выживших микроорганизмов, а эффективность этих мер должна быть оценена. Действие этого процесса во время проведения испытания должно быть подтверждено соответствующими органами контроля.
Примечание - Проблемы, связанные с использованием изношенных контактных линз, - по приложению Е.
5 Требования к характеристикам
5.1 Автономное испытание. Основные критерии
5.1.1 Бактерии
Число выживших колоний микроорганизмов на 1 мл должно быть сокращено в среднем объеме, но не менее чем на 99,9% (3,0 log) в пределах минимально рекомендованного периода впитывания.
Примечание - Значение определяют по среднему значению редукций, выраженных в логарифмах, каждого введенного микроорганизма для отдельных испытуемых партий.
5.1.2 Плесень и дрожжи
Число выживших колоний микроорганизмов на 1 мл должно быть сокращено в среднем объеме, но не менее чем на 90% (1,0 log) в пределах минимально рекомендованного периода впитывания, с увеличением не менее чем в четыре раза минимально рекомендованного периода впитывания в пределах экспериментальной ошибки ±0,5 log.
Примечание - Значение определяют по среднему значению редукций, выраженных в логарифмах, каждого введенного микроорганизма для отдельных испытуемых партий.
5.2 Автономное испытание. Вспомогательные критерии
Средства, не удовлетворяющие критериям по 5.1.1 и 5.1.2, должны быть оценены путем программного испытания по 6.4. При этом должно быть выполнено условие: сумма средних значений выживших колоний микроорганизмов составляет редукцию минимум 5,0 log для бактерий трех видов при минимальной средней редукции 1,0 log для бактерий каждого отдельного вида за время рекомендованного периода впитывания. Остановка развития дрожжевых и плесневых грибов должна наблюдаться в пределах экспериментальной ошибки ±0,5 log за время рекомендованного периода впитывания.
5.3 Программное испытание. Программные критерии
В микроорганизмах каждого вида среднее число бактерий, сохранивших жизнеспособность, не должно превышать 10 КОЕ/мл при каждом сочетании тип линзы/условие хранения. Это требование должно выполняться для всех испытуемых партий.
Для вычисления среднего значения не следует комбинировать данные о линзах более чем одного типа.
Примечание - При оценке программы ухода за контактными линзами одного типа используется среднее значение КОЕ/мл бактерий каждого вида с 24 инокулированных и обработанных согласно инструкции изготовителя линз одного типа. При оценке программы ухода за контактными линзами более одного типа используют усредненные данные с 12 инокулированных и обработанных согласно инструкции изготовителя линз каждого типа. См. таблицу 4 по необходимому числу линз.
Таблица 1 - Сводные данные по критериям требований характеристик процедур дезинфекции контактных линз
Испытание | Среднее значение редукции во время впитывания, выраженной в логарифмах | ||||
Плесень | Бактерии | ||||
FS | СА | SM | РА | SA | |
Автономное испытание: Главные критерии | 1 | 1 | 3 | 3 | 3 |
Автономное испытание: Вспомогательные критерии | |||||
Программное испытание: Программные критерии |
|
|
|
|
|
SA = S. aureus ATCC 6538; SM = S. marcescens ATCC 13880; CA = С. albicans ATCC 10231; FC=F. solani ATCC 36031.
| |||||
6 Методы испытания
6.1 Материалы и реактивы
Материалы и реактивы, т.е. тест-культуры (тест-штаммы), среды и реактивы, оборудование и образцы, являются общими для автономной процедуры в отношении дезинфицирующих средств и для программной процедуры при дезинфекции контактных линз.
6.1.1 Тест-культуры (тест-штаммы)
Следует использовать тест-штаммы, приведенные в таблице 2.
Примечание - Допускается использовать тест-штаммы из других коллекций культур, перечисленных в приложении А.
Таблица 2 - Тест-штаммы
Pseudomonas aeruginosa | ATCC 9027 |
Staphylococcus aureus | ATCC 6538 |
Serratia marcescens | ATCC 13880 |
Candida albicans | ATCC 10231 |
Fusarium solani | ATCC 36031 |
6.1.2 Питательные среды и реактивы
6.1.2.1 Картофельный агар с декстрозой (PDA).
6.1.2.2 Триптоновый соевый агар (TSA).
6.1.2.3 Агар Сабуро с декстрозой (SDA).
6.1.2.4 Фосфатно-солевой раствор Dulbecco с буферной добавкой, без хлорида кальция и хлорида марганца (DPBS): 200 мг/л KCI, 200 мг/л KНРО
, 8000 мг/л NaCI и 2160 мг/л Na
HPO
·7Н
О или подходящий растворитель.
6.1.2.5 Фосфатно-солевой раствор Dulbecco с буферной добавкой плюс 0,05% (масса/объем) полисорбита 80 (DPBST) или подходящий растворитель.
6.1.2.6 Оцененные нейтрализирующие реактивы/среды (при необходимости), например нейтрализующий бульон Dey-Engley (DEB) и бульон Letheen*.
_______________
* Нейтрализующий бульон Dey-Engley (DEB) и бульон Letheen представлены в качестве примера. Данная информация предоставляется для удобства пользователей настоящего стандарта.
6.1.3 Испытательное оборудование
Для проведения испытаний требуется следующее лабораторное оборудование:
6.1.3.1 Стерильные пипетки.
6.1.3.2 Ватные тампоны.
6.1.3.3 Трубки.
6.1.3.4 Чашки Петри (от 90 до 100 мм х20 мм).
6.1.3.5 Инкубатор.
6.1.3.6 Спектрометр (для определения плотности клетки).
6.1.3.7 Устройство для подсчета числа колоний.
6.1.3.8 Центрифуга.
6.1.4 Испытуемые образцы
Средство, которое подлежит испытанию, должно быть средством, реализуемым на рынке. Аликвотные пробы должны быть взяты непосредственно из контейнера непосредственно перед проведением испытания.
Следует испытать три партии средства. Каждая партия средства должна быть испытана отдельным тест-штаммом.
6.1.5 Сохранение тест-культуры (тест-штамма)
Сохранение тест-культуры проводят в соответствии с рекомендациями куратора соответствующей коллекции культур.
Тест-культуры должны изыматься из коллекций (ATCC, NCIB, NCTC, NCPF или других коллекций культур) не более пяти раз каждой тест-культуры (см. приложение А), при этом изымают тест-культуру предыдущего раза.
6.2 Приготовление микробиологической культуры (инокулята)
Приготовление вводимых микроорганизмов (инокулята) является общим и для автономной процедуры в отношении дезинфицирующих продуктов, и для программной процедуры для дезинфекции контактной линзы.
В программной процедуре по дезинфекции контактных линз искусственная слеза (органический грунт) может входить в состав вносимого инокулята (см. приложение Е).
Культивируют инокулят на скошенном агаре при условиях, указанных в таблице 3.
Таблица 3 - Среды и инкубационные условия для выращивания вводимого инокулята
Инокулят | Среда | Температура, °С | Инкубационный период, ч |
P. aeruginosa | TSA | От 30 до 35 | От 18 до 24 |
S. aureus | TSA | От 30 до 35 | От 18 до 24 |
S. marcescens | TSA | От 30 до 35 | От 18 до 24 |
С. albicanx или | SDA | От 20 до 25 | От 42 до 48 |
С. albicans | SDA | От 30 до 35 | От 18 до 24 |
F. solani | PDA | От 20 до 25 | От 10 до 14 |
Используют стерильный DPBST или подходящий растворитель для смыва каждой культуры с агара; смыв культуры с агара промывают, переносят в подходящий сосуд и встряхивают. Отфильтровывают взвеси F. solani через стерильную стеклянную вату или марлю, чтобы удалить нитяные фрагменты.
Культивированные микроорганизмы после сбора допускается промывать с использованием центрифуги. Для осуществления диспергирования отдельных клеток допускается бактерийные взвеси отфильтровывать (например, используя размер пор фильтра от 3 до 5 мкм). Все вводимые тест-культуры доводят до концентрации от 1х10 до 1х10
КОЕ/мл с помощью DPBST или другого подходящего растворителя. Определяют приблизительную концентрацию клеток каждой взвеси измерением помутнения взвеси или раствора взвеси с помощью спектрометра. Действительную концентрацию КОЕ/мл определяют во время испытания для каждой взвеси, например чашечным методом подсчета.
Если используют центрифугу, каждый процесс центрифугирования следует проводить при температуре от 20 °С до 25 °С не более 10 мин и не более 4000 об/мин. Более длительные периоды центрифугирования могут потребовать более низких скоростей.
Взвеси бактериальных и дрожжевых клеток используют в день приготовления. Споровые взвеси можно использовать в течение 7 дней после приготовления при условии хранения их при температуре от 2 °С до 8 °С.
6.3 Автономная процедура
6.3.1 Методика испытаний введением тест-культур
6.3.1.1 Готовят одну или более пробирок (для каждой испытуемой партии), содержащую как минимум 10 мл раствора испытуемого средства на каждую вводимую тест-культуру.
Примечание - Для обеспечения эффективного техничного исполнения испытания следует использовать пробирки для образцов, контейнеры. Поскольку между ингредиентами раствора и материалом пробирок может быть несовместимость, необходимо использовать пробирки, изготовленные из соответствующего материала.
Вводят в пробирку с испытуемым образцом средства взвесь испытуемых тест-культур в количестве от 1,0х10 до 1,0х10
КОЕ/мл. Следует убедиться, что объем вносимой бактериальной культуры не превышает 1% объема образца. Следует обеспечить полное диспергирование инокулята путем надлежащего перемешивания.
6.3.1.2 Хранить инокулированное средство следует при температуре от 20 °С до 25 °С. Температуру необходимо регулировать с помощью калиброванного устройства и регистрировать показания температуры.
Если средство чувствительно к свету, его следует защищать в течение периода проведения испытания от попадания света.
6.3.1.3 Берут 1,0 мл аликвотных проб инокулированного средства для определения числа жизнеспособных микроорганизмов в течение периода времени, составляющего 25%, 50%, 75% и 100% минимального рекомендованного времени дезинфекции всех микроорганизмов, и в дополнение - не менее 400% минимального рекомендованного времени дезинфекции дрожжей и плесени. Если рекомендуется дезинфицировать контактные линзы в течение ночи, время пропитывания составляет 8 ч.
6.3.1.4 Подвергают каждую из 1,0 мл аликвотных проб, взятых через заданные промежутки времени, действию соответствующей серии десятичных разведений в оцененных нейтрализующих средах. Хорошо перемешивают взвесь встряхиванием (на вортексе) и дают постоять, чтобы завершить нейтрализацию. Условия нейтрализации должны быть основаны на проверке контроля восстановительной среды (см. 6.3.2.2).
Если противомикробное средство в составе невозможно надлежащим образом инактивировать или нейтрализовать, удаляют его оцененным методом мембранной фильтрации (см. приложение В).
6.3.1.5 Определяют число жизнеспособных микроорганизмов в соответствующих растворах путем приготовления тройных чашек (если не оговорено иное) с подходящей восстановительной средой (например, ТSА для бактерий и SDА для плесени и дрожжей).
Если была применена мембранная фильтрация для удаления или нейтрализации противомикробных средств, культивируют мембраны на этих средах.
Если используют чашечный метод розлива, хранят агар перед разливкой в разливочных чашках при температуре ниже 50 °С.
Агаровые среды, используемые для определения количества жизнеспособных микроорганизмов, также могут содержать противомикробные инактиваторы или нейтрализаторы.
6.3.1.6 Чашки с тест-культурами должны быть инкубированы при температуре от 30 °С до 35 °С. Посевы с дрожжевыми грибами (дрожжами) инкубируют при температуре от 20 °С до 25 °С или от 30 °С до 35 °С. Посевы с плесневыми грибами инкубируют при температуре от 20 °С до 25 °С. Должны быть определены периоды инкубации для оптимального пророста бактерий, дрожжей и плесени. Периоды инкубации должны быть основаны на анализе контроля питательной среды (см. 6.3.2). Записывают число наблюдаемых КОЕ/мл на чашках, которые поддаются подсчету.
Примечание - Чашки во время инкубации следует периодически наблюдать, чтобы предотвратить появление чашек, в которых из-за чрезмерного роста бактерий, дрожжей и плесени КОЕ не поддаются подсчету.
6.3.1.7 Определяют среднее число КОЕ, поддающихся подсчету, на чашках. Вычисляют уменьшение числа микроорганизмов в заданные моменты времени.
Примечание - Каждая чашка с КОЕ, поддающимися подсчету, содержит от 30 до 300 КОЕ для бактерий или дрожжей и от 8 до 80 КОЕ - для плесени, за исключением случаев, когда КОЕ наблюдаются только в чашках для разведения 10 или 10
.
6.3.1.8 Отсутствие микроорганизмов необходимо документировать, например, написав "0" или "HP" (нет роста), когда чашки для всех растворов образца в отдельный момент времени не содержат КОЕ.
6.3.2 Средства контроля
6.3.2.1 Контроль вносимой бактериальной культуры
Готовят объем вносимой бактериальной культуры путем диспергирования идентичной аликвотной пробы инокулированного материала в объеме растворителя по 6.3.1.1 (например, DPBST) для получения конечной концентрации от 1,0х10 до 1,0х10
КОЕ/мл. Следует убедиться, что объем вносимой бактериальной культуры не превышает 1% объема образца. Диспергирование вносимой культуры необходимо обеспечить перемешиванием. Оценивают данный контрольный образец в начале испытания на КОЕ/мл, чтобы продемонстрировать пригодность среды, используемой для роста испытуемого микроорганизма, и определяют концентрацию исходной вносимой бактериальной культуры. Помещают соответствующую аликвотную пробу из каждой пробирки на восстановительную агаровую чашку в тройном объеме (если не оговорено иное).
6.3.2.2 Контроль питательной среды
Разбавляют 1/10 раствора дезинфицирующего средства в оцененном нейтрализующем бульоне (1 мл в 9 мл). Дают бульону постоять до завершения реакции нейтрализации. Готовят вторую контрольную пробирку, содержащую 10 мл подходящего растворителя (например, DPBST). Вводят в пробирки достаточный объем культуры, чтобы получилось от 10 до 100 КОЕ/мл вводимого микроорганизма на каждую чашку. Выдерживают в течение соответствующего периода времени при температуре окружающей среды, не допуская размножения инокулированных микроорганизмов. Помещают соответствующую аликвотную пробу из каждой пробирки на чашку с питательным агаром в тройном объеме (если не оговорено иное).
Для пророста бактерий следует выдерживать чашки при температуре от 30 °С до 35 °С. Для пророста дрожжей следует выдерживать чашки при температуре от 20 °С до 25 °С или от 30 °С до 35 °С. Для пророста плесени следует выдерживать чашки при температуре от 20 °С до 25 °С. Определяют минимальные периоды выдерживания для достижения оптимального пророста бактерий, дрожжей и плесени.
Если для нейтрализации требуется разбавление более чем 1:10, применяют мембранную фильтрацию.
Оценивают нейтрализацию продукта перед каждым введением микроорганизма.
6.3.2.3 Требования к контролю
Если контрольное значение выходит за пределы заданного значения, результаты испытания считают недействительными, испытание проводят повторно.
6.3.3 Отчет об испытаниях
В отчете об испытаниях должна быть представлена следующая информация:
a) ссылка на настоящий стандарт;
b) описание средства:
- наименование средства;
- номер партии;
- конечный срок действия;
- изготовитель;
- условия хранения;
- активное(ые) вещество(а) и его(их) концентрация(и) (при необходимости);
c) фамилия (фамилии) оператора(ов);
d) отклонения от протокола;
e) период инкубации;
f) период хранения инокулированного средства;
g) полученные результаты.
Если средство удовлетворяет главным критериям автономного испытания, его можно маркировать как средство, предназначенное для дезинфекции контактных линз. Если средство удовлетворяет только вспомогательным критериям автономного испытания и проходит программное испытание, его следует маркировать как часть программы дезинфекции контактных линз.
6.4 Программная процедура
6.4.1 Инокуляция линзы
Испытание проводят с использованием линз типа, на который рассчитано использование программы, например неионные, с низким содержанием воды, ионные, с высоким содержанием воды, изготовленные из акрилата кремния и т.д. Для данного испытания следует применять новые и неиспользованные линзы. При испытании программы по уходу за контактными линзами с использованием линз одного типа вносят каждую инокулированную культуру на восемь линз из каждой партии испытуемого средства; в результате испытывают всего 24 линзы каждого состава микробами каждого вида. При испытании программы по уходу за контактными линзами гидрогельного типа инокулируют четыре линзы группы 1 и четыре линзы группы 4 микробами каждого вида на каждую партию испытуемого средства; в результате испытывают всего 12 линз каждого типа на микробы каждого вида. Можно провести испытание дополнительных гидрогельных линз; однако следует испытывать минимум четыре линзы каждого типа на микробы каждого вида на сформированную партию средств. При испытании программы по уходу с использованием всех линз негидрогельного типа инокулируют четыре линзы, изготовленные из акрилата кремния, и четыре линзы, изготовленные из фторакрилата кремния, микробами каждого вида на каждую партию испытуемого средства; в результате испытывают всего 12 линз каждого типа на микробы каждого вида. При испытании программы по уходу с использованием всех гидрогельных и негидрогельных линз требуется проведение испытания с использованием линз группы 1 и группы 4, линз, изготовленных из акрилата кремния, и негидрогельных линз, изготовленных из фторакрилата кремния.
Число линз, требуемое для проведения испытания, приведено в таблице 4.
Таблица 4 - Необходимое число линз на каждый вид тест-культуры
Число линз на каждый вид тест-культуры | |||||
Испытуемый образец | Испытания на один тип линзы | Испытания на все гидрогельные линзы | Испытания на все негидрогельные линзы | ||
(например, группа 1) | Группа 1 неионные, с низким содержанием воды | Группа 4 ионные, с высоким и средним содержанием воды | Акрилат кремния | Фторакрилат кремния | |
Раствор Партия 1 | 8 | 4 | 4 | 4 | 4 |
Раствор Партия 2 | 8 | 4 | 4 | 4 | 4 |
Раствор Партия 3 | 8 | 4 | 4 | 4 | 4 |
Итого | 24 | 12 | 12 | 12 | 12 |
| |||||
Помещают испытуемую и контрольную линзы в стерильную чашку Петри вогнутой стороной вверх. Инокулируют каждую линзу, поместив 0,01 мл тест-культуры внизу линзы в точке соприкосновения с чашкой Петри. Помещают 0,01 мл той же тест-культуры непосредственно на вогнутую поверхность линзы.
Дают тест-культуре впитаться в каждую линзу в течение 5-10 мин при температуре от 20 °С до 25 °С.
6.4.2 Обработка линз
После поглощения внесенной тест-культуры проводят дезинфекцию контактных линз, включая этапы чистки, промывания и пропитки, установленные в соответствии с инструкциями изготовителя на линзу каждого типа. В протоколах испытания должны быть указаны параметры методик чистки и промывания (например, длительность протирания и промывания и объемы промывания).
6.4.3 Восстановление выживших микроорганизмов
(см. приложение В в части метода мембранной фильтрации)
6.4.3.1 Помещают соответствующий объем оцененной нейтрализующей среды в фильтровальный аппарат (В.1.2.1). Условия нейтрализации должны быть основаны на анализе контроля питательной среды (см. 6.4.4.2).
6.4.3.2 Переносят все содержимое контейнера испытуемой контактной линзы (линзу и раствор) в нейтрализующую среду фильтровального аппарата (В.1.2.2), определив перед фильтрацией длительность нейтрализации (см. приложение В).
6.4.3.3 Прикладывают пониженное давление и фильтруют раствор. Промывают фильтр в нейтрализующей среде соответствующего объема.
6.4.3.4 Соблюдая стерильность, переносят контактную линзу на поверхность агаровой среды, подходящей для культивирования испытуемой тест-культуры. Наносят некоторый объем той же агаровой среды, сохраняемой при температуре 50 °С, на линзу и дают остыть.
6.4.3.5 Прикладывают испытуемый фильтр к поверхности соответствующих твердых сред (могут быть среды по 6.3.1.5).
6.4.3.6 Для пророста бактерий следут выдержать чашки при температуре от 30 °С до 35 °С. Для пророста дрожжей следует выдержать чашки при температуре от 20 °С до 25 °С или от 30 °С до 35 °С. Для пророста плесени следует выдержать чашки при температуре от 20 °С до 25 °С. Периоды инкубации для оптимального культивирования бактерий, дрожжей и плесени должны быть определены. Минимальные периоды инкубации должны быть основаны на анализе контроля питательной среды (см. 6.4.4). Записывают число наблюдаемых КОЕ, которые поддаются подсчету на чашках. Чашки следует периодически наблюдать во время инкубации, чтобы предотвратить появление чашек, в которых из-за чрезмерного роста бактерий, дрожжей и плесени во время инкубации КОЕ не поддаются подсчету.
6.4.4 Средства контроля
6.4.4.1 Контроль инокуляции линзы
Испытуемые микробы каждого вида переносят с трех инокулированных линз в пробирки с подходящим растворителем (например, DPBST). Встряхивают в течение 30 с. Последовательно три раза разбавляют и выделяют соответствующие разбавители (если не указано иначе), чтобы провести подсчет жизнеспособных клеток. Такой подсчет подтверждает, что число микроорганизмов на линзе в момент ввода программы является адекватным. Среднее значение подсчетов должно быть не менее 2х10 КОЕ/линза и не больше 2х10
КОЕ/линза.
6.4.4.2 Контроль питательной среды
Готовят три фильтровальных аппарата (если не указано иное) по 6.4.3, содержащих нейтрализующую среду и дезинфицирующее средство в нужных объемах (см. приложение В). Дают постоять, чтобы завершить нейтрализацию. Добавляют от 5 до 100 КОЕ тест-культуры (одна на каждый фильтр), фильтруют и культивируют по 6.4.3.
Следует убедиться, что тройной объем культурального материала находится на подходящей среде (если не указано иначе).
На фильтре из нейтрализующего бульона должно быть восстановлено не менее 50% культурального материала.
Следует обеспечить нейтрализацию средства каждой вводимой тест-культуры.
6.4.5 Отчет об испытаниях
В отчете об испытаниях должна быть представлена следующая информация:
a) ссылка на настоящий стандарт;
b) описание средства:
- наименование средства;
- номер партии;
- конечный срок действия;
- изготовитель;
- условия хранения;
- активное(ые) вещество(а) и его(их) концентрация(и) (при необходимости);
c) фамилия (фамилии) оператора(ов);
d) отклонения от протокола;
e) период инкубации;
f) период хранения инокулированного средства;
g) полученные результаты.
Если средство удовлетворяет главным критериям автономного испытания, его следует маркировать как средство, предназначенное для дезинфекции контактных линз. Если средство удовлетворяет только вспомогательным критериям автономного испытания и проходит программное испытание, его следует маркировать как часть программы дезинфекции контактных линз.
Приложение А
(справочное)
Испытуемые организмы из других коллекций тест-культур
А.1 Общие положения
Подробные данные об испытуемых микроорганизмах, коллекциях тест-культур и учреждениях, где хранят культуры, представлены в таблицах А.1 и А.2 соответственно.
Таблица А.1 - Испытуемые микроорганизмы из других коллекций тест-культур
Pseudomonas aeruginosa | MUAVCR278 | CCM 1961 | CIP 82.118 | DSM 1128 | DSM 1385 |
Staphylococcus aureus | CIP 4.83 | DSM 799 | IFO 13276 | NCIB 9518 | NCTC 10788 |
Serratia marcescens | CCM 303 | DSM 47 | DSM 30121 | CDC 813-60 | NCIB 9155 |
Candida albicans | CBS 6431 | CCY 29-3-106 | CIP 48.72 | DSM 1386 | IFO 1594 |
Таблица А.2 - Коллекции культур и учреждения
АТСС | Американская коллекция типовых культур, Роквилл, Мэриленд, США |
MUAVCR | Институт микробиологии Академии наук Чешской Республики, Прага, Чешская республика |
CBS | Центральное бюро плесневых культур, Баам, Нидерланды |
CCM | Чешское собрание (коллекция) микроорганизмов, Естественно-научный факультет Университета им. Масарика, Брно, Чешская республика |
CCY | Коллекция культур дрожжей, Институт химии Словацкой Академии наук, Братислава, Словакия |
CDC | Центры по контролю заболеваний, Атланта, Джорджия, США |
CIP | Коллекция бактерий в институте Пастера, Париж, Франция |
DSM | АО "Немецкое собрание (коллекция) микроорганизмов и клеточных культур", Брауншвейг, Германия |
IAM | Институт прикладной микробиологии, Токийский университет, Токио, Япония |
IFO | Институт по ферментации, Осака, Япония |
NCIB | Национальная коллекция промышленных бактерий, Абердин, Шотландия, Великобритания |
NCIMB | Национальная коллекция промышленных и морских бактерий, Абердин, Шотландия, Великобритания |
NCPF | Национальная коллекция патогенных грибов, Микологическая справочная лаборатория, Центральная лаборатория здравоохранения, Лондон, Великобритания |
NCTC | Национальная коллекция типовых культур, Центральная лаборатория здравоохранения, Лондон, Великобритания |
NCYC | Национальная коллекция дрожжевых культур, Натфильд, Суррей, Великобритания |
NRRL | Северный региональный научно-исследовательский центр, Американский департамент сельского хозяйства, Пеория, Иллинойс, США |
VTT | Технический научно-исследовательский центр Финляндии, VTT фонд промышленных микроорганизмов, Эспоо, Финляндия |
Тест-культуры, взятые из различных коллекций, должны быть эквивалентны штаммам АТСС (Американские коллекции типовых культур).
Приложение В
(справочное)
Пример метода мембранной фильтрации
В.1 Материалы и реактивы
В.1.1 Питательные среды и реактивы
В.1.1.1 Разбавляющая жидкость с нейтрализаторами или без них.
В.1.1.2 Триптоновый соевый агар (TSA).
В.1.1.3 Фосфатно-солевой раствор Dulbecco с буферной добавкой, без хлорида кальция и хлорида марганца (DPBS): 200 мг/л KCI, 200 мг/л KНРО
, 8000 мг/л NaCI и 2160 мг/л Na
HPO
·7Н
О или подходящий растворитель.
В.1.1.4 Фосфатно-солевой раствор Dulbecco с буферной добавкой плюс 0,05% (масса/объем) полисорбита 80 (DPBST) или подходящий растворитель.
В.1.1.5 Оцененные нейтрализирующие реактивы/среды (при необходимости), например нейтрализующий бульон Dey-Engley (DEB) и бульон Letheen*.
_______________
* Нейтрализующий бульон Dey-Engley (DEB) и бульон Letheen приведены в качестве примеров. Данная информация предоставляется для удобства пользователей настоящего стандарта.
В.1.2 Испытательное оборудование
Обычное испытательное оборудование (например, стерильные пипетки, чашки Петри, контейнеры), включая следующие устройства:
В.1.2.1 Стерильный аппарат для размещения стерильного мембранного фильтра и фильтрата.
В.1.2.2 Оборудование для создания вакуума или давления, чтобы обеспечить прохождение жидкой фазы инокулированного тест-раствора через мембранный фильтр с соблюдением стерильности.
Номинальный размер отверстия мембранного фильтра должен быть не более 0,45 мкм, диаметр должен составлять не менее 47 мм. Мембранный фильтр не должен содержать химических веществ, которые могут оказать токсическое действие на микробные клетки.
В.2 Метод испытания и результаты
В.2.1 В стерильном фильтровальном устройстве (В.1.2.2) смачивают стерильный мембранный фильтр (В.1.2.1) в стерильном средстве DPBST (В.1.1.4) или в подходящем разбавителе.
В.2.2 С соблюдением стерильности переносят измеренный объем вносимого тест-раствора в стерильное средство DPBST объемом от 50 до 100 мл (В.1.1.4) или в растворяющую жидкость и тщательно перемешивают.
Примечание - При этом уменьшается вероятность того, что многочисленные КОЕ сосредоточатся на фильтре в одном и том же месте.
В.2.3 Перекачивают разбавленный раствор в мембрану и фильтр посредством вакуума или давления.
В.2.4 Промывают мембранный фильтр несколько раз растворяющей жидкостью, которая может содержать дополнительные нейтрализующие вещества (если необходимо).
Примечание - Трех объемов растворяющей жидкости (каждый по 100 мл) обычно достаточно для удаления и/или растворения противомикробного вещества. Действительный объем следует определить эмпирическим путем по каждому составу для каждого вводимого микроорганизма.
В.2.5 Инкубируют мембранный фильтр соответствующими средами для обеспечения выращивания КОЕ на поверхности фильтра.
Примечание - Это можно осуществить путем стерильного удаления мембранного фильтра из сборочного узла фильтра и установкой мембраны на поверхности стерильной агаровой чашки без наличия жидкости или мембрану можно поместить в агаровый сандвич. Допускается использовать модуль стерильного мембранного фильтра, что требует наличия дополнительных стерильных сред для герметичного фильтра и инкубации мембраны в месте нахождения.
В.2.6 Определяют среднее число КОЕ/мл, поддающихся подсчету, на мембранных фильтрах (от 3 до 100 КОЕ/47 мм - на фильтре для бактерий и от 3 до 10 КОЕ/47 мм - на фильтре для плесени). Вычисляют и документально фиксируют значение КОЕ/мл инокулированного раствора.
В.3 Средства контроля
Следует подтвердить эффективность нейтрализатора путем ввода аликвотной пробы инокулированного тест-раствора в стерильную растворяющую жидкость объемом от 50 до 100 мл, используя то же соотношение объема тест-раствора и объема растворяющей жидкости. Перекачивают весь объем на мембрану и фильтр под давлением или в вакууме. Промывают фильтр несколько раз растворяющей жидкостью, используя тот же объем, что и при процедуре испытания. Переносят от 5 до 100 КОЕ вводимых микроорганизмов (один вид на фильтр) в 100 мл разбавляющей жидкости и наносят на мембрану. Инкубируют мембранный фильтр вместе со средами, как описано в процедуре испытания (см. В.2.5).
Повторяют процедуру с использованием растворяющей жидкости, не подвергавшейся действию тест-раствора. Сравнивают объемы с объемами, полученными тем же методом, но с использованием соответствующего растворителя (например, DPBST) вместо тест-раствора. Следует подтвердить, что культуральный материал на соответствующей среде присутствует (если не указано иное). Следует обеспечить восстановление на фильтре не менее 50% культурального материала из нейтрализующего бульона.
Приложение С
(справочное)
Испытание на наличие вирусов
В силу значительных различий жизненных форм вирусы не размножаются и не распространяются на контактных линзах, контейнерах или в средствах по уходу за ними, как это могут делать грам-отрицательные бактерии (например, Pseudomonas и Serratia) или Acanthamoeba. Это происходит оттого, что вирусы являются внутриклеточными паразитами и требуют наличия живых клеток, в которых они размножаются (см. [1]). Передача вирусного кератита, вызываемого вирусом Herpes simplex, обычно происходит в детстве, и 80% населения уже заражено вирусом Herpes simplex к 15 годам. Неоднократное инфицирование взрослых людей вызывается стрессом, лихорадкой или УФ-излучением, из-за реактивации скрытых вирусов, уже присутствующих в нервных и других тканях (см. [2] и [3]). Возможно перенесение инфекции из одного органа тела в другой орган.
Имеет место перенос вирусов, например HIV, гепатита или аденовирусов, с пробных очковых линз в кабинете врача (см. [4]-[6]), потому что вирусы могут сохранять жизнеспособность на поверхности линзы. В результате проведения информационного поиска не были обнаружены отчеты, в которых описывался перенос вирусов контактными линзами при индивидуальном использовании и непосредственная связь между пользователем контактных линз и вирусными инфекциями наружных покровов глазного яблока.
Настоящий стандарт устанавливает метод для оценки систем дезинфекции контактных линз, предназначенных только для индивидуального использования. Поскольку случаи переноса вирусной инфекции через пользователя контактных линз не подтверждены документально и вирусы не могут распространяться на контактных линзах и в контейнерах линз, настоящий стандарт не рекомендует проводить испытание на вирулицидность.
В случае возникновения вирусной глазной инфекции во время ношения контактных линз рекомендуется уничтожить линзу и контейнер линзы, чтобы предотвратить возможность возникновения повторной инфекции.
Приложение D
(справочное)
Испытание на наличие Acanthamoeba
Acanthamoeba может вызывать редкое, но очень тяжелое заболевание - акантамебный кератит. Такая форма кератита возникает, в основном, у пользователей контактных линз и связана с использованием зараженных средств ухода за контактными линзами. Применение водопроводной воды или солевого раствора для чистки контактных линз, приготовленного в домашних условиях из нестерильной дистиллированной воды, является важным фактором риска, связанным с заболеваниями (см. [7]-[10]). Пользователи контактных линз должны строго придерживаться инструкций изготовителя (см. [11] и [12]).
Считается, что Acanthamoeba оказывает стимулирующее воздействие на бактерии, прилипающие к контактной линзе, к контейнеру контактной линзы и/или средству по уходу за линзами. Когда загрязненную контактную линзу вынимают из корпуса и вставляют в глаз, Acanthamoeba проникает в роговичный эпителий (см. [13]-[17]).
При проведении информационного поиска было выявлено, что Acanthamoeba очень устойчивы к замораживанию, диссекации и антимикробным средствам, включая противобактериальные, противогрибковые, антипротозойные, противовирусные и противораковые средства (см. [14]). В настоящее время не существует стандартных методов испытания средств, культивирования и подсчета выживших Acanthamoeba, а также типирования Acanthamoeba (см. [18] и [19]). Чтобы уничтожить Acanthamoeba, необходимо тепло или сильнодействующие антимикробные средства с длительным периодом впитывания, однако эти средства могут быть очень токсичными для глаз. Поэтому большинство средств, предназначенных для дезинфекции контактных линз с рекомендуемым периодом впитывания, не уничтожают Acanthamoeba, особенно цисты (см. [14], [20]-[28]). Поскольку бактерии являются источником питания для Acanthamoeba (см. [23]), чистка и промывание линз в стерильном растворе, хранение линз в стерильном предохраняющем растворе, содержание контейнера линзы в чистоте и сухости и частая замена контейнера линзы могут способствовать предотвращению заражения Acanthamoeba (см. [9] и [30]). Средство по уходу за контактными линзами, которое устраняет заражение бактериями, также может снизить риск заражения Acanthamoeba (см. [30] и [31]).
На основании этой информации, т.е. при учете факторов: редкое попадание инфекции, наличие профилактического источника заражения, отсутствие стандартной методологии, - настоящий стандарт не рекомендует проводить испытание на наличие Acanthamoeba.
Приложение Е
(справочное)
Искусственные слезы (органический грунт), получаемые при проведении лабораторных испытаний
Для оценки средств дезинфекции контактных линз искусственная слеза не требуется, но ее можно использовать; в настоящем приложении искусственная слеза обсуждается в контексте применения к контактным линзам и средствам по уходу за контактными линзами.
Установлено, что наличие искусственной слезы может влиять на бактерицидную активность некоторых дезинфицирующих средств (см. [51]). При проведении программного испытания искусственная слеза может быть добавлена в линзы, чтобы имитировать налеты, которые могут появляться в реальных ситуациях. Включение органической нагрузки предусматривает оценивание этапа чистки для удаления инородных веществ или связанных с ними микроорганизмов, а также взаимодействие остаточного органического вещества с пропитывающим раствором.
Было сделано множество попыток разработать и стандартизировать модель искусственной слезы с целью оценивания средств по уходу за контактными линзами. Цель попыток состояла в имитации естественной слезной жидкости; однако ни одна модель не продемонстрировала полностью очень сложные свойства человеческих слез или не создавала естественную слезную пленку на контактной линзе.
Слезная пленка состоит из поверхностного липидного слоя, водного слоя и муцинового слоя. Водный слой содержит не менее 60 белковых компонентов, включая лизозимы, лактоферрин, липакалин, трансферрин, альбумин, каерулоплазмин, комплемент, гликопротеиды, антипротеиназы и различные иммуноглобулины; особенно секреторный IgA (см. [32]-[35]). Хотя существует много лабораторных моделей искусственных слез (см. [36]-[40]), ни одна из них не содержит все компоненты естественных слез (см. [13]). Более того, концентрации слезных компонентов: активность и источники (например, яично-белый цвет по сравнению с лизозимом человека) в искусственных моделях не полностью совпадают со слезами человека (см. [32], [33], [42] и [43]).
В дополнение к составу слезных компонентов необходимо учитывать некоторые дополнительные факторы при попытке имитации естественной слезной пленки. Состав слез человека меняется со временем и у каждого человека разный (см. [13]). Наиболее важно то, что, как только слезы поглощаются линзой, активность слезной пленки может отличаться от первоначальной активности.
Можно обнаружить и другие несоответствия при попадании искусственных слез на поверхность линзы:
a) характер и состав макромолекулярной пленки на линзе будут зависеть от химической природы полимерной матрицы линзы (см. [46]-[50]) и
b) налеты на линзе будут зависеть от применяемой методики нанесения налета (см. [41] и [45]). Искусственные слезы на линзе могут не точно представлять человеческие слезы, особенно когда граница раздела глаз - воздух и механическое мигание не продублировано in vitro (в лабораторных условиях).
Вследствие того, что добавление искусственной слезы не было стандартизировано для применения в данном методе по настоящий момент времени, искусственная слеза не требуется для оценивания средств дезинфекции контактных линз. Известно, что некоторые правительственные органы здравоохранения (например, Управление по контролю продуктов и лекарств, США) рекомендуют использовать искусственную слезу для регистрации средства. Следовательно, настоящий стандарт касается программного испытания, проводимого либо с искусственной слезой, либо без нее. Ниже приведен пример приготовления и использования искусственной слезы (см. [52]).
Искусственную слезу готовят следующим образом: культивируют S. cerevisiae на SDA при температуре от 20 °С до 25 °С в течение 48 ч. Результат приготовления инокулята должен быть идентичен результату по 6.2. Взвесь уничтожают при нагревании до (100±2) °С в течение 10 мин и центрифугировании при скорости не более 5000 об/мин в течение не более 30 мин. Снова получают взвесь в бычьей сыворотке, которая прошла обработку температурой при 56 °С в течение 30 мин для полноты инактивации. Концентрация S. cerevisiae в сыворотке должна составлять от 1х10 до 1х10
КОЕ/мл.
После получения вводимого микроорганизма центрифугируют взвесь тест-микроорганизм. Снова получают взвесь в искусственной слезе с концентрацией от 1х10 до 1х10
КОЕ/мл. Это и есть культуральный материал, который нужно использовать в 6.4.
Приложение ДА
(обязательное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации
ДА.1 Сравнение национальных стандартов Российской Федерации со ссылочными международными стандартами, использованными в настоящем стандарте в качестве нормативных ссылок, приведено в таблице ДА.1.
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ИСО 18369-1:2006 | MOD | ГОСТ Р 53941-2010 (ИСО 18369-1:2006) Оптика офтальмологическая. Линзы контактные. Часть 1. Термины, определения и буквенные обозначения |
ЕН 1040:1997 | - | * |
ЕН 1275:1997 | - | * |
* Соответствующий национальный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов. Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: - MOD - модифицированные стандарты. | ||
Библиография
EH 1040:1997 Chemical disinfectants and antiseptics. Basic bactericidal activity - Test method and requirements (phase 1)
EH 1275:1997 Chemical disinfectants and antiseptics. Basis fungicidal activity - Test method and requirements (phase 1)
К приложению С
[1] | RICHMOND S. Principles of Virology. In D.L.Easty (ed), Virus disease of the eye. Year Book Medical Publishers, Inc., Chicago, 1985, pp.1-20 |
[2] | BELFORT, MOLINARI R.H. and POLACK F.M. Herpetic keratitis. In F.M.Polack (ed.) External diseases of the eye. Ediciones Scriba, S.A., Barcelona, Spain, 1991, pp.139-146 |
[3] | BLYTH W.A. Latency and recurrence in Herpes simplex infection. In D.L. (ed), Virus disease of the eye. Year Book Medical Publishers, Inc. Chicago, 1985, pp.83-92 |
[4] | COHEN E.J. Is your office safe? Yes, Cornea. 9 (Suppl. I): 1990, pp.41-43 |
[5] | DARRELL R.W. and JACOB G.B. Hepatitis В surface antigen in human tears. Arch. Ophthalmol. 96 pp.674-676 |
[6] | VOGT M.W., HO D.D., BAKAR S.R., GILBARD J.P., SCHOOLEY R.T. and HIRSCH M.S. Safe disinfection of contact lenses after contamination with HTLV-III. Ophthalmol. 93 (6): 1986, pp.771-774 |
К приложению D
[7] | KILVINGTON S., LARKIN D.F., WHITE D.G. and BEECHING J.R. Investigation of Acanthamoeba keratitis. J. Clin. Microbial. 28 1990, pp.2722-2725 |
[8] | MATHEWS T.D., FRAZER D.G., MINASSIAN D.C., RADFORD C.F. and DART J.K.G. Risks of keratitis and patterns of use with disposable lenses. Arch. Ophthalmol. 110 1992, pp.1559-1562 |
[9] | SEAL D., STAPLETON F.D. and DART J.K.G. Possible environmental sources of Acanthamoeba spp. in contact lens wearers. Brit. J. Ophthalmol. 76 1992, pp.424-427 |
[10] | STAPLETON F.D., SEAL D.V. and DART J.K.G. Possible environmental sources of Acanthamoeba species that cause keratitis in contact lens wearers. Rev. Inf. Dis. 13 (suppl 5): 1991, p.392 |
[11] | MOORE M.B. Acanthamoeba keratitis and contact lens wear: the patient is at fault. Cornea. 9 (Suppl. 1): 1990, pp.33-35 |
[12] | PALMER M.L. and HYNDIUK R.A. Contact lens related keratitis. Intl. Ophthalmol. Clin. 33 1993, pp.23-49 |
[13] | LARKIN D.F.P., KILVINGTON S. and EASTY D.L. Contamination of contact lens storage cases by Acanthamoeba and bacteria. Brit. J. Ophthalmol. 74 1990, pp.133-135 |
[14] | LUDWIG I.H., MEISLER D.M., RUTHERFORD I., BICAN F.E., LANGSTON R.H.S. and VISVERVARA G.S. Susceptibility of Acanthamoeba to soft contact lens Disinfection Systems. Invest. Ophthalmol. Vis. Sci. 27 1986, pp.626-628 |
[15] | SILVANY R.E., DOUGHERTY J.M., MCCULLEY J.P., WOOD T.S., BOWMAN R.W. and MOORE M.B. The effect of currently available contact lens disinfection systems on Acanthamoeba castellani and Acanthamoeba polyphaga. Ophthalmol. 97 (3) March 1990, pp.286-290 |
[16] | GORLIN A.I., GABRIEL M.M., WILSON L.A. and AHEARN D.G. Binding of Acanthamoeba to hydrogel contact lenses. Curr. Eye Res. 15 1996, pp.151-155 |
[17] | STEHR-GREEN J.K., VISVESVARA T.M. and G.S. The epidemiology of Acanthamoeba keratitis in the United States. Amer. J. Ophthalmol. 107 1989, pp.331-336 |
[18] | MEISLER D.M. and RUTHERFORD I. Acanthamoeba disinfection of soft contact lenses. Rev. Inf. Dis. 13 (Suppl. 5), 1991, pp.410-412 |
[19] | WILHELMUS K.R. and JONES D.B. Program Planning for Research on Acanthamoeba, Reviews of Infectious Diseases. 13 (suppl. 5), 1991, pp.446-450 |
[20] | CONNOR C.G., HOPKINS S.L. and SALISBURY R.D. Effectivity of contact lens disinfection systems against Acanthamoeba culbertsoni. Optom. & Vis. Sci. 68 1991, pp.138-141 |
[21] | DAVIES D.J.G., ANTHONY Y., MEAKIN B.J., KILVINGTON S. and ANGER C.B. Evaluation of the antiacanthamoebal activity of five contact lens disinfectants. ICLC. 17 1990, pp.14-20 |
[22] | HOLDEN B. A report card on hydrogen peroxide for contact lens disinfection. CLAO J. 16 [(I). Suppl.]: 1990, pp.61-64 |
[23] | KILVINGTON S. Activity of water biocide chemicals and contact lens disinfectants on pathogenic free-living amoebae. Intl. Biodeterioration. 26 1990, p.127 |
[24] | SEAL D.V., HAY J., DEVONSHIRE P. and KIRKNESS C.M. Acanthamoeba and contact lens disinfection: should chlorine be discontinued? Brit. J. Ophthalmol. 77 1993, p.128 |
[25] | KILVINGTON S.D., ANTHONY Y., DAVIES D.J.G. and MEAKIN M.J. Effect of contact lens disinfectants against Acanthamoeba cysts. Rev. Inf. Dis. 13 (Suppl 5): 1991, pp.414-415 |
[26] | KILVINGTON S.D. Acanthamoeba trophozoite and cyst adherence to four types of soft contact lens and removal by cleaning agents. Eye. 7 1993, pp.535-538 |
[27] | SEAL D. and HAY J. Contact lens disinfection and Acanthamoeba: Problems and practicalities. The Pharm. J. May 30 1992, pp.717-719 |
[28] | LOPEZ A., CALLEJAR M. and CLARAMONTE P. Effect of non-oxidizing contact lens disinfection systems on Acanthamoeba culbertsoni. Contactologia. 14E: 1992, pp.68-73 |
[29] | BOTTONE E.J., MADAYAG R.M. and QURESHI M.N. Acanthamoeba keratitis: synergy between amoebic and bacterial cocontaminants in contact lens care systems as a prelude to infection. J. Clin. Microbial. 30 1992, pp.2447-2450 |
[30] | DONZIS P.В., MONDINO B.J., WEISSMAN B.A. and BRUCKNER D.A. Microbial contamination of contact lens care systems. Amer. J. Ophthalmol. 104 1987, pp.325-333 |
[31] | DONZIS P.В., MONDINO B.J., WEISSMAN B.A. and BRUCKNER D.A. Microbial analysis of contact lens care systems contaminated with Acanthamoeba. Amer. J. Ophthalmol. 108 1989, pp.53-56 |
К приложению Е
[32] | VAN HAERINGEN N.J. Clinical biochemistry of tears. Surv. Ophthalmol. 26 1981, pp.84-96 |
[33] | GACHON A-M., RICHARD J. and DASTUGUE B. Human tears: normal protein pattern and individual protein determinations in adults. Curr. Eye. Res. 2 1983, pp.301-308 |
[34] | WEDLER F.C., ILLMAN В., HORENSKEY D. and MOWREY-MCKEE M. Analysis of protein and mucin components deposited on hydrophillic contact lenses. Clin. and Exp. Optom. 70 1987, pp.59-68 |
[35] | DELAIRE A., LASSAGNE H. and GACHON A.M.H. New members of the lopocalin family in human tear fluid. Exp. Eye Res. 55 1992, pp.645-647 |
[36] | FDA Testing Guidelines for Class III Soft (Hydrophillic) Contact Lens Solutions (draft). 1985 |
[37] | French Guidelines. AFNOR NF 72 190 |
[38] | The Japanese Standards of Pharmaceutical Ingredients and Supplement. (JSP1) 1991 |
[39] | MINER N.A., WHITMORE E. and MCBEE M. A quantitative organic "soil" neutralisation test for disinfectants. Dev Indust. Microbial. 16 1975, pp.23-30 |
[40] | MIREJOVSKY D., PATEL A., RODRIGUEZ D. and HUNT T. Lipid adsorption onto hydrogel contact lens materials. Advantages of nile red over oil red О in visualization of lipids. Optom. and Vis Sc. 68 1991, pp.858-864 |
[41] | HART D.E., TIDSALE R. and SACK R. Origin and composition of lipid deposits on soft contact lenses. Ophthalmol. 93 1986, pp.495-503 |
[42] | YAMADA M., TAKECHI K. and HASEGAWA E. The possible role of human lysozyme in soft contact lens hygiene, II. Enzymatic properties and antimicrobial activities J. Jpn С.L. Soc. 22 1980, pp.138-142 |
[43] | ALCON Total protein analysis of FDA organic soil used in the multi-item test. 1994 |
[44] | CHENG J.W., MATSUMATO S. and ANGER С. The effect of tear protein on preservative toxicity. Poster Presentation at CLAO. 1994 |
[45] | SACK R., JONES В., ANTIGNANI A., LIBOW R. and HARVEY H. Specificity and biological activity of protein deposited on the hydrogel surface. Invest. Ophthalmol. Vis. Sci. 28 1987, pp.842-849 |
[46] | STONE R., MOWREY-MCKEE M. and KREUTZER P. Protein: source of lens discoloration. Contact Lens Forum. 1984, 9:33 |
[47] | SACK R., HARVEY H. and NUNES I. Disinfection associated spoilage of high water content ionic matrix hydrogels. CLAO J. 15 1989, pp.138-145 |
[48] | BOHNERT J.L., HORBETT Т., RATNER B. and ROYCE F. Adsorption of proteins from artificial tear solutions to contact lens materials. Invest. Ophthalmol. Vis. Sci. 29 1988, pp.362-373 |
[49] | MINARIK L. and RAPP J. Protein deposits on individual hydrophillic contact lenses: effects of water and ionicity. CLAO J. 15 1989, pp.185-188 |
[50] | TRIPATHI P.С and TRIPATHI R.C. Analysis of glycoprotein deposits on disposable soft contact lenses. Invest. Ophthalmol Vis. Sci. 33 1992, pp.121-125 |
[51] | SCHUNK T. and SCHWEISFURTH R.S. Disinfectant performance of oxidizing contact lens solutions: Quantitative suspension tests with organic soil contaminants. Contactologia. 11 1989, pp.84-89 |
[52] | FDA 510(k) Guidelines for Contact Lens Care Products, May 1, 1997 |
[53] | FARRIS R.L. Tear analysis in contact lens wearers. Trans. Am. Ophthalmol. Soc. 83 1985, pp.501-545 |
Электронный текст документа
и сверен по:
, 2011