ГОСТ ISO 10273-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ ДЛЯ ЖИВОТНЫХ
Горизонтальный метод обнаружения условно-патогенной бактерии Yersinia enterocolitica
Microbiology of food and animal feeding stuffs. Horizontal method for the detection of presumptive pathogenic Yersinia enterocolitica
МКС 07.100.30*
_____________________
* По данным официального сайта Росстандарта
ОКС 07.100.30; 65.120; 67.050, здесь и далее. -
.
Дата введения 2015-07-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Государственным научным учреждением Всероссийским научно-исследовательским институтом консервной и овощесушильной промышленности Российской академии сельскохозяйственных наук (ГНУ ВНИИКОП Россельхозакадемии)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 декабря 2013 г. N 63-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 17 марта 2014 г. N 159-ст межгосударственный стандарт ГОСТ ISO 10273-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2015 г.
5 Настоящий стандарт идентичен международному стандарту ISO 10273:2003* Microbiology of food and animal feeding stuffs - Horizontal method for the detection of presumptive pathogenic Yersinia enterocolitica (Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод выявления условно-патогенной бактерии Yersinia enterocolitica).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Международный стандарт разработан подкомитетом ISO/ТС 34/SC 9 "Микробиология" Технического комитета по стандартизации ISO/TC 34 "Пищевые продукты" Международной организации по стандартизации (ISO).
Перевод с английского языка (en).
Официальный экземпляр международного стандарта, на основе которого подготовлен настоящий межгосударственный стандарт, имеется в Федеральном агентстве по техническому регулированию и метрологии Российской Федерации.
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам приведены в дополнительном приложении ДА.
Степень соответствия - идентичная (IDT)
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
ПРЕДУПРЕЖДЕНИЕ - Использование настоящего стандарта может быть связано с применением опасных материалов, процедур и оборудования. Пользователь настоящего стандарта несет ответственность за установление соответствующих условий безопасности и за применение регламентированных ограничений.
1 Область применения
Настоящий стандарт распространяется на пищевые продукты и корма для животных и устанавливает горизонтальный метод обнаружения Yersinia enterocolitica, которые являются условно патогенными для человека.
Метод применим также для выявления данных микроорганизмов в объектах окружающей среды в сфере пищевого производства и оборота пищевых продуктов.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты*:
_______________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ISO 6887-1:1999 Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 1: General rules for the preparation of the initial suspension and decimal dilutions (Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 1. Общие правила приготовления исходной суспензии и десятичных разведений)
ISO 6887-2 Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 2: Specific rules for the preparation of meat and meat products (Микробиология пищевых продуктов и кормов для животных. Подготовка проб, исходной суспензии и десятикратных разведений для микробиологических исследований. Часть 2. Специальные правила подготовки мяса и мясных продуктов)
ISO 6887-3 Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 3: Specific rules for the preparation of fish and fishery products (Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 3. Специальные правила для приготовления рыбы и рыбных продуктов)
ISO 6887-4 Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 4: Specific rules for the preparation of products other than milk and milk products, meat and meat products, and fish and fishery products (Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 4. Специальные правила для приготовления продуктов, кроме молока и молочных продуктов, мяса и мясных продуктов и рыбы и рыбопродуктов)
ISO 7218 Microbiology of food and animal feeding stuffs - General requirements and guidance for microbiological examinations (Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям)
ISO 8261 Milk and milk products. General guidance for the preparation of tests samples, initial suspensions and decimal dilutions for microbiological examination (Молоко и молочные продукты - Общие правила приготовления проб для испытаний, исходных суспензий и десятикратных разведений для микробиологических исследований)
ISO/TS 11133-1 Microbiology of food and animal feeding stuffs - Guidelines on preparation and production of culture media - Part 1: General guidelines on quality assurance for the preparation of culture media in the laboratory (Микробиология пищевых продуктов и кормов для животных. Правила приготовления и производства питательных сред. Часть 1. Общие правила по обеспечению качества приготовления питательных сред в лаборатории)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 условно-патогенные Yersinia enterocolitica: Психротрофные бактерии, образующие характерные колонии на плотной селективной среде и обладающие биохимическими свойствами, относящимися к критериям патогенности, описание которых приведено в настоящем стандарте.
3.2 обнаружение условно-патогенных Yersinia enterocolitica: Определение присутствия или отсутствия данных бактерий в определенной массе или объеме продукта после проведения испытания в соответствии с настоящим стандартом.
4 Сущность метода
4.1 Общие положения
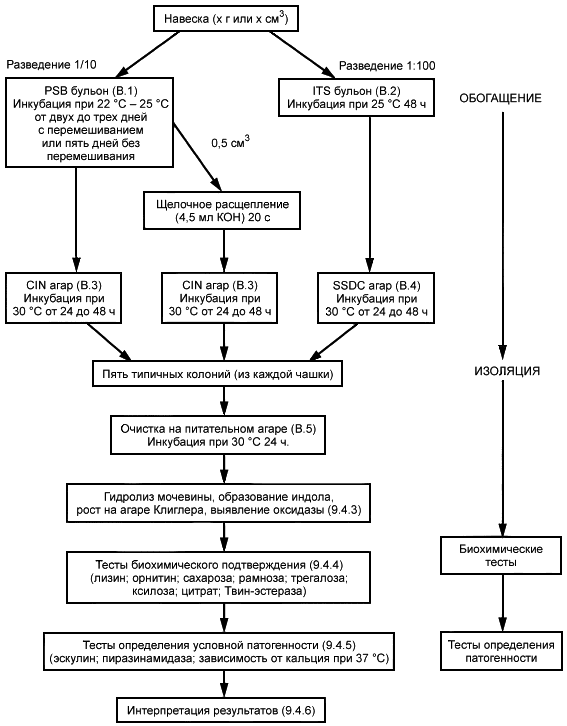
Метод обнаружения условно-патогенных бактерий Yersinia enterocolitica состоит из трех последовательных этапов.
4.2 Обогащение в селективной жидкой среде
Пробой продукта инокулируют две среды обогащения:
- бульон, содержащий пептон, сорбит и желчные соли (PSB), и
- бульон, содержащий иргазан, тикарциллин и хлорат калия (ITC).
ITC бульон инкубируют при температуре (25±1) °С в течении 48 ч, a PSB бульон в течение 3-5 дней.
Примечание - Обогащение в ITC бульоне предназначено [1] для изоляции Yersinia enterocolitica биовара 4/серовара О:3, но не для биовара 1В серовара О:8, биовара 2/серовара О:9 [2], или биовара 2 серовара О:5,27. Для изоляции Yersinia enterocolitica биовара 2/серовара О:9 необходимо использовать среду ITC бульон без хлората и с содержанием хлорида магния исходной концентрацией 80% и малахитового зеленого [3].
4.3 Пересев на чашки для идентификации
Культуры, полученные по 4.2, пересевают на следующие две селективные агаризованные среды:
- агар с цефсулодином, иргазаном и новобиоцином (CIN) [7];
- сальмонелла/шигелла агар, с дезоксихолатом натрия и хлоридом кальция (SSDC).
Посевы инкубируют при 30 °С, просматривают в зависимости от среды через 24 ч и, если необходимо, после 48 ч при просмотре отмечают наличие характерных колоний Yersinia enterocolitica.
4.4 Подтверждение
Выделенные колонии, предположительно относящиеся к бактериям Yersinia enterocolitica, проверяют с помощью подтверждающих биохимических тестов, тестов для биотипирования, тестов являющихся критериями патогенности, и возможных серологических тестов.
5 Реактивы и среды
Общие правила микробиологических исследований - по ISO 7218, специальные требования к качеству и приготовлению сред - по ISO/TS 11133-1, практические руководства по эксплуатационным испытаниям питательных сред - по ISO/TS 11133-2.
В связи с большим количеством питательных сред и реагентов и для удобства пользования их состав представлен в приложении В, которое содержит описание приготовления и хранения.
5.1 Среда для обогащения
5.1.1 Бульон, содержащий пептон, сорбит и желчные соли (PSB)
См. В.1.
5.1.2 Бульон, содержащий иргазан, тикарциллин и хлорат калия (ITC)
См. В.2.
5.2 Агаризованные среды для пересева на чашки
5.2.1 Агар с цефсулодином, иргазаном и новобиоцином (CIN)
См. В.3.
5.2.2 Сальмонелла/Шигелла агар, с дезоксихолатом натрия и хлоридом кальция (SSDC)
См. В.4.
5.2.3 Питательный агар
См. В.5.
5.3 Среды и реактивы для идентификации
5.3.1 Среда уреаза/индол
См. В.6.
5.3.2 Реактивы для определения индола
См. В.7.
5.3.3 Агар Клиглера
См. В.8.
5.3.4 Реактивы для определения оксидазы
См. В.9.
5.3.5.1 Лизин декарбоксилазная среда
См. В.10.
5.3.5.2 Орнитин декарбоксилазная среда
См. В.11.
5.3.6 Среда для ферментации углеводов (сахароза, рамноза, тригалоза и ксилоза)
См. В.12.
5.3.7 Цитратная среда Симмонса
См. В.13.
5.3.8 Твин-эстеразная среда
См. В.14.
5.3.9 Агар с желчью и эскулином
См. В.15.
5.3.10 Агар с казеином и соей
См. В.16.
5.3.11 Казеин соевый агар, для определения пиразинамидазы
5.3.12 Железо (II) аммоний цитрат раствор, для определения пиразинамидазы
См. В.18.
5.3.13 Казеин-соевый агар, с магнием и оксалатом.
См. В.19.
5.4 Солевой раствор
См. В.20.
5.5 Гидроксид калия в солевом растворе
См. В.21.
5.6 Настой телятины, бульон
См. В.22.
5.7 Стерильный глицерин
См. В.23.
6 Аппаратура и материалы
Примечание - Инструменты одноразового применения - приемлемая альтернатива стеклянной посуде многократного пользования, если они имеют подходящие технические характеристики.
Оборудование обычной микробиологической лаборатории (см. ISO 7218) и, в частности, следующее:
6.1 Аппаратура для стерилизации (печь) или влажной стерилизации (автоклав).
6.2 Термостаты, способные поддерживать температуру (22±1) °С, (25±1) °С, (30±1) °С и (37±1) °С.
6.3 Сушильные шкафы или печи, с конвективной вентиляцией, способные поддерживать температуру от (37±1) °С до (50±1) °С.
6.4 Водяные бани или термостаты, способные поддерживать температуру (22±1) °С, (24±1) °С и (25±1) °С, предпочтительнее с перемешивающим оборудованием.
6.5 Водяная баня, поддерживающая температуру от 44 °С до 47 °С.
6.6 Пробирки, размерами 18180 мм, 9
180 мм и 12
50 мм.
6.7 Бутылки и/или колбы подходящей вместимости.
6.8 Чашки Петри, сделанные из стекла или пластика, диаметром от 90 до 100 мм.
6.9 Мерные пипетки номинального объема 10 см и 1 см
, градуированные, с ценой деления 0,1 см
.
6.10 Пипеторы или другие микробиологические системы защиты пипеток.
6.11 Петля диаметром около 3 мм, из провода из платины/иридия и/или никеля/хрома, стеклянные стержни и пастеровские пипетки.
Могут использоваться стерильные пластиковые одноразовые петли или иглы.
Петля из никель/хрома не подходит для оксидазного теста (см. 9.4.3.5).
6.12 рН-метр, с точностью измерения до 0,1 единицы рН при температуре 25 °С.
6.13 Свет, настроенный для косого освещения.
6.14 Увеличительное стекло или стереомикроскоп.
6.15 Перистальтический блендер.
7 Отбор проб
Важно, чтобы для испытания в лабораторию поступила представительная проба, не поврежденная и не измененная в ходе транспортирования или хранения.
Замораживание проб перед проведением анализа не рекомендуется, несмотря на то, что бактерии рода Yersinia выявляются в замороженных продуктах.
Отбор проб не является частью метода, установленного в настоящем стандарте. В случае отсутствия конкретного стандарта на отбор проб продукта рекомендуется, чтобы заинтересованные стороны достигли согласия по процедуре отбора проб.
8 Приготовление испытуемой пробы
Пробу для испытания готовят в соответствии с определенной частью ISO 6887 или стандартом на конкретный продукт. В случае отсутствия конкретного стандарта рекомендуется, чтобы заинтересованные стороны достигли согласия по данному вопросу.
9 Порядок проведения испытания (см. приложение А)
9.1 Проба для испытания и исходная суспензия
9.1.1 См. соответствующую часть ISO 6887 или ISO 8261, или стандарта на конкретный продукт.
9.1.2 Для приготовления исходной суспензии помещают количество пробы для испытания (известной массы или объема) в известный объем PSB бульона (В.1), для достижения разведения 1/10 (по массе к объему или объему к объему). Гомогенизируют суспензию, используя перистальтический блендер в течение 2 мин.
9.1.3 Готовят вторую исходную суспензию по тому же принципу с ITC бульоном (В.2) так, чтобы получить соотношение навески к среде обогащения разведением 1/100 (масса к объему или объем к объему).
9.2 Обогащение
Инкубируют две исходные суспензии (9.1.2 и 9.1.3) следующим образом:
a) PSB среду при температуре от 22 °С до 25 °С от 42 до 72 ч с перемешиванием или в течение пяти дней без перемешивания.
b) ITC среду при температуре 25 °С в течение 48 ч.
9.3 Пересев и идентификация
9.3.1 После инкубации в среде обогащения (9.2) необходимо провести следующие операции:
9.3.2 Культуру, выросшую на PSB бульоне (9.2), пересевают посредством петли (6.11) на поверхность чашки Петри с CIN агаром (В.З) для получения хорошо изолированных колоний.
9.3.3 Используя стерильную пипетку (6.9), переносят 0,5 см культуры, выросшей на PSB бульоне (9.2), в 4,5 см
раствора гидроксида калия (В.21) и перемешивают. После выдержки в течение (20±5) с инокулируют с помощью петли (6.11) поверхность чашки с CIN агаром (В.3) для получения хорошо изолированных колоний.
9.3.4 Культурой, выросшей на ITC бульоне (9.2), инокулируют с помощью петли (6.11) поверхность чашки с SSDC агаром (В.4) для получения хорошо изолированных колоний.
9.3.5 Переворачивают чашки вверх дном (9.3.2-9.3.4) и помещают их в термостат (6.2) при температуре 30 °С.
9.3.6 После инкубирования в течение 24 ч проверяют чашки с помощью увеличительного стекла (6.14), предпочтительно снабженного косым светом (6.13) с целью выявления присутствия колоний, типичных для Yersinia enterocolitica по следующим признакам:
a) на CIN агаре типичные колонии Yersinia enterocolitica мелкие (1 мм), ровные с красным центром и полупрозрачными краями, при проверке с помощью косого света (6.13) не имеют радужного перелива и тонко гранулированы;
b) на SSDC агаре типичные колонии Yersinia enterocolitica мелкие (1 мм) и серые с расплывчатыми краями, не обладают радужным переливом и тонко гранулированы при проверке под лучами косого света.
Примечание - Косой падающий свет помогает отличать типичные колонии Yersinia enterocolitica от похожих колоний бактерий рода Pseudomonas.
9.3.7 Если рост колоний медленный - окраска слабая или если нет типичных колоний - продолжается инкубация в чашках до 48 ч, и затем их снова просматривают.
9.4 Подтверждение
9.4.1 Для биохимической идентификации может быть использован коммерчески доступный и позволяющий проводить идентификацию Yersinia enterocolitica набор. Некоторые минимальные наборы для биохимической идентификации не идентифицируют точно такие виды бактерий рода Yersinia как Yersinia mollaretii и Yersinia bercovieri (прежние биовары Yersinia enterocolitica 3А и 3В) и Yersinia intermedia, которые идентифицируются как Yersinia enterocolitica. В этом случае должно быть проведено определение образования кислоты из муката. Требуется улучшение различительных тестов данных минимальных наборов для биохимической идентификации.
9.4.2 Отбор колоний для подтверждения
9.4.2.1 Для подтверждения берут с каждой чашки каждой селективной среды (см. 9.3.2-9.3.4) пять колоний, считающихся типичными или предположительно типичными. Переносят отобранные колонии на поверхность чашек с питательным агаром (В.5) таким образом, чтобы получить рост хорошо изолированных колоний.
Посевы инкубируют при температуре 30 °С в течение 24 ч.
Проверяют чашки на чистоту культуры. Если присутствуют смешанные культуры, то переносят каждую индивидуальную колонию снова на питательный агар и инкубируют, как указано выше.
Используют только чистые культуры для биохимических подтверждений и тестов на патогенность.
9.4.2.2 Плазмиды, которые определяют свойства патогенности бактерий рода Yersinia, могут быть спонтанно потеряны во время культивирования свыше 30 °С или при длительном культивировании при температуре ниже 30 °С.
Поэтому их сохраняют как замороженные культуры путем немедленного культивирования каждой чистой культуры в настое телячьего бульона (В.22).
Посевы инкубируют при температуре от 22 °С до 25 °С в течение от 24 до 48 ч. Добавляют 10%-ный стерильный глицерин (В.23), хорошо перемешивают и замораживают, предпочтительно до температуры минус 70 °С.
9.4.3 Тесты для определения принадлежности культур к Yersinia enterocolitica
9.4.3.1 При помощи петли (6.11) инокулируют среды по 9.4.3.2-9.4.3.4 и проводят определение оксидазы, как описано в 9.4.3.5, для каждой культуры, полученной из колоний, отобранных по 9.4.2.
9.4.3.2 Определение уреазы (гидролиза мочевины)
Необходимо использовать прочный инструмент для инокуляции бульона под поверхность уреаза/индол среды (В.6).
Посевы инкубируют при температуре 30 °С в течение 24 ч, предпочтительно на водяной бане.
Розовато-фиолетовый или красно-розовый цвета указывают на положительную уреазную реакцию. Yersinia enterocolitica в большинстве случаев дает положительную реакцию на уреазу в течение от 1 до 5 мин. Скорость позитивной реакции может быть критерием диагностической оценки.
Оранжево-желтый цвет указывает на негативную уреазную реакцию (отсутствие гидролиза мочевины). Может иметь место ложная негативная реакция, если среда инокулирована микроорганизмами, не относящимися к Yersinia enterocolitica.
9.4.3.3 Определение образования индола
Добавляют от 0,1 до 0,2 см реактива (В.7) в пробирки (9.4.3.2) для выявления индола.
Красное кольцо, которое образуется в течение 15 мин на поверхности среды, указывает на позитивную реакцию.
9.4.3.4 Определение роста на агаре Клиглера
Проводят посев уколом столбика агара и затем проводят посев по всей скошенной поверхности (В.7.2).
Посевы инкубируют при температуре 30 °С в течение от 24 до 48 ч.
Интерпретируют изменения в среде следующим образом:
a) столбик агара
- желтый - глюкоза положительная (ферментирует глюкозу);
- красный или неизменившийся: глюкоза отрицательная (глюкозу не ферментирует);
- черный - образование сероводорода;
- пузырьки или разрывы - образование газа из глюкозы;
b) скошенная поверхность агара
- желтая: лактоза положительная (утилизация лактозы);
- красная или неизменившаяся: лактоза отрицательная (нет утилизации лактозы).
9.4.3.5 Выявление оксидазы
Используя стеклянный стержень или петлю из платины/иридия (6.11), отбирают часть каждой выбранной типичной колонии (9.4.2) и распределяют ее на слегка влажной (одна капля) фильтровальной бумаге с реактивом на оксидазу (В.9) или на диске, который имеется в продаже. Не используют петлю или проволоку из никеля/хрома (см. 6.11).
Тест считается отрицательным, если цвет фильтровальной бумаги не изменился на розовато-лиловый, фиолетовый или глубокий голубой в течение 10 с.
9.4.4 Тесты биохимического подтверждения
9.4.4.1 Отбор колоний и процедура
9.4.4.1.1 Идентификация колоний включает:
- гидролиз мочевины: положительная;
- образование индола: положительная или отрицательная;
- ферментация глюкозы: положительная;
- образование газа из глюкозы: отрицательная;
- ферментация лактозы: отрицательная;
- образование сероводорода: отрицательная;
- выявление оксидазы: отрицательная.
Примечания
1 Мочевиноотрицательные виды существуют, но не известны как патогенные.
2 При образовании газа из глюкозы может образовываться несколько пузырьков. Хотя считается, что Yersinia, как правило, ферментирует углеводы без образования газа, некоторые виды Yersinia enterocolitica (такие, как Yersinia enterocolitica биовар 3) могут образовывать один или два пузырька (слабое газообразование).
3 Некоторые виды Yersinia enterocolitica являются лактозоположительными и извлекаются главным образом из молочных продуктов. Согласно современным знаниям они, в основном, не патогенны.
9.4.4.1.2 Используя петлю или проволоку (6.11), инокулируют среды по 9.4.4.2-9.4.4.5 каждой культурой, полученной из изолированных колоний (9.4.2) на питательном агаре и отобранных согласно 9.4.4.1.1.
9.4.4.2 Выявление лизиндекарбоксилазы
Проводят посевы под поверхность жидкой среды (В.10). Если пробирки не полностью наполнены средой и негерметичны, то покрывают их поверхность расплавленным (нагретым и затем сразу охлажденным, но так, что остается жидким) вазелиновым маслом или стерильным жидким парафином.
Посевы инкубируют при 30 °С в течение 24 ч.
Фиолетовый цвет после инкубирования свидетельствует о положительной реакции. Желтый цвет указывает на отрицательную реакцию.
9.4.4.3 Выявление орнитиндекарбоксилазы
Проводят посевы под поверхность жидкой среды (В.11). Если пробирки не полностью наполнены средой и негерметичны, то наслаивают на поверхность расплавленное (нагретое и затем сразу охлажденное, но так, чтобы оставалось жидким) вазелиновое масло или стерильный жидкий парафин.
Инкубируют при 30 °С в течение 24 ч.
Фиолетовый цвет после инкубирования свидетельствует о положительной реакции.
Желтый цвет указывает на отрицательную реакцию.
9.4.4.4 Ферментация сахарозы, рамнозы, тригалозы и ксилозы
Инокулируют каждую среду (В.12) под поверхность жидкости.
Посевы инкубируют при 30 °С в течение 24 ч.
Желтый цвет после инкубирования свидетельствует о положительной реакции. Красный цвет указывает на отрицательную реакцию.
9.4.4.5 Определение гидролиза цитрата
Засевают скошенную поверхность агара (В.13). Крышки пробирок закрывают неплотно так, чтобы воздух мог поступать для создания аэробных условий роста.
Посевы инкубируют при 30 °С в течение 24 ч.
Реакция положительная, если среда становится голубой.
9.4.4.6 Выявление твин-эстеразы
Засевают скошенную поверхность агара (В.14).
Посевы инкубируют при 25 °С в течение пяти дней и периодически проверяют. Реакция положительна если зоны просветления стремительно расширяются в зависимости от появления микрокристаллов олеата кальция.
9.4.5 Тест на условную патогенность
9.4.5.1 Отбор колоний и процедура
9.4.5.1.1 Для изучения используют колонии, которые имеют следующие характеристики:
- выявление лизиндекарбоксилазы: отрицательная;
- выявление орнитиндекарбоксилазы: положительная;
- ферментация рамнозы: отрицательная;
- ферментация сахарозы: положительная;
- гидролиз цитрата: отрицательная.
Примечания
1 Редкие виды условно-патогенных бактерий Yersinia enterocolitica, являющиеся сахарозоотрицательными, выделяют из свинины.
2 У биоваров Yersinia enterocolitica 4 и 5 отмечена отрицательной реакцией на орнитиндекарбоксилазу.
9.4.5.1.2 Используя петлю или проволоку (6.11), инокулируют среды по 9.4.5.2-9.4.5.4 каждой чистой культурой на питательном агаре из отобранных колоний (9.4.5.1).
9.4.5.2 Ферментация эскулина
Засевают скошенную поверхность (В.15) агара. Посевы инкубируют при 30 °С в течение 24 ч.
Черный ореол вокруг колоний указывает на положительную реакцию.
Примечание - Этот тест для ферментации эскулина эквивалентен тесту для ферментации салицина.
9.4.5.3 Выявление пиразиномидазы
Инокулируют скошенную поверхность среды (В.17).
Посевы инкубируют при (30±1) °С в течение 48 ч.
Добавляют 1 см 1%-ного железо (II) аммоний сульфата (В.18).
Появление через 15 мин розовато-коричневого цвета указывает на положительную реакцию.
9.4.5.4 Тест на усвоение кальция при 37 °С
9.4.5.4.1 Тест на усвоение кальция при 37 °С может быть заменен утилизацией ацетата натрия.
Примечание - Тесты, инкубируемые при 37 °С, могут повлечь потерю этого свойства, так как гены, в которых закодировано данное свойство, находятся в плазмидах.
9.4.5.4.2 Из каждой чистой культуры, изолированной на питательном агаре (9.4.5.1), суспендируют небольшую порцию колонии в растворе хлорида натрия (В.20) для получения суспензии с содержанием приблизительно 1000 бактерий в см.
Инокулируют 0,1 см каждой суспензии:
- две чашки с казеин-соевым агаром (В.16), и
- две чашки с казеин-соевым агаром с магнием и оксалатом (В.19).
Инкубируют одну чашку каждой среды при температуре 25 °С в течение 48 ч, и другую - при температуре 37 °С в течение 48 ч.
9.4.5.4.3 Реакция считается положительной, если при 25 °С колонии стандартного размера и если при 37 °С, в присутствии магния и оксалата, ингибирование культуры проявляется в том, что 20% колоний меньше по размеру, достигая 0,1 мм в диаметре, а остальные от 0,5 до 1 мм.
Те колонии, которые ингибируются, являются зависимыми от кальция и считаются условно патогенными.
9.4.6 Интерпретация биохимических тестов и тестов на патогенность
9.4.6.1 Виды условно-патогенных бактерий Yersinia enterocolitica в основном показывают реакции, представленные в таблице 1; могут быть проведены дополнительные тесты (см. таблицу С.1).
Таблица 1 - Интерпретация биохимических тестов и тестов на патогенность для Yersinia enterocolitica
Тест | Реакция |
Определение вида | |
Мочевина (9.4.3.2) | + |
Индол (9.4.3.3) | -/+ |
Глюкоза (9.4.3.4) | + |
Образование газа из глюкозы (9.4.3.4) | - |
Лактоза (9.4.3.4) | - |
Сероводород (9.4.3.4) | - |
Оксидаза (9.4.3.5) | - |
Лизин декарбоксилаза (9.4.4.2) | - |
Орнитин декарбоксилаза (9.4.4.3) | + |
Сахароза (9.4.4.4) | + |
Трегалоза (9.4.4.4) | +/- |
Рамноза (9.4.4.4) | +/- |
Ксилоза (9.4.4.4) | +/- |
Цитрат (9.4.4.5) | - |
Твин-эстераза (9.4.4.6) | +/- |
Определение патогенности | |
Эскулин (9.4.5.2) | - |
Пиразиномидаза (9.4.5.3) | - |
Зависимость от кальция при 37 °С (9.4.5.4) | + |
| |
9.4.6.2 Определение биовара Yersinia enterocolitica в соответствии с тестами, предложенными в таблице Д.1 (приложение Д) должно проводиться, главным образом, для подтверждения условной патогенности (Твин-эстераза, эскулин, пиразинамидаза, индол, ксилоза, трегалоза). Биовары Yersinia enterocolitica 1В, 2, 3, 4 и 5 являются патогенными.
9.4.6.3 Тесты на эскулин и пиразинамидазу проводят с целью выявления условной патогенности. Виды, показывающие эскулин и/или пиразинамидаза положительную реакцию и отрицательную реакцию на зависимость от кальция при 37 °С, не являются патогенными. Виды, показывающие эскулин и пиразинамидаза отрицательную реакцию и положительную реакцию на зависимость от кальция при 37 °С являются патогенными. Тесты на выявление патогенности следует проводить регулярно.
9.4.6.4 По эпидемиологическим показаниям должно быть проведено выявление соматических антигенов бактерий Yersinia enterocolitica. Для условно-патогенных видов используют соответствующие антисыворотки, обычно принадлежащие сероварам О:3, О:8 и О:5,27.
10 Протокол испытаний
Протокол испытаний должен содержать:
a) всю информацию, необходимую для полной идентификации пробы;
b) используемый метод приготовления проб, если он известен;
c) используемый метод испытаний со ссылкой на настоящий стандарт;
d) использованную температуру инкубирования;
e) все рабочие детали, не установленные в настоящем стандарте или дополнительные, вместе с деталями любых инцидентов, которые могли бы повлиять на результат(ы) испытаний;
f) полученный(е) результат(ы) испытания или, если были произведены повторные испытания, окончательно полученные результаты.
Протокол испытаний должен также указывать, проводились или нет дальнейшие испытания вне лаборатории и если они проводились, то каковы результаты.
Приложение А
(обязательное)
Схема процедуры
Приложение В
(обязательное)
Состав и приготовление питательных сред и реактивов
В.1 Бульон, содержащий пептон, сорбит и желчные соли (PSB)
В.1.1 Состав:
ферментативный гидролизат казеина - 5,0 г;
сорбит - 10,0 г;
натрия хлорид - 5,0 г;
натрий фосфорнокислый двузамещенный ![]() - 8,23 г;
- 8,23 г;
натрий фосфорнокислый однозамещенный моногидрат ![]() - 1,2 г;
- 1,2 г;
желчные соли - 1,5 г;
вода - 1000 см.
В.1.2 Приготовление
Растворяют компоненты или дегидратированную основу в воде, нагревая при необходимости. Если необходимо, регулируют рН так, чтобы после стерилизации он составлял 7,6±0,2 при температуре 25 °С.
Разливают среду в пробирки или колбы подходящей вместимости, чтобы получить порции, необходимые для испытуемых проб (см. 9.1.2).
Стерилизуют в течение 15 мин в автоклаве (6.1) при температуре 121 °С.
В.2 Бульон, содержащий иргазан, тикарциллин, хлорат калия (ITC)
В.2.1 Основа среды
В.2.1.1 Состав:
ферментативный гидролизат казеина - 10,0 г;
дрожжевой экстракт - 1,0 г;
магний хлористый 6-водный ![]() - 60,0 г;
- 60,0 г;
натрия хлорид - 5,0 г;
малахитовый зеленый, 0,2% водный раствор - 5,0 см;
вода - 1000 см.
В.2.1.2 Приготовление
Растворяют компоненты или дегидратированную основу в воде, нагревая при необходимости. Если необходимо, регулируют рН так, чтобы после стерилизации он составлял 6,9±0,2 при температуре 25 °С.
Разливают основу среды в колбы (6.7) подходящей вместимости, для получения необходимых порций (например, 988 см для 1 дм
готовой среды). Стерилизуют в течение 15 мин в автоклаве (6.1) при температуре 121 °С.
В.2.2 Раствор тикарциллина (1 мг/см)
В.2.2.1 Состав
тикарциллин - 10,0 мг;
вода - 10 см.
В.2.2.2 Приготовление
Растворяют тикарциллин в воде. Стерилизуют фильтрацией.
В.2.3 Иргазан [5-хлоро-2-(2,4-дихлорофенокси)фенол], спиртовой раствор (1 мг/см)
В.2.3.1 Состав:
иргазан - 10,0 мг;
этанол, 95% (по объему) - 10,0 см.
В.2.3.2 Приготовление
Растворяют иргазан в этаноле перед использованием или хранят раствор при температуре минус 20 °С не более четырех недель.
В.2.4 Раствор хлората калия (100 мг/см)
В.2.4.1 Состав:
калия хлорат ![]() - 10,0 г;
- 10,0 г;
вода - 100 см.
В.2.4.2 Приготовление
Растворяют хлорат калия в воде. Стерилизуют фильтрацией.
В.2.5 Готовая среда
В.2.5.1 Состав:
основа среды (В.2.1) - 988 см;
раствор тикарциллина (В.2.2) - 1 см;
раствор иргазана (В.2.3) - 1 см;
раствор хлората калия (В.2.4) - 10 см.
В.2.5.2 Приготовление
При необходимости, добавляют, соблюдая правила асептики, растворы тикарциллина, иргазана и хлората калия к основе среды, охлаждают до 47 °С и перемешивают.
Асептически разливают среду в пробирки по 10 см или колбы подходящей вместимости по 100 см
(см. 9.1.3), при этом должно быть минимальное соотношение свободного объема к объему среды (относительный анаэробиоз).
В.3 Агар, содержащий цефсулодин, иргазан и новобиоцин (CIN)
В.3.1 Основа среды
В.3.1.1 Состав:
ферментативный гидролизат желатина - 17,0 г;
ферментативный гидролизат казеина и тканей животных - 3,0 г;
дрожжевой экстракт - 2,0 г;
маннит - 20,0 г;
пируват натрия - 2,0 г;
натрия хлорид - 1,0 г;
магния сульфат 7-водный ![]() - 0,01 г;
- 0,01 г;
дезоксихолат натрия - 0,5 г;
нейтральный красный - 0,03 г;
кристаллический фиолетовый - 0,001 г;
агар - 9-18 г;
_______________
В зависимости от желирующих свойств.
вода - 1000 см.
В.3.1.2 Приготовление
Растворяют при кипячении компоненты или дегидратированную основу в воде. Если необходимо, регулируют рН так, чтобы после стерилизации он составлял 7,4±0,2 при температуре 25 °С.
Разливают основную среду в колбы (6.7) подходящего объема. Стерилизуют в течение 15 мин в автоклаве (6.1) при температуре 121 °С.
В.3.2 Раствор цефсулодина (15 мг/см)
В.3.2.1 Состав:
цефсулодин - 1,5 г;
вода - 100 см.
В.3.2.2 Приготовление
Растворяют цефсулодин в воде. Стерилизуют фильтрацией.
В.3.3 Иргазан [5-хлоро-2-(2,4-дихлорофенокси)фенол], спиртовой раствор (4 мг/см)
В.3.3.1 Состав:
иргазан - 0,4 г;
этанол, 95% (от объема) - 100 см.
В.3.3.2 Приготовление
Перед применением растворяют иргазан в этаноле, допускается хранение раствора при температуре приблизительно минус 20 °С не более четырех недель.
В.3.4 Раствор новобиоцина (2,5 мг/см)
В.3.4.1 Состав:
новобиоцин - 0,25 г;
вода - 100 см.
В.3.4.2 Приготовление
Растворяют новобиоцин в воде. Стерилизуют фильтрацией.
В.3.5 Готовая среда
В.3.5.1 Состав:
основа среды (В.3.1) - 997 см;
раствор цефсулодина (В.3.2) - 1 см;
раствор иргазана (В.3.3) - 1 см;
раствор новобиоцина - 1 см.
В.3.5.2 Приготовление
Добавляют асептически раствор каждого антибиотика к основе среды, охлажденной до 45 °С, и перемешивают.
В.3.5.3 Приготовление чашек с CIN агаром
Разливают в стерильные чашки Петри (6.8) приблизительно по 15-20 см готовой среды. Оставляют на горизонтальной поверхности для застывания.
В.4 Сальмонелла/Шигелла агар с дезоксихолатом натрия и хлоридом кальция (SSDC)
В.4.1 Состав:
дрожжевой экстракт - 5,0 г;
мясной экстракт - 5,0 г;
ферментный гидролизат животных тканей - 5,0 г;
лактоза - 10,0 г;
желчные соли - 8,5 г;
дезоксихолат натрия - 10,0 г;
хлорид кальция - 1,0 г;
цитрат натрия - 10,0 г;
тиосульфат натрия 5-водный ![]() - 8,5 г;
- 8,5 г;
железо (III) цитрат - 1,0 г;
бриллиантовый зеленый - 0,0003 г;
нейтральный красный - 0,025 г;
агар - 9-18 г;
_______________
В зависимости от желирующих свойств.
вода - 1000 см.
В.4.2 Приготовление
Растворяют компоненты или дегидратированную основу в воде при кипячении. Если необходимо, регулируют рН так, чтобы он составлял 7,4±0,2 при температуре 25 °С. Не стерилизуют.
В.4.3 Приготовление чашек с SSDC агаром
Разливают в стерильные чашки Петри (6.8) приблизительно по 15-20 см готовой среды, охлажденной до 45 °С. Оставляют на горизонтальной поверхности для застывания.
Приготовленные заранее чашки с неподсушенным агаром должны храниться в темном месте одну неделю при температуре (8±2) °С в пластиковом пакете. Не следует охлаждать их до температуры (3±2) °С, так как в среде образуется осадок и ухудшаются ее характеристики.
В.5 Питательный агар
В.5.1 Состав:
мясной экстракт - 3,0 г;
пептон - 5,0 г;
агар - 9-18 г;
_______________
В зависимости от желирующих свойств.
вода - 1000 см.
В.5.2 Приготовление
Растворяют компоненты или дегидратированную основу в воде, доводя до кипения. Если необходимо, регулируют рН так, чтобы после стерилизации он составлял 7,0±0,2 при температуре 25 °С. Разливают среду в колбы (6.7) подходящей вместимости. Стерилизуют в течение 15 мин в автоклаве (6.1) при температуре 121 °С.
В.5.3 Приготовление чашек с питательным агаром
Разливают в стерильные чашки Петри (6.8) приблизительно по 15-20 см готовой среды, охлажденной до 45 °С. Оставляют на горизонтальной поверхности для застывания.
В.6 Среда уреаза/индол
В.6.1 Состав:
L-Триптофан, не содержащий индол - 3,0 г;
однозамещенный фосфорнокислый калий ![]() - 1,0 г;
- 1,0 г;
двузамещенный фосфорнокислый калий ![]() - 1,0 г;
- 1,0 г;
натрия хлорид - 5,0 г;
мочевина - 20,0 г;
этанол 95% (по объему) - 10 см;
феноловый красный - 0,025 г;
вода - 1000 см.
В.6.2 Приготовление
Растворяют L-Триптофан в воде, нагретой до 60 °С, охлаждают, затем растворяют остальные компоненты в воде, размешивая их.
Альтернативный путь - размешивание дегидратированной основы в воде.
Если необходимо, регулируют рН так, чтобы он составлял 6,9±0,2 при температуре 25 °С. Стерилизуют фильтрованием. Асептически разливают среду по 0,5 см в стерильные пробирки размером 12
50 мм (6.6). Хранят в темном месте при температуре (3±2) °С.
В.7 Реактив Ковача
В.7.1 Состав:
4-диметиламинобензальдегид - 5,0 г;
соляная кислота, плотностью от 1,18 г/ см
до 1,19 г/ см
- 25 см
;
2-метилбутан-2-ол - 75 см.
В.7.2 Приготовление
Растворяют 4-диметиламинобензальдегид в 2-метилбутан-2-оле на водяной бане при температуре 60 °С. Охлаждают до комнатной температуры и помещают колбы в ледяную ванну. Затем осторожно добавляют соляную кислоту, медленно перемешивая. Хранят при температуре (3±2) °С во флаконах янтарного цвета. Не следует применять резиновые бутылочные крышки, так как они портят реактивы.
В.8 Агар Клиглера
В.8.1 Состав:
мясной экстракт - 3,0 г;
дрожжевой экстракт - 3,0 г;
казеин панкреатический пептон - 20,0 г;
натрия хлорид - 5,0 г;
лактоза - 10,0 г;
глюкоза - 1,0 г;
железо (II) сульфат - 0,2 г;
тиосульфат натрия 5-водный ![]() - 0,3 г;
- 0,3 г;
феноловый красный - 0,025 г;
агар - 9-18 г;
_______________
В зависимости от желирующих свойств.
вода - 1000 см.
В.8.2 Приготовление
Растворяют компоненты или дегидратированную основу в воде, доводя ее до кипения. Если необходимо, регулируют рН так, чтобы после стерилизации он составлял 7,4±0,2 при температуре 25 °С. Разливают среду по 10 см в пробирки (6.6) подходящей вместимости. Стерилизуют в течение 15 мин в автоклаве (6.1) при температуре 121 °С.
Оставляют пробирки в наклонном положении, пока агар застывает, так, чтобы получить столбик приблизительно 3 см высотой и скошенную поверхность длиной 5 см.
В.9 Реактив для выявления оксидазы
В.9.1 Состав:
N,N,N',N' -тетраметил-пара-фенилендиамин дихлоргидрат - 1,0 г);
_______________
Дигидрохлорид может быть замещен оксалатом, но срок годности приготовленного раствора короче.
вода -100 см.
В.9.2 Приготовление
Растворяют реактивы в воде непосредственно перед использованием.
Хранить при температуре (3±2) °С в темном месте не более одной недели.
В.10 Лизин декарбоксилазная среда
В.10.1 Состав:
L-лизин моногидрохлорид - 5,0 г;
дрожжевой экстракт - 3,0 г;
глюкоза - 1,0 г;
бромкрезоловый пурпурный - 0,015 г;
вода - 1000 см.
В.10.2 Приготовление
Растворяют компоненты в воде, нагревая при необходимости.
Если необходимо, регулируют рН так, чтобы после стерилизации он составлял 6,8±0,2 при температуре 25 °С. Разливают среду по 5 см в пробирки, размером 9
180 мм (6.6). Стерилизуют в течение 15 мин в автоклаве (6.1) при температуре 121 °С.
В.11 Орнитин декарбоксилазная среда
В.11.1 Состав:
L-орнитин моногидрохлорид - 5,0 г;
дрожжевой экстракт - 3,0 г;
глюкоза - 1,0 г;
бромкрезоловый пурпурный - 0,015 г;
вода - 1000 см.
В.11.2 Приготовление
Растворяют компоненты в воде, при необходимости производя нагрев. Если необходимо, регулируют рН так, чтобы после стерилизации он составлял 6,8±0,2 при температуре 25 °С. Разливают среду по 5 см в пробирки, размером 9
180 мм (6.6). Стерилизуют в течение 15 мин в автоклаве (6.1) при температуре 121 °С.
В.12 Среда для ферментации углеводов (пептонная вода с феноловым красным, рамнозой или сахарозой, или трегалозой, или ксилозой)
В.12.1 Основа среды
В.12.1.1 Состав:
пептон - 10,0 г;
натрия хлорид - 5,0 г;
феноловый красный - 0,02 г;
вода - 1000 см.
В.12.1.2 Приготовление
Растворяют компоненты или дегидратированную основу в воде, нагревая при необходимости. Если необходимо, регулируют рН так, чтобы после стерилизации он составлял 6,8±0,2, при температуре 25 °С. Разливают основную среду в колбы (6.7) подходящей вместимости. Стерилизуют в течение 10 мин в автоклаве (6.1) при температуре 121 °С.
В.12.2 Растворы углеводов (рамнозы, сахарозы, трегалозы или ксилозы, 100 мг/см)
В.12.2.1 Состав:
углевод (рамноза, сахароза, трегалоза или ксилоза) - 10,0 г;
вода - 100 см.
В.12.2.2 Приготовление
Готовят отдельные растворы каждого углевода, добавляя его в дистиллированную воду. Стерилизуют фильтрацией.
В.12.3 Готовая среда
В.12.3.1 Состав:
основа среды (В.12.1) - 900 см;
раствор углевода (В.12.2) - 100 см.
В.12.3.2 Приготовление
Для каждого углевода добавляют асептически раствор углевода в основу среды, охлажденную до 45 °С, и перемешивают.
Разливают с соблюдением правил асептики готовую среду по 100 см в пробирки (6.6) или бутылки (6.7) подходящей вместимости.
В.13 Цитратная среда Симмонса
В.13.1 Состав:
натрия цитрат - 2,0 г;
натрия хлорид - 5,0 г;
двузамещенный фосфорнокислый калий ![]() - 1,0 г;
- 1,0 г;
бромтимоловый голубой - 0,08 г;
аммония дигидрофосфат ![]() - 1,0 г;
- 1,0 г;
магния сульфат - 0,2 г;
агар - 9-18 г;
_______________
В зависимости от желирующих свойств.
вода -1000 см.
В.13.2 Приготовление
Растворяют компоненты или дегидратированную основу в воде, доводя ее до кипения. Если необходимо, регулируют рН так, чтобы после стерилизации он составлял 6,8±0,2, при температуре 25 °С. Разливают среду по 10 см в пробирки (6.6) подходящей вместимости. Если новые пробирки не доступны, перед использованием необходимо тщательно очистить имеющиеся; важно, чтобы в них не оставалось веществ, способных помешать данному исследованию.
Стерилизуют в течение 15 мин в автоклаве (6.1) при температуре 121 °С. Оставляют пробирки в наклонном положении для получения скошенной поверхности и столбика высотой 2,5 см.
В.14 Среда для теста на Твин-эстеразу
В.14.1 Основа среды
В.14.1.1 Состав:
пепсиновый гидролизат мяса - 10,0 г;
натрия хлорид - 5,0 г;
кальция хлорид ![]() - 0,1 г;
- 0,1 г;
агар - 9-18 г;
_______________
В зависимости от желирующих свойств.
вода - 1000 см.
В.14.1.2 Приготовление
Растворяют компоненты в воде, при необходимости нагревая. Если необходимо, регулируют рН так, чтобы после стерилизации он составлял 7,4±0,2 при температуре 25 °С. Стерилизуют в течение 30 мин в автоклаве (6.1) при температуре 121 °С.
В.14.2 Готовая среда
В.14.2.1 Состав:
основа (В.14.1) - 990 см;
Твин 80 (сорбитол моно-олеат) - 10 см
.
В.14.2.2 Приготовление
Добавляют раствор Твин 80 к жидкой основе и гомогенизируют. Стерилизуют в течение 30 мин в автоклаве (6.1) при температуре 110 °С. Разливают среду по 2,5 см
в пробирки (6.6) подходящей вместимости.
Кладут пробирки практически в горизонтальное положение так, чтобы получить длинную скошенную поверхность с минимальным столбиком.
В.15 Агар с желчью и эскулином
В.15.1 Состав:
мясной экстракт - 3,0 г;
мясной пептон - 5,0 г;
эскулин - 1,0 г;
желчные соли - 40,0 г;
железо (III) цитрат - 0,5 г;
агар - 9-18 г;
_______________
В зависимости от желирующих свойств.
вода - 1000 см.
В.15.2 Приготовление
Растворяют компоненты или дегидратированную основу в воде, доводя ее до слабого кипения. Если необходимо, регулируют рН так, чтобы после стерилизации он составлял 6,6±0,2 при температуре 25 °С. Разливают среду по 10 см в пробирки (6.6) подходящей вместимости. Стерилизуют в течение 15 мин в автоклаве (6.1) при температуре 121 °С.
Оставляют пробирки в наклонном положении для получения столбика высотой 2,5 см.
В.16 Казеин-соевый агар
В.16.1 Состав:
ферментный гидролизат казеина - 15,0 г;
соевый пептон - 5,0 г;
натрия хлорид - 5,0 г;
агар - 9-18 г;
_______________
В зависимости от желирующих свойств.
вода - 1000 см.
В.16.2 Приготовление
Растворяют компоненты или дегидратированную основу в воде, доводя ее до кипения. Если необходимо, регулируют рН так, чтобы после стерилизации он составлял 7,3±0,2 при 25 °С. Разливают среду в колбы (6.7) подходящей вместимости и в количестве 830 см. Эта среда требуется для использования в В.19.5.1. Стерилизуют в течение 15 мин в автоклаве (6.1) при температуре 121 °С.
В.17 Казеин-соевый агар для выявления пиразинамидазы
В.17.1 Состав:
ферментный гидролизат казеина - 15,0 г;
соевый пептон - 5,0 г;
пиразинкарбоксиамид ![]() - 1,0 г;
- 1,0 г;
натрия хлорид - 5,0 г;
агар - 9-18 г;
_______________
В зависимости от желирующих свойств.
трис-малеат буфер (0,2 моль/дм, рН 6) - 1000 см
.
В.17.2 Приготовление
Растворяют компоненты или дегидратированную основу в воде, доводя ее до кипения. Если необходимо, регулируют рН так, чтобы после стерилизации он составлял 7,3±0,2 при температуре 25 °С. Разливают среду по 10 см в колбы (6.7) подходящей вместимости. Стерилизуют в течение 15 мин в автоклаве (6.1) при температуре 121 °С.
После стерилизации оставляют застывать в наклонном положении для получения длинной скошенной поверхности.
В.18 Раствор сульфата аммония железа (II) для выявления пиразинамидазы
В.18.1 Состав:
сульфат аммония железа (II) - 1,0 г;
вода - 100 см.
В.18.2 Приготовление
Растворяют сульфат аммония железа (II) в воде. Желательно немедленное использование.
В.19 Казеин-соевый агар с магнием и оксалатом
В.19.1 Основа среды (см. В.16)
В.19.2 Раствор хлорида магния
В.19.2.1 Состав:
хлорид магния 6-водный ![]() (0,25 моль/дм
(0,25 моль/дм) - 5,09 г;
вода - 100 см.
В.19.2.2 Приготовление
Растворяют хлорид магния в воде. Стерилизуют фильтрацией.
В.19.3 Раствор оксалата натрия
В.19.3.1 Состав:
оксалат натрия - 3,35 г;
вода - 100 см.
В.19.3.2 Приготовление
Растворяют оксалат натрия в воде. Стерилизуют фильтрацией.
В.19.4 Раствор глюкозы
В.19.4.1 Состав:
глюкоза - 18,0 г;
вода - 100 см.
В.19.4.2 Приготовление
Растворяют глюкозу в воде. Стерилизуют фильтрацией.
В.19.5 Готовая среда
В.19.5.1 Состав:
основа среды (В.16) - 830 см;
раствор хлорида магния (В.18.2) - 80 см;
раствор оксалата натрия (В.18.3) - 80 см;
раствор глюкозы (В.18.4) - 10 см.
В.19.5.2 Приготовление
Добавляют асептически растворы хлорида магния, оксалата натрия и глюкозы к основе среды, охлажденной до 47 °С, и перемешивают.
В.19.5.3 Приготовление чашек с агаром.
Разливают по 15-20 см агара в каждую стерильную чашку Петри (6.8). Оставляют в горизонтальном положении для застывания.
В.20 Солевой раствор
В.20.1 Состав:
натрия хлорид - 5 г;
вода - 1000 см.
В.20.2 Приготовление
Растворяют хлорид натрия в воде. Разливают раствор в колбы (6.7) подходящей вместимости. Стерилизуют в течение 15 мин в автоклаве (6.1) при температуре 121 °С.
В.21 Гидроксид калия в солевом растворе
В.21.1 Состав:
гидроксид калия ![]() - 0,5 г;
- 0,5 г;
солевой раствор (В.20) - 100 см.
В.21.2 Приготовление
Растворяют гидроксид калия в солевом растворе. Разливают раствор в колбы (6.7) подходящей вместимости. Стерилизуют в течение 15 мин в автоклаве (6.1) при температуре 121 °С.
Примечание - Раствор 40%-ного гидроксида калия может быть приготовлен и храниться при (3±2) °С. Разведение 1:80 этого раствора позволяет получать 0,5%-ный раствор в 0,5%-ном растворе
.
В.22 Настой телячьего бульона
В.22.1 Состав:
телячья настойка (дегидратированная) - 500 г;
ферментный гидролизат казеина - 10 г;
натрия хлорид - 5 г;
вода - 1000 см.
В.22.2 Приготовление
Растворяют компоненты или дегидратированную основу в воде, при необходимости нагревая. Если необходимо, регулируют рН так, чтобы после стерилизации он составлял 7,4±0,2 при температуре 25 °С. Разливают среду по 10 см в пробирки (6.6) и закрывают. Стерилизуют в течение 15 мин в автоклаве (6.1) при температуре 121 °С.
В.23 Стерильный глицерин
Разливают глицерин по 100 см в колбы или бутылки и стерилизуют в течение 15 мин в автоклаве (6.1) при температуре 121 °С.
Приложение С
(справочное)
Биохимические характеристики Yersinia pseudotuberculosis, Yersinia enterocolitica и биохимически родственных видов, определенные при температуре 30 °С
С.1 Биохимические характеристики Yersinia pseudotuberculosis, Yersinia enterocolitica и биохимически родственных видов, определенные при температуре 30 °С, приведены в таблице С.1.
Таблица С.1 - Биохимические характеристики бактерий рода Yersinia, определенные при 30 °С
Тест | Yersinia pseudotuberculosis | Yersinia enterocolitica | Биохимически родственные виды |
Глюкоза | + | + | + |
Газ из глюкозы | - | - (или несколько пузырей) | - (или несколько пузырей) |
Лактоза | - | - | - |
ONPG | + | +/- | +/- |
Адонитол | - | - | - |
Целлобиоза | - | + | D |
Дульцит | - | - | - |
Маннит | + | + | + |
Мелибиоза | +/- | - | D |
Рамноза | + | - | D |
Сахароза | - | + | D |
Сорбит | - | +/- | D |
Трегалоза | + | +/- | + |
Ксилоза | + | D | + |
Эскулин | + | D | D |
Салицин | + | D | D |
Мочевина | + | + | + |
Индол | - | D | D |
Фогес - Проскауэр | - | +*/- | D |
Сероводород | - | - | - |
Деаминаза (АРР) | - | - | - |
Лизин | - | - | - |
Орнитин | - | +/- | + |
Цитрат (Симмонс) | - | - | D |
Липаза (Твин 80) | - | D | D |
Мукат | - | - | D |
| |||
Приложение D
(справочное)
Биовары (биотипы) Yersinia enterocolitica
D.1 Биовары Yersinia enterocolitica приведены в таблице D.1.
Таблица D.1 - Биовары Yersinia enterocolitica
Биовар | Твин-эстераза | Эскулин | Пиразинамидаза | Индол | Ксилоза | Трегалоза |
1А | + | + | + | + | + | + |
1В | + | - | - | + | + | + |
2 | - | - | - | (+) | + | + |
3 | - | - | - | - | + | + |
4 | - | - | - | - | - | + |
5 | - | - | - | - | D | - |
| ||||||
Приложение ДА
(справочное)
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам
Таблица ДА.1
Обозначение и наименование ссылочного международного стандарта | Степень соответствия | Обозначение и наименование межгосударственного стандарта |
ISO 6887-1 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 1. Общие правила приготовления исходной суспензии и десятичных разведений | - | * |
ISO 6887-2 Микробиология пищевых продуктов и кормов для животных. Подготовка проб, исходной суспензии и десятикратных разведений для микробиологических исследований. Часть 2. Специальные правила подготовки мяса и мясных продуктов | - | * |
ISO 6887-3 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 3. Специальные правила для приготовления рыбы и рыбных продуктов | - | * |
ISO 6887-4 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 4. Специальные правила для приготовления продуктов, кроме молока и молочных продуктов, мяса и мясных продуктов и рыбы и рыбопродуктов | - | * |
ISO 7218 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям | IDT | ГОСТ ISO 7218-2011 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям |
ISO 8261 Молоко и молочные продукты. Общие правила приготовления проб для анализа, исходных суспензий и десятичных разведений для микробиологических исследований | - | * |
ISO/TS 11133-1 Микробиология пищевых продуктов и кормов для животных. Правила приготовления и производства питательных сред. Часть 1. Общие правила по обеспечению качества приготовления питательных сред в лаборатории | IDT | ГОСТ ISO 11133-1-2011 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления культуральных сред в лаборатории |
* Соответствующий межгосударственный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов. Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: - IDT - идентичные стандарты. | ||
Библиография
[1] | WAUTERS, G., GOOSSENS, V., JANSSENS, M. and VANDEPITTE, J. New enrichment method for isolation of pathogenic Yersinia enterocolitica serogroup O:3 from pork. Appl. Environ. Microbiol., 54, 1988, pp.851-854 |
[2] | DE BOER, E. Isolation of Yersinia enterocolitica from foods. Int. J. Food Microbiol., 17, 1992, pp.75-84 |
[3] | DE ZUTTER, L., LE MORT, L., JANSSENS, M. and WAUTERS, G. Short-comings of irgasan ticarcillin chlorate broth for the enrichment of Yersinia enterocolitica biovar 2, serovar 9 from meat. Int. J. Food. Microbiol., 23, 1994, pp.231-237 |
[4] | SCHIEMANN, D.A. Synthesis of selective agar medium for Yersinia enterocolitica. Can. J. Microbiol., 25, 1979, pp.1298-1304 |
[5] | AULISIO, C.C.G., MEHLMAN, I.J. and SANDERS, A.C. Alkali method for rapid recovery of Yersinia enterocolitica and Yersinia pseudotuberculosis from foods. Appl. Environ. Microbiol., 39, 1980, pp.135-140 |
[6] | ARCHER, J.R., SCHELL, R.F., PENNELL, D.R. and WICK, P.D. Identification of Yersinia spp. with the API 20E system. J. Clin. Microbiol., 25, 1987, pp.2398-2399 |
[7] | SHARMA, N.K., DOYLE, P.W., GERBASI, S.A. and JESSOP, J.H. Identification of Yersinia species by the API 20E. J. Clin. Microbiol., 28, 1990, pp.1443-1444 |
[8] | FARMER III, J.J., CARTER, G.P., MILLER, V.L., FALKOW, S. and WACHSMUTH, I.K. Pyrazinamidase, CR-MOX Agar, Salicin Fermentation - Esculin Hydrolysis, and D-Xylose fermentation for identifying pathogenic serotypes of Yersinia enterocolitica. J. Clin. Microbiol., 30, 1992, pp.2589-2594 |
[9] | Food and Drug Administration. Protocol in FDA. Yersinia enterocolitica and Yersinia pseudotuberculosis. In: Bacteriological Analytical Manual, 8th edn., Washington, DC, 1998 |
__________________________________________________________________________
УДК 543.9:006.354 МКС 07.100.30 IDT
Ключевые слова: микробиология, пищевые продукты, корма для животных, Yersinia enterocolitica, инкубирование посевов, чашки Петри, питательные среды, обогащение, пересев, идентификация, биовары
__________________________________________________________________________
Электронный текст документа
и сверен по:
, 2014

