ГОСТ Р ИСО 17604-2011
Группа Н19
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ ДЛЯ ЖИВОТНЫХ
Отбор проб с туши для микробиологического анализа
Microbiology of food and animal feeding stuffs. Carcass sampling for microbiological analysis
ОКС 07.100.30
Дата введения 2013-01-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 ПОДГОТОВЛЕН Государственным научным учреждением Всероссийским научно-исследовательским институтом мясной промышленности им. В.М.Горбатова Российской академии сельскохозяйственных наук (ГНУ ВНИИМП им. В.М.Горбатова Россельхозакадемии) на основе собственного аутентичного перевода на русский язык стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 226 "Мясо и мясная продукция"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 13 декабря 2011 г. N 942-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 17604:2003* "Микробиология пищевых продуктов и кормов для животных. Отбор проб с туши для микробиологического анализа" (ISO 17604:2003 "Microbiology of food and animal feeding stuffs - Carcass sampling for microbiological analysis"), включая изменение А1:2009 "Отбор проб с тушек домашней птицы (ISO 17604:2003/Amd.1:2009 "Amendment 1: Sampling of poultry carcasses").
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
Настоящий стандарт устанавливает методы отбора проб для выявления и подсчета количества микроорганизмов на поверхности туши в процессе первичной переработки убойных животных и сельскохозяйственной птицы (далее - птица).
Отбор проб для микробиологических исследований проводят с целью:
- производственного контроля на предприятиях, где проводится убой и/или первичная переработка крупного рогатого скота, лошадей, свиней, мелкого рогатого скота, промысловых животных и птицы;
- определения степени безопасности продукции;
- надзора за распространением патогенных микроорганизмов.
Настоящий стандарт предусматривает использование деструктивных и недеструктивных методов отбора проб, выбор которых зависит от конкретных условий.
В настоящем стандарте не регламентированы периодичность и кратность (плана) отбора проб.
В приложении А представлены рекомендуемые зоны отбора проб с туши, в приложении В - требования к микробиологическим исследованиям, в приложении С - сравнительный анализ деструктивных и недеструктивных методов, в приложении D - методы отбора проб с тушек птицы для микробиологических исследований.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты*:
_______________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ИСО 4833 Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод подсчета микроорганизмов. Метод подсчета колоний при температуре 30 °С (ISO 4833 Microbiology of food and animal feeding stuffs - Horizontal method for the enumeration of microorganisms - Colony-count technique at 30 °C)
ИСО 5552* Мясо и мясные продукты. Обнаружение и подсчет Enterobacteriaceae без восстановления жизненных функций. Метод наиболее вероятного числа и метод подсчета колоний (ISO 5552 Meat and meat products - Detection and enumeration of Enterobacteriaceae without resuscitation - MPN technique and colony-count technique)
_______________
* Заменен на ИСО 21528-1, ИСО 21528-2.
ИСО 6579 Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод обнаружения Salmonella spp. (ISO 6579 Microbiology of food and animal feeding stuffs - Horizontal method for the detection of Salmonella spp.)
ИСО 6887-1 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 1. Общие правила приготовления исходной суспензии и десятичных разведений (ISO 6887-1 Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 1: General rules for the preparation of the initial suspension and decimal dilutions)
ИСО 6887-2 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 2. Специальные правила для подготовки мяса и мясных продуктов (ISO 6887-2 Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 2: Specific rules for the preparation of meat and meat products)
ИСО 7218 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям (ISO 7218 Microbiology of foods and animal feeding stuffs - General rules for microbiological examinations)
ИСО 7251 Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод обнаружения и определения количества презумптивных бактерий Escherichia coli. Метод наиболее вероятного числа (ISO 7251 Microbiology of food and animal feeding stuffs - Horizontal method for the detection and enumeration of presumptive Escherichia coli - Most probable number technique)
ИСО 10272* Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод обнаружения термоустойчивых бактерий рода Campylobacter (ISO 10272 Microbiology of food and animal feeding stuffs - Horizontal method for detection of thermotolerant Campylobacter)
_______________
* Заменен на ИСО 10272-1, ИСО 10272-2, ИСО 10272-3.
ИСО 10273 Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод обнаружения презумптивных патогенных бактерий Yersinia enterocolitica (ISO 10273 Microbiology of food and animal feeding stuffs - Horizontal method for the detection of presumptive pathogenic Yersinia enterocolitica)
ИСО 13720* Мясо и мясные продукты. Подсчет количества Pseudomonas spp. (ISO 13720 Meat and meat products - Enumeration of Pseudomonas spp.)
_______________
* Заменен на ИСО 13720:2010.
ИСО 16654 Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод обнаружения Escherichia coli O157 (ISO 16654 Microbiology of food and animal feeding stuffs - Horizontal method for the detection of Escherichia coli O157)
3 Методы отбора проб
Пробы отбирают с использованием деструктивных и недеструктивных методов (см. приложение С). Основным ограничением для использования деструктивных методов отбора проб является нарушение товарного вида туши. Недеструктивные методы дают возможность исследовать большие площади. Некоторые наиболее контаминированные зоны можно контролировать с использованием как деструктивных, так и недеструктивных методов (см. С.2 и С.3).
4 Периодичность отбора проб
Кратность и периодичность отбора проб зависят:
- от используемой технологии убоя и первичной переработки различных видов животных;
- программы управления рисками;
- объема выпускаемой продукции;
- эпизоотического состояния, из которого поступило животное.
При производственном контроле кратность и периодичность отбора проб зависят от санитарного состояния цехов убоя и первичной переработки убойных животных. При выполнении надзорных мероприятий за распространением патогенных микроорганизмов время отбора проб, кратность, периодичность и выбор зоны отбора проб с туши должны определяться из расчета наибольшей степени вероятности их выявления.
5 Точки отбора проб
5.1 Выбор туши
Для отбора проб может быть выбрана любая туша.
5.2 Производственный контроль
Точки для отбора проб в убойном пункте (цехе) выбирают в зависимости от используемой технологии убоя и первичной переработки убойных животных.
Они должны быть выбраны в соответствии с принципами управления рисками и определять проблемные места на производстве.
Примерами контрольных точек могут являться нижеперечисленные:
- после полировочной машины (убой свиней);
- после моечной машины (убой свиней);
- после съемки шкуры (убой крупного рогатого скота, мелкого рогатого скота, промысловых животных, выращенных в неволе, и другие);
- после нутровки;
- в холодильной камере, не позднее 12 ч после убоя (см. С.4).
5.3 Выявление патогенных микроорганизмов
Для выявления патогенных микроорганизмов отбор проб с туш всех видов убойных животных рекомендуется проводить:
- непосредственно перед охлаждением;
- в камере охлаждения, не позднее 12 ч после убоя (см. С.4).
6 Зоны отбора проб
6.1 Производственный контроль
Зоны для отбора проб на туше выбирают в зависимости от технологии убоя и первичной переработки убойных животных (см. рисунки А.1, А.2, А.3). Перечень указанных зон носит рекомендательный характер.
Отбор проб при производственном контроле желательно осуществлять с одних и тех же зон туши в течение определенного периода времени.
Пробы рекомендуется отбирать с большего числа туш, а не с большего количества зон одной туши.
6.2 Выявление патогенных микроорганизмов
При выявлении патогенных микроорганизмов на туше зоны для отбора проб выбирают в зависимости от технологии убоя и первичной переработки различных видов животных. Выбор зон проводят с целью выявления наиболее контаминированных зон на туше (см. таблицу А.1). Перечень указанных зон носит рекомендательный характер.
Пробы рекомендуется отбирать с большего числа туш, а не с большего количества зон одной туши.
Несмотря на то, что в рамках надзорных мероприятий предпочтительнее отбирать пробы с большей площади туши, отбор проб с меньшей площади, но более контаминированной зоны, может давать схожие результаты.
7 Методика отбора проб
7.1 Общее положение
Для проведения сравнительного анализа полученных результатов пробы следует отбирать одним и тем же методом.
7.2 Деструктивные методы
7.2.1 Метод с применением полого пробоотборника
7.2.1.1 Реактивы
а) Спирт этиловый 70%-ный и 90%-ный (по объему).
7.2.1.2 Инструменты и материалы
a) Скальпели стерильные.
b) Пинцеты стерильные.
c) Пробоотборники стерильные площадью зоны среза 5 см.
d) Горелка переносная газовая или горелка Бунзена.
e) Салфетки или вата.
f) Пакеты полимерные стерильные для гомогенизатора перистальтического типа, соответствующие размерам пробы и объему добавляемого раствора.
7.2.1.3 Отбор проб
Пробы отбирают с определенных зон туши с помощью стерильного пробоотборника (7.2.1.2 с). Полученные диски шкуры или мышечной ткани около 2 мм толщиной отделяют от туши с помощью стерильного скальпеля и пинцета и кладут в промаркированный стерильный полимерный пакет (7.2.1.2 f).
7.2.1.4 Очистка и стерилизация инструментов
Пробоотборник (7.2.1.2 с), скальпель и пинцет должны быть очищены и простерилизованы после каждой процедуры отбора проб в следующем порядке:
a) инструменты очищают салфеткой или ватой, смоченной в 70%-ном этиловом спирте;
b) погружают во флакон с 70%-ным этиловым спиртом;
c) фламбируют или, если применение открытого пламени недопустимо, дают спирту испариться;
d) охлаждают.
Так как для обработки инструментов требуется определенное время, лучше иметь два набора инструментов, при этом необходимо предотвратить возможность их контаминации перед применением. Допускается использование одноразовых стерильных инструментов.
7.2.2 Метод с применением рамки-трафарета
7.2.2.1 Инструменты и материалы
a) Скальпели стерильные.
b) Пинцеты стерильные.
c) Рамки-трафареты стерильные, с внутренней площадью, например, 10, 20 или 25 см.
d) Пакеты полимерные стерильные для гомогенизатора перистальтического типа.
7.2.2.2 Отбор проб
Пробы толщиной около 2 мм вырезают с поверхности определенных зон туши при помощи рамки-трафарета с помощью стерильных скальпеля и пинцета.
Инструменты могут быть использованы повторно в соответствии с 7.2.1.4.
7.3 Недеструктивные методы
7.3.1 Метод с использованием влажного и сухого тампонов [1]
7.3.1.1 Реактивы
а) Раствор пептонно-солевой стерильный общего назначения (см. ИСО 6887-1), разлитый по 10 см в пробирки или колбы.
7.3.1.2 Инструменты и материалы
a) Тампоны ватные, стерильные, больших размеров с деревянными ручками.
b) Рамки-трафареты стерильные, с внутренней площадью, например, 50 см и более.
7.3.1.3 Отбор проб
Увлажняют тампон в 10 см пептонно-солевого раствора (7.3.1.1 а). На каждую зону, выбранную для отбора проб, накладывают с усилием рамку-трафарет (7.3.1.2 b). Всю площадь внутри рамки-трафарета в горизонтальном направлении протирают смоченным тампоном, немного надавливая и поворачивая для лучшего использования всей его поверхности. Затем тампон помещают в раствор, использованный для смачивания, надломив его деревянный стержень о внутреннюю поверхность колбы. Берут сухой тампон и протирают ту же площадь еще раз, как указано выше, и помещают в ту же колбу с раствором.
Инструменты могут быть использованы повторно в соответствии с 7.2.1.4.
7.3.2 Метод отбора проб с использованием губки
7.3.2.1 Реактивы
а) Раствор пептонно-солевой стерильный общего назначения (см. ИСО 6887-1), разлитый по 25 см в колбы.
7.3.2.2 Инструменты и материалы
a) Губка стерильная (свободная от ингибиторов) в стерильном полимерном пакете.
b) Рамка-трафарет стерильная площадью внутренней поверхности 100 см (10x10 см).
c) Перчатки стерильные.
7.3.2.3 Отбор проб
Определяют зону отбора проб. Открывают пакет, содержащий стерильную губку (7.3.2.2 а), и добавляют достаточный для ее смачивания объем пептонно-солевого раствора (7.3.2.1 а). Губку с внешней стороны пакета разминают до полного ее смачивания. Надевают стерильные перчатки и осторожно извлекают губку из пакета. Помещают рамку-трафарет (7.3.2.2 а) на выбранную зону, протирают губкой ограниченную рамкой площадь (10x10 см) приблизительно 10 раз в вертикальном и 10 раз в горизонтальном направлениях.
После указанной процедуры губку кладут обратно в пакет. Добавляют в пакет оставшийся водно-солевой раствор до общего объема 25 см.
Инструменты могут быть использованы повторно в соответствии с 7.2.1.4.
7.3.3 Метод с использованием жесткого тканевого тампона
7.3.3.1 Реактивы
а) Раствор пептонно-солевой стерильный общего назначения (см. ИСО 6887-1), разлитый по 25 см в колбы.
7.3.3.2 Инструменты и материалы
a) Тампон стерильный жесткий тканевой.
b) Пакеты пластиковые стерильные для гомогенизатора перистальтического типа.
c) Рамка-трафарет стерильная площадью внутренней поверхности 100 см (10x10 см).
d) Перчатки стерильные.
7.3.3.3 Отбор проб
На точке отбора проб открывают пластиковый пакет с тампоном (7.3.3.2 а) и добавляют около 10 см пептонно-солевого раствора (7.3.3.1 а). Сжимают и разминают тампон через внешнюю стенку пакета для лучшего смачивания. Помещают рамку-трафарет на исследуемую зону.
Берут пакет с внешней стороны и выворачивают его наизнанку (используя как перчатку) или используют стерильные перчатки для протирания тампоном исследуемой поверхности 10 раз в горизонтальном и 10 раз в вертикальном направлениях. Затем помещают тампон обратно в пластиковый пакет и добавляют оставшееся количество раствора до достижения общего объема 25 см.
Инструменты могут быть использованы повторно в соответствии с 7.2.1.4.
8 Хранение и транспортирование проб
Транспортирование проб проводят в герметичном термоконтейнере с охлаждающими блоками льда или блоками, содержащими дробленый лед.
Не допускается замораживание проб или их соприкосновение с охлаждающими блоками, содержащими лед.
Каждый образец исследуют в лаборатории не позднее одного часа после отбора пробы или помещают на хранение при температуре (2±2) °С не более чем на 24 ч (см. ИСО 7218).
Приложение А
(справочное)
Зоны отбора проб
Выбор зон для отбора проб на туше зависит от технологии убоя и первичной переработки различных видов животных.
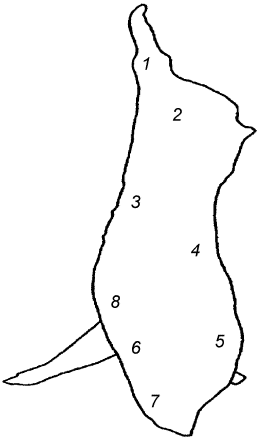
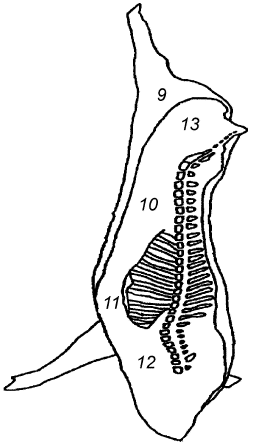
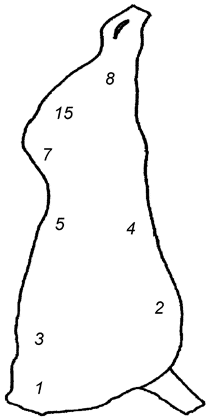
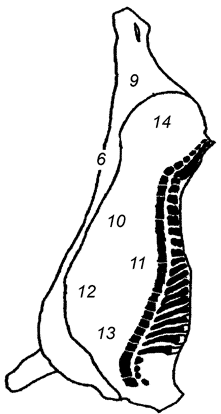
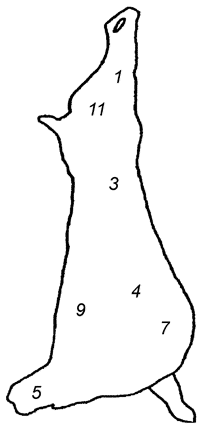
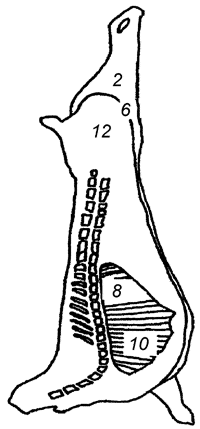
Целью выбора является определение зон с высокой степенью контаминации микроорганизмами (см. таблицу А.1). На рисунках А.1, А.2 и А.3 приведены примеры зон для отбора проб с поверхности туш свиней, крупного рогатого скота и мелкого рогатого скота [2].
Таблица А.1 - Зоны с наиболее высокой степенью контаминации микроорганизмами
Туша свиная | Туша крупного рогатого скота | Туша мелкого рогатого скота |
Задняя голяшка (1) | Наружная часть грудного отруба (2) | Наружная часть пашины (3) |
Наружная часть тазобедренного отруба (2) | Наружная часть подлопаточного отруба (3) | Наружная часть реберного отруба (4) |
Наружная часть пашины (3) | Наружная часть пашины (4) | Внутренняя часть реберного отруба (8) |
Середина наружной части спинно-поясничного отруба (4) | Боковая часть тазобедренного отруба (6) | Наружная часть грудного отруба (7) |
Внутренняя часть пашины (10) | Нижняя часть тазобедренного отруба (8) | - |
Примечание - Номера в скобках указывают на зоны, представленные на рисунках А.1-А.3. | ||
|
|
а) Латеральная часть | b) Медиальная часть |
Рисунок А.1 - Свиная туша. Примеры зон отбора проб
|
|
а) Латеральная часть | b) Медиальная часть |
Рисунок А.2 - Туша крупного рогатого скота. Примеры зон отбора проб
|
|
а) Латеральная часть | b) Медиальная часть |
Рисунок А.3 - Туша мелкого рогатого скота. Примеры зон отбора проб
Приложение В
(обязательное)
Микробиологические исследования
В.1 Подготовка исследуемых проб
Подготовку проб проводят в соответствии с ИСО 6887-2. Общие правила микробиологических исследований - в соответствии с ИСО 7218.
В.2 Производственный контроль
Количество колоний на 1 см поверхности туши определяют в соответствии с ИСО 4833. Подсчет микроорганизмов семейства Enterobacteriaceae проводят в соответствии с ИСО 5552, количество презумптивных бактерий Escherichia coli - в соответствии с ИСО 7251, а количество презумптивных Pseudomonas spp. - в соответствии с ИСО 13720.
При проведении производственного контроля вышеупомянутые методы должны быть адаптированы для подсчета колоний на см взамен подсчета колониеобразующих единиц (КОЕ) на грамм или на см
.
В.3 Выявление патогенных микроорганизмов
Патогенные микроорганизмы могут быть определены качественно.
Микроорганизмы рода Salmonella определяют в соответствии с ИСО 6569, микроорганизмы рода Campylobacter - в соответствии с ИСО 10272, микроорганизмы вида Yersinia enterocolitica - в соответствии с ИСО 10273, микроорганизмы вида Escherichia coli O157:H7 - в соответствии с ИСО 16654.
Приложение С
(справочное)
Сравнение методов
С.1 Преимущества деструктивных методов
Срез поверхностных тканей туши позволяет отобрать все бактерии, находящиеся на ней, в то время как другими методами этого достичь невозможно. Стабильная выявляемость максимального количества микроорганизмов с поверхности может быть достигнута при использовании деструктивного метода. Не все бактерии, находящиеся на поверхности, могут быть отобраны другими методами, выращены и проинкубированы согласно условиям проведения исследования классическими методами.
Повторяемость и воспроизводимость деструктивных методов менее переменны, в то время как результаты исследования проб, отобранных с использованием недеструктивных методов, сильнее зависят от человеческого фактора.
С.2 Недостатки деструктивных методов
Только небольшая часть туши может быть использована для отбора проб деструктивным методом, так как срез ткани с поверхности приводит к нарушению целостности туши, что неприемлемо с коммерческой точки зрения.
При низкой контаминации микроорганизмами и их неравномерном распределении или же при незначительном количестве искомых патогенных микроорганизмов это может привести к значительной погрешности в результатах исследований.
С.3 Оценка диагностической ценности
Исходя из данных [3] рассчитано, что в процессе взятия смыва с поверхности туш свиней отбирается в среднем только 30% того количества бактерий семейства Enterobacteriaceae, которое могло бы быть отобрано посредством деструктивного метода с аналогичной поверхности.
Недеструктивные методы характеризуются низкой степенью воспроизводимости и большим разбросом полученных результатов.
Исходя из данных [4] рассчитано, что при исследовании говяжьих туш, контаминированных Escherichia coli или колиформными бактериями, чувствительность недеструктивных методов при взятии пробы с площади, равной 100 см, составляет только 30%-40% в сравнении с деструктивным методом. Рассчитанное число Каппа в 0,22 единицы показывает низкую степень сходимости результатов этих методов (таблица С.1). Из таблицы С.2 видно, что при низком уровне контаминации даже деструктивный метод на практике не столь эффективен, как следовало бы ожидать. В таблице С.3 приведены приблизительные значения абсолютной чувствительности деструктивного и недеструктивного методов. Расчетная чувствительность в 80% для деструктивного метода (11/14) однозначно лучше 50% недеструктивного метода (7/14), однако оба метода отбора проб приводят к недооценке истинной распространенности микроорганизмов.
Таблица С.1 - Сравнение деструктивного и недеструктивного методов отбора проб при исследовании туш с 16 КОЕ/см обсемененностью колиформными бактериями
Критерии оценки | Выявлено деструктивным методом (100 см | |||
Да | Нет | Итого | ||
Выявлено недеструктивным методом (100 см | Да | 4 | 3 | 7 |
Нет | 7 | 16 | 23 | |
Итого | 11 | 19 | 30 | |
Относительная чувствительность (4/11), % | 36 | |||
Относительная специфичность (16/19), % | 84 | |||
Относительный прогнозирующий уровень положительного результата (4/7), % | 57 | |||
Относительный прогнозирующий уровень отрицательного результата (16/23), % | 69 | |||
Относительная точность [(4+16)/30], % | 67 | |||
Очевидная распространенность (7/30), % | 23 | |||
Истинная распространенность* (11/30), % | 37 | |||
Отмеченная согласованность между методами (20/30) | 0,666 | |||
Положительная согласованность (да/да) по случаю [(7/30) | 0,086 | |||
Отрицательная согласованность (нет/нет) по случаю [(23/30) | 0,486 | |||
Общая согласованность по случаю ( | 0,572 | |||
Отмеченная согласованность минус общая согласованность по случаю ( | 0,094 | |||
Максимальная согласованность вне случая (1- | 0,428 | |||
Число Каппа** | 0,220 | |||
* Истинная распространенность определена деструктивным методом. ** Значение числа Каппа между 0,4 и 0,7 представляет хорошую согласованность. Значение числа Каппа в 0,22 представляет плохую согласованность. Примечание - Расчет на основе данных [4]. | ||||
Таблица С.2 - Диагностическое значение деструктивного и недеструктивного методов отбора проб относительно обнаружения туш с обсемененностью 16 КОЕ/см колиформными бактериями
Методы оценки | Действительно ли | |||
Да | Нет | Итого | ||
Выявлено деструктивным методом (100 см | Да | 11 | 0 | 11 |
Нет | 3 | 16 | 19 | |
Итого | 14 | 16 | 30 | |
Выявлено недеструктивным методом (100 см | Да | 7 | 0 | 7 |
Нет | 7 | 16 | 23 | |
Итого | 14 | 16 | 30 | |
Примечание - Подсчитано с использованием данных из источника [4]. | ||||
Таблица С.3 - Оценка деструктивного и недеструктивного методов отбора проб
Оценка методов* | Деструктивный метод | Недеструктивный метод |
Чувствительность, % | 79 | 50 |
Специфичность, % | 100 | 100 |
Положительный прогнозирующий уровень, % | 100 | 100 |
Отрицательный прогнозирующий уровень, % | 84 | 70 |
Точность, % | 90 | 77 |
Очевидная распространенность, % | 37 | 23 |
Истинная распространенность, % | 47 | 47 |
* Расчеты чувствительности, специфичности, прогнозирующего уровня, точности и т.д. см. в таблице С.1. | ||
Тем не менее, точных данных о диагностических параметрах (таких как чувствительность, специфичность точность и предсказуемость) классических методов отбора проб, до сих пор широко используемых, в литературе не обнаружено [5].
С.4 Точки отбора проб
Отбор проб в холодильных камерах через 12-24 ч после убоя животного может оказаться не совсем приемлемым по многим параметрам. Например, быстрая заморозка свиных туш при температуре от минус 30 °С до минус 35 °С может уничтожить патогенные микроорганизмы или значительно их повредить, также при отвердевании жировой ткани усложняется процесс восстановления бактериальных клеток.
Приложение D
(обязательное)
Отбор проб с тушек птицы
D.1 Область применения
В этом приложении изложены методы отбора проб с тушек птицы для микробиологического исследования:
1) метод отбора проб путем ополаскивания тушки;
2) методы отбора проб кожи тушки;
3) метод свабирования тушки.
D.2 Методы отбора проб
Выбор метода отбора проб зависит от цели микробиологических исследований, требуемой чувствительности и конкретной ситуации.
При исследовании птицы путем ополаскивания целой тушки более точным является недеструктивный метод.
Метод отбора проб кожи может быть как деструктивным (например, отбор кожи с грудки), так и недеструктивным (например, отбор кожи шеи).
Пробы можно отбирать как с маленьких, так и с больших частей тушки, в частности с грудной части, а количество пробы может быть измерено путем взвешивания.
Микробиологическую контаминацию тушек птицы наблюдают преимущественно на ее поверхности. Отбор проб из глубоких тканей, таких как мышцы, проводят только при необходимости.
Для исследования тушек птицы больших размеров (например, индеек) может быть применен недеструктивный метод - свабирование.
D.3 Периодичность отбора проб
См. раздел 4.
D.4 Точки отбора проб
См. раздел 5.
Отбор тушек птицы проводят в убойном пункте (цехе) либо сразу после мойки, либо после охлаждения (до процесса заморозки, разделки или упаковки).
D.5 Зоны отбора проб
См. раздел 6.
Общепринятым методом является ополаскивание всей поверхности тушки птицы.
При отборе пробы кожи выбор зон отбора зависит от конкретной технологии и используемого оборудования при убое птицы.
Шея и грудка - это те зоны, с которых обычно отбираются пробы, тем не менее и другие зоны на тушках могут быть контаминированы в высокой степени.
D.6 Методика отбора проб
D.6.1 Растворы и реактивы
D.6.1.1 Вода буферная пептонная (ВБП) или иные растворы, в зависимости от проводимых микробиологических исследований (см. ИСО 6887-1).
D.6.1.2 Спирт этиловый 70%-ный (по объему) или спиртовые салфетки.
D.6.2 Материалы
D.6.2.1 Перчатки стерильные.
D.6.2.2 Пакеты (стерильные) для стомахера, объем которых зависит от размера пробы (в зависимости от того, что будет взято - тушка или кожа).
D.6.2.3 Замки-стяжки пластиковые (или аналогичные) для закрывания пакетов (D.6.2.2).
D.6.2.4 Ножницы стерильные.
D.6.2.5 Скальпели стерильные.
D.6.2.6 Пинцеты стерильные.
D.6.2.7 Трафарет квадратный стерильный с внутренней площадью, например 10 или 25 см.
D.6.2.8 Тампоны стерильные с ватно-шерстным наконечником и с деревянной или пластиковой ручкой.
D.6.3 Метод отбора проб путем ополаскивания тушки
Тушки птицы для исследования отбирают, как правило, с конвейера переработки. При отборе проб открывают большой пакет (D.6.2.2), не касаясь его внутренней поверхности.
На тушку, находящуюся на линии, надевают этот пакет обеими руками и, удерживая с наружной стороны пакета ноги птицы, снимают тушку с конвейера (освободив лапки с подвесок). Следует избегать отбора тушек со значительным количеством стекающей с них воды. Если это произошло, удаляют тушку в асептических условиях на отдельные продезинфицированные подвески и дают возможность стечь воде с тушки, прежде чем помещают ее обратно в пакет.
Днище пакета с тушкой фиксируют на ровной поверхности. Придерживая верх пакета, приоткрывают его и добавляют стерильный раствор для разведения, как правило, в количестве 400 см во внутреннюю полость тушки и наружную ее часть. Удаляют избыток воздуха из пакета и закрывают его специальным замком. Аккуратно держа пакет одной рукой за днище, другой за верх, ополаскивают тушку внутри и снаружи путем встряхивания примерно в течение 1 мин. Далее аккуратно переворачивают пакет круговыми движениями туда и обратно для гарантированного ополаскивания всех поверхностей (внутренней и наружной) тушки. Пакет ставят на ровную поверхность и, поддерживая тушку, открывают его. Тушку достают из пакета рукой в перчатке (одноразовой), избегая чрезмерного стекания жидкости обратно в пакет. Избегают касания рукой внутренней поверхности пакета. Закрывают пакет, чтобы избежать вытекания смывной жидкости или ее контаминации. Можно также перенести смывную жидкость из пакета в стерильный контейнер в асептических условиях. Смывную жидкость далее отправляют на микробиологический анализ.
D.6.4 Методы отбора проб кожи
D.6.4.1 Отбор проб кожи с шеи
Кожный покров шеи обычно удаляют с тушек после того, как они сходят с линии переработки, поэтому они должны быть отобраны заранее, но могут быть отделены позднее и взвешены (по отдельности или совместно с другими пробами). Для отбора проб надевают стерильные перчатки (D.6.2.1). Берут ножницы (D.6.2.4) и обрабатывают их методом фламбирования (D.6.1.2). Открывают пакет (D.6.2.2) для взятия проб, не касаясь его внутренней поверхности. Пакет берут за нижний край и вдавливают его в глубь пакета. Не следует брать для отбора проб тушки с очень коротким лоскутком кожи шеи. Нижней внутренней стороной пакета захватывают кожу шеи и быстро отрезают ее. В дальнейшем может потребоваться удаление части подкожного жира или других прилежащих тканей. Взвешивают отобранный образец (как правило, его масса составляет около 20 г). При необходимости составляют объединенную пробу массой, например, 25 или 50 г.
D.6.4.2 Отбор проб кожи с грудки
Надевают стерильные перчатки (D.6.2.1). Берут отобранную тушку птицы и кладут ее на ровную поверхность, избегая контакта с поверхностью отбираемого участка кожи. С помощью стерильного трафарета (D.6.2.7), скальпеля (D.6.2.5) и пинцета (D.6.2.6) отбирают необходимый участок кожи с грудки, например 10 или 25 см. Возможны определенные трудности при взятии проб кожи с тушки, не прошедшей стадии охлаждения, так как кожа на ней мягкая и эластичная. В этом случае возможен альтернативный метод отбора пробы кожи. Для этого необходимо вырезать кусок кожи нужного размера без трафарета (приблизительно) и взвесить его. Результаты микробиологического анализа рассчитывают, исходя из массы образца (например, как КМАФАнМ в 1 г или присутствие/отсутствие в 25 г). Если метод предусматривает отбор объединенной пробы, например от пяти тушек, необходимо отбирать приблизительно одинаковые порции проб от каждой тушки. Кусочки кожи с грудки собирают в пакет (D.6.2.2), исходя из общей площади отбираемой поверхности или массы отбираемой пробы.
D.6.5 Метод свабирования тушки
См. 7.3.
D.7 Хранение и транспортирование проб
См. раздел 8.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов ссылочным национальным стандартам Российской Федерации
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ИСО 4833 | - | * |
ИСО 5552 | - | * |
ИСО 6579 | MOD | ГОСТ Р 52814-2007 (ИСО 6579:2002) "Продукты пищевые. Метод выявления бактерий рода Salmonella" |
ИСО 6887-1 | - | * |
ИСО 6887-2 | - | * |
ИСО 7218 | IDT | ГОСТ Р ИСО 7218-2008* "Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям" |
________________ * На территории Российской Федерации документ не действует. Действует ГОСТ ISO 7218-2011. - . | ||
ИСО 7251 | MOD | ГОСТ Р 52830-2007 (ИСО 7251:2005) "Микробиология пищевых продуктов и кормов для животных. Метод обнаружения и определения количества презумптивных бактерий Escherichia coli. Метод наиболее вероятного числа" |
ИСО 10272 | - | * |
ИСО 10273 | - | * |
ИСО 13720 | - | * |
ИСО 16654 | MOD | ГОСТ Р 53913-2010 (ИСО 16654:2001) "Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод обнаружения Escherichia coli O157" |
* Соответствующий национальный стандарт отсутствует. До его принятия рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов. Примечание - В настоящей таблице использованы следующие условные обозначения степени соответствия стандартов: - IDT - идентичные стандарты; - MOD - модифицированные стандарты. | ||
Библиография
[1] | Kitchell A.G., Ingram G.C. and Hudson W.R. Microbiological in abattoirs: Technical Series No. 7, Academic Press, London, 1973, pp.43-61 |
[2] | Roberts T.A., MacFie J.H. and Hudson W.R. The effect of incubation temperature and site of sampling on the assessment of numbers of bacteria on red meat. J.Hyg.Camb., 85, 1980, p.371 |
[3] | Snijders J.M.A., Janssen M.H.W., Gerats G.E. and Corstiaensen G.P. A comparative study of sampling techniques for monitoring carcass contamination. Int. J. Food. Microbiol., 1, 1984, pp.229-236 |
[4] | Dorsa W.J., Siragusa G.R., Cutter C.N., Berry E.D. and Koohmairaie M. Efficacy of using a sponge sampling method to recover low levels of Escherichia coli O157:H7, Salmonella typhimurium and aerobic bacteria from beef carcass surface tissue. Food Microbiol., 14, 1997, pp.63-69 |
[5] | Berends R.B., Van Knapen F., Mossel D.A.A., Burt S.A. and Snijders J.M.A. Salmonella spp. On pork at cutting plants at the retail level and the influence of particular risk factors. Int. J. Food Microbiol., 44, 1998, pp.207-217 |
Электронный текст документа
и сверен по:
, 2013