ГОСТ 32031-2012
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКТЫ ПИЩЕВЫЕ
Методы выявления бактерий Listeria monocytogenes
Food products. Methods for detection of Listeria monocytogenes
МКС 07.100.30
Дата введения 2014-07-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 РАЗРАБОТАН Государственным научным учреждением Всероссийским научно-исследовательским институтом мясной промышленности имени В.М.Горбатова Российской академии сельскохозяйственных наук (ГНУ ВНИИМП им.В.М.Горбатова Россельхозакадемии)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (ТК 226)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 03 декабря 2012 г. N 54-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узстандарт |
(Поправка. ИУС N 6-2019).
4 Настоящий стандарт соответствует международному стандарту ISO 11290-1:1996* Microbiology of food and animal feeding stuffs - Horizontal method for the detection and enumeration of Listeria monocytogenes - Part 1: Detection method (Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод обнаружения и подсчета микроорганизмов Listeria monocytogenes. Часть 1. Метод обнаружения) и изменения к нему ISO 11290-1:1996/Amd.1:2004 Microbiology of food and animal feeding stuffs -- Horizontal method for the detection and enumeration of Listeria monocytogenes -- Part 1: Detection method -- Amendment 1: Modification of the isolation media and the haemolysis test, and inclusion of precision data (Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод обнаружения и подсчета микроорганизмов Listeria monocytogenes. Часть 1. Метод обнаружения. Изменение 1. Модификация разделительной среды и определение гемолитической активности, а также включение показателей прецизионности)
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Степень соответствия - неэквивалентная (NEQ).
Стандарт подготовлен на основе применения ГОСТ Р 51921-2002
5 Приказом Федерального агентства по техническому регулированию и метрологии от 28 июня 2013 г. N 309-ст межгосударственный стандарт ГОСТ 32031-2012 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2014 г.
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет.
ВНЕСЕНА поправка, опубликованная в ИУС N 6, 2019 год с учетом уточнения, опубликованного в ИУС 11-2019
Поправка внесена изготовителем базы данных
1 Область применения
Настоящий стандарт распространяется на пищевые продукты и устанавливает методы выявления бактерий Listeria monocytogenes.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ ISO 7218-2011 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
ГОСТ ISO 11133-1-2011 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления культуральных сред в лаборатории
ГОСТ ISO 11133-2-2011 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 2. Практические руководящие указания по эксплуатационным испытаниям культуральных сред
ГОСТ ISO 16140-2011 Микробиология продуктов питания и кормов для животных. Протокол валидации альтернативных методов
ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 26668-85 Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов
ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов
ГОСТ 30425-97 Консервы. Метод определения промышленной стерильности
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями.
3.1 бактерии рода Listeria: Микроорганизмы, которые образуют типичные колонии на плотных селективных средах и являются грамположительными неспорообразующими короткими палочками, иногда почти коккоподобными, располагающимися одиночно или короткими цепочками, реже образующие длинные нити.
3.2 Listeria monocytogenes: Микроорганизмы, которые образуют типичные колонии на плотных селективных средах и идентифицируемые* по морфологическим, культуральным и биохимическим свойствам.
_______________
* Текст документа соответствует оригиналу. - .
Примечание - Описание и методы определения морфологических, культуральных и биохимических характеристик этих микроорганизмов приведены в настоящем стандарте.
3.3 выявление Listeria monocytogenes: Определение наличия или отсутствия Listeria monocytogenes в определенной массе или объеме продукта в соответствии с настоящим стандартом.
4 Сокращения
В настоящем стандарте используют следующие сокращения:
ALOA - агар Listeria пo Оттавиани и Агости;
ГРМ - гидролизат рыбной муки;
ИФА - иммуноферментный анализ;
МПА - мясопептонный агар;
МПБ - мясопептонный бульон;
ПАЛ - питательный агар для выделения листерий;
ПБЛ - питательный бульон для выделения листерий;
ПЦР - полимеразная цепная реакция;
TSYEA - триптон-соевый агар с дрожжевым экстрактом;
TSYEB - триптон-соевый бульон с дрожжевым экстрактом.
5 Сущность метода
Метод выявления бактерий L. monocytogenes в определенной массе или объеме продукта состоит из четырех последовательных этапов (см. 5.1, 5.2, 5.3, 5.4 и приложение А).
5.1 Первичное обогащение анализируемой пробы в жидкой среде со сниженной концентрацией селективных компонентов (полуконцентрированный бульон Фразера) при температуре 30 °С в течение 24 ч.
Примечание - Бактерии рода Listeria в продукте могут находиться в небольшом количестве, очень часто на фоне значительного количества микроорганизмов других родов. Поэтому для выявления небольшого количества бактерий рода Listeria, а так же "поврежденных" клеток в пробе необходим этап селективного обогащения на среде с пониженной концентрацией селективных компонентов.
5.2 Вторичное обогащение посевного материала, полученного по 5.1 в жидкой среде с полной концентрацией селективных компонентов (бульон Фразера) при температуре (37±1) °С в течение 48 ч.
5.3 Пересев посевного материала, полученного по 5.1 и 5.2, параллельно на две плотные селективные среды:
а) первая среда (обязательная): ALOA;
б) вторая среда: одна из плотных селективных сред, на выбор лаборатории, дополнительно к агару по 5.3 (а), такие как Оксфорд агар, Палкам агар или ПАЛ.
Посевы на ALOA культивируют при температуре (37±1) °С и просматривают через (24±3) ч, а при необходимости еще через (24±3) ч, контролируя наличие роста характерных для L. monocytogenes колоний.
Посевы на второй селективной среде культивируют при соответствующей температуре и просматривают на наличие роста колоний с характерным для бактерий рода Listeria ростом после определенного времени.
5.4 Идентификация отобранных колоний
Пересев колоний, полученных по 5.3. с характерным ростом для бактерий рода Listeria и вида Listeria monocytogenes на плотные питательные среды и культивирование при температуре (37±1) °С в течение (24±3) ч и их идентификация по соответствующим морфологическим, культуральным и биохимическим признакам.
6 Питательные среды, тест-системы и реактивы
6.1 Общие требования
Состав и приготовление питательных сред и реактивов - в соответствии с приложением Б.
6.2 Селективные среды первичного обогащения
В качестве селективных сред первичного обогащения могут быть использованы следующие среды.
6.2.1 Бульон Фразера полуконцентрированный - по Б.1.1.
6.2.2 Селективный накопительный бульон UVM - по Б.1.2.
6.2.3 Питательный бульон для выделения и культивирования листерий (ПБЛ I) - по Б.1.3.
6.3 Селективные среды вторичного обогащения
В качестве селективных сред вторичного обогащения могут быть использованы следующие среды.
6.3.1 Бульон Фразера - по Б.2.1.
6.3.2 Селективный накопительный бульон (UVM II) - по Б.2.2.
6.3.3 Питательный бульон для выделения и культивирования листерий (ПБЛ II) - по Б.2.3.
6.4 Селективные плотные среды
6.4.1 Агар Listeria пo Оттавиани и Агости (ALOA) - по Б.3.1.1.
6.4.2 Бриллианс Listeria агар (BRILLIANCE LISTERIA agar) - по Б.3.1.2.
В качестве второй среды необходимо использовать одну из следующих:
6.4.3 Оксфорд агар - по Б.3.2.1.
6.4.4 Палкам агар - по Б.3.2.2.
6.4.5 Питательный агар для выделения листерий (ПАЛ) - по Б.3.2.3.
6.5 Питательные среды для изучения культурально-морфологических свойств бактерий рода Listeria
6.5.1 Плотные питательные среды
6.5.1.1 Триптон-соевый агар с дрожжевым экстрактом (TSYEA) - по Б.4.1.1.
6.5.1.2 Трипказо-соевый агар (TSA) - по Б.4.1.2.
6.5.1.3 Мясопептонный агар (МПА) - по Б.4.1.3.
6.5.2 Жидкие питательные среды
6.5.2.1 Триптон-соевый бульон с дрожжевым экстрактом (TSYEB) - по Б.4.2.1.
6.5.2.2 Трипказо-соевый бульон (TSB) - по Б.4.2.2.
6.5.2.3 Мясопептонный бульон (МПБ) - по Б.4.2.3.
6.6 Среды и реактивы для идентификации бактерий рода Listeria
6.6.1 Раствор с объемной долей перекиси водорода 3% - по ГОСТ 10444.1.
6.6.2 Растворы и реактивы для окраски по Граму - по ГОСТ 10444.1.
6.6.3 Коммерческие наборы для окраски по Граму - согласно инструкции изготовителя.
6.6.4 Среда для определения подвижности бактерий - по Б.8.
6.6.5 Среда для определения лецитиназной активности - по Б.10.1 и Б.10.2.
6.7 Среды и реактивы для идентификации бактерий вида Listeria monocytogenes
6.7.1 Среда и реактив для определения -гемолитической активности
6.7.1.1 Кровяной агар - по Б.5.
6.7.1.2 Суспензия из эритроцитов барана - по Б.6.
6.7.2 Буфер фосфатно-солевой - по Б.11.
6.7.3 Среда для проведения КАМП-теста - по Б.9.
6.7.4 Среды для определения ферментативных свойств культуры - по Б.7.1 и Б.7.2.
6.7.5 Углеводы - по Б.7.1.2.
6.7.5.1 Рамноза.
6.7.5.2 Ксилоза.
6.7.5.3 альфа-метил D-маннозид (Methyl -D-mannopyranoside).
7 Средства измерений, аппаратура, посуда, материалы и тест-штаммы
Аппаратура и материалы по ГОСТ 10444.1 и ГОСТ ISO 7218 со следующими дополнениями.
рН-метр с точностью измерения ±0,1 ед. рН.
Шкаф сушильный стерилизационный для сухой стерилизации или автоклав для влажной стерилизации.
Термостат, поддерживающий температуру между (25±1) °С и (50±1) °С.
Термостаты, поддерживающие температуры: (25±1)°С, (30±1)°С, (37±1)°С.
Баня водяная, поддерживающая температуру 44 °С - 47 °С.
Петля, игла из платиново-иридиевого или никель-хромового сплава или пластиковая диаметром около 3 мм.
Шпатели стеклянные формы хоккейной клюшки.
Пробирки стерильные.
Колбы и флаконы необходимой вместимости.
Дозаторы автоматические переменного объема.
Наконечники одноразовые, стерильные для дозаторов.
Чашки Петри стеклянные или пластиковые диаметром от 90 до 100 мм.
Микроскоп для фазово-контрастной микроскопии.
Контрольные тест-штаммы:
- S. aureus;
- R. equi;
- L. innocua;
- L. ivanovii;
- L. monocytogenes;
- E. faecalis:
- E. coli.
Примечание - Допускается применение средств измерений, аппаратуры с аналогичными метрологическими и техническими характеристиками, а также материалов и реактивов по качеству не хуже указанных.
8 Отбор проб
Отбор проб - по ГОСТ 26668.
Проба должна быть представительной, а также без повреждений и изменений при транспортировании и хранении.
9 Подготовка проб
Подготовка проб - по ГОСТ 26670.
10 Проведение испытания
Схема проведения испытания приведена в приложении А.
10.1 Проба для анализа и исходная суспензия
Анализируемую пробу X (г или см) вносят в селективную среду первичного обогащения, исходя из соотношения продукта и среды 1:9.
10.2 Первичное обогащение
Исходную суспензию (см. 10.1) культивируют при температуре (30±1) °С в течение (24±3) ч.
10.3 Вторичное обогащение
10.3.1 Посевной материал, полученный по 10.2 в объеме 0,1 см, пересевают в пробирку, содержащую 10 см
среды обогащения (см. 6.3).
10.3.2 Посевы (см. 10.3.1) культивируют в течение (48±2) ч при температуре (37±1)°С.
10.4 Пересев на плотные селективные среды
10.4.1 Из пробирок с посевами (см. 10.2) после культивирования с помощью петли или шпателя (см. 7.5) проводят пересев на поверхность первой плотной селективной среды (см. 6.4.1) так, чтобы получить хорошо изолированные колонии.
Аналогичным образом проводят пересев и на вторую плотную селективную среду (см. 6.4.2 или 6.4.3, или 6.4.4)* .
________________
* Письмом Росстандарта от 09.08.2021 N 2319-ОГ/03 разъясняется, что "подпункт 10.4.1 ГОСТ 32031-2012 должен быть изложен в следующей редакции: "10.4.1 Из пробирок с посевами (см. 10.2) после культивирования с помощью петли или шпателя (см. 7.5) проводят пересев на поверхность первой плотной селективной среды (см. 6.4.1 или 6.4.2) так, чтобы получить хорошо изолированные колонии." - .
10.4.2 С посевным материалом, выращенным на среде обогащения (см. 10.3.2), повторяют процедуру приведенную в 10.4.1.
10.4.3 Чашки с посевами на первой плотной селективной среде (см. 10.4.1 и 10.4.2) культивируют вверх дном в термостате при температуре (37±1) °С в течение 24-48 ч.
Чашки с посевами на второй плотной селективной среде инкубируют согласно инструкции производителя питательных сред.
10.4.4 Через (24±3) ч или (48±2) ч [если после (24±3) ч отмечен слабый рост культуры или его отсутствие] культивирования на первой и второй плотной селективной средах (10.4) учитывают наличие колоний с ростом характерных для бактерий рода Listeria и Listeria monocytogenes.
10.4.4.1 На первой селективной плотной среде бактерии вида L. monocytogenes и L. ivanovii растут в виде сине-зеленых колоний, окруженные непрозрачным ореолом (типичные колонии). Другие виды бактерий рода Listeria также растут в виде сине-зеленых колоний, без ореола.
Примечания
1 Некоторые штаммы L. monocytogenes могут давать очень слабый ореол вокруг колонии или вовсе не иметь его. Это характерно для "поврежденных" клеток L. monocytogenes (например, вследствие воздействия кислот).
2 Некоторые штаммы L. monocytogenes характеризуются пониженной фосфатидилинозитолфосфолипазной С активностью. Для выявления таких штаммов требуется более продолжительное культивирование.
10.4.4.2 Посевы на второй плотной селективной среде просматривают на наличие колоний с ростом характерным для бактерий рода Listeria.
На Палкам агаре все виды бактерий рода Listeria формируют мелкие серовато-зеленые или оливково-зеленые колонии с черным ореолом, иногда с черным центром.
На Оксфорд агаре все виды бактерий рода Listeria формируют мелкие сероватые колонии, окруженные черным ореолом.
На ПАЛ все виды бактерий рода Listeria формируют мелкие серовато-желтые колонии с черным ореолом.
10.4.4.3 При отсутствии роста характерных колоний бактерий рода Listeria и Listeria monocytogenes на первой и второй плотных селективных средах исследования прекращают и делают заключение об отсутствии в исследуемой пробе продукта бактерий Listeria monocytogenes.
10.5 Идентификация выделенных культур до рода Listeria
10.5.1 Выбор колоний для подтверждения
10.5.1.1 С каждой чашки с плотной селективной средой (см. 10.4.4.1 и 10.4.4.2) отбирают по пять колоний с ростом, характерным для бактерий рода Listeria и Listeria monocytogenes.
Если на чашке выросло менее пяти типичных колоний, отбирают их все.
10.5.1.2 Отобранные колонии пересевают на поверхность подсушенного триптон-соевого агара с дрожжевым экстрактом (см. 6.5.1.1) или другого плотного питательного агара (см. 6.5.1.2-6.5.1.3) так, чтобы получить изолированные колонии.
Посевы культивируют при температуре (37±1) °С в течение (24±3) ч до появления видимого роста.
На триптом-соевом агаре с дрожжевым экстрактом бактерии рода Listeria растут в виде выпуклых, бесцветных и непрозрачных колоний в диаметре от 1,0 до 2,0 мм.
Для подтверждения принадлежности выделенной культуры к бактериям рода Listeria проводят следующие тесты.
10.5.2 Реакция на каталазу
Берут изолированную колонию, выделенную по 10.5.1.2, и вносят в каплю 3%-ного раствора перекиси водорода (см. 6.6.1). Мгновенное образование пузырьков газа указывает на положительную реакцию.
Бактерии рода Listeria являются каталазоположительными.
10.5.3 Окраска по Граму
Культуры, выделенные по 10.5.1.2, окрашивают по Граму (по ГОСТ 30425) и микроскопируют.
Бактерии рода Listeria являются грамположительными тонкими, короткими палочками.
10.5.4 Определение подвижности
Культуру, выделенную по 10.5.1.2, пересевают в триптон-соевый бульон с дрожжевым экстрактом (см. 6.5.2.1) или в другую жидкую питательную среду (см. 6.5.2.2-6.5.2.3).
Посевы культивируют при температуре (25±1) °С от 8 до 24 ч до появления мутности в бульоне. Затем каплю культуральной жидкости помещают на предметное стекло и накрывают сверху покровным стеклом и микроскопируют.
В поле зрения микроскопа должны наблюдаться короткие палочки с опрокидывающими движениями.
При культивировании посевов в жидкой питательной среде при температуре выше (25±1) °С подвижность бактерий не наблюдается.
В качестве альтернативного теста определения подвижности можно использовать посев культуры уколом в питательную среду (см. 6.6.4).
Посевы культивируют в термостате при температуре (25±1) °С в течение 48 ч.
Бактерии рода Listeria подвижны при температуре (25±1) °С, образуют характерный рост вокруг линии укола, похожий на зонтик. Если рост слабый необходимо культивировать еще пять суток с ежедневным просмотром посевов.
10.5.5 Характеристика бактерий рода Listeria
Бактерии рода Listeria - это грамположительные короткие тонкие палочки, каталазоположительные, подвижные при температуре не выше (25±1) °С.
10.6 Идентификация бактерий рода Listeria (см. 10.5.5) до вида
Культуры, полученные по 10.5.1.2 и соответствующие 10.5.5, идентифицируют следующими методами.
10.6.1 Определение бета-гемолитической активности
10.6.1.1 С использованием кровяного агара
Поверхность кровяного агара (см. 6.7.1.1) перед использованием необходимо тщательно подсушить. Чашку с тыльной стороны целесообразно разделить на квадраты и проколоть каждый маркированный квадрат бактериальной иглой с колонией культуры отобранной с триптон-соевого агара с дрожжевым экстрактом (см. 10.5.1.2). На каждую чашку с кровяным агаром, кроме исследуемых культур, должны быть посеяны контрольные штаммы, такие как L. monocytogenes (положительный контроль) и L. innocua (отрицательный контроль).
Посевы культивируют при температуре (37±1) °С в течение (24±2) ч.
Зона -гемолиза на кровяном агаре у культуры L. monocytogenes - в виде узкой, чистой, светлой зоны; L. innocua - нет зоны гемолиза вокруг укола; L. seeligeri - слабая зона гемолиза; L. ivanovii - широкая, четко обозначенная зона гемолиза.
После инкубирования проводят визуальное сравнение прозрачности зон вокруг анализируемых и контрольных культур.
Примечание - Зона -гемолиза более четко видна при удалении колонии с поверхности агара вокруг места посева.
10.6.1.2 С использованием суспензии эритроцитов барана
В 0,15 см триптон-соевого бульона с дрожжевым экстрактом (см. 6.5.2.1) необходимо внести одну колонию культуры полученную по 10.5.1.2 и соответствующую 10.5.5.
Посевы культивируют при температуре (37±1) °С в течение 24 ч. Затем добавляют 0,15 см суспензии эритроцитов барана (см. 6.7.1.2) и продолжают культивирование при температуре (37±1) °С от 15 до 60 мин, с последующим охлаждением при температуре (3±2) °С около 2 ч.
При наличии у культуры гемолитической активности - жидкость окрашена в соломенно-коричневый цвет и отсутствует осадок красных кровяных клеток на дне лунки.
При отсутствии гемолитической активности наблюдается осадок красных кровяных клеток на дне лунки. Клетки могут быть красно-коричневыми по цвету.
Если реакция неопределенная, следует оставить культуру при температуре (3±2) °С на 24 ч.
10.6.2 Определение лецитиназной активности
Поверхность лецитин-агара с активированным углем (см. 6.6.5) и без угля (см. 6.6.5) перед использованием необходимо тщательно подсушить. Чашку с тыльной стороны целесообразно разделить на квадраты и высевать на каждый маркированный квадрат бактериальной петлей колонию культуры отобранной с триптон-соевого агара с дрожжевым экстрактом (см. 10.5.1.2). На каждую чашку с лецитин-агаром с активированным углем и без угля, кроме исследуемых культур, должен быть посеян контрольный штамм L. monocytogenes (положительный контроль).
Посевы культивируют при температуре (37±1) °С в течение (48±2) ч.
Культура L. monocytogenes дает плотную зону помутнения шириной 3,0-6,0 мм на лецитин-агаре с активированным углем за счет гидролиза лецитина.
Культура L. monocytogenes не дает плотную зону помутнения на лецитин-агаре без активированного угля.
10.6.3 Определение ферментативных свойств L. monocytogenes
У культур, полученных по 10.5.1.2 и соответствующих требованиям 10.5.5, определяют ферментативные свойства.
Для этого используют суточную культуру.
Посевы следует культивировать при температуре (37±1) °С в течение пяти суток.
Положительную реакцию в отношении углеводов определяют по изменению окраски среды в желтый цвет за счет образования кислоты. Изменение цвета среды происходит, как правило, в течение 24-48 ч.
В таблице 1 приведены биохимические свойства различных видов бактерий рода Listeria.
Таблица 1
Виды | Реакция на | Ферментация | КАМП-тест | |||
рамноза | ксилоза | альфа-метил | S. aureus | R. equi | ||
L. monocytogenes | + | + | - | + | + | - |
L. innocua | - | V | - | + | - | - |
L. ivanovii | + | - | + | - | - | + |
L. seeligeri | ( + ) | - | + | V | (+) | - |
L. welshimeri | - | V | + | + | - | - |
L. grayi subsp. grayi | - | - | - | + | - | - |
L. grayi subsp. murrayi | - | V | - | + | - | - |
V: вариабельная реакция. (+): слабая реакция. +: >90% положительных реакций. -: нет реакции. | ||||||
Примечание - Для изучения биохимических свойств выделенных по 10.5.1.2 колоний можно использовать следующие коммерческие тест-системы: Listeria ID MID-67, Microbact 12L. api Listeria.
10.6.4 КАПМ тест
Допускается для подтверждения гемолитической активности как вспомогательный тест использовать КАМП-тест.
Двухсуточные культуры гемолитических штаммов Staphylococcus aureus и Rhodococcus equi высевают на кровяной агар, как показано на рисунке 1.
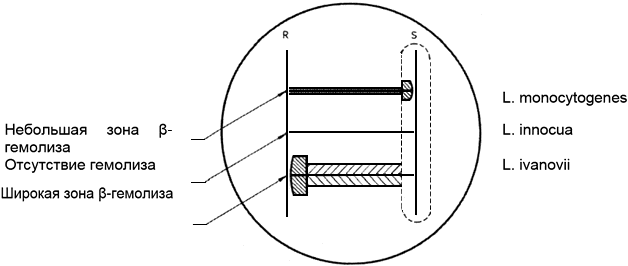
Рисунок 1 - Посев и интерпретация КАМП теста
Между вертикальными линиями Staphylococcus aureus и Rhodococcus equi засевают параллельными линиями исследуемые культуры на расстоянии друг от друга не менее 1 см и от вертикальных линий - 0,5 см.
Посевы культивируют при температуре (37±1) °С в течение 24 ч.
Для положительного контроля рекомендуется провести посев тест-штамма Listeria monocytogenes 766 аналогично посеву исследуемых культур.
После культивирования посевов отмечают изменение (расширение и просветление) зоны гемолиза в зонах, соседствующих с вертикальными штрихами Staphylococcus aureus и Rhodococcus equi.
Listeria monocytogenes дает положительную реакцию (расширение и просветление зоны гемолиза) около штриха Staphylococcus aureus и отрицательную (отсутствие изменений в зоне гемолиза) - около штриха Rhodococcus equi (см. табл.1).
Культуры микроорганизмов S. aureus, R. equi, L. monocytogenes, L. innocua и L. ivanovii для целевого использования, выращенные на скошенной плотной питательной среде (см. Б.4.1) при температуре (37±1) °С, необходимо хранить при температуре (3±2) °С.
10.6.5 Характеристика бактерий Listeria monocytogenes
К бактериям Listeria monocytogenes относятся грамположительные короткие тонкие палочки, каталазоположительные, подвижные при температуре (25±1) °С и характеризующиеся признаками, описанными в таблице 1.
10.7 Ускоренная идентификация бактерий рода Listeria и Listeria monocytogenes с использованием различных тестов и тест-систем
Допускается проведение ускоренной идентификации выделенных микроорганизмов (см. 10.5.1.2) с использованием валидированных и сертифицированных по ГОСТ ISO 16140 тестов и тест-систем, в том числе следующих.
10.7.1 Идентификация выделенных бактерий до рода Listeria
Listeria Latex Kit.
Singlepath Listeria.
VIDAS Listeria Duo (LDUO).
10.7.2 Идентификация выделенных бактерий до вида Listeria monocytogenes
VIDAS Listeria monocytogenes II (LMO2).
Singlepath L'mono.
BAX System PCR assay for L. monocytogenes.
BAX System PCR assay for L. monocytogenes 24E.
TaqMan Listeria monocytogenes Detection Kit и PrepMan Ultra Sample Preparation Reagent.
Foodproof Listeria monocytogenes Detection Kit, 5'nuclease.
10.8 Штаммовая идентификация
По эпидемиологическим показаниям штаммы, идентифицированные как L. monocytogenes, направляют в референс лаборатории для серотипирования и/или генотипирования.
11 Обработка результатов испытаний
Обработку результатов проводят в соответствии с ГОСТ ISO 7218 и отмечают наличие или отсутствие бактерий L. monocytogenes в исследованной пробе с указанием массы в граммах или объема в см.
Примечание - Если были изолированы другие виды бактерий рода Listeria, допускается отмечать эту информацию в протоколе испытания, если это предварительно согласовано между заинтересованными сторонами.
12 Оформление протокола испытания
В протоколе испытания необходимо указать метод испытания и полученные результаты. В нем должны быть также упомянуты все процедуры, не указанные в настоящем стандарте, или рассматриваемые как дополнительные, а также сведения о любых случаях, вероятно повлиявших на результаты.
В протокол испытаний должна быть включена вся информация, необходимая для точной идентификации образца.
13 Требования безопасности
Требования к безопасности при выполнении работ и квалификации оператора - по ГОСТ ISO 7218.
Для защиты здоровья лабораторного персонала настоятельно рекомендуется проводить работу, связанную с выявлением бактерий Listeria monocytogenes, в хорошо оснащенных лабораториях квалифицированным микробиологом и соблюдать особую осторожность при работе с зараженным материалом. В частности, не рекомендуется беременному персоналу работать с бактериями Listeria monocytogenes.
Приложение А
(обязательное)
Схема проведения испытания

Примечание - Первичное селективное обогащение необходимо для восстановления поврежденных клеток, а также для ингибирования роста посторонней микрофлоры.
Приложение Б
(обязательное)
Состав и приготовление питательных сред и реактивов
Б.1 Селективные среды первичного обогащения
Б.1.1 Полуконцентрированный бульон Фразера (Half Fraser broth)
Б.1.1.1 Основа среды
Состав: | |
мясной пептон (пептический перевар животной ткани) | 5,0 г |
триптон (ферментативный гидролизат казеина) | 5,0 г |
мясной экстракт | 5,0 г |
дрожжевой экстракт | 5,0 г |
хлорид натрия | 20,0 г |
натрий фосфорнокислый двухзамещенный | 12,0 г |
калий фосфорнокислый однозамещенный | 1,35 г |
эскулин | 1,0 г |
дистиллированная вода | 1000 см |
Приготовление:
Компоненты или сухую готовую среду растворяют в дистиллированной воде, нагревая при необходимости.
Устанавливают рН среды таким образом, чтобы после стерилизации его значение составляло (7,2±0,2) ед. рН при температуре 25 °С. Разливают основу среды в колбы или флаконы соответствующего объема в количестве необходимом для проведения анализа (см. 10.1) и стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
Примечание - Раствор хлорида лития и раствор налидиксовой кислоты могут быть добавлены в основу до стерилизации.
Б.1.1.2 Растворы селективных добавок
Б.1.1.2.1 Раствор хлорида лития
Состав: | |
хлорид лития | 3,0 г |
дистиллированная вода | 10,0 см |
Приготовление:
Хлорид лития растворяют в дистиллированной воде и стерилизуют раствор путем фильтрования.
Предупреждение - Необходимо принимать все меры предосторожности при растворении хлорида лития в воде, так как реакция является экзотермической. Раствор хлорида лития раздражает слизистую оболочку.
Б.1.1.2.2 Раствор натриевой соли налидиксовой кислоты
Состав: | |
натриевая соль налидиксовой кислоты | 0,1 г |
0,05 моль/дм | 10,0 см |
Приготовление:
Натриевую соль налидиксовой кислоты растворяют в растворе гидроксида натрия и стерилизуют раствор путем фильтрования.
Б.1.1.2.3 Раствор акрифлавииа гидрохлорида
Состав: | |
акрифлавин гидрохлорида | 0,25 г |
дистиллированная вода | 100 см |
Приготовление:
Акрифлавин гидрохлорида растворяют в дистиллированной воде и стерилизуют раствор путем фильтрования.
Б.1.1.2.4 Раствор цитрата аммонийного железа (III)
Состав: | |
цитрат аммонийного железа (III) | 5,0 г |
дистиллированная вода | 100 см |
Приготовление
Цитрат аммонийного железа (III) растворяют в дистиллированной воде и стерилизуют раствор путем фильтрования.
Б.1.1.3 Готовая среда
Состав среды: | |
основа среды (см. Б.1.1.1) | 100 см |
раствор хлорида лития (см. Б.1.1.2.1) | 1,0 см |
раствор натриевой соли налидиксовой кислоты (см. Б.1.1.2.2) | 0,1 см |
раствор акрифлавина гидрохлорида (см. Б.1.1.2.3) | 0,5 см |
раствор цитрата аммонийного железа (III) (см. Б.1.1.2.4) | 1,0 см |
Приготовление:
В основу среды добавляют четыре раствора селективных добавок непосредственно перед использованием.
Б.1.2 Селективный накопительный бульон (UVM)
Состав среды: | |
триптоза | 10,0 г |
мясной экстракт | 5,0 г |
дрожжевой экстракт | 5,0 г |
хлористый натрий | 20,0 г |
фосфорнокислый натрий двузамещенный | 12,0 г |
калий фосфорнокислый однозамещенный | 1,35 г |
эскулин | 1,0 г |
налидиксовая кислота | 20,0 мг |
акрифлавин гидрохлорида | 12,0 мг |
дистиллированная вода | 1000,0 см |
Приготовление:
Компоненты или сухую готовую среду растворяют в дистиллированной воде нагревая при необходимости.
Устанавливают рН среды таким образом, чтобы после стерилизации его значение составляло (7,2±0,2) ед. рН. Разливают среду в колбы или во флаконы соответствующего объема в количестве 225 см и стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
Б.1.3 Питательный бульон для выделения и культивирования листерий (ПБЛ I)
Б.1.3.1 Основа среды
Состав: | |
гидролизат казеина ферментативный | 10,0 г |
пептон мясной ферментативный | 15,0 г |
гидролизат дрожжей автолизованных | 2,0 г |
хлорид натрия | 3,5 г |
хлорид лития | 3,0 г |
дистиллированная вода | 1000,0 см |
Приготовление:
Компоненты или сухую готовую среду растворяют в дистиллированной воде, нагревая при необходимости.
Устанавливают рН среды таким образом, чтобы после стерилизации его значение составляло (7,0±0,2) ед. рН при температуре 25 °С. Разливают среду в колбы или флаконы соответствующего объема и стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
Б.1.3.2 Раствор селективной добавки
Состав: | |
налидиксовая кислота | 10 мг |
акрифлавин | 5 мг |
полимиксин В сульфат | 5 мг |
стерильная дистиллированная вода | 10 см |
Приготовление:
Налидиксовую кислоту, акрифлавин и полимиксин В сульфат растворяют в стерильной дистиллированной воде.
Б.1.3.3 Готовая среда
Состав среды: | |
основа среды (см. Б.1.3.1) | 1000 см |
раствор селективной добавки (см. Б.1.3.2) | 4,44 см |
Приготовление:
В основу среды добавляют раствор селективной добавки. Среду хранят не более двух суток в защищенном от света месте при температуре не выше 8 °С.
Б.2 Селективные среды вторичного обогащения
Б.2.1 Бульон Фразера (Fraser broth)
Б.2.1.1 Основа среды
Состав: | |
мясной пептон (пептический перевар животной ткани) | 5,0 г |
триптон (ферментативный гидролизат казеина) | 5,0 г |
мясной экстракт | 5,0 г |
дрожжевой экстракт | 5,0 г |
хлорид натрия | 20,0 г |
натрий фосфорнокислый двухзамещенный | 12,0 г |
калий фосфорнокислый однозамещенный | 1,35 г |
эскулин | 1,0 г |
хлорид лития | 3,0 г |
натриевая соль налидиксовой кислоты | 0,1 г |
дистиллированная вода | 1000 см |
Приготовление:
Компоненты или сухую готовую среду растворяют в дистиллированной воде, нагревая ее при необходимости.
Устанавливают рН среды таким образом, чтобы после стерилизации его значение составляло (7,2±0,2) ед. рН при температуре 25 °С. Разливают основу среды в колбы или флаконы соответствующего объема в количестве необходимом для проведения анализа и стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
Б.2.1.2 Растворы селективных добавок
Б.2.1.2.1 Раствор акрифлавина гидрохлорида
Согласно Б.1.1.2.3.
Б.2.1.2.2 Раствор цитрата аммонийного железа (III)
Согласно Б.1.1.2.4.
Б.2.1.3 Готовая среда
Приготовление:
В пробирки с 10 см основой среды (см. Б.2.1.1) добавляют по 0,1 см
раствора акрифлавина гидрохлорида (см. Б.2.1.2.1) и раствор цитрата аммонийного железа (III) (см. Б.2.1.2.2) непосредственно перед использованием.
Б.2.2 Селективный накопительный бульон (UVM II)
Б.2.2.1 Основа среды
Согласно Б.1.2.
Б.2.2.2 Раствор акрифлавина гидрохлорида
Состав: | |
акрифлавин гидрохлорида | 13 мг |
стерильная дистиллированная вода | 10 см |
Приготовление:
Акрифлавин гидрохлорида растворяют в стерильной дистиллированной воде.
Б.2.2.3 Готовая среда
Состав среды: | |
основа среды (см. Б.2.2.1) | 1000 см |
раствор акрифлавина гидрохлорида (см. Б.2.2.2) | 4,44 см |
Приготовление:
К 1000,0 см основы среды (см. Б.2.2.1) добавляют раствор акрифлавина гидрохлорида (см. Б.2.2.2).
Б.2.3 Питательный бульон для выделения и культивирования листерий (ПБЛ II)
Б.2.3.1 Основа среды
Согласно Б.1.3.
Б.2.3.2 Раствор селективной добавки
Состав: | |
налидиксовая кислота | 10 мг |
акрифлавин гидрохлорида | 5 мг |
полимиксин В сульфат | 5 мг |
стерильная дистиллированная вода | 5 см |
Приготовление:
Налидиксовую кислоту, акрифлавин гидрохлорида и полимиксин В сульфат растворяют в стерильной дистиллированной воде.
Б.2.3.3 Готовая среда
Состав среды: | |
основа среды (см. Б.2.3.1) | 1000 см |
раствор селективной добавки (см. Б.2.3.2) | 4,44 см |
Приготовление:
В основу среды (см. Б.2.3.1) добавляют раствор селективной добавки (см. Б.2.3.2) и разливают в стерильные пробирки по 10 см. Среду хранят не более 22 сут в защищенном от света месте при температуре не выше 8 °С.
Б.3 Селективные плотные среды для пересева
Б.3.1 Первая среда
Б.3.1.1 Агар Listeria no Оттавиани и Агости (ALOA)
Б.3.1.1.1 Основа среды
Состав: | |
ферментативный перевар животного белка | 18,0 г |
панкреатический гидролизат казеина | 6,0 г |
дрожжевой экстракт | 10,0 г |
пируват натрия | 2,0 г |
глюкоза | 2,0 г |
глицерофосфат магния | 1,0 г |
сульфат магния (безводный) | 0,5 г |
хлорид натрия | 5,0 г |
хлорид лития | 10,0 г |
натрий фосфорнокислый двузамещенный (безводный) | 2,5 г |
5-бромо-4-хлоро-3-индолил- | 0,05 г |
агар | 12,0-18,0 г |
дистиллированная вода | 930 см |
Приготовление:
Компоненты или сухую готовую среду растворяют при нагревании в дистиллированной воде.
Устанавливают рН среды таким образом, чтобы после стерилизации его значение составляло (7,2±0,2). Разливают основу среды в колбы или флаконы соответствующего объема и стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
Б.3.1.1.2 Растворы селективных добавок
Б.3.1.1.2.1 Раствор налидиксовой кислоты
Состав: | |
натриевая соль налидиксовой кислоты | 0,02 г |
0,05 моль/дм | 5,0 см |
Приготовление:
Натриевую соль налидиксовой кислоты растворяют в 5 см 0,05 моль/дм
раствора гидроксида натрия и стерилизуют раствор путем фильтрования.
Б.3.1.1.2.2 Раствор цефтазидима
Состав: | |
цефтазидим | 0,02 г |
дистиллированная вода | 5,0 см |
Приготовление
Цефтазидим растворяют в 5 см дистиллированной воды и стерилизуют раствор путем фильтрования через мембрану с диаметром пор 0,45 мкм.
Б.3.1.1.2.3 Раствор полимиксина В сульфат
Состав: | |
полимиксина В сульфат | 76700,0 е.а. |
дистиллированная вода | 5,0 см |
Приготовление:
925 см, если используют раствор амфотерицина В.
Полимиксин В сульфат растворяют в 5 см дистиллированной воды и стерилизуют раствор путем фильтрования через мембрану с диаметром пор 0,45 мкм.
Б.3.1.1.3 Растворы антибиотиков
Б.3.1.1.3.1 Раствор циклогексимида
Состав: | |
циклогексимид | 0,05 г |
этанол | 2,5 см |
дистиллированная вода | 2,5 см |
Приготовление
Циклогексимид растворяют в 2,5 см этанола, затем добавляют 2,5 см
дистиллированной воды и стерилизуют раствор путем фильтрования через мембрану с диаметром пор 0,45 мкм.
Б.3.1.1.3.2 Раствор амфотерицина В (используется, как альтернатива для раствора циклогексимида)
Состав: | |
амфотерицин В | 0,01 г |
соляная кислота (HCI) (1 моль/дм | 2,5 см |
диметилформамид (DMF) | 7,5 см |
Приготовление:
Амфотерицин растворяют в растворе соляной кислоты (HCI) и диметилформамида (DMF) и стерилизуют раствор путем фильтрования через мембрану с диаметром пор 0,45 мкм.
Предупреждение - Раствор HCI и диметилформамид (DMF) очень токсичен. Обращаться с осторожностью.
Б.3.1.1.4 Дифференциальная добавка
Состав: | |
L- | 2,0 г |
холодная дистиллированная вода | 50 см |
Приготовление:
L--фосфатидилинозитал (Sigma P 6636
) растворяют в холодной дистиллированной воде. Раствор перемешивают в течение 30 мин до получения гомогенной суспензии. Автоклавируют при температуре 121 °С в течение 15 мин с последующим охлаждением до температуры (47±2) °С.
Б.3.1.1.5 Готовая среда
Состав среды: | |
основа среды (см. Б.3.1.1.1) | 930,0 (см |
раствор налидиксовой кислоты (см. Б.3.1.1.2.1) | 5,0 см |
раствор цефтазидима (см. Б.3.1.1.2.2) | 5,0 см |
раствор полимиксина В сульфата (см. Б.3.1.1.2.3) | 5,0 см |
раствор циклогексимида (см. Б.3.1.1.3.1) | 5,0 см |
или амфотерицина В (см. Б.3.1.1.3.2) | 10,0 см |
дифференциальная добавка (см. Б.3.1.1.4) | 50,0 см |
Приготовление:
В расплавленную и охлажденную на водяной бане до температуры (47±2) °С основу среды, добавляют, тщательно перемешивая после каждого добавления, растворы ингибиторов, антибиотиков и добавок.
рН готовой среды должен составлять (7,2±0,2) ед. рН.
Готовая среда должна быть гомогенной и непрозрачной.
В стерильные чашки Петри разливают свежеприготовленную готовую среду приблизительно по 15-20 см и дают агару затвердеть.
Непосредственно перед применением среда в чашках должна быть подсушена в соответствии с ГОСТ ISO 11133-1.
Б.3.1.2 Бриллианс Listeria агар (BRILLIANCE LISTERIA agar)
Б.3.1.2.1 Основа среды
Состав: | |
пептон | 18,5 г |
дрожжевой экстракт | 4,0 г |
хлорид натрия | 9,5 г |
пируват натрия | 2,0 г |
хлорид лития | 15,0 г |
мальтоза | 4,0 г |
5-бромо-4-хлоро-3-индолил- | 0,2 г |
агар | 14,0 г |
дистиллированная вода | 930 см |
________________
* 925 см, если используют раствор амфотерицина В.
Приготовление:
Компоненты или сухую готовую среду растворяют при нагревании в дистиллированной воде.
Устанавливают рН среды таким образом, чтобы после стерилизации его значение составляло (7,2±0,2) ед. рН. Разливают основу среды в колбы или флаконы соответствующего объема и стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
Б.3.1.2.2 Растворы селективных добавок
Б.3.1.2.2.1 Раствор налидиксовой кислоты
Состав: | |
натриевая соль налидиксовой кислоты | 0,02 г |
0,05 моль/дм | 5,0 см |
Приготовление:
Натриевую соль налидиксовой кислоты растворяют в 5 см 0,05 моль/дм
раствора гидроксида натрия и стерилизуют раствор путем фильтрования.
Б.3.1.2.2.2 Раствор цефтазидима
Состав: | |
цефтазидим | 0,02 г |
дистиллированная вода | 5,0 см |
Приготовление:
Цефтазидим растворяют в 5 см дистиллированной воды и стерилизуют раствор путем фильтрования через мембрану с диаметром пор 0,45 мкм.
Б.3.1.2.2.3 Раствор полимиксина В сульфат
Состав: | |
полимиксина В сульфат | 76700,0 е.а. |
дистиллированная вода | 5,0 см |
Приготовление:
Полимиксин В сульфат растворяют в дистиллированной воде и стерилизуют раствор путем фильтрования через мембрану с диаметром пор 0,45 мкм.
Б.3.1.2.3 Растворы антибиотиков
Б.3.1.2.3.1 Раствор циклогексимида
Состав: | |
циклогексимид | 0,05 г |
этанол | 2,5 см |
дистиллированная вода | 2,5 см |
Приготовление:
Циклогексимид растворяют в 2,5 см этанола, затем добавляют 2,5 см
дистиллированной воды и стерилизуют раствор путем фильтрования через мембрану с диаметром пор 0,45 мкм.
Б.3.1.2.3.2 Раствор амфотерицина В (используют, как альтернативу для раствора циклогексимида)
Состав: | |
амфотерицин В | 0,01 г |
соляная кислота (HCI) 1 моль/дм | 2,5 см |
диметилформамид (DMF) | 7,5 см |
Приготовление:
Амфотерицин растворяют в растворе HCI и диметилформамида (DMF) и стерилизуют раствор путем фильтрования через мембрану с диаметром пор 0,45 мкм.
Предупреждение - Раствор HCI и диметилформамид (DMF) очень токсичен. Обращаться с осторожностью.
Б.3.1.2.4 Дифференциальная добавка
Состав: | |
L- | 2,0 г |
холодная дистиллированная вода | 50 см |
Приготовление:
L--фосфатидилинозитал (Sigma P 6636
)* растворяют в холодной дистиллированной воде. Раствор перемешивают в течение 30 мин до получения гомогенной суспензии. Автокларируют при температуре 121 °С в течение 15 мин с последующим охлаждением до температуры (47±2) °С.
Б.3.1.2.5 Готовая среда
Состав среды: | |
основа среды (см. Б.3.1.2.1) | 933,0 (см |
раствор налидиксовой кислоты (см. Б.3.1.2.2.1) | 5,0 см |
раствор цефтазидима (см. Б.3.1.2.2.2) | 5,0 см |
раствор полимиксина В сульфат (см. Б.3.1.2.2.3) | 5,0 см |
раствор циклогексимида (см. Б.3.1.2.3.1) | 5,0 см |
или амфотерицина В (см. Б.3.1.2.3.2) | 10,0 см |
дифференциальная добавка (см. Б.3.1.2.4) | 50,0 см |
________________
* Данная информация является рекомендуемой и приведена для удобства пользователей настоящего стандарта.
** 925 см, если используют раствор амфотерицина В.
Приготовление:
В расплавленную и охлажденную на водяной бане до температуры (47±2) °С основу среды (см. Б.3.1.2.1) добавляют растворы ингибиторов (см. Б.3.1.2.2.1, Б.3.1.2.2.2, Б.3.1.2.2.3), антибиотика (см. Б.3.1.2.3) и дифференциальную добавку (см. Б.3.1.2.4), тщательно перемешивая после каждого добавления.
рН готовой среды должен составлять (7,2±0,2) ед. рН.
Готовая среда должна быть гомогенной и непрозрачной.
В стерильные чашки Петри разливают свежеприготовленную готовую среду приблизительно по 15-20 см и дают агару затвердеть.
Непосредственно перед применением среда в чашках должна быть подсушена в соответствии с ГОСТ ISO 11133-1.
Б.3.1.3 Оценка качества первой среды
Определение селективности и продуктивности питательной среды необходимо проводить согласно ГОСТ ISO 11133-2.
В таблице Б.1 приведены тесты для оценки качества первой среды.
Таблица Б.1
Функция | Инкуби- | Контрольные штаммы | Рекомен- | Метод контроля | Критерий | Характер- |
Продуктивность | 37 °С | L. monocytogenes 4b АТСС 13932 | TSA | Количест- | Коэффициент продуктивности | Зелено- |
Специфичность | 37 °С | L. innocua АТСС 33090 (или другие эквивалентные штаммы в зарегистрированной коллекции микроорганизмов) | Качест- | Зелено- | ||
Селективность | 37 °С | Е. coli АТСС 25922 или | Качест- | Полное подавление | - | |
Примечание - Штаммы | ||||||
Б.3.2 Вторая среда селективная среда для посева*
_______________
* Текст документа соответствует оригиналу. - .
Б.3.2.1 Оксфорд агар (Oxford agar)
Б.3.2.1.1 Основа среды
Состав: | |
пептон | 23,0 г |
крахмал | 1,0 г |
хлорид натрия | 5,0 г |
эскулин | 1,0 г |
цитрат аммонийного железа (III) | 0,5 г |
хлорид лития | 15,0 г |
агар (в зависимости от плотности среды) | 9,0-18,0 г |
дистиллированная вода | 1000,0 см |
Приготовление:
Компоненты или сухую готовую среду растворяют в дистиллированной воде при нагревании.
Устанавливают рН среды таким образом, чтобы после стерилизации его значение составляло (7,0±0,2). Разливают основу среды в колбы или флаконы соответствующего объема и стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
Б.3.2.1.2 Раствор селективной добавки
Состав: | |
циклогексимид | 400,0 мг |
сульфат колистина (полимиксин Е) | 20,0 мг |
гидрохлорид акрифлавина | 5,0 мг |
цефотетан | 2,0 мг |
фосфомицин | 10,0 мг |
этанол | 5,0 см |
дистиллированная вода | 5,0 см |
Приготовление:
Компоненты добавки растворяют в смеси этанола и воды. Стерилизуют раствор фильтрованием.
Б.3.2.1.3 Готовая среда
Приготовление:
В расплавленную и охлажденную на водяной бане до температуры (47±2) °С основу среды (см. Б.3.2.1.1) добавляют, тщательно перемешивая, раствор селективной добавки (см. Б.3.2.1.2).
В стерильные чашки Петри разливают свежеприготовленную готовую среду приблизительно по 15-20 см и дают агару затвердеть.
Непосредственно перед применением среда в чашках должна быть подсушена в соответствии с ГОСТ ISO 11133-1.
Б.3.2.2 Палкам агар (PALCAM agar)
Б.3.2.2.1 Основа среды
Состав: | |
пептон | 23,0 г |
крахмал | 1,0 г |
хлорид натрия | 5,0 г |
дрожжевой экстракт | 3,0 г |
D-глюкоза | 0,5 г |
D-маннитол | 10,0 г |
эскулин | 0,8 г |
цитрат аммонийного железа (III) | 0,5 г |
фенол красный | 0,08 г |
хлорид лития | 15,0 г |
агар | 9,0-18,0 г* |
дистиллированная вода | 960,0 см |
________________
* В зависимости от плотности среды.
Приготовление:
Компоненты или сухую готовую среду растворяют в дистиллированной воде при нагревании.
Устанавливают рН среды таким образом, чтобы после стерилизации его значение составляло (7,2±0,2). Разливают основу среды в колбы или флаконы соответствующего объема и стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
Б.3.2.2.2 Раствор сульфата полимиксина В
Состав: | |
полимиксина В сульфат (100000 е.а.) | 0,1 г |
дистиллированная вода | 100 см |
Приготовление:
Растворяют полимиксина В сульфат в воде. Стерилизуют раствор фильтрованием.
Б.3.2.2.3 Раствор гидрохлорида акрифлавина
Состав: | |
акрифлавина гидрохлорид | 0,05 г |
дистиллированная вода | 100 см |
Приготовление:
Растворяют гидрохлорид акрифлавина в дистиллированной воде. Стерилизуют раствор фильтрованием.
Б.3.2.2.4 Раствор пентагидрата цефтазидима натрия
Состав: | |
пентагидрат цефтазидима натрия | 0,116 г |
дистиллированная вода | 100 см |
Приготовление:
Растворяют пентагидрат цефтазидим натрия в воде. Стерилизуют раствор фильтрованием.
Б.3.2.2.5 Готовая среда
Состав: | |
основа агара (В.3.3.1) | 960,0 см |
раствор сульфата полимиксина В (В.3.3.2) | 10,0 см |
раствор акрифлавина гидрохлорида (В.3.3.3) | 10,0 см |
раствор пентагидрата цефтазидима натрия (В.3.3.4) | 20,0 см |
Приготовление:
В расплавленную и охлажденную на водяной бане до (47±2) °С основу среды (см. Б.3.2.2.1), добавляют, тщательно перемешивая, растворы добавок (см. Б.3.2.2.2-Б.3.2.2.3).
В стерильные чашки Петри разливают свежеприготовленную готовую среду приблизительно по 15-20 см и дают агару затвердеть.
Непосредственно перед применением среда в чашках должна быть подсушена в соответствии с ГОСТ ISO 11133-1.
Б.3.2.3 Питательный агар для выделения листерий (ПАЛ)
Б.3.2.3.1 Основа среды
Состав: | |||
гидролизат казеина панкреатический | 10,0 г | ||
гидролизат рыбной муки панкреатический | 15,0 г | ||
гидролизат автолизованных дрожжей | 2,0 г | ||
хлорид натрия | 3,5 г | ||
хлорид лития | 15,0 г | ||
цитрат аммонийного железа | 0,5 г | ||
эскулин | 0,8 г | ||
агар | 13,0 г | ||
дистиллированная вода | до 1000,0 см | ||
Приготовление:
Компоненты растворяют в дистиллированной воде при нагревании и тщательно перемешивают до полного растворения. Устанавливают рН (7,0±0,2) ед. рН и стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
Б.3.2.3.2 Раствор селективной добавки
Состав: | |
налидиксовая кислота | 20 мг |
акрифлавин гидрохлорида | 10 мг |
полимиксин В сульфат | 10 мг |
стерильная дистиллированная вода | 10 см |
Приготовление:
Налидиксовую кислоту, акрифлавин и полимиксин В сульфат растворяют в стерильном физиологическом растворе.
Б.3.2.3.3 Готовая среда
Состав: | |
основа среды (см. Б.3.2.3.1) | 1000 см |
раствор селективной добавки (см. Б.3.2.3.2) | 4,44 см |
Приготовление:
К расплавленной основе среды добавляют с соблюдением правил асептики раствор селективной добавки. Готовую среду разливают в стерильные чашки Петри и хранят не более 22 сут в защищенном от света месте при температуре не выше 8 °С.
Б.4 Питательные среды, используемые для изучения культурально-морфологических свойств
Б.4.1 Плотные питательные среды
Б.4.1.1 Триптон-соевый агар с дрожжевым экстрактом (TSYEA)
Состав: | |
триптон или панкреатический гидролизат казеина | 17,0 г |
соевый пептон | 3,0 г |
хлорид натрия | 5,0 г |
калий фосфорнокислый двузамещенный | 2,5 г |
глюкоза | 2,5 г |
дрожжевой экстракт | 6,0 г |
агар | 9,0-18,0 г* |
дистиллированная вода | 1000,0 см |
* В зависимости от плотности среды.
Приготовление:
Растворяют компоненты или сухую готовую среду в дистиллированной воде, нагревая. При необходимости установить рН так, чтобы после стерилизации его значение соответствовало (7,3±0,2) ед. рН при температуре 25 °С. Среду необходимого объема разливают в пробирки. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин. Скашивают агар. Для приготовления чашек с агаром готовую среду разливают в стерильные чашки Петри в объеме, необходимом для проведения теста. Дают агару застыть.
Б.4.1.2 Трипказо-соевый агар (TSA)
Состав среды: | |
триптон | 15,0 г |
соевый пептон | 5,0 г |
хлорид натрия | 5,0 г |
агар | 5,0 г |
дистиллированная вода | 1000,0 см |
Приготовление:
Растворяют компоненты или сухую готовую среду в дистиллированной воде, нагревая. Устанавливают рН (7,3±0,2) ед. рН и стерилизуют при температуре (121±1) °С в течение 15 мин.
Приготовленную среду разливают в чашки Петри и хранят в защищенном от света месте при температуре не выше 8 °С.
Б.4.1.3 Мясопептонный агар (МПА)
В соответствии с ГОСТ 10444.1 (пункт 5.12).
Б.4.2 Жидкие питательные среды
Б.4.2.1 Триптон-соевый бульон с дрожжевым экстрактом (TSYEB)
Состав среды: | |
триптон или панкреатический гидролизат казеина | 17,0 г |
соевый пептон | 3,0 г |
хлорид натрия | 5,0 г |
калий фосфорнокислый двузамещенный | 2,5 г |
глюкоза | 2,5 г |
дрожжевой экстракт | 6,0 г |
дистиллированная вода | 1000,0 см |
Приготовление:
Компоненты или сухую готовую среду растворяют в дистиллированной воде, при необходимости нагревая. Устанавливают рН (7,3±0,2) ед. рН. Среду разливают в пробирки или колбы и стерилизуют при температуре (121±1) °С в течение 15 мин.
Б.4.2.2 Трипказо-соевый бульон (TSB)
Состав среды: | |
триптон | 17,0 г |
соевый пептон | 3,0 г |
хлорид натрия | 5,0 г |
калия фосфат однозамещенный | 2,5 г |
декстроза | 2,5 г |
дистиллированная вода | 1000,0 см |
Приготовление:
Компоненты или сухую готовую среду растворяют в дистиллированной воде, при необходимости нагревая. Устанавливают рН (7,3±0,2) ед. рН. Среду разливают в пробирки или колбы и стерилизуют при температуре (121±1) °С в течение 15 мин.
Приготовленную среду хранят в защищенном от света месте при температуре не выше 8 °С.
Б.4.2.3 Мясопоптонный бульон (МПБ)
В соответствии с ГОСТ 10444.1 (пункт 5.12).
Б.5 Среда для определения -гемолитической активности
Б.5.1 Кровяной агар
Б.5.1.1 Основа среды (вариант 1)
Состав: | |
мясной пептон | 15,0 г |
печеночный перевар | 2,5 г |
дрожжевой экстракт | 5,0 г |
хлорид натрия | 5,0 г |
агар | 9,0-18,0 г * |
дистиллированная вода | 1000,0 см |
* В зависимости от плотности среды.
Приготовление:
Компоненты или сухую готовую среду растворяют в дистиллированной воде, нагревая на водяной бане. При необходимости установить рН так, чтобы после стерилизации его значение соответствовало (7,2±0,2) ед. рН при температуре 25 °С. Среду разливают в колбы и стерилизуют при температуре (121±1)°С в течение 15 мин.
Б.5.1.2 Основа среды (вариант 2)
Состав и приготовление согласно ГОСТ 10444.1 (пункт 5.12).
Б.5.1.3 Дефибринированная кровь барана
Приготовление:
В стерильную колбу со стеклянными бусами вливают 8 см только что взятой крови барана и непрерывно встряхивают в течение 10-15 мин, в результате чего находящийся в крови фибрин выпадает в осадок, обволакивая бусы. Дефибринированную кровь сливают в другую колбу или пробирку. Слитая дефибринированная кровь утрачивает способность свертываться и может храниться при температуре (4±1) °С в течение одной недели.
Б.5.1.4 Готовая среда
Состав среды: | |
основа среды (см. Б.5.1 или Б.5.2) | 100 см |
дефибринированная кровь барана | 5,0-7,0 см |
Приготовление:
В основу среды (см. Б.5.1 или Б.5.2), охлажденную на водяной бане до температуры (47±2) °С, добавляют дефибринированную кровь барана (см. Б.5.1.3). Среда должна иметь рН (7,2±0,2) ед. рН.
Готовую среду осторожно перемешивают и разливают в чашки Петри (не более 10 см на чашку) и после затвердения агара подсушивают его при температуре (47±2) °С в течение 30 мин или в ламинарном боксе в течение 1-2 ч или в других условиях, обеспечивающих испарение конденсационной влаги и исключающих микробное загрязнение.
Среду в чашках хранят при температуре (4±1) °С не более двух суток.
Слой агара в чашке Петри должен быть равномерно окрашен в красный цвет. Для посева должна использоваться подсушенная среда.
Б.6 Суспензия из эритроцитов барана для определения гемолитической активности
Приготовление:
Кровь из яремной вены барана отбирают в стерильную банку с бусами и дефибринируют (см. Б.5.1.3). Эритроциты трижды отмывают изотоническим раствором хлорида натрия путем центрифугирования при 1000-2000 об/мин в течение 5-10 мин соответственно. После последнего центрифугирования надосадочная жидкость должна быть прозрачной. Красный цвет жидкости (гемолиз) свидетельствует о непригодности эритроцитов к применению. Отмытые эритроциты барана необходимо хранить при температуре (3±2) °С не более двух суток.
Если гемолиз эритроцитов барана не наблюдается, необходимо внести 2 см кровяных телец в 98 см
фосфатно-солевого буфера (PBS) (см. Б.11).
Если гемолиз эритроцитов наблюдается, необходимо внести около 4 см слоя кровяных телец в 10 см
фосфатно-солевого буфера (PBS) (см. Б.11) и осторожно перемешать, а затем центрифугировать. Если жидкость на поверхности стала четко красного цвета благодаря выраженному гемолизу, не допускается использование такой суспензии эритроцитов, она должна утилизироваться.
Суспензию эритроцитов барана необходимо хранить при температуре (3±2) °С не более пяти суток.
Б.7 Среды для определения ферментативных свойств
Б.7.1 Бульон с бромкрезоловым пурпурным
Б.7.1.1 Основа среды
Состав: | |
протеозный пептон | 10,0 г |
мясной экстракт | 1,0 г |
хлорид натрия | 5,0 г |
бромкрезоловый пурпурный | 0,02 г |
дистиллированная вода | 1000,0 см |
Приготовление:
Компоненты или сухую готовую среду растворяют в дистиллированной воде.
Устанавливают рН среды таким образом, чтобы после стерилизации его значение составляло (6,8±0,2) ед. рН. Разливают среду в пробирки соответствующего объема и стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
Б.7.1.2 Растворы углеводов
Состав: | |
углевод* | 5,0 г |
дистиллированная вода | 100 см |
* L-рамноза, D-ксилоза и альфа-метил D-маннозид (Methyl -D-mannopyranoside).
Приготовление:
Каждый из углеводов отдельно растворяют в 100 см дистиллированной воды и стерилизуют раствор путем фильтрования.
Б.7.1.3 Готовая среда
Состав: | |
основа среды (см. Б.7.1.1) | 9,0 см |
углевод (см. Б.7.1.2) | 1,0 см |
Приготовление:
В асептических условиях в основу среды (см. Б.7.1) перед применением добавляют раствор каждого углевода (см. Б.7.2) в отдельности.
Б.7.2 Среды Гисса
Состав и приготовление в соответствии ГОСТ 10444.1.
Углеводы: L-рамноза, D-ксилоза и альфа-метил D-маннозид (Methyl -D-mannopyranoside).
Б.8 Агар для определения подвижности культуры микроорганизма
Состав среды: | |
ферментативный гидропизат казеина | 20,0 г |
пептон | 6,1 г |
агар-агар | 3,5 г |
дистиллированная вода | 1000,0 см |
Приготовление:
Компоненты или сухую готовую среду растворяют в дистиллированной воде при нагревании.
Устанавливают рН среды таким образом, чтобы после стерилизации его значение составляло (7,3±0,2) ед. рН. Разливают среду в пробирки соответствующего объема в количестве 5 см и стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
Б.9 Среды для проведения КАМП (CAMP) теста
Для проведения этого теста могут быть использованы чашки Петри с кровяным агаром (см. Б.5.1.4), но предпочтительнее использовать чашки с двойным слоем: среды (см. Б.5.1.1 или Б.5.1.2) и тонкого слоя кровяного агара (см. Б.5.1.4).
Среду (см. Б.5.1.1 или Б.5.1.2) разливают примерно по 10 см в стерильные чашки Петри и дают застыть. Затем очень тонким слоем заливают кровяной агар (см. Б.5.1.4), но не более 3 см
на чашку. Дают агару застыть.
Если кровяной агар (см. Б.5.1.4) вносится в заранее приготовленные чашки со средой (см. Б.5.1.1 или Б.5.1.2), то перед тем, как внести ее, необходимо прогреть эти чашки в течение 20 мин в термостате при температуре 37 °С.
Б.10 Среда для определения лецитиназной активности
Б.10.1 Лецитин-агар с активированным углем
Б.10.1.1 Основа среды
Состав: | |
панкреатический гидролизат рыбной муки | 15,0 г |
панкреатический гидролизат казеина | 10,0 г |
экстракт дрожжевой | 2,0 г |
натрий хлорид | 3,5 г |
глюкоза | 1,0 г |
агар | 10,0±2,0 г |
дистиллированная вода | 1000 см |
Приготовление:
Компоненты или сухую готовую среду растворяют в дистиллированной воде, кипятят в течение 2 мин до полного расплавления агара, фильтруют через ватно-марлевый фильтр, разливают в стерильные колбы и флаконы и стерилизуют автоклавированием при температуре 121 °С в течение 15 мин.
Б.10.1.2 Активированный уголь
Активированный уголь растирают до порошкообразного состояния.
Б.10.1.3 Эмульсия яичного желтка
Поверхность яйца обрабатывают этиловым спиртом, стерильным пинцетом пробивают с двух сторон отверстия и через одно из них полностью удаляют белок. Желток выливают в стерильную колбу.
Для приготовления желточной эмульсии к одному желтку с соблюдением правил асептики добавляют 150 см стерильного физиологического раствора и тщательно перемешивают до получения однородной массы.
Б.10.1.4 Готовая среда
Состав: | |
основа среды (см. Б.10.1) | 100 см |
активированный уголь (см. Б.10.2) | 0,5 г |
желточная эмульсия (см. Б.10.3) | 5 см |
Приготовление:
Расплавленную основу среды (см. Б.10.1) охлаждают до температуры (47±2,0) °С, добавляют активированный уголь (см. Б.10.2) и желточную эмульсию (см. Б.10.3), тщательно перемешивают и разливают по (20±5) см в стерильные чашки Петри и после застывания подсушивают в термостате при температуре (37±1) °С в течение (40±5) мин.
Б.10.2 Лецитин-агар без угля
Б.10.2.1 Основа среды
Состав: | |
панкреатический гидролизат рыбной муки | 15,0 г |
панкреатический гидролизат казеина | 10,0 г |
экстракт дрожжевой | 2,0 г |
натрий хлорид | 3,5 г |
глюкоза | 1,0 г |
агар | 10,0±2,0 г |
дистиллированная вода | 1000 см |
Приготовление:
Компоненты или сухую готовую среду растворяют в дистиллированной воде, кипятят в течение 2 мин до полного расплавления агара, фильтруют через ватно-марлевый фильтр, разливают в стерильные колбы и флаконы и стерилизуют автоклавированием при температуре 121 °С в течение 15 мин.
Б.10.2.2 Эмульсия яичного желтка
Поверхность яйца обрабатывают этиловым спиртом, стерильным пинцетом пробивают с двух сторон отверстия и через одно из них полностью удаляют белок. Желток выливают в стерильную колбу.
Для приготовления желточной эмульсии к одному желтку с соблюдением правил асептики добавляют 150 см стерильного фосфатно-солевого буфера (PBS) (см. Б.11) и тщательно перемешивают до получения однородной массы.
Б.10.2.3 Готовая среда
Состав среды: | |
основа среды (см. Б.10.2.1) | 100 см |
желточная эмульсия (см. Б.10.2.2) | 5 см |
Приготовление:
Расплавленную основу среды (см. Б.10.2.1) охлаждают до температуры (47±2,0) °С, добавляют желточную эмульсию (см. Б.10.2.2), тщательно перемешивают и разливают по (20±5) см в стерильные чашки Петри и после застывания подсушивают в термостате при температуре (37±1) °С в течение (40±5) мин.
Б.11 Фосфатно-солевой буфер (PBS)
Состав среды: | |
натрий фосфорнокислый двухзамещенный | 8,98 г |
натрий фосфорнокислый однозамещенный | 2,71 г |
хлорид натрия | 8,5 г |
дистиллированная вода | 1000,0 см |
Приготовление:
Компоненты или сухую готовую среду растворяют в дистиллированной воде. При необходимости установить рН так, чтобы после стерилизации его значение соответствовало (7,2±0,2) ед. рН при температуре 25 °С. Стерилизуют в автоклаве при температуре 121 °С в течение 15 мин.
____________________________________________________________________________________
УДК 663/664:543.9:006.354 МКС 07.100.30 NEQ
Ключевые слова: пищевые продукты, бактерии Listeria monocytogenes, селективное обогащение, идентификация бактерий рода Listeria
____________________________________________________________________________________
Редакция документа с учетом
изменений и дополнений подготовлена

