ГОСТ 32064-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКТЫ ПИЩЕВЫЕ
Методы выявления и определения количества бактерий семейства Enterobacteriaceae
Food products. Methods for detection and quantity determination of family Enterobacteriaceae
МКС 07.100.30
Дата введения 2014-07-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Государственным научным учреждением "Всероссийский научно-исследовательский институт консервной и овощесушильной промышленности" Российской академии сельскохозяйственных наук (ГНУ ВНИИКОП Россельхозакадемии)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 7 июня 2013 г. N 43)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Киргизия | KG | Кыргызстандарт |
Казахстан | KZ | Госстандарт Республики Казахстан |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 27 июня 2013 г. N 237-ст межгосударственный стандарт ГОСТ 32064-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2014 г.
5 Настоящий стандарт модифицирован по отношению к международным стандартам ISO 21528-1:2004* Microbiology of food and animal feeding stuffs - Horizontal methods for the detection and enumeration of Enterobacteriaceae - Part 1: Determination and enumeration by MPN technique with pre-enrichment (Микробиология пищевых продуктов и кормов для животных. Горизонтальные методы обнаружения и подсчета бактерий Enterobacteriaceae. Часть 1. Обнаружение и подсчет методом MPN с предварительным обогащением) и ISO 21528-2:2004 Microbiology of food and animal feeding stuffs - Horizontal methods for the detection and enumeration of Enterobacteriaceae - Part 2: Colony-count method (Микробиология пищевых продуктов и кормов для животных. Горизонтальные методы обнаружения и подсчета бактерий Enterobacteriaceae. Часть 2. Метод подсчета колоний) с внесением технических отклонений путем изменения содержания отдельных структурных элементов, которые выделены курсивом**. Оригинальный текст русской версии этих структурных элементов примененных международных стандартов и объяснения причин внесения дополнений приведены в тексте в виде примечаний. Полный перечень всех технических отклонений с разъяснением причин их внесения приведен во введении к настоящему стандарту.
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей.
** В оригинале обозначения и номера стандартов и нормативных документов в разделах "Предисловие" и "Введение", приводятся обычным шрифтом, остальные по тексту документа выделены курсивом. - .
Международные стандарты разработаны подкомитетом ISO/ТС 34/SC 9 "Микробиология" технического комитета по стандартизации ISO/TC 34 "Пищевые продукты".
Перевод с английского языка (en).
Официальные экземпляры международных стандартов, на основе которых подготовлен настоящий межгосударственный стандарт, имеются в Федеральном агентстве по техническому регулированию и метрологии Российской Федерации (Росстандарте).
Сравнение структур международных стандартов со структурой настоящего стандарта приведено в приложении ДВ.
Степень соответствия - модифицированная (MOD).
Стандарт подготовлен на основе ГОСТ Р 54005-2010
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
Введение
В настоящий стандарт включены дополнительные по отношению к международным стандартам ИСО 21528-1 и ИСО 21528-2 требования, отражающие потребности национальной экономики государств, указанных в предисловии, а именно:
- введен дополнительный метод посева на поверхность агаризованной селективной среды для твердых пищевых продуктов, содержащих в 1 г не менее 1500 КОЕ бактерий семейства Enterobacteriaceae, и для жидких пищевых продуктов, содержащих в 1 см не менее 150 КОЕ бактерий семейства Enterobacteriaceae. Рост факультативно-анаэробных бактерий возможен на поверхности среды и этот поверхностный рост облегчает дальнейшую идентификацию бактерий, метод посева на поверхность агаризованной среды предусмотрен ГОСТ 26670. Также с использованием этого метода предусмотрено выявление бактерий семейства Enterobacteriaceae, при условии, что пробу продукта для анализа, в которой предусмотрено выявление, возможно, посеять по этому методу;
- включен метод посева мембранных фильтров, который также является разновидностью посева на поверхность агаризованной питательной среды;
- в раздел 2 "Нормативные ссылки" введены ссылки на межгосударственные стандарты;
- предусмотрен, при выявлении или при определении количества по методу НВЧ бактерий семейства Enterobacteriaceae, непосредственный посев в селективные питательные среды для пищевых продуктов, в которых микроорганизмы не подвергнуты каким- либо сублетальным воздействиям;
- для увеличения объема или массы пробы продукта для анализа предусмотрено использование для посева питательных сред двойной концентрации;
- при испытании высококислотных продуктов для создания оптимальных условий роста микроорганизмов предусмотрено доведение рН до нейтрального значения в самих продуктах;
- предусмотрено использование дополнительных питательных сред и реактивов традиционно используемых на территории государств, указанных в предисловии, для выявления бактерий семейства Enterobacteriaceae;
- в подтверждающие тесты введен метод окраски по Граму, так как бактерии семейства Enterobacteriaceae это, прежде всего, грамотрицательные бактерии, а при идентификации переходят от общих признаков к частным;
- дополнительное приложение ДА "Схемы методов выявления и определения количества бактерий семейства Enterobacteriaceae по методу НВЧ";
- дополнительное приложение ДБ "Расчет наиболее вероятного числа микроорганизмов";
- дополнительное приложение ДВ "Сопоставление структуры настоящего стандарта со структурой примененных в нем международных стандартов ИСО 21528-1 и ИСО 21528-2".
Не включены в настоящий стандарт:
- ссылки на ИСО 6887 (четыре части) и ИСО 8261, касающиеся требований к подготовке проб для проведения испытания, так как подготовку проб проводят по ГОСТ 26669;
- ссылки на ИСО/ТУ 11133 (две части), касающиеся требований по обеспечению качества подготовки культуральных сред, так как эти требования включены в настоящий стандарт;
- приложение А (нормативное) "Схема методики обнаружения" и приложение В "Схема процедуры для метода НВЧ" (ИСО 21528-1), которые для удобства пользования объединены в справочном приложении ДА настоящего стандарта;
- приложение А (нормативное) "Доверительные пределы для оценки небольших количеств колоний" (ИСО 21528-2), т. к. эта информация содержится в ГОСТ 26670;
- структурный элемент "Библиография", так как соответствующая ссылка отсутствует в настоящем стандарте.
1 Область применения
Настоящий стандарт распространяется на пищевые продукты, а также корма для животных, пробы окружающей среды в сфере производства и обработки пищевых продуктов и устанавливает:
- качественный метод выявления бактерий семейства Enterobacteriaceae;
- количественный метод наиболее вероятного числа (НВЧ);
- количественные методы посева в или на агаризованные селективно-диагностические среды.
Метод НВЧ применяют для пищевых продуктов, содержащих в 1 г твердого продукта не более 150 или в 1 см жидкого продукта не более 15 колониеобразующих единиц (КОЕ) бактерий семейства Enterobacteriaceae.
Метод посева в агаризованные селективно-диагностические среды применяют для пищевых продуктов, содержащих в 1 г твердого продукта не менее 150 или в 1 см жидкого продукта не менее 15 колониеобразующих единиц (КОЕ) бактерий семейства Enterobacteriaceae.
Метод посева на агаризованные селективно-диагностические среды применяют для пищевых продуктов, содержащих в 1 г твердого продукта не менее 1500 или в 1 см жидкого продукта не менее 150 КОЕ бактерий семейства Enterobacteriaceae.
Примечание - Метод посева на поверхность агаризованной среды предусмотрен ГОСТ 26670 и введен дополнительно в связи с тем, что рост факультативно-анаэробных бактерий возможен на поверхности среды и этот поверхностный рост облегчает дальнейшую идентификацию бактерий.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 3622-68 Молоко и молочные продукты. Отбор проб и подготовка их к испытанию
ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
ГОСТ ISO 7218-2011 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 13496.0-80 Комбикорма, сырье. Методы отбора проб
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов
ГОСТ 29228-91 (ИСО 835-2-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 2. Пипетки градуированные без установленного времени ожидания
ГОСТ 30425-97 Консервы. Метод определения промышленной стерильности
ГОСТ 31099-2002* Микробиология. Корма, комбикорма, комбикормовое сырье. Общее руководство по приготовлению разведений для микробиологических исследований
________________
* На территории Российской Федерации действует ГОСТ Р 51426-99, здесь и далее по тексту. - .
ГОСТ 31904-2012 Продукты пищевые и вкусовые. Методы отбора проб для микробиологических анализов
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться замененным (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 бактерии семейства Enterobacteriaceae: Факультативно-анаэробные грамотрицательные палочки, не образующие спор, которые образуют типичные колонии на агаризованных селективно-диагностических средах, сбраживают глюкозу, с образованием или без образования газа, и дают отрицательную реакцию на оксидазу.
3.2 выявление бактерий семейства Enterobacteriaceae: Определение присутствия или отсутствия бактерий семейства Enterobacteriaceae в определенной массе или объеме продукта.
3.3 определение количества бактерий семейства Enterobacteriaceae:
3.3.1 Количество бактерий, содержащееся в 1 см или 1 г продукта, определенное путем посева продукта и/или его разведений в или на агаризованную селективно-диагностическую среду.
3.3.2 Количество бактерий, содержащееся в 1 см или 1 г продукта, определенное по методу НВЧ.
3.4 Выявление и определение количества бактерий семейства Enterobacteriaceae проводят по методам, приведенным в настоящем стандарте.
4 Метод выявления и определение количества бактерий семейства Enterobacteriaceae по методу НВЧ
Метод выявления и определения определенного количества бактерий семейства Enterobacteriaceae по методу НВЧ основан на высеве определенного количества продукта и/или разведений пробы для анализа в жидкую неселективную среду, инкубировании посевов, пересеве культуральной жидкости в жидкую селективную среду, учете положительных пробирок, и пересева культуральной жидкости на поверхность агаризованной селективно-диагностической среды для подтверждения по биохимическим и культуральным признакам роста принадлежности выделенных типичных колоний к бактериям семейства Enterobacteriaceae.
4.1 Выявление бактерий семейства Enterobacteriaceae
4.1.1 Предварительное обогащение в неселективной среде
В забуференную пептонную воду высевают пробу для анализа, предназначенную для испытания, затем инкубируют при температуре (37±1) °С в течение (18±2) ч.
4.1.2 Обогащение в селективной жидкой среде
Пробирку с селективной средой инокулируют 1 см из пробирки, полученной по 4.1.1, и инкубируют при температуре (37±1) °С в течение (24±2) ч.
4.1.3 Выделение типичных колоний
На поверхность селективно-диагностической агаризованной среды высевают культуру, полученную по 4.1.2, посевы инкубируют при температуре (37±1) °С.
Посевы просматривают через (24±2) ч для определения наличия типичных для бактерий семейства Enterobacteriaceae колоний.
4.1.4 Подтверждение принадлежности выделенных типичных колоний к бактериям семейства Enterobacteriaceae
Типичные колонии, полученные по 4.1.3, пересевают на поверхность питательного агара для дальнейшего подтверждения принадлежности выделенных культур к бактериям семейства Enterobacteriaceae.
4.1.5 Схема выявления бактерий семейства Enterobacteriaceae приведена в справочном приложении ДА.
4.2 Определение количества бактерий семейства Enterobacteriaceae (метод НВЧ)
4.2.1 Предварительное обогащение в неселективной среде
Для посева используют не менее трех последовательных разведений для анализа, отличающиеся между собой в 10 раз по массе или объему. Для посева используют не менее трех последовательных 10-кратных разведений. По 1 см исходной пробы и каждого последующего разведения вносят в жидкую неселективную среду не менее, чем в трех повторностях. Выбираемая последовательность разведений для посева зависит от предполагаемого уровня обсемененности продукта бактериями семейства Enterobacteriaceae или от нормативных значений.
Предварительное неселективное обогащение проводят путем посева определенного объема продукта и/или его разведений в забуференную пептонную воду.
Посевы инкубируют при температуре (37±1) °С в течение (18±2) ч.
4.2.2 Обогащение в селективной жидкой среде
Пробирки с селективной средой инокулируют 1 см из каждого посева, полученного по 4.2.1, и инкубируют при температуре (37±1) °С в течение (24±2) ч.
4.2.3 Выделение типичных колоний, подтверждение принадлежности выделенных типичных колоний к бактериям семейства Enterobacteriaceae
Выделение типичных колоний, подтверждение принадлежности выделенных типичных колоний к бактериям семейства Enterobacteriaceae проводят по 4.1.3 и 4.1.4.
4.2.4 Схема определения количества бактерий семейства Enterobacteriaceae по методу НВЧ с предварительным обогащением приведена в справочном приложении ДА.
4.2.5 Наиболее вероятное число бактерий семейства Enterobacteriaceae в 1 см или 1 г пробы продукта (НВЧ) рассчитывают исходя из числа посевов, в которых подтверждено присутствие этих бактерий. Определение наиболее вероятного числа - в соответствии с таблицей приложения ДБ.
4.3 При выявлении бактерий семейства Enterobacteriaceae и определения их количества по методу НВЧ в свежих продуктах, не содержащих сублетально поврежденных микроорганизмов, подвергнутых каким-либо воздействиям, например сушке, заморозке и т.д., допускается высевать пробу продукта для анализа и/или его разведения непосредственно в селективные среды, минуя этап неселективного обогащения.
Количество высеваемого продукта или его разведения и среды должно быть в соотношении не менее чем 1:10.
При увеличении массы или объема высеваемой пробы продукта допускается использование селективных жидких сред двойной концентрации.
При непосредственном посеве продукта в селективную среду посевы инкубируют при температуре (37±1) °С в течение 48 ч.
Примечание - 4.3 введен в связи с тем, что непосредственный посев в селективные питательные среды для пищевых продуктов, в которых микроорганизмы не подвергнуты каким-либо сублетальным воздействиям, предусмотрен для упрощения испытания и сокращения его продолжительности.
5 Методы определения количества бактерий семейства Enterobacteriaceae (подсчет колоний)
Методы определения количества бактерий семейства Enterobacteriaceae основаны на посеве определенного количества продукта и/или его разведений в или на агаризованные селективно-диагностические среды, инкубировании посевов, подсчете типичных колоний, подтверждении по биохимическим и культуральным признакам принадлежности выделенных типичных колоний к бактериям семейства Enterobacteriaceae.
5.1 Метод посева в агаризованную селективно-диагностическую среду
5.1.1 Для определения количества бактерий семейства Enterobacteriaceae по 1 см из двух последовательных разведений продукта, если продукт жидкий, или по 1 см
исходного разведения в случае не жидкого продукта вносят в две стерильные чашки Петри.
Другую пару чашек используют для более разведенного высеваемого продукта - исходной суспензии и/или десятикратных разведений продукта.
Чашки с внесенным в них продуктом и/или его разведением заливают селективно-диагностической агаризованной питательной средой.
Посевы в чашках инкубируют при температуре (37±1) °С в течение (24±2) ч.
5.1.2 После инкубирования посевов отбирают чашки, на которых выросло от 15 до 150 типичных колоний. Подсчитывают на отобранных чашках количество выросших типичных колоний.
При посеве методом мембранных фильтров на них подсчитывают колонии, если их менее 15.
Примечание - Дополнение введено в связи с тем, что поверхность мембранного фильтра намного меньше, чем чашки Петри.
Выбирают по три типичных колонии каждого типа для пересева на поверхность питательного агара для дальнейшего подтверждения принадлежности выросших культур к бактериям семейства Enterobacteriaceae.
5.2 Метод посева на агаризованную селективно-диагностическую среду
5.2.1 На подсушенную поверхность агаризованной селективно-диагностической среды двух чашек Петри наносят по 0,1-0,2 см продукта, если продукт жидкий, или исходной суспензии в случае не жидкого продукта.
Другую пару чашек используют для других количеств высеваемого продукта - исходной суспензии и/или десятикратных разведений продукта.
Внесенный в чашки продукт или его разведения распределяют по поверхности селективно-диагностической агаризованной питательной среды стерильным шпателем.
Посевы в чашках инкубируют при температуре (37±1) °С в течение (24±2) ч.
5.2.2 Подсчет и отбор типичных колоний для дальнейшего подтверждения их принадлежности к бактериям семейства Enterobacteriaceae проводят по 5.1.2.
Примечание - 5.2 введен дополнительно в связи с включением в настоящий стандарт метода посева на поверхность питательных сред.
5.3 Количество продукта и/или его разведений для посева в или на агаризованную селективно-диагностическую среду зависит от предполагаемого уровня обсемененности продукта бактериями семейства Enterobacteriaceae или от нормативных значений.
5.4 Количество бактерий семейства Enterobacteriaceae на 1 см или на 1 г анализируемого продукта пересчитывают по ГОСТ 26670, исходя из числа подтвержденных типичных колоний, выросших на чашках Петри при посеве в или на агаризованные селективно-диагностические среды.
6 Питательные среды и растворы реактивов
Химические вещества, используемые для приготовления питательных сред и реактивов должны быть аналитического качества, а вода дистиллированной.
6.1 Селективная среда обогащения: глюкозный бульон с желчью и бриллиантовым зеленым
6.1.1 Состав:
ферментативный гидролизат животных тканей, г | 10,0 |
глюкоза, г | 5,0 |
натрий фосфорнокислый двузамещенный безводный ( | 6,45 |
калий фосфорнокислый однозамещенный безводный ( | 2,0 |
говяжья желчь для бактериологического использования, г | 20,0 |
бриллиантовый зеленый, г | 0,0125 |
(или 2,5 см | |
вода, см | 1000 |
6.1.2 Приготовление
Растворяют компоненты или дегидратированную основу среды в воде. Нагревают среду на слабом огне до кипения, кипятят 1-2 мин, фильтруют через ватно-марлевый фильтр, доводят объем до 1 дм, охлаждают до температуры 45 °С - 55 °С. Устанавливают рН так, чтобы он составлял (7,2±0,2) ед. рН при температуре 25 °С, после чего среду доводят до кипения.
Среду не стерилизуют.
Среду разливают в стерильную посуду:
- по 10 см в пробирки размером приблизительно 16x160 мм при использовании среды нормальной концентрации;
- по 10 см в пробирки размером приблизительно 20х200 мм при использовании среды двойной концентрации;
- по 90 см в колбы.
Примечание - Дополнение введено в связи с тем, что использование сред двойной концентрации предусматривает добавление количества продукта или его разведения по объему, равному количеству среды, для этого должны использоваться пробирки большей вместимости.
Срок хранения среды при температуре (5±3) °С - не более 1 мес.
6.1.3 Раствор бриллиантового зеленого
6.1.3.1 Состав:
бриллиантовый зеленый, г | 0,5 |
вода, см | 100 |
6.1.3.2 Приготовление
Бриллиантовый зеленый переносят в фарфоровую ступку и постепенно растворяют в воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят водой до метки.
Примечание - Пункт 6.1.3 введен дополнительно в связи с тем, что в стандартах ИСО предусмотрено внесение красок в дегидратированную основу среды в сухом виде, а при приготовлении среды из отдельных компонентов, краски вносятся в виде растворов, (см. также 6.2.3, 6.2.4, 6.4.3.)
6.2 Глюкозный агар с желчью и фиолетовым красным (VRBG)
6.2.1 Состав:
ферментативный гидролизат животных тканей, г | 7,0 |
экстракт дрожжей, г | 3,0 |
говяжья желчь для бактериологического использования, г | 1,5 |
глюкоза, г | 10,0 |
натрии хлористый, г | 5,0 |
нейтральный красный, г | 0,03 |
(или 1 см | |
кристаллический фиолетовый, г | 0,002 |
(или 0,2 см | |
агар, г | 9-18 |
(зависит от желирующей способности агара); | |
вода, см | 1000 |
6.2.2 Приготовление
Растворяют компоненты или дегидратированную основу среды в воде. Нагревают среду на слабом огне до кипения, кипятят 1-2 мин, фильтруют через ватно-марлевый фильтр, доводят объем до 1 дм, охлаждают до температуры 45 °С - 55 °С. Устанавливают рН так, чтобы он составлял (7,4±0,2) ед. рН при температуре 25 °С, после чего среду доводят до кипения, разливают в стерильные колбы. Среду не стерилизуют.
Срок хранения расплавленной среды с момента ее приготовления - не более 4 ч.
6.2.3 Раствор нейтрального красного
6.2.3.1 Состав:
нейтральный красный, г | 3,0 |
вода, см | 100 |
6.2.3.2 Приготовление
Нейтральный красный переносят в фарфоровую ступку и постепенно растворяют в воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят водой до метки.
6.2.4 Раствор кристаллического фиолетового
6.2.4.1 Состав:
кристаллический фиолетовый, г | 1,0 |
вода, см | 100 |
6.2.4.2 Приготовление
Кристаллический фиолетовый переносят в фарфоровую ступку и постепенно растворяют в воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят водой до метки.
Примечание - Пункты 6.2.3-6.2.4 введены дополнительно в соответствии с 6.1.2.
6.2.5 Приготовления чашек Петри с агаром
Приблизительно по 15 см агаризованной среды, охлажденной до температуры 44 °С - 47 °С, разливают в стерильные чашки Петри и дают затвердеть.
Непосредственно перед использованием подсушивают поверхность среды в чашках Петри, предпочтительно при снятых крышках и поверхностью агара, смотрящей вниз, в сушильном шкафу до тех пор (около 30 мин), пока на поверхности агара не останется влаги.
Приготовленную среду в чашках Петри можно хранить в условиях, которые не приведут к изменению химического состава среды, до двух недель при температуре (5±3) °С.
6.3 Питательный агар
6.3.1 Состав
мясной экстракт, г | 3,0 |
ферментативный гидролизат животных тканей, г | 5,0 |
натрий хлористый, г | 5,0 |
агар, г | 9-18 |
(зависит от желирующей способности агара) | |
вода, см | 1000 |
6.3.2 Приготовление
Растворяют компоненты или дегидратированную основу среды в воде. Нагревают среду на слабом огне до кипения, кипятят 1-2 мин, доводят объем до 1 дм, охлаждают до температуры 45 °С - 55 °С. Устанавливают рН так, чтобы после стерилизации он составлял (7,3±0,2) ед. рН при температуре 25 °С. Разливают среду по колбам или пробиркам и стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
6.4 Глюкозный агар
6.4.1 Состав
ферментативный гидролизат казеина, г | 10,0 |
экстракт дрожжей, г | 1,5 |
глюкоза, г | 10,0 |
натрий хлористый, г | 5,0 |
бромкрезоловый пурпуровый, г | 0,015 |
(или 1,5 см | |
агар, г | 9-18 |
(зависит от желирующей способности агара) | |
вода, см | 1000 |
6.4.2 Приготовление
Растворяют компоненты или дегидратированную основу среды в воде. Нагревают среду на слабом огне до кипения, кипятят 1-2 мин, доводят объем до 1 дм, охлаждают до температуры 45 °С - 55 ° С. Устанавливают рН так, чтобы он составлял (7,0±0,2) ед. рН при температуре 25 °С. Разливают среду по 5 см
в пробирки и стерилизуют в автоклаве при температуре (112±1) °С в течение 20 мин.
Примечание - Изменение режима стерилизации среды введено в связи с тем, что среды Гисса с углеводами для предотвращения разложения углеводов стерилизуют при 112 °С.
Пробирки после стерилизации оставляют в вертикальном положении. Приготовленную среду можно хранить при температуре (5±3) °С не более 1 нед. Если среда хранилась при температуре (5±3) °С, то непосредственно перед использованием, среду прогревают (регенерируют) в кипящей водяной бане или текучим паром в автоклаве в течение 15 мин, затем быстро охлаждают до температуры инкубации посевов.
6.4.3 Раствор бромкрезолового пурпурового
6.4.3.1 Состав:
бромкрезоловый пурпуровый, г | 1 |
раствор гидроокиси натрия молярной | |
концентрации с ( | 19 |
вода, см | 80 |
6.4.3.2 Приготовление
Бромкрезоловый пурпуровый переносят в фарфоровую ступку с 19 см раствора гидроокиси натрия молярной концентрации с (
![]() )=0,1 моль/дм
)=0,1 моль/дм и после растворения добавляют воду.
Примечание - Пункт 6.4.3 введен дополнительно в соответствии с 6.1.2.
6.5 Селективная обогатительная среда (среда Кесслера)
6.5.1 Состав:
пептон, г | 10,0 |
глюкоза, г | 2,5 |
желчь, г | 5,0 |
раствор кристаллического фиолетового, приготовленный по 6.2.4, см | 2,0 |
вода, см | 1000 |
6.5.2 Приготовление
При нагревании растворяют компоненты в воде. Нагревают на слабом огне до кипения, кипятят 1-2 мин, фильтруют через ватно-марлевый фильтр, доводят объем до 1 дм, охлаждают до температуры 45 °С - 55 °С и устанавливают рН так, чтобы после стерилизации он составлял (7,2±0,1) ед. рН при температуре 25 °С.
Среду разливают по 6.1.2.
Стерилизуют среду в автоклаве при температуре (115±1) °С в течение 20 мин.
6.6 Селективная обогатительная среда (бульон Мак-Конки)
6.6.1 Состав:
пептон, г | 20,0 |
глюкоза, г | 10,0 |
желчь, г | 5,0 |
раствор бромкрезолового пурпурового, приготовленный по 6.4.3, см | 1,0 |
натрий хлористый, г | 5,0 |
вода, см | 1000 |
6.6.2 Приготовление
При нагревании все компоненты растворяют в воде. Нагревают на слабом огне до кипения, кипятят 1-2 мин, фильтруют через ватно-марлевый фильтр, доводят объем до 1 дм, охлаждают до температуры 45 °С - 55 °С и устанавливают рН так, чтобы после стерилизации он составлял (7,2±0,1) ед. рН при температуре 25 °С. Разливают среду по 6.5.2 и стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
6.7 Агар Эндо
Среду готовят в соответствии с рекомендациями, указанными на этикетке.
6.8 Среда Гисса с глюкозой
Среду готовят по ГОСТ 10444.1 или используют сухую среду с глюкозой, среду готовят в соответствии с рекомендациями, указанными на этикетке.
6.9 ГРМ-агар (сухой питательный агар на основе гидролизата рыбной муки для культивирования микроорганизмов)
Среду готовят в соответствии с рекомендациями, указанными на этикетке.
6.10 Мясо-пептонный агар
Среду готовят по ГОСТ 31099 и ГОСТ 10444.1.
Примечание - 6.5-6.10 введены дополнительно для отражения потребностей национальной экономики государств, принявших стандарт. Предусмотрено использование дополнительных питательных сред и реактивов, традиционно применяемых на территории государств, принявших стандарт, для выявления бактерий семейства Enterobacteriaceae.
6.11 Реактив для определения оксидазы
6.11.1 Состав:
N,N,N',N'-тетраметил- | 1,0 |
вода, см | 100 |
6.11.2 Приготовление
Растворяют компонент в воде температурой 10 °С - 15 °С. Реактив готовят непосредственно перед использованием.
Для определения оксидазы допускается использование дисков и растворов, зарегистрированных в порядке, действующем на территории государства, принявшего стандарт, промышленного производства. Для контроля качества дисков и растворов используют музейные оксидазоположительные и оксидазоотрицательные культуры.
6.12 При приготовлении селективных жидких сред двойной концентрации количество ингредиентов или дегидратированной основы среды увеличивается в два раза, а количество воды остается без изменения.
6.13 Растворы и реактивы для окраски по Граму готовят по ГОСТ 31099 и ГОСТ 10444.1.
Растворы и реактивы для окраски по Граму, а также растворы, приготовленные по 6.1.3, 6.2.3, 6.2.4, 6.4.3, хранят в закрытых сосудах из темного стекла при комнатной температуре не более 3 мес.
6.14 Допускается использование готовых и дегидратированных питательных сред, в т.ч. хромогенных, зарегистрированных на территории государства, принявшего стандарт.
Примечание - 6.12-6.14 введены дополнительно для отражения потребностей национальной экономики государства, принявшего стандарт.
7 Аппаратура, посуда, вспомогательные материалы, реактивы
Приемлемой альтернативой посуды многоразового применения является одноразовая посуда, если она отвечает соответствующим требованиям.
7.1 Оборудование лабораторное для микробиологических исследований - по ГОСТ ISO 7218 и ГОСТ 10444.1.
7.2 Аппарат для сухой стерилизации (стерилизационный сушильный шкаф) или влажной стерилизации (автоклав), с регулирующими устройствами для поддержания заданной температуры, с допустимой погрешностью не более ±1 °С.
7.3 Термостат, поддерживающий температуру (37±1) °С.
7.4 Баня водяная, поддерживающая заданную температуру от 44 °С до 47 °С с погрешностью ±0,5 °С.
7.5 Прибор для мембранной фильтрации растворов.
7.6 Весы лабораторные для взвешивания реактивов с пределами допускаемой абсолютной погрешности однократного взвешивания ±0,01 мг* и ±10 мг.
________________
* Письмом Росстандарта от 23.06.2021 N 1637-ИК/03 разъясняется, что "в части пределов допускаемой абсолютной погрешности лабораторных весов для взвешивания реактивов допущена опечатка". Следует читать: ±0,01 г. - .
7.7 Пробирки и колбы разной вместимости по ГОСТ 25336. Допускается использование флаконов или бутылок с нетоксичными металлическими или пластиковыми завинчивающимися крышками.
7.8 Микроскоп биологический, обеспечивающий просмотр в проходящем свете, с увеличением 900-1000.
7.9 Петля бактериологическая, с размером диаметра петли около 3 мм.
7.10 рН-метр с диапазоном измерений от 2 до 18 ед. рН, погрешность измерений ±0,01 ед. рН при температуре 20 °С - 25 °С.
7.11 Стекла предметные по ГОСТ 9284.
7.12 Стекла покровные по ГОСТ 6672.
7.13 Пипетки градуированные или автоматические, вместимостью от 1 до 10 см по ГОСТ 29228.
7.14 Чашки Петри нормального размера (диаметр 100 мм) и/или большого размера (диаметр 150 мм) по ГОСТ 25336.
7.15 Бриллиантовый зеленый.
7.16 Желчь говяжья сухая.
7.17 Экстракт мясной.
7.18 Нейтральный красный.
7.19 Гидролизат животных тканей ферментативный.
7.20 Гидролизат казеина ферментативный.
Допускается применение других средств измерений, вспомогательного оборудования с аналогичными метрологическими и техническими характеристиками, а также материалов, по качеству не хуже указанных в разделе 7.
8 Отбор и подготовка проб
8.1 Отбор проб - по ГОСТ 3622, ГОСТ 13496.0 и ГОСТ 31904.
Для испытания должна быть отобрана и направлена представительная проба, не поврежденная и не измененная в ходе транспортирования или хранения.
8.2 Подготовка проб - по ГОСТ 31099 и ГОСТ 26669.
Примечание - Раздел 8 введен дополнительно в соответствии с требованиями межгосударственной стандартизации.
9 Проведение испытания
9.1 Метод выявления бактерий семейства Enterobacteriaceae
9.1.1 Приготовление исходного и десятикратных разведений - по ГОСТ 31099 и ГОСТ 26669.
9.1.2 Предварительное обогащение в неселективной среде
В зависимости от предполагаемой обсемененности продукта бактериями семейства Enterobacteriaceae или нормативных значений , см
, жидкой пробы, или
, см
, исходной суспензии при испытании твердых продуктов и/или их разведений переносят в пробирку, содержащую забуференную пептонную воду. Соотношение количества высеваемого продукта и забуференной пептонной воды соответственно 1:10.
Посевы инкубируют при температуре (37±1) °С в течение (18±2) ч.
9.1.3 Обогащение в селективной жидкой среде
Пробирку с селективной средой инокулируют 1 см из пробирки, полученной по 9.1.2, и инкубируют при температуре (37±1) °С в течение (24±2) ч.
При непосредственном посеве продукта в селективную среду в зависимости от требуемых пределов выявления , см
, жидкой пробы или
, см
, исходной суспензии при использовании других продуктов переносят в пробирку, содержащую 10 см
обогатительной селективной среды двойной концентрации для 1 см
10 см
, или в пробирку, содержащую 10 см
обогатительной селективной среды нормальной концентрации для
1 см
.
При испытании высококислотных продуктов для предотвращения резкого снижения рН (на 0,5 и более) питательных сред рН питательных сред после внесения в них продукта или его разведения доводят до допустимых значений с помощью стерильного раствора гидроокиси натрия, приготовленного по ГОСТ 10444.1, или при приготовлении питательных сред рН устанавливают выше заданного с учетом его последующего снижения при внесении продукта. Количество добавляемого стерильного раствора гидроокиси натрия или величину, на которую необходимо увеличить рН при приготовлении питательных сред, устанавливают опытным путем.
Допускается доводить рН до нейтрального значения с помощью стерильного раствора гидроокиси натрия непосредственно в высококислотном продукте.
Посевы непосредственно в селективную среду инкубируют в течение 24-48 ч, через 24 ч проводят предварительный учет роста бактерий в среде, а через 48 ч - окончательный.
Примечание - Дополнение введено в связи с тем, что подкисление сред проводят для создания оптимальных условий роста микроорганизмов.
9.1.4 Выделение типичных колоний
Используя петлю, пересевают культуры с селективной питательной среды с признаками роста на поверхность одной из селективно-диагностических сред, приготовленных по 6.2 или 6.7.
Посевы инкубируют при температуре (37±1) °С в течение (24±2) ч.
9.1.5 Выбор колоний для подтверждения
После инкубирования посевов по 9.1.4 отмечают рост типичных колоний.
На глюкозном агаре с желчью и фиолетовым красным бактерии семейства Enterobacteriaceae образуют колонии розовые, красные или пурпурные (с ореолом или без него).
На среде Эндо бактерии семейства Enterobacteriaceae образуют колонии темно-красные с металлическим блеском или без него, розовые, прозрачные.
Из каждой инкубированной чашки (см. 9.1.4), на которой обнаружены типичные колонии, выбирают по три хорошо изолированных колонии каждого типа и пересевают каждую отобранную колонию отдельно на поверхность питательного агара.
Посевы инкубируют при температуре (37±1) °С в течение (24±2) ч.
9.1.6 Подтверждение принадлежности типичных колоний к бактериям семейства Enterobacteriaceae
Принадлежность выросших культур к бактериям семейства Enterobacteriaceae подтверждают по отношению к окраске по Граму, отсутствию оксидазы и по ферментации глюкозы.
9.1.6.1 Окраска по Граму
Приготовление мазков из культур, выросших на скошенной поверхности питательного агара, и окраску их по Граму проводят по ГОСТ 30425.
Бактерии семейства Enterobacteriaceae - грамотрицательные палочки.
Допускается окраску по Граму заменять тестом Грегерсена, для этого на предметном стекле в капле 3%-ного водного раствора калия гидроокиси эмульгируют культуру микроорганизмов, взятую из колонии с агаризованной среды. Если через несколько секунд взвесь ослизняется и за петлей тянутся слизистые нити, то это указывает на принадлежность испытуемой культуры к грамотрицательному виду. У грамположительных бактерий слизистых нитей не образуется.
Примечание - Пункт 9.1.6.1 введен дополнительно в связи с тем, что бактерии семейства Enterobacteriaceae это, прежде всего, грамотрицательные бактерии, а при идентификации переходят от общих признаков к частным, поэтому прежде всего необходимо определить отношение выявленных бактерий к окраске по Граму.
9.1.6.2 Определение отсутствия оксидазы
Используя платиново-иридиевую петлю (проволоку) или никель-хромовую или стеклянную палочку, отбирают культуры, выросшие на поверхности питательного агара (см. 9.1.5) и наносят штрихами на фильтровальную бумагу, смоченную реактивом для определения оксидазы (6.11).
Результат испытания считают отрицательным, если фильтровальная бумага на месте нанесения штрихов не посинела в течение 10 с.
9.1.6.3 Определение ферментации глюкозы
Для определения ферментации глюкозы испытуемую культуру высевают уколом в глюкозный агар (6.4) или среду Гисса с глюкозой (6.8). Посевы термостатируют при температуре (37±1) °С в течение (24 ±2) ч.
Бактерии семейства Enterobacteriaceae ферментируют глюкозу с образованием только кислоты (цвет среды меняется) или кислоты и газа.
9.1.7 По результатам дополнительного подтверждения к бактериям семейства Enterobacteriaceae относят факультативно-анаэробные, не образующие спор грамотрицательные оксидазоотрицательные палочки, сбраживающие глюкозу с образованием кислоты или кислоты и газа.
9.2 Метод НВЧ-определение количества бактерий семейства Enterobacteriaceae
9.2.1 Приготовление исходного разведения и десятикратных разведений - по ГОСТ 31099 и ГОСТ 26669.
Готовят достаточное число разведений по ГОСТ 26669, гарантируя, что все пробирки, соответствующие конечному разведению, покажут отрицательный результат.
9.2.2 Инокуляция и инкубация
9.2.2.1 Используют по три пробирки для каждой пробы продукта для анализа и/или его разведения.
9.2.3 Предварительное обогащение в неселективной среде
Посевы для предварительного обогащения проводят с учетом требований 4.2.1.
Например, в каждую из трех пробирок с 9 см забуференнной пептонной воды вносят по 1 см
продукта, если анализируемый продукт жидкий, или вносят по 10 см
исходного разведения нежидкого продукта в колбу с 90 см
забуференнной пептонной воды.
В каждую из трех пробирок с 9 см забуференнной пептонной воды вносят по 1 см
первого десятикратного разведения продукта, если исходный продукт жидкий, или вносят по 1 см
исходного разведения продукта, в случае нежидкого продукта.
В каждую из трех пробирок с 9 см забуференнной пептонной воды вносят по 1 см
второго десятикратного разведения продукта, если исходный продукт жидкий, или вносят по 1 см
первого десятикратного исходного разведения продукта, в случае нежидкого продукта.
Каждое последующее разведение высевают, используя новую стерильную пипетку. Осторожно перемешивают инокулум и среду.
Посевы инкубируют при температуре (37±1) °С в течение (18±2) ч.
9.2.4 Обогащение в селективной жидкой среде
Пробирки с селективной средой инокулируют 1 см из каждого посева, полученного по 9.2.3, и инкубируют при температуре (37±1) °С в течение (24±2) ч.
Посев непосредственно в селективную питательную среду проводят в соответствии с 9.1.3.
9.2.5 Выделение типичных колоний, подтверждение принадлежности выделенных колоний к бактериям семейства Enterobacteriaceae
Выделение типичных колоний, подтверждение принадлежности выделенных колоний к бактериям семейства Enterobacteriaceae проводят по 9.1.4-9.1.6.
9.2.6 Наиболее вероятное число бактерий семейства Enterobacteriaceae в 1 см или 1 г пробы продукта (НВЧ) рассчитывают исходя из числа посевов, в которых подтверждено присутствие этих бактерий. Для определения наиболее вероятного числа пользуются таблицей ДБ.1 приложения ДБ. Для примера, приведенного в 9.2.3, полученные табличные значения делят на десять, так как высевали 1 г (10
), 0,1 г (10
) и 0,01 г (10
), а масса (объемы) проб для анализа выбранные для посева, отличаются от табличных значений в десять раз.
9.3 Метод определения количества бактерий семейства Enterobacteriaceae - (подсчет колоний)
9.3.1 Приготовление исходного и десятикратных разведений - по ГОСТ 31099 и ГОСТ 26669.
9.3.2 Метод определения количества бактерий семейства Enterobacteriaceae посевом в агаризованную среду
9.3.2.1 Для посева жидкого продукта или исходного разведения нежидкого продукта или их разведений используют по две чашки Петри для продукта и каждого его разведения. Переносят стерильной пипеткой 1 см продукта или разведения в центр каждой чашки. Для посева в чашку Петри продукта и каждого его разведения используют отдельную стерильную пипетку.
9.3.2.2 В каждую чашку Петри (9.3.2.1) наливают около 15 см одной из сред (6.2, 6.7), охлажденной до температуры 44 °С - 47 °С. Время, прошедшее между посевом продукта и/или его разведения в чашку Петри и заливкой среды, не должно превышать 15 мин.
Аккуратно перемешивают инокулят со средой и оставляют смесь для застывания, для этого чашки Петри помещают на холодную горизонтальную поверхность.
В качестве арбитражной среды используют VRBG- агар.
Одновременно для контроля стерильности агаризованной среды в стерильную чашку Петри наливают приблизительно 15 см среды и инкубируют вместе с посевами.
9.3.2.3 В случае ожидаемого ползучего роста допускается наслаивание второго слоя среды. Для этого после застывания среды в чашках Петри на ее поверхность наливают около 4 см использованной агаризованной среды (6.2, 6.7) температурой 44 °С - 47 °С. Добавленная среда должна затвердеть.
9.3.3 Метод определения количества бактерий семейства Enterobacteriaceae посевом на агаризованную среду
9.3.3.1 При определении количества бактерий семейства Enterobacteriaceae посевом на агаризованные селективно-диагностические среды (6.2, 6.7) по 0,1 или 0,2 см продукта или его разведения наносят на поверхность одной из этих сред, разлитых в чашки Петри по две для каждой пробы продукта для анализа или ее разведения. Подготовку чашек Петри со средой к посеву и посев проводят по ГОСТ 26670.
При применении метода мембранных фильтров фильтры после фильтрации переносят на поверхность агаризованной селективно-диагностической среды, избегая образования пузырьков воздуха между средой и фильтром. Поверхность фильтра с осевшими на ней бактериями должна быть обращена вверх.
Примечание - Пункт 9.3.3 введен дополнительно в связи с включением в настоящий стандарт метода посева на поверхность питательных сред (раздел 1).
9.3.3.2 Переворачивают крышкой вниз чашки Петри с посевами по 9.3.2.3 и 9.3.3.1 и инкубируют в термостате при температуре (37±1) °С в течение (24±2) ч.
9.3.4 Подсчет количества колоний
После инкубации по 9.3.3.2 отбирают чашки, на которых выросло от 15 до 150 колоний. Посевы просматривают, отмечают рост типичных колоний и подсчитывают их количество.
Характеристика типичных колоний - по 9.1.5.
9.3.5 Подтверждение принадлежности бактерий из типичных колоний к бактериям семейства Enterobacteriaceae
Отбирают не менее чем по три типичные колонии. Каждую отобранную колонию пересевают на поверхность питательного агара. Посевы термостатируют при температуре (37±1) °С в течение (24±2) ч.
Подтверждение принадлежности выделенных типичных колоний к бактериям семейства Enterobacteriaceae проводят по 9.1.6.
9.3.6 Допускается также выявление бактерий семейства Enterobacteriaceae проводить посевом в или на агаризованную среду при условии, что пробу для анализа, в которой предусматривается выявление, возможно посеять по этому методу.
При выявлении бактерий семейства Enterobacteriaceae посевом в или на агаризованную среду подсчета количества выросших колоний не проводят.
Примечание - Пункт 9.3.6 введен дополнительно в связи с тем, что выявление бактерий семейства Enterobacteriaceae в определенной пробе для анализа возможно проводить путем посева этой пробы в или на агаризованные среды.
9.3.7 Подсчет и выражение результатов
Если при подтверждении типичных колоний в двух из трех или трех из трех отобранных колоний подтвержден рост бактерий семейства Enterobacteriaceae, то считают, что все колонии, выросшие на чашке Петри (см. 9.3.4), принадлежат к бактериям семейства Enterobacteriaceae. Если в одной из трех колоний подтвержден рост бактерий семейства Enterobacteriaceae, то количество бактерий семейства Enterobacteriaceae определяют, исходя из процентного отношения подтвержденных колоний к общему количеству колоний, взятых для подтверждения.
Пересчет количества бактерий семейства Enterobacteriaceae, определенного посевом в или на агаризованные среды, на 1 г (см) продукта проводят по ГОСТ 26670.
Результаты определения количества бактерий семейства Enterobacteriaceae и выявления их в определенной пробе продукта для анализа выражают по ГОСТ 26670.
Примечание - Пункт 9.3.7 введен дополнительно в связи с тем, что обработка и выражение результатов микробиологических испытаний приведены в ГОСТ 26670.
10 Протокол испытания
Результаты оценивают по каждой пробе для анализа отдельно.
Протокол испытания должен включать:
- всю информацию, необходимую для полной идентификации продукта;
- используемый метод в соответствии с настоящим стандартом;
- все детали испытания, не установленные настоящим стандартом;
- полученный(е) результат(ы).
Приложение ДА
(справочное)
Схемы методов выявления и определения количества бактерий семейства Enterobacteriaceae по методу НВЧ
ДА.1 Схема определения количества бактерий семейства Enterobacteriaceae по методу НВЧ с предварительным обогащением приведена на рисунке ДА.1.
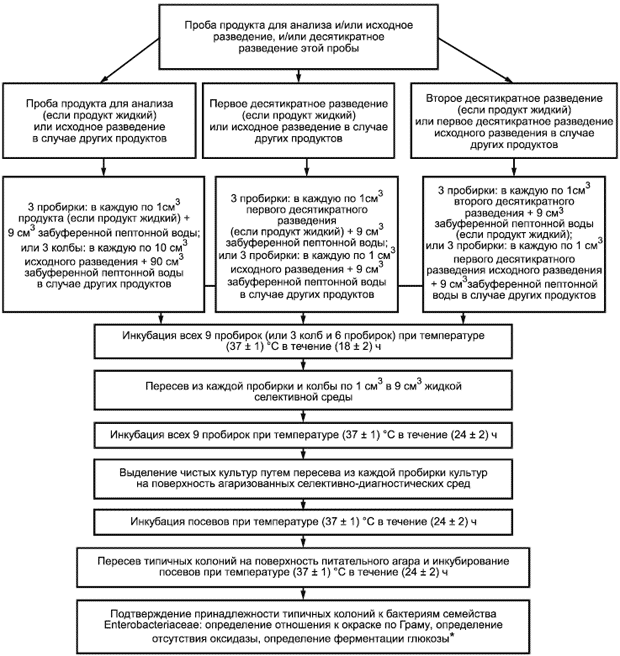
Рисунок ДА.1
_______________
* Подсчет НВЧ проводят в соответствии с таблицей ДБ.
ДА.2 Схема выявления бактерий семейства Enterobacteriaceae с предварительным обогащением и без предварительного обогащения приведена на рисунке ДА.2.
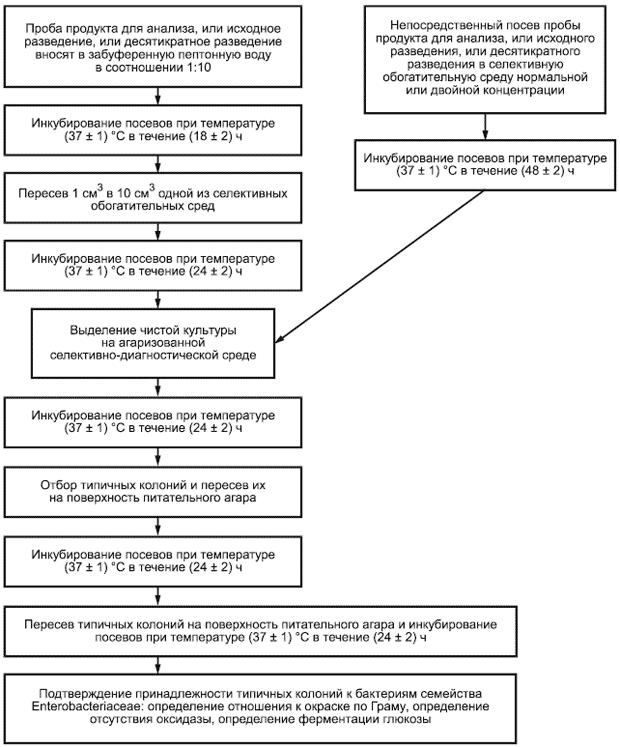
Рисунок ДА.2
Приложение ДБ
(справочное)
Расчет наиболее вероятного числа микроорганизмов
ДБ.1 Расчет наиболее вероятного числа микроорганизмов приведен в таблице ДБ.1.
Таблица ДБ.1
Количество положительных пробирок в каждом из трех последовательных разведений | НВЧ | Категория оценки НВЧ для разного количества одновременно испытанных проб для анализа | Фактическое количество микроорганизмов в 1 г (см | |||||||
10 | 10 | 10 | 1 | 2 | 3 | 5 | 10 | 95% | 99% | |
0 | 0 | 0 | <3 | 0,0-9,4 | 0,0-14,0 | |||||
0 | 1 | 3 | 3 | 3 | 2 | 2 | 2 | 1 | 0,1-9,5 | 0,0-14,0 |
0 | 0 | 3 | 2 | 2 | 1 | 1 | 1 | 1 | 0,1-10,0 | 0,0-16,0 |
0 | 1 | 1 | 6 | 0 | 3 | 3 | 3 | 3 | 1,2-17,0 | 0,5-25,0 |
0 | 2 | 0 | 6 | 3 | 2 | 2 | 2 | 1 | 1,2-17,0 | 0,5-25,0 |
0 | 3 | 0 | 9 | 0 | 0 | 0 | 0 | 3 | 3,5-35,0 | 1,8-46,0 |
1 | 0 | 0 | 4 | 1 | 1 | 1 | 1 | 1 | 0,2-17,0 | 0,1-25,0 |
1 | 0 | 1 | 7 | 2 | 1 | 1 | 1 | 1 | 1,2-17,0 | 0,5-25,0 |
1 | 0 | 2 | 11 | 0 | 0 | 0 | 3 | 3 | 4,0-35,0 | 2,0-46,0 |
1 | 1 | 0 | 7 | 1 | 1 | 1 | 1 | 1 | 1,3-20,0 | 0,6-27,0 |
1 | 1 | 1 | 11 | 3 | 3 | 3 | 2 | 2 | 4,0-35,0 | 2,0-46,0 |
1 | 2 | 0 | 11 | 2 | 2 | 1 | 1 | 1 | 4,0-35,0 | 2,0-46,0 |
1 | 2 | 1 | 15 | 3 | 3 | 3 | 3 | 2 | 5,0-38,0 | 2,0-52,0 |
1 | 3 | 1 | 16 | 3 | 3 | 3 | 3 | 2 | 5,0-38,0 | 2,0-52,0 |
2 | 0 | 0 | 9 | 1 | 1 | 1 | 1 | 1 | 1,5-35,0 | 0,7-46,0 |
2 | 0 | 1 | 14 | 2 | 1 | 1 | 1 | 1 | 4,0-35,0 | 2,0-46,0 |
2 | 0 | 2 | 20 | 0 | 3 | 3 | 3 | 3 | 5,0-38,0 | 2,0-52,0 |
2 | 1 | 0 | 15 | 1 | 1 | 1 | 1 | 1 | 4,0-38,0 | 2,0-52,0 |
2 | 1 | 1 | 20 | 2 | 2 | 1 | 1 | 1 | 5,0-38,0 | 2,0-52,0 |
2 | 1 | 2 | 27 | 0 | 3 | 3 | 3 | 3 | 9,0-94,0 | 5,0-142,0 |
2 | 2 | 0 | 21 | 1 | 1 | 1 | 1 | 1 | 5,0-40,0 | 2,0-55,0 |
2 | 2 | 1 | 28 | 3 | 2 | 2 | 2 | 1 | 9,0-94,0 | 5,0-142,0 |
2 | 2 | 2 | 35 | 0 | 0 | 0 | 0 | 3 | 9,0-94,0 | 5,0-142,0 |
2 | 3 | 0 | 29 | 3 | 2 | 2 | 2 | 1 | 9,0-94,0 | 5,0-142,0 |
2 | 3 | 1 | 36 | 0 | 3 | 3 | 3 | 3 | 9,0-94,0 | 5,0-142,0 |
3 | 0 | 0 | 23 | 1 | 1 | 1 | 1 | 1 | 5,0-94,0 | 3,0-142,0 |
3 | 0 | 1 | 38 | 1 | 1 | 1 | 1 | 1 | 9,0-104,0 | 5,0-157,0 |
3 | 0 | 2 | 64 | 3 | 3 | 2 | 2 | 2 | 16,0-181,0 | 10,0-250,0 |
3 | 1 | 0 | 43 | 1 | 1 | 1 | 1 | 1 | 9,0-181,0 | 5,0-250,0 |
3 | 1 | 1 | 75 | 1 | 1 | 1 | 1 | 1 | 17,0-199,0 | 11,0-270,0 |
3 | 1 | 2 | 120 | 3 | 2 | 2 | 2 | 1 | 30,0-360,0 | 20,0-440,0 |
3 | 1 | 3 | 160 | 0 | 0 | 0 | 3 | 3 | 30,0-380,0 | 20,0-520,0 |
3 | 2 | 0 | 93 | 1 | 1 | 1 | 1 | 1 | 18,0-360,0 | 12,0-430,0 |
3 | 2 | 1 | 150 | 1 | 1 | 1 | 1 | 1 | 30,0-380,0 | 20,0-520,0 |
3 | 2 | 2 | 210 | 2 | 1 | 1 | 1 | 1 | 30,0-400,0 | 20,0-560,0 |
3 | 2 | 3 | 290 | 3 | 3 | 3 | 2 | 2 | 90,0-990,0 | 50,0-1520,0 |
3 | 3 | 0 | 240 | 1 | 1 | 1 | 1 | 1 | 40,0-990,0 | 30,0-1520,0 |
3 | 3 | 1 | 460 | 1 | 1 | 1 | 1 | 1 | 90,0-1960,0 | 50,0-2830,0 |
3 | 3 | 2 | 1100 | 1 | 1 | 1 | 1 | 1 | 200,0-4000,0 | 100,0-5700,0 |
3 | 3 | 3 | >1100 | - | - | - | - | - | - | - |
Описание метода НВЧ и разъяснение по его применению
1 Из пробы продукта для анализа готовят исходное и ряд десятикратных разведений до такой степени, чтобы можно было определить предполагаемое НВЧ бактерий семейства Enterobacteriaceae.
Высеваемые объемы продукта и его разведения выбирают следующим образом:
а) по 1 см из разведения 10
и последующих более высоких разведений, если необходимо определить количество бактерий семейства Enterobacteriaceae, превышающее 3 клетки в 1 г (см
) продукта;
б) по 10 см из разведения 10
или 1 см
неразведенного продукта и по 1 см
из разведения 10
и последующего более высокого разведения, если необходимо определить количество бактерий семейства Enterobacteriaceae, превышающее 3 клетки в 10 г (см
) продукта;
в) по 10 и 1 см неразведенного продукта и ряда его разведений, если необходимо определить количество бактерий семейства Enterobacteriaceae, превышающее 3 клетки в 100 г (см
) продукта.
2 Разведения и неразведенный продукт высевают параллельно в три колбы (пробирки) с питательной средой. Инокулум объемом 1 см высевают в 10 см
среды нормальной концентрации, инокулумы объемом 10 см
высевают в 10 см
среды двойной концентрации.
3 Посевы инкубируют в условиях, указанных в настоящем стандарте.
4 НВЧ бактерий семейства Enterobacteriaceae определяют, исходя из количества положительных пробирок с посевами по таблице.
5 Для определения НВЧ выбирают три самых высоких последовательных разведения, в первом из которых все три повторности положительные, а в последнем и в последующем уже не оцениваемом разведении все три повторности отрицательные (например: 3, 2, 0 или 3, 2, 1, 0).
6 Если после разведения, в котором все три пробирки были отрицательными, одна из пробирок большего (то есть следующего за ним) разведения окажется положительной (например: 3, 2, 0, 1), то для определения НВЧ учитывают три разведения, начиная с того, в котором количество положительных пробирок было меньше трех (то есть 2, 0, 1).
7 Если после наибольшего разведения с тремя положительными пробирками было посеяно лишь одно разведение, в котором оказались положительными одна или две пробирки, то НВЧ бактерий семейства Enterobacteriaceae записывают как "более чем", так как в последующих разведениях могли бы быть положительные пробирки. Например, при посеве число положительных пробирок соответствовало 3, 3, 1 или 3, 3, 2, то согласно таблице НВЧ будет более 460 или более 1100.
8 Если ни в одном из разведений не было трех положительных пробирок, то для определения НВЧ учитывают три последовательных разведения (например, 2, 2, 1, 0 или 2, 1, 0, 0).
9 Если все пробирки посеянных разведений будут отрицательными (то есть 0, 0, 0), то НВЧ бактерий семейства Enterobacteriaceae ниже числа, выявляемого посеянными разведениями (например, "ниже чем 3 в 10 г") и наоборот, если все пробирки посеянных разведений будут положительными (то есть 3, 3, 3), то НВЧ будет выше его максимального значения, определяемого посеянными разведениями (например, "выше чем 1100 в 1 г").
При необходимости определения конечного числа бактерий исследование повторяют.
10 Если три десятикратных разведения были более низкими или более высокими по сравнению с приведенными в таблице, то НВЧ бактерий семейства Enterobacteriaceae в продукте будет на столько разрядов ниже или выше, на сколько разрядов посеянные разведения отличаются от табличных.
Например, для комбинации чисел 3, 2, 1 НВЧ составляет 150 микроорганизмов в 1 г продукта в случае, если посеяны по 1 см разведения 10
, 10
, 10
. Если для посева использованы разведения 10
, 10
, 10
, то найденное НВЧ равно 150·10=1500 микроорганизмов в 1 г (см
). Если для посева использовались 10 и 1 см
неразведенного продукта и 1 см
разведения 10
, то НВЧ равно 150:100=1,5 в 1 г (см
) или 15 микроорганизмов в 10 см
продукта.
11 Из значений НВЧ учитывают те, которые отвечают наиболее вероятным комбинациям трехзначного числа первой категории. Если НВЧ, соответствующего комбинации трехзначного числа первой категории, не получено, то его определяют комбинациями трехзначного числа, соответствующего второй категории.
Приведенные в таблице наиболее вероятные числа соответствуют случаям, когда высевали по 1 см из 10
, 10
, 10
разведений, то есть 0,1, 0,01 и 0,001 г (см
) продукта.
Категория 1 - наиболее часто встречаемые комбинации положительных пробирок, вероятность получения которых равна 95%.
Категория 2 - комбинации положительных пробирок, вероятность получения которых равна 4%.
Категория 3 или 0 - комбинации положительных пробирок, вероятность получения которых для нормальных продуктов равна нулю для категории 0, либо мало вероятна для категории 3. Комбинации этих категорий могут быть следствием ошибки опыта или присутствия в продукте бактериостатических веществ.
С увеличением числа испытуемых проб от одной и той же партии продукта точность НВЧ повышается на одну, а иногда и на две категории.
Разъяснение к методу определения НВЧ в нежидких продуктах
При определении НВЧ в нежидких продуктах исходное разведение не всегда может быть десятикратным. При испытании нежидких продуктов следует иметь в виду, растворяются ли эти продукты или нет (в этом случае получается смыв с продукта). Если исходное разведение не десятикратное, то оно берется за основу и из него готовят десятикратные разведения.
НВЧ определяют сначала в 1 см исходного разведения, а затем это значение пересчитывается на 1 г продукта.
Пример 1. Испытание растворимых продуктов (сахар, соль, пасты и т.д.)
Для приготовления исходного разведения 20 г продукта внесли в 50 см раствора для приготовления разведений.
20 г +50 см=70 см
раствора, который берется за основу для приготовления десятикратных разведений.
Для подсчета по методу НВЧ выбираем 3 последовательных разведения, например:
10 см исходного разведения;
1 см исходного разведения;
1 см первого десятикратного исходного разведения.
Выбранные разведения посеяли в 3-кратной повторности.
Предположим, получены в конце испытания следующие результаты:
10 см | + + +, т.е. 3; |
1 см | + - -, т.е. 1; |
1 см | |
исходного разведения | - - -, т.е. 0. |
По таблице НВЧ для числа 310 находим количество, равное 43, это число необходимо разделить на 100, т.к. выбранные для посева разведения отличаются от табличных в 100 раз. Табличные разведения - 10, 10
,10
, а посеянные -10
, 10
, 10
.
43:100=0,43 клетки - это количество в 1 см исходного раствора, принятого за основу.
Пересчитаем это количество на 1 г испытуемого продукта:
0,43·70:20=0,805 клетки в 1 г продукта или приблизительно 8 клеток в 10 г продукта.
Пример 2. Испытание нерастворимых продуктов (морковь, специи и т.д.)
При испытании нерастворимых продуктов получается смыв микроорганизмов с продукта. Расчет НВЧ - аналогичный указанному в п.1, за исключением того, что в расчет берут не 70 см (20 г + 50 см
), а 50 см
.
0,43·50:20=1,07 клетки в 1 г или 11 клеток в 10 г.
Приложение ДВ
(справочное)
Сравнение структуры международных стандартов со структурой межгосударственного стандарта
Таблица ДВ.1
Структура международного стандарта ИСО 21528-1:2004 | Структура международного стандарта ИСО 21528-2:2004 | Структура межгосударственного стандарта | ||||||
Раздел | Пункт | Подпункт | Раздел | Пункт | Подпункт | Раздел | Пункт | Подпункт |
1 Область распространения | - | - | 1 Область распространения | - | - | 1 Область применения | - | - |
2 Нормативные ссылки | - | - | 2 Нормативные ссылки | - | - | 2 Нормативные ссылки | - | - |
3 Термины и определения | 3.1-3.3 | - | 3 Термины и определения | 3.1, 3.2 | - | 3 Термины и определения | 3.1-3.4 | 3.3.1, 3.3.2 |
4 Принцип | 4.1, 4.2 | 4.1.1-4.1.3, 4.2.1-4.2.5 | 4 Принцип | 4.1-4.4 | - | 4 Метод выявления и определения количества бактерий семейства Enterobacteriaceае по методу НВЧ | 4.1-4.3 | 4.1.1-4.1.5, 4.2.1-4.2.5 |
5 Методы определения количества бактерий семейства Enterobacteriaceае (подсчет колоний) | 5.1-5.4 | 5.1.1, 5.1.2, 5.2.1, 5.2.2 | ||||||
5 Культуральные среды, разбавитель и реактив | 5.1-5.3 | - | 5 Разбавитель, питательные среды и реактив | 5.1-5.3 | - | 6 Питательные среды и реактивы | 6.1-6.14 | - |
6 Аппаратура и стеклянная посуда | 6.1-6.11 | - | 6 Аппаратура и стеклянная посуда | 6.1-6.10 | - | 7 Аппаратура, посуда, материалы и реактивы | 7.1-7.20 | - |
7 Отбор проб | - | - | 7 Отбор проб | - | - | 8 Отбор и подготовка проб | 8.1-8.2 | - |
8 Приготовление пробы для испытания | - | - | 8 Приготовление пробы | - | - | |||
9 Методика | 9.1-9.6 | 9.2.1-9.2.3, 9.3.1-9.3.3, 9.4.1-9.4.2, 9.6.1-9.6.2. | 9 Методика | 9.1-9.6 | 9.3.1-9.3.4, 9.6.1-9.6.3 | 9 Проведение испытания | 9.1-9.2 | 9.1.1-9.1.7, 9.2.1-9.2.6 |
10 Выражение результатов | 10.1-10.3 | - | 10 Выражение результатов | - | - | - | - | - |
11 Прецизионность | - | - | - | - | - | - | - | - |
12 Протокол испытания | - | - | 11 Протокол испытания | - | - | 10 Протокол испытания | - | - |
Приложения А (нормативное) Схема методики обнаружения | - | - | 12 Приложение А (нормативное) Доверительные пределы для оценки небольших количеств колоний | - | - | Приложение ДА (справочное) Схемы методов выявления и определения количества бактерий семейства Enterobacteriасеае по методу НВЧ | - | - |
Приложение В (нормативное) Схема процедуры для метода MPN | - | - | - | - | - | Приложение ДБ (справочное) Расчет наиболее вероятного числа микроорганизмов | 1-11 | - |
- | - | - | - | - | - | Приложение ДВ (справочное) Сопоставление структуры настоящего стандарта со структурой примененных в нем ИСО 21528-1 и ИСО 21528-2 | - | - |
13 Библиография | ||||||||
Электронный текст документа
и сверен по:
, 2013

