ГОСТ 32010-2013
Группа Н09
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКТЫ ПИЩЕВЫЕ
Метод выявления бактерий рода Shigella
Food products. Method for detection of Shigella species bacteria
МКС 07.100.30
67.040
Дата введения 2014-07-01
_______________
Дату введения стандарта в действие на территории государств устанавливают их национальные органы по стандартизации.
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Государственным научным учреждением "Всероссийский научно-исследовательский институт консервной и овощесушильной промышленности" Российской академии сельскохозяйственных наук (ГНУ ВНИИКОП Россельхозакадемии)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 7 июня 2013 г. N 43)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 27 июня 2013 г. N 231-ст межгосударственный стандарт ГОСТ 32010-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2014 г.
5 Настоящий стандарт подготовлен на основе применения ГОСТ Р 54085-2010
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
1 Область применения
Настоящий стандарт распространяется на пищевые продукты и устанавливает метод выявления в определенной массе или объеме продукта бактерий рода Shigella.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ ISO 7218-2011 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
ГОСТ 6691-77 Реактивы. Карбамид. Технические условия
ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 10444.1-84 Консервы. Приготовление растворов реактивов, красок, индикаторов и питательных сред, применяемых в микробиологическом анализе
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 26669-85 Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов
ГОСТ 26670-91 Продукты пищевые. Методы культивирования микроорганизмов
ГОСТ 29228-91 (ИСО 835-2-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 2. Пипетки градуированные без установленного времени ожидания
ГОСТ 30425-97 Консервы. Метод определения промышленной стерильности
ГОСТ 31659-2012 (ISO 6579:2002) Продукты пищевые. Метод выявления бактерий рода Salmonella.
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применяют следующие термины с соответствующими определениями:
3.1 бактерии рода Shigella: Грамотрицательные факультативно-анаэробные бактерии, которые на агаризованных селективно-диагностических средах образуют типичные колонии. Описание и методы определения биохимических и серологических характеристик этих микроорганизмов приведены в настоящем стандарте.
3.2 выявление бактерий рода Shigella: Определение присутствия или отсутствия бактерий рода Shigella в определенной массе или объеме продукта в соответствии с настоящим стандартом.
4 Сущность метода
4.1 Общие положения
Метод выявления бактерий рода Shigella в определенной массе или объеме пищевого продукта состоит из следующих этапов: высев определенного количества продукта в жидкую неселективную среду, инкубирование посевов, последующее выявление в этих посевах бактерий, способных развиваться в жидкой селективной среде, образующих типичные колонии на агаризованных селективно-диагностических средах, имеющих типичные для бактерий рода Shigella биохимические и серологические характеристики.
4.2 Предварительное обогащение в неселективной жидкой среде
Бактерии рода Shigella могут присутствовать в пищевом продукте в небольшом количестве вместе с большим количеством других бактерий из семейства Enterobacteriaceae или других семейств. Поэтому предварительное обогащение необходимо для выявления небольшого числа клеток бактерий рода Shigella или сублетально поврежденных клеток бактерий рода Shigella.
Для предварительного неселективного обогащения используют забуференную пептонную воду, для некоторых пищевых продуктов используют другую среду для предварительного обогащения по 8.1.2.
Забуференную пептонную воду инокулируют при комнатной температуре пробой пищевого продукта для анализа, затем посевы инкубируют при температуре (37±1) °С в течение (18±2) ч.
Для большего эффекта перед внесением анализируемой пробы продукта забуференную пептонную воду нагревают до температуры (37±1) °С, то есть до температуры инкубирования посевов.
4.3 Обогащение в селективной жидкой среде
Бульон для бактерий рода Shigella инокулируют культурой, полученной по п.4.2, а затем инкубируют при температуре (37±1) °С в течение (24±2) ч.
4.4 Выделение чистой культуры
Культуры, полученные по 4.3, пересевают на две агаризованные селективно-диагностические среды:
- ксилоза лизин дезоксихолатный агар (XLD агар) и на одну из агаризованных сред - гектоеновый энтероагар, сальмонелла-шигелла агар, висмут-сульфит агар, среду Плоскирева, среду Эндо, среду Левина или дезоксихолатный цитратный агар.
Посевы на агаризованных средах инкубируют при температуре (37±1) °С и по окончании (24±2) ч посевы просматривают.
Арбитражной средой является ксилоза лизин дезоксихолатный агар (XLD агар).
4.5 Проведение идентификации
По биохимическим и серологическим тестам подтверждают принадлежность бактерий из колоний, выросших на чашках Петри по 4.4, к бактериям рода Shigella.
5 Питательные среды, реактивы и сыворотки
5.1 Общие положения
Химические вещества, используемые для приготовления питательных сред и реактивов, должны быть квалификации х.ч или ч.д.а., а вода должна быть дистиллированной.
5.2 Питательные среды, растворы реактивов
5.2.1 Среда для неселективного предварительного обогащения: вода пептонная забуференная - приложение А (А.1).
5.2.2 Селективная обогатительная среда: бульон для бактерий рода Shigella - приложение А (А.2).
5.2.3 Среды агаризованные селективно-диагностические
5.2.3.1 Первая среда: ксилоза лизин дезоксихолатный агар (XLD агар) - приложение А (А.3.1).
5.2.3.2 Вторая среда - приложение А (А.3.2).
5.2.4 Агар питательный или ГРМ-агар - приложение А (А.4).
5.2.5 Агар мясо-пептонный - приложение А (А.5).
5.2.6 Бульон мясо-пептонный с глюкозой - приложение А (А.6).
5.2.7 Среды с углеводами (Среды Гисса) - приложение А (А.7).
5.2.8 Агар трехсахарный железистый (TSI агар) или агар Клиглера, или агар Олькеницкого - приложение А (А.8).
5.2.9 Агар с мочевиной (Кристенсена) - приложение А (А.9).
5.2.10 Среда для определения L-лизин декарбоксилазы - приложение А (А.10).
5.2.11 Среда для Фогес-Проскауера (VP) реакции - приложение А (А.11).
5.2.12 Реактив для Фогес-Проскауера(VP)реакции - приложение А (А.12).
5.2.13 Среда Козера - приложение А (А.13).
5.2.14 Среда Симмонса - приложение А (А.14).
5.2.15 Агар дезоксихолатный цитратный - приложение А (А.15).
5.2.16 Энтероагар гектоеновый - приложение А (А.16).
5.2.17 Агар питательный полужидкий - приложение А (А.17).
5.2.18 Агар мясо-пептонный полужидкий - приложение А (А.18).
5.2.19 Раствор физиологический - приложение А (А.19).
5.3 Сыворотки
5.3.1 Сыворотки диагностические шигеллезные агглютинирующие адсорбированные поливалентные сухие к Shigella dysenteriae 1, 2; 3-7; 8-12.
5.3.2 Сыворотки диагностические шигеллезные агглютинирующие адсорбированные поливалентные сухие к Shigella boydii 1, 2, 4, 5, 7, 9, 12; 3, 6, 8, 10, 11; 13, 14, 15.
5.3.3 Сыворотки диагностические шигеллезные агглютинирующие адсорбированные поливалентные сухие к Shigella flexneri I-V.
5.3.4 Сыворотки диагностические шигеллезные агглютинирующие адсорбированные поливалентные сухие к Shigella flexneri I-VI и Shigella sonnei.
5.3.5 Для идентификации бактерий рода Shigella используют постановку реакции агглютинации с диагностическими шигеллезными агглютинирующими адсорбированными поливалентными сыворотками.
Адсорбированные сыворотки содержат антитела, которые агглютинируют взвеси культур шигелл, содержащие соответствующие антигены.
Каждое опытное определение должно быть гарантированным, то есть используемая сыворотка должна быть пригодной для агглютинации бактерий рода Shigella.
Качество сывороток проверяется в реакции с контрольным штаммом бактерий рода Shigella.
5.3.6 Сухие агглютинирующие адсорбированные сыворотки промышленного производства готовят перед употреблением в соответствии с рекомендациями, указанными в прилагаемых к ним инструкциях.
6 Аппаратура, посуда, материалы, реактивы
Приемлемой альтернативой посуды многоразового применения является одноразовая посуда, если она отвечает соответствующим требованиям.
6.1 Оборудование лабораторное для микробиологических исследований - по ГОСТ ISO 7218, ГОСТ 10444.1.
6.2 Аппарат для сухой стерилизации (стерилизационный сушильный шкаф) или влажной стерилизации (автоклав), с регулирующими устройствами для поддержания заданной температуры, с допустимой погрешностью не более ±1 °С.
6.3 Термостат, поддерживающий температуру (37±1) °С.
6.4 Баня водяная, поддерживающая заданную температуру от 44 °С до 47 °С с погрешностью ±0,5 °С.
6.5 Прибор для мембранной фильтрации растворов.
6.6 Весы лабораторные для взвешивания реактивов с пределами допускаемой абсолютной погрешности однократного взвешивания ±0,01 мг и ±10 мг.
6.7 Пробирки и колбы разной вместимости по ГОСТ 25336. Допускается использование флаконов или бутылок с нетоксичными металлическими или пластиковыми завинчивающимися крышками.
6.8 Микроскоп биологический, обеспечивающий просмотр в проходящем свете, с увеличением 900-1000.
6.9 Петля бактериологическая, с размером диаметра петли около 3 мм.
6.10 рН-метр с диапазоном измерений рН от 2 до 18, погрешностью измерений ±0,01 ед. рН при температуре 20 °С - 25 °С.
6.11 Стекла предметные по ГОСТ 9284.
6.12 Стекла покровные по ГОСТ 6672.
6.13 Пипетки градуированные или автоматические, вместимостью от 1 до 10 см по ГОСТ 29228.
6.14 Чашки Петри нормального размера (диаметр 100 мм) и/или большого размера (диаметр 150 мм) по ГОСТ 25336.
6.15 Натрий дезоксихолат.
6.16 Аммоний железо III цитрат.
6.17 Карбамид (мочевина) по ГОСТ 6691.
6.18 Контрольные штаммы бактерий рода Shigella.
6.19 Креатина моногидрат.
6.20 Ксилоза.
6.21 L-лизин моногидрохлорид.
6.22 Экстракт мясной.
6.23 Настой сердца (порошок).
6.24 Новобиоцин натриевая соль.
6.25 Пептический перевар животных тканей.
6.26 Протеозопептон.
6.27 Твин-80.
6.28 Феноловый красный.
6.29 Гидролизат казеина ферментативный.
6.30 Железа III цитрата тригидрат.
6.31 Цитрат натрия.
6.32 Спирт этиловый пищевой 96%-ный.
Допускается применение других средств измерений, вспомогательного оборудования с аналогичными метрологическими и техническими характеристиками, а также материалов по качеству не хуже указанных в разделе 6.
7 Отбор и подготовка проб
Отбор и подготовка проб - по ГОСТ 26669.
Для анализа отбирают лабораторную пробу, не поврежденную и не измененную по качеству в ходе транспортирования и хранения.
8 Проведение испытания | - в соответствии с приложением Б (рисунок Б.1) |
8.1 Проба для анализа и исходное разведение
8.1.1 Общие положения
Для приготовления исходного разведения в основном используют как разбавитель неселективную среду, указанную в 5.2.1 и 4.2 (забуференную пептонную воду).
Соотношение массы (объема) анализируемого продукта и объема неселективной среды должно составлять 1:10.
Допускается объединение проб для анализа в том случае, если анализируется больше одной пробы от продукта и когда объединенная проба не влияет на результат испытания. (Например, необходимо исследовать 10 навесок по 25 г. Объединяют 10 навесок (общая масса составит 250 г) и прибавляют 2,25 дм неселективной среды).
8.1.2 Специфика приготовления исходного разведения для некоторых продуктов
Указанную специфику приготовления применяют только для выявления бактерий рода Shigella.
8.1.2.1 Какао и какаосодержащие продукты (какао больше чем 20%)
Добавляют в забуференную пептонную воду (по 5.2.1) 50 г казеина (не используют кислый казеин) или 100 г обезжиренного молочного порошка. Казеин и молочный порошок добавляют при приготовлении забуференной пептонной воды до стерилизации.
8.1.2.2 Высококислотные пищевые продукты.
При неселективном обогащении должна быть гарантия того, что рН будет не менее 5,0.
рН высококислотных пищевых продуктов стабилизируют путем использования забуференной пептонной воды двойной концентрации.
Допускается при высеве жидких высококислотных пищевых продуктов, для предотвращения снижения рН сред на 0,5 и более, рН продукта перед посевом доводить до (7,0±0,2).
При высеве твердых высококислотных пищевых продуктов допускается перед посевом доводить рН продукта до (7,0±0,2).
Доведение рН продукта проводят с соблюдением правил асептики с помощью стерильных растворов гидроокиси натрия и соляной кислоты, приготовленных по ГОСТ 10444.1. Количество добавляемых растворов устанавливают опытным путем.
8.2 Неселективное обогащение
Посев в забуференную пептонную воду по 8.1.1 инкубируют при температуре (37±1) °С в течение (18±2) ч.
8.3 Селективное обогащение
Культуры, полученные после инкубирования по 8.2, пересевают в среду для селективного обогащения. Для этого по 1 см культуральной жидкости пересевают в 10 см
бульона для бактерий рода Shigella.
Посевы инкубируют при температуре (37±1) °С в течение (24±2) ч.
Если от одного пищевого продукта проведен высев нескольких проб продукта (каждой пробы отдельно) для выявления бактерий рода Shigella, то допускается из каждой пробы по 8.2 проводить пересев в один флакон с бульоном для шигелл. При этом количество селективной среды во флаконе должно быть увеличено, по сравнению с 10 см, во столько раз, из скольких проб проводят пересев.
Свежие продукты, не содержащие сублетально поврежденных микроорганизмов, подвергнутых каким-либо воздействиям, например сушке, заморозке и т.д., допускается высевать непосредственно в селективную среду, минуя этап неселективного обогащения. Объем высеваемого продукта и среды должны быть в соотношении не менее 1:10.
8.4 Выделение чистой культуры
8.4.1 Культуры через 24 ч инкубирования на селективной среде пересевают так, чтобы получить изолированные колонии на ксилоза лизин дезоксихолатный агар (XLD агар) и на одну из агаризованных сред: гектоеновый энтероагар, сальмонелла-шигелла агар, висмут-сульфит агар, среду Плоскирева, среду Эндо, среду Левина или дезоксихолатный цитратный агар.
При отсутствии чашек большого размера по 6.14 используют для посева петлей две чашки нормального размера по 6.14 (одну за другой). Пересев проводят в соответствии с требованиями приложения В.
На ксилозализин дезоксихолатном агаре проводят учет ферментации лактозы, сахарозы, ксилозы, декарбоксилирование лизина, образование сероводорода.
Бактерии рода Shigella не ферментируют лактозу, сахарозу, ксилозу, не декарбоксилируют лизин и не образуют сероводород.
На гектоеновом энтероагаре проводят учет ферментации лактозы, сахарозы, салицина, образование сероводорода.
Бактерии рода Shigella не ферментируют салицин.
На сальмонелла-шигелла агаре проводят учет ферментации лактозы, образование сероводорода.
На дезоксихолатном цитратном агаре, среде Плоскирева, среде Эндо, среде Левина проводят учет ферментации лактозы.
На висмут-сульфитном агаре проводят учет ферментации глюкозы, обнаружения сульфитредуцирующих свойств.
Бактерии рода Shigella не обладают сульфитредуцирующими свойствами.
8.4.2 Посевы на чашках Петри по 8.4.1 переворачивают на крышку дном вверх и помещают в термостат при температуре (37±1) °С и инкубируют в течение (24±2) ч.
8.4.3 После инкубации просматривают чашки с посевами и отмечают присутствие типичных для бактерий рода Shigella колоний и атипичных колоний, которые могут быть отнесены к бактериям рода Shigella. Отмечают их местоположение на дне чашек.
Типичные колонии бактерий рода Shigella, вырастающие на XLD агаре, имеют красный цвет, который принадлежит цвету индикатора.
Типичные колонии бактерий рода Shigella, вырастающие на гектоеновом энтероагаре, имеют зеленый или голубоватый цвет.
Типичные колонии бактерий рода Shigella, вырастающие на дезоксихолатном цитратном агаре, на сальмонелла-шигелла агаре, на средах Эндо, Плоскирева, Левина, круглые бесцветные или слегка розоватые.
Типичные колонии бактерий рода Shigella, вырастающие на висмут-сульфитном агаре, имеют серо-зеленый цвет.
При отсутствии в посевах на селективно-диагностических средах типичных для бактерий рода Shigella колоний дают заключение об отсутствии бактерий рода Shigella в анализируемой пробе продукта.
При наличии хотя бы на одной селективно-диагностической среде типичных колоний проводят подтверждение принадлежности их к бактериям рода Shigella.
8.5 Подтверждение принадлежности выделенных бактерий к роду Shigella
8.5.1 Общие положения
Для определения биохимических характеристик выделенных бактерий допускается использование идентификационных наборов. Эти наборы используют в соответствии с инструкцией.
Для биохимической идентификации допускается использование тест-систем промышленного производства, разрешенных к применению в установленном порядке.
8.5.2 Отбор колоний для подтверждения
Для подтверждения берут посев из каждой селективной среды (8.4) в чашку Петри по 8.4.1 (две чашки нормального размера считают за одну), сначала одну типичную колонию, если она окажется отрицательной, берут еще четыре колонии.
Для идентификации в случае эпидемиологической ситуации одновременно отбирают пять колоний. Если на одной чашке меньше пяти типичных колоний, то отбирают все типичные колонии.
Переносят отобранные колонии на скошенную поверхность питательного или ГРМ-агара в чашках или пробирках (5.2.4) или мясо-пептонного агара (5.2.5), для идентификации отбирают полностью изолированные колонии. Посевы инкубируют при температуре (37±1) °С в течение (24±2) ч.
Для биохимической и серологической идентификации используют чистые культуры бактерий.
Из отобранных для биохимической идентификации колоний приготовляют мазки и окрашивают по Граму по ГОСТ 30425.
Бактерии рода Shigella являются грамотрицательными прямыми палочками.
Допускается окраску по Граму заменять тестом Грегерсена. Для этого на предметном стекле в капле 3%-ного водного раствора калия гидроокиси эмульгируют культуру микроорганизмов, взятую из колонии с агаризованной среды. Если через несколько секунд взвесь ослизнет и за петлей потянутся слизистые нити, то это указывает на принадлежность анализируемой культуры к грамотрицательному виду бактерий. У грамположительных бактерий слизистых нитей не образуется.
8.5.3 Биохимическое подтверждение
У отобранных и предварительно пересеянных культур изучают характер роста на TSI агаре, или агаре Клиглера, или среде Олькеницкого, возможность расщепления мочевины, образования ацетоина, утилизации цитрата, наличие L-лизин декарбоксилазы и подвижность.
8.5.3.1 Общие положения
Петлей инокулируют специфические среды с 8.5.3.2 по 8.5.3.7 каждой культурой, полученной из колоний по 8.5.2.
8.5.3.2 TSI агар (5.2.8), среда Олькеницкого или агар Клиглера
Засевают штрихом скошенную поверхность агара и уколом столбик. Инкубируют при температуре (37±1) °С в течение (24±2) ч.
Интерпретируют изменения в среде:
а) Столбик | ||
- желтый | глюкозу ферментирует (реакция положительная) | |
- красный или не изменившийся | глюкозу не ферментирует (реакция отрицательная) | |
- черный | образование сероводорода | |
- пузырьки или разрывы | образование газа при ферментации глюкозы | |
б) Скошенная поверхность | ||
- желтая | лактозу и (или) сахарозу ферментирует (реакция положительная) | |
- красная или не изменившаяся | лактозу и (или) сахарозу не ферментирует (реакция отрицательная). Агар Клиглера содержит два сахара (глюкозу и лактозу), поэтому по скошенной поверхности учитывают только ферментацию лактозы |
Типичные культуры бактерий рода Shigella показывают щелочную (красную) поверхность и кислый (желтый) столбик без образования газа (пузырьков), сероводород (черный агар) не образуется.
Отношение выделенных культур к бактериям рода Shigella не может основываться только на результатах теста на TSI агаре или на агаре Клиглера, или среде Олькеницкого.
Дальнейшему изучению подвергают бактерии, показавшие типичные характеристики на TSI агаре или на агаре Клиглера, или среде Олькеницкого.
При учете результатов роста выявленных бактерий на трехсахарном агаре (агаре Клиглера, среде Олькеницкого) учитывают рост, типичный для бактерий рода Salmonella, руководствуясь требованиями ГОСТ 31659. Если подобный рост бактерий обнаружен, то дальнейшее испытание проводят с учетом возможного присутствия бактерий рода Salmonella.
8.5.3.3 Агар с мочевиной (агар Кристенсена) (5.2.9)
Культуры пересевают штрихом на поверхность агара Кристенсена с мочевиной. Посевы инкубируют при температуре (37±1) °С в течение (24±2) ч, наблюдая за посевами через определенные промежутки времени.
При положительной реакции, расщеплении мочевины с выделением аммония, цвет фенолового красного изменяется от розового до сильного светло-вишневого.
Для уреазоположительных бактерий реакция в основном становится видимой после 2 ч инкубирования.
Бактерии рода Shigella не расщепляют мочевину.
8.5.3.4 Определение L-лизин декарбоксилазы (5.2.10)
Инокулируют снизу жидкую среду для определения L-лизин декарбоксилазы (5.2.10). Посевы инкубируют при температуре (37±1) °С в течение (24±2) ч.
Помутнение и пурпуровый цвет после инкубации указывают на положительную реакцию. Желтый цвет указывает на отрицательную реакцию.
Бактерии рода Shigella не обладают L-лизиндекарбоксилазой (реакция отрицательная).
8.5.3.5 Определение образования ацетоина (реакция Фогес-Проскауера) (5.2.12)
Анализируемую культуру суспензируют петлей в стерильной пробирке, содержащей 3 см VP среды (5.2.11) или мясо-пептонного бульона с глюкозой (5.2.6).
Посевы инкубируют при температуре (37±1) °С в течение (24±2) ч.
После инкубации прибавляют две капли раствора креатина, три капли спиртового раствора 1-нафтола и две капли раствора гидроокиси калия, перемешивают содержимое пробирки после прибавления каждого реактива.
Образование от розового до светло-красного цвета после 15 мин указывает на положительную реакцию.
Бактерии рода Shigella не образуют ацетоин (реакция Фогес-Проскауера отрицательная).
Допускается определение ацетоина проводить без применения раствора креатина. Для этого после инкубирования к 1 см отобранной культуральной жидкости прибавляют 0,6 см
раствора 1-нафтола и 0,2 см
раствора гидроокиси калия, содержимое пробирки перемешивают после прибавления каждого реактива.
Появление розового окрашивания через 15 мин указывает на положительную реакцию.
8.5.3.6 Определение подвижности
Культуры пересевают уколом в полужидкий питательный агар (5.2.17) или полужидкий мясо-пептонный агар (5.2.18).
Посевы инкубируют при температуре (37±1) °С в течение (24±2) ч.
При росте подвижных культур отмечается диффузионный рост по всему столбику агара, при росте неподвижных культур - вдоль места укола.
Бактерии рода Shigella неподвижны.
8.5.3.7 Определение утилизации цитрата
Культуру высевают в пробирки со средой Козера (5.2.13) или на поверхность среды Симмонса (5.2.14). Посевы инкубируют при температуре (37±1) °С в течение 24-48 ч. Изменение оливково-зеленого цвета сред на васильковый (или синий) указывает на положительную реакцию.
Бактерии рода Shigella не утилизируют цитрат.
8.5.3.8 Интерпретация биохимических тестов приведена в таблице Г.1 приложения Г.
8.5.4 Серологическое подтверждение
8.5.4.1 Общие положения
Определение присутствия антигенов у изучаемых культур (8.5.2) проводят путем постановки реакции агглютинации на предметном стекле с соответствующими сыворотками после исключения самоагглютинирующих штаммов. Сыворотки используют в соответствии с инструкцией изготовителя, если есть отличие от описания приведенного ниже.
Серологическое подтверждение принадлежности к бактериям рода Shigella проводят с культурами, предварительно пересеянными на поверхность питательного агара, мясо-пептонного агара или ГРМ-агара.
8.5.4.2 Исключение самоагглютинирующих штаммов
Помещают каплю физиологического раствора на тщательно очищенное предметное стекло. Диспергируют в этой капле часть тестируемой колонии так, чтобы получилась гомогенная и густая суспензия.
Допускается размешивание части колонии в капле воды и перемешивание этого раствора с одной каплей физиологического раствора.
Покачивают осторожно стекло в течение 30-60 с. Отмечают результаты на темном фоне, лучше с помощью увеличительного стекла. Если наблюдается в разной степени склеивание бактерий, то есть образование осадка, то считают, что тестируемые штаммы обладают самоагглютинацией.
Штаммы бактерий, обладающие самоагглютинацией, не подвергают дальнейшему серологическому испытанию.
8.5.4.3 Определение наличия антигенов
Культуры бактерий, у которых не выявлено самоагглютинации, испытывают в реакции агглютинации с агглютинирующими адсорбированными поливалентными шигеллезными сыворотками.
Подготовка сывороток к постановке реакции агглютинации и методика ее проведения указаны в наставлении, прилагаемом к сывороткам.
Агглютинация (наличие О-антигенов) проявляется в виде склеивания бактериальной массы и полного или частичного просветления жидкости.
При отрицательной реакции агглютинации культура после тщательного смешивания с каплей сыворотки образует гомогенную смесь.
Используют поливалентные сыворотки, одну после другой.
8.5.5 Интерпретация биохимических и серологических тестов
Интерпретация подтверждающих тестов (8.5.3 и 8.5.4) для испытанных культур бактерий (8.5.2) представлена в таблице 1.
Таблица 1 - Интерпретация подтверждающих тестов
Биохимические реакции | Самоагглютинация | Серологические реакции | Интерпретация |
Типичные | Нет | Антигены обнаружены | Штамм относится к бактериям рода Shigella |
Типичные | Нет | Антигены не обнаружены | Могут быть бактериями рода Shigella |
Типичные | Да | Не тестируется (см. 8.5.4.2) | |
Нетипичные | Нет/Да | Антигены обнаружены | |
Нетипичные | Нет/Да | Антигены не обнаружены | Не относятся к бактериям рода Shigella |
При определении биохимических и серологических тестов выделенных культур в качестве контроля используют типичные по этим показателям штаммы бактерий рода Shigella, указанные в разделе 6.
Культуры, предположительно отнесенные к бактериям рода Shigella, передают в компетентные аккредитованные центры по изучению этих бактерий для окончательного типирования. Культуру отправляют с сопроводительными документами, содержащими всю информацию.
В этом случае результаты выявления бактерий рода Shigella выдают после получения ответа по окончательному типированию.
При выявлении бактерий рода Shigella пользуются схемой, указанной в Приложении Б.
9 Обработка результатов
9.1 Результаты оценивают по каждой пробе отдельно.
9.2 Результаты выявления бактерий рода Shigella в определенной массе или объеме продукта записывают: "Бактерии рода Shigella обнаружены (не обнаружены) в г (см
) продукта"
- масса (объем) анализируемой пробы пищевого продукта, в которой выявляли бактерии рода Shigella, г (см
).
10 Протокол испытания
Протокол испытания должен включать следующее:
- используемый метод отбора проб;
- использование каких-либо отклонений в методе обогащения или инкубации;
- все условия испытания, не включенные в настоящий стандарт, а также причины, которые могут влиять на результаты;
- полученные результаты.
11 Требования безопасности
Требования безопасности выполнения работ и квалификации оператора - по ГОСТ ISO 7218.
Приложение А
(обязательное)
Состав и приготовление питательных сред и растворов реактивов
А.1 Вода пептонная забуференная
А.1.1 Состав
Пептон | 10,0 | |
Натрий хлористый ( | 5,0 | |
Натрий фосфорнокислый двузамещенный 12-водный ( | 9,0 | |
Калий фосфорнокислый однозамещенный ( | 1,5 | |
Вода, см | 1000 |
А.1.2 Приготовление
При нагревании растворяют компоненты в воде. Устанавливают рН, так чтобы после стерилизации он составлял (7,0±0,2) при температуре 25 °С. Разливают среду во флаконы подходящей вместимости с учетом добавления необходимой массы (объема) пробы пищевого продукта (если масса навески равна 25 г, то разливают по 225 см, то есть в соотношении 1:10). Стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
А.2 Среда обогатительная селективная: бульон для бактерий рода Shigella
А.2.1 Основа среды
Гидролизат казеина ферментативный, г | 20,0 |
Натрий хлористый, г | 5,0 |
Калий фосфорнокислый двузамещенный, г | 2,0 |
Калий фосфорнокислый однозамещенный, г | 2,0 |
Глюкоза, г | 1,0 |
Твин-80, г | 1,5 |
Вода, см | 1000 |
При нагревании и частом помешивании растворяют в 1 дм воды дегидратированные компоненты или 31,5 г дегидратированной основы.
Устанавливают рН так, чтобы после стерилизации он составлял (7,0±0,2) при температуре 25 °С. Разливают среду во флаконы. Стерилизуют при температуре (121±1) °С в течение 15 мин, охлаждают до 45-50 °С и с соблюдением правил асептики добавляют на 1 дм среды 5 см
раствора селективной добавки, приготовленного по А.2.2. Тщательно перемешивают и равномерно разливают в стерильную посуду (флаконы или колбы, или пробирки). Готовая среда должна быть прозрачной и иметь светло-янтарную окраску.
А.2.2 Добавка селективная
А.2.2.1 Состав
Новобиоцин, мг | 55 |
Вода, см | 5 |
А.2.2.2 Приготовление
С соблюдением правил асептики растворяют новобиоцин в стерильной воде, тщательно перемешивают. Антибиотик новобиоцин подавляет рост грамположительных и некоторых грамотрицательных бактерий.
А.3 Среды агаризованные селективно-диагностические
А.3.1 Первая среда: Агар ксилоза лизин дезоксихолатный (XLD агар)
А.3.1.1 Основа среды
А.3. 1.1.1 Состав
Экстракт дрожжевой (порошок), г | 3,0 | |
Натрий хлористый, г | 5,0 | |
Ксилоза, г | 3,5 | |
Лактоза, г | 7,5 | |
Сахароза, г | 7,5 | |
L-лизин гидрохлорид, г | 5,0 | |
Тиосульфат натрия, г | 6,8 | |
Железо III аммоний цитрат, г | 0,8 | |
Феноловый красный, г (или 20 см | 0,08 | |
Натрий дезоксихолат, г | 2,5 | |
Агар, г (зависит от желирующих свойств) | 9,0-18,0 | |
Вода, см | 1000 |
А.3.1.1.2 Приготовление
При нагревании и частом помешивании растворяют дегидратированные компоненты основы или дегидратированную основу в воде.
Доводят до кипения, но не кипятят, избегая перегрева. Устанавливают рН так, чтобы после прогрева он составлял (7,4±0,2) при температуре 25 °С. Разливают основу во флаконы подходящей вместимости. Затем прогревают на кипящей водяной бане около 5 мин.
А.3.1.2 Раствор фенолового красного
А.3.1.2.1 Состав
Феноловый красный, г | 0,4 |
Вода, см | 100 |
А.3.1.2.2 Приготовление
Феноловый красный переносят в фарфоровую ступку и постепенно растворяют в воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят водой до метки. Раствор хранят в закрытом сосуде из темного стекла при комнатной температуре.
А.3.1.3 Приготовление чашек с агаром
После прогрева среду помещают в водяную баню при температуре 44-47 °С, затем перемешивают и разливают приблизительно по 15 см в стерильные чашки Петри. Дают затвердеть.
Чашки со средой хранят в холодильнике при температуре (3±2) °С не более 5 сут.
Перед использованием подсушивают (приблизительно 30 мин) поверхность агара в чашках Петри (предпочтительней с открытой крышкой и поверхностью агара вниз) в шкафу или термостате с температурой 37-55 °С до тех пор, пока поверхность агара не станет сухой.
А.3.2 Вторая среда:
А.3.2.1 Среда Плоскирева.
А 3.2.2 Среда Эндо.
А.3.2.3 Среда Левина.
А.3.2.4 Агар сальмонелла-шигелла.
А.3.2.5 Агар дезоксихолатный цитратный.
А.3.2.6 Агар висмут-сульфитный.
Среды готовят в соответствии с рекомендациями, указанными на этикетке.
А.4 Агар питательный или ГРМ-агар
А.4.1 Состав
Экстракт мясной, г | 3 |
Пептон, г | 5 |
Агар (зависит от желирующих свойств), г | 9,0-18,0 |
Вода, см | 1000 |
А.4.2 Приготовление
При нагревании растворяют компоненты в воде. Устанавливают рН так, чтобы после стерилизации он составлял (7,4±0,2) при температуре 25 °С. Переносят питательную среду в пробирки или флаконы, стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
А.4.3 Приготовление чашек Петри с питательным агаром
После стерилизации или расплавления среду помещают в водяную баню при температуре 44-47 °С, затем разливают приблизительно по 15 см в стерильные чашки Петри. Дают затвердеть. Используют среду без подсушивания.
Допускается использование ГРМ-агара (питательный агар для культивирования микроорганизмов на основе гидролизата рыбной муки), который готовят в соответствии с рекомендациями, указанными на этикетке.
А.5 Агар мясо-пептонный - по ГОСТ 10444.1
А.6 Бульон мясо-пептонный с глюкозой - по ГОСТ 10444.1
Для посевов используют среду, разлитую в пробирки по 6-7 см.
А.7 Среды с углеводами (среды Гисса)
Среды готовят по ГОСТ 10444.1 или используют сухие среды с углеводами, среду для которых готовят в соответствии с рекомендациями, указанными на этикетке.
А.8 Агар трехсахарный железистый (TSI агар). Или агар Клиглера, или агар Олькеницкого
А.8.1 Состав TSI агара
Экстракт мясной, г | 3,0 | |
Экстракт дрожжевой (порошок), г | 3,0 | |
Пептон, г | 20,0 | |
Натрий хлористый, г | 5,0 | |
Лактоза, г | 10,0 | |
Сахароза, г | 10,0 | |
Глюкоза, г | 1,0 | |
Железа III цитрат, г | 0,3 | |
Натрия тиосульфат, г | 0,3 | |
Феноловый красный, г (или 6 см | 0,024 | |
Агар (зависит от желирующих свойств), г | 9,0-18,0 | |
Вода, см | 1000 |
А.8.2 Приготовление
При нагревании растворяют дегидратированные компоненты или дегидратированную основу среды в воде. Устанавливают рН так, чтобы после стерилизации он составлял (7,4±0,2) при температуре 25 °С. Переносят по 7-8 см среды в пробирки. Стерилизуют в автоклаве при (121±1) °С в течение 15 мин. После стерилизации оставляют в наклонном положении, так чтобы получился столбик среды высотой, равной двум диаметрам пробирки (2-2,5 см), а над ним скошенная поверхность длиной около 5 см.
Допускается использование агара Клиглера или среды Олькеницкого. Среды готовят в соответствии с рекомендациями, указанными на этикетке.
А.9 Агар с мочевиной (агар Кристенсена)
А.9.1 Основа среды
А.9.1.1 Состав
Пептон, г | 1,0 | |
Глюкоза, г | 1,0 | |
Натрий хлористый, г | 5,0 | |
Калий фосфорнокислый однозамещенный, г | 2,0 | |
Феноловый красный, г (или 3 см | 0,012 | |
Агар (зависит от желирующих свойств), г | 9,0-18,0 | |
Вода, см | 1000 |
А.9.1.2 Приготовление
При нагревании растворяют дегидратированные компоненты или дегидратированную основу в воде. Устанавливают рН так, чтобы после стерилизации он составлял (6,8±0,2) при температуре 25 °С. Основу среды равномерно разливают в колбы или флаконы и стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
А.9.2 Раствор мочевины
А.9.2.1 Состав
Мочевина, г | 40 |
Вода, см | 100 |
А.9.2.2 Приготовление
Мочевину помещают в колбу вместимостью 100 см, растворяют в воде, объем раствора доводят водой до метки. Раствор мочевины стерилизуют методом мембранной фильтрации по ГОСТ 26670 через фильтры с размером пор 0,22 мкм, или текучим паром в течение 30 мин.
А.9.3 Раствор фенолового красного
А.9.3.1 Состав и приготовление по А.3.1.2
А.9.4 Среда готовая
А.9.4.1 Состав
Основа (А.9.1), см | 950 |
Раствор мочевины (А.9.2), см | 50 |
А.9.4.2 Приготовление
Прибавляют с соблюдением правил асептики раствор мочевины к основе, предварительно расплавленной и охлажденной до температуры 44-47 °С. Разливают готовую среду в стерильные пробирки по 7-8 см. После этого среду скашивают так, чтобы получились скошенная поверхность и столбик среды высотой, равной приблизительно двум диаметрам пробирки - 2-2,5 см.
А.10 Среда для определения L-лизин декарбоксилазы
А.10.1 Состав
L - лизин моногидрохлорид, г | 5,0 | |
Экстракт дрожжевой, г | 3,0 | |
Глюкоза, г | 1,0 | |
Бромкрезоловый пурпуровый, г (или 5 см | 0,015 | |
Вода, см | 1000 |
А.10.2 Приготовление
При нагревании растворяют дегидратированные компоненты или дегидратированную основу в воде. Устанавливают рН так, чтобы после стерилизации он составлял (6,8±0,2) при температуре 25 °С. Разливают среду по 2-5 см в стерильные пробирки. Стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
А.10.3 Раствор бромкрезолового пурпурного
А.10.3.1 Состав
Бромкрезоловый пурпурный, г | 0,3 |
Вода, см | 100 |
А.10.3.2 Приготовление
Бромкрезоловый пурпурный переносят в фарфоровую ступку и постепенно растворяют в воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят водой до метки.
Раствор хранят в закрытом сосуде из темного стекла при комнатной температуре не более 3 мес.
А.11 Среда для Фогес-Проскауера (VP) реакции
А.11.1 Состав
Пептон, г | 7,0 |
Глюкоза, г | 5,0 |
Калий двузамещенный фосфорнокислый, г | 5,0 |
Вода, см | 1000 |
А.11.2 Приготовление
При нагревании растворяют дегидратированные компоненты или дегидратированную основу в воде. Устанавливают рН так, чтобы после стерилизации он составлял (6,8±0,2) при температуре 25 °С. По 3 см среды разливают в пробирки. Стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
А.12 Реактив для Фогес-Проскауера (VP) реакции
А.12.1 Раствор креатина (N-амидиносаркозин)
А.12.1.1 Состав
Креатина моногидрат, г | 0,5 |
Вода, см | 100 |
А.12.1.2 Приготовление
Растворяют креатина моногидрат в воде.
А.12.2 1-нафтол, спиртовой раствор
А.12.2.1 Состав
1-нафтол, г | 6 |
Этиловый спирт 96%-ный (по объему), см | 100 |
А.12.2.2 Приготовление
Растворяют 1-нафтол в 96%-ном этиловом спирте.
А.12.3 Калия гидроксида раствор
А.12.3.1 Состав
Калия гидроксид ( | 40 |
Вода, см | 100 |
А.12.3.2 Приготовление
Растворяют калия гидроксид в мерной колбе вместимостью 100 см, раствор доводят водой до метки.
А.13 Среда Козера
А.13.1 Состав
Натрий-аммоний фосфорнокислый двузамещенный, г | 1,5 |
Калий фосфорнокислый однозамещенный, г | 1,0 |
Магний сернокислый, г | 0,2 |
Цитрат натрия, г | 3,0 |
Вода, см | 1000 |
А.13.2 Приготовление
При нагревании растворяют дегидратированные компоненты или дегидратированную основу в воде. Устанавливают рН так, чтобы после стерилизации он составлял (7,2±0,1) при температуре 25 °С. По 3 см среды разливают в пробирки. Стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
После стерилизации к 1 дмсреды добавляют 10 см
спиртового бромтимолового синего, приготовленного по А.13.3, затем по 6-7 см
среды разливают в стерильные пробирки. Приготовленная среда должна иметь оливково-зеленый цвет.
А.13.3 Бромтимолового синего раствор
А.13.3.1 Состав
Бромтимоловый синий, г | 0,5 |
Вода, см | 100 |
А.13.3.2 Приготовление
Бромтимоловый синий переносят в фарфоровую ступку и постепенно растворяют в дистиллированной воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят дистиллированной водой до метки.
Раствор хранят в закрытом сосуде из темного стекла при комнатной температуре не более 3 мес.
А.14 Среда Симмонса
Для приготовления среды Симмонса к 1 дм среды Козера (А.13) перед стерилизацией добавляют 18-20 г агара. Среду после стерилизации и добавления раствора бромтимолового синего разливают по 6-7 см
в стерильные пробирки или по 15 см
в чашки Петри. Среду в пробирках скашивают.
А.15 Агар дезоксихолатный цитратный
А.15.1 Состав 1 и состав 2 - в соответствии с таблицей А.1
Наименование компонента | Состав 1 | Состав 2 |
Настой сердца (порошок), г | 10,0 | - |
Протеозопептон, г | 10,0 | - |
Перевар животной ткани пептический, г | - | 10,0 |
Экстракт мясной, г | - | 10,0 |
Лактоза, г | 10,0 | 10,0 |
Цитрат натрия, г | 20,0 | 20,0 |
Аммоний железо III цитрат, г | 2,0 | - |
Железа III цитрата тригидрат, г | - | 1,0 |
Натрия дезоксихолат, г | 5,0 | 5,0 |
Нейтральный красный, г | 0,02 | 0,02 |
Агар, г | 13,5 | 13,5 |
Вода, см | 1000 | 1000 |
А.15.2 Приготовление
При нагревании растворяют дегидратированные компоненты или дегидратированную основу (состав 1 или состав 2) в воде. Устанавливают рН так, чтобы после нагревания для состава 1 при температуре 25 °С рН составлял (7,5±0,2) и для состава 2 при температуре 25 °С рН составлял (7,3±0,2). Среду не автоклавируют. После охлаждения до температуры 44 °С-47 °С среду разливают приблизительно по 15 см в стерильные чашки Петри.
А.16 Энтероагар гектоеновый
А.16.1 Состав
Протеозопептон, г | 12,0 |
Экстракт дрожжевой, г | 3,0 |
Желчь, г | 9,0 |
Лактоза, г | 12,0 |
Сахароза, г | 12,0 |
Салицин, г | 2,0 |
Натрий хлористый, г | 5,0 |
Натрия тиосульфат, г | 5,0 |
Железо III аммонийное цитрат, г | 1,5 |
Бромтимоловый синий, г | 0,065 |
Фуксин (кислый), г | 0,1 |
Агар, г | 15,0 |
А.16.2 Приготовление
При нагревании растворяют дегидратированные компоненты или дегидратированную основу в 1 дм воды, кипятят в течение 1 мин, охлаждают до температуры 44 °С-47 °С и разливают приблизительно по 15 см
в стерильные чашки Петри.
А.17 Полужидкий питательный агар
А.17.1 Состав
Экстракт мясной, г | 3,0 |
Пептон, г | 5,0 |
Агар (зависит от желирующих свойств), г | 4,0-9,0 |
Вода, см | 1000 |
А.17.2 Приготовление
При нагревании растворяют дегидратированные компоненты или дегидратированную основу в воде. Устанавливают рН так, чтобы после стерилизации он составлял (7,0±0,2) при температуре 25 °С.
Перед стерилизацией среду разливают по 7-8 см в пробирки. Стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
А.18 Полужидкий мясо-пептонный агар
Готовят по ГОСТ 10444.1 так же, как мясо-пептонный агар, но при приготовлении добавляют 4,0-9,0 г агара на 1 дм мясо-пептонного бульона, перед стерилизацией по 7-8 см
среды разливают в пробирки.
А.19 Физиологический раствор
А.19.1 Состав
Натрий хлористый, г | 8,5 |
Вода, см | 1000 |
А.19.2 Приготовление
Растворяют хлористый натрий в воде. Устанавливают рН так, чтобы после стерилизации он составлял (7,0±0,2) при температуре 25 °С. Стерилизуют в автоклаве при температуре (121±1) °С в течение 15 мин.
Готовые питательные среды хранят в соответствии с ГОСТ 10444.1.
Допускается использование готовых и дегидратированных, в т.ч. хромогенных питательных сред аналогичного состава, разрешенных к применению в установленном порядке.
Приложение Б
(справочное)
Схема проведения испытания
Б.1 Схема выявления бактерий рода Shigella приведена на рисунке Б.1
Рисунок Б.1
Приложение В
(справочное)
В.1 Примеры схем 1 и 2 пересева культур с селективной среды на поверхность селективно-диагностических сред приведены на рисунке В.1*.
_______________
* Предлагаемые схемы используют с целью максимального выявления всех культур, присутствующих на петле при пересеве с селективной среды.
Схема 1
- поверхность среды в чашке Петри делится с внешней стороны на сектора;
- петлей с селективной среды отбирается культуральная жидкость. Этой петлей наносятся начальные штрихи на каждый сектор;
- затем этой же петлей, начиная с последнего сектора, проводят рассев нанесенной культуры по поверхности всего сектора.
Затем переходят к предпоследнему сектору и т.д.
Схема 2
- петлей с селективной среды отбирается культуральная жидкость;
- наносится петлей штрих от наружной окружности к центру;
- на нанесенном штрихе мысленно выбирается несколько точек.
Этой же петлей проводят рассев культуры сначала по большей окружности, затем по следующей окружности ближе к центру и т.д.
Заканчивая пересев по окружности петлей, не касаются радиуса с первоначально нанесенной культурой. Рассев таким образом можно проводить, положив чашку Петри на трафарет.
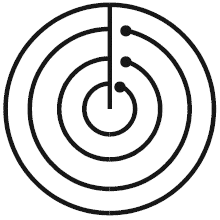
Рисунок В.1
Приложение Г
(справочное)
Г.1 Интерпретация биохимических тестов бактерий рода Shigella приведена в таблице Г.1*
_______________
* В таблице Г.1 указан процент положительных реакций.
Таблица Г.1
Тесты | Штаммы бактерий рода Shigella | |
Shigella boydii, S.dysenteriae, S.flexneri | Shigella sonnei | |
Кислота из глюкозы | 99 | 99 |
Газ из глюкозы | 0 | 0 |
Кислота из лактозы | 0 | 0 |
Кислота из сахарозы | 1 | 1 |
| 0 | 0 |
Гидролиз мочевины | 0 | 0 |
Лизин декарбоксилоза | 0 | 0 |
Кислота из ксилозы | 0 | 0 |
Продукция ацетоина | 0 | 0 |
Усвоение цитрата | 0 | 0 |
Подвижность | 0 | 0 |
Кислота из салицина | 0 | 0 |
Электронный текст документа
и сверен по:
, 2013

