ГОСТ Р 53973-2010
Группа Н09
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕРМЕНТНЫЕ ПРЕПАРАТЫ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
Метод определения -глюканазной активности
Enzyme preparations for food industry. Method for determination of -glucanase activity*
________________
* Поправка. ИУС N 9-2015, Измененная редакция, Изм. N 1.
ОКС 07.100.30
ОКСТУ 9291
Дата введения 2012-01-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 РАЗРАБОТАН Государственным научным учреждением Всероссийским научно-исследовательским институтом пищевой биотехнологии Россельхозакадемии (ГНУ ВНИИПБТ Россельхозакадемии)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 176 "Спиртовая, дрожжевая и ликероводочная продукция"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 26 ноября 2010 г. N 541-ст
4 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
ВНЕСЕНА поправка*, опубликованная в ИУС N 9, 2015 год
________________
* См. ярлык "Примечания".
Поправка внесена изготовителем базы данных
ВНЕСЕНО Изменение N 1, утвержденное и введенное в действие Приказом Росстандарта от 29.09.2015 N 1400-ст c 01.01.2016
Изменение N 1 внесено изготовителем базы данных по тексту ИУС N 1, 2016 год
1 Область применения
Настоящий стандарт устанавливает метод определения -глюканазной активности ферментных препаратов. Метод может быть использован для определения
-глюканазной активности ферментных препаратов и ферментсодержащих смесей, применяемых в пищевой промышленности.
Примечание - -глюканазную активность исследуемых ферментных препаратов (ФП) обеспечивают ферменты
-глюканазы эндо- и экзо-действия.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ Р ИСО 5725-1-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 1. Основные положения и определения
ГОСТ 61-75 Реактивы. Кислота уксусная. Технические условия
ГОСТ 83-79 Реактивы. Натрий углекислый. Технические условия
ГОСТ 199-78 Реактивы. Натрий уксуснокислый 3-водный. Технические условия
ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2603-79 Реактивы. Ацетон. Технические условия
ГОСТ 3765-78 Реактивы. Аммоний молибденовокислый. Технические условия
ГОСТ 4165-78 Реактивы. Медь (II) сернокислая 5-водная. Технические условия
ГОСТ 4166-76 Реактивы. Натрий сернокислый. Технические условия
ГОСТ 4201-79 Реактивы. Натрий углекислый кислый. Технические условия
ГОСТ 4204-77 Реактивы. Кислота серная. Технические условия
ГОСТ 5845-79 Реактивы. Калий-натрий виннокислый 4-водный. Технические условия
ГОСТ 6038-79 Реактивы. D-глюкоза. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 13867-68 Продукты химические. Обозначение чистоты
ГОСТ 18481-81 Ареометры и цилиндры стеклянные. Общие технические условия
ГОСТ 20264.0-74 Препараты ферментные. Правила приемки и методы отбора проб
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ Р 53228-2008 Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
(Измененная редакция, Изм. N 1).
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 гидролиз: Расщепление исходного соединения на более простые в присутствии молекул воды.
3.2 ферментативный гидролиз: Расщепление высокомолекулярных соединений при участии катализаторов белковой природы - гидролитических ферментов (гидролаз, класс 3 [1]).
3.3 субстрат: Соединение или вещество, на которое воздействует данный фермент.
3.4 -глюкан: Высокомолекулярное соединение, полимер, в котором остатки глюкозы соединены гликозидными связями; с водой образует коллоидные растворы.
3.5 системные названия ферментов: Названия, указывающие природу химической реакции, катализируемой данным ферментом, в соответствии с современной классификацией (КФ), принятой Международной комиссией по ферментам.
Примечание - Системные названия ферментов.
В группу -D-глюканаз эндодействия, катализирующих расщепление
-D-глюканов, входит 6 ферментов:
- 1,4-(1,3:1,4)--D-глюкан-4-глюканогидролаза (КФ 3.2.1.4) [1] - эндо-1,4-
-глюканаза (целлюлаза) - гидролизует
-1,4-гликозидные связи в целлюлозе,
-глюканах зерна;
- 1,3-(1,3:1,4)--D-глюкан-3(4)-глюканогидролаза (КФ 3.2.1.6) - эндо-1,3-
-глюканаза (ламинариназа) - катализирует расщепление внутренних
-1,3- или
-1,4-связей в
-D-глюканах;
- 1,3--D-глюканглюканогидролаза (КФ 3.2.1.39) - эндо-1,3-1,4-
-глюканаза (эндо-1,3-
-глюканаза) - гидролизует преимущественно внутренние 1,3-
-гликозидные связи);
- 1,3-1,4--D-глюкан-4-глюканогидролаза (КФ 3.2.1.73) - лихеназа - гидролизует
-1,4-гликозидные связи в
-D-глюканах, имеющих
-1,3- и
-1,4-связи;
- 1,6--D-глюканглюканогидролаза (КФ 3.2.1.75) - эндо-1,6-
-глюканаза - гидролизует
-1,6-связи внутри 1,6-
-D-глюканов;
- 1,2--D-глюканглюканогидролаза (КФ 3.2.1.71) - эндо-1,2-
-глюканаза - гидролизует внутренние
-1,2-гликозидные связи глюкана.
В группу -D-глюканаз экзодействия входят ферменты
-D-глюкозидглюкогидролазы (КФ 3.22.1.21) -
-глюкозидазы; целлобиоза, расщепляют последнюю с нередуцирующего конца
-1,4-связь в
-D-глюкозидах, высвобождая
-D-глюкозу.
4 Метод определения ферментативной активности  -глюканазы с субстратом
-глюканазы с субстратом  -глюкан
-глюкан
4.1 Характеристика метода
4.1.1 Метод основан на количественном определении редуцирующих (восстанавливающих) сахаров, образующихся в результате действия фермента -глюканазы на
-глюкан при температуре 50 °С.
4.1.2 За единицу -глюканазной активности (1 ед.
![]() ) принимают количество фермента, действующего на
) принимают количество фермента, действующего на -глюкан, из ячменя с высвобождением 1 мкмоля восстанавливающих сахаров (в глюкозном эквиваленте), образующихся за 1 мин при стандартных условиях (температура 50 °С и значение рН 5,0).
4.1.3 Содержание редуцирующих сахаров, образующихся в результате ферментативной реакции, определяют колориметрическим методом, основанным на взаимодействии сахаров с реактивом Шомоди-Нельсона [2]. В результате этой реакции образуется соединение голубого цвета, интенсивность окраски которого пропорциональна содержанию редуцирующих сахаров, образовавшихся в процессе ферментативной реакции. Интенсивность окраски полученных растворов измеряют на фотоэлектроколориметре при длине световой волны 610 нм; активность выражается в ед. -ГкС/г или см
испытуемого препарата.
4.2 Средства измерений, вспомогательное оборудование, реактивы, материалы
4.2.1 Для определения -глюканазной активности используют следующие средства измерений, вспомогательное оборудование, лабораторную посуду, реактивы, материалы:
- весы неавтоматического действия по ГОСТ Р 53228, с пределами абсолютной допускаемой погрешности ±0,5 мг;
- фотоэлектроколориметр (КФК-3) или спектрофотометр (СФ) любого типа, которые обеспечивают измерения при длине световой волны 610 нм с погрешностью измерения коэффициента пропускания не более 1% (не более 0,01 единицы оптической плотности);
- холодильник бытовой;
- рН-метр любого типа для измерения в диапазоне от 0 до 14 рН с пределом допускаемой погрешности в эксплуатации ±0,1 единицы рН;
- магнитную мешалку любой марки, которая обеспечивает скорость вращения до 800 мин;
- ультратермостат или водяной термостат с точностью регулирования температуры ±1 °С;
- лабораторную центрифугу любого типа, которая обеспечивает скорость вращения не менее 7000 мин;
- водяную баню любого типа, которая обеспечивает поддержание температуры (100±1) °С;
- секундомер с емкостью шкалы счетчика 1 мин, ценой деления 1 с и погрешностью ±1,5 с;
- пипетки автоматические вместимостью от 0,1 до 1,0 см, 1,0 см
и от 0,2 до 5,0 см
с наконечниками;
- встряхиватель V-3 типа Вортекс или аналогичный для перемешивания жидкости;
- термометры ртутные стеклянные лабораторные от 0 °С до 50 °С и от 0 °С до 100 °С с ценой деления 0,1 °С или 0,5 °С по ГОСТ 28498;
- ареометры общего назначения по ГОСТ 18481;
- стаканы и колбы стеклянные лабораторные В-1-150 ТС, В-1-800 ТС, Кн-1-100-14/23 ТС по ГОСТ 25336;
- стаканчики для взвешивания (бюксы) СВ-19/9 по ГОСТ 25336;
- воронки В-75-140 ХС по ГОСТ 25336;
- пробирки П1-14-120 ХС или П1-16-150 ХС по ГОСТ 25336;
- колбы мерные 1-25-2, 1-50-2, 1-100-2, 1-200-2, 1-250-2, 2-1000-2 по ГОСТ 1770;
- цилиндры 1-25-2, 1-50-2, 1-100-2, 1-250-2 по ГОСТ 1770;
- пипетки стеклянные 1-2-2-1, 1-2-2-2, 1-2-2-5, 1-2-2-10 по ГОСТ 29227;
- бумагу фильтровальную лабораторную по ГОСТ 12026;
- -глюкан из ячменя, содержание основного вещества не менее 95%;
- натрий уксуснокислый по ГОСТ 199;
- кислоту уксусную ледяную по ГОСТ 61;
- ацетон по ГОСТ 2603;
- натрий углекислый по ГОСТ 83;
- калий-натрий виннокислый 4-водный по ГОСТ 5845;
- медь сернокислую 5-водную по ГОСТ 4165;
- натрий углекислый кислый по ГОСТ 4201;
- аммоний молибденовокислый 4-водный по ГОСТ 3765;
- натрий сернокислый по ГОСТ 4166;
- кислоту серную концентрированную для пробы Саваля по ГОСТ 4204;
- натрий кислый мышьяковокислый, содержание основного вещества 98%;
- D(+)-глюкозу по ГОСТ 6038;
- воду дистиллированную по ГОСТ 6709.
(Измененная редакция, Изм. N 1).
4.2.2 Все реактивы должны относиться к подгруппе чистоты 2 (х.ч.) или 3 (ч.д.а.) по ГОСТ 13867.
4.2.3 Допускается применение средств измерений, вспомогательного оборудования с аналогичными метрологическими и техническими характеристиками, а также реактивов по качеству не хуже вышеуказанных.
4.3 Подготовка к анализу
4.3.1 Приготовление ацетатного буферного раствора молярной концентрации 0,1 моль/дм с рН 5,0 из растворов уксуснокислого натрия и уксусной кислоты
4.3.1.1 Приготовление раствора (CH
COONa)=0,1 моль/дм
(раствор А)
В мерную колбу вместимостью 1 дм помещают навеску безводного уксуснокислого натрия массой (8,20±0,01) г или (13,60±0,01) г CH
COONa·3Н
О и растворяют приблизительно в 300 см
дистиллированной воды. Затем доводят до метки дистиллированной водой при 20 °С и перемешивают.
4.3.1.2 Приготовление раствора (СН
СООН)=0,1 моль/дм
(раствор Б)
В мерную колбу вместимостью 1 дм вносят 5,72 см
ледяной уксусной кислоты, разводят приблизительно 300 см
дистиллированной воды. Объем доводят до метки дистиллированной водой при 20 °С и перемешивают.
4.3.1.3 Для приготовления ацетатного буферного раствора в колбе смешивают растворы уксуснокислого натрия (раствор А) и уксусной кислоты (раствор Б) в соотношении 2:1, создавая значение рН смеси, равное 5,0. При необходимости доводят рН раствора до 5,0 одним из исходных растворов. Буферный раствор хранят в закрытой стеклянной посуде при 4 °С в течение четырех недель.
4.3.2 Приготовление реактива Шомоди
4.3.2.1 Приготовление раствора А
Безводный углекислый натрий массой (24,00±0,01) г и виннокислый калий-натрий 4-водный массой (12,00±0,01) г растворяют в стакане в 250 см дистиллированной воды. К этому раствору добавляют при перемешивании раствор сернокислой меди 5-водной, для чего навеску CuSO
·5Н
О массой (4,00±0,01) г растворяют в 40 см
дистиллированной воды при 20 °С. Затем в полученную смесь вносят безводный кислый углекислый натрий массой (16,00±0,01) г и содержимое стакана вновь перемешивают. Получают раствор А.
4.3.2.2 Приготовление раствора Б
В другом стакане растворяют безводный сернокислый натрий массой (18,00±0,01) г в 500 см горячей (~80 °С) дистиллированной воды и кипятят раствор на слабом огне 40 мин, после чего остужают. Получают раствор Б.
4.3.2.3 В мерной колбе вместимостью 1 дм смешивают приготовленные растворы А и Б, доводят объем смеси до метки дистиллированной водой. Полученный реактив Шомоди стабилен в течение 2-3 мес при хранении его в стеклянной темной посуде при комнатной температуре.
4.3.3 Приготовление реактива Нельсона
4.3.3.1 Приготовление раствора А
Навеску безводного молибденовокислого аммония массой (50,00±0,01) г или (68,40±0,01) г 4-водного растворяют в стакане в 800 см горячей (~60 °С) дистиллированной воды. Раствор охлаждают до 5 °С - 10 °С.
4.3.3.2 Приготовление раствора Б
В навеску концентрированной серной кислоты массой (42,00±0,02) г вносят навеску безводного кислого мышьяковокислого натрия массой (6,00±0,01) г (или 10 г NaHAsO
·7Н
О).
4.3.3.3 Раствор А переносят в мерную колбу вместимостью 1 дм. К раствору А при перемешивании осторожно добавляют раствор Б. Объем смеси доводят до метки дистиллированной водой. Полученную смесь инкубируют в течение 48 ч при температуре 40 °С, после чего при наличии осадка фильтруют через стеклянный фильтр. Полученный реактив Нельсона стабилен в течение 2-3 мес при хранении его в темном месте при температуре (20,0±0,2) °С.
4.3.4 Приготовление раствора -глюкана с массовой долей 1,0% (субстрат)
Субстратом является -глюкан ячменный.
-глюкан массовой доли 1,0% готовят в 0,1 моль/дм
ацетатном буфере (рН 5,0). В стакан вместимостью 100 см
вносят 0,5 г
-глюкана, добавляют 49,5 см
ацетатного буферного раствора по 4.3.1 и непрерывно перемешивают около 1 ч на магнитной мешалке при комнатной температуре. Затем раствор
-глюкана помещают в кипящую водяную баню на 2-3 мин, периодически перемешивая, после чего содержимое охлаждают. Полученный раствор
-глюкана при необходимости центрифугируют в течение 7 мин при 6000 мин
. Хранят в закрытой стеклянной посуде. Раствор стабилен в течение 1 сут.
4.3.5 Приготовление градуировочных растворов глюкозы
4.3.5.1 Приготовление основного градуировочного раствора глюкозы с массовой долей 1 мг/см
В мерную колбу вместимостью 100 см помещают (0,1000±0,0005) г глюкозы, растворяют в небольшом количестве ацетатного буферного раствора с рН 5,0 молярной концентрации 0,05 моль/дм
, получая его путем разведения ацетатного буферного раствора по 4.3.1 дистиллированной водой в соотношении 1:1. Раствор тщательно перемешивают и доводят объем до метки буферным раствором концентрации 0,05 моль/дм
.
(Измененная редакция, Изм. N 1).
4.3.5.2 Приготовление рабочих градуировочных растворов глюкозы
Из основного градуировочного раствора глюкозы по 4.3.5.1 готовят серию разведений в соответствии с таблицей 1.
Таблица 1
Объем градуировочного раствора глюкозы массовой концентрации 1 мг/см | Объем буферного раствора молярной концентрации 0,05 моль/дм | Массовая концентрация глюкозы в рабочем растворе, мг/см |
0,10 | 4,90 | 0,02 |
0,20 | 4,80 | 0,04 |
0,30 | 4,70 | 0,06 |
0,40 | 4,60 | 0,08 |
0,50 | 4,50 | 0,10 |
Рабочие градуировочные растворы глюкозы готовят в день построения градуировочного графика, при этом берут по три параллельных разведения для приготовления каждой концентрации раствора глюкозы.
4.3.6 Построение градуировочного графика
В каждую из параллелей, состоящей из пяти пробирок (16х150 мм), вносят в* по 1 см рабочих градуировочных растворов глюкозы различных концентраций в соответствии с таблицей 1, добавляют в каждую пробирку по 1 см
реактива Шомоди, приготовленного по 4.3.2, перемешивают и помещают пробирки в кипящую водяную баню на 20 мин.
_______________
* Текст документа соответствует оригиналу. - .
Пробирки охлаждают в холодной воде до температуры (20,0±0,2) °С, добавляют по 1 см реактива Нельсона, приготовленного по 4.3.3, содержимое перемешивают, инкубируют 10 мин при температуре (20,0±0,2) °С и вносят по 7 см
дистиллированной воды, доводя объем содержимого пробирки до 10 см
.
Одновременно готовят контрольную пробу на реактивы по 4.5.2. Оптические плотности растворов глюкозы измеряют на фотоэлектроколориметре или спектрофотометре при длине световой волны 610 нм в кюветах с толщиной поглощающего светового слоя 10 мм в сравнении с контролем на реактивы.
Для построения каждой точки градуировочного графика вычисляют среднеарифметическое значение оптической плотности трех параллельных измерений.
По полученным среднеарифметическим значениям строят градуировочный график зависимости оптической плотности (поглощения) от концентрации глюкозы (мг/см). Рабочая зона градуировочного графика лежит в пределах от 0,10 до 1,1 единицы оптической плотности.
На оси абсцисс откладывают массовую концентрацию глюкозы
в мг/см
; на оси ординат
- соответствующие значения оптической плотности
при
610 нм. На рисунке 1 приведен пример градуировочного графика. Величина, характеризующая наклон градуировочной прямой и обратная ее тангенсу угла наклона, составляет, например 0,098 (1/tg=0,098), что является коэффициентом
, входящим в формулу расчета
-глюканазной активности. Величина коэффициента может меняться в зависимости от приготовленных реактивов Шомоди и Нельсона. Таким образом, эта величина равна массовой концентрации глюкозы на оси
при оптической плотности на оси
, равной 1,0.
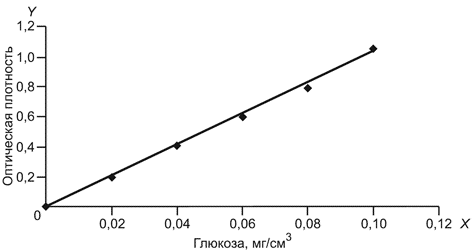
Рисунок 1
Градуировочный график строят каждый раз при приготовлении новых реактивов Шомоди и Нельсона, а также при замене прибора.
4.4 Подготовка пробы
4.4.1 Отбор проб проводят по ГОСТ 20264.0.
Анализируемые образцы ферментных препаратов в форме порошка или жидком виде можно использовать без предварительной подготовки.
4.4.2 Приготовление основного раствора анализируемого образца ферментного препарата
В стаканчик для взвешивания помещают сухой анализируемый образец ферментного препарата массой (0,1000±0,0005) г или жидкий ферментный препарат массой (1,00±0,02) г и суспендируют в небольшом количестве дистиллированной воды. Суспензию количественно переносят в мерную колбу вместимостью 100 см, доводят объем до метки дистиллированной водой при 20 °С и тщательно перемешивают. Приготовленный раствор ферментного препарата является основным раствором анализируемого образца.
(Измененная редакция, Изм. N 1).
4.4.3 Приготовление рабочего раствора анализируемого образца ферментного препарата
Рабочий раствор анализируемого ферментного препарата готовят из основного раствора по 4.4.2 путем дальнейшего разведения его дистиллированной водой таким образом, чтобы при определении активности оптические плотности опытного и контрольного растворов находились в пределах рабочей зоны градуировочного графика по 4.3.6.
Количество фермента, взятого на анализ, должно быть рассчитано так, чтобы в реакционной смеси по 4.5.1.2 присутствовал избыток субстрата и чтобы измеряемые величины оптической плотности по 4.5.1.5 при колориметрировании в кювете с толщиной поглощающего свет слоя 10 мм лежали в диапазоне значений 0,8-1,1.
При отклонении оптической плотности от указанных значений необходимо подобрать разведение препарата таким образом, чтобы оптическая плотность окрашенных растворов по 4.5.1.5 соответствовала указанным пределам диапазона.
Каждое разведение испытуемого раствора анализируют в двух повторностях. Для анализа берут две параллельные навески препарата.
Рабочий раствор ферментного препарата готовят непосредственно перед определением.
4.5 Проведение анализа
4.5.1 Проведение ферментативной реакции
4.5.1.1 В две опытные пробирки (16х150 мм) вносят по 0,5 см субстрата
-глюкана по 4.3.4. В пробирки добавляют по 0,3 см
дистиллированной воды. Содержимое пробирок перемешивают и прогревают в ультратермостате с температурой (50±1) °С в течение 5 мин.
4.5.1.2 В пробирки добавляют по 0,2 см рабочего раствора анализируемого образца ферментного препарата по 4.4.3, предварительно прогретого до температуры (50±1) °С, и тщательно перемешивают. Реакционную смесь инкубируют при температуре (50±1) °С в течение 10 мин, ведя отсчет с момента начала ферментативной реакции.
4.5.1.3 По окончании реакции в пробирки вносят по 1 см реактива Шомоди по 4.3.2, тщательно перемешивают, закрывают стеклянными пробками, помещают в кипящую водяную баню на 20 мин.
4.5.1.4 Пробирки охлаждают в холодной воде, добавляют 1,0 см реактива Нельсона по 4.3.3, перемешивают и инкубируют 10 мин при (20,0±0,2) °С, периодически тщательно перемешивая. При образовании осадка или мути в пробирки добавляют по 1 см
ацетона и перемешивают до полного их исчезновения. В этом случае ацетон добавляют в контрольные пробирки "фона" реактивов по 4.5.2 и "фона" субстрата по 4.5.3.
4.5.1.5 Содержимое пробирок доводят до общего объема 10 см дистиллированной водой и измеряют оптическую плотность
на фотоэлектроколориметре или спектрофотометре при длине световой волны 610 нм в кюветах с толщиной поглощающего свет слоя 10 мм против "фона" реактивов по 4.5.2. Значение оптической плотности должно быть в диапазоне 0,8-1,1.
4.5.1.6 Если значение оптической плотности опытной пробы находится за пределами рабочей зоны градуировочного графика и не укладывается в диапазон ее значения, определение активности следует повторить с рабочим раствором анализируемого образца, содержащим большее или меньшее количество фермента соответственно.
4.5.2 Определение оптической плотности "фона" реактивов
Контрольным раствором при колориметрировании исследуемых растворов является "фон" реактивов. Против него производят измерение оптической плотности опытной пробы , "фона" субстрата
и "фона" фермента
. Контрольную пробу на реактивы осуществляют, внося в пробирку 0,5 см
ацетатного буферного раствора по 4.3.1, 0,5 см
дистиллированной воды и 1 см
реактива Шомоди по 4.3.2. Содержимое пробирки перемешивают и инкубируют в кипящей водяной бане 20 мин. Дальнейшие операции осуществляют аналогично 4.5.1.4-4.5.1.5.
(Измененная редакция, Изм. N 1).
4.5.3 Определение оптической плотности "фона" субстрата
В пробирку вносят по 0,5 см субстрата
-глюкана по 4.3.4, добавляют 0,5 см
дистиллированной воды и 1 см
реактива Шомоди по 4.3.2. Содержимое пробирки перемешивают и инкубируют в кипящей водяной бане 20 мин. Дальнейшие операции осуществляют аналогично 4.5.1.4-4.5.1.5. Показания оптической плотности на субстрат обозначают
.
4.5.4 Определение оптической плотности "фона" фермента
В пробирку вносят 0,5 см ацетатного буфера по 4.3.1, 0,2 см
рабочего раствора ферментного препарата по 4.4.3 и 0,3 см
дистиллированной воды, затем добавляют 1 см
реактива Шомоди по 4.3.2. Содержимое пробирки инкубируют в кипящей водяной бане 20 мин. Дальнейшие операции осуществляют аналогично 4.5.1.4-4.5.1.5. Показания оптической плотности на "фон" фермента обозначают как
.
(Измененная редакция, Изм. N 1).
4.6 Обработка результатов
4.6.1 Ферментативную активность -глюканазы (
![]() ) в анализируемом образце в ед.
) в анализируемом образце в ед. -ГкС/г или ед.
-ГкС/см
вычисляют по формуле
![]() , (1)
, (1)
где - коэффициент по 4.3.6;
- разность величин оптической плотности,
![]() ,
,
- величина оптической плотности опытной пробы;
- величина оптической плотности "фона" субстрата;
- величина оптической плотности "фона" фермента;
2,78 - коэффициент, учитывающий пятикратное разбавление рабочего раствора ферментного препарата непосредственно в реакционной смеси, время проведения ферментативной реакции (10 мин) и молекулярный вес глюкозы (0,18016 мг/мкмоль), т.е. 5/10·0,18016 = 2,78;
- плотность ферментного препарата (для жидких препаратов) по ГОСТ 18481, г/см
;
- масса ферментного препарата, взятая на гидролиз (расчет ведется на 1 см
рабочего раствора анализируемого образца ферментного препарата), г.
(Измененная редакция, Изм. N 1).
4.6.2 За окончательный результат принимают среднеарифметическое значение двух параллельных определений, выполненных в условиях повторяемости, если выполняется условие приемлемости (2).
Границы относительной погрешности ±7% (соответствуют значению относительной расширенной неопределенности
при коэффициенте охвата
2).
Результат анализа представляют в виде
![]() при
при 0,95,
где - среднеарифметическое значение двух параллельных измерений, признанных приемлемыми, ед.
-ГкС/г (ед.
-ГкС/см
);
- границы абсолютной погрешности измерений, ед.
![]() /г (ед.
/г (ед. ![]() /см
/см), вычисляют по формуле
![]() или
или ![]() .
.
Наименьшие разряды числовых значений результата измерения и численных показателей точности должны быть одинаковы.
Значащих цифр численных показателей точности измерений должно быть не более двух.
4.7 Сходимость и воспроизводимость результатов
4.7.1 Результаты измерений, полученные в условиях повторяемости (сходимости), признаются удовлетворительными, если выполняется условие приемлемости
![]() , (2)
, (2)
где и
- результаты двух параллельных определений, полученные в условиях повторяемости, ед.
![]() /г или ед.
/г или ед. ![]() /см
/см;
0,01 - коэффициент для пересчета процентов в абсолютные значения;
- предел повторяемости (сходимости), равный 8%;
- среднеарифметическое значение двух параллельных определений, ед.
![]() /г или ед.
/г или ед. ![]() /см
/см анализируемого препарата.
4.7.2 Результаты измерений, полученные в условиях воспроизводимости по ГОСТ Р ИСО 5725-1, признаются удовлетворительными, если выполняется условие приемлемости
![]() , (3)
, (3)
где и
- результаты двух определений, полученные в условиях воспроизводимости, ед.
![]() /г или ед.
/г или ед. ![]() /см
/см анализируемого препарата;
- среднеарифметическое значение двух определений, выполненных в разных лабораториях в условиях воспроизводимости, ед.
![]() /г или ед.
/г или ед. ![]() /см
/см анализируемого препарата;
100 - коэффициент для пересчета в проценты;
![]() - критическая разность, равная 10%.
- критическая разность, равная 10%.
Библиография
[1] | Enzyme Nomenclature, recommendations of thenomenclature Committee of the IUB//N.Y., Academic Press - 1984 |
[2] | Полыгалина Г.В., Чередниченко B.C., Римарева Л.В. Определение активности ферментов: Справочник. М.: ДеЛи принт, 2003. 372 с. |
Электронный текст документа
и сверен по:
, 2011
Редакция документа с учетом
изменений и дополнений подготовлена

