ГОСТ Р 55302-2012
Группа Н09
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕРМЕНТНЫЕ ПРЕПАРАТЫ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
Метод определения ксиланазной активности
Enzyme preparations for food industry. Method for determination of xylanase activity*
________________
* Поправка (ИУС N 9-2015).
ОКС 07.100.30
ОКСТУ 9291
Дата введения 2014-01-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 РАЗРАБОТАН Государственным научным учреждением "Всероссийский научно-исследовательский институт пищевой биотехнологии" Российской академии сельскохозяйственных наук (ГНУ "ВНИИПБТ" Россельхозакадемии)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 176 "Спиртовая, дрожжевая и ликероводочная продукция"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 29 ноября 2012 г. N 1509-ст
4 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемом информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
ВНЕСЕНА поправка, опубликованная в ИУС N 9, 2015 год
Поправка внесена изготовителем базы данных
ВНЕСЕНО Изменение N 1, утвержденное и введенное в действие Приказом Росстандарта от 29.09.2015 N 1403-ст c 01.01.2016
Изменение N 1 внесено изготовителем базы данных по тексту ИУС N 1, 2016 год
1 Область применения
Настоящий стандарт устанавливает метод определения ксиланазной активности ферментных препаратов (ФП) и ферментсодержащих смесей ксиланолитического действия, применяемых в пищевой промышленности.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р 12.1.019-2009 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
ГОСТ Р ИСО 5725-1-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 1. Основные положения и определения
ГОСТ Р ИСО 5725-2-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 2. Основной метод определения повторяемости и воспроизводимости стандартного метода измерений
ГОСТ Р 53228-2008 Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ 12.0.004-90 Система стандартов безопасности труда. Организация обучения безопасности труда. Общие положения
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.2.007.0-75 Система стандартов безопасности труда. Изделия электротехнические. Общие требования безопасности
ГОСТ 12.4.009-83 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ 12.4.021-75 Система стандартов безопасности труда. Системы вентиляционные. Общие требования
ГОСТ 12.4.103-83 Система стандартов безопасности труда. Одежда специальная защитная, средства индивидуальной защиты ног и рук. Классификация
ГОСТ 61-75 Реактивы. Кислота уксусная. Технические условия
ГОСТ 83-79 Реактивы. Натрий углекислый. Технические условия
ГОСТ 199-78 Реактивы. Натрий уксуснокислый 3-водный. Технические условия
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2603-79 Реактивы. Ацетон. Технические условия
ГОСТ 3765-78 Реактивы. Аммоний молибденовокислый. Технические условия
ГОСТ 4165-78 Реактивы. Медь (II) сернокислая 5-водная. Технические условия
ГОСТ 4166-76 Реактивы. Натрий сернокислый. Технические условия
ГОСТ 4201-79 Реактивы. Натрий углекислый кислый. Технические условия
ГОСТ 4204-77 Реактивы. Кислота серная. Технические условия
ГОСТ 5845-79 Реактивы. Калий-натрий виннокислый 4-водный. Технические условия
ГОСТ 6038-79 Реактивы. D-глюкоза. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 13867-68 Продукты химические. Обозначение чистоты
ГОСТ 18481-81 Ареометры и цилиндры стеклянные. Общие технические условия
ГОСТ 20264.0-74 Препараты ферментные. Правила приемки и методы отбора проб
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячно издаваемого информационного указателя "Национальные стандарты", опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 гидролиз: Расщепление исходного соединения на более простые в присутствии молекул воды.
3.2 ферментативный гидролиз: Расщепление высокомолекулярных соединений при участии катализаторов белковой природы - гидролитических ферментов (гидролаз, класс 3 [1]).
3.3 субстрат: Соединение или вещество, на которое воздействует данный фермент.
3.4 ксилан: Высокомолекулярное соединение, полимер ксилозы, в котором остатки глюкозы соединены -1,4-гликозидными связями; с водой образует коллоидные растворы.
3.5 системные названия ферментов: Названия, указывающие природу химической реакции, катализируемой данным ферментом, в соответствии с современной классификацией (КФ), принятой Международной комиссией по ферментам.
Примечания
1 К ксиланазам относится система ферментов, катализирующих расщепление -гликозидных связей в
-ксиланах.
2 Системные названия ферментов:
- 1,4--D-ксиланксиланогидролаза (КФ 3.2.1.8) - эндо-1,4-ксиланаза. Фермент катализирует реакцию расщепления 1,4-
-ксилозидных связей в ксиланах;
- 1,3--D-ксиланксиланогидролаза (КФ 3.2.1.32) - ксиланаза или эндо-1,3-
-ксиланаза. Фермент беспорядочно гидролитически расщепляет внутримолекулярные 1,3-
-гликозидные связи в - 1,3-
-D-ксиланах;
- 1,4--D-ксиланксилогидролаза (КФ 3.2.1.37) - экзо-1,4-
-ксилозидаз, или ксилобиаза, или
-ксилозизаза. Гидролизует 1,4-
-D-ксиланы путем последовательного отщепления с нередуцирующего конца молекулы полисахарида остатков D-ксилозы;
- 1,3--ксиланксилогидролаза (КФ 3.2.1.72) - экзо-1,3-
-ксилазадаза. Фермент катализирует последовательное отщепление с нередуцирующего конца молекул 1,3-
-ксиланов.
4 Метод определения ферментативной активности ксиланазы с субстратом ксилан
4.1 Сущность метода
4.1.1 Метод основан на количественном определении редуцирующих (восстанавливающих) сахаров, образующихся в результате действия фермента ксиланазы на ксилан при температуре 50 °С.
4.1.2 За единицу ксиланазной активности принимают количество фермента, действующего на ксилан из березы с высвобождением 1 мкмоля восстанавливающих сахаров (в глюкозном эквиваленте), образующихся за 1 мин при стандартных условиях (температура 50 °С и значение кислотности 5,0 ед. рН).
4.1.3 Содержание редуцирующих сахаров, образующихся в результате ферментативной реакции, определяют колориметрическим методом, основанным на взаимодействии сахаров с реактивом Шомоди-Нельсона [2]. В результате этой реакции образуется соединение голубого или бирюзового цвета, интенсивность окраски которого пропорциональна содержанию редуцирующих сахаров, образовавшихся в процессе ферментативной реакции. Интенсивность окраски полученных растворов измеряют на фотоэлектроколориметре или спектрофотометре при длине световой волны 610 нм; активность выражается в ед. КС/г или ед. КС/см анализируемого препарата.
4.2 Требования безопасности
4.2.1 При выполнении анализов необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007 и ГОСТ 12.4.103.
4.2.2 Помещение, где проводят работы с реактивами, должно быть оснащено приточно-вытяжной вентиляцией по ГОСТ 12.4.021.
4.2.3 Электробезопасность при работе с электроустановками - по ГОСТ 12.2.007.0 и по ГОСТ Р 12.1.019.
4.2.4 Организация обучения работающих безопасности труда - по ГОСТ 12.0.004.
4.2.5 Помещение лаборатории должно соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004 и иметь средства пожаротушения по ГОСТ 12.4.009.
4.2.6 Содержание вредных веществ в воздухе рабочей зоны не должно превышать норм, установленных ГОСТ 12.1.005.
4.3 Средства измерений, вспомогательное оборудование, посуда, реактивы, материалы
4.3.1 Для определения ксиланазной активности используют следующие средства измерений, вспомогательное оборудование, посуду, реактивы, материалы:
- весы по ГОСТ Р 53228, обеспечивающие точность взвешивания с пределом допускаемой абсолютной погрешности ±0,5 мг;
- фотоэлектроколориметр (КФК-3) или спектрофотометр (СФ) любого типа, которые обеспечивают измерения при длине световой волны 610 нм с погрешностью измерения коэффициента пропускания не более 1% (не более 0,01 единицы оптической плотности);
- холодильник бытовой;
- рН-метр любого типа для измерения в диапазоне от 0 до 14 ед. рН с пределом допускаемой погрешности в эксплуатации ±0,1 ед. рН;
- мешалку магнитную любой марки, которая обеспечивает скорость вращения до 800 мин;
- ультратермостат или термостат водяной с точностью регулирования температуры ±1 °С;
- центрифугу лабораторную любого типа, которая обеспечивает скорость вращения не менее 7000 мин;
- баню водяную любого типа, которая обеспечивает поддержание температуры (100±1) °С;
- секундомер с емкостью шкалы счетчика 1 мин, ценой деления 1 с и погрешностью ±1,5 с;
- пипетки автоматические вместимостью от 0,1 до 1,0 см, 1,0 см
, от 0,2 до 5,0 см
и от 2,0 до 10,0 см
с наконечниками;
- встряхиватель V-3 типа Вортекс или аналогичный для перемешивания жидкости со скоростью вращения от 50 до 3400 об/мин;
- термометры ртутные стеклянные лабораторные по ГОСТ 28498 от 0 °С до 50 °С и от 0 °С до 100 °С, ценой деления 0,1 °С или 0,5 °С;
- ареометры общего назначения по ГОСТ 18481;
- стаканы и колбы стеклянные лабораторные В-1-150 ТС, В-1-800 ТС, Кн-1-100-14/23 ТС по ГОСТ 25336;
- стаканчики для взвешивания (бюксы) СВ-19/9 по ГОСТ 25336;
- воронки В-75-140 ХС по ГОСТ 25336;
- пробирки П1-14-120 ХС или П1-16-150 ХС по ГОСТ 25336;
- колбы мерные 1-25-2, 1-50-2, 1-100-2, 1-200-2, 1-250-2, 2-1000-2 по ГОСТ 1770;
- цилиндры 1-25-2, 1-50-2, 1-100-2, 1-250-2 по ГОСТ 1770;
- пипетки стеклянные 1-2-2-1, 1-2-2-2, 1-2-2-5, 1-2-2-10 по ГОСТ 29227;
- бумагу фильтровальную лабораторную по ГОСТ 12026;
- ксилан из бука, с массовой долей основного вещества не менее 90%;
- натрий уксуснокислый по ГОСТ 199;
- кислоту уксусную ледяную по ГОСТ 61;
- ацетон по ГОСТ 2603;
- натрий углекислый по ГОСТ 83;
- калий-натрий виннокислый 4-водный по ГОСТ 5845;
- медь сернокислую 5-водную по ГОСТ 4165;
- натрий углекислый кислый по ГОСТ 4201;
- аммоний молибденовокислый 4-водный по ГОСТ 3765;
- натрий сернокислый по ГОСТ 4166;
- кислоту серную концентрированную для пробы Саваля по ГОСТ 4204;
- натрий кислый мышьяковокислый, с массовой долей основного вещества 98%;
- D(+)-глюкозу по ГОСТ 6038;
- воду дистиллированную по ГОСТ 6709.
(Измененная редакция, Изм. N 1).
4.3.2 Все реактивы должны относиться к подгруппе чистоты 2 (х.ч.) или 3 (ч.д.а.) по ГОСТ 13867.
4.3.3 Допускается применение средств измерений, вспомогательного оборудования с аналогичными метрологическими и техническими характеристиками, а также реактивов по качеству не хуже вышеуказанных.
4.4 Подготовка к анализу
4.4.1 Приготовление ацетатного буферного раствора молярной концентрации 0,1 моль/дм с кислотностью 5,0 ед. рН из растворов уксуснокислого натрия и уксусной кислоты
4.4.1.1 Приготовление раствора уксуснокислого натрия молярной концентрации (
![]() )=0,1 моль/дм
)=0,1 моль/дм (раствор А)
В мерную колбу вместимостью 1 дм помещают (8,20±0,01) г безводного уксуснокислого натрия или (13,60±0,01) г
![]() и растворяют приблизительно в 300 см
и растворяют приблизительно в 300 см дистиллированной воды. Затем доводят до метки дистиллированной водой при 20 °С и перемешивают.
4.4.1.2 Приготовление раствора уксусной кислоты молярной концентрации (
![]() ) = 0,1 моль/дм
) = 0,1 моль/дм (раствор Б)
В мерную колбу вместимостью 1 дм вносят 5,72 см
ледяной уксусной кислоты, разводят приблизительно 300 см
дистиллированной воды. Объем доводят до метки дистиллированной водой при 20 °С и перемешивают.
4.4.1.3 Для приготовления ацетатного буферного раствора в колбе смешивают растворы уксуснокислого натрия (раствор А) и уксусной кислоты (раствор Б) в соотношении 2:1, создавая значение рН смеси, равное 5,0 ед. рН. При необходимости доводят кислотность раствора до 5,0 ед. рН одним из исходных растворов.
Срок хранения буферного раствора в закрытой стеклянной посуде при 4 °С - не более четырех недель.
4.4.2 Приготовление реактива Шомоди
4.4.2.1 Приготовление раствора В
(24,00±0,01) г безводного углекислого натрия и (12,00±0,01) г виннокислого калий-натрия 4-водного растворяют в стакане в 250 см дистиллированной воды. К этому раствору добавляют при перемешивании раствор сернокислой меди 5-водной, для чего (4,00±0,01) г
![]() растворяют в 40 см
растворяют в 40 см дистиллированной воды при 20 °С. Затем в полученную смесь вносят (16,00±0,01) г безводного кислого углекислого натрия и содержимое стакана вновь перемешивают. Получают раствор В.
4.4.2.2 Приготовление раствора Г
В другом стакане растворяют (18,00±0,01) г безводного сернокислого натрия в 500 см горячей (~80 °С) дистиллированной воды и кипятят раствор на слабом огне 40 мин, после чего остужают. Получают раствор Г.
4.4.2.3 В мерной колбе вместимостью 1 дм смешивают приготовленные растворы В и Г, доводят объем смеси до метки дистиллированной водой при температуре 20 °С.
Срок хранения реактива Шомоди в стеклянной темной посуде при комнатной температуре - не более 3 мес.
4.4.3 Приготовление реактива Нельсона
4.4.3.1 Приготовление раствора Д
(50,00±0,01) г безводного молибденовокислого аммония или (68,40±0,01) г 4-водного растворяют в стакане в 800 см горячей (~60 °С) дистиллированной воды. Раствор охлаждают до 5 °С - 10 °С.
4.4.3.2 Приготовление раствора Е
К (42,00±0,02) г концентрированной серной кислоты добавляют (6,00±0,01) г безводного кислого мышьяковокислого натрия (или 10 г ![]() ).
).
4.4.3.3 Раствор Д переносят в мерную колбу вместимостью 1 дм. К раствору Д при перемешивании осторожно добавляют раствор Е. Объем смеси доводят до метки дистиллированной водой. Полученную смесь инкубируют в течение 48 ч при температуре 40 °С, после чего при наличии осадка фильтруют через стеклянный фильтр.
Срок хранения реактива Нельсона в темном месте при температуре (20,0±0,2) °С - не более 3 мес.
4.4.4 Приготовление раствора ксилана с массовой долей 1,0% (субстрат)
Субстратом является ксилан из бука. Ксилан массовой доли 1,0% готовят в 0,1 моль/дм ацетатном буфере (5,0 ед. рН). В стакан вместимостью 100 см
вносят 0,5 г ксилана, добавляют 49,5 см
ацетатного буферного раствора по 4.4.1 и непрерывно перемешивают около 1 ч на магнитной мешалке при комнатной температуре. Затем раствор ксилана помещают в кипящую водяную баню на 2-3 мин, периодически перемешивая, после чего содержимое охлаждают. Полученный раствор ксилана при необходимости центрифугируют в течение 7 мин при 6000 мин
.
Срок хранения раствора в закрытой стеклянной посуде - не более 1 сут.
(Измененная редакция, Изм. N 1).
4.4.5 Приготовление градуировочных растворов глюкозы
4.4.5.1 Приготовление основного раствора глюкозы с массовой долей 1 мг/см
В мерную колбу вместимостью 100 см помещают (0,1000±0,0005) г глюкозы, растворяют в небольшом количестве ацетатного буферного раствора с кислотностью 5,0 ед. рН молярной концентрации 0,05 моль/дм
, получая его путем разведения ацетатного буферного раствора по 4.4.1 дистиллированной водой в соотношении 1:1. Раствор тщательно перемешивают и доводят объем до метки буферным раствором концентрации 0,05 моль/дм
.
Срок хранения основного раствора глюкозы в закрытой стеклянной посуде при 4 °С - не более 4 нед.
(Измененная редакция, Изм. N 1).
4.4.5.2 Приготовление рабочих градуировочных растворов глюкозы
Из основного градуировочного раствора глюкозы по 4.4.5.1 готовят серию разведений в соответствии с таблицей 1.
Таблица 1
Объем градуировочного раствора глюкозы массовой концентрации 1 мг/см | Объем буферного раствора молярной концентрации 0,05 моль/дм | Массовая концентрация глюкозы в рабочем растворе, мг/см |
0,10 | 4,90 | 0,02 |
0,20 | 4,80 | 0,04 |
0,30 | 4,70 | 0,06 |
0,40 | 4,60 | 0,08 |
0,50 | 4,50 | 0,10 |
Рабочие градуировочные растворы глюкозы готовят в день построения градуировочного графика, при этом берут по три параллельных разведения для приготовления каждой концентрации раствора глюкозы.
4.4.6 Построение градуировочного графика
В каждую из пяти пробирок (16х150 мм) вносят по 1 см рабочих градуировочных растворов глюкозы различных концентраций в соответствии с таблицей 1, добавляют в каждую пробирку по 1 см
реактива Шомоди, приготовленного по 4.4.2, перемешивают и помещают пробирки в кипящую водяную баню на 20 мин.
Пробирки охлаждают в холодной воде, добавляют по 1 см реактива Нельсона, приготовленного по 4.4.3, и выдерживают в течение 10 мин, периодически тщательно перемешивая, после чего вносят по 7 см
дистиллированной воды, доводя объем содержимого пробирки до 10 см
.
Одновременно готовят контрольную пробу на реактивы по 4.6.2. Оптические плотности растворов глюкозы измеряют на фотоэлектроколориметре или спектрофотометре при длине световой волны 610 нм в кюветах с толщиной поглощающего светового слоя 10 мм в сравнении с контролем на реактивы.
Для построения каждой точки градуировочного графика вычисляют среднеарифметическое значение результатов оптической плотности трех параллельных измерений.
По полученным среднеарифметическим значениям результатов строят градуировочный график зависимости оптической плотности (поглощения) от массовой концентрации глюкозы (мг/см). Рабочая зона градуировочного графика лежит в пределах от 0,10 до 1,1 единицы оптической плотности.
На оси абсцисс откладывают массовую концентрацию глюкозы
в мг/см
; на оси ординат
- соответствующие значения оптической плотности
при
610 нм. На рисунке 1 приведен пример градуировочного графика. Величина, обратная тангенсу угла наклона калибровочной кривой, составляет, например, 0,098 (
![]() 0,098), что является коэффициентом
0,098), что является коэффициентом , входящим в формулу расчета ксиланазной активности. Величина коэффициента может меняться в зависимости от приготовленных реактивов Шомоди и Нельсона. Таким образом, эта величина равна массовой концентрации глюкозы в рабочем растворе, отложенной на оси
, при оптической плотности на оси
, равной 1,0.
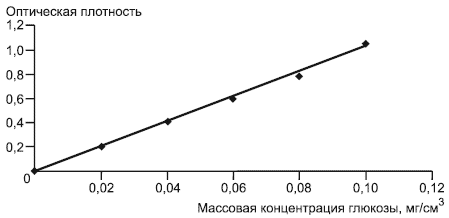
Рисунок 1 - Пример градуировочного графика
Градуировочный график строят каждый раз при приготовлении новых реактивов Шомоди и Нельсона, а также при замене прибора.
4.5 Подготовка пробы
4.5.1 Отбор проб проводят по ГОСТ 20264.0.
Анализируемые пробы ферментных препаратов в форме порошка или жидком виде можно использовать без предварительной подготовки.
4.5.2 Приготовление основного раствора анализируемой пробы ферментного препарата
В стаканчик для взвешивания помещают (0,1000±0,0005) г сухого ферментного препарата или (1,00±0,01) г жидкого ферментного препарата и суспендируют в небольшом количестве дистиллированной воды. Суспензию количественно переносят в мерную колбу вместимостью 100 см, доводят объем до метки дистиллированной водой при температуре 20 °С и тщательно перемешивают. Приготовленный раствор ферментного препарата является основным раствором анализируемого образца.
Срок хранения основного раствора ферментного препарата при температуре 20 °С - не более 1 ч.
(Измененная редакция, Изм. N 1).
4.5.3 Приготовление рабочего раствора анализируемого образца ферментного препарата
Рабочий раствор анализируемого ферментного препарата готовят из основного раствора по 4.5.2 путем дальнейшего разведения его дистиллированной водой таким образом, чтобы при определении активности оптические плотности опытного и контрольного растворов находились в пределах рабочей зоны градуировочного графика по 4.4.6.
Количество фермента, взятого для анализа, должно быть рассчитано так, чтобы в реакционной смеси по 4.6.1.2 присутствовал избыток субстрата и чтобы измеряемые величины оптической плотности по 4.6.1.5 при колориметрировании в кювете с толщиной поглощающего светового слоя 10 мм лежали в диапазоне значений 0,8-1,1.
При отклонении оптической плотности от указанных значений необходимо подобрать разведение препарата таким образом, чтобы оптическая плотность окрашенных растворов по 4.6.1.5 соответствовала указанным пределам диапазона.
Каждую пробу анализируют два раза в условиях повторяемости в соответствии с требованиями ГОСТ Р ИСО 5725-1 и ГОСТ Р ИСО 5725-2.
Раствор готовят в день определения. Длительность использования рабочего раствора ферментного препарата не должна превышать 1 ч с момента приготовления во избежание потерь его ферментативной активности.
4.6 Проведение анализа
4.6.1 Проведение ферментативной реакции
4.6.1.1 В две пробирки (16х150 мм) вносят по 0,5 см субстрата ксилана по 4.4.4. В пробирки добавляют по 0,3 см
дистиллированной воды. Содержимое пробирок перемешивают и прогревают в ультратермостате с температурой (50±1) °С в течение 5 мин.
4.6.1.2 В пробирки добавляют по 0,2 см рабочего раствора анализируемой пробы ферментного препарата по 4.5.3, предварительно прогретого до температуры (50±1) °С, и тщательно перемешивают. Реакционную смесь инкубируют при температуре (50±1) °С в течение 10 мин, ведя отсчет с момента начала ферментативной реакции.
4.6.1.3 По окончании реакции в пробирки вносят по 1 см реактива Шомоди по 4.4.2, тщательно перемешивают, закрывают стеклянными пробками, помещают в кипящую водяную баню на 20 мин.
4.6.1.4 Пробирки охлаждают в холодной воде, добавляют 1,0 см реактива Нельсона по 4.4.3, перемешивают и выдерживают 10 мин, периодически тщательно перемешивая. Полученные растворы приобретают синюю или бирюзовую окраску различной интенсивности. При образовании осадка или мути в пробирки добавляют по 1 см
ацетона и перемешивают до полного их исчезновения. В этом случае ацетон добавляют в пробирки контрольного раствора на реактивы по 4.6.2 и раствора субстрата по 4.6.3.
4.6.1.5 Содержимое пробирок доводят до общего объема 10 см дистиллированной водой и измеряют оптическую плотность
на фотоэлектроколориметре или спектрофотометре при длине световой волны
610 нм в кюветах с толщиной поглощающего светового слоя 10 мм против контрольного раствора на реактивы по 4.6.2. Значение оптической плотности должно быть в диапазоне 0,8-1,1.
4.6.1.6 Если значение оптической плотности опытной пробы находится за пределами рабочей зоны градуировочного графика и не укладывается в диапазон ее значения, определение активности следует повторить с рабочим раствором анализируемого образца, содержащим большее или меньшее количество фермента соответственно.
4.6.2 Определение оптической плотности контрольного раствора на реактивы
Измерение оптической плотности опытной пробы , раствора субстрата
и рабочего раствора фермента
осуществляют против кюветы с контрольным раствором на реактивы. Контрольный раствор на реактивы готовят, внося в пробирку 0,5 см
ацетатного буферного раствора по 4.4.1, 0,5 см
дистиллированной воды и 1 см
реактива Шомоди по 4.4.2. Содержимое пробирки перемешивают и инкубируют в кипящей водяной бане 20 мин. Дальнейшие операции осуществляют аналогично 4.6.1.4-4.6.1.5.
4.6.3 Определение оптической плотности раствора субстрата
В пробирку вносят по 0,5 см субстрата ксилан по 4.4.4, добавляют 0,5 см
дистиллированной воды и 1 см
реактива Шомоди по 4.4.2. Содержимое пробирки перемешивают и инкубируют в кипящей водяной бане 20 мин. Дальнейшие операции осуществляют аналогично 4.6.1.4-4.6.1.5. Показания оптической плотности раствора субстрата обозначают
.
4.6.4 Определение оптической плотности рабочего раствора фермента
В пробирку вносят 0,5 см ацетатного буфера по 4.4.1, добавляют 0,3 см
дистиллированной воды и 0,2 см
рабочего раствора фермента по 4.5.3, затем добавляют 1 см
реактива Шомоди по 4.4.2. Содержимое пробирки инкубируют в кипящей водяной бане 20 мин. Дальнейшие операции осуществляют аналогично 4.6.1.4-4.6.1.5. Показания оптической плотности рабочего раствора фермента обозначают как
.
4.7 Обработка результатов
4.7.1 Ферментативную активность ксиланазы в анализируемой пробе, в ед. КС/г или ед. КС/см
, вычисляют по формуле
![]() , (1)
, (1)
где - коэффициент по 4.4.6;
- разность величин оптической плотности,
![]() ,
,
- оптическая плотность анализируемого раствора;
- оптическая плотность раствора субстрата;
- оптическая плотность рабочего раствора фермента;
2,78 - коэффициент, учитывающий пятикратное разбавление рабочего раствора ферментного препарата непосредственно в реакционной смеси, время проведения ферментативной реакции (10 мин) и молекулярный вес глюкозы (0,18016 мг/мкмоль), т.е. 5/10·0,18016 = 2,78;
- плотность ферментного препарата (для жидких препаратов) по ГОСТ 18481, г/см
;
- масса ферментного препарата, взятая на гидролиз (расчет ведется на 1 см
рабочего раствора анализируемой пробы ферментного препарата), г.
(Измененная редакция, Изм. N 1).
4.7.2 За окончательный результат определения принимают среднеарифметическое значение результатов двух параллельных определений, выполненных в условиях повторяемости, если выполняется условие приемлемости (2).
Границы относительной погрешности ±7% (соответствуют значению относительной расширенной неопределенности
при коэффициенте охвата
2).
Результат анализа в документах, предусматривающих его использование, представляют в виде
![]() , при
, при 0,95,
где - доверительная вероятность;
- среднеарифметическое значение результатов двух параллельных определений, признанных приемлемыми (4.8.1), ед. КС/г (ед. КС/см
);
- значение границ абсолютной погрешности результатов определений ед. КС/г (ед. КС/см
), определяемое по формуле
![]() или
или ![]() ,
,
где - границы относительной погрешности результата анализа ксилазной активности в анализируемой пробе при
0,95.
Наименьшие разряды числовых значений результата измерения и численных показателей точности должны быть одинаковы.
Значащих цифр численных показателей точности измерений должно быть не более двух.
4.8 Сходимость и воспроизводимость результатов
4.8.1 Результаты измерений, полученные в условиях повторяемости (сходимости), признаются удовлетворительными, если выполняется условие приемлемости
![]() , (2)
, (2)
где и
- результаты двух параллельных определений, полученные в условиях повторяемости при
0,95, ед. КС/г или ед. КС/см
;
0,01 - коэффициент для пересчета процентов в абсолютные значения;
- предел повторяемости (сходимости), равный 7%;
- среднеарифметическое значение результатов двух параллельных определений, ед. КС/г или КС/см
анализируемого препарата.
4.8.2 Результаты определений, полученные в условиях воспроизводимости по ГОСТ Р ИСО 5725-1, признаются удовлетворительными, если выполняется условие приемлемости
![]() , (3)
, (3)
где и
- окончательные результаты определений, полученные в условиях воспроизводимости в двух лабораториях в точном соответствии с методикой, ед. КС/г или ед. КС/см
анализируемого препарата;
- среднеарифметическое значение двух окончательных результатов измерений, полученных в условиях воспроизводимости, ед. КС/г или ед. КС/см
анализируемого препарата;
100 - коэффициент для пересчета в проценты;
![]() - критическая разность, равная 10%.
- критическая разность, равная 10%.
5 Условия проведения измерений
При выполнении измерений в лаборатории должны соблюдаться следующие условия:
- температура окружающего воздуха | (20±1) °С; |
- относительная влажность воздуха | (60±20)%; |
- атмосферное давление | (84,0 |
- напряжение в сети | (220±10) В. |
6 Требования к квалификации операторов
К проведению анализов допускаются лица, имеющие квалификацию не ниже среднего технического образования, владеющие навыками работы в лаборатории, проведения анализов и изучившие инструкции по эксплуатации используемой аппаратуры.
Библиография
[1] | Enzyme Nomenclature, recommendations of the nomenclature Committee of the IUB // N.Y., Academic Press - 1984 |
[2] | Полыгалина Г.В., Чередниченко B.C., Римарева Л.В. Определение активности ферментов: Справочник. М.: ДеЛи принт, 2003. 372 с. |
Электронный текст документа
и сверен по:
, 2013
Редакция документа с учетом
изменений и дополнений подготовлена

