ГОСТ ISO/TS 13136-2016
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
Микробиология пищевой продукции и кормов для животных
ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ ДЛЯ ОПРЕДЕЛЕНИЯ ПАТОГЕННЫХ МИКРООРГАНИЗМОВ
Горизонтальный метод определения бактерий Escherichia coli, продуцирующих Шига-токсин, в том числе серогрупп О157, О111, О26, О103 и О145
Microbiology of food and animal feed. Real-time polymerase chain reaction (PCR)-based method for the detection of food-borne pathogens. Horizontal method for the detection of Shiga toxin-producing Escherichia coli (STEC) and the determination of O157, O111, O26, O103 and O145 serogroups
МКС 07.100.30
65.120
67.050
Дата введения 2017-07-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены в ГОСТ 1.0-2015 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2015 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным научным учреждением "Всероссийский научно-исследовательский институт технологии консервирования" (ФГБНУ "ВНИИТеК") на основе официального перевода на русский язык англоязычной версии международного документа, указанного в пункте 5, который выполнен ФГБНУ "ВНИИТеК"
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 июля 2016 г. N 89-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Туркмения | TM | Главгосслужба "Туркменстандартлары" |
(Поправка. ИУС N 1-2023).
4 Приказом Федерального агентства по техническому регулированию и метрологии от 7 ноября 2016 г. N 1606-ст межгосударственный стандарт ГОСТ ISO/TS 13136-2016 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2017 г.
5 Настоящий стандарт идентичен международному документу ISO/TS 13136:2012* "Микробиология пищевой продукции и кормов для животных. Полимеразная цепная реакция в режиме реального времени для определения патогенных микроорганизмов. Горизонтальный метод определения бактерий Escherichia coli, продуцирующих Шига-токсин, в том числе серогрупп О157, О111, О26, О103 и О145" [Microbiology of food and animal feed - Real-time polymerase chain reaction (PCR)-based method for the detection of food-borne pathogens - Horizontal method for the detection of Shiga toxin-producing Escherichia coli (STEC) and the determination of O157, O111, O26, O103 and O145 serogroups", IDT].
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Международный документ разработан Техническим комитетом по стандартизации ISO/TC 34 "Пищевые продукты" Международной организации по стандартизации (ISO).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты" (по состоянию на 1 января текущего года), а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет ()
ВНЕСЕНА поправка, опубликованная в ИУС N 1, 2023 год
Поправка внесена изготовителем базы данных
Введение
Escherichia coli, продуцирующая Шига-токсин (STEC), является патогенной кишечной палочкой, которая может вызывать диарею, а также более тяжелые заболевания человека, такие как геморрагический колит и гемолитико-уремический синдром (ГУС). Хотя существует большое количество серогрупп STEC, серогруппы О157, О26, О111, О103 и О145 гарантированно вызывают наиболее тяжелые заболевания, в частности, ГУС (см. [1]).
Примечание - Необходимо принимать во внимание все виды Escherichia coli, выделяющие Шига-токсин, поскольку они патогенны для человека и потенциально способны вызвать тяжелые заболевания в зависимости от характеристик рисков, которые несут в себе продовольственные товары (готовая к употреблению пищевая продукция или пищевая продукция, предназначенная для потребления после технологической обработки, такой как пастеризация, приготовление пищи и т.п., проводимой с целью снижения широкого спектра бактерий, присутствующих в пищевой продукции), а также от состояния здоровья людей, потребляющих пищевую продукцию.
Кроме того, учитывая высокую геномную пластичность данного вида бактерий, не исключено, что новые механизмы вирулентности могут приводить к созданию новых серопатогрупп, таких как продуцирующая Шига-токсин энтероагрегативная серопатогруппа Е. coli О104, которая вызвала вспышки ГУС в Германии и Франции в мае и июне 2011 г. Новые атипичные серопатогруппы Е. coli могут образовываться в результате трансформации генов stx при воздействии бактериофага на штамм Е. coli, патогруппы которого не продуцируют Шига-токсин.
Метод, установленный в настоящем стандарте, распространяется на данные атипичные штаммы и они могут быть надежно выявлены, поскольку в них присутствуют гены stx.
1 Область применения
Настоящий стандарт устанавливает метод идентификации бактерий Escherichia coli, продуцирующих Шига-токсин (STEC), посредством обнаружения следующих генов:
a) основных генов вирулентности STEC, stx и еае (см. [2], [3]);
b) генов, входящих в состав ДНК бактерий Escherichia coli серогрупп О157, О111, О26, О103 и О145 (см. [3], [4]).
При обнаружении одного или обоих видов генов stx проводят разделение штаммов.
Выделение STEC из проб, в которых присутствуют бактерии с генами, характерными для серогрупп, на которые распространяется метод настоящего стандарта, можно упростить путем использования методик обогащения, предназначенных для работы с серогруппами (например, иммуномагнитного разделения).
В методе, установленном в настоящем стандарте, полимеразную цепную реакцию (ПЦР) в режиме реального времени используют в качестве контрольной методики обнаружения генов вирулентности и генов, присутствующих в геноме серогрупп.
Настоящий стандарт распространяется на:
1) продукцию, предназначенную для потребления человеком и кормления животных;
2) пробы окружающей среды, взятые из зоны производства пищевых продуктов и осуществления технологических операций с пищевыми продуктами;
3) пробы окружающей среды из зоны производства сырья.
В настоящем стандарте применены следующие условные обозначения:
- stx: гены, ответственные за синтез Шига-токсина (используют также синоним - vtx);
- Stx: Шига-токсин [используют также синоним - Vtx (веротоксин)];
- STEC: Escherichia coli, выделяющие Шига-токсин [используют также синоним - VTEC (Escherichia coli, выделяющие веротоксин)];
- еае: гены интимина.
2 Нормативные ссылки
Для применения настоящего стандарта необходимы следующие ссылочные стандарты*. В случае недатированных ссылок применяют последнее издание ссылочного стандарта (включая все его изменения).
________________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ISO 7218 Microbiology of food and animal feeding stuffs. General requirements and guidance for microbiological examinations (Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям)
ISO 20838 Microbiology of food and animal feeding stuffs. Polymerase chain reaction (PCR) for the detection of food-borne pathogens. Requirements for amplification and detection for qualitative methods (Микробиология пищевых продуктов и кормов для животных. Полимеразная цепная реакция (ПЦР) для обнаружения патогенных микроорганизмов в пищевых продуктах. Требования к амплификации и детектированию для качественного анализа)
ISO 22174 Microbiology of food and animal feeding stuffs. Polymerase chain reaction (PCR) for the detection of food-borne pathogens. General requirements and definitions (Микробиология пищевых продуктов и кормов для животных. Полимеразная цепная реакция (ПЦР) для обнаружения патогенных микроорганизмов в пищевых продуктах. Общие требования и определения)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 Escherichia coli, продуцирующие Шига-токсин; STEC [Shiga toxin-producing Escherichia coli (STEC)]: Штаммы E. coli, имеющие гены, ответственные за синтез Шига-токсина
3.2 Escherichia coli, продуцирующие Шига-токсин (STEC), вызывающие повреждение путем прикрепления бактерий и разрушения ими щеточной каймы эпителия клеток кишечника (Shiga toxin-producing Escherichia coli causing the attaching and effacing lesion, STEC causing the attaching and effacing lesion): Штаммы E. coli, имеющие гены, ответственные за синтез Шига-токсина и ген, ответственный за синтез интимина (еае).
Примечание - Данная комбинация генов вирулентности часто бывает причиной наиболее тяжелых форм болезней, вызванных STEC.
3.3 Escherichia coli, продуцирующие Шига-токсин (STEC), серогруппы которых являются высокопатогенными (Shiga toxin-producing Escherichia coli belonging to highly pathogenic serogroups, STEC belonging to highly pathogenic serogroups): Штаммы E. coli, имеющие гены, ответственные за синтез Шига-токсина, ген, ответственный за синтез интимина (еае) и относящиеся к серогруппам О157, О111, О26, О103 и О145.
4 Сущность метода
4.1 Общие положения
Используемый метод состоит из следующих последовательных этапов:
a) микробное обогащение;
b) выделение нуклеиновых кислот (ДНК);
c) выявление генов вирулентности;
d) выявление генов, присутствующих в серогруппах;
e) селекция из положительных проб.
Примечание - Блок-схема проведения исследования представлена на рисунке А.1.
4.2 Микробное обогащение
Бактерии STEC выявляют после увеличения их количества путем инкубирования анализируемой пробы в неселективной жидкой питательной среде, например:
a) модифицированный триптон-соевый бульон (триптон-соевый бульон с добавлением соли желчных кислот N 3, концентрация которой - 1,5 г/дм, и добавлением новобиоцина, концентрация которого - 16 мг/дм
) - mTSB+N;
b) забуференная пептонная вода (BPW);
c) модифицированный триптон-соевый бульон (триптон-соевый бульон с добавлением соли желчных кислот N 3, концентрация которой - 1,5 г/дм, и добавлением акрифлавина, концентрация которого - 12 мг/дм
) - mTSB+A, для анализа молока и молочных продуктов.
mTSB используют при анализе проб, предположительно содержащих большие количества нецелевых микроорганизмов.
Новобиоцин и акрифлавин подавляют рост грамположительных бактерий и способствуют росту грамотрицательных бактерий, в том числе STEC.
BPW применяют для анализа проб, которые предположительно содержат подвергнутые стрессу целевые бактерии (например, пробы замороженных продуктов), чтобы реанимировать подвергнутые стрессу бактерии STEC, и предположительно содержащие меньшее количество нецелевых микроорганизмов, чем свежие пробы.
Примечание - Добавление новобиоцина является спорным и было исследовано несколькими авторами. Было установлено, что минимальная ингибирующая концентрация антибиотика для бактерий STEC, не относящихся к серогруппе О157, ниже, чем для штаммов серогруппы О157 (см. [5]). Добавление новобиоцина при обогащении в mTSB, когда концентрация новобиоцина является типичной (20 мг/дм), как это установлено в [19], приводило к подавлению роста приблизительно одной трети клеток штаммов бактерий, не относящихся к серогруппе О157 (см. [6]), что повышает риск ложно-отрицательных результатов.
4.3 Выделение нуклеиновых кислот (ДНК)
Нуклеиновые кислоты экстрагируют в соответствии с требованиями используемой системой ПЦР в режиме реального времени.
4.4 Выявление целевых генов
Очищенную ДНК используют для обнаружения следующих целевых генов:
- основные гены вирулентности для STEC: генов stx, кодирующих токсины Шига и еае-гена, кодирующего белок массой 90 кда - интимин, участвующих в механизме адгезии, которая является характерным признаком штаммов STEC, вызывающих тяжелые заболевания. Гены stx кодируют семейство токсинов, в том числе два основных типа: stx1 и stx2. Stx2 состоит из семи четко установленных вариантов - от stx2a до stx2g (см. [22]). Варианты генов stx2a, stx2b и stx2c, присутствующие в штаммах бактерий STEC, в числе генов, которые приведены в разделе 1, представляют собой целевые гены, кодирующие Шига-токсин, на которые распространяется настоящий стандарт.
В базе данных GenBank генам, кодирующим данные варианты stx2, присвоены следующие обозначения: stx2a: Х07865; stx2b: L11078; stx2c: М59432.
- ген еае, кодирующий интимин;
- гены для определения соответствующей серогруппы: rflbE(O157), wbdl(O111), wzx(O26), ihp1(O145) и wzx(O103).
4.5 Выявление
Выявление целевых генов проводят в соответствии с требованиями используемой системы ПЦР в режиме реального времени.
4.6 Селекция из положительных проб
Если есть подозрение, что в пробе присутствуют STEC, проводят селекцию микроорганизмов. В случае обнаружения по меньшей мере одной серогруппы, которая описана в разделе 1, допускается проводить обогащение данной серогруппы (например, методом иммуномагнитного разделения), после чего проводят посев на агар с триптоном, желчью и глюкуроновой кислотой (ТВХ) или на определенную селективную среду, если существует такая возможность (см. приложение F, примечания 2 и 3). Данную операцию проводят с целью облегчения отделения STEC от фоновой микрофлоры.
5 Разбавители, питательные среды и реактивы
В ходе проведения анализа, если не указано иное, используют реактивы только признанной аналитической степени чистоты и стерильную, дистиллированную, деминерализованную воду или воду эквивалентной чистоты.
5.1 Питательные среды
5.1.1 Модифицированный триптон-соевый бульон (mTSB)
5.1.1.1 Базовый состав и рН среды
Ферментативный перевар казеина - 17 г;
Ферментативный перевар сои - 3 г;
D(+)-глюкоза - 2,5 г;
Натрия хлорид - 5 г;
Калий фосфорнокислый двухзамещенный (![]() ) - 4 г;
) - 4 г;
Соли желчных кислот N 3 - 1,5 г;
Дистиллированная вода - до 1000 см;
рН (7,4±0,2) ед. рН.
Процедура приготовления среды следующая: компоненты сухой питательной среды растворяют в воде. Устанавливают рН на уровне (7,4±0,2) ед. рН при температуре 25°С и стерилизуют автоклавированием при температуре 121°С в течение 15 мин.
5.1.1.2 Раствор новобиоцина
Состав раствора:
Новобиоцин - 0,16 г;
Вода - 10 см.
Процедура приготовления раствора следующая: новобиоцин растворяют в воде и стерилизуют путем мембранной фильтрации с помощью фильтров с размерами пор 0,22 мкм или 0,45 мкм.
Раствор готовят в день его использования.
5.1.1.3 Раствор акрифлавина
Состав раствора:
Акрифлавин - 0,12 г;
Вода - 10 см.
Процедура приготовления раствора следующая: акрифлавин растворяют в воде и стерилизуют путем мембранной фильтрации с помощью фильтров с размерами пор 0,22 мкм или 0,45 мкм.
Раствор готовят в день его использования.
5.1.1.4 Приготовление готовой питательной среды
Непосредственно перед использованием 1 см раствора новобиоцина (см. 5.1.1.2) или раствора акрифлавина добавляют (см. 5.1.1.3) к 1000 см
охлажденного бульона mTSB (см. 5.1.1.1).
Конечная концентрация новобиоцина в mTSB должна быть 16 мг/дм.
Конечная концентрация акрифлавина в mTSB должна быть 12 мг/дм.
5.1.2 Забуференная пептонная вода (BPW)
Состав и рН BPW:
Пептоны - 10 г;
Натрия хлорид - 5,0 г;
Натрий фосфорнокислый двухзамещенный двенадцативодный (![]() ) - 3,5 г;
) - 3,5 г;
Калий фосфорнокислый однозамещенный (![]() ) - 1,5 г;
) - 1,5 г;
Вода - до 1000 см;
рН (7,0±0,2) ед. рН.
Процедура приготовления BPW следующая: компоненты сухой питательной среды растворяют в воде. Устанавливают рН на уровне (7,0±0,2) ед. рН при температуре 25°С и стерилизуют автоклавированием при температуре 121°С в течение 15 мин.
5.2 Реактивы для экстракции нуклеиновых кислот (ДНК)
Реактивы, используемые для экстракции нуклеиновых кислот, не приведены в настоящем пункте, поскольку они могут быть разными в зависимости от используемого метода (см. 9.3).
5.3 Реактивы, используемые при проведении ПЦР
Используют реактивы, приведенные в ISO 20838.
5.3.1 Олигонуклеотиды (праймеры) и зонды обнаружения
Праймеры и зонды для обнаружения конкретных целевых последовательностей генов стандартными методами ПЦР и методами ПЦР в режиме реального времени приведены в приложениях С и Е.
6 Оборудование и лабораторная посуда
Используют обычное оборудование, необходимое для микробиологической лаборатории (см. ISO 7218) и, в частности, следующее.
6.1 Баня водяная или нагревательный блок, способные поддерживать температуру до 100°С.
6.2 Термостат (см. ISO 7218), способный поддерживать температуру на уровне (37±1)°С.
6.3 Оборудование для выделения нуклеиновых кислот (ДНК), выбираемое в зависимости от используемого метода, при необходимости.
6.4 Пипетки вместимостью от 1 мм до 100 мм
(см. [16]).
6.5 Тонкостенные микропробирки для проведения ПЦР в режиме реального времени, вместимостью 0,2 и 0,5 см, многолуночные микропланшеты для проведения ПЦР или другая подходящая прозрачная одноразовая пластиковая лабораторная посуда.
6.6 Амплификатор, некоторые торговые марки которого доступны на рынке и который выбирают в зависимости от методов, используемых в лаборатории.
6.7 Прибор для обнаружения продуктов ПЦР
Прибор для проведения ПЦР в режиме реального времени позволяет обнаружить световое излучение, которое появляется после ПЦР-анализа с использованием 5'-нуклеазы.
6.8 Перистальтический смеситель со стерильными пакетами, в некоторых случаях оснащенный прибором регулирования скорости и времени.
7 Отбор проб
Отбор проб не является частью метода, установленного в настоящем стандарте. Информация об отборе проб приведена в определенных стандартах на конкретную продукцию, а также в определенных нормативных документах. В случае, когда стандарт, где приведена информация об отборе проб конкретного вида продукции, отсутствует, рекомендуется, чтобы заинтересованные стороны пришли к соглашению по данному вопросу.
В лабораторию необходимо доставить представительную пробу, которая не была повреждена или изменена в процессе транспортирования или хранения.
8 Подготовка пробы для испытания
Испытуемую пробу подготавливают в соответствии с конкретным стандартом на конкретный вид продукции. В случае, когда стандарт, где приведена информация о подготовке проб конкретного вида продукции, отсутствует, рекомендуется, чтобы заинтересованные стороны пришли к соглашению по данному вопросу.
9 Методика проведения испытания
9.1 Приготовление анализируемой пробы и исходной суспензии
9.1.1 Общие положения
Используют количество среды для обогащения, необходимое для получения окончательного разведения 10 первоначальной анализируемой пробы.
9.1.2 Приготовление анализируемых проб с предположительно высоким уровнем фоновой микрофлоры
В случае твердых проб пищевой продукции порцию анализируемой пробы (х г) в стерильных условиях переносят в мешок перистальтического смесителя, содержащий 9х см бульона mTSB, в который добавлен новобиоцин или акрифлавин (см. 5.1.1.4). Рекомендуется использовать мешки, оснащенные фильтрами.
Полученную смесь гомогенизируют в смесителе (см. 6.8; см. ISO 7218).
В случае жидких проб пищевой продукции порцию анализируемой пробы (х см) в стерильных условиях переносят в мешок перистальтического смесителя, содержащий 9х см
бульона mTSB для обогащения, в который добавлен новобиоцин или акрифлавин (см. 5.1.1.4).
9.1.3 Приготовление анализируемых проб, предположительно содержащих целевые бактерии, подвергнутые стрессу
Замороженные пробы размораживают при комнатной температуре, затем порцию анализируемой пробы (х г или х см) переносят в мешок перистальтического смесителя или пробирку, содержащую 9х см
BPW (см. 5.1.2) и далее действуют, как это описано выше.
9.2 Обогащение
9.2.1 Инкубирование
Содержимое мешка перистальтического смесителя, пробирки или флакона (см. 9.1.2) инкубируют при температуре (37±1)°С в течение 18-24 ч.
9.2.2 Контроль над процессом (для ПЦР в реальном времени)
Контроль над процессом выполняют в соответствии с положениями, изложенными в ISO 22174.
Руководство по внутреннему контролю амплификации (IAC) и контролю над процессом приведены в приложении D и С.3.8.
9.3 Выделение нуклеиновых кислот (ДНК)
Методики экстракции нуклеиновых кислот (ДНК) должны соответствовать методикам, применяемым в отношении грамотрицательных бактерий. Полный перечень методов приведен в [10]. Кроме того, допускается использовать имеющиеся в продаже наборы в соответствии с инструкциями изготовителя.
9.4 ПЦР-амплификация (для ПЦР в режиме реального времени)
9.4.1 Общие положения
Используемый процесс ПЦР-амплификации применяют при проведении ПЦР в режиме реального времени.
Необходимо выполнять все требования к ПЦР-амплификации, которые изложены в ISO 20838.
Информация о праймерах и зондах для обнаружения, использующихся при проведении ПЦР в режиме реального времени, приведена в приложении Е.
9.4.2 Обнаружение продуктов ПЦР
Прибор для обнаружения продуктов ПЦР улавливает световое излучение, как только оно возникает в процессе амплификации.
9.4.3 Интерпретация результатов ПЦР-анализа
Результаты, полученные при проведении ПЦР, в том числе контрольные, информация о которых приведена в ISO 22174 и в приложении D, обрабатывается программным обеспечением прибора для амплификации. В ходе процесса амплификации программное обеспечение прибора контролирует ПЦР-амплификацию с использованием 5'-нуклеазы посредством анализа интенсивности флуоресценции репортерного красителя для каждой пробы, ![]() - это разность
- это разность и контрольного значения интенсивности флуоресценции репортерного красителя, определенного в результате первых нескольких циклов. Значение порогового цикла,
, определяют как номер цикла, при котором значение интенсивности флуоресценции
данной пробы превышает установленное значение порогового цикла.
В случае, если были получены сомнительные результаты, проводят проверку кривых значений излучения на графике. Для проб, демонстрирующих положительный результат, характерна кривая, на которой явно выражено усиление флуоресценции, начиная с количества циклов, значения которых соответствуют .
Если полученные значения приводят к непредвиденным результатам, то анализ повторяют.
Данный метод является последовательным (см. блок-схему на рисунке А.1). Стадии данного метода следующие:
- стадия 1: обнаружение генов, кодирующих Шига-токсин и гена, кодирующего интимин (см. ПЦР А, приведено в приложении Е; данную процедуру можно также провести с помощью дуплексной ПЦР);
- стадия 2 а): проведение испытания проб, содержащих бактерии с генами stx и еае гена, на молекулярное серогруппирование (см. ПЦР Б, приведено в приложении Е);
- стадия 2 б): Выделение штаммов бактерий из проб, бактерии в которых содержат гены, кодирующие Шига-токсин; допускается использовать метод обогащения конкретных серогрупп (например, иммуномагнитное разделение) для повышения эффективности отделения клеток бактерий STEC от проб, содержащих хотя бы одну из серогрупп, приведенных в разделе 1 (см. 9.5 и рисунок В.1).
9.5 Выделение штаммов
Выделение штаммов бактерий STEC необходимо для подтверждения того, что положительный результат ПЦР-анализа получен из ДНК именно этих живых бактериальных клеток.
В случае наличия одного из генов, характерных для серогрупп, приведенных в разделе 1, допускается проведение обогащения конкретной серогруппы с целью повышения эффективности стадии выделения, после чего проводят прямой посев на подходящую плотную среду и скрининг колоний на наличие генов вирулентности.
Для подтверждения наличия генов вирулентности в выделенных колониях используют протоколы, описывающие проведение стандартной ПЦР, ПЦР в режиме реального времени (см. приложения С и Е), а также протокол проведения любого другого вида ПЦР, которая аналогична ранее указанным видам ПЦР.
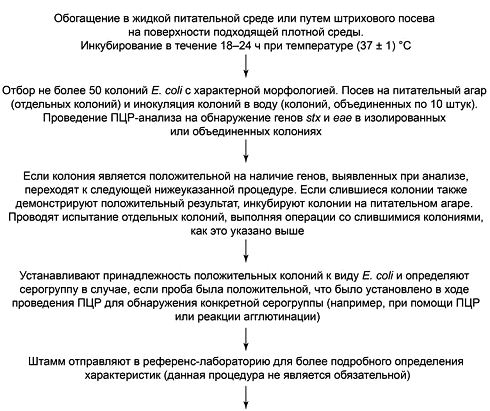
Блок-схема выделения бактерий STEC приведена на рисунке В.1, а методика данной процедуры - в приложении F.
10 Интерпретация результатов
a) Пробы, не содержащие бактерий с stx-геном: в х г или х см анализируемой пробы STEC не обнаружены (см. ISO 7218).
При отсутствии генов stx, проведение испытания прекращают и не проводят дальнейшего определения наличия гена еае и генов, присутствующих в серогруппах, приведенных в разделе 1.
В случае, когда не удалось провести выделение бактерий из проб, положительных на наличие stx-генов, тогда:
b) Пробы, положительные на наличие stx-генов: в х г или х см анализируемой пробы предположительно обнаружены STEC.
c) Пробы, положительные на наличие генов stx и еае: в х г или х см анализируемой пробы предположительно обнаружены STEC, вызывающие повреждение путем прикрепления бактерий и разрушения ими щеточной каймы эпителия клеток кишечника.
d) Пробы, положительные на наличие генов stx и еае, а также генов, характерных для одной из серогрупп, приведенных в разделе 1: в х г или х см анализируемой пробы предположительно обнаружена серогруппа STEC XX
.
_______________
XX - это серогруппа с искомыми генами.
В случае, когда удалось провести выделение и подтверждение бактерий из проб, положительных на наличие stx-генов, тогда:
e) Выделенные штаммы Е. coli, положительные на наличие stx-гена: наличие STEC в х г или х см анализируемой пробы.
f) Выделенные штаммы Е. coli, положительные на наличие генов stx и еае: в х г или х см анализируемой пробы обнаружены STEC, вызывающие повреждение путем прикрепления бактерий и разрушения ими щеточной каймы эпителия клеток кишечника.
g) Выделенные штаммы Е. Coli, положительные на наличие генов stx и еае, а также генов, характерных для одной из серогрупп, приведенных в разделе 1: обнаружена серогруппа STEC XX в х г или х см
анализируемой пробы.
_______________
Серогруппа, выделенный штамм которой используют для обнаружения присутствия соответствующих генов или при помощи фенотипичного определения.
11 Эксплуатационные характеристики
11.1 Метод ПЦР в режиме реального времени, установленный в настоящем стандарте, прошел процедуру валидационного исследования в соответствии с требованиями, приведенными в [17].
11.2 Чувствительность и предел обнаружения бактерий методом ПЦР в режиме реального времени были определены с помощью разведений плазмид, содержащих клонированные гены, кодирующие специализированную экспрессию (см. [8]). Результаты данного исследования приведены в таблице 1.
Таблица 1 - Чувствительность и предел обнаружения 5'-нуклеазы с помощью ПЦР для некоторых генов, рассматриваемых в настоящем стандарте (см. [8]).
Целевой ген | Предел обнаружения, количество копий за реакцию | Эффективность, % |
stx1 | 5 | 94,7 |
stx2 | 5 | 94,0 |
rfbE | 1 | 94,2 |
wbdl | 5 | 94,0 |
wzx | 5 | 97,7 |
ihp1 | 5 | 99,6 |
Дополнительное исследование (см. [17]) проводилось с целью определения эффективности предлагаемых подходов к проведению ПЦР в режиме реального времени при анализе смешанных культур серогрупп STEC, приведенных в области применения настоящего стандарта; при этом предполагается использовать лабораторный штамм К-12 (С600). Результаты исследования приведены в таблице 2.
Таблица 2 - Обнаружение малого числа бактерий STEC в смешанных культурах (см. [15])
Серотип STEC | КОЕ/см | Предел обнаружения | |||||||
stx1/ | еае | rfbE | wbd1 | wzx | ihp1 | fliC | wzx | ||
O26:Н11 | 2-3 | 28-31 | 31-32 | - | - | - | - | - | 31-33 |
10-20 | 25-27 | 28-29 | - | - | - | - | - | 29 | |
О103:Н2 | 2-3 | 29-30 | 31-32 | - | - | 32-33 | - | - | - |
10-20 | 26-27 | 29-30 | - | - | 29-31 | - | - | - | |
O111:[Н8] | 2-3 | 26-27 | 30-31 | - | 30-31 | - | - | - | - |
10-20 | 24-25 | 29-30 | - | 27-28 | - | - | - | - | |
O145:[Н28] | 2-3 | 32-33 | 31-32 | - | - | - | 31-34 | - | - |
10-20 | 30-32 | 29-31 | - | - | - | 30 | - | - | |
O157:Н7 | 2-3 | 29-30 | 29-31 | 31-32 | - | - | - | 33-38 | - |
10-20 | 26-28 | 26-29 | 29-31 | - | - | - | 31-33 | - | |
11.3 Исследование включало изучение комплекта из пяти имитационных каркасных тампонов (влажных губок), содержащих целевые микроорганизмы, в том числе серогруппы STEC О157 и О26, а также фоновую микрофлору (см. таблицу 3). При выборе имитационных каркасных тампонов в качестве матрицы для анализа руководствовались основными положениями (см. [19]).
Таблица 3 - Состав проб, исследованных в ходе межлабораторного испытания
Значения приведены в КОЕ/см
Загрязняющая микрофлора и гены | Проба А | Проба В | Проба С | Проба D | Проба Е |
STEC O157 | 2 | 2·10 | 20 | 0 | 0 |
STEC О26 | 0 | 40 | 4·10 | 40 | 0 |
E. coli | 10 | 10 | 10 | 10 | 10 |
К. pneumoniae | 2·10 | 2·10 | 2·10 | 2·10 | 2·10 |
S. faecalis | 5·10 | 5·10 | 5·10 | 5·10 | 5·10 |
В исследовании по определению Е. coli принимали участие 14 национальных референс-лабораторий (NRL). В ходе оценки эффективности данного метода при определении серогрупп STEC, отличных от серогруппы O157 (серогруппы O26) были получены следующие значения:
- Чувствительность (Se) - 100% (при доверительном интервале 95%, 96,97%-100%);
- Специфичность (Sp) - 99,62% (при доверительном интервале 95%, 97,5%-100%).
Результаты анализа, полученные в каждой национальной референс-лаборатории, принимавшей участие в исследовании, приведены в таблице 4.
Таблица 4 - Результаты обнаружения генов вирулентности и генов серогрупп в культурах после их обогащения методом ПЦР в режиме реального времени (часть метода анализа, проводившегося в ходе третьего совместного межлабораторного испытания)
Целевой ген | Проба | Лаборатории, принимавшие участие в исследовании | ||||||||||||||
stx | А | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
В | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |
С | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |
D | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |
Е | - | - | - | - | - | - | - | - | - | + | - | - | - | - | - | |
еае | А | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
В | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |
С | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |
D | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |
Е | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
Ген серогруппы О26 | А | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
В | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
С | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
D | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
Е | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
Ген серогруппы О111 | А | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
В | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
С | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
D | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
Е | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
Ген серогруппы О103 | А | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
В | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
С | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
D | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
Е | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
Ген серогруппы О145 | А | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - |
В | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
С | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
D | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
Е | - | - | - | - | - | - | - | - | - | - | - | - | - | - | - | |
| ||||||||||||||||
Национальные референс-лаборатории получили запрос, чтобы они также проводили выделение серогрупп STEC, отличных от серогруппы О157, которыми загрязнены пробы. Результаты данной процедуры приведены в таблице 5.
Таблица 5 - Выделение бактерий серогруппы STEC О26 из культур после их обогащения методом ПЦР в режиме реального времени (Подтверждение позитивных культур путем выделения инфекционных штаммов, проводившегося в ходе третьего совместного межлабораторного испытания)
Вид испытания | Проба | Истинное значение | Лаборатории, принимавшие участие в исследовании | |||||||||||||
Выделение серогруппы О26 | В | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
С | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |
D | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |
Отчет, включающий всесторонний анализ результатов, полученных в ходе третьего совместного межлабораторного испытания, имеется в открытом доступе (см. [9]).
Расширенная неопределенность , характеризующая концентрацию бактерий в инокуляте, равна 0,22·
КОЕ/см
для штаммов Е. coli (соответствующая информация приведена в [20]).
Приложение А
(обязательное)
Блок-схема процедуры проведения анализа
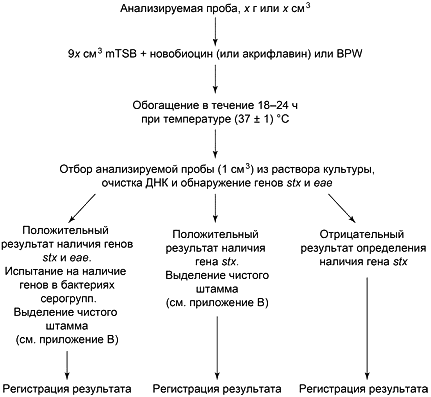
Рисунок А.1 - Блок-схема процедуры проведения анализа
Приложение В
(обязательное)
Блок-схема процедуры выделения и подтверждения
_______________
См. приложение F.
В.1 В случае, если проба положительная для одного из генов серогрупп, на которые распространяется данный метод, в целях повышения эффективности выделения бактерий допускается проводить обогащение бактерий определенных серогрупп.
Рисунок В.1 - Блок-схема процедуры выделения чистых штаммов и подтверждения результата
Приложение С
(справочное)
Идентификация Escherichia coli*, продуцирующих Шига-токсин (STEC), путем выявления генов вирулентности мультиплексной ПЦР-амплификацией и обнаружение продуктов ПЦР путем электрофореза в агарозном геле
_______________
* В оригинале слова "Escherichia coli" в наименовании приложения C выделены курсивом. - .
С.1 Общие положения
STEC являются штаммами Escherichia coli, которые позволяют внедряться лизогенным бактериофагам, имеющим гены, кодирующие синтез Шига-токсинов (см. [12]). Метод, описанный в настоящем приложении, позволяет обнаружить с помощью мультиплексной ПЦР наличие STX-кодирующих генов в культурах Е. coli, принадлежащих к STEC. Проводят также определение наличия гена еае, поскольку он присутствует в штаммах STEC, вызывающих тяжелые заболевания человека.
Использование пар олигонуклеотидных праймеров stx1F/stx1R и stx2F/stx2R (cм. [11]), позволяет обнаружить гены stx1 и stx2 соответственно. stx2F/stx2R позволяет обнаружить все варианты гена stx2, кроме stx2f. Тем не менее, это не является существенным для здоровья населения, так как данный вид гена в основном присутствует в STEC, выделенных из птиц (см. [20]). Праймеры, используемые для обнаружения гена еае (см. [11]), способны распознавать все описанные в публикациях полиморфные варианты этого гена.
Примечание - Метод, приведенный в настоящем приложении, используют в отношении чистых бактериальных культур только для подтверждения принадлежности выделенных штаммов.
С.2 Сокращения
О.П.: отдельная проба.
С.3 Порядок проведения метода
С.3.1 Сущность метода
Метод основан на ПЦР-амплификации специфических областей ДНК из ДНК-матрицы, с олигонуклеотидами, вызывая начало реакции ПЦР
Обнаружение stx1, stx2 и еае генов проводят с помощью мультиплексной ПЦР с использованием специфических праймеров (см. таблицу С.1). Метод состоит из следующих этапов:
- пробоподготовка;
- проведение ПЦР;
- визуализация продуктов ПЦР с помощью горизонтального электрофореза в агарозном геле.
С.3.2 Пробоподготовка
Полученные бактериальные культуры на твердых питательных средах, например на триптон-соевом агаре (TSA), обрабатывают следующим образом:
- отбирают одну колонию стерильной петлей, захватывающей объем 1 мм;
- пробоподготовка осуществляется путем суспендирования бактерий в 100 мм стерилизованной воды, деионизированной путем фильтрации через фильтр milliQ
с диаметром пор 0,22 мкм, с последующим кипячением в течение 10 мин.
_______________
MilliQ является торговым наименованием продукции, поставляемой Millipore Corporation. Данная информация приведена для удобства пользователей настоящим стандартом и не является рекламой ISO данной продукции. Допускается применение аналогичных продуктов, если доказано, что они обеспечивают получение сопоставимых результатов.
С.3.3 Проведение ПЦР
Для каждой пробы готовится отдельно 50 мм реакционной смеси, состоящей из реакционного буфера,
![]() в концентрации 1,2 ммоль/дм
в концентрации 1,2 ммоль/дм, дезоксинуклиотидфосфатаз (dNTP) в концентрации 0,2 ммоль/дм
каждой, 50 пмоль каждого праймера, 2 единицы Taq-полимеразы и 10 мм
ДНК-матрицы.
Объем реагентов зависит от конечного объема реакции. При проведении ПЦР-реакций используют деионизованную воду, указанную в С.3.2.
Проведение каждой ПЦР включает в себя положительный и два отрицательных контроля. ДНК-матрицу для положительного контроля получают из штамма E.coli, гарантированно содержащего гены вирулентности, в то время как отрицательным контролем служит ДНК-изолят от непатогенных штаммов E.coli (не несущих в своем геноме генов вирулентности), вторым отрицательным контролем служит реакционная смесь без добавления матричной ДНК.
Проведение реакции происходит в амплификаторе с запрограммированным тепловым профилем (см. [11] и таблицу С.1).
С.3.4 Электрофорез в агарозном геле
Готовят раствор агарозы в концентрации 20 г/дм в однократном трис/борат/ЭДТА (ТВЕ) или трис/этилацетат/ЭДТА (ТАЕ) буфере. Заполняют каждую лунку затвердевшего агарозного геля продуктами ПЦР в объеме 15 мм
, смешанных с красителем. Электрофорез проводят в однократном буфере (ТВЕ или ТАЕ) при постоянном напряжении (100 V). Использование маркера молекулярного веса позволяет определить необходимые молекулярные массы полученных ампликонов (см. таблицу С.1).
Примечание - Правильное определение полос в агарозном геле, после проведения электрофореза, является важным моментом в оценке наличия генов вирулентности. Убедитесь, что полосы, полученные на положительном контроле, точно соответствуют определенной молекулярной массе.
В агарозный гель необходимо добавить бромистый этидий для визуализации продуктов ПЦР. При воздействии на данный реактив ультрафиолетового излучения он флуоресцирует красно-оранжевым цветом. Конечная концентрация бромистого этидия составляет 0,5 мкг/см при добавлении перед заливкой агарозного геля в планшет для гель-электрофореза.
В качестве альтернативы допускается окрашивание агарозного геля после электрофореза в водном растворе этидий бромида концентрацией 0,5 мкг/см.
С.3.5 Оборудование
Используют обычное оборудование, необходимое для микробиологической лаборатории (см. ISO 7218) и, в частности, следующее.
С.3.5.1 Ламинарный бокс для ПЦР.
С.3.5.2 Дозатор, вместимостью 1 см стерильный.
С.3.5.3 Стерильные бактериологические петли.
С.3.5.4 Флаконы из боросиликатного стекла, вместимостью 500 см.
С.3.5.5 Цилиндры из боросиликатного стекла, вместимостью 500 см.
С.3.5.6 Цилиндры из боросиликатного стекла, вместимостью 1 дм.
С.3.5.7 Термостат, способный поддерживать температуру на уровне (37±1)°С.
С.3.5.8 Технические настольные весы.
С.3.5.9 Автоклав.
С.3.10* Устройство для раскапывания.
_______________
* Нумерация соответствует оригиналу. - .
С.3.5.11 Микропипетки.
С.3.5.12 Наконечники для микропипеток, стерильные.
С.3.5.13 Микропробирки, вместимостью 1,5 см.
С.3.5.14 Микропробирки для ПЦР, вместимостью 0,2 или 0,5 см.
С.3.5.15 Амплификатор.
С.3.5.16 Магнитная мешалка.
С.3.5.17 Магнитное устройство для перемешивания.
С.3.5.18 Деионизатор воды.
С.3.5.19 Камера для электрофореза.
С.3.5.20 УФ-трансиллюминатор.
С.3.5.21 Льдогенератор.
С.3.5.22 Микроволновая печь.
С.3.6 Реактивы и среды
В ходе анализа, если не указано иное, используются реактивы ч.д.а. и стерильная дистиллированная или деминерализованная вода или вода эквивалентной чистоты.
С.3.6.1 Агар микробиологический.
С.3.6.2 Раствор dNTP.
С.3.6.3 Синтетические олигонуклеотидные праймеры.
С.3.6.4 Taq ДНК-полимераза и десятикратный реакционный буфер с или без ![]() .
.
С.3.6.5 Буфер для электрофореза.
С.3.6.6 Маркер молекулярного веса ДНК.
С.3.6.7 Краситель для внесения в продукты ПЦР.
С.3.6.8 Агароза.
С.3.6.9 Раствор этидия бромида или другой краситель ДНК в геле.
С.3.7 Безопасность и защитные устройства
Некоторые штаммы STEC могут инфицировать людей при очень низкой инфекционной дозе и могут вызвать серьезные заболевания. Были зарегистрированы случаи инфицирования в лаборатории. Поэтому, работая с STEC, требуются профессиональные навыки работы в лаборатории и использование защитных устройств. Этидия бромид является мутагенным и токсичным реагентом, поэтому им необходимо пользоваться соблюдая технику безопасности и применяя средства защиты (лабораторный халат и латексные перчатки). Ультрафиолетовое излучение может привести к повреждению глаз, в связи с этим является обязательным использование полиметилметакрилатных щитов и защитных очков.
С.3.8 Штаммы микроорганизмов и контроли для ПЦР
В качестве положительного контроля используют STEC штаммы микроорганизмов несущие в своем геноме гены stx1, stx2 и гены еае. Примером может служить эталонный штамм E. coli O157 EDL933 (WDCM 00188, см. [12], [13]).
В качестве отрицательного контроля следует использовать любой штамм E. coli К12, например, MG1655.
Контроли для ПЦР получают, как указано в С.3.2. Контроли могут быть подготовлены заранее и хранится в аликвотах по 10 мм, готовых к использованию при температуре минус 20°С в течение 8 мес.
С.3.9 Интерпретация результатов
Пробы, показывающие фрагменты амплификации ожидаемого размера (см. С.3.4 и в таблице С.1), считаются положительными на наличие в своем геноме целевых генов.
Необходимо включать положительные и отрицательные контроли в каждой реакции, давая положительные и отрицательные результаты, соответственно. Если контроли дают неоднозначные результаты, необходимо повторить всю процедуру анализа.
Проверка правильности ампликона с помощью прямого секвенирования или других подходящих способов можно считать излишним, так как этот метод предназначен для подтверждения штаммов, выделенных и уже подвергшихся ПЦР-анализу в режиме реального времени.
Подтверждение ампликонов (например, путем прямого секвенирования или путем анализа эндонуклеазы рестрикции) необходимо проводить при получении неоднозначных результатов.
Таблица С.1 - Олигонуклиотидные праймеры, получаемые фрагменты ожидаемого размера
Целевой ген | Название праймеров (см. [11]) | Последовательность праймеров | Размер ампликонов, bp |
еае | eaeAF | GAC CCG GCA CAA GCA TAA GC | 384 |
eaeAR | CCA CCT GCA GCA АСА AGA GG | ||
stx1 | stx1F | ATA AAT CGC CAT TCG TTG ACT AC | 180 |
stx1R | AGA ACG CCC ACT GAG АТС АТС | ||
stx2 (группа) | stx2F | GGC ACT GTC TGA AAC TGC TCC | 255 |
stx2R | TCG CCA GTT АТС TGA CAT TCTG | ||
Параметры амплификации (см. [11]): 35 циклов ПЦР, каждый из которых включает 1 мин денатурации при температуре 95°С; 2 мин отжига при температуре 65°С в течение первых 10 циклов, уменьшая температуру до 60°С с 11 до 15 цикла (1°С за цикл) и 1,5 мин относительного удлинения при температуре 72°С, увеличивая до 2,5 мин с 25 до 35 цикла. | |||
Приложение D
(справочное)
Внутренний контроль амплификации
Три различных внутренних контроля элементов амплификации (lACs) могут быть использованы в ПЦР в режиме реального времени:
- TaqMan® представляет собой внутренний положительный контроль. Это комплект реагентов, включающий в себя все необходимые реагенты (праймеры, Vic™
IAC ДНК-мишень и стоп-раствор). IAC ДНК-мишень требует разбавления в 10 раз, для достижения количества копий примерно для 100 ПЦР-реакции. Размер образующегося ПЦР продукта неизвестен.
_______________
TaqMan и Vic являются торговыми наименованиями продукции, поставляемой Applied Biosystems. Данная информация приведена для удобства пользователей настоящим стандартом и не является рекламой ISO данной продукции. Допускается применение аналогичных продуктов, если доказано, что они обеспечивают получение сопоставимых результатов.
- Использование формулы pUC 19 на основе внутреннего контроля амплификации IAC [27]. Приблизительно 100 копий целевой ДНК (PUC 19) следует использовать в реакции ПЦР. Размер образующегося ПЦР продукта IAC составляет 119 bp.
- Рекомбинантную плазмиду (имеющую название Piac-STEC) можно использовать в конкретных анализах stx с помощью ПЦР в режиме реального времени. Этот элемент IAC содержит следующий ДНК-фрагмент, клонированный в позицию EcoRI плазмиды pUC19:
5'ATTTTTGTTACTGTGACAGCTGAAGCTTTACGTGAATCGCCAGCGGCATCAGCACCTTGTCGCCTTGCGTATAGATGTTGATCTTACATTGAACTGGGGAATT-3' (жирным шрифтом выделены прямой и обратный stx1/stx2 праймеры, связывающие сайты последовательности; подчеркнутая последовательность: IAC-зонд сайт связывания).
IAC может быть усилен генами stx, используя те же праймеры, для stx генов (см. приложение Е), с теми же условиями и в той же ПЦР-пробирке [14]. Он обнаруживает специфическую ДНК в пробе (5' [Red640]-CAAGGCGACAAGGTGCTGATGCCG-[BHQ2] 3'), включенного в смесь ПЦР в концентрации, идентичной что и для зондов ДНК генов stx1 и stx2 (как помечены [флюоресцином] и [BHQ1] на их 5'- и 3'-концах соответственно). В общей сложности 64 копий IAC следует использовать в реакции ПЦР. Продукт ПЦР МАК96 парных оснований. Производительность в результате stx-IAC ПЦР в режиме реального времени было показано с помощью искусственно и естественно загрязненных проб пищевых продуктов (см. [5]).
Вторая и третья системы также могут быть использованы в качестве контроля экстракции путем добавления 100 копий плазмиды pUC 19 или plAC-STEC в пробу перед стадией очистки ДНК.
Приложение Е
(справочное)
Праймеры и зонды для ПЦР-анализа
Описанный протокол ПЦР в режиме реального времени основан на использовании следующих праймеров и зондов, которые должны рассматриваться в качестве контрольных реактивов. Тем не менее, другие методы, включающие использование различных праймеров и зондов, могут быть использованы при условии, что они были признаны эквивалентными тем, которые указаны в таблицах Е.1 и Е.2 в соответствии с [17].
Е.1 Праймеры и зонды
Последовательности праймеров и зондов, представленные в таблицах Е.1 и Е.2, используют для:
- выявления генов stx и еае с помощью ПЦР в режиме реального времени (ПЦР А);
- выявления генов, которые содержат определенные серогруппы, с помощью ПЦР в режиме реального времени (ПЦР Б).
В таблицах Е.1 и Е.2 не указаны вид репортера и вид флуорофора, так как это во многом зависит от оборудования для ПЦР в режиме реального времени, используемого в каждой конкретной лаборатории.
Таблица Е.1 - Праймеры и зонды, используемые для 5'-нуклеазой ПЦР
Целевой ген | Прямой праймер, обратный праймер и последовательность зондов (5'-3') | Размер ампликона bp | Локализация в геноме | Порядковый номер в базе GenBank |
stx1 [3] | ТТТ GTY ACT GTS АСА GCW GAA GCY ТТА CG | 131 | 878-906 | М16625 |
ССС CAG ТТС ARW GTR AGR ТСМ ACR ТС | 983-1008 | |||
Зонд - CTG GAT GAT СТС AGT GGG CGT ТСТ TAT GTAA | 941-971 | |||
stx2 | ТТТ GTY ACT GTS АСА GCW GAA GCY ТТА CG | 128 | 785-813 | Х07865 |
ССС CAG ТТС ARW GTR AGR TCM ACR TC | 887-912 | |||
Зонд - TCG TCA GGC ACT GTC TGA AAC TGC TCC | 838-864 | |||
еае [2] | CAT TGA TCA GGA TTT TTC TGG TGA ТА | 102 | 899-924 | Z11541 |
СТС ATG CGG AAA TAG CCG TTA | 1000-979 | |||
Зонд - ATA GTC TCG CCA GTA TTC GCC ACC AAT ACC | 966-936 | |||
| ||||
| ||||
Таблица Е.2 - Праймеры и зонды используемые для усиления антиген-специфических генов при проведении ПЦР-анализа с использованием 5'-нуклеазы
Целевой ген (серогруппы) | Прямой праймер, обратный праймер и последовательность зондов (5'-3') | Размер ампликона bp | Локализация в геноме | Порядковый номер в базе GenBank |
rfbE (O157) [3] | ТТТ САС ACT TAT TGG ATG GTC TCAA | 88 | 348-372 | AF163329 |
CGA TGA GTT TAT CTG CAA GGT GAT | 412-435 | |||
Зонд - AGG ACC GCA GAG GAA AGA GAG GAA TTA AGG | 381-410 | |||
wbdl (O111) [3] | CGA GGC AAC АСА TTA TAT AGT GCT TT | 146 | 3464-3489 | AF078736 |
TTT TTG AAT AGT TAT GAA CAT CTT GTT TAGC | 3579-3609 | |||
Зонд - TTG AAT CTC CCA GAT GAT CAA CAT CGT GAA | 3519-3548 | |||
wzx (O26) [3] | CGC GAC GGC AGA GAA AATT | 135 | 5648-5666 | AF5290801 |
AGC AGG CTT TTA TAT TCT CCA ACT TT | 5757-5782 | |||
Зонд - CC CGT TAA АТС AAT ACT ATT TCA CGA GGT TGA | 5692-5724 | |||
ihp1 (O145) [3] | CGA TAA TAT TTA CCC CAC CAG TAC AG | 132 | 1383-1408 | AF531429 |
CC GCC GCA ATG CTT | 1500-1514 | |||
Зонд - CCG CCA TTC AGA ATG CAC АСА ATA TCG | 1472-1498 | |||
wzx (O103) [4] | CAA GGT GAT TAC GAA AAT GCA TGT | 99 | 4299-4323 | AY532664 |
GAA AAA AGC ACC CCC GTA CTT AT | 4397-4375 | |||
Зонд - AT AGC CTG TTG TTT TAT | 4356-4373 |
Приложение F
(обязательное)
Выделение чистых штаммов STEC
Данную методику используют для выделения чистых штаммов STEC из проб, положительно прореагировавших на ПЦР в режиме реального времени.
a) В случае положительного результата о присутствии одного из генов, связанных с серогруппами рассматриваемых в рамках настоящего стандарта, проводится процедура обогащения, для облегчения выделения STEC (см. примечание 1).
b) Обогащение проводится на культуральных средах для обогащения SSE или на ТВХ или другой подходящей среде (см. примечание 2). Инкубируют в течение 18 ч до 24 ч при температуре (37±1)°С.
c) 50 колоний Е. coli с характерной морфологией или с характерными признаками (см. примечание 5) снимают с питательного агара (NA) (см. примечание 3) и переносят в пробирки с водой (колонии могут быть объединены в воде в общей сложности по 10).
d) Проводят детекцию на наличие stx-кодирующих генов в изолированных колониях, перенесенных в воду (см. примечание 4).
e) Если проба будет положительной, высевают клетки на питательный агар для анализа отдельных колоний, чтобы выделить одну положительную колонию.
f) Идентифицируют колонии, как Е. coli, и подтверждают наличие еае-гена и принадлежность к серогруппе (например, с помощью ПЦР в режиме реального времени (см. приложении F, а также примечание 5).
g) Изоляты ДНК могут быть отправлены в референс-лабораторию для дальнейшего подтверждения.
Примечание 1 - Обогащение конкретных серогрупп можно провести с помощью иммунологических систем, таких как IMS или ее эквивалентов, при этом, как правило, следуют инструкциям производителя.
Примечание 2 - Для подтверждения принадлежности проб к О157 серогруппе применяют [19] или альтернативные методы, валидированые в соответствии с [18]. Принадлежность к сорбитол-ферментирующим Е. coli серогруппы О157 определяют наличием теллурита, используя селективную среду СТ SMAC согласно [19]. Поэтому является целесообразным использование дублирующей чашки Петри с SMAC без антибиотиков.
Для выделения STEC, принадлежащих к серогруппе О26, используют селективную плотную питательную среду (МакКонки), которая содержит рамнозу вместо лактозы (RMAC). Это очень эффективный способ выявления штаммов STEC серогруппы О26, которые не ферментируют рамнозу в отличие от других видов Е. coli.
Примечание 3 - Существует несколько типов питательных сред на основе агара, либо в виде готовых к использованию чашек или для приготовления в лаборатории из сухих порошков. Каждый тип неселективной питательной агаровой среды (например, TSA) подходит для целей выращивания колонии для дальнейшей дифференциации. Также можно использовать энтерогемолизический агар. Это имеет преимущество, так как способность продуцировать энтерагемолезин является общим признаком STEC патогенных для человека.
Примечание 4 - ПЦР в режиме реального времени, описанная в данном стандарте может быть использована для подтверждения наличия генов stx и еае в геноме клеток выделенных штаммов. Стандартная ПЦР может быть использована в качестве альтернативы (см. приложение В).
Примечание 5 - Подтверждение принадлежности колоний к Е. coli можно провести при использовании любого коммерческого биохимического анализа, либо по способности клеток выделять индол. Дифференциация по серогруппам может быть проведена либо с помощью ПЦР, либо с помощью реакции агглютинации с использованием коммерческой антисыворотки.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего межгосударственного стандарта |
ISO 7218 | IDT | ГОСТ ISO 7218-2015 "Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям" |
ISO 20838 | - | * |
ISO 22174 | - | * |
* Соответствующий межгосударственный стандарт отсутствует. До его принятия рекомендуется использовать перевод на русский язык данного международного стандарта. Официальный перевод данного международного стандарта находится в Федеральном информационном фонде стандартов. | ||
Библиография
[1] | Scientific Opinion of the Panel on Biological Hazards (BIOHAZ) - Monitoring of verotoxigenic Escherichia coli (V TEC) and identification of human pathogenic V TEC types (Quest i on N о EFSA-Q-20 07-03 6). Eur. Food Saf. Author. J. 2007, (579), pp.1-61 |
[2] | Nielsen, E.M., Andersen, M.T. Detection and characterization of verocytotoxin-producing Escherichia coli by automated 5' nuclease PCR assay. J. Clin. Microbiol. 2003, 41, pp.2884-2893 |
[3] | Perelle, S., Dilasser, F., Grout, J., Fach, P. Detection by 5' nuclease PCR of Shiga-toxin producing Escherichia coli O26, O55, O91, O103, O111, O113, O145 and O157:H7, associated with the world'smost frequent clinical cases. Mol. Cell Probes 2004, 18, pp.185-192 |
[4] | Perelle, S., Dilasser, F., Grout, J., Fach, P. Detection of Escherichia coli serogroup O103 by realtime polymerase chain reaction. J. Appl. Microbiol. 2005, 98, pp.1162-1168 |
[5] | Vimont, A., Delignette-Muller, M.L., Vernozy-Rozand, С. Supplementation of enrichment broths by novobiocin for detecting Shiga toxin-producing Escherichia coli from food: A controversial use. Lett. Appl. Microbiol. 2007, 44, pp.326-331 |
[6] | Uemura, R., Sueyoshi, M., Nagayoshi, M., Nagatomo, H. Antimicrobial susceptibilities of Shiga toxin producing Escherichia coli isolates from pigs with edema disease in Japan. Microbiol. Immunol. 2003, 47, pp.57-61 |
[7] | Validation AFNOR des methodes alternatives d'analyse: Application a la microbiologie alimentaire [AFNOR validation of alternative analytical methods: Application to food microbiology]. Quimper: Adria Developpement. 56 p. Available (viewed 2012-10-17) at: http://www.afnor-validation.org/rapports-synthese/GENESYSTEMS/Synt%20GEN%2025- 06%2011-08%20(fr).pdf |
[8] | KagKli, d.-m, Weber, t.P., van den bulcKe, m., Folloni, s., tozzoli, r., morabito, s., ermolli, m.gribaldo, I., van den eede, g. Application of the modular approach to an in-house validation study of real-time PCR methods for the detection and serogroup determination of verocytotoxigenic Escherichia coli. Appl. Environ. Microbiol. 2011, 77, pp.6954-6963 |
[9] | EUROPEAN UNION REFERENCE LABORATORY VTEC. Proficiency tests and ring trials on detection and typing methods. Rome: Istituto Superiore di Sanita. Available (viewed 2012-10-17) at: http://www.iss.it/vtec/neww/cont.php?id147&lang2&tipo15 |
[10] | Sambroo K.J., Russel., D.W. Molecular cloning: A laboratory manual, 3rd edition, 3 vols. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press, 2001 |
[11] | Paton, A.W., Paton, J.С. Detection and characterization of Shiga toxigenic Escherichia coli by using multiplex PCR assays for stx1, stx2, eaeA, enterohemorrhagic E. coli hlyA, r f b O111, and r f b O157. J. Clin. Microbiol. 1998, 36, pp.598-602 |
[12] | O'Brien, A.D., NeWland, J.W., Miller, S.F., Holmes, R.K., Smith, H.W., Formal, S.B. Shiga-like toxinconverting phages from Escherichia coli strains that cause hemorrhagic colitis or infantile diarrhea. Science 1984, 226, pp.694-696 |
[13] | Perna, N.T., PlunKett, iii, g., burland, v., mau, b., glasner, J.d., rose, d.J., et al. Genome sequence of enterohaemorrhagic Escherichia coli О157:H7. Nature 2001, 409, pp.529-533 |
[14] | HoorFar, J., Malorny, В., AbdulmaWJood, A., CooK, N., Wagner, M., Fach, P. Practical considerations in design of internal amplification controls for diagnostic PCR assays. J. Clin. Microbiol. 2004, 42, pp.1863-1868 |
[15] | Beutin, L., Jahn, S., Fach, P. Evaluation of the 'GeneDisc' real-time PCR system for detection of enterohaemorrhagic Escherichia coli (EHEC) О26, O103, O111, O145 and O157 strains according to theirvirulence markers and their O- and H-antigen-associated genes. J. Appl. Microbiol. 2009, 106, pp.1122-32 |
[16] | ISO 7550 Лабораторная посуда - Одноразовые микропипетки |
[17] | ISO 16140:2003 Микробиология пищевых продуктов и кормов для животных. Протокол валидации, альтернативные методы |
[18] | ISO 16140-2 Микробиология пищевых продуктов и кормов для животных. Проверка Способ - Часть 2: Протокол для проверки собственных методов против эталонного метода |
[19] | ISO 16654 |
[20] | ISO/TS 19036:2006 Микробиология пищевых продуктов и кормов для животных. Руководящие принципы для оценки погрешности измерения для количественных определений |
[21] | ISO 20837 Микробиология пищевых продуктов и кормов для животных. Полимеразная цепная реакция (ПЦР) для обнаружения пищевых патогенов - Требования к подготовке образцов для качественного обнаружения |
[22] | Scheutz, F., teel, l.d., beutin, I., Pierard, d., buvens, g., Karch, h., mellmann, a., caPrioli, a., tozzoli, r., morabito, s., strocKbine, n.a., melton-celsa, a.г., sanchez, m., Persson, s., o'brien, a.d. A multi-center evaluation of a sequence-based protocol to subtype Shiga toxins and standardize Stx nomenclature. J. Clin. Microbiol. 2012 Jul 3 |
[23] | National center For emerging and zoonotic inFectious diseases. division oF Foodborne, Waterborne, and environmental diseases. National Enteric Disease Sur veillance: Shiga toxin-producing Escherichia coli (STEC) Annual Summary, 2009. Bethesda, MD: CDC, 2012 |
[24] | EuroPean Food saFety authority and euroPean centre For disease Prevention and control. The European Union Summary Report on Trends and Sources of Zoonoses, Zoonotic Agents and Food-borne Outbreaks in 2010. Eur. Food Saf. Author. J. 2012, 10, p.2597 |
[25] | EuroPean Food saFety authority. Technical specifications for the monitoring and reporting of verotoxigenic Escherichia coli (VTEC) on animals and food (VTEC surveys on animals and food). Eur. Food Saf. Author. J. 2009, 7, p.1366 |
[26] | Schmidt, h., scheeF, J., morabito, s., caPrioli, a., Wieler, l.h., Karch, h. A new Shiga toxin 2 variant (Stx2f) from Escherichia coli isolated from pigeons. Appl. Environ. Microbiol. 2000, 66, pp.1205-8 |
[27] | Fricker, m., messelhusser, u., busch, u., scherer, s., ehling-schulz, m. Diagnostic real-time PCR assays for the detection of emetic Bacillus cereus strains in foods and recent food-borne outbreaks. Appl. Environ. Microbiol. 2007, 73, pp.1892-1898 |
_______________
Ввиду того, что на момент времени публикации ISO/TS 13136:2012 действовал только один ([19]), в котором приведен эталонный метод обнаружения серогруппы Е. Coli O157 в пищевых продуктах, рассматриваемый метод был валидирован и сертифицирован только в рамках валидации NF (см. [7]) в отношении обнаружения STEC только серогруппы O157.
В соответствии с данным исследованием часть метода, касающаяся серогруппы STEC O157, была сертифицирована AFNOR как эквивалентная методу, приведенному в международном стандарте [17] (номер сертификата - GEN 25/04-11/08). Исчерпывающая информация по валидации приведена в [7].
УДК 579.672:006.354 | МКС 07.100.30 | IDT |
Ключевые слова: пищевая продукция, корма для животных, микробиология пищевой продукции и кормов для животных, полимеразная цепная реакция в режиме реального времени, определение патогенных микроорганизмов, горизонтальный метод определения Escherichia coli, Шига-токсин, STEC, серогруппы О157, О111, О26, О103, О145, амплификация | ||
Редакция документа с учетом
изменений и дополнений подготовлена