ГОСТ 34896-2022
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЙ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКА
Сенсибилизация кожи in vitro
МЕТОД ОПРЕДЕЛЕНИЯ ЛЮЦИФЕРАЗЫ ARE-NRF2
Methods for studying the effects of chemicals on the human body. In Vitro Skin Sensitisation ARE-Nrf2. Luciferase Test Method
МКС 71.040.10;
13.020.01
Дата введения 2024-05-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены".
Сведения о стандарте
1 ПОДГОТОВЛЕН республиканским унитарным предприятием "Белорусский государственный институт метрологии" (БелГИМ) на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 5
2 ВНЕСЕН Государственным комитетом по стандартизации Республики Беларусь
3 ПРИНЯТ Евразийским советом по стандартизации, метрологии и сертификации по результатам голосования в АИС МГС (протоколом от 30 сентября 2022 г. N 154-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | ЗАО "Национальный орган по стандартизации и метрологии" Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Кыргызстан | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 16 ноября 2023 г. N 1410-ст межгосударственный стандарт ГОСТ 34896-2022 введен в действие в качестве национального стандарта Российской Федерации с 1 мая 2024 г.
5 Настоящий стандарт является модифицированным по отношению к международному документу OECD 442d:2018* "Руководство по тестированию химической продукции. Сенсибилизация кожи in vitro. Метод определения люциферазы ARE-Nrf2" ("OECD Guidelines for the testing of chemicals - In Vitro Skin Sensitisation - ARE-Nrf2 Luciferase Test Method", MOD) путем изменения его структуры для приведения в соответствие с правилами, установленными в ГОСТ 1.5 (подразделы 4.2 и 4.3).
Наименование настоящего стандарта изменено относительно наименования указанного международного документа для увязки с наименованиями, принятыми в существующем комплексе межгосударственных стандартов.
Международный документ разработан Международной организацией экономического сотрудничества и развития (OECD).
Сопоставление структуры настоящего стандарта со структурой указанного международного документа приведено в дополнительном приложении ДА
6 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты".
Введение
Активация кератиноцитов. Руководство по проведению испытаний на основе ключевых событий
Под веществом, способным вызвать сенсибилизацию кожи в соответствии с положениями Согласованной на Глобальном уровне Системы классификации и маркировки химических веществ Организации Объединенных Наций (СГС ООН) [1], принято понимать вещество, воздействие которого при его повторяющемся контакте с кожей может приводить к развитию аллергической реакции. Существует соглашение среди специалистов относительно ключевых биологических событий, лежащих в основе появления сенсибилизации кожи. Современные знания о химических и биологических пределах, связанных с сенсибилизацией кожи, были обобщены в виде пути неблагоприятного исхода (АОР) [2], начинающегося с исходного молекулярного события, включающего промежуточные события, и заканчивающегося неблагоприятным исходом, а именно появлением признаков аллергического контактного дерматита. Данный АОР предназначен для химической продукции, которая реагирует с тиолами (т.е. цистеином) и первичными аминами (т.е. лизином), например органической. В данном случае в роли исходного молекулярного события (т.е. первого ключевого события) выступает реакция ковалентного связывания электрофильных веществ с нуклеофильными центрами белков кожи. Второе ключевое событие в данном АОР развивается в кератиноцитах и включает как воспалительный ответ, так и изменение в экспрессии генов, связанное специфическим путем передачи сигналов клеток, таких как пути, зависящие от элемента антиоксидантного/электрофильного ответа (antioxidant/electrophile response element - ARE). Третьим ключевым событием является активация дендритных клеток, и обычно она оценивается по экспрессии специфических поверхностных клеточных маркеров, хемокинов и цитокинов. Четвертое ключевое событие - это пролиферация Т-клеток [3].
Испытания in vitro методом KeratinoSens™ на основе сигнального пути ARE-Nrf2 с использованием люциферазы считаются научно обоснованными. Метод KeratinoSens™ первым был подвергнут валидационным испытаниям с последующим вынесением независимой экспертной оценки Научно-консультативным комитетом EURL ECVAM (ESAC) и получением официального одобрения со стороны EURL ECVAM, что позволило в дальнейшем рассматривать данный метод в качестве валидированного референтного метода (validated reference method - VRM) [3], [4], [5], [6]. Метод LuSens на основе сигнального пути ARE-Nrf2 с использованием люциферазы также был подвергнут валидационному испытанию с применением действующих стандартов результативности, результаты которого после проведенного анализа легли в основу еще одного положительного заключения ESAC [7], [8], [9], [10].
Методы испытаний, включенные в настоящий стандарт, могут различаться как в части содержания процедур, используемых для получения необходимой информации, так и в части выбора измеряемых показателей. Применение любого из них обеспечивает выполнение установленных на национальном уровне требований к результатам испытаний химической продукции на способность вызывать активацию кератиноцитов, выступающую в качестве одного из ключевых событий АОР для сенсибилизации кожи, чему в значительной степени способствует соблюдение принципа взаимного признания данных.
1 Область применения
Настоящий стандарт устанавливает методы испытаний in vitro, направленные на изучение механизмов, действием которых обусловлено второе ключевое событие АОР для сенсибилизации кожи, а именно активация кератиноцитов [2]. Представленные методы испытаний обеспечивают возможность классификации химической продукции, способной и не способной вызывать сенсибилизацию кожи, в соответствии с СГС ООН [1]. В настоящее время в стандарте описаны следующие методы испытаний:
- метод исследования KeratinoSens™ на основе сигнального пути ARE-Nrf2 с использованием люциферазы (3.2);
- метод исследования LuSens на основе сигнального пути ARE-Nrf2 с использованием люциферазы (3.3).
2 Термины, определения и сокращения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 валидированный референтный метод (validated reference method (VRM)): Первый(ые) метод (ы), официально признанный(ые) научно обоснованным(ыми) и используемый(ые) в качестве эталонного(ых) для целей валидационных испытаний прочих методов на основе их рабочих характеристик.
2.2 вещество (substance): Химические элементы и их соединения, представленные в естественном состоянии или полученные при выполнении производственного процесса, включая любые добавки, необходимые для сохранения стабильности продукта, а также любые примеси, наличие которых обусловлено применяемым процессом, но исключая любые растворители, удаление которых не сказывается на стабильности вещества или на его составе [1].
2.3 воспроизводимость (reproducibility): Согласованность результатов, получаемых при повторном испытании одного и того же вещества с применением одного и того же протокола (см. "Надежность") [21].
2.4 достоверный метод исследования (valid test method): Метод исследования, признаваемый в достаточной степени релевантным и надежным для применения в конкретной области и базирующийся на научно обоснованных принципах. Ни один метод исследования не является достоверным в абсолютном смысле и может рассматриваться как таковой только для ограниченной области применения [21].
2.5 интегрированный подход к испытаниям и оценке; IATA (Integrated Approach on Testing and Assessment): Структурированный подход, служащий для определения степени опасности (потенциала), описания характера опасности (способности) и/или оценивания безопасности (в зависимости от потенциала/способности и экспозиции) химической продукции или групп химической продукции, который заключается в стратегическом интегрировании и взвешивании всех значимых данных для обобщения информации с целью принятия решения нормативного характера о потенциальной опасности, рисках и необходимости проведения дальнейших целенаправленных и, соответственно, минимально достаточных по объему испытаний.
2.6 исследуемая химическая продукция (test chemical): Химическая продукция (вещества или смеси), которая подвергается испытаниям.
2.7 коэффициент вариации (coefficient of variation): Мера изменчивости, рассчитываемая для группы данных, характеризующих параллельно обрабатываемые пробы, путем деления значения стандартного отклонения на среднее значение. Значение данного коэффициента может быть выражено при умножении на 100.
2.8 контрольная проба растворителя/вещества-носителя (solvent/vehicle control): Ничем не обработанная проба, включающая в себя все составляющие испытательной системы, содержащая растворитель или вещество-носитель и используемая наряду с пробами, содержащими исследуемое вещество, и другими контрольными пробами для определения базового отклика для образцов, обработанных исследуемым веществом, разведенным в том же растворителе или веществе-носителе. При параллельном использовании с отрицательной контрольной пробой также позволяет выяснить, взаимодействует ли растворитель или вещество-носитель с испытательной системой.
2.9 кратное повышение уровня индукции активности люциферазы (fold luciferase activity induction): Отношение люминесценции обработанных клеток (минус контрольная проба) к люминесценции клеток, подвергшихся одновременному действию контрольной пробы растворителя/вещества-носителя (минус контрольная проба).
2.11 надежность (reliability): Показатель того, что метод испытаний может быть реализован с получением воспроизводимых результатов в рамках одной или различных лабораторий в течение продолжительного времени при применении одного и того же протокола. Он оценивается путем вычисления внутри- и межлабораторной воспроизводимости и внутрилабораторной повторяемости [21].
2.12 не содержащий ксенобиотиков (xeno-free): Материал, в котором отсутствуют какие-либо составляющие, не принадлежащие тому же виду, что и используемые клетки, в рассматриваемом случае - человеческие.
2.13 однокомпонентное вещество (mono-constituent substance): Вещество, характеризуемое количественным составом, в котором одна основная структурная составляющая содержится в количестве не менее чем 80% (по массе).
2.14 опасность (hazard): Изначально присущее конкретной химической продукции или ситуации свойство, заключающееся в их потенциальной способности вызывать деструктивные последствия в случаях, когда организм, система или субпопуляция подвергаются их воздействию.
2.15 отрицательная контрольная проба (negative control): Ничем не обработанная используемая параллельно проба, включающая в себя все составляющие испытательной системы. Используется наряду с пробами, обработанными исследуемой химической продукцией и другими контрольными пробами для выяснения, взаимодействует ли используемый растворитель с испытательной системой.
2.16 положительная контрольная проба (positive control): Используемая параллельно проба, содержащая все компоненты испытательной системы и обрабатываемая с использованием вещества, заведомо дающего положительный отклик. Чтобы обеспечить возможность учитывать изменчивость во времени отклика, получаемого для данной пробы, этот положительный отклик не должен быть слишком завышенным.
2.17 путь неблагоприятного исхода (Adverse Outcome Pathway; АОР): последовательность событий, начиная с особенностей химической структуры, характерных для целевого химического вещества или группы однотипных химических веществ, включая исходное молекулярное событие, и заканчивая неблагоприятным исходом, который можно наблюдать in vivo [2].
2.18 релевантность (relevance): Характеристика соответствия метода испытаний результату, полученному при исследованиях, а также его обоснованности и пригодности для определенных целей применения. Данная характеристика указывает пределы, в которых метод испытаний позволяет правильно измерить или спрогнозировать исследуемый биологический эффект. Релевантность включает рассмотрение точности (соответствия) метода испытаний [21].
2.19 смесь (mixture): Смесь или раствор, состоящие из двух или более веществ, в которых они не вступают в реакцию друг с другом [1].
2.20 Согласованная на Глобальном уровне Система классификации и маркировки химической продукции (ООН); СГС (Globally Harmonized System of Classification and Labelling of Chemicals (UN); GHS): Система, предусматривающая классификацию химической продукции (веществ и смесей) в зависимости от характерных видов и уровней физической опасности, опасности для здоровья человека или опасности для окружающей среды, с применением соответствующих средств информирования, таких как пиктограммы, сигнальные слова, краткая характеристика опасности, меры по предупреждению опасности и паспорта безопасности, чтобы обеспечить информацией о ее негативном воздействии с целью защиты людей (в том числе сотрудников, работников, перевозчиков, потребителей и представителей аварийных служб) и окружающей среды [1].
2.21 специфичность (specificity): Доля всей дающей отрицательный результат/неактивной химической продукции, которая была правильно классифицирована с применением соответствующего метода испытаний. Этот показатель является мерой точности для метода испытаний, позволяющего получать однозначные результаты, и служит важной отправной точкой при оценке релевантности такого метода [1].
2.22 стандарты результативности (performance standards): Стандарты, основанные на применении валидированного метода испытаний, который признан научно обоснованным, и обеспечивающие основу для сравнительной оценки других предлагаемых методов испытаний, подобных ему с механистической и функциональной точки зрения. Стандарты устанавливают: (1) важнейшие составляющие метода испытаний; (2) минимальный перечень эталонных химических веществ, отобранных из числа веществ, которые применялись для подтверждения пригодности валидированного метода испытаний, а также (3) сопоставимые уровни надежности и точности по результатам использования валидированного метода испытаний, которые предлагаемый метод испытаний должен демонстрировать при его оценке с использованием этого минимального перечня эталонных химических веществ [21].
2.23 точность (accuracy): Близость результата испытаний, полученного с применением соответствующего метода испытаний, к принятому эталонному значению величины. Точность является показателем результативности метода и одним из аспектов релевантности. Данный термин часто применяется как взаимозаменяемый для термина "согласованность" (concordance) для указания доли корректных результатов, полученных с применением соответствующего метода испытаний [3].
2.24 чувствительность (sensitivity): Доля всей дающей положительный результат/активной химической продукции, которая была правильно классифицирована с применением соответствующего метода испытаний. Этот показатель является мерой точности для методов испытаний, позволяющих получать однозначные результаты, и служит важной отправной точкой при оценке релевантности таких методов [21].
2.25 химическая продукция (вещества) для проверки квалификации (proficiency chemicals (substances)): Совокупность эталонных химических веществ, входящих в стандарты результативности и пригодных для использования лабораториями при подтверждении своей достаточной технической компетентности в части применения стандартизированных методов испытаний. Критериями отбора для таких веществ обычно выступают охват широкого диапазона возможных реакций, доступность для коммерческого приобретения, а также наличие достоверных справочных данных.
2.26 эталонная химическая продукция (вещества) (reference chemicals (substances)): Совокупность химических веществ, используемых для подтверждения способности нового метода испытания соответствовать тем же критериям приемлемости, что и валидированный референтный метод испытания (методы испытаний). Эти химические вещества должны относиться к тем же классам опасности химических веществ, для испытаний которых предназначен соответствующий метод, и должны охватывать весь диапазон возможных реакций на воздействие химической продукции, с которой он должен применяться, от сильной до слабой и отрицательной.
2.27 ARE: Элемент антиоксидантного ответа (другое обозначение - EpRE (electrophile response element), элемент электрофильного ответа) представляет собой элемент ответа, обнаруживаемый в предпромоторной области многих цитопротекторных генов и генов фазы II системы детоксикации. Активируясь при взаимодействии с фактором Nfr2, он опосредует транскрипционную индукцию этих генов.
2.28 CV (cell viability): Уровень жизнеспособности клетки.
2.29 CV75: Расчетное значение концентрации, обеспечивающее жизнеспособность 75% клеток.
2.30 EC1,5: Интерполированное значение концентрации, обеспечивающее 1,5-кратное повышение уровня индукции люциферазы.
2.34 Keap1: Kelch-подобный ЕСН-ассоциированный протеин 1 - сенсорный белок, способный осуществлять регуляцию активности фактора транскрипции Nrf2. В отсутствие индукции сенсорный белок Kеар1 стимулирует Nrf2 к убиквитированию с протеолитической деградацией в протеасоме.
Ковалентная модификация активных цистеиновых остатков Kеар 1 малыми молекулами может приводить к диссоциации Nrf2 от Kеар1 [22], [23], [24].
2.35 Nrf2: Ядерный фактор 2, связанный с эритроидным фактором 2, - транскрипционный фактор, одна из составляющих пути антиоксидантного ответа. Неубиквитированный Nrf2 накапливается в цитоплазме и транслоцируется в ядро, где соединяется с ARE в восходящей промоторной области многих цитопротекторных генов, инициируя их транскрипцию [22], [23], [24].
2.36 UVCB (substances of unknown or variable composition, complex reaction products or biological materials): Вещества неизвестного или переменного состава, продукты комплексных реакций или вещества биологического происхождения.
3 Методы
3.1 Обоснование и принципы методов испытаний, представленных в стандарте по проведению испытаний на основе ключевых событий
3.1.1 Оценивание сенсибилизации кожи обычно проводится с использованием лабораторных животных. Классические методы исследований с использованием подопытных морских свинок, максимизационная сенсибилизирующая проба на морских свинках (Guinea Pig Maximisation Test - GPMT) Магнуссона и Клигмана либо тест Бюлера [11] позволяют оценить как фазу индукции, так и контрольную фазу исследования сенсибилизации кожи. Методы исследований с использованием мышей, такие как LLNA [12] и три его модификации, для которых не требуется применение радиоактивных веществ - LLNA:DA [13], LLNA:BrdU-ELISA и BrdU-FCM [14], оценивают только идукционный ответ, и поэтому заслужили признание по сравнению с испытаниями на морских свинках с точки зрения меньшего нанесения вреда животным в сочетании с возможностью получения объективных данных измерений, иллюстрирующих течение фазы индукции для сенсибилизации кожи.
3.1.2 Новым способом оценивания потенциальных уровней опасности развития сенсибилизации кожи при воздействии химических веществ стало применение методов испытаний in chemico и in vitro, основанных на механистических моделях и воспроизводящих первые три ключевых события АОР для сенсибилизации кожи. В [15] описывается метод прямого анализа реакционной способности пептидов, что соответствует первому ключевому событию; в центре внимания настоящего стандарта находится процесс активации кератиноцитов [15], ассоциируемый со вторым ключевым событием, а [16] в свою очередь рассказывает об активации дендритных клеток, третьем ключевом событии АОР для сенсибилизации кожи. Четвертое ключевое событие, заключающееся в пролиферации Т-клеток, оценивается косвенным образом - по методу изучения реакции регионарных лимфатических узлов (Local Lymph Node Assay - LLNA), с использованием подопытных мышей [12].
3.1.3 Так как активация кератиноцитов представляет собой лишь одно из ключевых событий АОР, вызывающих сенсибилизацию кожи [2], [17], сведения, получаемые с помощью методов испытаний, разработанных специально для наблюдения за данным ключевым событием, могут оказаться недостаточными в случае их самостоятельного применения для подготовки заключения о наличии или отсутствии у этих веществ способности оказывать сенсибилизирующее воздействие на кожу. Поэтому данные, полученные с помощью методов, описанных в настоящем стандарте, предлагается рассматривать как существенные при решении вопросов об отнесении того или иного вещества к перечню веществ, способных вызывать сенсибилизацию кожи (т.е. к классу опасности 1 согласно СГС ООН), либо неаллергенных веществ в порядке реализации этих методов в рамках интегрированных подходов к испытаниям и оценке (Integrated Approaches to Testing and Assessment - IATA), наряду с прочей дополняющей ее значимой информацией, характеризующей иные ключевые события в структуре АОР для кожной сенсибилизации по результатам экспериментов in vitro, а также информацией, полученной с применением методов, не предусматривающих непосредственного проведения испытаний, таких как сопоставление по методу аналогий с веществами, обладающими схожими химическими свойствами [17]. Опубликованы примеры использования данных, полученных с применением этих методов, в рамках так называемых установленных подходов (Defined Approaches), т.е. подходов, стандартизированных как с точки зрения набора используемых источников информации, так и с точки зрения порядка формирования прогнозного заключения [17], которые также могут быть востребованы при выполнении работ в рамках IATA.
3.1.4 Методы испытаний, описанные в настоящем стандарте, не предназначены для автономного применения и не обеспечивают возможность классификации веществ, вызывающих сенсибилизацию кожи, в соответствии с подклассами опасности 1A и 1B, как предусмотрено СГС ООН [1], для нужд официальных органов, контролирующих эти две необязательные подклассу, а также не могут применяться для целей прогнозирования способности исследуемых веществ вызывать сенсибилизацию в процессе принятия решений по оценке необходимых мер безопасности при обращении с этими веществами. Тем не менее при условии, что это не противоречит требованиям действующего законодательства, положительные результаты, полученные с помощью этих методов, могут сами по себе рассматриваться как достаточное основание для отнесения химического вещества к классу опасности 1 согласно СГС ООН.
3.1.5 Под "исследуемой химической продукцией" для целей настоящего стандарта понимается продукция, которая подвергается испытаниям, использование данного термина не связано с возможностью применения предлагаемых методов для исследования тех или иных однокомпонентных веществ, многокомпонентных веществ и/или их смесей. При проведении испытаний на погруженных культурах важно убедиться в достаточном растворении исследуемой химической продукции в соответствующей рабочей среде или по меньшей мере в образовании ей устойчивой взвеси (например, путем проведения визуального контроля раствора вещества, приготовленного с использованием этой среды в максимальной предусмотренной конечной концентрации, с целью подтвердить отсутствие нерастворенных остатков, а также исключить вероятность выпадения осадка или разделения фаз в растворе, которому предварительно позволили отстояться в течение нескольких часов).
3.1.6 Количество доступной информации о возможности применения предлагаемых методов для анализа многокомпонентных веществ и смесей веществ в настоящее время ограничено [18], [19], [20]. Тем не менее, несмотря на отсутствие заключения по результатам соответствующего валидационного испытания, с технической точки зрения эти методы можно считать пригодными для испытания таких веществ и смесей. Перед исследованием смесей, химических веществ, определение которых затруднено (например, нестабильных), или таких химических веществ, которые не могут быть с уверенностью отнесены к области применения настоящего стандарта, в каждом случае следует уточнять, в какой мере результаты такого испытания могут быть научно обоснованными. Кроме того, в процессе проведения испытаний многокомпонентных веществ или смесей не следует забывать об опасности неверного толкования характера наблюдаемых реакций за счет воздействия присутствующих в этих веществах и смесях цитотоксических составляющих (так, например, последствия высокого уровня содержания цитотоксических составляющих, не обладающих сенсибилизирующими свойствами, могут маскировать отклик на присутствие слабо аллергенных составляющих либо выраженных аллергенных составляющих, представленных в низкой концентрации). Соответственно, в конкретной ситуации оправданным с научной точки зрения шагом следует считать организацию раздельных испытаний ключевых составляющих, преобладающих в данной смеси, т.е. одной основной либо нескольких более мелких фракций, результаты которых позволяли бы в дальнейшем достоверно судить о сенсибилизирующем потенциале смеси в целом.
3.2 Сенсибилизация кожи in vitro. Метод исследования KeratinoSens™ на основе сигнального пути ARE-Nrf2 с использованием люциферазы
3.2.1.Исходные положения, пригодность и ограничения
3.2.1.1 Метод исследования, изложенный в пункте 3.2, касается второго ключевого события АОР для сенсибилизации кожи [2], а именно активации кератиноцитов, путем использования люциферазы для получения оценки интенсивности опосредуемой через Nrf2 активации генов, зависимых от элемента антиоксидантного ответа (ARE). Известно, что воздействие веществ, вызывающих кожную сенсибилизацию, приводит к индукции генов, регулируемых с помощью ARE [22], [3]. Низкомолекулярные электрофильные вещества, к числу которых следует относить кожные аллергены, способны вызывать изменения в сенсорном белке Kеар1 (Kelch-подобном ЕСН-ассоциированном протеине 1), например за счет ковалентной модификации его цистеинового остатка, что влечет за собой его диссоциацию от транскрипционного фактора Nrf2 (ядерного фактора 2, связанного с эритроидным фактором 2). После диссоциации Nrf2 может активировать ARE-зависимые гены, такие как гены, кодирующие ферменты фазы детоксикации II [22], [23], [24].
3.2.1.2 Метод KeratinoSens™ для проведения испытаний in vitro на основе сигнального пути ARE-Nrf2 с использованием люциферазы (далее - KeratinoSens™) успешно прошел соответствующие исследования [3], [23], [5], необходимые для его валидации, с последующим вынесением независимой экспертной оценки Референтной лабораторией Европейского союза по валидации методов, альтернативных методам испытаний на животных (EURL ECVAM) [6]. Метод KeratinoSens™ признан научно обоснованным и допущен к применению в рамках IATA для идентификации между веществами, способными и не способными вызывать кожную сенсибилизацию, в целях определения степени их опасности [6].
3.2.1.3 В соответствии с данными, полученными в ходе проведения валидационных исследований, а также результатами специализированных внутрилабораторных испытаний, использованными на этапе независимой экспертной оценки, метод подтвердил свою пригодность для применения на базе лабораторий, которые уже имеют достаточный опыт выполнения аналитических работ с клеточными культурами [6]. Ожидаемый уровень воспроизводимости прогнозных заключений для метода исследования KeratinoSens™ составляет порядка 85% как при подготовке их в пределах одной лаборатории, так и при подготовке различными лабораториями [6]. При расчете показателей точности (77% - 155/201), чувствительности (78% - 71/91) и специфичности (76% - 84/110) метода KeratinoSens™ для идентификации веществ, способных вызывать кожную сенсибилизацию (т.е. относящихся к классу опасности 1 согласно СГС ООН) и не способных вызывать кожную сенсибилизацию, по сравнению с аналогичными результатами, обеспечиваемыми методом LLNA, были использованы все доступные данные, представленные в EURL ECVAM для оценки результативности и проведения экспертного анализа метода [6]. Полученные значения согласуются с опубликованными значениями, полученными по итогам проведения внутрилабораторных испытаний приблизительно 145 испытанных веществ (точность - 77%, чувствительность - 79%, специфичность - 72%) [5], что указывает на пригодность метода исследования KeratinoSens™ к применению в качестве вспомогательного средства для выявления опасностей, связанных с развитием кожной сенсибилизации. Впрочем, показатели точности, приведенные выше для метода KeratinoSens™, как если бы он выступал в роли самостоятельно применяемого метода исследования, выполняют здесь сугубо справочные функции, поскольку любые результаты, полученные с его помощью, следует рассматривать не автономно, а в сочетании с информацией из других источников - в контексте соответствующего установленного подхода или IATA и с учетом положений пунктов 3.1.3 и 3.1.4. В свою очередь, при подготовке оценки эффективности применения методов определения кожной сенсибилизации, не требующих использования подопытных животных, важно иметь в виду, что применение метода LLNA, равно как и других методов, которые предполагают проведение испытаний на животных, может не в полной мере раскрывать характер воздействия исследуемого вещества на организм человека.
3.2.1.4 Исходя из имеющихся данных, установлено, что метод KeratinoSens™ подходит для проведения исследований широкого спектра химической продукции, включающей различные органические функциональные группы, механизмы реакций, сенсибилизирующий потенциал при воздействии на кожу (подтвержденным путем проведения испытаний in vivo), а также различные физико-химические свойства [3], [4], [5], [6]. Метод испытаний применим к химической продукции, свободно растворимой в соответствующей рабочей среде или образующей в ней устойчивую взвесь (т.е. коллоидный раствор или суспензию, в которых химическая продукция не образует осадка и не разделяется на фазы). Если химическая продукция не удовлетворяет указанным условиям при максимальном требуемом конечном значении концентрации в размере 2000 мкМ, могут быть проведены ее исследования при более низких значениях концентрации. В подобных случаях результаты, удовлетворяющие необходимым критериям для отнесения их к положительным, все еще могут рассматриваться как доказательство способности исследуемой химической продукции вызывать кожную сенсибилизацию. Отрицательные результаты, полученные при проведении испытаний с максимальным достигаемым значением концентрации менее 1000 мкМ и при полном отсутствии цитотоксических проявлений, должны рассматриваться как "сомнительные" (см. модель построения прогнозов в 3.2.4.3.1). В то же время, если в процессе испытаний с максимально достигаемой концентрацией испытательного раствора менее 1000 мкМ можно наблюдать некоторые признаки цитотоксического воздействия (уровень жизнеспособности менее 70%), то в этом случае при оценивании результатов эксперимента к ним все еще могут применяться соответствующие критерии, позволяющие интерпретировать такие результаты как достоверно отрицательные. Большинство однокомпонентных веществ со значением показателя LogP более 7 могут быть нерастворимы в используемой рабочей среде, однако если практическая возможность растворения или получения устойчивой взвеси такого вещества была подтверждена и задокументирована, проведение испытаний в соответствии с рассматриваемым методом считается для них допустимым.
3.2.1.5 К получаемым отрицательным результатам в любом случае следует относиться с осторожностью, поскольку в условиях применения рассматриваемого метода вещества, проявляющие исключительную химическую активность по отношению к лизиновым остаткам, могут быть ошибочно определены как вещества, дающие отрицательный отклик, исходя из того, что ключевым механизмом активации сигнального пути Keap1-Nrf2-ARE, по всей видимости, является электрофильная реакция стрессоров с нуклеофильными тиолами (цистеиновыми сульфгидрильными группами) Keap 1. Устранить эту неопределенность можно используя информацию, получаемую путем дополнительного анализа реакционной способности исследуемых веществ в отношении пептидов, в частности путем проведения исследований с применением методов, позволяющих различать реакции с цистеином и лизином. Кроме того, из-за ограниченного метаболического потенциала используемой клеточной линии [26] и с учетом особенностей условий проведения эксперимента прогаптены (т.е. химические вещества, требующие ферментной активации, например, с участием ферментов Р450) и прегаптены (т.е. химическая продукция, активируемая в процессе автоокисления), в особенности те, скорость окисления которых невелика, также могут давать отрицательные результаты. С другой стороны, установлено, что применение комбинации методов исследований, покрывающей 1, 2 и 3 ключевые события АОР, позволяет с высокой долей уверенности определять большую часть прегаптенов (т.е. химической продукции, активируемой в процессе автоокисления) и прогаптенов (т.е. химической продукции, требующей ферментной активации, например, с участием ферментов Р450), таким образом, получаемые с помощью такого подхода отрицательные результаты, как правило, являются достаточно убедительными и могут использоваться для классификации химической продукции по степени ее опасности [28], [36], [34]. Также существует вероятность получения ложноположительных результатов для такой исследуемой химической продукции, которая не обладает сенсибилизирующими свойствами, но воздействие которой может выступать как фактор химического стресса [6]. Наконец, химическая продукция, способная взаимодействовать с ферментом люциферазой, может оказывать нежелательное влияние на ее активность при проведении экспериментов на клеточных культурах, заключающееся либо в отчетливом ингибировании реакций, либо, напротив, в усилении люминесценции [29]. Так, например, по опыту проведения иного рода исследований репортерных генов с использованием люциферазы известно, что фитоэстрогены в концентрации, превышающей 1 мкМ, влияют на распространение сигналов люминесценции, что объясняется сверхактивацией ее репортерного гена [30]. Как следствие, любые случаи экспрессии люциферазы, достигаемой при высоких значениях концентрации фитоэстрогенов или близких к ним соединений, которые, подобно фитоэстрогенам, могут вызывать сверхактивацию репортерного гена люциферазы, подлежат отдельному тщательному изучению [30]. При наличии доказательств, свидетельствующих о непригодности метода KeratinoSens™ для исследований каких-либо других определенных категорий химической продукции, его не следует применять с этими конкретными категориями химической продукции.
3.2.1.6 В дополнение к возможности различать химическую продукцию, способную вызывать кожную сенсибилизацию (т.е. относимую к классу опасности 1 согласно СГС ООН), и химическую продукцию, не способную вызывать кожную сенсибилизацию, метод исследования KeratinoSens™ также позволяет получать информацию типа "концентрация - эффект", потенциально важную для оценивания размера сенсибилизирующей способности химического вещества при условии его применения в рамках комплексных исследовательских подходов, таких как IATA [27], [31]. Примеры использования результатов, полученных при помощи метода KeratinoSens™, в сочетании с информацией из других источников приведены в [5], [27], [32], [33], [34], [35], [36]. В частности, описана практика комбинированного использования данных "доза - эффект" согласно методу KeratinoSens™ и количественных данных о реакционной способности химической продукции для оценки ее сенсибилизирующей способности при проведении экспериментов по методу LLNA и испытаний на человеке [37], а также в процессе реализации байесовских интегрированных стратегий испытаний для такой способности на основе метода LLNA [27], [38]. Помимо этого, отдельному рассмотрению подвергнуты вопросы, связанные с порядком оценивания сенсибилизирующей способности химической продукции непосредственно в отношении человека [39]. Наконец, представлены описания, посвященные использованию метода тестирования KeratinoSens™ для оценки сенсибилизирующей способности химической продукции, принадлежащей к конкретным химическим классам [37], [40].
3.2.2 Сущность метода испытания
3.2.2.1 Метод исследования KeratinoSens™ предусматривает использование иммортализованной линии адгерентных клеток, полученных из человеческих кератиноцитов и стабильно содержащих репортерный ген люциферазы, контролируемый элементом антиоксидантного ответа гена AKR1C2 человека [41]. Известно, что активация данного гена происходит при воздействии веществ, способных вызывать кожную сенсибилизацию [42], [43]. Таким образом, клеточная линия характеризуется наличием гена люциферазы, контролируемого на уровне транскрипции конститутивным промотором, слитым с элементом ARE. Сигнал люциферазы свидетельствует об активации сенсибилизирующим веществом эндогенных Nrf2-зависимых генов; тезис о зависимости появления люциферазного сигнала в рекомбинантной клеточной линии от действия Nrf2 имеет научное подтверждение [44]. Это позволяет выполнять количественные измерения индукции гена люциферазы (путем наблюдения за интенсивностью люминесценции) с использованием хорошо изученных фотогенных субстратов люциферазы в качестве индикатора активности фактора транскрипции Nrf2 в клетках после воздействия на них электрофильных испытуемых веществ.
3.2.2.3 До того как приступить к регулярному применению метода KeratinoSens™ в соответствии с настоящим стандартом, лаборатории должны подтвердить свою техническую компетентность путем исследования десяти специально отобранных химических веществ, перечисленных в приложении A.
3.2.2.4 Стандарты результативности (СР) [10] облегчают процесс валидации новых или модифицированных методов исследования in vitro на основе сигнального пути ARE-Nrf2 с использованием люциферазы, подобных валидированному референтному методу (VRM) KeratinoSens™, и позволяют оперативно вносить соответствующие изменения в OECD 442d с целью включения в него этих методов. Присоединение к системе взаимного признания данных (Mutual Acceptance of Data - MAD) для методов испытания, успешно прошедших валидацию в соответствии с CP, гарантируется только при условии, что эти методы были рассмотрены и официально включены в OECD 442d.
3.2.3 Методика испытаний
_______________
3.2.3.1 Подготовка клеточных культур кератиноцитов
3.2.3.1.1 Для испытаний используют трансгенную линию клеток KeratinoSens™, снабженную стабильной вставкой репортерного гена люциферазы, контролируемого элементом ARE. Непосредственно после получения образцов клеток KeratinoSens™ их размножают в порядке, предусмотренном протоколом метода испытаний (например, выполняют в общей сложности от двух до четырех клеточных пассажей), и оставляют на хранение в замороженном состоянии в форме гомогенной маточной суспензии. В дальнейшем клетки этого исходного материала по мере необходимости размножают в пределах не более чем 25 пассажей для использования в процессе рутинных исследований в сочетании с соответствующей поддерживающей/ростовой питательной средой (модифицированной по способу Дульбекко средой Игла (Dulbecco’s Modified Eagle’s medium - DMEM), с добавлением сыворотки крови и генетицина в целях сохранения стабильности генов), как указано в действующем протоколе DB-ALM [25].
3.2.3.1.2 Конфлюентность используемых клеток должна соответствовать значениям от 80% до 90%, в то же время необходимо следить за тем, чтобы выращиваемые клетки ни в коем случае не достигали стопроцентной конфлюентности. За сутки до начала испытаний необходимое количество отобранных клеток помещают в лунки 96-луночных планшетов из расчета 10000 клеток/лунку. При посеве важно контролировать отсутствие нежелательного осаждения клеток в исходном материале, чтобы обеспечить равномерное количественное распределение клеток между лунками. Следствием неравномерного посева может стать высокая изменчивость результатов для разных лунок. В каждом повторении три параллельно обрабатываемых пробы служат для измерений активности люциферазы, и по крайней мере одна параллельно обрабатываемая проба используется для наблюдения за жизнеспособностью клеток.
3.2.3.2 Подготовка исследуемых и контрольных химических веществ
3.2.3.2.1 Подготовку исследуемых химических веществ и контрольных веществ осуществляют непосредственно в день проведения испытаний. Исследуемые химические вещества растворяются в диметилсульфоксиде (dimethyl sulfoxide - DMSO, ДМСО, CAS No. 67-68-5, степень чистоты 99% или более) до получения желаемых конечных значений концентрации (например, 200 мМ). Растворы на основе ДМСО можно рассматривать как самостерилизующиеся; это означает, что дополнительно фильтровать их с целью стерилизации не требуется. Если исследуемые химические вещества не удается растворить в ДМСО, их растворяют в стерильной воде или непосредственно в питательной среде, полученные растворы стерилизуют фильтрованием. Если для исследуемых химических веществ не может быть установлено точное значение молекулярной массы (ММ), то соответствующий стандартный раствор по умолчанию готовят со значением концентрации 40 мг/мл, или 4% (масса/объем). Использование иных растворителей, отличных от ДМСО, воды или питательной среды, должно быть научно обосновано.
3.2.3.2.2 На основе стандартных растворов исследуемых химических веществ выполняют последовательные разбавления с использованием ДМСО или другого подходящего растворителя (например, стерильной воды или питательной среды) для получения 12 базовых значений концентрации этого химического вещества (в интервале от 0,098 до 200 мМ). Независимо от выбранного растворителя растворы с базовыми значениями концентрации в дальнейшем подвергают дополнительному 25-кратному разбавлению в питательной среде, содержащей сыворотку крови, и уже после этого используют для обработки образцов с применением еще одного, 4-кратного коэффициента разбавления, таким образом, конечные значения концентрации исследуемого химического вещества варьируются в интервале от 0,98 до 2000 мкМ (из расчета коэффициента разбавления, равного 2). В обоснованных случаях (например, если химические вещества могут оказывать цитотоксическое воздействие либо характеризуются низкой растворимостью) допускается использовать отличные от указанных значения концентрации. При проведении исследований химических веществ, для которых не могут быть установлены точные значения ММ, последовательные разбавления аналогичным образом выполняют с использованием ДМСО или другого подходящего растворителя, чтобы получить необходимые конечные значения концентрации (например, в интервале от 0,196 до 400 мкг/мл).
3.2.3.2.3 При каждом повторении в число материалов для проведения испытаний дополнительно включают контрольную пробу растворителя/вещества носителя (например, ДМСО), резервируя для нее достаточное число лунок на каждом планшете (например, шесть). Для контрольной пробы растворителя/вещества-носителя повторяют ту же последовательность разбавлений, что и для базовых значений концентрации согласно 3.2.3.2.2, чтобы конечное значение концентрации растворителя/вещества-носителя составляло 1%, т.е. заведомо являлось пренебрежимым с точки зрения влияния на жизнеспособность клеток и при этом соответствовало концентрации ДМСО, достигаемой в пробах исследуемого химического вещества и в положительных контрольных пробах. Для веществ, не растворимых в ДМСО, разбавления которых были приготовлены на воде, уровень содержания ДМСО во всех лунках, в которые помещается конечный испытуемый раствор, должен быть доведен до 1% по аналогии с растворами других исследуемых и контрольных химических веществ. В методе KeratinoSens™ контрольная проба растворителя/вещества-носителя (т.е. ДМСО) является также отрицательной контрольной пробой.
3.2.3.3 Внесение исследуемой химической продукции и эталонных веществ
3.2.3.3.1 Подготовка соответствующего прогнозного заключения (положительного или отрицательного) для каждой исследуемой химической продукции или эталонного вещества положительной контрольной пробы требует проведения одного эксперимента, включающего в себя по меньшей мере два независимых повторения, по три параллельно обрабатываемых пробы в каждом (итого: n = 6). В случае несогласующихся результатов между двумя независимыми повторениями выполняют третье повторение с тремя параллельно обрабатываемыми пробами (итого: n = 9). Независимые повторения выполняют в разные дни с использованием свежих стандартных растворов исследуемой химической продукции и с независимо отобранными образцами клеточного материала. Указанное условие не исключает, однако, возможность принадлежности отобранных клеток к одному и тому же пассажу клеточной культуры.
3.2.3.3.2 После посева на 96-луночные микротитровальные планшеты, который выполняется в порядке, описанном в 3.2.3.1.2, образцы клеток оставляют для дальнейшего роста в течение 24 ч. После этого использованную питательную среду удаляют и заменяют ее свежей питательной средой (150 мкл питательной среды с добавлением сыворотки крови, но без добавления генетицина, как установлено в протоколе DB-ALM [25]), в которую дополнительно вносят по 50 мкл 25-кратных разбавлений исследуемого химического вещества или вещества контрольной пробы соответственно. По меньшей мере одна лунка на каждом планшете должна оставаться пустой (без образцов клеток и без добавления проб) для оценивания соответствующих фоновых значений.
3.2.3.4 Измерения активности люциферазы
3.2.3.4.1 Для надлежащего определения значений показателя люминесценции решающее значение имеют следующие факторы:
- выбор люминометра с достаточным уровнем чувствительности;
- использование микропланшета с лунками достаточной глубины, не допускающего перекрестного светового загрязнения;
- использование субстрата люциферазы, обеспечивающего достаточную интенсивность светового излучения, для достижения приемлемого уровня чувствительности и снижения изменчивости результатов;
- приемлемый и постоянный уровень фоновой освещенности.
Перед началом испытаний проводят контрольный эксперимент по схеме, описанной в приложении В, чтобы убедиться в соблюдении всех вышеприведенных требований.
3.2.3.4.2 По окончании 48-часового периода воздействия исследуемой химической продукции и эталонных веществ образцы клеток в лунках промывают фосфатным буферным солевым раствором и для подготовки к последующему определению характеристик люминесценции добавляют в каждую лунку соответствующий лизисный буферный раствор, выдерживая его с образцами в течение достаточного количества времени (например, в течение 20 мин при комнатной температуре).
3.2.3.4.3 После этого планшеты с клеточным лизатом помещают в люминометр для выполнения измерений в соответствии со следующей программой: (i) добавление субстрата люциферазы (по 50 мкл в каждую лунку), (ii) выдерживание в течение 1 с, (iii) интегрирование измеряемых значений активности люциферазы в течение 2 с. Выбор параметров, отличных от указанных, например с учетом конструктивных особенностей используемой модели люминометра, должен быть подкреплен соответствующим обоснованием. Дополнительно для целей измерений допускается использование так называемых "тлеющих" люминесцентных субстратов при условии положительного исхода контрольного эксперимента, проведение которого предусмотрено приложением В.
3.2.3.5 Оценка цитотоксичности
3.2.4 Данные и протоколы испытаний
3.2.4.1 Интерпретация данных
3.2.4.1.1 Следующие параметры рассчитываются с помощью метода испытания KeratinoSens™:
Уровень жизнеспособности определяют в соответствии с уравнением 3:
3.2.4.1.3 Рекомендуется визуально контролировать достоверность получаемых данных при помощи графиков. Если наблюдаемая зависимость "доза - эффект" не может быть отчетливо представлена в виде кривой либо если построенная кривая имеет две фазы (т.е. дважды пересекает пороговую линию, соответствующую множителю 1,5), эксперимент повторяют, чтобы убедиться, является ли подобное поведение типичным для исследуемой химической продукции, или это погрешность результатов эксперимента. Если двухфазный характер кривой сохраняется при повторном независимом эксперименте, то для подготовки отчета используют меньшее из двух значений концентрации, т.е. то, при котором фиксируется первое пересечение линии, соответствующей множителю 1,5.
3.2.4.1.4 В редких случаях при проведении исследований по методу KeratinoSens™ в условиях, когда отмечается статистически незначимое 1,5-кратное и более повышение уровня индукции люциферазы, за которым следует более высокое значение концентрации, демонстрирующее статистически значимый уровень индукции, результаты соответствующего повторения рассматриваются как достоверные и положительные лишь при том условии, что статистически значимый уровень индукции, соответствующий 1,5-кратному порогу или превышающий его, был получен для значения концентрации, при котором не наблюдались цитотоксические проявления.
3.2.4.2 Критерии приемлемости
При проведении исследований по методу KeratinoSens™ должны выполняться следующие критерии приемлемости.
- Значение показателя индукции активности люциферазы, полученное при использовании коричного альдегида для целей положительного контроля, должно демонстрировать статистически значимое превышение 1,5-кратного порога (например, по результатам использования t-критерия) по меньшей мере для одного из используемого для испытаний значения концентрации (в интервале от 4 до 64 мкМ).
- Среднее значение коэффициента вариации результатов измерений люминисценции для контрольной пробы растворителя/вещества-носителя (в данном случае ДМСО) должно составлять менее 20% в каждом повторении. При более высоком уровне изменчивости полученные результаты признаются недостоверными.
3.2.4.3 Интерпретация результатов и модель построения прогнозов
3.2.4.3.1 Положительное прогнозное заключение по результатам применения метода KeratinoSens™ подготавливают в случае строгого выполнения следующих четырех условий для двух из двух или двух из трех повторений, в противном случае по результатам применения метода подготавливают отрицательное прогнозное заключение (рис.1):
- должна прослеживаться отчетливая зависимость уровня индукции люциферазы от размера используемой дозы (либо, в ином случае, наблюдаться двухфазное изменение отклика, как описано в 3.2.4.1.3).
Если в пределах заданного повторения были полностью выполнены первые три условия, но при этом не было отмечено отчетливое повышение уровня индукции люциферазы по мере роста используемой дозы, то результаты для этого повторения должны быть определены как "неубедительные", из чего может следовать необходимость проведения дальнейших испытаний (рис.1). Кроме того, неубедительными следует считать отрицательные результаты, полученные при воздействии исследуемых химических веществ, испытания с которыми проводились при максимальном значении концентрации менее 1000 мкМ (или 200 мкг/мл для исследуемых химических веществ, точное значение ММ для которых не может быть установлено) и воздействие которых при максимальном значении концентрации, использованном для испытаний, не привело к цитотоксическим последствиям (снижению жизнеспособности до менее чем 70%) (см. 3.2.1.4).
 |
Рисунок 1 - Модель построения прогнозов для метода исследований KeratinoSens™
Прогнозное заключение, подготавливаемое по результатам применения метода KeratinoSens™, должно рассматриваться в контексте соответствующего установленного подхода или IATA и с учетом положений 3.1.3 и 3.1.4.
3.2.4.4 Протокол испытаний
Протокол испытаний должен включать в себя следующую информацию:
Исследуемая химическая продукция
Однокомпонентное вещество:
- химическое наименование, а именно название (названия) по IUPAC или CAS, регистрационный номер (номера) CAS, коды SMILES или InChl, структурную формулу и/или другие отличительные признаки, такие как номер производственной/коммерческой партии и конечный срок годности;
- внешний вид, растворимость в воде и ДМСО, молекулярную массу, а также другие важные физико-химические характеристики;
- сведения о (не) растворимости или способности образовывать устойчивую взвесь в используемых рабочих средах;
- степень чистоты, химическую характеристику примесей с учетом целесообразности и возможности практической реализации и т.п.;
- способ обработки перед началом испытаний, если такая обработка проводилась (например, подогрев, измельчение);
- значение (значения) концентрации веществ при проведении испытаний;
- условия хранения и сведения о стабильности веществ, если таковые имеются.
Многокомпонентное вещество с неопределенным или переменным составом (UVCB) или смесь веществ:
- полное описание химической продукции, например химическое обозначение (см. выше), степень чистоты, количественные характеристики и соответствующие физико-химические характеристики (см. выше) ее составляющих;
- внешний вид, растворимость в воде и ДМСО, а также другие важные физико-химические характеристики;
- значение молекулярной массы или - для смесей веществ/полимеров с известным составом - усредненной молекулярной массы либо иные сведения, важные для целей исследования;
- сведения о (не) растворимости или способности образовывать устойчивую взвесь в используемых рабочих средах;
- способ обработки перед началом испытаний, если такая обработка проводилась (например, подогрев, измельчение);
- значение (значения) концентрации веществ при проведении испытаний;
- условия хранения и сведения о стабильности веществ, если таковые имеются.
Контрольные пробы
Положительная контрольная проба:
- химическое наименование, а именно название (названия) по IUPAC или CAS, регистрационный номер (номера) CAS, коды SMILES или InChl, структурную формулу и/или другие отличительные признаки;
- внешний вид, растворимость в воде и ДМСО, а также другие важные физико-химические характеристики;
- степень чистоты, химическую характеристику примесей с учетом целесообразности и возможности практической реализации и т.п.;
- способ обработки перед началом испытаний, если такая обработка проводилась (например, подогрев, измельчение);
- значение (значения) концентрации веществ при проведении испытаний;
- условия хранения и сведения о стабильности веществ, если таковые имеются;
- ссылки на результаты прошлых испытаний положительных контрольных проб, если таковые проводились, подтверждающие достоверный характер критериев приемлемости, использованных для циклов испытаний.
Контрольная проба растворителя/вещества-носителя:
- химическое наименование, а именно название (названия) по IUPAC или CAS, регистрационный номер (номера) CAS и/или другие отличительные признаки;
- степень чистоты, химическую характеристику примесей с учетом целесообразности и возможности практической реализации и т.п.;
- внешний вид, растворимость в воде и ДМСО, молекулярную массу, а также другие важные физико-химические характеристики, если используемые растворитель/веществоноситель/отрицательная контрольная проба отличаются от указанных в 3.2;
- условия хранения и сведения о стабильности веществ, если таковые имеются;
- обоснование выбора растворителя/вещества-носителя для каждой исследуемой химической продукции.
Условия испытаний в соответствии с применяемым методом
- название/имя и адрес лица/организации, осуществлявших финансирование, лаборатории, где проводились испытания, а также имя руководителя исследования;
- описание применявшегося метода;
- сведения об использованной клеточной линии, условиях хранения клеточного материала и источниках его поступления (например, о лаборатории или учреждении, предоставивших материал);
- сведения о числе пассажей и уровне конфлюентности клеток, использованных для испытаний;
- сведения о методе подсчета клеток, применявшемся при посеве клеток перед проведением испытаний, и мерах, принимавшихся для обеспечения их равномерного количественного распределения между лунками (см. 14);
- сведения о люминометре, с помощью которого выполнялись измерения (например, модель), а также о настройках прибора, использованном субстрате люциферазы и данных, подтверждающих правильность измерений интенсивности люминесценции по итогам контрольного эксперимента, порядок проведения которого описан в приложении 3 к настоящему дополнению;
- применяемый порядок подтверждения достаточной квалификации лаборатории для владения данным методом исследования (путем проведения испытаний специально отобранных для этого химических веществ и т.п.) или подтверждения воспроизводимости результатов метода исследования за известный период времени.
Порядок испытаний
- сведения о количестве повторений и числе параллельно обрабатывавшихся образцов;
- значение концентрации исследуемого химического вещества, порядок его нанесения и продолжительность экспозиции (если отличаются от рекомендованных);
- описание применявшихся критериев оценки и принятия решений;
- описание применявшихся критериев приемлемости результатов испытаний;
- описание любых изменений, внесенных в методику испытаний.
Результаты
- значение коэффициента вариации, установленное исходя из результатов измерений люминесценции контрольной пробы растворителя/отрицательной контрольной пробы для каждого эксперимента;
- график, представляющий кривые зависимости "доза - эффект" для изменений уровня индукции активности люциферазы и показателей жизнеспособности;
- прочие наблюдения, важные для результатов исследования, если таковые имеются.
Оценка результатов
- оценку результатов, полученных с применением метода исследования KeratinoSens™;
- оценку результатов, полученных с применением метода исследования в контексте IATA при условии наличия значимой информации из иных источников.
Выводы
3.3 Сенсибилизация кожи in vitro. Метод исследования LuSens на основе сигнального пути ARE-Nrf2 с использованием люциферазы
3.3.1 Исходные положения, пригодность и ограничения
3.3.1.1 Настоящий метод исследования, касается второго ключевого события АОР для сенсибилизации кожи [2], а именно активации кератиноцитов, путем использования люциферазы для получения оценки интенсивности опосредуемой через Nrf2 активации генов, связанных с элементом антиоксидантного ответа (ARE). Известно, что воздействие веществ, вызывающих сенсибилизацию кожи, приводит к индукции генов, регулируемых ARE [22], [3]. Низкомолекулярные электрофильные вещества, к числу которых относятся кожные аллергены, способны вызывать изменения в сенсорном белке Keap1 (Kelch-подобном ECH-ассоциированном протеине 1), например за счет ковалентной модификации его цистеинового остатка, что влечет за собой его диссоциацию от транскрипционного фактора Nrf2 (ядерного фактора 2, связанного с эритроидным фактором 2).
3.3.1.2 Метод LuSens для проведения испытаний in vitro на основе сигнального пути ARE-Nrf2 с использованием люциферазы (далее - LuSens) успешно прошел соответствующее валидационное исследование с применением действующих стандартов результативности на основе валидированного референтного метода (VRM) KeratinoSens™ с последующим вынесением независимой экспертной оценки Референтной лабораторией Европейского союза по валидации методов, альтернативных методам испытаний на животных (EURL ECVAM) [9]. Метод LuSens признан научно обоснованным и допущен к применению в рамках IATA для идентификации между веществами, способными и не способными вызывать сенсибилизацию кожи, в целях определения степени их опасности [9].
3.3.1.3 Метод исследования LuSens обладает доказанной пригодностью для применения на базе лабораторий, которые уже имеют достаточный опыт выполнения аналитических работ с клеточными культурами, и отвечает критериям внутри- и межлабораторной воспроизводимости, предусмотренным стандартами результативности [9]. Дополнительные сведения, полученные в ходе ранее проведенных внутрилабораторных испытаний 72 наименований исследуемой химической продукции, свидетельствуют о сопоставимом с VRM уровне достоверности прогнозирования (точность - 74%, чувствительность - 74% и специфичность - 74%) при различении веществ, способных вызывать сенсибилизацию кожи (т.е. относящихся к классу опасности 1 согласно СГС ООН) и не способных вызывать сенсибилизацию кожи, по сравнению с аналогичными результатами, обеспечиваемыми методом LLNA [7], [9], что указывает на пригодность LuSens к применению в качестве вспомогательного средства для выявления опасностей, связанных с развитием кожной сенсибилизации. Показатели точности, приведенные выше для метода LuSens, как если бы он выступал в роли самостоятельно применяемого метода исследования, являются справочными, поскольку любые результаты, полученные с его помощью, следует рассматривать не автономно, а в сочетании с информацией из других источников - в контексте IATA или DA и с учетом положений 3.1.3 и 3.1.4. В свою очередь при подготовке оценки эффективности применения методов определения кожной сенсибилизации, не требующих использования подопытных животных, важно иметь в виду, что применение метода LLNA, равно как и других методов, которые предполагают проведение испытаний на животных, может не в полной мере раскрывать характер воздействия исследуемого вещества на организм человека.
3.3.1.4 Исходя из имеющихся данных, установлено, что метод LuSens подходит для проведения испытаний широкого спектра химических веществ, включающих различные органические функциональные группы, механизмы реакций, сенсибилизирующий потенциал при воздействии на кожу (подтвержденным путем проведения испытаний in vivo), а также различные физико-химические свойства [7], [8]. Метод испытаний применим к химической продукции, свободно растворимой в соответствующей рабочей среде или образующей в ней устойчивую взвесь (т.е. коллоидный раствор или суспензию, в которых химическое вещество не образует осадка и не разделяется на фазы). Если химическая продукция не удовлетворяет указанным условиям при максимальном требуемом конечном значении концентрации (т.е. 2000 мкМ либо 2000 мкг/мл - если точное значение ее молекулярной массы неизвестно), могут быть проведены ее исследования при более низких значениях концентрации. В подобных случаях результаты эксперимента, которые согласно действующим критериям должны интерпретироваться как положительные, все еще могут рассматриваться как доказательство способности исследуемой химической продукции вызывать сенсибилизацию кожи. Отрицательные результаты, полученные при проведении испытаний с максимальной достигаемой концентрацией менее 2000 мкМ (либо 2000 мкг/мл - если точное значение молекулярной массы вещества неизвестно) и при полном отсутствии цитотоксических проявлений, должны рассматриваться как "сомнительные" (см. модель построения прогнозов в 3.3.4.6). В то же время, если в процессе испытаний с концентрацией испытательного раствора менее 2000 мкМ (либо 2000 мкг/мл - если точное значение молекулярной массы неизвестно) можно наблюдать некоторые признаки цитотоксического воздействия (уровень жизнеспособности менее 70%), в этом случае при оценивании результатов эксперимента к ним все еще могут применяться соответствующие критерии, позволяющие интерпретировать такие результаты как достоверно отрицательные. Большинство однокомпонентных веществ со значением показателя LogP более 7 могут быть нерастворимы в используемой рабочей среде, однако если практическая возможность растворения или получения устойчивой взвеси такого вещества была подтверждена и задокументирована, проведение испытаний в соответствии с рассматриваемым методом считается для них допустимым.
3.3.1.5 К получаемым отрицательным результатам следует относиться с осторожностью, поскольку в условиях применения рассматриваемого метода вещества, проявляющие исключительную химическую активность по отношению к лизиновым остаткам, могут быть ошибочно пределены как вещества, дающие отрицательный отклик, исходя из того что ключевым механизмом активации сигнального пути Keap1-Nrf2-ARE, по всей видимости, является электрофильная реакция стрессоров с нуклеофильными тиолами (цистеиновыми сульфгидрильными группами) Keap-1. Устранить эту неопределенность можно используя информацию, получаемую путем дополнительного анализа реакционной способности исследуемых веществ в отношении пептидов, в частности путем проведения испытаний с применением методов, позволяющих различать реакции с цистеином и лизином. Кроме того, следует иметь в виду, что в силу ограниченных метаболических возможностей используемой клеточной линии [26] и с учетом особенностей условий проведения эксперимента прогаптены (т.е. химические вещества, требующие ферментной активации, например, с участием ферментов Р450) и прегаптены (т.е. химические вещества, активация которых происходит за счет автоокисления), в особенности те, скорость окисления которых невелика, также могут давать отрицательные результаты. С другой стороны, установлено, что применение комбинации методов испытаний, покрывающей 1, 2 и 3 ключевые события в структуре АОР, позволяет с высокой долей уверенности определять большую часть прегаптенов (т.е. химических веществ, активируемых в процессе автоокисления) и прогаптенов (т.е. химической продукции, требующей ферментной активации, например, с участием ферментов Р450), таким образом, полученные отрицательные результаты в этом случае, как правило, являются достаточно убедительными и могут в дальнейшем использоваться для целей официальной классификации химической продукции по степени ее опасности [27], [28], [32]. Одновременно со сказанным выше существует вероятность получения ложноположительных результатов для такой исследуемой химической продукции, которая не обладает сенсибилизирующими свойствами, но воздействие которой может тем не менее выступать как фактор химического стресса подобно тому, как это происходит в случае применения VRM [6]. Наконец, химическая продукция способна взаимодействовать с ферментом люциферазой, может оказывать нежелательное влияние на ее активность при проведении экспериментов на клеточных культурах, заключающееся либо в отчетливом ингибировании реакций, либо, напротив, в усилении люминесценции [29]. Так, например, по опыту проведения иного рода испытаний репортерных генов с использованием люциферазы известно, что фитоэстрогены в концентрации, превышающей 1 мкМ, влияют на распространение сигналов люминесценции, что объясняется сверхактивацией ее репортерного гена [30]. Как следствие, любые случаи экспрессии люциферазы, достигаемой при высоких значениях концентрации фитоэстрогенов или близких к ним соединений, которые, предположительно, подобно фитоэстрогенам могут вызывать сверхактивацию репортерного гена люциферазы, подлежат отдельному тщательному изучению [30]. При наличии доказательств, свидетельствующих о непригодности метода LuSens для исследований каких-либо других конкретных категорий химической продукции, его не следует применять с этими конкретными категориями химической продукции.
3.3.1.6 В дополнение к возможности различать вещества, способные вызывать сенсибилизацию кожи (т.е. относимые к классу опасности 1 согласно СГС ООН), и вещества, не способные вызывать сенсибилизацию кожи, метод исследования LuSens также позволяет получать информацию (например, типа "концентрация - ответ"), потенциально важную для оценивания размера сенсибилизирующей способности веществ при условии его применения в рамках комплексных исследовательских подходов, таких как IATA, подобно тому, как это предусмотрено для VRM [27]. Тем не менее сохраняется необходимость проведения дальнейших работ, желательно с использованием данных, полученных на человеке, в целях определения конкретного содержательного вклада, который проведение испытаний по методу LuSens, наряду с другими доступными источниками информации, может вносить в подготовку оценки сенсибилизирующей способности, прежде всего в контексте IATA [31]. Примеры использования результатов, полученных при помощи методов на основе сигнального пути ARE-Nrf2 с использованием люциферазы, в сочетании с информацией из других источников приведены в документах по ссылкам [32], [31].
3.3.2 Сущность метода испытания
3.3.2.1 Метод исследования LuSens предусматривает использование иммортализованной линии адгерентных клеток, полученных из человеческих кератиноцитов и стабильно содержащих репортерный ген люциферазы, контролируемый элементом антиоксидантного ответа гена крысы NQO1 [41]. Известно, что активация ARE-зависимых генов, таких как NQO1, происходит при воздействии веществ, способных вызывать контактную сенсибилизацию [49], [50]. Таким образом, клеточная линия характеризуется наличием гена люциферазы, контролируемого на уровне транскрипции промотором, слитым с элементом ARE [7]. Сигнал люциферазы свидетельствует об активации сенсибилизирующим веществом эндогенных Nrf2-зависимых генов; тезис о зависимости появления люциферазного сигнала в рекомбинантной клеточной линии от действия Nrf2 имеет прямое научное подтверждение для VMR [28] и косвенное - для LuSens [7]. Указанный факт дает возможность выполнять количественные измерения индукции гена люциферазы (путем наблюдения за интенсивностью люминесценции) с использованием хорошо изученных фотогенных субстратов люциферазы в качестве индикатора активности фактора транскрипции Nrf2 в клетках после воздействия на них электрофильных химических веществ.
3.3.2.3 До того как приступить к регулярному применению метода LuSens в соответствии с настоящим руководством по проведению испытаний, лаборатории должны подтвердить свою техническую компетентность путем исследования десяти специально отобранных химических веществ, перечисленных в приложении D.
3.3.3 Методика испытаний
_______________
3.3.3.1 Подготовка культур кератиноцитов
3.3.3.1.1 Для исследования используют трансгенную линию клеток LuSens, снабженную стабильной вставкой репортерного гена люциферазы, контролируемого элементом ARE. После получения клетки размножают в порядке, установленном протоколом метода исследования (например, выполняют в общей сложности от одного до трех пассажей), и оставляют на хранение в замороженном состоянии в форме гомогенной маточной суспензии. Клетки из этого исходного материала по мере необходимости размножают в пределах не более чем 20 пассажей для использования в процессе рутинных испытаний в сочетании с соответствующей поддерживающей/ростовой питательной средой (например, модифицированной по способу Дульбекко средой Игла (DMEM), с добавлением сыворотки крови и антибиотиков, таких как пуромицин в поддерживающей среде (для целей отбора) и пенициллин/стрептомицин (во избежание загрязнения культуры)), как указано в действующем протоколе для метода исследования [51]. Напротив, в процессе испытаний в питательную среду не должны добавляться антибиотики.
3.3.3.1.2 Конфлюентность используемых клеток должна соответствовать значению от 80% до 90%, в то же время важно следить за тем, чтобы выращиваемые клетки ни в коем случае не достигали стопроцентной конфлюентности. За день до начала испытаний необходимое количество отобранных клеток помещают в лунки 96-луночных планшетов, придерживаясь оптимальной плотности посева (10000 клеток/лунку). В процессе посева важно контролировать отсутствие нежелательного осаждения клеток в исходном материале, чтобы обеспечить равномерное количественное распределение клеток между лунками. Следствием неравномерного посева может стать высокая изменчивость результатов для разных лунок. При каждом повторении непосредственно для измерений активности люциферазы с каждым значением концентрации исследуемого вещества служат три параллельно обрабатываемых пробы, в то время как еще три аналогичные пробы используются для наблюдения за жизнеспособностью клеток.
3.3.3.2 Приготовление исследуемой химической продукции и контрольных веществ
3.3.3.2.1 Приготовление растворов исследуемых и контрольных веществ (либо оттаивание их из стабильного замороженного состояния) осуществляют непосредственно в день проведения испытаний. Исследуемые химические вещества растворяют в подходящем растворителе, например диметилсульфоксиде (ДМСО, CAS No. 67-68-5, степень чистоты 99% или более), до такого конечного значения концентрации, которое обеспечивало бы достижение максимального значения концентрации, требуемого для проведения испытаний (например, 200 мМ). Растворы на основе ДМСО можно рассматривать как самостерилизующиеся, поэтому фильтровать их с целью стерилизации не требуется. Если исследуемые химические вещества не удается растворить в ДМСО, их растворяют в стерильной воде или непосредственно в питательной среде, принимая при этом необходимые меры, чтобы гарантировать стерильность полученных конечных растворов. Если для испытуемого химического вещества не может быть установлено точное значение молекулярной массы (ММ), то соответствующий стандартный раствор по умолчанию приготавливают со значением концентрации 200 мг/мл, или 20% (масса/объем). Использование иных растворителей, отличных от ДМСО, воды или питательной среды, должно быть подкреплено соответствующим научным обоснованием.
3.3.3.2.2 На основе стандартных растворов исследуемого химического вещества выполняют последовательные разбавления с использованием ДМСО или, в случае работы с веществами, нерастворимыми в ДМСО, стерильной воде или питательной среде, для получения соответствующих базовых значений концентрации этого химического вещества (например, 12 значений в интервале от 0,098 до 200 мМ). Независимо от выбранного растворителя растворы с базовыми значениями концентрации в дальнейшем подвергают дополнительному 25-кратному разбавлению в питательной среде, содержащей сыворотку крови, и уже после этого используют для обработки образцов с применением еще одного, 4-кратного коэффициента разбавления, чтобы достичь желаемых конечных значений концентрации исследуемого химического вещества (например, варьирующихся в интервале от 0,98 до 2000 мкМ из расчета коэффициента разбавления, равного 2). При проведении испытаний химических веществ, для которых не могут быть установлены точные значения ММ, последовательные разбавления аналогичным образом выполняют с использованием ДМСО или другого подходящего растворителя, а именно так, чтобы получить соответствующие конечные значения концентрации (например, в интервале от 0,98 до 2000 мкг/мл).
3.3.3.2.4 При каждом повторении анализу параллельно подвергают контрольную пробу соответствующего растворителя/вещества-носителя (например, ДМСО), для которой на каждом планшете следует зарезервировать достаточное количество лунок (например, 12 для испытаний на цитотоксичность для подбора диапазона значений дозы и 24 для основной части испытаний с измерениями активности люциферазы, как указано в действующем протоколе [51]). Контрольную пробу растворителя/вещества-носителя разбавляют в том же порядке, что и растворы с базовыми значениями концентрации согласно 3.3.3.2.2, таким образом, конечное значение концентрации растворителя/вещества-носителя в ней должно соответствовать аналогичному установленному значению концентрации для исследуемой химической продукции и вещества положительной контрольной пробы (т.е. 1%) и не должно оказывать существенного влияния на жизнеспособность клеток. Для веществ, нерастворимых в ДМСО, разбавления которых были приготовлены на воде, уровень содержания ДМСО во всех лунках, в которые помещается конечный испытуемый раствор, должен быть доведен до значения, аналогичного значению для растворов других исследуемых и контрольных химических веществ (1%).
3.3.3.2.5 При каждом повторении анализу параллельно подвергают также отрицательную контрольную пробу, для которой на каждом планшете следует зарезервировать достаточное количество лунок (например, 3 для испытаний на цитотоксичность для подбора диапазона значений дозы и 6 для основной части испытаний с измерениями активности люциферазы, как указано в действующем протоколе [51]). При проведении испытаний по методу LuSens для целей параллельного отрицательного контроля используют DL-молочную кислоту в концентрации 5000 мкМ (или 450 мкг/мл) (CAS No. 50-21-5, степень чистоты 99% или более), о которой известно, что она не обладает сенсибилизирующими свойствами и обеспечивает получение отрицательного прогнозного заключения по результатам применения рассматриваемого метода. Использование для приготовления отрицательных контрольных проб других подходящих химических веществ допускается при наличии данных прошлых испытаний, подтверждающих их соответствие сопоставимым критериям приемлемости при выполнении аналитического цикла. Далее, в соответствии с методом LuSens в ходе испытаний необходимо предусмотреть наличие достаточного количества лунок (например, 6 для испытаний на цитотоксичность для подбора диапазона значений дозы и 12 для основной части испытаний с измерениями активности люциферазы, как указано в действующем протоколе [51]), содержащих холостую контрольную пробу питательной среды, единственными составляющими которой должны быть питательная среда и необработанные клетки.
3.3.3.3 Внесение исследуемой химической продукции и эталонных веществ
3.3.3.3.1 Подготовка соответствующего прогнозного заключения (положительного или отрицательного) для каждого исследуемого химического вещества или эталонных веществ положительной контрольной пробы требует проведения одного эксперимента, включающего в себя по меньшей мере два независимых повторения, по три параллельно обрабатываемые пробы в каждом (итого: n = 6). В случае несогласующихся результатов между двумя независимыми повторениями выполняют третье повторение с тремя параллельно обрабатываемыми пробами (итого: n = 9). Независимые повторения выполняют в разные дни, с использованием свежих стандартных растворов исследуемых химических веществ и с независимо отобранными образцами клеточного материала. Указанное условие не исключает, однако, возможности принадлежности отобранных клеток к одному и тому же пассажу клеточной культуры.
3.3.3.3.2 После посева на 96-луночные микротитровальные планшеты, который выполняется в порядке, описанном в 3.3.3.1.2, образцы клеток оставляют для дальнейшего роста в течение 24 ч. После этого использованную питательную среду удаляют и заменяют ее свежей питательной средой (150 мкл DMEM с добавлением сыворотки крови, но без добавления антибиотиков, как установлено в действующем протоколе для метода исследования [51]), в которую дополнительно вносят 50 мкл 25-кратно разбавленной исследуемой химической продукции или вещества контрольной пробы соответственно. По меньшей мере одна лунка на каждом планшете должна оставаться пустой (без образцов клеток и без добавления химической продукции), что позволяет выполнять оценивание соответствующих фоновых значений.
3.3.3.4 Измерения активности люциферазы
3.3.3.4.1 Для надлежащего определения значений показателя люминесценции решающее значение имеют следующие факторы:
- выбор люминометра с достаточным уровнем чувствительности;
- использование микропланшета с лунками достаточной глубины, не допускающего перекрестного светового загрязнения;
- использование субстрата люциферазы, обеспечивающего достаточную интенсивность светового излучения, для достижения приемлемого уровня чувствительности и снижения изменчивости результатов;
- приемлемый и постоянный уровень фоновой освещенности.
Перед началом испытаний проводят контрольный эксперимент по схеме, описанной в приложении F, чтобы убедиться в соблюдении всех трех приведенных выше требований.
3.3.3.4.2 По окончании 48-часового периода воздействия исследуемой химической продукции и эталонных веществ образцы клеток в лунках промывают фосфатным буферным солевым раствором и для подготовки к последующему определению характеристик люминесценции добавляют в каждую лунку соответствующий лизисный буферный раствор, выдерживая его с образцами в течение достаточного количества времени (например, в течение 5-10 мин в темном месте).
3.3.3.4.3 После этого планшеты с клеточным лизатом помещают в люминометр для выполнения измерений в соответствии со специальной программой, предусмотренной действующим протоколом для метода исследования [51]. Выбор параметров, отличных от указанных, например с учетом конструктивных особенностей используемой модели люминометра, должен быть подкреплен соответствующим обоснованием. Дополнительно для целей измерений допускается использование так называемых "тлеющих" люминесцентных субстратов при условии положительного исхода контрольного эксперимента, проведение которого предусмотрено приложением F.
3.3.3.5 Оценка цитотоксичности
3.3.4 Данные и протокол испытаний
Оценивание данных
3.3.4.1 При проведении испытаний по методу LuSens вычислению подлежат значения следующих параметров (соответствующие уравнения см. в приложении G):
- кратное значение уровня повышения индукции активности люциферазы при всех используемых значениях концентрации исследуемой химической продукции, положительной и отрицательной контрольных проб;
Критерии приемлемости
3.3.4.5 При проведении испытаний по методу LuSens должны соблюдаться перечисленные ниже критерии приемлемости. Если какой-либо из этих критериев не выполняется, полученные данные признают недостоверными и выполняют еще одно повторение.
- Среднее значение повышения уровня индукции активности люциферазы для положительной контрольной пробы, а именно ДМЭГ в концентрации 120 мкМ (или иной сопоставимой концентрации - см. 3.3.3.2.6), должно соответствовать 2,5 или более, при этом положительная контрольная проба должна обеспечивать сохранение относительной жизнеспособности клеток на уровне 70% или более по сравнению с контрольной пробой растворителя/вещества-носителя.
- Среднее значение повышения уровня индукции активности люциферазы для отрицательной контрольной пробы, а именно DL-молочной кислоты в концентрации 5000 мкМ, и базовый уровень экспрессии для необработанных клеток должны быть в 1,5 раза ниже по сравнению со средними значениями для контрольной пробы растворителя/вещества-носителя.
- Среднее значение коэффициента вариации результатов измерений люминисценции для контрольных проб растворителя/вещества-носителя (например, ДМСО) должно составлять менее 20% в каждом повторении.
- По меньшей мере три используемых значения концентрации должны обеспечивать сохранение жизнеспособности клеток на уровне не менее чем 70% по сравнению с контрольной пробой растворителя/вещества-носителя. Помимо этого, для признания результата исследования химической продукции отрицательным важно, чтобы по меньшей мере одно значение ее концентрации, используемое при испытаниях, оказывало цитотоксическое воздействие, т.е. обеспечивало снижение жизнеспособности клеток до уровня менее 70%, или максимальное используемое значение концентрации для этого вещества равнялось 2000 мкМ (либо 2000 мкг/мл - если точное значение его молекулярной массы неизвестно).
Интерпретация результатов и модель построения прогнозов
3.3.4.7 Положительное прогнозное заключение по результатам применения метода LuSens подготавливают в случае строгого выполнения следующих условий для двух из двух или двух из трех повторений, в противном случае по результатам применения метода подготавливают отрицательное прогнозное заключение (рис.1):
3.3.4.8 Отрицательные результаты, полученные для исследуемых химических веществ, не способных образовывать устойчивую взвесь в соответствующих средах, не испытывавшихся со значениями концентрации до 2000 мкМ (либо 2000 мкг/мл - если точное значение их молекулярной массы неизвестно) включительно и не проявляющих цитотоксических свойств ни с одним используемым значением концентрации (см. 3.3.4.5), в свою очередь должны определяться как "неубедительные" (см. 3.3.1.4).
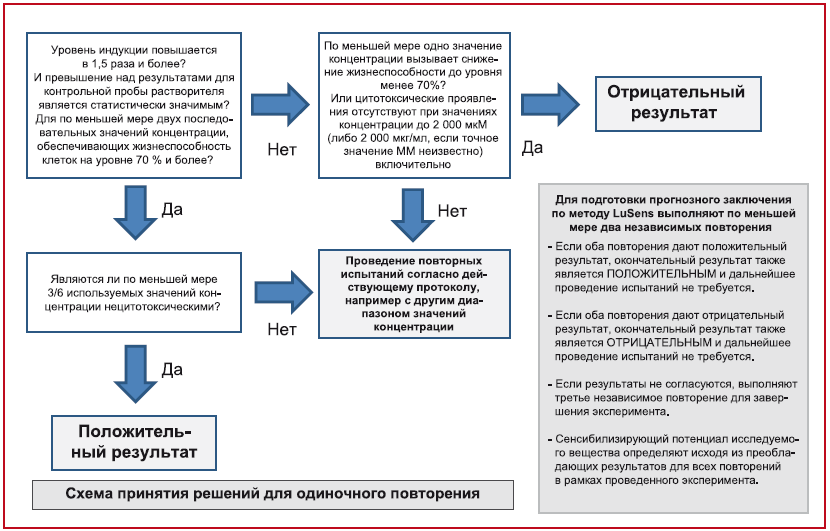 |
Рисунок 2 - Обзор критериев, применяемых для построения прогнозов в соответствии с методом исследования LuSens
Прогнозное заключение, подготавливаемое по результатам применения метода LuSens, должно рассматриваться в контексте соответствующего установленного подхода или IATA и с учетом положений 3.1.3 и 3.1.4.
Протокол испытаний
3.3.4.9 Протокол испытаний должен включать в себя следующую информацию:
Исследуемая химическая продукция
Однокомпонентное вещество:
- химическое наименование, а именно название (названия) по IUPAC или CAS, регистрационный номер (номера) CAS, коды SMILES или InChl, структурную формулу и/или другие отличительные признаки, такие как номер производственной/коммерческой партии и конечный срок годности;
- внешний вид, растворимость в воде и ДМСО, молекулярную массу, а также другие важные физико-химические характеристики;
- сведения о (не) растворимости или способности образовывать устойчивую взвесь в используемых рабочих средах;
- степень чистоты, химическую характеристику примесей, с учетом целесообразности и возможности практической реализации и т.п.;
- способ обработки перед началом испытаний, если такая обработка проводилась (например, подогрев, измельчение);
- значение (значения) концентрации веществ при проведении испытаний;
- условия хранения и сведения о стабильности веществ, если таковые имеются.
Многокомпонентное вещество с неопределенным или переменным составом (UVCB) или смесь веществ:
- полное описание химической продукции, например химическое обозначение (см. выше), степень чистоты, количественные характеристики и соответствующие физико-химические характеристики (см. выше) ее составляющих;
- внешний вид, растворимость в воде и ДМСО, а также другие важные физико-химические характеристики;
- значение молекулярной массы или - для смесей веществ/полимеров с известным составом - усредненной молекулярной массы либо иные сведения, важные для целей исследования;
- сведения о (не) растворимости или способности образовывать устойчивую взвесь в используемых рабочих средах;
- способ обработки перед началом испытаний, если такая обработка проводилась (например, подогрев, измельчение);
- значение (значения) концентрации веществ при проведении испытаний;
- условия хранения и сведения о стабильности веществ, если таковые имеются.
Контрольные пробы
Положительная контрольная проба:
- химическое наименование, а именно название (названия) по IUPAC или CAS, регистрационный номер (номера) CAS, коды SMILES или InChl, структурную формулу и/или другие отличительные признаки;
- внешний вид, растворимость в воде и ДМСО, а также другие важные физико-химические характеристики;
- степень чистоты, химическую характеристику примесей, с учетом целесообразности и возможности практической реализации и т.п.;
- способ обработки перед началом испытаний, если такая обработка проводилась (например, подогрев, измельчение);
- значение (значения) концентрации веществ при проведении испытаний;
- условия хранения и сведения о стабильности веществ, если таковые имеются;
- ссылки на результаты прошлых испытаний положительных контрольных проб, если таковые проводились, подтверждающие достоверный характер критериев приемлемости, использованных для циклов испытаний.
Контрольная проба растворителя/вещества-носителя:
- химическое наименование, а именно название (названия) по IUPAC или CAS, регистрационный номер (номера) CAS и/или другие отличительные признаки;
- степень чистоты, химическую характеристику примесей, с учетом целесообразности и возможности практической реализации и т.п.;
- внешний вид, молекулярную массу, а также другие важные физико-химические характеристики, если используемые растворитель/вещество-носитель/отрицательная контрольная проба отличаются от указанных в 3.3;
- условия хранения и сведения о стабильности веществ, если таковые имеются;
- обоснование выбора растворителя/вещества-носителя для каждой исследуемой химической продукции.
Отрицательная контрольная проба:
- химическое наименование, а именно название (названия) по IUPAC или CAS, регистрационный номер (номера) CAS и/или другие отличительные признаки;
- степень чистоты, химическую характеристику примесей, с учетом целесообразности и возможности практической реализации и т.п.;
- внешний вид, молекулярную массу, а также другие важные физико-химические характеристики, если используемые отрицательные контрольные пробы отличаются от указанных в 3.3;
- сведения об условиях хранения и стабильности вещества, если таковые имеются;
- обоснование выбора вещества отрицательной контрольной пробы в случае использования для этой цели веществ, отличных от указанных в настоящем стандарте.
Условия испытаний в соответствии с применяемым методом
- название/имя и адрес лица/организации, осуществлявших финансирование, лаборатории, где проводились испытания, а также имя руководителя исследования;
- описание применявшегося метода;
- сведения об использованной клеточной линии, условиях хранения клеточного материала и источниках его поступления (например, о лаборатории или учреждении, предоставивших материал);
- сведения о числе пассажей и уровне конфлюентности клеток, использованных для испытаний;
- сведения о методе подсчета клеток, применявшемся при посеве клеток перед проведением испытаний, и мерах, принимавшихся для обеспечения их равномерного количественного распределения между лунками (см. 13);
- сведения о люминометре, с помощью которого выполнялись измерения (например, модель), а также о настройках прибора, использованном субстрате люциферазы и данных, подтверждающих правильность измерений интенсивности люминесценции по итогам контрольного эксперимента, порядок проведения которого описан в приложении 3 к настоящему дополнению;
- применяемый порядок подтверждения достаточной квалификации лаборатории для владения данным методом исследования (путем проведения испытаний специально отобранных для этого химических веществ и т.п.) или подтверждения воспроизводимости результатов метода исследования за известный период времени.
Порядок испытаний
- сведения о количестве повторений и числе параллельно обрабатывавшихся образцов;
- значение концентрации исследуемого химического вещества, порядок его нанесения и продолжительность экспозиции (если отличаются от рекомендованных)
- описание применявшихся критериев оценки и принятия решений;
- описание применявшихся критериев приемлемости результатов испытаний;
- описание любых изменений, внесенных в методику испытаний.
Результаты
- средние значения (т.е. средние арифметические значения показателей жизнеспособности клеток и повышения уровня индукции активности люциферазы), а также СО по всей совокупности данных для всех отдельных повторений;
- указание класса исследуемого химического вещества в соответствии с моделью построения прогнозов;
- значение коэффициента вариации, установленное исходя из результатов измерений люминесценции контрольной пробы растворителя/вещества-носителя для каждого эксперимента;
- график, представляющий кривые зависимости "доза - эффект" для изменений уровня индукции активности люциферазы и показателей жизнеспособности;
- прочие наблюдения, важные для результатов исследования, если таковые имеются.
Оценка результатов
- оценка результатов, полученных с применением метода исследования LuSens;
- оценка результатов, полученных с применением метода, в общем контексте IATA при условии наличия значимой информации из иных источников.
Выводы
Приложение A
(обязательное)
Химические вещества для проверки квалификации
Сенсибилизация кожи in vitro. Метод исследования KeratinoSens™ на основе сигнального пути ARE-Nrf2 с использованием люциферазы
Таблица A.1 - Список рекомендованных веществ для проверки квалификации при проведении испытаний по методу KeratinoSens™
Химические вещества для проверки квалификации | Регистра- ционный номер CAS | Агрегатное состояние | Прогнозное заключение по методу LLNA (1) | Кате- гория хими- ческой проду- кции (2) | Прогнозное заключение по методу KeratinoSens™ (3) | Диапазон нормиро- ванных значений (мкМ) (4) | Диапазон нормиро- ванных значений (мкМ) (4) |
Салициловая кислота | 69-72-7 | Твердая | Не вызывает сенсиби- лизацию | Кат.6 | Отрицательное | >1000 | >1000 |
Молочная кислота | 50-21-5 | Жидкая | Не вызывает сенсиби- лизацию | Кат.6 | Отрицательное | >1000 | >1000 |
Глицерин | 56-81-5 | Жидкая | Не вызывает сенсиби- лизацию | Кат.6 | Отрицательное | >1000 | >1000 |
Изопропанол | 67-63-0 | Жидкая | Не вызывает сенсиби- лизацию | Кат.5 | Отрицательное | >1000 | >1000 |
Этиленгликоль диметакрилат | 97-90-5 | Жидкая | Вызывает сенсиби- лизацию (слабую) | Кат.4 | Положительное | 5-125 | >500 |
Коричный спирт | 104-54-1 | Твердая | Вызывает сенсиби- лизацию (слабую) | Кат.3 | Положительное | 25-175 | >1000 |
2-меркапто- бензотиа- зол | 149-30-4 | Твердая | Вызывает сенсиби- лизацию (умеренную) | Кат.3 | Положительное | 25-250 | >500 |
4-метил- аминофенол сульфат | 55-55-0 | Твердая | Вызывает сенсиби- лизацию (сильную) | Кат.3 | Положительное | <12,5 | 20-200 |
Метил- дибромо- глутаронитрил | 35691- 65-7 | Твердая | Вызывает сенсиби- лизацию (сильную) | Кат.2 | Положительное | <20 | 20-100 |
2,4-динитро- хлорбензол | 97-00-7 | Твердая | Вызывает сенсиби- лизацию (экстре- мальную) | Кат.1 | Положительное | <12,5 | 5-20 |
Примечание 1 - Прогнозные заключения о степени опасности (сенсибилизирующей способности) химической продукции in vivo подготовлены в соответствии с данными, полученными по методу LLNA [5]. Степень сенсибилизирующей способности веществ in vivo оценивалась с использованием критериев, предложенных ЕСЕТОС [31]. Примечание 2 - Согласно Баскеттеру (Basketter) и его коллегам [46], кат.1 вызывает отчетливые признаки контактной аллергии, кат.2 является частой причиной развития контактной аллергии, кат.3 - распространенной причиной развития контактной аллергии, кат.4 - малораспространенной причиной развития контактной аллергии, кат.5 - редкой причиной развития контактной аллергии, а кат.6, как правило, не вызывает каких-либо признаков контактной аллергии [46]. Примечание 3 - Прогнозное заключение, подготавливаемое по результатам применения метода KeratinoSens™, должно рассматриваться в контексте соответствующего установленного подхода или IATA и с учетом положений 3.1.3 и 3.1.4. Примечание 4 - На основе данных предыдущих наблюдений [6]. | |||||||
Приложение B
(обязательное)
Адаптация метода исследования KeratinoSens™ к применению с клеточной культурой, не содержащей ксенобиотиков, с использованием человеческих биоматериалов
Адаптированная реализация метода исследования KeratinoSens™ может быть достигнута с использованием человеческих биоматериалов (сыворотки крови человека и рекомбинантного человеческого трипсина) для получения культуры клеток, не содержащей ксенобиотиков, при условии подтверждения реализующей его лабораторией своей достаточной технической компетентности (как описано в приложении А) для применения такого адаптированного метода [47].
Таблица B.1 - Сводная таблица изменений для адаптации метода
Параметры метода | Валидированный референтный метод (KeratinoSens™) (дополнение 1А) | Адаптированный метод без ксенобиотиков (настоящее приложение) |
Сыворотка | Указано: "сыворотка" (в протоколе DB-ALM 155 "фетальная телячья сыворотка") (3.3.3.1.1) | Установлено: сыворотка крови человека, 10% |
Измерения цитотоксичности | МТТ: инкубация 4 ч; 10% НДС на ночь для растворения; считывание показаний на 600 нм (3.2.3.5) | МТТ (1 мг/мл): инкубация 3 ч; изопропанол для растворения; считывание показаний на 570 нм |
Положительная контрольная проба | Коричный альдегид, 4-64 мкМ (3.2.3.2.4) | Коричный альдегид, 8-128 мкМ |
Трипсин | Не указано (в протоколе DB-ALM 155 трипсин ЭДТА) | Рекомбинантный трипсин неживотного происхождения (TrypZean, Sigma-Aldrich Т3499) |
Основные изменения, внесенные для формирования нексенобиотических условий. Прочие изменения, внесенные в параметры метода [47]. | ||
Что касается всех прочих аспектов, адаптированная реализация метода исследования KeratinoSens™ без ксенобиотиков на основе только материалов, взятых из тела человека, должна отвечать стандартным требованиям метода, описанным в 3.2 и в протоколе DB-ALM [25] для эталонной линии клеток KeratinoSens™.
Приложение C
(обязательное)
Контроль качества измерений люминесценции
Базовый эксперимент для обеспечения оптимальных условий измерений люминесценции при реализации метода исследования KeratinoSens™
Решающее значение для получения достоверных результатов при выполнении измерений с помощью люминометра имеет соблюдение следующих трех условий:
- обеспечение достаточного уровня чувствительности для поддержания стабильности фоновых показателей в контрольных лунках;
- отсутствие градиента показаний в пределах одного планшета в связи с продолжительным временем считывания;
- отсутствие светового загрязнения в лунках, граничащих с лунками с высоким уровнем люминесценции.
Перед тем как приступить к испытаниям, рекомендуется убедиться в правильности измерений люминесценции путем выполнения их на контрольном планшете, как описано ниже (методом тройного анализа).
Таблица C.1 - Схема заполнения планшета для первого проверочного эксперимента
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
A | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО |
B | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО |
C | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО |
D | ДМЭГ 0,98 | ДМЭГ 1,95 | ДМЭГ 3,9 | ДМЭГ 7,8 | ДМЭГ 15,6 | ДМЭГ 31,25 | ДМЭГ 62,5 | ДМЭГ 125 | ДМЭГ 250 | ДМЭГ 500 | ДМЭГ 1000 | ДМЭГ 2000 |
E | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО |
F | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО |
G | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО |
H | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | КА 4 | КА 8 | КА 16 | КА 32 | КА 64 | Холо- стая проба |
Примечание - ДМЭГ(EGDMA) = этиленгликоль диметакрилат (CAS No: 97-90-5), высокоиндуцирующее соединение. КА (С) = коричный альдегид, положительная контрольная проба (CAS N: 104-55-2). Значения концентрации указаны в мкМ. | ||||||||||||
Результаты анализа контроля качества должны подтверждать следующее:
- зависимость между увеличением дозы и повышением уровня индукции люциферазы в лунках с H7 по H11, с кратным повышением индукции в интервале от 2 до 8 в лунке H11;
- отсутствие зависимости между увеличением дозы и повышением уровня индукции люциферазы в рядах C и E (отсутствие значений, равных или превышающих 1,5 (в идеальном случае 1,3) с учетом вероятного светового загрязнения, в особенности по соседству с лунками, демонстрирующими высокий уровень люминесценции, в ряду с EGMDA;
- отсутствие статистически значимых расхождений между рядами A, B, C, E, F и G (т.е. без уклона над плитой);
- изменчивость в любом из рядов A, B, C, E, F и G, а также в лунках с ДМСО в ряду H, на уровне менее 20% (т.е. стабильные фоновые показатели).
Приложение D
(обязательное)
Химические вещества для проверки квалификации
Кожная сенсибилизация in vitro. Метод исследования LuSens на основе сигнального пути ARE-Nrf2 с использованием люциферазы
До того как приступить к регулярному применению метода исследования согласно 3.3, лаборатории должны подтвердить свою техническую компетентность, подготовив достоверный прогноз для 10 рекомендованных наименований химических веществ для проверки квалификации, перечисленных в таблице Г.1, и правильно определив исходные значения показателей в соответствующем нормированном диапазоне по меньшей мере для восьми из десяти таких веществ. Вещества для проверки квалификации согласно приведенному списку подобраны таким образом, чтобы охватить весь диапазон возможных реакций при развитии кожной сенсибилизации. Дополнительными критериями отбора послужили доступность этих веществ для коммерческого приобретения и наличие для них как достоверных справочных данных, полученных in vivo, так и достоверных данных, полученных in vitro с применением метода исследования LuSens.
Таблица D.1 - Список рекомендованных веществ для проверки квалификации при проведении исследований по методу LuSens
Химические | Регистра- | Агрега- | Прогнозное | Категория | LuSens | ||
вещества для проверки квалификации | ционный номер CAS | тное состоя- ние | заключение по методу LLNA (1) | опасности для человека (2) | Прогнозное заключение In Vitro (3) | (мкМ) Диапазон норми- рованных значений (4) | (мкМ)
Диапазон нормиро- ванных значений (4) |
Салициловая кислота | 69-72-7 | Твердая | Не вызывает сенсиби- лизацию | Кат.6 | Отрица- тельное | >1000 | >2000 |
Глицерин | 56-81-5 | Жидкая | Не вызывает сенсиби- лизацию | Кат.6 | Отрица- тельное | >1000 | >2000 |
Изопропанол | 67-63-0 | Жидкая | Не вызывает сенсиби- лизацию | Кат.5 | Отрица- тельное | >1000 | >2000 |
Сульфа- ниламид | 63-74-1 | Твердая | Не вызывает сенсиби- лизацию | Отсутствует (Basketter et al. 1994) | Отрица- тельное | >1000 | >2000 |
Эвгенол | 97-53-0 | Жидкая | Вызывает сенсиби- лизацию (слабую) | Кат.3 | Положи- тельное | <500 | <1000 |
Коричный спирт | 104-54-1 | Твердая | Вызывает сенсиби- лизацию (слабую) | Кат.3 | Положи- тельное | <170 | >420 |
2-меркапто- бензотиазол | 149-30-4 | Твердая | Вызывает сенсиби- лизацию (умеренную) | Кат.3 | Положи- тельное | <800 | <2000 |
4-метил- амино-фенол сульфат | 55-55-0 | Твердая | Вызывает сенсиби- лизацию (сильную) | Кат.3 | Положи- тельное | <30 | <50 |
Метилди- бромоглутаро- нитрил | 35691- 65-7 | Твердая | Вызывает сенсиби- лизацию (сильную) | Кат.2 | Положи- тельное | <25 | <50 |
2,4-динитро- хлорбензол | 97-00-7 | Твердая | Вызывает сенсиби- лизацию (экстре- мальную) | Кат.1 | Положи- тельное | <5 | <10 |
Примечание 1 - Заключения о степени опасности (сенсибилизирующей способности) химических веществ in vivo подготовлены в соответствии с данными, полученными по методу LLNA [5]. Степень сенсибилизирующей способности веществ in vivo оценивалась с использованием критериев, предложенных ЕСЕТОС [31]. Примечание 2 - Согласно Баскеттеру (Basketter) и его коллегам [45], кат.1 вызывает отчетливые признаки контактной аллергии, кат.2 является частой причиной развития контактной аллергии, кат.3 - распространенной причиной развития контактной аллергии, кат.4 - малораспространенной причиной развития контактной аллергии, кат.5 - редкой причиной развития контактной аллергии, а кат.6, как правило, не вызывает каких-либо признаков контактной аллергии. Примечание 3 - Прогнозное заключение, подготавливаемое по результатам применения метода исследования на основе сигнального пути ARE-Nrf2 с использованием люциферазы, должно рассматриваться в контексте соответствующего установленного подхода или IATA и с учетом положений 3.1.3 и 3.1.4. Примечание 4 - На основе данных предыдущих наблюдений [7], [8]. При том что показатель не является частью модели построения прогнозов LuSens, его значение может быть определено на основе полученных данных и использовано для уточнения границ диапазонов реакции на воздействие химических веществ, включенных в список для проверки квалификации при проведении исследований по методу LuSens. Представленные значения были рассчитаны с учетом требований приложения IA (3.3.3.5). | |||||||
Приложение E
(обязательное)
Сравнение основных этапов протоколов проведения испытаний для методов LuSens и VRM KeratinoSens™
VRM (KeratinoSens™) | LuSens | |
Подготовка культур кератиноцитов | ||
Размножение | от 2 до 4 пассажей | от 1 до 3 пассажей |
Криоконсервация и хранение | от 2 до 4 пассажей | 3 пассажа |
Количество пассажей клеточных культур перед проведением основного эксперимента | не менее 2 | не менее 5 |
Максимальное число пассажей после хранения в замороженном состоянии | 25 пассажей | 20 пассажей для испытаний на цитотоксичность с целью подбора диапазона значений дозы. 15 пассажей для основной части испытаний с измерениями активности люциферазы |
Среда размножения | DMEM, с добавлением сыворотки крови и генетицина | DMEM, с добавлением сыворотки крови, пенициллина/стрептомицина и пуромицина |
Уровень конфлюентности клеток при проведении испытаний | от 80% до 90% | |
Срок отбора клеток перед проведением испытаний | 1 день | |
Формат микропланшетов для проведения испытаний | 96-луночные планшеты | |
Плотность посева клеток для проведения испытаний | 10000 клеток/лунку, за исключением лунки, предназначенной для измерений фоновых показателей | |
Количество параллельно обрабатываемых образцов для каждого значения концентрации исследуемого химического вещества (в каждом повторении) | 3 лунки (на разных планшетах) для измерений активности люциферазы 1 лунка для оценивания уровня цитотоксичности | по 3 лунки (на одном и том же планшете) для всех видов испытаний, т.е. для испытаний на цитотоксичность с целью подбора диапазона значений дозы и для основной части испытаний с измерениями активности люциферазы (итого: 3 лунки для измерений активности люциферазы и 3 лунки для параллельного оценивания уровней цитотоксичности) |
Подготовка исследуемых и контрольных химических веществ | ||
Приготовление растворов | Непосредственно в день испытаний | |
Растворитель | ДМСО, стерильная вода или питательная среда для исследуемых веществ, нерастворимых в ДМСО | ДМСО или питательная среда для исследуемых веществ, нерастворимых в ДМСО |
Концентрация стандартного раствора | 200 мМ | |
Исследуемые вещества, точная молекулярная масса которых неизвестна | Стандартный раствор в концентрации по умолчанию (40 мг/мл, или 4% (масса/объем)) | Стандартный раствор в концентрации по умолчанию (200 мг/мл, или 20% (масса/объем)) |
Диапазон конечных значений концентрации для 96-луночного планшета | 12 значений концентрации (2-кратное разбавление) в диапазоне от 0,98 до 2000 мкМ | Испытания на цитотоксичность с целью подбора диапазона значений дозы: 12 значений концентрации (2-кратное разбавление) в диапазоне от 0,98 до 2000 мкМ Основная часть испытаний с измерениями активности люциферазы: 6 значений концентрации (1,2-кратное разбавление) в диапазоне от /2,074 до мкМ |
Контрольная проба растворителя | 1%-ный раствор ДМСО (18 параллельно обрабатываемых проб в каждом повторении) | 1%-ный раствор ДМСО 12 параллельно обрабатываемых проб в каждом повторении для испытаний на цитотоксичность с целью подбора диапазона значений дозы и 24 параллельно обрабатываемых пробы в каждом повторении для основной части испытаний с измерениями люциферазы |
Отрицательная контрольная проба | См. контрольную пробу растворителя | DL-молочная кислота, 5000 М 3 параллельно обрабатываемых пробы в каждом повторении для испытаний на цитотоксичность с целью подбора диапазона значений дозы и 6 параллельно обрабатываемых проб в каждом повторении для основной части испытаний с измерениями люциферазы |
Положительная контрольная проба | Коричный альдегид Четыре значения концентрации (2-кратное разбавление) в диапазоне от 4 до 64 мкМ (3 параллельно обрабатываемых пробы в каждом повторении) | ДМЭГ, 120 М или с иным значением концентрации, обеспечивающим повышение уровня индукции люциферазы в 2,5 раза, при котором уровень жизнеспособности клеток соответствует 70% или более (2 параллельно обрабатываемых пробы в каждом повторении для испытаний на цитотоксичность с целью подбора диапазона значений дозы и 5 параллельно обрабатываемых проб в каждом повторении для основной части испытаний с измерениями люциферазы) |
Контрольная проба питательной среды | Не применяется | (6 параллельно обрабатываемых проб в каждом повторении для испытаний на цитотоксичность с целью подбора диапазона значений дозы и 12 параллельно обрабатываемых проб в каждом повторении для основной части испытаний с измерениями люциферазы) |
Холостая контрольная проба (без образцов клеток) | 3 параллельно обрабатываемых пробы в каждом повторении | 1 параллельно обрабатываемая проба в каждом повторении |
Внесение исследуемых и контрольных химических веществ и оцениваемые показатели | ||
Количество повторений для каждого значения концентрации исследуемого химического вещества | Не менее двух независимых повторений, по три параллельно обрабатываемых пробы в каждом (n = 6), а в случае получения несогласующихся результатов также третье, дополнительное повторение (n = 9). Все повторения выполняют в разные дни, с использованием свежих растворов исследуемых химических веществ и с независимо отобранными образцами клеточного материала (которые могут, однако, характеризоваться одинаковым числом пассажей клеток) | |
Среда, используемая для обработки клеток | 150 мкл питательной среды DMEM, с добавлением сыворотки крови, но без добавления антибиотиков (т.е. генетицина, пенициллина/стрептомицина и пуромицина), в которую помещают 50 мкл раствора исследуемого вещества и контрольных веществ с 25-кратным разбавлением | |
Время экспозиции | 48 часов при значении температуры (37 ±1)°C и уровне содержания в воздухе 5% Во избежание испарения летучих испытуемых веществ, с последующим перекрестным загрязнением ими соседних лунок, поверхность планшетов накрывают фольгой | |
Измерения люминесцентной активности | По окончании экспозиции образцы клеток промывают фосфатным буферным солевым раствором и, с целью подготовки к считыванию показаний люминесценции, добавляют в каждую лунку соответствующий лизисный буферный раствор, после чего оставляют на 20 мин при комнатной температуре. Пластины с клеточным лизатом помещают в люминометр для выполнения измерений в соответствии со следующей программой: (i) добавление субстрата люциферазы (по 50 мкл в каждую лунку), (ii) выдерживание в течение 1 с, (iii) интегрирование измеряемых значений активности люциферазы в течение 2 с | По окончании экспозиции в каждую лунку с целью подготовки к считыванию показаний люминесценции добавляют соответствующий лизисный буферный раствор и, помешивая, выдерживают в темном месте в течение 5-10 мин. Измерения люминесценции выполняют в течение 2 секунд с помощью люминометра. Прочие условия могут варьироваться в зависимости от используемой модели люминометра |
Оценивание уровня цитотоксичности | По окончании экспозиции добавляют раствор МТТ в концентрации 5 мг/мл и производят инкубирование клеток в течение 4 ч при температуре (37 ±1)°C и уровне содержания в воздухе 5% После этого образцы клеток оставляют на ночь для лизиса (с 10%-ным раствором НДС), затем перемешивают и измеряют их световое поглощение на длине волны 600 нм | По окончании экспозиции добавляют 200 мкл раствора МТТ (0,5 мг/мл) и производят инкубирование клеток в течение 2 ч при температуре (37 ±1)°C и уровне содержания в воздухе 5% Осуществляют лизис клеток в течение 5 мин (путем добавления 10%-ного (масса/объем) раствора НДС и 0,4%-ного (по объему) раствора уксусной кислоты в ДМСО), после чего измеряют световое поглощение образцов на длине волны 570 и 690 нм |
Оцениваемые показатели | : максимальное среднее значение кратного повышения индукции независимо от используемого значения концентрации : интерполированное значение концентрации, при котором наблюдается 1,5-кратное повышение уровня индукции активности люциферазы : интерполированные значения концентрации, при которых наблюдается 50%-ное и 30%-ное снижение уровня жизнеспособности клеток соответственно | Кратное значение повышения уровня индукции активности люциферазы как среднее для всех используемых значений концентрации Жизнеспособность клеток как среднее значение для всех используемых значений концентрации : интерполированное значение концентрации, при котором сохраняют жизнеспособность 75% клеток |
Критерии приемлемости | ||
Положительный контроль активности люциферазы | Статически значимое увеличение уровня индукции более чем в 1,5 раза по меньшей мере при одном используемом значении концентрации положительной контрольной пробы (коричного альдегида в концентрации от 4 до 64 мкМ). Значение для положительной контрольной пробы должно варьироваться в пределах 2 СО для среднего значения по результатам прошлых исследований (например, в интервале от 2 до 30 мкМ согласно соответствующим данным базы по валидации). Средний показатель повышения уровня индукции для коричного альдегида в концентрации 64 мкМ должен быть в пределах от 2 до 8 | Увеличение уровня индукции в 2,5 раза при использовании положительной контрольной пробы (например, ДМЭГ в концентрации 120 М) по сравнению с данными для контрольной пробы растворителя при нецитотоксическом значении концентрации, т.е. жизнеспособность на уровне 70% по сравнению с контрольной пробой растворителя |
Отрицательный контроль активности люциферазы | Не применяется | Увеличение уровня индукции менее чем в 1,5 раза при использовании отрицательной контрольной пробы (DL-молочной кислоты в концентрации 5000 мкМ) по сравнению с контрольной пробой растворителя |
Изменчивость результатов для контрольной пробы растворителя | Коэффициент вариации равен 20% (18 параллельно обрабатываемых проб) | Коэффициент вариации равен 20% (не менее 21 параллельно обрабатываемой пробы) |
Прочие требования | Не применяется | Не следует допускать, чтобы средний базовый уровень экспрессии для контрольной пробы питательной среды (содержащей только клетки и питательную среду) превышал уровень индукции активности люциферазы в 1,5 или более раза по сравнению с аналогичным показателем для контрольной пробы растворителя. По меньшей мере три используемых значения концентрации (из шести, принятых для основной части испытаний с измерениями активности люциферазы) не должны оказывать цитотоксическое воздействие (жизнеспособность клеток равна 70%). При этом, однако, если предполагается получение отрицательного результата, по меньшей мере одно используемое значение концентрации (из шести, принятых для основной части испытаний с измерениями активности люциферазы) должно оказывать цитотоксическое воздействие (жизнеспособность клеток менее 70%) |
Модель построения прогнозов | ||
Положительное прогнозное заключение подготавливают в случае строгого выполнения следующих условий для двух из двух или двух из трех повторений, в противном случае подготавливают отрицательное прогнозное заключение | 1. Кратное значение Imax для исследуемого химического вещества больше или равно 1,5 ( 1,5%) и статистически значимым образом отличается от аналогичного показателя для контрольной пробы растворителя/вещества-носителя (по результатам использования двустороннего непарного Т-критерия Стьюдента). 2. Уровень жизнеспособности клеток превышает 70% (>70%) при самом низком значении концентрации, соответствующем 1,5-кратному повышению уровня индукции активности люциферазы (т.е. при значении концентрации, служащем для определения параметра ). 3. Значение меньше 1000 (<1000) мкМ (либо 200 (<200) мкг/мл - если точное значение молекулярной массы неизвестно). При этом прослеживается отчетливая зависимость уровня индукции люциферазы от размера используемой дозы | 1. Повышение уровня индукции люциферазы в 1,5 раза или более ( 1,5%) по сравнению с аналогичным показателем для контрольной пробы растворителя наблюдается по меньшей мере для двух последовательных используемых значений концентрации, не вызывающих цитотоксических проявлений (т.е. таких, при которых уровень жизнеспособности клеток составляет 70% или более ( 70%)). 2. По меньшей мере три использованных значения концентрации не должны оказывать цитотоксического воздействия (уровень жизнеспособности клеток должен составлять 70% или более ( 70%)). |
Химическая продукция, не способная образовывать устойчивую взвесь | Отрицательные результаты, полученные для исследуемых химических веществ, не способных образовывать устойчивую взвесь при значениях концентрации менее 1000 мкМ (либо 200 мкг/мл - если точное значение их молекулярной массы неизвестно), определяются как "неубедительные" | Отрицательные результаты, полученные для исследуемых химических веществ, не способных образовывать устойчивую взвесь и не испытывавшихся со значениями концентрации до 2000 мкМ (либо 2000 мкг/мл - если точное значение их молекулярной массы неизвестно) включительно, определяются как "неубедительные" |
Приложение F
(обязательное)
Контроль качества измерений люминесценции
Базовый эксперимент для контроля оптимальных условий измерений люминесценции при реализации метода исследования LuSens
В целях обеспечения оптимальных условий измерения люминесценции, если анализ подобного рода осуществляется впервые, предварительно рекомендуется выполнить один или два аналитических цикла согласно методу исследования LuSens с ДМЭГ в качестве исследуемого вещества, с возрастающими значениями концентрации и с использованием схемы заполнения планшета, представленной ниже. При выполнении этих повторений необходимо учитывать следующие аспекты:
- уровень индукции люциферазы при обработке образцов растворами ДМЭГ с возрастающими значениями концентрации должен повышаться по мере увеличения размера используемой дозы (лунки A-C: 1-6);
- напротив, зависимость уровня индукции люциферазы от размера используемой дозы не должна прослеживаться в лунках D: 1-6 и A-D: 7 (т.е. пустых) при сравнении с уровнем люминесценции, наблюдаемым в лунках A-D: 8-12;
- процентное значение стандартного отклонения изменчивости по меньшей мере в 21 лунке с растворителем/веществом-носителем (F-G: 1-12) должно в среднем составлять менее 20% и не должно характеризоваться "градиентной" картиной изменения.
Таблица Е.1 - Схема заполнения планшета для первого проверочного эксперимента
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
A | ДМЭГ /2,07 | ДМЭГ /1,73 | ДМЭГ /1,44 | ДМЭГ /1,2 | ДМЭГ | ДМЭГ | ||||||
B | ДМЭГ /2,07 | ДМЭГ /1,73 | ДМЭГ /1,44 | ДМЭГ /1,2 | ДМЭГ | ДМЭГ | ||||||
C | ДМЭГ /2,07 | ДМЭГ /1,73 | ДМЭГ /1,44 | ДМЭГ | ДМЭГ | ДМЭГ | ||||||
D | ||||||||||||
E | Пита- тельная среда | Пита- тельная среда | Пита- тельная среда | Пита- тельная среда | Пита- тельная среда | Пита- тельная среда | Пита- тельная среда | Пита- тельная среда | Пита- тельная среда | Пита- тельная среда | Пита- тельная среда | Пита- тельная среда |
F | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО |
G | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО | ДМСО |
H | DL-молочная кислота, 5000 M | ДМЭГ, 120 М | Холо- стая проба | |||||||||
Приложение G
(обязательное)
Выполнение расчетов в соответствии с методом исследования LuSens
G.2 Уровень жизнеспособности клеток для целей метода исследования LuSens определяют в соответствии с уравнением Ж.2:
Приложение ДА
(справочное)
Сопоставление структуры настоящего стандарта со структурой международного документа
Таблица ДА.1
Структура настоящего стандарта | Структура международного документа | |||
Разделы | Подразделы | Перечисления | Разделы | Перечисления |
Введение | 1, 3-4 | - | ||
1 | - | - | 2 | - |
2 | - | - | 7, дополнение IA | - |
- | - | 7, дополнение IB | - | |
2.1 | - | Приложение 1 | - | |
2.2 | - | Приложение 1 | - | |
2.3 | - | Приложение 1 | - | |
2.4 | - | Приложение 1 | - | |
2.5 | - | Приложение 1 | - | |
2.6 | - | Приложение 1 | - | |
2.7 | - | Приложение 1 | - | |
2.8 | - | Приложение 1 | - | |
2.9 | - | Приложение 1 | - | |
2.10 | - | Приложение 1 | - | |
2.11 | - | Приложение 1 | - | |
2.12 | - | Приложение 1 | - | |
2.13 | - | Приложение 1 | - | |
2.14 | - | Приложение 1 | - | |
2.15 | - | Приложение 1 | - | |
2.16 | - | Приложение 1 | - | |
2.17 | - | Приложение 1 | - | |
2.18 | - | Приложение 1 | - | |
2.19 | - | Приложение 1 | - | |
2.20 | - | Приложение 1 | - | |
2.21 | - | Приложение 1 | - | |
2.22 | - | Приложение 1 | - | |
2.23 | - | Приложение 1 | - | |
2.24 | - | Приложение 1 | - | |
2.25 | - | Приложение 1 | - | |
2.26 | - | Приложение 1 | - | |
2.27 | - | Приложение 1 | - | |
2.28 | - | Приложение 1 | - | |
2.29 | - | Приложение 1 | - | |
2.30 | - | Приложение 1 | - | |
2.31 | - | Приложение 1 | - | |
2.32 | - | Приложение 1 | - | |
2.33 | - | Приложение 1 | - | |
2.34 | - | Приложение 1 | - | |
2.35 | - | Приложение 1 | - | |
2.36 | - | Приложение 1 | - | |
3 | 3.1.1 | - | 5 | - |
3.1.2 | - | 6 | - | |
3.1.3 | - | 7 | - | |
3.1.4 | - | 8 | - | |
3.1.5 | - | 9 | - | |
3.1.6 | - | 10 | - | |
3.2.1.1 | - | 1, дополнение IA | - | |
3.2.1.2 | - | 2, дополнение IA | - | |
3.2.1.3 | - | 3, дополнение IA | - | |
3.2.1.4 | - | 4, дополнение IA | - | |
3.2.1.5 | - | 5, дополнение IA | - | |
3.2.1.6 | - | 6, дополнение IA | - | |
3.2.2.1 | - | 8, дополнение IA | - | |
3.2.2.2 | - | 9, дополнение IA | - | |
3.2.2.3 | - | 10, дополнение IA | - | |
3.2.2.4 | - | 11, дополнение IA | - | |
3.2.3 | - | 12, дополнение IA | - | |
3.2.3.1.1 | - | 13, дополнение IA | - | |
3.2.3.1.2 | - | 14, дополнение IA | - | |
3.2.3.2.1 | - | 15, дополнение IA | - | |
3.2.3.2.2 | - | 16, дополнение IA | - | |
3.2.3.2.3 | - | 17, дополнение IA | - | |
3.2.3.2.4 | - | 18, дополнение IA | - | |
3.2.3.3.1 | - | 19, дополнение IA | - | |
3.2.3.3.2 | - | 20, дополнение IA | - | |
3.2.3.3.3 | - | 21, дополнение IA | - | |
3.2.3.4.1 | - | 22, дополнение IA | - | |
3.2.3.4.2 | - | 23, дополнение IA | - | |
3.2.3.4.3 | - | 24, дополнение IA | - | |
3.2.3.5 | - | 25, дополнение IA | - | |
3.2.4.1.1 | - | 26, дополнение IA | - | |
3.2.4.1.2 | - | 27, дополнение IA | - | |
3.2.4.1.3 | - | 28, дополнение IA | - | |
3.2.4.1.4 | - | 29, дополнение IA | - | |
3.2.4.1.5 | - | 30, дополнение IA | - | |
3.2.4.2 | - | 31, дополнение IA | - | |
3.2.4.3.1 | - | 32, дополнение IA | - | |
3.2.4.3.2 | - | 33, дополнение IA | - | |
3.2.4.4 | - | 33, дополнение IA | - | |
3.3.1.1 | - | 1, дополнение IB | - | |
3.3.1.2 | - | 2, дополнение IB | - | |
3.3.1.3 | - | 3, дополнение IB | - | |
3.3.1.4 | - | 4, дополнение IB | - | |
3.3.1.5 | - | 5, дополнение IB | - | |
3.3.1.6 | - | 6, дополнение IB | - | |
3.3.2.1 | - | 8, дополнение IB | - | |
3.3.2.2 | - | 9, дополнение IB | - | |
3.3.2.3 | - | 10, дополнение IB | - | |
3.3.3 | - | 11, дополнение IB | - | |
3.3.3.1.1 | - | 12, дополнение IB | - | |
3.3.3.1.2 | - | 13, дополнение IB | - | |
3.3.3.2.1 | - | 14, дополнение IB | - | |
3.3.3.2.2 | - | 15, дополнение IB | - | |
3.3.3.2.3 | - | 16, дополнение IB | - | |
3.3.3.2.4 | - | 17, дополнение IB | - | |
3.3.3.2.5 | - | 18, дополнение IB | - | |
3.3.3.2.6 | - | 19, дополнение IB | - | |
3.3.3.3.1 | - | 20, дополнение IB | - | |
3.3.3.3.2 | - | 21, дополнение IB | - | |
3.3.3.3.3 | - | 22, дополнение IB | - | |
3.3.3.4.1 | - | 23, дополнение IB | - | |
3.3.3.4.2 | - | 24, дополнение IB | - | |
3.3.3.4.3 | - | 25, дополнение IB | - | |
3.3.3.5 | - | 26, дополнение IB | - | |
3.3.4.1 | - | 27, дополнение IB | - | |
3.3.4.2 | - | 28, дополнение IB | - | |
3.3.4.3 | - | 29, дополнение IB | - | |
3.3.4.4 | - | 30, дополнение IB | - | |
3.3.4.5 | - | 31, дополнение IB | - | |
3.3.4.6 | - | 32, дополнение IB | - | |
3.3.4.7 | - | 33, дополнение IB | - | |
3.3.4.8 | - | 34, дополнение IB | - | |
3.3.4.9 | - | 35, дополнение IB | - | |
Приложение А | - | Приложение 1 Дополнение IA | - | |
Приложение Б | - | Приложение 2 Дополнение IA | - | |
Приложение В | - | Приложение 3 Дополнение IA | - | |
Приложение Г | - | Приложение 1 Дополнение IB | - | |
Приложение Д | - | Приложение 2 Дополнение IB | - | |
Приложение Е | - | Приложение 3 Дополнение IB | - | |
Приложение Ж | - | Приложение 4 Дополнение IB | - | |
Библиография | Литература | |||
Библиография
[1] | United Nations (UN) (2017). Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Seventh revised edition, New York and Geneva, United Nations Publications. Available at: [https://www.unece.org/trans/danger/publi/ghs/ghs_rev07/07files_e0.html] (Согласованная на Глобальном уровне Система классификации и маркировки химических веществ (СГС). Седьмое пересмотренное издание). |
[2] | OECD (2012). Series on Testing and Assessment No. 168. The Adverse Outcome Pathway for Skin Sensitisation Initiated by Covalent Binding to Proteins. Part 1: Scientific Evidence. Organisation for Economic Cooperation and Development, Paris. Available at: http://www.oecd.org/officialdocuments/publicdisplaydocumentpdf/?cote=ENV/JM/MONO(2012) 10/PART1&docLanguage=En (Серия по испытаниям и оценке N 168. Путь неблагоприятного исхода для сенсибилизации кожи, обусловленной ковалентным связыванием с белками. Часть 1. Научное обоснование). |
[3] | Emter R., Ellis G., Natsch A. (2010). Performance of a novel keratinocyte-based reporter cell line to screen skin sensitizers in vitro. Toxicology and Applied Pharmacology 245, 281-290 (Рабочие характеристики новой репортерной линии клеток-кератиноцитов для скринингового анализа веществ, вызывающих сенсибилизацию кожи, в условиях in vitro). |
[4] | Natsch A., Bauch C., Foertsch L., Gerberick F., Normann K., Hilberer A., Inglis H., Landsiedel R., Onken S., Reuter H., Schepky A., Emter R. (2011). The intra- and inter-laboratory reproducibility and predictivity of the KeratinoSens assay to predict skin sensitizers in vitro: results of a ring-study in five laboratories. Toxicol. In Vitro 25, 733-744 (Внутри- и межлабораторные показатели воспроизводимости и достоверности прогнозирования метода KeratinoSens, применяемого in vitro для предсказания способности веществ вызывать сенсибилизацию кожи. Результаты круговых сличений в пяти лабораториях). |
[5] | Natsch A., Ryan C.A., Foertsch L., Emter R., Jaworska J., Gerberick G.F., Kern P. (2013). A dataset on 145 chemicals tested in alternative assays for skin sensitization undergoing prevalidation. Journal of Applied Toxicology 33, 1337-1352 (База данных по 145 химическим веществам, прошедшим испытания на сенсибилизацию кожи с применением альтернативных методов, подлежащих валидации). |
[6] | EURL-ECVAM (2014). Recommendation on the KeratinoSensTM assay for skin sensitisation testing, 42 pp. Available at: [http://ihcp.jrc.ec.europa.eu/our_labs/eurl-ecvam/eurl-ecvam- recommenda-tions/recommendation-keratinosens-skin-sensitisation] (Рекомендации по выполнению анализа по методу KeratinoSens™ при проведении испытаний на сенсибилизацию кожи). |
[7] | Ramirez T., Mehling A., Kolle S.N., Wruck C.J., Teubner W., Eltze T., Aumann A., Urbisch D., van Ravenzwaay В., Landsiedel R. (2014). LuSens: a keratinocyte based ARE reporter gene assay for use in integrated testing strategies for skin sensitization hazard identification. Toxicol In vitro 28, 1482-1497 (LuSens. Метод исследования с использованием ARE-элемента репортерного гена линии кератиноцитов, подлежащий применению в рамках интегрированных стратегий проведения испытаний для получения оценки опасности развития сенсибилизации кожи). |
[8] | Ramirez T., Stein N., Aumann A., Remus Т., Edwards A., Norman K.G., Ryan C., Bader J.E., Fehr M., Burleson F., Foertsch L., Wang X., Gerberick F., Beilstein P., Hoffmann S., Mehling A., van Ravenzwaay В., Landsiedel R. (2016). Intra- and inter-laboratory reproducibility and accuracy of the LuSens assay: A reporter gene-cell line to detect keratinocyte activation by skin sensitizers. Toxicol In Vitro 32, 278-286 (Внутри- и межлабораторные показатели воспроизводимости и достоверности прогнозирования метода LuSens. Использование линии клеток со встроенным репортерным геном для обнаружения реакции активации кератиноцитов при воздействии веществ, вызывающих сенсибилизацию кожи). |
[9] | ESAC (2016). ESAC opinion on the BASF-coordinated Performance Standards-based validation of the LuSens test method for skin sensitisation testing. Available at: [http://publications.jrc.ec.europa.eu/repository/bitstream/JRC103706/esac_opinion_2016-04_lusens_final.pdf] (Заключение ESAC по итогам валидации метода исследования LuSens для определения кожной сенсибилизации с применением действующих стандартов результативности при участии лаборатории-координатора BASF). |
[10] | OECD (2015). Guidance Document No 213. Performance Standards for assessment of proposed similar or modified in vitro skin sensitisation ARE-NrF2 luciferase test methods. Series on Testing and Assessment. Available at: http://www.oecd.org/env/ehs/testing/series-testing-assessment-publications-number.htm (Руководящий документ N 213. Стандарты результативности для предлагаемых идентичных или модифицированных методов испытаний кожной сенсибилизации in vitro на основе сигнального пути ARE-Nrf2 с использованием люциферазы. Серия по испытаниям и оценке). |
[11] | OECD (1992). OECD Guidelines for the Testing of Chemicals No. 406. Skin Sensitisation. Organisation for Economic Cooperation and Development, Paris. Available at: [http://www.oecd.org/env/testguidelines] (Руководство по проведению испытаний химических веществ N 406. Сенсибилизация кожи). |
[12] | OECD (2010). OECD Guidelines for Chemical Testing No. 429. Skin sensitization: Local Lymph Node assay. Organisation for Economic Cooperation and Development, Paris. Available at: [http://www.oecd.org/env/testguidelines] (Руководство по проведению испытаний химических веществ N 429. Сенсибилизация кожи. Метод изучения реакции регионарных лимфатических узлов). |
[13] | OECD (2010). OECD Guidelines for Chemical Testing No. 442A. Skin sensitization: Local Lymph Node assay: DA. Organisation for Economic Cooperation and Development, Paris. Available at: [http://www.oecd.org/env/testguidelines] (Руководство по проведению испытаний химических веществ N 442А. Сенсибилизация кожи. Метод изучения реакции регионарных лимфатических узлов. Протокол DA). |
[14] | OECD (2010). OECD Guidelines for Chemical Testing No. 442B. Skin sensitization: Local Lymph Node assay: BrdU-ELISA. Organisation for Economic Cooperation and Development, Paris. Available at: [http://www.oecd.org/env/testguidelines] (Руководство по проведению испытаний химических веществ N 442В. Сенсибилизация кожи. Метод изучения реакции регионарных лимфатических узлов, Протокол BrdU-ELISA). |
[15] | OECD (2015). OECD Guideline for the Testing of Chemicals No. 442C: In Chemico Skin Sensitisation: Direct Peptide Reactivity Assay (DPRA). Organisation for Economic Cooperation and Development, Paris (Руководство по проведению испытаний химических веществ N 442С. Сенсибилизация кожи in chemico. Прямой анализ реакционной способности в отношении пептидов). |
[16] | OECD (2017). OECD Guideline for the Testing of Chemicals No. 442E: In Vitro Skin Sensitisation assays addressing the AOP Key Event on Activation of Dendritic Cells. Organisation for Economic Cooperation and Development, Paris. Available at: [http://www.oecd.org/env/testguidelines] (Руководство по проведению испытаний химических веществ N 442Е. Методы испытаний сенсибилизации кожи in vitro с использованием ключевого события активации дендритных клеток в структуре АОР). |
[17] | OECD (2016). Series on Testing & Assessment No. 256: Guidance Document On The Reporting Of Defined Approaches And Individual Information Sources To Be Used Within Integrated Approaches To Testing And Assessment (IATA) For Skin Sensitisation, Annex 1 and Annex 2. ENV/JM/HA(2016)29. Organisation for Economic Cooperation and Development, Paris. Available at: [https://community.oecd.org/community/iatass] (Серия по испытаниям и оценке N 256. Руководящий документ по предоставлению отчетности об установленных подходах и индивидуальных источниках информации, подлежащих использованию в рамках интегрированных подходов к испытаниям и оценке (IATA) для сенсибилизации кожи. Приложение 1 и приложение 2). |
[18] | Andres E., Sa-Rocha V.M., Barrichello C., Haupt T., Ellis G., Natsch A. (2013). The sensitivity of the KeratinoSensTM assay to evaluate plant extracts: A pilot study. Toxicology In Vitro 27, 1220-1225 (Чувствительность метода KeratinoSensTM при анализе растительных экстрактов). |
[19] | Kolle, S.N., Mehling A., Teubner W., van Ravenzwaay В., Landsiedel R. (2013). Alternative method in practice: Post-validation experience of the skin sensitization in vitro test strategy. Toxicology Letters 221, S204 (Практическое применение альтернативного метода. Опыт реализации стратегии испытаний кожной сенсибилизации in vitro на этапе поствалидации). |
[20] | Settivari RS, Gehen SC, Amado RA, Visconti NR, Boverhof DR, Carney EW (2015). Application of the KeratinoSens™ assay for assessing the skin sensitization potential of agrochemical active ingredients and formulations. Regul Toxicol Pharmacol; 72(2):350-60 (Применение метода KeratinoSens™ для оценивания сенсибилизирующего потенциала при воздействии на кожу активных компонентов и смесей агрохимического назначения). |
[21] | OECD (2005), Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment, OECD Series on Testing and Assessment No. 34. OECD, Paris. Available at: [http://www.oecd.ora/env/testguidelinesl] (Руководящий документ по валидации и международному признанию новых или актуализированных методов испытаний для оценивания опасностей. Публикации по охране труда, окружающей среды и технике безопасности. Серия по испытаниям и оценке (N 34)). |
[22] | Natsch А. (2010). The Nrf2-Keap1-ARE Toxicity Pathway as a Cellular Sensor for Skin Sensitizers-Functional Relevance and Hypothesis on Innate Reactions to Skin Sensitizers. Toxicological Sciences 113, 284-292 (Путь токсического воздействия Nrf2-Keap1-ARE как клеточный детектор веществ, вызывающих сенсибилизацию кожи. Функциональная значимость и гипотеза природной детерминированности кожных реакций на сенсибилизирующие вещества). |
[23] | Dinkova-Kostova A.T., Holtzclaw W.D., Kensler T.W. (2005). The role of Keap1 in cellular protective responses. Chem. Res. Toxicol. 18, 1779-1791 (Роль Keap1 в формировании защитной реакции клеток). |
[24] | Kansanen E., Kuosmanen S.M., Leinonen H., Levonen A.L. (2013). Keap1-Nrf2 pathway: Mechanisms of activation and dysregulation in cancer. Redox Biol. 1, 45-49 (Сигнальный путь Keap1 - Nrf2. Механизмы активации и дисрегуляции при развитии раковых заболеваний). |
[25] | DB-ALM (INVITTOX) (2013). Protocol 155: KeratinoSensTM, 17 pp. Available: [http://ecvam-dbalm.jrc.ec.europa.eu/] (Протокол 155. KeratinoSensTM). |
[26] | Fabian E., Vogel D., Blatz V., Ramirez T., Kolle S., Eltze T., van Ravenzwaay B., Oesch F., Landsiedel R. (2013). Xenobiotic metabolizing enzyme activities in cells used for testing skin sensitization in vitro. Arch Toxicol 87, 1683-1969 (Активность ксенобиотик-метаболизирующих ферментов в клетках, используемых для испытаний сенсибилизации кожи in vitro). |
[27] | Jaworska J., Dancik Y., Kern P., Gerberick F., Natsch A. (2013). Bayesian integrated testing strategy to assess skin sensitization potency: from theory to practice. J. Appl. Toxicol. 33, 1353-1364 (Применение байесовской интегрированной стратегии проведения испытаний для оценивания сенсибилизирующего потенциала при воздействии на кожу. От теории к практике). |
[28] | Casati S., Aschberger K., Asturiol D., Basketter D., Dimitrov S., Dumont C., Karlberg A.T., Lepoittevin J.P., Patlewicz G., Roberts D.W., Worth A. (2016). Ability of non-animal methods for skin sensitisation to detect pre- and pro-haptens: Report and recommendations of an EURL ECVAM expert meeting. EUR 27752 EN. Available at: https://eurl-ecvam.jrc.ec.europa.eu/eurl- ecvam-status-reports/pre-prohapten-workshop-report (Способность методов определения кожной сенсибилизации, не требующих использования подопытных животных, к выявлению пре- и прогаптенов. Отчет и рекомендации заседания экспертов EURL ECVAM). |
[29] | Thome N., Inglese J., Auld D.S. (2010). Illuminating Insights into Firefly Luciferase and Other Bioluminescent Reporters Used in Chemical Biology. Chemistry and Biology 17, 646-657 (Пояснительные замечания для выполнения работ с люциферазой светлячков и прочими биолюминесцентными репортерными веществами, используемыми в области химической биологии). |
[30] | OECD (2012). BG1Luc Estrogen Receptor Transactivation Test Method for Identifying Estrogen Receptor Agonists and Antagonists. OECD Guidelines for Chemical Testing No. 457. Organisation for Economic Cooperation and Development, Paris. Available at: [http://www.oecd.org/env/testguidelines] (Применение метода исследования на основе трансактивации эстрогенового рецептора BG1Luc для определения агонистов и антагонистов эстрогеновых рецепторов. Руководство ОЭСР по проведению испытаний химических веществ N 457). |
[31] | ECETOC (2003). Contact sensitization: Classification according to potency. European Centre for Ecotoxicology & Toxicology of Chemicals (Контактная сенсибилизация. Классификация по уровню сенсибилизирующей способности). |
[32] | Bauch C., Kolle S.N., Ramirez T., Eltze T., Fabian E., Mehling A., Teubner W., van Ravenzwaay В., Landsiedel R. (2012). Putting the parts together: combining in vitro methods to test for skin sensitizing potentials. Regul. Toxicol. Pharmacol. 63, 489-504 (Построение общей картины. Комбинированное применение методов in vitro при проведении испытаний с целью определения сенсибилизирующего потенциала при воздействии на кожу). |
[33] | Natsch A., Emter R., Ellis G. (2009). Filling the concept with data: integrating data from different in vitro and in silico assays on skin sensitizers to explore the battery approach for animal-free skin sensitization testing. Toxicol. Sci. 107, 106-121 (Наполнение концепции данными. Обобщение данных по итогам различных экспериментов in vitro и in silico, посвященных воздействию веществ, способных вызывать сенсибилизацию кожи, в целях изучения перспектив комплексного подхода к проведению испытаний на сенсибилизацию кожи без использования подопытных животных). |
[34] | Ball N., Cagen S., Carrillo J.C., Certa H., Eigler D., Emter R., Faulhammer F., Garcia C., Graham C., Haux C., Kolle S.N., Kreiling R., Natsch A., Mehling A. (2011). Evaluating the sensitization potential of surfactants: integrating data from the local lymph node assay, guinea pig maximization test, and in vitro methods in a weight-of-evidence approach. Regul Toxicol. Pharmacol. 60, 389-400 (Оценивание сенсибилизирующего потенциала поверхностно-активных веществ. Обобщение данных, получаемых по методу изучения реакции регионарных лимфатических узлов, при помощи теста максимизации для морских свинок, а также с применением соответствующих методов in vitro на основе подхода с вынесением оценки по совокупности полученных свидетельств). |
[35] | Urbisch D., Mehling A., Guth K., Ramirez Т., Honarvar N., Kolle S., Landsiedel R., Jaworska J., Kern P.S., Gerberick F., Natsch A., Emter R., Ashikaga Т., Miyazawa M., Sakaguchi H. (2015). Assessing skin sensitization hazard in mice and men using non-animal test methods. Regul. Toxicol. Pharmacol. 71, 337-351 (Оценивание опасности развития сенсибилизации кожи у мышей и человека с применением методов, не требующих использования подопытных животных). |
[36] | Urbisch D., Becker M., Honarvar N., Kolle S.N., Mehling A., Teubner W., Wareing B., Landsiedel R. (2016). Assessment of Pre- and Pro-haptens Using Non-animal Test Methods for Skin Sensitization. Chem. Res. Toxicol. 29, 901-13 (Оценивание способности пре- и прогаптенов вызывать сенсибилизацию кожи с применением методов испытаний, не предусматривающих проведение испытаний на подопытных животных). |
[37] | Natsch A., Emter R., Gfeller H., Haupt T., Ellis G. (2015). Predicting Skin Sensitizer Potency Based on In vitro Data from KeratinoSens and Kinetic Peptide Binding: Global Versus Domain-Based Assessment. Toxicol Sci 143, 319-332 (Предсказание сенсибилизирующей способности веществ при их воздействии на кожу в соответствии с данными in vitro, полученными с применением метода KeratinoSens и метода, использующего кинетическое связывание пептидов. Сравнение глобального подхода к получению оценки и подхода на основе анализа отдельных областей). |
[38] | Jaworska J.S., Natsch A., Ryan C., Strickland J., Ashikaga T., Miyazawa M. (2015). Bayesian integrated testing strategy (ITS) for skin sensitization potency assessment: a decision support system for quantitative weight of evidence and adaptive testing strategy. Arch Toxicol 89, 2355-2383 (Применение байесовской интегрированной стратегии проведения испытаний для оценивания способности вызывать сенсибилизацию кожи. Система поддержки принятия решений для количественной стратегии оценивания с использованием оценки на основе совокупности имеющихся свидетельств и адаптивного подхода к проведению испытаний). |
[39] | Strickland J., Zang Q., Paris M., Lehmann D.M., Allen D., Choksi N., Matheson J., Jacobs A., Casey W., Kleinstreuer N. (2017). Multivariate models for prediction of human skin sensitization hazard. J Appl Toxicol 37, 347-360 (Многовариантные модели предсказания опасности кожной сенсибилизации у человека). |
[40] | Delaine T., Ponting D.J., Niklasson I.B., Emter R., Hagvall L., Norrby P.O., Natsch A., Luthman K., Karlberg A.T. (2014). Epoxyalcohols: bioactivation and conjugation required for skin sensitization. Chem Res Toxicol 27, 1860-1870 (Эпоксидные спирты. Необходимость биологической активации и конъюгации для развития сенсибилизации кожи). |
[41] | Wasserman W.W., Fahl W.E. (1997). Comprehensive analysis of proteins which interact with the antioxidant responsive element: correlation of ARE-BP-1 with the chemoprotective induction response. Arch. Biochem. Biophys. 344, 387-396 (Комплексный анализ белков, взаимодействующих с элементом антиоксидантного ответа. Корреляция между связыванием ARE-BP-1 и реакциями индукции на хемопротекторы). |
[42] | Gildea L.A., Ryan С.А., Foertsch L.M., Kennedy J.M., Dearman R.J., Kimber I., Gerberick G.F. (2006). Identification of gene expression changes induced by chemical allergens in dendritic cells: opportunities for skin sensitization testing. J. Invest. Dermatol. 126, 1813-1822 (Выявление изменений в экспрессии генов, вызываемых воздействием аллергенов химического происхождения, в дендритных клетках. Перспективы применения для целей исследования сенсибилизации кожи). |
[43] | Ryan С.А., Gildea L.A., Hulette B.C., Dearman R.J., Kimber I. And Gerberick G.F. (2004). Gene expressing changes in peripheral blood-derived dendritic cells following exposure to a contact allergen. Toxicol. Lett. 150, 301-316 (Изменения в экспрессии генов в дендритных клетках периферической крови, наступающие после воздействия на них контактных аллергенов). |
[44] | Emter R., van der Veen J.W., Adamson G., Ezendam J., van Loveren H., Natsch A. (2013). Gene expression changes induced by skin sensitizers in the KeratinoSens™ cell line: Discriminating Nrf2-dependent and Nrf2-independent events. Toxicol. In Vitro 27, 2225-2232 (Изменения в экспрессии генов под действием веществ, вызывающих сенсибилизацию кожи, в клетках линии KeratinoSens™. Различение Nrf2-зависимых и Nrf2-независимых событий). |
[45] | Basketter D.A., N., Ashikaga Т., Barroso J., Gilmour N., Goebel C., Hibatallah J., Hoffmann S., Kern P., Martinozzi-Teissier S., Maxwell G., Reisinger K., Sakaguchi H., Schepky A., Tailhardat M., Templier M. (2014). Categorization of chemicals according to their relative human skin sensitizing potency. Dermatitis 25, 11-21 (Классификация химических веществ по их относительной способности вызывать сенсибилизацию кожи у человека). |
[46] | Belot N., Sim B., Longmore C.L., Roscoe L., Treasure C. (2017). Adaptation of the KeratinoSens™ skin sensitisation test to animal-product-free cell culture. ALTEX. 2017 Mar 16. doi: 10.14573/altex.1701311 (Адаптация метода исследования кожной сенсибилизации KeratinoSens™ к применению для клеточных культур, не содержащих компонентов растительного происхождения). |
[47] | Patlewicz G., Casati S., Basketter D.A., Asturiol D., Roberts D.W., Lepoittevin J.-P., Worth A. and Aschberger K. (2016). Can currently available non-animal methods detect pre and pro haptens relevant for skin sensitisation? Regul Toxicol Pharmacol, 82, 147-155 (Обеспечивают ли доступные на сегодняшний день методы испытаний, не предусматривающие использование подопытных животных, выявление пре- и прогаптенов, вызывающих сенсибилизацию кожи?). |
[48] | EURL ECVAM (2018). The LuSens test method Validation Study Report. Accessible at: https://tsar.jrc.ec.europa.eu/test-method/tm2011-10 (Метод исследования LuSens. Отчет о валидационных испытаниях). |
[49] | Ade N., Leon F., Pallardy M., Peiffer J.L., Kerdine-Romer S., Tissier M.H., Bonnet P.A., Fabre I., Ourlin J.C. (2009); HMOX1 and NQO1 genes are upregulated in response to contact sensitizers in dendritic cells and THP-1 cell line: role of the Keap1/Nrf2 pathway. Toxicol Sci. 2009 Feb; 107(2):451-60 (Активация генов HMOX1 и NQO1 в дендритных клетках и клеточной линии ТНР-1 как ответ на воздействие контактных аллергенов. Роль сигнального пути Keap1/Nrf2). |
[50] | Pronk, Andre Boorsma, Ralph Gottschalk, Henk Van Loveren; Keratinocyte Gene Expression Profiles Discriminate Sensitizing and Irritating Compounds, Toxicological Sciences, Volume 117, Issue 1, 1 September 2010, Pages 81-89, https://doi.org/10.1093/toxsci/kfq182. (Профили экспрессии генов в кератиноцитах для определения соединений, способных оказывать сенсибилизирующее и раздражающее воздействие). |
[51] | DB-ALM Protocol No. 184 (2017). LuSens Assay. Available at https://ecvam-dbalm.jrc.ec.europa.eu (Протокол N 184. Метод LuSens). |
УДК 661:615.099:006.354 | МКС 71.040.10; 13.020.01 | MOD |
Ключевые слова: химическая продукция, ключевое событие, сенсибилизация кожи in vitro, люцифераза, основа сигнального пути ARE-Nrf2 | ||

