ГОСТ 32538-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Определение биоконцентрации на рыбах в проточных аквариумах
Testing of chemicals of environmental hazard. Determination of bioconcentration in flow-through fish test
МКС 71.040.50
Дата введения 2014-08-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены".
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ" (ФГУП "ВНИЦСМВ"); Техническим комитетом по стандартизации N 339 "Безопасность сырья, материалов и веществ" на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 14 ноября 2013 г. N 44)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г. N 771-ст межгосударственный стандарт ГОСТ 32538-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 августа 2014 г.
5 Настоящий стандарт идентичен международному документу OECD, Test No. 305:1996* "Биоконцентрация: Определение биоконцентрации на рыбах в проточных аквариумах" ("Bioconcentration: Flow-through Fish Test", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Наименование настоящего стандарта изменено относительно наименования указанного международного документа для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6)
6 ВВЕДЕН ВПЕРВЫЕ
7 ПЕРЕИЗДАНИЕ. Май 2019 г.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
В подробной обзорной статье по биоконцентрации, подготовленной Японией (февраль 1990), было рекомендовано объединить пять существующих методов по определению биоконцентрации ОЭСР (305 А-Е) в единый метод. В то же время проводилась работа по актуализации Руководства 305 Е "Исследование на рыбах в проточных аквариумах", представляющего собой измененный метод межлабораторных исследований [1]. Было достигнуто соглашение, что актуализированная версия Руководства 305 Е станет основой для объединенного метода.
Международный документ ОЭСР Тест N 305 представляет собой консолидированный вариант метода на основе пяти предыдущих методов (305 А-Е) и заменяет их. Метод описывает процедуру для определения потенциала биоконцентрации веществ в рыбе в проточных аквариумах. Исследование рекомендуется проводить в проточных условиях, однако, при условии соответствия критериям применимости (см. параграф 5.2), допускается проведение исследования в полустатическом режиме.
1 Область применения
Настоящий стандарт устанавливает процедуру определения возможности биоконцентрации веществ в рыбе в проточных аквариумах.
Метод дает подробное описание выполнения испытания, предоставляя при этом адекватную свободу для адаптации проекта эксперимента к условиям отдельных лабораторий, а также для выполнения различных оценок опытных веществ. Метод наиболее подходит для определения стабильных органических веществ, чьи показатели ![]() находятся в пределах от 1,5 до 6,0 (4), но также может использоваться со сверхлипофильными веществами (
находятся в пределах от 1,5 до 6,0 (4), но также может использоваться со сверхлипофильными веществами (![]() 6,0). Предварительная оценка коэффициента биоконцентрации, иногда обозначаемая как
6,0). Предварительная оценка коэффициента биоконцентрации, иногда обозначаемая как , для таких сверхлипофильных веществ предположительно будет выше, чем ожидаемые коэффициенты биоконцентрации (
![]() ) в статических условиях, получаемые в ходе лабораторных экспериментов. Предварительные оценки коэффициента биоконцентрации органических веществ со значениями
) в статических условиях, получаемые в ходе лабораторных экспериментов. Предварительные оценки коэффициента биоконцентрации органических веществ со значениями ![]() примерно до 9,0 могут быть получены с помощью уравнения Бинтейна и его соавторов.
примерно до 9,0 могут быть получены с помощью уравнения Бинтейна и его соавторов.
Параметры, которые характеризуют потенциал биоконцентрации включают: константу величины поглощения (), константу величины выведения (
) и коэффициент биоконцентрации (
![]() ).
).
Опытные вещества с меткой способны упростить анализ образцов воды и рыбы и могут использоваться в случае необходимости принятия решения, следует ли выполнять идентификацию и количественное определение продуктов распада. При измерении общего количества остатков с радиоактивной меткой (например, горением или растворением ткани), расчет производят на основе исходного соединения, аккумулированных продуктов обмена веществ и ассимилированного углерода. Поэтому значения
, полученные на основе остаточного количества веществ с радиоактивной меткой, могут быть несопоставимы с
, полученными на основе определенного химического анализа одного лишь исходного соединения. В исследованиях, где используются вещества с меткой, процедуры очистки помогут в определении значения
, основанного на исходном соединении, а также дать оценку главным продуктам обмена веществ, в случае необходимости. Определение
для исходного соединения должно основываться на концентрации исходного соединения в рыбе, а не на общем количестве меченых остатков.
, полученные на основе общего количества меченых остатков, могут служить одним из критериев необходимости в идентификации продуктов распада и их количественном определении. Также возможно объединить исследование метаболизма рыбы с исследованием биоконцентрации анализом и идентификацией остаточных количеств веществ в тканях.
2 Термины, обозначения и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 биоконцентрация/бионакопление (bioconcentration/bloaccumulation): Повышение концентрации исследуемого веществ в/на организме (определенных тканях) относительно концентрации исследуемого вещества в среде обитания.
2.2 константа величины выведения (потери) (depuration (loss) rate constant): Значение, определяющее показатель уменьшения концентрации исследуемого вещества в рыбе (или ее определенных тканях) после перемещения исследуемой рыбы из среды, содержащей исследуемое вещество, в среду, не содержащую такое вещество (
выражена в днях
).
2.3 константа величины поглощения (uptake rate constant): Числовая величина, определяющая показатель повышения концентрации исследуемого вещества в/на исследуемой рыбе (или ее определенных тканях) в случае, когда рыба подвергается воздействию этого химического вещества (
выражена в днях
).
2.4 коэффициент разделения октанол/вода (octanol-water partition coefficient): Соотношение растворимости химического вещества в н-октаноле и воде в состоянии равновесия, также выражается, как
. Логарифм
используется в качестве потенциала химического вещества к биоконцентрации в водных организмах.
2.5 плато/стационарное состояние (plateau/steady-state): Состояние, которое достигается, когда кривая графика опытного вещества, накопленного в рыбе (), и времени становится параллельной временной оси, и результаты трех последовательно проведенных анализов
, выполненных с образцами, отбираемыми по меньшей мере через каждые два дня, которые не отличаются друг от друга более, чем на ±20%, а также при отсутствии значительной разницы между тремя периодами отбора образцов. Если анализируются смешанные образцы, то требуется, по меньшей мере, четыре последовательно проведенных анализа. Для медленно отбираемых опытных веществ интервал в семь дней будет самым подходящим.
2.6 фаза воздействия или поглощения (exposure/uptake phase): Время, в течение которого рыба подвергается воздействию исследуемого химического вещества.
2.7 фаза поствоздействия или очистки (потеря) [post-exposure or depuration (loss) phase]: Время, следующее за перемещением исследуемой рыбы из среды, содержащей исследуемое вещество в среду, свободную от исследуемого вещества, в течение которого изучается выведение (или чистая потеря) вещества из исследуемой рыбы (или ее определенных тканей).
2.8 фактор биоконцентрации (
или
) (bioconcentration factor): Соотношение между концентрацией исследуемого вещества в/на рыбе или определенных тканях [
в виде мг/г (частей на миллион)] и концентрацией химического вещества в окружающей среде [
в виде мг/г (частей на миллион)] в любой момент времени в течение фазы поглощения.
2.9 фактор биоконцентрации стационарного состояния (![]() или
или ) (steady state bioconcentration factor): Фактор, не меняющийся значительно на протяжении длительного периода времени, если концентрация опытного вещества в окружающей среде остается постоянной в течение всего периода времени.
2.10 фактор биоконцентрации (bioconcentration factor): Кинетический коэффициент концентрации [![]() ], рассчитанный непосредственно на основе кинетических констант скорости (
], рассчитанный непосредственно на основе кинетических констант скорости (![]() - см. ниже).
- см. ниже).
3 Общие положения
3.1 Тест состоит из двух частей: фазы воздействия (поглощения) и фазы поствоздействия (очистки). Во время фазы поглощения отдельные группы рыб одного вида подвергают воздействию образцов исследуемого вещества, по меньшей мере, в двух концентрациях. Затем помещают в промежуточную среду, не содержащую исследуемое вещество, для прохождения фазы очистки. Данная фаза необходима всегда, за исключением случаев, когда поглощение вещества во время первой фазы оказалось незначительным (например, показатель меньше 10). Концентрацию тестируемого вещества в/на рыбе (или специальных образцах ткани) отслеживают на протяжении обеих фаз теста. Помимо тестирования с применением двух разных концентраций, контрольную группу рыб помещают в идентичные условия за исключением отсутствия в среде тестируемого вещества для соотнесения возможных негативных последствий, наблюдаемых в двух первых тестируемых группах с показателями контрольной группы и получения информации о фоновом уровне концентрации тестируемого вещества.
3.2 Фаза поглощения длится 28 сут за исключением случаев, когда стационарное состояние достигается раньше. Стационарное состояние достигается при значении концентрации исследуемого вещества в рыбе в пробах, взятых с двухдневным интервалом и различающихся не более чем на 20%.
Прогнозирование длительности фазы поглощения и времени наступления стационарного состояния может основываться на уравнениях, приведенных в приложении C.
Фазу очистки начинают с перемещения рыбы в чистый сосуд с аналогичной средой без содержания тестируемого вещества. Коэффициент биоконцентрации рассчитывают одновременно и как соотношение (![]() ) концентрации в рыбе (
) концентрации в рыбе (), и в воде (
) в предполагаемый момент стационарного состояния, и как кинетический коэффициент биоконцентрации
, являющийся соотношением констант поглощения (
) и выделения (
) при условии, что биоконцентрация может быть представлена реакцией первого порядка
.
_________________
Если реакция не первого порядка, следует использовать более сложные модели (см. приложение E).
3.3 Если в течение 28 дней стадия стабильности не наступает, фаза поглощения продлевается до ее наступления или до 60 дней, в зависимости от того, что наступит раньше; после этого начинается фаза очистки.
3.4 Константа поглощения, константа очистки (потери) (или константы, для получения которых применяются более сложные модели), коэффициент биоконцентрации, а также, если возможно, предел достоверности для каждого из этих параметров рассчитываются при помощи моделей, наиболее соответствующих полученным данным по концентрации в рыбе и в воде.
3.5 Коэффициент биоконцентрации выражается функцией общего веса рыбы во влажном состоянии. В определенных целях могут использовать специальные образцы ткани или органы (например, мышцы, печень), если рыба достаточно велика, кроме того, рыба может быть разделена на филе и внутренности. Так как для многих органических веществ существует зависимость между потенциальной биоконцентрацией и липофильностью, наличествует соответствующая взаимосвязь между количеством жира в тестируемой рыбе и наблюдаемым уровнем биоконцентрации тестируемых веществ. Таким образом, для снижения воздействия этой причины вариативности в результатах теста, для веществ с высокой липофильностью (т.е. имеющих ![]() 3) биоконцентрацию следует определять относительно количества жировой ткани в дополнение к весу всей туши. Содержание жира должно, по возможности, определяться на том же биологическом материале, что и применяемый для определения биоконцентрации тестируемого вещества.
3) биоконцентрацию следует определять относительно количества жировой ткани в дополнение к весу всей туши. Содержание жира должно, по возможности, определяться на том же биологическом материале, что и применяемый для определения биоконцентрации тестируемого вещества.
4 Подготовка к испытанию
4.1 Подготовка исследуемого вещества
4.1.1 Перед проведением теста на биоконцентрацию необходимо собрать следующую информацию о веществе:
- растворимость в воде [3];
- коэффициент разделения октанол/вода, , в соответствии с [4], [5], [9];
- гидролиз, в соответствии с [6];
- фотопревращение в воде, обусловленное воздействием естественного или искусственного солнечного света, и в условиях освещения, применяемого для проведения теста на биоконцентрацию [10];
- поверхностное натяжение (для веществ, у которых нельзя определить ![]() ) [7];
) [7];
- давление паров [8];
- полная биоразлагаемость (если применимо), в соответствии с [11].
4.1.2 Определяют дополнительную информацию о токсичности для видов рыб, используемых в тестировании, предпочтительно асимптотическое значение .
4.1.3 Требуется наличие соответствующего аналитического метода с известной точностью и чувствительностью для количественного определения вещества в тестовых растворах и биологическом материале, а также подробности подготовки тестируемых образцов и их хранения.
4.1.4 Должен быть известен аналитический предел чувствительности для определения содержания исследуемого вещества в воде и в образцах ткани рыб. В случае тестирования вещества с меткой , должно быть известно процентное содержание радиоактивных примесей.
4.2 Надежность теста
Тест считают надежным при соблюдении следующих условий:
- колебание температуры менее ±2°С;
- концентрация кислорода в растворе не ниже 60%;
- концентрация тестируемого вещества в резервуарах составляет ±20% от средних значений, полученных в фазе поглощения;
- количество летальных исходов или других негативных последствий/заболеваний, как в контрольной, так и в тестируемой группах рыб составляет к концу теста не более 10%; в случае если время проведения теста было увеличено на несколько недель или месяцев, летальные исходы и прочие негативные последствия в обеих группах рыб должны составлять менее 5% в месяц и не превышать 30% за весь период тестирования.
4.3 Контрольные препараты
Применение контрольных препаратов с известной потенциальной возможностью биоконцентрации может быть уместным в экспериментальной методике, если в ней есть необходимость.
4.4 Оборудование
Следует избегать использования материалов для всех частей оборудования, которые могут раствориться, выступить в качестве сорбента или выделиться в раствор, и, тем самым оказать негативное воздействие на рыбу.
Могут применяться стандартные прямоугольные или цилиндрические резервуары, изготовленные из химически неактивного материала и подходящие по емкости с учетом предполагаемой загрузки.
Использование мягких пластиковых трубок должно быть минимальным. Рекомендуется использовать тефлон (), нержавеющую сталь и/или стеклянные трубки. Для веществ с высоким коэффициентом адсорбции, например, синтетических пиретроидов, может потребоваться силанизированное стекло. В таких случаях оборудование после использования должно быть уничтожено.
4.5 Вода
4.5.1 Воду для тестов получают из чистых и одинаковых по качеству воды источников. Качество воды для раствора должно быть таким, чтобы обеспечить выживание выбранных для тестирования видов рыб на время адаптации и самого тестирования без появления анормальных признаков во внешнем виде и поведении особей. В воде особи должны быть способны к жизни, росту и размножению (например, в качестве лабораторных культур или в исследовании на токсичность на протяжении всего жизненного цикла). Должны быть известны следующие показатели воды:
- уровень рН;
- жесткость;
- общее количество нерастворимых примесей;
- содержание общего органического углерода и, при необходимости, аммония, нитрита, щелочные свойства;
- соленость (для морских видов).
В приложении А даны рекомендуемые максимальные показатели ряда характеристик для пресной и морской воды, применяемой в тестах.
4.5.2 Качество воды должно быть одинаковым в ходе всего теста.
Уровень рН должен находиться в пределах от 6,0 до 8,5 рН. В ходе теста он может колебаться в пределах ±0,5.
Во избежание нежелательного влияния воды в растворе на результаты теста (например, комплексообразования тестируемого вещества) или негативного воздействия на тестируемые виды рыб, пробы воды должны регулярно браться на анализ.
Необходимо определять содержание тяжелых металлов (например, ,
,
,
,
,
), основных анионов и катионов (например,
,
,
,
,
,
), пестицидов (например, общее содержание фосфорорганических и хлорорганических пестицидов), содержание общего органического углерода и взвешенных твердых частиц. Анализ можно проводить, например, раз в три месяца, поскольку проверяемая вода сохраняет относительно одинаковые свойства. Состав воды сохраняется в течение, по меньшей мере, одного года, отборы проб на анализ могут проводиться реже, интервалы между отборами могут быть увеличены (например, до полугода).
4.5.3 Природное содержание частиц, так же как и общее содержание органического углерода (ТОС) в воде, должно быть как можно ниже во избежание адсорбции тестируемого вещества на органическом веществе, что может привести к снижению его биологической доступности. Максимально допустимое значение составляет 5 мг/л для твердых частиц (сухого вещества, не проходящего 0,45 мкм фильтр) и 2 мг/л для общего органического углерода (приложение А). При необходимости, воду перед употреблением следует отфильтровать. Увеличение содержания органического углерода в воде из-за попадания в нее продуктов жизнедеятельности рыб и остатков корма должно быть насколько возможно минимальным. В течение всего теста концентрация органического углерода в испытательных резервуарах не должна превышать концентрацию органического углерода, выделяющегося из исследуемого вещества и, если он используется, растворяющего агента, более чем на 10 мг/л (±20%).
4.6 Растворы для тестирования
4.6.1 Исходный раствор исследуемого вещества готовится соответствующей концентрации. Предпочтительно, чтобы исходный раствор был подготовлен путем простого смешивания или взбалтывания тестируемого вещества в воде. Не рекомендуется использовать растворители или диспергирующие (растворяющие) реагенты; тем не менее их применение допускается для достижения необходимой концентрации исходного раствора. В качестве растворителей могут выступать этанол, метанол, этиленгликоль монометиловый эфир, диметиловый эфир этиленгликоля, диметилформамид и триэтиленгликоль. Из диспергирующих реагентов применяются Кремофор RH40 (Cremophor RH40). Твин 80 (Tween 80), метилцеллюлоза 0,01% и НСО-40. Следует с осторожностью применять реагенты, легко поддающиеся биологическому разложению, так как они могут вызвать проблемы роста бактерий при тестировании в проточных аквариумах. Тестируемое вещество может нести радиоактивную метку и должно иметь максимальную чистоту (предпочтительно >98%).
4.6.2 При проведении тестирования в проточных аквариумах, система, непрерывно вводящая и разбавляющая исходный раствор тестируемого вещества (например, дозирующий насос, пропорциональный растворитель, система сатурации), должна вводить в резервуары тестируемое вещество в соответствующей концентрации.
Предпочтительно, чтобы в течение дня раствор в резервуарах полностью сменялся пять раз. Проточная модель является наиболее предпочтительной, когда ее применение невозможно (например, когда тестируемые организмы подвергаются негативному воздействию), возможно использование полунепрерывного метода, при условии соблюдения критериев надежности теста. Скорость потока исходного раствора и воды должна замеряться за 48 часов до начала тестирования и хотя бы раз в день в ходе тестирования. Рекомендуется включать в эту проверку определение скорости течения потока через каждую опытную камеру, поскольку скорости потоков, как между камерами, так и в них, не должны отличаться более чем на 20%.
4.7 Выбор видов организмов для тестирования
Важными критериями при выборе видов являются их доступность, размер и возможность удовлетворительно содержать их в лаборатории. Остальными критериями при выборе видов рыб являются возобновление вида, коммерческие, экологические соображения, а также восприимчивость вида, успешный опыт прошлого и т.п. Рекомендуемые виды для исследований даны в приложении В. Использоваться могут и другие виды, но это потребует адаптации процедуры испытания, дабы обеспечить подходящие условия испытания. В этом случае в отчет включают обоснование выбора вида и метода, какие были применены для испытания.
4.7.1 При выборе видов для тестирования оценивают:
- доступность;
- возможность получения экземпляров удобного для проведения исследования размера и создания удовлетворительных условий их жизни в лабораторных условиях;
- рекреационную ценность видов;
- коммерческую ценность видов;
- экологическую ценность видов;
- сравнительную чувствительность;
- успешное использование в прошлом и т.д.
Список рекомендуемых для тестирования видов приведен в приложении B. Прочие виды также могут подвергаться тестированию, в этом случае может потребоваться изменение процедуры тестирования для создания оптимальных тестовых условий.
В этом случае должно быть подготовлено обоснование выбора конкретного вида и экспериментального метода тестирования.
4.8 Содержание рыбы
4.8.1 Адаптация к новой среде, выбранной для теста группы рыб, длится по меньше мере две недели. Особи должны содержаться в воде той же температуры и получать тот же рацион, что и в ходе предстоящего исследования.
4.8.2 Через 48 часов адаптации подсчитывают количество летальных исходов и производится оценка в соответствии со следующими критериями.
- при летальных исходах выше 10% популяции за семь дней бракуется вся партия;
- при летальных исходах от 5% до 10% популяции за семь дней продление периода адаптации еще на семь дней;
- при летальных исходах менее 5% популяции за семь дней результат принимается. Если в последующие семь дней количество летальных исходов превышает 5%, вся партия бракуется.
4.8.3 Особи, участвовавшие в тестировании, не должны иметь видимых признаков заболеваний или аномальных признаков. Больная рыба должна быть умерщвлена. Особи не должны получать какого-либо лечения в течение двух недель, предшествующих тесту, или в ходе самого исследования.
5 Проведение исследования
5.1 Предварительное исследование
Проведение предварительного тестирования может быть полезно для определения оптимальных условий исследования для конкретного теста, например, выбора концентрации(й) исследуемого вещества, длительности фаз воздействия и очистки.
5.2 Условия воздействия
5.2.1 Длительность фазы воздействия
5.2.1.1 Оценка длительности фазы воздействия может быть получена с помощью имеющегося практического опыта (например, из предшествующих исследований или накопленных данных о веществе с родственной структурой), или из эмпирических соотношений, использующих данные о растворимости в воде, либо коэффициенте разделения октанол/вода исследуемого вещества (приложение C).
5.2.1.2 Фаза воздействия длится в течение 28 сут, если только не возникают признаки того, что стационарное состояние было достигнуто раньше. Если в течение 28 сут стационарное состояние не наступило, фазу воздействия продлевают и измерения продолжают до его наступления или до истечения 60 дней, в зависимости от того, что произойдет раньше.
5.2.2 Длительность фазы очистки
Половины фазы очистки достаточно для соответствующего (например, 90%) снижения дозовой нагрузки вещества (приложение C). Если время, требующееся для достижения 95% очистки, оказывается слишком длительным, превышая, например, по длительности двойной срок фазы воздействия (т.е. более 56 дней), оно может быть уменьшено (например, до наступления момента, когда стабильная концентрация исследуемого вещества будет составлять менее 10%).
Для веществ с более сложным принципом воздействия и очистки, чем однокамерная модель с использованием рыб, и превышающих кинетику первого порядка, более длительные фазы очистки допускаются, с тем чтобы определить константу скорости вывода вещества. Этот срок варьируется в зависимости от того, в течение какого времени концентрация исследуемого вещества в рыбе остается выше уровня обнаружения.
5.2.3 Количество исследуемых рыб
5.2.3.1 Количество рыб должно определяться таким образом, чтобы при каждом выборочном обследовании была возможность взять по четыре особи из каждого образца концентрации исследуемого вещества. В случае, если требуется большая статистическая мощность, количество особей на каждый образец должно быть увеличено.
5.2.3.2 Если для исследования используются взрослые особи, необходимо указать их пол (мужской/женский или и тот, и другой одновременно). Если в тестировании участвуют и те, и другие, необходимо указать разницу в липидном содержании у обоих полов, чтобы она была несущественной перед началом исследования; может потребоваться совместное содержание всех мужских и женских особей.
5.2.3.3 При любом исследовании необходимо выбирать рыбу с приблизительно одинаковым весом, чтобы вес самой маленькой особи составлял не менее двух третей веса самой крупной. Все рыбы должны быть одного возраста и из одного источника. Поскольку вес и возраст особей иногда значительно влияют на показатели , тщательно документируйте эту информацию.
5.2.4 Внесение рыб
5.2.4.1 Необходимо придерживаться большого соотношения вода/рыба для того, чтобы минимизировать уменьшение значения из-за добавления рыбы в начале испытания, а также, чтобы избежать уменьшения концентрации растворенного кислорода. Способ внесения рыб должен быть подходящим для выбранного вида особей. Рекомендуется соблюдать соотношение от 0,1 до 1 г рыбы (живого веса) на литр воды в день. Высокий уровень внесения рыб может использоваться при условии, что необходимая концентрация исследуемого вещества изменяется в пределах не более 20%, а концентрация растворенного кислорода - не ниже 60% от насыщения.
5.2.4.2 При выборе условий внесения рыбы должны быть приняты во внимание естественные условия обитания выбранного вида рыб.
Пример - Для донной рыбы может понадобиться аквариум с большим размером дна, чем для морской рыбы, при одинаковом объёме аквариума.
5.2.5 Кормление
5.2.5.1 В течение периодов адаптации и проведения испытаний необходимо обеспечить надлежащий режим питания рыб известными жирами и общим содержанием белка в достаточном количестве для поддержания их в здоровом состоянии и удержания живого веса. Необходимо обеспечить ежедневное кормление в течение периодов адаптации и проведения испытаний на уровне приблизительно от 1% до 2% живого веса; при этом концентрация жиров у большинства видов рыб будет оставаться на сравнительно постоянном уровне в течение проведения испытаний. Количество подаваемой пищи необходимо пересчитывать, например, раз в неделю, для поддержания постоянного веса и содержания жиров. Для этого, вес рыбы в каждой испытательной камере можно оценить по уровню веса рыбы, образцы которой наиболее часто находятся в этой камере. Рыбу, находящуюся в камере, не взвешивают.
5.2.5.2 Ежедневно следует откачивать несъеденную пищу и экскременты из испытательных камер вскоре после кормления (от 30 мин до 1 ч). По возможности обеспечивают чистоту камер в ходе проведения испытаний для поддержания концентрации органических веществ на низком уровне, поскольку наличие органического углерода может ограничить способность к бионакоплению исследуемого вещества.
5.2.5.3 Пищу необходимо проанализировать на наличие исследуемого вещества. Также рекомендуется исследовать пищу на наличие пестицидов и тяжелых металлов.
5.2.6 Свет и температура
Длина светового дня должна составлять от 12 до 16 час, температура (±2°С) должна соответствовать исследуемым видам рыб (см. приложение B). Вид и характеристики освещения должны соблюдаться. Необходимо помнить о возможном фотопревращении исследуемого вещества под воздействием излучения. Необходимо использовать надлежащее освещение, чтобы рыба не подвергалась воздействию неестественных фотопродуктов. В некоторых случаях, имеет смысл использовать фильтр для защиты от ультразвукового излучения длины волны менее 290 нм.
5.2.7 Исследуемые концентрации
5.2.7.1 Необходимо исследовать воздействие, по крайней мере, двух концентраций исследуемого вещества на рыб в проточных условиях. Следует выбрать высокую (или самую высокую) концентрацию исследуемого вещества, которая составляет около 1% кратковременной асимптотической , и которая, по крайней мере, в десять раз выше своего предела обнаружения в воде используемым аналитическим методом. Самая высокая исследуемая концентрация может определяться делением кратковременной 96 ч
на соответствующее соотношение кратковременной/продолжительной токсичности (например, соответствующее соотношение для некоторых химических препаратов равно примерно трем, а для некоторых - выше 100). По возможности выбирают другую концентрацию (концентрации), чтобы она отличалась от вышеприведенной на коэффициент равный 10. Если это невозможно вследствие 1% критерия
и аналитического предела, можно использовать коэффициент меньше 10 или необходимо рассмотреть использование вещества, меченного
. Не следует использовать концентрации выше растворимости исследуемого вещества.
5.2.7.2 Если используется растворяющий агент, его концентрация не должна превышать 0,1 мл/л и должна быть одинаковой во всех резервуарах для исследований. Необходимо знать его долю (вместе с исследуемым веществом) в общем содержании органического углерода в исследуемой воде. Следует избегать применения таких материалов.
5.2.8 Контрольный раствор
Контрольный раствор, содержащий воду, используемую для разбавления или, если применимо, контрольный раствор, содержащий растворяющий агент, необходимо исследовать в дополнение к серии испытаний при условии, что агент не будет воздействовать на рыбу. Если это условие не выполняется, тогда необходимо проводить исследование двух контрольных образцов.
5.2.9 Частота измерения качества воды
В ходе испытания необходимо измерять растворенный кислород, общий органический углерод, рН и температуру во всех резервуарах. Общую жесткость и минерализацию (если применимо) необходимо измерять в контрольном растворе (растворах) и одном резервуаре при высокой (самой высокой) концентрации. Растворенный кислород и минерализацию (если применимо) необходимо измерять как минимум, три раза: в начале, примерно в середине и в конце периода поглощения, и один раз в неделю в течение фазы очистки. Общий органический кислород необходимо измерять в начале испытаний (24 ч и 48 ч до начала испытаний фазы поглощения) перед добавлением рыбы и, по крайней мере, один раз в неделю, в течение обоих фаз поглощения и очистки. Температуру необходимо измерять ежедневно, рН - в начале и в конце каждого периода, а жесткость - один раз при каждом испытании. Температуру необходимо контролировать постоянно, по крайней мере, в одном сосуде.
5.3 Отбор проб и анализ рыбы и воды
5.3.1 График взятия проб рыбы и воды
5.3.1.1 Пробу воды берут в испытательных камерах для определения концентрации исследуемого вещества перед добавлением рыбы в течение обеих фаз поглощения и очистки. Следует взять пробу воды в то же время, что и пробу рыбы, а также перед кормлением. В течение периода поглощения определяются концентрации исследуемого вещества для проверки соответствия критерию надежности.
5.3.1.2 Отбор проб рыбы необходимо производить не менее, чем в пяти случаях в течение фазы поглощения и не менее, чем в четырех случаях в течение фазы очистки. Поскольку в некоторых случаях будет сложно дать довольно точную оценку коэффициента биоконцентрации ![]() на основании такого числа проб (особенно, когда указывается не простая кинетика очищения первого порядка), возможно, нужно будет брать пробы чаще в обеих фазах (приложение D). Дополнительные пробы хранят как описано в 5.2.6 и анализируют их, если результаты анализов первой серии испытаний будут недостаточными для вычисления
на основании такого числа проб (особенно, когда указывается не простая кинетика очищения первого порядка), возможно, нужно будет брать пробы чаще в обеих фазах (приложение D). Дополнительные пробы хранят как описано в 5.2.6 и анализируют их, если результаты анализов первой серии испытаний будут недостаточными для вычисления с желаемой точностью.
5.3.1.3 Пример приемлемого графика отбора проб приведен в приложении D. Другие графики можно легко рассчитать с использованием других принятых величин для вычисления времени воздействия для 95% поглощения.
5.3.1.4 Отбор проб продолжают в течение фазы поглощения в течение 28 сут, если только до истечения этого периода не будет достигнуто стационарное состояние. Если стационарное состояние не будет достигнуто в течение 28 сут, продолжают отбор до момента его достижения или в течение 60 сут, в зависимости от того, какой период окажется короче. Перед началом фазы очистки перемещают рыбу в чистые резервуары.
5.3.2 Отбор проб и подготовка проб
5.3.2.1 Пробы воды на анализ берут, например, посредством откачки инертной трубкой из центра испытательной камеры. Поскольку с помощью фильтрации или центрифугирования не всегда можно отделить часть исследуемого вещества, недоступного биологически от той части, которая поддается биологическому усвоению (особенно для суперлипофильных химических веществ, т.е. химических веществ с ![]() больше 5), пробы можно не подвергать такой обработке. Вместо этого, необходимо приложить все усилия, чтобы емкости оставались как можно чище, и контролировать содержание общего органического углерода в течение обеих фаз поглощения и очистки.
больше 5), пробы можно не подвергать такой обработке. Вместо этого, необходимо приложить все усилия, чтобы емкости оставались как можно чище, и контролировать содержание общего органического углерода в течение обеих фаз поглощения и очистки.
5.3.2.2 Отбирают нужное количество рыбы (обычно минимум четыре) из испытательных камер во время отбора каждой пробы. Быстро ополаскивают отобранную рыбу водой, промокают, сразу же убивают, используя наиболее подходящий гуманный метод, и взвешивают.
5.3.2.3 Желательно проанализировать рыбу и воду немедленно после взятия проб для того, чтобы предотвратить деградацию или другие потери и рассчитать приблизительные значения величин поглощения и очищения пока испытание продолжается. Незамедлительное проведение анализа также предотвращает задержку в определении фазы плато.
5.3.2.4 Если анализ не был проведен немедленно, обеспечивают хранение пробы подходящим способом. Перед началом анализа необходимо найти информацию о подходящем способе хранения для определенного исследуемого вещества - например, глубокая заморозка, хранение при 4°С, продолжительность хранения, отбор и т.д.
5.3.3 Качество аналитического метода
Поскольку принципиальными при проведении исследования являются точность и чувствительность аналитического метода анализа исследуемого вещества, необходимо экспериментально удостовериться, что точность и воспроизводимость химического анализа, а также выделение исследуемого вещества из воды и рыбы являются удовлетворительными для данного метода. Также проверяют, чтобы исследуемого вещества не было обнаружено в использованной для разбавления воде. При необходимости корректируют значения и
, полученные при проведении испытания, в соответствии с исходными значениями контрольных растворов. Необходимо работать с пробами воды и рыбы все время так, чтобы минимизировать загрязнение и потери (например, в результате адсорбции на устройстве отбора проб).
5.3.4 Анализ проб рыб
5.3.4.1 Если в испытании используют меченые радиоактивным изотопом соединения, можно проанализировать общее число радиоактивных изотопов (т.е. исходных веществ и их метаболитов), или можно очистить пробы для проведения отдельного анализа исходного соединения. Также можно охарактеризовать основные метаболиты в стационарном состоянии или в конце периода поглощения в зависимости от того, что наступит ранее.
Если ![]() в пересчете на меченые остатки превышает или равен 1000, рекомендуется идентифицировать и количественно определять для определенных классов веществ, например, для пестицидов, продукты разложения в тканях рыбы, если они составляют не менее 10% от общего количества остатков в стационарном состоянии. Если продукты разложения в тканях рыбы, составляющие не менее 10% от общего количества остатков меченых радиоактивным изотопом, идентифицированы и количественно определены, также рекомендуется идентифицировать и определить количественное содержание продуктов разложения в исследуемой воде.
в пересчете на меченые остатки превышает или равен 1000, рекомендуется идентифицировать и количественно определять для определенных классов веществ, например, для пестицидов, продукты разложения в тканях рыбы, если они составляют не менее 10% от общего количества остатков в стационарном состоянии. Если продукты разложения в тканях рыбы, составляющие не менее 10% от общего количества остатков меченых радиоактивным изотопом, идентифицированы и количественно определены, также рекомендуется идентифицировать и определить количественное содержание продуктов разложения в исследуемой воде.
5.3.4.2 Для каждой отдельно взвешенной рыбы обычно требуется определять концентрацию исследуемого вещества. Если это невозможно, следует выполнить объединение проб при каждом их отборе, однако данное объединение будет ограничивать возможности статистической обработки данных. Если использование определенной методики статической обработки данных и статистическая мощность являются важными параметрами, тогда для выполнения объединения проб, обеспечения применимости статистической обработки и требуемой статистической мощности в испытании необходимо использовать соответствующее количество рыб.
5.3.4.3 Величина ![]() должна быть выражена в виде функции от общего живого веса и для в высокой степени липофильных веществ - в виде функции от содержания жиров. Если это возможно, определите содержание жиров в рыбе при каждом отборе проб. Для определения содержания жиров используют подходящие методы. По возможности необходимо проводить анализ жиров по тому же извлеченному фрагменту ткани, который был использован для анализа исследуемого вещества, поскольку зачастую необходимо удалять жиры из извлеченного фрагмента перед проведением хроматографического анализа. Содержание жиров в рыбе (в виде мг/кг сырой массы) в конце эксперимента не должно отличаться от содержания жиров в начале более чем на 25%. Также необходимо указывать процентное содержание сухого вещества в ткани для возможности пересчета концентрации жиров из сырого состояния в сухое.
должна быть выражена в виде функции от общего живого веса и для в высокой степени липофильных веществ - в виде функции от содержания жиров. Если это возможно, определите содержание жиров в рыбе при каждом отборе проб. Для определения содержания жиров используют подходящие методы. По возможности необходимо проводить анализ жиров по тому же извлеченному фрагменту ткани, который был использован для анализа исследуемого вещества, поскольку зачастую необходимо удалять жиры из извлеченного фрагмента перед проведением хроматографического анализа. Содержание жиров в рыбе (в виде мг/кг сырой массы) в конце эксперимента не должно отличаться от содержания жиров в начале более чем на 25%. Также необходимо указывать процентное содержание сухого вещества в ткани для возможности пересчета концентрации жиров из сырого состояния в сухое.
6 Данные и отчетность
6.1 Обработка результатов
6.1.1 Получают кривую поглощения исследуемого вещества путем нанесения на график его концентрации в/на рыбе (или определенных тканях) в фазе поглощения в зависимости от времени, отмеченного на обычной шкале. Если кривая достигает стационарных значений, то есть, в приближении становится асимптотической к временной оси, рассчитывают ![]() в стабильном состоянии из:
в стабильном состоянии из:
6.1.2 Если стабильное состояние не достигнуто, можно рассчитать ![]() с достаточной точностью
с достаточной точностью
![]()
при оценке опасности в "стационарном состоянии" при достижении 80% (![]() ) или 95% (
) или 95% (![]() ) равновесия.
) равновесия.
6.1.3 Константу биоконцентрации () определяют как отношение двух кинетических констант уравнений первого порядка
![]() . Кинетическую константу выведения (
. Кинетическую константу выведения () обычно определяют из кривой выведения (т.е. график зависимости уменьшения концентрации исследуемого вещества в рыбе от времени). Кинетическую константу поглощения (
) рассчитывают с помощью заданного
и значения
, которое получается из кривой поглощения. Описание этих методов приведено в приложении E. Предпочтительным методом получения
и констант скорости
и
является компьютерный метод расчета нелинейного параметра. В противном случае, для расчета
и
могут использоваться графические методы. Если кривая выведения очевидно не является кривой первого порядка, тогда необходимо применять более сложные модели и необходимо проконсультироваться у специалиста по медико-санитарной статистике.
6.2 Интерпретация результатов
6.2.1 Если измеренные значения концентраций исследуемых растворов находятся на уровнях, близко расположенных к пределу чувствительности аналитического метода, результаты должны толковаться с осторожностью.
6.2.2 Четко определенные кривые поглощения и выведения являются показателем данных биоконцентрации хорошего качества. Различие констант поглощения/выведения между двумя пробными концентрациями должны составлять менее 20%. Наблюдаемые значительные различия в величинах поглощения/выведения между двумя применяемыми исследуемыми концентрациями должны быть зафиксированы и предоставлены возможные объяснения. В основном, ссылаясь на хорошо изученные исследования, предел достоверности составляет ±20%.
6.3 Отчет об испытаниях
6.3.1 Отчет об испытаниях должен включать в себя следующую информацию:
- Исследуемое вещество:
- физические свойства и, если применимо, физико-химические свойства;
- данные по идентификации химического вещества (включая содержание органического углерода, если применимо);
- если применялась радиоактивная метка, точное положение меченого(ых) атома(ов) и процентное соотношение радиоактивности вследствие загрязнения.
- Образцы при проведении испытаний:
- научное название, источник, любая предварительная обработка, акклиматизация, возраст, размерный ряд и т.д.
- Условия проведения испытаний:
- используемая процедура испытаний (например, проточная или полустатическая);
- тип и характеристики используемого освещения и длина(ы) светового дня;
- план испытаний (например, количество и размер испытательных камер, частота замены воды, количество повторений, количество рыб при повторении, количество исследуемых концентраций, длина фаз поглощения и очистки, частота отбора проб рыбы и воды);
- метод подготовки исходных растворов и частота их обновления (необходимо предоставить данные о растворяющем агенте, его концентрации и его доле в содержании органического углерода исследуемой воды, при использовании);
- номинальные пробные концентрации, значения измеряемых величин и их стандартные отклонения в испытательных резервуарах и метод, согласно которому они были получены;
- источник воды, использованной для разведения, описание какой-либо предварительной обработки, результаты какого-либо показа способности исследуемой рыбы жить в воде и водные характеристики: рН, жесткость, температура, концентрация растворенного кислорода, уровни остаточного хлора (при наличии данных), общий органический углерод, взвешенные твердые частицы, минерализация исследуемой среды (если применимо) и любые другие проведенные измерения;
- качество воды в испытательных сосудах, рН, жесткость, общий органический углерод, температура и концентрация растворенного кислорода;
- подробная информация о кормлении [например, тип пищи, источник, состав (по крайней мере), содержание жиров и белков (при наличии данных) предоставленное количество и частота];
- информация об обработке проб рыбы и воды, включая подробности о подготовке, хранении, отборе и аналитических процедурах (и воспроизводимости) для исследуемого вещества и содержании жиров (если оно было измерено).
Результатами являются:
- результаты любых выполненных предварительных исследований;
- смертность рыбы в контрольных исследованиях и рыбы в каждой испытательной камере и любое наблюдаемое аномальное поведение;
- содержание жиров в рыбе (при определении в случае испытаний);
- кривые (включая все измеряемые данные), показывающие поглощение и выведение исследуемого химического вещества в рыбе, время достижения стабильного состояния;
- ,
(со стандартным отклонением и диапазоном, если применимо) для всех проб [
выражено в мг/г живого веса (частей на миллион) всего тела или его определенных тканей, например, жиры и
мг/мл (частей на миллион)]. Величины
для контрольных рядов (исходные данные также должны быть предоставлены);
- фактор биоконцентрации стабильного состояния, (![]() ) и/или фактор кинетической концентрации (
) и/или фактор кинетической концентрации () и, если применимо, 95%-ный предел достоверности для констант скорости поглощения и выведения (потери) (все должно быть выражено в отношении к общему весу и общему содержанию жиров особи или ее определенных тканей), пределы достоверности и стандартное отклонение (при наличии данных) и используемые методы вычисления/анализа данных для каждой концентрации исследуемого вещества;
- использованные вещества с радиоактивной меткой и, если необходимо, накопление любых обнаруженных метаболитов;
- что-либо необычное в испытании, любое отклонение от методик и любая другая сопутствующая информация.
6.3.2 Минимизируют количество результатов из-за "необнаружения на пределе чувствительности" предварительной проработкой методов и экспериментального планирования, т.к. такие результаты не могут использоваться для расчета констант скорости реакции.
Приложение A
(справочное)
Некоторые химические характеристики приемлемой воды для разведения
Таблица A.1
Вещество | Предельная концентрация |
Твердые примеси | 5 мг/л |
Общий органический углерод | 2 мг/л |
Неионизированный аммиак | 1 |
Остаточный хлор | 10 |
Всего фосфороорганических пестицидов | 50 нг/л |
Всего хлорорганических пестицидов плюс полихлорированных бифенилов | 50 нг/л |
Общий органический хлор | 25 нг/л |
Алюминий | 1 |
Мышьяк | 1 |
Хром | 1 |
Кобальт | 1 |
Медь | 1 |
Железо | 1 |
Свинец | 1 |
Никель | 1 |
Цинк | 1 |
Кадмий | 1 |
Ртуть | 100 нг/л |
Серебро | 100 нг/л |
Приложение B
(рекомендуемое)
Виды рыб, рекомендуемые для испытаний
Таблица B.1
Рекомендованные виды | Рекомендованный интервал температур для испытаний, °С | Рекомендованная общая длина исследуемой особи, см |
Danio rerio (Teleostei, Cyprinidae) (Гамильтог-Бучанан) Полосатая перцина | 20-25 | 3,0±0,5 |
Pimephales promelas (Teleostei, Cyprinidae) (Рафинеске) Толстоголовый гольян | 20-25 | 5,0±2,0 |
Cyprinus carpio (Teleostei, Cyprinidae) (Линнаес) Карп | 20-25 | 5,0±3,0 |
Oryzias latipes (Teleostei, Poecilliidae) (Темминк и Шлегель) Японская оризия или медак | 20-25 | 4,0±1,0 |
Poecilia reticulata (Teleostei, Poeciliidae) (Питерс) Гуппи | 20-25 | 3,0±1,0 |
Lepomis macrochirus (Teleostei Centrarchidae) (Рафинеске) Синежаберный солнечник | 20-25 | 5,0±2,0 |
Oncorhynchus mykiss (Teleostei Salmonidae (Валбаум) Радужная форель | 13-17 | 8,0±4,0 |
Gasterosteus aculeatus (Teleostei, (Gasterosteidae) (Линнаес) Обыкновенная трехиглая корюшка* | 18-20 | 3,0±1,0 |
________________
* Текст документа соответствует оригиналу. - .
Примеры разные эстуарных и морских видов рыб, которые использовались в различных странах, например:
Спот | (Leiostomus xanthurus) |
Изменчивый карпозубик | (Cyprinodon variegatus) |
Атеринка | (Menidia beryllina) |
Шайнер | (Cymatogaster agregate) |
Морской язык | (Parophrys vetulus) |
Шлемоносец | (Leptocottus armatus) |
Обыкновенная трехиглая колюшка | (Gasterosteus aculeatus) |
Морской окунь | (Dicentracus labrax) |
Уклейка | (Alburnus alburnus) |
Коллекция
Пресноводную рыбу, перечисленные виды которой приведены выше, легко разводить и/или легко находить в течение всего года, тогда как доступность морских и эстуарных видов частично ограничена соответствующими странами. Их можно разводить и выращивать в рыбном хозяйстве или в лаборатории, при условии соблюдения санитарных мер безопасности (отсутствие заболеваний и паразитов) для того, чтобы исследуемые особи были здоровы, а их происхождение было известно. Такие рыбы доступны во многих странах мира.
Приложение C
(рекомендуемое)
Прогноз длительности фаз поглощения и очистки
C.1 Прогноз длительности фазы поглощения
Перед проведением исследования вычисляют и в стационарном состоянии, которое может быть получено из эмпирических соотношений
и коэффициента разделения н-октанол/вода (
) или соотношения
и растворимости в воде (
).
Величину (день
) можно рассчитать по формуле (C.1), например, из следующего эмпирического соотношения, см. [12]:
![]() , (
, (0,95) (C.1)
где - коэффициент разделения н-октанол/вода.
Другие соотношения приведены в [13].
Если коэффициент разделения () неизвестен, расчет может быть выполнен по [14], если известна растворимость в воде (
) вещества, с использованием уравнения
![]() , (
, (0,994) (C.2)
где = растворимость (моль/л): (
36).
Эти соотношения применяются только к химическим веществам с величинами ![]() от 2 до 6,5, см. [15].
от 2 до 6,5, см. [15].
Время для достижения некоторого процентного соотношения "стационарного состояния" может быть получено с помощью применения расчета из общего кинетического уравнения, описывающего поглощение и выведение (уравнение скорости реакции первого порядка):
![]() ,
,
или, если является константой:
![]() . (C.3)
. (C.3)
Когда "стационарное состояние" приближается к ![]() , уравнение (C.3) можно упростить см. [15, 16]:
, уравнение (C.3) можно упростить см. [15, 16]:
![]()
или
![]() .
.
Тогда уравнение (C.5) можно использовать для расчета концентрации в рыбе в "стационарном состоянии" ().
Уравнение (C.3) может быть преобразовано следующим образом:
![]()
или
![]() . (C.4)
. (C.4)
Применяя уравнение (C.4), можно рассчитать время, необходимое для достижения некоторого процентного соотношения "стационарного состояния", если величина предварительно рассчитана с использованием уравнений (C.1) или (C.2).
В качестве руководства статистически оптимальная продолжительность фазы поглощения для составления статистически приемлемых данных () является таким периодом, который требуется для построения кривой логарифма концентрации исследуемого вещества в рыбе от линейного времени для достижения его средней точки или
![]() , или 80% стационарного состояния, но не более
, или 80% стационарного состояния, но не более ![]() или 95% стационарного состояния [17].
или 95% стационарного состояния [17].
Время для достижения 80% "стационарного состояния" вычисляется по уравнению (C.4)
![]()
или
![]() . (C.5)
. (C.5)
Аналогично 95% "стационарного состояния" равняются:
![]() , (C.6)
, (C.6)
Пример - Длительность фазы поглощения (up) для исследуемого вещества с ![]() =4 будет равна (используя уравнения C.1, C.5 и C.6):
=4 будет равна (используя уравнения C.1, C.5 и C.6):
![]() =-0,414·4+1,47,
=-0,414·4+1,47,
=0,652 дней
,
up (80%)=1,6/0,652, т.е. 2,45 дней (59 час),
up (95%)=3,0/0,652, т.е. 4,60 дней (110 час).
Обычно для исследуемого вещества с s=10 моль/л [log(s)=-5,0], продолжительность поглощения (up) будет равна (используя уравнения C.1, C.2 и C.5, C.6):
![]() =0,862·(-5,0)+0,710=5,02,
=0,862·(-5,0)+0,710=5,02,
![]() =-0,414·(5,02)+1,47,
=-0,414·(5,02)+1,47,
=0,246 дней
,
up (80%)=1,6/0,246, т.е. 6,5 дней (156 час),
up (95%)=3,0/0,246, т.е. 12,2 дней (293 час).
В качестве альтернативы, уравнение:
![]() (час)
(час)
может быть использовано при расчете времени для достижения фактического стационарного состояния, см. [14].
C.2 Прогноз продолжительности фазы очистки
Прогноз времени, требуемого для уменьшения концентрации веществ в организме к некоторому процентному соотношению исходной концентрации также может быть получен из общего уравнения, описывающего поглощение и выведение (уравнение скорости реакции первого порядка), см. [13] и [20].
Для фазы очистки равно нулю. Уравнение может быть приведено к
![]()
или
![]() ,
,
где - концентрация в начале периода очистки.
50% очистки будет достигнуто за время ():
![]()
или
![]() .
.
Аналогично 95% очистки будет достигнуто при:
![]() .
.
Если 80% поглощения используется для первого периода (![]() ), а 95% потери в фазе очистки (
), а 95% потери в фазе очистки (![]() ), тогда фаза очистки приблизительно вдвое длиннее продолжительности фазы поглощения.
), тогда фаза очистки приблизительно вдвое длиннее продолжительности фазы поглощения.
Необходимо отметить, что расчеты основаны на предположении, что модели поглощения и очистки будут соответствовать кинетике первого порядка. Если кинетика первого порядка очевидно не соблюдается, необходимо использовать более сложные модели.
Приложение D
(справочное)
Теоретический пример графика отбора проб для испытаний биоконцентрации веществ с ![]()
Таблица D.1
Отбор проб рыб | График отбора проб | |||
Минимально требуемая частота (дни) | Дополнительный отбор проб (дни) | N | N рыбы в пробе | |
Фаза поглощения | -1 | 2 | ||
0 | 2 | Добавление 45-80 рыб | ||
1 | 0,3 | 2 | 4 | |
0,4 | (2) | (4) | ||
2 | 0,6 | 2 | 4 | |
0,9 | (2) | (4) | ||
3 | 1,2 | 2 | 4 | |
1,7 | (2) | (4) | ||
4 | 2,4 | 2 | 4 | |
3,3 | (2) | (4) | ||
5 | 4,7 | 2 | 6 | |
Фаза очистки | Перенос рыбы в воду, не содержащую химическое вещество | |||
6 | 5,0 | 4 | ||
5,3 | (4) | |||
7 | 5,9 | 4 | ||
7,0 | (4) | |||
8 | 9,3 | 4 | ||
11,2 | (4) | |||
9 | 14,0 | 6 | ||
17,5 | (4) | |||
Примечание - Расчет Общая продолжительность эксперимента установлена как 3·up=3·4,6 дней, т.е. 14 дней. Расчет поглощения (up) см. в приложении C. | ||||
Приложение E
(рекомендуемое)
Двухкомпонентная модель
E.1 Различие моделей
Считается, что большинство данных по биоконцентрации "обоснованно" хорошо описываются простой двухкомпонентной/двухпараметрической моделью, что отражается прямолинейным участком кривой, проходящей через точки, соответствующие концентрациям вещества в рыбе в течение фазы выведения, при их нанесении на полулогарифмическую бумагу.
E.2 Графический метод определения константы скорости выведения (потери)
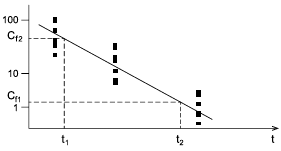
Нанесите значение концентрации исследуемого вещества, обнаруженного в каждой пробе рыбы в зависимости от времени отбора проб на полулогарифмическую бумагу. Угловым коэффициентом этой линии является .
|
![]() .
.
Отклонения от прямой линии могут означать более сложную модель выведения, чем кинетика первого порядка.
Графический метод можно применять для растворяющих методов выведения, отклоняющихся от кинетики первого порядка.
E.3 Графический метод определения константы скорости поглощения
При заданной рассчитайте
следующим образом:
![]() . (E.1)
. (E.1)
Величина находится как срединная точка плавной кривой поглощения, представляющей собой зависимость
концентрации от времени (на арифметической шкале).
E.4 Компьютерный метод расчета констант скорости поглощения и очистки (потери)
Предпочтительными способами получения коэффициента биоконцентрации, а также констант скорости и
являются методы расчета нелинейных параметров на компьютере. Эти программы находят величины
и
на основании данных об изменении концентрации с течением времени и соответствующей модели:
![]() ,
, ![]() , (E.2)
, (E.2)
![]() ,
, , (E.3)
где - время в конце фазы поглощения.
Этот подход позволяет оценить стандартное отклонение и
.
Поскольку в большинстве случаев может определяться из кривой выведения со сравнительно высокой точностью, и поскольку между двумя параметрами
и
существует сильная корреляция, при последовательном расчете рекомендуется сначала вычислить
только из данных выведения и далее вычислить
из данных поглощения с использованием нелинейной регрессии.
Библиография
[1] | OECD guidelines for testing of chemicals. Test No. 305 B bioconcentration: Flow-through Fish Test, 1996 |
[2] | CEC, Bioaccumulation of chemical substances in fish: the flow-through method - Ring Test Programme, 1984-1985 Final report, March 1987. Authors: P. Kristensen and N. Nyholm |
[3] | OECD guidelines for testing of chemicals. Test No. 105: Water Solubility, July 1995 |
[4] | OECD guidelines for testing of chemicals. Test No. 107: Partition Coefficient (n-octanol/water): Shake Flask Method, July 1995 |
[5] | OECD guidelines for testing of chemicals. Test No. 117: Partition Coefficient (n-octanol/water), HPLC Method, Nov 2004 |
[6] | OECD guidelines for testing of chemicals. Test No. 111: Hydrolysis as a Function of pH. Nov 2004 |
[7] | OECD guidelines for testing of chemicals. Test No. 115: Surface Tension of Aqueous Solutions. July 1995 |
[8] | OECD guidelines for testing of chemicals. Test No. 104: Vapour Pressure, July 2006 |
[9] | OECD guidelines for testing of chemicals. Test No. 123: Partition Coefficient (1-Octanol/Water): Slow-Stirring Method, July 2006 |
[10] | Direct Phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No. 3 |
[11] | OECD guidelines for testing of chemicals. Test No. 301: Ready Biodegradability, July 1992 |
[12] | ASTM E-1022-84 (Reapproved 1988). Standard Practice for conducting Bioconcentration Tests with Fishes and Saltwater Bivalve Molluscs |
[13] | Spacie A. and Hamelink J.L. (1982). Alternative models for describing the bioconcentration of organics in fish. Env. Toxicol. and Chemist. Vol. 1 |
[14] | Kristensen P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate organic matter to the bioavailability of chemicals. Water Quality Institute, Denmark |
[15] | Chiou C.T. and Schmedding D.W. (1982). Partitioning of organic compounds in octanolwater systems. Environ. Sci. Technol. Vol. 16 (1) |
[16] | Hawker D.W. and Connell D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22 (6) |
[17] | Branson D.R., Blau G.E., Alexander H.C. and Neely W.B. (1975). Transactions of the American Fisheries Society, 104 (4) |
[18] | Ernst W. (1985). Accumulation in Aquatic Organisms. In: Appraisal of tests to predict the environmental behaviour of chemicals. 1985 SCOPE, John Wiley & Sons Ltd., New York. |
[19] | Reilly P.M., Bajramovic R., Blau G.E., Branson D.R. and Sauerhoff M.W. (1977). Guidelines for the optimal design of experiments to estimate parameters in first order kinetic models, Can. J. Chem. Eng. |
[20] |
|
[21] | US Food and Drug Administration. Revision. Pesticide analytical manual. Vol. 1. 5600 Fisher's Lane, Rockville, MD 20852, July 1975 |
[22] | US EPA (1974). Section 5, A(1) Analysis of Human or Animal Adipose Tissue, in Analysis of Pesticide Residues in Human and Environmental Samples, Thompson J.F. (ed), Research Triangle Park, N.C; 27711 |
[23] | Compaan H. (1980) in The determination of the possible effects of chemicals and wastes on the aquatic environment: degradation, toxicity, bioaccumulation. Ch. 2.3 in Part II. Government Publishing Office, The Hague, The Netherlands |
[24] | Gardner et al. (1995). Limnol. & Oceanogr., 30:1099-1105 |
[25] | Randall R.C., Lee H., Ozretich R.J., Lake J.L. and Pruell R.J. (1991). Evaluation of selected lipid methods for normalizing pollutant bioaccumulation. Environ. Toxicol. Chem. Vol. 10, p.1431-1436 |
УДК 658.382.3:006.354 | МКС 71.040.50 |
Ключевые слова: химическая продукция, воздействие на окружающую среду, окружающая среда, острая токсичность, рыбы | |
Электронный текст документа
и сверен по:
, 2019