ГОСТ 32427-2013
Группа Т58
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Определение биоразлагаемости: 28-дневный тест
Testing methods for chemicals of environmental hazard. Definition of biodegradability: 28-day test
МКС 71.040.50
Дата введения 2014-08-01
Предисловие
Цели, основные принципы и порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ" (ФГУП "ВНИЦСМВ")
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (Росстандарт)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 5 ноября 2013 г. N 61-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Азербайджан | AZ | Азстандарт |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Туркменистан | TM | Главгосслужба "Туркменстандартлары" |
Узбекистан | UZ | Узстандарт |
Украина | UA | Минэкономразвития Украины |
4 Настоящий стандарт идентичен международному документу OECD Test No 301:1992* "Ready Biodegradability" (Тест N 301 "Быстрая биоразлагаемость").
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Перевод с английского языка (en).
Степень соответствия - идентичная (IDT)
5 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г. N 770-ст межгосударственный стандарт ГОСТ 32427-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 августа 2014 г.
6 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты." В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
Введение
Настоящий стандарт содержит описание шести методов, позволяющих выявить способность химических веществ подвергаться биоразложению в аэробной водной среде. В настоящем стандарте приведено описание следующих методов:
метод А: поглощение растворенного органического углерода (РОУ);
метод В: выделение диоксида углерода (Модифицированный тест Штурма);
метод С: MITI (I) (Тест Министерства Международной торговли и Промышленности, Япония);
метод D: испытание в закрытом сосуде;
метод Е: модифицированный тест ОЭСР;
метод F: манометрическое определение БПК.
Метод А идентичен ISO 7827-1984. Методы В, D и Е представляют собой модифицированные версии более ранних Руководящих документов ОЭСР, принятых в 1981 г. Метод F является новым, подобным методу С, главное отличие состоит в используемой посевной культуре.
За время использования данных шести методов, включая межлабораторный тест (кольцевой тест) ОЭСР 1988 г., был получен обширный практический материал. Накопленный опыт и кольцевой тест подтвердили, что все эти методы могут использоваться для оценки способности микроорганизмов к разложению. Однако, в зависимости от физических характеристик исследуемого вещества, может быть выбран тот или иной метод.
Общие указания, включая характерные для всех шести методов, представлены ниже. Детальные описания отдельных методов даны в соответствующих разделах (методы от А до F).
1 Область применения
Настоящий стандарт устанавливает методы испытаний для определения способности химических веществ подвергаться биоразложению в аэробной водной среде.
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями.
2.1 10-дневный интервал (10-d window): 10 дней с момента достижения 10% биодеградации.
2.2 биоразлагаемое вещество (inherently biodegradable): Классификация химических веществ, для которых существуют определенные доказательства способности к биодеградации (первичной или полной) в любом испытании на способность к биологическому разложению.
2.3 биохимическое потребление кислорода, мг , БПК (biochemical oxygen demand (BOD)): Количество кислорода, потребляемое при биохимическом окислении исследуемого вещества микроорганизмами в аэробных условиях. Примечание - также выражается как количество кислорода в мг, потребляемого на мг исследуемого вещества.
2.4 лаг-фаза (lag phase): Период от инокуляции теста на разложение до увеличения процента деградации приблизительно до 10%. Характеризуется вариабельностью и плохой воспроизводимостью.
2.5 легкоразлагаемое вещество (readily biodegradable): Произвольная классификация химических веществ, прошедших определенные испытания на окончательную биодеградацию; испытания проводятся в строгих условиях, что позволяет предположить, что данные химические вещества будут подвергаться быстрой и полной биодеградации в водной среде при аэробных условиях.
2.6 неорганический углерод; НУ (inorganic carbon): Углерод входящий в состав неорганических молекул.
2.7 общий органический углерод; ООУ (total organic carbon (TOC)): Общее содержание органического углерода в образце (суммарное содержание органического углерода в растворе и суспензии).
2.8 общий углерод ОУ (total carbon (ТС)): Общее содержание органического и неорганического углерода в исследуемом образце.
2.9 первичная биоразлагаемость (primary biodegradation): Изменение в химической структуре вещества, вызванное биологическим действием, приводящим к утрате специфических свойств данного вещества.
2.10 полная биоразлагаемость (аэробная) (ultimate biodegradation): Уровень разложения, достигаемый при полном использовании микроорганизмами химического вещества, приводящий к образованию углекислого газа, воды, минеральных солей и новых микробиологических клеточных элементов (прирост биомассы).
2.11 пригодность к очистке (treatability): Подверженность веществ к удалению во время биологической обработки сточных вод без оказания негативного влияния на обычный ход процессов очистки. В общем случае, биоразлагаемые вещества поддаются очистке, что не является характерным для всех биоразлагаемых веществ. Учитываются также и абиотические процессы.
2.12 растворенный кислород, мг/л; РК (dissolved oxygen, (DO)): Концентрация кислорода, растворенного в водном образце.
2.13 растворенный органический углерод: РОУ (dissolved organic carbon (DOC)): Количество органического углерода, присутствующего в растворе после фильтрования через мембранный фильтр с размером пор 0,45 мкм или после центрифугирования с ускорением порядка 4000 г* (порядка 40000 м/сек) в течение 15 мин.
_______________
* Текст документа соответствует оригиналу. - .
2.13* теоретическое выделение углекислого газа , мг: (theoretical carbon dioxide
![]() ): Количество углекислого газа, вычисленное, исходя из известного или измеренного содержания углерода в исследуемом веществе, образующееся при его полной минерализации. Примечание - также выражается как количество углекислого газа в мг, образующегося на мг исследуемого вещества.
): Количество углекислого газа, вычисленное, исходя из известного или измеренного содержания углерода в исследуемом веществе, образующееся при его полной минерализации. Примечание - также выражается как количество углекислого газа в мг, образующегося на мг исследуемого вещества.
_______________
* Нумерация соответствует оригиналу. - .
2.14 теоретическое потребление кислорода, мг; ТПК (theoretical oxygen demand ![]() ): Общее количество кислорода, необходимое для полного окисления исследуемого химического вещества.
): Общее количество кислорода, необходимое для полного окисления исследуемого химического вещества.
Примечание - ТПК вычисляется из молекулярной формулы и также может быть выражено как количество кислорода, потребляемое на мг исследуемого вещества.
2.15 фаза деградации (degradation phase): Время от окончания периода лаг-фазы до времени, когда деградация достигнет 90% от максимально возможного уровня.
2.16 химическое потребление кислорода, мг; ХПК (chemical oxygen demand (COD)): Количество кислорода, потребляемое при химическом окислении исследуемого вещества кипящим раствором бихромата калия в кислоте.
Примечание - Также выражается как количество кислорода в мг, потребляемое на мг исследуемого вещества.
3 Основные требования к условиям, обеспечению и проведению испытаний химической продукции, представляющей опасность для окружающей среды, на определение биоразлагаемости в 28-дневном тесте
3.1 Общие принципы проведения испытаний
3.1.1 Раствор или суспензия исследуемого вещества в минеральной питательной среде высевается и инкубируется в аэробных условиях в темноте или при рассеянном свете. Количество РОУ в исследуемом растворе, получаемое от посевного материала (инокулята), должно сохраняться на минимально возможном уровне, по сравнению с количеством органического углерода тестируемого вещества.
3.1.2 Для определения поправки на эндогенные эффекты инокулята могут быть проведены параллельные контрольные эксперименты с посевным материалом, но без внесения исследуемого вещества. Следует учитывать, что эндогенная активность клеток в присутствии химического вещества не будет точно и полностью соответствовать эндогенной активности в контрольном эксперименте. Для проверки воспроизводимости эксперимента параллельно ставится референтная (стандартная) смесь.
3.1.3 В общем случае биоразлагаемость сопровождается определением таких параметров, как РОУ, выделение и потребление кислорода. Для определения начала и окончания биологического распада необходимо проводить измерения в достаточно частых интервалах. При использовании автоматических респирометров измерение осуществляется непрерывно. В некоторых случаях измерения РОУ проводятся в дополнение к каким-либо другим параметрам, но обычно это делается только в начале и в конце эксперимента. Также для оценки основной деградации исследуемого вещества и определения концентрации каких-либо промежуточных продуктов может использоваться специфический химический анализ. Это условие является обязательным в методе MITI (метод С).
3.1.4 В общем случае эксперимент длится в течение 28 дней, однако он может быть завершен и раньше (до истечения 28 дней), то есть, как только кривая биоразложения выйдет на плато как минимум для трех определений. Также эксперимент может быть продлен по истечении 28 дней, когда кривая показывает, что биологический распад начался, но плато-фаза не была достигнута к 28 дню, однако в таких случаях химическое вещество не будет классифицировано как биоразлагаемое.
3.2 Информация об исследуемом веществе
3.2.1 Для выбора наиболее подходящего метода необходимо иметь сведения о растворимости химического вещества, давлении паров и адсорбционных характеристиках. Для вычисления теоретических значений и/или проверки измеренных величин ТПК, , РОУ, ООУ и ХПК необходимо знать химическую или структурную формулу исследуемого вещества. Для интерпретации полученных результатов, особенно в случаях, когда результат находится близко к пороговому значению, требуется информация о чистоте или относительном соотношении главных компонентов в исследуемом материале.
3.2.2 Информация о токсичности исследуемого вещества на бактериальную культуру (приложение А) может быть крайне необходимой для выбора подходящих экспериментальных концентраций и иметь существенное значение для правильной интерпретации низких показателей биоразложения.
3.3 Применение и подбор методов испытаний
Тестируемые вещества с растворимостью в воде как минимум 100 мг/л могут быть исследованы всеми методами, если только вещество не является летучим и не склонно к адсорбции. В таблице 1 приведены надлежащие экспериментальные методы для плохо растворимых в воде веществ и веществ, являющихся летучими или подверженных адсорбции. Методы обращения с плохо растворимыми в воде и летучими веществами описаны в приложении Б, но в методе MITI (метод С) не допускается использование растворителей и эмульгаторов. Умеренно летучие химические вещества могут быть исследованы с использованием метода поглощения РОУ в том случае, если в экспериментальном сосуде имеется достаточное воздушное пространство (ограниченное соответствующим образом). В этом случае необходимо проводить абиотический контроль для учета любых физических потерь.
Таблица 1 - Применение экспериментальных методов для плохо растворимых, летучих и адсорбирующихся веществ
Экспериментальный метод | Аналитический метод | Возможность применения для веществ: | ||
плохо растворимых | летучих | адсорбирующихся | ||
Поглощение РОУ (метод А) | Растворенный органический углерод | - | - | +/- |
Выделение | Респирометрия: выделение | + | - | + |
MITI I (метод С) | Респирометрия: потребление кислорода | + | +/- | + |
Испытание в закрытом сосуде (метод D) | Респирометрия: растворенный кислород | +/- | + | + |
Модифицированный тест ОЭСР (метод Е) | Растворенный органический углерод | - | - | +/- |
Манометрическое определение БПК (метод F) | Потребление кислорода | + | +/- | + |
3.4 Пороговые значения
3.4.1 Пороговыми значениями для веществ, подверженных биологическому разложению являются следующие показатели: 70% удаление РОУ и 60% ТПК или образование для манометрических методов определения БПК. Показатели для манометрических методов будет ниже, поскольку углерод исследуемого вещества частично включается в новые клетки, процент произведенного
ниже, чем процент используемого углерода. Данные проходные значения должны быть достигнуты в 10-дневный интервал в течение 28 дней эксперимента, за исключением случаев, рассмотренных в п.3.4.2.
3.4.2 10-дневный интервал начинается, когда степень биологического разложения достигает 10% РОУ, ТПК или , и должен закончиться до наступления 28 дня испытания. Химические вещества, для которых пороговое значение достигается по истечении 28-дневного периода, не считаются биоразлагаемыми. Понятие 10-дневного интервала не используется в методе MITI (метод С). Значение, полученное в 14-дневном интервале, будет приемлемо в методе с использованием закрытого сосуда, если будет очевидно, что использование необходимого для оценки 10-дневного интервала количества сосудов затрудняет проведение эксперимента.
3.5 Референтные (стандартные) вещества
Для оценки правильности выполнения экспериментальных процедур проводят параллельное исследование референтных веществ, удовлетворяющих критериям способности к биоразложению. Исследование проводят в подходящих экспериментальных емкостях параллельно, как часть обычного эксперимента. В качестве стандартных веществ используют:
- анилин (свежедистиллированный);
- натрий уксуснокислый;
- натрия бензоат.
Данные стандартные вещества подвержены разложению во всех экспериментальных методах, даже в случаях, когда специально не вносится никакой инокулят.
3.6 Воспроизводимость экспериментов
Эксперименты по определению способности к биологическому разложению необходимо проводить как минимум дважды. В общем случае считается что, чем больше концентрация микроорганизмов, добавленных первоначально в экспериментальную среду, тем меньше будет расхождение между повторными экспериментами.
4 Общие процедуры и реактивы для проведения испытаний химической продукции, представляющей опасность для окружающей среды, на определение биоразлагаемости в 28-дневном тесте
Общие условия использования методов приведены в таблице 2. Оборудование и другие экспериментальные условия, имеющие отношение к определенному методу, описаны в соответствующем разделе отдельно для каждого метода.
Таблица 2 - Условия проведения испытания
Тест | Затухание DOC | Выделение | Манометрическая респирометрия | Модифи- | Испытания в закрытом сосуде | MITI (I) |
Концентрация тестового вещества | ||||||
мг/л | 100 | 2-10 | 100 | |||
мг ХПК/л | 10-40 | 10-20 | 10-40 | |||
Мг ТПК/л | 50-100 | 5-10 | ||||
Концентрация инокулята: | ||||||
взвешенных веществ, мг/л |
| 30 | ||||
Эффлюента, мл/л |
| 0,5 |
| |||
примерно клеток/л | 10 | 10 | 10 | 10 | ||
Концентрация элементов в минеральной среде (в мг/л): | ||||||
116 | 11,6 | 29 | ||||
1,3 | 0,13 | 1,3 | ||||
86 | 8,6 | 17,2 | ||||
122 | 12,2 | 36,5 | ||||
2,2 | 2,2 | 6,6 | ||||
9,9 | 9,9 | 29,7 | ||||
0,05-0,1 | 0,05-0,1 | 0,15 | ||||
рН | 7,4±0,2 | предпочтительно 7 | ||||
Температура, °С | 22±2 | 25 ±1 | ||||
4.1 Вода
При проведении исследования используется деионизированная или дистиллированная вода, не содержащая ингибирующих концентраций токсичных веществ (например, ионов ). Содержание органического углерода в используемой воде не должно превышать 10% от содержания органического углерода в тестовом материале. Высокая чистота используемой воды необходима для того, чтобы избежать получения холостых результатов. Загрязнение может появляться из-за содержания внутренних примесей и от ионообменных смол и продуктов жизнедеятельности микроорганизмов и водорослей. Для каждой серии экспериментов необходимо использовать воду только из одной партии, предварительно протестировав ее на содержание РОУ. Проведение такой проверки не является обязательным для метода D, однако величина потребления кислорода водой должна быть ниже (см. 9.4.1.1).
4.2 Питательная среда
Питательные среды готовят из основных растворов с соответствующей концентрацией минеральных компонентов, в частности, фосфата калия, фосфата натрия и хлорида аммония, хлорида кальция, сульфата магния и хлорида железа (III). Поскольку в методе Е используется очень бедная посевная культура, содержащая низкие концентрации микроэлементов и факторов роста, питательная среда для данного метода может быть обогащена дополнительными компонентами. Характеристики основных растворов минеральных солей, микроэлементов и факторов роста и используемые соотношения указаны в соответствующем разделе отдельно для каждого метода.
4.3 Методы внесения тестируемого и референтного веществ
Метод, используемый для внесения тестируемого и референтного веществ к реакционной смеси, зависит от природы химического вещества, особенно от его растворимости в воде. Для веществ, обладающих растворимостью более 1 г/л, готовят основные растворы соответствующих концентраций и используют их аликвоты для подготовки окончательного экспериментального раствора. Плохо растворимые (растворимость менее 1 г/л) вещества необходимо растворять в минеральной среде, чтобы избежать разбавления буферного раствора. Еще менее растворимые вещества необходимо добавлять непосредственно к окончательному раствору питательной среды.
Исследование слаборастворимых и нерастворимых веществ проводят по приложению Б, но в методе MITI (метод С) не следует использовать ни органические растворители, ни эмульгаторы.
4.4 Посевная культура (инокулят)
Инокулят может быть получен из множества источников, в частности из активного ила, сточных вод (нехлорированных), поверхностных вод и почвы или их смеси. Если в методах поглощения РОУ (метод А), выделения (метод В) и манометрического определения БПК (метод F) используется активный ил, то он должен быть получен из очистных сооружений или в лабораторных условиях из бытовых сточных вод. Посевная культура из других источников, обычно обладающая более низкими значениями клеточной плотности, будет способствовать большому расхождению результатов. Для модифицированного метода ОЭСР (метод Е) и метода испытания в "закрытом сосуде" (метод D) требуется использование более разбавленной посевной культуры без хлопьев. Наиболее приемлемым источником посевной культуры являются вторичные отстойники очистных сооружений или культура, полученная в лаборатории. Для метода MITI (метод С) посевную культуру получают из комбинированного источника. Характеристики источников и подготовка посевной культуры описаны в соответствующем разделе отдельном для каждого метода.
4.5 Предварительная подготовка инокулята
Инокулят должен быть предварительно подготовлен к эксперименту, но не может быть предварительно адаптирован к исследуемому веществу. Предварительная подготовка заключается в аэрации (в питательной среде) активного ила или воды вторичных отстойников в течение 5-7 дней при температуре проведения испытания. В некоторых случаях предварительная подготовка увеличивает точность методов испытаний, уменьшая количество холостых результатов. Подобная подготовка не является необходимой для посевной культуры для метода MITI (метод С).
4.6 Абиотический контроль
При необходимости можно оценить способность исследуемого вещества к абиотическому разложению путем определения поглощения РОУ, потребления кислорода или выделения диоксида углерода в стерильных контрольных пробах, не содержащих посевной культуры. Стерилизация осуществляется мембранной фильтрацией (от 0,2 до 0,45 мкм) или добавлением соответствующего токсичного компонента необходимой концентрации. Если используется мембранная фильтрация, забор образцов осуществляется асептически для обеспечения стерильности. За исключением случаев, когда адсорбция исследуемого вещества была заранее исключена, испытания на биоразложение, такие как поглощение РОУ, особенно с использованием инокулята из активного ила, должны включать абиотический контроль с инокулятом и токсичным компонентом.
4.7 Количество колб и образцов
4.7.1 Необходимо использовать как минимум две колбы или емкости, содержащие исследуемое вещество и посевную культуру и, как минимум, две емкости, содержащие только посевную культуру. Одной емкости достаточно для проведения испытания с референтным веществом и инокулятом, а также, при необходимости, для исследования токсичности, абиотического разложения и контроля адсорбции. Для методов испытания в "закрытом сосуде" (метод D) и MITI (метод С) существуют специальные требования к количеству экспериментальных емкостей. Данные требования указаны в соответствующих разделах для каждого метода. Измерение РОУ и/или других характеристик для экспериментальной и контрольной емкостей необходимо проводить параллельно. Желательно измерения РОУ в других флаконах проводить в нескольких параллелях, однако это не всегда возможно.
4.7.2 Необходимо представить достаточное количество образцов и данных для оценки процента разложения в 10-дневном интервале, однако точный момент наступления лаг-фазы определить невозможно из-за широкого диапазона лаг-фаз и скоростей разложения вещества. В методе MITI (метод С) и при использовании автоматического респирометра в манометрическом методе определения БПК (метод F), забор проб на потребление кислорода не представляет затруднений. В последнем методе ежедневный отбор данных является достаточным, если не используется автоматический респирометр. Специальные указания по отбору проб приведены в соответствующем разделе отдельно для каждого метода.
5 Данные и отчет о проведении эксперимента
5.1 Обработка результатов
5.1.1 При вычислении процента биоразложения , используют средние значения повторных измерений одного и того же параметра в экспериментальных емкостях и в контроле с посевной культурой. Формулы для вычисления приведены в соответствующем разделе отдельно для каждого метода. Процесс деградации представляется графически, и, при необходимости, на графике обозначается 10-дневный интервал. Необходимо вычислить и указать в отчете достигнутое разложение в процентах и величину плато или в конце эксперимента и/или в конце 10-дневного интервала, если это требуется. В манометрическом методе определения БПК, азотсодержащие химические вещества могут повлиять на значение поглощения кислорода за счет процесса нитрификации (см. приложения В и Г). Кроме того, если ТПК не может быть вычислено в силу того, что состав тестируемого материала недостаточно определен, для вычисления процента биодеградации может использоваться величина ХПК. Однако, необходимо принять во внимание, что величина ХПК, как правило, не столь высока, как ТПК, поскольку некоторые химические вещества очень плохо окисляются в эксперименте на ХПК, что может привести к ошибочно высоким показателям биоразложения.
5.1.2 Когда известны определенные химические аналитические данные, первичное биологическое разложение вычисляют по следующей формуле:
![]() , (1)
, (1)
где - первичная деградация за время
, %, обычно 28 дней;
- остаточное количество исследуемого химического вещества в инокулированной питательной среде в конце исследования, мг;
- остаточное количество исследуемого химического вещества в абиотическом контрольном эксперименте в конце исследования, мг.
5.2 Достоверность экспериментов
5.2.1 Эксперимент считают достоверным, если различие максимумов повторных величин разложения исследуемого вещества на плато, либо в конце эксперимента, либо в конце 10-дневного интервала (в зависимости от необходимости), составляет менее 20% и, если процент биологического разложения референтного вещества достигает порогового значения, к 14 дню эксперимента. Если какое-либо условие из перечисленных выше не соблюдается, эксперимент необходимо повторить. В силу строгости методов низкие значения экспериментальных величин не обязательно означают, что исследуемое вещество не разлагается микроорганизмами в природных условиях, но указывают, что необходимо проведение дополнительной оценки способности к биоразложению.
5.2.2 Если в эксперименте на токсичность, содержащем как исследуемое, так и референтное вещества, в течение 14 дней демонстрируется менее, чем 35% деградации (на основании РОУ) или менее, чем 25% деградация (на основании полного ТПК или ), исследуемое вещество может быть признано ингибирующим (см. приложение А). Серия экспериментов должна быть проведена повторно с более низкой концентрацией исследуемого вещества (если это может быть сделано без серьезного влияния на точность определения РОУ) и/или с более высокой концентрацией посевной культуры, но не более, чем 30 мг/л в пересчете на твердое вещество.
5.2.3 Прочие условия достоверности результатов испытаний, индивидуальные для различных методов, приведены в соответствующих разделах.
5.3 Отчет о проведении испытания
Отчет о проведении испытания должен включать нижеследующие разделы:
5.3.1. Исследуемое вещество.
5.3.1* Физическая природа и, при необходимости, физико-химические свойства.
_______________
* Нумерация соответствует оригиналу. - .
5.3.2 Идентификационные данные.
5.3.2* Условия проведения испытания.
_______________
* Нумерация соответствует оригиналу. - .
5.3.2.1 Инокулят: природа и источник образца, концентрация и предварительная подготовка.
5.3.2.2 Соотношение и характеристики промышленных сточных вод в сбросах (если это известно).
5.3.2.3 Продолжительность эксперимента, температура.
5.3.2.4 В случае исследования плохо растворимых веществ методы подготовки экспериментальных растворов/суспензий.
5.3.2.5 Используемый экспериментальный метод причины и научные обоснования любых изменений хода выполнения эксперимента*
_______________
* Текст документа соответствует оригиналу. - . .
5.3.3. Результаты эксперимента:
5.3.3.1 Данные эксперимента в табличной форме.
5.3.3.2 Любые наблюдаемые явления ингибирования.
5.3.3.3 Любая наблюдаемая абиотическая деградация.
5.3.3.4 Определенные химические аналитические данные при наличии.
5.3.3.5 Аналитические данные по промежуточным соединениям при наличии.
5.3.3.6 График зависимости разложения (в процентах) от времени для исследуемого и стандартных веществ, лаг-фазы, фазы деградации, 10-дневные интервалы и наклон кривой.
5.3.3.7 Удаление (в процентах) в плато-фазе, в конце эксперимента и/или в конце 10-дневного интервала.
5.3.4. Обсуждение результатов.
6. Метод А. Определение поглощения растворенного органического углерода
6.1 Общие сведения и принцип метода
6.1.1 Общие сведения относительно оценки способности к биоразложению приведены в разделе 5. Метод А может использоваться для нелетучих веществ, имеющих растворимость в воде, как минимум, 100 мг/л. Должно быть известно содержание углерода в исследуемом образце и, желательно, чистота или относительное содержание основных компонентов. Данный метод фактически идентичен ISO 7827-1984. Также метод А подобен методу Е (Модифицированному тесту ОЭСР), но допускает использование более высоких концентраций клеточной культуры.
6.1.2 Измеренный объем питательной среды с инокулянтом, содержащей известную концентрацию исследуемого вещества (от 10 до 40 мг РОУ/л) в качестве единственного номинального источника органического углерода, подвергается аэрации в темноте или при рассеянном свете при температуре (22±2) °С. Процесс биологического разложения сопровождается анализом РОУ через короткие интервалы в течение 28-дневного периода. Степень биологического разложения вычисляется как процент величины выделенного РОУ (с поправкой на контрольный эксперимент с инокулянтом) от его первоначального количества. Первичная биоразлагаемость также может вычисляться с помощью дополнительного химического анализа тестируемого вещества, который проводится в начале и в конце инкубации.
6.2 Описание метода
6.2.1 Оборудование
При проведении эксперимента используется стандартное лабораторное оборудование, а также:
- конические колбы объемом от 250 мл до 2 л, в зависимости от объема, необходимого для анализа РОУ. Колбы должны быть тщательно вымыты (например, с использованием спиртового раствора соляной кислоты), промыты водой и высушены перед каждым экспериментом;
- аппарат для встряхивания - для размещения конических колб с автоматическим контролем температуры или с возможностью использования при постоянной комнатной температуре, достаточной мощности для поддержания аэробных условий во всех колбах;
- аппарат для фильтрации с подходящими мембранами;
- аппарат для измерения концентрации РОУ (DOC анализатор);
- прибор для определения растворенного кислорода (для проверки аэробных условий эксперимента);
- центрифуга.
6.2.2 Вода
Характеристики воды, которая должна использоваться в эксперименте, см. раздел 4.
6.2.3 Основные растворы для питательной среды
Готовят следующие основные растворы, реактивы, ч.д.а.:
(a) | калия дигидроортофосфат, | 8,50 г |
дикалия гидрофосфат, | 21,75 г | |
динатрия гидроортофосфат, дигидрат, | 33,40 г | |
хлорид аммония, | 0,50 г |
Растворяют в воде и доводят до 1 литра. рН раствора должен составлять 7,4.
(b) | кальция хлорид безводный, | 27,50 г |
или | ||
кальция хлорид дигидрат, | 36,40 г |
Растворяют в воде и доводят до 1 л.
(c) | магния сульфат гептагидрат, | 22,50 г |
Растворяют в воде и доводят до 1 литра.
(d) | железа (III) хлорид гексагидрат, | 0,25 г |
Растворяют в воде и доводят до 1 л.
Примечание - Для того, чтобы избежать необходимости приготовления данного раствора непосредственно перед использованием, в свежеприготовленный раствор добавляют одну каплю концентрированной соляной кислоты или 0,4 г этилендиаминтетрауксусной кислоты (ЭДТА динатриевая соль) на 1 л.
Если в растворах образуются осадки, необходимо заменить их свежими растворами.
6.2.4 Приготовление питательной среды
10 мл раствора (а) смешивают с 800 мл воды, затем добавляют 1 мл растворов (b), (с) и (d) и доводят объем до 1 л.
6.2.5 Приготовление раствора тестируемых веществ
Если растворимость вещества превышает 1 г/л, то в небольшом количестве воды растворяют соответственно от 1 до 10 г исследуемого или референтного вещества и доводят объем до 1 л. В ином случае, готовят основные растворы в питательной среде или добавляют химическое вещество непосредственно к питательной среде, предварительно удостоверившись, что вещество растворилось.
6.2.6 Инокулят
Инокулят может быть получен из различных источников: активного ила, сточных вод, поверхностных вод, почв, или их смеси.
6.2.7 Инокулят из активного ила
6.2.7.1 Отбирают свежий образец активного ила из аэротенка очистных сооружений или из лабораторной установки переработки бытовых сточных вод. При необходимости отфильтровывают крупные частицы через мелкое сито, затем выдерживают раствор в аэробных условиях.
6.2.7.2 Другим способом активный ил, после удаления крупных частиц, отстаивают или центрифугируют (например, 1100 g в течение 10 минут). Удаляют надосадочную жидкость. Осадок промывают в питательной среде. Смешивают концентрированный ил с питательной средой, для получения концентрации от 3 до 5 г сухого веса на 1 л. Затем аэрируют.
6.2.7.3 Ил необходимо забирать с очистных сооружений, работающих в нормальном режиме. Если ил взят с крупнотоннажных очистных сооружений, или предполагается, что он содержит ингибиторы, его необходимо промыть. Повторно взвешенный ил после тщательного перемешивания отстаивают или центрифугируют, удаляют супернатант и снова повторно готовят суспензию промытого ила в дополнительном объеме питательной среды. Эту процедуру повторяют до тех пор, пока ил не будет очищен от взвешенных веществ или ингибиторов.
6.2.7.4 После приготовления суспензии активного ила, или из необработанного ила, непосредственно перед использованием определяют величину сухого остатка.
6.2.7.5 В дальнейшем можно гомогенизировать активный ил (от 3 до 5 г сухого веса 1 л). Обработку активного ила проводят в гомогенизаторе Уоринга в течение 2 минут на средней скорости. Гомогенизированный ил отстаивают в течение минимум 30 минут, или при необходимости дольше, и декантируют жидкость для использования в качестве посевного материала с концентрацией примерно 10 мл/л питательной среды.
6.2.8 Прочие источники посевной культуры
6.2.8.1 Другим способом инокулят может быть получен из вторичных отстойников очистных сооружений или лабораторной установки по переработке бытовых сточных вод. Отбирают свежий образец и сохраняют его в аэробных условиях во время транспортировки. Образец отстаивают в течение 1 часа или фильтруют его через грубую фильтровальную бумагу, отфильтрованные сточные воды или фильтрат выдерживают в аэробных условиях в течение необходимого времени. До 100 мл подобной посевной культуры может использоваться на 1 л питательной среды.
6.2.8.2 Еще одним источником посевной культуры могут служить природные поверхностные воды. В данном случае, забирают образец соответствующих поверхностных вод, например, вод реки, озера, и сохраняют в аэробных условиях в течение необходимого времени. При необходимости, проводят концентрирование посевной культуры фильтрацией или центрифугированием.
6.2.9 Предварительная подготовка инокулята
Инокулят должен быть предварительно подготовлен к условиям проведения эксперимента, но не может быть заранее адаптирован к тестируемому веществу. Предварительная подготовка заключается в аэрации активного ила (в питательной среде) или воды из вторичных отстойников в течение 5-7 дней при температуре проведения исследования. Предварительное создание условий иногда улучшает точность метода испытаний, уменьшая количество холостых значений.
6.2.10 Подготовка колб
6.2.10.1 В качестве образца: добавьте по 800 мл питательной среды в двухлитровые конические колбы и достаточное количество основных растворов исследуемого и референтного веществ в отдельные колбы так, чтобы концентрация химического эквивалента составляла от 10 до 40 мг РОУ/л. Измерьте значения рН и, при необходимости, доведите его до 7,4. Добавьте в колбы активный ил или другой источник посевной культуры, чтобы финальная концентрация не превышала 30 мг по сухому остатку/л. Также подготовьте контрольные пробы с посевной культурой в минеральной среде, но без добавления исследуемого или стандартного веществ.
6.2.10.2 При необходимости используют одну емкость для проверки возможной ингибирующей активности исследуемого вещества, внося инокулянт, содержащий сопоставимые концентрации исследуемого и референтного веществ в питательной среде.
6.2.10.3 Кроме того, если требуется, определите деградацию в абиотических условиях путем отстаивания исследуемого вещества в колбе простерилизованного неинокулированного раствора вещества. Стерилизация раствора проводится мембранной фильтрацией (от 0,2 до 0,45 мкм) или добавлением подходящего токсичного вещества в соответствующей концентрации.
6.2.10.4 Дополнительно, если ожидается, что исследуемое вещество значительно адсорбируется на стекле, иле и т.д., проводят предварительную оценку для определения вероятной степени адсорбции и, таким образом, пригодности метода для данного вещества (см. таблицу 1). Готовят колбу, содержащую исследуемое вещество, посевную культуру и стерилизующий агент.
6.2.10.5 Доводят объемы питательной среды во всех колбах до 1 литра и, после перемешивания, отбирают образец из каждой колбы для определения начальной концентрации РОУ в параллельных экспериментах (см. приложение В, пункт В.4). Закрывают горлышко колб (например, алюминиевой фольгой) таким образом, чтобы обеспечить свободный воздухообмен между колбой и окружающей атмосферой. Для начала эксперимента устанавливают емкости в аппарате для встряхивания.
6.2.11 Количество колб
В обычном случае используются следующие колбы:
- колбы 1 и 2, содержащие исследуемое вещество и посевную культуру (экспериментальная суспензия);
- колбы 3 и 4, содержащие только посевную культуру (контрольный эксперимент с посевной культурой);
- колба 5, содержащая референтное вещество и посевную культуру (контроль экспериментальных процедур); и, предпочтительно,
а также, при необходимости
- колба 6, содержащая исследуемое вещество и стерилизующий агент (абиотический стерильный контрольный эксперимент);
- колба 7, содержащая исследуемое вещество, посевную культуру и стерилизующий агент (контроль адсорбции);
- колба 8, содержащая исследуемое вещество, стандартное вещество и посевную культуру (контроль токсичности).
6.3 Процедура эксперимента
6.3.1 Определение растворенного органического углерода
В течение эксперимента определяют концентрацию РОУ в образцах из каждой колбы в параллельных экспериментах в определенных временных интервалах. Обязательно параллельное определение РОУ в экспериментальной суспензии и в контрольном эксперименте с посевной культурой. Желательно определять РОУ и в других колбах также параллельно, однако это не всегда возможно.
6.3.2 Отбор проб
Для каждого определения берут только минимально необходимый объем экспериментальной суспензии. Прежде, чем осуществлять отбор проб, необходимо устранить любые потери вследствие испарения путем добавления соответствующего количества воды. Тщательно перемешивают питательную среду до отбора образца так, чтобы материал, адсорбированный на стенках емкости, был смыт и растворен до отбора пробы. Сразу после отбора пробы ее фильтруют через мембранный фильтр или центрифугируют (см. приложение В, пункт В.4). Анализ пробы, отфильтрованной или обработанной в центрифуге, проводят в тот же день, в ином случае, хранят при температуре от 2 °С до 4 °С в течение максимум 48 ч или при температуре ниже минус 18 в течение более длительного периода.
6.3.3 Частота отбора проб
Отобранное количество проб должно быть достаточным для оценки процента деградации в 10-дневный период. Точной схемы отбора проб не существует. Если анализ производится в день отбора проб, исходя из результатов данного анализа, необходимо оценить следующее время отбора пробы. Если пробы сохраняются, то отбор проб производится ежедневно или раз в 2 дня. Сначала необходимо провести анализ последней пробы (28 день) и, путем постепенного обратного отбора соответствующих образцов для анализа, можно получить качественное описание кривой биологического распада с относительно небольшим количеством определений. Конечно, если в последней пробе (28 день) демонстрируется отсутствие биоразложения, дальнейшего анализа проб проводить не нужно.
6.4 Данные и отчет о проведении эксперимента
6.4.1 Обработка результатов
6.4.1.1 Данные эксперимента должны приводиться в прилагаемом отчете.
6.4.1.2 Процент деградации () в каждый период времени отбора пробы должен быть вычислен отдельно для каждой колбы, содержащей исследуемое вещество (т.е. колбы 1 и 2) с использованием средних значений параллельных измерений РОУ (см. технические спецификации (образец в приложении Д)) для того, чтобы можно было оценить достоверность эксперимента. Процент деградации вычисляется по формуле (2)
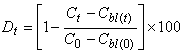 , (2)
, (2)
где - деградация в момент времени
, %;
- начальная концентрация РОУ в инокулированной питательной среде, содержащей исследуемое вещество, мг РОУ/л;
- средняя концентрация РОУ в инокулированной питательной среде, содержащей исследуемое вещество в момент времени
, мг РОУ/л;
- начальная концентрация РОУ в контрольном эксперименте с посевной культурой, мг РОУ/л;
- средняя концентрация РОУ в контрольном эксперименте в момент времени
, мг РОУ/л.
Все концентрации измеряются экспериментально.
6.4.1.3 Если эксперимент удовлетворяет критериям достоверности, необходимо представить ход процесса разложения на графике, используя средние данные для колб, содержащих исследуемое вещество. На графике необходимо представить 10-дневный интервал. В зависимости от того, что необходимо, вычисляют и указывают в отчете процент удаления в плато-фазе в конце эксперимента и/или в конце 10-дневного интервала.
6.4.1.4 Если доступны определенные химические аналитические данные, вычисляют основную биодеградацию (см. раздел 5).
6.4.1.5 Когда используется абиотический контроль, вычисляют процент абиотической деградации по формуле
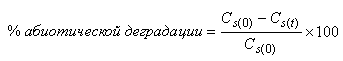 , (3)
, (3)
где - концентрация РОУ в стерильном контрольном образце в день 0,
- концентрация РОУ в стерильном контрольном образце в день
.
6.4.2 Достоверность экспериментов
Критерии достоверности приведены в разделе 5.
6.4.3 Отчет о проведении эксперимента
Отчет о проведении испытания должен содержать информацию в соответствии с разделом 5.
6.4.4 Пример представления результатов эксперимента
Образцы представления результатов приведены в приложении Д.
7 Метод В. Определение выделения диоксида углерода ( )
)
7.1 Общие сведения и принцип метода
7.1.1 Общие сведения относительно оценки способности к биоразложению приведены в соответствии с 4. Необходимо ознакомиться с данным разделом до начала проведения испытания. Метод В может использоваться для нелетучих исследуемых веществ. Также должно быть известно содержание углерода в исследуемом образце и, желательно, чистота или относительное содержание основных компонентов.
7.1.2 Измеренный объем инокулированной минеральной питательной среды, содержащий известную концентрацию исследуемого вещества (от 10 до 20 мг РОУ или ТПК/л) в качестве единственного номинального источника органического углерода, подвергается аэрации путем пропускания через раствор воздуха, не содержащего диоксида углерода, с контролируемой скоростью в темноте или при рассеянном свете. В течение 28 дней эксперимента деградация сопровождается определением объема выделенного диоксида углерода ![]() . Диоксид углерода
. Диоксид углерода улавливается раствором гидроксида натрия или бария и его количество измеряется титрованием остаточного гидроксида или по содержанию неорганического углерода. Количество углекислого газа, полученного из исследуемого вещества (с учетом результатов контрольного эксперимента с посевной культурой), выражается в процентах
. Степень биологического разложения может быть также вычислена путем дополнительного анализа РОУ, проведенного в начале и в конце инкубации.
7.2 Описание метода
7.2.1 Оборудование
При проведении эксперимента используется стандартное лабораторное оборудование, а также:
a) колбы, объемом 2-5 л, оснащенные аэрационной трубкой, практически достигающей основания колбы и выходного отверстия (трубка не должна мешать работе магнитной мешалки во время ее использования);
b) магнитные мешалки, используемые при исследовании плохо растворимых веществ;
c) поглотительные сосуды для улавливания ;
d) устройство для управления и измерения газового потока;
e) аппарат для поглощения углекислого газа, аппарат для подготовки воздуха, очищенного от углекислого газа в ином случае может использоваться смесь кислорода и азота без из газовых баллонов, в правильных соотношениях (20%
: 80%
);
f) устройство для определения углекислого газа титриметрически или в форме неорганического анализа углерода;
g) устройство для мембранной фильтрации (дополнительно);
h) анализатор РОУ (дополнительно).
7.2.2 Вода
Характеристики воды, которая должна использоваться в эксперименте, приведены в разделе 4.
7.2.3 Основные растворы для питательной среды
Необходимо подготовить основные растворы, как описано в пункте 6.2.3.
7.2.4 Подготовка питательной среды
Необходимо подготовить питательную среду, как описано в пункте 6.2.4.
7.2.5 Приготовление раствора тестируемых веществ
Необходимо подготовить раствор тестируемых веществ, как описано в пункте 6.2.5. Для плохо растворимых веществ см. приложение Б.
7.2.6 Инокулят
7.2.6.1 Инокулят может быть получен из различных источников: активный ил; сточные воды; поверхностные воды, почвы, или их смесь.
7.2.6.2 Инокулят из активного ила
Необходимо подготовить инокулят из активного ила, как описано в пункте 6.2.7.
7.2.6.3 Другие источники инокулята
Также инокулят может быть получен из вторичных отстойников очистных сооружений или лабораторной установки, перерабатывающей бытовые сточные воды, или из поверхностных водоемов. Для более подробных сведений см. 6.2.8.
7.2.7 Предварительная обработка инокулята
Необходимо подготовить инокулят из активного ила, как описано в пункте 6.2.9.
7.2.8 Подготовка колб
7.2.8.1 Приведем пример:
значения (объем и вес) представлены для пятилитровых колб, содержащих 3 л суспензии. Если используются меньшие объемы, необходимо соответственно изменять объемы, учитывая, что образовавшийся углекислый газ должен быть измерен точно. В каждую 5-литровую колбу добавляют 2400 мл питательной среды. Затем в колбу добавляют соответствующий объем подготовленного активного ила так, чтобы концентрация взвешенных твердых частиц в окончательном растворе инокулированной смеси (3 л) не превышала 30 мг/л. В ином случае сначала разбавляют готовый активный ил до получения суспензии концентрацией от 500 до 1000 мг/л в питательной среде прежде, чем добавить аликвоту суспензии в 5-литровую колбу для достижения концентрации 30 мг/л; это гарантирует большую точность (также, могут использоваться и другие источники посевной культуры, см. 6.2.8). Затем проводят аэрацию данных инокулированных смесей в течение ночи воздухом, не содержащим , для очистки системы от углекислого газа.
7.2.8.2 В дублирующие колбы добавляют отдельно исследуемое и референтное вещества в виде известных объемов основных растворов так, чтобы обеспечивались концентрации от 10 до 20 мг РОУ или ТПК/л с учетом добавления тестируемых веществ; некоторые колбы оставляют без добавления тестирующих веществ для проведения контрольного эксперимента с посевной культурой. Плохорастворимые вещества добавляют непосредственно в колбы по весу или по объему или руководствуются приложением Б. Доводят объемы суспензий во всех колбах до 3 л путем добавления питательной среды, ранее обработанной воздухом без содержания .
7.2.8.3 При необходимости используют одну колбу для исследования возможных ингибирующих эффектов исследуемого вещества, добавив исследуемое и референтное вещества в тех же концентрациях, в которых они присутствуют в остальных колбах.
7.2.8.4 Также, при необходимости, определяют, подвергается ли исследуемое вещество разложению в абиотических условиях с использованием стерилизованного неинокулированного раствора химического вещества. Стерилизацию можно провести, добавив токсичное вещество в соответствующей концентрации.
7.2.8.5 Если используется раствор гидроксида бария, соединяют три поглотителя, содержащие 100 мл 0,0125 М раствора гидроксида бария каждый, последовательно с каждой 5-литровой колбой. Данный раствор не должен содержать осажденных сульфатов или карбонатов, их концентрация должна быть измерена непосредственно перед использованием. Если используется гидроксид натрия, то необходимо соединить два поглотительных сосуда, второй используется в качестве контрольного для подтверждения того, что весь углекислый газ был поглощен первым. Поглотительные сосуды, оснащенные пробкой, подходят для проведения эксперимента. Добавляют 200 мл 0,05 М раствора гидроксида натрия в каждую колбу. Этого достаточно для того, чтобы обеспечить поглощение всего диоксида углерода, выделяющегося при полном разложении исследуемого вещества. Поскольку даже свежеприготовленный раствор гидроксида натрия будет содержать следовые количества карбонатов, необходимо делать поправку на них в контрольном эксперименте.
7.2.8.6 Дополнительно могут быть отобраны пробы для анализа РОУ (см. приложение В) и/или определенного химического анализа.
7.2.9 Количество колб
В общем случае, используются следующие колбы:
- колбы 1 и 2, содержащие исследуемое вещество и посевную культуру (тестовая суспензия);
- колбы 3 и 4, содержащие только инокулянт (нулевой контроль);
- колба 5, содержащая референтное вещество и посевную культуру (контроль экспериментальных процедур); и, предпочтительно,
а также
- колба 6, содержащая исследуемое вещество и стерилизующий агент (абиотический стерильный контроль);
- колба 7, содержащая исследуемое вещество, посевную культуру и стерилизующий агент (контроль адсорбции);
- колба 8, содержащая исследуемое вещество, референтное вещество и посевную культуру (контроль токсичности).
7.3 Процедура эксперимента
Начинают эксперимент, пропуская воздух, не содержащий , через суспензию со скоростью от 30 до 100 мл/мин.
7.3.1 Определение
7.3.1.1 Обязательно регистрировать выделение в исследуемых суспензиях и контрольных экспериментах с посевной культурой параллельно и, желательно, проводить параллельные измерения и для прочих экспериментальных сосудов.
7.3.1.2 В течение первых 10 дней рекомендуется, чтобы анализ проводился каждый 2 или 3 день, а затем, по крайней мере, каждый 5 день до 28 дня так, чтобы мог быть выявлен 10-дневный интервал. В те дни, когда проводятся измерения
, разъединяют ближайший к экспериментальной колбе поглотитель гидроксида бария и титруют раствор гидроксида 0,05 М раствором
с использованием фенолфталеина в качестве индикатора. Оставшиеся абсорберы перемещают на одно место ближе к испытательному сосуду и помещают новый абсорбер, содержащий 100 мл свежего 0,0125 М раствора гидроксида бария, в конце ряда. При необходимости, титрование проводят, например, когда наблюдается существенное осаждение в первой ловушке и прежде, чем оно появится во второй, или, по меньшей мере, еженедельно. В альтернативном варианте, с использованием в качестве абсорбента гидроксида натрия
![]() , пробу раствора гидроксида натрия забирают из абсорбера, ближайшего к экспериментальной колбе с помощью шприца. Необходимый объем пробы будет зависеть от используемого метода анализа углерода, но проба не должна значительно изменять объема абсорбционного раствора в течение эксперимента. Введите образец в часть неорганического углерода в углеродном анализаторе для прямого анализа выделяемого углекислого газа. Анализ содержимого второй ловушки необходимо проводить только по окончании эксперимента для корректировки с учетом возможного выноса диоксида углерода.
, пробу раствора гидроксида натрия забирают из абсорбера, ближайшего к экспериментальной колбе с помощью шприца. Необходимый объем пробы будет зависеть от используемого метода анализа углерода, но проба не должна значительно изменять объема абсорбционного раствора в течение эксперимента. Введите образец в часть неорганического углерода в углеродном анализаторе для прямого анализа выделяемого углекислого газа. Анализ содержимого второй ловушки необходимо проводить только по окончании эксперимента для корректировки с учетом возможного выноса диоксида углерода.
7.3.1.3 На 28 день исследования отбирают произвольные пробы для анализа РОУ и/или специфического химического анализа. Добавляют 1 мл концентрированной соляной кислоты в каждую экспериментальную колбу и проводят аэрацию содержимого в течение ночи для удаления диоксида углерода, присутствующего в исследуемых суспензиях. На 29 день эксперимента проводят последний анализ выделенного углекислого газа.
7.4 Данные и отчет о проведении эксперимента
7.4.1 Обработка результатов
7.4.1.1 Данные эксперимента должны быть приведены в прилагаемом отчете.
7.4.1.2 Количество выделенного вычисляется по количеству гидроксида, оставшегося в экспериментальной колбе. Когда в качестве абсорбента используется 0,0125 М раствор
![]() , его оставшееся количество оценивается титрованием 0,05 М раствором
, его оставшееся количество оценивается титрованием 0,05 М раствором (для титрования 100 мл
![]() необходимо 50 мл
необходимо 50 мл ).
7.4.1.3 Поскольку 1 ммоль образуется на каждый 1 ммоль
![]() , прореагировавшего до
, прореагировавшего до ![]() , и 2 ммоль
, и 2 ммоль , необходимого для титрования оставшегося
![]() , и, учитывая, что молекулярная масса
, и, учитывая, что молекулярная масса составляет 44 г, количество выделенного
, (мг) вычисляется по формуле
![]() . (4)
. (4)
Таким образом, в данном случае, коэффициент преобразования объема , необходимого для титрования, к массе выделенного
(мг) составляет 1,1. Вычисляют количество
, полученного только из инокулята и инокулята с исследуемым веществом, используя соответствующие величины, полученные при титровании; разница данных показателей представляет собой количество
, полученного только из одного только исследуемого вещества. Например, если на титрование в эксперименте только с инокулятом затрачено 48 мл
, а в эксперименте с инокулятом и исследуемым веществом - 45 мл, то:
количество от инокулята =1,1
(50-48)=2,2 мг
количество от инокулята и экспериментального вещества =1,1х(50-45)=5,5 мг
и, таким образом, количество , полученного от исследуемого вещества, составляет 3,3 мг.
7.4.1.4 Процент биодеградации вычисляется по формулам (5), (6).
![]() (5)
(5)
или
![]() , (6)
, (6)
где 3,67 - коэффициент преобразования (44/12) для углерода к углекислому газу. Процент биодеградации рассчитывают после любого временного интервала путем сложения величин процента , вычисленных для каждого из дней, до необходимого момента, в которые производилось измерение.
7.4.1.5 В случае, если в качестве абсорбента используется раствор гидроксида натрия, вычисляют количество выделенного после каждого временного интервала на основании концентрации неорганического углерода и объема использованного абсорбента.
Процент биоразлагаемости вычисляют по формуле (7).
![]() . (7)
. (7)
7.4.1.6 Процесс деградации необходимо представить на графике и обозначить 10-дневный интервал. Кроме того, необходимо вычислить и представить в заключительном отчете процент удаления в плато-фазе, в конце эксперимента и/или, при необходимости, по окончании 10-дневного интервала.
7.4.1.7 При необходимости вычислите удаление РОУ, используя соотношение (2).
7.4.1.8 Когда проводится абиотический контрольный эксперимент, процент абиотической деградации вычисляют по формуле (8).
![]() . (8)
. (8)
7.4.2 Достоверность экспериментов
7.4.2.1 Содержание неорганического углерода в суспензии тестируемого вещества в питательной среде в начале эксперимента должно составлять менее 5% ОУ, и полный объем выделенного в контрольном эксперименте с посевной культурой в обычном случае не должен превышать 40 мг/л питательной среды. Если полученные величины превосходят 70 мг
/л, данные и техника проведения эксперимента должны быть пересмотрены.
7.4.2.2 Прочие критерии достоверности эксперимента, приведенные в разделе 7.4.3, также могут использоваться.
7.4.3 Отчет о проведении испытания
Отчет о проведении эксперимента должен включать информацию согласно разделу 5. Образцы представления результатов приведены в приложении Е.
8 Метод С. Модифицированный тест MITI (I)
8.1 Общие сведения и принцип метода
8.1.1 Общие сведения относительно оценки способности к биоразложению приведены в разделе 8.4. Необходимо ознакомиться с данным разделом до начала проведения испытания. При использовании Метода С должны быть известны химическая формула исследуемого вещества, его чистота или относительные пропорции основных компонентов, необходимые для вычисления ТПК. Исследование нерастворимых и летучих веществ может быть проведено при условии проведения предварительной подготовки. Нерастворимые вещества должны быть диспергированы, например, с использованием материала очень мелкого помола или ультразвука, но не растворителей или эмульгаторов. Для летучих веществ объем свободного пространства для газа в автоматическом респирометре должен быть сведен к минимуму.
8.1.2 Потребление кислорода в растворе или суспензии тестируемого вещества в питательной среде, инокулированной специально выращенными, неадаптированными микроорганизмами, измеряется автоматически в течение 28 дней затемненным изолированным респирометром при температуре (25+1) °С. Выделенный углекислый газ поглощается натронной известью. Биоразлагаемость выражается как потребление кислорода в процентах (с учетом данных контрольного эксперимента с посевной культурой) от теоретического потребления кислорода (ТПК). Основная биоразлагаемость в процентах также вычисляется из дополнительного специфического химического анализа, который проводится в начале и в конце периода инкубации, и, при необходимости, окончательная биоразлагаемость путем анализа РОУ.
8.2 Описание метода
8.2.1 Оборудование
8.2.1.1 При проведении эксперимента используется следующее стандартное лабораторное оборудование:
a) автоматический электролитический прибор для измерения БПК или респирометр, обычно оборудованный 6 колбами (300 мл каждая), и оснащенный чашками для абсорбента ;
b) лабораторная комната с постоянной температурой и/или водяной баней, способной поддерживать температуру (25±1) °С или точнее;
c) установка для мембранной фильтрации (дополнительно);
d) анализатор углерода (дополнительно).
8.2.1.2 Вода
Характеристики воды, которая должна использоваться в эксперименте, приведены в разделе 7.4.
8.2.1.3 Основные растворы для минеральной среды
Подготовьте следующие основные растворы, реактивы, ч.д.а.:
a) | калия дигидроортофосфат, | 8,50 г |
дикалия гидрофосфат, | 21,75 г | |
динатрия гидроортофосфат, додекагидрат, | 44,60 г | |
хлорид аммония, | 1,70 г |
Растворяют в воде и доводят до 1 литра. рН раствора должен составлять 7,2.
b) | магния сульфат, гептагидрат, | 22,50 г |
Растворяют в воде и доводят до 1 литра.
c) | кальция хлорид, безводный, | 27,50 г |
Растворяют в воде и доводят до 1 литра.
d) | хлорид железа (III), гексагидрат, | 0,25 г |
Растворяют в воде и доводят до 1 литра. pH раствора должен составлять 7,2.
8.2.1.4 Подготовка минеральной среды
Отберите по 3 мл каждого раствора (а), (b), (с) и (d) и доведите растворы до 1 литра.
8.2.1.5 Основные растворы исследуемых веществ
Если растворимость вещества превышает 1 г/л, растворяют от 1 до 10 г, по необходимости, исследуемого и референтного веществ в воде и доводят раствор до 1 литра. В ином случае готовят растворы в питательной среде или добавляют исследуемое вещество непосредственно к питательной среде. Для подготовки плохо растворимых веществ см. 7.2.1.6.
8.2.1.6 Предварительная подготовка инокулята
Отбирают свежие пробы не менее чем от 10 источников посевной культуры, преимущественно, из областей, где используется и сбрасывается в окружающую среду большое количество химических веществ. Отбирают по 1 л образцов активного ила, поверхностных почв, воды из очистных сооружений, рек, озер, морей и тщательно их перемешивают.
После отстаивания и удаления взвешенных частиц доводят значение рН супернатанта до 7±1 раствором гидроксида натрия или фосфорной кислоты. Для заполнения емкости для активного ила используют необходимый объем отфильтрованного супернатанта и проводят его аэрацию в течение 23,5 ч. Спустя 30 минут после завершения аэрации удаляют примерно 1/3 объема супернатанта и добавляют равный объем раствора (рН 7), содержащего по 0,1% глюкозы, пептона и ортофосфата калия к оставшемуся отстоянному материалу и возобновляют аэрацию. Эту процедуру повторяют 1 раз в сутки.
Использование емкости для активного ила должно проводиться согласно принципам надлежащей лабораторной практики: сточные воды не должны содержать загрязнений;
температура должна поддерживаться на уровне (25±2) °С и рН - (7±1);
ил должен хорошо осаждаться;
аэрация должна быть достаточной для поддержания аэробных условий смеси на протяжении всего времени;
в активном иле должны присутствовать простейшие организмы, и активность ила должна проверяться по отношению к референтному веществу как минимум каждые 3 месяца. Активный ил нельзя использовать в качестве инокулянта по крайней мере, до истечения 1 месяца после отбора и не более чем после 4 месяцев. После этого, производят отбор образцов равными частями, как минимум из 10 мест один раз каждые 3 месяца. Чтобы поддержать одинаковую активность свежего и старого ила, смешивают отфильтрованный супернатант используемого активного ила с равным объемом отфильтрованного супернатанта недавно собранной смеси 10 образцов и обрабатывают полученный раствор как описано выше. Использовать культуру как инокулюм можно через 18-24 часа после подкормки.
8.2.1.7 Подготовка колб
Готовят следующие шесть колб:
- колба 1, содержащая раствор исследуемого вещества в воде с концентрацией 100 мг/л;
- колбы 2, 3 и 4, содержащие раствор исследуемого вещества в питательной среде с концентрацией 100 мг/л;
- колба 5, содержащая раствор референтного вещества (например, анилина) в питательной среде с концентрацией 100 мг/л;
- колба 6, содержащая раствор чистой питательной среды.
Плохо растворимые вещества добавляют непосредственно в колбы по весу или по объему или руководствуются приложением Б, учитывая, что использование растворителей или эмульгаторов недопустимо. Абсорбент добавляют в специальных чашках в экспериментальные сосуды. Доводят, если это необходимо, рН растворов в колбах 2, 3 и 4 до 7 до внесения инокулята.
8.3 Процедура эксперимента
8.3.1 Вносят небольшой объем посевной культуры в колбы 2, 3 и 4 (тестовые растворы), 5 (контроль активности) и 6 (холостой контроль) для получения концентрации по сухому остатку 30 мг/л. Инокулят не добавляется в колбу 1, которая используется для абиотического контроля. Собирают оборудование, проверяют установку на герметичность, начинают перемешивание и измерение потребления кислорода в темноте. Проверяют температуру, мешалку и кулонометрический регистратор потребления кислорода и ежедневно фиксируют любые изменения цвета содержимого сосудов. Оценивают потребление кислорода непосредственно для 6 колб соответствующим методом, например, шестипозиционным рекордером, который записывает кривую БПК.
8.3.2 По окончании периода инкубации, обычно на 28 день, измеряют рН содержимого колб и определяют концентрацию остаточного исследуемого вещества и любых промежуточных соединений и, в случае исследования растворимых в воде веществ, концентрацию РОУ (приложение В). В случае исследования летучих веществ необходимо соблюдать специальные меры. Если происходит нитрификация, по возможности определяются концентрации нитратов и нитритов.
8.4 Данные и отчет о проведении эксперимента
8.4.1 Обработка результатов
8.4.1.1 Данные эксперимента должны быть приведены в прилагаемом отчете о проведении испытания (технических спецификациях).
8.4.1.2 Потребление кислорода (мг) делят на массу используемого исследуемого вещества (мг) после определенного периода времени с учетом значения потребления кислорода, полученного в контрольном эксперименте с посевной культурой, для того же периода времени. Это позволит оценить БПК, выраженное в мг кислорода на мг исследуемого вещества по следующей формуле:
![]() . (9)
. (9)
Значение биоразлагаемости в % получают из соотношения (10).
![]() . (10)
. (10)
8.4.1.3 Для смесей ТПК вычисляется на основании элементного анализа, как для одного вещества. Используйте соответствующее значение ТПК (ТПК или ТПК
) в зависимости от того, является ли нитрификация полной или отсутствует (приложение В). Если нитрификация происходит, но является неполной, необходимо сделать поправку на потребление кислорода при нитрификации, которое вычисляется на основе изменений концентраций нитритов и нитратов (приложение Г).
8.4.1.4 Основную биоразлагаемость в процентах от деградации основного вещества вычисляют, используя соотношение, приведенное в разделе 7.4. Если снижение концентрации тестируемого вещества наблюдается в колбе 1, используемой для измерения абиотического разложения, необходимо указать это в отчете о проведении испытания и использовать концентрацию исследуемого вещества в данной колбе после 28 дней для вычисления биоразлагаемости в процентах.
8.4.1.5 В случае, когда выполняются определения РОУ (дополнительно), необходимо вычислить окончательную биоразлагаемость в процентах в момент времени с использованием соотношения, приведенного в описании Метода А. Если убыток РОУ наблюдается в колбе 1, используемой для измерения абиотического разложения, используйте концентрацию РОУ в данной колбе на 28 день для расчета процента биодеградации.
8.4.2 Достоверность результатов
8.4.2.1 Потребление кислорода в холостом контроле обычно составляет от 20 до 30 мг /л и не должно превышать 60 мг
/л через 28 дней. Если наблюдаются значения выше 60 мг
/л, необходимо провести экспертизу данных и процедуры выполнения эксперимента. Если значение рН лежит вне диапазона от 6 до 8,5, и потребление кислорода исследуемым веществом составляет менее 60%, эксперимент необходимо повторить с меньшей концентрацией исследуемого вещества.
8.4.2.2 Эксперимент считается достоверным, если различие между крайними значениями величин деградации исследуемого вещества в дублирующих экспериментах в плато-фазе или в конце эксперимента соответственно менее 20%, и если разложение анилина в %, вычисленное из потребления кислорода, превышает 40% после 7 дней и 65% после 14 дней эксперимента. Если какое-либо условие из данных не выполняется, эксперимент необходимо провести повторно. Низкие значения не обязательно означают, что исследуемое вещество не подвергается биодеградации в природных условиях, но указывает на то, что для определения способности к биодеградации необходимо провести дополнительные исследования.
8.4.3 Отчет о проведении испытания
Отчет о проведении испытания должен включать информацию, указанную в разделе 5. Образец представления результатов исследований (технические спецификации) приведен в приложении Ж.
9 Метод D. Испытание в закрытом сосуде
9.1 Общие сведения и принцип метода
9.1.1 Общие сведения относительно оценки способности к биоразложению приведены в разделе 9.4. Необходимо ознакомиться с данным разделом до начала проведения испытания. При использовании Метода D должны быть известны химическая формула исследуемого вещества, его чистота или относительные пропорции основных компонентов, необходимые для вычисления ТПК. Если ТПК не может быть вычислено, необходимо определять ХПК, но, если исследуемое вещество не полностью окисляется в тесте на определение ХПК, могут быть получены ошибочно высокие значения биоразложения в процентах. Исследование нерастворимых и летучих веществ может проводиться при соблюдении специальных мер предосторожности. Значения биоразлагаемости для нерастворимых веществ могут быть ошибочно низкими в случае, если периодически не перемешивать содержимое колб во время периода инкубации.
9.1.2 В раствор исследуемого вещества в питательной среде, обычно концентрацией от 2 до 5 мг/л, вносится относительно небольшое количество микроорганизмов смешанной популяции. Колбы заполняют раствором полностью, плотно закрывают и содержат в темноте при постоянной температуре. В течение 28 дней эксперимента проводят постоянный анализ содержания растворенного кислорода. Количество кислорода, потребляемого популяцией микроорганизмов в процессе биологического разложения исследуемого вещества, с учетом потребления кислорода в контрольном эксперименте с посевной культурой, проводимом параллельно, выражается как процент ТПК или, что менее желательно, ХПК.
9.2 Описание метода
9.2.1 Оборудование
9.2.1.1 При проведении эксперимента используется стандартное лабораторное оборудование, а также:
a) колбы для измерения БПК, оснащенные стеклянными задвижками, например, объемом от 250 до 300 мл или от 100 до 125 мл.
Примечание - Важно, чтобы колбы были тщательно промыты перед использованием. Если для определения растворенного кислорода используется метод Винклера, достаточно несколько раз ополоснуть колбу водопроводной водой и затем деионизированной водой. Но в случае, если используется электродный метод, необходима более тщательная подготовка. В пустую колбу добавляют от 5 до 10 мл моющего раствора (например, 2,5 г йода и 12,5 г йодида калия на литр 1% масс./объемн. серной кислоты), тщательно перемешивают для того, чтобы полностью покрыть стенки колбы. Оставляют на 15 минут, выливают раствор и тщательно ополаскивают водопроводной, а затем деионизированной водой;
b) водяная баня или инкубатор для содержания колб при постоянной температуре ±1 °С или точнее с затемнением;
c) большие стеклянные колбы (объемом от 2 до 5 л) для подготовки среды и заполнения колб для определения БПК;
d) кислородный электрод и измеритель или оборудование и реактивы для титрования Винклера.
9.2.2 Вода
Характеристики воды, которая должна использоваться в эксперименте, приведены в разделе 8.4.
9.2.3 Основные растворы для минеральной среды
Подготовьте следующие основные растворы, реактивы, ч.д.а.:
a) | калия дигидроортофосфат, | 8,50 г |
дикалия гидрофосфат, | 21,75 г | |
динатрия гидроортофосфат, дигидрат, | 33,40 г | |
хлорид аммония, | 0,50 г |
Растворяют в воде и доводят до 1 литра. рН раствора должен составлять 7,4.
b) | кальция хлорид безводный, | 27,50 г |
или | ||
кальция хлорид дигидрат, | 36,40 г |
Растворяют в воде и доводят до 1 литра.
c) | магния сульфат гептагидрат, | 22,50 г |
Растворяют в воде и доводят до 1 литра.
d) | железа (III) хлорид, гексагидрат, | 0,25 г |
Растворяют в воде и доводят до 1 литра.
Примечание - Для того, чтобы избежать необходимости приготовления данного раствора, непосредственно перед использованием добавляют одну каплю концентрированной соляной кислоты или 0,4 г этилендиаминтетрауксусной кислоты (ЭДТА динатриевая соль) на 1 л приготовленного раствора.
Если в основных растворах образуется осадок, их необходимо заменить свежими растворами.
9.2.4 Приготовление минеральной питательной среды
Смешивают по 1 мл растворов а), b), с) и d) с 800 мл воды и затем доводят до 1 л.
9.2.5 Подготовка основных растворов исследуемого вещества
Если растворимость вещества превышает 1 г/л, растворяют от 1 до 10 г исследуемого или референтного вещества в воде и доводят до 1 литра. В ином случае готовят основные растворы в питательной среде или добавляют химическое вещество непосредственно к питательной среде, обеспечивая полное растворение вещества.
9.2.6 Инокулят
9.2.6.1 Инокулят может быть получен из воды из вторичных отстойников очистных сооружений или от лабораторной установки, преимущественно перерабатывающей бытовые сточные воды. Пробы собирают и обрабатывают, как это описано в 6.2.8.1. В обычном случае используют от одной капли (0,05 мл) к 5 мл фильтрата на литр среды. Для определения оптимального объема данных сточных вод может потребоваться проведение дополнительных испытаний.
9.2.6.2 В качестве альтернативного источника инокулята может использоваться вода природных водоемов. В данном случае отбирают пробу соответствующей поверхностной воды, например, из реки, озера, моря и выдерживают ее в аэробных условиях в течение необходимого времени. Как и в случае со сточными водами, оптимальный объем для использования в качестве посевной культуры может определяться на основании дополнительных испытаний.
9.2.7 Предварительная подготовка посевной культуры
При необходимости, может быть проведена предварительная подготовка посевной культуры путем аэрации воды из вторичных отстойников в течение 5-7 дней при температуре эксперимента, без использования дополнительных процедур или добавок.
9.2.8 Подготовка колб
9.2.8.1 Проводят активную аэрацию питательной среды в течение, как минимум, 20 мин и дают раствору отстояться. В общем случае, среда готова к использованию после отстаивания через 20 ч при температуре эксперимента. Проводят каждую серию испытаний с питательной средой, полученной из одной и той же партии. Определяют концентрацию растворенного кислорода для контроля. Концентрация должна составлять приблизительно 9 мг/л при 20 °С. Проводят все манипуляции для заполнения флаконов полностью, до самого верха, избегая появления пузырей, например, с помощью сифонов.
9.2.8.2 Готовят одновременно партии колб для БПК для определения исследуемого и референтного веществ в параллельных экспериментальных сериях. Одновременно готовят необходимое количество колб для БПК, включая содержащие посевную культуру, для проведения, по крайней мере, двух дублирующих измерений потребления кислорода в желаемых временных интервалах, например, после 0, 7, 14, 21 и 28 дней испытания. Для точного выявления 10-дневного интервала может потребоваться большее число колб.
9.2.8.3 Добавляют полностью аэрированную питательную среду в большие колбы так, чтобы они были заполнены приблизительно на 1/3. Затем добавляют достаточное количество растворов исследуемого и референтного веществ (или добавляют вещество другим способом, (см. приложение Б) для разбавления в большие колбы так, чтобы окончательная концентрация химических веществ не превышала 10 мг/л. К холостой пробе в следующей большой колбе не добавляют никакие химические вещества.
9.2.8.4 Для того, чтобы убедиться, что активность посевной культуры не снижена, концентрация растворенного кислорода в колбах БПК не должна быть ниже 0,5 мг/л. В общем случае, это соответствует концентрации исследуемого вещества (примерно 2 мг/л). Значение большей концентрации, которая может использоваться, может быть получено из ТПК исследуемого вещества (мг /мг химического вещества). Для веществ, плохо подвергающихся разложению, и веществ с низким значением ТПК может использоваться концентрация от 5 до 10 мг/л. В некоторых случаях было бы желательно провести параллельную серию экспериментов с исследуемым веществом при двух различных концентрациях, например, 2 и 5 мг/л. В обычном случае вычисляют ТПК на основе образования солей аммония, но, если известна или возможна нитрификация, поправки к изменениям концентрации нитритов и нитратов вычисляют на основе образования нитрата ТПК
(см. приложение В.2). Однако, если нитрификация не полная, но тем не менее происходит, внесите поправку в концентрацию нитритов и нитратов, определенных в ходе анализов (см. приложение Г).
9.2.8.5 Если должна быть определена токсичность исследуемого вещества (в случае, например, получения низких значений биоразлагаемости в предыдущих экспериментах), необходимо использовать другую серию колб. Готовят другую большую колбу для содержания аэрированной питательной среды (приблизительно 1/3 от объема колбы) плюс исследуемое и референтное вещество в окончательной концентрации, обычно такой же, как и в других колбах.
9.2.8.6 Добавляют в растворы в больших колбах сточные воды из вторичных отстойников (одна капля, или приблизительно 0,05 мл, до 5 мг/л, см. 9.2.6.1) или посевную культуру из другого источника, такого, как речная вода (см. 9.2.6.2). Затем доводят растворы до необходимого объема аэрированной питательной средой, используя шланг, достигающий основания колбы, для лучшего перемешивания.
9.2.8.7 Количество колб
При обычных условиях используются следующие колбы:
- по крайней мере 10 колб, содержащих исследуемое вещество и посевную культуру (экспериментальную суспензию);
- по крайней мере 10 колб, содержащих только посевную культуру (холостой опыт);
- по крайней мере 10 колб, содержащих стандартное вещество и посевную культуру (контроль активности), и, при необходимости,
- 6 колб, содержащих исследуемое вещество, референтное вещество и посевную культуру (контроль токсичности).
Для того, чтобы точно выявить 10-дневный интервал, необходимо примерно вдвое больше колб.
9.3 Процедура эксперимента
9.3.1 Каждый приготовленный раствор или суспензию немедленно распределяют по соответствующим группам колб БПК с помощью шланга с небольшим переливом. Раствор забирают из самой низкой четверти (не основания) соответствующей большой колбы так, чтобы все колбы БПК были полностью заполнены. При тестировании плохо растворимых веществ, добавленных в соответствии с методами, описанными в приложении Б, необходимо убедиться, что содержимое больших колб хорошо перемешано. Легко постукивают по колбе для удаления воздушных пузырьков. Важно, чтобы во флаконах под пробкой не оставалось воздушных пузырьков.
9.3.2 Колбы с нулевой экспозицией необходимо немедленно проанализировать на содержание растворенного кислорода электродным методом или методом Винклера. Содержимое колб может быть сохранено для последующего анализа методом Винклера путем добавления сульфата марганца (II) и гидроксида натрия (первый реагент Винклера). Тщательно закупоренные колбы, содержащие кислород в форме коричневого гидрата оксида марганца (III), выдерживают в темноте при температуре от 10 °С до 20 °С не более чем в течение 24 часов до начала осуществления оставшихся этапов метода Винклера. Оставшиеся дублирующие колбы закупоривают, проверяя, чтобы не осталось воздушных пузырей, и выдерживают при 20 °С в темноте.
9.3.3 Каждая серия определений должна сопровождаться полной параллельной серией определений в контрольных экспериментах. Выбирают, по крайней мере, повторяющиеся колбы из всех серий для анализа растворенного кислорода в интервалах времени (как минимум, еженедельно) в течение 28 дней инкубации. Еженедельные пробы должны обеспечивать оценку процента удаления в 14-дневном интервале, тогда как отбор проб каждые 3-4 дня должен обеспечивать идентификацию 10-дневного интервала, для чего потребуется вдвое больше колб.
9.3.4 Для азотсодержащих веществ должны быть сделаны поправки на потребление кислорода при нитрификации. Для этого используют метод с кислородными электродами для определения концентрации растворенного кислорода, затем отбирают пробу из колбы БПК для анализа на содержание нитритов и нитратов. В зависимости от возрастания концентрации нитритов и нитратов, вычисляют количество потребляемого кислорода (см. приложение В).
9.4 Данные и отчет о проведении эксперимента
9.4.1 Обработка результатов
9.4.1.1 Данные эксперимента должны быть приведены в прилагаемом отчете (технические спецификации).
9.4.1.2 Сначала вычисляют БПК, полученное после каждого периода времени, вычитая уменьшение содержания кислорода (мг /л) в контрольном эксперименте с посевной культурой от значения, полученного при исследовании вещества. Делят данное скорректированное значение уменьшения содержания кислорода на концентрацию (мг/л) исследуемого вещества, чтобы получить БПК, определяемое, как содержание кислорода в мг на мг исследуемого вещества. Вычисляют значение биоразложения в процентах путем деления полученного показателя БПК на показатель ТПК (вычисленный в В.2) или ХПК, определенный при анализе (в соответствии с В.3).
![]() (8)
(8)
или
![]() ; (9)
; (9)
![]() . (10)
. (10)
Следует отметить, что два данных метода не обязательно дают одни и те же значения; желательно использовать прежний метод.
9.4.1.3 Для исследуемых веществ, содержащих азот, используют соответствующее ТПК ( или
) в зависимости от того, известна ли или ожидается нитрификация (см. В.2). Если нитрификация происходит, но не является полной, вычислите поправку для потребления кислорода при нитрификации, в зависимости от изменения концентрации нитритов и нитратов в течение 28-дневного эксперимента (приложение Г).
9.4.2 Достоверность результатов
9.4.2.1 Содержание кислорода в контрольном эксперименте с посевной культурой не должно превышать 1,5 мг растворенного кислорода на 1 л после 28 дней эксперимента. Значения превышающие данный уровень, говорят о необходимости пересмотра экспериментальной процедуры. Остаточная концентрация кислорода в экспериментальных колбах при любых условиях не должна быть ниже 0,5 мг/л. Такие низкие значения содержания кислорода являются приемлемыми, только если используемый метод определения растворенного кислорода позволяет проводить точное измерение таких величин.
9.4.2.2 Также могут использоваться прочие критерии достоверности, приведенные в разделе 8.4.
9.4.3 Отчет о проведении испытания
Отчет о проведении испытания должен содержать информацию, описанную в разделе 8.4. Образец представления результатов приведен в приложении И.
10 Метод Е. Модифицированный тест ОЭСР
10.1 Общие сведения и принцип метода
10.1.1 Общие сведения относительно оценки способности к биоразложению приведены в разделе 9.2.1, необходимо ознакомиться с данным разделом до начала проведения испытания. Метод Е может использоваться для нелетучих веществ, имеющих растворимость в воде как минимум 100 мг/л. Также должно быть известно содержание углерода и, желательно, чистота или относительное содержание основных компонентов. Данный метод идентичен методу А, но применим при низких концентрациях микроорганизмов.
10.1.2 В измеренный объем минеральной среды, содержащей известную концентрацию исследуемого вещества (от 10 до 40 мг РОУ/л) в качестве единственного номинального источника органического углерода, вводится 0,5 мл сточных вод на 1 л питательной среды. Затем производится аэрация смеси в темноте или рассеянном свете при температуре (22±2) °С. Процесс биологического разложения сопровождается анализом РОУ через короткие интервалы в течение 28-дневного периода. Степень биологического разложения вычисляется путем представления концентрации удаленного РОУ (исправленного с учетом контрольного эксперимента с посевной культурой) в виде процента от первоначальной концентрации.
10.2 Описание метода
10.2.1 Оборудование
10.2.1.1 При проведении эксперимента используется стандартное лабораторное оборудование, а также:
a) конические колбы, например, объемом от 250 мл до 2 л, в зависимости от объема, необходимого для анализа РОУ (колбы необходимо тщательно промыть, например, спиртовым раствором соляной кислоты, прополоскать и высушить перед каждым экспериментом);
b) аппарат для встряхивания, шейкер - для размещения конических колб с автоматическим контролем температуры или с возможностью использования при постоянной комнатной температуре и достаточной мощности для поддержания аэробных условий во всех колбах;
c) аппарат для фильтрации с подходящими мембранами;
d) анализатор РОУ;
e) прибор для определения растворенного кислорода, использующийся для проверки того, что колба содержится в аэробных условиях;
f) центрифуга.
10.2.1.2 Вода
Характеристики воды, которая должна использоваться в эксперименте, приведены в разделе 4.
10.2.1.3 Основные растворы для питательной среды
Необходимо подготовить основные растворы для питательной среды, как описано в 6.2.3 метода А.
10.2.1.4 Подготовка питательной среды
Необходимо подготовить питательную среду так, как описано в 6.2.4. В методе Е в качестве прививочного материала используется только 0,5 мл сточной воды на 1 л, поэтому в питательную среду, возможно, необходимо ввести микроэлементы и факторы роста. Это производится путем добавления 1 мл каждого из следующих растворов на 1 л готовой среды:
a) | Растворы микроэлементов | |
Марганца сульфат, тетрагидрат, | 39,9 мг | |
Борная кислота, | 57,2 мг | |
Цинка сульфат гептагидрат, | 42,8 мг | |
Аммония гептамолибдат, | 34,7 мг | |
Fe-хелат ( | 100,0 мг | |
Растворяют и доводят объем до 1 л. | ||
b) | Растворы витаминов | |
Дрожжевой экстракт | 15,0 мг |
Растворяют дрожжевой экстракт в 100 мл воды. Стерилизуют путем пропускания через 0,2 мкм мембрану или готовят заново.
10.2.1.5 Приготовление раствора тестируемых веществ
Необходимо подготовить основные растворы для питательной среды, как описано в 6.2.5.
10.2.1.6 Инокулят
Посевную культуру получают из сточных вод вторичных отстойников очистных сооружений или лабораторной установки, преимущественно перерабатывающей бытовые сточные воды, и готовят, как описано в 6.2.8.1 метода А. Используют 0,5 мл фильтрата на литр питательной среды.
10.2.1.7 Предварительная обработка инокулята
Если необходимо, инокулят может быть предварительно обработан, как описано в 6.2.9.
10.2.1.8 Подготовка колб
В качестве образца:
порции питательной среды объемом 800 мл вводят в двухлитровые конические колбы и добавляют достаточные объемы основных растворов исследуемого и референтного веществ в разные колбы, чтобы довести концентрацию химического эквивалента от 10 до 40 мг РОУ/л. Проверяют и доводят значение рН до 7,4, при необходимости. В колбы вводят посевную культуру (сточные воды) по 0,5 мл/л среды. Так же готовят контрольные колбы с раствором посевной культуры в питательной среде, но без добавления исследуемого или референтного веществ.
Контроль токсичности, абиотический и адсорбционный контроль также могут быть проведены при необходимости в соответствии с процедурами, как описано в 6.2.10.2-6.2.10.4.
Доводят объемы во всех колбах до 1 литра раствором питательной среды и после перемешивания отбирают образец из каждой колбы для определения начальной концентрации РОУ в двух повторностях (см. приложение В.4). Закрывают отверстия колб, например, алюминиевой фольгой, таким образом, чтобы обеспечивался свободный воздухообмен между колбой и окружающей атмосферой. Затем помещают сосуды в аппарат для перемешивания для начала эксперимента.
10.2.1.9 Количество колб
При обычных условиях используется такое же количество колб как в методе А:
- колбы 1 и 2, содержащие исследуемое вещество и посевную культуру (экспериментальная суспензия);
- колбы 3 и 4, содержащие только посевную культуру (холостой опыт);
- колба 5, содержащая референтное вещество и посевную культуру (контроль активности); и, предпочтительно и при необходимости,
а также по необходимости:
- колба 6, содержащая исследуемое вещество и стерилизующий агент (абиотический стерильный контрольный эксперимент);
- колба 7, содержащая исследуемое вещество, посевную культуру и стерилизующий агент (контроль адсорбции);
- колба 8, содержащая исследуемое вещество, стандартное вещество и посевную культуру (контроль токсичности).
10.3 Процедура эксперимента
10.3.1 Определение РОУ
Необходимо определить РОУ как описано в 6.3.1.
10.3.2 Отбор проб
Необходимо отобрать пробы как описано в 6.3.2.
10.3.3 Частота отбора проб
Необходимо отобрать пробы с такой частотой, как описано в 6.3.3.
10.4 Данные и отчет о проведении эксперимента
10.4.1 Обработка результатов
10.4.1.1 Данные эксперимента должны быть приведены в прилагаемом отчете (техническая спецификация).
10.4.1.2 Вычисляют биоразлагаемость в процентах для каждого момента времени, когда проводился анализ пробы, используя формулу (2).
10.4.1.3 Представляют процесс деградации графически и указывают 10-дневный интервал. Вычисляют и приводят в отчете величину удаления в процентах, которая была достигнута в плато-фазе, в конце эксперимента и/или в конце 10-дневного интервала, по необходимости.
10.4.1.4 Если известны определенные химические аналитические данные, вычисляют основную биоразлагаемость в процентах с использованием формул (9), (10).
10.4.2 Достоверность результатов
Эксперимент считают достоверным, если выполняются критерии, приведенные в разделе 10.4.
10.4.3 Отчет о проведении испытания
Отчет о проведении испытания должен содержать информацию, приведенную в разделе 9.4. Образец представления результатов приведен в приложении К.
11 Метод F. Манометрический метод определения БПК
11.1 Общие сведения и принцип метода
11.1.1 Общие сведения относительно оценки способности к биоразложению приведены в разделе 10.4, необходимо ознакомиться с данным разделом до начала проведения испытания. При использовании метода Е* должны быть известны химическая формула исследуемого вещества, его чистота или относительное содержание основных компонентов, необходимое для вычисления ТПК. Если ТПК не может быть вычислено, должно быть определено РОУ, однако, если исследуемое вещество не подвергается полному окислению в эксперименте на определение РОУ, могут быть получены ошибочно высокие значения биоразлагаемости. Исследование нерастворимых и летучих веществ может быть осуществлено при условии проведения предварительной подготовки.
_______________
* Текст документа соответствует оригиналу. - .
11.1.2 Измеренный объем инокулированной питательной среды, содержащий известную концентрацию исследуемого вещества (100 мг исследуемого вещества на 1 л дает минимальное значение от 50 до 100 мг ТПК/л) в качестве единственного номинального источника органического углерода, перемешивается в закрытой колбе при постоянной температуре (±1 °С или менее) в течение 28 дней. Потребление кислорода определяется либо измерением количества кислорода (произведенного электролитическим путем), требующегося для поддержания постоянного объема газа в респирометрической колбе, или по изменению объема или давления (или комбинация этих двух показателей) в аппарате. Выделенный углекислый газ поглощается раствором гидроксида калия или другого подходящего абсорбента. Количество кислорода, потребляемого популяцией микроорганизмов во время биодеградации исследуемого вещества (с учетом потребления кислорода в контрольном эксперименте с посевной культурой, проводящемся параллельно) выражают как процент ТПК или, что менее приемлемо, РОУ. По выбору, основная биоразлагаемость также может быть вычислена из дополнительного специального химического анализа, проведенного в начале и в конце инкубации, и окончательная биоразлагаемость может быть вычислена с помощью анализа РОУ.
11.2 Описание метода
11.2.1 Оборудование
11.2.1.1 При проведении эксперимента используется стандартное лабораторное оборудование, а также:
a) Респирометр;
b) Температурный контроль, поддерживающий температуру ±10 °С;
c) Аппарат для мембранной фильтрации (дополнительно);
d) Анализатор углерода (дополнительно).
11.2.2 Вода
Характеристики воды, которая должна использоваться в эксперименте, приведены в разделе 4.
11.2.3 Основные растворы для питательной среды
Необходимо подготовить основные растворы для питательной среды как описано в 6.2.3.
11.2.4 Подготовка питательной среды
Необходимо подготовить питательную среду как описано в 6.2.4 метода А.
11.2.5 Приготовление раствора тестируемых веществ
Подготовьте растворы таким же образом, как описано в 6.2.5. Для подготовки растворов слабо растворимых веществ см. приложение В.
11.2.6 Инокулят
Инокулят может быть получен из множества источников: активного ила, сточных вод, поверхностных вод и почв или из смеси данных источников, как описано в методе А.
11.2.7 Предварительная подготовка инокулята
Инокулят может быть предварительно подготовлен к экспериментальным условиям, как описано в 6.2.9.
11.2.8 Подготовка колб
11.2.8.1 Готовят растворы экспериментальных и референтных веществ в отдельных партиях, в питательной среде со средней эквивалентной концентрацией, обычно 100 мг вещества на 1 л (от 50 до 100 мг ТПК/л) с использованием основных растворов. Вычисляют ТПК на основании образования солей аммония, если отсутствует нитрификация, в противном случае расчет должен основываться на формировании нитрата (в соответствии с В.2). Определяют значения рН и в случае необходимости доводят до 7,4±0,2. Плохо растворимые вещества необходимо добавлять на более поздней стадии эксперимента.
11.2.8.2 Если необходимо определить токсичность исследуемого вещества, готовят раствор в питательной среде, содержащий как экспериментальное, так и референтное вещества в тех же концентрациях, как в индивидуальных растворах.
11.2.8.3 Если требуется проводить измерения абиотической деградации, готовят раствор исследуемого вещества с содержанием 100 мг ТПК/л, который был стерилизован добавлением токсичного вещества в соответствующей концентрации.
11.2.8.4 Добавляют необходимые объемы растворов исследуемого и референтного веществ, как минимум, дублирующие респирометрические колбы. В следующую колбу добавляют только питательную среду (контроль активности культуры) и, при необходимости, смешанный раствор экспериментального/референтного вещества и стерильного раствора. Если исследуемое вещество является плохорастворимым, добавляют его непосредственно на данном этапе по весу или объему или обрабатывают его так же, как описано в приложении Б. Добавляют гидроксид калия, шарики натронной извести или другого абсорбента в отделения поглотителя .
11.2.8.5 Количество колб
В общем случае используется то же самое число колб, как и в методе А:
- колбы 1 и 2, содержащие исследуемое вещество и посевную культуру (экспериментальная суспензия);
- колбы 3 и 4, содержащие только посевную культуру (холостой эксперимент);
- колба 5, содержащая референтное вещество и посевную культуру (контроль активности культуры);
и, при необходимости, также:
- колба 6, содержащая исследуемое вещество и стерилизующий агент (абиотический стерильный контрольный эксперимент);
- колба 7, содержащая исследуемое вещество, референтное вещество и посевную культуру (контроль токсичности).
11.3 Процедура эксперимента
11.3.1 Доводят колбы до желаемой температуры и вводят в соответствующие колбы подготовленный активный ил или другой источник посевной культуры, чтобы концентрация ила по сухому остатку составляла не более 30 мг/л. Собирают оборудование, запускают мешалку, проверяют оборудование на герметичность и начинают измерение потребления кислорода. Как правило, требуется только снимать необходимые показания и проводить ежедневные проверки поддержания необходимой температуры и соответствующего перемешивания.
11.3.2 При использовании автоматического респирометра проводится непрерывное измерение потребления кислорода, таким образом 10-дневный интервал может быть легко определен. Для неавтоматического респирометра будут приемлемыми ежедневные измерения.
11.3.3 Вычисляют потребление кислорода по результатам измерений, проводимых в регулярные и постоянные интервалы времени, используя методы, представленные изготовителем оборудования. По окончании периода инкубации, составляющего, как правило, 28 дней, измеряют рН содержимого колб, особенно если значение потребления кислорода ниже или выше ТПК , для
-содержащих химических веществ.
11.3.4 При необходимости, отбирают пробы из респирометрических колб в начале и конце эксперимента для анализа РОУ и/или аналитического определения химического вещества (в соответствии с В.4). При первоначальном отборе убеждаются, что объем экспериментальной суспензии, остающейся в колбе, известен. Если кислород поглощается -содержащим исследуемым веществом, определяют увеличение концентрации нитритов и нитратов за 28 дней и вычисляют количество кислорода, потребляемого в результате нитрификации (приложение Г).
11.4 Данные и отчет о проведении испытания
11.4.1 Обработка результатов
11.4.1.1 Данные о проведении эксперимента должны содержаться в прилагаемом отчете.
11.4.1.2 Сначала вычисляют БПК (мг /мг исследуемого вещества) для каждого периода времени путем деления потребления кислорода (мг) исследуемым веществом, скорректированного с учетом данных контрольного эксперимента с посевной культурой, на массу исследуемого вещества:
![]() . (11)
. (11)
Вычисляют биоразлагаемость согласно уравнениям (9), (10).
11.4.1.3 Когда дополнительные определения специфического химического вещества и/или РОУ проведены, вычисляют биоразлагаемость в процентах по формулам (2), (3), (11).
11.4.2 Достоверность результатов
11.4.2.1 Потребление кислорода в контрольном эксперименте с посевной культурой обычно составляет от 20 до 30 мг /л и не должно превышать 60 мг/л через 28 дней. Для величин, превышающих 60 мг/л, требуется экспертиза данных и экспериментальной процедуры. Если величины рН находятся вне диапазона от 6 до 8,5 и потребление кислорода исследуемым веществом составляет менее 60%, эксперимент необходимо провести повторно с меньшей концентрацией исследуемого вещества.
11.4.2.2 Также могут использоваться критерии достоверности, представленные в разделе 10.4.
11.4.3 Отчет о проведении испытания
Отчет о проведении испытания должен содержать информацию, описанную в разделе 10.4. Образец представления результатов представлен в приложении Л.
Приложение А
(обязательное)
Оценка способности к биоразложению химических веществ, обладающих вероятной токсичностью для инокулята
Если химическое вещество, прошедшее исследования на способность к биоразложению, оказывается неспособным к биоразложению, для определения отличия между ингибированием и инертностью рекомендуется проведение настоящей процедуры.
А.1 Такая же или идентичная посевная культура используется в экспериментах на биоразлагаемость и токсичность.
А.2 Для оценки токсичности химических веществ, исследуемых на способность к биоразложению, подходящим является использование одного или комбинации методов ингибирования скорости дыхания активного ила согласно [10], [11], БПК и/или ингибирования роста.
А.3 Если ингибирования за счет токсичности необходимо избежать, концентрации исследуемого вещества, используемые в исследовании на биоразлагаемость, не должны превышать 1/10 величин (или менее величин
), полученных в исследовании на токсичность. Для веществ с величиной
, превышающей 300 мг/л, вероятность того, что они будут оказывать токсичное воздействие в исследованиях на биоразложение, мала.
А.4 Величины менее 20 мг/л, вероятно, будут представлять серьезные проблемы для последующих исследований. Необходимо исследовать низкие концентрации вещества, обеспечивая использование метода D или использования
-меченого материала. В ином случае, для посевной культуры, ранее подвергавшейся действию исследуемого вещества, возможно использование более высоких концентраций исследуемого вещества. В последнем случае теряется специфический критерий способности вещества к биоразложению.
Приложение Б
(обязательное)
Определение способности к биодеградации плохо растворимых веществ
В экспериментах на определение способности к биодеградации с плохо растворимыми веществами особое внимание необходимо уделять также нижеследующим аспектам.
Б.1 Поскольку гомогенные жидкости редко представляют сложности при отборе проб, рекомендуется твердые материалы гомогенизировать любым применимым способом, чтобы избежать ошибок из-за неоднородности. Особую осторожность необходимо проявлять в случае, когда из смеси химических веществ с большим количеством примесей необходимо отобрать пробы объемом несколько мг.
Б.2 В течение эксперимента могут использоваться различные способы перемешивания. Следует отметить, что перемешивание должно быть достаточным для поддержания дисперсности вещества, но не приводить к избыточному нагреванию или пенообразованию.
Б.3 Допустимо использование эмульгатора, который способствует образованию стабильной дисперсии исследуемого вещества. Эмульгатор не должен быть токсичным для микроорганизмов, не должен подвергаться биоразложению или вызывать пенообразование во время эксперимента.
Б.4 Для растворителей применяются те же критерии, что и для эмульгаторов.
Б.5 Не рекомендуется использовать твердые контейнеры для твердых тестируемых веществ, но они могут использоваться для маслянистых веществ.
Б.6 В случае использования вспомогательных веществ, таких как эмульгаторы, растворители и носители, необходимо проводить контрольный эксперимент на биоразложение вспомогательного вещества.
Б.7 Любой из данных респирометрических методов определения БПК может использоваться для определения способности к биоразложению плохо растворимых веществ.
Приложение В
(обязательное)
Вычисление и определение соответствующих итоговых параметров
В зависимости от выбранного метода требуется вычислять определенные итоговые параметры. Использование данных параметров описано в соответствующих разделах для каждого метода.
В.1 Содержание углерода
Содержание углерода вычисляется из известного элементного состава или определяется элементным анализом исследуемого вещества.
В.2 Теоретическое потребление кислорода (ТПК)
Теоретическое потребление кислорода (ТПК) может быть вычислено, если элементный состав известен или его можно определить.
Для вещества ![]() ТПК без нитрификации будет составлять:
ТПК без нитрификации будет составлять:
![]() ; (В.1)*
; (В.1)*
_______________
* Формула соответствует оригиналу. - .
с нитрификацией:
![]() , (В.2)
, (В.2)
где - молекулярная масса.
В.3 Химическое потребление кислорода (ХПК)
Химическое потребление кислорода (ХПК) для растворимых в воде органических веществ определяется согласно установленным процедурам, например, по ISO 6060.
Химическое потребление кислорода (ХПК) часто, особенно в случае плохо растворимых веществ, определяется, главным образом, в соответствии с приведенным выше аналитическим методом, то есть в закрытой системе с уравнителем давления. В данной модификации вещества, которые с трудом определяются стандартным методом (например, уксусная кислота), могут подвергаться успешному количественному определению. Метод также может не работать, например, в случае с пиридином. Если концентрация бихромата калия увеличивается от 0,016 Н (0,0026 М), до 0,25 Н (0,0416 М), прямое взвешивание 5-10 мг вещества облегчается, что является существенным для определения ХПК плохо растворимых в воде веществ.
В.4 Растворенный органический углерод (РОУ)
Растворенный органический углерод (РОУ) - органический углерод любого химического вещества или смеси, проходящий в воде через 0,45 мкм фильтр.
Пробы отбираются из экспериментальных сосудов и немедленно фильтруются в аппарате для фильтрации с использованием соответствующего мембранного фильтра. Первые 20 мл (количество может быть уменьшено, если используются маленькие фильтры) фильтрата удаляются. Объемы от 10 до 20 мл или меньшие, если отбираются (объем в зависимости от количества, необходимого для анализатора углерода), сохраняются для проведения анализа углерода. Концентрация РОУ определяется с помощью анализатора органического углерода, который может проводить точное измерение эквивалентной концентрации углерода, равной или ниже 10% начальной концентрации РОУ, используемой в эксперименте.
Отфильтрованные пробы, анализ которых невозможно провести в тот же рабочий день, могут быть сохранены в холодильнике при температуре ниже 4 °С. Пробы могут сохраняться в течение 48 часов до проведения анализа или дольше при температуре минус 18 °С.
Примечание - Мембранные фильтры часто пропитываются поверхностно-активными веществами для обеспечения гидрофилизации. Таким образом, фильтр может содержать до нескольких мг растворенного органического углерода, который будет оказывать влияние на определение способности к биоразложению. ПАВ и другие растворимые органические соединения удаляются из фильтров путем кипячения в деионизированной воде в течение трех периодов, каждый по одному часу. Затем фильтры могут храниться в воде в течение одной недели. Если используются одноразовые картриджи для фильтра, каждая партия должна быть проверена для подтверждения того, что фильтр не является источником растворимого органического углерода.
В зависимости от типа мембранного фильтра исследуемое вещество может удерживаться за счет адсорбции. Таким образом, может быть необходимо удостовериться, что химическое вещество не удерживается фильтром.
Центрифугирование при 4000 [Ускорение свободного падения. Стандартное ("нормальное") значение, принятое при построении систем единиц, составляет
9,80665 м/с
] (около 40,000* м·сек
) в течение 15 минут может использоваться для дифференцирования ТОУ против РОУ вместо фильтрации. Метод не является надежным при начальных концентрациях менее 10 мг РОУ/л, поскольку либо не все микроорганизмы удаляются, либо углерод как часть бактериальной плазмы не растворен.
_______________
* Текст документа соответствует оригиналу. - .
Приложение Г
(обязательное)
Корректировка потребления кислорода с учетом нитрификации
На результаты респирометрических методов определения БПК с определением потребления кислорода в качестве аналитической процедуры значительное влияние может оказывать поглощение кислорода, появляющееся за счет процесса окисления аммония.
Если при оценке потребления кислорода при биодеградации веществом, не содержащим азот, нитрификация не учитывается, возникающие ошибки не являются существенными (не более 5%), даже если окисление аммонийного азота в среде происходит неравномерно между экспериментальными сосудами и холостым тестом. Однако, для веществ, содержащих азот, в результатах могут возникнуть серьезные ошибки, если наблюдаемое потребление кислорода не скорректировано с учетом кислорода, потребляемого при окислении аммонийного азота до нитрита и нитрата. В случае полной нитрификации, или преобразования аммония до нитрата, применяется следующее уравнение:
![]() . (Г.1)
. (Г.1)
Количество кислорода, требуемое для 14 г азота, составляет 64 г, и, таким образом, кислород, потребляемый при образовании нитрата, составляет 4,57, умноженное на концентрацию нитрата. Если происходит полная нитрификация, следует использовать следующее уравнение:
![]() ;
;
(Г.2)
![]() .
.
Кислород, поглощенный 14 г азота, будет окислен до 48 г нитрита, то есть фактор составляет 3,43.
Поскольку реакции являются последовательными, так как выполняются особенными видами микроорганизмов, концентрация нитритов может увеличиваться или уменьшаться, в последнем случае будет формироваться эквивалентная концентрация нитрата. Таким образом, количество кислорода, потребляемого при формировании нитрата, равно увеличению концентрации нитрата в 4,57, тогда как количество кислорода, связанного с формированием нитрита, увеличивает концентрации нитрита в 3,43 или, с уменьшением его концентрации, потребление кислорода составляет 3,43, умноженное на уменьшение концентрации.
В альтернативном случае, если определен только "общий окисленный азот", потребление кислорода за счет нитрификации может быть принято как 4,57, умноженное на увеличение окисленного азота.
Скорректированная величина потребления кислорода за счет окисления углерода сравнивается с ТПК, как указано в приложении Б.
Приложение Д
(рекомендуемое)
Технические спецификации для метода А. Определение поглощения растворенного органического углерода
Д.1 Лаборатория
Д.2 Дата начала тестирования
Д.3 Тестируемое вещество:
а) наименование;
b) концентрация основного раствора, мг/л;
c) первоначальная концентрация в среде, , мг/л;
d) объем колбы для тестирования (), мл;
е) ТПК или ХПК, мг /мг тестируемого вещества (
,
).
Д.4 Инокулят:
a) источник;
b) проведенная обработка;
c) предварительная обработка (если проводилась);
d) концентрация взвешенных веществ в реакционной массе, мг/л.
Д.5 Определение углерода
Таблица Д.1 - Анализатор углерода:
| РОУ после | ||||||
N колбы | 0 | ||||||
Тестируемое вещество + инокулят | 1 | ||||||
значение | |||||||
2 | |||||||
значение | |||||||
Холостая проба, инокулят без тестируемого вещества | 3 | ||||||
значение | |||||||
4 | |||||||
значение | |||||||
значение | |||||||
Д.6 Оценка исходной информации
Таблица Д.2
Номер колбы | Расчет результатов | % деградации после | ||||
1 |
| 0 | ||||
2 |
| 0 | ||||
Значение* |
| 0 | ||||
* Примечание - Подобные форматы могут быть использованы для референтных веществ и контроля токсичности. | ||||||
Д 7. Абиотическая деградация (необязательно)
Таблица Д.3
Время, дни | ||
0 | ||
Концентрация РОУ в стерильной контрольной пробе, мг/л | ||
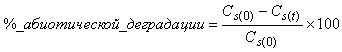 . (Д.1)
. (Д.1)
Д.8. Специфический химический анализ (рекомендуется)
Таблица Д.4
Остаточное количество тестируемых веществ на конец эксперимента | % начального разложения | |
Стерильный контроль | - | |
Инокулируемая тестируемая среда |
|
Приложение Е
(рекомендуемое)
Технические спецификации для метода В. Определение выделения диоксида углерода ()
Е.1 Лаборатория
Е.2 Дата начала тестирования
Е.3 Тестируемое вещество:
a) Наименование:
b) Концентрация основного раствора, мг/л:
c) Первоначальная концентрация в среде, , мг/л:
d) Общее количество углерода, добавленного в колбу , мг :
e) , мг
:
Е.4 Инокулят:
a) Источник:
b) Проведенная обработка:
c) Предварительная обработка (если проводилась):
d) Концентрация взвешенных веществ в реакционной массе, мг/л:
Е.5 Выработка и разложение
Таблица 5* - Метод: ![]() другой.
другой.
_______________
* Нумерация соответствует оригиналу. - .
Время, дни | Выделение | Общее производство | Значение | |||||||
Тестируемое вещество | Холостая проба | |||||||||
Колба 1 | Колба 2 | Колба 3 | Колба 4 | Значение | Колба 1 | Колба 2 | Колба 1 | Колба 2 | Значение* | |
0 | ||||||||||
. . . | ||||||||||
28 | ||||||||||
* Не учитывать, если наблюдается большая разница в значениях между повторностями. Примечание - Подобные форматы могут быть использованы для референтных веществ и контроля токсичности. | ||||||||||
Е.6 Анализ углерода (необязательно)
Таблица 6 - Анализатор углерода
Время, день | Тестируемое вещество, мг/л | Холостая проба, мг/л |
0 |
| |
28 |
| |
| ||
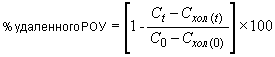 . (E1)
. (E1)
Е.7 Абиотическая деградация (рекомендуется)
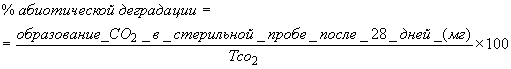 . (Е2)
. (Е2)
Приложение Ж
(рекомендуемое)
Технические спецификации для метода С. Модифицированный тест MITI (I)
Ж.1 Лаборатория
Ж.2 Дата начала тестирования
Ж.3 Тестируемое вещество:
a) Наименование:
b) Концентрация основного раствора, мг/л:
c) Первоначальная концентрация в среде, , мг/л:
d) Объем реакционной смеси (), мл:
е) ТПК, мг /л:
Ж.4 Инокулят:
a) Источники забора ила:
1. | 6. |
2. | 7. |
3. | 8. |
4. | 9. |
5. | 10. |
b) Концентрация взвешенных веществ в активном иле после акклиматизации с искусственным илом, мг/л;
c) Объем добавленного ила/литр питательной среды, мл;
d) Концентрация ила в итоговой среде, мг/л;
e) Предварительная обработка (если проводилась);
f) Концентрация взвешенных веществ в реакционной массе, мг/л.
Ж.5 Потребление кислорода: способность к разложению микроорганизмами
Таблица Ж.1 - Тип используемого респирометра
Время, день | ||||
Потребление | ||||
Потребление | ||||
Поправка на потребление | ||||
БПК(мг | ||||
| ||||
| ||||
| ||||
% деградации БПК/ТПК*100 | ||||
1 | ||||
2 | ||||
3 | ||||
Значение* | ||||
* Не учитывать, если наблюдается большое расхождение в значениях между повторностями. | ||||
Ж.6 Анализ углерода (необязательно)
Таблица Ж.2 - Анализатор углерода
Колба | Значение РОУ | % удаленного РОУ | Значение | |||
Измеренное | С поправками | |||||
Вода + тестируемое вещество | - | - | ||||
Ил + тестируемое вещество | | |||||
Ил + тестируемое вещество | ||||||
Ил + тестируемое вещество | ||||||
Контрольная холостая проба | - | - | - | |||
![]() . (Ж.1)
. (Ж.1)
Ж.7 Специфический химический анализ
Таблица Ж.3
Остаточное количество тестируемого вещества в конце теста | % первичной | |
Холостая проба с водой | ||
Инокулированная среда | ||
![]() . (Ж.2)
. (Ж.2)
Расчет производится для колб ,
,
соответственно.
Примечание - Следует приложить кривую расчета зависимости ХПК от времени, если она имеется.
Приложение И
(рекомендуемое)
Технические спецификации для метода Г. Испытание в закрытом сосуде
И.1 Лаборатория
И.2 Дата начала тестирования
И.3 Тестируемое вещество:
a) Наименование:
b) Концентрация основного раствора, мг/л:
c) Первоначальная концентрация в среде, мг/мг тестируемого вещества:
d) ТПК или ХПК, мг /л:
И.4 Инокулят:
a) Источники забора ила:
b) Предварительная обработка (если проводилась):
c) Концентрация взвешенных веществ в реакционной массе, мл/л:
И.5 Проведение испытания:
Таблица И.1 - Метод: Винклер/электрод
N Колбы | мг | |||||
Холостая проба - с инокулятом, но без тестируемого вещества | 1 |
| ||||
2 | ||||||
Значение пробы |
| |||||
Тестируемое вещество с инокулятом | 1 | |||||
2 | ||||||
Примечание - Подобные форматы могут быть использованы для референтных веществ и контроля токсичности. | ||||||
И.6 Поправка на нитрификацию (см. приложение Г)
Таблица И.2
Время инкубации, дни | ||||||
0 | ||||||
(i) | Концентрация нитратов (мг | |||||
(ii) | Изменения концентрации нитратов (мг | - | ||||
(iii) | Кислородный эквивалент (мг/л) | - | ||||
(iv) | Концентрация нитритов (мг | |||||
(v) | Изменения концентрации нитратов (мг/л) | - | ||||
(vi) | Кислородный эквивалент (мг/л) | - | ||||
(iii+vi) | Общий кислородный эквивалент | - | ||||
И.7 Истощение РК
Таблица И.3 - % деградации (% D)
Истощение РК после | ||||
| ||||
| ||||
| ||||
| ||||
| ||||
* Принимается, что | ||||
И.8 Холостая проба определения РК
Кислородное потребление холостой пробой: ![]() мг/л. Это потребление важно для валидации результатов испытания и должно составлять не менее 1,5 мг/л.
мг/л. Это потребление важно для валидации результатов испытания и должно составлять не менее 1,5 мг/л.
Приложение К
(рекомендуемое)
Технические спецификации для метода Е. Модифицированный тест ОЭСР
К.1 Лаборатория
К.2 Дата начала тестирования
К.3 Тестируемое вещество:
a) Наименование;
b) концентрация основного раствора, мг/л;
c) первоначальная концентрация в среде, мг/л;
d) концентрация эффлюента в реакционной смеси, мл/л.
К.4 Определение углерода
Таблица К.1 - Анализатор углерода
N колбы | РОУ после | ||||||
0 | |||||||
Тестируемое вещество+инокулят | 1 | ||||||
значение | |||||||
2 | |||||||
значение | |||||||
Холостая проба - инокулят без тестируемого вещества | 3 | ||||||
значение | |||||||
4 | |||||||
значение | |||||||
| |||||||
К.5 Оценка исходной информации
Таблица К.2
N Колбы | Расчет результатов | % деградации после | ||||
0 | ||||||
1 |
| 0 | ||||
2 |
| 0 | ||||
Среднее значение* |
| 0 | ||||
* Примечание - Подобные форматы могут быть использованы для референтных веществ и контроля токсичности. | ||||||
К.7* Абиотическая деградация (необязательно)
_______________
* Нумерация соответствует оригиналу. - .
Таблица К.3
Время, дни | ||
0 | ||
Концентрация РОУ в стерильной контрольной проверке | ||
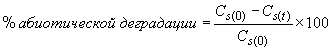 . (К.1)
. (К.1)
К.8 Специфический химический анализ (необязательно)
Таблица К.4
Остаточное количество тестируемого вещества в конце теста | % первичной биодеградации | |
Стерильный контроль | ||
Инокулированная питательная среда |
|
Приложение Л
(рекомендуемое)
Технические спецификации для метода F. Манометрический метод определения БПК
Л.1 Лаборатория
Л.2 Дата начала тестирования
Л.3 Тестируемое вещество:
a) Наименование:
b) Концентрация основного раствора, мг/л:
c) Первоначальная концентрация в среде, мг/л:
d) Объем колбы для тестирования (м), мл:
е) ТПК или ХПК, мг/мг тестируемого вещества (
,
).
Л.4 Инокулят
a) Источники забора ила:
b) Предварительная обработка (если проводилась):
c) Концентрация взвешенных веществ в реакционной массе, мл/л:
Л.5 Потребление кислорода: способность к разложению микроорганизмами
Таблица Л.1 - Тип используемого респирометра
Время, дни | ||||||
Потребление | ||||||
Потребление Значение | ||||||
Поправка на потребление |
| |||||
БПК (мг |
| |||||
% деградации БПК/ТПК*100 |
| |||||
Значение* | ||||||
* Не учитывать, если есть большая разница в значениях. | ||||||
Л.6 Поправка на нитрификацию (см. приложение Г)
Таблица Л.2
Время инкубации, день | ||||
0 | 28 | Разница | ||
(i) | Концентрация нитратов (мг | (N) | ||
(ii) | Кислородный эквивалент (4,57 | - | - | |
(iii) | Концентрация нитритов (мг | (N) | ||
(iv) | Кислородный эквивалент (3,43 | - | - | |
(ii+iv) | Общий кислородный эквивалент | - | - | |
Л.7 Анализ углерода (необязательно)
Таблица 17 - Анализатор углерода
Время, дни | Тестируемое вещество (мг/л) | Холостая проба (мг/л)) |
0 |
| |
28 |
| |
| ||
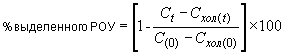 . (Л.1)
. (Л.1)
Л.8 Специфический химический анализ (необязательно)
Таблица 18
Остаточное количество тестируемого вещества в конце теста | % первичной биодеградации | |
Стерильный контроль | ||
Инокулированная питательная среда |
|
Л.9 Абиотическая деградация
Пусть - потребление кислорода в стерильных колбах на конец тестирования (мг), тогда:
![]() ; (Л.2)
; (Л.2)
![]() . (Л.3)
. (Л.3)
Библиография
[1] Reynolds L. et al (1987). Evaluation of the toxicity of substances to be assessed for biodegradability. Chemosphere, 16, 2259.
[2] de Morsier A. et al (1987). Biodegradation tests for poorly soluble compounds. Chemosphere, 16, 833.
[3] Gerike P. (1984). The Biodegradability testing of poorly water soluble compounds. Chemosphere 13, 169.
[4] Draft ISO Standard 10634 (1990). Water Quality, Evaluation in an aqueous medium of the "ultimate" biodegradability of low-soluble organic compounds.
[5] Standard Methods for the Examination of Water and Wastewater, 12th ed, Am. Pub. Hlth. Ass., Am. Wat. Poll. Control Fed., Oxygen Demand, P 65 (1965).
[6] Wagner R. (1976). Vom Wasser, 46, 139.
[7] DIN 38 409 Teil 41 - Deutsche Einheitsverfahren zur Wasser, Abwasser und Schlammuntersuchung, Summarische Wirkungs- und Stoffkenngrossen (Gruppe H). Bestimmung des Chemischen Sauerstofbedarfs (CSB) (H 41), Normenausschuss Wasserwesen (NAW) in DIN Deutsches Institut fur Normung e.V.
[8] Kelkenberg H. (1975). Z. Wasser und Abwasserforschung, 8, 146 (1975).
[9] Gerike P. (1984). The biodegradability testing of poorly water soluble compounds. Chemosphere, 13 (1), 169.
[10] OECD Guidelines for the Testing of Chemicals, Section 2. Test No. 209: Activated Sludge, Respiration Inhibition Test (Carbon and Ammonium Oxidation), 2010, 18.
[11] ISO 8192:2007 Water quality -- Test for inhibition of oxygen consumption by activated sludge.
_________________________________________________________________________________
УДК 658.382.3:006.354 МКС 71.040.50 Т58
Ключевые слова: методы испытаний, химическая продукция, окружающая среда, биоразлагаемость
___________________________________________________________________________________
Электронный текст документа
и сверен по:
, 2014

