ГОСТ Р ИСО 23118-2023
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
МОЛЕКУЛЯРНЫЕ ДИАГНОСТИЧЕСКИЕ ИССЛЕДОВАНИЯ IN VITRO
Требования к процессам преаналитического этапа исследования метаболомики мочи, сыворотки и плазмы венозной крови
Molecular in vitro diagnostic examinations. Requirements for the processes of the preanalytical stage of the study of the metabolomics of urine, serum and plasma of venous blood
ОКС 11.100.10
Дата введения 2024-05-01
Предисловие
1 ПОДГОТОВЛЕН Ассоциацией специалистов и организаций лабораторной службы "Федерация лабораторной медицины" (Ассоциация "ФЛМ") (Комитетом по молекулярной диагностике инфекционных и неинфекционных заболеваний "ФЛМ") на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 380 "Клинические лабораторные исследования и диагностические тест-системы ин витро"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 19 июля 2023 г. N 563-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 23118:2021* "Молекулярные диагностические исследования in vitro. Требования к процессам преаналитического этапа исследования метаболомики мочи, сыворотки и плазмы венозной крови" (ISO 23118:2021 "Molecular in vitro diagnostic examinations - Specifications for pre-examination processes in metabolomics in urine, venous blood serum and plasma", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Международный стандарт разработан Техническим комитетом ИСО/ТК 212 "Клинические лабораторные исследования и диагностические тест-системы in vitro" в сотрудничестве с Европейским комитетом по стандартизации (СЕН), СЕН/ТК 140 "Диагностические медицинские устройства In vitro".
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
Введение
Метаболомика - дисциплина, которая занимается комплексным анализом метаболома - полного набора малых молекул (молекулярная масса <2000 Да) в определенной биологической системе, такой как клетка, ткань, орган или целый организм [1]. В большинстве случаев исследования метаболома проводят с помощью двух основных аналитических методов, а именно метода масс-спектрометрии (МС) и ядерного магнитного резонанса (ЯМР) [2]-[4]. В случае МС чувствительность может достигать пикомолярных значений, но в то же время метод требует разделения образца и многократного проведения исследований для определенных классов соединений. Спектроскопия ЯМР позволяет исследовать метаболиты, концентрации которых выше 1 мкМ, и в основном используется для нецелевого исследования, где все метаболиты в концентрациях выше предела обнаружения наблюдаются одновременно, независимо от их химической природы, без необходимости разделения образца.
Метаболом динамичен и довольно чувствителен к внешним воздействиям. Метаболом может резко измениться во время взятия образцов, транспортирования, хранения и обработки. Следовательно, результат исследований не будет соответствовать физиологическому состоянию здоровья пациента, отражая искаженный состав метаболома. Было установлено, что на преаналитическом этапе исследования важно учесть влияние двух основных факторов:
a) ферментативная активность в образцах, в основном связанная с присутствием клеток;
b) химические реакции (например, окислительно-восстановительные реакции) между метаболитами или между метаболитами и кислородом (см. [5]-[11]).
Кроме того, на результаты исследования может повлиять использование добавок или токсичных веществ, поэтому выбор подходящих пробирок для взятия крови и пластиковых контейнеров для образцов также является важным аспектом преаналитического этапа.
Были проведены исследования с целью установления критериев предварительной оценки сточки зрения поддержания исходного метаболома образца путем определения критических этапов и параметров, влияющих на состав метаболома. Кроме того, для обеспечения сопоставимости результатов исследования в рамках проведения межлабораторных сличений необходима стандартизация всего процесса предварительного этапа исследования. На современном техническом уровне не существует определенных процедур предварительных оценок метаболома в образце. Как следствие, процедуры, применяемые различными лабораториями, по-разному влияют на метаболом образцов, делая сравнение результатов проведенных исследований нецелесообразным. Принятие настоящих требований к преаналитическому этапу позволит сравнивать и оценивать результаты, полученные различными лабораториями в ходе исследования метаболома.
Настоящий стандарт разработан на основе анализа результатов исследований с целью стандартизации исследования метаболома мочи, сыворотки и плазмы на преаналитическом этапе.
1 Область применения
Настоящий стандарт устанавливает требования и содержит рекомендации по обращению, документированию и обработке образцов биологической жидкости в рамках выполнения преаналитического этапа исследования метаболомики мочи, плазмы и сыворотки венозной крови. Настоящий стандарт применяется к исследованиям метаболома и рекомендуется для использования медицинскими лабораториями, заказчиками лабораторных исследований, разработчиками и производителями медицинских изделий для диагностики in vitro, учреждениями и компаниями, проводящими биомедицинские исследования, биобанками и регулирующими органами.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты [для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных - последнее издание (включая все изменения)]:
ISO 15189, Medical laboratories - Requirements for quality and competence (Медицинские лаборатории. Требования к качеству и компетентности)
ISO 15190, Medical laboratories - Requirements for safety (Медицинские лаборатории. Требования к безопасности)
3 Термины и определения
В настоящем стандарте применены термины по ИСО 15189, а также следующие термины с соответствующими определениями.
Терминологические базы данных ИСО и МЭК доступны по следующим интернет-адресам:
- платформа онлайн-просмотра ИСО по адресу: http://www.iso.org/obp:
- Электропедия МЭК по адресу: http://www.electropedia.org/.
3.1 биожидкость (biofluid): Биологическая жидкость, которая может выделяться (например, моча или пот), секретироваться (например, грудное молоко, слюна или желчь), извлекаться с помощью иглы (например, кровь или спинномозговая жидкость) или быть получена из патологических образований (например, пузырьковая или кистозная жидкость).
3.2 исследование (examination): Ряд операций, имеющий объектом определения значения или характеристики свойства.
Примечание 1 - Процессы, которые начинаются с изолированного аналита и включают в себя все виды тестирования параметров или проведение химических реакций для получения количественного или качественного результата исследования.
Примечание 2 - Для проведения исследования метаболома выделение аналита необязательно.
[ИСО 20166-1:2018, 3.10, изменено - термин "аналитический тест" исключен и добавлено примечание 2]
3.3 голодание (fasting): Воздержание от приема любой твердой или жидкой пищи, кроме воды, не менее 8 ч.
3.4 масс-спектрометрия; МС (mass spectrometry): Метод, используемый для исследования химических соединений на основе отношения их массы к заряду.
3.5 метаболическое профилирование (metabolic profiling): Использование аналитического оборудования для одновременного исследования совокупности метаболитов (3.6) в биологических системах, которые могут быть измерены с помощью используемого (или выбранного) метода.
Пример - Примерами таких методов являются ЯМР и МС.
3.6 метаболиты (metabolites): Молекулы малой молекулярной массы (2000 Да), являющиеся промежуточными продуктами и/или продуктами метаболизма организма человека, его микрофлоры, поступающие с пищей, напитками, лекарствами или загрязняющими веществами.
Примечание 1 - Дополнительная информация приведена в [1].
3.7 метаболом (metabolome): Совокупность метаболитов (3.6), обнаруживаемых в организме или биологическом образце.
Примечание 1 - Дополнительная информация приведена в [1].
3.8 метаболомика (metabolomics): Комплексный анализ метаболома (см. 3.7) биологического образца (3.14) [например, организма, клетки, ткани или биожидкостей (3.1)].
3.9 метаболомика на основе МС (MS-based metabolomics): Использование масс-спектрометрии (3.4) для измерения метаболитов (3.6) в биологических образцах.
3.10 спектроскопия ядерного магнитного резонанса; ЯМР (nuclear magnetic resonance spectroscopy): Метод, основанный на селективном поглощении высокочастотных радиоволн ядрами атомов под воздействием стационарного магнитного поля.
Примечание 1 - ЯМР позволяет получить информацию о химических и структурных свойствах молекул.
3.11 метаболомика на основе ЯМР (NMR-based metabolomics): Использование ЯМР-спектроскопии (3.10) для измерения метаболитов (3.6) в биологических образцах.
3.12 плазма (plasma): Жидкая часть несвернувшейся (стабилизированной антикоагулянтом) крови.
Примечание 1 - Образцы плазмы могут содержать антикоагулянты.
3.13 процесс подготовки, преаналитический этап, преаналитический рабочий процесс (preexamination processes, preanalytical phase, preanalytical workflow): Процессы, которые начинаются в хронологическом порядке с направления врача, включающего исследование (3.2), подготовку и идентификацию пациента, сбор первичного(ых) образца(ов), их временное хранение и транспортирование в медицинскую лабораторию, выделение аналита, анализ полученных результатов.
Примечание 1 - Преаналитический этап включает в себя подготовительные процессы, которые могут повлиять на результат исследования (3.2).
[ИСО 15189:2012, 3.15, изменено - добавлен дополнительный термин и внесена более подробная информация]
3.14 первичная проба; образец (primary sample, specimen): Дискретная порция биологической жидкости, выдыхаемого воздуха, волос или тканей, взятая для исследования (3.2), изучения или анализа одной или нескольких величин или свойств, которые предполагается приписать целому.
[ИСО 15189:2012, 3.16, изменено - термин и определение используют без исходных примечаний]
3.15 комнатная температура (room temperature): Температура, которая установлена для целей настоящего стандарта в пределах от 18°C до 25°C.
3.16 сыворотка (serum): Надосадочная жидкость, которую можно отделить от свернувшегося образца крови.
3.17 стабильность (stability): Способность стандартного образца сохранять установленное значение свойства в определенных пределах в течение определенного промежутка времени при хранении в заданных условиях.
[ИСО Руководство 30:2015, 2.1.15 - термин и определение используют без исходного примечания]
4 Общие положения
Общие требования к системе менеджмента качества медицинских лабораторий, и в частности к сбору образцов и обращению с ними (включая предотвращение перекрестного загрязнения), приведены в ИСО 15189 или ИСО/МЭК 17020. Требования к лабораторному оборудованию, реактивам и расходным материалам - в соответствии с ИСО 15189. Также может применяться ИСО/МЭК 17020.
Процессы преаналитического этапа диагностики могут повлиять на окончательный результат исследования, риски их выполнения должны быть оценены (см. также ИСО 14971). Меры по снижению или устранению выявленных рисков устанавливают в случае их влияния на результат исследования; метод исследования должен гарантировать достоверность результата исследований с учетом предполагаемых рисков. Исследование отдельных аспектов преаналитического этапа важно и необходимо для обеспечения сохранности метаболома с целью исключения возможного влияния на результаты исследования. Это может быть обеспечено, например, проведением запланированного периодического исследования образцов на определенном участке временного интервала, соответствующего продолжительности этапов транспортирования и хранения, а также обеспечением мер по предотвращению или уменьшению воздействия различных факторов на процессы преаналитического этапа.
При отсутствии технологий стабилизации образца в отношении метаболома взятие образцов (сбор мочи, взятие крови) следует проводить в медицинских организациях или учреждениях, использующих процедуры для обработки биожидкостей.
В частности, для образцов, предназначенных для исследования метаболома должны быть выполнены следующие этапы:
a) предварительная подготовка пациента (голодание, терапия и т.д.);
b) взятие образцов (сбор мочи, взятие крови);
c) выбор контейнеров/пробирок для взятия образцов и контейнеров для их транспортирования (например, пробирки, термоконтейнеры, контейнер для хранения и транспортирования);
d) выбор способа стабилизации (например, выбор веществ, добавляемых для стабилизации образца);
e) документирование данных о любых применяемых добавках (антикоагулянтах);
f) документирование данных о типах и количестве образцов, а также их описание.
Требования к безопасности транспортирования и обращению образцов должны соответствовать ИСО 15189 и ИСО 15190. Следует соблюдать руководящие принципы Всемирной организации здравоохранения (ВОЗ) по безопасному транспортированию инфекционных веществ и образцов для диагностики [14].
5 Моча
5.1 Деятельность, осуществляемая за пределами лаборатории
5.1.1 Сбор мочи
5.1.1.1 Общие положения
При сборе образца мочи необходимо учитывать требования (например, патологическое состояние пациента, объем образца) для предполагаемого молекулярного исследования (см. также ИСО 15189).
5.1.1.2 Информация об образце донора/пациента
Документация должна включать идентификационный номер образца донора/пациента, который может быть в виде кода.
Документация должна включать (но не ограничиваться):
a) состояние здоровья и соответствующие факторы образа жизни донора/пациента [например, патологическое состояние, тип заболевания, сопутствующее(ие) заболевание(я)];
b) демографические данные (например, возраст, пол);
c) информацию о лечении, любом приеме лекарственных средств, медицинском обследовании донора/пациента до сбора мочи (например, анестетики, лекарства, диагностические процедуры);
d) время сбора, включая информацию о последнем приеме пищи, предшествующей физической активности;
e) соответствующее согласие донора/пациента.
5.1.1.3 Выбор и маркировка контейнеров для сбора
Лаборатория должна предоставить рекомендации по применению контейнеров, предназначенных для сбора мочи.
Добавки обычно не используют, так как они могут повлиять на результат исследования. Если добавки необходимы для конкретных целей исследования, то необходимо проанализировать их влияние на результат исследования. Некоторые добавки в контейнерах для сбора мочи могут представлять опасность для доноров/пациентов (например, токсичные или вызывающие коррозию вещества).
Для идентификации образцов, собранных в контейнеры для сбора мочи, следует применять процедуру маркировки в соответствии со стандартными операционными процедурами (см. также ИСО 15189) или процедуру маркировки путем нанесения штрихкода.
5.1.1.4 Сбор и получение образца мочи
5.1.1.4.1 Общие положения
Инструкции по сбору мочи должны быть даны донору/пациенту, включая любые меры безопасности, которые необходимо соблюдать при обращении с контейнерами для сбора мочи, содержащими вредные добавки. Все медицинские изделия, предназначенные для сбора мочи, должны быть проверены на совместимость с метаболомикой с целью подтверждения отсутствия влияния на профиль метаболома.
Примечание - Для детей, не приученных к туалету, наиболее популярным является неинвазивный метод сбора чистой мочи, который Национальный институт здравоохранения и клинического мастерства (NICE) в 2007 г. определил как золотой стандарт. Это предполагает сбор мочи посредством удержания специального мочеприемника в потоке мочи. NICE предлагает мочеприемники для сбора мочи как один из лучших вариантов сбора чистого образца мочи у новорожденных.
Первую утреннюю порцию средней порции мочи следует собирать как минимум после 8-часового голодания. Употребление алкоголя может влиять на концентрацию метаболитов в моче. Необходимо указать, если образцы собраны в разное время или в ходе 24-часового сбора. Любые изменения технологии сбора мочи должны быть валидированы. Рекомендуется провести исследование метаболома мочи, собранной натощак, среди группы доноров, имеющих сходные характеристики, например возраст, пол, условия питания, интенсивность физических нагрузок, прием лекарственных препаратов, способ сбора мочи.
Собирают достаточный объем мочи в соответствии с требованиями преаналитического и аналитического этапов исследования.
Любая клиническая процедура, влияющая на сбор образцов, должна быть задокументирована. Общий собранный объем мочи должен быть задокументирован.
5.1.1.4.2 Информация об образце мочи и требованиях к ее хранению в месте сбора мочи
Поскольку метаболический профиль образца может измениться после сбора мочи под влиянием условий хранения, что может повлиять на достоверность результата исследования, документация по первичному образцу мочи должна включать время и дату сбора.
Образец цельной мочи должен храниться при температуре от 2°C до 8°C не более 2 ч и не должен замораживаться перед центрифугированием и/или фильтрацией, чтобы избежать разрушения клеток при образовании кристаллов льда, если иное не предусмотрено методом исследования.
Допустимая общая продолжительность хранения образца мочи включает время хранения в месте сбора мочи, транспортирование в лабораторию для проведения исследований и дальнейшее хранение в лаборатории или других учреждениях.
5.1.2 Требования к транспортированию
Во время транспортирования образец хранят в прохладном месте (диапазон температур от 2°C до 8°C).
Должны быть приняты надлежащие меры для обеспечения условий транспортирования в требуемом температурном диапазоне и сокращения времени доставки, которая должна быть завершена в течение 2 ч после сбора.
Конкретные параметры времени и температуры транспортирования должны быть задокументированы. Любые отклонения также должны быть задокументированы.
Следует соблюдать Руководство ВОЗ по безопасному транспортированию инфекционных сред и образцов [14].
5.2 Деятельность, осуществляемая внутри лаборатории
5.2.1 Прием образцов
Время транспортирования и состояние полученных образцов мочи (например, маркировка, условия транспортирования, объем, утечка и осаждение) должны быть задокументированы. Несоответствия маркировки и условий транспортирования, а также отличия в объеме мочи от инструкций, данных для сбора мочи или требований к подготовке образцов должны быть задокументированы.
При выявлении несоответствий в части условий и времени транспортирования, общего времени хранения, объема мочи, которые могут повлиять на достоверность и надежность результата исследования [7]-[9], должен быть получен новый образец.
Следует оценить свойства образца (например, значение pH, концентрацию креатинина, загрязнение кровью и/или бактериями), если это необходимо для проведения исследования.
5.2.2 Требования к хранению
Температура хранения и временной интервал между получением образца и его обработкой должны быть задокументированы.
Температура хранения - см. 5.1.1.4.2.
Общая продолжительность хранения образца мочи должна включать время хранения в месте сбора мочи (см. 5.1.1.4.2), транспортирование в лабораторию (см. 5.1.2) и дальнейшее хранение в лаборатории или других учреждениях.
Для некоторых исследований требуются специальные условия хранения образцов мочи. Необходимо соблюдать инструкции производителей контейнеров для взятия и транспортирования образцов. Должны быть приняты соответствующие меры для обеспечения соблюдения рекомендаций по температуре хранения образцов.
5.2.3 Обработка образца мочи
Обработку образца мочи осуществляют центрифугированием (рекомендуемые: от 1000 до 3000 g в течение 5 мин при температуре от 2°C до 8°C) с последующей фильтрацией (например, с отсекающим фильтром 0,20 мкм) для удаления твердых частиц и клеток.
В качестве альтернативы можно использовать только фильтрацию.
Доказано, что фильтрующие материалы и устройства не поглощают и не выделяют метаболиты и не влияют на результаты исследований.
Примечание - Вышеупомянутые способы обработки образца (центрифугирование и фильтрация) важны для предотвращения разрушения клеток, которые могли бы загрязнить образец [7]-[9].
Альтернативные процедуры обработки должны быть валидированы.
5.2.4 Требования к долгосрочному хранению образца мочи
Температура и продолжительность периодов между получением образца мочи, обработкой и замораживанием обработанной пробы должны быть задокументированы.
Если обработанный образец предназначен для хранения в замороженном виде, необходимо подтвердить, что заморозка не влияет на достоверность результата исследования метаболома. Обработанный образец следует аликвотировать в криопробирки требуемого объема, необходимого для последующего исследования его метаболического профиля. Минимальный объем аликвоты зависит от метода аналитического исследования. Контейнеры для сбора мочи должны быть проверены на отсутствие содержания загрязняющих веществ (например, фталатов), которые могут повлиять на достоверность результата исследования.
Перед замораживанием клетки должны быть удалены в соответствии с 5.2.3. Может применяться замораживание с регулируемой скоростью посредством медленного охлаждения.
Строгое соблюдение процедур центрифугирования/фильтрации (см. 5.2.3) и хранения при температуре минус 70°C обеспечивает стабильность обнаруживаемой с помощью ЯМР части метаболома в течение не менее пяти лет [9].
Для метаболомики на основе МС в случае метаболитов, которые не измеряют в рамках традиционных исследований, при отсутствии конкретных рекомендаций следует хранить образец при температуре ниже минус 130°C для обеспечения более длительной стабильности [15]. Для конкретных метаболитов следует провести исследование долгосрочной стабильности образца.
5.2.5 Размораживание образца мочи
Рекомендуется размораживание образца мочи на льду. Продолжительность оттаивания должна быть задокументирована. Время, прошедшее после оттаивания до проведения исследования, должно быть задокументировано.
Процедура оттаивания и продолжительность хранения до начала последующего исследования должны быть валидированы.
6 Кровь
6.1 Деятельность, осуществляемая за пределами лаборатории
6.1.1 Первичное взятие крови
6.1.1.1 Общие положения
При взятии образца крови необходимо учитывать требования (например, патологическое состояние донора/пациента, объем образца) для предполагаемого молекулярного исследования (см. также ИСО 15189).
6.1.1.2 Информация об образце донора/пациента
Документация должна включать идентификацию личности (ID) донора/пациента, которая может быть в форме кода.
Документация должна включать следующую информацию (но не ограничиваться):
a) состояние здоровья и факторы образа жизни донора/пациента крови [например, патологическое состояние, тип заболевания, сопутствующее(ие) заболевание(я)];
b) демографические данные (например, возраст, пол);
c) информацию о лечении, любом приеме лекарственных средств, медицинском обследовании донора/пациента до взятия крови (например анестетики, лекарства, диагностические процедуры);
d) время взятия крови, включая информацию о последнем приеме пищи, предшествующем физической активности;
e) соответствующее согласие донора/пациента.
6.1.1.3 Выбор пробирки для взятия крови
Выбирают пробирку для взятия крови, позволяющую получить достаточное количество венозной крови. Вместимость пробирки для взятия крови определяют объемом венозной крови, необходимым для выполнения как преаналитических, так и аналитических процессов.
Выбор конкретной пробирки, подходящей для взятия плазмы или сыворотки, будет зависеть от метода исследования метаболического профиля.
Для плазмы в качестве антикоагулянтов можно использовать этилендиаминтетрауксусную кислоту (ЭДТА), фторид натрия или цитрат. ЭДТА предпочтительнее для исследования метаболомики на основе метода ЯМР, а также для большинства исследований рассеянного склероза [2], [7], [9]. В метаболомике на основе ЯМР использование пробирок с гепарином проблематично. Несмотря на то, что спектры ЯМР явно не изменены, сигналы ЯМР гепарина могут усложнить анализ других резонансов, в том числе исходящих от подклассов липопротеинов. Антикоагулянт, используемый для стабилизации образцов, должен подходить для последующего МС исследования. Использование молекул с высокой молекулярной массой, таких как гепарин, может мешать измерению.
Пробирки, используемые для взятия крови, могут содержать дополнительные добавки, такие как активаторы свертывания для сыворотки или полимерные гели (гелевые сепараторы), которые облегчают отделение плазмы/сыворотки от клеточного компонента.
Использование антикоагулянта и любых других добавок должно быть задокументировано, поскольку их присутствие может повлиять на достоверность результатов исследования (см. примеры в приложении А) [9], [16].
6.1.1.4 Взятие образца крови у донора/пациента
Требования, связанные со взятием крови у донора/пациента для исследований метаболома, следующие:
a) время взятия крови в соответствии с ИСО 15189 должно быть задокументировано;
b) для идентификации пробирок образцов взятой крови следует применять процедуру маркировки в соответствии со стандартными операционными процедурами (см. также ИСО 15189) или процедуру маркировки путем нанесения штрих кода;
c) кровь следует собирать как минимум после 8-часового голодания. Если образцы были взяты в других условиях или в условиях, не связанных с голоданием, данную информацию необходимо задокументировать;
d) следует использовать традиционные процедуры венепункции. Могут потребоваться меры для предотвращения возможного обратного потока. Необходимо соблюдать инструкции производителей по использованию пробирок для взятия крови. В определенных обстоятельствах можно применять различные методы венепункции;
e) пробирки для взятия крови должны быть наполнены кровью в соответствии с инструкциями производителей, особое внимание следует обратить на правильное положение пробирки во время взятия крови, а также на требуемый объем заполнения;
f) необходимо соблюдать инструкции изготовителей пробирок для взятия крови по смешиванию или переворачиванию пробирки сразу после взятия крови;
g) пробирки для взятия крови не должны поглощать или выделять метаболиты, влияющие на достоверность результатов исследований.
Примечание - Если добавки не будут однородно смешаны с образцом крови, то могут произойти процессы, которые дополнительно влияют на метаболический профиль образца, тем самым влияя на достоверность результатов исследований.
6.1.1.5 Предварительная обработка образца крови
Сопроводительная документация на образец крови должна включать время взятия крови.
Обработка (см. 6.2.2) образца крови должна начинаться в течение 30 мин после взятия (когда образцы хранят при комнатной температуре) [9]. Если производитель пробирок для взятия образцов в инструкции по применению указывает иной временной интервал, то такая информация должна быть задокументирована.
Если исследование предназначено для конкретных метаболитов, то промежуток времени хранения до начала исследования может быть увеличен при условии проведения валидации процедуры.
Все этапы предварительной обработки образцов должны быть задокументированы и валидированы.
6.1.2 Транспортирование предварительно обработанных образцов в лабораторию
Если первичную кровь не обрабатывают по месту ее взятия, образец крови должен быть транспортирован в лабораторию и после этого обработан в соответствии с 6.1.1.5.
Процедура использования пневматической системы транспортирования пробирок должна быть валидирована, так как на образец может повлиять ускорение/замедление его продвижения в пневматической системе [17].
Должны быть приняты соответствующие меры для соблюдения требований к условиям транспортирования (температура транспортирования) и сокращения времени доставки.
6.2 Деятельность, осуществляемая внутри лаборатории
6.2.1 Прием образцов
Время транспортирования и состояние полученного образца крови (например, маркировка, условия транспортирования, объем, протекающая/поврежденная пробирка) должны быть задокументированы. Несоответствия маркировки и условий транспортирования, а также отличий в объеме крови от установленных требований для взятия крови или к подготовке образцов, должны быть задокументированы.
В случае выявления несоответствий в части условий и времени транспортирования образца, общего времени хранения образца, объема крови, которые могут повлиять на достоверность и надежность результата исследования, следует, по возможности, получить новый образец.
6.2.2 Обработка образцов
Обработку следует начинать в течение 30 мин (при комнатной температуре) после взятия крови (см. также 6.1.1.5). Сыворотка и плазма должны быть приготовлены в соответствии с задокументированными стандартными операционными процедурами. Для удаления всех циркулирующих клеточных загрязнений можно использовать специальные процедуры подготовки плазмы.
Примечание 1 - Примером такой процедуры является двухэтапное центрифугирование. Второй этап центрифугирования обычно представляет собой ультрацентрифугирование жидкой части.
Применяемые документированные процедуры должны быть валидированы.
Примечание 2 - Применение ультрацентрифугирования значительно изменяет, например, профиль липопротеинов и тем самым существенно влияет на метаболомику с помощью ЯМР.
Для сыворотки время обработки начинается с формирования сгустка, для чего перед центрифугированием требуется примерно 30 мин отстаивания пробирки при комнатной температуре. Если возникают проблемы со свертываемостью, то эту информацию необходимо задокументировать.
Если обработанный образец предназначен для хранения в замороженном виде (см. 6.2.4), то перед замораживанием его следует аликвотировать в криопробирки в объеме, необходимом для исследования метаболического профиля. Минимальный объем аликвоты зависит от метода исследования. Пробирки должны быть проверены, чтобы избежать загрязнения образца (например, фталатами).
6.2.3 Транспортирование обработанных образцов в лабораторию для проведения метаболомного исследования или в биобанк
Если образцы транспортируют в лабораторию для немедленного исследования, условия транспортирования должны быть валидированы.
Если применимо, образцы следует транспортировать в биобанк и обратно в замороженном виде (см. 6.2.4).
При получении образцов время, условия транспортирования и состояние образца сыворотки или плазмы (например, маркировка, объем образца, утечка) должны быть задокументированы. Несоответствия маркировки и условий транспортирования, а также отличия в объеме крови от установленных требований должны быть задокументированы.
В случае выявления несоответствий в части условий и времени транспортирования, хранения и наличия других факторов, которые могут оказывать воздействие на достоверность и надежность результатов исследований [7]-[11], следует, по возможности, получить новый образец.
Следует соблюдать Руководство ВОЗ по безопасному транспортированию инфекционных веществ и диагностических образцов [14].
6.2.4 Требования к долгосрочному хранению
Температура и продолжительность между получением образца, его обработкой и замораживанием обработанной пробы должны быть задокументированы.
Может применяться замораживание с регулируемой скоростью.
Соблюдение процедуры центрифугирования (см. 6.2.2) и хранения при температуре минус 70°C достаточно для обеспечения стабильности обнаруживаемой с помощью ЯМР части метаболома в течение не менее пяти лет [9].
Для метаболомики на основе масс-спектрометрии в случае метаболитов, которые не измеряются в рамках традиционных исследований, при отсутствии конкретных рекомендаций следует хранить образец при температуре ниже минус 130°C для обеспечения более длительной стабильности [16]. Для конкретных метаболитов следует провести исследование долгосрочной стабильности образца.
6.2.5 Размораживание и использование сыворотки и плазмы
Для проведения исследований образец необходимо разморозить. Рекомендуется размораживание на льду. Процедура оттаивания и период времени для начала последующего исследования должны быть валидированы.
Приложение А
(справочное)
Нестабильность метаболома
А.1 Общие положения
Существуют два основных критических аспекта стабильности метаболома биологических жидкостей ex-vivo:
a) изменения образцов после их взятия, вызванные присутствием клеток, связанных с ферментативными реакциями;
b) изменения образцов после их взятия, обусловленные химическими реакциями, протекающими в сложной смеси молекул и растворенного кислорода.
Далее приведены примеры наблюдаемых изменений в моче и сыворотке/плазме крови, которые могут служить критериями оценки достоверности результатов.
А.2 Моча
a) Изменения после сбора мочи, вызванные присутствием клеток
Три образца мочи (1, 2 и 3), характеризующиеся разным клеточным составом (т.е. 1 - очень высокое; 2 - умеренное; 3 - низкое), были собраны, разделены на две разные аликвоты: одна (обозначенная R) была проанализирована без дополнительной обработки, другая (обозначенная P) была подвергнута предварительному (мягкому) центрифугированию перед исследованием. Содержание клеток оценивали по визуальному осмотру осадка, присутствующего после мягкого предварительного центрифугирования в аликвоте P.
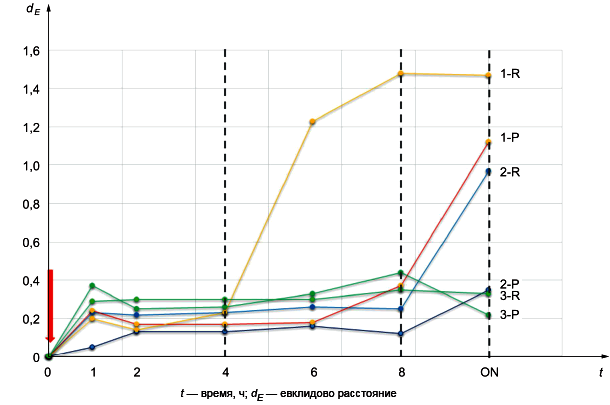
Стабильность во времени метаболома в моче P и R контролировали путем получения спектров ЯМР (исследование 1Н NOESY при 600 МГц, 300 K) в различные моменты времени после сбора образца (0; 1; 2; 4; 6; 8 ч), максимум до 20-24 ч, обозначенных как ночные (ON) (см. рисунок А.1). Образцы хранили при температуре 4°C между получением спектров ЯРМ.
Отклонение от исходного метаболома вычисляли как евклидово расстояние между спектрами, полученными в каждый момент времени, и спектром в момент времени 0. Евклидово расстояние между двумя спектрами вычисляли как расстояние в n-мерном пространстве, где n соответствует числу точек, составляющих каждый спектр.
|
Примечание - Красная стрелка указывает время 0.
Рисунок А.1 - Отклонение от исходного метаболома в образцах с разным клеточным составом
Профиль образца 3 очень стабилен во времени как в P, так и в R моче. Напротив, профили образцов 2-R и 1-R со временем становились все более нестабильными по сравнению с их аналогами Р. Эти данные показывают, что использование мягкого центрифугирования и/или фильтрации для удаления клеток из свежей мочи обеспечивает надлежащую консистенцию и стабильность образца. Важность этого этапа обработки зависит от содержания клеток в каждом образце, которое варьирует от пациента к пациенту. Чем больше количество клеток, тем больше степень наблюдаемых изменений. Следует избегать замораживания перед удалением клеток, чтобы предотвратить разрушение клеток и выход внутриклеточного содержимого.
b) Изменения после сбора мочи в результате химических реакций
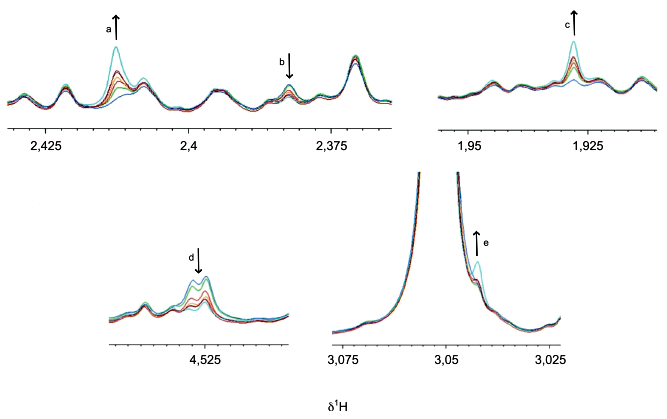
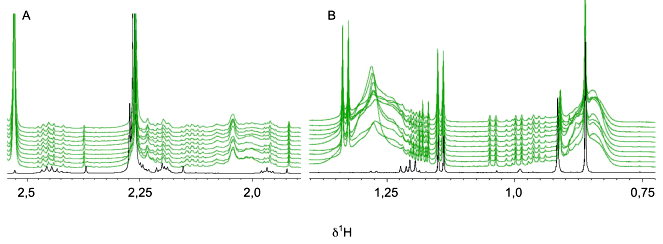
Стабильность метаболома в предварительно обработанной моче P отслеживали в течение 24 ч, получая ЯМР-спектры каждые 2 ч; в промежутках между измерениями образцы хранились при температуре 4°C. Исследования 1H NOESY были проведены на частоте 600 МГц, 300 K в разные моменты времени после предварительной обработки (0; 1; 2; 4; 6; 8 ч), максимум до 20-24 ч исследования выполняли всю ночь (ON).
|
_______________
![]() Сукцина.
Сукцина.
![]() Пируват.
Пируват.
![]() Ацетат.
Ацетат.
![]() Аскорбат.
Аскорбат.
![]() Креатин.
Креатин.
синяя линия спектра - t=0 ч; зеленая линия спектра - t=1 ч; красная линия спектра - t=2 ч; оранжевая линия спектра - t=4 ч; темно-красная линия спектра - t=6 ч; фиолетовая линия спектра - t=8 ч; голубая линия спектра - t=ON (ночь); ![]() -химический сдвиг протона, Гц/МГц (химический сдвиг, Гц/МГц, обычно обозначают как ppm)
-химический сдвиг протона, Гц/МГц (химический сдвиг, Гц/МГц, обычно обозначают как ppm)
Примечание - Стрелки указывают направление изменения во времени.
Рисунок А.2 - Эффекты, не зависящие от фазы обработки образцов мочи
Существует ряд изменений, которые происходят независимо от присутствия клеток и могут быть связаны с окислительно-восстановительными реакциями (ферментативными или неферментативными). Сукцинат, пируват, ацетат, аскорбат и креатин входят в число наиболее уязвимых метаболитов (см. рисунок А.2). Для поддержания уровней наиболее чувствительных метаболитов образцы следует хранить на льду перед обработкой и немедленно замораживать при температуре минус 80°C. Подобные эффекты наблюдаются в результате повторяющихся циклов замораживания/оттаивания, поэтому их следует избегать.
А.3 Сыворотка/плазма крови
а) Изменения после взятия образца, вызванные присутствием клеток
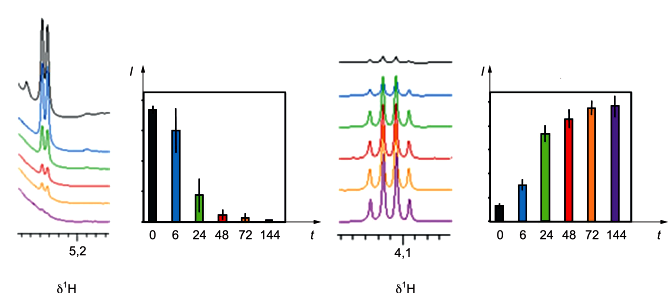
Образцы плазмы с ЭДТА были взяты у пяти здоровых доноров. Для каждого донора образцы исследовали в шести временных точках (0; 6; 24; 48; 72 и 144 ч). Образцы перед исследованием хранили при комнатной температуре. Исследованные образцы сразу же замораживали и размораживали непосредственно перед проведением исследования. Были проведены исследования Н NOESY при 600 МГц и 310 К. Изменения уровней метаболитов определяли путем интегрирования репрезентативных сигналов
Н ЯМР
|
t - время, ч; I - относительная интенсивность (произвольные единицы измерения); ![]() - протонный химический сдвиг, Гц/МГц
- протонный химический сдвиг, Гц/МГц
Рисунок А.3 - Изменения уровней глюкозы (левые панели) и лактата (правые панели) в образцах плазмы перед обработкой
Между взятием крови и исследованием общий метаболический профиль претерпевает изменения в концентрации нескольких метаболитов. Наиболее значительные изменения, связанные с красными кровяными тельцами, относятся к глюкозе, которая уменьшается, и лактату, который увеличивается (см. рисунок А.3). Таким образом, очень важно исследовать образцы как можно быстрее.
|
красная линия спектра - 0 ч; голубая линия спектра - 4 ч; фиолетовая линия спектра - 8 ч; зеленая линия спектра - 12 ч; ![]() - протонный химический сдвиг, Гц/МГц
- протонный химический сдвиг, Гц/МГц
Примечание - Стрелки указывают направление изменения во времени.
Рисунок А.4 - Изменения уровня цитрата в образцах сыворотки после обработки
b) Изменения после взятия крови в результате химических реакций
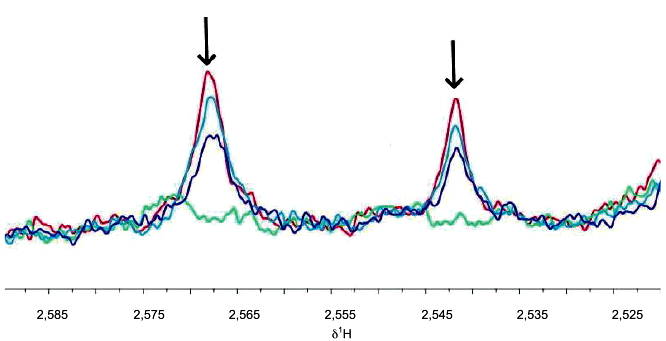
Стабильность метаболома в сыворотке крови отслеживали в течение 12 ч, получая спектр ЯМР каждые 4 ч (0; 4; 8; 12 ч). Образцы хранили при температуре 4°C между получением спектров ЯРМ. Исследования Н NOESY были проведены при 600 МГц и 310 К.
Сигналы цитрата полностью исчезают, если образец выдерживают при температуре 4°C в течение 12 ч (см. рисунок А.4). Это изменение может быть связано с окислительно-восстановительными реакциями. Замораживания при температуре минус 80°C сразу после получения сыворотки достаточно, чтобы погасить эту реакцию. Таким образом, эти результаты показывают, что после обработки крови полученные образцы сыворотки и плазмы должны быть немедленно заморожены, чтобы избежать такого рода изменений.
Подобные эффекты также наблюдаются в результате повторяющихся циклов замораживания/оттаивания, поэтому их следует избегать.
А.4 Выбор пробирок для взятия крови
Выбор подходящей пробирки для взятия крови может повлиять на результаты последующих исследований. Например, вакуумные пробирки для взятия крови могут содержать добавки, такие как антикоагулянты (ЭДТА, цитрат натрия, гепарин) или полимерные гели (гель-сепаратор), которые облегчают отделение плазмы/сыворотки от клеточного компонента. Наличие добавок не является "нейтральным" по отношению к результатам исследования.
Например, спектры 1Н NOESY (600 МГц, 310 К) были получены как на образцах цитратной плазмы (выделена из образцов крови с использованием в качестве антикоагулянта цитрата натрия, а в качестве разделителя клеток - полисахарида), так и на холостой пробе с использованием буфера, добавляемого производителем пробирок, содержащих антикоагулянт и разделитель клеток (см. рисунок А.5).
|
зеленая верхняя линия спектра - спектрограммы образцов плазмы с цитратом натрия и раствором Ficoll™ Hypaque™ в фосфатном буфере ЯМР; черная нижняя линия спектра - спектрограммы образцов плазмы в фосфатном буфере ЯМР, рекомендованном производителем для добавления к цитрату натрия, и раствором Ficoll™ Hypaque™; ![]() - протонный химический сдвиг, Гц/МГц
- протонный химический сдвиг, Гц/МГц
Рисунок А.5 - Спектры ЯМР Н, полученные на цитрате плазмы, раствор Ficoll™ Hypaque™
![]()
_______________
![]() Ficoll™ и Hypaque™ являются примерами подходящих продуктов, имеющихся в продаже. Данная информация приведена для удобства пользователей настоящего стандарта и не означает одобрения этих продуктов со стороны ИСО.
Ficoll™ и Hypaque™ являются примерами подходящих продуктов, имеющихся в продаже. Данная информация приведена для удобства пользователей настоящего стандарта и не означает одобрения этих продуктов со стороны ИСО.
Рисунок демонстрирует, что для исследования не следует применять плазму, полученную с использованием разделительных сред, поскольку такой способ влечет появление сигналов, некоторые из которых очень интенсивны и имеют различную ширину линии, что сильно уменьшает активную область спектра и количество метаболитов, которые могут быть включены для проведения последующего исследования. На практике почти 30% активной области спектра становится безрезультатной из-за того, что происходит интерференция сильных сигналов добавок. Использование соответствующих пробирок для взятия крови необходимо, чтобы избежать помех при проведении исследования. Возможность использования различных пробирок для взятия крови должна быть проверена в зависимости от выбранного аналитического оборудования.
Применяемые на преаналитическом этапе вспомогательные материалы (изделия), изготовленные из пластмассы, также могут выделять загрязняющие вещества в исследуемый образец. В связи с чем рекомендуется проводить валидацию материалов с обязательным проведением холостых исследований перед их использованием.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ISO 15189 | IDT | ГОСТ Р ИСО 15189-2015 "Лаборатории медицинские. Частные требования к качеству и компетентности" |
ISO 15190 | MOD | ГОСТ Р 52905-2007 (ИСО 15190:2003) "Лаборатории медицинские. Требования безопасности" |
Примечание - В настоящей таблице использованы следующие условные обозначения степени соответствия стандартов:
| ||
Библиография
[1] | Wishart Dsfeunang Y.D., Marcu A., Guo A.C, Liang K., |
[2] | Dona A.C, |
[3] | Vignoli A., Ghini V., Meoni G., Licari Ctakis P.G., Tenori L., et al. High-throughput metabolomics by 1D NMR. Angew. Chem. Int. Ed. Engl. 2019, 58 pp.968-994 |
[4] | Dettmer K., Aronov P.A., Hammock B.D. Mass spectrometry-based metabolomics. Mass Spectrom. Rev. 2007, 26 pp.51-78 |
[5] | Ceglarek U., Dittrich J., Helmschrodt C., Wagner K., Nofer J.-R. et al. Preanalytical standardization of sphingosine-1-phosphate, sphinganine-1-phosphate and sphingosine analysis in human plasma by liquid chromatography- tandem mass spectrometry. Clin. Chim. Acta. 2014, 435 pp.1-6 |
[6] | Helmschrodt C., Becker S., Thiery J., Ceglarek U. Preanalytical standardization for reactive oxygen species derived oxysterol analysis in human plasma by liquid chromatography-tandem mass spectrometry. Biochem. Biophys. Res. Commun. 2014, 446 pp.726-730 |
[7] | Bernini P., Bertini I., Luchinat C., Nincheri P., Staderini S., Turano P. Standard operating procedures for pre-analytical handling of blood and urine for metabolomics studies and biobanks. J. Biomol. NMR. 2011, 49 pp.231-243 |
[8] | Emwas A.-H., Luchinat C., Turano P., Tenori L., Roy R., Salek R.M. et al. Standardizing the experimental conditions for using urine in NMR-based metabolomic studies with a particular focus on diagnostic studies: a review. Metabolomics. 2015, 11 pp.872-894 |
[9] | Ghini V., Quaglio D., Luchinat C., Turano P. NMR for sample quality assessment in metabolomics. New Biotechnol. 2019, 52 pp.25-34 |
[10] | Kamlage Bmaldonado S.G., Bethan B., Peter E., Schmitz O., Liebenberg V., et al. Quality Markers Addressing Preanalytical Variations of Blood and Plasma Processing Identified by Broad and Targeted Metabolite Profiling. Clin. Chem. 2014, 60 pp.399-412 |
[11] | Kamlage B., Neuber S., Bethan B., |
[12] | ISO/IEC 17020, Conformity assessment - Requirements for the operation of various types of bodies performing inspection |
[13] | ISO 14971, Medical devices - Application of risk management to medical devices |
[14] | WHO Guidelines for the Safe Transport of Infectious Substances and Diagnostic Specimens https://www.who.int/csr/emc97_3.pdf |
[15] | Hubel A., Spindler R., Skubitz A.P.N. Storage of human biospecimens: selection of the optimal storage temperature. Biopreservation and biobanking 2014, 12, pp.165-175 |
[16] | Ghini V., Unger F.T., Tenori L., Turano P., Juhl H., David K.A. Metabolomics profiling of pre-and post-anesthesia plasma samples of colorectal patients obtained via Ficoll separation. Metabolomics. 2016, 11 pp.1769-1778 |
[17] | Streichert T., Otto B., Schnabel C., Nordholt G. et al. Determination of hemolysis thresholds by the use of data loggers in pneumatic tube systems. Clin. Chem. 2011, 57 pp.1390-1397 |
УДК 57.085.2:006.354 | ОКС 11.100.10 |
| |
Ключевые слова: молекулярные диагностические исследования in vitro, требования к процессам преаналитического этапа, исследования метаболомики мочи, сыворотки и плазмы венозной крови | |
Электронный текст документа
и сверен по:
М.: ФГБУ "РСТ", 2023