ГОСТ ISO 10993-23-2023
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
Изделия медицинские
ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 23
Исследования раздражающего действия
Medical devices. Biological evaluation of medical devices. Part 23. Irritant studies
МКС 11.100.20
Дата введения 2024-06-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией "Институт медико-биологических исследований и технологий" (АНО "ИМБИИТ") на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 25 сентября 2023 г. N 165-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | ЗАО "Национальный орган по стандартизации и метрологии" Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узстандарт |
(Поправка. ИУС № 4-2024).
4 Приказом Федерального агентства по техническому регулированию и метрологии от 10 октября 2023 г. N 1092-ст межгосударственный стандарт ГОСТ ISO 10993-23-2023 введен в действие в качестве национального стандарта Российской Федерации с 1 июня 2024 г.
5 Настоящий стандарт идентичен международному стандарту ISO 10993-23:2021* "Оценка биологического действия медицинских изделий. Часть 23. Исследования на раздражение" ("Biological evaluation of medical devices - Part 23: Tests for irritation", IDT).
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
6 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
ВНЕСЕНА поправка, опубликованная в ИУС № 4, 2024 год
Введение
ISO (Международная организация стандартизации) является федерацией национальных органов по стандартизации (органов - членов ISO). Работу по подготовке международных стандартов проводят под руководством технических комитетов ISO. Каждая организация-член, заинтересованная в области деятельности, для которой создан технический комитет, имеет право быть представленной в данном комитете. Международные правительственные и неправительственные организации, также принимают участие в работе ISO. ISO тесно сотрудничает с Международной электротехнической комиссией (IEC) по вопросам стандартизации электротехнической продукции.
Процедуры, примененные при разработке настоящего стандарта, а также процедуры, предназначенные для его дальнейшей поддержки, приведены в Директиве ISO/IEC, часть 1. В частности, нужно отметить необходимость различных критериев утверждения для различных типов документов ISO. Настоящий стандарт составлен в соответствии с редакционными правилами Директив ISO/IEC, часть 2 (www.iso.org/directives). Необходимо обратить внимание на возможность того, что некоторые элементы настоящего стандарта могут быть объектом патентных прав.
ISO снимает с себя ответственность за обозначение каких-либо таковых патентных прав. Детали каких-либо патентных прав, обозначенных при разработке документа, будут содержаться во введении и/или в списке полученных патентных деклараций ISO (см. www.iso.org/patents).
Любая торговая марка, упомянутая в настоящем стандарте, является информацией, приведенной для удобства пользователей, и не является рекламой.
Для разъяснения добровольного характера стандартов, значений конкретных терминов ISO и выражений, связанных с оценкой соответствия, а также информации о приверженности ISO принципам ВТО по техническим барьерам в торговле (ТВТ), см. следующий URL: www.iso.org/iso/foreword.html.
Настоящий стандарт разработан Техническим комитетом ISO/TC 194, Биологическая и клиническая оценка медицинских изделий, в сотрудничестве с Техническим Комитетом CEN/TC 206, Оценка биологического и клинического действия медицинских изделий, Европейского Комитета по стандартизации (CEN), в соответствии с Соглашением о техническом сотрудничестве между ISO и CEN (Венское соглашение).
Список всех частей серии ISO 10993 находится на сайте ISO.
Все отзывы и вопросы по данному стандарту должны быть направлены в национальные органы по стандартизации пользователя. Полный список данных органов приводится по адресу: www.iso.org/members.html.
Настоящий стандарт оценивает возможные контактные опасности медицинских изделий, которые могут вызвать раздражение.
Некоторые составляющие материалы медицинских изделий были исследованы с продемонстрированным потенциалом к раздражению кожи или слизистой. Другие материалы и их химические компоненты не были исследованы и могут индуцировать нежелательные реакции при контакте с тканью человека. Таким образом, изготовитель обязан оценивать каждое изделие на предмет потенциального нежелательного воздействия до выхода изделия на рынок.
Раздражающий потенциал медицинского изделия или его компонентов может быть спрогнозирован либо исследованием на животных in vivo, либо исследованием раздражения in vitro пригодным методом.
ISO 10993-2 устанавливает требования к обращению с животными для оценки биологического действия медицинских изделий и выделяет три принципа: замещения, сокращения и улучшения исследований на животных. Настоящий стандарт описывает методы для определения раздражающих свойств медицинских изделий, материалов или их экстрактов с помощью исследований in vitro или in vivo. Исследования in vitro предпочтительнее исследований in vivo при надлежащей валидации и предоставлении соответствующей информации равнозначной той, которая получена при исследованиях in vivo (см. ISO 10993-1 и ISO 10993-2).
Традиционно исследования на мелких лабораторных животных проводились до испытаний на людях, чтобы позволить предположить реакцию человека.
Совсем недавно в качестве дополнения или альтернативы исследования на людях были добавлены методы in vitro.
Для исследования кожного раздражения индивидуальными химическими веществами были разработаны исследования in vitro с применением моделей реконструированного эпидермиса человека (RHE) (см. [31]). Метод был адаптирован для обнаружения раздражающих химических веществ в экстрактах из медицинского изделия. Результаты широкого круга исследований, в которых были применены две модели RHE, показали, что эти модели также могут использоваться для обнаружения раздражающих химических веществ, экстрагированных из полимерных материалов [поливинилхлорид (ПВХ) и силикон], как правило применяемых при производстве медицинских изделий (см. [6]). Данный метод оказался таким же чувствительным при обнаружении низких концентраций отдельных сильно раздражающих соединений, как и кожная проба на человеке и внутрикожное исследование на кроликах (см. [14]). Таким образом, поэтапный подход к исследованию раздражителя может начинаться с модели RHE in vitro.
Разработанные и валидированные модели RHE пригодны для прогнозирования ответа тканей кожи человека на раздражение. Рекомендуется ознакомиться с другими альтернативными моделями in vitro для оценки раздражающего потенциала при применении на слизистой или эпителии роговицы.
Предполагается, что для предоставления в нормативные органы данные исследования должны проводиться с применением надлежащих лабораторных практик (GLP) или ISO/IEC 17025 по применимости в соответствующей стране и соответствовать нормативным требованиям, связанным с обращением с животными. При необходимости рекомендуется проводить статистический анализ данных.
Настоящий стандарт предназначен для использования профессионалами с надлежащей квалификацией и опытом, способными интерпретировать его требования и оценить результаты оценки каждого медицинского изделия с учетом всех факторов, относящихся к изделию, его предполагаемого применения и существующих данных о медицинском изделии, полученных из обзора научной литературы и предшествующего клинического опыта.
Исследования, включенные в настоящий стандарт, являются важными инструментами для разработки безопасных продуктов, если они проводятся и интерпретируются подготовленными сотрудниками.
Настоящий стандарт основывается на многочисленных стандартах и руководствах, включая Руководство по исследованиям OECD [TG], Фармакопею США (см. [40]) и Европейскую Фармакопею (см. [39]). Он предназначен служить основным документом для выбора и проведения исследований, позволяющих оценить реакцию на раздражение, относящихся к безопасности медицинских материалов и изделий.
Инструкции для подготовки материалов конкретно в связи с вышеупомянутыми исследованиями приводятся в обязательном приложении A. В обязательном приложении D описаны несколько специальных исследований на раздражение in vivo для медицинских изделий, не контактирующих с кожей. Дополнительно обязательное приложение E предоставляет информацию для проведения исследования раздражения кожи человека.
1 Область применения
Настоящий стандарт распространяется на медицинские изделия (МИ) и материалы, применяемые для их изготовления, и устанавливает требования к проведению исследований на раздражающее действие. Исследования предназначены для прогнозирования и классификации раздражающего действия МИ/материалов в соответствии с ISO 10993-1 и ISO 10993-2.
Настоящий стандарт устанавливает требования:
- к проведению предварительных исследований раздражающего действия, включая методы in silico и in vitro при воздействии на кожу;
- проведению исследований методами in vitro и in vivo;
- обработке и интерпретации результатов исследований.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты [для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных - последнее издание (включая все изменения)]:
ISO 10993-1, Biological evaluation of medical devices - Part 1: Evaluation and testing within a risk management process. (Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента рисков)
ISO 10993-2, Biological evaluation of medical devices - Part 2: Animal welfare requirements (Оценка биологического действия медицинских изделий. Часть 2. Требования к обращению с животными)
ISO 10993-9, Biological evaluation of medical devices - Part 9: Framework for identification and quantification of potential degradation products (Оценка биологического действия медицинских изделий. Часть 9. Основные принципы идентификации и количественного определения потенциальных продуктов деградации)
ISO 10993-12, Biological evaluation of medical devices - Part 12: Sample preparation and reference materials (Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и контрольные образцы)
ISO 10993-13, Biological evaluation of medical devices - Part 13: Identification and quantification of degradation products from polymeric medical devices (Оценка биологического действия медицинских изделий. Часть 13. Идентификация и количественное определение продуктов деградации полимерных медицинских изделий)
ISO 10993-14, Biological evaluation of medical devices - Part 14: Identification and quantification of degradation products from ceramics (Оценка биологического действия медицинских изделий. Часть 14. Идентификация и количественное определение продуктов деградации изделий из керамики)
ISO 10993-15, Biological evaluation of medical devices - Part 15: Identification and quantification of degradation products from metals and alloys (Оценка биологического действия медицинских изделий. Часть 15. Идентификация и количественное определение продуктов деградации изделий из металлов и сплавов)
ISO 10993-18, Biological evaluation of medical devices - Part 18: Chemical characterization of materials (Оценка биологического действия медицинских изделий. Часть 18. Исследование химических свойств материалов)
ISO 14155, Clinical investigation of medical devices for human subjects Good clinical practice (Клинические исследования медицинских изделий для людей. Надлежащая клиническая практика)
OECD 404, Acute Dermal Irritation/Corrosion (Острое раздражение/Коррозия кожи)
OECD 439, In vitro Skin Irritation: Reconstructed Human Epidermis Test Method (Раздражение кожи in vitro: метод испытания реконструированного эпидермиса человека)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями.
ISO и IEC поддерживают терминологическую базу данных, используемую в целях стандартизации по следующим адресам:
- Электропедия IEC: доступна по адресу http://www.electropedia.org/;
- платформа онлайн-просмотра ISO: доступна по адресу http://www.iso.org/obp.
3.1 контрольный экстрагент (blank): Экстрагент, не содержащий исследуемую пробу, и подвергающийся тому же воздействию в идентичной емкости, в тех же условиях, что и экстрагент с исследуемой пробой во время экстракции.
[ISO 10136-1:1993, 3.8, уточнен - термин изменился с "раствора контрольного экстрагента" на "контрольный экстрагент"]
3.2 доза; дозировка (dose, dosage): Количество вводимого исследуемого образца (см. 3.14) (например, масса, объем), выраженного на единицу массы тела или площади поверхности.
Примечание - Термины часто взаимозаменяемы (дозировка является более распространенной).
3.3 эритема (erythema): Покраснение кожи или слизистой мембраны.
3.4 струп (eschar): Корка или обесцвеченный отшелушивающийся участок кожи.
3.5 экстракт (extract): Жидкость или суспензия, полученные в результате воздействия экстрагента (см. 3.16) на исследуемый или контрольный образец при контролируемых условиях.
3.6 раздражитель (irritant): Агент, производящий раздражение (см. 3.7).
3.7 раздражающее действие (irritation): Локализованный неспецифичный воспалительный ответ на однократное, многократное или непрерывное применение вещества/материала.
Примечание - Раздражение кожи является обратимой реакцией и, как правило, характеризуется местной эритемой (см. 3.3) и эдемой (см. 3.10) кожи.
3.8 некроз (necrosis): Гибель клеток в результате необратимых изменений, вызванных травмой или заболеванием.
Примечание - Восстановление тканей будет происходить либо в результате полного функционального восстановления, либо в результате образования рубца.
3.9 отрицательный контроль (negative control): Материал и/или вещество с достаточно изученными характеристиками, которые при применении в конкретном методе исследования подтверждают воспроизводимость этого метода и соответствие отрицательного, нереактивного или минимального биологического ответа в тест-системе установленным требованиям.
Примечание - На практике отрицательные контроли (NC) включают контрольный экстрагент (см. 3.1), экстрагенты (см. 3.16)/растворители и стандартные образцы.
3.10 отек (oedema): Увеличение объема ткани вследствие анормальной инфильтрации жидкости.
Примечание - В качестве синонима термина "отек" допускается использовать термин "эдема".
3.11 положительный контроль (positive control): Материал и/или вещество с достаточно изученными характеристиками, которые при применении в конкретном методе подтверждают воспроизводимость этого метода и соответствие положительного или реактивного биологического ответа в тест-системе установленным требованиям.
3.12 разъедание [коррозия] кожи (skin corrosion): Необратимое повреждение кожи после применения испытуемой пробы (см. 3.14), проявляющееся некрозом (3.8), затрагивающим эпидермис и дерму.
Пример - Действие соединения, химического вещества или исследуемой пробы, приводящее к изъязвлению кожи (см. 3.15).
3.13 исследуемый образец (test material): Материал, изделие, часть изделия или его компонент, которые отбираются для биологического или химического исследования.
3.14 исследуемая проба (test sample): Материал, изделие, часть изделия, компонент, экстракт (см. 3.5) или его часть, подвергаемые биологическим или химическим исследованиям или оценке.
3.15 изъязвление (ulceration): Открытая рана с потерей поверхностных слоев ткани.
3.16 экстрагент (vehicle): Жидкость, используемая для увлажнения, разбавления, суспендирования, экстракции (см. 3.5) или для растворения исследуемого вещества/материала.
3.17 контроль экстрагента (vehicle control): Экстрагент (см. 3.16), не содержащий исследуемый образец (см. 3.13), сохраняется в сосуде, идентичном сосуду с исследуемым образцом, и подвергается условиям, идентичным тем, которым исследуемый образец подвергается экстракции.
Примечание - Контрольный экстрагент предназначен для оценки возможных побочных эффектов, связанных с емкостью для экстракции, экстрагирующей жидкостью и процессом экстракции.
4 Основные принципы - поэтапный подход
Существующие методы исследования раздражения были разработаны для обнаружения возможного раздражающего действия на кожу и слизистые оболочки. Другие виды нежелательного воздействия, такие как сенсибилизация, данными исследованиями, как правило, не выявляются. Исторически исследование на раздражение проводилось на кроликах. Для обнаружения раздражающего действия имплантатов или изделий, присоединяемых извне, внутрикожная реакция более приемлема (см. 7.2).
Следует отдавать предпочтение исследованиям in vitro вместо in vivo в соответствии с ISO 10993-2, так как новые исследования in vitro являются научно обоснованными и пригодными для использования с МИ и становятся все более доступными. Результаты широкого круга исследований, в которых были применены две модели RHE, показали, что эти модели также могут использоваться для обнаружения раздражающих химических веществ, экстрагированных из полимерных материалов [поливинилхлорид (ПВХ) и силикон], как правило, применяемых при производстве МИ (см. [6]). Было показано, что этот метод одинаково чувствителен к обнаружению низких концентраций некоторых сильнораздражающих соединений по сравнению с кожной пробой на человеке и внутрикожном исследовании на кроликах (см. [14]). Таким образом, исследование на раздражение в условиях in vitro должно быть проведено перед исследованием на животных или человеке.
Примечание - Доступная детальная информация по применимости моделей RHE для конкретного исследуемого МИ должна быть рассмотрена.
Настоящий стандарт описывает поэтапный подход, который должен включать один или несколько следующих пунктов:
a) химическая характеристика, дополненная при необходимости химическими исследованиями образцов в соответствии с общими принципами, указанными в ISO 10993-9, ISO 10993-13, ISO 10993-14, ISO 10993-15 и ISO 10993-18;
b) обзор литературы, как указано в ISO 10993-1, включая оценку химических и физических свойств и информацию по раздражающему потенциалу любого составляющего продукта, а также структурно связанных химических веществ и материалов;
Примечание - Методы in silico (связь активность-структура, QSAR, метод аналогий) могут указать на потенциальную раздражающую активность.
c) альтернативное исследование in vitro с применением валидированной модели RHE согласно методам 6.2-6.12;
Примечание - Для специальных исследований на раздражающее действие МИ, контактирующих со слизистыми оболочками или эпителием глаза (приложение D), модели RHE не адаптированы, и рекомендуется изучить использование других моделей in vitro с соответствующими клетками или тканями, если они подходят для использования с МИ.
d) исследования на животных in vivo;
Примечание - Исследования на животных in vivo применимы, когда материалы не могут быть охарактеризованы и оценка риска не может быть проведена с использованием информации, полученной методами, описанными в a), b) и c).
e) клинические исследования согласно ISO 14155 и этическим принципам, регулирующим клинические исследования, не должны проводиться, пока раздражающий потенциал изделия не будет установлен посредством одного или более методов оценки, описанных с a) по d).
5 Оценка данных перед исследованием
5.1 Общие положения
Применяются требования, изложенные в ISO 10993-1:2018 (раздел 5) о классификации МИ, а также следующее.
Нестерильные образцы должны быть изучены in vivo только с неповрежденной кожей, так как вероятность микробного загрязнения исследуемого образца может затруднить интерпретацию заключительной пробы. В случаях, когда стерильность исследуемого образца не может быть гарантирована, но образец считается незагрязненным, необходимо обосновать интрадермальное введение.
5.2 Типы материалов
5.2.1 Предварительная оценка
Необходимо учитывать, что при изготовлении и сборке МИ в качестве вспомогательных средств для обработки могут использоваться дополнительные химические компоненты, например, смазочные материалы или средства для удаления плесени. Дополнительно к химическим компонентам изначального материала и производственных технологических добавок и примесей в готовом изделии могут присутствовать остатки адгезива/растворителя при сборке, остатки стерилизующих агентов или продукты реакции, возникающие в результате процесса стерилизации. Представляют ли эти компоненты риск или опасность для здоровья, зависит от характеристик выщелачивания или деградации готовых изделий. Потенциальная раздражающая активность таких компонентов должна быть принята во внимание (учтена). Следующие типы материалов часто применяются в МИ и могут нести риски раздражения.
5.2.2 Керамика, металлы и сплавы
Данные материалы, как правило, являются менее сложными, чем полимеры и материалы биологического происхождения, сточки зрения количества химических составляющих.
5.2.3 Полимеры
Данные материалы с точки зрения состава более сложны химически, чем керамика, металлы и сплавы. В них может находиться некоторое количество продуктов реакции, загрязнений и добавок, а завершенность полимеризации может различаться.
5.2.4 Материалы биологического происхождения
Состав этих материалов изначально сложен. Они часто содержат технологические добавки и примеси, например перекрестносшивающие и антимикробные агенты. Образцы биологических материалов могут отличаться от образца к образцу.
5.3 Информация о химическом составе
5.3.1 Общие положения
Описание химических компонентов МИ должно соответствовать ISO 10993-18. В соответствии с ISO 10993-1 степень требуемой физической и/или химической характеристики зависит от степени знаний о составе материала и от характера и длительности контакта МИ с организмом. Как минимум, характеристика должна включать составляющие химические вещества МИ и возможные остаточные технологические средства или добавки, применяемые при его производстве. Тщательность, необходимая при характеристике химических составляющих, в основном определяется характером, степенью, частотой и длительностью воздействия и опасностями, идентифицированными для МИ или материала. Необходимо получить количественные данные, если они имеют отношение к биологической безопасности. Если количественные данные не получены, то причина должна быть обоснована и задокументирована.
5.3.2 Существующие источники данных
По возможности, качественная и количественная информация по составу материала должна быть получена от поставщика. Для полимеров это часто требует доступа к внутренней информации; необходимо ввести положения для передачи и использования таковой конфиденциальной информации.
Качественная информация о каких-либо дополнительных добавках обработки (например, смазках для форм) также должна быть получена от соответствующих участников производственной цепочки, включая преобразователей и производителей компонентов.
При отсутствии каких-либо данных о составе рекомендуется поиск литературы для установления вероятной природы изначального материала или материалов, а также любых добавок для помощи в выборе наиболее подходящих методов анализа данного материала.
Химическая характеристика МИ должна быть получена в соответствии с ISO 10993-18.
Примечание - Состав керамик, металлов и сплавов может быть указан в соответствии со стандартами ISO или Американского общества по испытанию материалов (ASTM) или он может быть указан пользователем, или и то, и другое. Тем не менее, чтобы получить полную качественную и количественную информацию о составе, может потребоваться запросить их у поставщика или изготовителя исходного материала, а также у изготовителей компонентов, чтобы убедиться, что вспомогательные средства для обработки также идентифицированы. Мастер-файл (досье) на материал, хранящийся в контролирующих органах, является еще одним источником данных, если таковой доступен.
6 Исследования раздражения in vitro
6.1 Общие положения
Метод in vitro на моделях RHE для исследования раздражения был разработан конкретно для определения способности чистых веществ к раздражению кожи (см. [3], [12]) (см. OECD 439). Метод был адаптирован и валидирован двумя моделями RHE для обнаружения раздражающих химических веществ в экстрактах МИ (см. [5], [6], [12], [13], [17]-[19]). Данный метод оказался таким же чувствительным для обнаружения низких концентраций отдельных сильных раздражителей в экстрактах из полимерных медицинских материалов [ПВХ и силикон] при сравнении с кожной пробой на человеке и внутрикожном исследовании на кроликах (см. [20]). Таким образом, исследование RHE, как описывается в данном документе, может заменить исследование раздражения на кроликах in vivo путем воздействия на кожу и интракутанным (интрадермальным) введением.
Примечание - При возможности приводят детальную информацию по применимости модели RHE для конкретного исследуемого МИ.
6.2 Модель реконструированного эпидермиса человека in vitro
6.2.1 Тест-система - модель реконструированного эпидермиса человека
Модель RHE должна состоять из нормальных эпидермальных кератиноцитов человеческого происхождения, которые были культивированы для формирования многослойной высокодифференцированной модели эпидермиса человека. Она должна состоять из организованных базального, шиповатого и гранулярного слоев, а также многослойного рогового слоя, содержащего межклеточные ламеллярные липидные слои, расположенные по типу, аналогичному схеме in vivo. Нормальные кератиноциты человека, полученные от здоровых добровольцев, должны культивироваться несколько дней на мембране или фильтре воздухо-водного раздела для формирования трехмерной эпидермальной модели, состоящей из основного базального, супра-базального, шиповатого и гранулярного слоев, а также функционирующего рогового слоя. Модельная система должна обеспечивать возможность непосредственного добавления как полярных (например, физиологического раствора), так и неполярных (например, кунжутного масла) экстрактов на апикальную поверхность RHE конструкции.
Материалы, непригодные для экстракции (например, жидкости, гели, пасты и взвешенные частицы) могут быть приемлемыми для тест-системы. При их использовании необходимо предоставить данные валидации для демонстрации способности тест-системы обнаруживать раздражающую активность данных форм материалов до исследования.
6.2.2 Принцип метода
Конечные точки: определение жизнеспособности клеток основывается на клеточном восстановлении МТТ (3-(4,5-диметилтиазолил-2)-2, 5-бромид дифенилтетразолиума) и последующем преобразованием его в пурпурную соль формазана, которую количественно измеряют после извлечения из ткани (см. [9], [16]). Жизнеспособность клеток в обработанных тканях выражается в процентах от отрицательного контроля. Сокращение жизнеспособности клеток в процентном выражении применяется для прогнозирования раздражающей способности.
Процедура коротко: исследования, проведенные с полимерными биоматериалами, специально произведенными для поглощения раздражающих веществ при низких концентрациях, показали, что необходимо продленное воздействие по сравнению с протоколом OECD 439 для неразбавленных химических веществ. Инкубационный период воздействием от 18 до 24 ч при температуре 37°C для воздействия потенциально низких концентраций раздражителей в экстрактах из биоматериалов является достаточным для прогнозирования раздражения in vitro по снижению жизнеспособности ткани на 50% (см. [4], [6], [13], [17], [19]). Как воздействие в течение 18 ч, так и воздействие в течение 24 ч показали сходные результаты в обеих моделях RHE, оцененных при анализе по круговой системе с использованием экстрактов МИ (см. [13], [17], [19]).
Контроли экстрагентов должны включать физиологический раствор (NaCI 0,9%) и кунжутное масло, прошедшие процедуру экстракции МИ ISO 10993-12. Для каждой обработанной ткани жизнеспособность выражается как относительный процент к отрицательным контрольным тканям, обработанным DPBS или PBS (среднее значение).
Ограничения метода: метод неприменим к газам и аэрозолям. Он неприменим для оценки раздражения при прямом контакте с твердыми материалами, так как плотный контакт по всей исследуемой поверхности не может быть гарантирован.
Известные случаи исследуемых соединений, требующих конкретные контроли: некоторые химические вещества могут напрямую сократить реагент МТТ (например, электрофилы, предметы исследования с высоким pH), в то время как другие химические вещества могут напрямую окрасить ткань или клетки. Такие свойства исследуемого образца могут только помешать, если достаточные количества химического вещества присутствуют на ткани под конец периода воздействия. В таких случаях необходимо применить особую процедуру, позволяющую количественное исчисление "истинной" редукции МТТ. Протокол для определения возможного взаимодействия с МТТ приведен в ссылках [20] и [21]. Применение специфичных и адаптированных контролей позволяет вычислить истинную жизнеспособность ткани после вычитания неспецифичных оптических плотностей (ОП) из-за прямой химической редукции МТТ или химического остаточного цвета, выделенного из тканей, или и того, и другого.
6.2.3 Прогностическая модель
Прогностическая модель основана на модели прогнозирования OECD 439 и данных, полученных позже при оптимизации протокола МИ (см. [4], [6], [14], [17], [19]).
Если жизнеспособность клеток после воздействия составляет >50%, то исследуемая проба классифицируется как не раздражитель (NI).
6.3 Материалы
6.3.1 Модели реконструированного эпидермиса человека - описание продукта
Эпидермальные клетки забирают у здоровых добровольцев с отрицательными результатами анализов на ВИЧ 1 и 2, а также на антитела гепатита С и антигены гепатита В с соблюдением правил обращения с биологическими материалами.
_______________
Обе модели были оценены референтной лабораторией ЕС Европейского Центра Валидации Альтернативных Методов (EURL ECVAM) для определения кожного раздражения химическими веществами и включены в OECD 439 и Руководство ЕС В.46 (см. [41]). Эти модели были валидированы с неразбавленными промышленными химическими веществами в целях классификации и маркировки. Другие модели, описанные и признанные в OECD 439, могут использоваться для кожного раздражения МИ при их валидации для исследований экстрактов МИ на предмет раздражения кожи и ткани. Валидация нового метода, основанного на RHE, сходного с референтным методом, называется наверстывающей валидацией (catch-up validation) (см. [3], [37]).
Валидация новой модели RHE, приведенной в OECD 439 для определения кожного раздражения in vitro, должна продемонстрировать такие же показатели с точки зрения прогностических возможностей и внутрилабораторной вариабельности, как и в первоначальном циклическом исследовании (см. [6]). Межлабораторное исследование (как минимум в трех лабораториях) должно проводиться слепым методом с тремя повторами (три производственные партии модели RHE) (см. [37]) на наборе раздражающих и нераздражающих материалов, эквивалентных набору исходных материалов в циклическом исследовании.
6.3.2 Приготовление экстрактов из МИ
Приготовление экстрактов МИ и/или биоматериалов должно производиться в соответствии с ISO 10993-12.
- Полярные экстракты должны быть приготовлены в 0,9%-ном физиологическом растворе (900 мг на 100 мл сверхчистой или деионизованной воды).
- Неполярные экстракты должны быть приготовлены в кунжутном масле из sesamum indicum (примеры приемлемого качества: сверхрафинированное и фармацевтической степени чистоты).
Примечание 1 - В циклическом исследовании [6] было показано, что 0,9%-ный физиологический раствор и кунжутное масло подходят в качестве экстрагентов для раздражающих веществ, присутствующих как в ПВХ (PVC), так и в силиконовых полимерах, для применения в модели RHE in vitro. Таким образом, данные жидкости рекомендуются как экстрагенты.
Если для экстракции применяются другие экстрагенты, то необходимо предоставить данные валидации для подтверждения, что замена экстрагентов не повлияет на способность тест-системы дифференцировать отрицательные, слабые, умеренные и сильные раздражители.
Время и температура экстракции должны быть обоснованы согласно ISO 10993-12.
Примечание 2 - В циклическом исследовании раздражение МИ на модели RHE применялись экстракты обогащенных полимеров (PVC и силикон), а экстракция проводилась при (37±1)°C в течение (72±2) ч с непрерывной ажитацией/встряхиванием.
Материалы, не предназначенные для экстракции (например, жидкости, гели, пасты и взвешенные частицы) могут быть приемлемыми для тест-системы. При использовании таких материалов необходимо предоставить данные валидации для демонстрации способности тест-системы обнаруживать раздражающую способность материалов до исследования.
6.4 Методы
6.4.1 Общие положения
ВНИМАНИЕ - Процедура, описанная в настоящем стандарте, требует применения опасных реагентов. Настоящий стандарт не охватывает все сопряженные вопросы безопасности. Ответственностью пользователя настоящего стандарта являются принятие профилактических мер, а также мер по охране труда и безопасности, и обеспечение соответствия нормативным требованиям.
МТТ представляет следующие опасности:
- Н302: вреден при проглатывании;
- Н315: вызывает кожное раздражение;
- Н319: вызывает серьезное раздражение глаз;
- Н330: смертелен при вдыхании;
- Н335: может вызвать респираторное раздражение;
- Н341: может быть причиной генетических дефектов (указать путь воздействия, если достоверно доказано, что никакие другие пути воздействия не могли вызвать риск).
Изопропанол представляет следующие риски:
- Н225: легко воспламеняющиеся жидкость и пар;
- Н319: вызывает серьезное раздражение глаз;
- Н336: может вызвать сонливость или головокружение.
6.4.2 Процедура исследования
В приложении В приведен перечень для исследования раздражения in vitro с использованием моделей RHE.
Все процедуры, проведенные при исследовании раздражения на модели RHE, следует отразить документально. Пример списка документации метода (MDS) приводится в приложении C. Описание различных шагов, связанных с проведением исследования раздражения кожи in vitro, приводится ниже. Необходимо следовать следующим шагам, обосновывая любые отклонения, сопровождая их данными валидации.
- Подготавливают исследуемые и контрольные пробы в виде экстрактов из изделия/биоматериала на полярном (солевом) и неполярном (кунжутное масло) экстрагентах. Время начала экстракции должно основываться на времени, выбранном для экстракции согласно ISO 10993-12 и времени готовности ткани к обработке (в зависимости от времени получения и необходимых предварительных инкубации тканей RHE). Экстракт исследуемого материала/МИ должен быть использован в течение срока, допустимого ISO 10993-12 для применения в экстрактах для исследования биосовместимости. Во время периода экстракции применяют непрерывную ажитацию/встряхивание.
- Затем переносят ткань RHE из среды транспортировочных планшетов в среду культуральных планшетов в соответствии с инструкцией изготовителя. Если того требуют инструкции изготовителя тканей, то предварительно инкубируют ткани, поместив их в культуральные планшеты подходящего размера со средой для анализа (см. 6.5.1).
- Если экстракты из материала положительного контроля не включены, то в день эксперимента добавляют положительный контроль (SDS) в полярный (солевой) экстрагент в указанной концентрации. Можно применять более низкие концентрации SDS (например, от 0,25% до 0,5%) в качестве положительного контроля после демонстрации применимости и положительных результатов (см. [17], [19]).
- Наносят отрицательный контроль, положительный контроль, контроли экстрагентов и исследуемую пробу в объеме 100 мкл на поверхность ткани RHE.
- Переносят и погружают в экстракт формазана изопропанол.
- Экстракция формазаном: не менее 2 ч при комнатной температуре или в течение ночи (в герметичной емкости, при комнатной температуре).
- Встряхивают и гомогенизируют.
- Переносят экстракт на формазане в 96-луночный планшет.
- Измеряют оптическую плотность (OD), используя спектрофотометр для планшетов.
6.4.3 Среда и растворы для конечной точки
6.4.3.1 Раствор МТТ
Раствор МТТ чувствителен к свету. Следует защищать его от света фольгой или подходящим материалом.
Растворяют порошок МТТ в концентрации 5 мг/мл в PBS (базовая концентрация). Фильтруют через фильтр 0,22 мкм. Подготавливают готовые к использованию растворы (например, аликвотами в 1 мл) в стерильных темных микропробирках емкостью 1,5 мл. Хранят реагенты в морозильной камере при минус 20°C. Срок хранения: 1 год при минус 20°C.
В качестве альтернативы можно использовать препарат МТТ, предоставленный изготовителем тканей RHE.
Разводят базовый раствор МТТ предварительно подогретой средой до концентрации в 1 мг/мл.
Раствор следует беречь от света и хранить не более 2 ч после приготовления.
6.4.3.2 Раствор изопропанола
Применяют неразбавленный 2-пропанол (CAS N 67-63-0).
6.4.4 Приготовление исследуемой пробы и контроля
Документируют основную информацию о контроле экстрагента и экстракте, включая коды или номера, физическое состояние, объем или массу, срок годности и условия хранения. Записывают детали приготовления и метода. Пример записей представлен в приложении С.
Особая процедура для положительного контроля (1% об/об SDS): 500 мкл водного 20%-ного SDS необходимо смешать с 9,5 мл экстрагента (солевого) и тщательно перемешать. Из данного раствора отбирают 100 мкл, которые добавляют к образцам ткани.
В качестве положительного контроля могут применяться более низкие концентрации SDS (например, от 0,25% до 0,5%) после демонстрации приемлемости и положительных результатов (см. [17], [19]).
Положительный контроль в носителе полярной экстракции должен быть приготовлен перед применением в каждый день эксперимента.
_______________
Особая процедура для экстрагентов: контроли экстрагентов (0,9%-ный физиологический раствор и кунжутное масло) должны быть помещены в сосуд для экстракции (например, флакон из желтого стекла) и подвержены идентичной процедуре экстракции, например (72±2) ч при температуре (37±1)°C как с исследуемыми образцами. Если пробы должны быть испытаны прямым контактом с образцами ткани, то вышеописанный этап можно опустить.
Количество материалов для положительного контроля ограничено. В качестве положительного контроля для моделей RHE in vitro можно использовать полимер Y-4 (см. [22]), предоставленный Исследовательским институтом Хатано Центра продовольственной и лекарственной безопасности (Япония), или другие подтвержденные контроли при валидации, предоставленной соответствующими поставщиками. Силиконовый SDS может быть использован в качестве положительного контроля при экстракции физиологическим раствором, если это подтверждено.
6.5 Оценка эффективности испытания
6.5.1 Получение тканей реконструированного эпидермиса человека
Состав набора и процедуры пробы должны быть отражены документально (например, в MDS).
6.5.2 Подготовка и преинкубация
- Если инструкции изготовителя ткани того требуют, то преинкубируют ткань, поместив ее в культуральные планшеты надлежащего размера со средой согласно инструкциям изготовителя ткани.
- Наполняют соответствующее количество лунок свежей среды согласно инструкции изготовителя.
- В стерильных условиях открывают планшеты, содержащие ткани RHE. Под стерильным воздушным потоком убирают крышку и аккуратно (используя стерильный пинцет) извлекают каждую вкладку, содержащую эпидермальную ткань. Удаляют какую-либо остающуюся агарозу, прилегающую к внешним сторонам вкладки, путем осторожного промакивания стерильной фильтровальной бумагой или марлей и помещают ткани в подготовленные стерильные лунки со свежей средой.
- Визуально проверяют, не осталось ли агарозы, и переносят ткань на свежую среду, наклоняя вставку, чтобы избежать образования пузырьков под ней.
Примечание - 24-луночный планшет, используемый для транспортировки, можно хранить запечатанным при комнатной температуре для проверки на предмет признаков возможной контаминации к концу недели.
- Проверяют состояние тканей RHE и регистрируют изменения в тканях.
6.6 Нанесение исследуемой пробы и промывание
6.6.1 Общие положения
Хотя проведение исследования на раздражение in vitro соответствует одинаковым принципам для всех моделей, необходимо осознавать, что при выполнении проб могут возникнуть второстепенные различия между конкретными моделями.
Если существует стандартная операционная процедура (СОП) для конкретной модели RHE, то необходимо следовать СОП изготовителя, учитывая особые аспекты (например, время воздействия) для исследования экстракта МИ как представлено в настоящем стандарте. Перед применением модели RHE, указанной в OECD 439, для исследования либо экстрактов МИ, либо МИ, либо и тех, и других необходимо продемонстрировать применимость конкретной модели. Данные коммерческие или оптимизированные инструкции должны, при применении с системами МИ, приводить к результатам, эквивалентным уже утвержденным методам, включенным в настоящий стандарт.
6.6.2 Подготовка
- Предварительно подогревают поддерживающую культуральную среду до комнатной температуры.
- Удаляют преинкубационные планшеты из инкубатора примерно за 5 мин до воздействия на экстракты.
- Перед воздействием на экстракты:
- подготавливают культуральные планшеты соответствующего размера для инкубации тканей RHE с исследуемыми образцами и контролями;
- маркируют все крышки планшетов кодами исследуемой пробы; по три ткани/лунки на исследуемую пробу и контроли;
- освежают среду под вкладками (добавляют нужное количество среды) или переносят вкладки в новый планшет со свежей средой.
6.6.3 Воздействие исследуемого экстракта и контролей
Примечание - Модельная поверхность является гидрофобной, и важно удостовериться, что 100 мкл хорошо распределены по всей поверхности эпидермиса. Иногда с полярными растворителями из-за механизмов напряженности поверхности капля распределяется только по периферии эпидермиса. В таком случае либо используют кончик пипетки, чтобы расправить образец, или пинцет для того, чтобы поместить вкладку на дно планшета, пока не покрыта вся поверхность эпидермиса. Дополнительно для масляных экстрактов можно использовать шарикоголовую стеклянную пипетку Пастера для распределения исследуемого образца, чтобы обеспечить нужный контакт со всем эпидермисом.
- Помещают планшеты с тканями в ламинарный бокс до окончания обработки всех образцов.
- После воздействия тщательно промывают ткани стерильным DPBS или PBS, наполняя и опустошая тканевую вкладку несколько раз для удаления какого-либо остаточного материала исследуемого образца. Рекомендуется 15-25-кратное промывание. Необходимо следовать конкретным инструкциям, если таковые предоставлены изготовителем модели RHE. Промывание не должно быть слишком осторожным, иначе исследуемый образец не будет полностью удален.
- После промывания вкладки удаляют остаточный DPBS или PBS путем переворачивания и легкого встряхивания вкладки. Осушивают вкладку переворачиванием на стерильную впитывающую бумагу.
- Осушивают поверхность вкладки (например, используя двусторонний тампон).
- Переносят просушенные вкладки ткани в подходящие контейнеры или лунки планшета культивирования тканей, заранее наполненные свежей средой пробы (0,3 мл/лунку), пока все ткани не промыты. Переходят к инкубации МТТ.
Если следы исследуемого образца продолжают находиться на поверхности, то необходимо постараться удалить их стерильным намоченным ватным тампоном. Регистрируют данную процедуру. Поверхность ткани может быть оценена визуально диссектирующим стереоскопом.
6.7 Анализ МТТ для определения жизнеспособности ткани реконструированного эпидермиса человека после воздействия
6.7.1 Инкубация с МТТ и экстракция изопропанолом
Жизнеспособность ткани RHE оценивают измерением сокращения МТТ. Измерение количества МТТ проводят незамедлительно после окончания воздействия. Остатки исследуемых проб удаляют промыванием тканей.
Подготовка раствора МТТ и предварительное наполнение 24-луночного планшета (300 мкл/лунка) должны быть проведены до начала процедуры промывания.
- Подготавливают среду МТТ и 24-луночные планшеты со средой пробы. Пипетируют 300 мкл среды МТТ (концентрация 1 мг/мл) в каждую лунку требуемого числа 24-луночных планшетов.
- После завершения инкубации с МТТ промакивают остатки среды с МТТ с тканевых вкладышей и переносят ткани в подходящие контейнеры или лунки планшетов культивации тканей, предварительно наполненные нужным количеством изопропанола согласно инструкциям поставщика RHE.
_______________
- После инкубации прокалывают пленку (пакет) и ткань острой или инъекционной иглой 20-го калибра для получения всего экстракта из соответствующей лунки. Получают раствор с растворенным формазаном для измерения абсорбции. Перед переносом экстракта из контейнеров или луночных чашек в 96-луночные планшеты проводят пипеткой вверх и вниз не менее 3 раз для получения однородного экстрагента.
6.7.2 Измерения абсорбции
- Переносят на каждый образец ткани 2 или 3x200 мкл аликвот (= 2 или 3 лунки на образец ткани) из каждой исследуемой лунки на 96-луночный плоскодонный микротитрационный планшет (с соответствующей маркировкой) в зависимости от инструкций поставщика RHE. Один 96-луночный планшет используют для каждого измерения.
Примечание - Следует соблюдать осторожность во избежание испарения изопропанола на 96-луночных планшетах. VC1 и VC2 на планшетных картах в приложении С всегда являются контролями для 0,9% солевого раствора и кунжутного масла. В пробе RHE in vitro применяется контрольный фон изопропанола для определения OD в пробе RHE.
- Измеряют OD на спектрофотометре для 96-луночных планшетов, используя светофильтр согласно инструкциям изготовителя и раствор изопропанола в качестве фонового контроля. Как правило, применяют фильтр в 570 нм или 630 нм.
Примечание - Измерение при 570 нм проводят без эталонного фильтра, так как "классический" эталонный фильтр, часто используемый в исследовании с МТТ (630 нм), все еще находится в пределах диапазона длин волн абсорбции формазана. Поскольку фильтры имеют определенный диапазон, их использование может привести к уменьшению динамического диапазона выходного сигнала.
6.8 Критерии приемлемости исследования
Примечание - Если Y-4 применяется в качестве материала положительного контроля, можно использовать клетки с жизнеспособностью <50% вместо <40% в соответствии с данными из первоисточника при циклических исследованиях для экстрактов МИ (см. [6]).
Критерии приемлемости исследования: все данные исследуемых проб считаются достоверными, если данные отрицательных и положительных контролей экстрагента отвечают вышеуказанным критериям.
6.9 Этап вычисления данных
6.9.1 Общие положения
Следующие этапы расчета применимы к большинству исследуемых проб со следующими характеристиками:
- не взаимодействует с реагентом МТТ (см. 6.2.2), неокрашенная, с низкой способностью окрашивать ткани;
6.9.2 Фоновый контроль изопропанола для оптической плотности в пробе реконструированного эпидермиса человека
Вычисляют среднюю OD от шести репликатов раствора изопропанола для каждого планшета.
Вычисляют стандартное отклонение между оптической плотностью каждой ткани.
6.9.3 Отрицательные контроли, обработанные фосфатно-солевым буферным раствором Дюльбекко и фосфатно-солевым буферным раствором
Корректируют фоновое значение изопропанола путем вычитания среднего значения OD фона изопропанола из OD отрицательных DPBS или контролей, обработанных PBS.
Рассчитывают среднюю OD на образцы ткани (три репликата/повторения).
Средняя OD для всех образцов тканей соответствует 100% жизнеспособности.
Рассчитывают стандартное отклонение между OD каждого образца ткани и жизнеспособностью.
6.9.4 Положительный контроль
- Вычисляют скорректированное значение фона изопропанола вычитанием средней оптической плотности фона изопропанола из оптической плотности положительного контроля.
- Вычисляют среднюю оптическую плотность на ткань (три репликата).
- Вычисляют жизнеспособность на ткань путем деления средней OD ткани PC на среднюю OD ткани NC и умножения результата на 100.
- Вычисляют среднюю жизнеспособность для всех тканей.
- Вычисляют стандартное отклонение между оптической плотностью каждой ткани и жизнеспособностью.
6.9.5 Исследуемый экстракт и VC проба (TTs)
- Корректируют фоновое значение изопропанола путем вычитания средней OD фона изопропанола из OD исследуемого экстракта.
- Рассчитывают средний OD на образцы ткани (три репликата/повторения).
- Рассчитывают жизнеспособность на ткань путем деления средней OD ткани ТТ на среднюю OD ткани NC и умножения результата на 100.
- Рассчитывают среднюю жизнеспособность для всех образцов тканей.
- Рассчитывают стандартное отклонение между OD каждого образца ткани и жизнеспособностью.
Процент жизнеспособности каждого обработанного эпидермиса рассчитывают относительно среднего значения отрицательных контролей. Также необходимо вычислить коэффициент вариативности (CV). Средняя относительная жизнеспособность трех тканей используется для классификации данных в соответствии с моделью прогнозирования.
6.10 Интерпретация данных - Прогностическая модель
Раздражающий потенциал исследуемых образцов прогнозируется средней жизнеспособностью тканей под воздействием исследуемого образца. Среднюю жизнеспособность вычисляют по трем отдельным тканям. Раздражающий потенциал прогнозируется, если средняя относительная жизнеспособность равна или ниже 50% отрицательного контроля.
Таблица 1 - Классификация исследуемой пробы
Критерий для интерпретации In vitro | Классификация |
Средняя жизнеспособность ткани составляет 50% по меньшей мере в одном экстрагенте | Раздражитель (I) |
Средняя жизнеспособность ткани составляет >50% в двух экстрагентах | Не раздражитель (NI) |
Примечание - В случае чистых химических веществ модель RHE in vitro для исследования раздражающего действия обнаруживает раздражители, классифицируемые согласно UN GHS, категории 2 (раздражитель) и категории 1 (коррозия кожи), как указано в OECD 439 и OECD 431 (см. [31]). Дополнительно она может идентифицировать нераздражающие химические вещества "низкой опасности" по категории UN GHS когда жизнеспособность тканей превышает 50%. В таблице 3 (реакции на раздражение in vivo) модели RHE идентифицируют категории реакции как "незначительные" и "серьезные".
6.11 Бланк документации метода
В качестве примера в приложении C приводится MDS для управления данными, позволяющая осуществлять надлежащий контроль качества (т.е. правильная установка, калибровка, функционирование оборудования и качество заготовок). Для каждых партий эпидермиса и эксперимента сохраняют оригиналы необходимых MDS, заполняют дату экспериментов, вносят требуемую информацию в таблицы и подписывают MDS.
6.12 Отчет об исследовании
Отчет об исследовании должен включать, по меньшей мере, следующие сведения:
- описание исследуемого материала(ов) или изделия;
- подробное описание метода, использованного при приготовлении исследуемых образцов;
- описание примененной модели RHE;
- копию сертификата контроля качества используемой партии тканей (предоставляется изготовителем модели RHE);
- описание протокола пробы, включая метод введения образца и время воздействия;
- запись наблюдений за тканями;
- все индивидуальные необработанные данные (например, OD для каждой лунки), связанные с определением жизнеспособности тканей;
- оценку результатов и классификацию испытуемых проб/образцов;
- примененный международный стандарт (включая год публикации);
- любые отклонения от процедуры;
- любые наблюдаемые необычные свойства;
- дату исследования.
7 Исследования раздражения in vivo
7.1 Общие положения
Исследование раздражающих свойств МИ, их компонентов, биоматериалов или всего вышеуказанного может проводиться на изделиях, их компонентах, самих биоматериалах или их экстрактах либо на всем вышеуказанном.
Факторы, влияющие на результаты исследований раздражения in vivo, включают следующее:
- природу изделия, используемого в кожной пробе;
- дозу исследуемого материала;
- способ нанесения исследуемого материала;
- степень окклюзии;
- место нанесения;
- количество и длительность воздействия;
- методы, применяемые при оценке исследования.
Дополнительная информация представлена в приложении F.
В то время как гибкость в отношении точного соблюдения протокола позволяет исследователю повысить чувствительность исследования в соответствии с условиями применения и воздействием на человека, последовательность процедуры способствует сопоставимости результатов исследований с различными материалами и из разных лабораторий.
В процедуры исследований были включены положения для оценки изделий и материалов, которые будут подвергаться либо повторному, либо длительному воздействию, либо и тому, и другому. Исследование должно быть предназначено для преувеличения ожидаемого контакта (либо по времени, либо по концентрации, либо и то, и другое) в клинической ситуации. Об этом необходимо помнить при интерпретации результата.
В исключительных случаях, когда требуется дальнейшая оценка/характеристика риска, возможно появление необходимости исследования материалов, которые либо являются раздражителем, либо имеют рН вне диапазона, обозначенного выше. Такие случаи должны быть обоснованы и отражены документально.
7.2 Исследование раздражения на кожу животных
7.2.1 Принцип
Проводят оценку способности исследуемого материала вызывать раздражение кожи на подходящей модели животного.
Кролик (Oryctolagus cuniculus) является предпочтительной моделью животного для данного исследования.
7.2.2 Исследуемые образцы
Если исследуемый образец является твердым или жидким веществом, то он должен быть подготовлен согласно приложению A.
Необходимо продемонстрировать чувствительность метода. Это достигается включением в процедуру исследования положительного контроля. Применение положительного контроля требуется только когда испытательная лаборатория не получила положительных результатов, используя метод испытания в течение предшествующих шести месяцев.
Примечание - Надлежащим положительным контролем является SDS, также известный как лаурилсульфат натрия (SLS).
7.2.3 Животные и условия их содержания
Следует использовать трех здоровых молодых взрослых кроликов-альбиносов любого пола одной линии массой не более 2 кг. Так как кожное раздражение не будет отличаться у самцов и самок, можно использовать животных любого пола. При этом самки должны быть нерожавшими и небеременными. При ожидаемом раздражении необходимо рассмотреть первоначальное исследование на одном животном. Если не наблюдается хорошо определяемой положительной реакции, превышающей 2 балла по шкале на эритему или эдему (см. таблицу 2), то должно быть использовано как минимум два дополнительных животных. Если реакция при исследовании с использованием трех животных является неоднозначной, то следует рассмотреть возможность продолжения дальнейшего исследования.
Животные должны быть акклиматизированы и получать уход согласно ISO 10993-2.
7.2.4 Процедура исследования
7.2.4.1 Подготовка животных
7.2.4.2 Нанесение исследуемой пробы
7.2.4.2.1 Нанесение пробы в форме порошка или жидкости
Наносят 500 мг или 500 мкл исследуемого материала непосредственно на каждый исследуемый участок кожи, как показано на рисунке 1. Для твердых и гидрофобных материалов увлажнение не требуется. Если материал в форме порошка, то он должен быть слегка увлажнен водой или другим подходящим экстрагентом перед нанесением (см. приложение A). Два участка наблюдения должны быть обработаны каждой исследуемой и контрольной пробами (см. рисунок 1).
1 - голова; 2 - исследуемая область; 3 - контрольная область; 4 - выстриженная дорсальная область; 5 - хвост
Рисунок 1 - Расположение областей для аппликации
7.2.4.2.2 Нанесение экстрактов и контролей экстрактов
Закрывают места нанесения повязкой (полуокклюзионной или окклюзионной) как минимум на 4 ч. По истечении времени контакта удаляют повязку и отмечают положения участков, используя несмываемый маркер, не являющийся раздражителем кожи. Удаляют остатки исследуемого образца подходящим способом, например промыванием теплой водой или другим подходящим раствором, и тщательно просушивают.
7.2.4.2.3 Нанесение твердой пробы
Нанесите образцы исследуемой пробы непосредственно на кожу каждого бока каждого кролика, как показано на рисунке 1. Таким же образом наносят контрольные образцы. При исследовании твердых образцов (которые могут быть измельчены в порошок) они должны быть достаточно увлажнены водой или, при необходимости, соответствующим раствором для обеспечения хорошего контакта с кожей (см. приложение A). При использовании растворов необходимо учитывать их влияние на раздражение кожи, вызванное исследуемым материалом.
7.2.5 Наблюдение за животными
7.2.5.1 Общие положения
Для визуальной оценки кожных реакций рекомендуется использовать естественное освещение или освещение со светом полного спектра.
Описывают и оценивают кожные реакции на предмет эритемы и эдемы согласно системе оценки, приведенной в таблице 2, для каждого места нанесения в каждом временном интервале и регистрируют результаты для отчета исследования.
Примечание - В определенных случаях могут помочь гистологические или неинвазивные техники оценки кожных реакций.
7.2.5.2 Исследование с однократной экспозицией
Для исследований однократного воздействия отмечают внешний вид каждого участка нанесения при (1±0,1) ч, (24±2) ч, (48±2) ч и (72±2) ч после удаления подушечек. При наличии устойчивых язв для оценки обратимости или необратимости процесса может потребоваться увеличение срока наблюдения до 14 дней. Животные должны наблюдаться как минимум раз в день в течение этого увеличенного срока.
7.2.5.3 Исследование с повторными экспозициями
Повторное воздействие можно проводить только после завершения исследования острого однократного воздействия [после как минимум (72±2) ч наблюдения]. Повторное воздействие должно ограничиваться предназначенным клиническим применением изделия.
Повторное воздействие после незначительной реакции в исследовании однократного воздействия должно быть обосновано.
Для исследований повторного воздействия отмечают внешний вид мест нанесения через (1±0,1) ч после удаления подушечек и сразу перед следующим нанесением. Количество воздействий может различаться.
После последнего воздействия отмечают внешний вид каждого места нанесения через (1±0,1), (24±2), (48±2) и (72±2) ч после удаления подушечек. При наличии устойчивых язв для оценки обратимости или необратимости процесса может потребоваться увеличение срока наблюдения до 14 дней. Животных следует наблюдать как минимум раз в день в течение этого увеличенного срока.
7.2.6 Оценка результатов
Реакции в различных временныхточках после нанесения должны оцениваться согласно таблице 2.
Таблица 2 - Система оценки кожной реакции
Реакция | Оценка раздражения |
Образование эритемы и струпа | |
Отсутствие эритемы | 0 |
Очень незначительная эритема (практически незаметная) | 1 |
Хорошо определяемая эритема | 2 |
Умеренная эритема | 3 |
Сильная эритема (свекольного цвета) до формирования струпа, мешающего оценке эритемы | 4 |
Образование отека (эдемы) | |
Отсутствие эдемы | 0 |
Очень незначительный отек (эдема, практически незаметная) | 1 |
Хорошо определяемый отек (эдема, определенно поднятые края хорошо определяются) | 2 |
Умеренный отек (эдема, поднятая примерно на 1 мм) | 3 |
Сильный отек (эдема, поднятая более чем на 1 мм и простирающаяся за пределы зоны воздействия) | 4 |
Максимально возможный балл раздражения | 8 |
Другие нежелательные явления на кожных участках должны быть отражены документально и сообщены. | |
Для исследований однократного воздействия определяют индекс первичного раздражения (PII) следующим способом.
Для вычислений используют только наблюдения через (24±2), (48±2) и (72±2) ч. Наблюдения, сделанные до введения или через 72 ч для мониторинга восстановления, не используют в данном определении.
После 72-часовой оценки все баллы эритемы, плюс баллы эдемы (24±2), (48±2) и (72±2) ч подсчитывают отдельно для каждого исследуемого образца и бланковой пробы для каждого животного. Основной балл раздражения на животное подсчитывают делением суммы всех баллов на 6 (два участка исследования/наблюдения, три временные точки).
Для получения первичного индекса раздражения для исследуемой пробы суммируют все основные баллы раздражения отдельных животных и делят на количество животных (как правило, три).
При использовании контроля экстрагента или отрицательного контроля вычисляют первичный балл раздражения для контролей и вычитают этот балл из балла с использованием исследуемого образца для получения первичного балла раздражения.
Для исследования при повторных воздействиях первичный балл раздражения для каждого животного следует вычислять по вышеуказанному принципу, учитывая все точки оценки. При повторных воздействиях определяют суммарный индекс раздражения следующим образом.
Складывают баллы раздражения всех животных и делят на общее количество животных. Данное значение является суммарным индексом раздражения.
Суммарный индекс раздражения сравнивают с категориями ответной реакции, приведенными в таблице 3, и соответствующую категорию ответа отражают в отчете.
Примечание - Категории раздражения основываются на данных, сравнивающих первичный индекс раздражения химическими веществами у кроликов с первичным индексом раздражения у человека на те химические вещества, которые были исследованы на обоих видах.
При любой ответной реакции отражают документально максимальный первичный балл раздражения, приведенный в таблице 3, для каждого животного, время начала реакции и время максимальной реакции.
Первичный или суммарный индекс раздражения характеризуется числом (баллом) и описанием (категорией ответа), приведенным в таблице 3. При исследовании разных экстрактов категорию ответа определяют экстрактом с самым высоким PII.
Таблица 3 - Категории первичного или суммарного индекса раздражения у кроликов
Средний балл | Категория ответной реакции |
0-0,4 | Незначительная |
0,5-1,9 | Легкая |
2-4,9 | Умеренная |
5-8 | Сильная |
7.2.7 Отчет об исследовании
Отчет об исследовании должен включать:
- описание исследуемого материала или материалов или изделия;
- предназначенное использование/применение исследуемого материала или материалов или изделия;
- детальное описание метода, применяемого при приготовлении исследуемого образца или исследуемого материала;
- описание исследуемого животного/животных;
- метод нанесения на исследуемые участки и тип (полуокклюзивный или окклюзивный) материала перевязки;
- как обозначались участки нанесения, проводилась оценка;
- записи наблюдений;
- количество воздействий и интервалы между ними, когда проводилось повторное воздействие;
- оценку результатов;
- примененный международный стандарт (включая год его публикации);
- любые отклонения от процедуры;
- любые наблюдаемые необычные свойства;
- дату исследования.
7.3 Исследование раздражения на животных при внутрикожном (интрадермальном) введении
7.3.1 Введение
Для МИ, контактирующих с поврежденной или подверженной опасности повреждения поверхностью, присоединяемых извне или имплантатов, рекомендуется исследование внутрикожной (интрадермальной) реактивности. Проводят оценку способности исследуемого образца вызывать раздражение после внутрикожной инъекции экстрактов из образца.
7.3.2 Исключение из исследования
7.3.3 Исследуемая проба
Исследуемая проба должна являться экстрактом, приготовленным в соответствии с приложением А. Так как на каждом животном находятся несколько участков для исследования, можно нанести несколько исследуемых проб вместе с соответствующими отрицательными контролями или контролем экстрактанта. Для данного исследования не существует положительного эталонного материала, тем не менее некоторые химикаты (SDS, гептановая кислота, молочная кислота, нонановая кислота) дадут положительную реакцию. Во избежание некроза кожи должны быть использованы низкие концентрации, вызывающие раздражение с интенсивностью >1 балла (см. 7.3.7). Применение положительного контроля для подтверждения чувствительности метода требуется только когда испытательная лаборатория не получала положительных результатов при использовании метода исследования за предыдущие шесть месяцев.
Некоторые МИ, такие как кожные наполнители (филлеры), следует осторожно дозировать, так как кожный наполнитель (филлер) останется в месте введения, его не следует путать с отеком.
7.3.4 Животные и условия их содержания
Следует использовать здоровых, молодых и взрослых кроликов-альбиносов любого пола одной линии массой не менее 2 кг. Так как не ожидается, что кожное раздражение будет различаться у самцов и самок, можно использовать любой пол. Используемые самки должны быть нерожавшими и небеременными. Животные должны быть акклиматизированы и получать уход согласно ISO 10993-2. Необходимо использовать как минимум трех животных для оценки исследуемого материала. При ожидаемом раздражении необходимо рассмотреть предварительное исследование на одном животном. Если не наблюдается хорошо определяемый положительный ответ, превышающий 2 балла по шкале оценки на эритему или отек (см. таблицу 4), то необходимо использовать минимум двух дополнительных животных. Если ответная реакция при исследовании с использованием минимум трех животных неоднозначна, то необходимо рассмотреть возможность дальнейшего исследования.
7.3.5 Процедура исследования
В течение периода от 4 до 18 часов до исследования коротко подстригают шерсть на спинах животных, оставляя достаточное расстояние с обеих сторон позвоночника для инъекции экстрактов.
Вводят внутрикожно 200 мкл экстракта, полученного при помощи полярного или неполярного экстрактанта, в пять участков на одном боку каждого кролика. Для внутрикожных инъекций используют самую маленькую иглу, соответствующую вязкости исследуемого образца.
Пример расположения мест инъекции приведен на рисунке 2.
Таким же образом вводят 200 мкл полярного или неполярного контроля экстрагента в пять участков противоположного бока каждого кролика (например, см. рисунок 2).
Если используют другие экстрагенты и контроли экстрагента, то повторяют вышеописанные действия.
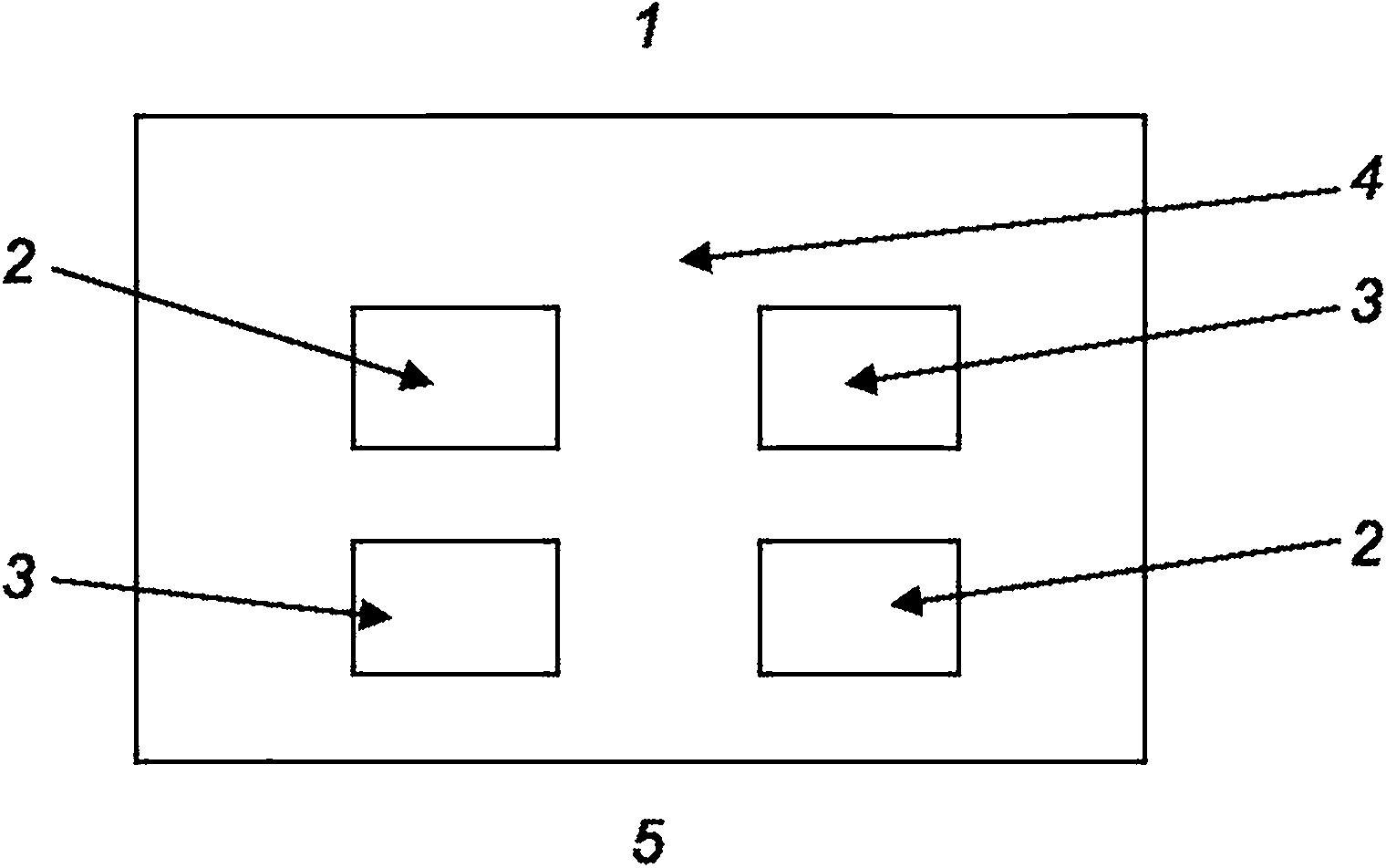 |
1 - голова; 2 - 200 мкл инъекции полярного экстракта; 3 - 200 мкл инъекции неполярного экстракта; 4 - 200 мкл инъекции контрольного полярного экстрагента; 5 - 200 мкл инъекции контрольного неполярного экстрагента; 6 - хвост
Рисунок 2 - Размещение мест инъекций
7.3.6 Наблюдение за животными
Отмечают внешний вид каждого места инъекции сразу после инъекции и через (24±2), (48±2) и (72±2) ч после инъекции.
Оценивают реакцию ткани на эритему и отек согласно системе, приведенной в таблице 4, для каждого места инъекции и при каждом наблюдаемом временном интервале и записывают результаты.
Примечание 1 - Интрадермальная инъекция масла часто вызывает воспалительную ответную реакцию.
Чтобы помочь оценить ответную реакцию для определения зоны раздражения, через (72±2) ч можно провести внутривенное введение подходящего витального красителя, такого как трипановый синий или синий Эванса.
Примечание 2 - Можно применять гистологические или неинвазивные методы при их наличии для помощи в оценке.
Таблица 4 - Система баллов для внутрикожной (интрадермальной) реакции
Реакция | Оценка раздражения |
Образование эритемы и струпа | |
Отсутствие эритемы | 0 |
Слабая эритема (практически незаметная) | 1 |
Четко выраженная эритема | 2 |
Умеренная эритема | 3 |
Резко выраженная эритема (свекольного цвета) свекольно-красного цвета до формирования струпа, мешающего оценке эритемы | 4 |
Образование отека (эдемы) | |
Отсутствие отека (эдемы) | 0 |
Слабый отек (эдема, практически незаметная) | 1 |
Четко выраженный отек (эдема) (края области отчетливо приподняты) | 2 |
Умеренный отек (эдема) (поднятие области примерно на 1 мм) | 3 |
Резко выраженный отек (эдема) (поднятие области более чем на 1 мм и распространение за пределы зоны воздействия) | 4 |
Максимально возможный балл раздражения | 8 |
Другие нежелательные изменения на участках кожи должны быть задокументированы и сообщены. | |
7.3.7 Оценка результатов
Итоговый балл, меньше или равный 1,0, будет классифицирован как нераздражитель in vitro в модели RHE.
Проба контроля экстрагента является полярным или неполярным контролем экстрагента, как указано на рисунке 2.
7.3.8 Отчет об исследовании
Отчет об исследовании должен включать следующую информацию:
- описание исследуемых материалов или изделия;
- предполагаемое использование/применение исследуемого материала/ов или изделия;
- подробное описание метода, использованного при приготовлении исследуемых образцов;
- описание подопытных животных;
- метод инъекции;
- как проводилась оценка местной реакции;
- запись наблюдений;
- оценку результатов;
- примененный международный стандарт (включая дату публикации);
- любые отклонения от процедуры;
- любые наблюдаемые необычные свойства;
- дату исследования.
8 Исследование раздражения на коже человека
8.1 Введение
Оценка потенциального риска раздражения также может быть проведена с использованием данных исследований накожных аппликаций на человеке.
Исследование на человеке может служить нескольким целям:
- прямая идентификация опасности для человека путем испытания химических веществ на людях, а не на лабораторных животных;
- предоставление оценки риска определенных химических веществ, контакт человека с которыми высок;
- облегчение экстраполяции на человека данных, полученных ранее в ходе лабораторных исследований на животных.
Настоящий стандарт позволяет получать данные о раздражении кожи непосредственно от людей для целей идентификации опасности. Его цель - определить, представляет ли материал или медицинское устройство значительную опасность раздражения кожи после острого воздействия.
Клинические исследования следует проводить в соответствии с ISO 14155. Дополнительные конкретные требования к клиническим исследованиям описаны в приложении Е.
Примечание - Приложение F приводит дальнейшую информацию по исследованиям раздражения.
8.2 Предварительная оценка
Адекватная информация по профилю токсичности материала или МИ и (где применимо) составляющих его химических веществ, включая данные чрезкожной абсорбции, должны быть доступны, чтобы обозначить, что исследование не представляет какого-либо значительного риска для здоровья.
Материалы не должны быть исследованы на людях, если:
- было показано, что они являются раздражителем в прогностической пробе, in vitro или in vivo.
Примечание - В отдельных ситуациях может быть необходимым провести дополнительные исследования образцов раздражителей/экстрактов продуктов на людях для дальнейшей характеристики потенциального риска для человека;
- было показано, что они вызывают коррозию в прогностическом анализе, либо in vitro, либо in vivo;
- потенциальная коррозионная активность для кожи человека может быть предсказана либо на основе взаимосвязи структуры и активности, либо на основе физико-химических свойств, таких как сильный кислотный или щелочной показатель, либо и то, и другое;
- они представляют риск сенсибилизации кожи или респираторного тракта;
- они представляют любую острую токсичную опасность при условиях исследования;
- они представляют любую генотоксичную, репродуктивную или канцерогенную опасность.
Приложение A
(обязательное)
Подготовка образцов для исследования на раздражение
A.1 Общие положения
При проведении исследований на раздражение и интерпретации полученных данных необходимо учитывать характер, степень, частоту, длительность и другие условия воздействия МИ на человека. Одним из важнейших параметров в этих исследованиях является подготовка исследуемых образцов. Настоящее приложение приводит общую информацию по приготовлению исследуемых проб для исследования раздражения как in vitro, так и in vivo. Применимость и использование различных типов исследуемых проб описываются в соответствующих разделах настоящего стандарта.
A.2 Образцы для воздействия прямым контактом
A.2.1 Твердые исследуемые образцы
Для обеспечения хорошего контакта с тканями твердое вещество может быть измельчено в порошок, соблюдая осторожность для предотвращения контаминации, или достаточно увлажнено водой или подходящим нераздражающим раствором. В случае керамики, где требуется измельчение, необходимо помнить, что физико-химические свойства керамики могут быть изменены, что может оказать заметное влияние на биологическую активность.
Порошки (например, супер-абсорбенты) необходимо исследовать прямым осаждением или превращением в массу в подходящем растворителе. Контроль, использующий тот же растворитель, должен быть оценен параллельно с увлажненным, разведенным или суспендированным исследуемым материалом.
Примечание - Площадь поверхности либо размер частиц, либо и то, и другое являются важными факторами для биологических ответов, таких как фагоцитоз, который играет важную роль в воспалительных и иммунных реакциях.
A.2.2 Жидкие исследуемые образцы
Жидкости необходимо исследовать непосредственно неразбавленными или, если это целесообразно, разбавленными подходящим раствором. Контроль, использующий тот же растворитель, следует оценивать параллельно с разбавленной исследуемой жидкостью.
A.3 Экстракты из исследуемых образцов
Твердый материал может быть исследован путем приготовления экстракта. При исследовании экстрактов таковые должны быть приготовлены в соответствии с ISO 10993-12 с применением полярных, неполярных и/или дополнительных растворителей при необходимости. Необходимо предоставить обоснование выбора метода экстракции.
Бланковый образец с использованием экстрагирующего растворителя должен быть оценен параллельно с экстрактом исследуемого материала.
A.4 Растворы
Если исследуемый образец должен быть экстрагирован, разбавлен, суспендирован или увлажнен, то необходимо использовать подходящий нераздражающий раствор. В ISO 10993-12 приведен список надлежащих растворов.
A.5 Стерильные исследуемые образцы
Если готовое изделие поставляется в стерильном состоянии, то исследуемые образцы должны быть простерилизованы тем же способом до исследования. Изделия, стерилизуемые этиленоксидом, представляют техническую проблему, так как этиленоксид и продукты его реакции могут произвести биологический ответ в исследованиях, приведенных в настоящем стандарте.
Чтобы можно было провести различие между эффектами, вызванными исследуемым образцом, или остаточными количествами окиси этилена, когда наблюдается раздражающая реакция, следует учитывать оценку реакции на образец до и после стерилизации окисью этилена.
Приложение B
(справочное)
Этапы (процедура) исследования раздражения in vitro с использованием моделей реконструированного эпидермиса человека
- Подготавливают исследуемую и контрольную пробы в качестве экстрактов в полярном (солевом) и неполярном (кунжутное масло) экстрагенте до получения ткани, как правило, за (48-72) ч до получения тканей RHE в зависимости от необходимых предварительных инкубации тканей RHE. Время экстракции и температура должны быть обоснованы в соответствии с ISO 10993-12.
Примечание - В обширном анализе по циклической системе для оценки RHE для оценки раздражения экстрактов МИ применялись полимеры с добавками (PVC и силикон), а экстракция проводилась при температуре (37±1)°C в течение (72±2) ч при непрерывном взбалтывании/встряхивании.
- Получение: переносят эпидермис со среды транспортных планшетов на поддерживающую среду.
- Если в испытание не включены экстракты материалов положительного контроля, то в день эксперимента добавляют положительный контроль (SDS) в полярный (солевой) экстрагент в установленных концентрациях. Можно применять более низкие концентрации (например, от 0,25% до 0,5%) в качестве положительного контроля после подтверждения приемлемости и положительных результатов (см. [17], [19]).
- Используют отрицательный контроль, положительный контроль, контроли экстрагентов и исследуемых проб (экстрактов из исследуемых образцов) при объеме 100 мкл на поверхности ткани.
- Прерывают обработку промыванием DPBS или PBS.
Примечание - Перед оценкой жизнеспособности RHE культуральная среда ниже вкладки может быть собрана для дополнительного определения цитокинов.
- Подготавливают раствор МТТ и инкубационные планшеты МТТ.
- Переносят ткани в раствор МТТ.
- Переносят и погружают в среду для экстракции формазаном (изопропанолом).
- Экстракция формазаном: не меньше 2 ч при комнатной температуре или на ночь, герметично закрытая, при комнатной температуре.
- Встряхивают и гомогенизируют.
- Переносят образовавшийся раствор в 96-луночный планшет.
- Измеряют OD, используя планшетный спектрофотометр.
Порядок действий, приведенный выше, содержится в таблице В.1.
Таблица В.1 - Процедура исследования на раздражение с применением реконструированного эпидермиса человека
Время | Порядок действий |
От минус 48 ч до 72 ч | Подготавливают полярный и неполярный экстракты (37±1)°C |
Получение тканей | |
Преинкубируют ткани согласно инструкциям изготовителя (например, от 2 ч до 24 ч) | |
Начало исследования Т=0 ч | Применяют NC, PCs, VCs и исследуемые образцы в объеме 100 мкл на поверхности ткани |
Инкубация T=18 ч или T=24 ч | Инкубируют при температуре (37 ±1)°C и (5 ±1)% во влажной атмосфере инкубатора в течение ночи (например, 18-24 ч, в зависимости от изготовителя) |
Конец инкубации Следующий день | Прерывают обработку промыванием DPBS или PBS |
Измерение жизнеспособности | Подготавливают раствор МТТ |
Переносят ткань в раствор МТТ | |
Инкубация МТТ T=3 ч | Инкубируют ткани в течении 3 ч ±5 мин при температуре (37 ±1)°C и (5 ±1)% во влажной атмосфере инкубатора |
Обнаружение формазана | Подготавливают раствор экстракции МТТ с изопропанолом |
Экстракция формазаном T=2 ч | Инкубируют ткани, по меньшей мере, 2 ч или на ночь при комнатной температуре в изопропаноле |
Встряхивают и гомогенизируют после экстракции формазаном | |
Переносят экстрагированный раствор формазана на 96-луночный планшет | |
Измерение | Измеряют OD при помощи спектрофотометра |
Приложение C
(справочное)
Пример формы документации процедуры исследования с использованием моделей реконструированного эпидермиса человека
Номер исследования: | ||||||||||||
Дата: | ||||||||||||
Имя файла данных в формате XLS: | ||||||||||||
Проведено: | Подписи: | |||||||||||
Временной протокол (см. таблицу C.1) | ||||||||||||
Получение тканей RHE (дата, день, час): | ID: | |||||||||||
Изготовитель/поставщик: | ||||||||||||
Таблица C.1 - Протокол этапов по времени
Этап | Дата (день-месяц-год) | Первая серия | Вторая серия | ||
начало | конец | начало | конец | ||
Предварительная инкубация (от 2 до 24 ч) | |||||
Воздействие (18±1) ч (24±2) ч | |||||
Промывание | |||||
Исследование МТТ 3 ч ±5 мин | |||||
Экстракция как минимум 2 ч | |||||
Измерение | |||||
Проверка оборудования
Проверка оборудования должна быть включена в систему качества лаборатории, проводящей исследование. Необходимо отразить документально такие параметры исследования, как инкубатор, рефрижератор и условия водяной бани. Аспекты качества оборудования и лабораторных принадлежностей (например, пипеток) должны быть отражены документально.
Эффективность исследования
Эффективность исследования приведена в таблице C.2.
Таблица C.2 - Компоненты для исследования
Поставщик реконструированного эпидермиса, номер партии: | Дата производства: |
Среда пробы, номер партии: | Срок годности: |
Концентрат МТТ, номер партии: | Срок годности: |
Разбавитель МТТ, номер партии: | Дата производства: |
Изопропанол (экстрактант МТТ), номер партии: | Срок годности: |
(D)PBS, номер партии: | Срок годности: |
Другие замечания: | |
Идентификационный номер ID/Дата:
Визуальный контроль качества кожи приведен в таблице C.3.
Таблица C.3 - Визуальный контроль качества кожи
Внешний вид | Набор 1 | Набор 2 |
Макро. | ||
Количество исключенных тканей: - с дефектами краев; - пузырьками воздуха; - обширной влагой на поверхности. | ||
Используйте баллы: 1 - очень хорошо, 2 - хорошо, 3 - приемлемо, 4 - неприемлемо. | ||
Специфические наблюдения:
Растворы и экстрагенты
Наполненный химический положительный контроль.
Солевой раствор SDS 1% (об/об), приготовленный из 20% раствора SDS: в день исследования следует приготовить свежие растворы 1% SDS в физиологическом растворе и кунжутном масле путем смешивания 10 мкл 20% SDS с 1,9 мл экстрагента. Тщательно перемешивают вихревым способом после приготовления и перед нанесением на поверхность ткани. Срок годности истекает в тот же день.
- эталон 20% базового раствора SDS, партия N: | ; | |||
- физиологический раствор (0,9% NaCI), партия N: | ; | |||
- дата приготовления: | ||||
Приготовление физиологического раствора (0,9% NaCI):
- Наименование NaCI, партия N: | ||||
- Способ стерилизации: | ||||
- Дата приготовления: | ||||
- Срок действия: | ||||
Приготовление раствора (D)PBS:
- Наименование концентрата (D)PBS, партия N: | |||||||
- Корректировка pH (до 7,0): | |||||||
- Способ стерилизации: | |||||||
- Дата приготовления: | |||||||
- Срок действия: | |||||||
Кунжутное масло:
- Наименование, партия N: | |||
- Срок действия: | |||
Замечания по отдельным тканям
При наблюдении каких-либо отклонений во время исследований, замене тканей или любой технической проблеме отмечают это в таблице C.4.
Регистрируют номер ткани, код образца и наблюдение или примечание.
Таблица C.4 - Замечания по отдельным тканям
Код образца | Номер ткани | Примечания |
Идентификационный номер ID/Дата:
Спектрофотометрическое измерение
Конфигурация планшета для считывания
Регистрируют расположение проб на 96-луночном планшете. Строго придерживаются установленного дизайна планшета согласно указаниям изготовителя. Примеры схемы планшета при использовании исследования МИ по круговой системе для исследования раздражения (см. [6]) приведены в таблицах C.5 и C.6.
Включают ридер за 10 мин до измерения или согласно инструкции по эксплуатации.
Таблица C.5 - Модель EpiDerm RHE
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | ||
A | bckg | bckg | bckg | bckg | bckg | bckg | |||||||
B | NC | PC | VC1 | VC2 | TA1 | TA2 | TA3 | TA4 | TA5 | TA6 | TA7 | TA8 | Ткань 1 |
C | NC | PC | VC1 | VC2 | TA1 | TA2 | TA3 | TA4 | TA5 | TA6 | TA7 | TA8 | |
D | NC | PC | VC1 | VC2 | TA1 | TA2 | TA3 | TA4 | TA5 | TA6 | TA7 | TA8 | Ткань 2 |
E | NC | PC | VC1 | VC2 | TA1 | TA2 | TA3 | TA4 | TA5 | TA6 | TA7 | TA8 | |
F | NC | PC | VC1 | VC2 | TA1 | TA2 | TA3 | TA4 | TA5 | TA6 | TA7 | TA8 | Ткань 3 |
G | NC | PC | VC1 | VC2 | TA1 | TA2 | TA3 | TA4 | TA5 | TA6 | TA7 | TA7 | |
H |
где bckg - раствор изопропанола для измерения фона;
NC - отрицательный контроль ((D) PBS);
PC - положительный контроль (раствор SDS (PC));
VC - контроль экстрагента [например, физиологический раствор (VC1) и кунжутное масло (VC2)];
TA1 ... TA7 - испытуемые пробы 1-7.
Таблица C.6 - Модель SkinEthic RHE
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
A | bckg | bckg | bckg | bckg | bckg | bckg | пустой | пустой | пустой | пустой | пустой | пустой |
B | NC | NC | NC | NC | NC | NC | NC | NC | NC | пустой | пустой | пустой |
C | NaCI | NaCI | NaCI | NaCI | NaCI | NaCI | NaCI | NaCI | NaCI | пустой | пустой | пустой |
D | SO | SO | SO | SO | SO | SO | SO | SO | SO | пустой | пустой | пустой |
E | PC | PC | PC | PC | PC | PC | PC | PC | PC | пустой | пустой | пустой |
F | NaCl 1 | NaCI 1 | NaCI 1 | NaCI 1 | NaCI 1 | NaCI 1 | NaCI 1 | NaCI 1 | NaCI 1 | пустой | пустой | пустой |
G | SO 1 | SO 1 | SO 1 | SO 1 | SO 1 | SO 1 | SO 1 | SO 1 | SO 1 | пустой | пустой | пустой |
H | NaCI 2 | NaCI 2 | NaCI 2 | NaCI 2 | NaCI 2 | NaCI 2 | NaCI 2 | NaCI 2 | NaCI 2 | пустой | пустой | пустой |
Ткань 1 | Ткань 2 | Ткань 3 | ||||||||||
где bckg - раствор изопропанола для фонового измерения;
NC - отрицательный контроль ((D) PBS контроль экстрагента);
SO - контроль экстрагента, кунжутное масло;
PCNACL - положительный контроль образца в экстрактанте (NaCI);
PCSO - положительный контроль образца в экстрактанте (кунжутное масло);
NaCl - трижды по 200 мкл пробы изопропанола для каждой инкубации ткани исследуемого образца 1;
SO 1 - трижды по 200 мкл пробы изопропанола для каждой инкубации ткани исследуемого образца 1.
Проверка длины волны
Обозначают галочкой (V) правильную настройку фильтра в таблице C.7.
Таблица C.7 - Настройка фотометра
Длина волны: 570 (от 550 нм до 570 нм) |
Идентификационный номер ID/Дата:
Архивирование
Необработанные данные сохранены в/как:
Развернутая таблица сохранена в/как:
MDS сохранен в/как:
Характеристика исследуемых образцов (см. таблицу С.8)
Лаборатория: | Исследование N: | Проба N: |
Таблица С.8 - Приготовление и инкубация исследуемых образцов
Название или код исследуе- мого материала | Исполь- зуемое количество образца | Объем добавлен- ного экстракта | Инкубатор | Время помещения | Время изъятия | Внешний вид до и после экстракции |
Идентификационный номер ID/Дата:
Приложение D
(обязательное)
Специальные исследования на раздражение
D.1 Общие положения
Существуют следующие специальные исследования на раздражение. Данные исследования применимы для МИ, предназначенных для применения в специфических областях. При применении необходимо предоставить обоснование для выбора метода исследования.
D.2 Исследование глазного раздражения
D.2.1 Общие положения
Исследование глазного раздражения должно рассматриваться только если данные по безопасности не могут быть получены другими способами и только для материалов, входящих в контакт с глазом или веком.
OECD 405 по острому глазному раздражению/коррозии (см. [29]) описывает пошаговую стратегию исследования in vivo для определения свойств химических веществ, раздражающих/корродирующих глаз. Используя эту стратегию, а также анализ по совокупности доказательств (когда вся доступная информация по способности к раздражению глаз рассматривается до перехода к исследованию in vivo), важно избегать необоснованного использования животных. Сокращение исследований веществ, приводящих к выраженной реакции у животных, содействует сбережению животных и надежности научных данных. Хотя TG 405 является методом исследования in vivo, он также поддерживает принцип 3 Rs в сокращении и улучшении исследований на животных. Данное исследование не было валидировано для экстрактов МИ.
D.2.2 Альтернативное исследование глазного раздражения in vitro
Было оценено несколько альтернативных методов исследований на глазное раздражение in vitro. Тем не менее, они еще не были валидированы для применения в исследованиях МИ. Ни одно исследование in vitro не способно заменить исследование глазного раздражения in vivo, охватывая все конечные точки in vivo. Тем не менее стратегические комбинации нескольких альтернативных методов исследования внутри (многоуровневой) стратегии исследования могут быть способны заменить глазной тест Дрейза (Draize). Возможная концептуальная схема для такой (многоуровневой) стратегии исследования была разработана для химических веществ в рамках рабочей группы EURL ECVAM (см. [23]). Схема основана на альтернативных методах глазного раздражения, которые различаются их способностью определять серьезные раздражающие вещества (ЕС R41; GHS "Категория 1"), либо вещества, считающиеся нераздражающими (ЕС "неклассифицируемые" GHS. Нет категории). Согласно этой схеме весь диапазон раздражимости может быть решен путем распределения исследований в многоуровневой стратегии, которая может применяться с любого конца: для определения первых серьезных раздражителей и решения отсутствия раздражимости (подход сверху вниз) или для процедуры в обратном порядке, начиная с определения нераздражителей (подход снизу вверх). Легкая степень раздражения допустима на последнем уровне при применении обоих подходов.
Уже существует несколько руководств OECD по исследованиям, основывающимся на методах in vitro, связанных с конечной точкой "глазное раздражение": OECD 437:2020, OECD 438:2017, OECD 460:2017, OECD 491:2020 и OECD 492:2017. Эти руководства для определения раздражающей активности химических веществ основываются на валидированных (Межведомственным координационным комитетом по валидации альтернативных методов - ICCVAM, EURL ECVAM, Японским центром по валидации альтернативных методов - JaCVAM или другими) исследованиях in vitro. В этих руководствах описаны следующие методы: метод исследования помутнения и проницаемости роговицы крупного рогатого скота (см. OECD 437), метод исследования на изолированном глазе цыпленка (см. OECD 438), метод исследования проницаемости флуоресцеина с использованием клеток, растущих на полупроницаемой мембране (см. OECD 460), и метод исследования краткосрочного воздействия in vitro (см. OECD 491), состоящий из основанной на цитотоксичности пробы in vitro, которая проводится на конфлюэнтном монослое клеток роговицы кролика (SIRC), и исследования с применением реконструированного человеческого роговицеподобного эпителия, так называемого, исследования реконструированного человеческого роговицеподобного эпителия (RHCE) (см. OECD 492). Ни одно из данных исследований OECD не было валидировано для МИ.
D.2.3 Принцип
Проводят оценку способности исследуемого материала вызывать глазное раздражение.
D.2.4 Исключения из исследования
В исключительных случаях, когда требуется дальнейшая характеризация/оценка риска, может возникнуть необходимость исследовать материалы, являющиеся минимально раздражающими. Такие случаи должны быть обоснованы и отражены документально.
D.2.5 Исследуемые образцы
Если образец является жидкостью, то вводят 100 мкл без разбавления в нижний конъюнктивальный мешок одного глаза.
Если образец является твердым или гранулированным продуктом, то его измельчают в мелкий порошок. После осторожного утрамбовывания вводят количество, занимающее объем в 100 мкл и массой не более чем 100 мг, в нижний конъюнктивальный мешок одного глаза.
Примечание - Некоторые изделия не подходят для исследования непосредственно на глазе. Механические повреждения могут привести к бесполезности исследования.
Если исследуемый образец содержится в пульверизаторе, то выпускают и вводят 100 мкл как для жидкостей.
Если исследуемый образец содержится в аэрозольном контейнере, то исследуют
- либо однократным распылением длительностью 1 с на расстоянии 10 см, направленным в открытый глаз или
- перемещением аэрозоля в прохладный контейнер и обращением с ним, как с жидкостью.
Если исследуемый образец таков, что может быть нанесен только как экстракт, то экстракты подготавливают в соответствии с приложением А. Вводят 100 мкл аликвот экстракта в нижний конъюнктивальный мешок одного глаза.
При условиях, идентичных примененным выше, подготавливают бланковую жидкость, используя как полярный, так и неполярный растворитель, без исследуемого образца.
D.2.6 Животные и условия их содержания
Следует использовать здоровых молодых взрослых кроликов альбиносов любого пола одной линии массой не менее 2 кг. Так как не ожидается, что глазное раздражение будет отличаться у самцов и самок, можно использовать один пол. При выборе самок они должны быть нерожавшими и небеременными.
Животные должны быть акклиматизированы и содержаться согласно ISO 10993-2.
Изначально для оценки исследуемого образца необходимо использовать одно животное. Отчетливо определяемый положительный ответ (см. таблицу D.1) исключает необходимость дополнительного исследования. Для материалов, которые, как ожидается, не вызовут выраженного глазного раздражения (например, растворов для контактных линз, хорошо охарактеризованных, не цитотоксичных материалов или других, с научно подтвержденным отсутствием раздражающих свойств), изначально можно проводить исследования на трех кроликах без предварительного скрининга на одном кролике.
Если реакции на твердые или жидкие образцы не наблюдаются (см. таблицу D.1), то следует использовать как минимум еще двух животных. Для экстрактов следует использовать как минимум еще двух животных на один экстракт.
Если ответная реакция с использованием минимум трех животных неоднозначная или неясная, то следует рассмотреть возможность дополнительного исследования.
D.2.7 Процедура исследования
Не ранее, чем за 24 ч до начала исследования визуально осматривают оба глаза каждого кролика на предмет глазных аномалий. Если у любого глаза есть признаки аномалий, то кролика необходимо заменить.
После осмотра глаз можно использовать флюоресцин натрия 2% Британской Фармакопеи (ВР) (см. [38]) или эквивалент для визуализации какого-либо повреждения роговицы. Рекомендуется использовать офтальмоскоп, ручную щелевую лампу или другое подходящее устройство.
Вводят исследуемый образец, как обозначено в D.2.5, в один глаз.
После введения веки держат вместе примерно 1 с.
Контралатеральный глаз каждого животного служит контролем и должен обрабатываться бланковой жидкостью или, при исследовании экстракта, бланковым контролем. В качестве бланка можно использовать воду или физраствор, если исследуемые образцы находятся в неразбавленном виде.
Если ожидается повторное воздействие материала, а исследуемый материал не показал значительного ответа на острое исследование, то может быть проведено исследование повторного воздействия. Повторное воздействие должно проводиться только после завершения исследования острого воздействия спустя как минимум (72±2) ч. Продолжительность воздействия должна соответствовать продолжительности использования исследуемого образца/устройства в клинической практике.
D.2.8 Наблюдение за животными
У животных, получающих однократное введение исследуемого материала, осматривают оба глаза каждого животного примерно через (1±0,1), (24±2), (48±2) и (72±2) ч после введения.
При наличии устойчивых изъязвлений, для определения прогресса или обратимости изъязвлений, может потребоваться продленное наблюдение, которое не должно превышать 21 д. Продленное наблюдение для животных с тяжелыми изъязвлениями не оправданно.
Примечание - ISO 9394 приводит руководство для исследования контактных линз, которое требует воздействие по 8 ч в день в течение 21 дня. Это исключение из правил [1].
Оценивают и отражают документально любые наблюдаемые реакции в соответствии с оценочной шкалой глазных изъязвлений, приведенной в таблице D.1.
Таблица D.1 - Система оценки повреждений глаз
Реакция | Балл |
a) Роговица | |
1) Степень помутнения (по самой плотной зоне) | |
Без помутнения | 0 |
Отдельные или рассыпанные участки, радужная оболочка детально видна | 1 |
Легко определяемые прозрачные участки, детали радужной оболочки частично неразличимы | 2 |
Опалесцирующие участки, детали радужной оболочки неразличимы, размер зрачка едва различим | 3 |
Непрозрачная, детали радужной оболочки неразличимы | 4 |
2) Пораженная область роговицы | |
Одна четверть (или меньше), не отсутствует | 0 |
Больше, чем одна четверть, но меньше, чем половина | 1 |
Больше, чем половина, но меньше, чем три четверти | 2 |
Больше, чем три четверти, вплоть до всей площади | 3 |
b) Радужная оболочка | |
1) Нормальная | 0 |
Складки выше нормы, гиперемия, перикорнеальная инъекция (все вместе, по отдельности или сочетание), радужная оболочка все еще реагирует на свет (вялая положительная реакция) | 1 |
Отсутствие реакции на свет, геморрагия, серьезные повреждения (любое из них или все вместе) | 2 |
c) Конъюнктива | |
1) Покраснение (относится к пальпебральной и бульбарной конъюнктивам, исключая роговицу и радужную оболочку) | |
Сосуды нормальные | 0 |
Сосуды инъеционированы выше нормы | 1 |
Более диффузное, насыщенно малиново-красная, отдельные сосуды трудно различимы | 2 |
Диффузное, выраженное красное | 3 |
2) Хемоз | |
Без опухания | 0 |
Любое опухание выше нормы (включая мигательную перепонку) | 1 |
Явное опухание с частичным выворотом век | 2 |
Опухание с полузакрытыми веками | 3 |
Опухание от полузакрытых до полностью закрытых век | 4 |
3) Выделения | |
Без выделений | 0 |
Любое количество, отличающееся от нормального (не включает незначительные количества, наблюдаемые во внутреннем углу глаза у здоровых животных) | 1 |
Выделения с увлажнением век и волосков, непосредственно прилегающих к векам | 2 |
Выделения с увлажнением век и волосков, а также значительной зоны вокруг глаз | 3 |
Положительный результат. | |
У животных, получающих многократные введения исследуемого материала, осматривают оба глаза каждого животного непосредственно до и через (1±0,1) ч после каждого введения.
Если есть признаки раздражения после последнего введения, то наблюдение может быть продлено. При стойком поражении роговицы или другом раздражении глаз может потребоваться длительное наблюдение, чтобы определить развитие поражений и их обратимость.
Оценивают и отражают документально любые наблюдаемые реакции в соответствии с таблицей D.1.
Немедленно выводят животное из исследования и подвергают эвтаназии, если у него наблюдаются:
- очень тяжелое глазное повреждение (например, отслаивание и изъязвление конъюнктивальной мембраны, перфорация роговицы, кровь или гной в передней камере);
- кровяные или гнойные выделения;
- значительное изъязвление роговицы.
Выводят из исследования любое животное с максимальной ответной реакцией по шкале, приведенной в таблице D.1, т.е.:
- отсутствие светового рефлекса (ответ радужной оболочки 2 степени) или непрозрачность роговицы (4 степень) без признаков восстановления в течение (24±2) ч или
- максимальное воспаление конъюнктивы (хемоз 4 степени вместе с покраснением 3 степени) без признаков восстановления в течение (48±2) ч
и подвергают эвтаназии.
D.2.9 Оценка результатов
D.2.9.1 Общие положения
Различия между исследуемым и контрольным глазами должны быть охарактеризованы и описаны с точки зрения системы оценки, приведенной в таблице D.1.
D.2.9.2 Острое воздействие
Если обработанный глаз демонстрирует положительную реакцию у более чем одного животного (см. таблицу D.1) при каком-либо из наблюдений, то материал считается глазным раздражителем и дальнейшее исследование не требуется.
Если только один из трех обработанных глаз демонстрирует легкую или умеренную реакцию или если реакция неоднозначна, то используют дополнительных животных.
После обработки дополнительных животных исследуемый материал признается глазным раздражителем, если более чем половина обработанных глаз в исследуемой группе показывает положительный результат (см. таблицу D.1) на любой стадии наблюдения.
Резко выраженная реакция только у одного животного считается достаточной для признания материала глазным раздражителем.
D.2.9.3 Повторное воздействие
Исследуемый материал считается глазным раздражителем, если более половины животных в исследуемой группе показали положительный результат (см. таблицу D.1) при любой стадии наблюдения.
D.2.10 Отчет об исследовании
Отчет об исследовании должен включать следующую информацию:
- примененный международный стандарт (включая дату публикации);
- описание исследуемых образцов;
- предполагаемое использование/применение исследуемых образцов;
- подробное описание метода, использованного при приготовлении исследуемых образцов;
- описание подопытных животных;
- метод введения;
- как проводилась оценка ответной реакции;
- запись наблюдений;
- оценку результатов;
- любые отклонения от процедуры;
- любые наблюдаемые особенности;
- дату исследования.
D.3 Исследование раздражения на слизистой ротовой полости
D.3.1 Общие положения
Исследование раздражения полости рта должно рассматриваться только для материалов с предназначенным контактом с тканями полости рта, если данные по безопасности не могут быть получены другими способами. Также, как и модели in vitro реконструированного эпидермиса человека, теперь существуют и модели слизистой in vitro. Это включает применение восстановленных структур слизистой человека (см. [10]). Тем не менее они еще не были утверждены для использования в исследовании МИ.
D.3.2 Принцип
Проводят оценку потенциала исследуемого материала вызывать раздражение ткани полости рта.
D.3.3 Исключение из исследования
В исключительных случаях, когда требуется дальнейшая оценка/характеристика риска, может стать необходимым испытать материалы, которые либо являются раздражителем, либо имеют рН вне диапазона, обозначенного выше. Такие случаи должны быть обоснованы и отражены документально.
D.3.4 Исследуемый образец
Подготавливают исследуемые образцы в соответствии с приложением A.
D.3.5 Животные и условия содержания
Следует использовать здоровых молодых и взрослых сирийских хомяков любого пола из одной неродственной линии. Животные должны быть акклиматизированы и содержаться согласно ISO 10993-2.
В дополнение к вышесказанному, по необходимости, надевают подходящий ошейник шириной от 3 мм до 4 мм на шею каждого животного, чтобы он не мешал нормальному питанию и дыханию, но предотвращал удаление ватного шарика животным. Взвешивают каждое животное ежедневно в течение 7 дней во время периода исследования. Осматривают каждое животное с потерей массы тела и корректируют его ошейник по необходимости. Если животное продолжает терять массу тела, то его исключают из исследования.
Первоначально для оценки исследуемых образцов следует использовать как минимум трех животных.
Примечание - Может быть применимо использование дополнительных животных, обработанных отрицательным контролем или контролем экстрагента.
Если ответ в первоначальном исследовании неоднозначен или неясен, то следует рассмотреть возможность проведения дополнительного исследования.
D.3.6 Процедура исследования
У каждого животного выворачивают защечные мешки. Промывают мешки физиологическим раствором и осматривают на предмет любых аномалий.
Для твердых исследуемых материалов помещают образец (диаметром не больше, чем 5 мм) напрямую в защечный мешок.
Для жидких исследуемых материалов или образцов экстракта мочат ватный шарик образцом, записывают впитанный объем и помещают шарик в один мешок каждого животного. В качестве альтернативы необходимый объем образца может быть залит в защечный мешок.
В другой защечный мешок, который будет служить контролем процедуры, образец не помещают. По необходимости, животные отрицательного контроля могут исследоваться параллельно, также получая контроль процедуры.
Когда требуется, снова надевают ошейник и возвращают животное в клетку.
Длительность воздействия должна соответствовать ожидаемой при использовании материала, но не менее 5 мин.
После воздействия удаляют ошейник и ватный шарик, промакивают мешок физраствором, стараясь не затронуть другой мешок.
При остром воздействии повторяют вышеописанную процедуру каждый час (±0,1 ч) в течение 4 ч. Другие схемы обработки (например, основанные на клиническом применении) должны быть обоснованы и отражены документально.
При проведении исследований с повторным воздействием количество нанесений, их длительность и интервал между ними основываются на времени воздействия, ожидаемом в клинической практике.
D.3.7 Наблюдение за животными
Осматривают мешки макроскопически после удаления шариков. Перед повторным воздействием следует осмотреть макроскопически мешки.
Описывают внешний вид защечных мешков у каждого животного и оценивают реакции поверхности мешка на предмет эритемы по системе, приведенной в таблице D.2 для каждого животного в каждый временной интервал. Записывают результаты для отчета об исследовании.
Через (24±2) ч после последней обработки осматривают защечные мешки макроскопически, проводят эвтаназию и отбор образцов тканей из репрезентативных областей мешков. Помещают образцы тканей в соответствующий фиксатор для гистологического изучения.
Таблица D.2 - Макроскопическая система оценки реакций слизистой оболочки
Реакция | Балл |
Эритема и формирование струпа | |
Отсутсвие* эритемы | 0 |
Очень незначительная эритема (едва заметная) | 1 |
Четко выраженная эритема | 2 |
Умеренная эритема | 3 |
Резкая эритема (свекольно-красная) с образованием струпа, мешающего оценке эритемы | 4 |
Другие негативные изменения тканей должны быть отражены документально и включены в отчет. | |
D.3.8 Оценка результатов
D.3.8.1 Макроскопическая оценка
Сравнивают обработанный защечный мешок с контралатеральным защечным мешком с мешками животных в контрольной группе.
Баллы (см. таблицу D.2) суммируют для каждого наблюдения и сумму делят на количество наблюдений для определения среднего балла на животное.
Примечания:
1 Эти наблюдения могут помочь при гистологической оценке.
2 Наблюдения, сделанные до первого нанесения исследуемого образца, не включаются в средний балл.
D.3.8.2 Гистологическая оценка
Раздражающие эффекты на ткань ротовой полости должны быть оценены патологоанатом (морфологом) при помощи микроскопа. Оценивают каждую ткань по системе, приведенной в таблице D.3.
Баллы для микроскопической оценки всех животных в исследуемой группе суммируют и сумму делят на количество наблюдений для получения среднего балла исследуемой группы. Повторяют для контрольной группы или групп. 16 является максимальным баллом.
Для микроскопической оценки в контрольном защечном мешке общий балл, превышающий девять, может указывать на скрытую патологию, а у контрольного животного - травму при воздействии. Обе ситуации могут потребовать повторного исследования, если другие исследуемые или контрольные животные демонстрируют эквивалентно высокие баллы.
Чтобы получить индекс раздражения, вычитают средний балл контрольной группы из среднего балла опытной группы (см. таблицу D.4).
Для исследований повторного воздействия может потребоваться модификация таблицы D.3 для дополнительных тканевых ответов, связанных с хроническим раздражением.
D.3.9 Отчет об исследовании
Отчет об исследовании должен включать следующую информацию:
- описание исследуемых образцов;
- предполагаемое использование/применение исследуемых образцов;
- подробное описание метода, использованного при приготовлении исследуемых образцов;
- описание подопытных животных;
- метод нанесения;
- как проводилась оценка ответной реакции;
- запись наблюдений;
- гистологическую оценку;
- оценку результатов;
- примененный международный стандарт (включая дату публикации);
- любые отклонения от процедуры;
- любые наблюдаемые особенности;
- дату исследования.
Таблица D.3 - Система микроскопической оценки реакции тканей слизистой
Реакция | Количественная оценка |
Эпителий | |
Нормальный, неповрежденный | 0 |
Дегенерация, сплющивание клеток | 1 |
Метаплазия | 2 |
Фокальная эрозия | 3 |
Общая эрозия | 4 |
Инфильтрация лейкоцитами (при высоком разрешении) | |
Отсутствует | 0 |
Минимальная (меньше 25) | 1 |
Легкая (26-50) | 2 |
Умеренная (51-100) | 3 |
Ярко выраженная (больше 100) | 4 |
Застой в сосудах | |
Отсутствует | 0 |
Минимальный | 1 |
Легкий | 2 |
Умеренный | 3 |
Ярко выраженный, с повреждением сосудов | 4 |
Отек (эдема) | |
Отсутствует | 0 |
Минимальный | 1 |
Легкий | 2 |
Умеренный | 3 |
Ярко выраженный | 4 |
Таблица D.4 - Индекс раздражения
Средний балл | Характеристика ответной реакции |
0 | Отсутствует |
1-4 | Минимальный |
5-8 | Легкий |
9-11 | Умеренный |
12-16 | Резкий |
Другие отрицательные изменения тканей должны быть отражены документально и включены в оценку ответа. Микроскопическая оценка, приведенная в таблице D.3, применима ко всем перечисленным исследованиям. "Индекс раздражения" разработан для применения с моделью вагинального раздражения, но может применяться для других исследований. | |
D.4 Исследование раздражения на пенис
D.4.1 Общие положения
Исследование пенильного раздражения должно рассматриваться только для материалов, предназначенных для контакта с пенильной тканью и, если данные по безопасности не могут быть получены другими способами.
D.4.2 Принцип
Проводят оценку способности исследуемого материала вызывать раздражение пенильной ткани.
D.4.3 Исключение из исследования
D.4.4 Исследуемый образец
Если исследуемый образец твердый или жидкий, то его следует подготовить в соответствии с приложением A.
D.4.5 Животные и условия их содержания
Следует использовать самцов кролика-альбиноса или морской свинки. Они должны быть здоровыми молодыми взрослыми особями с массой не меньше 2 кг для кроликов и от 300 г до 500 г для морских свинок.
Животные должны быть акклиматизированы и содержаться согласно ISO 10993-2.
Доступная длина пениса должна быть по меньшей мере 1 см.
Из-за индивидуальных различий в пигментации животные должны наблюдаться и оцениваться на предмет эритемы до первого нанесения. Для оценки эритемы следует использовать систему, приведенную в таблице D.2. Животные с серьезным изменением пигментации или с эритемой в 2 и выше балла не должны использоваться.
Изначально следует использовать по меньшей мере трех животных для оценки исследуемого материала и трех животных в качестве контрольной группы.
Если ответ в первоначальном исследовании неоднозначен или неясен, то необходимо рассмотреть дополнительное исследование.
D.4.6 Процедура исследования
Помещают животное в супинальную позицию с конечностями, зафиксированными ассистентом.
Указательным и средним пальцем осторожно надавливают на зону гениталий для высвобождения пениса.
Когда пенис виден, наносят достаточное количество (примерно 200 мкл) исследуемого образца, чтобы убедиться, что пенис полностью им покрыт.
Позволяют пенису вернуться в оболочку. Необходимо предотвратить облизывание места нанесения и внесение мешающих факторов, затрудняющих оценку первичного раздражения (например, применить елизаветинский воротник).
В качестве альтернативы животное может быть закреплено в ограничителе соответствующей конструкции в течение (1±0,1) ч после последнего нанесения.
При остром воздействии повторяют вышеописанную процедуру каждый час (±0,1) ч в течение 4 ч. Другие схемы обработки (например, основанные на клиническом применении) должны быть обоснованы и отражены документально.
При проведении длительных исследований с повторным воздействием количество нанесений, их длительность и интервал между ними основываются на времени воздействия, ожидаемом в клинической практике.
D.4.7 Наблюдение за животными
Для острого воздействия отмечают внешний вид пениса через (1±0,1) ч после первоначального нанесения (например, сразу перед следующим нанесением) и последующих обработок. Отмечают и отражают документально внешний вид пениса через (1±0,1), (24±2) и (48±2) ч после последнего нанесения.
При проведении длительных исследований с повторным воздействием отмечают внешний вид пениса через (1±0,1) ч после первоначального воздействия и сразу перед следующим нанесением.
Оценивают реакции поверхности кожи на предмет эритемы согласно системе, приведенной в таблице D.2, для каждого животного в каждый временной интервал и записывают результаты для отчета об исследовании.
Если у какого-либо животного имеется покраснение до первоначального воздействия, то балл, присвоенный до первоначального воздействия, вычитается из баллов оценки эритемы при наблюдениях в разные сроки, чтобы определить степень эритемы, обусловленную исследуемой пробой. Наивысшим возможным баллом для каждого наблюдения является 4.
D.4.8 Оценка результатов
D.4.8.1 Макроскопическая оценка
Сравнивают обработанный пенис и его оболочку с пенисом контрольных животных.
Для определения среднего балла на животное баллы (см. таблицу D.2) за каждое наблюдение суммируют и делят на количество наблюдений для определения среднего балла на животное.
Примечания:
1 Эти наблюдения могут помочь при гистологической оценке.
2 Первоначальные наблюдения, сделанные до первого нанесения исследуемого материала, не включают в средний балл.
Сразу после 48 ч наблюдения проводят эвтаназию. Отделяют дистальный отдел пениса и оболочку и помещают в соответствующий фиксатор для гистологического изучения.
D.4.8.2 Гистологическая оценка
Раздражающие эффекты на коже пениса должны оцениваться патологоанатом (морфологом). Оценивают каждую ткань по системе, приведенной в таблице D.3.
Баллы для микроскопической оценки всех животных в исследуемой группе складывают и сумму делят на количество наблюдений для получения среднего балла исследуемой группы. 16 является максимальным баллом.
Повторяют процедуру оценки для контрольной группы (групп).
Для микроскопической оценки общий балл, превышающий девять, у контрольного животного может указывать на травму при воздействии. Может потребоваться повторное исследование, если другие опытные или контрольные животные демонстрируют такие же высокие баллы.
Для получения индекса раздражения вычитают средний балл контрольной группы из среднего балла опытной группы (см. таблицу D.4).
Для длительных исследований с повторным воздействием может потребоваться модификация таблицы D.3 для включения дополнительных тканевых реакций, обусловленных хроническим раздражением.
D.4.9 Отчет об исследовании
Отчет об исследовании должен включать следующую информацию:
- примененный международный стандарт (включая год публикации);
- описание исследуемого образца;
- предполагаемое использование/применение исследуемых образцов;
- подробное описание метода, использованного при приготовлении исследуемых образцов;
- описание подопытных животных;
- метод нанесения;
- как проводилась оценка ответной реакции;
- запись наблюдений;
- гистологическую оценку;
- оценку результатов;
- любые отклонения от процедуры;
- любые наблюдаемые особенности;
- дату исследования.
D.5 Исследование ректального раздражения
D.5.1 Общие положения
Исследование ректального раздражения должно рассматриваться для материалов, предназначенных для контакта с ректальной тканью, если данные по безопасности не могут быть получены другими способами.
D.5.2 Принцип
Проводят оценку способности материала вызывать раздражение ректальной ткани.
D.5.3 Исключение из исследования
D.5.4 Исследуемый образец
Если исследуемый образец твердый или жидкий, то его следует подготовить в соответствии с приложением А.
D.5.5 Животные и условия их содержания
Следует использовать молодых взрослых кроликов-альбиносов одной линии любого пола массой не меньше 2 кг. При использовании других особей выбор необходимо обосновать.
Животные должны быть акклиматизированы и содержаться согласно ISO 10993-2.
Первоначально следует использовать, по меньшей мере, трех животных для оценки исследуемых образцов, а также трех животных используют в качестве контрольной группы.
Если ответ первоначального исследования неоднозначен или неясен, то необходимо рассмотреть дополнительное исследование.
Животные должны быть осмотрены на предмет ректальных выделений, опухания или других признаков инфекции нижних отделов кишечника или и того, и другого, наличия раздражения или травмы перед каждой обработкой либо всех сразу.
D.5.6 Процедура исследования
Прикрепляют короткий (6 см) мягкий катетер или тупоконечную канюлю к шприцу, объемом более 1 мл. Наполняют шприц и катетер для введения 1 мл исследуемой пробы. Подготавливают отдельный шприц с прикрепленным катетером для каждого животного.
Закрепляют животное, поместив его в фиксирующее устройство, оставляющее доступ к промежности, либо ассистент должен осторожно удерживать животное, закрепив его задние лапы таким образом, чтобы обеспечить доступ к промежности.
Непосредственно перед введением смачивают катетер контрольной пробой образца или подходящей смазкой.
Поднимают хвост животного для доступа к промежности. Осторожно вводят смоченный катетер глубоко в прямую кишку и вводят всю дозу в 1 мл из шприца. Выводят катетер и утилизируют его надлежащим образом.
Из-за разницы во вместительности прямой кишки отдельных животных некоторое количество исследуемой пробы может вытекать во время процедуры или сразу после введения. Вытекший материал осторожно удаляют мягкой тканью.
Повторяют вышеописанную процедуру в течение пяти дней подряд с интервалами (24±2) ч. Другие режимы обработки (например, основанные на клиническом применении) должны быть обоснованы и отражены документально.
При проведении длительных исследований с повторным воздействием количество нанесений, их длительность и интервал между ними определяют с учетом клинического применения МИ.
D.5.7 Наблюдение за животными
Через (24±2) ч после первоначального нанесения и сразу перед каждой обработкой отмечают и регистрируют внешний вид промежности на предмет признаков выделений, эритемы и раздражения.
Животные, у которых наблюдаются излишние выделения, отечность или сложности с введением или все перечисленное, должны быть подвержены процедуре эвтаназии, а образцы их ткани исследованы (см. D.5.8.1 и D.5.8.2).
D.5.8 Оценка результатов
D.5.8.1 Макроскопическая оценка
Через (24±2) ч после последнего введения проводят процедуру эвтаназии. Отделяют весь нижний отдел кишечника, вскрывают в продольном направлении и осматривают на предмет признаков раздражения, травмы эпителиального слоя ткани и некроза.
Помещают прямую кишку и дистальную часть толстой кишки в подходящий фиксатор для гистологического изучения.
Сравнивают ректальные ткани опытных кроликов с ректальными тканями контрольных кроликов.
Записывают и описывают макроскопически внешний вид ректальной ткани для каждого животного, отмечая различия между опытными и контрольными участками.
Примечание - Эти наблюдения могут помочь при гистологической оценке.
D.5.8.2 Гистологическая оценка
Раздражающие эффекты на ректальную ткань должны быть оценены патологоанатом (морфологом). Оценивают каждую ткань по системе, приведенной в таблице D.3.
Суммируют баллы микроскопической оценки для всех животных в опытной группе и делят сумму на количество наблюдений для получения среднего балла опытной группы. Максимальным баллом является 16.
Повторяют процедуру оценки для контрольной группы (групп).
Для микроскопической оценки общий балл, превышающий девять, у контрольного животного может указывать на травму при введении. Может потребоваться повторное исследование, если другие опытные или контрольные животные демонстрируют такие же высокие баллы.
Для получения индекса раздражения вычитают средний балл контрольной группы из среднего балла опытной группы (см. таблицу D.4).
Для длительных исследований с повторным воздействием может потребоваться модификация таблицы D.3 для включения дополнительных тканевых реакций, обусловленных хроническим раздражением.
D.5.9 Отчет об исследовании
Отчет об исследовании должен включать следующую информацию:
- примененный международный стандарт (включая год публикации);
- описание исследуемых образцов;
- предполагаемое использование/применение исследуемых образцов;
- подробное описание метода, использованного при приготовлении исследуемых образцов;
- описание подопытных животных;
- метод нанесения;
- как проводилась оценка ответной реакции;
- запись наблюдений;
- гистологическую оценку;
- оценку результатов;
- любые отклонения от процедуры;
- любые наблюдаемые особенности;
- дату исследования.
D.6 Исследование вагинального раздражения
D.6.1 Общие положения
Исследование вагинального раздражения должно рассматриваться только для материалов, предназначенных для контакта с вагинальной тканью, и если данные по безопасности не могут быть получены другими способами.
D.6.2 Принцип
Проводят оценку способности исследуемого материала вызывать раздражение вагинальной ткани.
D.6.3 Исключение из исследования
D.6.4 Исследуемый образец
Если исследуемый образец твердый или жидкий, то его следует подготовить, как указано в приложении A.
D.6.5 Животные и условия их содержания
Следует использовать самок молодых взрослых кроликов-альбиносов одной линии массой не меньше 2 кг. При использовании других особей выбор необходимо обосновать. Животные должны быть возраста, при котором репродуктивный тракт достаточно развит для введения исследуемых образцов. Животные должны быть нерожавшими и небеременными.
Животные должны быть акклиматизированы и содержаться согласно ISO 10993-2.
По меньшей мере трех животных следует первоначально использовать для оценки испытуемых образцов, а трех животных используют как контрольную группу.
Если ответ в первоначальном исследовании неоднозначен или неясен, то необходимо рассмотреть дополнительное исследование.
Животные должны быть осмотрены на предмет вагинальных выделений, опуханий либо других признаков вагинальной инфекции или и того, и другого, раздражения или травмы перед каждой обработкой или всего вышеперечисленного. Необходимо проводить осмотр в стадии астрального цикла, чтобы убедиться, что не дается ложноположительная реакция на основании физиологических изменений в вагине.
D.6.6 Процедура исследования
Прикрепляют короткий (6 см) мягкий катетер или тупоконечную канюлю к шприцу, объемом более 1 мл. Наполняют шприц и катетер для введения 1 мл исследуемой пробы. Подготавливают отдельный шприц с прикрепленным катетером для каждого животного.
Закрепляют животное, помещают его в фиксирующее устройство, оставляющее доступ к половым органам, либо ассистент должен осторожно удерживать животное, закрепив его задние лапы таким образом, чтобы обеспечить доступ к влагалищу.
Непосредственно перед введением смачивают катетер контрольной пробой образца или подходящей смазкой.
Поднимают хвост животного для доступа к отверстию влагалища. Осторожно вводят смоченный катетер глубоко в вагину и вводят 1 мл из шприца. Выводят катетер и утилизируют его надлежащим образом.
Из-за разницы во вместительности влагалища отдельных животных некоторое количество исследуемой пробы может вытекать во время процедуры или сразу после введения. Вытекший материал осторожно удаляют мягкой тканью.
Повторяют вышеописанную процедуру с интервалами в (24±2) ч каждый день в течение пяти дней подряд. Другие графики обработки (например, основанные на клиническом применении) должны быть обоснованы и отражены документально.
При проведении длительных исследований с повторным воздействием количество нанесений, их длительность и интервал между ними определяют с учетом клинического применения МИ.
D.6.7 Наблюдение за животными
Через (24±2) ч после первоначального нанесения и сразу перед каждой обработкой отмечают и регистрируют внешний вид отверстия влагалища и промежности на предмет выделений, эритемы и отека (эдемы).
Животные, у которых наблюдаются излишние выделения, эритема и/или отек (эдема) или сложности с введением или все перечисленное, должны быть подвержены процедуре эвтаназии, а образцы их ткани исследованы (см. D.6.8.1 и D.6.8.2).
D.6.8 Оценка результатов
D.6.8.1 Макроскопическая оценка
Через (24±2) ч после последнего введения проводят процедуру эвтаназии. Отделяют всю вагину, вскрывают в продольном направлении и осматривают на предмет признаков раздражения, травмы эпителиального слоя ткани и некроза.
Помещают вагину в подходящий фиксатор для гистологического изучения. Следует забрать образцы ткани из трех отделов вагины, цервикального, центрального и хвостового.
Сравнивают вагины животных, подвергнутых воздействию исследуемой пробы, с вагинами контрольных животных.
Записывают и описывают макроскопически внешний вид ткани влагалища каждого животного, отмечая различия между опытными и контрольными группами.
Примечание - Эти наблюдения могут помочь при гистологической оценке.
D.6.8.2 Гистологическая оценка
Раздражающие эффекты должны быть оценены патологоанатом (морфологом). Оценивают каждую ткань по системе, приведенной в таблице D.3.
Суммируют баллы микроскопической оценки для всех животных в опытной группе и делят сумму на количество наблюдений для получения среднего балла опытной группы. Максимальным баллом является 16.
Повторяют процедуру оценки для контрольной группы (групп).
Для микроскопической оценки общий балл, превышающий девять, у контрольного животного может указывать на травму при введении. Может потребоваться повторное исследование, если другие опытные или контрольные животные демонстрируют эквивалентно высокие баллы.
Для получения индекса раздражения вычитают средний балл контрольной группы из среднего балла опытной группы (см. таблицу D.4).
Для длительных исследований с повторным воздействием может потребоваться модификация таблицы D.3 для включения дополнительных тканевых реакций, обусловленных хроническим раздражением.
D.6.9 Отчет об исследовании
Отчет об исследовании должен включать следующую информацию:
- примененный международный стандарт (включая год публикации);
- описание исследуемых образцов;
- предполагаемое использование/применение исследуемых образцов;
- подробное описание метода, использованного при приготовлении исследуемых образцов;
- описание подопытных животных;
- метод нанесения;
- как проводилась оценка ответной реакции;
- запись наблюдений;
- гистологическую оценку;
- оценку результатов;
- любые отклонения от процедуры;
- любые наблюдаемые особенности;
- дату исследования.
Приложение E
(обязательное)
Исследование раздражения на коже человека
E.1 Общие положения
В дополнение к ISO 14155 применяют следующие требования в той мере, где их применение более необходимо.
E.2 Принцип
Одну дозу исследуемого материала наносят под окклюзией на кожу добровольцев. Раздражение сводится к минимуму путем нанесения исследуемого материала на короткие периоды. Более длительные периоды воздействия могут быть применимы при определенных условиях (см. [11], [26]).
Главным условием оценки является определение пропорции добровольцев, у которых развивается кожное раздражение, относительно реакции на контрольный материал.
E.3 Описание метода
E.3.1 Отбор добровольцев
Настоящий стандарт предназначен для использования со здоровыми добровольцами. Добровольцам должно быть минимум 18 лет, они не должны быть беременными или кормящими. Добровольцы с чувствительностью к исследуемому образцу или с признаками дерматита должны быть исключены из исследования. Отбор добровольцев проводят под наблюдением дерматолога или другого квалифицированного специалиста.
E.3.2 Приготовление доз
Жидкие исследуемые образцы используют неразбавленными. При исследовании твердых образцов их необходимо смочить небольшим количеством воды (как правило, 200 мкл) или, где необходимо, другим подходящим экстрагентом для обеспечения хорошего контакта с кожей. Необходимо учитывать структуру твердого материала и способ приготовления пробы должен быть обоснован. При использовании увлажненных образцов необходимо убедиться, что каждый доброволец получает одинаковое количество исследуемого образца. Используют одинаковое количество воды для увлажнения образца для каждого участника исследования и регистрируют это количество.
При использовании экстракта следует учитывать его влияние на кожное раздражение исследуемым образцом. Если в качестве смачивающего агента для твердых образцов используется не вода, а другая жидкость, то рассматривают возможность нанесения подушечки с контролем экстрагента на каждого добровольца.
E.3.3 Процедура
E.3.3.1 Количество добровольцев
По меньшей мере 30 добровольцев должны завершить исследование, включая не менее чем одну треть каждого пола.
E.3.3.2 Нанесение исследуемых образцов
Наносят испытуемую пробу на неповрежденную кожу в подходящем месте, например, на внешнюю верхнюю часть руки посредством окклюзионной камеры, содержащей марлевую подушечку (pad). Место нанесения должно быть одинаковым для всех добровольцев и должно быть отражено документально. Как правило, размер подушечки должен быть не меньше 1,8 см, предпочтительно 2,5 см в диаметре. Подушечка должна удерживаться в контакте с кожей посредством подходящей нераздражающей повязки, включая нераздражающий фиксирующий пластырь, в течение всего периода воздействия.
Подушечка должна доставлять соответствующую дозу на единицу площади: примерно 50 мг на 100 мг испытуемой пробы на квадратный сантиметр считается оптимальным. При нанесении жидких исследуемых материалов, как правило, к марлевой накладке добавляется от 200 мкл до 400 мкл до ее увлажнения. При исследовании твердых материалов, как правило, смачивается 200 мг исследуемого материала и добавляется к марлевой накладке. В качестве альтернативного метода нанесения твердых образцов марлевая подушечка увлажняется, и испытуемый образец покрывает весь исследуемый участок.
E.3.3.3 Длительность воздействия
Во избежание неприемлемо сильных реакций следует применять осторожный подход к исследованию. Последовательная процедура аппликаций позволит избежать сильной реакции раздражения. Подушечки наносятся последовательно, с периодом 15 мин и 30 мин, и до 1 ч, 2 ч, 3 ч и 4 ч. 15-минутный, либо 30-минутный периоды воздействия могут быть пропущены при достаточных признаках, что чрезмерных реакций не случится после 1-часового воздействия. Переход к более длительным воздействиям, включая 24-часовое воздействие закрытой накладки на новый участок кожи, будет зависеть от отсутствия кожного раздражения (оценивается по меньшей мере до 48 ч) в результате более кратковременных воздействий, чтобы убедиться, что любая отложенная реакция на раздражитель адекватно оценена.
Нанесение материала для более длительного воздействия всегда производится на ранее необработанный участок.
В конце периода воздействия необходимо удалить остаточный испытуемый образец, по возможности, используя воду или соответствующую жидкость, не оказывая влияния на существующую реакцию или целостность эпидермиса.
E.3.3.4 Ограниченное воздействие
В дополнение к последовательному увеличению длительности нанесения как описано E.3.3.3, если есть подозрение, что материал может вызвать резкое раздражение, следует сократить время воздействия в пробной (пилотной) группе добровольцев. Затем на основе полученных данных можно определить ход исследования. Последующие аппликации проводят только после оценки через (48±2) ч и (72±2) ч.
E.3.3.5 Клинический осмотр и оценка кожных реакций
Места аппликаций осматривают на предмет признаков раздражения и ответы оценивают сразу после удаления подушечки и через (1±0,1) до (2±0,2) ч, (24±2) ч, (48±2) ч и (72±2) ч. Если необходимо определить обратимость реакции, период наблюдения может быть продлен сверх 72 ч. Кроме того, должно быть подробно описано состояние кожи до и после исследования, например, пигментация и степени влажности. Кожное раздражение должно быть оценено и отражено документально в соответствии с системой баллов, приведенной в таблице E.1.
Таблица E.1 - Исследование раздражения на коже человека, шкала баллов
Описание ответной реакции | Количественная оценка |
Ответная реакция отсутствует | 0 |
Слабо положительная реакция (как правило, характеризуется легкой эритемой и/или сухостью большей части места аппликации) | 1 |
Умеренно положительная реакция (как правило, явная эритема или сухость, возможно, распространяющаяся за пределы места аппликации) | 2 |
Сильно выраженная положительная реакция (сильная и часто распространяющаяся эритема с отеком (эдемой) и/или формированием струпа) | 3 |
Для добровольцев, у которых после воздействия меньше 4 ч оценка 1 или выше с баллом 1 или выше после считается, что у них будет более сильная реакция, если они будут подвергаться воздействию материала в течение 4 часов. Как только получена оценка 1 или выше, нет необходимости подвергать реагирующего добровольца дальнейшему воздействию материала. Могут потребоваться дальнейшие наблюдения для надлежащего ухода за добровольцами. В дополнение к наблюдению раздражения любые другие эффекты должны быть зарегистрированы и полностью описаны. Например, добровольцы должны быть обучены делать комментарии, связанные с аппликациями (например, осязательные эффекты), и экспериментаторы должны быть обучены отмечать немедленные реакции (например, крапивница) при удалении аппликаций. Такие наблюдения не обязательно указывают на эффект раздражителя, но должны включаться в отчет об исследовании, если замечены. Если они значительны, то должны рассматриваться в управлении исследованием для гарантии надлежащего ухода за добровольцами.
Важнейшими полученными данными являются данные о количестве добровольцев, у которых было или, как ожидается, будет раздражение кожи после воздействия до 4 часов. Необходимое время для выработки какого-либо ответа у человека не включается в оцениваемые результаты, а относится только к обеспечению надлежащего ухода за добровольцами.
E.3.3.6 Обоснование и выбор сопутствующего вещества положительного контроля
Так как человек показывает разнообразие в ответах на раздражители, следует включить положительный контроль для определения приемлемости набора исследований к обнаружению раздражающих эффектов исследуемого соединения. Предпочтительно использовать 20% SDS в качестве положительного контроля, так как его раздражающие эффекты хорошо охарактеризованы (см. приложение F). Возможно использование других контролей при обосновании.
Обычный положительный контроль может быть выбран в качестве контрольного показателя. Кожное раздражение не является абсолютным феноменом. Любой материал может вызвать кожное раздражение, это зависит от дозы, характера и длительности воздействия. Таким образом, исследования кожного раздражения у человека почти всегда сравнительны и должны быть связаны с известным химическим раздражителем.
E.4 Данные и отчетность
E.4.1 Данные
Данные, включая результаты положительных и отрицательных контрольных материалов, должны быть суммированы в форме таблицы с указанием балла раздражения для каждого человека после (24±2), (48±2) и (72±2) ч после удаления подушечки и других каких-либо наблюдаемых эффектов.
E.4.2 Оценка/интерпретация данных
Целью данного исследования является определение, представляет ли материал значительную потенциальную опасность кожного раздражения после острого воздействия. Таким образом, если материал вызывает кожное раздражение у добровольцев с частотой, аналогичной положительному контролю, он должен рассматриваться как сильный кожный раздражитель. С другой стороны, если он вызывает частоту кожного раздражения у добровольцев, которая существенно меньше положительного контроля, то он не должен рассматриваться как сильный кожный раздражитель. Является важным, что данные, полученные в контексте ухода за добровольцами, не должны быть спутаны с данными конечной точки, т.е. с данными пропорции субъектов, проявляющих раздражающую реакцию. Также важно не путать индивидуальные различия к кожному раздражению со способностью испытуемого образца вызывать кожное раздражение.
E.4.3 Отчет об исследовании
Для отчета об исследовании необходимо следовать требованиям ISO 14155. Для конкретной отчетности по исследованию раздражения кожи необходимо включить следующую информацию:
a) этические рассмотрения и подтверждения согласия добровольцев;
b) исследуемый материал:
1) физическая природа и, по применимости, физические свойства,
2) идентифицирующие данные;
c) экстрагент:
1) идентификацию и обоснование выбора экстрагента, применяемого для увлажнения твердого исследуемого материала;
d) добровольцы:
1) число добровольцев, участвующих в исследовании,
2) распределение возраста/пола добровольцев;
e) результаты:
1) скорость ответа через 0 ч, (1±0,1) ч до (2±0,2) ч, (24±2) ч, (48±2) ч и (72±2) ч и в другие периоды наблюдения;
2) сведение данных раздражающей реакции для каждого лица на каждый период наблюдения (с суммированной частотой скорости раздражающей реакции при, например, (24±2) ч, (48±2) ч и (72±2) ч после удаления подушечки),
3) описание всех наблюдаемых раздражающих реакций,
4) описание любых других эффектов в дополнение к наблюдаемому раздражению,
5) статистическую обработку результатов (сравнение с положительным контролем, например, используя точный тест Фишера),
6) описание или ссылка на исследование на животных in vitro или in vivo, если таковое проведено до исследования на человеке, включая детали процедуры и данные, полученные из исследуемых и ссылочных материалов;
f) обсуждение результатов;
g) примененный международный стандарт (включая год его публикации);
h) любые отклонения от процедуры;
i) любые наблюдаемые особенности;
j) дату исследования.
Приложение F
(справочное)
Справочный материал об исследованиях на раздражение
Применение лабораторных животных для исследований кожных раздражений снижается из-за развития моделей in vitro и более частого использования добровольцев. Применяют биоинженерные или неинвазивные объективные методы измерения для количественного определения раздражающего ответа, таким образом, снижая зависимость от более субъективных визуальных шкал считывания. Недавно модель RHE оценивалась на предмет применения в определении раздражающих химических веществ в экстрактах МИ [6]. По сравнению с OECD 439 были применены некоторые адаптации, делающие модель RHE применимой для обнаружения (низких) уровней раздражителей в экстрактах МИ. Кроме того, был накоплен многолетний опыт проведения теста Драйза на кожное раздражение на кроликах-альбиносах. Этот метод описан в OECD 404. Исследуемый образец наносят под марлевыми подушечками на интактные места на выстриженной спине. Аппликации проводят на трех кроликах. Подушечки закрепляют липкой лентой и все туловище животного оборачивают полуокклюзионной или окклюзионной повязкой на (4±0,5) ч. После 4 ч подушечки удаляют, исследуемые места очищают и спустя 1 ч оценивают реакцию на предмет эритемы и отека (эдемы). Реакции также оценивают через (24±2) ч, (48±2) ч и (72±2) ч.
Исследование кожного раздражения на мелких лабораторных животных проводят для помощи при идентификации материалов, которые могут быть потенциальными раздражителями кожи или слизистой ткани человека или и тем, и другим. Основным раздражителем является материал, вызывающий воспалительные изменения кожи в результате прямого повреждающего эффекта, характеризующегося либо наличием воспаления, либо, в случае сильного раздражителя, везикуляцией или некрозом, или и тем, и другим.
Кролик является предпочтительным подопытным животным, о чем свидетельствует большое количество информации по кожному раздражению у этих животных в Реестре токсичных эффектов химических веществ (RTECS). Из свыше 2000 записей RTECS 85% сообщают результаты исследований на кролике, 7,5% - на человеке, 4 % - на мышах и 3% - на морской свинке. В результате кролики применялись для получения абсолютного большинства существующих данных в доступной литературе. Если предназначенное применение изделия на это не указывает, то повреждение (например ссадина, царапина) области нанесения необязательно, так как многолетний опыт показывает сходные ответы для поврежденной и неповрежденной области.
Воздействие SDS калибрует группу добровольцев и служит точкой отсчета. SDS классифицируется как кожный раздражитель согласно критерию ЕС (Директива 88/379/Совета ЕЭК от 7 июня 1988). Тем не менее неясно, является ли SDS пороговым уровнем ответа, при котором химические вещества должны рассматриваться как кожные раздражители, или приближается к таковому. Таким образом, вместо использования неразбавленного материала, более применимо взять в качестве точки отсчета минимальный уровень SDS, рассматриваемый как минимум одной региональной группой (ЕС) как значительный острый кожный раздражитель, который является 20%-ным (массовая концентрация) водным препаратом. См. ссылку [27].
Исследование глазного раздражения на кролике было разработано для прогнозирования его у человека (см. [28]). Дрейз (Draize) опубликовал систему баллов для помощи в оценке глазного раздражения (см. [8]). Были опубликованы иллюстрированные руководства в качестве помощи при оценке поражений глаза.
Несколько альтернативных исследований in vitro оценивались для исследования глазного раздражения. Тем не менее, ни одно исследование in vitro не сможет заменить исследование глазного раздражения in vivo, которое охватывает все конечные точки in vivo. Тем не менее, стратегические комбинации нескольких альтернативных методов исследования внутри многоуровневой стратегии исследования могут быть способными заменить глазное исследование Дрейза (Draize). Возможная концептуальная схема для такой многоуровневой стратегии была разработана для химических веществ в рабочей группе EURL ECVAM (см. [23]). Схема основывается на альтернативных методах глазного раздражения, которые различаются в своей способности определять либо сильные раздражающие вещества (ЕС R41; "Категория 1" или "Категория 2" GHS) либо вещества, считающиеся нераздражающими (ЕС "неклассифицированные"; GHS "Без категории"). Согласно этой схеме весь диапазон раздражения может быть решен путем распределения исследований в многоуровневой стратегии, которая может применяться с любого конца: для определения первых серьезных раздражителей и решения отсутствия раздражимости (подход сверху вниз) или для процедуры в обратном порядке, начиная с определения не раздражителей (подход снизу вверх). Легкое раздражение может быть разрешено на последнем уровне при обоих подходах.
Уже существует несколько OECD руководств по исследованиям, основывающимся на методах in vitro, связанных с конечной точкой "глазное раздражение": OECD 437, OECD 438, OECD 460, OECD 491 и OECD 492. Эти руководства для определения раздражающей активности химических веществ основываются на валидированных (ICCVAM, EURL ECVAM, JaCVAM или других) исследованиях in vitro. Эти руководства описывают метод исследования помутнения и проницаемости бычьей роговицы (см. OECD 437), метод изолированного глазного исследования на цыплятах (см. OECD 438), метод исследования проникновения флуоресцеина с использованием клеток, растущих на полупроницаемой вкладке (см. OECD 460) и метод исследования краткосрочного воздействия in vitro (см. OECD 491), состоящий из основанной на цитотоксичности пробы in vitro, которая проводится на конфлюэнтном монослое клеток роговицы кролика датского госинститута сывороток (SIRC), и исследования с применением реконструированного человеческого роговицеподобного эпителия, так называемое исследование реконструированного человеческого роговицеподобного эпителия (RhCE) (см. OECD 492). Ни одно из данных исследований OECD не было валидировано для МИ.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего межгосударственного стандарта |
ISO 10993-1 | IDT | ГОСТ ISO 10993-1-2021 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента риска" |
ISO 10993-2 | - | *, |
ISO 10993-9 | IDT | ГОСТ ISO 10993-9-2022 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 9. Основные принципы идентификации и количественного определения потенциальных продуктов деградации" |
ISO 10993-12 | IDT | ГОСТ ISO 10993-12-2023 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Отбор и подготовка образцов для проведения исследований" |
ISO 10993-13 | IDT | ГОСТ ISO 10993-13-2016 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 13. Идентификация и количественное определение продуктов деструкции полимерных медицинских изделий" |
ISO 10993-14 | IDT | ГОСТ ISO 10993-14-2011 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 14. Идентификация и количественное определение продуктов деградации изделий из керамики" |
ISO 10993-15 | IDT | ГОСТ ISO 10993-15-2023 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 15. Идентификация и количественное определение продуктов деградации изделий из металлов и сплавов" |
ISO 10993-18 | IDT | ГОСТ ISO 10993-18-2022 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 18. Исследование химических свойств материалов в рамках процесса менеджмента риска" |
ISO 14155 | - | *, |
OECD 404 | - | * |
OECD 439 | - | * |
* Соответствующий межгосударственный стандарт отсутствует. До его принятия рекомендуется использовать перевод на русский язык данного международного стандарта. Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: IDT - идентичные стандарты. | ||
_______________
Библиография
[1] | ISO 9394:2012, Ophthalmic optics - Contact lenses and contact lens care products - Determination of biocompatibility by ocular study using rabbit eyes (Оптика офтальмологическая. Контактные линзы и изделия по уходу за ними. Определение биосовместимости контактных линз на кроликах) |
[2] | Agner T. Noninvasive measuring methods for the investigation of irritant patch test reactions. A study of patients with hand eczema, atopic dermatitis and controls. Acta Derm. Venereol. Suppl. (Stockh.). 1992, 173 pp.1-26 |
[3] | N., Tornier C., Robert C., Amsellem C, Roux M.-H., Doucet O. et al. A catch-up validation study on reconstructed human epidermis (SkinEthicTM RHE) for full replacement of the Draize skin irritation test. Toxicol . In Vitro. 2010, 24 pp.257-266 |
[4] | Casas J.W., Lewerenz G.M., Rankin E.A., Willoughby J.A.Sr, Blakeman L.C., McKim J.M.Jr. et al. In Vitro Human Skin Irritation Test for Evaluation of Medical Device Extracts. Toxicol. In Vitro. 2013, 27 pp.2175-2183 |
[5] | Coleman K.P., Grailer T.P., McNamara L.R., Rollins B.L., Christiano N.J., H. et al. Preparation of irritant polymer samples for an in vitro round robin study. Toxicol. In Vitro. 2018, 50 pp.401-406 |
[6] | De Jong W.H., Hoffmann S., Lee M., H., Pellevoisin C., Haishima Y. et al. Round robin study to evaluate the reconstructed human epidermis (RhE) model as an in vitro skin irritation test for detection of irritant activity in medical device extracts. Toxicol. In Vitro. 2018, 50 pp.439-449 |
[7] | Draize J.H., Woodand G., Calvery H.O. (1944) Methods for the study of irritation and toxicity of substances applied topically to the skin and mucous membranes. J. Pharmacol. Exp. Ther. 1944, 82 pp.337-390 |
[8] | Draize J.H. Appraisal of the safety of chemicals in foods, drugs, and cosmetics, Austin, Texas, Association of food and drug officials of the United States, Texas State Department of Health, 1959 |
[9] | Faller C., Bracher M., Dami N., Roguet R. Predictive ability of reconstructed human epidermis equivalents for the assessment of skin irritation of cosmetics. Toxicol. In Vitro. 2002, 16 pp.557-572 |
[10] | Hagi-Pavli E., Williams D.M., Rowland J.L., Thornhill M., Cruchley A.T. Characterizing the immunological effects of oral healthcare ingredients using an in vitro reconstructed human epithelial model. Food Chem. Toxicol. 2014, 74 pp.139-148 |
[11] | Horita K., Tomita C., Yasoshima M., Matsunaga K. Optimal evaluation time point for patch testing to predict skin irritation of commercial topical drugs. J. Dermatol. 2015, 42 pp.851-860 |
[12] | H., Hayden P., Klausner M., Kubilus J., Kearney P., Sheasgreen J. (2009): In Vitro Skin Irritation Test: Improving the Sensitivity of the EpiDerm Skin Irritation Test Protocol. ATLA 37, 671-669, 2009 |
[13] | H., Willoughby J.A., De Jong W.H., Letasiova S., Milasova T., Bachelor M.A. et al. Pre-validation of an in vitro skin irritation test for medical devices using the reconstructed human tissue model EpiDerm Toxicol . In vitro . 2018, 50 pp.407-417 |
[14] | H., Bendova H., Letasiova S., Coleman K.P., De Jong W.H., D. Evaluation of the medical devices benchmark materials in the controlled human patch testing and in the RhE in vitro skin irritation protocol. Toxicol. In Vitro. 2018, 50 pp.433-438 |
[15] | Lee C.H., Maibach H.I. The sodium lauryl sulfate model: an overview. Contact Dermat. 1995, 33 pp.1-7 |
[16] | Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J. Immunol. Methods. 1983, 65 pp.55-62 |
[17] | Olsen D.S., Lee M., Turley A.P. Assessment of test method variables for in vitro skin irritation testing of medical device extracts. Toxicol. In Vitro. 2018, 50 pp.426-432 |
[18] | Pellevoisin C., Tornier C., Bremond C., Rollins B., Briotet D., Turley A. et al. Skin irritation of medical devices: In vitro assay with EPISKIN reconstructed human epidermis (RHE). Toxicol. Lett. 2016, 258 (S63) p. viii |
[19] | Pellevoisin C., Videau C., Briotet D., C., Tornier C., Alonso A. et al. SkinEthic RHE for in vitro evaluation of skin irritation of medical device extracts. Toxicol . In Vitro. 2018, 50 pp.419-425 |
[20] | SOP of in vitro skin irritation of medical devices extracts with SkinEthic RHE. EPISKIN SA, Lyon (France), Available at https://www.episkin.com/~/media/Files/SOP-SkinEthic-RHE-lrritation-Medical-devices, 2018 |
[21] | In Vitro EpiDerm Skin Irritation Test (EPI-200-SIT). Protocol For use with MatTek Corporation’s Reconstructed Human Epidermal Model EpiDerm (EPI-200-SIT). MK-24-007-0023. Available at https://www.mattek.com/wp-content/uploads/Medical-Devices-Testing-Protocol 201603010.pdfhttps://www.mattek.com/wp-content/uploads/EPI-200-SIT-Skin-lrritation_MK-24-007-0023_10_02_19.pdf, 2017 |
[22] | Nomura Y., Lee M., Fukui C., Watanabe K., Olsen D., Turley A., Morishita Y., Kawakami T., Yuba Т., Fujimaki H., Inoue K., Yoshida M., Ogawa K., Haishima Y. Proof of concept testing of a positive reference material for in vivo and in vitro skin irritation testing. J Biomed Mater Res B Appl Biomater, 2018, 106(8) pp.2807-2814 |
[23] | Scott L., Eskes C., Hoffmann S., Adriaens E., N., Bufo M. et al. A proposed eye irritation testing strategy to reduce and replace in vivo studies using Bottom-Up and Top-Down approaches. Toxicol. In Vitro. 2010, 24 pp.1-9 |
[24] | Wahlberg J.E., Wahlberg E.N. Quantification of skin blood flow at patch test sites. Contact Dermat. 1987, 17 pp.229-233 |
[25] | Wahlberg J.E., Mailbach H.I. Nonanoic acid irritation - A positive control at routine patch testing? Contact Dermat. 1980, 6 pp.128-130 |
[26] | Walters R.M., Khanna P., Hamilton M., Mays D.A., Telofski L. Human Cumulative Irritation Tests of Common Preservatives Used in Personal Care Products: A Retrospective Analysis of Over 45000 Subjects. Toxicol. Sci. 2015, 148 pp.101-107 |
[27] | York M., Griffiths H.A., Whittle E. et al. Evaluation of a human patch test for the identification and classification of skin irritation potential, Contact Dermatitis, 1996, 34, pp.204-212 |
[28] | European Chemical Industry Ecology and Toxicology Centre Eye irritation testing, Monograph 11, Brussels, Belgium, 1988 |
[29] | Organization for Economic Cooperation and Development (OECD) Guidelines for testing of chemicals No. 405, Acute eye irritation/corrosion. OECD Publications, Paris, 2017 |
[30] | Organization for Economic Cooperation and Development (OECD) Guidelines for testing of chemicals. No. 430, In Vitro Skin Corrosion: Transcutaneous Electrical Resistance Test (TER). OECD Publications, Paris, 2015 |
[31] | Organization for Economic Cooperation and Development (OECD) Test No. 431: In vitro skin corrosion: reconstructed human epidermis (RHE) test method, OECD Guidelines for the Testing of Chemicals, Section 4, OCDE, Paris, 2019 |
[32] | Organization for Economic Cooperation and Development (OECD), Guidelines for testing of chemicals. No. 437. Bovine Corneal Opacity and Permeability Test Method for Identifying i) Chemicals Inducing Serious Eye Damage and ii) Chemicals Not Requiring Classification for Eye Irritation or Serious Eye Damage. OECD Publications, 2020 |
[33] | Organization for Economic Cooperation and Development (OECD) Test No. 438: Isolated Chicken Eye Test Method for Identifying i) Chemicals Inducing Serious Eye Damage and ii) Chemicals Not Requiring Classification for Eye Irritation or Serious Eye Damage, OECD Guidelines for the Testing of Chemicals, Section 4, OCDE, Paris, 2018 |
[34] | Organization for Economic Cooperation and Development (OECD) Guidelines for testing of chemicals. No. 460. Fluorescein Leakage Test Method for Identifying Ocular Corrosives and Severe Irritants. OECD Publications, Paris, 2017 |
[35] | Organization for Economic Cooperation and Development (OECD) Test No. 491: Short Time Exposure In Vitro Test Method for Identifying i) Chemicals Inducing Serious Eye Damage and ii) Chemicals Not Requiring Classification for Eye Irritation or Serious Eye Damage, OECD Guidelines for the Testing of Chemicals, Section 4, OCDE, Paris, 2020 |
[36] | Organization for Economic Cooperation and Development (OECD) Test No. 492: Reconstructed human Cornea-like Epithelium (RhCE) test method for identifying chemicals not requiring classification and labelling for eye irritation or serious eye damage, OECD Guidelines for the Testing of Chemicals, Section 4, OCDE, Paris, 2019 |
[37] | Organization for Economic Cooperation and Development (OECD) Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment, OECD Series on Testing and Assessment, No. 34, OECD Publishing, Paris, 2005 |
[38] | British Pharmacopoeia Commission. British Pharmacopoeia 2016. London: TSO; 2016 |
[39] | European Pharmacopoeia, 10th Edition, European Pharmacopoeia, Council of Europe, B.P 907, F-67029 Strasbourg, France, 2019 |
[40] | United States Pharmacopeia and National Formulary (USP 43-NF 38). Rockville, MD: United States Pharmacopeial Convention; 2020 |
[41] | Commission Regulation (EU) 2019/1390 of 31 July 2019 amending, for the purpose of its adaptation to technical progress, the Annex to Regulation (EC) No 440/2008 laying down test methods pursuant to Regulation (EC) No 1907/2006 of the European Parliament and of the Council on the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH) (Text with EEA relevance) OJ L 247, 26.9.2019 |
УДК 615.46:002:006.354 | МКС 11.100.20 | IDT |
Ключевые слова: медицинское изделие, оценка биологического действия, раздражение, общие требования к проведению исследований в процессе менеджмента рисков | ||

