ГОСТ Р 56395-2015/ISO/TS 22367:2008
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ЛАБОРАТОРИИ МЕДИЦИНСКИЕ
Снижение ошибок посредством менеджмента риска и постоянного улучшения
Medical laboratories. Reduction of errors through risk management and continual improvement
ОКС 11.100.01*
03.120.10
ОКП 94 0000
_____________________
* В ИУС N 12, 2015 года ГОСТ Р 56395-2015 приводится с ОКС 11.100.01,
здесь и далее. - .
Дата введения 2016-06-01
Предисловие
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью "МЕДИТЕСТ" (ООО "МЕДИТЕСТ") на основе собственного аутентичного перевода на русский язык международного документа, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 380 "Клинические лабораторные исследования и диагностические тест-системы ин витро"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 27 апреля 2015 г. N 302-ст
4 Настоящий стандарт идентичен международному документу ISO/TS 22367:2008* "Медицинские лаборатории. Снижение ошибок посредством менеджмента риска и постоянного улучшения" (ISO/TS 22367:2008 "Medical laboratories - Reduction of error through risk management and continual improvement").
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации и действующие в этом качестве межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет ()
Введение
Требованием международного стандарта ИСО 15189 является наличие у лаборатории процесса исследования аспектов, не соответствующих собственным процедурам и установленным требованиям системы менеджмента, и их идентификации.
ИСО 15189 устанавливает связь этого процесса как с корректирующими, так и с предупреждающими действиями. Дополнительным требованием стандарта является необходимость осуществления анализа пригодности и результативности системы и в целом деятельности по обслуживанию пациентов с внесением в систему необходимых изменений.
Лучше всего это может быть реализовано путем рассмотрения потенциальных рисков, определенных на каждом этапе каждого процесса.
Предупреждающие действия и надлежащие упреждающие процессы должны основываться на достоверной информации для предотвращения возможности возникновения несоответствующих аспектов. Корректирующие действия планируются аналогичным образом наряду с соответствующими упреждающими процессами; тем не менее, их предпринимают для исправления выявленных проблем и предупреждения их повторения. Менеджмент риска является плановым процессом, который является частью предупреждающих и корректирующих действий.
Предупреждающие и корректирующие действия могут быть более результативными, когда они основаны на информации, которая хорошо организована; системы классификации и анализа менеджмента риска - это два процесса, которые обеспечивают хорошо организованную информацию. В контексте организационного менеджмента риск охарактеризован как многомерная озабоченность по поводу стабильности и предсказуемости результата. Организационно риск включает в себя компоненты, которые влияют на операционную и техническую составляющие, обязательства и бизнес-аспекты лаборатории. В контексте постоянного улучшения элементы риска потенциальных потерь имеют более высокий приоритет, чем элементы выгоды. Рассмотрение риска обязательно включает в себя связанные, но различающиеся элементы вероятности возникновения и тяжести последствий.
Факторы, которые влияют на риск, могут действовать прямо или косвенно.
Схема менеджмента риска может состоять из следующих этапов:
a) планирование с учетом рисков;
b) определение риска и его последствий;
c) разработка стратегии управления риском;
d) мониторинг процесса управления риском.
Эти этапы соответствуют требованиям менеджмента, установленным в ИСО 15189, включающим:
- идентификацию и управление несоответствиями;
- разработку предупреждающих и корректирующих действий;
- проведение внутренних аудитов и анализ со стороны руководства;
- постоянное улучшение.
Настоящий стандарт предназначен для обеспечения первых шагов по внедрению менеджмента риска в структурные подразделения, организацию в целом и систему менеджмента качества медицинской лаборатории.
Классификация лабораторных несоответствий, ошибок и инцидентов является полезной для целей мониторинга и позволяет лаборатории определить их критичность, устанавливать приоритеты в их решении и определить истинные причинные факторы, которые приводят к ошибкам.
Также могут быть применены рекомендации, содержащиеся в локальных, региональных и национальных правилах.
1 Область применения
Настоящий стандарт предназначен для его применения совместно с ИСО 15189 в качестве системы для снижения лабораторных ошибок и повышения безопасности пациентов путем применения принципов менеджмента риска в отношении аспектов исследования, особенно преаналитических и постаналитических аспектов в цикле лабораторной медицинской помощи.
Настоящий стандарт устанавливает методологию для поиска и описания ошибок медицинской лаборатории, которых удастся избежать при применении ИСО 15189.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие международные стандарты и документы*:
________________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ИСО 9000 Системы менеджмента качества. Основные положения и словарь (ISO 9000, Quality management systems - Fundamentals and vocabulary)
ИСО 14971:2007 Медицинские изделия. Применение менеджмента риска к медицинским изделиям (ISO 14971:2007, Medical devices - Application of risk management to medical devices)
ИСО 15189 Медицинские лаборатории. Частные требования к качеству и компетентности (ISO 15189, Medical laboratories - Particular requirements for quality and competence)
Руководство ИСО/МЭК 73 Менеджмент риска. Словарь. Руководство по применению (ISO/IEC Guide 73, Risk management - Vocabulary - Guidelines for use)
3 Термины и определения
В настоящем стандарте применены термины по ИСО 9000, ИСО 14971, ИСО 15189, Руководству ИСО/МЭК 73, а также следующие термины с соответствующими определениями
3.1 лабораторная ошибка (laboratory error): Сбой в выполнении запланированного действия, которое должно быть завершено как предполагалось, или использование неправильного плана для достижения цели, происходящее на любой стадии лабораторного цикла, от заказа исследования до получения отчетных результатов и соответствующей интерпретации и реагирования на них.
3.2 активная ошибка (active error): Ошибка непосредственного исполнителя.
Примечание - См. [2].
3.3 когнитивная ошибка (cognitive error): Ошибка неправильного выбора вследствие недостаточного знания, неправильной интерпретации имеющейся информации или применения неправильного познавательного правила.
Примечание 1 - См. [1].
Примечание 2 - Ошибка также упоминается как "относящаяся к ошибке восприятия" или "промах" (см. [1]).
3.4 анализ характера и последствий отказов (failure modes and effects analysis); FMEA: Систематический анализ системы или продукции, включая идентификацию потенциальных отказов и оценку воздействия на общую систему/эксплуатационные характеристики продукта этого отказа.
Примечание 1 - Этот анализ также включает в себя оценку шагов, предпринятых для защиты от сбоев или снижения их последствий.
Примечание 2 - Процедуру иногда называют анализом "от частного к общему".
3.5 скрытая ошибка (latent error): Ошибка из-за исходных структурных факторов, не находящихся под контролем непосредственного исполнителя.
Пример - Неисправность оборудования, плохой дизайн, управленческое решение или организационная структура (см. [2]).
3.6 непознавательная ошибка (non-cognitive error): Ошибка из-за неосторожного или непреднамеренного отклонения от ожидаемого автоматического поведения.
Примечание 1 - См. [1].
Примечание 2 - Непознавательная ошибка также упоминается как "схематическая ошибка" или "случайная ошибка" (см. [9]).
3.7 анализ характера и последствий отказов процессов (failure mode and effects analysis): Анализ предполагаемого риска процессов с высоким уровнем риска для выявления необходимых улучшений, которые позволят уменьшить вероятность непредусмотренного неблагоприятного события.
4 Ответственность руководства за предупреждающие и корректирующие действия и постоянное улучшение
4.1 Общие положения
Руководство должно обеспечить предоставление достаточных ресурсов для того, чтобы предупреждающие и корректирующие действия могли быть определены и приняты.
4.2 Ответственность руководства за предупреждающие действия
Руководство должно:
- определять порядок и процессы сбора данных о характеристиках процесса в течение цикла испытаний;
- анализировать данные для определения тенденций и закономерностей, которые указывают на потенциальные проблемы или ошибки, которые могут иметь место;
- разрабатывать и осуществлять предупреждающие действия посредством улучшения процессов по устранению причин потенциальных несоответствий для предупреждения их возникновения.
4.3 Ответственность руководства за корректирующие действия
Руководство должно:
- определять порядок и процессы для идентификации и отчетности по выявленным несоответствиям, ошибкам и инцидентам;
- обеспечивать подготовку персонала для осуществления правильной идентификации и отчетности о несоответствиях, ошибках и инцидентах;
- рассматривать результаты анализа несоответствий, ошибок и инцидентов;
- разрабатывать коррекции и корректирующие действия для устранения или уменьшения вероятности повторения несоответствия, ошибки или инцидента.
4.4 Ответственность руководства за постоянное улучшение
Руководство должно обеспечивать, чтобы результаты менеджмента риска, предупреждающих и корректирующих действий были включены в постоянный процесс улучшения.
5 Идентификация потенциальных и фактических лабораторных несоответствий, ошибок и инцидентов
Потенциальные и фактические лабораторные несоответствия, ошибки и инциденты должны быть определены с помощью:
- анализа внутренних аудитов;
- отчетов об инцидентах;
- возможности для улучшения;
- анализа потенциального риска.
Схема общего аналитического процесса может быть использована для выявления потенциальных и фактических причин ошибочных результатов.
Каждый этап этого процесса должен быть проанализирован, чтобы определить оценку вероятности для каждой опасности (см. приложение А).
6 Классификация лабораторных несоответствий, ошибок и инцидентов
Выявленные лабораторные несоответствия, ошибки и инциденты могут быть классифицированы. Классификационные критерии могут включать в себя, но не ограничиваются перечисленными ниже.
a) Фазы цикла события:
1) преаналитические процедуры:
- неправильная идентификация пациента;
- неправильная диагностическая информация или ее отсутствие;
- некорректная интерпретация назначения;
- неправильная подготовка пациента;
- несоответствующий контейнер для биоматериала или консервант;
- неправильная маркировка контейнера-сборника;
- неправильное перемешивание образца;
- неправильное время взятия биоматериала;
- неправильные условия и сроки транспортирования;
2) аналитические процедуры:
- противоречивый результат контроля качества;
- несоответствие в процедуре;
- ошибка оборудования или реагента;
- задержка времени завершения (времени оборота).
Примечание - Задержка по времени может произойти в течение всего лабораторного цикла;
3) постаналитические процедуры:
- неверный результат;
- неправильная запись результата;
- неоднозначный отчет;
- результат приписывают не тому пациенту;
- отчет отправляют не тому пациенту;
- отсутствует информация об ограничениях в интерпретации результата;
b) Расследования лабораторного несоответствия, ошибки или инцидента процесса:
- внутренние или внешние по отношению к лаборатории;
c) Ответственность за события:
- скрытые или активные ошибки;
- когнитивные или непознавательные ошибки;
- внутренние или внешние события по отношению к лаборатории или невозможность их определения;
d) Предотвратимость:
- от тех, которые нельзя предотвратить, до легко предотвратимых;
e) Влияние на лечение пациента:
- отсутствует или минимальное;
- привело к задержке лечения или постановке диагноза;
- привело к неадекватному лечению или диагностике.
7 Предупреждающие и корректирующие действия
Идентификация потенциальных ошибок и лабораторных несоответствий посредством запланированного анализа процессов и выявления влияния изменений является весьма результативной для предотвращения появления ошибок. Лабораторные несоответствия, ошибки и инциденты могут быть идентифицированы при помощи анализа внутренних аудитов, отчетов об инцидентах, возможностей для улучшения или предполагаемого процесса анализа риска.
Предпринятые корректирующие действия, являющиеся следствием идентификации лабораторных несоответствий, приводят к снижению возможности повторного появления несоответствия или аналогичных несоответствий, если процесс расследования при разработке корректирующих действий включает в себя анализ первопричин, которые способствовали несоответствию.
Примечание - Желательно, чтобы тщательный анализ причин учитывал не только вероятную причину ошибки, но также и те факторы, которые могли способствовать возникновению причины. Желательно, чтобы план корректирующих мероприятий был направлен на все сопутствующие факторы.
8 Оценка риска, связанного с фактическими и потенциальными лабораторными несоответствиями
Менеджер по качеству должен установить и поддерживать процессы:
a) идентификации процессов с высоким уровнем риска, в которых потенциальная ошибка может привести к риску в отношении;
b) идентификации фактических инцидентов, связанных с отклонениями от требований стандартов;
c) определения и оценивания связанных рисков в области безопасности пациентов;
d) управления этими рисками;
e) мониторинга результативности управления.
Этот процесс должен учитывать модель риска (см. приложение В) и включать в себя метод оценки риска сбоев в процессе (см. приложение С).
Примечание 1 - Для предполагаемого анализа риска может быть использован метод FMEA или другие методы для определения потенциальных ошибок, проблем или рисков безопасности для пациентов, например процесс анализа опасностей (РНА - Process Hazard Analysis), виды отказов и анализ последствий и критичности отказов [Failure Modes Effects and Criticality Analysis - FME(C)A], анализ дерева отказов (Fault Tree Analysis - FTA), анализ опасных факторов и работоспособности (Hazard and Operability Analysis - HAZOP) и анализ опасностей и критических контрольных точек (Analysis and Critical Control Points - HACCP), ИСО 14971 (приложение G) рассматривает эти методы анализа и их применимость (см. [13]-[15], стандарты [16]-[18]).
Этот процесс должен также включать оценку процессов с потенциально высокой степенью риска на основании результатов ранее проведенных проверок, обследований, опыта или на основе фактических данных литературы о процедурах, где отказ может привести к значительным рискам безопасности для пациентов.
Менеджеру по качеству следует определить команду специалистов для изучения выбранного процесса.
Примечание 2 - Желательно, чтобы члены команды обладали знаниями процесса и последствий отказов.
Примечание 3 - Желательно, чтобы команда состояла из людей с соответствующими уровнем и видами знаний.
Команда специалистов должна обеспечить тщательный анализ процесса, включающий:
- каждую операцию процесса;
- информацию о том, как каждая операция процесса может дать сбой/отказ;
- информацию о том, как каждый отказ на каждой операции процесса может повлиять на безопасность пациентов;
- вероятность и тяжесть последствий каждого вида отказов;
- последствия наиболее критичных отказов;
- потенциальные первопричины влияния наиболее важных видов отказов;
- меры по устранению первопричин.
Примечание 4 - Рейтинг тяжести может быть классифицирован как пренебрежимо малый, незначительный, серьезный, критический и катастрофический. Вероятность может быть классифицирована как невероятная, маловероятная, возможная, вероятная и частая.
Анализ с применением FMEA должен лечь в основу плана предупреждающих действий по потенциальным проблемам или плана корректирующих действий для проблем, которые уже произошли.
9 Анализ лабораторных несоответствий, ошибок и инцидентов
Через равные промежутки времени содержимое файла плана корректирующих действий следует анализировать, чтобы определить схожие факторы и продолжающиеся проблемы, связанные с лабораторными несоответствиями, ошибками и инцидентами.
Лежащие в основе причинные факторы лабораторных несоответствий, ошибок и инцидентов должны быть проанализированы надлежащим образом (см. приложение С).
Результаты анализа следует включать в соответствующие предупреждающие, корректирующие действия и планы постоянного улучшения.
10 Планы предупреждающих и корректирующих действий
Руководство лаборатории должно подготовить план расследования и предотвращения/коррекции любого несоответствия, ошибки или инцидента, идентифицированных с применением FMEA или выявляемых другим образом. Такие планы должны включать в себя:
- область применения плана;
- описание последствий конкретного характера отказа, несоответствия, ошибки или инцидента;
- выявление потенциальных рисков, связанных с потенциальной ошибкой или несоответствием;
- распределение обязанностей в отношении требуемых изменений;
- требования для анализа;
- критерии приемлемости решения;
- потребность в предупреждающих или корректирующих действиях.
11 Файлы плана предупреждающих и корректирующих действий
Все лабораторные предупреждающие действия, корректирующие действия, несоответствия, ошибки и инциденты должны быть зарегистрированы в файле плана корректирующих и предупреждающих действий. Записи поддерживают в рабочем состоянии в соответствии с планом предупреждающих и корректирующих действий. Сформированные файлы следует регулярно анализировать в рамках анализа со стороны руководства.
12 План постоянного улучшения
После того, как расследование было завершено, руководству лаборатории следует проанализировать полученную информацию о собранных лабораторных несоответствиях, ошибках и инцидентах. Эта информация должна быть оценена с точки зрения возможного отношения к пациенту и лабораторной безопасности, особенно с учетом следующего:
- присутствуют ли ранее неидентифицированные опасности;
- аннулируются ли в результате первоначальные оценки лабораторных несоответствий, ошибок и инцидентов.
Если какое-либо из вышеперечисленных условий имеет место, то результаты оценки должны быть снова использованы как входные данные в процессе оценивания.
Кроме того, углубленное расследование первопричин лабораторных несоответствий, ошибок и инцидентов высокого риска следует проводить сразу же в целях предотвращения их повторения.
Приложение А
(справочное)
Анализ характера и последствий отказов
Анализ характера и последствий отказов (FMEA) является методом выявления потенциальных точек отказа в пределах процесса, их воздействия, а также выявления мер по снижению последствий отказов. Применять метод FMEA следует при принятии решения о введении нового процесса в лаборатории.
Хотя невозможно предвидеть все виды отказов, участники лабораторной команды могут сформулировать, насколько это возможно, наиболее обширный список потенциальных видов отказов.
Следует разработать блок-схему продукта/процесса с указанием основных стадий. Основные этапы процесса должны быть связаны между собой линиями, которые указывают, как компоненты или этапы связаны.
Диаграмма показывает логические связи компонентов и устанавливает структуру, вокруг которой FMEA может развертываться.
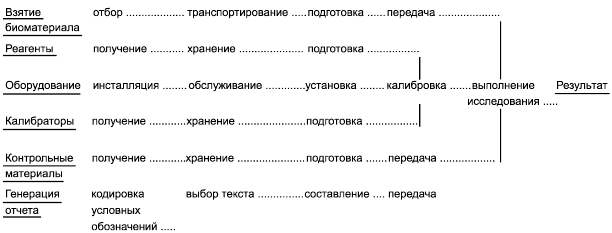
Рисунок А.1 представляет пример карты процесса в медицинской лаборатории, которая включает преаналитический, аналитический и постаналитический этапы, обращение с пробой, реагентами, оборудованием, приборами, калибраторами, контрольными материалами, создание отчета и отчетную документацию.
Рисунок А.1 - Пример карты процесса в медицинской лаборатории
Характер отказа, т.е. каким образом тот или иной процесс потенциально может дать сбой, определяют способом, который позволяет оценить, какими будут окончательные последствия. Последствия отказа определяют как результат сбоя режима процесса, полученный из-за ошибки исследования. Это может быть описано с точки зрения того, с чем пациент может столкнуться в результате возникновения идентифицированного отказа, например неудобство или вред в результате запаздывающих или неточных результатов исследования, диагностики или лечения.
Один характер отказа в одном компоненте может служить причиной другого характера отказа в другом виде деятельности в рамках процесса.
Для каждого идентифицированного вида отказа команда должна определить, какие в конечном итоге будут последствия, и установить численное ранжирование для тяжести последствий с целью определить, с какими отказами работать в первую очередь.
Затем группа должна определить меры управления и другие потенциальные процедуры мониторинга, которые могут предотвратить причину возникновения того или иного характера отказа. Каждая процедура должна быть оценена с целью определения, насколько хорошо она позволяет обнаружить потенциальный отказ.
После того как новый процесс уже применялся, могут появиться ранее необнаруженные или неизвестные виды отказов.
План FMEA по рассмотрению этих отказов должен быть обновлен в целях их предупреждения для продукта/процесса.
Приложение В
(справочное)
Модель для оценки риска причинения вреда
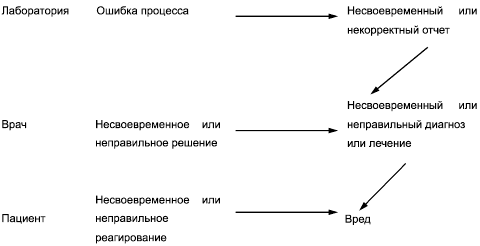
На рисунке В.1 представлен пример модели для оценки риска причинения вреда пациенту вследствие ошибочного результата.
Рисунок В.1 - Пример модели для оценки риска причинения вреда
Согласно этой модели последствия предоставления ошибочного результата врачу будут зависеть от действий врача и медицинской значимости соответствующего лабораторного процесса. Врачи используют результаты лабораторного исследования совместно с другой имеющейся медицинской информацией для оценки здоровья пациента и принятия решения. В некоторых случаях результат лабораторного исследования может быть единственным основанием для принятия медицинского решения.
Вероятность причинения вреда пациенту представляет собой сочетание вероятностей того, что будет происходить в результате каждого события из представленных в модели. Каждая отдельная вероятность частично компенсируется вероятностью того, что отказ, опасность или опасная ситуация будет распознана лабораторией или врачом, что позволяет вмешаться и предотвратить нанесение вреда. Фактическая цепь событий будет зависеть от конкретного лабораторного процесса, а риск от каждой комбинации событий следует оценивать независимо, используя эту схему в качестве ориентира.
Приложение С
(справочное)
Ранжирование уровней тяжести
Реагирование на лабораторные ошибки должно соответствовать вероятности их повторения и возможной степени тяжести их последствий. Риск ошибок, когда они пренебрежимо малы или их последствия малозначительны, может быть допустимым, если существует вероятность их частого повторения. С другой стороны, риск ошибок, которые являются потенциально опасными для жизни, даже если вероятность их возникновения мала, всегда будет неприемлемым. Там, где устранение или существенное уменьшение опасности невозможно, информирование об остаточной опасности можно рассматривать в качестве меры для снижения риска. В таблице С.1 приведен пример ранжирования уровня риска в зависимости от вероятности возникновения тяжести последствий.
Таблица С.1 - Пример ранжирования уровня риска в зависимости от вероятности возникновения тяжести последствий
Вероятность | Тяжесть | ||||
пренебрежимо мала | незначительна | серьезная | критическая | катастрофическая | |
Часто | Неприемлем | Неприемлем | Неприемлем | Неприемлем | Неприемлем |
Вероятно | Приемлем | Неприемлем | Неприемлем | Неприемлем | Неприемлем |
Возможно | Приемлем | Приемлем | Приемлем | Неприемлем | Неприемлем |
Отдаленно | Приемлем | Приемлем | Приемлем | Неприемлем | Неприемлем |
Невероятно | Приемлем | Приемлем | Приемлем | Приемлем | Приемлем |
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации (и действующим в этом качестве межгосударственным стандартам)
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ИСО 9000 | IDT | ГОСТ ISO 9000-2011 "Системы менеджмента качества. Основные положения и словарь" |
ИСО 14971:2007 | IDT | ГОСТ ISO 14971-2011 "Изделия медицинские. Применение менеджмента риска к медицинским изделиям" |
ИСО 15189 | IDT | ГОСТ Р ИСО 15189-2009 "Лаборатории медицинские. Частные требования к качеству и компетентности" |
Руководство ИСО/МЭК 73 | IDT | ГОСТ Р 51897-2011/Руководство ИСО 73:2009 "Менеджмент риска. Термины и определения" |
Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: | ||
Библиография
[1] | ASTION, ML, SHOJANIA, KG, HAMILL, TR, KIM, S and NG, VL, "Classifying laboratory incident reports to identify problems that jeopardize patient safety", American Journal of Clinical Pathology (2003), 120 (1), pp.18-26 |
[2] | KOHN, LT, CORRIGAN, JM and DONALDSON, MS, eds. To Err is Human: Building a Safer Health System, Institute of Medicine, Washington DC: National Academy Press (2000), (3) |
[3] | SPATH, PL, "Using failure mode and effects analysis to improve patient safety", Association of Operating Room Nurses (AORN) Journal (2003), 78 (2), pp.16-37 |
[4] | BONINI, PA, PLEBANI, M, CERIOTTI, F and RUBBOLI, T, "Errors in laboratory medicine", Clin Chem. (2002), 48, pp.691-698 |
[5] | CLSI/NCCLS, A Quality Management System Model for Health Care; Approved Guideline (2nd Edition), NCCLS document HS1-A3, Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087-1898 USA (2004) |
[6] | CLSI/NCCLS, Continuous Quality Improvement: Integrating Five Key Quality System Essentials; Approved Guideline (2nd Edition), NCCLS document GP22-A2, Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087-1898 USA (2004) |
[7] | CLSI/NCCLS, A Quality Management System Model for Health Care; Approved Guideline (2nd Edition), NCCLS document HS1-A3, Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087-1898 USA (2004) |
[8] | CLSI/NCCLS, Quality Management for Unit-Use Testing; Approved Guideline, NCCLS document EP18-A, Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087-1898 USA (2002) |
[9] | REASON, JT, Human Error, New York, NY: Cambridge University Press (1990) |
[10] | DAVIDSON FRAME, J, Managing Risk in Organizations: A Guide for Managers, San Francisco CA: Jossey-Bass (2003) |
[11] | ROBITAILLE, D, The Preventive Action Handbook, Chico, CA: Paton Press (2003) |
[12] | Guidelines for Hazard Evaluation Procedures - With Worked Examples (2nd Edition), Center for Chemical Process Safety/AIChE (1992), ISBN 0-8169-0491-X |
[13] | MIKE, W. Schmidt, The Use and Misuse of FMEA in Risk Analysis, (MDDI March 2004) |
[14] | STAMATIS, D.H., Failure Mode and Effect Analysis: FMEA From Theory to Execution (2nd Edition, 2003), ISBN 0873895983 |
[15] | MIL-STD-1629A, Military Standard Procedures for Performing a Failure Mode, Effects and Criticality Analysis, United States Department of Defense, Washington, DC 20301 (1980) |
[16] | IEC 60812, Analysis techniques for system reliability - Procedure for failure mode and effects analysis (FMEA) (МЭК 60812 Техника анализа надежности систем. Метод анализа видов и последствий неисправностей)* |
[17] | IEC 61025, Fault tree analysis (FTA) (МЭК 61025 Анализ дерева неисправностей)* |
[18] | IEC 61882, Hazard and operability studies (HAZOP studies) - Application guide (МЭК 61882 Исследование опасности и работоспособности)* |
_______________
* Официальный перевод этого стандарта находится в Федеральном информационном фонде технических регламентов и стандартов.
УДК 006.83:006.354 | ОКС 11.100.01 | ОКП 94 0000 |
Ключевые слова: медицинские лаборатории, снижение ошибок, менеджмент риска, постоянное улучшение | ||
Электронный текст документа
и сверен по:
, 2015