ГОСТ Р ИСО 22442-1-2011
Группа Р19
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ, ИСПОЛЬЗУЮЩИЕ ТКАНИ И ИХ ПРОИЗВОДНЫЕ ЖИВОТНОГО ПРОИСХОЖДЕНИЯ
Часть 1
Менеджмент риска
Medical devices utilizing animal tissues and their derivatives. Part 1. Application of risk management
ОКС 11.100.20
ОКП 93 9000
Дата введения 2012-03-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией "Институт медико-биологических исследований и технологий" (АНО "ИМБИИТ") на основе собственного аутентичного перевода на русский язык текста стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 422 "Оценка биологического действия медицинских изделий"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 15 июня 2011 г. N 124-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 22442-1:2007* "Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 1. Менеджмент риска" (ISO 22442-1:2007 "Medical devices utilizing animal tissues and their derivatives - Part 1: Application of risk management").
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
Введение
ИСО (Международная Организация Стандартизации) является всемирной федерацией органов национальных стандартов (организации - члены ИСО). Работа по подготовке международных стандартов обычно осуществляется Техническими комитетами ИСО. Каждая организация-член, заинтересованная в предмете, для которого создавался Технический комитет, имеет право быть представленной в этом комитете. Международные правительственные и неправительственные организации также принимают участие в работе во взаимодействии с ИСО. ИСО тесно сотрудничает с Международной Электротехнической Комиссией (МЭК) по всем вопросам электротехнической стандартизации.
Международные стандарты разрабатываются в соответствии с правилами, приведенными в Директивах ИСО /МЭК, часть 2.
Основной задачей Технических комитетов является подготовка международных стандартов. Проекты международных стандартов, принятые Техническими комитетами, распространяются организациям-членам для голосования. Публикация в качестве международного стандарта требует одобрения не менее 75% организаций-членов с правом голоса.
Необходимо обратить внимание на возможность того, что некоторые элементы данного документа могут подвергаться патентным правам. ИСО снимает с себя ответственность за обозначение каких-либо таковых патентных прав.
ИСО 22442-1 был подготовлен Техническим комитетом ИСО/ТС 194 "Биологическая оценка медицинских изделий", Подкомитет ПК 1 "Безопасность изделий из животной ткани".
ИСО 22442 состоит из следующих частей под общим наименованием "Изделия медицинские, использующие ткани и их производные животного происхождения":
- Часть 1: Менеджмент риска;
- Часть 2: Контроль отбора, сбора и обработки;
- Часть 3: Валидация уничтожения и/или дезактивации вирусов и агентов инфекционной губчатой энцефалопатии (TSE).
1 Область применения
1.1 Настоящий стандарт распространяется на медицинские изделия, за исключением диагностических медицинских изделий in vitro, изготовленных с использованием материалов животного происхождения, являющихся нежизнеспособными или приведенными в нежизнеспособное состояние.
Настоящий стандарт в сочетании с ИСО 14971 определяет процедуру для установления опасности и опасных ситуаций, связанных с такими изделиями, для расчета и оценки возможного риска, контроля такого риска и наблюдения за эффективностью такового контроля. Также настоящий стандарт устанавливает процесс принятия решения для допустимости остаточного риска, учитывая баланс остаточного риска, как определено в ИСО 14971, и ожидаемое медицинское преимущество по сравнению с существующими альтернативами.
1.2 Предназначением настоящего стандарта является предоставление требований и рекомендаций по контролю риска, связанного с опасностями, характерными для медицинских изделий, произведенных с использованием животных тканей или их производных, такими как:
a) контаминация бактериями, плесневыми или дрожжевыми грибами;
b) контаминация вирусами;
c) контаминация агентами, вызывающими инфекционные губчатые энцефалопатии (TSE);
d) материал, вызывающий нежелательные пирогенные, иммунологические или токсикологические реакции.
Схожие принципы могут быть применимы для паразитов и других неклассифицированных патогенных единиц.
1.3 Настоящий стандарт не устанавливает допустимые уровни, так как таковые определяются множеством факторов и не могут быть зафиксированы в настоящем стандарте, за исключением некоторых отдельных производных, отмеченных в приложении С. В приложении С установлены допустимые уровни риска TSE для производных жира, животного угля, молока и производных молока, производных шерсти и аминокислот.
Настоящий стандарт не определяет систему контроля качества для регулирования всех стадий производства медицинских изделий.
Настоящий стандарт не касается использования тканей человека в медицинских изделиях.
Примечания
1 Наличие полной системы контроля качества во время производства не является требованием настоящего стандарта. Тем не менее, обращено внимание на международные стандарты для систем контроля качества (см. ИСО 13485), регулирующие все стадии производства или переработки медицинских изделий.
2 Для рекомендаций по применению настоящего стандарта см. приложение А.
2 Нормативные ссылки
Следующие справочные документы* являются необходимыми для применения данного документа. При датированной ссылке применимо только указанное издание. При ссылке без даты применимо последнее издание указанного документа (включая любые поправки).
_______________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ИСО 10993-1 Биологическая оценка медицинских изделий. Часть 1. Оценка и испытания
ИСО 14971:2007 Изделия медицинские. Применение менеджмента рисков к медицинским изделиям
ИСО 22442-2:2007 Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 2. Контроль отбора, сбора и обработки
ИСО 22442-3:2007 Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 3. Валидация уничтожения и/или дезактивации вирусов и агентов инфекционной губчатой энцефалопатии
3 Термины и определения
В настоящем стандарте применены термины по ИСО 14971, а также следующие термины с соответствующими определениями:
3.1 животное: Любое позвоночное или беспозвоночное [включая земноводных, членистоногих (например, ракообразных), птиц, кораллы, рыб, рептилий, моллюсков и млекопитающих] за исключением человека (Homo sapiens).
3.2 клетка: Наименьшая организованная единица любой живой формы, способная к независимому существованию и к возмещению собственного вещества в подходящей среде.
3.3 производная: Вещество, полученное на основе животного материала путем производственного процесса (пример: гиалуроновая кислота, коллаген, желатин, моноклональные антитела, хитозан, альбумин).
3.4 уничтожение: Процесс удаления, путем которого сокращается число передающихся агентов.
Примечание 1 - Эффективность процесса для уничтожения вирусов и агентов TSE должна быть выражена математически посредством коэффициента сокращения (см. В.2 и ИСО 22442-3:2007, приложение F).
Примечание 2 - Целью уничтожения является предотвращение инфекции или патогенной реакции, вызванной передающимися агентами.
3.5 дезактивация: Процесс, посредством которого сокращена способность передающегося агента вызывать инфекцию или патогенную реакцию.
Примечание 1 - Эффективность процесса для дезактивации вирусов и агентов TSE должна быть выражена математически посредством коэффициента сокращения (см. ИСО 22442-3:2007, приложение F).
Примечание 2 - Целью дезактивации является предотвращение инфицирования передающимися агентами и их размножения.
3.6 медицинское изделие: Любой прибор, аппарат, приспособление, материал или другое изделие, включая программное обеспечение, используемое либо изолированно, либо в комбинации, которое предназначено изготовителем для применения, главным образом, в следующих целях:
- диагностика, профилактика, наблюдение, лечение или облегчение болезни;
- диагностика, наблюдение, лечение, облегчение или компенсация повреждения органов или физического недостатка;
- исследование, замена или изменение анатомии или физиологического процесса;
- контрацепция
и которое не является фармакологическим, иммунологическим или метаболическим средством, но может быть дополнено такими средствами.
Примечания
1 Данное определение было выработано Специальной Группой по Глобальной Гармонизации (GHTF) [39].
2 ИСО 22442 не применим к диагностическим изделиям in vitro.
3.7 нежизнеспособный: Не имеющий потенциала к метаболизму или размножению.
3.8 техническое соглашение: Обязательственный договор между двумя или более сторонами, распределяющий ответственность за технические требования.
3.9 ткань: Построение клеток и/или внеклеточных составляющих.
3.10 передающиеся агенты: Бактерии, плесневые и дрожжевые грибы, паразиты, вирусы, агенты TSE и неклассифицированные патогенные единицы.
4 Процесс контроля риска
4.1 Общая часть
Изготовитель должен обосновать использование животного материала (включая выбор видов животных и тканей), опираясь на приемлемость остаточного риска, учитывая баланс остаточного риска и ожидаемого медицинского преимущества по сравнению с существующими альтернативами.
Применимы требования ИСО 14971 и 4.2-4.5. Соответствие данным требованиям должно быть подтверждено инспекцией документации по контролю риска.
Примечание - Дальнейшее обсуждение медицинского преимущества и анализ соотношения риск-выгода изложены в ИСО 14971:2007, пункт D.6.
4.2 Анализ риска
4.2.1 Установление качественных и количественных характеристик, связанных с безопасностью медицинских изделий
4.2.1.1 Способ контакта изделия с тканями пациента
Количество материала, площадь контактной поверхности и тип материала, контактирующего с тканями тела или жидкостями, а также тип ткани организма или жидкости, с которыми происходит контакт, должны быть предусмотрены в анализе риска. Рекомендации для TSE приведены в D.3.7.
Примечания
1 Медицинские изделия, такие как ортопедическая обувь или компоненты, такие как кожаные ремни, которые контактируют только с неповрежденными кожными покровами, представляют низкий инфекционный риск.
2 Количество контактирующего материала является одним из факторов при определении биологических эффектов (см. ИСО 10993 для оценки таких эффектов).
3 Способ обработки животных тканей может оказать влияние на дезактивацию и/или уничтожение передающихся агентов, а на потенциал к сохранению жизнеспособных клеток может повлиять структура обрабатываемых животных тканей и их производных.
4.2.1.2 Условия включения ткани и/или ее компонентов в медицинское изделие или использование с таковым, или контактирующей с медицинским изделием
Необходимо предусмотреть следующие факторы, по применимости:
a) подтверждение, что готовое медицинское изделие не содержит какого-либо жизнеспособного животного материала, если в производстве медицинского изделия используются жизнеспособные животные материалы;
b) предназначенное использование любой животной ткани или ее производных;
c) географический источник, вид, возраст и корм (включая использование белка животного происхождения) животных;
d) ветеринарный контроль, условия, при которых животные материалы были собраны, потенциал к перекрестной контаминации;
e) тип и анатомический источник ткани;
f) производственный процесс, особенно если в нем использованы материалы, собранные от более чем одного животного;
g) характер материала, используемого в медицинском изделии (например, неповрежденная ткань, высокоочищенная производная ткань);
h) метод использования или включения в медицинское изделие.
Примечание - В случае медицинских изделий, использующих несколько рассматриваемых составляющих (например, различных видов, происхождения или тканей) или несколько схожих типов составляющих, произведенных с использованием разных методов, каждая отдельная составляющая должна быть проанализирована отдельно.
4.2.1.3 Условия стерилизации или применимость других методов микробиологического контроля
Учитывая биологический характер животных тканей и их производных, необходимо оценить колебания бионагрузки животного материала бактериями, а также плесневыми и дрожжевыми грибами.
Примечание - См. ИСО 11737-1, ИСО 14160.
4.2.1.4 Нежелательная экстракция
Возможное наличие токсичного осадка, связанного с применяемым производственным процессом, или побочных продуктов должно быть предусмотрено, принимая во внимание физические характеристики (например, пористость, гетерогенность) и химический состав животных тканей или их производных.
Примечание - См. ИСО 10993-1, ИСО 10993-9, ИСО 10993-17, ИСО 10993-18 и ИСО 10993-19.
4.2.2 Установление факторов опасности и опасных ситуаций
Возможные факторы опасности, связанные с животными тканями или их производными, должны быть установлены и отражены документально.
Особое внимание необходимо уделить факторам возможной опасности, представляемой животными тканями или их производными касательно:
- потенциальной контаминации передающимися агентами и их чувствительности к уничтожению и/или дезактивации в течение обработки;
- потенциала к контаминантам на готовом материале, которые могут вызвать нежелательную пирогенную, иммунологическую или токсикологическую реакцию;
- потенциала самого готового материала вызывать нежелательную пирогенную, иммунологическую или токсикологическую реакцию.
4.3 Оценка риска
В соответствии с ИСО 14971 должны быть оценены все установленные факторы риска. Биологическая безопасность должна быть оценена в соответствии с ИСО 10993-1. Оценка риска передающихся агентов должна быть внедрена отдельным анализом факторов риска, связанных с различными категориями передающихся агентов. В приложении В определены основные категории риска, необходимые к рассмотрению. Касательно риска TSE соответствие требованиям, обозначенным в приложении С для отдельных животных материалов, может обозначать приемлемость риска.
Примечание - В приложении С учтены элементы оценки риска и контроля риска.
4.4 Контроль риска
4.4.1 Общая часть
Варианты контроля риска должны быть отражены документально и обоснованы.
На диаграмме в приложении В приведен обзор процесса контроля риска. Если при использовании настоящего стандарта установлены дополнительные факторы риска, изготовитель медицинского изделия может избрать любой другой уместный стандарт или подход. Решение должно быть обосновано и отражено документально.
4.4.2 Контроль риска вирусов и агентов TSE
Контроль риска следует внедрять отдельным анализом факторов риска, связанных с различными категориями вирусов и агентов TSE. После определения характеристик продукта изготовитель медицинского изделия должен выполнять соответствующие требования как ИСО 22442-2, так и ИСО 22442-3, кроме тех случаев, когда либо вид животных не позволяет изготовителям полностью удовлетворить требования ИСО 22442-2, либо процесс дезактивации в соответствии с ИСО 22442-3 вызовет неприемлемую деградацию.
Производные жира, животный уголь и аминокислоты, приемлемые для риска TSE согласно рассмотрению в приложении С по причине их обработки, а не источника, также должны быть отнесены к имеющим приемлемый риск касательно вирусов.
В отношении риска TSE меры контроля, обозначенные в приложении С для определенных животных материалов, должны быть приняты по применимости. Если изготовитель считает любое требование неприменимым, причина и обоснование должны быть отражены документально.
Для медицинских изделий, в которых процесс дезактивации вызывает неприемлемую деградацию, изготовители могут применять ИСО 22442-2 для соответствия требованиям настоящего стандарта.
Если вид животных таков, что изготовители не могут полностью обеспечить соответствие требованиям ИСО 22442-2, они должны показать, что уровень дезактивации передающихся агентов в утвержденном производственном процессе достаточен для достижения приемлемого уровня риска согласно требованиям ИСО 22442-3.
Примечание - Критерии и принципы, относящиеся к контролю рисков TSE, описаны в приложении D. В приложении D приведена информация по соответствующим мерам контроля риска.
4.4.3 Контроль риска других факторов опасности
Контроль риска, связанного с бактериями, плесневыми и дрожжевыми грибами, а также нежелательными пирогенными, иммунологическими и токсикологическими реакциями, следует внедрять согласно существующим стандартам.
Производные жира, животный уголь и аминокислоты, приемлемые для риска TSE согласно рассмотрению в приложении С по причине их обработки, а не источника, также должны быть отнесены к имеющим приемлемый риск касательно бактерий, а также плесневых и дрожжевых грибов, учитывая выполнение надлежащих условий хранения.
Изготовитель должен проводить периодические микробиологические исследования для установления и квантификации исходной бионагрузки поступающего животного материала для производства медицинского изделия.
Примечание - Международными стандартами, которые могут быть применимыми, являются:
a) ИСО 11135, ИСО 11137, ИСО 11737-1, ИСО 13408, ИСО 14160, ИСО 14937, ИСО 17664 и ИСО 17665-1, которые могут быть уместны для бактерий, а также плесневых и дрожжевых грибов (см. библиографию);
b) все соответствующие части ИСО 10993, которые могут быть использованы для контроля факторов риска, связанных с нежелательными пирогенными, иммунологическими или токсикологическими реакциями (см. библиографию).
Использование этих международных стандартов проиллюстрировано в приложении В.
4.4.4 Оценка остаточного риска
4.4.4.1 Общая часть
Оценка остаточного риска должна быть проведена для каждого фактора риска.
4.4.4.2 Риск TSE
Риск TSE может быть признан приемлемым при соответствии всем приведенным ниже критериям с учетом наличия альтернативных материалов:
a) оценка остаточного риска показывает, что риск TSE был проконтролирован на достаточном уровне;
b) медицинское преимущество от предназначенного использования изделия признано превосходящим оценку остаточного риска.
Примечание - Рекомендации по контролю риска, применимого к агентам TSE, приведены в приложении D. Приемлемость может быть основана на соответствии особым требованиям для отдельных животных материалов, приведенным в приложении С, или требованиям, касающимся источников, сбора и обращения с материалами крупного рогатого скота, приведенным в приложении А ИСО 22442-2:2007.
Особые соображения приведены в приложении С в отношении остаточного риска TSE. Некоторые производные, такие как производные жира, животный уголь, производные молока, шерсти и аминокислоты, выработанные в соответствии с условиями, отмеченными в приложении С, считаются представляющими приемлемый риск ТSЕ.
В случаях, когда риск ТSЕ не был проконтролирован на уровне, представляющем достаточный уровень риска для пользователей или реципиентов, общий риск может быть признан достаточным только при уравновешивании факторами исключительного преимущества и выполнимости.
4.5 Оценка приемлемости общего остаточного риска
4.5.1 Общая часть
При оценке приемлемости общего остаточного риска следует учитывать баланс между остаточным риском после внедрения всех мер контроля риска и ожидаемым медицинским преимуществом по сравнению с существующими альтернативами. В случаях наличия факторов остаточного риска касательно контаминации передающимися агентами оценка должна особо рассмотреть факторы риска и выгоды при:
- использовании альтернативных материалов, не представляющих риска контаминации данными передающимися агентами, таких как синтетические материалы, материалы от других животных видов или материалы человеческого происхождения, и
- применении альтернатив изделию в целом для тех же предполагаемых целей.
В случаях, когда риск не был проконтролирован на уровне, представляющем приемлемый уровень риска для пользователей или реципиентов, общий риск может быть признан приемлемым только при уравновешивании факторами исключительного преимущества и выполнимости.
4.5.2 Документация
Рациональная основа приемлемости риска должна быть отражена в документации по контролю риска.
4.6 Производственная и постпроизводственная информационные системы
Изготовители должны обеспечить определение системой изменений в зоонозном статусе избранного источника животных материалов.
Приложение А
(справочное)
Рекомендации по применению настоящего стандарта
А.1 Общая часть
В ситуациях, обозначенных в настоящем стандарте как нуждающиеся в "предусмотрении", необходимо либо принять меры по контролю риска, либо обосновать в отчете контроля риска, почему этого не было сделано.
А.2 Применение к материалам из животных источников
Настоящий стандарт применим к таким материалам как:
- свиные сердечные клапаны, бычьи кости, лигаменты рогатого скота и бычий перикард;
- производные животных тканей, такие как сульфат хондроитина, полученный из акул, и коллаген, произведенный из шкур, а также животных крови и сыворотки;
- материалы, произведенные in vivo соответствующими животными, например антитела, используемые в производственном процессе;
- исходные материалы, такие как альбумин бычьей сыворотки, ферменты, культуральная среда, включая используемые для приготовления рабочих банков клеток, маточных банков клеток или маточной затравки для таких продуктов как гиалуроновая кислота.
А.3 Применение к материалам, поставленным третьими лицами
Настоящий стандарт может быть применен, когда материалы, используемые изготовителями медицинского изделия, были приготовлены из животных источников третьими лицами или субподрядчиками. Примером является желатин, полученный из животных шкур или костей. При рассмотрении риска, связанного с использованием этих продуктов, изготовители медицинского изделия должны запросить у своих поставщиков доказательства того, что при оценке пригодности животного материала были применены соответствующие требования ИСО 22442 либо были использованы альтернативные подходы. Полученная информация должна быть по применимости включена в отчет контроля риска, связанного с медицинским изделием, но может нуждаться в дополнении информацией, полученной от третьих лиц или субподрядчика.
Приложение В
(справочное)
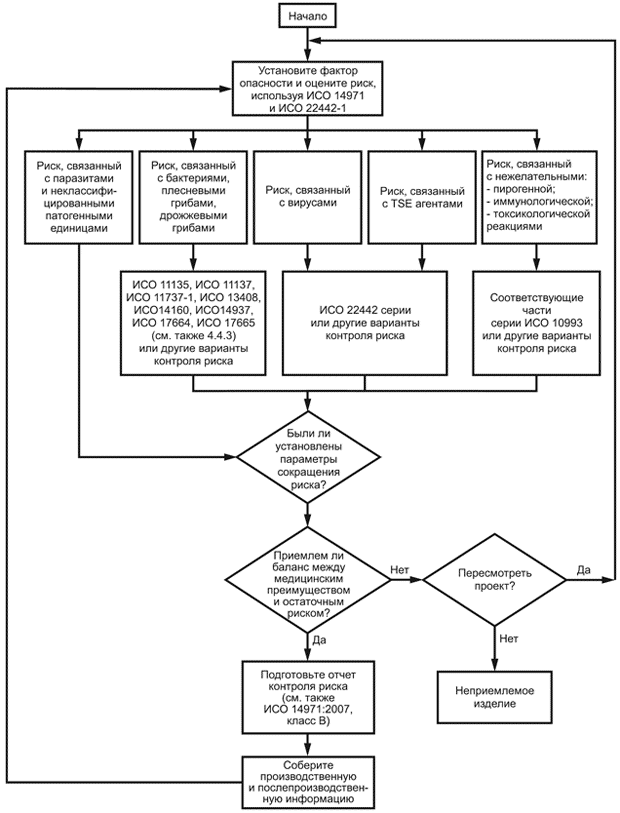
Графическое отображение части процесса контроля риска для медицинских изделий, использующих животный материал
Графическое отображение части процесса контроля риска для медицинских изделий, использующих животный материал, приведено на рисунке В.1.
Рисунок В.1 - Графическое отображение части процесса контроля риска
Данная схема иллюстрирует часть процесса контроля риска в соответствии с ИСО 14971 и настоящим стандартом. Процесс контроля риска должен предусматривать все рассматриваемые факторы риска, показанные на данной схеме.
Приложение С
(справочное)
Специальные требования для некоторых животных материалов с учетом контроля риска агентов TSE
С.1 Общая часть
Требования данного приложения не отменяют необходимость проведения оценки риска TSE, включая требования, изложенные в разделе 4 в качестве части процесса оценки и контроля риска, описанного в ИСО 14971.
Контроль риска может быть предусмотрен посредством обработки, источников или сочетанием обоих. Производные жира, животный уголь и аминокислоты приемлемы для риска TSE по причине их обработки, а не источника.
Приложение А ИСО 22442-2:2007 содержит дополнительные требования, относящиеся к применению настоящего стандарта к материалам из материалов животного происхождения (быков).
Для демонстрации соответствия требованиям настоящего стандарта необходимо привести в исполнение техническое соглашение между изготовителем медицинского изделия и поставщиком животного материала/производной (см. ИСО 22442-2:2007, раздел 6).
С.2 Коллаген
Коллаген является волокнистым белковым компонентом соединительной ткани млекопитающих.
Для коллагена необходимо предоставить документацию для демонстрации соответствия настоящему стандарту, учитывая соответствующие требования данного приложения.
При выполнении контроля риска, требуемого настоящим стандартом, необходимо учитывать следующее:
- для коллагена, произведенного из кости, кость должна быть получена из стран с минимальной подверженностью BSE (губчатой энцефалопатии крупного рогатого скота). Страны с ограниченной подверженностью BSE как источники кости должны быть обоснованы посредством ссылки на другие применимые меры контроля риска (см. приложение А ИСО 22442-2:2007). Недопустима кость, происхождением из стран, где инфицирование агентом BSE подтверждено на более высоком уровне, если источником не является стадо низкого риска, определенное в ИСО 22442-2;
- для коллагена, произведенного из костей, применимы производственные условия, обозначенные для желатина (см. ниже);
- коллаген, полученный из шкур и кожи, обычно не представляет значительного риска TSE, при условии, что во время их заготовки не допускается перекрестная контаминация потенциально инфицированными материалами, например тканями центральной нервной системы. Для демонстрации соответствия требованиям настоящего стандарта необходимо ввести меры по предотвращению перекрестной контаминации (см. ИСО 22442-2) и отразить документально меры, принятые согласно техническому соглашению между поставщиком коллагена и изготовителем медицинского изделия для предотвращения такой перекрестной контаминации.
Коллаген должен быть получен от животных, признанных годными для потребления человеком (см. ИСО 22442-2).
Примечания
1 "Минимальный риск BSE" следует понимать как Географический Риск BSE (GBR) I*, или страны в списке Службы Инспекции Состояния Животных и Растений (APHIS)**, или от стада низкого риска, как определено в ИСО 22442-2.
_______________
* Европейский Союз опубликовал документы по Географическому Риску BSE для ряда стран, доступные на веб-сайте Научного Совета по Планированию Комитета при Правительстве Евросоюза: http://europa.eu.int/comm/food/fs/sc/ssc/ouuutcome_en.html.
Список, разрешенный Европейским Управлением Безопасности Пищевых Продуктов, находится по следующему адресу: http://www.efsa.eu.int/science/tse_assessments/gbr_assessments/catindex_en.html.
** Разрешенный список, публикуемый Службой Инспекции Состояния Животных и Растений, находится на http://www.aphis.usda.gov/vs/ncie/country.htm/#BSE.
2 "Ограниченный риск TSE" следует понимать как GBR II или GBR III.
С.3 Желатин, произведенный из шкур и костей
С.3.1 Общая часть
Желатин является естественным растворимым белком, застудневающим или незастудневающим, получаемым частичным гидролизом коллагена, полученного из костей, шкур и кож, жил и сухожилий животных.
Для желатина необходимо предоставить документацию, демонстрирующую соответствие настоящему стандарту, учитывая применимые требования, приведенные в данном приложении.
Желатин должен быть получен от животных, признанных годными для потребления человеком.
При выполнении оценки и контроля риска, требуемых настоящим стандартом, необходимо принять во внимание положения С.3.2-С.3.4.
С.3.2 Шкуры в качестве исходного материала
Основываясь на существующем опыте, шкуры, используемые для производства желатина, представляют более безопасный исходный материал по сравнению с костями.
Желатин, полученный из шкур, обычно не представляет значительного риска BSE, при условии, что во время их заготовки не допускается перекрестная контаминация потенциально инфицированными материалами, например тканями центральной нервной системы. Для демонстрации соответствия требованиям настоящего стандарта необходимо ввести меры по предотвращению перекрестной контаминации (см. ИСО 22442-2) и отразить документально меры, принятые согласно техническому соглашению между поставщиком желатина и изготовителем медицинского изделия для предотвращения такой перекрестной контаминации.
С.3.3 Кости в качестве исходного материала
При использовании костей для производства желатина качество исходных материалов является основным параметром, обеспечивающим безопасность готового изделия. Таким образом, необходимо применить следующее:
- с учетом национального законодательства, кости должны быть получены из стран с минимальным или ограниченным риском BSE. Недопустима кость, происхождением из стран, где инфицирование агентом BSE подтверждено на более высоком уровне, если источником не является стадо низкого риска, определенное в ИСО 22442-2;
- череп и спинной мозг должны быть удалены из собранных костей (сырье/исходный материал) рогатого скота определенного возраста, как предписано в национальном законодательстве;
- дополнительно необходимо удалить позвоночники из сырья/исходных материалов от рогатого скота любого возраста из стран с ограниченным риском BSE.
С.3.4 Производственные методы
Не требуется никаких особых мер касательно условий обработки для желатина, полученного из шкур, с условием, что были установлены меры контроля во избежание перекрестной контаминации как в течение забора шкур, так и во время производственного процесса (см. С.3.2).
При использовании костей в качестве исходного материала необходимо применить один из описанных ниже производственных методов:
- хотя процесс щелочения (до завершающих стадий) показал немного более высокую способность к дезактивации/уничтожению по сравнению с процессом с применением кислоты, как кислотный, так и щелочной методы производства для выработки конечного желатина показали в общем схожие дезактивацию/уничтожение инфицированности BSE в валидационных испытаниях желатина. Исследования показали, что дополнительная щелочная обработка (рН 13 в течение 1 ч) костей/оссеина далее повышает способность кислотного производственного процесса к дезактивации/уничтожению BSE;
- для обычного щелочного производственного процесса кости мелко раздроблены, обезжирены горячей водой и деминерализованы разведенной хлористоводородной кислотой (концентрацией не меньше 4% и рН менее 1,5) в течение периода длительностью не менее двух дней для выработки оссеина. За этим следует щелочная обработка насыщенным раствором извести (как минимум, рН 12,5) в течение периода длительностью не менее 20 дней. Желатин экстрагируют, промывают, фильтруют и концентрируют. При меняют ступень обработки быстрым нагревом, используя температуру от 138 °С до 140 °С на 4 с. Кости рогатого скота также могут быть обработаны процессом с использованием кислоты. Ступень известкования в таком случае заменена кислотной предобработкой, при которой оссеин вымачивают в течение одной ночи при рН менее 4. При процессе нагрева/давления высушенные обезжиренные раздробленные кости автоклавируют насыщенным паром при давлении, превышающем 3 бар, и минимальной температуре в 133 °С в течение по меньшей мере 20 мин, после чего следует экстракция белка горячей водой. Завершающие стадии как кислотного процесса, так и процесса нагрева/давления схожи с щелочным процессом.
С.4 Производные бычьей крови
С.4.1 Общая часть
Сыворотку бычьего плода часто используют в клеточных культурах. Сыворотка бычьего плода должна быть получена от зародышей, забранных на бойне от здоровых самок, годных для потребления человеком, и матка должна быть полностью удалена. Кровь плода следует забирать в специально отведенном месте или участке путем пункции сердца, в закрытую систему сбора, используя стерильный метод.
Сыворотку новорожденного теленка получают от телят возрастом до 20 дней либо от животных возрастом менее 12 мес. В случае донорской бычьей сыворотки, при условии, что она может быть получена от животных возрастом менее 36 мес, статус BSE донорского стада должен быть четко определен и отражен документально. Во всех случаях сыворотку должны забирать сотрудники, подготовленные к таким процедурам, следуя обозначенным протоколам и мерам предосторожности, необходимым для избежания перекрестной контаминации с тканями более высокого риска.
Для производных бычьей крови необходимо предоставить документацию, демонстрирующую соответствие настоящему стандарту, учитывая соответствующие требования данного приложения. При выполнении контроля риска, требуемого настоящим стандартом, необходимо принять во внимание положения С.4.2-С.4.4.
С.4.2 Отслеживаемость
Отслеживание до бойни должно быть гарантировано для каждой партии сыворотки или плазмы. Бойни должны иметь в наличии списки ферм, откуда были получены животные. Если сыворотка получена от живых животных, для каждой партии сыворотки должна существовать документация для обеспечения отслеживавмости до ферм и до отдельных животных. В случаях, когда отслеживаемость до отдельного животного не является возможной, это должно быть обосновано в документации контроля риска.
С.4.3 Географическое происхождение
Бычья кровь должна быть получена из стран с минимальным риском BSE, если не обосновано и не санкционировано иное.
С.4.4 Методы забоя
Если кровь получена от забитых животных, метод забоя является важным для обеспечения безопасности материала. Было доказано, что оглушение электрошоком определенного разряда с прокалыванием или без, а также пневматическим оглушителем, особенно если таковой впускает воздух, может разрушить мозг и распространить мозговой материал по системе кровообращения. Существуют данные, что непроникающее оглушение может вызывать эмболию центральной нервной системы (ЦНС). Методы забоя должны быть описаны для процесса сбора бычьей крови, кроме случаев, когда материал был получен из страны с незначительным географическим риском BSE (см. ИСО 22442-2:2007, А.3.1).
Когда источником крови являются страны с ограниченным риском BSE, для забоя животных возрастом более 12 мес необходимо использовать непроникающий оглушитель или электронаркоз. Применение непроникающего оглушения должно быть обосновано применением оценки риска распространения частиц мозга в крови.
Примечание - Дополнительная информация по методам оглушения находится в документах Научного Совета по Планированию (SSC) по методам оглушения и риску BSE (Риск распространения частиц мозга в крови и туше при применении некоторых методов оглушения), принятых на совещании от 10-11 января 2002 г. (http://europa.eu.int/comm/food/fs/sc/ssc/out245_en.pdf) и документах Рабочей Группы Европейского Управления Безопасности Пищевых Продуктов (EFSA) по риску BSE от распространения частиц мозга в крови и туше, Вопрос номер EFSA-Q-2003-122, принятых 21 октября 2004 г. (http://www.efsa.europa.eu/en/science/biohaz/biohaz-opinions/731.html)
С.5 Производные жира
Жиром называют жир, получаемый из тканей, включая подкожные, брюшные и межмышечные области и кости.
Считается, что производные жира, такие как глицерол и жирные кислоты, выработанные из жира путем строгих процессов, имеют малую вероятность инфицированности. По этой причине такие материалы, выработанные при условиях, по меньшей мере, таких же строгих, как приведенные ниже, должны рассматриваться как представляющие приемлемый риск ТSЕ, вне зависимости от географического происхождения и характера тканей, из которых получены производные жира.
Примерами строгих процессов являются:
a) переэтерификация или гидролиз при температуре не менее чем 200 °С в течение не менее чем 20 мин под давлением (производство глицерола, жирных кислот и эфиров жирных кислот);
b) сапонификация раствором гидроксида натрия при концентрации в 12 моль/л (производство глицерола и мыла);
c) периодический процесс: при температуре не менее чем 95 °С в течение не менее чем 3 ч;
d) непрерывный процесс: при температуре не менее чем 140 °С, под давлением в течение не менее чем 8 мин или аналогичные условия;
e) дистилляция при температуре 200 °С.
С.6 Животный уголь
Животный уголь изготовляют карбонизацией животных тканей, таких как кости, используя температуру выше 800 °С.
Вне зависимости от географического происхождения и характера тканей, животный уголь, приготовленный при этих условиях, должен рассматриваться как представляющий приемлемый риск ТSЕ.
С.7 Молоко и производные молока
Определенные материалы, включая лактозу, экстрагируют из молочной сыворотки, жидкости, отработанной при производстве сыра после коагуляции. Коагуляция может включать в себя использование сычужного фермента теленка, экстракт сычугов или сычужный фермент, полученный от других жвачных. Была проведена оценка риска для лактозы и других производных молочной сыворотки, полученных с использованием сычужного фермента теленка*, и сделано заключение о том, что риск ТSЕ незначителен, если сычужный фермент теленка выработан в соответствии с процессом, описанным в отчете оценки риска Комитета по Запатентованным Лекарственным Препаратам (СРМР) [42]. С учетом национального законодательства, производные молока, выработанные согласно условиям, приведенным ниже, считаются представляющими приемлемый риск ТSЕ:
- молоко получено от здоровых животных при тех же условиях, что и молоко, получаемое для потребления человеком;
- никакие другие материалы, полученные от жвачных, за исключением сычужного фермента теленка, не использовались в приготовлении таких производных (например, перевары казеина панкреатическими ферментами).
_______________
* Комитет по Запатентованным Лекарственным Препаратам и его Биотехнологическая Рабочая Группа провели оценку риска и нормативов лактозы, приготовленной с использованием сычужного фермента теленка. Оценка риска включала источник животных, отделение сычугов и наличие четко определенных процедур гарантии качества. Качество любых заменителей молока, используемых для корма животного, от которого получены сычуги, является особенно важным.
С.8 Шерсть и ее производные
Шерсть и ее производные, такие как ланолин и спирты шерстяного жира, должны отвечать требованиям настоящего стандарта при условии, что шерсть получена от живых здоровых животных.
Производные шерсти, выработанные из шерсти, полученной от забитых животных, признанных "годными для потребления человеком", считаются представляющими приемлемый риск ТSЕ, если производственный процесс отвечает, по меньшей мере, одному из условий обработки, приведенных ниже, касательно рН, температуры и продолжительности обработки:
- обработка при рН, более или равном 13 (начальная; соответствует концентрациям гидроксида натрия, более или равным 0,1 моль/л), при температуре, более или равной 60 °С, в течение по меньшей мере 1 ч; это обычно происходит во время стадии щелочной экстракции;
- молекулярная дистилляция при температуре, более или равной 220 °С, под сниженным давлением.
С.9 Аминокислоты
Аминокислоты могут быть получены гидролизом животных материалов из различных источников.
Аминокислоты, приготовленные с использованием следующих условий обработки, считаются представляющими приемлемый риск ТSЕ:
- аминокислоты, выработанные из шкур и кожпроцессом, включающим воздействие на материал рН от 1 до 2, последующим рН более 11, последующей тепловой обработкой при температуре 140 °С в течение 30 мин при 3 бар;
- полученные аминокислоты или пептиды должны быть отфильтрованы после выработки;
- необходимо провести анализ, используя утвержденный и чувствительный метод для контроля каких-либо остаточных неповрежденных макромолекул с установленным обоснованным пределом.
Приложение D
(справочное)
Информация, связанная с контролем риска TSE
D.1 Общая часть
Естественно случающиеся инфекционные губчатые энцефалопатии (TSE) включают почесуху (у овец и коз), хроническую изнуряющую болезнь (у чернохвостых оленей и лосей), губчатую энцефалопатию крупного рогатого скота (BSE) у рогатого скота, а также кур и болезнь Крейтцфельдта-Якоба (CJD) у людей. Обнаружение in vivo агентов, вызывающих эти заболевания, является сложным. После многолетних латентных периодов агенты вызывают заболевание и, наконец, ведут к летальному исходу. Какие-либо терапевтические меры неизвестны.
Существующая информация о характеристиках возбудителей ограничена. Они чрезвычайно устойчивы к большинству химических и физических процедур, дезактивирующих обычные вирусы. Они не вызывают обнаруживаемого иммунного ответа. Существуют естественные барьеры, ограничивающие межвидовое распространение передающегося агента, но при соответствующих условиях они могут быть преодолены. Это обычно зависит от штамма, дозы, способа воздействия и видового барьера. Испытания на лабораторных животных показали, что внутрицеребральная инокуляция является наиболее эффективным путем передачи.
D.2 Риск для человека
Существуют значительные косвенные доказательства, что вариантная форма человеческого CJD (vCJD) проистекает от BSE, и разумно утверждать, что агент BSE может передаваться человеку. Таким образом, настоящий стандарт содержит ряд требований, обеспечивающих контроль факторов риска при использовании биологических материалов от видов, подверженных TSE, для производства медицинских изделий. В данном приложении приведены рекомендации, которые необходимо соблюдать для сведения к минимуму риска контаминации. В нем определено, когда применимы требования, указанные в настоящем стандарте, и когда уместна информация из других источников. Все изделия следует рассматривать в индивидуальном порядке.
D.3 Контроль риска агентов TSЕ
D.3.1 Принцип
Безопасность медицинского изделия с точки зрения его потенциала передачи агента TSE зависит от ряда факторов, восемь наиболее важных из которых приведены ниже и должны быть проанализированы, оценены и урегулированы:
- используемые животные виды (см. D.3.2);
- географические источники (см. D.3.3);
- характер исходной ткани (см. D.3.4);
- контроль забоя и обработки для предотвращения перекрестной контаминации (см. D.3.5);
- методы, используемые для дезактивации или удаления агентов TSE (см. D.3.6);
- количество исходного материала животного происхождения, требуемого для выработки одной единицы медицинского изделия (см. D.3.7.1);
- количество материала животного происхождения, контактирующего с пациентами и пользователями (см. D.3.7.2);
- способ введения/администрации (см. D.3.7.3).
При наличии выбора у изготовителей предпочтительно использование материалов от животных видов, не имеющих отношения к TSE, или материалов неживотного происхождения.
D.3.2 Используемые животные виды (см. ИСО 22442-2)
Риск TSE связан с истоковым видом, штаммами и характером исходной ткани.
Так как накапливание инфицированности TSE происходит в течение инкубационного периода в несколько лет, забор от молодых здоровых животных считается фактором снижения риска. Использование животных постарше может повысить риск.
Использование в качестве источников животных в возрасте до 6 мес может предоставить пониженный уровень риска. Использование павших животных, животных, забитых в аварийно-защитных целях, а также животных с подозрением на TSE может значительно повысить риск и должно быть исключено. Факторы риска такого характера предусматриваются путем демонстрации соответствия требованиям в ИСО 22442-2:2007, приложение А.
D.3.3 Географические источники (см. ИСО 22442-2)
Определенные факторы влияют на географический риск инфекции BSE, связанный с использованием сырьевых тканей или производных из отдельных стран. Они применимы конкретно к BSE, но могут также быть использованы для определения риска от TSE в других видах.
Примечание - Изготовители должны учитывать опубликованные экспертные оценки, касающиеся риска BSE, связанного с определенными странами.
Примеры:
1 Европейский Союз опубликовал документы по Географическому Риску BSE (GBR) для ряда стран (доступно на сайте Научного Совета по Планированию Комитета при Правительстве Евросоюза: http://europa.eu.int/comm/food/fs/sc/ssc/outcome_en.html).
2 Департамент Сельского Хозяйства США опубликовал список разрешенных и несанкционированных стран-источников (опубликован Службой Инспекции Состояния Животных и Растений, см. сноску 2) к С.2, приложение С): http://www/efsa.eu.int/science/tse_assessments/gbr_assessments/catindex_en.html.
3 Министерство здоровья, труда и благосостояния Японии также опубликовало список разрешенных и несанкционированных стран-источников (см. библиографию [45]).
Кодекс Наземных Животных ВОЗЖ (OIE), относящийся к BSE, доступен на сайте http://www.oie.int/eng/normes/mcode/en_chapitre_2.3.13.htm.
D.3.4 Характер исходной ткани
Изготовитель должен учитывать классификацию факторов опасности, связанных с различными типами исходной ткани. По возможности, соответственно местным обычаям и практикам, источники животной ткани должны подвергаться контролю и индивидуальной инспекции ветеринаром, а туша животного должна быть сертифицирована как годная для потребления человеком. Изготовитель не должен использовать в качестве источника животную ткань, классифицированную как имеющую потенциально высокую инфицированность TSE. Единственным исключением являются случаи отсутствия альтернативной исходной ткани и значительного медицинского преимущества для пациента.
Классификация факторов опасности, связанных с различными типами исходного животного материала, была установлена и утверждена Всемирной Организацией Здравоохранения [41]. Таблицы D.1-D.3 основаны на классификации тканей ВОЗ в 2006 г. Оценки риска должны быть пересмотрены в свете более современной информации по мере ее поступления и должны учитывать уровень неопределенности, свойственный существующим данным.
В таблицах D.1, D.2 и D.3 использованы следующие символы ввода данных:
"+" - наличие инфицированности или PrP*;
"-" - отсутствие инфицированности PrP;
NT - не испытывалось;
NA - неприменимо;
? - спорные или неопределенные результаты;
() - ограниченные или предварительные данные.
_______________
* PrP= белок приона - инфекционная изоформа TSE.
Таблица D.1 - Категория А: ткани с высокой инфицированностью
Ткани ЦНС, которые приобретают титр инфицированности в поздних стадиях TSE, и некоторые ткани, анатомически связанные с ЦНС | ||||||||
Ткани | TSE человека | Рогатый скот | Овцы и козы | |||||
vCJD | Другие TSE | BSE | Почесуха | |||||
инфициро- | PrP | инфициро- | PrP | инфициро- | PrP | инфициро- | PrP | |
Головной мозг | + | + | + | + | + | + | + | + |
Спинной мозг | + | + | + | + | + | + | + | + |
Сетчатка глаза | NT | + | + | + | + | NT | NT | + |
Зрительный нерв | NT | + | NT | + | + | NT | NT | + |
Спинно-мозговые узлы | + | + | NT | + | + | NT | NT | + |
Тройничные узлы | + | + | NT | + | + | NT | NT | + |
Гипофиз | NT | + | + | + | - | NT | + | NT |
Твердая мозговая оболочка | NT | - | + | - | NT | NT | NT | NT |
| ||||||||
Таблица D.2 - Категория В: ткани с более низкой инфицированностью
Периферические ткани с положительным анализом на инфицированность и/или PrP | ||||||||
Ткани | TSE человека | Рогатый скот | Овцы и козы | |||||
vCJD | Другие TSE | BSE | Почесуха | |||||
инфициро- | PrP | инфициро- | PrP | инфициро- | PrP | инфициро- | PrP | |
Периферическая нервная система | ||||||||
Периферические нервы | + | + | (-) | + | + | + | + | + |
Кишечные сплетения | NT | + | NT | (-) | NT | + | NT | + |
Лимфоретикулярные ткани | ||||||||
Селезенка | + | + | + | + | - | - | + | + |
Лимфоузлы | + | + | + | - | - | - | + | + |
Миндалина | + | + | NT | - | + | - | + | + |
Мигательная перепонка | NA | NA | NA | NA | + | - | NT | + |
Вилочковая железа | NT | + | NT | - | - | NT | + | NT |
Пищеварительный тракт | ||||||||
Пищевод | NT | - | NT | - | - | NT | NT | + |
Передний отдел желудка | NA | NA | NA | NA | - | NT | NT | + |
Желудок/сычуг | NT | - | NT | NT | - | NT | NT | + |
Двенадцатиперстная кишка | NT | - | NT | NT | - | NT | NT | + |
Тонкая кишка | NT | + | NT | - | - | NT | NT | + |
Подвздошная кишка | NT | + | NT | - | + | + | + | + |
Аппендикс | - | + | NT | - | NA | NA | NA | NA |
Толстый кишечник | + | + | NT | - | - | NT | + | + |
Репродуктивные ткани | ||||||||
Плацента | NT | - | (+) | - | - | NT | + | + |
Другие ткани | ||||||||
Легкое | NT | - | + | - | - | NT | - | - |
Печень | NT | - | + | - | - | NT | + | NT |
Почка | NT | - | + | - | - | - | - | - |
Надпочечник | NT | + | - | - | NT | NT | + | NT |
Поджелудочная железа | NT | - | NT | - | - | NT | + | NT |
Костный мозг | - | - | (-) | - | (+) | NT | + | NT |
Скелетные мышцы | NT | + | (-) | + | (+) | NT | - | + |
Язык | NT | - | NT | - | - | NT | NT | + |
Кровеносные сосуды | NT | + | NT | + | - | NT | NT | + |
Слизистая носа | NT | NT | NT | + | - | NT | + | + |
Слюнная железа | NT | - | NT | NT | - | NT | + | NT |
Роговица | NT | - | + | - | NT | NT | NT | NT |
Биологические жидкости | ||||||||
ЦСЖ | - | - | + | - | - | NT | + | NT |
Кровь | + | ? | - | ? | - | ? | + | ? |
Тем не менее, несколько лабораторий, используя новые, высокочувствительные методы обнаружения PrP | ||||||||
Таблица D.3 - Категория С: ткани без обнаруженной инфицированности или PrP
Ткани | TSE человека | Рогатый скот | Овцы и козы | |||||
vCJD | Другие TSE | BSE | Почесуха | |||||
инфици- | PrP | инфици- | PrP | инфици- | PrP | инфици- | PrP | |
Репродуктивные ткани | ||||||||
Семенник | NT | - | (-) | - | - | NT | - | NT |
Простата/эпидидимис/семенной пузырек | NT | - | (-) | - | - | NT | - | NT |
Семенная жидкость | NT | - | (-) | - | - | NT | NT | NT |
Яичник | NT | - | NT | - | - | NT | - | NT |
Матка (без беременности) | NT | - | NT | - | - | NT | - | NT |
Плацентные жидкости | NT | NT | (-) | NT | - | NT | NT | NT |
Плод | NT | NT | NT | NT | - | NT | - | - |
Эмбрионы | NT | NT | NT | NT | - | NT | ? | NT |
Скелетно-мышечные ткани | ||||||||
Кость | NT | NT | NT | NT | - | NT | NT | NT |
Сердце/перикардий | NT | - | - | - | - | NT | - | NT |
Жила | NT | NT | NT | NT | - | NT | NT | NT |
Другие ткани | ||||||||
Десенная ткань | NT | - | - | - | NT | NT | NT | NT |
Зубная мякоть | NT | - | NT | - | NT | NT | NT | NT |
Трахея | NT | - | NT | - | - | NT | NT | NT |
Кожа | NT | - | NT | - | - | NT | - | NT |
Жировая ткань | NT | - | (-) | - | - | NT | NT | NT |
Щитовидная железа | NT | - | (-) | - | NT | NT | - | NT |
Молочная железа/вымя | NT | NT | NT | NT | - | NT | - | NT |
Биологические жидкости, секреции и выделения | ||||||||
Молоко | NT | NT | (-) | NT | - | - | - | NT |
Колострум | NT | NT | (-) | NT | (-) | - | - | NT |
Пуповинная кровь | NT | NT | (-) | NT | - | NT | NT | NT |
Слюна | NT | - | - | NT | NT | NT | - | NT |
Пот | NT | NT | - | NT | NT | NT | NT | NT |
Слезы | NT | NT | - | NT | NT | NT | NT | NT |
Носовая слизь | NT | - | - | NT | NT | NT | NT | NT |
Желчь | NT | NT | NT | NT | NT | NT | NT | NT |
Моча | NT | NT | - | - | - | NT | NT | NT |
Кал | NT | NT | - | NT | - | NT | - | NT |
| ||||||||
Помещение данной ткани в ту или иную категорию может зависеть от конкретного заболевания и может быть пересмотрено по мере поступления новых данных в результате все более чувствительных анализов. В сущности, возможно представить, что обнаружение инфицированности с использованием трансгенных мышей, которые сверхэкспрессируют гены, кодирующие различные белки приона, или обнаружение PrP с использованием некоторых недавно разработанных методов амплификации могут оказаться более чувствительными, чем исследования передачи в биопробах диких животных и, таким образом, могут не соотноситься с передачей заболевания в природе.
Также важно осознавать разницу между категориями инфицированности и категориями риска, что требует учета не только уровня инфицированности в ткани, но и количества ткани, контактирующей с человеком или животным, а также пути передачи инфекции. Напри мер, несмотря на то, что уровень инфицированности ткани (концентрация инфицированности в ткани, как отражено титром) является наиболее важным фактором при оценке риска передачи перекрестной контаминацией инструментов во время хирургических процедур (например, нейрохирургия по сравнению с общей хирургией), это только одна определяющая риска передачи путем переливания крови, при котором большое количество материала с низкой инфицированностью вводится непосредственно в систему кровообращения, или риска передачи через пищу, который вне зависимости от высокой или низкой инфицированности, включает относительно неэффективный пероральный путь инфицирования.
D.3.5 Контроль забоя и обработки (см. ИСО 22442-2)
Изготовитель должен обеспечить принятие всех необходимых мер для сведения к минимуму риска перекрестной контаминации во время забоя и обработки.
D.3.6 Методы, используемые для дезактивации или удаления агентов TSE (см. ИСО 22442-3)
Для изделий, которые не могут перенести процесс дезактивации/уничтожения без подвергания неприемлемой деградации, изготовитель должен полагаться в основном на контроль источников (см. ИСО 22442-2).
Для других изделий в случае заявлений изготовителя о способности производственных процессов удалить или дезактивировать агенты TSE таковые должны быть подкреплены соответствующей документацией. Уместная информация из соответствующего обзора научной литературы может быть использована для поддержки факторов дезактивации/уничтожения в случаях, когда определенные процессы, упомянутые в литературе, сопоставимы с используемыми для изделия.
В случае, если обзор литературы не может обосновать заявления, изготовитель должен провести специальное исследование дезактивации и/или уничтожения, которое должно предусмотреть следующее:
- установление опасности, связанной с тканью;
- установление уместных модельных агентов TSE;
- рациональную основу выбора конкретных комбинаций модельных агентов TSE;
- установление стадии, избранной для уничтожения и/или дезактивации агентов TSE;
- вычисление коэффициентов сокращения.
Заключительный отчет должен определить производственные параметры и пределы, критические для эффективности процесса дезактивации или уничтожения.
Необходимо применить надлежащие процедуры, отраженные документально, для обеспечения использования утвержденных параметров обработки во время обычного производства.
D.3.7 Подверженность риску TSE
D.3.7.1 Количество исходного животного материала, необходимого для производства одной единицы медицинского изделия
Изготовитель должен оценить количество необработанных тканей или производных животного происхождения, необходимых для производства одной единицы медицинского изделия. Изготовитель должен оценить, имеет ли производственный процесс потенциал к концентрации уровней агентов TSE, присутствующих в исходных животных тканях или производных.
D.3.7.2 Количество материала животного происхождения, контактирующего с пациентами и пользователями
Изготовители должны учитывать максимальное количество животного материала, который может контактировать с пациентами и пользователями (включая какую-либо абсорбцию и/или деградацию). Необходимо учитывать количество медицинских изделий, которые могут быть использованы в данной процедуре, и число процедур.
D.3.7.3 Путь введения
Необходимо учитывать путь введения, рекомендованный в информации об изделии.
От наивысшего риска до самого низкого, список состоит из:
a) изделий, контактирующих с центральной нервной системой (включая внутриглазной путь введения);
b) изделий, контактирующих с центральной системой кровообращения или вводимых парентерально, или инвазивных, или используемых на открытых ранах, включая язвенные препараты;
c) изделий, требующих введения на неповрежденные слизистые мембраны, например конъюнктивные, внутриносовые, бронхиальные, ректальные, вагинальные, пузырные; изделия, которые должны оставаться в ротовой полости (ротовые, подъязычные) или быть проглоченными;
d) продуктов, предназначенных для нанесения на неповрежденные внешние кожные покровы.
D.3.7.4 Оценка риска подверженности
Необходимо оценить степень подверженности риску TSE и эффект этого на общий риск ТSЕ.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам Российской Федерации
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ИСО 10993-1:1999 | IDТ | ГОСТ Р ИСО 10993-1-2009 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования |
ИСО 14971:2007 | IDТ | ГОСТ Р ИСО 14971-2009 Изделия медицинские. Применение менеджмента риска к медицинским изделиям |
ИСО 22442-2:2007 | IDТ | ГОСТ Р ИСО 22442-2-2011 Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 2. Контроль отбора, сбора и обработки |
ИСО 22442-3:2007 | IDТ | ГОСТ Р ИСО 22442-3-2011 Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 3. Валидация уничтожения и/или дезактивации вирусов и агентов инфекционной губчатой энцефалопатии |
Примечание - В таблице использовано следующее условное обозначение степени соответствия стандартов: - IDT - идентичные стандарты. | ||
Библиография
[1] | ИСО 10993-2 Оценка биологическая медицинских изделий. Часть 2. Требования к охране здоровья животных |
[2] | ИСО 10993-3 Оценка биологическая медицинских изделий. Часть 3. Испытания на генотоксичность, канцерогенность и токсичность, влияющую на репродуктивность |
[3] | ИСО 10993-4 Оценка биологическая медицинских изделий. Часть 4. Выбор испытаний, относящихся к взаимодействию с кровью |
[4] | ИСО 10993-5 Оценка биологическая медицинских изделий. Часть 5. Испытания на цитотоксичность in vitro |
[5] | ИСО 10993-6 Оценка биологическая медицинских изделий. Часть 6. Испытания для определения локальных эффектов после имплантации |
[6] | ИСО 10993-7 Оценка биологическая медицинских изделий. Часть 7. Остатки при стерилизации этиленоксидом |
[7] | ИСО 10993-9 Оценка биологическая медицинских изделий. Часть 9. Структура идентификации и квантификации потенциальных продуктов разложения |
[8] | ИСО 10993-10 Оценка биологическая медицинских изделий. Часть 10. Пробы на раздражение и аллергическую реакцию замедленного типа |
[9] | ИСО 10993-11 Оценка биологическая медицинских изделий. Часть 11. Испытания на системную токсичность |
[10] | ИСО 10993-12 Оценка биологическая медицинских изделий. Часть 12. Подготовка проб и эталонных материалов |
[11] | ИСО 10993-13 Оценка биологическая медицинских изделий. Часть 13. Идентификация и количественная оценка продуктов разложения в полимерных медицинских устройствах |
[12] | ИСО 10993-14 Оценка биологическая медицинских изделий. Часть 14. Идентификация и количественная оценка продуктов разложения керамики |
[13] | ИСО 10993-15 Оценка биологическая медицинских изделий. Часть 15. Идентификация и количественная оценка продуктов разложения металлов и сплавов |
[14] | ИСО 10993-16 Оценка биологическая медицинских изделий. Часть 16. Концепция токсикокинетических исследований продуктов разложения и выщелачиваемых веществ |
[15] | ИСО 10993-17 Оценка биологическая медицинских изделий. Часть 17. Установление допустимых пределов выщелачиваемых веществ |
[16] | ИСО 10993-18 Оценка биологическая медицинских изделий. Часть 18. Определение химических характеристик материалов |
[17] | ИСО 10993-19 Оценка биологическая медицинских изделий. Часть 19. Физико-химическая, морфологическая и топографическая характеристика материалов |
[18] | ИСО 10993-20 Оценка биологическая медицинских изделий. Часть 20. Принципы и методы иммунотоксикологических испытаний медицинских изделий |
[19] | ИСО 11135 Стерилизация медицинских изделий. Оксид этилена. Часть 2. Руководство по применению ИСО 11135-1 |
[20] | ИСО 11137 (все части) Стерилизация медицинской продукции. Требования к валидации и текущему контролю. Радиационная стерилизация |
[21] | ИСО 11737-1 Стерилизация медицинских изделий. Микробиологические методы. Часть 1. Оценка популяции микроорганизмов на продуктах |
[22] | ИСО 13408-1 Асептическая обработка медицинских изделий. Часть 1. Общие требования |
[23] | ИСО 13408-2 Асептическая обработка медицинских изделий. Часть 2. Фильтрация |
[24] | ИСО 13408-3 Асептическая обработка медицинских изделий. Часть 3. Лиофилизация |
[25] | ИСО 13408-4 Асептическая обработка медицинских изделий. Часть 4. Методики очистки на месте |
[26] | ИСО 13408-5 Асептическая обработка медицинских изделий. Часть 5. Стерилизация на месте |
[27] | ИСО 13408-6 Асептическая обработка медицинских изделий. Часть 6. Системы изоляторов |
[28] | ИСО 13485 Изделия медицинские. Системы менеджмента качества. Требования к регулированию |
[29] | ИСО 14160 Стерилизация одноразовых медицинских изделий, содержащих материалы животного происхождения. Валидация и текущий контроль стерилизации жидкими стерилизующими веществами |
[30] | ИСО 14937 Стерилизация медицинской продукции. Общие требования для определения характеристик стерилизующего вещества и для разработки, валидации и текущего контроля процессов стерилизации медицинских изделий |
[31] | ИСО 17664 Стерилизация медицинских изделий. Информация, предоставляемая изготовителем для обработки повторно стерилизуемых медицинских изделий |
[32] | ИСО 17665-1 Стерилизация медицинской продукции. Влажный жар. Часть 1. Требования к разработке, валидации и текущему контролю процесса стерилизации медицинских приборов |
[33] | European Pharmacopoeia, 2.6.8 Pyrogens |
[34] | European Pharmacopoeia, 2.6.14 Bacterial endotoxins |
[35] | European Pharmacopoeia, 5.2.8 Minimizing the risk of transmitting animal spongiform encephalopathy agents via human and veterinary medicinal products |
[36] | US Pharmacopeia <85> Bacterial Endotoxins Test |
[37] | US Pharmacopeia <151> Pyrogen Test |
[38] | Supplement 1, Japanese Pharmacopoeia XIV, 17. Basic Requirements for Viral Safety of Biotechnological/Biological Products, listed in Japanese pharmacopoeia, pp.1618-1631, 2003 |
[39] | Global Harmonization Task Force (GHTF) - Study Group 1 (SG1) Document No. N029R13, Stage PD dated December 2003 (http://www.ghtf.org) |
[40] | WHO Guidelines on Transmissible Spongiform Encephalopathies in relation to Biological and Pharmaceutical Products, 2003 (www.who.int/bloodproducts/publications/en/WHO_TSE_2003.pdf) |
[41] | WHO Guidelines on Tissue Infectivity Distribution in Transmissible Spongiform Encephalopathies, 2006 (http://www.who.int/bloodproducts/cs/TSEPUBLISHEDREPORT.pdf) |
[42] | EMEA/410/01 Rev.2 - October 2003, Note for guidance on minimising the risk of transmitting animal spongiform encephalopathy agents via human and veterinary medicinal products adopted by the Committee for Proprietary Medicinal Products (CPMP) and by the Committee for Veterinary Medicinal Products (CVMP) - Official Journal of the European Union 28.1.2004 |
[43] | EMEA/CPMP/571/02 - February 2002, Public statement on Lactose prepared using calf rennet of the European Agency for the Evaluation of Medicinal Products |
[44] | Terrestrial Animal Health Code from OIE - Office International des Epizooties/World Organisation for Animal Health (http://www.oie.int/) |
[45] | Notification No. 177 of the Ministry of Health, Labour and Welfare on the standard for biological ingredients, 31 March 2005 on Standards for Raw Materials Originating from Living Organisms (http://www.nihs.go.jp/cgtp/cgtp/guidline/03052001.pdf) (in Japanese) |
[46] | MEDDEV 2.11/1, rev 1, February 2004, Guidelines relating to Medical Devices Directives, Application of Council Directive 93/42/EEC taking into account the Commission Directive 2003/32/EC for medical devices utilising tissues or derivatives originating from animals for which a TSE risk is suspected, a guide for manufacturers and notified bodies (http://www.meddev.net/) |
[47] | Assessment of Risk of Bovine Spongiform Encephalopathy in Pharmaceutical Products, Part 1, Pharmaceutical Research and Manufacturers of America (PhRMA) BSE Committee, BioPharm., 11, Number 1, pp.20-31, 56, January, 1998 |
[48] | Assessment of Risk of Bovine Spongiform Encephalopathy in Pharmaceutical Products, Part 2, Example Risk Assessment for a Hypothetical Product, Pharmaceutical Research and Manufacturers of America (PhRMA) BSE Committee, BioPharm., 11, Number 3, pp.18-30, March, 1998 |
Электронный текст документа
и сверен по:
, 2011