ФЕДЕРАЛЬНОЕ АГЕНТСТВО
ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ

НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСТ Р
ИСО 17511-
2022
ИЗДЕЛИЯ МЕДИЦИНСКИЕ ДЛЯ ДИАГНОСТИКИ IN VITRO
Требования к установлению метрологической прослеживаемости значений, приписанных калибраторам, контрольным материалам правильности и образцам биологического материала человека
(ISO 17511:2020, In vitro diagnostic medical devices — Requirements for establishing metrological traceability of values assigned to calibrators, trueness control materials and human samples, IDT)
Издание официальное
Москва Российский институт стандартизации 2022
ГОСТ Р ИСО 17511—2022
Предисловие
1 ПОДГОТОВЛЕН Ассоциацией специалистов и организаций лабораторной службы «Федерация лабораторной медицины» (Ассоциация «ФЛМ») и Федеральным государственным унитарным предприятием «Всероссийский научно-исследовательский институт метрологии им. Д.И. Менделеева» (ФГУП «ВНИИМ им. Д.И. Менделеева») на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 380 «Клинические лабораторные исследования и диагностические тест-системы ин витро»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 10 ноября 2022 г. № 1268-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 17511:2020 «Медицинские изделия для диагностики in vitro. Требования к установлению метрологической прослеживаемости значений, присваиваемых калибраторам, материалам контроля и образцам биологического материала человека» (ISO 17511:2020 «In vitro diagnostic medical devices — Requirements for establishing metrological traceability of values assigned to calibrators, trueness control materials and human samples», IDT).
Международный стандарт разработан Техническим комитетом ISO/TC 212 «Клинические лабораторные исследования и диагностические тест-системы ин витро» Международной организации по стандартизации (ISO).
Наименование настоящего стандарта изменено относительно наименования международного стандарта для приведения в соответствие с ГОСТ Р 1.5—2012 (пункт 3.5).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты, сведения о которых приведены в дополнительном приложении ДА.
Дополнительные сноски в тексте стандарта, выделенные курсивом, приведены для пояснения текста оригинала
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
© ISO, 2020 © Оформление. ФГБУ «Институт стандартизации», 2022
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
II
ГОСТ Р ИСО 17511—2022
Содержание
1 Область применения..................................................................1
2 Нормативные ссылки .................................................................2
3 Термины, определения и сокращения....................................................2
4 Общие требования, предъявляемые к установлению, валидации и документированию
метрологической прослеживаемости значений, определенных с указанным МИ IVD в образцах биологического материала человека ...................................................18
5 Модель иерархии калибровки для метрологической прослеживаемости.......................29
6 Информация о маркировке, предоставляемая изготовителем конечным пользователям.........48
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов национальным стандартам...............................................49
Библиография........................................................................50
III
ГОСТ Р ИСО 17511—2022
Введение
Задачей лабораторной медицины являются исследования измеряемой величины в биологическом материале человека и получение результатов, позволяющих клиницистам оценить риск заболевания или установить диагноз и принять решение по лечению заболевания. Для применения в клинической практике результаты исследования биологического материала человека в различных лабораториях или с использованием разных медицинских изделий для диагностики in vitro (МИ IVD) в одной лаборатории должны быть эквивалентны независимо от использованных методик измерения. Эквивалентность результатов позволяет единообразно применять пределы значений, используемых при принятии медицинских решений, и референтные интервалы, что может снизить риск причинения вреда, вызванного медицинскими решениями, основанными на неэквивалентных результатах обследования. Эквивалентность результатов, полученных различными МИ IVD для одной и той же измеряемой величины, имеет также важное значение для анализа результатов исследований медицинской документации, направленных на поддержку клинических решений, и при проведении эпидемиологических исследований.
Эквивалентность результатов для измеряемой величины в образцах биологического материала человека может быть достигнута путем установления метрологической прослеживаемости значений, присвоенных калибраторам, используемым в методике измерений (МИзм) к высшему доступному уровню эталонной системы для данной измеряемой величины. Метрологическая прослеживаемость описывает иерархию калибровки и последовательность присвоений значений, демонстрируя неразрывную взаимосвязь между результатом измерения для образца биологического материала человека и доступным компонентом эталонной системы наивысшего уровня в иерархии калибровки. Уровень, с которого начинается метрологическая прослеживаемость (т. е. наивысший уровень метрологической прослеживаемости в иерархии калибровки), зависит от наличия референтных методик измерения более высокого порядка (РМИзм), стандартных образцов (СО) или протоколов гармонизации для заявленной измеряемой величины.
Ограничения в применении метрологически прослеживаемых калибровок возникают, когда разные МИ IVD, предназначенные для одной измеряемой величины, не могут выполнить измерения одних или предельно связанных измеряемых величин. Некоторые измеряемые показатели, представляющие медицинский интерес, могут быть четко определенными элементами или молекулами. Все большее число медицинских решений зависит от измерений показателей, которые представлены сложными и изменяющимися химическими соединениями типами молекул и их комплексами в изменяющихся пропорциях, например: гликопротеины, обладающие множественными изоформами, различные аминокислотные последовательности, последовательности нуклеотидов и другие сложные формы молекул. Когда селективность МИ IVD не соответствует целевому применению, специфическое влияние на величину измеряемого показателя в образце биологического материала человека, вызванное такими факторами, как болезнь, прием лекарственных препаратов или иными патологическими состояниями, может привести к получению ошибочных значений величины, которую намеревались измерить. Даже при наличии метрологической прослеживаемости до эталонов более высокого порядка селективность МИ на всех уровнях иерархии калибровки для данного МИ IVD может оказать влияние на получение результатов, эквивалентных результатам других МИ IVD для той же измеряемой величины в образцах биологического материала человека.
В настоящем стандарте представлены требования к производителям МИ IVD по документированию иерархии калибровки для величины, измеренной с использованием указанного МИ IVD в образцах биологического материала человека. Настоящий стандарт включает в себя различные модели иерархии калибровки, предлагающие возможные технические решения для измеряемых величин различного рода для установления метрологической прослеживаемости приписанных значений для образцов биологического материала человека, калибраторов и материалов контроля правильности. Применение настоящего стандарта как части широкой программы управления рисками для производителей МИ IVD соответствует требованиям ИСО 14971 и будет способствовать снижению рисков причинения вреда пациентам из-за неэквивалентности результатов измерений различными МИ IVD.
IV
ГОСТ Р ИСО 17511—2022
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ ДЛЯ ДИАГНОСТИКИ IN VITRO
Требования к установлению метрологической прослеживаемости значений, приписанных калибраторам, контрольным материалам правильности и образцам биологического материала человека
In vitro diagnostic medical devices. Requirements for establishing metrological traceability of values assigned to calibrators, trueness control materials and human biological samples
Дата введения —2023—11—01
1 Область применения
Настоящий стандарт определяет технические требования и документацию, необходимые для установления метрологической прослеживаемости значений, присваиваемых калибраторам, материалам контроля правильности и образцам биологического материала человека для величин измеряемых медицинскими изделиями для диагностики in vitro (МИ IVD). Образцы биологического материала человека — это образцы, предназначенные для измерения и соответствующие спецификации каждого МИ IVD. Метрологическая прослеживаемость значений величин в образцах биологического материала человека распространяется до наиболее высокого доступного уровня эталонной системы, оптимальнее всего — до референтных методик измерений (РМИзм) и сертифицированных стандартных образцов (ССО).
Все стороны, принимающие участие в любом из этапов, описанных в иерархии калибровки для МИ IVD, должны соответствовать приведенным требованиям. Эти стороны включают производителей МИ IVD, разработчиков РМИзм (см. ИСО 15193), производителей стандартных образцов (СО) (см. ИСО 15194) и референтные/калибровочные лаборатории (см. ИСО 15195), поддерживающие иерархию калибровки для МИ IVD, но не ограничиваются ими.
Примечание 1 — К производителям СО, предназначенных для стандартизации или калибровки МИ IVD, относят коммерческие и некоммерческие организации, производящие СО, применяемые многими конечными пользователями МИ IVD и/или калибровочными лабораториями или используемые одной медицинской лабораторией конечного пользователя в качестве эталона (калибратора), предназначенного исключительно для калибровки по разработанной лабораторией МИзм.
Настоящий стандарт применяют:
а) ко всем МИ IVD, которые используют для получения результатов измерений в виде числовых значений, т. е. с применением рациональных (относительных) и/или дифференциальных (интервальных) шкал, а также дискретных шкал;
Ь) к МИ IVD, используемым для получения результата измерения как качественной оценки, установленной через отношение результатов двух измерений (т. е. сигнала от испытуемого образца и сигнала от СО с охарактеризованной концентрацией или активностью на уровне порогового значения), или через дискретную шкалу с соответствующим(и) порогом(ами) принятия решения. Также включены МИ IVD, для которых результаты классифицируют по порядковым категориям на основе предустановленных количественных интервалов для величины;
с) СО, предназначенным для использования в качестве материалов контроля правильности для верификации или оценки калибровки МИ IVD, т. е. к некоторым коммутативным ССО и некоторым материалам внешней оценки качества (EQA) (если это указано в заявлении о предполагаемом использовании СО);
Издание официальное
1
ГОСТ Р ИСО 17511—2022
d) калибраторам и контрольным материалам правильности для определенных МИ IVD с присвоенными значениями, предназначенным для использования совместно с указанным МИ IVD;
е) МИ IVD, соответствующим приведенным в перечислениях а) и Ь) и не требующим калибровки конечным пользователем (т. е. в тех случаях, когда изготовитель выполняет заводскую калибровку МИ IVD).
Настоящий стандарт не применяют:
а) к калибраторам и материалам контроля правильности для МИ IVD, в которых, как следует из их состава, содержится нулевое количество измеряемого вещества;
Ь) контрольным материалам, которые используют только для внутреннего контроля качества в медицинских лабораториях для оценки непрецизионности МИ IVD, повторяемости или воспроизводимости и/или для оценки изменений результатов МИ IVD по сравнению с полученными в условиях ранее выполненной калибровки;
с) контрольным материалам, используемым в медицинских лабораториях только для внутреннего контроля качества, для которых приписанные при поставке рекомендуемые допустимые значения метрологически не прослеживаются к компонентам эталонной системы более высокого порядка;
d) свойствам, представленным в виде номинальных и порядковых шкал, где величины не указаны.
Примечание 2 — Номинальные шкалы обычно используют для сообщения, например, об идентичности типов клеток крови, типов микроорганизмов, идентичности последовательностей нуклеиновых кислот, идентичности частиц в моче.
Примечание 3 — Порядковые шкалы часто применяют к результатам, дифференцированным на дихотомические группы (например, «больной» или «здоровый»), а иногда и к результатам, дифференцированным на недихотомические группы, где группы результатов упорядочены по рангу, но ранговые группы не могут быть дифференцированы с точки зрения относительной степени различия, например, отрицательный, +1, +2, +3 для оценки наличия гемоглобина в образцах мочи визуальным наблюдением.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты [для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных — последнее издание (включая все изменения)]:
ISO 18113-2, In vitro diagnostic medical devices — Information supplied by the manufacturer (labelling) — Part 2: In vitro diagnostic reagents for professional use [Изделия медицинские для диагностики in vitro. Информация, предоставляемая производителем (маркировка). Часть 2. Реагенты для диагностики in vitro для профессионального применения]
ISO 15193, In vitro diagnostic medical devices — Measurement of quantities in samples of biological origin — Requirements for content and presentation of reference measurement procedures (Изделия медицинские для диагностики in vitro. Измерение величин в образцах биологического происхождения. Требования к содержанию и представлению референтных методик измерения)
ISO 15194, In vitro diagnostic medical devices — Measurement of quantities in samples of biological origin — Requirements for certified reference materials and the content of supporting documentation (Изделия медицинские для диагностики in vitro. Измерение величин в образцах биологического происхождения. Требования к сертифицированным стандартным образцам и содержанию сопроводительной документации)
3 Термины, определения и сокращения
Для целей настоящего стандарта применяют следующие термины, определения и сокращения.
Терминологические базы данных ИСО и МЭК доступны по следующим адресам:
- электронная платформа ИСО с функцией онлайн-просмотра терминов по адресу: http://www.iso. org/obp;
- электронная база МЭК Electropedia по адресу: http://www.electropedia.org/.
3.1 аналит (analyte): Компонент, представленный в названии измеряемой величины (см. 3.38).
Пример — В описании величины (см. 3.38) «масса белка в суточной моче» белок является анали-том; в молярной концентрации глюкозы в плазме крови глюкоза — аналитом. В обоих случаях длинная фраза представляет собой измеряемую величину (см. 3.26).
2
ГОСТ Р ИСО 17511—2022
3.2 аналитическая избирательность; избирательность измерительной системы; избирательность (analytical selectivity; selectivity of a measuring system; selectivity): Свойство измерительной системы (см. 3.29), применяемой согласно установленной методике измерений (см. 3.27), для получения измеренного значения величины (см. 3.38) для одной или нескольких измеряемых величин (см. 3.26), такое, что значения каждой измеряемой величины (см. 3.26) не зависят от других измеряемых величин (см. 3.26) или других величин (см. 3.38) в исследуемом явлении, теле или веществе.
Пример — Способность измерительной системы (см. 3.29) измерять молярную концентрацию креатинина в плазме крови без влияния со стороны других компонентов, присутствующих в образце.
Примечание 1 — В химии избирательность измерительной системы (см. 3.29) обычно определяют для величин (см. 3.38) с выбранными компонентами в тех концентрациях, которые лежат в пределах установленных интервалов.
Примечание 2 — В физике избирательность является понятием, близким к понятию «специфичность», иногда используемому в химии.
[Руководство ИСО/МЭК 99:2007, 4.13 с изменениями — термин «аналитическая избирательность» добавлен в качестве предпочтительного. Включен только пример 5 с сокращенным текстом и примечаниями 3 и 4]
3.3 смещение измерения; смещение (measurement bias; bias): Оценка систематической погрешности измерения.
Примечание 1 — См. Руководство ИСО/МЭК 99:2007, 2.17, систематическая погрешность измерения.
Примечание 2 — Это определение применимо только к количественным измерениям.
[Руководство ИСО/МЭК 99:2007, 2.18 с изменениями — примечания 1 и 2 добавлены к записи]
3.4 калибровка (calibration): Операция, с помощью которой при заданных условиях на первом этапе устанавливают соотношение между значениями величины (см. 3.38) с неопределенностями измерений (см. 3.48), обеспечиваемыми эталонами (см. 3.28), и соответствующими показаниями со связанными с ними неопределенностями измерений (см. 3.48), а на втором этапе используют эту информацию для установления соотношения для получения результата измерения на основе показания (см. 3.48).
Примечание 1 — Калибровка может быть выражена как функция калибровки, диаграмма калибровки, калибровочная кривая или таблица калибровки. В некоторых случаях она может включать аддитивную или мультипликативную поправку к показаниям с соответствующей неопределенностью измерений (см. 3.48).
Примечание 2 — Калибровку не следует путать ни с регулировкой измерительной системы (см. 3.29), часто ошибочно называемой «самокалибровка», ни с верификацией (см. 3.50) калибровки.
Примечание 3 — Часто только первый шаг в приведенном выше определении представляет собой калибровку.
[Руководство ИСО/МЭК 99:2007, 2.39]
3.5 иерархия калибровки (calibration hierarchy): Последовательность калибровок (см. 3.4), начиная с эталона и заканчивая измерительной системой (см. 3.29), причем в этой последовательности результат каждой калибровки (см. 3.4) зависит от результата предыдущей калибровки (см. 3.4).
Примечание 1 — Неопределенность измерений (см. 3.48) неизбежно возрастает вместе с последовательностью калибровок (см. 3.4).
Примечание 2 — Элементами иерархии калибровки являются один или более эталонов (см. 3.28) и измерительные системы (см. 3.29), функционирующие в соответствии с МИзм (см. 3.27).
Примечание 3 — Сличение между двумя эталонами (см. 3.28) может быть рассмотрено как калибровка (см. 3.4), если это сличение используют для проверки и, при необходимости, для корректировки значения величины (см. 3.38) и неопределенности измерений (см. 3.48), приписываемых одному из эталонов (см. 3.28).
Примечание 4 — В настоящем стандарте иерархия калибровки определена как подробное описание процесса приписывания значения измеряемой величины (см. 3.26) образцу с использованием указанной последовательности применения МИзм (см. 3.27) и СО (см. 3.39) [калибруемых по доступным СО (см. 3.39) более высокого порядка и/или МИзм (см. 3.27) для того же типа величины (см. 3.38)].
Примечание 5 — Для целей настоящего определения «образец» включает образцы биологического материала человека, а также калибровочные материалы (см. 3.6), материалы EQA или другие СО (см. 3.39).
3
ГОСТ Р ИСО 17511—2022
[Руководство ИСО/МЭК 99:2007, 2.40 с изменениями — исключено примечание 3. Примечание 4 стало примечанием 3, а примечания 4 и 5 были добавлены]
3.6 калибратор; калибровочный материал (calibrator; calibration material): Эталон (см. 3.28), используемый при калибровке (см. 3.4) измерительной системы (см. 3.29) в соответствии с указанной МИзм (см. 3.27).
[Руководство ИСО/МЭК 99:2007, 5.12 с изменениями — термин «калибровочный материал» добавлен в качестве допустимого термина, термин «измерительной системы в соответствии с указанной МИзм» — в конце определения, примечание удалено]
3.7 каталитическая активность (catalytic activity): Свойство компонента, соответствующее скорости превращения катализируемого вещества в ходе заданной химической реакции в заданной измерительной системе (см. 3.29).
Примечание 1 — В настоящем стандарте «компонентом» является фермент.
Примечание 2 — Величина (см. 3.38) «каталитическая активность» связана с количеством активного фермента, а не с его концентрацией; см. 3.8.
Примечание 3 — Когерентной производной единицей SI является «катал» (кат), равный «молю в секунду» (моль • с-1).
Примечание 4 — МИзм (см. 3.27) служит существенным элементом определения измеряемой величины (см. 3.26).
Примечание 5 — Во многих случаях вместо скорости превращения субстрата, указанного в кратком названии ферментного аналита (см. 3.1), например «креатин» в наименовании «креатинкиназа», измеряют скорость превращения индикаторного вещества как субстрата комбинированной реакции. Тогда измеряемая величина (см. 3.26) должна быть определена как «каталитическая активность фермента, измеренная по скорости превращения индикаторного вещества в заданной системе в соответствии с данной МИзм (см. 3.27)», например: «каталитическая активность креатинкиназы, измеренная по скорости превращения НАДФ+ с помощью референтной методики IFCC в сыворотке крови человека».
[ИСО 18153:2003, 3.2]
3.8 концентрация каталитической активности; каталитическая концентрация (catalytic-activity concentration; catalytic concentration): Каталитическая активность (см. 3.7) компонента, деленная на объем основной системы.
Примечание 1 — Когерентной производной единицей СИ* является «катал на кубический метр» или «моль на секунду в кубический метр» (кат • м-3 = моль • с-1 • м-3). В лабораторной медицине единицей измерения объема может быть избран литр, л.
Примечание 2 — В настоящем стандарте компонентом служит фермент, а основной системой может быть, например, образец плазмы крови.
[ИСО 18153:2003, 3.3]
3.9 сертифицированный стандартный образец; ССО (certified reference material; CRM): CO (см. 3.39), который сопровождается документацией, выданной уполномоченным органом**, в которой указано одно или более значений определенного свойства с соответствующими неопределенностями (см. 3.48) и прослеживаемостью (см. 3.31), установленными с использованием обоснованных процедур.
Пример — Сыворотка крови человека с приписанным значением величины (см. 3.38) концентрации холестерина и соответствующей неопределенностью измерений (см. 3.48), указанными в сертификате, которая используется как калибратор (см. 3.6) или контрольный материал правильности (см. 3.46).
Примечание 1 — «Документация» предоставляется в форме «сертификата» (см. Руководство ИСО 31).
Примечание 2 — Процедуры производства и аттестации ССО приведены, например, в ИСО 17034:2016 и Руководстве ИСО 35:2017.
Примечание 3 — В этом определении «неопределенность» охватывает как понятие «неопределенность измерения» (см. 3.48), так и понятие «неопределенность, связанную со значением качественного свойства», такого как, например, идентичность и последовательность. «Прослеживаемость» охватывает понятия «метрологическая прослеживаемость (см. 3.31) значения величины» и «прослеживаемость значения качественного свойства».
* Международная система единиц.
** У каждой страны собственный уполномоченный государственный орган.
4
ГОСТ Р ИСО 17511—2022
Примечание 4 — Установленные значения величины (см. 3.38) ССО требуют указания метрологической прослеживаемости (3.31) с соответствующей неопределенностью измерений (см. 3.48) [25].
Примечание 5 — ISO/REMCO имеет аналогичное определение 1251, но использует атрибуты «метрологический» и «метрологически» по отношению как к величине (см. 3.38), так и к качественному свойству.
Примечание 6 — Установленные требования к ССО и содержанию сопроводительной документации (в области МИ IVD) приведены в ИСО 15194.
Примечание 7 — Для конкретного материала наличие сертификата калибровки (см. 3.4), выданного аккредитованной калибровочной (см. 3.4) лабораторией, не означает присвоения статуса ССО этим типам материалов.
[Руководство ИСО/МЭК 99:2007, 5.14 с изменениями — добавлены примечания 6 и 7]
3.10 коммутативность стандартного образца; коммутативность (commutability of a reference material; commutability): Свойство CO (см. 3.39), отражающее близость соотношения результатов измерений определенной величины (см. 3.38) в данном стандартном образце, который получен в соответствии с двумя данными МИзм (см. 3.27), к соотношению результатов измерений для других определенных материалов.
Примечание 1 — СО (см. 3.39), рассматриваемый в настоящем стандарте, обычно является калибратором (см. 3.6), а другие материалы — рутинными пробами*.
Примечание 2 — При оценке коммутативности СО (см. 3.39) рекомендуется соотносить результаты всех применимых МИзм (см. 3.27).
Примечание 3 — Степень соответствия результатов измерений определяют с точки зрения пригодности для использования СО (см. 3.39) согласно предполагаемому назначению.
Примечание 4 — Утверждение о коммутативности ограничено определенными методиками измерений (см. 3.27), указанными в конкретном сопоставлении.
[Руководство ИСО/МЭК 99:2007, 5.15 с изменениями — примечания 2 и 3 удалены. Добавлены примечания 2—4]**
3.11 контрольный материал (control material): Вещество, материал или изделие, предназначенные изготовителем (см. 3.22) для применения при проверке функциональных характеристик МИ IVD (см. 3.21).
[ИСО 18113-1:2009, 3.13]
3.12 калибратор конечного пользователя МИ IVD; калибратор конечного пользователя (end-user IVD MD calibrator; end-user calibrator): CO (cm. 3.39), применяемый в качестве эталона (см. 3.28), предназначенного для использования в одной или нескольких МИзм (см. 3.27) МИ IVD (см. 3.21), предназначенных для исследования конкретной измеряемой величины (см. 3.26) в образцах биологического материала человека.
Примечание 1 — Калибраторы конечного пользователя включают СО (см. 3.39) или калибраторы (см. 3.6), применяемые в процессе производства изготовителем (см. 3.22) для проведения окончательной калибровки (см. 3.4) МИ IVD (см. 3.21) до выпуска МИ IVD (см. 3.21) и поставки конечному пользователю, в тех случаях, когда калибровка конечного пользователя не требуется (т. е. заводской калибровки).
Примечание 2 — Информация о выполненной(ых) на заводе калибровке(ах) (см. 3.4) включает данные о калибровке (см. 3.4) (уравнения, формулы, функции, параметры, данные), хранящиеся, например, в электронном формате, для использования микропроцессором в составе измерительной системы (см. 3.21) МИ IVD (см. 3.29) для преобразования сигнала, генерируемого в ходе измерения неизвестных образцов биологического материала человека, в молярную концентрацию или другое конечное измеренное значение.
3.13 эквивалентность измеренных значений; эквивалентные результаты (equivalence of measured values; equivalent results): Близость измеренных значений между различными МИ IVD (см. 3.21), предназначенными для измерения той же измеряемой величины (см. 3.26), при которой различия в измеренных значениях в тех же образцах биологического материала человека не влияют на клиническую интерпретацию.
* В ГОСТ Р ИСО 11095—2007 для обозначения стандартных образцов, не имеющих метрологической прослеживаемости, используют также термин «образец сравнения».
** Данный стандартный образец может быть получен при рутинных, лабораторных исследованиях и не требует регистрации уполномоченными органами.
5
ГОСТ Р ИСО 17511—2022
Примечание 1 — Вывод об эквивалентности измеренных значений для одних образцов биологического материала человека для применения двух или более МИзм (см. 3.27) основан на нахождении различий в измеренных значениях в рамках заранее определенного предела или границ.
[Harmonization.net, с изменениями — формулировка изменена для более четкого понимания]
3.14 стандартный образец более высокого порядка; СО более высокого порядка (higher order reference material; higher order RM): Сертифицированный стандартный образец (см. 3.9), соответствующий международно признанным требованиям качества и обеспечивающий метрологическую основу для иерархии калибровки (см. 3.5), к которой изготовители (см. 3.22) могут установить метрологическую прослеживаемость (см. 3.31).
Примечание 1 — Требования к качеству для СО более высокого порядка изложены в ИСО 15194.
Примечание 2 — СО более высокого порядка включают соответствующие назначению первичные СО (см. 3.35), первичные калибраторы (см. 3.37), вторичные калибраторы (см. 3.42) и международно признанные калибраторы (3.17).
Примечание 3 — Чистые вещества представляют собой первичный эталон (см. 3.37) и высшее звено метрологической прослеживаемости (см. 3.31) для большинства цепей прослеживаемости в химии, термометрии и калориметрии в целом и для сертификации растворов и, в частности, матричных (см. 3.24) СО (см. 3.39) (см. Руководство ИСО 35:2017).
Примечание 4 — По данным раздела «Часто задаваемые вопросы и ответы» (FAQ) [27] Объединенного комитета по прослеживаемости в лабораторной медицине (JCTLM), СО более высокого порядка представляет собой ССО (см. 3.9), соответствующий международно принятым требованиям к качеству, с которым могут соотноситься результаты измерений и для которого полностью установлена неопределенность измерений (см. 3.48). С метрологической точки зрения СО более высокого порядка представляет СО (см. 3.39), находящийся на более высоком уровне в иерархии калибровки (см. 3.5). ССО высших порядков, при их наличии, используются производителями (см. 3.22) МИ IVD (см. 3.21) для присвоения значений рабочим калибраторам (см. 3.51). Эти рабочие калибраторы (см. 3.51) впоследствии применяются изготовителем (см. 3.22) для присвоения значений измеряемым величинам (см. 3.26) в калибраторах конечного пользователя (см. 3.12) МИ IVD и контрольных материалах (см. 3.11), используемых с МИ IVD (см. 3.21) в медицинских лабораториях и иных организациях, выполняющих тестирование IVD. СО более высокого порядка чаще всего производятся и распространяются национальными метрологическими институтами (ИМИ), например Национальным институтом стандартов и технологий США (NIST), Объединенным исследовательским центром Европейской комиссии (EU-JRC), LGC Standards (Великобритания), Всемирной организацией здравоохранения (ВОЗ), Национальным институтом биологических стандартов и контроля (Великобритания), Национальным институтом метрологии (CN), Национальным метрологическим институтом Японии (JP), Институтом эталонных материалов по стандартам клинической химии (JP), Японским комитетом промышленных стандартов (JISC), Национальным центром метрологии (MX) и др. Некоторые производители коммерчески доступных СО также предоставляют СО, находящиеся в перечне JCTLM [28].
3.15 референтная методика измерений более высокого порядка; РМИзм более высокого порядка (higher order reference measurement procedure; higher order RMP): Референтная методика измерения (см. 3.40), соответствующая международно признанным требованиям качества, устанавливающая принятые метрологические отношения в рамках иерархии калибровки (см. 3.5), к которой изготовители (см. 3.22) могут провести метрологическую прослеживаемость (см. 3.31), и признанная как обеспечивающая результаты измерений, пригодные для предполагаемого использования при оценке правильности измерений (см. 3.47).
Примечание 1 — Требования к качеству для РМИзм более высокого порядка (см. 3.15) изложены в ИСО 15194.
Примечание 2 — В связи с более высокой стоимостью, сложностью оборудования и требований к подготовке операторов РМИзм более высокого порядка обычно разрабатывают в национальных метрологических (см. 3.32) институтах и/или аккредитованных калибровочных (см. 3.4) лабораториях.
Примечание 3 — В лабораторной медицине РМИзм (см. 3.40), соответствующие требованиям ИСО 15193, считают РМИзм более высокого порядка.
Примечание 4 — Согласно JCTLM FAQs [27], РМИзм более высокого порядка представляют подробно документированные высокоточные МИзм (см. 3.27), используемые для присвоения значений калибровочным материалам (см. 3.6). МИзм более высокого порядка (см. 3.27) часто отличает высокая стоимость разработки, избыточная сложность для ежедневного применения и непригодность для высокопроизводительного выполнения анализов.
6
ГОСТ Р ИСО 17511—2022
3.16 влияющая величина (influence quantity): Величина (см. 3.38), при прямом измерении не влияющая на величину (см. 3.38), которую фактически измеряют, но влияющая на соотношение между показанием и результатом измерения.
Пример — Молярная концентрация билирубина при прямом измерении молярной концентрации гемоглобина в плазме крови человека.
[Руководство ИСО/МЭК 99:2007, 2.52, с изменениями — исключены 3 примера и 2 примечания]
3.17 международно признанный калибратор; международно признанный калибровочный материал; международный эталон (international conventional calibrator; international conventional calibration material; international measurement standard): Калибратор (см. 3.6), значение величины (см. 3.38) которого не является метрологически прослеживаемым (см. 3.31) до СИ, а приписано на основе международного соглашения.
Примечание 1 — Величину (см. 3.38) определяют в зависимости от предполагаемого клинического применения.
3.18 международно признанная референтная методика измерений; международно признанная РМИзм (international conventional reference measurement procedure; international conventional RMP): МИзм (см. 3.27), которая позволяет получать значения, метрологически не прослеживаемые до СИ, но которые по международному соглашению используют в качестве референтных значений для определенной величины (см. 3.38).
Примечание 1 — Величину (см. 3.38) определяют в зависимости от предполагаемого клинического применения.
3.19 международный протокол гармонизации (international harmonisation protocol): Процесс стандартизации, осуществляемый международным органом для достижения эквивалентности измеренных значений (см. 3.13) величины для двух или более МИ IVD (см. 3.21), предназначенных для исследования измеряемой величины (см. 3.26), при отсутствии РМИзм более высокого порядка (см. 3.15) и соответствующих назначению ССО (см. 3.9) или международно признанных калибраторов (см. 3.17).
Примечание 1 — Международный протокол гармонизации может быть использован для достижения стандартизации измеренных значений заявленной измеряемой величины (см. 3.26) при отсутствии других пригодных для применения составляющих референтной системы более высокого порядка.
3.20 международный эталон (international measurement standard): Эталон (см. 3.28), который признан всеми государствами, подписавшими международное соглашение, и предназначен для глобального применения как основа для присвоения значений другим эталонам той же величины (см. 3.38).
Пример 1 — Международный прототип килограмма.
Пример 2 — ECO®-DA470k/IFCC для калибровки (см. 3.4) диагностических устройств in vitro на основе иммуноанализа или контрольных продуктов для сертифицированных белков. Европейская комиссия — Объединенный исследовательский центр (JRC), Гиль, Бельгия.
Пример 3 — Тройная точка воды — единственная комбинация давления и температуры, при которой вода, лед и водяной пар сосуществуют в устойчивом равновесии, наступающем ровно при температуре 273,16 К (0,01 °C; 32,02 °F) при парциальном давлении пара 611,657 Па (6,116 57 мбар; 0,006 036 59 атм).
[Руководство ИСО/МЭК 99:2007, 5.2 с изменениями — примечания 2 и 3 исключены. Добавлены новые примеры 2 и 3]
3.21 медицинское изделие для диагностики in vitro; медицинское изделие IVD; МИ IVD (in vitro diagnostic medical device; IVD medical device; IVD MD): Изделие, используемое по отдельности или в комбинации, предназначенное изготовителем (см. 3.22) для исследований in vitro образцов биологического материала человека единственно или главным образом для получения информации, которая может быть использована для целей диагностики, мониторинга или определения совместимости, включающее в себя реагенты, калибраторы (см. 3.6), контрольные материалы (см. 3.11), емкости для сбора и хранения проб, программное обеспечение и относящиеся к ним инструменты или приборы или другие предметы.
[ИСО 18113-1:2009, 3.27]
3.22 изготовитель (manufacturer): Организация, ответственная за разработку, изготовление, сборку, упаковку и маркировку МИ IVD (см. 3.21), сборку измерительной системы (см. 3.29) или адапта-
7
ГОСТ Р ИСО 17511—2022
цию МИ IVD (см. 3.21) перед его размещением на рынке и/или вводом в эксплуатацию, независимо от того, производились ли эти операции данной организацией или от ее имени третьей стороной.
Примечание 1 — Под организацией понимаются юридическое или физическое лицо, корпорация, ассоциация, учреждение или медицинская лаборатория. Организация должна быть идентифицируемой.
Примечание 2 — Изготовитель несет юридическую ответственность за обеспечение соответствия всем применимым нормативным требованиям к МИ IVD (см. 3.21) в тех странах, где он предполагает производство или реализацию, если только эта ответственность не возложена на другое юридическое лицо регулирующим органом (РО).
Примечание 3 — Обязанности изготовителя приведены в других руководящих документах GHTF. Эти обязанности включают в себя выполнение требований как до начала обращения, так и после начала обращений.
Примечание 4 — «Проектирование и/или производство», как указано в приведенном выше определении, может включать разработку спецификации, изготовление, сборку, обработку, упаковку, переупаковку, маркировку, повторную маркировку, стерилизацию, установку, или восстановление МИ IVD (см. 3.21), или объединение набора МИ IVD (см. 3.21) и, возможно, других продуктов для медицинских целей.
Примечание 5 — Любая организация, которая собирает или адаптирует МИ IVD (см. 3.21), которое уже поставлено изготовителем для целей выполнения исследований образцов биологического материала человека в соответствии с инструкциями по использованию, не является изготовителем при условии, что сборка или адаптация не изменяют предполагаемого применения МИ IVD (см. 3.21).
Примечание 6 — Любая организация, которая изменяет предполагаемое применение или модифицирует МИ IVD (3.21), не действуя от имени первоначального производителя, и которая делает его доступным для использования под собственным именем, должна считаться изготовителем модифицированного устройства.
Примечание 7 — Уполномоченный представитель, дистрибьютор или импортер, который только добавляет собственный адрес и контактные данные к МИ IVD (см. 3.21) или упаковке, не вскрывая и не изменяя существующую маркировку, не считается изготовителем.
Примечание 8 — В той мере, в какой вспомогательное оборудование подпадает под действие нормативных требований [к МИ IVD (см. 3.21)], организация, ответственная за разработку и/или производство этого вспомогательного оборудования, считается изготовителем.
[ИСО 18113-1:2009, 3.36, с изменениями — заменены «физическое или юридическое лицо» и «лицо» на «организация»; примечания исключены; введено новое примечание; добавлены примечания 2—8 и приведены источники (с незначительными изменениями для обеспечения согласованности терминологии, приведенной в этом определении) из GHTF/SG1 N055:2009, 5.1]
3.23 матричный эффект (matrix effect): Влияние свойства образца, не зависящее от присутствия аналита (см. 3.1), на измерение, и тем самым на измеренное значение величины (см. 3.38).
Примечание 1 — Заданной причиной матричного эффекта является влияющая величина (см. 3.16).
Примечание 2 — Термин «матричный эффект» иногда ошибочно используют в случаях некоммутатив-ности материала вследствие таких причин, как, например, денатурация аналита (см. 3.1) или добавление неоригинального компонента [суррогатного аналита (см. 3.1)], предназначенного для имитации измеряемой величины (см. 3.26).
[ИСО 15194:2009, 3.7, с изменениями — исключены примечание 2 и пример; добавлено примечание 2]
3.24 матрица; матричная система (matrix; system matrix): <Вещество> все компоненты материальной системы, за исключением аналита (см. 3.1).
Примечание 1 — Биологическая система, за исключением аналита (см. 3.1), является матрицей вещества.
[ИСО 15194:2009, 3.6, с изменениями — добавлены <вещество> как домен; синоним «матричная система»; примечание]
3.25 максимально допустимая неопределенность измерения Umax(y) [maximum allowable measurement uncertainty, Umax^y)]-. Максимальная, соответствующая назначению неопределенность измерения (см. 3.48) для результатов измерений, полученных с помощью данной МИзм (см. 3.27), и указанная в качестве верхнего предела, основанного на оценке медицинских требований.
8
ГОСТ Р ИСО 17511—2022
Примечание 1 — Руководство ISO/IEC 99:2007, 4.26, определяет максимально допустимую погрешность измерения. В современном английском языке разница между терминами allowed (разрешено) и permitted (разрешенный) аналогична разнице между понятиями tolerance (допустимость) и authorization (разрешение). Термин «разрешение» включает установленное законодательством обязательное требование. Для большинства измеряемых величин (см. 3.26) в лабораторной медицине отсутствуют установленные законодательством ограничения характеристик, поэтому предпочтительным прилагательным в контексте этого определения является «допустимый».
Примечание 2 — В настоящем стандарте спецификация максимально допустимой неопределенности измерения (см. 3.25) для МИ IVD (см. 3.21) сокращенно называется Umax(y).
3.26 измеряемая величина (measurand): Величина (см. 3.38), которую предполагается измерить.
Примечание 1 — Определение измеряемой величины требует знаний вида величины (3.38), описания состояния явления, тела или вещества, несущего эту величину (см. 3.38), включая любой соответствующий компонент и задействованные химические соединения.
Примечание 2 — Во 2-м издании VIM и в МЭК 60050-300:2001 измеряемая величина определена как «величина (см. 3.38), подлежащая измерению».
Примечание 3 — Измерение, включая измерительную систему (см. 3.29) и условия, при которых проводят измерение, может изменить явление, тело или вещество таким образом, что величина (см. 3.38) в процессе измерения может отличаться от измеряемой величины, как она определена. В этом случае необходима соответствующая коррекция.
Пример — Длина стального стержня, являющаяся измеряемой величиной, в состоянии температурного равновесия с окружающей средой при температуре 23 °C будет отличной от длины при температуре 20 °C, в этом случае необходима коррекция.
Примечание 4 — В химии «аналит» (см. 3.1) или наименование вещества или соединения являются терминами, иногда применяемыми для обозначения измеряемой величины. Такое применение ошибочно, поскольку эти термины не относятся к величинам (см. 3.38).
Примечание 5 — В лабораторной медицине описание измеряемой величины включает наименование величины (см. 3.38) (например, молярная концентрация вещества), компонент/аналит (см. 3.1) (например, P-D-глюкоза) и биологическую систему, в которой она обнаружена (например, плазма крови).
[ИСО 18113-1:2009, 3.39, с изменениями — добавлены примечания 3 и 5, пример]
3.27 методика измерения; МИзм (measurement procedure; МР): Детальное описание измерения в соответствии с одним или несколькими принципами измерений и данным методом измерения (см. 3.30), которое основано на модели измерений и включает вычисления, необходимые для получения результата измерения.
Примечание 1 — МИзм обычно описывают достаточно подробно в виде документа, чтобы позволить оператору выполнять измерение.
Примечание 2 — МИзм может включать заявление относительно целевой неопределенности измерения (см. 3.48).
Примечание 3 — МИзм иногда называют стандартной операционной процедурой, сокращенно СОП.
[Руководство ИСО/МЭК 99:2007, 2.6]
3.28 эталон (measurement standard; standard): Реализация определения данной величины (см. 3.38) с установленным значением величины (см. 3.38) и связанной с ним неопределенностью измерения (см. 3.48), используемая в качестве основы для сравнения.
Пример 1 — Эталон массы 1 кг со связанной стандартной неопределенностью измерений (см. 3.48) 3 мкг.
Пример 2 — Набор референтных растворов кортизола в сыворотке крови человека, имеющих сертифицированное значение величины с неопределенностью измерений (см. 3.48) для каждого раствора.
Пример 3 — СО (см. 3.39), обеспечивающий значения величины (см. 3.38) с неопределенностями измерений (см. 3.48) массовой концентрации каждого из десяти различных белков.
Примечание 1 — Реализация определения данной величины (см. 3.38) может обеспечиваться измерительной системой (см. 3.29), материальной мерой или СО (см. 3.39).
9
ГОСТ Р ИСО 17511—2022
Примечание 2 — Эталон часто используют как основу для установления измеренных значений величины (см. 3.38) со связанными с ними неопределенностями измерений (см. 3.48) для других величин (см. 3.38) того же рода и, таким образом, для установления метрологической прослеживаемости (см. 3.31) через калибровку (см. 3.4) других эталонов, средств измерений или измерительных систем (см. 3.29).
Примечание 3 — Термин «реализация» использован в настоящем стандарте в наиболее общем смысле. Он означает три процедуры реализации. Первая состоит в физической реализации единицы измерения из ее определения и является реализацией в буквальном смысле. Вторая, называемая «репродукция», состоит не в реализации единицы измерения из ее определения, а в установлении высокостабильного эталона, основанного на физическом явлении, как, например, в случае использования стабилизированных по частоте лазеров для установления эталона метра, эффекта Джозефсона для вольта или квантового эффекта Холла для ома. Третья процедура состоит в принятии материальной меры в качестве эталона. Это имеет место в случае эталона (см. 3.28) 1 кг.
Примечание 4 — Стандартная неопределенность измерений (см. 3.48), связанная с эталоном, всегда является составляющей суммарной стандартной неопределенности измерений (см. 3.33) для результатов измерений, полученных с использованием эталона (см. Руководство ИСО/МЭК 98-3:2008 — GUM, 2.3.4). Часто такая составляющая мала по сравнению с другими составляющими суммарной стандартной неопределенности измерений (см. 3.33).
Примечание 5 — Значение величины (см. 3.38) и неопределенность измерений (см. 3.48) следует определять во время использования эталона.
Примечание 6 — Несколько величин (см. 3.38) одного рода или различных родов могут быть реализованы в одном устройстве, которое обычно также называют эталоном.
[Руководство ИСО/МЭК 99:2007, 5.1, с изменениями — исключены примеры 2—4 и примечания 7-9]
3.29 измерительная система (measuring system; measurement system): Набор одного или более средств измерений и часто других устройств, включающий при необходимости реактивы или источники питания, собранный и приспособленный для получения информации об измеренных значениях величины (см. 3.38) в пределах установленных интервалов для величин (см. 3.38) указанных видов.
Примечание 1 — Измерительная система может состоять только из одного средства измерений.
[Руководство ИСО/МЭК 99:2007, 3.2]
3.30 метод измерения (measurement method; method of measurement): Общее описание логической последовательности операций, которые используют при измерении.
Примечание 1 — Методы измерения могут быть классифицированы различными способами, такими как:
- метод измерений замещением;
- дифференциальный метод измерений;
- нулевой метод измерений;
- метод прямых измерений;
- метод косвенных измерений.
См. МЭК 60050-300:2001.
[Руководство ИСО/МЭК 99:2007, 2.5]
3.31 метрологическая прослеживаемость (metrological traceability): Свойство результата измерений, в соответствии с которым результат может быть соотнесен с основой для сравнения через документированную непрерывную цепь калибровок (см. 3.4), каждая из которых вносит вклад в неопределенность измерений (см. 3.48).
Примечание 1 — Для этого определения основой для сравнения может быть определение единицы измерения при ее практической реализации или МИзм (см. 3.27), включающая единицу измерения для величин (см. 3.38), отличных от порядковых, или эталон (см. 3.28).
Примечание 2 — Метрологическая прослеживаемость требует установленной иерархии калибровки (см. 3.5).
Примечание 3 — Описание основы для сравнения должно включать время, в которое она была использована в данной иерархии калибровки (см. 3.5), вместе с любой другой существенной метрологической информацией относительно этой основы, например: о том, когда была выполнена первая калибровка (см. 3.4) в иерархии калибровки (см. 3.5).
10
ГОСТ Р ИСО 17511—2022
Примечание 4 — Для измерений с более чем одной входной величиной (см. 3.38) в модели измерений, каждое из входных значений величины (см. 3.38) должно само быть метрологически прослеживаемо, и иерархия калибровки (см. 3.5) может иметь форму разветвленной структуры или сети. Усилия, связанные с установлением метрологической прослеживаемости для каждого значения входной величины (см. 3.38), должны быть соизмеримы с ее относительным вкладом в результат измерения.
Примечание 5 — Метрологическая прослеживаемость результата измерения не гарантирует, что неопределенность измерений (см. 3.48) соответствует заданной цели или то, что отсутствуют ошибки.
Примечание 6 — Сличение двух эталонов (см. 3.28) может быть рассмотрено как калибровка (см. 3.4), если сличение используется для контроля и, если необходимо, для корректировки значения величины (см. 3.38) и неопределенности измерений (см. 3.48), приписываемых одному из эталонов (см. 3.28).
Примечание 7 — Для подтверждения метрологической прослеживаемости ILAC рассматривает следующие элементы: непрерывная цепь метрологической прослеживаемости к международным эталонам (см. 3.20) или национальным эталонам (см. 3.28), документированная неопределенность измерений (см. 3.48), документированная МИзм (см. 3.27), аккредитация на техническую компетентность, метрологическая прослеживаемость до СИ и интервалы между калибровками (см. 3.4) (см. ILAC Р10:01/2013).
Примечание 8 — Сокращенный термин «прослеживаемость» иногда используют для обозначения «метрологической прослеживаемости», а также для других понятий, таких как «прослеживаемость образца», «прослеживаемость документа», «прослеживаемость прибора» или «прослеживаемость материала», где частью слова является трансформированный корень «слеж» от слова «след». Вследствие этого предпочтительнее использовать термин «метрологическая прослеживаемость» без использования сокращений, если существует риск неясности.
Примечание 9 — В отношении примечания 4 VIM, 2.50, определяет входную величину (см. 3.38) в модели измерения как величину (см. 3.38), которая должна быть измерена, или величину (см. 3.38), значение которой может быть получено иным образом для вычисления значения измеряемой величины (см. 3.26).
Пример —Длина стального стержня при заданной температуре является измеряемой величиной (см. 3.26), в то время как температура окружающей среды, наблюдаемая длина стального стержня и коэффициент теплового расширения стального стержня являются входными величинами (см. 3.38) в модели измерений.
[Руководство ИСО/МЭК 99:2007, 2.41, с изменениями — добавлены примечание 9 и пример]
3.32 метрология (metrology): Наука об измерениях и их применении.
Примечание 1 — Метрология включает в себя все теоретические и практические аспекты измерений вне зависимости от неопределенности измерений (см. 3.48) и области применения.
[Руководство ИСО/МЭК 99:2007, 2.2]
3.33 суммарная стандартная неопределенность измерений; суммарная стандартная неопределенность и(у) [combined standard measurement uncertainty; combined standard uncertainty; u(y)]: Стандартная неопределенность измерений (см. 3.48), которую получают с использованием индивидуальных стандартных неопределенностей измерений, связанных с входными величинами (см. 3.38) в модели измерений (см. 4.7).
[Руководство ИСО/МЭК 99:2007 2.31, с изменением — примечание исключено]
3.34 прецизионность измерений (precision of measurement): Близость между показаниями или измеренными значениями величины (см. 3.38), наблюдаемыми при повторных измерениях одного или подобных объектов при заданных условиях.
Примечание 1 — Прецизионность измерений обычно выражается численно через показатели непре-цизионности, такие как стандартное отклонение, дисперсия или коэффициент вариации, при заданных условиях измерений.
Примечание 2 — Заданные условия могут быть, например, условиями сходимости измерений, условиями промежуточной прецизионности измерений или условиями воспроизводимости измерений (см. ИСО 5725-1:1994).
Примечание 3 — Прецизионность измерений используют для определения сходимости измерений, промежуточной прецизионности измерений и воспроизводимости измерений.
Примечание 4 — Иногда прецизионность измерений ошибочно используют для обозначения точности измерения.
[Руководство ИСО/МЭК 99:2007 2.15]
11
ГОСТ Р ИСО 17511—2022
3.35 первичный стандартный образец; первичный СО (primary reference material; primary RM): Образец аналита (см. 3.1) высокой чистоты с аттестованным значением массовой/молярной доли аналита (см. 3.1) в образце, представляющий собой реализацию единицы величины Международной системы единиц (СИ) для данного аналита (см. 3.1).
Примечание 1 — Первичному стандартному образцу значение присваивается либо непосредственно первичной РМИзм (см. 3.36), либо косвенно путем определения примесей в образце соответствующими аналитическими методами (например, методом баланса масс).
3.36 первичная референтная методика измерений; первичная РМИзм (primary reference measurement procedure; primary RMP): Референтная методика измерений (см. 3.40), используемая для получения результата измерения без сравнения с эталоном (см. 3.28) единицы величины (см. 3.38) того же рода.
Пример — Объем воды, дозированный пипеткой номинальным объемом 50 мл при температуре 20 °C, измеряют путем взвешивания воды, слитой из пипетки в мензурку, измеряя массу мензурки с водой за вычетом массы первоначально пустой мензурки и вводя поправку на действительную температуру воды, используя плотность.
Примечание 1 — Термин «первичная РМИзм» (см. 3.36), используемый в настоящем стандарте, включает в себя полную подробную инструкцию по измерению, тогда как термин «первичный метод измерения» (см. 3.30), определенный Консультативным комитетом по количеству вещества (CCQM), является общим описанием принципа измерения или метода измерения (см. 3.29), охватывающего различные методики.
[Руководство ИСО/МЭК 99:2007, 2.8, с изменениями — примечания 1 и 2 исключены и добавлено примечание 1]
3.37 первичный эталон; первичный калибратор (primary measurement standard; primary standard; primary calibrator): Эталон (см. 3.28), основанный на использовании первичной РМИзм (см. 3.36) или созданный как артефакт, выбранный по соглашению.
Пример 1 — Первичный эталон молярной концентрации, полученный путем растворения установленного количества вещества химического элемента в указанном объеме раствора.
Пример 2 — Первичный эталон давления на основе независимых измерений силы и площади.
Пример 3 — Первичный эталон для измерений молярного отношения изотопов, приготовленный смешиванием указанного количества веществ определенных изотопов.
Пример 4 — Ячейка с тройной точки воды в качестве первичного эталона термодинамической температуры.
Пример 5 — Международный прототип килограмма как артефакт, выбранный по соглашению.
[Руководство ИСО/МЭК 99:2007, 5.4]
3.38 величина (quantity): Свойство явления, тела или вещества, которое может быть выражено количественно в виде числа с указанием отличительного признака как основы для сравнения.
Пример 1 — «Плазма (кровь) — ион натрия; молярная концентрация, равная 143 ммоль/л для данного человека в данный момент времени».
Пример 2 — Счетная концентрация эритроцитов в образце крови (цельная кровь — эритроциты; счетная концентрация, равная 5 ■ 106/мкл для данного человека в данный момент времени).
Примечание 1 — Предпочтительным форматом IUPAC-IFCC для обозначения величин в лабораторной медицине является «система — компонент; род величины».
Примечание 2 — Величину не следует путать с аналитом (см. 3.1).
Примечание 3 — МИзм (см. 3.27), для которых результат измерения выражен качественным образом (например, «присутствует» или «не присутствует») по отношению к коэффициенту или счетной шкале с заранее определенным порогом принятия решения, соответствуют данному определению термина «величина».
[Руководство ИСО/МЭК 99:2007, 1.1, с изменениями — примечания 1—6 исключены, а пример 2, примечания 2 и 3 добавлены]
12
ГОСТ Р ИСО 17511—2022
3.39 стандартный образец*; СО (reference material; RM): Материал достаточно однородный и стабильный в отношении определенных свойств для того, чтобы его использовать при измерении или оценивании качественных свойств в соответствии с предполагаемым назначением.
Пример 1 — Примеры СО с величинами (см. 3.38):
а) вода установленной степени чистоты, динамическая вязкость которой использована для калибровки вискозиметров;
Ь) сыворотка крови человека без приписанного значения величины (см. 3.38) — молярной концентрации собственного холестерина, используемая только как контрольный материал (см. 3.11) для подтверждения прецизионности измерений.
Пример 2 — Примеры СО качественных свойств:
а) цветовая диаграмма, которая показывает один цвет или более;
Ь) структура ДНК, содержащая определенную последовательность нуклеотидов;
с) моча, содержащая 19-андростендион.
Пример 3 — Вещество с указанной тройной точкой в ячейке тройной точки.
Пример 4 — Стекло с указанной оптической плотностью в держателе светофильтра.
Пример 5 — Сферические частицы одного размера, размещенные на предметном стекле микроскопа.
Пример 6 — Сыворотка крови человека с приписанным значением концентрации холестерина (моль) и связанной с ним неопределенностью измерений (см. 3.48), используемая в качестве калибратора (см. 3.6) или материала контроля правильности (см. 3.46) измерений.
Примечание 1 — Оценивание качественного свойства дает значение этого качественного свойства и соответствующую неопределенность. Эта неопределенность не является неопределенностью измерений (см. 3.48).
Примечание 2 — СО с приписанными значениями величины (см. 3.38) или без них могут быть использованы для контроля прецизионности измерений, тогда как для калибровки (см. 3.4) или контроля правильности измерений (см. 3.46) — только СО с приписанными значениями величины (см. 3.38).
Примечание 3 — Понятие «стандартный образец» охватывает как образцы с величинами (см. 3.38), так и образцы с качественными свойствами.
Примечание 4 — СО иногда включают в состав измерительной системы (см. 3.29).
Примечание 5 — Некоторые СО имеют приписанные значения величины (см. 3.38), которые метрологически прослеживаются (см. 3.31) к внесистемной единице измерения. К таким материалам относят вакцины, которым Международные единицы (ME) [29] приписываются ВОЗ.
Примечание 6 — В данном измерении примененный СО может быть использован только либо для калибровки (см. 3.4), либо для обеспечения качества.
Примечание 7 — Спецификации на СО должны включать прослеживаемость материалов, которая указывает на его происхождение и обработку [25].
Примечание 8 — ISO/REMCO имеет аналогичное определение [25], но применяет термин «процесс измерения» для обозначения понятия «исследование» (см. ИСО 15189:2012), включающий как измерение величины (см. 3.38), так и исследование качественного свойства.
Примечание 9 — СО, сопровождаемый документацией, выданной уполномоченным органом и ссылающейся на валидированные методики, использованные для получения значения определенного свойства с соответствующей неопределенностью измерений (см. 3.48) и метрологической прослеживаемостью (см. 3.31), называется ССО (см. 3.9).
* Использование термина «стандартный образец» для перевода выражения «reference material» в области обеспечения метрологической прослеживаемости в лабораторной медицине основано на его определении в РМГ 29—2013: «Материал, достаточно однородный и стабильный в отношении определенных свойств для того, чтобы использовать его при измерении или оценивании качественных свойств в соответствии с предполагаемым назначением». Это определение отличается от приведенного в разделе основных понятий Федерального закона от 11 июня 2021 г.№ 102-ФЗ: «Образец вещества (материала) с установленными по результатам испытаний значениями одной и более величин, характеризующих состав или свойство этого вещества (материала)» и тем самым не позволяет разделять понятия «стандартный образец» и «сертифицированный стандартный образец».
13
ГОСТ Р ИСО 17511—2022
Примечание 10 — Требования к характеристикам СО, предназначенных для калибровки (см. 3.4) РМИзм (см. 3.40), описаны в ИСО 15194.
Примечание 11 — Использование СО включает калибровку (см. 3.4) измерительной системы (см. 3.29), оценку МИзм (см. 3.27), присвоение значений другим материалам и контроль качества. См. также эталон (см. 3.28).
Примечание 12 — Пример СО с величиной (см. 3.38): Плазма крови, содержащая указанную массовую долю глюкозы, предназначенная для использования в качестве калибратора (см. 3.6).
[Руководство ИСО/МЭК 99:2007, 5.13, с изменениями — примечание 3 — исключен пример 1.с; примечание 4 — заменено «...специально изготовленное устройство» на «...измерительная система»]
3.40 референтная методика измерений; РМИзм (reference measurement procedure; RMP): МИзм (см. 3.27), для которой принято, что она обеспечивает приемлемость результатов измерений для их использования при оценке правильности (см. 3.47) измеренных значений величин (см. 3.38), полученных по другим МИзм (см. 3.27) величин (см. 3.38) того же рода, а также для калибровки (см. 3.4) или для определения характеристик СО (см. 3.39).
Примечание 1 — Требования к РМИзм для применения в иерархиях калибровки (см. 3.5), поддерживающих МИ IVD (см. 3.21), приведены в ИСО 15193.
[Руководство ИСО/МЭК 99:2007, 2.7, с изменением — примечание 1 добавлено]
3.41 референтная измерительная система (reference measurement system): Измерительная система (см. 3.29), признанная пригодной для ее предполагаемого использования при оценке или установлении правильности измерений (см. 3.47) значений величины, полученных с использованием других МИзм (см. 3.27) для измеряемой величины (см. 3.26), включает в себя (1) единицу измерения, (2) определение измеряемой величины (см. 3.26), (3) РМИзм (см. 3.40), (4) стандартные образцы (см. 3.39) и (5) одну или несколько лабораторий, предоставляющих референтные измерительные услуги.
Примечание 1 — Определение заимствовано из [30].
3.42 вторичный эталон; вторичный калибратор (secondary measurement standard; secondary standard; secondary calibrator): Эталон (см. 3.28), который калибруется (см. 3.4) по первичному эталону (см. 3.37) для величины (см. 3.38) того же рода.
Примечание 1 — Калибровку вторичного эталона (см. 3.4) можно проводить непосредственно по первичному эталону (см. 3.37) или включать промежуточную измерительную систему (см. 3.29), калиброванную по первичному эталону (см. 3.37) с приписыванием результата измерения вторичному эталону.
Примечание 2 — Эталон (см. 3.28), величина которого определяется соотношением к первичной РМИзм (см. 3.36), является вторичным эталоном.
Примечание 3 — Альтернативным, не включенным в VIM 5.5 термином, применимым для вторичного эталона или калибратора (см. 3.6), является «вторичный стандартный образец».
[Руководство ИСО/МЭК 99:2007, 5.5, с изменениями — добавлено примечание 3]
3.43 выбранная производителем методика измерений; выбранная производителем МИзм (manufacturer’s selected measurement procedure; manufacturer’s selected MP): МИзм (см. 3.27), которая калибруется по одному или более первичному (см. 3.37) или вторичному калибратору (см. 3.42), при их наличии.
Примечание 1 — Пропускная способность и другие предпочтительные характеристики производительности могут сделать данную выбранную МИзм (см. 3.27) менее предпочтительной для применения в условиях, требующих большего объема и более быстрого выполнения работ. Выбранная МИзм (см. 3.27) в дополнение к установленным (и приемлемым) аналитическим характеристикам также может иметь установленную клиническую достоверность. Изготовители (см. 3.22) иногда используют выбранные МИзм (см. 3.27) в качестве основы для помощи в исследованиях и разработке новых МИзм (см. 3.27) [предназначенных для продажи изготовителем (см. 3.22)], их применяют для поддержки присвоения значений «рабочий» или «мастер» калибраторам (см. 3.51), обеспечивающим повседневное присвоение значений калибратору конечного пользователя МИ IVD как «изделию» (см. 3.12) для использования в одном или более МИ IVD (см. 3.21).
Примечание 2 — Выбранная производителем МИзм может быть основана на таких же принципе и методе измерения (3.30), как и МИ IVD (см. 3.21) конечного пользователя, но выполнена в более точно контролируемых условиях (например, с большим числом повторов и/или с более строгой системой контроля), с целью уменьшения неопределенности измерений (см. 3.48) в значении измеренной величины (см. 3.38).
14
ГОСТ Р ИСО 17511—2022
Примечание 3 — Выбранная производителем МИзм может быть основана на таких же принципе и методе измерения (см. 3.30), как и РМИзм более высокого порядка (см. 3.15) для измеряемой величины (см. 3.26).
3.44 установленная изготовителем методика измерений; установленная изготовителем МИзм (manufacturer’s standing measurement procedure; manufacturer’s standing MP): МИзм (см. 3.27), калиброванная с помощью СО (см. 3.39) или с помощью рабочего калибратора производителя (см. 3.51), используемая для оценки или присвоения значений калибратору конечного пользователя (см. 3.12).
Примечание 1 — Установленная изготовителем МИзм может быть основана на таких же принципе и методе измерения (см. 3.30), как и в МИ IVD (см. 3.21) конечного пользователя, но выполнена в более точно контролируемых условиях (например, с большим числом повторов и/или с более строгой системой контроля), чтобы уменьшить неопределенность измерения (см. 3.48) в значении измеренной величины (см. 3.38).
3.45 истинное значение величины; истинное значение (true value of a quantity; true value): Значение величины, которое соответствует определению величины (см. 3.38).
Примечание 1 — В концепции погрешности при описании измерения истинное значение величины рассмотрено как единственное и на практике непознаваемое. Концепция неопределенности признает, что в действительности по причине неполного описания величины (см. 3.38) существует не единственное истинное значение величины, а, скорее, набор истинных значений величины, согласующийся с определением. Однако этот набор значений в принципе и на практике является недостижимым. При других подходах используют не понятие истинного значения величины, а понятие метрологической совместимости результатов измерений для оценки их достоверности.
Примечание 2 — В частном случае фундаментальных констант величину (см. 3.38) рассматривают как имеющую единственное истинное значение величины.
Примечание 3 — Когда дефинициальную неопределенность, связанную с измеряемой величиной (см. 3.26), рассматривают как пренебрежимо малую по сравнению с остальными составляющими неопределенности измерений (см. 3.48), измеряемая величина (см. 3.26) может быть представлена как имеющая «по существу единственное» истинное значение. Такой подход принят в GUM и связанных с ним документами, где слово «истинный» приведено как излишнее.
Примечание 4 — Согласно концепции истинного значения вследствие присущей неопределенности измерений (см. 3.48) истинное значение не может быть познано.
[Руководство ИСО/МЭК 99:2007, 2.11, с изменениями — добавлено примечание 4]
3.46 материалы контроля правильности; контроль правильности (trueness control material; trueness control): CO (cm. 3.39), используемый для оценки смещения измерения (см. 3.3) заданной величины (см. 3.38) в заданной измерительной системе (см. 3.29).
Примечание 1 — Материалы для контроля правильности часто изготавливают в матрице (см. 3.24), предназначенной для имитации матрицы (см. 3.24) предполагаемых образцов биологического материала человека.
Примечание 2 — Материалы контроля правильности должны быть оценены для установления их коммутативности (см. 3.10) с образцами биологического материала человека.
Примечание 3 — Материалы для контроля правильности могут быть предоставлены их производителями (см. 3.22) в качестве ССО (см. 3.9).
3.47 правильность измерений; правильность (trueness of measurement; measurement trueness; trueness): Близость среднего арифметического бесконечно большого числа повторно измеренных значений величины к опорному значению величины.
Примечание 1 — Правильность измерений не является величиной и поэтому не может быть выражена численно, однако соответствующие показатели приведены в ИСО 5725-1.
Примечание 2 — Правильность измерений обратна по отношению к систематической погрешности измерения, но не имеет связи со случайной погрешностью измерения.
Примечание 3 — Понятие «точность измерения» не следует использовать для понятия «правильность измерения».
Примечание 4 — Для качественных исследований правильность измерения (близость совпадения) может быть выражена в соотношениях истинно положительных и ложноотрицательных (т. е. процентов совпадения с исследованием эталона).
15
ГОСТ Р ИСО 17511—2022
Примечание 5 — Правильность — это свойство МИзм (см. 3.27), отражающее смещение (см. 3.3) результата измерений от ожидаемого или целевого значения. Она описывается качественно как хорошая или плохая. МИзм (см. 3.27) имеет хорошую правильность, если смещение (см. 3.3) результатов измерений мало.
Примечание 6 — Меру правильности обычно выражают в определении систематической погрешности (см. 3.3). Правильность иногда называют «точность среднего».
[Руководство ИСО/МЭК 99:2007, 2.14, с изменениями — добавлены примечания 3 и 6. Примечание 6 — согласно ИСО 16577:2016, 3.105]
3.48 неопределенность измерений; неопределенность (uncertainty of measurement; measurement uncertainty): Неотрицательный параметр, характеризующий рассеяние значений величины, приписываемых измеряемой величине (см. 3.26) на основе используемой информации.
Примечание 1 — Неопределенность измерений включает составляющие, обусловленные систематическими эффектами, такие как составляющие, связанные с поправками и приписанными значениями эталонов (см. 3.28). Иногда не вводят поправки на оцененные систематические эффекты, а вместо этого последние рассматривают как составляющие неопределенности измерений.
Примечание 2 — Параметром может быть, например, стандартное отклонение, называемое стандартной неопределенностью измерения (или заданное кратное ему значение), или половина ширины интервала с установленной вероятностью охвата.
Примечание 3 — Неопределенность измерений включает в себя, в общем случае, много составляющих. Некоторые из этих составляющих могут быть оценены по типу А неопределенности измерений на основании статистического распределения значений величины из серий измерений и могут характеризоваться стандартными отклонениями. Другие составляющие, которые могут быть оценены по типу В неопределенности измерений, могут также характеризоваться стандартными отклонениями, оцениваемыми из функций плотности вероятностей на основании опыта или другой информации.
Примечание 4 — В общем, для данного набора информации понятно, что неопределенность измерений связывают с установленным значением величины, приписываемым измеряемой величине (см. 3.26). Изменение этого значения приводит к изменению связанной с ним неопределенности.
Примечание 5 — Оценку неопределенности измерений типа А определяют как оценку составляющей неопределенности измерений посредством статистического анализа измеренных значений величины, полученных при определенных условиях измерения [адаптировано из VIM, 2.28].
Примечание 6 — Оценку неопределенности измерений типа В определяют как оценку составляющей неопределенности измерений, определенной иным способом, чем оценивание неопределенности измерений по типу А. Она может включать стандартные отклонения: а), полученные из информации, связанной со значениями величины, взятыми из надежных публикаций; Ь), связанные со значениями величины ССО (см. 3.9); с), полученные из сертификатов калибровки (см. 3.4); d), установленные из личного опыта или иных источников [адаптировано из VIM, 2.29].
[Руководство ИСО/МЭК 99:2007, 2.26]
3.49 валидация (validation): Верификация (см. 3.50), при которой установленные требования соответствуют предполагаемому использованию.
Пример 1 — МИзм (см. 3.27), обычно используемая для измерения массовой концентрации азота в воде, может быть валидирована также для измерения массовой концентрации азота в сыворотке крови человека.
Пример 2 — МИзм (см. 3.27), для определения используемой концентрации креатинина (массовой) в сыворотке крови человека, также может быть валидирована для измерения концентрации креатинина (массовой) в моче человека.
Пример 3 — МИзм (см. 3.27) для измерения концентрации простатоспецифического антигена (ПСА) (массовой) в сыворотке крови при диагностике рака предстательной железы у мужчин старше 40 лет.
Примечание 1 — В ИСО 9000 валидация определена как подтверждение посредством предоставления объективных доказательств того, что требования для конкретного предполагаемого использования или применения выполнены.
16
ГОСТ Р ИСО 17511—2022
[Руководство ИСО/МЭК 99:2007, 2.45, с изменениями — добавлены примеры 2, 3 и примечание 1. Пример 2 и примечание 1 — согласно ИСО 18113-1:2009, 3.72]
3.50 верификация (verification): Предоставление объективных доказательств, что данный объект полностью соответствует установленным требованиям.
Пример 1 — Подтверждение того, что данный СО (см. 3.39), как заявлено, является однородным для образцов с массой не более 10 мг относительно значения величины и соответствующей МИзм (см. 3.27).
Пример 2 — Подтверждение того, что эксплуатационные характеристики или установленные законом требования к измерительной системе (см. 3.29) достигнуты.
Пример 3 — Подтверждение того, что целевая неопределенность измерений (см. 3.48) может быть достигнута.
Примечание 1 — При необходимости, неопределенность измерений (см. 3.48) следует учитывать.
Примечание 2 — Объектом может быть, например, процесс, МИзм (см. 3.27), материал, смесь (соединение) или измерительная система (см. 3.29).
Примечание 3 — Установленными требованиями, например, могут быть те, что соответствуют спецификации производителя (см. 3.22).
Примечание 4 — В законодательной метрологии (см. 3.32), как определено в OIML V1:2013, и в общем при оценке соответствия верификация относится к исследованиям и маркировке и/или выдаче свидетельства о поверке измерительной системы (см. 3.29).
Примечание 5 — Верификацию не следует путать с калибровкой (см. 3.4). Не каждая верификация является валидацией (см. 3.49).
Примечание 6 — В химии верификация идентичности объекта или реакции требует описания структуры, или свойств такого объекта, или реакции.
Примечание 7 — Верификация — это процесс, с помощью которого лаборатория подтверждает, что установленные требования к производительности IVD (например, точность, прецизионность, интервал измерений) могут быть воспроизведены в лаборатории до проведения исследований образцов биологического материала человека.
Примечание 8 — Верификация может быть достаточной для внедрения нового IVD, если тест выполняют и применяют в соответствии с инструкцией, прилагаемой к упаковке.
[Руководство ИСО/МЭК 99:2007, 2.44, с изменениями — добавлены примечания 7 и 8]
3.51 рабочий эталон; рабочий калибратор производителя; мастер-калибратор производителя (working measurement standard; working standard; manufacturer’s working calibrator; manufacturer’s master calibrator): Эталон (см. 3.28), используемый для калибровки или поверки средств измерений или измерительных систем (см. 3.29).
Примечание 1 — Рабочий эталон обычно калибруют (присваивают значение) по исходному эталону (см. 3.28).
Примечание 2 — При верификации (см. 3.50) также иногда используют термины «проверочный эталон» или «контрольный эталон».
Примечание 3 — Изготовитель (см. 3.22) может выбрать приготовление рабочего калибратора производителя, который предназначен для передачи правильности (см. 3.47) посредством калибровки (см. 3.4) калибраторов МИ IVD конечного пользователя (см. 3.12).
Примечание 4 — Рабочий эталон иногда реализуется как суррогатный СО (см. 3.39) вместо более дорогого СО более высокого порядка (см. 3.14).
[Руководство ИСО/МЭК 99:2007, 5.7, изменено — добавлены примечания 3 и 4]
17
ГОСТ Р ИСО 17511—2022
4 Общие требования, предъявляемые к установлению, валидации и документированию метрологической прослеживаемости значений, определенных с указанным МИ IVD в образцах биологического материала человека
4.1 Требования к документированию метрологической прослеживаемости измеренных значений величин
Изготовитель должен задокументировать полную иерархию калибровки и определить наиболее высокий метрологический уровень, до которого можно проследить результирующие значения измеренных величин в соответствии с требованиями, изложенными в настоящем стандарте.
Документация изготовителя по метрологической прослеживаемости измеренных значений величин в образцах биологического материала человека указанными МИ IVD должна включать:
а) описание референтной измерительной системы, включая следующие элементы:
i. применимую систему единиц (например, SI, ME или др.) и определение измеряемой величины,
ii. МИзм высшего порядка, если применимо, или протоколы для установления метрологически прослеживаемой калибровки для МИ IVD.
Примечание 1 — Протоколы в перечислении «ii» включают протоколы, определенные уполномоченным органом или другим авторитетным органом (так называемой международной профессиональной организацией),
iii. (если применимо) СО для калибровки любой МИзм, приведенной в перечислении «ii»,
iv. референтные лаборатории и/или сети лабораторий, назначенные национальными метрологическими институтами, профессиональными медицинскими объединениями, органами по аккредитации или другими уполномоченными органами, способные обеспечить целевое исследование измеряемой величины в предполагаемых образцах человека.
Примечание 2 — Лаборатории, относящиеся к перечисляемым в «iv», включают калибровочные или референтные лаборатории, используемые изготовителем (или от его имени);
Ь) описание иерархии калибровки, обычно состоящей из чередующихся пар МИзм и СО, устанавливающих непрерывную последовательность переноса значений, начиная с эталона высшего доступного уровня [см. 4.1, а)] и заканчивая измеренными значениями величины, полученными для образцов биологического материала человека с использованием МИ IVD;
с) спецификацию для Umax(y) для МИ IVD [т. е. верхний предел спецификации неопределенности измерений (см. 3.25)]. Оцененная суммарная расширенная неопределенность измерений U(y) (см. 4.3.2) должна быть задокументирована таким образом, чтобы она не превышала Umax(y). Эта оценка должна включать оценку суммарной стандартной неопределенности и(у) (см. 3.33) конечных измеренных значений на образцах биологического материала человека для указанного МИ IVD. Оценка и(у) (см. 3.33) должна учитывать (и документировать) иса/ значение, присвоенное любым калибраторам, используемым для калибровки МИ IVD, независимо от того, выполняется ли конечная калибровка МИ IVD конечным пользователем МИ IVD или изготовителем МИ IVD (иногда называемая «заводская калибровка»);
d) краткое описание валидационного(ых) исследования(ий), подтверждающего(их) утверждение о метрологической прослеживаемости конечных измеренных значений величин, присвоенных образцам биологического материала человека, с использованием указанного МИ IVD.
4.2 Определение измеряемой величины
Измеряемая величина должна быть определена и описана в соответствии со следующими характеристиками и включена в документацию производителя:
а) наименование аналита (например, P-D-глюкоза);
Ь) биологическая система (например, плазма крови человека). Необходимо учитывать предполагаемое использование в медицине, относящееся к принятию частного медицинского решения.
Пример — Хорионический гонадотропин человека (общий (i-hCG) в плазме крови человека, используемый либо для определения беременности, либо для обнаружения опухоли и проведения мониторинга;
с) род величины (например, молярная концентрация);
18
ГОСТ Р ИСО 17511—2022
d) единица измерения (например, ммоль/л);
е) в тех случаях, когда измеряемую величину определяют конкретной МИзм, протоколом измерения или группой МИзм (т. е. измеряемая величина, устанавливаемая в процессе проведения конкретных действий), МИзм или протоколы должны быть указаны. МИзм, калибраторы или протоколы, необходимые для определения конкретной измеряемой величины, должны быть доступны для общего доступа и использования соответствующим квалифицированным лабораторным персоналом.
4.3 Спецификации максимально допустимой расширенной неопределенности измерений
Umax(y)
4.3.1 Общие требования
Umax(y) для МИ IVD должна быть установлена изготовителем для измерений с использованием МИ IVD с его предполагаемыми установками регулировок с предполагаемыми образцами биологического материала человека, и, как минимум, в пределах интервалов измерений, в которых принимаются медицинские решения. Спецификации Umax(y) должны быть включены в документацию производителя по иерархии калибровки для МИ IVD.
4.3.2 Диапазон спецификации
Спецификация Umaxfy), установленная изготовителем МИ IVD, должна учитывать суммарную неопределенность измерений, связанную со всеми этапами иерархии калибровки для МИ IVD, вплоть до и включая присвоение значения калибраторам МИ IVD конечного пользователя в дополнение к ожидаемому вкладу в неопределенность вследствие повседневного применения в МИ IVD, как минимум в условиях повторяемости.
Примечание 1 — Спецификация Umax(y) для МИ IVD — это спецификация для суммарной расширенной (к = 2) максимально допустимой неопределенности измерений, охватывающей все этапы калибровочной иерархии, включая конечное измерение с использованием образцов биологического материала человека. Стратегии установления Umax(y) для МИ IVD были центральными темами различных международных конференций [31]—[34].
4.4 Определение иерархии калибровки
4.4.1 Общие требования
Иерархия калибровки должна быть определена как ряд последовательных калибровок с приписыванием значений, чередование между соответствующими назначению МИзм и СО (эталонами или калибраторами), начинающейся с эталона и/или МИзм и заканчивающейся значениями измеряемой величины в исследуемых образцах биологического материала человека, определенными конечным пользователем МИ IVD. Техническая документация иерархии калибровки должна включать графическое представление (т. е. рисунок или другое изображение), демонстрирующее взаимосвязь финальных результатов измерений образцов биологического материала человека, исследованных с использованием данного МИ IVD, с эталоном высшего доступного метрологического уровня.
Примечание 1 — В зависимости от наличия для данной измеряемой величины эталонов более высокого уровня (СО и МИ), для нее могут быть возможны различные иерархии калибровки и варианты передачи значений величины (см. раздел 5).
Примечание 2 — Результат (итог) каждой последующей калибровки в иерархии зависит от результата (итога) предыдущей калибровки (см. раздел 5).
Примечание 3 — Для некоторых измеряемых величин величина, которую измеряют, изменяется на различных этапах иерархии калибровки.
Пример 1 — Для некоторых белков в сыворотке измеряемая величина может выражаться молярной концентрацией определенного пептида, полученного из исследуемого белка, или молярной концентрацией функционального эпитопа.
Пример 2 —Для P-D-глюкозы в сыворотке крови измеряемая величина может быть фракцией массы производного P-D-глюкозы, определяемой с помощью масс-спектрометрии, или продукта ферментативного гидролиза P-D-глюкозы (например, Н2О2 при использовании глюкозооксидазной методики).
4.4.2 Измеренная величина
Для каждого шага в определенной иерархии калибровки, при возможности, должна быть идентифицирована величина, измеряемая в применимом СО (или образцах биологического материала человека в случае конечных измерений с помощью МИ IVD), а также должна быть установлена взаимосвязь между измеренной(ыми) величиной(ами) и измеряемой величиной.
19
ГОСТ Р ИСО 17511—2022
4.4.3 Высший уровень метрологической прослеживаемости
Для данной измеряемой величины должны быть идентифицированы находящиеся на высшем уровне метрологической иерархии МИзм, протокол измерений или калибровочный материал в иерархии калибровки и должен быть определен высший уровень метрологической прослеживаемости для рассматриваемой измерительной системы.
4.4.4 Прослеживаемость к Международной системе единиц
Для МИ IVD, которое претендует на метрологическую прослеживаемость к СИ переданных значений для образцов биологического материала человека, определенная иерархия калибровки должна поддерживаться доступными элементами референтной системы более высокого порядка, включая или СО (применительно к требованиям ИСО 15194) и РМИзм (применительно к требованиям ИСО 15193), или один из этих элементов, которые позволяют реализовать соответствующую единицу величины Международной системы единиц для соответствующей измеряемой величины.
4.4.5 Внесистемная прослеживаемость МИ IVD
Для того чтобы претендовать на метрологическую прослеживаемость калибровки и передаваемых значений (например, в внесистемных или международных общепринятых единицах) с использованием непрослеживаемого к Международной системе единиц МИ IVD, иерархия калибровки для МИ IVD должна быть определена таким образом, чтобы обеспечить последовательную реализацию соответствующих (внесистемных) единиц измерения.
4.4.6 Число уровней в указанной иерархии
Число уровней (т. е. число последовательных пар МИзм и калибраторов) в иерархии калибровки может быть изменено сторонами, реализующими иерархию калибровки, при условии, что изменения валидированы и сохранены наиболее высокие элементы метрологической иерархии (см. раздел 5).
4.5 Выбор и требования к СО и калибраторам
4.5.1 Общие требования
Калибраторы (эталоны), используемые на каждом этапе иерархии калибровки, должны быть задокументированы на соответствие назначению стороной, ответственной за данный этап калибровки. Обоснование выбора каждого калибратора в рамках калибровочной иерархии должно быть включено в документацию производителя МИ IVD.
4.5.2 Характеристики, подлежащие документированию
Для каждого калибратора или СО, применяемого в установленной иерархии калибровки для конкретного МИ IVD (за исключением калибраторов МИ IVD для конечного пользователя), должны быть определены и задокументированы следующие характеристики, а также обеспечена их согласованность в заменяющих партиях:
а) предполагаемое использование материала;
Ь) идентификация аналита (с указанием, если применимо, атомных или молекулярных форм и/ или химических суррогатных форм);
с) источник происхождения материала (например, синтетический, рекомбинантный, микробный, человеческий или животный);
d) фаза(ы) (газ, жидкость, твердое тело);
е) агрегатное(ые) состояние(я) (раствор, суспензия, лиофилизированная);
f) матрица материала (например, водная, матрица других растворителей, буфер, белковый раствор, образцы биологического материала человека);
д) приписанные значения и их метрологическая прослеживаемость;
h) расширенная неопределенность измерений U(y), присвоенных СО значений.
Примечание 1 — Расширенная неопределенность измерения U(y), деленная на коэффициент охвата (указанный в сертификате СО), представляет собой стандартную неопределенность измерения и(у), которую используют при дальнейшем расчете суммарной неопределенности измерения.
Примечание 2 — Для несертифицированных СО (см. 3.39) или калибраторов стандартную неопределенность присвоенного значения и соответствующий коэффициент покрытия иногда выражают как распределение плотности вероятности присвоенного значения;
i) стабильность;
j) однородность внутри партии;
к) характеристики коммутативности;
I) признание, если при наличии (например, международное, региональное, национальное);
20
ГОСТ Р ИСО 17511—2022
т) орган, выдающий документ, если при наличии (например, ВОЗ, JISC, EU-JRC, NIST);
п) статус сертификации (сертифицированный, несертифицированный).
4.5.3 СО более высокого порядка, соответствующие ИСО 15194
Когда для реализации конкретных этапов калибровочной иерархии требуются СО более высокого порядка, должны быть использованы материалы, соответствующие требованиям ИСО 15194, если они подходят и доступны. Документация о статусе соответствия ИСО 15194 любых применимых СО, которые включают в себя различные уровни калибровочной иерархии для МИ IVD, должна быть включена (или указана) в комплекте технической документации производителя МИ IVD.
Примечание — Объединенный комитет по прослеживаемости в лабораторной медицине (JCTLM) [28] создал список СО, которые соответствуют требованиям ИСО 15194.
4.5.4 СО, не соответствующие ИСО 15194
Когда соответствующие требованиям ИСО 15194 СО недоступны или доступные СО непригодны по другим причинам (т. е. не установлена или неудоворетворительна коммутативность), другие СО, не соответствующие требованиям ИСО 15194, могут быть применены на более высоком (высшем) уровне в данной калибровочной иерархии для МИ IVD при условии, что стороны, ответственные за установление иерархии калибровки, продемонстрируют (документированным подтверждением) соответствие назначению и рабочие характеристики этих СО.
Документация таких СО должна содержать характеристики материала, указанные в 4.5.2.
4.5.5 Коммутативность СО
При возможности применения коммутативность СО по отношению к образцам биологического материала человека должна быть задокументирована для соответствия его предполагаемому использованию согласно положению СО в калибровочной иерархии МИ IVD.
Примечание — МИзм, включая те, которые используют для охарактеризования и/или приготовления первичных СО (например, чистых веществ) и первичных калибраторов (см. раздел 5, рисунки 1 и 3, т. 1 и т. 2), обычно не могут быть применены к образцам биологического материала человека, как это требуется при выполнении оценок коммутативности, поэтому оценка коммутативности таких СО на этих уровнях (раздел 5, рисунки 1 и 3, т. 1 и т. 2) калибровочной иерархии не требуется.
4.5.6 Исключение из требования оценки коммутативности
При наличии РМИзм для измеряемой величины (см. раздел 5, рисунки 1—3, р. 3) коммутативность СО может быть оценена на том уровне, на котором в иерархии калибровки используют вторичный (матричный) СО или другой вторичный калибратор (раздел 5, рисунки 1—3, р. 3), например ССО, как в случае калибратора, выбранного изготовителем МИзм (раздел 5, рисунки 1—3, р. 4). Для последующих шагов вниз по иерархии калибровки, таких как этап передачи значения с применением рабочего калибратора (раздел 5, рисунки 1—3, т. 4) для калибровки установленной изготовителем МИзм (раздел 5, рисунки 1—3, р. 5), коммутативность СО/рабочего калибратора (раздел 5, рисунки 1—3, т. 4) должна быть проанализирована для обеспечения надлежащей передачи значения и предотвращения смещения.
4.5.7 Применение некоммутативного ССО
Если ССО (раздел 5, рисунки 1—3, т. 3) или международно признанный калибратор, предназначенный для калибровки установленной производителем МИзм (раздел 5, рисунки 1—3, р. 4), демонстрирует коммутативность с образцами биологического материала человека при измерении некоторыми, но не всеми МИ IVD конечного пользователя, предназначенными для исследования заявленной измеряемой величины, эти ССО могут быть использованы в качестве калибратора в иерархии калибровки для данного МИ IVD, для которых СО не продемонстрировали коммутативности с предполагаемыми образцами биологического материала человека, путем применения поправочного коэффициента или функции для приписанных значений ССО. Если это применимо, подробная информация об использовании и валидации такой коррекции приписанных значений ССО или других СО, таких как международно признанные калибраторы, должна быть приведена в документации по иерархии калибровки для указанного МИ IVD, и иса1 значений, присвоенных калибратору(ам) конечного пользователя МИ IVD, и включать любую дополнительную неопределенность, связанную с поправочным коэффициентом или с функцией.
4.5.8 Альтернативные СО
При отсутствии коммутативных ССО или международно признанных калибраторов должно быть задокументировано обоснование выбора любых альтернативных СО (используемых в качестве кали-21
ГОСТ Р ИСО 17511—2022
браторов) на каждом этапе применения в иерархии калибровки. Альтернативные СО должны быть задокументированы таким образом, чтобы они соответствовали своему целевому назначению, каждый из них должен иметь приписанное значение со стандартной неопределенностью измерений, и должна быть продемонстрирована их коммутативность с предполагаемыми образцами биологического материала человека на каждом этапе передачи калибровки, на котором они используются. Техническая документация для таких альтернативных СО должна включать соответствующие характеристики, указанные в 4.5.2.
Примечание 1 — Альтернативные СО включают панели и/или пулы индивидуальных образцов биологического материала человека, дополненные или «обогащенные» образцы, приготовленные в естественных или искусственных матрицах, или иные подходящие материалы.
Примечание 2 — Рекомендации по надлежащему выбору элементов панели образцов биологического материала человека для использования в калибровочной иерархии приведены в [18] —[20].
Примечание 3 — Предполагается, что образцы биологического материала человека являются коммутативными при хранении в условиях, валидированных на не изменение стабильности измеряемой величины или матрицы.
Примечание 4 — Валидация условий хранения образцов биологического материала человека для определенной измеряемой величины может быть выполнена с помощью репрезентативной панели отдельных образцов биологического материала человека. Такая валидация условий хранения панелей образцов биологического материала человека может быть использована для поддержки последующих панелей образцов, полученных от лиц с аналогичными характеристиками здоровья/патологий, при поддержании калибровочной иерархии для указанного МИ IVD без требования валидации коммутативности хранящихся панелей образцов.
4.5.9 Обогащение альтернативного СО
Когда панели образцов биологического материала человека применяют в качестве альтернативных СО в калибровочной иерархии для определенного МИ IVD, если аналит в образцах биологического материала человека (панелях или пулах), предназначенных для использования в качестве СО, должен быть модифицирован путем обогащения или истощения для достижения соответствующих значений величин, то коммутативность модифицированных образцов должна быть подтверждена. Когда выявляют специфические для образцов интерференции или идентифицируют ограничения МИзм по несе-лективности, отдельные образцы биологического материала человека, проявляющие эти ограничения, исключают из панелей образцов биологического материала человека, предназначенных для использования в качестве калибраторов в иерархии калибровки.
4.5.10 Некоммутативные калибраторы МИ IVD для конечного пользователя
Если в качестве калибраторов МИ IVD для конечного пользователя используют некоммутативные материалы (см. рисунки 1—6, р. 5), то в иерархии калибровки должны быть применены коммутативные материалы (например, панель биологических образцов человека), позволяющие определить поправочный коэффициент или корректирующую функцию для присвоения арбитражных значений некоммутативным калибраторам МИ IVD конечного пользователя, компенсирующим любую ошибку, вызванную некоммутативностью. В этих случаях детали проведения и валидации такой корректировки присвоенных значений некоммутативных калибраторов МИ IVD для конечного пользователя должны быть приведены в документации калибровочной иерархии для указанного МИ IVD, и значений иса/, присвоенных калибратору(ам) МИ IVD конечного пользователя, должна включать любую дополнительную неопределенность, связанную с поправочным коэффициентом или функцией.
4.6 Отбор и требования к МИзм
4.6.1 Обоснование выбора МИзм и ответственность за документацию
Каждый последовательный шаг передачи значения в иерархии калибровки должен включать определенную МИзм, которая подходит для этой цели. Обоснование выбора МИзм на каждом уровне установленной калибровочной иерархии должно быть включено в документацию производителя МИ IVD и сопровождаться подтверждающими данными, свидетельствующими о том, что аналитические эксплуатационные характеристики каждой МИзм соответствуют эксплуатационным требованиям (т. е. назначению). Часть документации для данной МИзм в калибровочной иерархии может быть получена от третьей стороны, например от разработчика определенной МИзм.
4.6.2 Метрологический статус МИзм
МИзм на каждом уровне определенной калибровочной иерархии должны быть идентифицированы с точки зрения их метрологического статуса. РМИзм, содержащие элементы калибровочной иерар-22
ГОСТ Р ИСО 17511—2022
хии согласно моделям, описанным в разделе 5, и соответствующие требованиям ИСО 15193, считают МИзм более высокого метрологического порядка. Различные РМИзм более высокого порядка могут быть развернуты на разных ступенях иерархии. В случае отсутствия надлежащих РМИзм ИСО 15193 МИзм, не отвечающие требованиям ИСО 15193, могут по-прежнему применяться в иерархии (например, выбранная МИзм производителя или установленная МИзм производителя) до тех пор, пока стороны, ответственные за иерархию калибровки, продемонстрировали (с документальной достоверностью) пригодность соответствующих МИзм к назначению и эксплуатационным характеристикам.
Пример — В иерархии калибровки для конкретной измеряемой величины, прослеживаемой к СИ РМИзм более высокого порядка, откалиброванной с помощью ССО, применяют на самом высоком уровне иерархии калибровки. На последующих (более низких) уровнях иерархии калибровки вводят шаги переноса значений для присвоения значений коммерческим калибраторам, которые разворачивают МИзм метрологически более низкого уровня (например, международные общепринятые МИзм, выбранные изготовителем РМИзм и/или установленные МИзм изготовителя), калиброванные с помощью вторичных калибраторов (с сертификацией или без нее).
Примечание 1 — Некоторые МИзм, являющиеся частью калибровочной иерархии, особенно на нижних уровнях калибровочной иерархии, основаны на таком же принципе, как и МИзм конечного пользователя МИ IVD (например, постоянная МИзм изготовителя).
Примечание 2 — В научных изданиях часто публикуются полные описания РМИзм более высокого порядка, устанавливающие прослеживаемость до единиц измерения СИ и соответствующие ИСО 15193.
4.6.3 Референтные измерительные лаборатории
Референтные измерительные лаборатории согласно ИСО 15195 могут быть выбраны производителем или другой ответственной стороной для оказания референтных измерительных услуг в поддержку внедрения метрологически прослеживаемой калибровочной иерархии. Выбранные референтные измерительные лаборатории, даже если они не соответствуют ИСО 15195, должны продемонстрировать свою компетентность в обеспечении наиболее доступных измерений для выбранной измеряемой величины с точки зрения метрологической прослеживаемости значений, измеренных в биологических образцах человека предполагаемых типов и в рамках установленных калибровочной иерархией.
Примечание — Соответствие ИСО 15195 демонстрируется независимо путем внесения в базу данных JCTLM перечня услуг референтной измерительной лаборатории [28].
4.6.4 Воздействие влияющих величин
Описание метрологически прослеживаемой калибровочной иерархии для МИ IVD должно включать результаты исследования воздействия влияющих величин на соответствующие МИзм на каждом уровне калибровочной иерархии.
4.6.5 Изменения измеряемой величины в пределах калибровочной иерархии
Для обеспечения непрерывной цепочки взаимосвязей и возможности представления измеренных величин, которые можно проследить до наиболее высокого порядка доступных РМИзм (в пределах приемлемых с медицинской точки зрения пределов), на всех уровнях калибровочной иерархии должны быть приняты меры для решения и/или предотвращения проблем, связанных с различиями или изменениями измеряемой величины между различными МИзм на разных уровнях калибровочной иерархии. В этом контексте следует признавать и минимизировать по мере необходимости различия между измеряемой величиной (или измеряемым количеством) и величиной, подлежащей измерению (количеством, предназначенным для измерения).
Примечание 1 — Несколько МИ IVD, предназначенных для измерения одного количества, но основанных на разных химических принципах, иногда дают разные значения для одного биологического образца человека или референтного материала.
Примечание 2 — На конкретные МИ IVD иногда влияют характеристики селективности измерений, такие как третичные конформации молекул, микрогетерогенность или химические формулы целевого аналита.
Пример 1 — Когда существует переменная микрогетерогенность аналита (изоформ, производных) в одном или обоих калибраторах и/или предполагаемых биологических образцах человека (например, классы аналита, такие как ферменты, антитела, гликопротеины, биомаркеры микроорганизмов и другие свободные или связанные формы аналита).
Примечание 3 — Сложности метрологической прослеживаемости часто возникают, когда принцип МИ IVD основан на обнаружении суррогата определенного аналита (например, пептидного фрагмента крупного белка,
23
ГОСТ Р ИСО 17511—2022
а не всей белковой молекулы) или когда калибратор МИ IVD содержит тот аналит, который является суррогатом аналита, обнаруженного в биологических образцах человека.
Пример 2 — Две или более иммуноаналитические МИзм для МИ IVD предназначены для измерения молярной концентрации вещества одного белкового гормона (например, тиреотропного гормона, ТТГ]. Если различные иммуноаналитические МИзм для МИ IVD распознают и реагируют в разной степени с различными эпитопами ТТГ, то значения для различных, хотя и взаимосвязанных количеств генерируются каждым МИ IVD, что, возможно, приводит к отсутствию эквивалентности в конечных измеренных значениях в определенных биологических образцах человека.
Пример 3 — Неэквивалентность значений между различными МИ IVD может наблюдаться среди очень селективных (но различных) принципов измерения (например, масс-спектрометрической МИзм методики иммуноанализа белкового гормона в сыворотке крови человека). Каждое МИ IVD направлено на обнаружение различных изоформ или фрагментов одного и того же белка, но при этом могут быть определены различные значения, т. к. с помощью каждого МИ IVD измеряют разные количества.
Пример 4 — Калибратор конечного пользователя для МИ IVD, предназначенный для измерения сывороточного билирубина, может содержать дитауробилирубин (синтетический суррогатный аналит, не обнаруженный в качестве природного вещества в биологических образцах человека) вместо (или в дополнение к) естественных неконъюгированных конъюгатов билирубина и глюкуронида билирубина. Относительная селективность МИ IVD для суррогатного аналита по сравнению с природным анали-том, обнаруженным в биологических образцах человека, может изменяться в течение срока службы МИ IVD из-за таких факторов, как старение одного или нескольких реагентов, что делает недействительными значения, присвоенные калибраторам МИ IVD конечного пользователя.
Пример 5 — При проведении иммунохимического измерения молярной концентрации ферритина в сыворотке крови с микрогетерогенностью аналита различные изоформы ферритина распознаются в разной степени различными моноклональными антителами, включенными в различные МИ IVD, что приводит к получению различных сообщаемых значений для различных МИ IVD с определенными биологическими образцами человека.
4.7 Оценки погрешности установленного значения для калибратора МИ IVD конечного пользователя
4.7.1 Общие требования
Суммарная стандартная неопределенность измерения значения, присвоенного калибратору МИ IVD (обозначенному иса/ в настоящем стандарте), должна быть оценена и предоставлена конечным пользователям от изготовителя. При этом иса/ не должна превышать допустимую долю Umax(y) спецификации для МИ IVD с учетом коэффициента охвата к.
Примечание — Расчет распределения ошибок для иса/ приведен в других документах [33], [34].
4.7.2 Документация для метода оценки иса1
Значение иса/ оценивают предпочтительно в соответствии с принципами GUM. Независимо от того, используется ли GUM метод или другой метод оценки иса1, метод статистического расчета иса1 должен быть задокументирован и сохранен в техническом файле калибратора МИ IVD, по крайней мере, в течение срока службы изделия.
4.7.3 Статистические аспекты и сферы применения оценки иса/
Для каждого калибратора МИ IVD, идентифицированного изготовителем для использования при калибровке конкретного МИ IVD, иса1, подлежащую оценке и предоставляемую изготовителем калибратора МИ IVD, определяют путем статистического объединения неопределенностей, связанных с каждым из последовательных шагов присвоения значений под контролем производителя. При определении ucai изготовитель должен также учитывать указанные и прогнозируемые неопределенности, вносимые на всех этапах получения значений более высокого порядка в определенной иерархии калибровки, включая этапы, не находящиеся под контролем производителя, такие как (где это применимо) стандартная неопределенность значения, приписанного СО наиболее высокого порядка. Дополнительные требования при оценке ucai включают следующее:
- оценка иса1 должна быть основана как минимум на одном репрезентативном (единичной) лоте или партии реагента;
- следует учитывать установленные и прогнозируемые вариации и соответствующие стандартные неопределенности в определенных калибраторах и реагентах МИ IVD, а также в любых промежуточных 24
ГОСТ Р ИСО 17511—2022
СО и измерительных системах или МИзм во всей калибровочной иерархии (обусловленные, например, такими факторами, как неоднородность и нестабильность материала, но не ограничиваясь ими).
Примечание 1 — Оценочное значение иса/ часто варьируется между различными партиями калибраторов МИ IVD конечного пользователя, особенно в том случае, когда различные партии калибраторов для одного МИ IVD имеют существенно различающиеся приписанные значения.
4.7.4 Выражение иса1
Значение иса/ выражают в виде стандартного отклонения SD. Когда много компонентов неопределенности объединяют для оценки суммарной стандартной неопределенности, каждый компонент неопределенности [т. е. и(у) на каждом уровне калибровочной иерархии] сначала должен быть выражен как дисперсия SD2. Затем составляющие дисперсии суммируют, и квадратный корень из суммы дисперсий представляет собой суммарную стандартную неопределенность и(у) (см. пример 1). Значение иса1 может быть альтернативно вычислено и выражено в терминах относительной комбинированной неопределенности или процента относительной комбинированной неопределенности, %ги(у), т. е. относительной неопределенности к среднему или целевому значению измеряемой величины в калибраторе (см. пример 2).
Примечание 1 — Минимальной информацией, необходимой для оценки вклада неопределенности любой МИзм в иерархию калибровки, является стандартное отклонение МИзм в условиях повторяемости (uRw.px), а также достоверность значения, присвоенного любым калибраторам, используемым для этого МИзм.
Примечание 2 — Расчеты, приведенные в примерах 1 и 2, применимы только в тех случаях, когда входные величины независимы. Если входные величины не являются независимыми, то ковариации являются подходящими.
Пример 1 — Суммарную стандартную неопределенность вычисляют по формуле
и(у) = ^[u(y)i + и(у)% + и(у)^ + ... + и(у)2п], (1)
где и(у) — суммарная стандартная неопределенность конечной измеряемой величины; и(у)1; и(У)2> и(У)з> — и(У)п — стандартные неопределенности составляющих отклонений от каждого шага в определенной калибровочной иерархии.
Расширенную суммарную неопределенность U вычисляют по формуле
U = u(y)k, (2)
где и(у) — суммарная стандартная неопределенность, вычисляемая по формуле (1);
к — коэффициент охвата (часто 2, для уровня достоверности приблизительно 95 %).
Пример 2 — Относительную суммарную неопределенность и(у), %, измерительной системы вычисляют по формуле
и(у) = /[%п^^%1^^ (3)
где %ги(у) — совокупный процент относительной стандартной неопределенности, где каждую составляющую относительную неопределенность вычисляют по формуле
%ги(у) = 100 • ufy^mfy)", (4)
где 7оги(у)п — процент относительной стандартной неопределенности n-го компонента неопределенности;
и(у)п — стандартная неопределенность n-й составляющей неопределенности;
т(у)п — среднее измеренное (или целевое) значение измеряемой величины для измерения п-го компонента по МИзм.
Квадрат каждой составляющей процентной относительной неопределенности 70ги(у)2, т. е. процентную относительную дисперсию вычисляют по формуле
°/оги(у)2п = [100 • ^yj^mfy)^2, (5)
где 7оги(у)2 — относительная дисперсия неопределенности, 7о, n-го компонента.
Затем суммируют относительные отклонения компонентов в процентах и вычисляют квадратный корень из суммы относительных отклонений компонентов в процентах в соответствии с формулой (3), чтобы получить °/оги(у), суммарную относительную стандартную неопределенность в процентах для измерительной системы.
25
ГОСТ Р ИСО 17511—2022
4.7.5 Модификации продукта
Когда МИ IVD или разработанный калибратор конечного пользователя для МИзм IVD модифицируется изготовителем (либо первоначальным изготовителем, либо другой организацией), иса/ присвоенных значений для каждого соответствующего калибратора МИ IVD должен быть подтвержден или переоценен изготовителем, если только не предусмотрено обоснование того, почему это изменение не влияет на иса1.
Примечание — В данном пункте изготовитель — это любая организация, включая медицинскую лабораторию, которая модифицирует МИ IVD.
4.7.6 Информация, которая должна быть предоставлена конечному пользователю
Для приписанных значений калибраторов МИ IVD минимальная информация о иса/, которая должна быть предоставлена изготовителем калибратора конечному пользователю по запросу, составляет числовое значение у, и^у), где у— значение, приписанное калибратору.
Примечание 1 — Оценки иса/ калибраторов МИ IVD иногда представляют в виде расширенной неопределенности Ucai, где иса/ = ucai(y) ■ к, обычно с коэффициентом покрытия к = 2, соответствующим уровню достоверности приблизительно 95 %. Поскольку предпочтительной информацией, предоставляемой изготовителем, является иса/ только в виде суммарной стандартной неопределенности, представление информации о расширенной неопределенности Ucai присвоенных калибратором значений не рекомендуется.
Примечание 2 — В зависимости от национальных и региональных требований конечные пользователи МИ IVD в медицинских лабораториях часто используют значение иса1, предоставленное производителем калибратора МИ IVD, для оценки комбинированной точности измерения величины для биологического образца человека, определенной с помощью указанного конечного пользователя МИ IVD.
4.8 Подтверждение (валидация) метрологической прослеживаемости значений, приписанных калибратору МИ IVD
4.8.1 Общие требования к подтверждению
Изготовитель калибратора МИ IVD должен обеспечить подтверждение метрологической прослеживаемости значения, приписанного калибратору МИ IVD.
Примечание 1 — Как указано в 3.49, в ИСО 9000 валидация определена как подтверждение (подкрепленное объективными доказательствами) того, что требования для конкретного предполагаемого использования или применения выполнены. ИСО 9000 далее определяет «объективные доказательства» как данные, подтверждающие существование чего-либо. Объективные доказательства получаются с помощью наблюдения, измерения, тестирования или других средств.
Примечание 2 — Валидация метрологической прослеживаемости калибровки может быть достигнута с помощью целого ряда инструментов и стратегий. Наиболее прямолинейными стратегиями разработки объективных доказательств достоверности прослеживаемости калибровок являются измерения с наиболее полно разработанными референтными системами. Более сложные стратегии валидации (и повышенная ответственность за документацию) требуются для иерархий калибровки, поддерживающих измерения без существующих эталонов более высокого порядка или протоколов гармонизации.
4.8.2 Стратегии подтверждения
Разработка исследований для подтверждения прослеживаемости приписанных значений для калибраторов МИ IVD конечных пользователей должна быть задокументирована изготовителем в технической документации МИ IVD. Выбор конкретной стратегии валидации для данной калибровочной иерархии должен зависеть от уровня и технических характеристик референтной системы для измеряемой величины, а также от наличия материалов (СО) и МИзм, необходимых для выполнения перечисленных ниже типов исследований. Для данной калибровочной иерархии может быть применено несколько стратегий валидации по выбору стороны (чаще всего изготовитель), ответственной за определение калибровочной иерархии конкретного МИ IVD. Стратегии исследования, применимые для валидации заявленной прослеживаемости калибровки для МИ IVD, включают, но не ограничиваются:
а) проверку коммутативных СО (предпочтительно ССО и/или материалов контроля правильности; см. 3.46);
Ь) участие в EQA, тестировании квалификации (РТ) или других схемах межлабораторных сличений, использующих коммутативные исследуемые образцы, с целевыми значениями, предпочтительно назначаемыми РМИзм (при наличии) или протоколом гармонизации;
26
ГОСТ Р ИСО 17511—2022
с) исследование заложенных в банк биологических образцов человека со значениями, ранее приписанными РМИзм;
d) сравнительные исследования метода с использованием множества биологических образцов человека, в сопоставлении с РМИзм более высокого порядка;
е) сравнительные исследования метода с использованием набора биологических образцов человека с другой независимой МИзм (не являющейся РМИзм);
f) аналитические контрольные материалы более высокого порядка, встроенные в иерархию калибровки и МИзм, приписывающие значения, с акцентом на использование тщательно откалиброванных, прослеживаемых к СИ средств измерений и контрольных материалов (например, весов, вольюметри-ческой стеклянной посуды, спектрофотометров, термометров, средств контроля окружающей среды, реагентов с наивысшей доступной чистотой).
Примечание 1 — Среди возможных способов подтверждения, описанных выше, доступность РМИзм является наиболее важным фактором.
Примечание 2 — Среди общих стратегий подтверждения, описанных выше, стратегии по перечислениям а)—е) сосредоточены на выходе (т. е. истинности измеренных значений) указанной калибровочной иерархии, в то время как стратегии по перечислению f) — на правильности и воспроизводимости процесса передачи значений и процедур в рамках калибровочной иерархии (т. е. критических шагов, таких как объемные и гравиметрические измерения).
Примечание 3 — Руководство по надлежащему отбору участников панели проб биологического материала человека для сравнительных исследований методов по перечислениям с), d) и е) приведено в [18]—[20].
4.8.3 Положения по проектированию испытаний и критерии приемки
Для валидационных испытаний, включающих сравнение методов с использованием панелей биологических образцов человека для подтверждения утверждений о метрологической прослеживаемости значения, присвоенного калибратору МИ IVD [см. 4.8.2, с), d) и е)], должны быть учтены известные переменные, влияющие на измерения биологического образца человека и/или калибратора как для испытуемого МИ IVD, так и для РМИзм (или другой МИзм), с которой будут сравниваться результаты испытуемого МИ IVD. Заранее установленные критерии приемки для валидации должны быть получены исходя из спецификаций Umax(y) для МИ IVD, определенных в соответствующей иерархии калибровки для измеряемой величины (см. 4.3), и не должны превышать их. Количество повторов измерений каждого образца, полученных с помощью испытуемого МИ IVD, должно быть установлено таким образом, чтобы вероятность обнаружения смещения, такого же большого, как критерии валидации, была достаточно высокой (например, >80 %), в то время как вероятность неправильного отказа от критериев валидации была низкой (например, <5 %).
Примечание — Методы определения характеристик Umax(y) для МИ IVD подробно приведены в [31]-[34].
4.8.4 Иерархии калибровки с доступными РМИзм
Для иерархий калибровки, описанных в 5.2—5.4 (см. рисунки 1—3), при наличии РМИзм для измеряемой величины прослеживаемость значений, присвоенных калибраторам конечного пользователя и биологическим образцам человека, должна быть проверена путем сравнения измеренных значений с наборами биологических образцов человека типа(ов), предназначенных для использования с МИ IVD. Эти сравнения проводят между значениями, измеренными по РМИзм (см. рисунки 1—3, р. 3), и значениями, измеренными с помощью откалиброванного МИ IVD конечного пользователя. В тех случаях, когда физические ограничения и затраты делают такие сравнения непрактичными, вместо сравнения испытуемого МИ IVD с РМИзм наиболее высокого доступного уровня приемлемой альтернативой с документальным обоснованием должно быть сравнение со вторичной РМИзм (или другой РМИзм более низкого уровня), являющейся частью определенной иерархии калибровки для измеряемой величины (см. рисунки 1—3, р. 4).
4.8.5 Иерархии калибровки без РМИзм
Когда для иерархий калибровки измеряемых величин отсутствуют РМИзм для измеряемой величины, включая иерархиии калибровки, поддерживаемые международно признанным калибратором или международным протоколом гармонизации, как описано в 5.5 и 5.6 соответственно (рисунки 4 и 5), валидация метрологической прослеживаемости значений, приписанных калибраторам указанного МИ IVD для этих измеряемых величин, должна быть выполнена, с использованием заранее определенных критериев приемлемости, путем проведения сравнительных исследований с применением типа(ов)
27
ГОСТ Р ИСО 17511—2022
панелей биологических образцов человека, для которых предназначен МИ IVD. Для МИ IVD для измеряемых величин, стандартизованных с помощью международно признанного калибратора или ССО со значением, приписанным на основе консенсуса нескольких квалифицированных МИзм (но не референтных МИзм), как описано в 5.5 и рисунке 4, должно быть проведено по крайней мере одно сравнительное исследование метода в сравнении с другим и независимым МИ IVD, предназначенным для той же измеряемой величины, стандартизованным с тем же международно признанным калибратором или ССО и который претендует на метрологическую прослеживаемость к указанному международно признанному калибратору или ССО. При использовании МИ IVD для измерений, стандартизованных в соответствии с международным протоколом гармонизации (см. 5.6 и рисунок 5), должно быть проведено по крайней мере одно сравнительное исследование метода с другим и независимым МИ IVD, который гармонизирован в соответствии с международным протоколом гармонизации.
4.8.6 Иерархии калибровки без СО и ССО
В случае измеряемых величин без доступных РМИзм или ССО, а также без международно признанных калибраторов или протоколов гармонизации для измеряемой величины (см. 5.7 и рисунок 6), разработанные и поддерживаемые внутренние иерархии калибровки, определенные производителями МИ IVD и предназначенные для этих типов измеряемых величин, должны быть валидированы на метрологическую прослеживаемость значений, присвоенных калибраторам, в соответствии с заранее определенными критериями приемлемости путем проведения проверочных исследований, подтверждающих, что все установленные входные величины и влияющие величины в формуле измерения тщательно контролируются и воспроизводимы. Должны быть определены и охарактеризованы ключевые переменные измерения и влияющие величины, обеспечивающие производительность МИ IVD.
Нормальная вариация известных переменных МИзм и влияющих величин должна быть оценена и определена количественно с точки зрения их вклада в стандартную неопределенность измерения МИ IVD, а их совокупные эффекты (при статистическом суммировании) не должны превышать соответствующей доли Umax^y) для МИ IVD.
4.8.7 Валидация конструктивных изменений для калибратора МИ IVD конечного пользователя
В случае внесения конструктивных изменений в калибратора МИ IVD и согласно результатам соответствующих оценок рисков производитель должен провести повторную валидацию метрологической прослеживаемости значений, присвоенных калибратору МИ IVD, или обосновать в технической документации производителя (например, в документации проектирования), почему повторная валидация метрологической прослеживаемости не требуется. В ходе осуществления любых конструктивных изменений конечные пользователи должны быть проинформированы при появлении новой информации относительно ожидаемых характеристик калибратора и предназначенного для него МИ IVD.
Примечание — Конструктивные изменения включают (но не ограничиваются) изменения в характеристиках сырья, изменения в источниках сырья (например, переход от одного источника ткани к другому источнику ткани для фермента), изменения производственного процесса или поставщика, изменения спецификации количества измеряемой величины, изменения протокола присвоения значения величины.
4.9 Дополнительные обязанности по документированию иерархии калибровки
4.9.1 Обязательство перед конечным пользователем
Изготовитель калибратора(ов) МИ IVD конечного пользователя предоставляет конечным пользователям по запросу целевое значение, соответствующую метрологическую прослеживаемость и иса/ для каждого уровня калибратора, предусмотренного для использования с указанным МИ IVD.
4.9.2 Ведение документации
Документация на процедуры и данные, поддерживающие иерархию калибровки МИзм IVD для измерения конкретной(ых) измеряемой(ых) величины(величин) в биологических образцах человека, включая производственные спецификации, оцененные стандартные неопределенности измерений, материалы, проверочные и валидационные исследования, а также эксплуатационные процедуры, должна храниться в документации производителя, по крайней мере, в течение срока службы МИ IVD.
4.9.3 Сторонние производители калибраторов МИ IVD
В некоторых случаях производители МИ IVD указывают калибраторы МИ IVD конечного пользователя, изготовленные другим (вторым или независимым) производителем. Такие независимые (сторонние) производители калибраторов МИ IVD должны вести технический файл, подтверждающий требования метрологической прослеживаемости приписанных значений для каждого измерения, указанного 28
ГОСТ Р ИСО 17511—2022
в инструкции о предполагаемом использовании для такого применимого(ых) калибратора(ов) МИ IVD. Аналогичным образом, любой производитель калибратора МИ IVD, реализующий калибратор, предназначенный для использования МИ IVD третьей стороной (с или без сотрудничества с производителем измерительной системы МИ IVD), несет ответственность за выполнение всех требований к документации, определенных в настоящем стандарте.
4.9.4 Изменения, внесенные независимыми организациями
Если модификации МИ IVD определяют и реализуют медицинская лаборатория или другой независимый субъект, третья сторона или лицо, не являющееся первоначальным производителем МИ IVD, полное описание и повторная валидация иерархии калибровок, лежащих в основе зарегистрированных значений для биологических образцов человека при исследовании с помощью модифицированного МИ IVD, являются обязанностью организации(ий), который(ые) определил(и) и внедрил(и) эти модификации.
4.9.5 Калибровочные иерархии, поддерживающие МИ IVD, разработанные одной организацией для собственного пользования
В случае МИ IVD, разработанного одной организацией для собственного использования, разрабатывающая и/или реализующая организация несет ответственность за валидацию и описание всей иерархии калибровки вплоть до результатов биологических образцов человека.
4.9.6 СО конечного пользователя за исключением калибраторов МИ IVD
Для СО, не относящихся к калибраторам МИ IVD конечных пользователей [например, контрольных материалов правильности МИ IVD (см. 3.46)], производитель СО должен отвечать за валидацию и описание иерархии калибровки, которая является основой для любых значений измеряемой величины, присвоенных таким СО, и за документирование статуса коммутативности материала с биологическими образцами человека (если применимо) при использовании с любыми предполагаемыми МИзм, включая любые МИ IVD. Суммарную стандартную неопределенность измерения приписанных значений для этих видов СО для МИ IVD (которые не являются калибраторами МИ IVD) оценивает изготовитель и предоставляет конечным пользователям по запросу.
4.9.7 Материалы EQA и РТ с заявляемым метрологически прослеживаемым целевым значением
Изготовитель коммутативного материала на основе правильности (см. 3.46) для EQA и/или РТ с присвоенным(и) значением(и), которое(ые), как утверждается, метрологически прослеживает(ют)-ся до эталонов более высокого порядка (для одного или нескольких измеряемых величин), должен определить, описать и подтвердить соответствующую иерархию калибровки, поддерживающую приписанные значения для каждой заявленной измеряемой величины. Если заявлено производителем, коммутативность таких материалов EQA или РТ должна быть продемонстрирована в соответствии с опубликованными рекомендациями (см. CLSI ЕРЗО-А и [35]—[37]) для репрезентативных МИ IVD, широко используемых медицинскими лабораториями конечного пользователя. Приписанные значения для каждой измеряемой величины и расчетные значения иса1 определяют и предоставляют конечным пользователям по запросу.
5 Модель иерархии калибровки для метрологической прослеживаемости
5.1 Элементы описания иерархии калибровки
Иерархии калибровки для МИ IVD должны быть описаны в технической документации изготовителя. Описание иерархии калибровки должно включать следующие элементы:
а) определение измеряемой величины;
Ь) описание последовательности шагов калибровки и измерений, каждый из которых состоит из МИзм и калибратора, где «неизвестный(ые)» образец(образцы), измеряемый(ые) на каждом шаге иерархии (за исключением последнего шага), в свою очередь, использует(ют)ся как калибратор(ы) для следующего/последующего шага (МИзм);
с) оценка неопределенности приписанных значений измеряемой величины в стандартном(ых) образце(ах) (калибраторах МИ IVD), установленных на наиболее низком уровне в иерархии калибровки (обычно вместе с МИ IVD), чтобы позволить конечному пользователю оценить суммарную стандартную неопределенность регистрируемых значений в соответствующих образцах (например, образцы биологического материала человека, материалы EQA или другие калибраторы).
29
ГОСТ Р ИСО 17511—2022
Примечание 1 — Шесть описанных общих иерархий калибровки моделей (см. 5.2—5.7) являются иерархиями, которые могут быть реализованы производителями IVD для поддержки метрологически прослеживаемых калибровок для различных измеряемых величин. В этих моделях «правильность» от первого (высшего порядка) калибровочного материала и/или МИзм переносится к самому последнему измеряемому материалу (образцам биологического материала человека) на заключительном этапе последовательности измерений (как правило, МИ IVD).
Примечание 2 — Описанные модели иерархий калибровки представляют современный уровень техники и широко доступные технологии и применимы к определенным классам измеряемых величин в зависимости от наличия эталонов более высокого порядка. Представленные модели не предназначены для охвата всех возможностей и не исключают других возможностей; дополнительные модели могут быть описаны для поддержки конкретных измеряемых величин и/или новых технологий.
Примечание 3 — Количество уровней (т. е. пар МИзм и калибраторов), применяемых в калибровочной иерархии для данной измеряемой величины, является ответственностью сторон, реализующих калибровочную иерархию, при условии, что элементы наиболее высокого порядка (например, СО и/или РМИзм) остаются встроенными в конечную иерархию. Окончательный выбор конкретных метрологических уровней, которые должны быть включены в данную калибровочную иерархию, зависит от химических характеристик измеряемой величины, целевой неопределенности измерения для конечного результата и наличия МИзм, калибраторов и других соответствующих технологий (например, информационных технологий).
5.2 Иерархии калибровки с РМИзм и первичными СО
5.2.1 Общие положения
Модель иерархии калибровки для измеряемых величин, поддерживаемых доступными РМизм и первичными СО, с полной метрологической прослеживаемостью к СИ, показана на рисунке 1. Характеристики, которые должны быть рассмотрены в описании этих типов калибровочных иерархий, подробно представлены в 5.2.2— 5.2.13.
5.2.2 Определение измеряемой величины
Определение измеряемой величины должно включать единицу измерения СИ, будь то базовая или производная величина, к которой относится метрологическая прослеживаемость.
Пример 1 — 1) базовые величины: моль, килограмм; 2) производные величины: моль на кубический метр (= миллимоль на литр), грамм на килограмм.
Примечание 1 — Измеряемая величина на различных ступенях калибровочной иерархии может меняться по мере изменения исследуемого материала. Изменения измеряемой величины часто приводят к различным единицам СИ.
Пример 2 — При измерении методом баланса масс для оценки чистоты сертифицированного первичного СО кортизола определяют массовую долю примесей (измеряемая величина в данном случае), а не массовую долю кортизола, и чистоту материала указывают в виде массовой доли, с использованием единицы измерения грамм на килограмм, г/кг. Для других СО, используемых на более низких уровнях калибровочной иерархии МИ IVD для кортизола, таких как вторичные СО (например, ССО) или рабочие калибраторы изготовителя, измеряют молярную концентрацию кортизола (в сыворотке или другой жидкости организма), и результаты измерений выражают соответствующими единицами СИ (мкмоль/л).
Пример 3 — Для сложных измеряемых величин, таких как специфические белки в сыворотке крови человека (например, альбумин), измеряемой величиной в калибровочной иерархии на наиболее высоком уровне часто является чистота интактного белка (например, массовая доля, мг/г). На других более низких уровнях калибровочной иерархии измеряемой величиной часто является молярная концентрация специфических эпитопов или пептидов, полученных из определенного белка. В таких случаях измеряемая величина различна на разных уровнях иерархии, и приписанные значения для различных СО в рамках иерархии будут выражены в различных единицах СИ.
Примечание 2 — Некоторые измеряемые величины не могут быть выражены в единицах семи базовых величин СИ, но могут быть рассчитаны [38]. Примерами являются число (т. е. подсчет) определенных молекул, число определенных клеточных или биомолекулярных образований (например, число копий определенной последовательности нуклеиновой кислоты или число определенных частиц липопротеина). Необходимо полное описание подсчитываемой величины.
Пример 4 — Число CD4 клеток на единицу объема [40].
30
ГОСТ Р ИСО 17511—2022
Материал
Методика измерений
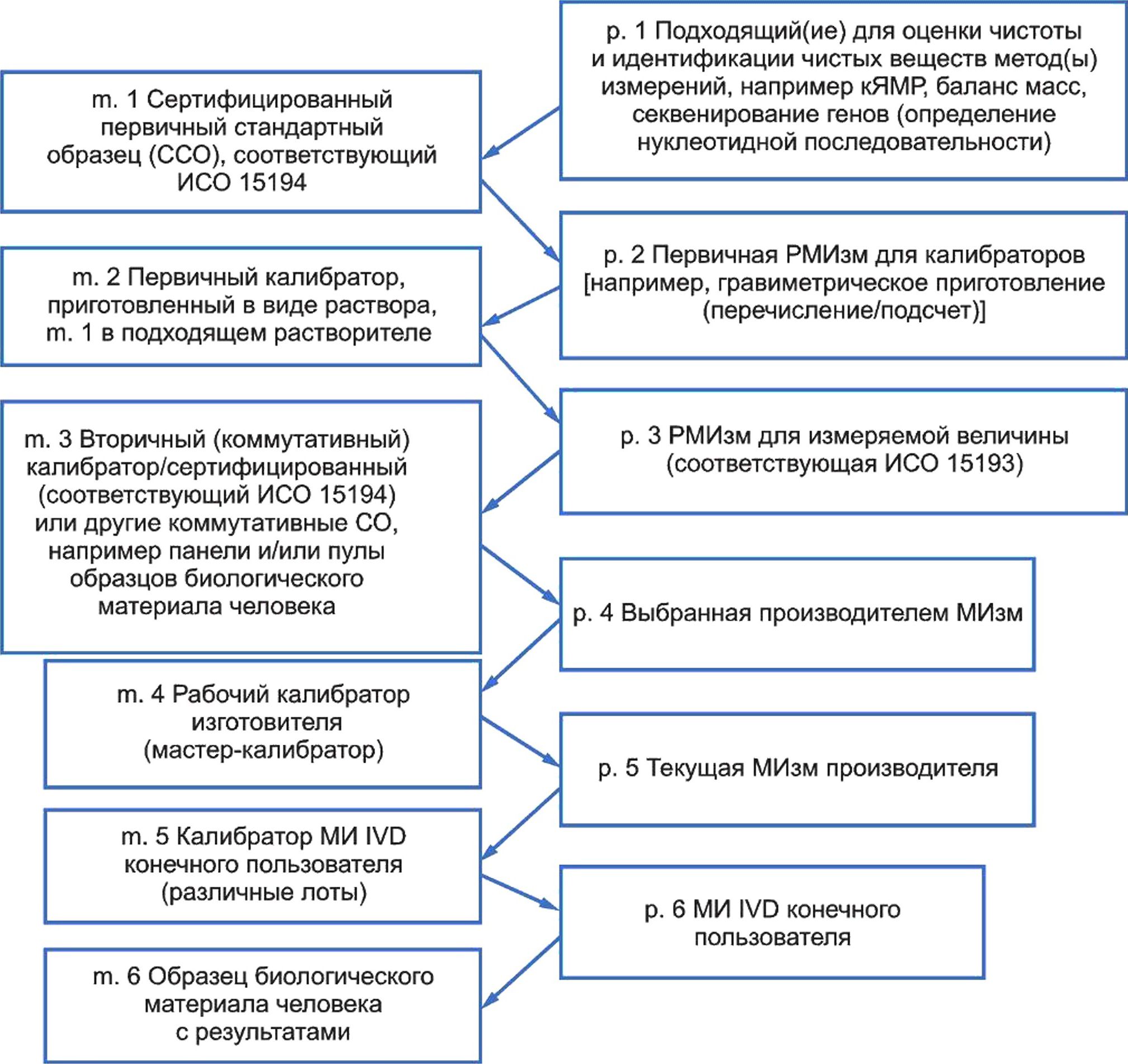
а Относительная стандартная неопределенность значения, %, присвоенного первичной референтной методикой измерения (РМИзм) [т. 1].
ь Приписанное значение относительной суммарной неопределенности, %, калибратору МИ IVD (т. 5) вычисляют по формуле
°^иса1 = §%™Ъ + %™^^
где °/oru2Rw_p 2, %ru2RW-p з и т. д. — относительная стандартная неопределенность, %, для каждой МИзм, применяемой в иерархии калибровки.
с Относительную суммарную стандартную неопределенность, %, измерения для регистрируемых значений измеряемой величины с использованием МИ IVD конечного пользователя вычисляют по формуле
%ru(y) = ^%ru2a, + %ru^w_p 6),
гце %ruRw_p 6— относительная стандартная неопределенность, %, МИ IVD конечного пользователя (условия повторяемости измерений).
Рисунок 1 — Иерархия калибровки. Полная метрологическая прослеживаемость до СИ
Пример 5 — Число копий определенной последовательности нуклеиновой кислоты KRAS на единицу объема [41].
Примечание 3 — Прослеживаемость к СИ для подсчетов устанавливается с помощью соответствующих валидированных счетных МИзм (см. ИСО 20391, ИСО 20395 и [38], [42]).
31
ГОСТ Р ИСО 17511—2022
5.2.3 Выбор РМИзм
Первичные РМИзм и другие пригодные для целей МИзм (см. рисунок 1, р. 1, р. 2) должны быть основаны на принципах измерения, демонстрирующих пригодность для целей, обеспечивающих метрологическую прослеживаемость к единице измерения СИ с наименьшей достижимой неопределенностью измерения. В данный момент времени может существовать более одной первичной РМИзм для приписывания значений величин данного вида первичным калибраторам. Значения, полученные двумя или более первичными РМИзм для данной измеряемой величины, не должны существенно отличаться в пределах заявленной неопределенности при определенном уровне достоверности.
Примечание — Счетные (на основе перечисления) МИзм могут составлять основу первичной РМИзм при условии детального описания измеряемой величины, установления селективности и полноты счета и заявления о неопределенности измерения.
Пример 1 — Две счетных МИзм для концентрации копий ДНК, которые не требуют калибратора, — это проточный цитометрический подсчет (FCM) и цифровая полимеразная цепная реакция (dPCR) [41], [43].
Пример 2 — Две счетных МИзм для измерения числа клеток, не требующие калибратора, — это микроскопия и FCM [42].
5.2.4 Первичная РМИзм
Выбранная первичная МИзм (см. рисунок 1, т. 1) должна быть наилучшей доступной реализацией (воплощением) единицы измерения с наименьшей достижимой относительной стандартной неопределенностью измерения (обозначается аббревиатурой %ruref.Ha рисунке 1). Первичный СО должен иметь свое значение, приписанное либо непосредственно первичной РМИзм, либо пригодной для цели МИзм при оценке идентичности и/или чистоте чистых веществ, например кЯМР, баланса масс, секвенирования генов [38], [39]. Приписывание значения и документирование для первичного СО должны соответствовать ИСО 15194.
Примечание — Первичный СО (см. рисунок 1, т. 1) обычно является высокоочищенным, содержит четко физико-химически определенный аналит, оценивается на стабильность, целостность состава и сопровождается сертификатом (т. е. ССО).
Пример 1 — P-D-глюкоза как SRM 917b1) из NIST; массовая доля p-D-глюкозы в материале составляет 997,0 мг/г, с расширенной неопределенностью измерения 0,2 мг/г (измеряемой величиной является массовая доля P-D-глюкозы в кристаллическом материале глюкозы, мг/г).
Пример 2 — Холестерин как SRM 911b1) из NIST; массовая доля (0,998 ± 0,001), где чистота и оценочная неопределенность основаны на научном суждении и оценке многочисленных аналитических тестов, применяемых к этому ССО в процессе сертификации. Приведенная неопределенность аппроксимирует два стандартных отклонения относительно сертифицированного значения (расширенная неопределенность равна 0,001 с коэффициентом покрытия к = 2, что дает уровень достоверности приблизительно 0,95).
5.2.5 Первичные калибраторы
Первичный калибратор (см. рисунок 1, р. 2) должен быть изготовлен из первичного СО (т. 1) с приписыванием значения с использованием первичной РМИзм (см. рисунок 1, р. 2).
Примечание — Часто первичной РМИзм является гравиметрия с растворением измеренной массы первичного СО в измеренной массе соответствующего растворителя.
Пример — Первичный калибратор для мочевой кислоты может быть получен гравиметрическим растворением в растворителе ССО чистой мочевой кислоты, например SRM 913b2), значение которого приписано NIST с сертифицированным значением массовой доли мочевой кислоты в чистом материале 0,998 кг/кг, с расширенной неопределенностью (уровень достоверности 95 %, к = 2) 0,002 кг/кг.
5.2.6 Присвоение значения вторичному СО или калибратору
Соответствующую РМИзм (см. рисунок 1, р. 3) для измеряемой величины следует использовать для приписывания значения вторичному калибратору или вторичному СО (см. рисунок 1, р. 3) со слож-
1) Данный СО является примером подходящего продукта, доступного на рынке. Эта информация приведена для удобства пользователей настоящего стандарта и не является одобрением ИСО такого продукта.
32
ГОСТ Р ИСО 17511—2022
ной матрицей. Для документирования РМИзм (см. рисунок 1, р. 3) для измеряемой величины должны применяться требования ИСО 15193.
Примечание 2 — В тех случаях, когда существует более одной РМИзм или несколько референтных лабораторий, способных выполнять одну и ту же МИзм для измеряемой величины, программы EQA, такие как схема внешней оценки качества IFCC для референтных (калибровочных) лабораторий в лабораторной медицине [44], могут предоставить полезную информацию об эквивалентности между различными РМИзм и различными референтными лабораториями.
5.2.7 Коммутативность СО
Вторичные калибраторы или вторичные СО (см. рисунок 1, гл. 3) должны быть коммутативными с образцами биологического материала человека, как это определено в исследованиях оценки коммутативности.
Примечание — См. CLSI ЕРЗО-А и [36]—[38] для проведения исследований коммутативности.
Пример — NIST SRM 967а1) креатинин в замороженной сыворотке человека, два отдельных флакона с сертифицированными значениями 0,0749 ммоль/л и 0,3427 ммоль/л, является примером коммутативного СО, подходящего для использования в качестве вторичного калибратора (см. рисунок 1, т. 3). Измеряемой величиной является молярная концентрация креатинина в замороженной сыворотке крови человека, ммоль/л. Сертифицированные значения концентрации для каждого уровня этого материала основаны на жидкостной хроматографии/масс-спектрометрии с изотопным разбавлением (ЖХ/ МС/ИР).
5.2.8 Выбранная изготовителем МИзм
Выбранная изготовителем МИзм (см. рисунок 1, р. 4) должна содержать измерительную систему, калибруемую одним или несколькими (коммутативными) калибраторами или СО (см. рисунок 1, р. 3), при их наличии.
Пример — Выбранной МИзм для измерения концентраций кортизола в плазме крови может служить газовая хроматография-масс-спектрометрия с изотопным разбавлением (ГХ/МС/ИР).
5.2.9 Рабочий калибратор
Значение рабочего калибратора производителя (см. рисунок 1, р. 4) должно быть приписано в соответствии с выбранной изготовителем МИзм (см. рисунок 1, р. 4) или (в зависимости от характеристик коммутативности рабочего калибратора) в соответствии с РМИзм (см. рисунок 1, р. 3). Вторичные (рабочие) калибраторы (см. рисунок 1, р. 4) должны быть коммутативны с биологическими образцами человека, что определяют в исследованиях оценки коммутативности (см. 4.5.5), в ходе которых сравнивают выбранную изготовителем МИзм (см. рисунок 1, р. 4) и установленную изготовителем МИзм (см. рисунок 1, р. 5) или РМИзм (см. рисунок 1, р. 3) и установленную изготовителем МИзм (см. рисунок 1, р. 5), если шаги (см. рисунок 1, р. 3 и р. 4) отсутствуют в иерархии калибровки.
Примечание 1 — Рабочий калибратор производителя (см. рисунок 1, гл. 4) иногда называют «мастер-калибратор производителя», «внутренний калибратор» или «мастер- калибратор».
Примечание 2 — Рабочий калибратор производителя часто представляет собой материал с матрицей, напоминающей предполагаемый биологический образец человека, предназначенный для измерения конечным пользователем с помощью МИ IVD.
Примечание 3 — Производители часто используют панели клинических образцов или серию пулов клинических образцов человека для рабочих калибраторов.
5.2.10 Установленная производителем МИзм
Установленная производителем МИзм (см. рисунок 1, р. 5) должна определить МИзм, которая калибруется одним или несколькими рабочими калибраторами производителя или другими коммутативными матричными калибраторами и валидирована на аналитическую селективность.
5.2.11 Калибратор производителя для конечного пользователя
Калибратор производителя для конечного пользователя (см. рисунок 1, р. 5) должен иметь значение, приписанное в соответствии с установленной производителем МИ (см. рисунок 1, р. 5) или выбранной МИ производителя (см. рисунок 1, р. 4), и должен быть предназначен для калибровки МИ IVD конечного пользователя (см. рисунок 1, р. 6).
1 > Данный СО является примером подходящего продукта, доступного на рынке. Эта информация приведена для удобства пользователей настоящего стандарта и не является одобрением ИСО такого продукта.
33
ГОСТ Р ИСО 17511—2022
5.2.12 иса/ приписанного значения калибратора конечного пользователя
Установленное значение иса/ калибратора конечного пользователя (см. рисунок 1, гл. 5) должно быть оценено изготовителем (см. 4.7), и в него должны быть включены все соответствующие неопределенности более высокого порядка, такие как неопределенность uRef установленного значения первичного СО (см. рисунок 1, т. 1) в дополнение к неопределенности каждой последующей МИзм в иерархии калибровки вплоть до включения установленной МИзм производителя (см. рисунок 1, р. 5).
5.2.13 Конечный пользователь МИ IVD
МИ IVD конечного пользователя (см. рисунок 1, р. 6) должен описываться измерительной системой, калиброванной одним или несколькими калибраторами конечного пользователя. Последнюю МИзм в иерархии калибровки для определенной измеряемой величины используют для исследования образцов человека и генерации окончательных измеренных значений для измеряемой величины с суммарными стандартными неопределенностями измерений сообщаемых значений, которые должны быть оценены конечным пользователем с учетом всех установленных неопределенностей измерений, накопленных на каждом более высоком шаге в определенной иерархии калибровки.
5.3 Иерархии калибровки с первичной РМИзм, определяющей измеряемую величину
5.3.1 Общие положения
Модель иерархии калибровки для измеряемых величин с первичной РМИзм, определяющей указанную величину (с метрологической прослеживаемостью до СИ), представлена на рисунке 2. Для этих типов величин не существуют первичных ССО. В таких случаях, как показано на примере иерархий калибровки для некоторых измеряемых величин концентрации каталитической активности ферментов в сыворотке крови человека (или других жидкостях организма), метрологическая прослеживаемость к Международной системе единиц основана на четко определенных и международно согласованных РМИзм. Характеристики, которые должны быть рассмотрены в описании этих иерархий калибровки, описаны в 5.3.2—5.3.11.
Примечание — Некоторые факторы свертывания крови также исследуют путем измерения концентрации их каталитической активности в крови или плазме крови, например фактор VIII [45].
5.3.2 Определение измеряемой величины
Определение измеряемой величины должно включать единицу измерения СИ, будь то базовая или производная величина, с которой должна быть связана метрологическая прослеживаемость.
Пример — Для каталитической концентрации ферментов соответствующие производные величины включают: моль в секунду на кубический метр (= моль с~1 ■ м~3), катал на литр (- кат ■ л~1).
Примечание 1 — Такой вид величины, как каталитическая концентрация — это каталитическая активность компонента в каталах (или моль в секунду), которая делится на объем (исходной) системы, отобранной в кубических метрах.
Примечание 2 — В лабораторной медицине знаменателем может быть выбран литр, с применением которого получают несогласованную производную единицу катал на литр, обозначаемую, как кат • л-1= кат/л = = моль ■ с-1л-1 = (моль/с)/л.
Примечание 3 — Другая несогласованная используемая единица основана на единице каталитической активности «энзимная единица» (или «международная единица»), обозначаемая U, с формулой преобразования 1 С/ = 1 мкмоль • мин-1 = 16 667 • 10—9 кат. Следовательно, 1 Uln = 16 667 ■ 10“9 кат/л. Единица измерения не зависит от МИзм.
5.3.3 РМИзм более высокого порядка, которая определяет измеряемую величину
РМИзм более высокого порядка (первичная), определяющая измеряемую величину (см. рисунок 2, р. 3), следует выполнять с помощью измерительной(ых) системы (систем), калиброванной(ых) в соответствии с различными подходящими для цели первичными РМИзм (см. рисунок 2, р. 1), такими как гравиметрия, термометрия, волюметрия, спектрофотометрия, потенциометрия, время, длина.
Примечание — Как определено Консультативным комитетом по количеству вещества (CCQM), случаи без первичного калибратора требуют, чтобы набор первичных методов измерений (см. рисунок 2, р. 1) был непосредственно применен к измерительной системе, что обеспечивает прослеживаемость к СИ стандартизованной первичной РМИзм (см. рисунок 2, р. 3).
34
ГОСТ Р ИСО 17511—2022
Материал
Методика измерений


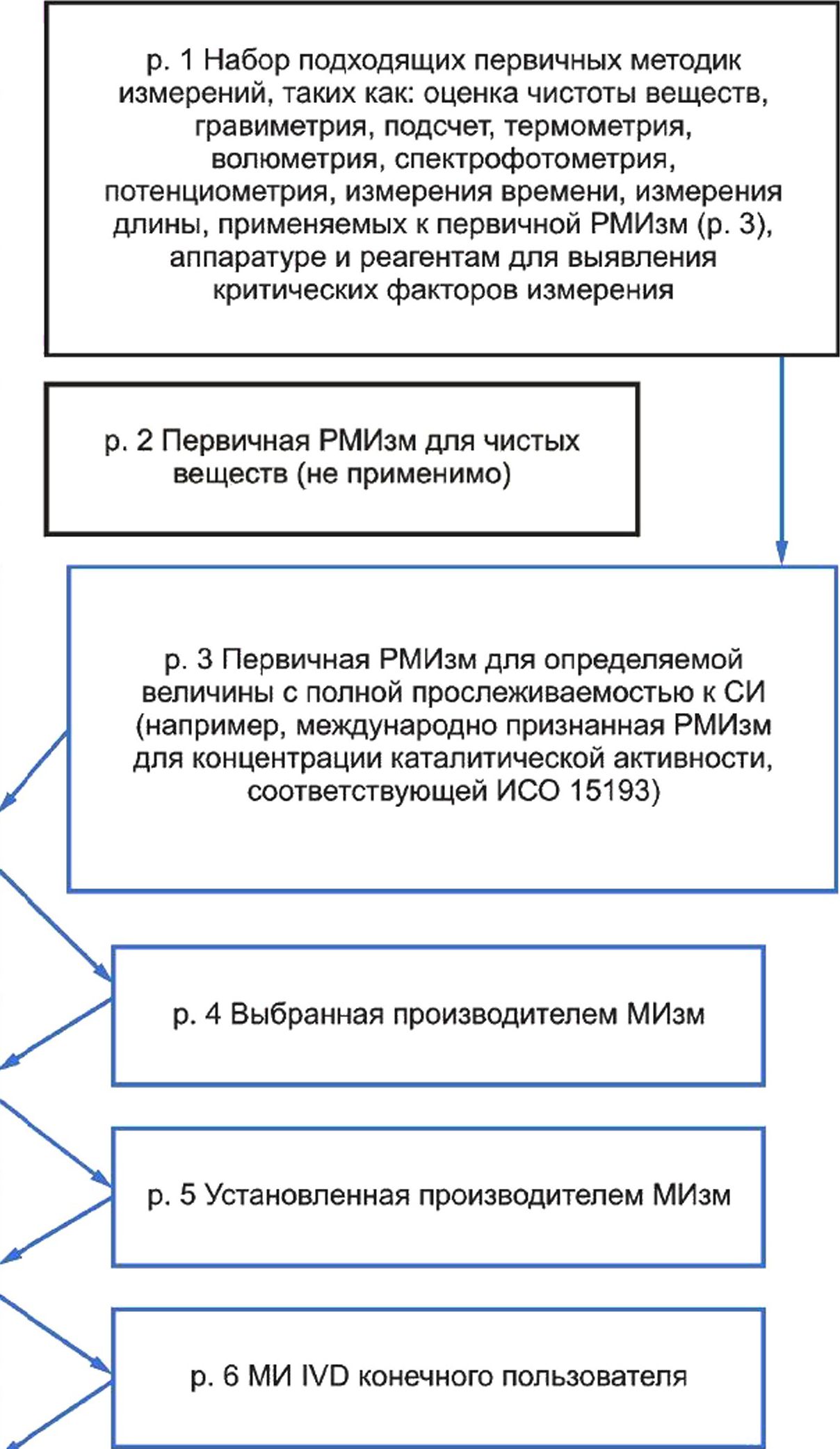
а Относительную суммарную неопределенность присвоения значения СО, %, [т. 3] вычисляют по формуле %%. з=>/%^77+%^|ЗТз'’
где °/<>ги2р 1 — относительная суммарная стандартная неопределенность измерения, %, для (р. 1) МИзм более высокого порядка по отношению, например, к термометрии, волюметрии, спектрофотометрии, pH, времени, длине и т. д.;
%ru2Rw-p з — относительное стандартное отклонение (CV%, %,) для МИзм (р. 3) в условиях повторяемости.
ь Относительную суммарную неопределенность, %, присвоения значения калибратора МИ IVD (гл. 5) вычисляют по формуле
/°гиса1 “
где °/oru2Rw_p 4 и %m^w_p 5 — относительные стандартные неопределенности, %, для каждой применимой МИзм в иерархии калибровки.
с Относительную суммарную стандартную неопределенность измерения, %, для сообщаемых значений измеряемой величины МИ IVD для конечного пользователя вычисляют по формуле
%ги(у) = ^%ru2ai +%ru^w_p 6),
где %ruRw_p 6 — относительная стандартная неопределенность, %, МИ IVD конечного пользователя на основе долговременной точности (условия повторяемости измерений).
Рисунок 2 — Иерархия калибровки. Измеряемая величина, определяемая по РМИзм, но без первичного СО величины, прослеживаемая к Международной системе единиц. Материалы (т. 1) и (т. 2), а также МИзм [р. 2] не применимы (Н/П)
35
ГОСТ Р ИСО 17511—2022
5.3.4 Первичная РМИзм и определение измеряемой величины
Для измеряемой величины, представляющей собой каталитическую концентрацию фермента, первичная РМИзм (см. рисунок 2, р. 3) является неотъемлемой частью ее определения. Соответственно, первичная РМИзм (см. рисунок 2, р. 3) должна быть описана достаточно подробно в отношении оборудования, реагентов, условий реакции и расчета по измеренному сигналу для того, чтобы РМИзм можно было воспроизвести в любой квалифицированной лаборатории, планирующей проведение измерений.
Примечание — Результаты измерений каталитической концентрации сравнимы только среди результатов разных лабораторий, если активность фермента измеряют в одинаковых условиях. Поэтому измеряемый фермент не может быть описан только типом величины (например, каталитической концентрацией), названием фермента и системы, но также требует определенной МИзм, особенно индикаторного компонента измеряемой реакции. На вершине калибровочной иерархии первичная РМИзм согласована на международном уровне.
Пример — Креатинкиназу измеряют по коэффициенту конверсии НАДФ+ в соответствии с IFCC РМИзм [46].
5.3.5 Документация первичной РМИзм
Документация для первичной РМИзм, применяемая в иерархии калибровки, как приведено на рисунке 2, р. 3 (например, для каталитической концентрации фермента в жидкости организма), должна соответствовать требованиям ИСО 15193. Кроме того, описание первичной РМИзм для измеряемой величины (см. рисунок 2, р. 3) должно включать следующую информацию (если применимо):
а) вид субстрата и его концентрация;
Ь) активаторы или ингибиторы и их концентрации;
с) направление катализируемой реакции;
d) индикаторная реакция;
е) буферная система и pH;
f) объемная доля образца;
д) объемная доля раствора стартового реагента;
h) измерение температуры;
i) время инкубации;
j) бланковый реагент;
к) материал, используемый для запуска реакции;
I) время задержки;
гл) интервал измерения;
п) длина волны измерения;
о) оптическая полоса пропускания;
р) длина оптического пути;
q) вид линии регрессии для анализа точек данных.
5.3.6 Присвоение значений вторичного СО
Первичную РМИзм для измеряемой величины (см. рисунок 2, р. 3) используют для присвоения значения вторичному калибратору или вторичному СО (см. рисунок 2, т. 3) со сложной матрицей.
Примечание — Такие вторичные СО или калибраторы (см. рисунок 2, гл. 3) часто имеют матрицу, напоминающую биологические образцы человека, предназначенные для измерения обычными МИзм конечных пользователей, чтобы повысить вероятность того, что эти материалы будут коммутативны с человеческими образцами при использовании в МИзм более низкого порядка в иерархии калибровки. Панели или пулы человеческих образцов представляют собой тип вторичных СО, применимый в этом контексте (см. рисунок 2, т. 3), в зависимости от биохимических характеристик (например, стабильности) конкретного измеряемого фермента.
Пример — ERM-AD457/IFCC, от директората Объединенного исследовательского центра Европейской комиссии F — здоровье, потребители и СО, сертифицирован на концентрацию каталитической активности аспартатамино-трансферазы и внесен в список JCTLM [28]. Исследования коммутативности [47] показали, что этот материал эквивалентен образцам сыворотки человека в 5 из 11 сравнений с РМИзм с использованием доступных МИ IVD.
5.3.7 Выбранная производителем МИзм
Выбранная производителем МИзм (см. рисунок 2, р. 4) должна определять ту МИзм, которая калибруется одним или несколькими вторичными СО или вторичными калибраторами (см. рисунок 2, гл. 3) и используется для присвоения значений рабочему(им) калибратору(ам) производителя (см. рисунок 2, т. 4). 36
ГОСТ Р ИСО 17511—2022
Примечание — Вторичные СО (см. рисунок 2, т. 3) имеют сертифицированные значения с соответствующими неопределенностями и присваиваются калибровочной лабораторией с использованием подходящей для цели первичной РМИзм.
5.3.8 Рабочий калибратор производителя
Рабочий калибратор производителя (см. рисунок 2, т. 4) должен иметь значения, присвоенные в соответствии с выбранной производителем МИзм (см. рисунок 2, р. 4) или в зависимости от характеристик коммутативности рабочего калибратора в соответствии с первичной РМИзм (см. рисунок 2, р. 3) для измеряемой величины. Вторичные (рабочие) калибраторы (см. рисунок 2, р. 4) должны быть коммутативными с биологическими образцами человека, как это определено в исследованиях оценки коммутативности (см. 4.5.5), в ходе которых сравнивают выбранную изготовителем МИзм (см. рисунок 2, р. 4) и установленную производителем МИзм (см. рисунок 2, р. 5) или РМИзм (см. рисунок 2, р. 3) и установленную производителем МИзм [см. рисунок 2, р. 5), если шаги (см. рисунок 2, р. 3 и р. 4) опущены из иерархии калибровки.
5.3.9 Установленная производителем МИзм
Установленная производителем МИзм (см. рисунок 2, р. 5) определяет МИзм, калиброванную одним или несколькими рабочими калибраторами производителя (см. рисунок 2, т. 4) или калибраторами более высокого уровня, и проходит валидацию для аналитической селективности.
5.3.10 Калибратор производителя для конечного пользователя
Калибратор производителя для конечного пользователя (см. рисунок 2, р. 5) должен иметь свое значение, присвоенное в соответствии с установленной МИ производителя (см. рисунок 2, р. 5), и предназначен для калибровки МИ IVD конечного пользователя. иса/ присвоенного значения калибратора конечного пользователя (см. рисунок 2, р. 5) оценивает производитель (см. 4.7), включая все соответствующие неопределенности более высокого порядка в дополнение к неопределенностям каждой из последующих МИ в иерархии калибровки вплоть до установленной производителем МИ (см. рисунок 2, Р- 5).
5.3.11 Конечный пользователь МИ IVD
Конечный пользователь МИ IVD (см. рисунок 1, р. 6) должен описывать измерительную систему, калиброванную одним или несколькими калибраторами конечного пользователя. Последнюю МИзм в иерархии калибровки для определенной измеряемой величины используют для изучения биологических образцов человека и для генерации окончательных измеренных значений для измеряемой величины с суммарными стандартными неопределенностями измерений сообщаемых значений, которые должны быть оценены конечным пользователем с учетом всех установленных неопределенностей измерений, накопленных на каждом более высоком шаге в определенной иерархии калибровки.
5.4 Иерархии калибровки для измеряемых величин, определенных РМИзм, калиброванной с помощью конкретного первичного калибратора
5.4.1 Общие положения
Иерархии калибровки для измеряемых величин, которые определяют посредством РМИзм с помощью конкретного первичного калибратора (с прослеживаемостью до СИ), представлены на рисунке 3. В таких случаях РМИзм определяет величину, которая является компонентом измеряемой величины (например, пептидный фрагмент или эпитоп), а не молекулярную структуру вещества, предназначенного для измерения. Характеристики, к которым следует обращаться при описании этих иерархий калибровки, подробно описаны в 5.4.2—5.4.10.
5.4.2 Определение измеряемой величины
В силу специфичности к конкретному эпитопу или молекулярной структуре, входящей в состав измеряемого вещества, измеряемую величину определяют РМИзм более высокого порядка, откалиброванной с помощью конкретного первичного калибратора.
Пример — В эталонной системе измерения IFCC для гемоглобина А1 с (HbAlc) измеряемую величину определяют, как молярную долю бета-цепей гемоглобина А1 с гликированием N-концевого валина или эпсилон-аминокислотных остатков (HbAlc) относительно негликированной фракции бета-цепи гемоглобина А (НЬАО) в цельной крови. Аналит определяют как гемоглобин (НВ), в котором необратимо гликированы один или оба N-концевых валина и эпсилон-аминокислоты бета-цепей.
37
ГОСТ Р ИСО 17511—2022
Материал
Методика измерений
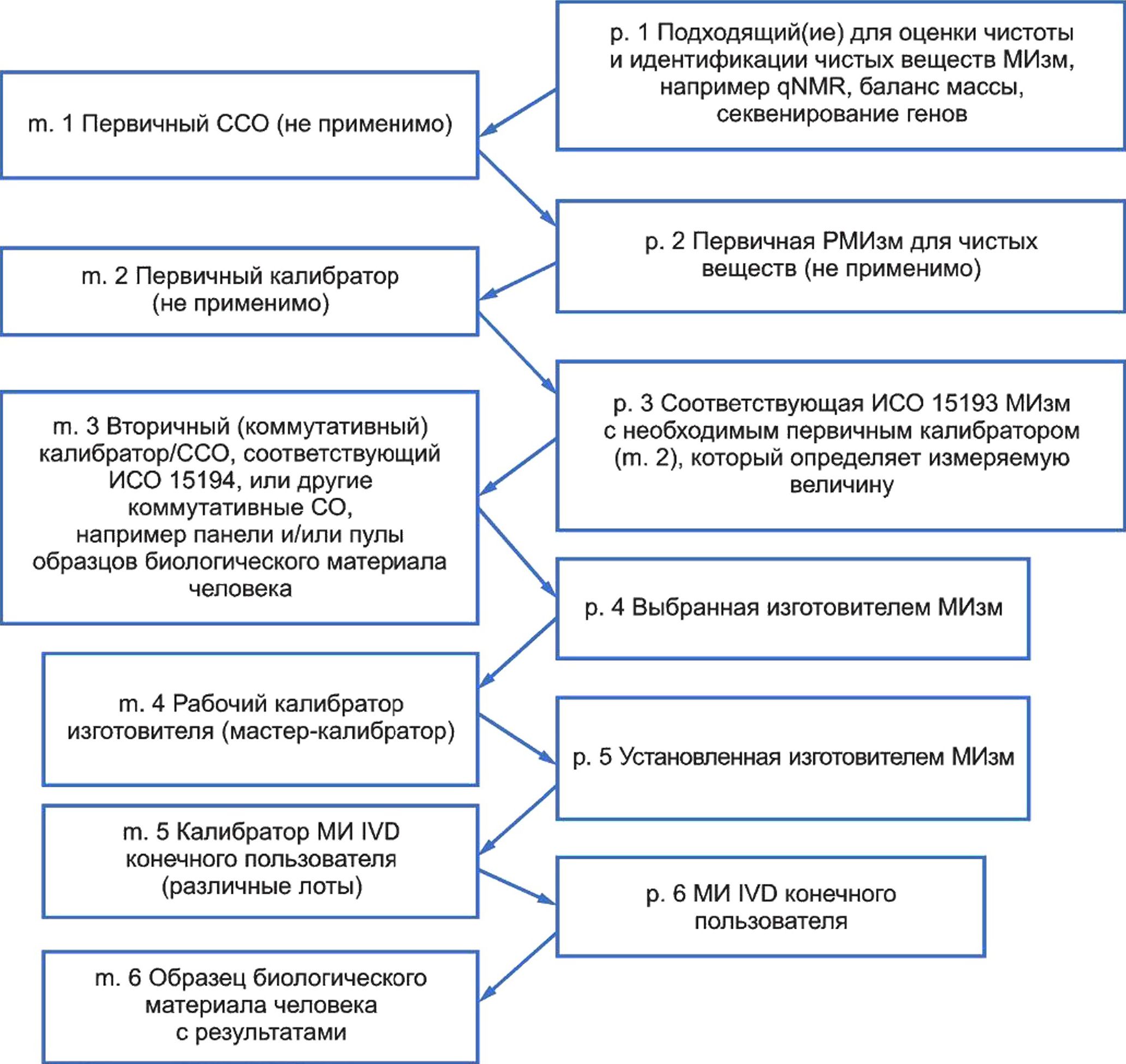
а Относительная стандартная неопределенность, %, значения, присвоенного первичной РМИзм (гл. 1).
ь Относительную суммарную неопределенность, %, присвоения значения калибратора МИ IVD (гл. 5) вычисляют по формуле
^cal =^i^^^
где %ru2Rw_p 2- °/°ru2RW-p з и т- Д- — относительная стандартная неопределенность, %, для каждой МИзм, применяемой в иерархии калибровки.
с Относительную суммарную стандартную неопределенность, %, измерения значений измеряемой величины для МИ IVD конечного пользователя вычисляют по формуле
%ги (у) = ^%ru2al +%ru2Rw_p 6),
we%ru2Rw_p 6 — относительная стандартная неопределенность, %, МИ IVD конечного пользователя на основе долговременной точности (условия повторяемости измерений).
Рисунок 3 — Иерархия калибровки. Измеряемая величина, определяемая РМИзм, калиброванной определенным
первичным калибратором
5.4.3 Присвоение значения первичному СО
Первичный СО (см. рисунок 3, т. 1) должен иметь значение, присвоенное одной или нескольким МИзм (для подтверждения подлинности и определения чистоты чистых веществ) (см. рисунок 3, р. 1). Избранные МИзм должны быть такими, чтобы эксплуатационные характеристики помогали обеспечить наименьшую относительную достижимую стандартную неопределенность измерения (обозначаемую аббревиатурой %ruref на рисунке 3) для заданного значения первичного СО. 38
ГОСТ Р ИСО 17511—2022
5.4.4 Присвоение значения первичному калибратору
Первичный калибратор (см. рисунок 3, т. 2) должен иметь значение, присвоенное одной или несколькими первичными РМИзм (например, гравиметрией) (см. рисунок 3, р. 2). Выбор первичного СО (см. рисунок 3, т. 1) в дополнение к подготовке и присвоению значения первичного калибратора (см. рисунок 3, т. 2) имеет решающее значение для определения измеряемой величины в сочетании с РМИзм (см. рисунок 3, р. 3).
Пример 1 — В эталонной измерительной системе IFCC для гемоглобина А1с (НЬА1с) для присвоения значения первичного калибратора (см. рисунок 3, т. 2) для использования в калибровке РМИзм (см. рисунок 3, р. 3) изготавливаются смеси чистого НЬА1с и чистого НЬАО, которые выделены с помощью катионообменной и аффинной хроматографии и охарактеризованы с помощью капиллярной изоэлектрической фокусировки и масс-спектрометрии с ионизацией электроспрем [48].
Пример 2— Количественное измерение С-реактивного белка (СРВ) методом гомогенного иммуноанализа зависит от олигомерного состояния анализируемого вещества [51]. Обычный референтный метод, основанный на обнаружении СРБ-производного монопептида, был бы слепым относительно олигомерного состояния СРВ. Чтобы исключить смещение в зависимости от различий в олигомерном состоянии белка в СО по сравнению с предполагаемыми образцами человека, фракцию мономера первичного СО и калибратора определяют независимо.
5.4.5 Выбор и предполагаемое использование РМИзм в иерархии калибровки
РМИзм (см. рисунок 3, р. 3) [которая при калибровке с помощью первичного калибратора (см. рисунок 3, т. 2) определяет измеряемую величину] следует использовать для присвоения значения вторичному калибратору или вторичному СО с комплексной матрицей (см. рисунок 3, гл. 3). Вторичный калибратор или вторичный СО (см. рисунок 3, т. 3) должен быть коммутативным с образцами биологического материала человека как в исходной МИзм (см. рисунок 3, р. 3), применяемой для присвоения его значения, так и в последующей МИзм (см. рисунок 3, р. 4), где он должен быть использован в качестве калибратора для целей присвоения значений рабочему(им) калибратору(ам) производителя (см. рисунок 3, т. 4).
Пример — В РМИзм IFCC для измерения гемоглобина А1С (НЬа1с) предложены две доступные РМИзм (см. рисунок 3, р. 3), с помощью которых избирательно измеряют гликированный п-концевой остаток бета-цепи гемоглобина (НЬ). Затем НЬ расщепляется на пептиды протеолитическим ферментом. Удельные гликированные и негликированные N-концевые пептиды бета-цепи НЬ измеряют методом разделения высокоэффективной жидкостной хроматографии (ВЭЖХ) с последующей масс-спектрометрией или капиллярным электрофорезом [49], [50].
5.4.6 Выбранная производителем МИзм
Выбранная производителем МИзм (см. рисунок 3, р. 4) должна определять измерительную систему, калибруемую одним или несколькими вторичными калибраторами или вторичным СО (см. рисунок 3, т.З). Ее основное назначение — перенос правильности на рабочий калибратор производителя (см. рисунок 3, т. 4). Таким образом, эта МИзм должна быть выбрана отчасти потому, что калибраторы (см. рисунок 3, т. 3 и/или т. 4) коммутативны образцам биологического материала человека.
Примечание — Такие вторичные СО или вторичные калибраторы, как правило, будут иметь матрицу, имитирующую образцы биологического материала человека, предназначенные для измерения МИ IVD конечного пользователя, чтобы повысить вероятность того, что эти СО станут коммутативны, помогая обеспечить их пригодность для использования с МИзм, которые предназначены для калибровки (т. е. рисунок 3, р. 4 и/или р. 5)
5.4.7 Рабочий калибратор производителя
Значение рабочего калибратора производителя (см. рисунок 3, т. 4) должно быть присвоено в соответствии с выбранной производителем МИзм (см. рисунок 3, р. 4). Калибровочный материал (см. рисунок 3, т. 4) должен демонстрировать коммутативность с предполагаемыми, что обеспечивает его пригодность при использовании с выбранной производителем МИзм (см. рисунок 3, р. 4) и процедурой калибровки, т. е. с установленной производителем МИзм (см. рисунок 3, р. 5).
Примечание — Рабочий калибратор производителя часто представляет собой материал с матрицей, напоминающей предполагаемые человеческие образцы, используемые с МИ IVD конечного пользователя, такие как панель или серия пулов человеческих образцов.
5.4.8 Установленная производителем МИзм
Установленная производителем МИзм (см. рисунок 3, р. 5) определяет МИзм, калиброванную одним или несколькими рабочими калибраторами производителя (см. рисунок 3, т. 4) или калибраторами более высокого уровня, и валидирована на аналитическую селективность.
39
ГОСТ Р ИСО 17511—2022
5.4.9 Калибратор МИ IVD конечного пользователя
Калибратор МИ IVD конечного пользователя производителя (см. рисунок 3, т. 5) должен иметь значение, присвоенное в соответствии с установленной МИзм производителя (см. рисунок 3, р. 5), и должен быть предназначен для калибровки МИ IVD конечного пользователя. Неопределенность иса1 присвоенного значения калибратора МИ IVD конечного пользователя (см. рисунок 3, т. 5) определяет производитель (см. 4.7) с учетом всех соответствующих неопределенностей более высокого порядка в дополнение к неопределенностям каждой из последующих МИзм в иерархии калибровки, вплоть до и включая установленную производителем МИзм (см. рисунок 3, р. 5].
5.4.10 Конечный пользователь МИ IVD
Конечный пользователь МИ IVD (см. рисунок 3, р. 6) должен описывать измерительную систему, калиброванную одним или несколькими калибраторами конечного пользователя. Последнюю МИзм в иерархии калибровки для определенной измеряемой величины используют для изучения биологических образцов человека и генерации окончательных измеренных значений для измеряемой величины с суммарными стандартными неопределенностями измерений сообщаемых значений, которые должны быть оценены конечным пользователем с учетом всех установленных неопределенностей измерений, накопленных на каждом более высоком шаге в определенной иерархии калибровки.
5.5 Иерархии калибровки с международным общепринятым калибратором, определяющим измеряемую величину
5.5.1 Общие положения
Иерархию калибровки, описанную на рисунке 4, применяют в тех случаях, когда имеется международный общепринятый калибратор, определяющий измеряемую величину (см. рисунок 4, т. 3) и соответствующий требованиям ИСО 15194. Для этих типов измеряемых величин отсутствуют РМИзм (см. рисунок 4, р. 2), первичные СО (см. рисунок 4, т. 1), первичные калибраторы (см. рисунок 4, т. 2) и прослеживаемость к СИ. Значение, присвоенное международному общепринятому калибратору (см. рисунок 4, т. 3), имеет арбитражное значение для измеряемой величины, которое присваивается согласованным на международном уровне протоколом приписывания значения (см. рисунок 4, р. 3), включающим в себя наивысший уровень метрологической прослеживаемости для указанной измеряемой величины. Характеристики, которые должны быть рассмотрены в описании этих типов иерархий калибровки, подробно описаны в 5.5.2—5.5.9.
5.5.2 Международный общепринятый калибратор. Описание материала
Международный общепринятый калибратор (см. рисунок 4, т. 3) должен представлять собой препарат, содержащий измеряемую величину (см. 3.17). В соответствующих случаях калибратор, изготовленный из предоставленного материала, должен иметь матрицы, сходные с матрицами образцов биологического материала человека и предназначенные для измерения МИ IVD, чтобы повысить вероятность того, что используемые в МИзм СО (например, рисунок 4, р. 3, р. 4 и/или р. 5), которые предназначены для калибровки в определенной иерархии калибровки (см. рисунок 4, т. 3), будут коммутативны с образцами биологического материала человека.
Примечание 1 — Измеряемая величина обычно присутствует в детально охарактеризованной форме и обычно содержится в матрице, напоминающей матрицу образцов биологического материала человека, измеряемых МИ IVD конечного пользователя.
Пример — Международный общепринятый калибратор, представленный в матрице, близкой к образцам человеческого происхождения, предназначенным для измерения с помощью определенного МИ IVD (например, объединенная сыворотка, объединенная моча).
Примечание 2 — Международный общепринятый калибратор в некоторых случаях не выпускается в форме, пригодной для непосредственного использования в качестве калибратора в МИзм. Например, международные общепринятые калибраторы могут поставлять в виде порошка или лиофилизата, требующего разбавления подходящим разбавителем перед использованием, или поставщик калибратора может включать конкретные инструкции по приготовлению и разведению в инструкции по применению.
Примечание 3 — Международный общепринятый калибратор может представлять собой один материал или несколько материалов, например панель образцов или серию пулов образцов, каждый из которых имеет различное количество измеряемой величины.
40
ГОСТ Р ИСО 17511—2022
Материал
Методика измерений
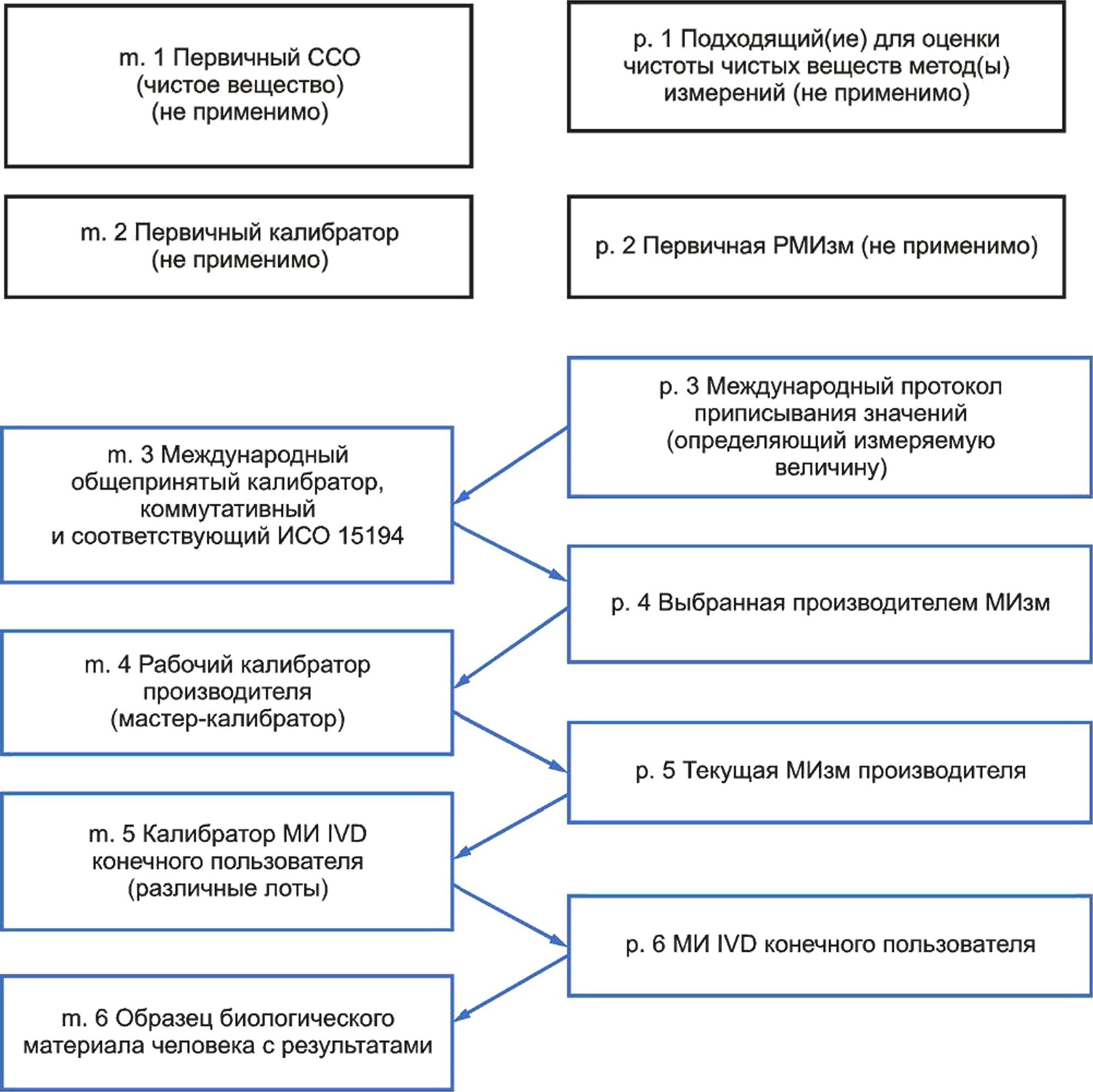
а Относительную суммарную неопределенность значения присвоения СО (т. 3), %, вычисляют по формуле %шт.з = %Ш^-Р. з-
где °/oruRw_p з — относительное стандартное отклонение (CV%), %, для МИзм [р. 3] в условиях повторяемости, т. е. неопределенность международного протокола для приписывания значения международного общепринятого калибратора (т. 3).
ь Относительную суммарную неопределенность присвоения значений калибратора МИ IVD (т. 5), %, вычисляют по формуле
^са/ = /%ги^ 3+%ru2Rw_p 4+%ru2Rw_p_ 5),
где °/oruRw_p 4 и %ruRw_p 5 — относительная стандартная неопределенность, %, для каждой применяемой МИзм в иерархии калибровки.
с Относительную суммарную стандартную неопределенность измерения, %, для сообщаемых значений измеряемой величины с МИ IVD конечного пользователя вычисляют по формуле
%™(у) = ^%ru2alV70ru^
где %ru2Rw_p 6 — относительная стандартная неопределенность, %, МИ IVD конечного пользователя на основе долговременной точности (условия повторяемости измерений).
Рисунок 4 — Иерархия калибровки. Измеряемая величина, определяемая протоколом приписывания значений для международного общепринятого калибратора (соответствует ИСО 15194; прослеживаемость к СИ отсутствует).
Материалы (гл. 1), (т. 2) и МИзм (р. 1) и (р. 2) не применимы (Н/П)
41
ГОСТ Р ИСО 17511—2022
5.5.3 Приписывание значения международному общепринятому калибратору
Протокол, согласованный на международном уровне (см. рисунок 4, р. 3), следует использовать для присвоения значения(ий) величины международному(ым) общепринятому(ым) калибратору(ам) (см. рисунок 4, т. 3).
Примечание 1 — Примером протокола является схема, в которой среднее значение (после удаления выбросов) измеряемой величины в международном общепринятом калибраторе определяют среди группы МИзм, которые квалифицированы как имеющие надлежащие эксплуатационные характеристики. Определение пригодности эксплуатационных характеристик обычно основано на результатах, измеренных для панели образцов биологического материала человека, и включает, в частности, рассмотрение: неточности, селективности, корреляции, уменьшения различий между процедурами, когда образец (потенциально международный общепринятый калибратор) используют для повторной калибровки процедур наряду с другими ключевыми величинами влияния.
Примечание 2 — Комитет экспертов ВОЗ по биологической стандартизации (ECBS) устанавливает международные биологические СО под названием «Международные стандарты (IS)» [ранее «Международные референтные препараты (IRP)»] для использования в биологических и иммунологических исследованиях. Для первой партии этих материалов международную единицу определяют как произвольно установленное количество материала и характеризуют его измеренной биологической активностью. Последующие партии калибруют путем межлабораторных сличений по сравнению с предыдущим материалом. Партии в серии задаются «1-й IS», «2-й IS» и т. д. Приписанное(ые) значение(ия) такого СО, даже если оно(и) высокой очистки, связано(ы) с определенной биологической МИзм (или другим согласованным на международном уровне протоколом) без метрологической прослеживаемости до единиц СИ. Такие материалы, следовательно, не могут быть названы первичными СО. Эти международные общепринятые СО могут быть использованы в качестве калибратора(ов) для МИ IVD только в том случае, если материал разработан на основе четкого определения количества, относящегося к предполагаемому медицинскому применению, и если присвоенное(ые) значение(ия) материала имеет неопределенность, приемлемую для калибровки МИ IVD.
5.5.4 Коммутативность международного общепринятого калибратора
Коммутативность международного общепринятого калибратора с образцами биологического материала человека должна быть подтверждена для репрезентативного числа различных МИ IVD в соответствии с предполагаемым использованием калибратора. Поставщик международного общепринятого калибратора перед первым выпуском материала для его применения по назначению должен провести оценку коммутативности. Изготовитель, ответственный за определение иерархии калибровки для конкретного МИ IVD, отвечает и за любые дополнительные оценки коммутативности, необходимые для обеспечения того, чтобы выбранный международный общепринятый калибратор был пригоден для использования с указанным МИ IVD, если это применимо.
Примечание 1 — Использование матрицы, подобной образцу биологического материала человека, в международном общепринятом калибраторе (или любом другом калибраторе) не является гарантией того, что полученный калибратор на самом деле является коммутативным материалом.
Примечание 2 — Протоколы для проведения оценки коммутативности доступны в CLSI ЕРЗО-А и [35]-[37].
Примечание 3 — Выбор МИзм для участия в исследовании коммутативности учитывает такие факторы, как доля рынка, а также различия в технологии среди доступных МИ IVD для конкретного измерения.
5.5.5 Калибровка и выбор выбранной производителем МИзм
Международный общепринятый калибратор (см. рисунок 4, т. 3) следует использовать для калибровки выбранной производителем МИзм (см. рисунок 4, р. 4). Выбранная производителем МИзм (см. рисунок 4, р. 4) должна определять измерительную систему, калибруемую одним или несколькими международными общепринятыми калибраторами. Выбранную МИзм при соответствующей калибровке следует использовать для определения приписанных значений рабочего калибратора производителя (см. рисунок 4, гл. 4).
5.5.6 Характеристики и приписывание значения рабочему калибратору производителя
Значение рабочего калибратора производителя (см. рисунок 3, т. 4) должно быть приписано в соответствии с выбранной производителем МИзм (см. рисунок 4, р. 4). Рабочий калибратор производителя (см. рисунок 4, т. 4) должен продемонстрировать коммутативность с предполагаемыми образцами биологического материала человека в отношении выбранной МИзм производителя (см. рисунок 4, р. 4) и установленной МИзм производителя (см. рисунок 4, р. 5).
42
ГОСТ Р ИСО 17511—2022
Примечание — Рабочие калибраторы производителя часто представляют собой материал с матрицей, напоминающей образцы биологического материала человека, предназначенные для измерения МИ IVD конечного пользователя. Рабочие калибраторы производителя в некоторых случаях состоят из панели или серии пулов образцов биологического материала человека.
5.5.7 Установленная производителем МИзм
Установленная производителем МИзм (см. рисунок 4, р. 5) определяет МИзм, откалиброванную одним или несколькими рабочими калибраторами изготовителя (см. рисунок 4, гл. 4) или калибраторами более высокого уровня, такими как международный общепринятый калибратор (см. рисунок 4, т. 3), и валидирована на аналитическую селективность.
5.5.8 Калибраторы МИ IVD конечного пользователя
Калибратор МИ IVD конечного пользователя (см. рисунок 4, р. 5) должен иметь свое значение, приписанное в соответствии с установленной производителем МИзм, и предназначен для калибровки МИ IVD конечного пользователя (см. рисунок 4, р. 6). иса/ приписанного значения калибратора МИ IVD конечного пользователя (см. рисунок 4, т. 5) оценивает изготовитель (см. 4.7), включая все соответствующие неопределенности более высокого порядка в дополнение к неопределенностям каждой из последующих МИзм в иерархии калибровки вплоть до установленной производителем МИзм (см. рисунок 4, р. 5).
5.5.9 Конечный пользователь МИ IVD
Конечный пользователь МИ IVD (см. рисунок 4, р. 6) должен описывать измерительную систему, калиброванную одним или несколькими калибраторами конечного пользователя. Последнюю МИзм в иерархии калибровки для определенной измеряемой величины используют для изучения образцов биологического материала человека и получения окончательных измеренных значений для измеряемой величины с суммарными стандартными неопределенностями измерений сообщаемых значений, которые должны быть оценены конечным пользователем с учетом всех установленных неопределенностей измерений, накопленных на каждом более высоком шаге в определенной иерархии калибровки.
5.6 Иерархии калибровки с метрологической прослеживаемостью, поддерживаемой международным протоколом гармонизации
5.6.1 Общие положения
Иерархию калибровки, описанную на рисунке 5, следует применять в тех случаях, когда измеряемая величина в биологических образцах человека определена международным протоколом гармонизации при отсутствии международно согласованных признанных РМИзм, первичных СО, общепризнанных РМИзм или СО, метрологической прослеживаемости к СИ. Характеристики, которые должны быть рассмотрены в описании этих типов иерархий калибровки, перечислены в 5.6.2—5.6.5.
5.6.2 Международный протокол гармонизации
Международный протокол гармонизации для измеряемой величины (см. рисунок 5, р. 3) должен определять наиболее высокий метрологический уровень в иерархии калибровки и предназначен для достижения эквивалентности сообщаемых результатов для предполагаемых образцов биологического материала человека (см. рисунок 5, т. 6) среди доступных гармонизированных МИ IVD конечного пользователя (см. рисунок 5, р. 6) для измеряемой величины.
Примечание — Дополнительная информация об использовании и применении протокола гармонизации в метрологически прослеживаемой иерархии калибровки приведена в ИСО 21151.
5.6.3 Присвоение значений СО гармонизации
В международном протоколе гармонизации (см. рисунок 5, р. 3) должен быть указан процесс, используемый для присвоения гармонизованных значений (произвольных единиц измерения, не прослеживаемых до СИ) СО гармонизации (см. рисунок 5, р. 3). Международный протокол гармонизации (см. рисунок 5, р. 3) должен определять, каким образом использованы СО гармонизации для оценки взаимосвязи между результатами СО гармонизации (см. рисунок 5, гл. 3) среди МИ IVD (см. рисунок 5, р. 6), принимающих участие в протоколе гармонизации. Неопределенности измерений ит 3, связанные с присвоенными количественными значениями для СО гармонизации, должны быть оценены и учтены в оценке иса/для указанных калибраторов МИ IVD конечного пользователя.
43
ГОСТ Р ИСО 17511—2022
Материал
Методика измерений

%™т.За
%~са/Ь
%ш(у)с
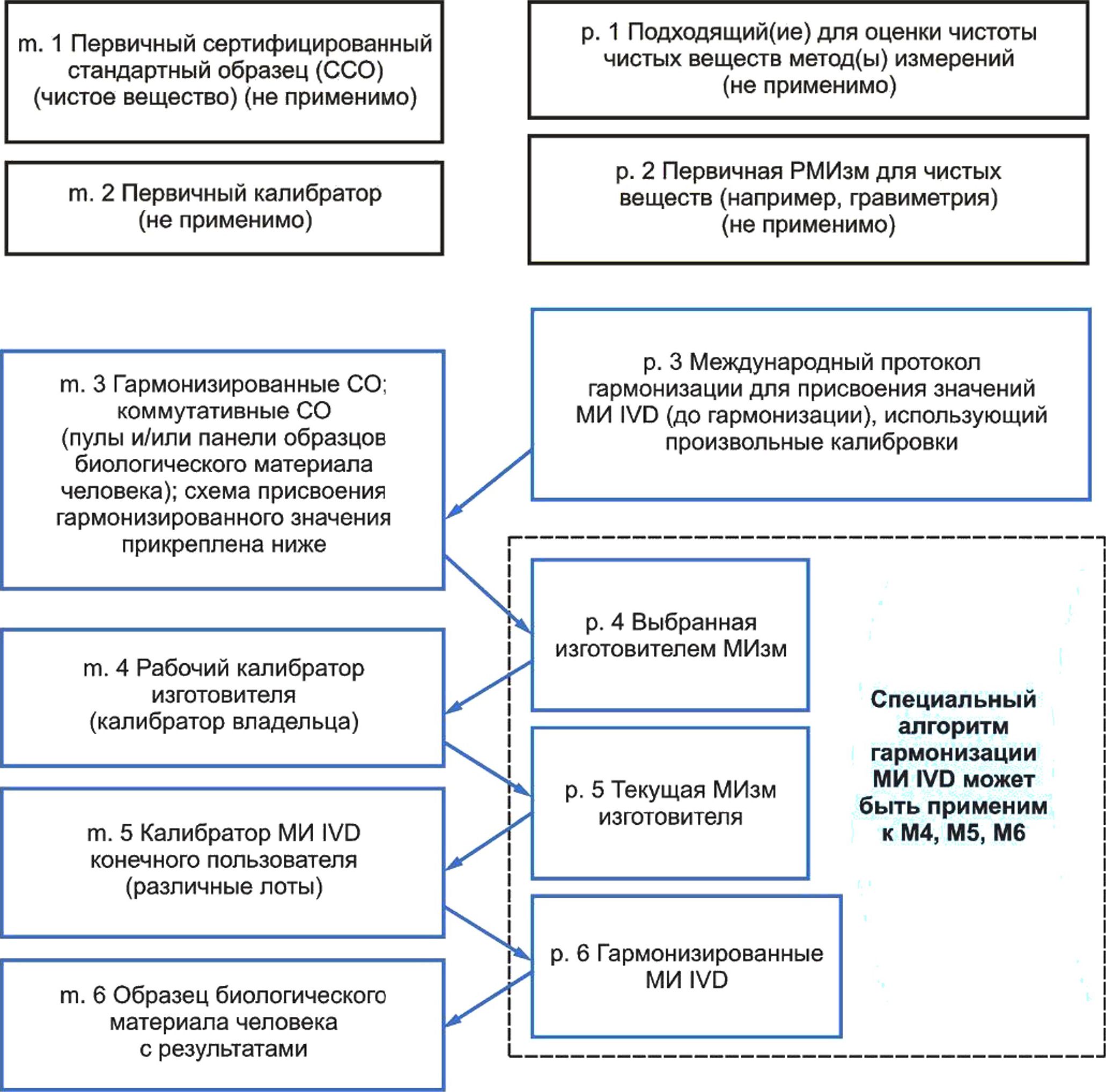
а Относительную суммарную неопределенность, %, присвоения значения СО (т. 3) вычисляют по формуле %шт. з = %Ш^-Р. з.
где %ruRw_p з — относительное стандартное отклонение (СУ%, %,) для МИзм (р. 3) в условиях повторяемости, т. е. неопределенность протокола присвоения значения СО гармонизации (т. 3).
ь Относительную суммарную неопределенность, %, присвоения значений калибратора МИ IVD (т. 5) вычисляют по формуле
°^са/ = ^/ош^ 3 + %ш^_р 4 + %ш^_р 5,
где °/oruRw_p 4 и %ruRw_p 5 — относительная стандартная неопределенность, %, для каждой МИзм, применяемой в иерархии калибровки.
с Относительную суммарную стандартную неопределенность измерения, %, для сообщаемых значений измеряемой величины с МИ IVD конечного пользователя вычисляют по формуле
%™(у) = /%ги^а1+%ru2Rw_p 6),
где Уоглр^р 6 — относительная стандартная неопределенность, %, для МИ IVD конечного пользователя на основе долговременной точности (условия повторяемости измерений).
Рисунок 5 — Иерархия калибровки. Измеряемая величина, определенная международным протоколом гармонизации (отсутствует ССО; не прослеживается до СИ). Материалы (гл. 1), (т. 2) и МИзм (р. 1) и (р. 2) не применимы (Н/П)
44
ГОСТ Р ИСО 17511—2022
5.6.4 Применение СО гармонизации
Каждый производитель МИ IVD должен определить и документировать алгоритм, специфичный для МИ IVD, который при применении выбранной МИзм (см. рисунок 5, р. 4) для приписывания значений рабочему(им) калибратору(ам) (см. рисунок 5, т. 4), или (Ь) к их выбранной МИзм (см. рисунок 5, р. 5) для присвоения значения калибратору или калибраторам МИ IVD конечного пользователя (см. рисунок 5, т. 5), или (с) к их гармонизированным МИ IVD (см. рисунок 5, р. 6) для присвоения значений биологическим образцам человека (см. рисунок 5, т. 6), позволит получить для образцов биологического материала человека с заданным МИ IVD эквивалентные результаты по сравнению с другими МИ IVD, участвующими в протоколе гармонизации. Неопределенность измерений, введенная специфичным для МИ IVD алгоритмом гармонизации, определенным каждым производителем МИ IVD, также учитывают и включают в оценку компонента инкрементной неопределенности измерений в применимом положении в иерархии калибровки, а также в итоговую суммарную неопределенность измерений калибратора(ов) конечного пользователя иса/для каждого гармонизированного МИ IVD.
5.6.5 Конечный пользователь МИ IVD
Конечный пользователь МИ IVD (см. рисунок 5, р. 6) должен описать измерительную систему, калиброванную одним или несколькими специальными калибраторами МИ IVD конечного пользователя (см. рисунок 5, т. 5). Последнюю МИзм в иерархии калибровки для определенной измеряемой величины используют для изучения биологических образцов человека и получения окончательных измеренных значений для измеряемой величины с суммарными стандартными неопределенностями измерений сообщаемых значений, которые должны быть оценены конечным пользователем с учетом всех установленных неопределенностей измерений, накопленных на каждом более высоком шаге в определенной иерархии калибровки.
5.7 Иерархии калибровки для измерений с метрологической прослеживаемостью только до внутренних произвольно определенных СО производителя
5.7.1 Общие положения
Иерархию калибровки, описанную на рисунке 6, применяют к измеряемым величинам с метрологической прослеживаемостью только к внутренним произвольно выбранным СО производителя (см. рисунок 6, гл. 3), для определенных измерений без сертифицированных чистых СО (см. рисунок 6, т. 1), без первичных калибраторов (см. рисунок 6, т. 2), без РМИзм (см. рисунок 6, р. 3), без протокола гармонизации и без прослеживаемости к СИ. Характеристики, которые должны быть рассмотрены в описании этих типов иерархий калибровки, подробно представлены в 5.7.2—5.7.7.
5.7.2 Выбор СО
Поскольку высшего порядка СО и МИзм (см. рисунок 6, т. 1, т. 2, р. 1, р. 2, р. 3) не существуют для этих видов измеряемых величин, арбитражный СО (см. рисунок 6, гл. 3) устанавливают, если это применимо, в качестве метрологически высокого уровня в иерархии калибровки измеряемой величины.
Примечание 1 — Для обеспечения согласованности калибровки указанных МИ IVD конечного пользователя этого типа производители иногда устанавливают арбитражные МИзм (см. рисунок 6, р. 4) и/или арбитражные СО (см. рисунок 6, т. 3) в качестве высшего уровня этих иерархий калибровки.
Примечание 2 — Арбитражные СО (см. рисунок 6, т. 3) иногда получают, например, из очищенных биомаркеров, а затем измеряют с помощью выбранной МИзм (см. рисунок 6, р. 4), что позволяет проводить дальнейшую калибровку и присваивать значения рабочему калибратору (см. рисунок 6, гл. 4). Такие рабочие калибраторы часто изготавливают в матричном материале образца биологического материала человека или в другой соответствующей матрице или альтернативно составляют, например, из панелей (или пулов) образцов биологического материала человека или «спайкированных» образцов биологического материала человека.
5.7.3 Выбранная производителем МИзм
В тех случаях, когда производитель устанавливает независимую калибровочную иерархию с использованием выбранной МИзм (см. рисунок 6, р. 4), где отсутствует СО для измеряемой величины (например, МИзм, зависящие от других свойств, таких как поглощение УФ-излучения; процедуры, основанные на подсчете и т. д.), выбранная МИзм должна быть метрологически наиболее высоким уровнем в указанной иерархии калибровки для определяемой измеряемой величины.
45
ГОСТ Р ИСО 17511—2022
Материал
Методика измерений

%™m.3a
%~са/>
%ги(у)°
т. 1 Первичный ССО (чистое вещество) (не применимо)
т. 2 Первичный калибратор (не применимо)
р. 1 Подходящий(ие) для оценки чистоты чистых веществ метод(ы) измерений (не применимо)
р. 2 Первичная РМИзм для чистых веществ (не применимо)
р. 3 РМИзм для измеряемой величины (не применимо)
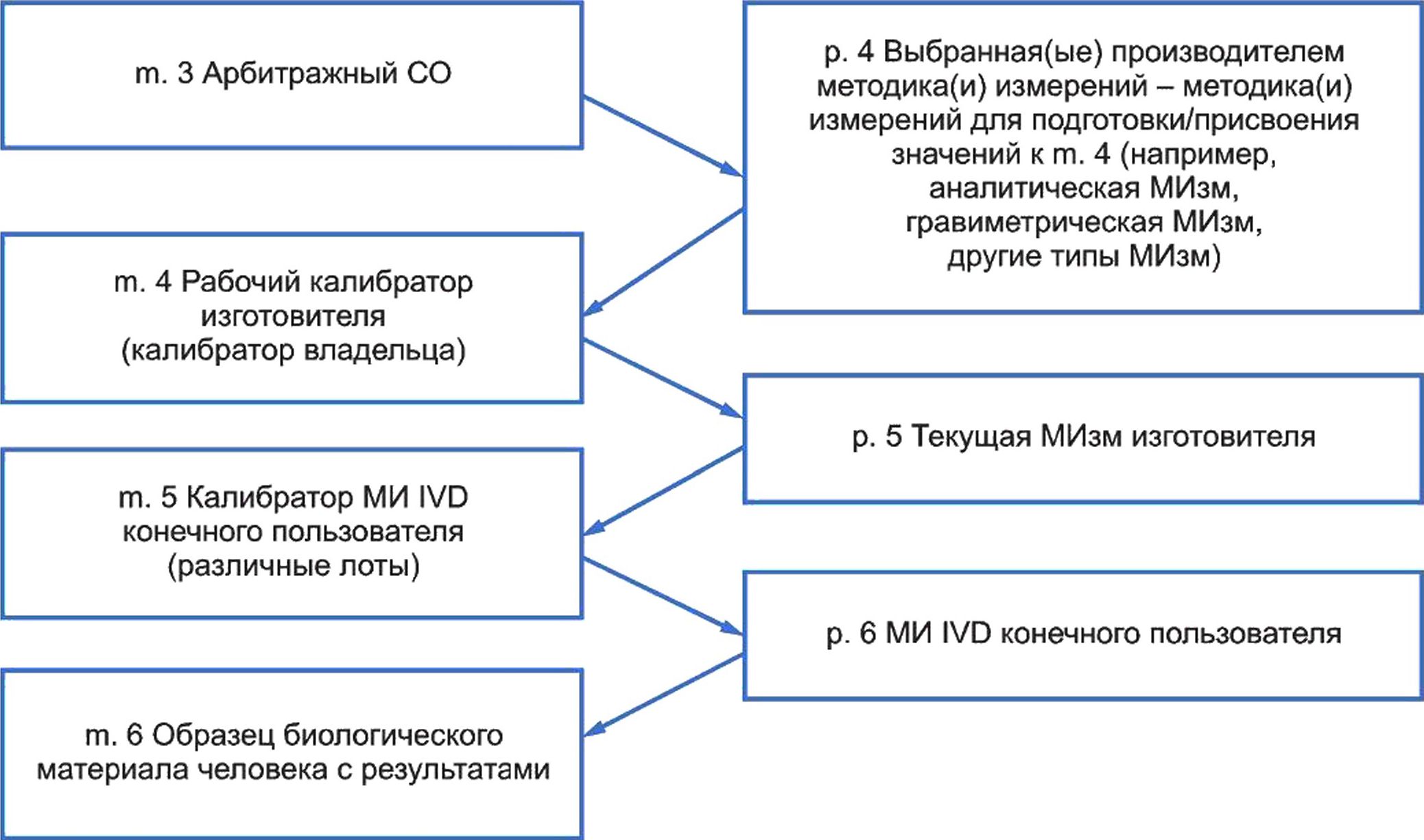
а Относительную суммарную неопределенность, %, присвоения значений арбитражного СО (т. 3).
ь Относительную суммарную неопределенность, %, присвоения значений калибратора МИ IVD (гл. 5) вычисляют по формуле
%^са/ -у/^й^7%п^^
+ %^rw-p.5-
где %wRvv p 4 и °/oruRw_p 5 — относительная стандартная неопределенность, %, для каждой МИзм, применяемой в иерархии калибровки.
с Относительную суммарную стандартную неопределенность измерения, %, для сообщаемых значений измеряемой величины с МИ IVD конечного пользователя вычисляют по формуле
%ги (у) = ^%ru^al +%ru^w_p 6),
где °/oru2Rw_p 6 — относительная стандартная неопределенность, %, МИ IVD для конечного пользователя на основе долговременной точности (условия повторяемости измерений).
Рисунок 6 — Иерархия калибровки. Измеряемая величина, определяемая внутренним произвольно определенным СО производителя (без первичного СО или ССО, РМИзм, протокола гармонизации; не прослеживается к СИ).
Материалы (т. 1) и (т. 2), а также МИзм (р. 1), (р. 2) и (р. 3) не применимы (Н/П)
46
ГОСТ Р ИСО 17511—2022
5.7.4 Установленная производителем МИзм
Установленная производителем МИзм (см. рисунок 6, р. 5) должна определять измерительную систему, калибруемую с помощью рабочего калибратора производителя (см. рисунок 6, т. 4), которая может состоять из арбитражных СО, включая панели образцов человека или пулы образцов. Установленную изготовителем МИзм (см. рисунок 6, р. 5) используют для определения присвоенных значений калибратору(ам) МИ IVD конечного пользователя производителя (см. рисунок 6, р. 5).
5.7.5 Калибраторы МИ IVD конечного пользователя
Произведенные калибраторы МИ IVD конечного пользователя (см. рисунок 6, т. 5) должны иметь значения, присвоенные согласно установленной МИзм производителя (см. рисунок 6, р. 5), и должны быть предназначены для использования в калибровке МИ IVD конечного пользователя (см. рисунок 6, р. 6). Неопределенность иса1 приписанного значения калибратора МИ IVD конечного пользователя (см. рисунок 6, т. 5) оценивает изготовитель (см. 4.7), включая все соответствующие неопределенности более высокого порядка в дополнение к неопределенностям каждой из последующих МИ в иерархии калибровки вплоть до установленной МИзм производителя (см. рисунок 6, р. 5).
5.7.6 Конечный пользователь МИ IVD
Конечный пользователь МИ IVD (см. рисунок 4, р. 6) должен описывать измерительную систему, калиброванную одним или несколькими калибраторами МИ IVD конечного пользователя. Последнюю МИзм (см. рисунок 6, р. 6) в иерархии калибровки для определенной измеряемой величины используют для исследования образцов биологического материала человека и получения конечных значений для измеряемой величины (см. рисунок 6, т. 6) с суммарными стандартными неопределенностями измерений в отчетных значениях, которые должны быть оценены конечным пользователем, принимая во внимание все установленные неопределенности измерений, полученные на каждой более высокой ступени в определенной иерархии калибровки.
5.7.7 Документация иерархии калибровки
Документация иерархии калибровки, включаемая в технический файл производителя для конкретного МИ IVD для измерения с метрологической прослеживаемостью в соответствии со схемой на рисунке 6, должна включать (в результате оценки риска) технические характеристики и валидационную документацию на элементы, критичные к производительности и воспроизводимости иерархии калибровки, включая, но не ограничиваясь ими:
а) спецификацию того сырья, которое должно быть подготовлено, приобретено, обработано или иным образом получено для приготовления любых арбитражных СО (см. рисунок 6, т. 3, т. 4) или реагентов и других компонентов МИзм (см. рисунок 6, р. 4, р. 5), включая спецификации для любых образцов биологического материала человека (или пулов) или других типов образцов, предназначенных для использования в качестве СО на различных уровнях (см. рисунок 6, т. 3, т. 4) в рамках иерархии калибровки;
Ь) спецификацию конкретной измеряемой величины и любых связанных с ней измеряемых величин и/или коэффициентов влияния, соответствующих каждому клиническому назначению указанной МИ IVD, которая достаточно подробно описана для обеспечения воспроизводимого отбора проб биологического материала человека и/или подготовки пула для последующих партий СО (см. рисунок 6, гл. 3, т. 4), если это применимо.
Примечание 1 — Предполагается, что измеряемая величина, присутствующая в каждом образце биологического материала человека, выбранном для участия в калибровочной панели (см. рисунок 6, т. 3 и/или т. 4), представляет собой измеряемую величину, представляющую интерес для каждого заявленного использования МИ IVD;
с) методики и рабочие инструкции по приписыванию значений величин образцам биологического материала человека (или пулам) или другим арбитражным материалам, предназначенным для использования в качестве СО (см. рисунок 6, т. 3, т. 4), включая описание тех мер, которые должны быть приняты для обеспечения согласованности процесса приписывания значений для сменных партий калибровочных панелей или других арбитражных СО, для этапов в иерархии калибровки, находящихся под контролем производителя.
Примечание 2 — Значения внутренних СО (см. рисунок 6, гл. 3, т. 4), присваивает изготовитель с использованием протоколов, включающих, например, а) арбитражные единицы измерения, Ь) стандартное добавление взвешенных или объемно распределенных объемов концентрата, с) прямые измерения с использованием выбранной изготовителем МИзм (см. рисунок 6, р. 4) (например, доступной коммерческой МИзм) или d) другие научно обоснованные методы, соответствующие технологии измерения и типу анализируемого вещества.
47
ГОСТ Р ИСО 17511—2022
Пример — Субпанель биологических образцов человека с первой калибровочной панели (см. рисунок 6, т. 3) часто используют для передачи присвоенных значений на последующую калибровочную панель.
6 Информация о маркировке, предоставляемая изготовителем конечным пользователям
Применяют требования, приведенные в ИСО 18113-2, 7.5.
48
ГОСТ Р ИСО 17511—2022
Приложение ДА (справочное) |
Сведения о соответствии ссылочных международных стандартов национальным стандартам
Таблица ДА.1
Обозначение ссылочного Степень международного стандарта соответствия | Обозначение и наименование соответствующего национального стандарта |
ISO 18113-2 IDT | ГОСТ Р ИСО 18113-2—2015 «Медицинские изделия для диагностики in vitro. Информация, предоставляемая изготовителем (маркировка). Часть 2. Реагенты для диагностики in vitro для профессионального применения» |
ISO 15193 IDT | ГОСТ Р ИСО 15193—2015 «Изделия медицинские для диагностики in vitro. Измерение величин в пробах биологического происхождения. Требования к описанию референтных методик выполнения измерений» |
ISO 15194 IDT | ГОСТ Р ИСО 15194—2013 «Изделия медицинские для диагностики in vitro. Измерение величин в пробах биологического происхождения. Требования к аттестованным стандартным образцам и содержанию сопроводительной документации» |
Примечание — В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов:
- IDT — идентичные стандарты.
49
ГОСТ Р ИСО 17511—2022
Библиография
[1] IEC 60050-300:2001 International Electrotechnical Vocabulary — Electrical and electronic measurements and measuring instruments — Part 311: General terms relating to measurements
[2] ISO Guide 31:2015, Reference materials — Contents of certificates, labels and accompanying documentation
[3] ISO Guide 35:2017, Reference materials — Guidance for characterization and assessment of homogeneity and stability
[4] ISO/IEC Guide 98-3:2008, Uncertainty of measurement — Part 3: Guide to the expression of uncertainty in measurement (GUM:1995)
[5] ISO/IEC Guide 99:2007, International vocabulary of metrology — Basic and general concepts and associated terms (VIM)
[6] ISO 5725-1:1994 Accuracy (trueness and precision) of measurement methods and results. Part 1: General principles and definitions
[7] ISO 9000 Quality management systems — Fundamentals and vocabulary
[8] ISO 15189:2012, Medical laboratories — Requirements for quality and competence
[9] ISO 15195, Laboratory medicine — Requirements for the competence of calibration laboratories using reference measurement procedures
[10] ISO/TR 16476:2016, Reference materials — Establishing and expressing metrological traceability of quantity values assigned to reference materials
[11] ISO/IEC 17025:2017, General requirements for the competence of testing and calibration laboratories
[12] ISO 17034:2016, General requirements for the competence of reference material producers
[13] ISO 18113-1:2009, In vitro diagnostic medical devices — Information supplied by the manufacturer (labelling)
[14] ISO 18153:2003, In vitro diagnostic medical devices — Measurement of quantities in biological samples — Metrological traceability of values for catalytic concentration of enzymes assigned calibrators and control materials
[15] ISO 20391-1:2018, Biotechnology — Cell counting — Part 1: General guidance on cell counting methods
[16] ISO 20395:2019, Biotechnology — Requirements for evaluating the performance of quantification methods for nucleic acid target sequences — qPCR and dPCR
[17] ISO 21151, (in development), In vitro diagnostic medical devices — Requirements for international harmonisation protocols establishing metrological traceability of values assigned to calibrators and human samples
[18] CLSI Measurement Procedure Comparison and Bias Estimation Using Patient Samples —Approved Guideline. EP09-A3. Clinical and Laboratory Standards Institute, Wayne, PA, 2013
[19] CLSI Evaluation of Commutability of Processed Samples —Approved Guideline. EP14-A3. Clinical and Laboratory Standards Institute, Wayne, PA, 2014
[20] CLSI Characterization and qualification of commutable reference materials for laboratory medicine — Approved Guideline. EP30-A. Clinical and Laboratory Standards Institute, Wayne, PA, 2010
[21] Global Harmonization Task Force (GHTF), Principles of IVD Medical Devices Classification, GHTF/SG1/N045: 2008
[22] Global Harmonization Task Force (GHTF), Definitions of the Terms Manufacturer, Authorised Representative, Distributor and Importer, Document GHTF/SG1/N055: 2009
[23] ILAC P10, 01/2013 ILAC Policy on Traceability of Measurement Results. International Laboratory Accreditation Cooperation (ILAC), PO Box 7507, Silverwater NSW 2128, Australia
[24] OIML V1 2013, Vocabulaire international des termes de metrologie legale (VIML), International Organization for Legal Metrology
[25] Emons H. et al. New definitions on reference materials. Accred Qual Assur. 2006; 10(10):576—578
[26] Harmonization.net.https://www.harmonization.net/media/1004/tool_box_2013.pdf (accessed 19/03/2018)
[27] Joint Committee for Traceability in Laboratory Medicine (JCTLM) FAQs, http://www.bipm.org/en/committees/jc/ jctlm/jctlm-faq.html, accessed 14 April 2016
[28] Joint Committee for Traceability in Laboratory Medicine (JCTLM). https://www.bipm.org/jctlm
[29] WHO, Guidelines for the preparation, characterization and establishment of international and other standards and reference reagents for biological substances. Techn Rep Ser 1990; No.800 (Annex 4):181—214
50
ГОСТ Р ИСО 17511—2022
[30] Panteghini М. Traceability, Reference Systems and Result Comparability. Clin Biochem Rev. 2007; 28(3):97—104
[31] Sandberg S. et al. Defining analytical performance specifications: consensus statement from the 1st strategic conference of the European Federation of Clinical Chemistry and Laboratory Medicine. Clin Chern Lab Med. 2015; 53(6):833-5
[32] Braga F. et al. Verification of in vitro medical diagnostics (IVD) metrological traceability: responsibilities and strategies. Clin Chim Acta. 2014; 432:55—61
[33] Braga F. et al. Performance criteria for combined uncertainty budget in the implementation of metrological traceability. Clin Chern Lab Med. 2015; 53(6):905—12
[34] Braga F. et al. Defining permissible limits for the combined uncertainty budget in the implementation of metrological traceability. Clin Biochem. 2018 Mar 8. pii: S0009-9120(18)30053-5. doi: 10.1016/j.clinbiochem.2018.03.007. [Epub ahead of print]
[35] Miller W.G., Schimmel H., Rej R. et al. IFCC Working Group Recommendations for Assessing Commutability Part 1: General Experimental Design. Clin Chern. 2018; 64(3):447—454
[36] Nilsson G. et al. IFCC Working Group Recommendations for Assessing Commutability Part 2: Using the Difference in Bias between a Reference Material and Clinical Samples. Clin Chern. 2018; 64(3):455—464
[37] Budd J.R. et al. IFCC Working Group Recommendations for Assessing Commutability Part 3: Using the Calibration Effectiveness of a Reference Material. Clin Chern. 2018; 64(3):465—474
[38] Draft of the ninth SI Brochure, 11 December 2015, https://www.bipm.org/utils/common/pdf/si-brochure-draft-2016. pdf, accessed 11/10/2017
[39] Westwood S.W. et al. Mass Balance Method for the SI Value Assignment of the Purity of Organic Compounds. Anal Chern. 2013; 85(6):3118—3126
[40] Stebbings R. et al. Quantification of cells with specific phenotypes I: Determination of CD4+ cell count per microliter in reconstituted lyophilized human PBMC prelabeled with anti-CD4 FITC antibody. Cytometry A. 2015; 87(3):244— 253
[41] Whale A.S., Jones G.M., Pavsic J., Dreo T., Redshaw N et al. Assessment of Digital PCR as a Primary Reference Measurement Procedure to Support Advances in Precision Medicine. Clin Chern. 2018; 64 (9), Published June 14, 2018 as doi:10.1373/clinchem.2O17.285478
[42] Kammel M. et al. Flow cytometer for reference measurements of blood cell concentrations with low uncertainties. Medical Measurements and Applications (MeMeA) (IEEE 2015) 517—520. DOI:10.1109/MeMeA.2015.7145258
[43] Yoo H.B. et al. An International Comparison of Enumeration-based Quantification of DNA Copy-concentration Using Flow Cytometric Counting and Digital Polymerase Chain Reaction. Anal Chern. 2016; 88(24):12169—12176
[44] International Federation of Clinical Chemistry and Laboratory Medicine (IFCC). IFCC External Quality Assessment Scheme for Reference (calibration) Laboratories in Laboratory Medicine (RELA), Rev. 1.3 (2008), http://www.dgkl-rfb.de:81/IFCC_EQAS_ProcManual.pdf
[45] Moser K.A. et al. Chromogenic factor VIII activity assay, Am J Hematol.2014; 89(7):781
[46] Schumann G. et al. IFCC Primary Reference Procedures for the Measurement of Catalytic Activity Concentrations of Enzymes at 37 °C. Part 2. Reference Procedure for the Measurement of Catalytic Concentration of Creatine Kinase. Clin Chern Lab Med. 2002; 40(6):635—642
[47] Toussaint B. et al. Traceability of values for catalytic activity concentration of enzymes: a Certified Reference Material for aspartate transaminase. Clin Chern Lab Med. 2010; 48(6):795—803
[48] Finke A. et al. Preparation of a candidate primary reference material for the international standardisation of HbA1c determinations. Clin Chern Lab Med. 1998; 36(5):299—308
[49] Finke A. et al. Preparation of a candidate primary reference material for the international standardisation of HbA1c determinations. Clin Chern Lab Med. 1998; 36(5):299—308
[50] Kobold U. et al. Candidate reference methods for HbA1c based on peptide mapping. Clin Chern.1997; 43(10):1944—51
[51] Rzychon M. et al. Analysis of the Physicochemical State of С-Reactive Protein in Different Preparations Including 2 Certified Reference Materials. Clin Chern. 2010; 56(9):1475—1482
51
ГОСТ Р ИСО 17511—2022
УДК 61:006.354
ОКС 11.100.10
Ключевые слова: метрологическая прослеживаемость, калибраторы, контрольные материалы правильности, иерархия калибровки, неопределенность измерения, референтные методики измерений
52
Редактор fl.С. Зимилова Технический редактор В.Н. Прусакова Корректор С.В. Смирнова Компьютерная верстка Л.А. Круговой
Сдано в набор 11.11.2022. Подписано в печать 24.11.2022. Формат 60*84%. Гарнитура Ариал. Усл. печ. л. 6,51. Уч.-изд. л. 5,85.
Подготовлено на основе электронной версии, предоставленной разработчиком стандарта
Создано в единичном исполнении в ФГБУ «Институт стандартизации» , 117418 Москва, Нахимовский пр-т, д. 31, к. 2.

